

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert

Grundlagen und Methoden der Physiologie; molekulare und zelluläre Aspekte
Stoffwechselwege und Enzyme



 Allosterie: ἄλλως = anders, στερεός = Ort
Allosterie: ἄλλως = anders, στερεός = OrtEnzyme sind Proteine, die bestimmte Reaktionen beschleunigen. Man unterscheidet nach ihrer Funktion -- Klasse I-Enzyme (Oxidoreduktasen)  -- Klasse II-Enzyme (Transferasen), z.B. Transaminasen (Aminogruppe), Kinasen (Phosphat), Methyltransferasen (Methylgruppe)  -- Klasse III-Enzyme (Hydrolasen), sie spalten oder verknüpfen Moleküle unter Einsatz von Wasser  -- Klasse IV-Enzyme (Lyasen, Synthasen), sie fügen kleine Moleküle an oder entfernen sie  -- Klasse V-Enzyme (Isomerasen) schalten zwischen isomeren Formen um (Epimerasen, Mutasen)  -- Klasse VI-Enzyme (Ligasen) verknüpfen Moleküle unter Verwendung energiereicher Phosphate Die für den Metabolismus notwendige Energie wird aus der Spaltung von Lipiden, Glucose u.a. gewonnen. Oxidative Energiegewinnung erfolgt z.T. in Mitochondrien, anoxidative im Zytoplasma. Spezialisierte Stoffwechselwege dienen der Verarbeitung stickstoffhaltiger Moleküle (Harnstoffzyklus), von Kohlenhydraten (Citratzyklus), Lipiden (Fettsäurezyklus) u.a. |
 aus Nahrungsstoffen
und im Körper nutzbaren Depots
gewonnen und auf Phosphatmoleküle
übertragen (ADP + P → ATP); vor allem entsteht Wärme, die nach außen abgegeben wird.
aus Nahrungsstoffen
und im Körper nutzbaren Depots
gewonnen und auf Phosphatmoleküle
übertragen (ADP + P → ATP); vor allem entsteht Wärme, die nach außen abgegeben wird.
 Abbildung: Elektrochemischer Protonengradient und ATP-Synthese
Abbildung: Elektrochemischer Protonengradient und ATP-Synthese
 bilden nicht genügend ATP, der Zellstoffwechsel leidet.
bilden nicht genügend ATP, der Zellstoffwechsel leidet.
 Abbildung: Metabolismus - wichtigste Wege
Abbildung: Metabolismus - wichtigste Wege
 füllt den Raum zwischen Zell- und Kernmembran aus und
beinhaltet Zellorganellen und fadenförmige Strukturen. Hier erfolgen
Zuckerabbau (Glykolyse), Synthese der Fettsäuren, Aktivierungen von
Aminosäuren u.a.
füllt den Raum zwischen Zell- und Kernmembran aus und
beinhaltet Zellorganellen und fadenförmige Strukturen. Hier erfolgen
Zuckerabbau (Glykolyse), Synthese der Fettsäuren, Aktivierungen von
Aminosäuren u.a.  Kohlenhydrate liefern Energie und sind Bestandteile z.B. von Glykoproteinen und Glykolipiden;
Kohlenhydrate liefern Energie und sind Bestandteile z.B. von Glykoproteinen und Glykolipiden; Lipide sind tragende
Komponenten von Zellmembranen und erfüllen verschiedenste Aufgaben
im Körper (nicht nur Energiespeicherung in Fettzellen);
Lipide sind tragende
Komponenten von Zellmembranen und erfüllen verschiedenste Aufgaben
im Körper (nicht nur Energiespeicherung in Fettzellen); Proteine sind Bau- und Funktionsmoleküle
in und außerhalb der Zelle, Informationsmoleküle (z.B. Zytokine und
Hormone), Enzyme;
Proteine sind Bau- und Funktionsmoleküle
in und außerhalb der Zelle, Informationsmoleküle (z.B. Zytokine und
Hormone), Enzyme; Nukleotide dienen der Informationsspeicherung (DNA) und -übertragung (RNA), dem Energiestoffwechsel (ATP) u.a.
Nukleotide dienen der Informationsspeicherung (DNA) und -übertragung (RNA), dem Energiestoffwechsel (ATP) u.a. ) benötigt, welche die betreffenden Reaktionen in spezifischer
Weise "einschalten", d.h. ermöglichen bzw. beschleunigen. Sie können die Aktivierungsenergie,
die für den Übergang von einem zu einem anderen Zustand nötig ist,
herabsetzen (
) benötigt, welche die betreffenden Reaktionen in spezifischer
Weise "einschalten", d.h. ermöglichen bzw. beschleunigen. Sie können die Aktivierungsenergie,
die für den Übergang von einem zu einem anderen Zustand nötig ist,
herabsetzen ( Abbildung). Dadurch wird der thermodynamische Anspruch
an die "Schwellenüberwindung" reduziert und ein Reaktionsgleichgewicht
stellt sich rascher ein. Mit anderen Worten, mehr Moleküle sind
in der Lage, in einer bestimmten Zeitspanne die Energiebarriere zu
überwinden.
Abbildung). Dadurch wird der thermodynamische Anspruch
an die "Schwellenüberwindung" reduziert und ein Reaktionsgleichgewicht
stellt sich rascher ein. Mit anderen Worten, mehr Moleküle sind
in der Lage, in einer bestimmten Zeitspanne die Energiebarriere zu
überwinden.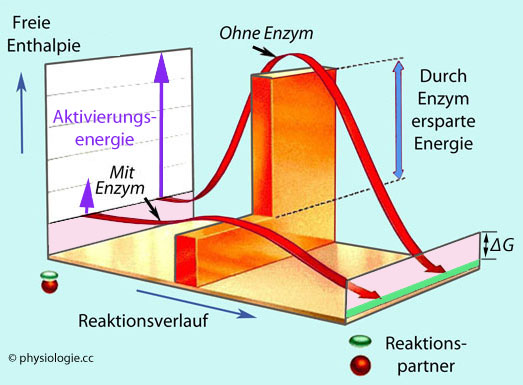
 Abbildung: Ein Enzym verringert die Energieschwelle für "seine" Reaktion
Abbildung: Ein Enzym verringert die Energieschwelle für "seine" Reaktion
 Als Aktivierungsenergie (activation energy)
bezeichnet man die mindestens notwendige Energie, die man potenziellen
Reaktionspartnern zuführen muss, um eine Reaktion zu starten (vgl. dort).
Als Aktivierungsenergie (activation energy)
bezeichnet man die mindestens notwendige Energie, die man potenziellen
Reaktionspartnern zuführen muss, um eine Reaktion zu starten (vgl. dort).  Abbildung). Enzyme ändern nichts am
chemischen
Gleichgewicht, steigern aber die "Trefferquote" der Reaktionspartner
durch Erhöhung der Reaktionsgeschwindigkeit der Hin- und Rückreaktion.
Sie können Reaktionen um
einen Faktor beschleunigen, der viele Zehnerpotenzen beträgt.
Abbildung). Enzyme ändern nichts am
chemischen
Gleichgewicht, steigern aber die "Trefferquote" der Reaktionspartner
durch Erhöhung der Reaktionsgeschwindigkeit der Hin- und Rückreaktion.
Sie können Reaktionen um
einen Faktor beschleunigen, der viele Zehnerpotenzen beträgt.  Cofaktoren sind Metallionen wie Magnesium (ATPasen, Adenylatcyclasen, Kinasen), Eisen (Hämproteine, Cytochrome, Katalasen, Peroxidasen), Zink (Superoxiddismutase, Kollagenase, Alkohol-Dehydrogenase, alkalische Phosphatase, Transkriptionsfaktoren, Carboanhydrase), Kupfer (Cytochrom C-Oxidase, Ferroxidase, Superoxiddismutase, Tyrosinase), Selen (Glutathionperoxidase).
Cofaktoren sind Metallionen wie Magnesium (ATPasen, Adenylatcyclasen, Kinasen), Eisen (Hämproteine, Cytochrome, Katalasen, Peroxidasen), Zink (Superoxiddismutase, Kollagenase, Alkohol-Dehydrogenase, alkalische Phosphatase, Transkriptionsfaktoren, Carboanhydrase), Kupfer (Cytochrom C-Oxidase, Ferroxidase, Superoxiddismutase, Tyrosinase), Selen (Glutathionperoxidase). Coenzyme sind kleine organische Moleküle, meist Vitaminabkömmlinge, wie Thiamin (Dehydrogenasen, Transketolase), Riboflavin (Redox-Enzyme), Niacin (Dehydrogenasen, Redox-Enzyme), Pantothensäure (Dehydrogenasen, Fettsäuresynthase), B6 (Transaminasen, Decarboxylasen, Glykogenphosphorylase), Folat (Transferasen / Synthasen), B12 (CoA-Mutase, Methioninsynthase), Ascorbinsäure (Hydroxylasen, Carboxylasen).
Coenzyme sind kleine organische Moleküle, meist Vitaminabkömmlinge, wie Thiamin (Dehydrogenasen, Transketolase), Riboflavin (Redox-Enzyme), Niacin (Dehydrogenasen, Redox-Enzyme), Pantothensäure (Dehydrogenasen, Fettsäuresynthase), B6 (Transaminasen, Decarboxylasen, Glykogenphosphorylase), Folat (Transferasen / Synthasen), B12 (CoA-Mutase, Methioninsynthase), Ascorbinsäure (Hydroxylasen, Carboxylasen). Die optimale Temperatur beträgt
für die meisten Enzyme 37°C, also die normale Betriebstemperatur des
Organismus. Steigende Temperatur unterhalb des Optimums erhöht auch die
Wahrscheinlichkeit des Zusammentreffens des Substrats mit dem aktiven
Zentrum des Enzyms, bei Temperaturwerten über dem Optimum kommt es zu
Denaturierung und Funktionsverlust des Enzyms.
Die optimale Temperatur beträgt
für die meisten Enzyme 37°C, also die normale Betriebstemperatur des
Organismus. Steigende Temperatur unterhalb des Optimums erhöht auch die
Wahrscheinlichkeit des Zusammentreffens des Substrats mit dem aktiven
Zentrum des Enzyms, bei Temperaturwerten über dem Optimum kommt es zu
Denaturierung und Funktionsverlust des Enzyms. Die Konzentration an Wasserstoffionen
spielt ebenfalls eine Rolle; die meisten Enzyme funktionieren zwischen
pH 4 und pH 8 (Enzyme im Magen, insbesondere Pepsin, funktionieren in
einem noch saureren pH-Bereich - Pepsin zwischen pH 0 und pH 3 - und
verlieren ihre Aktivität im Duodenum; das pankreatische Trypsin hat
sein pH-Optimum bei pH 8).
Die Konzentration an Wasserstoffionen
spielt ebenfalls eine Rolle; die meisten Enzyme funktionieren zwischen
pH 4 und pH 8 (Enzyme im Magen, insbesondere Pepsin, funktionieren in
einem noch saureren pH-Bereich - Pepsin zwischen pH 0 und pH 3 - und
verlieren ihre Aktivität im Duodenum; das pankreatische Trypsin hat
sein pH-Optimum bei pH 8). Die meisten Enzyme haben ein pH-Optimum um ca. 7,4 - dem "inneren pH" des Organismus (
Die meisten Enzyme haben ein pH-Optimum um ca. 7,4 - dem "inneren pH" des Organismus ( pH-Wert im Blut).
pH-Wert im Blut).  Proteinsynthese s. dort) oder abgebaut werden (
Proteinsynthese s. dort) oder abgebaut werden ( Ubiquitinmechanismus s. dort).
Beides wird von entsprechenden Rückkopplungsmechanismen gesteuert. Auf
diese Weise kann die Zelle über ihre Enzymausstattung die jeweils
gewünschten Stoffwechselwirkungen erzielen (z.B. Wachstum,
Hormonbildung, Sekretion...). Die Funktionen einer Zelle sind über ihre
Expression bestimmter Enzyme definiert, diese begünstigen die Bildung
bestimmter Stoffwechselprodukte, und diese können wiederum die Ablesung
von Genen beeinflussen (
Ubiquitinmechanismus s. dort).
Beides wird von entsprechenden Rückkopplungsmechanismen gesteuert. Auf
diese Weise kann die Zelle über ihre Enzymausstattung die jeweils
gewünschten Stoffwechselwirkungen erzielen (z.B. Wachstum,
Hormonbildung, Sekretion...). Die Funktionen einer Zelle sind über ihre
Expression bestimmter Enzyme definiert, diese begünstigen die Bildung
bestimmter Stoffwechselprodukte, und diese können wiederum die Ablesung
von Genen beeinflussen ( Abbildung). So
ergeben sich multiple Rückkopplungsschleifen, die einerseits den
Metabolismus der Zelle stabilisieren, andererseits den Stoffwechsel an
veränderte Rahmenbedingungen anpassen können.
Abbildung). So
ergeben sich multiple Rückkopplungsschleifen, die einerseits den
Metabolismus der Zelle stabilisieren, andererseits den Stoffwechsel an
veränderte Rahmenbedingungen anpassen können.
 Abbildung: Die Stellung von Enzymen zwischen Genen und Metabolismus in der Zelle
Abbildung: Die Stellung von Enzymen zwischen Genen und Metabolismus in der Zelle
 Abbildung).
Abbildung).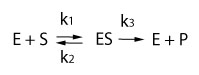
 Mit
zunehmender Substratkonzentration nimmt die Reaktionsgeschwindigkeit
zu, bis sie - bei mit Substrat gesättigtem Enzym - maximal ist (Vmax). Eine wichtige Größe zur Quantifizierung der Kinetik ist die Michaeliskonstante Km
Mit
zunehmender Substratkonzentration nimmt die Reaktionsgeschwindigkeit
zu, bis sie - bei mit Substrat gesättigtem Enzym - maximal ist (Vmax). Eine wichtige Größe zur Quantifizierung der Kinetik ist die Michaeliskonstante Km  :
:  Die Michaeliskonstante (Km, Michaelis-Menten-Konstante) ist diejenige Substratkonzentration (mol/l), bei der die Reaktionsgeschwindigkeit (Enzym / Substrat) die Hälfte des Maximalwertes erreicht (Vmax/2). Sie ist eine charakteristische Eigenschaft einer Transportsystems bzw. Enzyms und gilt
als Maß für die Affinität des Enzyms bzw. Transportproteins für sein Substrat:
Die Michaeliskonstante (Km, Michaelis-Menten-Konstante) ist diejenige Substratkonzentration (mol/l), bei der die Reaktionsgeschwindigkeit (Enzym / Substrat) die Hälfte des Maximalwertes erreicht (Vmax/2). Sie ist eine charakteristische Eigenschaft einer Transportsystems bzw. Enzyms und gilt
als Maß für die Affinität des Enzyms bzw. Transportproteins für sein Substrat:  Ein niedriger Km-Wert zeigt eine stabile Bindung (hohe Affinität) zwischen Enzym / Transporter und Substrat an (und umgekehrt: Ein hoher [Km] bedeutet niedrige Bindungsstärke).
Ein niedriger Km-Wert zeigt eine stabile Bindung (hohe Affinität) zwischen Enzym / Transporter und Substrat an (und umgekehrt: Ein hoher [Km] bedeutet niedrige Bindungsstärke). Maximale Reaktionsgeschwindigkeit erreicht ein Enzymsystem ab einer Substratkonzentration, die dem Zehnfachen des Km-Wertes entspricht.
Maximale Reaktionsgeschwindigkeit erreicht ein Enzymsystem ab einer Substratkonzentration, die dem Zehnfachen des Km-Wertes entspricht.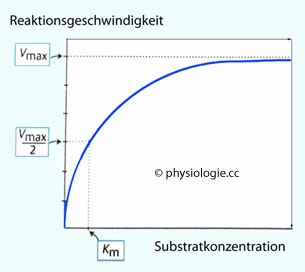
 Abbildung: Michaelis-Menten-Beziehung (Michaelis-Menten plot)
Abbildung: Michaelis-Menten-Beziehung (Michaelis-Menten plot)
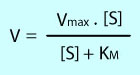
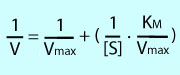
 dargestellt, ergibt sich eine Gerade (
dargestellt, ergibt sich eine Gerade ( Abbildung):
Abbildung):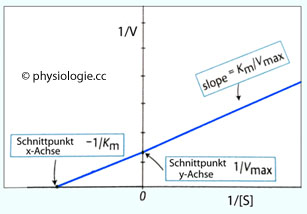
 Abbildung: Lineweaver-Burk-Diagramm
Abbildung: Lineweaver-Burk-Diagramm
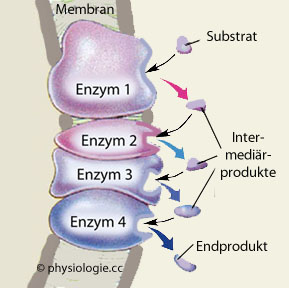
 Abbildung: Enzymkette
Abbildung: Enzymkette
 Abbildung), um eine Optimierung der Reaktionsabfolge
von einer Ausgangssubstanz (Substrat) über oft mehrere Zwischenstufen
bis zum fertigen Endprodukt zu erzielen.
Abbildung), um eine Optimierung der Reaktionsabfolge
von einer Ausgangssubstanz (Substrat) über oft mehrere Zwischenstufen
bis zum fertigen Endprodukt zu erzielen.  Die Bindungsfähigkeit eines Liganden an der Bindungsstelle (diese wird durch Cofaktoren beeinflusst),
Die Bindungsfähigkeit eines Liganden an der Bindungsstelle (diese wird durch Cofaktoren beeinflusst), die Aktivität des Proteins (ändert sich z.B. mit der Temperatur oder dem pH-Wert),
die Aktivität des Proteins (ändert sich z.B. mit der Temperatur oder dem pH-Wert), seine Fähigkeit zu einer entsprechenden Reaktion - durch aktivierende oder hemmende Faktoren.
seine Fähigkeit zu einer entsprechenden Reaktion - durch aktivierende oder hemmende Faktoren.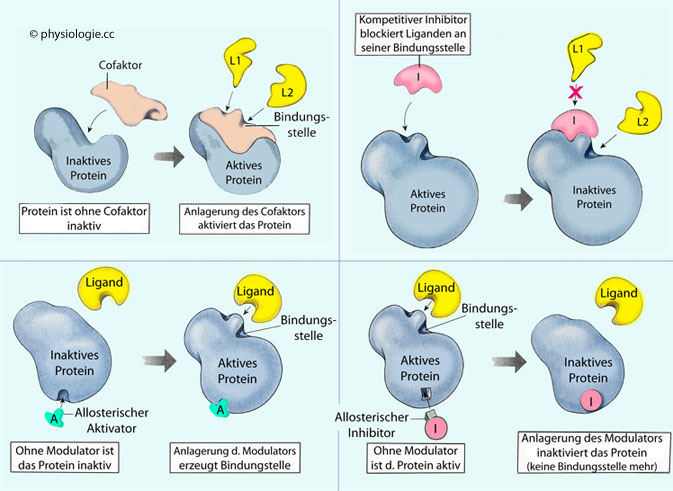
 Abbildung: Faktoren, welche die Bindung von Liganden an Proteine (Enzyme, Rezeptoren, ..) beeinflussen
Abbildung: Faktoren, welche die Bindung von Liganden an Proteine (Enzyme, Rezeptoren, ..) beeinflussen
 d.h. die Verquickung von Funktions- und Gestalteffekt. Ein Beispiel ist die S-Form der Bindungskurve des Hämoglobins (Besetzung eines der 4 Hämeinheiten mit Sauerstoff verändert die Form und damit die Bindungscharakteristik des Gesamtmoleküls).
d.h. die Verquickung von Funktions- und Gestalteffekt. Ein Beispiel ist die S-Form der Bindungskurve des Hämoglobins (Besetzung eines der 4 Hämeinheiten mit Sauerstoff verändert die Form und damit die Bindungscharakteristik des Gesamtmoleküls). Als allosterischen Regulator / Modulator bezeichnet man eine Substanz, die an einen Rezeptor oder ein Enzym - abseits dessen aktiver Stelle - bindet,
eine Gestalts- ("Allosterie") und damit Aktivitätsänderung dieses
Rezeptors oder Enzyms bewirkt. Eine solche Bindungsstelle heißt allosterische / regulatorische Stelle, der Effektorstoff wird - je nach Wirkung - als allosterischer Aktivator bzw. allosterischer Inhibitor bezeichnet.
Als allosterischen Regulator / Modulator bezeichnet man eine Substanz, die an einen Rezeptor oder ein Enzym - abseits dessen aktiver Stelle - bindet,
eine Gestalts- ("Allosterie") und damit Aktivitätsänderung dieses
Rezeptors oder Enzyms bewirkt. Eine solche Bindungsstelle heißt allosterische / regulatorische Stelle, der Effektorstoff wird - je nach Wirkung - als allosterischer Aktivator bzw. allosterischer Inhibitor bezeichnet.  Klassische Aktivierung und Hemmung, z.B. durch Kompetition mehrerer
Molekülarten um Bindung, oder allosterische Effekte - die Enzyme haben
neben katalytischen auch regulatorische Bereiche, an denen steuernde Substanzen wirken (
Klassische Aktivierung und Hemmung, z.B. durch Kompetition mehrerer
Molekülarten um Bindung, oder allosterische Effekte - die Enzyme haben
neben katalytischen auch regulatorische Bereiche, an denen steuernde Substanzen wirken ( Abbildung)
Abbildung)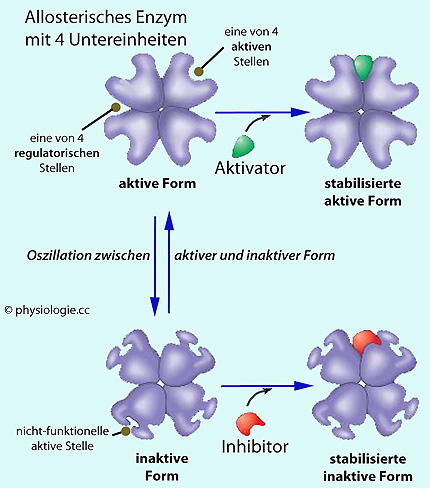
 Abbildung: Steuerung allosterischer Enzyme
Abbildung: Steuerung allosterischer Enzyme
 Interkonversion, d.h. Änderung des Aktivitätszustandes z.B. durch
Phosphorylierung (kann aktivieren oder auch inaktivieren)
Interkonversion, d.h. Änderung des Aktivitätszustandes z.B. durch
Phosphorylierung (kann aktivieren oder auch inaktivieren) Räumlich-zeitliche Separation und entsprechende Aktivierung (Zymogene werden in inaktiver Form gespeichert und erst aktiviert, wenn dies sinnvoll ist -
Räumlich-zeitliche Separation und entsprechende Aktivierung (Zymogene werden in inaktiver Form gespeichert und erst aktiviert, wenn dies sinnvoll ist -  s. Verdauungsenzyme)
s. Verdauungsenzyme) Isoenzyme: Homologe Enzymvarianten mit unterschiedlichen, je nach
Einsatzort optimierten Eigenschaften - z.B. LDH-Isoenzyme (Formen für
Herz, Lymphsystem, Lunge, Nieren, Leber / Muskulatur)
Isoenzyme: Homologe Enzymvarianten mit unterschiedlichen, je nach
Einsatzort optimierten Eigenschaften - z.B. LDH-Isoenzyme (Formen für
Herz, Lymphsystem, Lunge, Nieren, Leber / Muskulatur) Kinetik: Gleichgewicht Enzymnachbildung / Abbau (Turnover)
Kinetik: Gleichgewicht Enzymnachbildung / Abbau (Turnover) Enzymhemmung: Enzyme können durch Hemmung ihrer Aktivität reguliert werden (Enzymregulation).
Dies erfolgt durch Inhibitoren, die sich an das Enzym anlagern. Das hat
zur Folge, dass das Substrat nur langsam oder gar nicht mehr umgesetzt
werden kann. Die Inhibition kann reversibel (umkehrbar) oder
irreversibel sein. Irreversible Hemmung kann erfolgen
durch Modifikation bzw. Destruktion funktioneller
Gruppen am Enzym (z.B. durch Cyanid, Quecksilber u.a.).
Beispielsweise hemmt Penicillin permanent die Synthese von
Peptidoglycanen, Bausteinen der Bakterienwand.
Enzymhemmung: Enzyme können durch Hemmung ihrer Aktivität reguliert werden (Enzymregulation).
Dies erfolgt durch Inhibitoren, die sich an das Enzym anlagern. Das hat
zur Folge, dass das Substrat nur langsam oder gar nicht mehr umgesetzt
werden kann. Die Inhibition kann reversibel (umkehrbar) oder
irreversibel sein. Irreversible Hemmung kann erfolgen
durch Modifikation bzw. Destruktion funktioneller
Gruppen am Enzym (z.B. durch Cyanid, Quecksilber u.a.).
Beispielsweise hemmt Penicillin permanent die Synthese von
Peptidoglycanen, Bausteinen der Bakterienwand. Kompetitive Inhibition:
Der Inhibitor verdrängt das eigentliche Substrat - dank ähnlicher
Struktur - an der aktiven Stelle des
Enzyms, dessen Wirkung auf das Substrat dadurch nachlässt. Bindung
eines kompetitiven Inhibitors senkt die Affinität des Enzyms für sein
Substrat und erhöht folglich den KM-Wert. Erhöhung der
Substratkonzentration kann den Inhibitor wieder verdrängen
Kompetitive Inhibition:
Der Inhibitor verdrängt das eigentliche Substrat - dank ähnlicher
Struktur - an der aktiven Stelle des
Enzyms, dessen Wirkung auf das Substrat dadurch nachlässt. Bindung
eines kompetitiven Inhibitors senkt die Affinität des Enzyms für sein
Substrat und erhöht folglich den KM-Wert. Erhöhung der
Substratkonzentration kann den Inhibitor wieder verdrängen Nichtkompetitive Inhibition:
Der Inhibitor bindet nicht an die aktive, sondern eine andere Stelle
des Enzyms. Dies kann eine allosterische Stelle sein und man spricht
von allosterischer Hemmung. Jenenfalls führt die Anlagerung des
Inhibitors zu einer Veränderung der Form der aktiven Stelle des Enzyms,
dadurch sinkt die Reaktionsgeschwindigkeit
Nichtkompetitive Inhibition:
Der Inhibitor bindet nicht an die aktive, sondern eine andere Stelle
des Enzyms. Dies kann eine allosterische Stelle sein und man spricht
von allosterischer Hemmung. Jenenfalls führt die Anlagerung des
Inhibitors zu einer Veränderung der Form der aktiven Stelle des Enzyms,
dadurch sinkt die Reaktionsgeschwindigkeit Unkompetitive Inhibition:
In diesem Fall bindet der Inhibitor erst dann an das Enzym, wenn dieses
mit dem Substrat einen Komplex gebildet hat. Durch die Anlagerung des
Inhibitors an diesen Komplex ist die Wirkung des Enzyms auf das
Substrat blockiert, es entsteht kein Produkt mehr.
Unkompetitive Inhibition:
In diesem Fall bindet der Inhibitor erst dann an das Enzym, wenn dieses
mit dem Substrat einen Komplex gebildet hat. Durch die Anlagerung des
Inhibitors an diesen Komplex ist die Wirkung des Enzyms auf das
Substrat blockiert, es entsteht kein Produkt mehr.  ). Insgesamt führen wir dem Körper mit der Nahrung ~104 verschiedene Fremdstoffe (Xenobiotika
). Insgesamt führen wir dem Körper mit der Nahrung ~104 verschiedene Fremdstoffe (Xenobiotika  )
zu (z.B. in Kaffee ~300 verschiedene Substanzen). Diese werden
von fremdstoffmetabolisierenden Enzymen abgebaut, die im Rahmen von Phase I- und Phase II-Reaktionen aktiv werden: So werden etwa Phytoalexine in weniger gefährliche Stoffe umgewandelt und leichter ausscheidbar gemacht.
)
zu (z.B. in Kaffee ~300 verschiedene Substanzen). Diese werden
von fremdstoffmetabolisierenden Enzymen abgebaut, die im Rahmen von Phase I- und Phase II-Reaktionen aktiv werden: So werden etwa Phytoalexine in weniger gefährliche Stoffe umgewandelt und leichter ausscheidbar gemacht. Redoxreaktionen: Oxidoreduktasen (Klasse 1-Enzyme EC 1), sie erleichtern Redox-Reaktionen (Abgabe von Elektronen durch einen Donor = Oxidation - im Anabolismus wird oft NADPH oxidiert, dabei gibt es Elektronen ab; Aufnahme von Elektronen durch einen Akzeptor = Reduktion - im Katabolismus wird meist FAD oder NAD+ reduziert).
Redoxreaktionen: Oxidoreduktasen (Klasse 1-Enzyme EC 1), sie erleichtern Redox-Reaktionen (Abgabe von Elektronen durch einen Donor = Oxidation - im Anabolismus wird oft NADPH oxidiert, dabei gibt es Elektronen ab; Aufnahme von Elektronen durch einen Akzeptor = Reduktion - im Katabolismus wird meist FAD oder NAD+ reduziert).  Gruppenübertragungen: Transferasen (Klasse 2-Enzyme EC 2), sie übertragen funktionelle Gruppen von einem Molekül
auf ein anderes, z.B. Transaminasen (Aminogruppe -NH2), Methyltransferasen (Methylgruppe -CH3), Kinasen (Phosphatgruppe -PO43- von energiereichen Molekülen, typischerweise ATP). Kinasen gehören zur größeren Gruppe der Phosphotransferasen.
Gruppenübertragungen: Transferasen (Klasse 2-Enzyme EC 2), sie übertragen funktionelle Gruppen von einem Molekül
auf ein anderes, z.B. Transaminasen (Aminogruppe -NH2), Methyltransferasen (Methylgruppe -CH3), Kinasen (Phosphatgruppe -PO43- von energiereichen Molekülen, typischerweise ATP). Kinasen gehören zur größeren Gruppe der Phosphotransferasen. Kondensationen und Hydrolysen: Hydrolasen (Klasse 3-Enzyme EC 3) spalten
Moleküle unter Einsatz von Wasser oder verknüpfen Moleküle unter
Wasserausscheidung (Kondensation) - so entstehen z.B. Proteine aus
einzelnen Aminosäuren, Ribosomen wirken hydrolytisch; Peptidasen /
Proteasen wirken umgekehrt peptidbindungsspaltend, wobei H2O eingebaut wird. Phosphatasen entfernen Phosphatgruppen von Molekülen, während Phosphorylasen anorganisches Phosphat auf ein Empfängermolekül übertragen.
Kondensationen und Hydrolysen: Hydrolasen (Klasse 3-Enzyme EC 3) spalten
Moleküle unter Einsatz von Wasser oder verknüpfen Moleküle unter
Wasserausscheidung (Kondensation) - so entstehen z.B. Proteine aus
einzelnen Aminosäuren, Ribosomen wirken hydrolytisch; Peptidasen /
Proteasen wirken umgekehrt peptidbindungsspaltend, wobei H2O eingebaut wird. Phosphatasen entfernen Phosphatgruppen von Molekülen, während Phosphorylasen anorganisches Phosphat auf ein Empfängermolekül übertragen.  A-H + B-OH
A-H + B-OH Molekülspaltungen: Lyasen (Klasse 4-Enzyme EC 4) entfernen oder addieren Elemente z.B. von Wasser, CO2 oder Ammoniak von / zu einer Doppelbindung. Sie knüpfen kleine Moleküle - z.B. CO2 - an Doppelbindungen größerer und heißen deshalb auch Synthasen, können aber auch in umgekehrter Richtung wirken, z.B. Decarboxylasen.
Molekülspaltungen: Lyasen (Klasse 4-Enzyme EC 4) entfernen oder addieren Elemente z.B. von Wasser, CO2 oder Ammoniak von / zu einer Doppelbindung. Sie knüpfen kleine Moleküle - z.B. CO2 - an Doppelbindungen größerer und heißen deshalb auch Synthasen, können aber auch in umgekehrter Richtung wirken, z.B. Decarboxylasen. Isomerisierungen: Isomerasen (Klasse 5-Enzyme EC 5), sie "switchen" Moleküle zwischen isomeren Formen (Epimerasen, Mutasen)
Isomerisierungen: Isomerasen (Klasse 5-Enzyme EC 5), sie "switchen" Moleküle zwischen isomeren Formen (Epimerasen, Mutasen) Synthesen: Ligasen (Klasse 6-Enzyme EC 6), sie verknüpfen Moleküle (ähnlich Klasse IV-Enzymen, aber unter Verwendung energiereicher Phosphate). Sie heißen deshalb auch Synthasen.
Synthesen: Ligasen (Klasse 6-Enzyme EC 6), sie verknüpfen Moleküle (ähnlich Klasse IV-Enzymen, aber unter Verwendung energiereicher Phosphate). Sie heißen deshalb auch Synthasen.  Bewegung von Ionen / Molekülen über Membranen oder deren Separation in Membranen: Translokasen (Klasse 7-Enzyme EC 7).
Bewegung von Ionen / Molekülen über Membranen oder deren Separation in Membranen: Translokasen (Klasse 7-Enzyme EC 7). Kinasen übertragen Phosphatgruppen von einem energiereichen
Spendermolekül (ATP) auf ein anderes; Phosphorylasen fügen anorganische
Phosphatgruppen zu einem Empfängermolekül hinzu; Phosphatasen entfernen
Phosphatreste von Molekülen.
Kinasen übertragen Phosphatgruppen von einem energiereichen
Spendermolekül (ATP) auf ein anderes; Phosphorylasen fügen anorganische
Phosphatgruppen zu einem Empfängermolekül hinzu; Phosphatasen entfernen
Phosphatreste von Molekülen.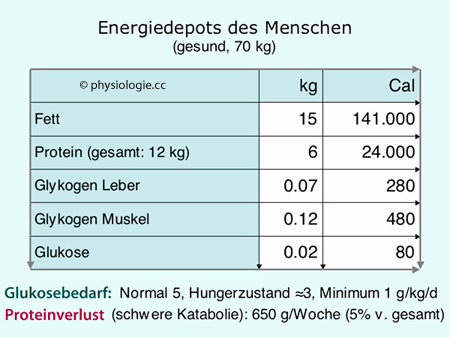
 Tabelle: Energiespeicher im Organismus einer normalgewichtigen erwachsenen Person
Tabelle: Energiespeicher im Organismus einer normalgewichtigen erwachsenen Person
 wird durch das Enzym Glykogen-Phosphorylase an mehreren Stellen der verzweigten Glykogenmoleküle
gleichzeitig bewerkstelligt und liefert direkt Glucose-1-Phosphat -
z.B. in den Muskelzellen, die damit direkt Energielieferanten erhält,
die dabei aufgrund der Phosphorylierung nicht aus der Zelle entweichen
können.
wird durch das Enzym Glykogen-Phosphorylase an mehreren Stellen der verzweigten Glykogenmoleküle
gleichzeitig bewerkstelligt und liefert direkt Glucose-1-Phosphat -
z.B. in den Muskelzellen, die damit direkt Energielieferanten erhält,
die dabei aufgrund der Phosphorylierung nicht aus der Zelle entweichen
können.  Die wichtigste Energiereserve des Körpers ist das Fettgewebe. Bei einem
Körperfett von z.B. 15 kg (
Die wichtigste Energiereserve des Körpers ist das Fettgewebe. Bei einem
Körperfett von z.B. 15 kg ( Tabelle) entspricht das etwa 140.000
Kilokalorien, bei einer erwachsenen Person der Energiebedarf für
mehr als zwei Monate. Tatsächlich bezieht der Organismus im Hungerzustand
den überwiegenden Großteil seiner Energie aus dem Fettgewebe
(
Tabelle) entspricht das etwa 140.000
Kilokalorien, bei einer erwachsenen Person der Energiebedarf für
mehr als zwei Monate. Tatsächlich bezieht der Organismus im Hungerzustand
den überwiegenden Großteil seiner Energie aus dem Fettgewebe
( Ketonkörper s. dort).
Ketonkörper s. dort). Als essentiell gelten Aminosäuren, die der Körper nicht selbst synthetisieren kann (und die daher mit der Nahrung zugeführt werden müssen); als bedingt essentiell solche, die er aus anderen stickstoffhaltigen Metaboliten bilden kann (falls diese in ausreichender Menge vorhanden sind).
Als essentiell gelten Aminosäuren, die der Körper nicht selbst synthetisieren kann (und die daher mit der Nahrung zugeführt werden müssen); als bedingt essentiell solche, die er aus anderen stickstoffhaltigen Metaboliten bilden kann (falls diese in ausreichender Menge vorhanden sind). Abbildung):
Abbildung):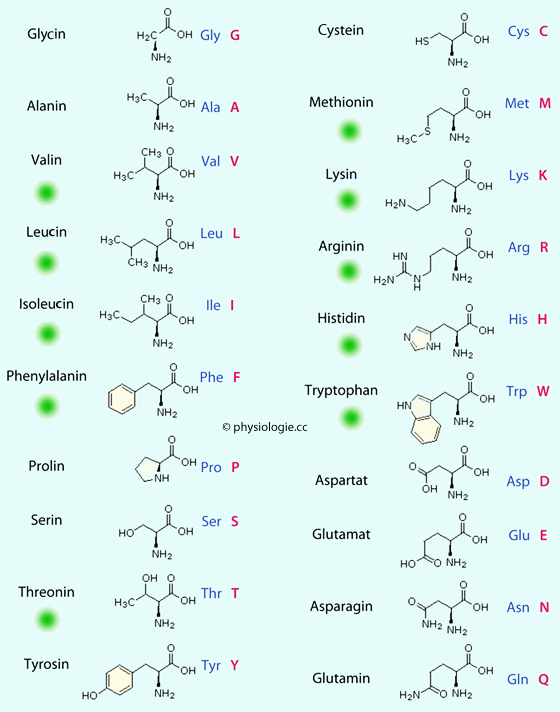
 Abbildung: Aminosäuren
Abbildung: Aminosäuren
 1992 erhielten die US-amerikanischen Biochemiker Edmond Fischer und Edwin Krebs (nicht verwandt mit Hans Krebs,
nach dem der Citratzyklus benannt ist und der 1953 Nobelpreisträger
war) den Nobelpreis für Physiologie oder Medizin "für ihre Entdeckung
der Mechanismen, welche die Stoffwechselvorgänge in Organismen
steuern". Fischer und Krebs arbeiteten über die Glykogenphosphorylase
und erforschten ihre Aktivierung / Inaktivierung mittels
second-messenger-Mechanismen.
1992 erhielten die US-amerikanischen Biochemiker Edmond Fischer und Edwin Krebs (nicht verwandt mit Hans Krebs,
nach dem der Citratzyklus benannt ist und der 1953 Nobelpreisträger
war) den Nobelpreis für Physiologie oder Medizin "für ihre Entdeckung
der Mechanismen, welche die Stoffwechselvorgänge in Organismen
steuern". Fischer und Krebs arbeiteten über die Glykogenphosphorylase
und erforschten ihre Aktivierung / Inaktivierung mittels
second-messenger-Mechanismen. 
 Mit ~10 MJ
verbraucht ein erwachsener Mensch etwa gleich viel Energie wie eine 100
W-Glühbirne. Dazu wird Sauerstoff benötigt: Zellen gewinnen ihre
Energieträger (ATP) vor allem durch oxidative Phosphorylierung von Nahrungsstoffen und im Körper nutzbaren Depots.
Bei deren Abbau gewonnene energiereiche Elektronen werden an der
inneren Mitochondrienmembran entlang einer enzymatischen Transportkette
weitergereicht, dabei gelangen Protonen in den Intermembranraum, die
beim Zurückdiffundieren durch ATP-Synthasen energiereiche Phosphate (ADP + P → ATP) erzeugen. Die hier gespeicherte Energie kann auf energieverbrauchende Vorgänge (Bewegung, Transport, Aufbau) übertragen werden. Vorübergehend
kann die Zelle ihren Energiebedarf auch anoxidativ
decken (anaerobe Glykolyse) Mit ~10 MJ
verbraucht ein erwachsener Mensch etwa gleich viel Energie wie eine 100
W-Glühbirne. Dazu wird Sauerstoff benötigt: Zellen gewinnen ihre
Energieträger (ATP) vor allem durch oxidative Phosphorylierung von Nahrungsstoffen und im Körper nutzbaren Depots.
Bei deren Abbau gewonnene energiereiche Elektronen werden an der
inneren Mitochondrienmembran entlang einer enzymatischen Transportkette
weitergereicht, dabei gelangen Protonen in den Intermembranraum, die
beim Zurückdiffundieren durch ATP-Synthasen energiereiche Phosphate (ADP + P → ATP) erzeugen. Die hier gespeicherte Energie kann auf energieverbrauchende Vorgänge (Bewegung, Transport, Aufbau) übertragen werden. Vorübergehend
kann die Zelle ihren Energiebedarf auch anoxidativ
decken (anaerobe Glykolyse) Enzyme stoßen
Reaktionen an, indem sie die Energieschwelle erniedrigen, die für deren
Start erforderlich ist. Über Wirkung aktiver Zentren und instabiler Zwischenzustände reduzieren sie die freie
Enthalpie des Übergangszustandes (freie Aktivierungsenergie), steigern die Zahl der Moleküle, die diese Energiebarriere überwinden, und können Reaktionen um Zehnerpotenzen beschleunigen. (In-) Aktivierung, Bildung und Abbau sowie Gruppierung von Schlüsselenzymen können ganze metabolische
Pfade einfrieren oder einschalten (veränderte Verfügbarkeit von Substraten oder
Intermediärprodukten). Enzyme ändern nichts am chemischen
Gleichgewicht, erhöhen aber die "Trefferquote" der Reaktionspartner und
damit die Geschwindigkeit der Hin- und Rückreaktion Enzyme stoßen
Reaktionen an, indem sie die Energieschwelle erniedrigen, die für deren
Start erforderlich ist. Über Wirkung aktiver Zentren und instabiler Zwischenzustände reduzieren sie die freie
Enthalpie des Übergangszustandes (freie Aktivierungsenergie), steigern die Zahl der Moleküle, die diese Energiebarriere überwinden, und können Reaktionen um Zehnerpotenzen beschleunigen. (In-) Aktivierung, Bildung und Abbau sowie Gruppierung von Schlüsselenzymen können ganze metabolische
Pfade einfrieren oder einschalten (veränderte Verfügbarkeit von Substraten oder
Intermediärprodukten). Enzyme ändern nichts am chemischen
Gleichgewicht, erhöhen aber die "Trefferquote" der Reaktionspartner und
damit die Geschwindigkeit der Hin- und Rückreaktion Eine Kenngröße
enzymatischer Aktivität ist die Michaelis-Menten-Konstante (KM) - die
Substratkonzentration, bei der die Reaktionsgeschwindigkeit halbmaximal
ist. KM kann als Maß für die Affinität eines Enzyms / Transportproteins
für sein Substrat gelten: Niedriger [KM]
bedeutet stabile Bindung (hohe Affinität) zwischen Enzym / Transporter
und Substrat, hoher [KM] bedeutet niedrige Bindungsstärke. Die Michaelis-Menten-Gleichung gibt die Geschwindigkeit (V) der katalysierten Reaktion an, sie hängt ab von der Substratkonzentration (S) und [KM]: V = Vmax ([S] / [S] + KM) Eine Kenngröße
enzymatischer Aktivität ist die Michaelis-Menten-Konstante (KM) - die
Substratkonzentration, bei der die Reaktionsgeschwindigkeit halbmaximal
ist. KM kann als Maß für die Affinität eines Enzyms / Transportproteins
für sein Substrat gelten: Niedriger [KM]
bedeutet stabile Bindung (hohe Affinität) zwischen Enzym / Transporter
und Substrat, hoher [KM] bedeutet niedrige Bindungsstärke. Die Michaelis-Menten-Gleichung gibt die Geschwindigkeit (V) der katalysierten Reaktion an, sie hängt ab von der Substratkonzentration (S) und [KM]: V = Vmax ([S] / [S] + KM)  Es
gibt
Oxidoreduktasen, Transferasen, Hydrolasen, Lyasen, Isomerasen,
Synthetasen, ATPasen / GTPasen. Viele Enzyme funktionieren allosterisch
(Konformationsänderung) und verfügen über unterschiedliche
Bindungsstellen (Anlagerung von Substrat einerseits, regulierenden
Signalmolekülen andererseits). Reguliert werden Enzymaktivitäten durch
Aktivierung und Hemmung,
z.B. durch allosterische Effekte oder Kompetition um Bindung; Änderung
des Aktivitätszustandes, z.B. durch Phosphorylierung;
räumlich-zeitliche Separation; oder Veränderung des Gleichgewichts
Enzymnachbildung / Abbau. Aktivatoren
arretieren das Molekül in der aktiven, Inhibitoren in der inaktiven
Form Es
gibt
Oxidoreduktasen, Transferasen, Hydrolasen, Lyasen, Isomerasen,
Synthetasen, ATPasen / GTPasen. Viele Enzyme funktionieren allosterisch
(Konformationsänderung) und verfügen über unterschiedliche
Bindungsstellen (Anlagerung von Substrat einerseits, regulierenden
Signalmolekülen andererseits). Reguliert werden Enzymaktivitäten durch
Aktivierung und Hemmung,
z.B. durch allosterische Effekte oder Kompetition um Bindung; Änderung
des Aktivitätszustandes, z.B. durch Phosphorylierung;
räumlich-zeitliche Separation; oder Veränderung des Gleichgewichts
Enzymnachbildung / Abbau. Aktivatoren
arretieren das Molekül in der aktiven, Inhibitoren in der inaktiven
Form Die wichtigste
Energiereserve des Körpers ist das Fettgewebe (Energiebedarf für Monate), aus ihm bezieht der Körper im
Hungerzustand den Großteil seiner Energie. Fette können aus Kohlenhydraten aufgebaut werden. Für einige Stunden kann
Energie aus Kohlenhydratreserven (Glykogen) bezogen werden: Glykogen-Phosphorylase
spaltet an mehreren Stellen der verzweigten Glykogenmoleküle gleichzeitig. Proteine sind wertvolle Baustoffe und werden nur im Notfall und zeitlich begrenzt zur Energiegewinnung herangezogen Die wichtigste
Energiereserve des Körpers ist das Fettgewebe (Energiebedarf für Monate), aus ihm bezieht der Körper im
Hungerzustand den Großteil seiner Energie. Fette können aus Kohlenhydraten aufgebaut werden. Für einige Stunden kann
Energie aus Kohlenhydratreserven (Glykogen) bezogen werden: Glykogen-Phosphorylase
spaltet an mehreren Stellen der verzweigten Glykogenmoleküle gleichzeitig. Proteine sind wertvolle Baustoffe und werden nur im Notfall und zeitlich begrenzt zur Energiegewinnung herangezogen Von den zwanzig Aminosäuren sind etwa die Hälfte essentiell - sie können vom Körper nicht (Lysin, Threonin) oder nur bedingt (Valin, Leucin, Isoleucin, Methionin, Phenylalanin, Tryptophan; während Wachstum und Schwangerschaft auch Arginin und Histidin) selbst
gebildet werden. Cystein und Tyrosin sind semiessentiell, d.h. sie
können vom Körper nur in Anwesenheit anderer, essentieller Aminosäuren
gebildet werden Von den zwanzig Aminosäuren sind etwa die Hälfte essentiell - sie können vom Körper nicht (Lysin, Threonin) oder nur bedingt (Valin, Leucin, Isoleucin, Methionin, Phenylalanin, Tryptophan; während Wachstum und Schwangerschaft auch Arginin und Histidin) selbst
gebildet werden. Cystein und Tyrosin sind semiessentiell, d.h. sie
können vom Körper nur in Anwesenheit anderer, essentieller Aminosäuren
gebildet werden |
