

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert


 Leber und Proteinstoffwechsel
Leber und Proteinstoffwechsel
 Aminierung: Amin von Ammonium, nach Gott Ἄμμων
Aminierung: Amin von Ammonium, nach Gott Ἄμμων| Hepatozyten beteiligen sich intensiv am Proteinstoffwechsel: -- Synthese der meisten Plasmaproteine, im Bedarfsfall von ~20 g/d bis auf ~60 g/d steigerbar  -- Desaminierung von Aminosäuren (Entfernung von Stickstoff)  -- Harnstoffsynthese (bis ~20 g/d), Entfernung von Ammonium  -- Synthese (aller nichtessentiellen) und Interkonversion von Aminosäuren  -- Regulierung der verschiedenen Aminosäuren im Blutplasma (Glutamin ist die Aminosäure mit der größten Konzentration im Blutplasma) Eiweißmangel steigert die Synthesekapazität für Protein in der Leber und regt die Mitosetätigeit an (die Leber kann dabei vergrößert sein). Eine gesunde Leber kann im Bedarfsfall den gesamten extrazellulären (mobilen) Proteinpool (~500 g) in weniger als 2 Wochen neu bilden - normalerweise hat sie dafür etwa einen Monat Zeit, nutzt also nur die Hälfte ihrer maximalen Synthesekapazität. |
 Aminosäuren
Aminosäuren  Proteinpool
Proteinpool
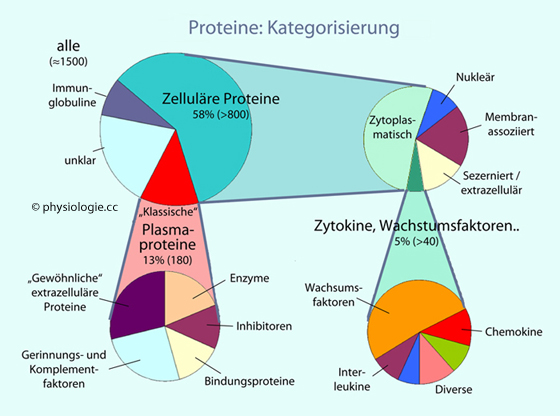
 Abbildung:
Kategorisierung von extrazellulär nachweisbaren Proteinen des Menschen
Abbildung:
Kategorisierung von extrazellulär nachweisbaren Proteinen des Menschen
 Abbildung), ist es klar, welche Bedeutung die Leber als ein zentrales
Stoffwechselorgan auch in dieser Hinsicht hat. Insbesondere sind es im
Extrazellulärraum vorliegende, mobile "Plasmaproteine", deren Menge und
Funktionsfähigkeit von den Hepatozyten reguliert wird.
Abbildung), ist es klar, welche Bedeutung die Leber als ein zentrales
Stoffwechselorgan auch in dieser Hinsicht hat. Insbesondere sind es im
Extrazellulärraum vorliegende, mobile "Plasmaproteine", deren Menge und
Funktionsfähigkeit von den Hepatozyten reguliert wird. Albumin (Transport, kolloidosmotischer Druck)
Albumin (Transport, kolloidosmotischer Druck) Komplementfaktoren (große Mengen an C3 und C5, weiters C1 bis C9)
Komplementfaktoren (große Mengen an C3 und C5, weiters C1 bis C9) Lipoproteine
Lipoproteine Transferrin
Transferrin Gerinnungsfaktoren
Gerinnungsfaktoren Hepatokine (Hormonartige Substanzen, Hormontransporter, Wachstumsfaktoren)
Hepatokine (Hormonartige Substanzen, Hormontransporter, Wachstumsfaktoren) Akutphasenproteine
Akutphasenproteine Bildung der meisten (90%) Plasmaproteine (Ausnahme Proteine aus dem extrahepatischen Immunsystem, insbesondere γ-Globulin). Die
Syntheseleistung beträgt normalerweise etwa 20 g Plasmaprotein pro
Tag und kann im Bedarfsfall um den Faktor 3 gesteigert werden.
Bildung der meisten (90%) Plasmaproteine (Ausnahme Proteine aus dem extrahepatischen Immunsystem, insbesondere γ-Globulin). Die
Syntheseleistung beträgt normalerweise etwa 20 g Plasmaprotein pro
Tag und kann im Bedarfsfall um den Faktor 3 gesteigert werden.Plasmaeiweißsynthese ~ 20 g/d steigerbar auf >60 g/d |
 Desaminierung
von Aminosäuren
Desaminierung
von Aminosäuren  (notwendiger Schritt zur Energiegewinnung via
Kohlenhydrate / Fette - die Kapazität der Nieren zur Desaminierung ist
viel geringer als die der Leber).
(notwendiger Schritt zur Energiegewinnung via
Kohlenhydrate / Fette - die Kapazität der Nieren zur Desaminierung ist
viel geringer als die der Leber). Entfernung von Ammonium / Bildung von Harnstoff (Abbildungen und
Entfernung von Ammonium / Bildung von Harnstoff (Abbildungen und  s. dort):
s. dort):  Beim
Abbau von Aminosäuren entsteht Ammoniak, und dieses ist in höherer
Konzentration toxisch. Der Metabolismus des Menschen kann Ammoniak
nicht weiter oxidieren / abbauen; der Großteil wird daher in Harnstoff
umgewandelt, und zwar von Hepatozyten (via Harnstoffzyklus
in der Leber - teils in den Mitochondrien, teils im Zytosol; das
entstehende Bicarbonat wirkt puffernd). Ammoniak kann in der Leber auch
zu Glutamat umgewandelt werden (Glutamat-Ammonium-Ligase, früher Glutaminsynthetase; die Muskulatur übernimmt etwa die Hälfte der Glutaminsynthese des Körpers).
Beim
Abbau von Aminosäuren entsteht Ammoniak, und dieses ist in höherer
Konzentration toxisch. Der Metabolismus des Menschen kann Ammoniak
nicht weiter oxidieren / abbauen; der Großteil wird daher in Harnstoff
umgewandelt, und zwar von Hepatozyten (via Harnstoffzyklus
in der Leber - teils in den Mitochondrien, teils im Zytosol; das
entstehende Bicarbonat wirkt puffernd). Ammoniak kann in der Leber auch
zu Glutamat umgewandelt werden (Glutamat-Ammonium-Ligase, früher Glutaminsynthetase; die Muskulatur übernimmt etwa die Hälfte der Glutaminsynthese des Körpers).  Ammonium (Blutplasma < Serum)
Ammonium (Blutplasma < Serum)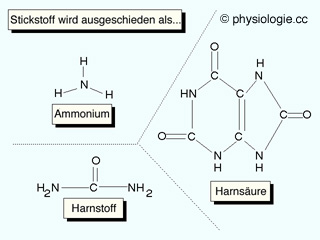
 Abbildung: Stickstoff verlässt den Körper als Harnstoff, Ammonium und Harnsäure
Abbildung: Stickstoff verlässt den Körper als Harnstoff, Ammonium und Harnsäure
 sinkt mit einer zunehmend anabolen Stoffwechsellage, d.h. positiver N-Bilanz (Stickstoffretention) - die durch Einwirkung anabol wirkender Hormone wie Insulin, Somatotropin oder Östrogenen unterstützt wird - wie bei Wachstumsschüben oder Heilungs- bzw. Reparaturvorgängen, und
sinkt mit einer zunehmend anabolen Stoffwechsellage, d.h. positiver N-Bilanz (Stickstoffretention) - die durch Einwirkung anabol wirkender Hormone wie Insulin, Somatotropin oder Östrogenen unterstützt wird - wie bei Wachstumsschüben oder Heilungs- bzw. Reparaturvorgängen, und  nimmt mit zunehmend kataboler Stoffwechsellage, d.h. negativer N-Bilanz (Stickstoffverlust) - z.B. im Postaggressionsstoffwechsel oder bei mangelnder Energiezufuhr - zu (Katecholamine, Glucagon oder Glucocorticoide wirken in diese Richtung).
nimmt mit zunehmend kataboler Stoffwechsellage, d.h. negativer N-Bilanz (Stickstoffverlust) - z.B. im Postaggressionsstoffwechsel oder bei mangelnder Energiezufuhr - zu (Katecholamine, Glucagon oder Glucocorticoide wirken in diese Richtung). 
 Abbildung: Aminosäuremetabolismus und Harnstoffsynthese in Hepatozyten
Abbildung: Aminosäuremetabolismus und Harnstoffsynthese in Hepatozyten Sofortige Verwendung zur Proteinsynthese, oder
Sofortige Verwendung zur Proteinsynthese, oder Desaminierung. Dabei entsteht Glutamat und die entsprechende Ketosäure (und das entsprechende Produkt).
Desaminierung. Dabei entsteht Glutamat und die entsprechende Ketosäure (und das entsprechende Produkt).
 Täglich werden in der Leber 6-20 Gramm Harnstoff gebildet (via Harnstoffzyklus
- auch Ornithin- oder Krebs-Henseleit- Zyklus
Täglich werden in der Leber 6-20 Gramm Harnstoff gebildet (via Harnstoffzyklus
- auch Ornithin- oder Krebs-Henseleit- Zyklus  genannt).
genannt). Interkonversion von / Synthese aus Aminosäuren (z.B. aller
nichtessentieller Aminosäuren). Die Leber reguliert die
Aminosäurekonzentrationen im Blut
Interkonversion von / Synthese aus Aminosäuren (z.B. aller
nichtessentieller Aminosäuren). Die Leber reguliert die
Aminosäurekonzentrationen im Blut In den Körper aufgenommene oder im Körper mobilisierte Aminosäuren werden entweder
unmittelbar für die Proteinsynthese verwendet oder werden abgebaut
(Desaminierung, Harnstoffzyklus u.a.). Dabei stehen für die Aufnahme in die Zelle 14 unterschiedliche Transportsysteme
zur Verfügung; die
Aufnahme ist teilweise natriumabhängig. Ist eines dieser Systeme
beschädigt, resultiert eine entsprechende Aminosäuretransportstörung
(z.B. Cystinurie, Glycinurie, Hartnup-Krankheit).
In den Körper aufgenommene oder im Körper mobilisierte Aminosäuren werden entweder
unmittelbar für die Proteinsynthese verwendet oder werden abgebaut
(Desaminierung, Harnstoffzyklus u.a.). Dabei stehen für die Aufnahme in die Zelle 14 unterschiedliche Transportsysteme
zur Verfügung; die
Aufnahme ist teilweise natriumabhängig. Ist eines dieser Systeme
beschädigt, resultiert eine entsprechende Aminosäuretransportstörung
(z.B. Cystinurie, Glycinurie, Hartnup-Krankheit).

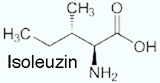
 Verzweigtkettige Aminosäuren (branched chain amino acids, BCAA) - Valin, Leucin, Isoleucin
-
haben apolare Seitenketten und sind daher amphipathisch, sie lagern
sich sowohl in wässriger Phase (hydrophile Betain-Seite) als auch
Fettphasen (lipophile Kohlenwasserstoff-Seite) relativ gut ein. Der
Abbau
verzweigtkettiger Aminosäuren beginnt vorwiegend in der Muskulatur
(nicht wie bei den meisten Aminosäuren in der Leber). Verzweigtkettige Aminosäuren werden u.a. bei Leberversagen therapeutisch
supplementiert
Verzweigtkettige Aminosäuren (branched chain amino acids, BCAA) - Valin, Leucin, Isoleucin
-
haben apolare Seitenketten und sind daher amphipathisch, sie lagern
sich sowohl in wässriger Phase (hydrophile Betain-Seite) als auch
Fettphasen (lipophile Kohlenwasserstoff-Seite) relativ gut ein. Der
Abbau
verzweigtkettiger Aminosäuren beginnt vorwiegend in der Muskulatur
(nicht wie bei den meisten Aminosäuren in der Leber). Verzweigtkettige Aminosäuren werden u.a. bei Leberversagen therapeutisch
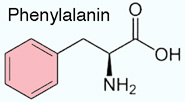
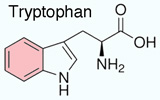
supplementiert Essentiell sind weiters die aromatischen Aminosäuren Phenylalanin und
Tryptophan; sie sind ziemlich hydrophob, Tryptophan sogar so stark, dass es im Plasma nicht frei gelöst vorliegt (es bindet an Albumin)
Essentiell sind weiters die aromatischen Aminosäuren Phenylalanin und
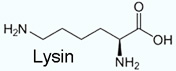
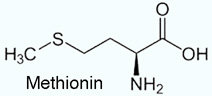
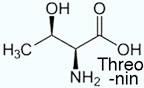
Tryptophan; sie sind ziemlich hydrophob, Tryptophan sogar so stark, dass es im Plasma nicht frei gelöst vorliegt (es bindet an Albumin) Lysin, Methionin und Threonin.
Lysin, Methionin und Threonin. Die Konzentration an Aminosäuren in extrazellulären Flüssigkeiten (extrazellulärer Aminosäurepool)
beträgt bei erwachsenen Personen insgesamt ~0,5-0,9 mM/l. Die einzelnen
Aminosäurenwerte sind sehr unterschiedlich, z.B. Glutamat ~10-130 µM/l, Glutamin ~200-750 µM/l, Glyzin 150-490 µM/l , Alanin 180-580 µM/l, Methionin ~10-40 µM/l etc.
Die Konzentration an Aminosäuren in extrazellulären Flüssigkeiten (extrazellulärer Aminosäurepool)
beträgt bei erwachsenen Personen insgesamt ~0,5-0,9 mM/l. Die einzelnen
Aminosäurenwerte sind sehr unterschiedlich, z.B. Glutamat ~10-130 µM/l, Glutamin ~200-750 µM/l, Glyzin 150-490 µM/l , Alanin 180-580 µM/l, Methionin ~10-40 µM/l etc.
 Abbildung: Glutamat
Abbildung: Glutamat  mit ~20% des extrazellulären Aminosäurepools (und im Blutplasma) am stärksten vertreten; es spielt eine
wichtige Rolle nicht nur für den Eiweißaufbau, sondern u.a. auch als
rasch verfügbares Substrat für den Energiestoffwechsel. (Glutamat ist ein Transmitter im Nervensystem.)
mit ~20% des extrazellulären Aminosäurepools (und im Blutplasma) am stärksten vertreten; es spielt eine
wichtige Rolle nicht nur für den Eiweißaufbau, sondern u.a. auch als
rasch verfügbares Substrat für den Energiestoffwechsel. (Glutamat ist ein Transmitter im Nervensystem.) Die Leber ist eine wichtige Synthesestation für Glutathion
(GSH) - Leberzellen enthalten bis zu 7 mM Glutathion. Dieses besteht
aus drei Aminosäuren: Glutaminsäure, Cystein und Glycin; der erste
Syntheseschritt wird durch das lebensnotwendige Enzym Glutamat-Cystein-Ligase bewerkstelligt.
Die Leber ist eine wichtige Synthesestation für Glutathion
(GSH) - Leberzellen enthalten bis zu 7 mM Glutathion. Dieses besteht
aus drei Aminosäuren: Glutaminsäure, Cystein und Glycin; der erste
Syntheseschritt wird durch das lebensnotwendige Enzym Glutamat-Cystein-Ligase bewerkstelligt. 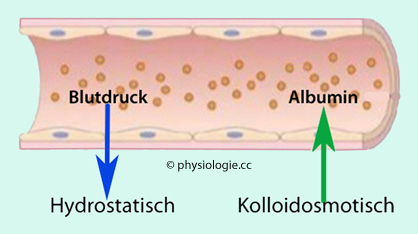
 Abbildung: Starling-Gleichgewicht
Abbildung: Starling-Gleichgewicht  (vereinfacht)
(vereinfacht)
 ) Effekt
der Plasmaproteine wird zu ~90% von Albumin getragen (relativ niedriges
Molekulargewicht von ~70 kDa; der Effekt hängt von der Zahl der
gelösten Makromoleküle, nicht deren molarer Masse ab).
) Effekt
der Plasmaproteine wird zu ~90% von Albumin getragen (relativ niedriges
Molekulargewicht von ~70 kDa; der Effekt hängt von der Zahl der
gelösten Makromoleküle, nicht deren molarer Masse ab).
 Abbildung: Proteinstoffwechsel
Abbildung: Proteinstoffwechsel

 Im Darm resorbierte Aminosäuren werden von Hepatozyten für Proteinsynthese (Plasmaproteine ~20 g/d, steigerbar auf >60 g/d) und Desaminierung (Produktion von Ammoniak / Harnstoff / Glutamin; Zitratzyklus) herangezogen. Zellen
benötigen Glutamin für Nukelotidsynthese und
Proteinglykosylierung, Glutamat für die
Synthese von anderen Aminosäuren, α-Ketoglutarat (Zitratzyklus) und Glutathion. Glutamin ist in der Nahrung reichlich vorhanden und die führende Aminosäure im Blutplasma (~20% des extrazellulären Aminosäurepools) Im Darm resorbierte Aminosäuren werden von Hepatozyten für Proteinsynthese (Plasmaproteine ~20 g/d, steigerbar auf >60 g/d) und Desaminierung (Produktion von Ammoniak / Harnstoff / Glutamin; Zitratzyklus) herangezogen. Zellen
benötigen Glutamin für Nukelotidsynthese und
Proteinglykosylierung, Glutamat für die
Synthese von anderen Aminosäuren, α-Ketoglutarat (Zitratzyklus) und Glutathion. Glutamin ist in der Nahrung reichlich vorhanden und die führende Aminosäure im Blutplasma (~20% des extrazellulären Aminosäurepools) Positive Stickstoffbilanz (N-Retention) bei anaboler Stoffwechsellage (Wachstumsschübe, Heilungsvorgänge) senkt die Harnstoffausscheidung (angeregt durch Insulin, Somatotropin Östrogene), negative Stickstoffbilanz (N-Verlust) bei kataboler Stoffwechsellage geht mit vermehrter Ausscheidung einher (unterstützt durch Katecholamine, Glukagon, Glukokortikoide). NH4+ wird im Harnstoffzyklus (Krebs-Henseleit-Zyklus ) metabolisiert (6-20 g/d) Positive Stickstoffbilanz (N-Retention) bei anaboler Stoffwechsellage (Wachstumsschübe, Heilungsvorgänge) senkt die Harnstoffausscheidung (angeregt durch Insulin, Somatotropin Östrogene), negative Stickstoffbilanz (N-Verlust) bei kataboler Stoffwechsellage geht mit vermehrter Ausscheidung einher (unterstützt durch Katecholamine, Glukagon, Glukokortikoide). NH4+ wird im Harnstoffzyklus (Krebs-Henseleit-Zyklus ) metabolisiert (6-20 g/d)  Der extrazelluläre Aminosäurepool
beträgt ~0,5-0,9 mM/l, die Leber stabilisiert die Konzentrationswerte der einzelnen Aminosäuren. Aminosäuren werden über unterschiedliche Transportsysteme - teilweise natriumabhängig - in Zellen transferiert. Glutamin (die häufigste Aminosäure im Plasma)
ist nicht nur für anabole Vorgänge (Eiweißsynthese), sondern auch für den Energiestoffwechsel rasch verwertbar. Glutathion (GSH: Glutaminsäure, Zystein, Glyzin) hat in Zellen (z.B. Erythrozyten) und Körperflüssigkeiten (Bronchialsekret, Kammerwasser) antioxidative Schutzwirkung Der extrazelluläre Aminosäurepool
beträgt ~0,5-0,9 mM/l, die Leber stabilisiert die Konzentrationswerte der einzelnen Aminosäuren. Aminosäuren werden über unterschiedliche Transportsysteme - teilweise natriumabhängig - in Zellen transferiert. Glutamin (die häufigste Aminosäure im Plasma)
ist nicht nur für anabole Vorgänge (Eiweißsynthese), sondern auch für den Energiestoffwechsel rasch verwertbar. Glutathion (GSH: Glutaminsäure, Zystein, Glyzin) hat in Zellen (z.B. Erythrozyten) und Körperflüssigkeiten (Bronchialsekret, Kammerwasser) antioxidative Schutzwirkung  Plasmaproteine werden kapillär filtriert, wandern durch
das Interstitium und über das Lymphsystem in den Kreislauf zurück.
Dieser Austausch von Plasmaprotein entspricht pro Tag ungefähr der im
Blutplasma vorhandenen Menge (~0,2 kg). Hypoproteinämie
regt Leberzellen zu Teilungen und vermehrter Proteinsynthese an; das
Organ vergrößert sich, die Syntheseleistung kann sich bis zu
verdreifachen. Im
Hungerzustand werden auch Plasmaproteine als Aminosäurequelle
herangezogen (Pinozytose durch Makrophagen, Abbau zu Aminosäuren,
Abgabe ans Blutplasma, Aufnahme im Gewebe). Das Verhältnis von
Gesamteiweiß in den Geweben zu Plasmaeiweißpool beträgt ziemlich
konstant 33:1, auch im Hungerzustand (Proteinreserve) Plasmaproteine werden kapillär filtriert, wandern durch
das Interstitium und über das Lymphsystem in den Kreislauf zurück.
Dieser Austausch von Plasmaprotein entspricht pro Tag ungefähr der im
Blutplasma vorhandenen Menge (~0,2 kg). Hypoproteinämie
regt Leberzellen zu Teilungen und vermehrter Proteinsynthese an; das
Organ vergrößert sich, die Syntheseleistung kann sich bis zu
verdreifachen. Im
Hungerzustand werden auch Plasmaproteine als Aminosäurequelle
herangezogen (Pinozytose durch Makrophagen, Abbau zu Aminosäuren,
Abgabe ans Blutplasma, Aufnahme im Gewebe). Das Verhältnis von
Gesamteiweiß in den Geweben zu Plasmaeiweißpool beträgt ziemlich
konstant 33:1, auch im Hungerzustand (Proteinreserve)
|
