

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert

Transport
im kardiovaskulären System (Kreislauf, Blut, Lymphe)

 Blut: Zusammensetzung
und Eigenschaften
Blut: Zusammensetzung
und Eigenschaften
© H. Hinghofer-Szalkay
 Buffy coat: buff = lederfarben, gelbbraun, coat = Film, Überzug, Schicht
Buffy coat: buff = lederfarben, gelbbraun, coat = Film, Überzug, Schicht
eosinophil: εως = Morgenröte (Eosin), φίλος = Freund
Erythropoetin: ἐρυθρός = rot, ποιεῖν = machen
Hämatokrit: αιμα = Blut, κρινειν = urteilen
Hämatopoese: αἷμα = Blut, ποιεῖν = erzeugen
Landsteiner: Karl Landsteiner
Leukopenie: λευκός = weiß, πενία = Mangel
Polyglobulie: πολύ = viel, globus = Kugel
Price-Jones'sche Kurve: Cecil Price-Jones
Stokes-Gesetz: George G. Stokes
Wiener: Alexander S. Wiener
Zytokine: κύτος = Gefäß (Zelle), κίνἔω = antreiben, bewegen
Blut besteht aus zellulären (Blutkörperchen: ~40%) und extrazellulären Bestandteilen (Plasma: ~60%). Klinische Labortwerte gewinnt man hauptsächlich aus Plasma (bzw. Serum): Dieses enthält
Substanzen, deren Konzentration Aufschluss über Aktivität und
Zustand von Zellen und Organen gibt (Elektrolyte, Substrate,
Metabolite, Enzyme, Hormone, Zytokine..). Großmolekulare Stoffe gelangen aus dem Interstitium
hauptsächlich über die Lymphe in das Blut.
Rote Blutkörperchen (Erythrozyten) transportieren mittels Hämoglobin Sauerstoff, weiße (Leukozyten) sind immunologisch, Blutplättchen (Thrombozyten)
vor allem im Rahmen der Blutstillung aktiv.
Erythrozyten (~5 Millionen / µl Blut) machen den größten Teil des Volumenanteils der
Blutkörperchen (Hämatokrit) aus. Sie werden unter dem Einfluss des in den Nieren gebildeten Hormons Erythropoetin
im roten Knochenmark gebildet und bleiben für ~120 Tage in der
Blutbahn, bevor sie abgebaut werden - Häm wird als
Gallenfarbstoff ausgeschieden, Aminosäuren (aus Globin) und Eisen werden wiederverwertet.
Leukozyten (einige Tausend / µl Blut) befinden sich zum Großteil im Gewebe und nützen den Kreislauf nur vorübergehend als
Transportweg. Im Differentialblutbild werden sie unterschieden als Granulozyten, Lymphozyten, Monozyten: Diese haben jeweils immunologische Spezialfunktionen.
Thrombozyten (etwa 0,3
Millionen / µl Blut) entstehen aus Megakaryozyten im Knochenmark, sind für die Blutstillung
unverzichtbar und kooperieren mit Leukozyten in der angeborenen Abwehr.
|
Übersicht  Komponenten des Blutplasmas
Komponenten des Blutplasmas  Blutbildung im Knochenmark
Blutbildung im Knochenmark  Erythrozyten
Erythrozyten  Blutbild
Blutbild
 Hämatokrit
Hämatokrit  Blutsenkung
Blutsenkung
 Praktische Aspekte
Praktische Aspekte  Core messages
Core messages
Blut
wird oft als ein "flüssiges Organ" bezeichnet, weil es vielfältige
Funktionen erfüllt und trotz seines Zellreichtums fließen kann. Es
besteht zu etwas weniger als die Hälfte seines Volumens aus Zellen
("Blutkörperchen"), der Rest ist eine als Blutplasma bezeichnete
eiweißreiche extrazelluläre Flüssigkeit. Dementsprechend hoch ist in
den Blutkörperchen der Kaliumspiegel, und im Blutplasma die
Natriumkonzentration. Eine der vielen Besonderheiten ist die Tatsache,
dass die roten Blutkörperchen (Erythrozyten) des Menschen keinen
Zellkern enthalten. Das verleiht ihnen die enorme Verformbarkeit in
der Strömung, entsprechend der Flüssigkeitsschichte im Blutgefäß, in
der sie sich gerade befinden - und damit eine erstaunlich niedrige
Viskosität.
Blut ist ein Transport- und Immunorgan
Jede Minute bildet der
Körper einer erwachsenen Person ~150 Millionen Erythrozyten und ~120 Millionen Granulozyten (s. weiter unten).
Megakaryozyten
liefern große Mengen an Blutplättchen nach.

 Abbildung: Zusammensetzung des Blutes
Abbildung: Zusammensetzung des Blutes
Nach einer Vorlage bei Thibodeau / Patton, Anatomy & Physiology (6th ed), Mosby Elsevier 2007
Die Werte stellen Mittelwerte bzw. gerundete Referenzbereiche für gesunde erwachsene Personen dar.
Plättchenzahl 0,25-0,4 Millionen / µl, Leukozyten 5-9 tausend / µl.
Neutrophile 60-70%, Lymphozyten 20-25%, Monozyten 3-8%, Eosinophile 2-4%, Basophile 0,5-1% aller Leukozyten im Blut

 Blut
ist ein Transportorgan. Es befördert Zellen ("Blutkörperchen") und Blutplasma und damit
Blut
ist ein Transportorgan. Es befördert Zellen ("Blutkörperchen") und Blutplasma und damit
 Wasser, und darin Stoffe, teils frei gelöst (wie
Sauerstoff, Kohlendioxid, Elektrolyte, Glucose, Harnstoff,
Aminosäuren, Proteine), teils an Protein gebunden (wie Lipide, Schilddrüsenhormone, Steroidhormone) - sie dienen Funktionen wie Ernährung, Immunabwehr, Blutgerinnung etc. Diese Stoffe übertragen auch
Wasser, und darin Stoffe, teils frei gelöst (wie
Sauerstoff, Kohlendioxid, Elektrolyte, Glucose, Harnstoff,
Aminosäuren, Proteine), teils an Protein gebunden (wie Lipide, Schilddrüsenhormone, Steroidhormone) - sie dienen Funktionen wie Ernährung, Immunabwehr, Blutgerinnung etc. Diese Stoffe übertragen auch
 Information (Hormone, Zytokine
Information (Hormone, Zytokine  , Wachstumsfaktoren, Mediatoren; genetische Information)
, Wachstumsfaktoren, Mediatoren; genetische Information)
 Weiters befördert das Blut Energie, die als Wärme über Haut und Schleimhäute an die Außenwelt
abgegeben wird.
Weiters befördert das Blut Energie, die als Wärme über Haut und Schleimhäute an die Außenwelt
abgegeben wird.
Komponenten des Blutplasmas

 Abbildung: Molare Konzentration von Plasmainhaltsstoffen (insgesamt ~0,3 M)
Abbildung: Molare Konzentration von Plasmainhaltsstoffen (insgesamt ~0,3 M)
Die
molare Beteiligung der Plasmaproteine ist sehr gering (türkisfarbener
Sektor), obwohl sie den Großteil der Masse gelöster Bestandteile
ausmachen (großes Molekulargewicht!).
Der kolloidosmotische Druck
beträgt 0,03 atm, der osmotische ~7,3 atm
 Zum Vergleich: Verteilung der Plasmabestandteile nach Masse s. dort
Zum Vergleich: Verteilung der Plasmabestandteile nach Masse s. dort
 Kommentierte Aufstellung der Massenkonzentrationswerte in Blut und
Plasma (in g/ml, mit Referenzbereichen sowie altersabhängigen
Unterschieden)
Kommentierte Aufstellung der Massenkonzentrationswerte in Blut und
Plasma (in g/ml, mit Referenzbereichen sowie altersabhängigen
Unterschieden)
 Stoffaustausch
Stoffaustausch: Blut tauscht mit dem Gewebe
Flüssigkeit und darin gelöste Stoffe aus. Dazu ist eine entsprechende
Austauschfläche erforderlich. Die
Kapillarwände einer erwachsenen
Person haben eine Gesamtoberfläche von ~
300 m2; alle roten
Blutkörperchen zusammen ~
3000 m2.
(
Würde man alle Erythrozyten eines Menschen aneinanderreihen, ergäbe
sich eine Linie von ~190.000 km Länge - fast das 5-fache des
Erdumfangs oder die halbe Strecke zum Mond.)
Blutplasma
|
|
mM |
g/l
|
|
mM |
g/l
|
| Natrium |
140-150 | 3,75
|
Aminosäuren |
2,4
Glutamat:
0,01-0,13
|
|
Kalium
|
4,4 | 0,16
|
Protein |
~1 | 60-80
|
Calcium
|
2-3 | 0,1
|
Triglyzeride |
1,5
(<2,3)
| 2
|
Magnesium
|
0,9 | 0,02
|
Cholesterin |
5 | <2,2
|
Chlorid
|
102-110 | 3,6
|
Phospholipide |
2,5 |
|
| Bicarbonat |
24-27 | 1,6
|
Freie Fettsäuren |
0,6 |
|
| Phosphat |
1-2
| 0,04
|
Lactat |
1,5 | <0,2
|
| Sulfat |
0,5-1
| 0,02
|
Pyruvat |
0,15 | <0,009
|
Glucose
|
5
| 0,6-1,1
(nüchtern)
|
Citrat |
0,15 |
|
| Harnstoff |
3-8
| 0,2-0,5
|
Ketonkörper
(nach nächtlichem Fasten)
|
0,02-0,27 | 0,002-0,028
|
Die feinsten Blutgefäße (Kapillaren, Venolen) lassen Stoffe aus
dem Blut ins Gewebe und aus dem Gewebe ins Blut übertreten. Die
Durchlässigkeit (Permeabilität) der Kapillarwände bestimmt die
Verteilung infundierter Stoffe; sie ist von Organ zu Organ sehr
unterschiedlich, z.B. niedrig im Gehirn, hoch in der Leber. Große
Moleküle bleiben länger in der Blutbahn, kleine (z.B. Kochsalz, Glucose) gelangen rasch ins Gewebe.
Zellen geben
Signalstoffe, metabolische Endprodukte u.a. an das Interstitium ab. Von
dort gelangen sie in Blutkapillaren oder werden mit dem Lymphsystem
abtransportiert.
Die Messung solcher Stoffe im Blut erlaubt eine diagnostische Aussage
über Zustand und Funktion von Organen und Geweben. Bei Organschäden
erhöht sich die Menge bestimmter Enzyme, die geschädigte Zellen
verlieren. Entzündungen verändern das Plasmaeiweißmuster und
beschleunigen die Blutsenkung.
Hämatopoese (Blutbildung)
 s. auch dort
s. auch dort
Jeden Tag werden mehr als 400 Milliarden Blutkörperchen neu synthetisiert. Pluripotente Stammzellen im roten Knochenmark (long-term hematopoietic stem cells, LT-HSCs) sind zu unlimitierter Selbsterneuerung fähig, spezialisierte Stammzellen (short-term hematopoietic stem cells, ST-HSCs) differenzieren weiter zu entsprechenden Vorläufern reifer Blutzellen ( BFU,
burst-forming unitscolony-forming units CFU). Hämatopoetisch wirkende Zytokine nennt man colony stimulating factors.
 Hämatopoetische Faktoren: Die Bildung
Hämatopoetische Faktoren: Die Bildung
 roter Blutkörperchen wird angeregt durch Erythropoetin aus Nieren (90%) und Leber (10%),
roter Blutkörperchen wird angeregt durch Erythropoetin aus Nieren (90%) und Leber (10%),
 weißer Blutkörperchen durch koloniestimulierende Faktoren (G-CSF, M-CSF, GM-CSF, Meg-CSF, S-CSF) und Interleukine (IL-2, 3, 5, I7, 11) aus Knochenmark (Stromazellen), Endothelien, Lymphozyten, Makrophagen, Fibroblasten, dendritischen Zellen,
weißer Blutkörperchen durch koloniestimulierende Faktoren (G-CSF, M-CSF, GM-CSF, Meg-CSF, S-CSF) und Interleukine (IL-2, 3, 5, I7, 11) aus Knochenmark (Stromazellen), Endothelien, Lymphozyten, Makrophagen, Fibroblasten, dendritischen Zellen,
 von Blutplättchen durch Thrombopoetin aus Leber und Nieren (geringgradig aus dem Knochenmark).
von Blutplättchen durch Thrombopoetin aus Leber und Nieren (geringgradig aus dem Knochenmark).
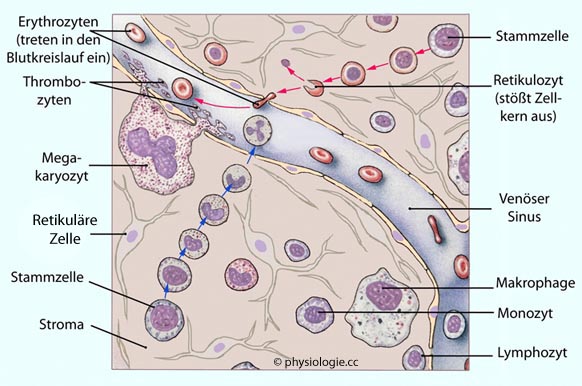

Abbildung: Blutbildung im roten Knochenmark
Nach einer Vorlage bei Silverthorn, Human Physiology, an integrated approach, 4th Int'l ed. 2007, Pearson / Benjamin Cummings
Im
roten Knochenmark teilen sich Stammzellen, die Tochterzellen bleiben
teils im Stammzellpool, die anderen differenzieren sich zu reifen Blutzellen. Rote Pfeile: Hämatopoese, blaue Pfeile: Reifung von neutrophilen Granulozyten.
Aus
hämatopoetischen Stammzellen entstehen alle Blutzellen (Erythro-,
Lympho-, Granulo-, Monozyten, Makrophagen, Thrombozyten). Mesenschymale
Stammzellen entwickeln sich zu Knorpel-, Knochen-, Fettzellen und
Stromazellen, welche die Blutbildung unterstützen.
Mit intakter
Zellmembran ausgekleidete Fragmente der Megakaryozyten separieren in
der Blutbahn von der Mutterzelle und werden zu Blutplättchen
(Thrombozyten).
Das Stroma besteht aus Kollagenfasern, extrazellulärer Matrix und fibroblastenähnlichen retikulären Zellen

 Bei Bedarf kann die Neubildung von Blutkörperchen 10-20 fach (oder noch höher) ansteigen, angeregt durch Wachstumsfaktoren wie
Bei Bedarf kann die Neubildung von Blutkörperchen 10-20 fach (oder noch höher) ansteigen, angeregt durch Wachstumsfaktoren wie
 Erythropoetin (Erythrozyten),
Erythropoetin (Erythrozyten),
 myeloide Wachstumsfaktoren (colony stimulating factors) / Interleukine (Leukozyten),
myeloide Wachstumsfaktoren (colony stimulating factors) / Interleukine (Leukozyten),
 Thrombopoetin und Interleukin 11 (Blutplättchen).
Thrombopoetin und Interleukin 11 (Blutplättchen).
Blutbildung erfordert auch die Anwesenheit entsprechender Spurenelemente (Eisen, Kobalt, Kupfer) und Vitamine (Folsäure, Kobalamin, Pyridoxin, Askorbinsäure, Riboflavin).
Die meisten Blutkörperchen
werden im roten Knochenmark nachgebildet (Schädelknochen, Beckenschaufel, Wirbelkörper, Brustbein, Teile der Extremitätenknochen), Lymphozyten in lymphatischen
Geweben. Vorstufen sind in Präparaten von Knochenmarkpunktat zu
finden. Aus einer Stammzelle können über 1000 fertige Blutkörperchen gebildet werden.
Wo befinden sich die Blutkörperchen? Etwa 90% der Leukozyten (vor allem Granulozyten) finden sich im Knochenmark, von wo sie durch Zytokine bzw. Komplementfaktoren mobilisiert werden können.
70% aller Lymphozyten sind in lymphatischen Organen geparkt, 10% im Knochenmark, 15% in übrigen Organen, nur ~5% "auf Patrouille" im Blut.
Erythrozyten befinden sich in der Blutbahn. Da das gesamte Blutvolumen (~5 l) durchschnittlich in 20-60
Sekunden einmal durch das kardiovaskuläre System gepumpt wird, ergibt
sich (bei einer Lebensdauer von 100-120 Tagen), dass rote
Blutkörperchen etwa 150.000 Umläufe durch den Kreislauf absolvieren, bevor sie
aus dem Blut entfernt und abgebaut werden (vor allem in der Milz).
Als Zytokine bezeichnete Signalstoffe (ihre
Konzentrationen im Blutplasma liegen unter Normalbedingungen im
pikomolaren Bereich, können bei Bedarf um bis zu 3 Zehnerpotenzen
ansteigen) regulieren
Differenzierung, Teilung und Reifung der Zellen zu Erythro- (Erythropoetin), Leuko- (colony stimulating factors) und
Thrombozyten (Thrombopoetin).
Rote Blutkörperchen transportieren Atemgase
Allgemeine Funktionen  Oxidationsschutz (Glutathion)
Oxidationsschutz (Glutathion)  Blutgruppen
Blutgruppen  Erythrozytenabbau
Erythrozytenabbau
Rote Blutkörperchen (Erythrozyten) machen ungefähr 80-85% aller Zellen des Körpers aus (5 Liter Blut beinhalten etwa 2,5 x 1013
(25 Billionen) Erys; man schätzt, dass der Mensch 3 x 1013 Zellen enthält - je nach Gewicht, Alter, Geschlecht 2-4 x 1013). Ihre Aufgabe ist der Atemgastransport (bei körperlicher Ruhe
werden rund je 0,3 Liter Sauerstoff und Kohlendioxid mit der Umgebung
ausgetauscht, bei Belastung entsprechend mehr). Sie sind kernlos (was
sie für die Passage enger Gefäße besonders flexibel macht), in ihrer
Membran sind keine MHC-Moleküle nachweisbar.
Erythrozyten haben keine MHC-Moleküle
|

 Abbildung: Erythropoese und der Lebenszyklus von Erythrozyten
Abbildung: Erythropoese und der Lebenszyklus von Erythrozyten
Nach einer Vorlage bei Aaronson / Ward / Connolly, The Cardiovascular System at a Glance, 5th ed. Wiley Blackwell 2020
Die Bildung roter Blutkörperchen (Erythropoese) erfolgt im roten
Knochenmark (beim Fetus in Leber und Milz). Sauerstoffmangel regt die
Bildung des Glycoproteins Erythropoetin an; dieses stammt zum Großteil
aus den Nieren (beim Fetus hauptsächlich aus der Leber)
 Zum Abbau des Hämoglobins s. unten
Zum Abbau des Hämoglobins s. unten

Die Erythropoese
wird durch Erythropoetin  angeregt und dauert jeweils etwa eine Woche
(Stammzelle → Präerythroblast → Erythroblast → Normoblast →
Retikulozyt → Erythrozyt). Eisen, Vitamin B12 und Folsäure
sind zur Blutbildung notwendig.
angeregt und dauert jeweils etwa eine Woche
(Stammzelle → Präerythroblast → Erythroblast → Normoblast →
Retikulozyt → Erythrozyt). Eisen, Vitamin B12 und Folsäure
sind zur Blutbildung notwendig.
 Über Erythroblasten und Eisenhaushalt s. dort
Über Erythroblasten und Eisenhaushalt s. dort
Rote Blutkörperchen müssen beim Weg durch die Blutgefäße beträchtliche Schubspannungen tolerieren ( s. Hämorheologie).
Auch treten starke mechanische Belastungen durch äußeren Druck auf exponiertes Gewebe auf (z.B. in der Fußsohle beim Gehen → Hämolyse einiger Erythrozyten).
s. Hämorheologie).
Auch treten starke mechanische Belastungen durch äußeren Druck auf exponiertes Gewebe auf (z.B. in der Fußsohle beim Gehen → Hämolyse einiger Erythrozyten).
Die Membran der Erythrozyten ist vor allem für Chloridionen durchgängig; das Membranpotential beträgt nur etwa -10 mV.
Eine erwachsene Person produziert pro Tag 40-50 ml Blut nach, das
entspricht (bei einem Hämatokrit von 0,4) der täglichen Neubildung von
etwa 7 Gramm Hämoglobin oder 200-250 Milliarden roten Blutkörperchen.
Hämoglobinsynthese ~7 g/d
|
7 Gramm Hämoglobin enthalten knapp 100 Milligramm Eisen; dass der
Mensch mit einer Eisenaufnahme von ~1-2 mg/d das Auslangen findet,
zeigt, dass das Eisen im Körper fast vollständig wiederverwertet wird.

Abbildung: Erythrozytenmembran
Nach Lux SE IV, Anatomy of the red cell membrane skeleton: unanswered questions. Blood 2016; 127:187-99
Ein
komplexes Netzwerk stabilisiert den Erythrozyten mechanisch bei seiner
fortwährenden Belastung bei der Passage durch die Blutgefäße. Besonders
auffallend ist ein aus Aktin und Spectrin bestehendes Faserwerk an der Innenseite der
Membran. Ankyrin ist ein Protein des Zellskeletts, über das Spectrin an die Membran bindet.
Bande 3 ist ein Transporteiweiß und dient dem Chlorid-Bicarbonat-Austausch, Bande 4 stabilisiert die Verbindung zwisachen Aktin und Spektrin, und
beeinflusst so mechanische Stabilität und Verformbarkeit des
Erythrozyten.
Glykophorin (GPB)
ist ein stark glykosyliertes Membranprotein, das durch Sialinsäure eine
starke Polarität des Erythrozyten bewirkt (gegenseitige Abstoßung,
Stabilisierung der Zellsuspension im Blut). Das Zellskelett-Protein Spektrine
bilden dreidimensionale Maschenwerke an der Innenseite der
Eryhrozytenmembran und stabilisieren die Erythrozyten, was wegen der
mechanischen Belastungen bei der Strömung durch die Gefäße notwendig
ist.
Die
funktionellen Implikationen sind Gegenstand der Forschung. Einige Proteine
sind in niedriger Konzentration in den Molekülkomplexen vorhanden, wie Kell,
Kx, CD44, CD47, DARC/Duffy, LW, Phosphofruktokinase, Aldolase, p55,
Peroxiredoxin 2 (Prx2), Adduzin, Dematin. Die Ankyrin- und
Aktin-Komplexe verändern sich in Zusammensetzung und Beweglichkeit.
CH,
calponin
homology - CH-Domänen binden Aktin

CH1 / CH2, aktinbindende β-Spectrin-Domänen

EF, Ca
++-bindende EF-Domäne des α-Spectrin

F-Aktin, fädiges Aktin

GEC,
glykolytischer Enzymkomplex

Glut1,
Glucosetransporter 1

GPA,
GPB, GPC/D, Glykophorin A, B, C / D

LW, Landsteiner-Wiener


RhAG, Rhesus-assoziiertes Glykoprotein

Ein
molekulares "Verstärkungsnetz" in der Wand der Erythrozyten
( Abbildung) unterstützt deren mechanische Belastbarkeit. Zu diesem
System gehören fadenförmige (Aktin, Spektrin) sowie Verankerungsmoleküle (Bande 4-Proteine, Ankyrin).
Abbildung) unterstützt deren mechanische Belastbarkeit. Zu diesem
System gehören fadenförmige (Aktin, Spektrin) sowie Verankerungsmoleküle (Bande 4-Proteine, Ankyrin).
Erythrozyten sind für ihren Energiestoffwechsel - wie Gehirn und Nierenmark - auf Glucose angewiesen. Glucose gelangt mittels des Transporters GLUT1
durch die Ery-Membran.
ATP benötigen Erythrozyten
vor allem für den Ionentransport durch die Ery-Membran.
 Der Glucoseverbrauch der roten Blutkörperchen beträgt bei einer erwachsenen Person etwa 30 g/d.
Der Glucoseverbrauch der roten Blutkörperchen beträgt bei einer erwachsenen Person etwa 30 g/d.
Rote Blutkörperchen verfügen weder über
Mitochondrien noch Zellkern und Ribosomen, und können daher nicht auf
Sauerstoff
zurückgreifen (kein Citratzyklus, keine Atmungskette); sie holen sich die Energie (ATP) anaerob aus der
Glykolyse (90% des Glucoseverbrauchs der Erythrozyten). Das entstehende Lactat wird ins Blut abgegeben und kann von
anderen Zellen (Leber, Muskel) in den oxidativen Stoffwechsel
zurückgeschleust werden.
Etwa 10% der Ery-Glucose läuft nicht in die Glykolyse, sondern den Pentosephosphatweg. Auf diese Weise können Erythrozyten das Redox-Enzymsystem NADPH/H+
herstellen, was für die Regeneration von Glutathion wichtig ist. NADPH
benötigen Erythrozyten auch für die Reduktion von S-S-Gruppen sowie für
die Durchgängigkeit der Zellmembran für Natrium.
Erythrozyten
lassen Wassermoleküle durch ihre Membran treten, wenn entsprechende
osmotische Gradienten auftreten (z.B. im Nierenmark). Dazu sind sie mit
Aquaporin-1-Kanälen ausgestattet (etwa 200,000 pro Zelle).
Glykolytische
ATP-Gewinnung ist der einzige Weg, wie Erythrozyten ihren
Energiehaushalt bestreiten und ATP-abhängige Ionenpumpen aktivieren.
Störungen im Bereich glykolytischer Enzyme blockieren diesen
Mechanismus, verhindern eine normale Ionenbilanz und führen zu
unkontrolliertem Flüssigkeitseinstrom und Schwellung bis hin zu
Hämolyse. Folge kann hämolytische Anämie sein.
Bei der Testung der
osmotischen Resistenz
werden Erythrozyten in hypotone Medien gebracht und untersucht, ab
welchem osmotischen Gradienten Hämolyse erfolgt. Ohne Aquaporine in
ihrer Membran würden die Erythrozyten nicht so rasch anschwellen, wie
sie es bei dieser Probe tun.
 Über Carboanhydrase und die Beteiligung der Erythrozyten am Säure-Basen-Haushalt s. dort
Über Carboanhydrase und die Beteiligung der Erythrozyten am Säure-Basen-Haushalt s. dort
Oxidationsschutz
Erythrozten enthalten etwa 2 mM Glutathion, ein atypisches Tripeptid (Glutamat - Cystein - Glyzin), das
extraribosomal
(und daher auch vom Erythrozyten) unter

Verbrauch von ATP synthetisiert
wird. Über die Thiolgruppe (HS-) können Elektronen abgegeben werden,
der entstehende Wasserstoff kann dann oxidierte Moleküle reduzieren.
Das Glutathionsystem -
Glutathion und
Glutathion-Disulfid - dient
als Oxidationsschutz für Ery-Membran, Hämoglobin und Enzyme.
Es sorgt insbesondere dafür, Wasserstoffperoxid und Sauerstoffradikale
unschädlich zu machen, die im Erythrozyten entstehen (hoher pO
2 im Erythrozyten, daher Entstehung vieler Sauerstoffradikale), z.B. bei der spontanen Oxidation des Hämoglobins (Fe
++,
ferrous state) zu
Methämoglobin (Fe
+++,
ferric state).
Methämoglobin
(MetHb) entsteht im Körper spontan und wird enzymatisch zu Hämoglobin rückverwandelt. Es kann Sauerstoff nicht binden ("funktionelle Anämie") und reduziert die O2-Transportkapazität
des Blutes auch durch Linksverschiebung der Sauerstoffbindungkurve des
verbliebenen normalen
Hämoglobins. MetHb macht normalerweise <2% des Hämoglobingehaltes
der Erythrozyten aus, abhängig vom Gleichgewicht seiner Bildung und
seiner Rückführung zu Fe++-Hämoglobin durch Aktivität der löslichen Isoform von Methämoglobin-Reduktase (korrekte Bezeichnung Cytochrom-b5-Reduktase). Dieses Enzym reduziert an Zytochrom gebundene Fe+++-Häm zum normalen Häm (mit Fe++) - dabei wird NADH zu NAD+ oxidiert (Elektronen werden entfernt).
Bei Werten über 2% wiegt
Methämoglobinämie vor, verursacht u.a. durch Mangel an
Cytochrom-b5-Reduktase (erbliche Form bei Mutation des Gens) oder
diverse Gifte (Nitrate / Nitrite etc).
Methämoglobin ist nicht rot, sondern bräunlich / bläulich. Pulsoximeter
missdeuten die Anwesenheit von MetHb als 85% Sauerstoffsättigung.
Im Sinne eines niedrigen MetHb-Spiegels wirken das Glutathion / NADPH-System und das MetHb-Reduktase / NADH-System.
Erythrozyten enthalten außerdem Superoxiddismutase (SOD) - das sind Enzyme, die - sehr reaktionsfreudige - Superoxide (Hyperoxide) zu Wasserstoffperoxid (H2O2) umwandeln.
Blutkörperchen haben antigene Eigenschaften, die in Blutgruppen zusammengefasst werden
Physiologische Immunreaktionen
können in der modernen Medizin zum Problem werden - zum Beispiel im
Rahmen von Transplantatabstoßungen oder Blutgruppenunverträglichkeit.
Antigene Blutgruppeneigenschaften: In der Membran der Blutkörperchen befinden sich verschiedenste
Moleküle (Glykolipide, Proteine), die bei Übertragung auf einen Empfänger (Bluttransfusion)
von dessen Immunsystem als fremd erkannt und attackiert werden können. Die antigenen Eigenschaften sind vor allem auf
(Spender-) Erythrozyten bedeutsam, sie können zu klinisch relevanten
Reaktionen (Transfusionszwischenfällen) führen: Aggregation und Verletzung der Erythrozyten - das Ergebnis ist Hämolyse (wie bei einer Typ-II-Reaktion).
Agglutinine: Die Antikörper, welche (nach vorangegangener Sensibilisierung) im Serum
vorhanden sind, mit Blutgruppeneigenschaften reagieren und Erythrozyten
verklumpen (agglutinieren) können, fallen in verschiedene
Immunglobulin-Klassen. Die wichtigsten gehören zum AB0-System (IgM) und
Rhesus-System (IgG). Nachdem diese Antikörper Blutkörperchen miteinander verbinden können, nennt man sie Hämagglutinine.
A und B sind Membraneigenschaften (Epitope), die denen von Mikroorganismen im Körper ähnlich sind. Daher bildet der Körper bei Fehlen von A oder B, oder A und
B auf den Blutkörperchen Antikörper (Klasse IgM, d.h. Pentamere mit 0,9 MD Molekülmasse), die eigentlich gegen antigene
Eigenschaften auf Mikroorganismen gerichtet sind, aber auch
Erythrozyten mit der entsprechenden Eigenschaft agglutinieren können.
Diese Agglutinine sind vom Typ IgM und können die Plazentarschranke nicht passieren; daher spielen Unterschiede im AB0-System zwischen Mutter und Fetus kaum eine Rolle.

Abbildung:
Schema zum AB0-System
Nach einer Vorlage bei Buzzle.com
Gegen Antigene, die nicht auf den eigenen
Erythrozyten vorhanden sind, liegen im Plasma Antikörper (Hämagglutinine) vor

Träger der Blutgruppe A bilden Anti-B, solche der Blutgruppe B
bilden Anti-A; bei Blutgruppe AB werden weder Anti-A noch Anti-B
gebildet, und bei Blutgruppe Null sind beide Agglutinine im Serum
enthalten.
Da bei gruppenungleichen Bluttransfusionen
Erythrozyten mit Agglutinogenen (A, B) von entsprechenden Agglutininen
im Plasma des Empfängers verklumpt werden, kann im Notfall (d.h. in
lebensbedrohlichen Situationen, in denen keine passenden Blutkonserven
verfügbar sind) Blut der Gruppe Null als "Universalspender" (universal donor) verwendet
werden (keine AB-Antigene auf den Erythrozyten, die Agglutinine A und B
werden im Kreislauf des Empfängers stark verdünnt und führen kaum zu
Agglutination der Erythrozyten des Empfängers).
Umgekehrt kann in einer solchen Notsituation auf AB-positive Menschen
Blut beliebiger AB0-Konstellation übertragen werden, da diese keine
AB-Agglutinine in ihrem Blutplasma haben (Blutgruppenträger AB als
"Universalempfänger") (universal recipient).
Bezüglich der Vererbung der
Blutgruppeneigenschaften muss man wissen, dass die Allele A und B
(Erythrozyten) kodominant sind (beide gleichzeitig exprimiert werden
können), während sie sich der Eigenschaft "H" (0) gegenüber (HH:
Blutgruppe 0) dominant verhalten.
Ein Allel ist eine (von meist zwei: mütterlich, väterlich) Form eines Gens. Eine heterozygozte Person verfügt über zwei unterschiedliche Allele eines betreffenden Gens.
 Bei Blutgruppe A
(Phänotyp) kann der Genotyp A0 oder AA sein (Serum enthält
Anti-B). Häufigkeit in Mitteleuropa: 42-47% (Deutschland 43%). Das
A-Allel findet sich häufig (>30%) bei Bewohnern von Teilen
Nordeuropas, Nordamerikas und Südaustraliens, selten (<5%) in
Mittel- und Südamerika
Bei Blutgruppe A
(Phänotyp) kann der Genotyp A0 oder AA sein (Serum enthält
Anti-B). Häufigkeit in Mitteleuropa: 42-47% (Deutschland 43%). Das
A-Allel findet sich häufig (>30%) bei Bewohnern von Teilen
Nordeuropas, Nordamerikas und Südaustraliens, selten (<5%) in
Mittel- und Südamerika
 Bei Blutgruppe B
(Phänotyp) kann der Genotyp B0 oder BB sein (Serum enthält
Anti-A). Häufigkeit in Mitteleuropa: 8-12% (Deutschland 11%). Das
B-Allel findet sich relativ häufig (>20%) bei Bewohnern weiter Teile
Asiens, selten (<5%) in Nord- und Südamerika und Australien
Bei Blutgruppe B
(Phänotyp) kann der Genotyp B0 oder BB sein (Serum enthält
Anti-A). Häufigkeit in Mitteleuropa: 8-12% (Deutschland 11%). Das
B-Allel findet sich relativ häufig (>20%) bei Bewohnern weiter Teile
Asiens, selten (<5%) in Nord- und Südamerika und Australien
 Bei Blutgruppe AB (Phänotyp) lautet der Genotyp AB (Serum enthält keine AB0-Agglutinine). Häufigkeit in Mitteleuropa: 3-5% (Deutschland 5%)
Bei Blutgruppe AB (Phänotyp) lautet der Genotyp AB (Serum enthält keine AB0-Agglutinine). Häufigkeit in Mitteleuropa: 3-5% (Deutschland 5%)
 Bei Blutgruppe 0
(Phänotyp) lautet der Genotyp 00 (Serum enthält Anti-A und
Anti-B). Häufigkeit in Mitteleuropa: 40-47% (Deutschland 41%). Dieser
Genotyp überwiegt in allen Teilen der Welt, insbesondere Mittel- und
Südamerika (>90%), Nordamerika (60-100%), am wenigsten in Mittel-
und Osteuropa, Zentralasien (40-60%)
Bei Blutgruppe 0
(Phänotyp) lautet der Genotyp 00 (Serum enthält Anti-A und
Anti-B). Häufigkeit in Mitteleuropa: 40-47% (Deutschland 41%). Dieser
Genotyp überwiegt in allen Teilen der Welt, insbesondere Mittel- und
Südamerika (>90%), Nordamerika (60-100%), am wenigsten in Mittel-
und Osteuropa, Zentralasien (40-60%)
Erythrozyten der Gruppe 0
(Null) sind im AB0-System nicht agglutinierbar ("Universalspenderblut"
der Gruppe 0). Null-Blut enthält aber Isoagglutinine A und B im Plasma,
das Erythrozyten anderer Gruppen (A, B, AB) agglutinieren würde
Blut der Gruppe AB enthält weder Isoagglutinine
A noch B im Plasma und agglutiniert daher weder A- noch B-positive
Erythrozyten, sollten solche transfundiert werden (AB-"Universalempfänger
")
A- und B-Isoagglutinine sind Immunglobuline vom Typ IgM (pentamer) und können die Plazentarschranke normalerweise nicht überwinden
Blutgruppenvererbung: Das Allel 0 (H) ist gegenüber A und B rezessiv. Die Allele A und B sind kodominant (Blutgruppe AB!)
|
Im Rhesus-System spielen
insgesamt etwa 50 (ähnlich aufgebaute) potentiell antigen wirkende
Proteine eine Rolle, die wichtigsten haben die Abkürzung c, C, D,
e und E erhalten (in alphabetischer Fortsetzung von A und B).
Ist der Faktor D
(RhD-Protein) auf den Erythrozyten nachweisbar, nennt man die betreffende Person
Rhesus-positiv, abgekürzt Rh(D)+, Rh+, Rh oder auch (entsprechend dem
Genotyp) Dd (dD), oder DD. Fehlt der Faktor D, ist die Person Rhesus-negativ - abgekürzt Rh(d), Rh−, rh oder dd.
rhesus-negative Menschen bilden normalerweise keine (präformierten) Rh-Antikörper
Wird aber eine rh-negative Mutter zum zweiten Mal mit einem
Rh-positiven Kind schwanger, kann es zu Rhesusinkompatibilität und
hämolytischer Anämie beim Kind kommen
Das Merkmal D ist dominant gegenüber d (Dd bedeutet Rhesus-Positivität)
Eine homozygot-positive Person (DD) bekommt immer Rhesus-positive Kinder
Eine heterozygot-positive
Person (Dd) kann mit einem rhesus-negativen Partner (dd) sowohl
Rhesus-positive (Dd) als auch rhesus-negative Kinder bekommen
(Wahrscheinlichkeit jeweils 50%)
|
Überträgt man Rhesus-positives Blut auf einen rhesus-negativen
Empfänger, hat das in der Regel keine Ery-Agglutination zur Folge -
zumindest, wenn der Empfänger nicht schon durch eine vorherige
Exposition gegenüber dem Faktor D sensibilisiert wurde. Allerdings
führt diese Fehlinfusion zur Sensibilisierung des Empfängers, und eine allfällige spätere Transfusion mit Rh+-Blut würde zu einem entsprechenden Zwischenfall führen.
Ein Sonderfall sind mögliche Reaktionen während einer Schwangerschaft in Bezug auf
Erythrozyten des Kindes in utero (Rhesus-Inkompatibilität).
Die häufigste Ursache für die Bildung von Rhesus-Antikörpern bei
rhesus-negativen Frauen (in Mitteleuropa ~15% aller Frauen) ist nicht
eine Bluttransfusion, sondern eine Schwangerschaft mit einem
Rh-positiven Kind: Spätestens bei der Entbindung gelangen
D+-Erythrozyten in den mütterlichen Kreislauf und bewirken (falls
keine rechtzeitige Prophylaxe
erfolgt) Sensibilisierung und Bildung von Anti-D-Antikörpern.
Die Rhesusprophylaxe besteht
aus der Gabe von maskierenden Antikörpern gegen D, d.h. sie binden an
das Rhesus-Antigen und verhindern dadurch dessen Erkennung durch
B-Lymphozyten, die Spezifität gegen "Rhesus" aufweisen.
Anti-D-Antikörper gehören zur IgG-Familie und überqueren die
Plazentarschranke. Sie können daher bei einer nächsten Rhesus-inkompatiblen Schwangerschaft
das fetale Blut hämolysieren, was dem Fetus schaden oder sogar sein
Absterben bewirken kann.
Blutgruppenabhängige Inkompatibilität zwischen Mutter und Kind spielt
überwiegend im Rhesus-System eine Rolle. Das AB0-System fällt kaum ins
Gewicht, weil die Antikörper zum Typ IgM gehören und die
Plazentarschranke nicht überwinden.
Vererbung von Blutgruppenfaktoren
Im ABO-System vererben sich die Eigenschaften über ein einziges AB0-Gen,
das eine Glykosyltransferase codiert und damit den Kohlenhydratanteil
des betreffenden Erythrozyten-Antigens modifizieren kann.
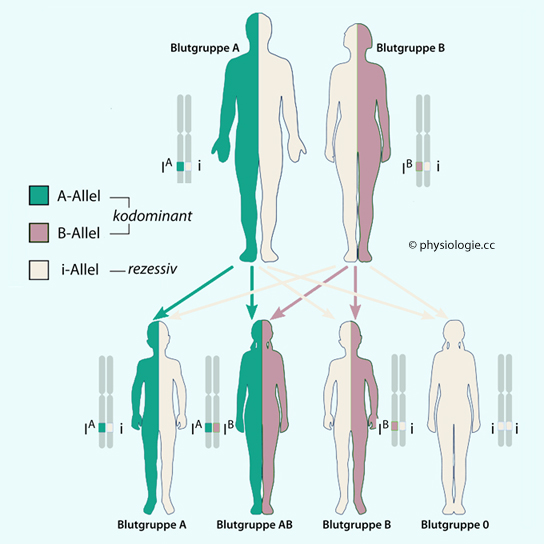
 Abbildung: Blutgruppenvererbung im AB0-System
Abbildung: Blutgruppenvererbung im AB0-System
Nach einer Vorlage bei Wikipedie
Beispiel: Vater
Blutgruppe A, Mutter B (beide mischerbig). Die Kinder haben mit jeweils
25% Wahrscheinlichkeit die Blutgruppen A, B, AB oder Null

Das Gen liegt in
Form eines von drei möglichen Allelen vor: i, IA oder IB ("I" für Isoagglutinogen).
Das Produkt von i ist die (so gut wie nicht antigene) Eigenschaft 0 (H), das von IA die Eigenschaft A und das von IB die Eigenschaft B.
Das Gen liegt - auf dem langen Arm des Chromosoms 19 - doppelt vor, ein
Allel stammt von der Mutter und eines vom Vater.
Demnach verfügt jeder
Mensch über eine Zweierkombination von AB0-Genen.
IA und IB sind kodominant; die Eigenschaften A und B können gleichzeitig realisiert werden.
IA und IB verhalten sich dominant gegenüber i.
Daraus ergeben sich folgende Möglichkeiten:
Genotyp
|
Phänotyp
(Blutgruppe)
|
i i
|
0 (H)
|
| i IA |
A
|
| IA IA |
A
|
| i IB |
B
|
| IB IB |
B
|
| IA IB |
AB
|
Im Rhesus-Blutgruppensystem spielt die Vererbung der Eigenschaft D die Hauptrolle. Sie wird über ein
Gen (RHD-Gen) auf dem kurzen Arm des Chromosoms 1 übertragen; hier gibt
es verschiedene mögliche Allele, vereinfacht können diese als "D" oder
"d" eingeteilt werden, wobei sich D dominant gegenüber d verhält.
Demnach haben rhesus-negative Eltern definitiv rhesus-negative Kinder
(Genotyp dd), denn sie können beide die Eigenschaft D (die zur
Expression des RhD-Proteins führt) nicht übertragen haben (beide dd) -
sonst wäre mindestens ein Elternteil Rhesus-positiv (Dd oder DD).
Andere Blutgruppensysteme: Neben AB0 und Rhesus existieren zahlreiche (über 30) weitere Blutgruppensysteme,
Inkompatibilitäten in ihrem Rahmen können in Einzelfällen klinisch
bedeutsame Situationen bedingen. Die Systeme
betreffen jeweils eigene Antigene (1 bis ~50 je System).
 1901 entdeckte der Österreicher (ab 1929 US-Bürger) Karl Landsteiner
ein System, das die Agglutination von Spendererythrozyten in
Empfängerplasma erklärt (Publikation: "Über die
Agglutinationserscheinungen normalen menschlichen Blutes"). Das System
wurde nach den ersten Buchstaben im Alphabet als A-B-Null-System
bezeichnet. 1930 erhielt er "für die Entdeckung der Blutgruppen des
Menschen" den Nobelpreis für Physiologie oder Medizin. 1937 entdeckte er zusammen mit dem Amerikaner
Alexander S. Wiener den Rhesus-Faktor.
1901 entdeckte der Österreicher (ab 1929 US-Bürger) Karl Landsteiner
ein System, das die Agglutination von Spendererythrozyten in
Empfängerplasma erklärt (Publikation: "Über die
Agglutinationserscheinungen normalen menschlichen Blutes"). Das System
wurde nach den ersten Buchstaben im Alphabet als A-B-Null-System
bezeichnet. 1930 erhielt er "für die Entdeckung der Blutgruppen des
Menschen" den Nobelpreis für Physiologie oder Medizin. 1937 entdeckte er zusammen mit dem Amerikaner
Alexander S. Wiener den Rhesus-Faktor.
Erythrozytenabbau
Werden
Erythrozyten beschädigt bzw. erreichen sie ein Alter von 100-120 Tagen,
werden sie durch Makrophagen in Milz und Leber abgefangen und
hämolysiert. Frei werdendes Hämoglobin wird durch einen Hämoglobintransporter
(CD163) abgefangen und alleine oder als Komplex mit Haptoglobin weiter
befördert. CD163 wird nur von Monozyten / Makrophagen produziert.

 Abbildung: Abbau des Häms zu Urobilin und Stercobilin
Abbildung: Abbau des Häms zu Urobilin und Stercobilin
Kombiniert nach Panini
SR, Medical Biochemistry, 2nd ed. 2021 (Thieme); und Klei TR, Meinderts
SM, van den Berg TK, van Bruggen R: From the Cradle to th Grave: The
Role of Macrophages in Erythropoiesis and Erytherophagocytosis. Front Immunol 2017
Makrophagen erkennen über mehrere Rezeptorsysteme gealterte / funktionsuntüchtige Erythrozyten in Milz und Leber, binden und phagozytieren sie.
Aus dem Hämoglobin der Erythrozyten trennen die das Häm vom
Proteinanteil, Hämoxydase oxydiert dieses zu Biliverdin (zweiwertiges
wird zu dreiwertigem Eisen, dieses wird recycelt; beim Aufbrechen einer Brücke zwischen zwei Pyrrolringen wird CO frei).
Biliverdin wird durch Wirkung der Bilirubinreduktase zu Bilirubin. Dieses gibt der
Makrophage an die Blutbahn weiter, über die es - reversibel an Albumin gebunden - zur Leber gelangt.
Die Leber nimmt
Biliverdin auf und macht es wasserlöslich - zum Großteil durch doppelte Glucuronierung (UDP =
Uridin-Diphosphat, GlcA = Glucuronsäure). Leberzellen
scheiden das Bilirubindiglucuronid in das Gallensystem aus, Galle
gelangt in den Dünndarm; hier verwandeln bakterielle Enzyme Bilirubindiglucuronid zu Urobilinogen.
Urobilinogen wird
im Darm resorbiert und kann von der Leber wiederverwendet werden. Ein
Teil gelangt über den Blutkreislauf zu den Nieren, wird hier zu Urobilin oxidiert
und mit dem Harn ausgeschieden (1-2 mg/d). Der Großteil des Urobilinogens verbleibt im Darm, wird hier
durch bakterielle Enzyme zu Sterkobilin, welches mit dem Stuhl
ausgeschieden wird (40-280 mg/d).
Gallenfarbstoffe haben unterschiedliche Farben: Häm erscheint lila,
Biliverdin grünlich, Bilirubin rötlich-orange; Urobilinogen ist
farblos, Urobilin gelblich (Farbe des Harns), Stercobilin rötlichbraun
(Farbe des Stuhls)

Makrophagen spielen für Entstehung, Freisetzung, Reparatur und Abbau roter
Blutkörperchen an verschiedenen Stellen des Körpers eine entscheidende
Rolle. Sie helfen nicht nur bei der Differenzierung der
Erythrozytenvorstufen im roten Knochenmark
(Steuerung der Erythropoese) und reparieren nach deren Freigabe in den
Kreislauf auftretende Schäden vorbeiströmender Erythrozyten in der Milz, sondern phagozytieren - nach rund vier Monaten Zirkulation jedes Ery - schließlich "ausgediente" rote Blutkörperchen in Milz und Leber mittels mehrfacher Rezeptorinteraktion und spalten Hämoglobin zum Globinanteil (dessen Aminosäuren
wiederverwertet werden) und Häm auf.
Das Häm wird mittels einer Hämoxygenase (HO - beim Menschen mehrere Isoformen) weiter abgebaut, dabei entstehen ( Abbildung)
Abbildung)
 Bilirubin / Biliverdin,
Bilirubin / Biliverdin,
 dreiwertiges Eisen (Fe3+) sowie
dreiwertiges Eisen (Fe3+) sowie
 Kohlenmonoxid
(das wiederum stark an Hämoglobin bindet. 1% des zirkulierenden Hämoglobins
enthält CO, dies ist die einzige physiologische Quelle von
Kohlenmonoxid im Blut).
Kohlenmonoxid
(das wiederum stark an Hämoglobin bindet. 1% des zirkulierenden Hämoglobins
enthält CO, dies ist die einzige physiologische Quelle von
Kohlenmonoxid im Blut).
Hämoxygenase kommt überall im Körper vor, sie ist aber in Milz,
Leber
und Nieren am stärksten aktiv. Sie unterliegt dem Einfluss mehrerer
Rückkopplungsfaktoren; so können sowohl Häm als auch Metallionen die
Synthese von
Hämoxygenase bis zu hundertfach steigern.
Frei gewordenes Fe3+ wird vom Makrophagen an seiner Zellmembran an das Glycoprotein Transferrin übertragen. Dieses bindet das Eisen reversibel mit sehr hoher Affinität und transportiert
es durch den Kreislauf. Die Transportkapazität ist gering (4 mg, etwa
0,1% des gesamten Eisenpools im Körper), aber die Übertragungsrate auf
Abnehmer des Eisens (rotes Knochenmark) hoch (etwa 1 mg/h).
Geschwindigkeitsbestimmend ("indirektes" → "direktes" Bilirubin) ist die Uridin 5'-Diphospho-Glucuron(os)yltransferase (UDP-GT) in der Leber - diese übernimmt die Glucuronierung des Bilirubins und damit etwa 80% der Produktion
löslicher Gallenfarbstoffe (10% werden sulfatiert, 10% anders löslich
gemacht). Neugeborene verfügen noch über eine sehr geringe
UDP-GT-Aktivität und neigen deshalb einige Tage nach ihrer Geburt zu
Gelbsucht (icterus neonatorum).
Die Bestimmung zellulärer Blutbestandteile wird als Blutbild bezeichnet
 Zum "Kleinen Blutbild"
zählen: Zahl der Erythrozyten, Leukozyten und Thrombozyten pro Liter
bzw. µl Blut; Hämoglobinkonzentration, Hämatokrit, MCV (Ery-Volumen in
µl), MCH (Ery-Hämoglobinmenge in pg) und MCHC (Hämoglobinkonzentration
in den Erythrozyten in g/l).
Verringerte Erythrozyten- bzw. Hämoglobinmasse im Blut (Anämie) reduziert die Sauerstofftransportkapazität
Zum "Kleinen Blutbild"
zählen: Zahl der Erythrozyten, Leukozyten und Thrombozyten pro Liter
bzw. µl Blut; Hämoglobinkonzentration, Hämatokrit, MCV (Ery-Volumen in
µl), MCH (Ery-Hämoglobinmenge in pg) und MCHC (Hämoglobinkonzentration
in den Erythrozyten in g/l).
Verringerte Erythrozyten- bzw. Hämoglobinmasse im Blut (Anämie) reduziert die Sauerstofftransportkapazität
 Verringerte Leukozytenzahl reduziert die immunologische Kapazität des Blutes
Verringerte Leukozytenzahl reduziert die immunologische Kapazität des Blutes
 Verringerte Thrombozytenzahl reduziert die Hämostasekapazität bzw. das Gerinnungsvermögen
Verringerte Thrombozytenzahl reduziert die Hämostasekapazität bzw. das Gerinnungsvermögen

Rotes Blutbild  Hämolyse
Hämolyse  Blutsenkung
Blutsenkung  Weisses Blutbild
Weisses Blutbild  Blutplättchen
Blutplättchen

Abbildung: Erythrozyten werden entsprechend ihrer Strömungsumgebung deformiert
Nach Lazaro GR, Hernandez-Machado A, Pagonabarraga I.
Rheology of red blood cells under flow in highly confined
microchannels. Soft Matter 2014; 10: 7195-206
Durch
Annahme einer - durch das parabelförmige Strömungsprofil des
Blutplasmas vorgegebenen - "Pfeilspitzenform" in engen Gefäßen können
rote Blutkörperchen (die im Ruhezustand einen Durchmesser von etwa 7 µm
haben - Diskozyten, unten) durch enge Kapillaren - bis zu 3 µm
Durchmesser - strömen (oben).
Blauer Pfeil: Stärkste Strömung im Gefäß (üblicherweise zentral)
 Vgl. Hämorheologie
Vgl. Hämorheologie
Zum roten Blutbild (Untersuchung der roten Blutkörperchen) gehören u.a. Erythrozytenzahl, Hämatokrit, Hämoglobinkonzentration:
 Erythrozyten
Erythrozyten im Vollblut
~5 Millionen / µl Kapillarblut
Frauen 4,1-5,1 - Männer 4,5-5,9
Erniedrigt:
Nach starken
Blutungen (Plasmavolumen erholt sich schneller -
Flüssigkeitsnachstrom aus dem Interstitium -, das senkt den
Erythrozytenanteil am Blutvolumen)
Beim intensivem Krafttraining (längerfristig - Plasmavolumen wächst rascher als Eryvolumen)
Schwangerschaft (Plasmavolumen wächst rascher als Eryvolumen)
 Hämatokrit (
Hämatokrit (Anteil der Erythrozyten am Volumen der Blutprobe
)
~0,44 (44%)
Frauen 0,38-0,48 - Männer 0,40-0,53
Erniedrigt:
 Nach starken Blutungen (Plasmavolumen erholt sich schneller)
Nach starken Blutungen (Plasmavolumen erholt sich schneller)
 Beim intensivem Krafttraining (Plasmavolumen wächst rascher als Eryvolumen)
Beim intensivem Krafttraining (Plasmavolumen wächst rascher als Eryvolumen)
 Schwangerschaft (Plasmavolumen wächst rascher als Eryvolumen)
Schwangerschaft (Plasmavolumen wächst rascher als Eryvolumen)

Abbildung: Erythrozytenmembran (Innenseite)
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 1st ed. Saunders 2003
Vereinfachtes Modell. Vgl. Abbildung oben

 Hämoglobin im Vollblut
Hämoglobin im Vollblut
~150 g/l Blut
Frauen 123-153, Männer 140-175
Erniedrigt:
 Nach starken Blutungen (Plasmavolumen erholt sich schneller)
Nach starken Blutungen (Plasmavolumen erholt sich schneller)
 Beim intensivem Krafttraining (Plasmavolumen wächst rascher als Eryvolumen)
Beim intensivem Krafttraining (Plasmavolumen wächst rascher als Eryvolumen)
 Schwangerschaft (Plasmavolumen wächst rascher als Eryvolumen)
Schwangerschaft (Plasmavolumen wächst rascher als Eryvolumen)


Altersabhängigkeit
 s. dort
s. dort

Mittlerer
Erythrozytendurchmesser
7-8 µm
Die statistische Verteilung der Erythrozytendurchmesser einer Blutprobe wird als
Price-Jones'sche Kurve bezeichnet.
 Diese lässt nicht nur die Größenverteilung erkennen, sondern auch, ob die Probe mehrere Ery-Populationen enthält (Mehrgipfligkeit der Verteilungskurve)
Diese lässt nicht nur die Größenverteilung erkennen, sondern auch, ob die Probe mehrere Ery-Populationen enthält (Mehrgipfligkeit der Verteilungskurve)

Mittleres
Erythrozytenvolumen
(MCV = mean corpuscular volume)
~90 fl (=Femtoliter =10-15 l)
Referenzbereich 80-96
"Normozytär" bedeutet: [MCV] im Normbereich
[MCV] erniedrigt: mikrozytäre Veränderung
[MCV] erhöht: makrozytäre Veränderung |

Über das
SI-System (Präfixe und Einheiten)
s.
dort

Mittlere
Hämoglobinmenge pro Erythrozyt
(MCH = mean corpuscular hemoglobin):
30 pg (10-12 g) / Erythrozyt
Referenzbereich 28-33
Der MCH ist leicht errechnet: Hämoglobinkonzentration / Erythrozytenzahl (bezogen auf dasselbe Volumen)
"Normochrom" bedeutet: [MCH] im Normbereich
[MCH] erniedrigt: hypochrome Veränderung
[MCH] erhöht: hyperchrome Veränderung
|

Mittlere
Hämoglobinkonzentration in der Erythrozytenfraktion
(MCHC = mean corpuscular hemoglobin concentration)
~340 g / l Erythrozyten
Referenzbereich 330-360
Berechnung MCHC:
Hämoglobinkonzentration / Hämatokrit
|

Anteil an
Retikulozyten (jungen Erythrozyten)
0,5-2% der Erys (25-75 Tausend/µl)
Die
Retikulozytenzahl spiegelt die Erythropoeseleistung des Knochenmarks
wider und steigt z.B. (kompensatorisch) bei hämolytischen Anämien
|
Hämolyse
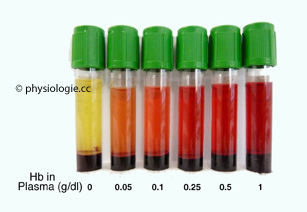
 Abbildung: Plasmafarbe und Hämolysegrad
Abbildung: Plasmafarbe und Hämolysegrad
Nach Brunel V, Larson T, Peschanski N, Cauliez B. Evaluation of haemolysis in
emergency department samples requesting high sensitivity troponin T
measurement. Ann Clin Biochem 2012; 49: 509-10
Links: Serumprobe frei von Hämolyse, bernsteinfarben, ohne Beimengung von Hämoglobin. Unten: abzentrifugierte Erythrozyten.
Daneben: Je höher der Hämoglobinanteil im Plasma (Hämolyse), desto intensiver dessen Rotfärbung (nach rechts ansteigend)

Hämolyse: Wird Blut mechanisch unter Druck gesetzt (z.B. beim Gehen in der Fußsohle) oder unsanft abgenommen (starker Unterdruck durch
ungeduldiges Ziehen am Spritzenstempel), kommt es zur Zerstörung
einiger Erythrozyten (mechanische Hämolyse), es tritt Hämoglobin aus und gelangt ins Plasma (freies Hämoglobin). Der Anteil an Hämoglobin im Plasma steigt dadurch messbar
an.
Bei intensiver Hämolyse färbt sich das Blutplasma rötlich - bei
geringem Hämolysegrad ist dies nicht mit freiem Auge sichtbar (nur
spektrophotometrisch), bei intensiverer Beschädigung ist der Effekt
deutlich zu erkennen ( Abbildung).
Abbildung).
 Osmotische
Resistenz der Erythrozyten: Widerstandsfähigkeit gegen
osmotische Zerstörung (Hämolyse) in hypotonen (verdünnten) Salzlösungen: Bis 180 mmol (isotone Flüssigkeit hat ~290 mmol)
Osmotische
Resistenz der Erythrozyten: Widerstandsfähigkeit gegen
osmotische Zerstörung (Hämolyse) in hypotonen (verdünnten) Salzlösungen: Bis 180 mmol (isotone Flüssigkeit hat ~290 mmol)
Spektrine stabilisieren Zellen, indem sie penta- oder hexagonale Stüchgitter an der Innenseite der Zellmembran bilden. Wenn
Erythrozyten aufbrechen (Hämolyse), tritt Hämoglobin aus, in den verbleibenden (hämoglobinlosen) Zellresten finden sich Spektringitter (spectre: Geist, Gespenst, "Blutschatten").
Blutsenkung
 Blutsenkungsreaktion (BSR, Blutkörperchensenkungsgeschwindigkeit nach Westergren, Erythrocyte sedimentation rate,
Wintrobe ESR,
Blutsenkungsreaktion (BSR, Blutkörperchensenkungsgeschwindigkeit nach Westergren, Erythrocyte sedimentation rate,
Wintrobe ESR,  Abbildung) nennt man die Bestimmung der Sinkgeschwindigkeit
roter Blutkörperchen bei 20-22°C in Citratblut (80% Blut, 20% 3,8%-ige
Natriumcitratlösung) in einem Plastik- (Monovette) oder Glasrohr mit
200 mm-Graduierung.
Abbildung) nennt man die Bestimmung der Sinkgeschwindigkeit
roter Blutkörperchen bei 20-22°C in Citratblut (80% Blut, 20% 3,8%-ige
Natriumcitratlösung) in einem Plastik- (Monovette) oder Glasrohr mit
200 mm-Graduierung.

 Abbildung: Blutsenkung
Abbildung: Blutsenkung
Schwarzer Pfeil: Befüllung auf Nullmarke; roter Pfeil: Serum-Ery-Grenze nach z.B. einer Stunde (Position gibt Senkungswert an, in diesem Fall "5")

Rote
Blutkörperchen haben aufgrund ihrer Dichte (~1090 g/l bei
Körpertemperatur), die höher ist als die von Blutserum (~1020 g/l), die
Tendenz, zu sedimentieren, werden aber durch das an ihnen
vorbeiströmende (aufsteigende) Blutplasma bei der Sedimentation
abgebremst. Das quantitative Muster an Plasmaproteinen bestimmt die
Geschwindigkeit des Vorganges.
Mit einem Membranpotential von etwa
-10mV (Zeta-Potential) wird durch elektrostatische Abstoßung eine
Aggregation verhindert und die Erythrozyten halten sich gegenseitig in Suspension.
"Weiße" Blutkörperchen (Leukozyten)
sind auf ständiger Patrouille durch den Organismus auf der Suche nach,
und im Kampf gegen Infektionserreger(n). Dazu nutzen sie das Blut- und Lymphgefäßsystem.
Man klassifiziert sie nach morphologischen (Kernform, allfällige
Granula) und funktionellen Merkmalen. Einige dieser Zellen attackieren
Pathogene direkt, andere sezernieren Stoffe, die sich im Körper
verteilen. Die einen agieren unabhängig (z.B. NK-Zellen), die anderen setzen auf Kooperation (z.B. T-Helferzellen). Leukozyten können - im Rahmen angeborener oder adaptiver Abwehr - phagozytieren, Zytokine sezernieren, oder auf andere Weise Immunfunktionen ausüben.
Alle Leukozyten - die sehr unterschiedliche Lebenszeiten haben -
stammen von Stammzellen ab, die im roten Knochenmark - im Rahmen der Hämatopoese - für Nachschub sorgen. Die
Neubildungsrate von weißen entspricht etwa der von roten
Blutkörperchen; dennoch ist die Leukozytenzahl im Blut um drei
Zehnerpotenzen geringer als die Erythrozytenzahl. Das liegt daran,
dass sich die meisten Leukozyten nicht im Blut, sondern im Gewebe
befinden. Dazu kommt ihre Lebensdauer (Granulozyten: einige
Tage; Lymphozyten: Tage bis Jahre).
Das weiße Blutbild umfasst Leukozytenzahl und Differentialblutbild:
 Leukozyten im Vollblut
Leukozyten im Vollblut
4 bis 11 Tausend/µl
Homöostase: Wie sich die Zahl
der Leukozyten im Kreislauf insgesamt reguliert, ist noch nicht
vollständig geklärt. Eine Rolle spielt sicher die Verfügbarkeit von
Ressourcen und wachstumsanregenden Faktoren, zu denen u.a. Zytokine, für Lymphozyten auch die Anregung durch entsprechende Antigene (klonale Selektion) gehört.

 Abbildung: Diapedese (Extravasation)
Abbildung: Diapedese (Extravasation)
Nach Schnoor M, Parkos CA. Disassembly of endothelial and epithelial junctions during leukocyte transmigration. Front Biosci 2008; 13: 6638-52
Leukozyten treten aus dem Blutstrom aus (gut untersucht) und dringen
durch epitheliale Grenzschichten (Mechanismus weniger klar). Die
Passage der Leukozyten durch den parazellulären Raum (Matrix) erfordert
multiple adhäsive Interaktionen und die Sekretion verschiedener
Matrix-Metalloproteasen (MMPs).
Die Abbildung deutet die Ligand- Rezeptor- Interaktion zwischen Leukozyten und Epithel an, sowie die Anwesenheit eines decay-accelerating factor (DAF) an der apikalen Membran der Epithelzellen - dieser erleichtert die Ablösung von Neutrophilen vom Epithel.
 Näheres s. dort
Näheres s. dort

 Differentialblutbild: Darunter versteht man die relative Häufigkeit (alle Leukos im Blutausstrich = 100%) von
Differentialblutbild: Darunter versteht man die relative Häufigkeit (alle Leukos im Blutausstrich = 100%) von

Granulozyten
~65% (35-85%) aller Leukozyten im Blut
Nach der Form des Chromatins im Zellkern unterscheidet man
 stabkernige
Granulozyten (bis 5% aller Leukozyten, bei Säuglingen und Kindern bis
10%); Stabkernige sind junge neutrophile Granulozyten mit einem stab-
bis hufeisenförmigen Zellkern. Erhöhte Werte finden sich z.B. bei
Entzündungsprozessen und Infektionskrankheiten ("Linksverschiebung")
stabkernige
Granulozyten (bis 5% aller Leukozyten, bei Säuglingen und Kindern bis
10%); Stabkernige sind junge neutrophile Granulozyten mit einem stab-
bis hufeisenförmigen Zellkern. Erhöhte Werte finden sich z.B. bei
Entzündungsprozessen und Infektionskrankheiten ("Linksverschiebung")
 segmentkernige
Granulozyten; diese machen den Großteil der Neutrophilen aus. Sie haben
ein gelapptes Chromatin und sind voll entwickelt. Bei reduzierter
Neubildung von Granulozyten erhöht sich der Anteil der Segmentkernigen
im Blut ("Rechtsverschiebung")
segmentkernige
Granulozyten; diese machen den Großteil der Neutrophilen aus. Sie haben
ein gelapptes Chromatin und sind voll entwickelt. Bei reduzierter
Neubildung von Granulozyten erhöht sich der Anteil der Segmentkernigen
im Blut ("Rechtsverschiebung")
 Die
Bedeutung der Granulozyten ist enorm: Agranulozytose (< 500
Neutrophile / µl Blut) bedingt stark erhöhtes Infektionsrisiko und kann
Sepsis bedingen (Chemotherapie: Tumortherapie-Komplikation).
Die
Bedeutung der Granulozyten ist enorm: Agranulozytose (< 500
Neutrophile / µl Blut) bedingt stark erhöhtes Infektionsrisiko und kann
Sepsis bedingen (Chemotherapie: Tumortherapie-Komplikation).
Granulozyten enthalten Granula, die Amine (darstellbar mit basischen
Farbstoffen), basische Proteine (saure Farbstoffe bzw. Eosin) oder
beides enthalten ("neutrale" Färbung). Dementsprechend unterscheidet man
Neutrophile Granulozyten
 vgl. dort
vgl. dort
40-75% der Leukozyten. Entsprechend der Vielgestaltigkeit ihres Kerns (2-5 Segmente) spricht man auch von polymorphkernigen Zellen (PMN, polymorphonuclear cells). Neutrophile Granulozyten
phagozytieren Mikroorganismen,
sie sind effektiv wirksam gegen
bakterielle und Pilzinfektionen. Ihre biologische Halbwertszeit im
Kreislauf beträgt ungefähr 7 Stunden. Dementsprechend gelangen pro Tag
mehr als 1011
neu gebildete Neutrophile in die Blutbahn; die Reifung vom
Metamyelozyten zu stab- bzw. segmentkernigen Neutrophilen dauert etwa 2
Wochen.
Nach der Phagozytose von Bakterien,
bei der sie ihre Lysosomen einsetzen, gehen Neutrophile zugrunde
(Eiterbildung). Sie dominieren frühe Entzündungsstadien, ein Anstieg der Neutrophilenzahl im Blut signalisiert oft eine akute Infektion.

Neutrophile Granulozyten
2500-7500 / µl Blut
40-75% aller Leukozyten im Blut

 Abbildung: Leukozyten
Abbildung: Leukozyten
Nach einer Vorlage in Doan / Lievano /
Swanson-Mungerson / Viselli, Immunology (3rd ed). Lippincott
Illustrated Reviews, Wolters Kluwer 2022
Granuläre
Leukozyten enthalten in ihrem Zytoplasma deutlich darstellbare körnige
Einschlüsse (Granula, links - daher "Granulozyten" mit
unterschiedlicher Anfärbbarkeit), agranuläre nicht (rechts).
Lymphozyten schließen B-, T- und NK-Zellen ein. Antikörper
produzierende B-Zellen nennt man Plasmazellen. Monozyten können
phagozytieren, im Gewebe nennt man sie Makrophagen.
Dendritische Zellen
sind Phagozyten mit zahlreichen astförmigen Verzweigungen des
Zytoplasma, man findet sie im Gewebe vor allem dort, wo Mikroben
vorkommen (z.B. Haut, Lunge, Gastrointestinaltrakt)

Eosinophile Granulozyten 
 vgl. dort
vgl. dort
Eosinophile Granulozyten - normalerweise 1-5% der Leukozyten im Blut - spielen
eine besondere Rolle bei der Abwehr von Parasiten und können
allergische Reaktionen auslösen. Die Effektorfunktionen inkludieren
Degranulierung mit Freisetzung von basischen Proteinen (MBP: major basic protein; ECP: eosinophil cationic protein),
Sauerstoffradikalen (ROS: Reactive oxygen species) wie Superoxide, Peroxide und Hypobromit; ferner Eikosanoiden,
Elastase und anderen Enzymen (diese Stoffe greifen die Zellwand von Parasiten an), Wachstumsfaktoren und Zytokinen.
 Eosinophile
Eosinophile Granulozyten
40-400 / µl Blut (Eosinophilie ab 1500/µl)
1-6% aller Leukozyten im Blut
Basophile
Granulozyten
 vgl. dort
vgl. dort
Basophile
Granulozyten haben (wie eosinophile) eine zweigelappten Kern und
stellen 0-1% (maximal 2%) der Leukozyten im Blut. Ihre Granula
enthalten vasoaktive Substanzen wie z.B. Histamin. Basophile
Granulozyten interagieren mit anderen Leukozyten, können durch Degranulation Heparin und Histamin freisetzen. Ihre Gewebeform sind Mastzellen.
 Basophile Granulozyten
0-100 / µl Blut
0-1% aller Leukozyten im Blut
Basophile Granulozyten
0-100 / µl Blut
0-1% aller Leukozyten im Blut
Basophile Granulozyten haben strukturelle und Funktionelle Ähnlichkeit mit Mastzellen:
Mastzellen
 vgl. dort
vgl. dort
Mastzellen - ursprünglich der Phagozytose
"verdächtigt" (daher der Name) - stammen
aus dem Knochenmark, aus dem sie als Vorstufen auswandern. Sie siedeln sich
außerhalb der Blutbahn an - meist in der Nähe von Nerven und Gefäßen an
Stellen, wo
sich Umwelt und Körper treffen (subepithelial in Haut und Schleimhäuten, Respirations-
und Verdauungssystem, Bindehaut). Mastzellen speichern Granula, aus denen sie bei Bedarf zahlreiche verschiedene Stoffe freisetzen (Degranulierung).

 Abbildung: Wie Mastzellen auf ihre Umgebung wirken
Abbildung: Wie Mastzellen auf ihre Umgebung wirken
Nach Dileepan KN et al: Mast-cell mediated immune regulation in health and disease. Front Med 2023; 10: 1213320
Mastzellen
können zahlreiche Zelltypen anregen oder hemmen. Einige davon (mit gut
untersuchter Wirkung) sind in der Abbildung gezeigt

Wie die  Abbildung
zeigt, übernehmen Mastzellen eine Fülle von Aufgaben, indem sie sowohl
auf Immun- als auch auf andere Zellen einwirken. So beeinflussen sie
Makrophagen (deren Phagozytoseaktivität sie klein halten), regen
NK-Zellen, dendritische Zellen und Endothelien an, aktivieren Th2- und
Treg-Zellen und inhibieren Th1-Zellen, regen Fibroblasten und
Osteoklasten an und aktivieren Nervenzellen. Auf diese komplexe Weise
bilden sie eine funktionelle Brücke zwischen Außen- und Innenwelt des
Immunsystems.
Abbildung
zeigt, übernehmen Mastzellen eine Fülle von Aufgaben, indem sie sowohl
auf Immun- als auch auf andere Zellen einwirken. So beeinflussen sie
Makrophagen (deren Phagozytoseaktivität sie klein halten), regen
NK-Zellen, dendritische Zellen und Endothelien an, aktivieren Th2- und
Treg-Zellen und inhibieren Th1-Zellen, regen Fibroblasten und
Osteoklasten an und aktivieren Nervenzellen. Auf diese komplexe Weise
bilden sie eine funktionelle Brücke zwischen Außen- und Innenwelt des
Immunsystems.
Mastzellen und Basophile haben einen gemeinsamen Vorläufer im
Knochenmark (CD34-positiv), das Mastzellen noch unreif verlassen; sie
differenzieren sich erst im Gewebe, während Basophile "fertig" aus dem
Knochenmark kommen.

 Über die Rolle von Leukozyten bei immunologischen Hypersensitivitätsreaktionen s. dort
Über die Rolle von Leukozyten bei immunologischen Hypersensitivitätsreaktionen s. dort
Lymphozyten
 vgl. dort
vgl. dort
Man unterscheidet thymusabhängige (T-), knochenmarkabhängige (B-) und
natürliche Killer- (NK-) Zellen. Lymphozyten machen ~30% (20-45%) der
Leukozyten aus (1500-3500 /µl Kapillarblut), sie stehen im Zentrum zellulärer wie humoraler immunologischer Abwehrmechanismen. Den geringsten Anteil (5-10% der Lymphozyten im Blut) machen NK-Zellen aus, diese können abnormale (infizierte oder maligne) Körperzellen abtöten, ohne sie zu phagozytieren.

Lymphozyten
1500-3500 / µl Blut
20-45% aller Leukozyten im Blut

Zu
Lymphozyten s. auch
dort

Monozyten
200-800 / µl Blut
2-8% aller Leukozyten im Blut

Über den
Austritt weißer Blutkörperchen aus Kapillaren in das Gewebe
s.
dort
Die Zahl der
Blutkörperchen ist ein Resultat eines Fließgleichgewichts zwischen Abbau und
Neubildung. Da sich Leukozyten hauptsächlich außerhalb der Blutbahn
aufhalten (Granulozyten zu 95%, Lymphozyten zu 98%), kann eine
Umverteilung zwischen intra- und extravasalen bzw. kapillär fixierten
Leukozyten ebenfalls Änderungen der Leukozytenzahlen im strömenden Blut
bedingen (Verteilungsleukozytose z.B. nach körperlicher Anstrengung).
Thrombozyten
 vgl. dort
vgl. dort
Die Untersuchung der Blutplättchen (Thrombozyten) umfasst
 ihre Zählung (Referenzbereich: 150-400 Tausend pro µl) sowie
ihre Zählung (Referenzbereich: 150-400 Tausend pro µl) sowie
 Aggregationstests zur Prüfung der Plättchenfunktion.
Aggregationstests zur Prüfung der Plättchenfunktion.
 Thrombozyten
Thrombozyten im Vollblut
Männer:
16-30 Jahre ~0,21-0,37 x 106/µl; 31-45 Jahre 0,20-0,36 x 106/µl; 46-60 Jahre 0,19-0,37 x 106/µl; >60 Jahre 0,18-0,36 x 106/µl
Frauen:
16-30 Jahre ~0,22-0,41 x 106/µl; 31-45 Jahre 0,21-0,38 x 106/µl; 46-60 Jahre 0,20-0,38 x 106/µl; >60 Jahre 0,19-0,37 x 106/µl
Wo befinden sich die weißen Blutkörperchen? Im Gegensatz zu
Erythrozyten und Thrombozyten, die sich so gut wie vollzählig in der Blutbahn
befinden, halten sich nur 5% der Granulozyten und 2% der Lymphozyten im Blut auf -
der Großteil des “Leukozytenpools” befindet sich im Gewebe. Auch
unterscheiden sich die Blutkörperchen in ihrer Lebensdauer:
Erythrozyten 3 bis 4 Monate; Thrombozyten und Granulozyten 1-2 Wochen;
kurzlebige Lymphozyten 5-10 Tage, langlebige vermutlich mehrere Jahre.
Daraus folgt, dass Leukozyten und Thrombozyten viel schneller
nachgebildet werden als Erythrozyten. Daher findet man im roten
Knochenmark auch vor allem Myelozyten (Vorstufen weißer Blutkörperchen)
und wenig Erythroblasten (Vorstufen roter Blutkörperchen).
Zu den
funktionellen Auswirkungen herabgesetzter Blutkörperchenzahlen gehören:

Verringerter
Sauerstofftransport bei Anämie

 Abwehrschwäche
Abwehrschwäche bei Leukopenie



Verlangsamte
Blutstillung bei Thrombopenie
Abweichungen der Blutkörperchenzahl vom Normbereich:
Zu-, Abnahme der
Erythrozytenzahl =
Polyglobulie 
(abnehmende Fließfähigkeit des Blutes),
Anämie (verringerte Sauerstofftransportkapazität)
Zu-, Abnahme der
Leukozytenzahl =
Leukozytose (meist Entzündungszeichen),
Leukopenie (Gefahr einer Abwehrschwäche)
Zu-, Abnahme der
Thrombozytenzahl =
Thrombozytose,
Thrombopenie (Gleichgewicht der Blutstillung beeinträchtigt)
Eisenmangel vermindert sowohl das Volumen (MCV) als auch den Hämoglobingehalt (MCH) der Erythrozyten
(mikrozytäre hypochrome Anämie)
Erythropoetinmangel bedingt reduzierte Ery-Zahl bei normalem MCV und MCH
(normozytäre normochrome Anämie)
Kobalaminmangel (Vitamin B12-Mangel) führt zur Bildung weniger, aber großer (MCV+) und hämoglobinreicher (MCH+) Erythrozyten
(makrozytäre hyperchrome Anämie)
|
Blutserum: Wird eine Blutprobe nicht weiter behandelt, kommt es innerhalb von Minuten zur Gerinnung ( s. dort).
Dabei werden die Gerinnungsfaktoren weitgehend aufgebraucht
(Fibrinnetz), und nach Zentrifugation der Probe entsteht
(ungerinnbares) Blutserum, das zwar der Zusammensetzung des Blutplasmas
in weiten Bereichen gleicht (z.B. Elektrolytkonzentrationen,
Hormonwerte...), aber einen etwas geringeren Eiweißgehalt aufweist
(wegen der Abscheidung des Gerinnsels, das ja aus Proteinen besteht).
s. dort).
Dabei werden die Gerinnungsfaktoren weitgehend aufgebraucht
(Fibrinnetz), und nach Zentrifugation der Probe entsteht
(ungerinnbares) Blutserum, das zwar der Zusammensetzung des Blutplasmas
in weiten Bereichen gleicht (z.B. Elektrolytkonzentrationen,
Hormonwerte...), aber einen etwas geringeren Eiweißgehalt aufweist
(wegen der Abscheidung des Gerinnsels, das ja aus Proteinen besteht).
Der labordiagnostische Vorteil von Serumproben besteht darin, dass
Messvorgänge nicht durch allfällige Gerinnung der Probe beeinträchtigt
werden.
Blutproben können durch Zusatz von Gerinnungshemmern (Antikoagulantien) ungerinnbar gemacht
werden:
 Natriumcitrat
Natriumcitrat
bildet mit
Calciumionen Komplexsalze und stoppt so die Gerinnung. Es
wird Blutkonserven beigesetzt, ferner findet es in der
Gerinnungsdiagnostik Verwendung (sein Effekt wird durch
Calciumzusatz
aufgehoben) und ist Standardzusatz bei der Bestimmung der
Blutsenkungsgeschwindigkeit
 EDTA
EDTA (Äthylen-Diamin-Tetra-Acetat) bindet ebenfalls Ca
++-Ionen. Man braucht es in der Hämatologie und für die Lipidanalytik (da es auch einen membranstabilisierenden Effekt hat)
 Heparin
Heparin inaktiviert Thrombin und Faktor X (

s.
dort)
und eignet sich für den Einsatz in der Blutgasanalyse und zur
Hämatokritmessung (heparinisierte Abnahmekapillaren). Es wird auch in
vivo verwendet, um die Blutgerinnung zu reduzieren (z.B. Hämodialyse).
Gewinnung von Blutplasma (FFP: fresh frozen plasma,
innerhalb von 8 Stunden nach der Blutspende auf -30°C abgekühlt bis zu
einem Jahr haltbar) erfordert den Zusatz von Gerinnungshemmern. Aus
einer geronnenen Blutprobe kann man durch Zentrifugieren Blutserum gewinnen, das kein Fibronogen (und kaum andere Gerinnungsfaktoren) mehr enthält.


 Blut besteht zu ~60% aus Blutplasma und ~40% (Hämatokrit) aus Blutkörperchen. Pro Minute bildet der Körper ~150 Millionen Erythrozyten und ~120 Millionen Granulozyten. Zytokine mobilisieren Leukozyten aus dem
Knochenmark, nur einige % befinden sich im Blutkreislauf. Die Kapillaren (Gesamtoberfläche ~300 m2) tauschen mit dem Gewebe Flüssigkeit und darin gelöste Stoffe aus, inklusive Atemgase: Erythrozyten (zusammen ~3000 m2 Membranfläche) befinden sich aussschließlich in der Blutbahn (Lebensdauer ~120 Tage), sie machen zahlenmäßig ~90% aller Zellen des Körpers aus (~25 x 1012 Erys in 5 l Blut). Die Erythropoese kann mehr als verzehnfacht werden (Erythropoetin) Blut besteht zu ~60% aus Blutplasma und ~40% (Hämatokrit) aus Blutkörperchen. Pro Minute bildet der Körper ~150 Millionen Erythrozyten und ~120 Millionen Granulozyten. Zytokine mobilisieren Leukozyten aus dem
Knochenmark, nur einige % befinden sich im Blutkreislauf. Die Kapillaren (Gesamtoberfläche ~300 m2) tauschen mit dem Gewebe Flüssigkeit und darin gelöste Stoffe aus, inklusive Atemgase: Erythrozyten (zusammen ~3000 m2 Membranfläche) befinden sich aussschließlich in der Blutbahn (Lebensdauer ~120 Tage), sie machen zahlenmäßig ~90% aller Zellen des Körpers aus (~25 x 1012 Erys in 5 l Blut). Die Erythropoese kann mehr als verzehnfacht werden (Erythropoetin)
 Erythrozyten (7-8 µm) tolerieren starke Schubspannungen (Aktin-Spektrin- Gerüst an der Innenseite der Membran, über Ankyrin und Bande 4-Proteine mit dem Zytoskelett verknüpft; Spektrin bildet dreidimensionale Maschenwerke und formt den Erythrozyten). Ihre Membran ist vor allem für Chloridionen durchgängig (Austausch gegen Bicarbonat), das Membranpotential beträgt
~-10 mV. Täglich werden 40-50 ml Blut nachgebildet (200-250 Milliarden Erys), das entspricht einer Hämoglobinsynthese von ~7g/d (knapp 100 mg Eisen werden fast vollständig wiederverwertet: Eisenaufnahme 1-2 mg/d). Ohne Mitochondrien sind Erys für den (anaeroben) Energiestoffwechsel (Ionentransport) auf Glucose (GLUT1) angewiesen (~30 g/d). Etwa
10% der Glucose gelangt in den Pentosephosphatweg (Herstellung von
NADPH für die Regeneration von Glutathion: anoxidative Kapazität) Erythrozyten (7-8 µm) tolerieren starke Schubspannungen (Aktin-Spektrin- Gerüst an der Innenseite der Membran, über Ankyrin und Bande 4-Proteine mit dem Zytoskelett verknüpft; Spektrin bildet dreidimensionale Maschenwerke und formt den Erythrozyten). Ihre Membran ist vor allem für Chloridionen durchgängig (Austausch gegen Bicarbonat), das Membranpotential beträgt
~-10 mV. Täglich werden 40-50 ml Blut nachgebildet (200-250 Milliarden Erys), das entspricht einer Hämoglobinsynthese von ~7g/d (knapp 100 mg Eisen werden fast vollständig wiederverwertet: Eisenaufnahme 1-2 mg/d). Ohne Mitochondrien sind Erys für den (anaeroben) Energiestoffwechsel (Ionentransport) auf Glucose (GLUT1) angewiesen (~30 g/d). Etwa
10% der Glucose gelangt in den Pentosephosphatweg (Herstellung von
NADPH für die Regeneration von Glutathion: anoxidative Kapazität)
 In der Membran
der Blutkörperchen befinden sich Glykolipide und Proteine, die bei
Bluttransfusionen vom Immunsystem als fremd erkannt und attackiert
werden und zu Aggregation (Agglutinine) und Hämolyse führen können. A und B
(AB0-Gen) sind Epitope, die denen von Mikroorganismen ähneln und bei deren
Fehlen IgM-Antikörper (Anti-A, Anti-B) gebildet werden (Blutgruppe
Null: beide Agglutinine im Serum). Im Rhesus-System (~50 ähnlich aufgebaute potentiell antigen wirkende Proteine) spielen vor allem c, C, D, e und E eine Rolle (D ist dominant gegenüber d;
homozygot-positive Menschen (DD) haben immer Rhesus-positive Kinder).
Die häufigste Ursache für die Bildung von Rh-Antikörpern (IgG) bei
rh-negativen Frauen ist eine Rh-positive Schwangerschaft: Spätestens bei der Entbindung gelangen D+-Erythrozyten in den
mütterlichen Kreislauf (Sensibilisierung, Bildung von
Anti-D-Antikörpern). Rhesusprophylaxe: Gabe von
maskierenden Anti-D-Antikörpern In der Membran
der Blutkörperchen befinden sich Glykolipide und Proteine, die bei
Bluttransfusionen vom Immunsystem als fremd erkannt und attackiert
werden und zu Aggregation (Agglutinine) und Hämolyse führen können. A und B
(AB0-Gen) sind Epitope, die denen von Mikroorganismen ähneln und bei deren
Fehlen IgM-Antikörper (Anti-A, Anti-B) gebildet werden (Blutgruppe
Null: beide Agglutinine im Serum). Im Rhesus-System (~50 ähnlich aufgebaute potentiell antigen wirkende Proteine) spielen vor allem c, C, D, e und E eine Rolle (D ist dominant gegenüber d;
homozygot-positive Menschen (DD) haben immer Rhesus-positive Kinder).
Die häufigste Ursache für die Bildung von Rh-Antikörpern (IgG) bei
rh-negativen Frauen ist eine Rh-positive Schwangerschaft: Spätestens bei der Entbindung gelangen D+-Erythrozyten in den
mütterlichen Kreislauf (Sensibilisierung, Bildung von
Anti-D-Antikörpern). Rhesusprophylaxe: Gabe von
maskierenden Anti-D-Antikörpern
 Die Neubildungsrate von weißen entspricht etwa der von roten Blutkörperchen; Leukozyten /
Thrombozyten leben kürzer als Erythrozyten, im roten Knochenmark findet man vor allem Myelozyten, wenig Erythroblasten. Zum "Kleinen Blutbild" gehören die Anzahl der Erythrozyten (~5 Mio / µl), Leukozyten (4 bis 11 Tausend/µl), Thrombozyten (150-400 Tausend pro µl); Hämoglobinkonzentration (~150 g/l Blut), Hämatokrit (~0,4), MCV (Ery-Volumen ~90 fl), MCH (Ery-Hämoglobinmenge 30 pg) und MCHC (Hämoglobinkonzentration ~340 g / l Ery), Anteil Retikulozyten (0,5-2% der Erys), evt. osmotische
Resistenz der Erys (Hämolyse bei ~180
mM). Differentialblutbild: Granulozyten ~65% aller Leukozyten im Blut (neutrophile 40-75%, eosinophile 1-6%, basophile ≤2%; stabkernige ≤5%), Lymphozyten 20-45%, Monozyten 2-8 % Die Neubildungsrate von weißen entspricht etwa der von roten Blutkörperchen; Leukozyten /
Thrombozyten leben kürzer als Erythrozyten, im roten Knochenmark findet man vor allem Myelozyten, wenig Erythroblasten. Zum "Kleinen Blutbild" gehören die Anzahl der Erythrozyten (~5 Mio / µl), Leukozyten (4 bis 11 Tausend/µl), Thrombozyten (150-400 Tausend pro µl); Hämoglobinkonzentration (~150 g/l Blut), Hämatokrit (~0,4), MCV (Ery-Volumen ~90 fl), MCH (Ery-Hämoglobinmenge 30 pg) und MCHC (Hämoglobinkonzentration ~340 g / l Ery), Anteil Retikulozyten (0,5-2% der Erys), evt. osmotische
Resistenz der Erys (Hämolyse bei ~180
mM). Differentialblutbild: Granulozyten ~65% aller Leukozyten im Blut (neutrophile 40-75%, eosinophile 1-6%, basophile ≤2%; stabkernige ≤5%), Lymphozyten 20-45%, Monozyten 2-8 %
 Verringerte Ery- bzw. Hämoglobinwerte (Anämie) → reduzierte Sauerstofftransportkapazität, verringerte Leukozytenzahl → Immunschwäche, verringerte Thrombozytenzahl → reduzierte Blutstillung / gerinnung.
Eisenmangel vermindert sowohl das Volumen (MCV) als auch den
Hämoglobingehalt (MCH) der Erythrozyten (mikrozytäre hypochrome
Anämie); Erythropoetinmangel bedingt reduzierte Ery-Zahl bei normalem
MCV und MCH (normozytäre normochrome Anämie); Kobalaminmangel (Vitamin
B12) führt zur Bildung weniger, aber großer (MCV+) und
hämoglobinreicher (MCH+) Erythrozyten (makrozytäre hyperchrome Anämie) Verringerte Ery- bzw. Hämoglobinwerte (Anämie) → reduzierte Sauerstofftransportkapazität, verringerte Leukozytenzahl → Immunschwäche, verringerte Thrombozytenzahl → reduzierte Blutstillung / gerinnung.
Eisenmangel vermindert sowohl das Volumen (MCV) als auch den
Hämoglobingehalt (MCH) der Erythrozyten (mikrozytäre hypochrome
Anämie); Erythropoetinmangel bedingt reduzierte Ery-Zahl bei normalem
MCV und MCH (normozytäre normochrome Anämie); Kobalaminmangel (Vitamin
B12) führt zur Bildung weniger, aber großer (MCV+) und
hämoglobinreicher (MCH+) Erythrozyten (makrozytäre hyperchrome Anämie)
|

 Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.
Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.





 Blut: Zusammensetzung
und Eigenschaften
Blut: Zusammensetzung
und Eigenschaften
 Buffy coat: buff = lederfarben, gelbbraun, coat = Film, Überzug, Schicht
Buffy coat: buff = lederfarben, gelbbraun, coat = Film, Überzug, Schicht Komponenten des Blutplasmas
Komponenten des Blutplasmas  Blutbildung im Knochenmark
Blutbildung im Knochenmark  Erythrozyten
Erythrozyten  Blutbild
Blutbild Hämatokrit
Hämatokrit  Blutsenkung
Blutsenkung
 Core messages
Core messages
 Abbildung: Zusammensetzung des Blutes
Abbildung: Zusammensetzung des Blutes
 Blut
ist ein Transportorgan. Es befördert Zellen ("Blutkörperchen") und Blutplasma und damit
Blut
ist ein Transportorgan. Es befördert Zellen ("Blutkörperchen") und Blutplasma und damit Wasser, und darin Stoffe, teils frei gelöst (wie
Sauerstoff, Kohlendioxid, Elektrolyte, Glucose, Harnstoff,
Aminosäuren, Proteine), teils an Protein gebunden (wie Lipide, Schilddrüsenhormone, Steroidhormone) - sie dienen Funktionen wie Ernährung, Immunabwehr, Blutgerinnung etc. Diese Stoffe übertragen auch
Wasser, und darin Stoffe, teils frei gelöst (wie
Sauerstoff, Kohlendioxid, Elektrolyte, Glucose, Harnstoff,
Aminosäuren, Proteine), teils an Protein gebunden (wie Lipide, Schilddrüsenhormone, Steroidhormone) - sie dienen Funktionen wie Ernährung, Immunabwehr, Blutgerinnung etc. Diese Stoffe übertragen auch Information (Hormone, Zytokine
Information (Hormone, Zytokine  , Wachstumsfaktoren, Mediatoren; genetische Information)
, Wachstumsfaktoren, Mediatoren; genetische Information)  Weiters befördert das Blut Energie, die als Wärme über Haut und Schleimhäute an die Außenwelt
abgegeben wird.
Weiters befördert das Blut Energie, die als Wärme über Haut und Schleimhäute an die Außenwelt
abgegeben wird.  Der Hämatokrit
Der Hämatokrit  ist der volumenmäßige Anteil der Erythrozyten an einer Blutprobe.
ist der volumenmäßige Anteil der Erythrozyten an einer Blutprobe. ~40% aus Blutkörperchen (zellulärer Anteil des Blutes) - nomalerweise
zum größten Teil durch Erythrozyten (Hämatokrit), nur zu einem sehr
geringen Anteil (<1%) durch Leuko- (Leukokrit) und Thrombozyten,
~40% aus Blutkörperchen (zellulärer Anteil des Blutes) - nomalerweise
zum größten Teil durch Erythrozyten (Hämatokrit), nur zu einem sehr
geringen Anteil (<1%) durch Leuko- (Leukokrit) und Thrombozyten, ~60% aus Blutplasma (proteinreiche extrazelluläre Flüssigkeit).
~60% aus Blutplasma (proteinreiche extrazelluläre Flüssigkeit).
 ,
das ist die Leukozytenschicht (Dichte bei 37°C etwa 1050 g/l) zwischen
Plasma (ungefähr 1020 g/l) und Erythrozyten (1090 g/l). Das Volumen des
buffy coat (Leukozyten und Thrombozyten) macht normalerweise weniger
als 1% des gesamten Probenvolumens (Blutvolumens) aus.
,
das ist die Leukozytenschicht (Dichte bei 37°C etwa 1050 g/l) zwischen
Plasma (ungefähr 1020 g/l) und Erythrozyten (1090 g/l). Das Volumen des
buffy coat (Leukozyten und Thrombozyten) macht normalerweise weniger
als 1% des gesamten Probenvolumens (Blutvolumens) aus.
 Abbildung: Molare Konzentration von Plasmainhaltsstoffen (insgesamt ~0,3 M)
Abbildung: Molare Konzentration von Plasmainhaltsstoffen (insgesamt ~0,3 M) Zum Vergleich: Verteilung der Plasmabestandteile nach Masse s. dort
Zum Vergleich: Verteilung der Plasmabestandteile nach Masse s. dort Kommentierte Aufstellung der Massenkonzentrationswerte in Blut und
Plasma (in g/ml, mit Referenzbereichen sowie altersabhängigen
Unterschieden)
Kommentierte Aufstellung der Massenkonzentrationswerte in Blut und
Plasma (in g/ml, mit Referenzbereichen sowie altersabhängigen
Unterschieden) Stoffaustausch: Blut tauscht mit dem Gewebe
Flüssigkeit und darin gelöste Stoffe aus. Dazu ist eine entsprechende
Austauschfläche erforderlich. Die Kapillarwände einer erwachsenen
Person haben eine Gesamtoberfläche von ~300 m2; alle roten Blutkörperchen zusammen ~3000 m2.
Stoffaustausch: Blut tauscht mit dem Gewebe
Flüssigkeit und darin gelöste Stoffe aus. Dazu ist eine entsprechende
Austauschfläche erforderlich. Die Kapillarwände einer erwachsenen
Person haben eine Gesamtoberfläche von ~300 m2; alle roten Blutkörperchen zusammen ~3000 m2.
 s. auch dort
s. auch dort Hämatopoetische Faktoren: Die Bildung
Hämatopoetische Faktoren: Die Bildung roter Blutkörperchen wird angeregt durch Erythropoetin aus Nieren (90%) und Leber (10%),
roter Blutkörperchen wird angeregt durch Erythropoetin aus Nieren (90%) und Leber (10%), weißer Blutkörperchen durch koloniestimulierende Faktoren (G-CSF, M-CSF, GM-CSF, Meg-CSF, S-CSF) und Interleukine (IL-2, 3, 5, I7, 11) aus Knochenmark (Stromazellen), Endothelien, Lymphozyten, Makrophagen, Fibroblasten, dendritischen Zellen,
weißer Blutkörperchen durch koloniestimulierende Faktoren (G-CSF, M-CSF, GM-CSF, Meg-CSF, S-CSF) und Interleukine (IL-2, 3, 5, I7, 11) aus Knochenmark (Stromazellen), Endothelien, Lymphozyten, Makrophagen, Fibroblasten, dendritischen Zellen, von Blutplättchen durch Thrombopoetin aus Leber und Nieren (geringgradig aus dem Knochenmark).
von Blutplättchen durch Thrombopoetin aus Leber und Nieren (geringgradig aus dem Knochenmark).
 Abbildung: Blutbildung im roten Knochenmark
Abbildung: Blutbildung im roten Knochenmark
 Bei Bedarf kann die Neubildung von Blutkörperchen 10-20 fach (oder noch höher) ansteigen, angeregt durch Wachstumsfaktoren wie
Bei Bedarf kann die Neubildung von Blutkörperchen 10-20 fach (oder noch höher) ansteigen, angeregt durch Wachstumsfaktoren wie  Erythropoetin (Erythrozyten),
Erythropoetin (Erythrozyten),  myeloide Wachstumsfaktoren (colony stimulating factors) / Interleukine (Leukozyten),
myeloide Wachstumsfaktoren (colony stimulating factors) / Interleukine (Leukozyten),  Thrombopoetin und Interleukin 11 (Blutplättchen).
Thrombopoetin und Interleukin 11 (Blutplättchen).  Oxidationsschutz (Glutathion)
Oxidationsschutz (Glutathion)  Blutgruppen
Blutgruppen  Erythrozytenabbau
Erythrozytenabbau

 Abbildung: Erythropoese und der Lebenszyklus von Erythrozyten
Abbildung: Erythropoese und der Lebenszyklus von Erythrozyten Zum Abbau des Hämoglobins s. unten
Zum Abbau des Hämoglobins s. unten
 angeregt und dauert jeweils etwa eine Woche
(Stammzelle → Präerythroblast → Erythroblast → Normoblast →
Retikulozyt → Erythrozyt). Eisen, Vitamin B12 und Folsäure
sind zur Blutbildung notwendig.
angeregt und dauert jeweils etwa eine Woche
(Stammzelle → Präerythroblast → Erythroblast → Normoblast →
Retikulozyt → Erythrozyt). Eisen, Vitamin B12 und Folsäure
sind zur Blutbildung notwendig.  Über Erythroblasten und Eisenhaushalt s. dort
Über Erythroblasten und Eisenhaushalt s. dort s. Hämorheologie).
Auch treten starke mechanische Belastungen durch äußeren Druck auf exponiertes Gewebe auf (z.B. in der Fußsohle beim Gehen → Hämolyse einiger Erythrozyten).
s. Hämorheologie).
Auch treten starke mechanische Belastungen durch äußeren Druck auf exponiertes Gewebe auf (z.B. in der Fußsohle beim Gehen → Hämolyse einiger Erythrozyten).  Abbildung: Erythrozytenmembran
Abbildung: Erythrozytenmembran CH1 / CH2, aktinbindende β-Spectrin-Domänen
CH1 / CH2, aktinbindende β-Spectrin-Domänen  EF, Ca++-bindende EF-Domäne des α-Spectrin
EF, Ca++-bindende EF-Domäne des α-Spectrin  F-Aktin, fädiges Aktin
F-Aktin, fädiges Aktin  GEC,
glykolytischer Enzymkomplex
GEC,
glykolytischer Enzymkomplex  Glut1, Glucosetransporter 1
Glut1, Glucosetransporter 1  GPA,
GPB, GPC/D, Glykophorin A, B, C / D
GPA,
GPB, GPC/D, Glykophorin A, B, C / D  LW, Landsteiner-Wiener
LW, Landsteiner-Wiener 
 RhAG, Rhesus-assoziiertes Glykoprotein
RhAG, Rhesus-assoziiertes Glykoprotein
 Abbildung) unterstützt deren mechanische Belastbarkeit. Zu diesem
System gehören fadenförmige (Aktin, Spektrin) sowie Verankerungsmoleküle (Bande 4-Proteine, Ankyrin).
Abbildung) unterstützt deren mechanische Belastbarkeit. Zu diesem
System gehören fadenförmige (Aktin, Spektrin) sowie Verankerungsmoleküle (Bande 4-Proteine, Ankyrin).  Der Glucoseverbrauch der roten Blutkörperchen beträgt bei einer erwachsenen Person etwa 30 g/d.
Der Glucoseverbrauch der roten Blutkörperchen beträgt bei einer erwachsenen Person etwa 30 g/d. Über Carboanhydrase und die Beteiligung der Erythrozyten am Säure-Basen-Haushalt s. dort
Über Carboanhydrase und die Beteiligung der Erythrozyten am Säure-Basen-Haushalt s. dort Verbrauch von ATP synthetisiert
wird. Über die Thiolgruppe (HS-) können Elektronen abgegeben werden,
der entstehende Wasserstoff kann dann oxidierte Moleküle reduzieren.
Verbrauch von ATP synthetisiert
wird. Über die Thiolgruppe (HS-) können Elektronen abgegeben werden,
der entstehende Wasserstoff kann dann oxidierte Moleküle reduzieren. 
 Abbildung:
Schema zum AB0-System
Abbildung:
Schema zum AB0-System
 Bei Blutgruppe A
(Phänotyp) kann der Genotyp A0 oder AA sein (Serum enthält
Anti-B). Häufigkeit in Mitteleuropa: 42-47% (Deutschland 43%). Das
A-Allel findet sich häufig (>30%) bei Bewohnern von Teilen
Nordeuropas, Nordamerikas und Südaustraliens, selten (<5%) in
Mittel- und Südamerika
Bei Blutgruppe A
(Phänotyp) kann der Genotyp A0 oder AA sein (Serum enthält
Anti-B). Häufigkeit in Mitteleuropa: 42-47% (Deutschland 43%). Das
A-Allel findet sich häufig (>30%) bei Bewohnern von Teilen
Nordeuropas, Nordamerikas und Südaustraliens, selten (<5%) in
Mittel- und Südamerika Bei Blutgruppe B
(Phänotyp) kann der Genotyp B0 oder BB sein (Serum enthält
Anti-A). Häufigkeit in Mitteleuropa: 8-12% (Deutschland 11%). Das
B-Allel findet sich relativ häufig (>20%) bei Bewohnern weiter Teile
Asiens, selten (<5%) in Nord- und Südamerika und Australien
Bei Blutgruppe B
(Phänotyp) kann der Genotyp B0 oder BB sein (Serum enthält
Anti-A). Häufigkeit in Mitteleuropa: 8-12% (Deutschland 11%). Das
B-Allel findet sich relativ häufig (>20%) bei Bewohnern weiter Teile
Asiens, selten (<5%) in Nord- und Südamerika und Australien Bei Blutgruppe AB (Phänotyp) lautet der Genotyp AB (Serum enthält keine AB0-Agglutinine). Häufigkeit in Mitteleuropa: 3-5% (Deutschland 5%)
Bei Blutgruppe AB (Phänotyp) lautet der Genotyp AB (Serum enthält keine AB0-Agglutinine). Häufigkeit in Mitteleuropa: 3-5% (Deutschland 5%) Bei Blutgruppe 0
(Phänotyp) lautet der Genotyp 00 (Serum enthält Anti-A und
Anti-B). Häufigkeit in Mitteleuropa: 40-47% (Deutschland 41%). Dieser
Genotyp überwiegt in allen Teilen der Welt, insbesondere Mittel- und
Südamerika (>90%), Nordamerika (60-100%), am wenigsten in Mittel-
und Osteuropa, Zentralasien (40-60%)
Bei Blutgruppe 0
(Phänotyp) lautet der Genotyp 00 (Serum enthält Anti-A und
Anti-B). Häufigkeit in Mitteleuropa: 40-47% (Deutschland 41%). Dieser
Genotyp überwiegt in allen Teilen der Welt, insbesondere Mittel- und
Südamerika (>90%), Nordamerika (60-100%), am wenigsten in Mittel-
und Osteuropa, Zentralasien (40-60%) 
 Abbildung: Blutgruppenvererbung im AB0-System
Abbildung: Blutgruppenvererbung im AB0-System
 1901 entdeckte der Österreicher (ab 1929 US-Bürger) Karl Landsteiner
ein System, das die Agglutination von Spendererythrozyten in
Empfängerplasma erklärt (Publikation: "Über die
Agglutinationserscheinungen normalen menschlichen Blutes"). Das System
wurde nach den ersten Buchstaben im Alphabet als A-B-Null-System
bezeichnet. 1930 erhielt er "für die Entdeckung der Blutgruppen des
Menschen" den Nobelpreis für Physiologie oder Medizin. 1937 entdeckte er zusammen mit dem Amerikaner
Alexander S. Wiener den Rhesus-Faktor.
1901 entdeckte der Österreicher (ab 1929 US-Bürger) Karl Landsteiner
ein System, das die Agglutination von Spendererythrozyten in
Empfängerplasma erklärt (Publikation: "Über die
Agglutinationserscheinungen normalen menschlichen Blutes"). Das System
wurde nach den ersten Buchstaben im Alphabet als A-B-Null-System
bezeichnet. 1930 erhielt er "für die Entdeckung der Blutgruppen des
Menschen" den Nobelpreis für Physiologie oder Medizin. 1937 entdeckte er zusammen mit dem Amerikaner
Alexander S. Wiener den Rhesus-Faktor.
 vgl. dort
vgl. dort
 Abbildung: Abbau des Häms zu Urobilin und Stercobilin
Abbildung: Abbau des Häms zu Urobilin und Stercobilin
 Abbildung)
Abbildung) Bilirubin / Biliverdin,
Bilirubin / Biliverdin,  dreiwertiges Eisen (Fe3+) sowie
dreiwertiges Eisen (Fe3+) sowie  Kohlenmonoxid
(das wiederum stark an Hämoglobin bindet. 1% des zirkulierenden Hämoglobins
enthält CO, dies ist die einzige physiologische Quelle von
Kohlenmonoxid im Blut).
Kohlenmonoxid
(das wiederum stark an Hämoglobin bindet. 1% des zirkulierenden Hämoglobins
enthält CO, dies ist die einzige physiologische Quelle von
Kohlenmonoxid im Blut).  Zum "Kleinen Blutbild"
zählen: Zahl der Erythrozyten, Leukozyten und Thrombozyten pro Liter
bzw. µl Blut; Hämoglobinkonzentration, Hämatokrit, MCV (Ery-Volumen in
µl), MCH (Ery-Hämoglobinmenge in pg) und MCHC (Hämoglobinkonzentration
in den Erythrozyten in g/l).
Zum "Kleinen Blutbild"
zählen: Zahl der Erythrozyten, Leukozyten und Thrombozyten pro Liter
bzw. µl Blut; Hämoglobinkonzentration, Hämatokrit, MCV (Ery-Volumen in
µl), MCH (Ery-Hämoglobinmenge in pg) und MCHC (Hämoglobinkonzentration
in den Erythrozyten in g/l). Verringerte Leukozytenzahl reduziert die immunologische Kapazität des Blutes
Verringerte Leukozytenzahl reduziert die immunologische Kapazität des Blutes Verringerte Thrombozytenzahl reduziert die Hämostasekapazität bzw. das Gerinnungsvermögen
Verringerte Thrombozytenzahl reduziert die Hämostasekapazität bzw. das Gerinnungsvermögen
 Hämolyse
Hämolyse  Blutsenkung
Blutsenkung  Weisses Blutbild
Weisses Blutbild  Blutplättchen
Blutplättchen
 Abbildung: Herstellung eines Blutausstrichs (blood smear)
Abbildung: Herstellung eines Blutausstrichs (blood smear) s. dort
s. dort 

 Abbildung: Erythrozyten werden entsprechend ihrer Strömungsumgebung deformiert
Abbildung: Erythrozyten werden entsprechend ihrer Strömungsumgebung deformiert Vgl. Hämorheologie
Vgl. Hämorheologie
 Erythrozyten im Vollblut
Erythrozyten im Vollblut Hämatokrit (Anteil der Erythrozyten am Volumen der Blutprobe)
Hämatokrit (Anteil der Erythrozyten am Volumen der Blutprobe)  Nach starken Blutungen (Plasmavolumen erholt sich schneller)
Nach starken Blutungen (Plasmavolumen erholt sich schneller) Beim intensivem Krafttraining (Plasmavolumen wächst rascher als Eryvolumen)
Beim intensivem Krafttraining (Plasmavolumen wächst rascher als Eryvolumen) Schwangerschaft (Plasmavolumen wächst rascher als Eryvolumen)
Schwangerschaft (Plasmavolumen wächst rascher als Eryvolumen)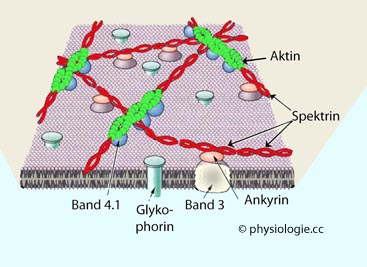
 Abbildung: Erythrozytenmembran (Innenseite)
Abbildung: Erythrozytenmembran (Innenseite)
 Hämoglobin im Vollblut
Hämoglobin im Vollblut Nach starken Blutungen (Plasmavolumen erholt sich schneller)
Nach starken Blutungen (Plasmavolumen erholt sich schneller) Beim intensivem Krafttraining (Plasmavolumen wächst rascher als Eryvolumen)
Beim intensivem Krafttraining (Plasmavolumen wächst rascher als Eryvolumen) Schwangerschaft (Plasmavolumen wächst rascher als Eryvolumen)
Schwangerschaft (Plasmavolumen wächst rascher als Eryvolumen)
 Altersabhängigkeit
Altersabhängigkeit  s. dort
s. dort Mittlerer Erythrozytendurchmesser
Mittlerer Erythrozytendurchmesser
 Mittleres Erythrozytenvolumen
Mittleres Erythrozytenvolumen  Mittlere Hämoglobinmenge pro Erythrozyt
Mittlere Hämoglobinmenge pro Erythrozyt  Mittlere Hämoglobinkonzentration in der Erythrozytenfraktion
Mittlere Hämoglobinkonzentration in der Erythrozytenfraktion  Anteil an Retikulozyten (jungen Erythrozyten)
Anteil an Retikulozyten (jungen Erythrozyten)
 Abbildung: Plasmafarbe und Hämolysegrad
Abbildung: Plasmafarbe und Hämolysegrad
 Abbildung).
Abbildung). Osmotische
Resistenz der Erythrozyten: Widerstandsfähigkeit gegen
osmotische Zerstörung (Hämolyse) in hypotonen (verdünnten) Salzlösungen: Bis 180 mmol (isotone Flüssigkeit hat ~290 mmol)
Osmotische
Resistenz der Erythrozyten: Widerstandsfähigkeit gegen
osmotische Zerstörung (Hämolyse) in hypotonen (verdünnten) Salzlösungen: Bis 180 mmol (isotone Flüssigkeit hat ~290 mmol) Blutsenkungsreaktion (BSR, Blutkörperchensenkungsgeschwindigkeit nach Westergren, Erythrocyte sedimentation rate,
Wintrobe ESR,
Blutsenkungsreaktion (BSR, Blutkörperchensenkungsgeschwindigkeit nach Westergren, Erythrocyte sedimentation rate,
Wintrobe ESR,  Abbildung) nennt man die Bestimmung der Sinkgeschwindigkeit
roter Blutkörperchen bei 20-22°C in Citratblut (80% Blut, 20% 3,8%-ige
Natriumcitratlösung) in einem Plastik- (Monovette) oder Glasrohr mit
200 mm-Graduierung.
Abbildung) nennt man die Bestimmung der Sinkgeschwindigkeit
roter Blutkörperchen bei 20-22°C in Citratblut (80% Blut, 20% 3,8%-ige
Natriumcitratlösung) in einem Plastik- (Monovette) oder Glasrohr mit
200 mm-Graduierung.
 Abbildung: Blutsenkung
Abbildung: Blutsenkung


 : Die Reibungskraft ist proportional dem Produkt aus Partikelradius x Partikelgeschwindigkeit x Viskosität der Flüssigkeit.
: Die Reibungskraft ist proportional dem Produkt aus Partikelradius x Partikelgeschwindigkeit x Viskosität der Flüssigkeit.  Leukozyten im Vollblut
Leukozyten im Vollblut
 Abbildung: Diapedese (Extravasation)
Abbildung: Diapedese (Extravasation) Näheres s. dort
Näheres s. dort
 Differentialblutbild: Darunter versteht man die relative Häufigkeit (alle Leukos im Blutausstrich = 100%) von
Differentialblutbild: Darunter versteht man die relative Häufigkeit (alle Leukos im Blutausstrich = 100%) von Granulozyten
Granulozyten stabkernige
Granulozyten (bis 5% aller Leukozyten, bei Säuglingen und Kindern bis
10%); Stabkernige sind junge neutrophile Granulozyten mit einem stab-
bis hufeisenförmigen Zellkern. Erhöhte Werte finden sich z.B. bei
Entzündungsprozessen und Infektionskrankheiten ("Linksverschiebung")
stabkernige
Granulozyten (bis 5% aller Leukozyten, bei Säuglingen und Kindern bis
10%); Stabkernige sind junge neutrophile Granulozyten mit einem stab-
bis hufeisenförmigen Zellkern. Erhöhte Werte finden sich z.B. bei
Entzündungsprozessen und Infektionskrankheiten ("Linksverschiebung") segmentkernige
Granulozyten; diese machen den Großteil der Neutrophilen aus. Sie haben
ein gelapptes Chromatin und sind voll entwickelt. Bei reduzierter
Neubildung von Granulozyten erhöht sich der Anteil der Segmentkernigen
im Blut ("Rechtsverschiebung")
segmentkernige
Granulozyten; diese machen den Großteil der Neutrophilen aus. Sie haben
ein gelapptes Chromatin und sind voll entwickelt. Bei reduzierter
Neubildung von Granulozyten erhöht sich der Anteil der Segmentkernigen
im Blut ("Rechtsverschiebung") Die
Bedeutung der Granulozyten ist enorm: Agranulozytose (< 500
Neutrophile / µl Blut) bedingt stark erhöhtes Infektionsrisiko und kann
Sepsis bedingen (Chemotherapie: Tumortherapie-Komplikation).
Die
Bedeutung der Granulozyten ist enorm: Agranulozytose (< 500
Neutrophile / µl Blut) bedingt stark erhöhtes Infektionsrisiko und kann
Sepsis bedingen (Chemotherapie: Tumortherapie-Komplikation). Neutrophile Granulozyten
Neutrophile Granulozyten
 Abbildung: Leukozyten
Abbildung: Leukozyten
 Eosinophile Granulozyten
Eosinophile Granulozyten Basophile Granulozyten
Basophile Granulozyten
 Abbildung: Wie Mastzellen auf ihre Umgebung wirken
Abbildung: Wie Mastzellen auf ihre Umgebung wirken
 Abbildung
zeigt, übernehmen Mastzellen eine Fülle von Aufgaben, indem sie sowohl
auf Immun- als auch auf andere Zellen einwirken. So beeinflussen sie
Makrophagen (deren Phagozytoseaktivität sie klein halten), regen
NK-Zellen, dendritische Zellen und Endothelien an, aktivieren Th2- und
Treg-Zellen und inhibieren Th1-Zellen, regen Fibroblasten und
Osteoklasten an und aktivieren Nervenzellen. Auf diese komplexe Weise
bilden sie eine funktionelle Brücke zwischen Außen- und Innenwelt des
Immunsystems.
Abbildung
zeigt, übernehmen Mastzellen eine Fülle von Aufgaben, indem sie sowohl
auf Immun- als auch auf andere Zellen einwirken. So beeinflussen sie
Makrophagen (deren Phagozytoseaktivität sie klein halten), regen
NK-Zellen, dendritische Zellen und Endothelien an, aktivieren Th2- und
Treg-Zellen und inhibieren Th1-Zellen, regen Fibroblasten und
Osteoklasten an und aktivieren Nervenzellen. Auf diese komplexe Weise
bilden sie eine funktionelle Brücke zwischen Außen- und Innenwelt des
Immunsystems. Lymphozyten
Lymphozyten Monozyten
Monozyten ihre Zählung (Referenzbereich: 150-400 Tausend pro µl) sowie
ihre Zählung (Referenzbereich: 150-400 Tausend pro µl) sowie  Aggregationstests zur Prüfung der Plättchenfunktion.
Aggregationstests zur Prüfung der Plättchenfunktion.  Thrombozyten im Vollblut
Thrombozyten im Vollblut Verringerter Sauerstofftransport bei Anämie
Verringerter Sauerstofftransport bei Anämie
 Abwehrschwäche bei Leukopenie
Abwehrschwäche bei Leukopenie 

 Verlangsamte
Blutstillung bei Thrombopenie
Verlangsamte
Blutstillung bei Thrombopenie (abnehmende Fließfähigkeit des Blutes), Anämie (verringerte Sauerstofftransportkapazität)
(abnehmende Fließfähigkeit des Blutes), Anämie (verringerte Sauerstofftransportkapazität) s. dort).
Dabei werden die Gerinnungsfaktoren weitgehend aufgebraucht
(Fibrinnetz), und nach Zentrifugation der Probe entsteht
(ungerinnbares) Blutserum, das zwar der Zusammensetzung des Blutplasmas
in weiten Bereichen gleicht (z.B. Elektrolytkonzentrationen,
Hormonwerte...), aber einen etwas geringeren Eiweißgehalt aufweist
(wegen der Abscheidung des Gerinnsels, das ja aus Proteinen besteht).
s. dort).
Dabei werden die Gerinnungsfaktoren weitgehend aufgebraucht
(Fibrinnetz), und nach Zentrifugation der Probe entsteht
(ungerinnbares) Blutserum, das zwar der Zusammensetzung des Blutplasmas
in weiten Bereichen gleicht (z.B. Elektrolytkonzentrationen,
Hormonwerte...), aber einen etwas geringeren Eiweißgehalt aufweist
(wegen der Abscheidung des Gerinnsels, das ja aus Proteinen besteht).  Natriumcitrat
bildet mit Calciumionen Komplexsalze und stoppt so die Gerinnung. Es
wird Blutkonserven beigesetzt, ferner findet es in der
Gerinnungsdiagnostik Verwendung (sein Effekt wird durch Calciumzusatz
aufgehoben) und ist Standardzusatz bei der Bestimmung der
Blutsenkungsgeschwindigkeit
Natriumcitrat
bildet mit Calciumionen Komplexsalze und stoppt so die Gerinnung. Es
wird Blutkonserven beigesetzt, ferner findet es in der
Gerinnungsdiagnostik Verwendung (sein Effekt wird durch Calciumzusatz
aufgehoben) und ist Standardzusatz bei der Bestimmung der
Blutsenkungsgeschwindigkeit EDTA (Äthylen-Diamin-Tetra-Acetat) bindet ebenfalls Ca++-Ionen. Man braucht es in der Hämatologie und für die Lipidanalytik (da es auch einen membranstabilisierenden Effekt hat)
EDTA (Äthylen-Diamin-Tetra-Acetat) bindet ebenfalls Ca++-Ionen. Man braucht es in der Hämatologie und für die Lipidanalytik (da es auch einen membranstabilisierenden Effekt hat) Heparin inaktiviert Thrombin und Faktor X (
Heparin inaktiviert Thrombin und Faktor X ( s. dort)
und eignet sich für den Einsatz in der Blutgasanalyse und zur
Hämatokritmessung (heparinisierte Abnahmekapillaren). Es wird auch in
vivo verwendet, um die Blutgerinnung zu reduzieren (z.B. Hämodialyse).
s. dort)
und eignet sich für den Einsatz in der Blutgasanalyse und zur
Hämatokritmessung (heparinisierte Abnahmekapillaren). Es wird auch in
vivo verwendet, um die Blutgerinnung zu reduzieren (z.B. Hämodialyse).
 Blut besteht zu ~60% aus Blutplasma und ~40% (Hämatokrit) aus Blutkörperchen. Pro Minute bildet der Körper ~150 Millionen Erythrozyten und ~120 Millionen Granulozyten. Zytokine mobilisieren Leukozyten aus dem
Knochenmark, nur einige % befinden sich im Blutkreislauf. Die Kapillaren (Gesamtoberfläche ~300 m2) tauschen mit dem Gewebe Flüssigkeit und darin gelöste Stoffe aus, inklusive Atemgase: Erythrozyten (zusammen ~3000 m2 Membranfläche) befinden sich aussschließlich in der Blutbahn (Lebensdauer ~120 Tage), sie machen zahlenmäßig ~90% aller Zellen des Körpers aus (~25 x 1012 Erys in 5 l Blut). Die Erythropoese kann mehr als verzehnfacht werden (Erythropoetin)
Blut besteht zu ~60% aus Blutplasma und ~40% (Hämatokrit) aus Blutkörperchen. Pro Minute bildet der Körper ~150 Millionen Erythrozyten und ~120 Millionen Granulozyten. Zytokine mobilisieren Leukozyten aus dem
Knochenmark, nur einige % befinden sich im Blutkreislauf. Die Kapillaren (Gesamtoberfläche ~300 m2) tauschen mit dem Gewebe Flüssigkeit und darin gelöste Stoffe aus, inklusive Atemgase: Erythrozyten (zusammen ~3000 m2 Membranfläche) befinden sich aussschließlich in der Blutbahn (Lebensdauer ~120 Tage), sie machen zahlenmäßig ~90% aller Zellen des Körpers aus (~25 x 1012 Erys in 5 l Blut). Die Erythropoese kann mehr als verzehnfacht werden (Erythropoetin) Erythrozyten (7-8 µm) tolerieren starke Schubspannungen (Aktin-Spektrin- Gerüst an der Innenseite der Membran, über Ankyrin und Bande 4-Proteine mit dem Zytoskelett verknüpft; Spektrin bildet dreidimensionale Maschenwerke und formt den Erythrozyten). Ihre Membran ist vor allem für Chloridionen durchgängig (Austausch gegen Bicarbonat), das Membranpotential beträgt
~-10 mV. Täglich werden 40-50 ml Blut nachgebildet (200-250 Milliarden Erys), das entspricht einer Hämoglobinsynthese von ~7g/d (knapp 100 mg Eisen werden fast vollständig wiederverwertet: Eisenaufnahme 1-2 mg/d). Ohne Mitochondrien sind Erys für den (anaeroben) Energiestoffwechsel (Ionentransport) auf Glucose (GLUT1) angewiesen (~30 g/d). Etwa
10% der Glucose gelangt in den Pentosephosphatweg (Herstellung von
NADPH für die Regeneration von Glutathion: anoxidative Kapazität)
Erythrozyten (7-8 µm) tolerieren starke Schubspannungen (Aktin-Spektrin- Gerüst an der Innenseite der Membran, über Ankyrin und Bande 4-Proteine mit dem Zytoskelett verknüpft; Spektrin bildet dreidimensionale Maschenwerke und formt den Erythrozyten). Ihre Membran ist vor allem für Chloridionen durchgängig (Austausch gegen Bicarbonat), das Membranpotential beträgt
~-10 mV. Täglich werden 40-50 ml Blut nachgebildet (200-250 Milliarden Erys), das entspricht einer Hämoglobinsynthese von ~7g/d (knapp 100 mg Eisen werden fast vollständig wiederverwertet: Eisenaufnahme 1-2 mg/d). Ohne Mitochondrien sind Erys für den (anaeroben) Energiestoffwechsel (Ionentransport) auf Glucose (GLUT1) angewiesen (~30 g/d). Etwa
10% der Glucose gelangt in den Pentosephosphatweg (Herstellung von
NADPH für die Regeneration von Glutathion: anoxidative Kapazität) In der Membran
der Blutkörperchen befinden sich Glykolipide und Proteine, die bei
Bluttransfusionen vom Immunsystem als fremd erkannt und attackiert
werden und zu Aggregation (Agglutinine) und Hämolyse führen können. A und B
(AB0-Gen) sind Epitope, die denen von Mikroorganismen ähneln und bei deren
Fehlen IgM-Antikörper (Anti-A, Anti-B) gebildet werden (Blutgruppe
Null: beide Agglutinine im Serum). Im Rhesus-System (~50 ähnlich aufgebaute potentiell antigen wirkende Proteine) spielen vor allem c, C, D, e und E eine Rolle (D ist dominant gegenüber d;
homozygot-positive Menschen (DD) haben immer Rhesus-positive Kinder).
Die häufigste Ursache für die Bildung von Rh-Antikörpern (IgG) bei
rh-negativen Frauen ist eine Rh-positive Schwangerschaft: Spätestens bei der Entbindung gelangen D+-Erythrozyten in den
mütterlichen Kreislauf (Sensibilisierung, Bildung von
Anti-D-Antikörpern). Rhesusprophylaxe: Gabe von
maskierenden Anti-D-Antikörpern
In der Membran
der Blutkörperchen befinden sich Glykolipide und Proteine, die bei
Bluttransfusionen vom Immunsystem als fremd erkannt und attackiert
werden und zu Aggregation (Agglutinine) und Hämolyse führen können. A und B
(AB0-Gen) sind Epitope, die denen von Mikroorganismen ähneln und bei deren
Fehlen IgM-Antikörper (Anti-A, Anti-B) gebildet werden (Blutgruppe
Null: beide Agglutinine im Serum). Im Rhesus-System (~50 ähnlich aufgebaute potentiell antigen wirkende Proteine) spielen vor allem c, C, D, e und E eine Rolle (D ist dominant gegenüber d;
homozygot-positive Menschen (DD) haben immer Rhesus-positive Kinder).
Die häufigste Ursache für die Bildung von Rh-Antikörpern (IgG) bei
rh-negativen Frauen ist eine Rh-positive Schwangerschaft: Spätestens bei der Entbindung gelangen D+-Erythrozyten in den
mütterlichen Kreislauf (Sensibilisierung, Bildung von
Anti-D-Antikörpern). Rhesusprophylaxe: Gabe von
maskierenden Anti-D-Antikörpern Die Neubildungsrate von weißen entspricht etwa der von roten Blutkörperchen; Leukozyten /
Thrombozyten leben kürzer als Erythrozyten, im roten Knochenmark findet man vor allem Myelozyten, wenig Erythroblasten. Zum "Kleinen Blutbild" gehören die Anzahl der Erythrozyten (~5 Mio / µl), Leukozyten (4 bis 11 Tausend/µl), Thrombozyten (150-400 Tausend pro µl); Hämoglobinkonzentration (~150 g/l Blut), Hämatokrit (~0,4), MCV (Ery-Volumen ~90 fl), MCH (Ery-Hämoglobinmenge 30 pg) und MCHC (Hämoglobinkonzentration ~340 g / l Ery), Anteil Retikulozyten (0,5-2% der Erys), evt. osmotische
Resistenz der Erys (Hämolyse bei ~180
mM). Differentialblutbild: Granulozyten ~65% aller Leukozyten im Blut (neutrophile 40-75%, eosinophile 1-6%, basophile ≤2%; stabkernige ≤5%), Lymphozyten 20-45%, Monozyten 2-8 %
Die Neubildungsrate von weißen entspricht etwa der von roten Blutkörperchen; Leukozyten /
Thrombozyten leben kürzer als Erythrozyten, im roten Knochenmark findet man vor allem Myelozyten, wenig Erythroblasten. Zum "Kleinen Blutbild" gehören die Anzahl der Erythrozyten (~5 Mio / µl), Leukozyten (4 bis 11 Tausend/µl), Thrombozyten (150-400 Tausend pro µl); Hämoglobinkonzentration (~150 g/l Blut), Hämatokrit (~0,4), MCV (Ery-Volumen ~90 fl), MCH (Ery-Hämoglobinmenge 30 pg) und MCHC (Hämoglobinkonzentration ~340 g / l Ery), Anteil Retikulozyten (0,5-2% der Erys), evt. osmotische
Resistenz der Erys (Hämolyse bei ~180
mM). Differentialblutbild: Granulozyten ~65% aller Leukozyten im Blut (neutrophile 40-75%, eosinophile 1-6%, basophile ≤2%; stabkernige ≤5%), Lymphozyten 20-45%, Monozyten 2-8 % Verringerte Ery- bzw. Hämoglobinwerte (Anämie) → reduzierte Sauerstofftransportkapazität, verringerte Leukozytenzahl → Immunschwäche, verringerte Thrombozytenzahl → reduzierte Blutstillung / gerinnung.
Eisenmangel vermindert sowohl das Volumen (MCV) als auch den
Hämoglobingehalt (MCH) der Erythrozyten (mikrozytäre hypochrome
Anämie); Erythropoetinmangel bedingt reduzierte Ery-Zahl bei normalem
MCV und MCH (normozytäre normochrome Anämie); Kobalaminmangel (Vitamin
B12) führt zur Bildung weniger, aber großer (MCV+) und
hämoglobinreicher (MCH+) Erythrozyten (makrozytäre hyperchrome Anämie)
Verringerte Ery- bzw. Hämoglobinwerte (Anämie) → reduzierte Sauerstofftransportkapazität, verringerte Leukozytenzahl → Immunschwäche, verringerte Thrombozytenzahl → reduzierte Blutstillung / gerinnung.
Eisenmangel vermindert sowohl das Volumen (MCV) als auch den
Hämoglobingehalt (MCH) der Erythrozyten (mikrozytäre hypochrome
Anämie); Erythropoetinmangel bedingt reduzierte Ery-Zahl bei normalem
MCV und MCH (normozytäre normochrome Anämie); Kobalaminmangel (Vitamin
B12) führt zur Bildung weniger, aber großer (MCV+) und
hämoglobinreicher (MCH+) Erythrozyten (makrozytäre hyperchrome Anämie)