




Die
vielfältigen somatischen Veränderungen während der Schwangerschaft sind
zum Großteil hormonabhängig: Die Östrogen- und Progesteronspiegel
steigen stetig an und bewirken die Zunahme von Atmung, Sauerstoff- und
Energieverbrauch, Blut- und Herzminutenvolumen, Fettgewebe (erhöhter
Leptinspiegel), täglichem Bedarf an Eiweiß, Vitaminen, Calcium, Eisen.
Insbesondere -- nimmt die Masse des Uterus östrogenbedingt zu, vor allem im Fundusbereich  -- bildet die Zervix einen den Brutraum abdichtenden Schwellkörper (Infektionsbarriere)  -- verändert sich die Vagina und wird stark vaskularisiert (Schutzfaktor)  -- wachsen die Brüste, bedingt durch Östrogen-, Progesteron-, hPL- und Prolaktinwirkung. Die Umstellung der Flüssigkeitsvolumina beruht ebenfalls auf hormonellen Effekten, z.B. aldosteronbedingte Natrium- und damit Wasserretention; die Osmolalität wird um etwa 10 mOsm herunterreguliert (Sollwertverstellung). Zu den zahlreichen weiteren physiologischen Veränderungen während der Schwangerschaft zählen auch deutliche Veränderungen im Gerinnungssystem, die sich ziemlich ausbalancieren - Blutstillung und Gerinnungsfähigkeit ändern sich insgesamt kaum. |
 Feto-plazentare Einheit
Feto-plazentare Einheit  Embryonale und fetale Entwicklung
Embryonale und fetale Entwicklung  Fetaler Kreislauf (prä- vs. postpartal)
Fetaler Kreislauf (prä- vs. postpartal)
 Kombiniertes Herzzeitvolumen
Kombiniertes Herzzeitvolumen
 Core messages
Core messages
 Herz und Kreislauf
Herz und Kreislauf  Atmung
Atmung  Gastrointestinales System
Gastrointestinales System  Nieren & Elektrolyte
Nieren & Elektrolyte  Hormone, Stoffwechsel
Hormone, Stoffwechsel  Immunsystem
Immunsystem  Gerinnungssystem
Gerinnungssystem  Zentralnervensystem
Zentralnervensystem  Weitere Veränderungen
Weitere Veränderungen Abbildung).
Abbildung).
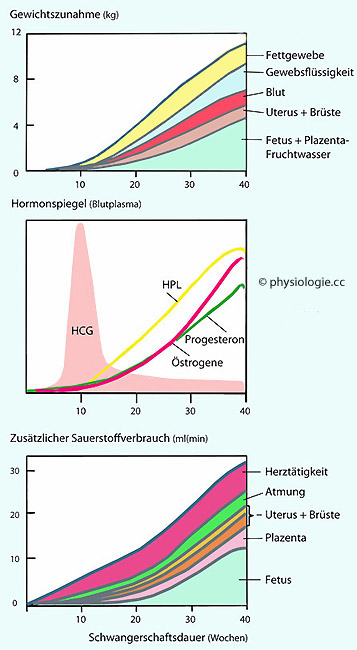
 Abbildung: Somatische und hormonelle Veränderungen während einer normalen Schwangerschaft
Abbildung: Somatische und hormonelle Veränderungen während einer normalen Schwangerschaft
| Die Plazenta übernimmt weitgehend die Synthese von Progesteron und Östrogenen |
 Kind ~3.5 kg
Kind ~3.5 kg
 Plazenta ~0.5 kg
Plazenta ~0.5 kg
 Fruchtwasser ~1 kg
Fruchtwasser ~1 kg
 Uteruswand ~1 kg
Uteruswand ~1 kg
 Brüste ~ 0.5 kg
Brüste ~ 0.5 kg
 Blut 1-2 kg
Blut 1-2 kg
 Interstitielle Flüssigkeit ~2 kg
Interstitielle Flüssigkeit ~2 kg
 Fettgewebe ~3 kg
Fettgewebe ~3 kg Der Uterus
nimmt unter der Wirkung der hohen Östrogenwerte an Gewicht und Größe enorm zu (von 60-80 auf 1000-1500 g),
vor allem im Fundusbereich. Das Myometrium hypertrophiert, die Durchblutung steigt bis
zum Ende der Schwangerschaft von ~1% auf bis zu 15% des
Herzminutenvolumens (450-650 ml/min) an. Der Mechanismus ist vor allem
zunehmende Vasodilatation.
Der Uterus
nimmt unter der Wirkung der hohen Östrogenwerte an Gewicht und Größe enorm zu (von 60-80 auf 1000-1500 g),
vor allem im Fundusbereich. Das Myometrium hypertrophiert, die Durchblutung steigt bis
zum Ende der Schwangerschaft von ~1% auf bis zu 15% des
Herzminutenvolumens (450-650 ml/min) an. Der Mechanismus ist vor allem
zunehmende Vasodilatation.  Die Zervix
(Gebärmutterhals; besteht zu 90% aus Bindegewebe) bildet
einen Schwellkörper aus Gefäßen, der den Brutraum gegen die
Vagina abschließt und beim Geburtsvorgang durch den
tiefertretenden Kopf des Kindes ausgepresst wird ("Öffnung des
Muttermundes"). Außerdem organisieren sich die Kollagenfasern in
aufgelockerter Weise um (prostaglandinbedingte "Zervixreifung").
Die Zervix
(Gebärmutterhals; besteht zu 90% aus Bindegewebe) bildet
einen Schwellkörper aus Gefäßen, der den Brutraum gegen die
Vagina abschließt und beim Geburtsvorgang durch den
tiefertretenden Kopf des Kindes ausgepresst wird ("Öffnung des
Muttermundes"). Außerdem organisieren sich die Kollagenfasern in
aufgelockerter Weise um (prostaglandinbedingte "Zervixreifung").  Als Zervixlänge (Länge des Gebärmutterhalses) bezeichnet man die Distanz zwischen innerem (internal orifice) und äußerem Muttermund (external orifice). Sie wird üblicherweise mittels Ultraschallbildgebung ermittelt und beträgt bei Nichtschwangeren 20-30 mm. In der Frühschwangerschaft (bis SSW 22) nimmt sie auf 30-50 mm zu. Mit zunehmendem Wachstum des Feten verkürzt sie sich anschließend wieder.
Als Zervixlänge (Länge des Gebärmutterhalses) bezeichnet man die Distanz zwischen innerem (internal orifice) und äußerem Muttermund (external orifice). Sie wird üblicherweise mittels Ultraschallbildgebung ermittelt und beträgt bei Nichtschwangeren 20-30 mm. In der Frühschwangerschaft (bis SSW 22) nimmt sie auf 30-50 mm zu. Mit zunehmendem Wachstum des Feten verkürzt sie sich anschließend wieder.  Bis zur 34. SSW sollte die Zervixlänge mindestens 25 mm betragen. Bei geringer Länge (Verkürzung des Gebärmutterhalses) droht
eine Zervixinsuffizienz (Muttermundschwäche), was zu vorzeitiger
Weitung (Öffnung der Zervix ohne Wehen) und zu einer Frühgeburt führen
kann.
Bis zur 34. SSW sollte die Zervixlänge mindestens 25 mm betragen. Bei geringer Länge (Verkürzung des Gebärmutterhalses) droht
eine Zervixinsuffizienz (Muttermundschwäche), was zu vorzeitiger
Weitung (Öffnung der Zervix ohne Wehen) und zu einer Frühgeburt führen
kann.  Die Vagina wird weicher,
samtartig, zeigt Bindegewebs- und Muskelwachstum, der
zytologische Abstrich ändert seine Charakteristika, die Venen
weiten sich, die stark vaskularisierte und durchblutete Scheide färbt sich bläulich (Chadwick-Zeichen
Die Vagina wird weicher,
samtartig, zeigt Bindegewebs- und Muskelwachstum, der
zytologische Abstrich ändert seine Charakteristika, die Venen
weiten sich, die stark vaskularisierte und durchblutete Scheide färbt sich bläulich (Chadwick-Zeichen  ),
es können Krampfadern entstehen. Das Sekret erscheint weißlich,
Glykogenabbau durch Lactobacillus acidophilus stellt den pH-Wert des
Scheidensekrets auf Werte zwischen 3,5 und 6,0 ein (Milchsäure).
),
es können Krampfadern entstehen. Das Sekret erscheint weißlich,
Glykogenabbau durch Lactobacillus acidophilus stellt den pH-Wert des
Scheidensekrets auf Werte zwischen 3,5 und 6,0 ein (Milchsäure). Die Brüste
proliferieren deutlich ab dem 2. Schwangerschaftsmonat (Mammogenese), bedingt durch
die ansteigenden Blutspiegel an Östrogenen, Progesteron und hPL
(plazentarem Laktogen) aus der Plazenta, sowie Prolaktin aus der
Hypophyse. Dabei nimmt das Drüsengewebe (das stark auf diese
hormonellen Reize anspricht) stärker zu als das Binde- und Fettgewebe
(duktale und lobuloalveoläre Hyperplasie und Hypertrophie). Prolaktin
und hPL bewirken in der 2. Schwangerschaftshälfte, dass sich laktogene
Alveolarzellen zu präsekretorischem Epithel differenzieren; einige
Wochen vor dem Geburtstermin bilden sie bereits etwas Kolostrum. Solange die Progesteronwerte hoch sind, wird die
komplette Ausdifferenzierung hintangehalten; dies ändert sich erst,
wenn der Progesteronspiegel unmittelbar präpartal zu sinken beginnt
(
Die Brüste
proliferieren deutlich ab dem 2. Schwangerschaftsmonat (Mammogenese), bedingt durch
die ansteigenden Blutspiegel an Östrogenen, Progesteron und hPL
(plazentarem Laktogen) aus der Plazenta, sowie Prolaktin aus der
Hypophyse. Dabei nimmt das Drüsengewebe (das stark auf diese
hormonellen Reize anspricht) stärker zu als das Binde- und Fettgewebe
(duktale und lobuloalveoläre Hyperplasie und Hypertrophie). Prolaktin
und hPL bewirken in der 2. Schwangerschaftshälfte, dass sich laktogene
Alveolarzellen zu präsekretorischem Epithel differenzieren; einige
Wochen vor dem Geburtstermin bilden sie bereits etwas Kolostrum. Solange die Progesteronwerte hoch sind, wird die
komplette Ausdifferenzierung hintangehalten; dies ändert sich erst,
wenn der Progesteronspiegel unmittelbar präpartal zu sinken beginnt
( Abbildung oben) - die Brüste sind nun zum Stillen vorbereitet.
Abbildung oben) - die Brüste sind nun zum Stillen vorbereitet. . Diese Proteohormone kommen in drei Molekülvarianten vor (2 über Disulfidbrücken
verbundene Peptidketten), die auf vier Rezeptortypen wirken.
. Diese Proteohormone kommen in drei Molekülvarianten vor (2 über Disulfidbrücken
verbundene Peptidketten), die auf vier Rezeptortypen wirken. 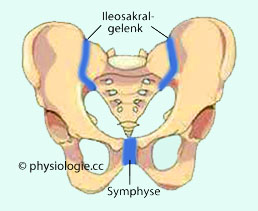
 Abbildung: Angriffspunkte der Relaxine an Beckengelenken
Abbildung: Angriffspunkte der Relaxine an Beckengelenken
 Abbildung) - die Zervix und der Bandapparat im Beckenring, insbesondere im Bereich der Symphyse, werden dehnbarer. Der Symphasenspalt weitet sich
um ca. 1 cm - das
erleichtert den Geburtsvorgang. Wahrscheinlich beteiligen sich Relaxine auch an der Dezidualisierung, d.h. der Umstellung der Uterusschleimhaut (Endometrium) auf die Implantation.
Abbildung) - die Zervix und der Bandapparat im Beckenring, insbesondere im Bereich der Symphyse, werden dehnbarer. Der Symphasenspalt weitet sich
um ca. 1 cm - das
erleichtert den Geburtsvorgang. Wahrscheinlich beteiligen sich Relaxine auch an der Dezidualisierung, d.h. der Umstellung der Uterusschleimhaut (Endometrium) auf die Implantation.  Der Relaxineffekt macht die Gelenke im Körper anfälliger für
mechanische Überlastung - das Einwirken großer Kräfte auf die Gelenke
(übermäßige Streckübungen) sollte während der Schwangerschaft vermieden
werden. Auch postpartal halten die Relaxinwirkungen an - für mehrere
Monate, bei längerer Stilldauer möglicherweise bis zu 2 Jahre.
Der Relaxineffekt macht die Gelenke im Körper anfälliger für
mechanische Überlastung - das Einwirken großer Kräfte auf die Gelenke
(übermäßige Streckübungen) sollte während der Schwangerschaft vermieden
werden. Auch postpartal halten die Relaxinwirkungen an - für mehrere
Monate, bei längerer Stilldauer möglicherweise bis zu 2 Jahre. Abbildung), was zur Stabilisierung des Blutdrucks beiträgt.
Abbildung), was zur Stabilisierung des Blutdrucks beiträgt. Abbildung), bedingt durch hormonabhängige Vasodilatation, wahrscheinlich ist auch Stickstoffmonoxid beteiligt) und steigen
dann bis zum Geburtstermin wieder auf etwa prägestationelle Werte
(oder auch darüber) an.
Abbildung), bedingt durch hormonabhängige Vasodilatation, wahrscheinlich ist auch Stickstoffmonoxid beteiligt) und steigen
dann bis zum Geburtstermin wieder auf etwa prägestationelle Werte
(oder auch darüber) an. 
 Abbildung: Systemische kardiovaskuläre Veränderungen in der Schwangerschaft
Abbildung: Systemische kardiovaskuläre Veränderungen in der Schwangerschaft
 die Ruhe-Herzfrequenz der Schwangeren um bis zu 25% oder
~15 Schläge/Minute (reflektorisch, weil der Blutdruck abnimmt),
die Ruhe-Herzfrequenz der Schwangeren um bis zu 25% oder
~15 Schläge/Minute (reflektorisch, weil der Blutdruck abnimmt),  das Ruhe-Schlagvolumen um bis zu 30% oder ~20 ml (erhöhtes Blutvolumen bewirkt stärkere diastolische Füllung),
das Ruhe-Schlagvolumen um bis zu 30% oder ~20 ml (erhöhtes Blutvolumen bewirkt stärkere diastolische Füllung),  das Ruhe-Herzzeitvolumen
bis zum 3. Trimenon um 30-50% (Kombination der obigen zwei Faktoren). Wehen erhöhen das Herzminutenvolumen zusätzlich. Die utero-plazentare Durchblutung steigt gegen Schwangerschaftsende auf ~600 ml/min an.
das Ruhe-Herzzeitvolumen
bis zum 3. Trimenon um 30-50% (Kombination der obigen zwei Faktoren). Wehen erhöhen das Herzminutenvolumen zusätzlich. Die utero-plazentare Durchblutung steigt gegen Schwangerschaftsende auf ~600 ml/min an. Kardiale Hypertrophie während der Schwangerschaft ist eine
physiologische Anpassung an den erhöhten Perfusionsbedarf
(ähnlich wie bei
Muskeltraining): Die uteroplazentare Durchblutung nimmt bis auf Werte
um die 750 ml/min (vor der Geburt) zu. Auch die Perfusion von Haut
(Wärmeabgabe), Brüsten und Verdauungstrakt steigt an. Die Durchblutung
der Nieren nimmt schon im ersten Trimenon um bis zu 80% zu (im späteren
Verlauf der Schwangerschaft meist wieder ab).
Kardiale Hypertrophie während der Schwangerschaft ist eine
physiologische Anpassung an den erhöhten Perfusionsbedarf
(ähnlich wie bei
Muskeltraining): Die uteroplazentare Durchblutung nimmt bis auf Werte
um die 750 ml/min (vor der Geburt) zu. Auch die Perfusion von Haut
(Wärmeabgabe), Brüsten und Verdauungstrakt steigt an. Die Durchblutung
der Nieren nimmt schon im ersten Trimenon um bis zu 80% zu (im späteren
Verlauf der Schwangerschaft meist wieder ab). Abbildung), beeinflusst durch zwei Komponenten:
Abbildung), beeinflusst durch zwei Komponenten: 

 Hämodynamische Veränderungen bei der Mutter während Schwangerschaft, Geburt und post partum  Nach Hebson C, Saraf A, Book WM: Risk assessment and management of the mother with cardiovascular disease. In: Chanani NK, Hamrick SEG (eds). Clinics in perinatology - cardiovascular disease. Elsevier 2016 |
|||
| Hämodynamische Zustandsvariable |
Durchschnittliche Veränderung bei normaler Schwangerschaft |
Veränderung während der Geburt |
Veränderung postpartal |
| Blutvolumen |
↑50% |
↑ | ↓ |
| Herzfrequenz |
↑10-15 bpm |
↑ | ↓ |
| Herzzeitvolumen |
↑50% (3. Trimester) |
↑ | ↓ |
| Systolischer Blutdruck |
↓10-20% |
↑ | ↓ |
| Schlagvolumen |
↑ (1./2. Trimester) |
↑ | ↓ |
| Gefäßwiderstand systemisch |
↓ | ↑ | ↓ |
| O2-Verbrauch (basal) |
↑ | ↑ | ↓ |
 Hämatokrit und Hämoglobinkonzentration im Blut sinken
aufgrund dieses Musters (das Plasmavolumen nimmt stärker zu - +1,5 l -
als das Volumen an Blutkörperchen - +0,5 l) deutlich ab (Hämoglobin auf
12-13 g/dl, sonst ~15 g/dl), was einer paradoxen Anämie entspricht
('Schwangerschaftsanämie',
unterer Hämoglobin-Grenzwert in der Schwangerschaft 11
g/l - keine
wirkliche Blutarmut, denn das Blutvolumen steigt um ~40%).
Hämatokrit und Hämoglobinkonzentration im Blut sinken
aufgrund dieses Musters (das Plasmavolumen nimmt stärker zu - +1,5 l -
als das Volumen an Blutkörperchen - +0,5 l) deutlich ab (Hämoglobin auf
12-13 g/dl, sonst ~15 g/dl), was einer paradoxen Anämie entspricht
('Schwangerschaftsanämie',
unterer Hämoglobin-Grenzwert in der Schwangerschaft 11
g/l - keine
wirkliche Blutarmut, denn das Blutvolumen steigt um ~40%). | Die Hämogobinkonzentration im mütterlichen Blut ist im 3. Trimenon niedriger als im Blut des Feten Der Hämatokrit sinkt gegen Ende der Schwangerschaft |
Das erhöhte Blutvolumen geht mit einer Steigerung des Herzminutenvolumens Hand in Hand (hohe kardiale Plastizität: Ruhe-HMV von ca. 5 l/min prägestational auf >6 l/min in der 35. Woche bis ~9 l/min unmittelbar postpartal!) und dient mehreren Funktionen:
 Versorgung des Feten und des vergrößerten Uterus
Versorgung des Feten und des vergrößerten Uterus
 Milderung orthostatischer Effekte (Wechsel der Körperposition)
Milderung orthostatischer Effekte (Wechsel der Körperposition)
 Reservevolumen gegenüber Blutverlust bei der Geburt
Reservevolumen gegenüber Blutverlust bei der Geburt| Hämatologische Kennzahlen (gerundete Mittelwerte) Nach Case / Waterhouse, Human Physiology - Age, Stress, and the Environment, 2nd ed. Oxford University Press 1994 |
||
| Index |
Nicht schwanger |
Drittes Trimenon |
| Erythrozytenzahl |
4,7.106/µl |
3,8.106/µl |
| Hämatokrit |
42% |
33% |
| Hämoglobin |
14 g/dl |
11,5 g/dl |
| Leukozytenzahl |
9.103/µl |
11.103/µl |
 Über Blutgruppen und Rhesus-Inkompatibilität s. dort.
Über Blutgruppen und Rhesus-Inkompatibilität s. dort. 
 Abbildung: Kompression der unteren Hohlvene durch das Gewicht des Feten, der auf die Wirbelsäule drückt (Frau in Rückenlage)
Abbildung: Kompression der unteren Hohlvene durch das Gewicht des Feten, der auf die Wirbelsäule drückt (Frau in Rückenlage)
 Abbildung) und damit Reduktion des cardiac
preload des rechten Herzens kommen: Herzzeitvolumen und Blutdruck nehmen
ab (Kollapsgefahr in liegender Position). Weiters nimmt die Durchblutung der Plazenta und damit auch der Gasaustausch ab (fetale Hypoxie).
Abbildung) und damit Reduktion des cardiac
preload des rechten Herzens kommen: Herzzeitvolumen und Blutdruck nehmen
ab (Kollapsgefahr in liegender Position). Weiters nimmt die Durchblutung der Plazenta und damit auch der Gasaustausch ab (fetale Hypoxie).  Abbildung) nimmt bei schwangeren Frauen zu (die Atemfrequenz nur bis zur Mitte der Gestationsperiode), veruracht durch mehrere Faktoren:
Abbildung) nimmt bei schwangeren Frauen zu (die Atemfrequenz nur bis zur Mitte der Gestationsperiode), veruracht durch mehrere Faktoren:  Druck
des wachsenden Feten auf das Zwerchfell, das um bis zu 4 cm thoraxwärts gedrängt wird.
Die Breite des Brustkorbes nimmt um etwa 2 cm zu, die Exkursionen des Zwerchfells (Atemamplitude) um 1-2 cm. Die FRC nimmt im Stehen um 20%, im Liegen um 30% ab.
Druck
des wachsenden Feten auf das Zwerchfell, das um bis zu 4 cm thoraxwärts gedrängt wird.
Die Breite des Brustkorbes nimmt um etwa 2 cm zu, die Exkursionen des Zwerchfells (Atemamplitude) um 1-2 cm. Die FRC nimmt im Stehen um 20%, im Liegen um 30% ab.  erhöhtes Stoffwechselaufkommen durch das feto-plazentare System. Der Sauerstoffbedarf nimmt bis zum Termin um 20-30% zu (Ruhewert von ~220 ml/min um ~15% auf 250-260 ml/min, der Fetus alleine braucht 12-13 ml/min);
erhöhtes Stoffwechselaufkommen durch das feto-plazentare System. Der Sauerstoffbedarf nimmt bis zum Termin um 20-30% zu (Ruhewert von ~220 ml/min um ~15% auf 250-260 ml/min, der Fetus alleine braucht 12-13 ml/min); progesteronbedingt
steigt die CO2-Empfindlichkeit
des Atemzentrums. Die alveoläre Ventilation nimmt
zu, Hyperventilation führt zu milder respiratorischer Alkalose, die
durch Reduktion der Bikarbonatkonzentration im Blutplasma (von 24 auf
20 mM) renal kompensiert wird (der Harn-pH nimmt leicht zu).
progesteronbedingt
steigt die CO2-Empfindlichkeit
des Atemzentrums. Die alveoläre Ventilation nimmt
zu, Hyperventilation führt zu milder respiratorischer Alkalose, die
durch Reduktion der Bikarbonatkonzentration im Blutplasma (von 24 auf
20 mM) renal kompensiert wird (der Harn-pH nimmt leicht zu).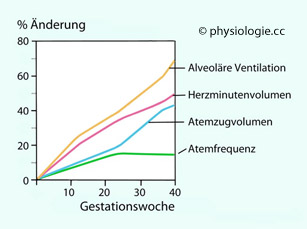
 Abbildung: Durchschnittliche prozentuelle Änderung der
Atmungskennwerte und des Herzzeitvolumens als Funktion der
Gestationsdauer
Abbildung: Durchschnittliche prozentuelle Änderung der
Atmungskennwerte und des Herzzeitvolumens als Funktion der
Gestationsdauer
 Der progesteronbedingt
erniedrigte Tonus des unteren Ösophagussphinkters beeinträchtigt dessen Funktionsfähigkeit
Der progesteronbedingt
erniedrigte Tonus des unteren Ösophagussphinkters beeinträchtigt dessen Funktionsfähigkeit  Der Uterus verdrängt Magen und Zwerchfell nach oben und reduziert den Knickwinkel des Oesophagus beim Eintritt in den Magen
Der Uterus verdrängt Magen und Zwerchfell nach oben und reduziert den Knickwinkel des Oesophagus beim Eintritt in den Magen Im dritten Trimenon erhöht der nach oben drängende Uterus den Mageninnendruck und beeinträchtigt damit den ösophagealen Verschlussmechanismus
Im dritten Trimenon erhöht der nach oben drängende Uterus den Mageninnendruck und beeinträchtigt damit den ösophagealen Verschlussmechanismus Die Magenentleerung ist bei Wehenaktivität herabgesetzt
Die Magenentleerung ist bei Wehenaktivität herabgesetzt Ab der 15. SSW produziert die Plazenta Gastrin, der pH-Wert des Mageninhalts nimmt ab (Übersäuerung).
Ab der 15. SSW produziert die Plazenta Gastrin, der pH-Wert des Mageninhalts nimmt ab (Übersäuerung). alkalische Phosphatase - eine Isoform der AP wird von der Plazenta gebildet, der Plasmaspiegel verdoppelt sich,
alkalische Phosphatase - eine Isoform der AP wird von der Plazenta gebildet, der Plasmaspiegel verdoppelt sich,  gamma-Glutamyltransferase (γ-GT),
gamma-Glutamyltransferase (γ-GT),  Alanin-Aminotransferase (ALAT) und
Alanin-Aminotransferase (ALAT) und  Lactat-Dehydrogenase
(LDH),
Lactat-Dehydrogenase
(LDH),  Abbildung ganz oben.
Abbildung ganz oben. Zum
Abschluss der Schwangerschaft sind etwa 1000 Gramm Protein
zusätzlich
synthetisiert worden: Dabei entfallen ~500g auf Fetus und Plazenta,
~500 g wurden für den Aufbau von Uterus (Muskelfasern), Brüsten
(Drüsengewebe) und Blut (Hämoglobin und Plasmaeiweiss) benötigt. Die
Konzentration von Aminosäuren ist im fetalen System höher als im
mütterlichen, dieser Gradient wird von der Plazenta eingestellt, die
sich auch aktiv an der Synthese von Aminosäuren beteiligt.
Zum
Abschluss der Schwangerschaft sind etwa 1000 Gramm Protein
zusätzlich
synthetisiert worden: Dabei entfallen ~500g auf Fetus und Plazenta,
~500 g wurden für den Aufbau von Uterus (Muskelfasern), Brüsten
(Drüsengewebe) und Blut (Hämoglobin und Plasmaeiweiss) benötigt. Die
Konzentration von Aminosäuren ist im fetalen System höher als im
mütterlichen, dieser Gradient wird von der Plazenta eingestellt, die
sich auch aktiv an der Synthese von Aminosäuren beteiligt. Der Eiweißbedarf (+30 g/d) und Vitaminbedarf ist erhöht, ebenfalls der Bedarf an
Eisen (+700 mg - die Eisenspeicher der Mutter nehmen mit der
Schwangerschaft meist deutlich ab). Der Bedarf an Folsäure
verdoppelt sich in der Schwangerschaft. Folsäurereich sind Leber und Gemüse (Bohnen, Spinat).
Folatsupplementierung von 0,4 mg/d während der Schwangerschaft ist
empfohlen worden.
Der Eiweißbedarf (+30 g/d) und Vitaminbedarf ist erhöht, ebenfalls der Bedarf an
Eisen (+700 mg - die Eisenspeicher der Mutter nehmen mit der
Schwangerschaft meist deutlich ab). Der Bedarf an Folsäure
verdoppelt sich in der Schwangerschaft. Folsäurereich sind Leber und Gemüse (Bohnen, Spinat).
Folatsupplementierung von 0,4 mg/d während der Schwangerschaft ist
empfohlen worden. Abbildung: Physiologische Veränderungen im Blutplasma während und nach der Schwangerschaft
Abbildung: Physiologische Veränderungen im Blutplasma während und nach der Schwangerschaft
 Der Vitamin D3-Spiegel der Schwangeren bestimmt die Knochendichte des Kindes bis zum ~9. Lebensjahr mit; Vitamin
D-Mangel in der Schwangerschaft tritt bei jeder zweiten Schwangeren auf
und führt zu verminderter Knochendichte beim Kind. Physiologischerweise nimmt der Vitamin-D3- und auch der Calcitoninspiegel bei Schwangeren über den (nichtschwangeren) Referenzbereich zu, der Parathormonspiegel hingegen - bei normalem Calciumangebot - ab (
Der Vitamin D3-Spiegel der Schwangeren bestimmt die Knochendichte des Kindes bis zum ~9. Lebensjahr mit; Vitamin
D-Mangel in der Schwangerschaft tritt bei jeder zweiten Schwangeren auf
und führt zu verminderter Knochendichte beim Kind. Physiologischerweise nimmt der Vitamin-D3- und auch der Calcitoninspiegel bei Schwangeren über den (nichtschwangeren) Referenzbereich zu, der Parathormonspiegel hingegen - bei normalem Calciumangebot - ab ( Abbildung).
Abbildung).  Abbildung).
Abbildung). Der Bedarf an Mineralien und Spurenelementen ändert sich. Zinkmangel
kann Wachstumsstörungen beim Feten zur Folge haben, eine tägliche
Zufuhr von 15 mg/d während der Schwangerschaft ist empfohlen. Die
Zufuhr von Nahrungseisen sollte auf höchstens ~30 mg/d beschränkt
bleiben, weil hohe Eisenzufuhr die Resorption von Zink im Darm hemmen
kann.
Der Bedarf an Mineralien und Spurenelementen ändert sich. Zinkmangel
kann Wachstumsstörungen beim Feten zur Folge haben, eine tägliche
Zufuhr von 15 mg/d während der Schwangerschaft ist empfohlen. Die
Zufuhr von Nahrungseisen sollte auf höchstens ~30 mg/d beschränkt
bleiben, weil hohe Eisenzufuhr die Resorption von Zink im Darm hemmen
kann. Um bis zu 75% erhöhte Nierendurchblutung (RBF) durch hormonelle Umstellungen,
Um bis zu 75% erhöhte Nierendurchblutung (RBF) durch hormonelle Umstellungen, Abnahme des Hämatokrit (bessere Fließfähigkeit des Blutes) und
Abnahme des Hämatokrit (bessere Fließfähigkeit des Blutes) und  sinkende Konzentration der Plasmaproteine (niedrigerer
kolloidosmotischer Effekt)
sinkende Konzentration der Plasmaproteine (niedrigerer
kolloidosmotischer Effekt)  Bei Graviden gilt als Obergrenze der Proteinausscheidung mit dem Harn 300 mg/24h (bei Nichtgraviden 150 mg/24h).
Bei Graviden gilt als Obergrenze der Proteinausscheidung mit dem Harn 300 mg/24h (bei Nichtgraviden 150 mg/24h).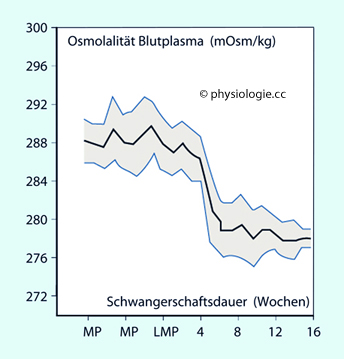
 Abbildung: Osmotische Konzentration im Blut der Mutter als Funktion der Schwangerschaftsdauer
Abbildung: Osmotische Konzentration im Blut der Mutter als Funktion der Schwangerschaftsdauer
 Abbildung), wahrscheinlich über Wirkung des hCG und Relaxins auf die Sensibilität der Osmorezeptoren im Gehirn. Die osmotische Schwelle zur ADH-Aktivierung ist bei Schwangeren infolge hormoneller Effekte auf
Osmorezeptoren unter 280 mOsm/kg gesenkt.
Abbildung), wahrscheinlich über Wirkung des hCG und Relaxins auf die Sensibilität der Osmorezeptoren im Gehirn. Die osmotische Schwelle zur ADH-Aktivierung ist bei Schwangeren infolge hormoneller Effekte auf
Osmorezeptoren unter 280 mOsm/kg gesenkt. 
 Abbildung: Endokrine Kontrolle während Schwangerschaft und Geburt
Abbildung: Endokrine Kontrolle während Schwangerschaft und Geburt Östrogene (Östradiolanstieg im Blutplasma bis Schwangenschaftsende von <0,3 auf ~20 ng/ml) bewirken eine Fülle von Umstellungen des mütterlichen
Organismus während der Schwangerschaft. Dazu zählt u.a. die gesteigerte
Produktion hormontransportierender Plasmaeiweiße. Östrogene erhöhen die
Empfindlichkeit des Myometriums gegenüber Oxytozin und steigern die
Produktion von Prostaglandinen (wehenfördernde Wirkung im Rahmen des
Geburtsvorgangs).
Östrogene (Östradiolanstieg im Blutplasma bis Schwangenschaftsende von <0,3 auf ~20 ng/ml) bewirken eine Fülle von Umstellungen des mütterlichen
Organismus während der Schwangerschaft. Dazu zählt u.a. die gesteigerte
Produktion hormontransportierender Plasmaeiweiße. Östrogene erhöhen die
Empfindlichkeit des Myometriums gegenüber Oxytozin und steigern die
Produktion von Prostaglandinen (wehenfördernde Wirkung im Rahmen des
Geburtsvorgangs).  Abbildung).
Abbildung). Progesteron (oft als "Schwangerschaftshormon" bezeichnet - Anstieg bis Schwangenschaftsende von ~≤15 auf bis zu ~200 ng/ml und darüber)
wird in der Frühschwangerschaft vom Gelbkörper und dann (2. / 3.
Trímester) von der Plazenta gebildet. In der 2. Zyklushälfte bereitet
es das Endometrium für eine Implantation vor (
Progesteron (oft als "Schwangerschaftshormon" bezeichnet - Anstieg bis Schwangenschaftsende von ~≤15 auf bis zu ~200 ng/ml und darüber)
wird in der Frühschwangerschaft vom Gelbkörper und dann (2. / 3.
Trímester) von der Plazenta gebildet. In der 2. Zyklushälfte bereitet
es das Endometrium für eine Implantation vor ( Abbildung:), während der Gravidität
erfüllt es u.a. folgende Aufgaben:
Abbildung:), während der Gravidität
erfüllt es u.a. folgende Aufgaben:
 Abbildung).
Abbildung). 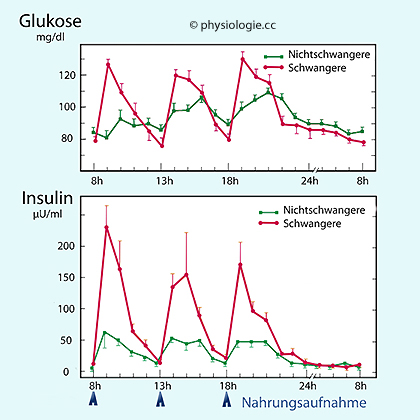
 Abbildung:
Antwort des Blutzucker- (oben) und Insulinspiegels (unten) auf
Nahrungsaufnahme bei Schwangeren und
Nichtschwangeren
Abbildung:
Antwort des Blutzucker- (oben) und Insulinspiegels (unten) auf
Nahrungsaufnahme bei Schwangeren und
Nichtschwangeren Die Amplitude der täglichen Schwankungen des Blutzucker- und des Insulinspiegels sind während der Schwangerschaft wesentlich erhöht (
Die Amplitude der täglichen Schwankungen des Blutzucker- und des Insulinspiegels sind während der Schwangerschaft wesentlich erhöht ( Abbildung). In
der zweiten Schwangerschaftshälfte verändert sich der Metabolismus von
anabol (Speicherung) auf katabol (Fettabbau); man spricht auch von "accelerated starvation".
Abbildung). In
der zweiten Schwangerschaftshälfte verändert sich der Metabolismus von
anabol (Speicherung) auf katabol (Fettabbau); man spricht auch von "accelerated starvation". Der
Nüchtern-Glucosespiegel bleibt bei Schwangeren meist im eng reguluerten
Bereich von 4-5 mM - nur postprandial steigt er stärker und länger
anhaltend an als sonst (reduzierte Glucosetoleranz infolge erhöhter
Insulinresistenz, vermutlich bedingt durch Veränderungen sowohl auf
Rezeptor- als auch intrazellulärer Signalwegebene). Hoher Blutzuckerspiegel erleichtert die Glucose-Aufnahme des Feten (höheres Konzentrationsgefälle in der Plazenta).
Der
Nüchtern-Glucosespiegel bleibt bei Schwangeren meist im eng reguluerten
Bereich von 4-5 mM - nur postprandial steigt er stärker und länger
anhaltend an als sonst (reduzierte Glucosetoleranz infolge erhöhter
Insulinresistenz, vermutlich bedingt durch Veränderungen sowohl auf
Rezeptor- als auch intrazellulärer Signalwegebene). Hoher Blutzuckerspiegel erleichtert die Glucose-Aufnahme des Feten (höheres Konzentrationsgefälle in der Plazenta).  Hypothalamische Sättigungszentren werden vermutlich durch Progesteron verstellt. Der erhöhte Progesteronspiegel steigert auch die alveoläre Ventilation. Fettgewebe
wird von der Schwangeren während der Schwangerschaftsmitte vermehrt
angelegt, zentral stärker als peripher. Diese Speicher werden
vorwiegend im dritten Trimenon - das durch Hyperlipidämie
gekennzeichnet ist (Triglyzeride, HDL, LDL, VLDL erhöht) - für den
fetalen Bedarf benötigt.
Hypothalamische Sättigungszentren werden vermutlich durch Progesteron verstellt. Der erhöhte Progesteronspiegel steigert auch die alveoläre Ventilation. Fettgewebe
wird von der Schwangeren während der Schwangerschaftsmitte vermehrt
angelegt, zentral stärker als peripher. Diese Speicher werden
vorwiegend im dritten Trimenon - das durch Hyperlipidämie
gekennzeichnet ist (Triglyzeride, HDL, LDL, VLDL erhöht) - für den
fetalen Bedarf benötigt.  Dieser
Befund, oder auch Kreislaufversagen bei Hypovolämie unter der Geburt,
kann zu Unterdurchblutung und Atrophie der Hypophyse mit entsprechendem
Ausfall troper Hormone führen (Sheehan-Syndrom).
Dieser
Befund, oder auch Kreislaufversagen bei Hypovolämie unter der Geburt,
kann zu Unterdurchblutung und Atrophie der Hypophyse mit entsprechendem
Ausfall troper Hormone führen (Sheehan-Syndrom). Abbildung: Entwicklung der ACTH- und Cortisolwerte im Blut der Mutter als Funktion der Schwangerschaftsdauer
Abbildung: Entwicklung der ACTH- und Cortisolwerte im Blut der Mutter als Funktion der Schwangerschaftsdauer
 Die Plazenta produziert CRH
(identisch mit dem von der Hypophyse synthetisierten), vor allem in der
Spätschwangerschaft. Zu dieser Zeit, und vor allem zum Geburtstermin,
nimmt die Konzentration an CRH-bindendem Protein
ab, und die Konzentration an freiem (biologisch wirksamem) CRH steigt
an. Das stimuliert die ACTH-Freisetzung, auch in der fetalen
Nebenniere. CRH regt die Wehentätigkeit an, indem es das Myometrium gegenüber Prostaglandinen und Oxytozin sensibilisiert.
Die Plazenta produziert CRH
(identisch mit dem von der Hypophyse synthetisierten), vor allem in der
Spätschwangerschaft. Zu dieser Zeit, und vor allem zum Geburtstermin,
nimmt die Konzentration an CRH-bindendem Protein
ab, und die Konzentration an freiem (biologisch wirksamem) CRH steigt
an. Das stimuliert die ACTH-Freisetzung, auch in der fetalen
Nebenniere. CRH regt die Wehentätigkeit an, indem es das Myometrium gegenüber Prostaglandinen und Oxytozin sensibilisiert. Abbildung):
Abbildung):  Die ACTH-Werte
sinken zu Beginn der Schwangerschaft zunächst (vielleicht wegen der
veränderten Cortisol-, vielleicht auch Progesteronwerte) und steigen
dann leicht an, bis sie zum Ende der Schwangerschaft mehr als
verdoppelt sind (~50 pg/ml). ACTH stimuliert nicht nur die Cortisolbildung, sondern auch die fetoplazentare Östrogensynthese;
Östrogene steigern die Kontraktilität der Uterusmuskulatur (direkt und
indirekt).
Die ACTH-Werte
sinken zu Beginn der Schwangerschaft zunächst (vielleicht wegen der
veränderten Cortisol-, vielleicht auch Progesteronwerte) und steigen
dann leicht an, bis sie zum Ende der Schwangerschaft mehr als
verdoppelt sind (~50 pg/ml). ACTH stimuliert nicht nur die Cortisolbildung, sondern auch die fetoplazentare Östrogensynthese;
Östrogene steigern die Kontraktilität der Uterusmuskulatur (direkt und
indirekt). Der Cortisolspiegel steigt durch reduzierte Clearance auf ~40 µg/dl (GesamtCortisol; der größte Teil
wird an Transcortin gebunden). Cortisol bewirkt eine Ausreifung fetaler Systeme (Lunge, Gastrointestinaltrakt) und regt die CRH-Produktion in der Plazenta an, was eine positive
Rückkopplung auf die CRH-ACTH-Cortisol-Achse bedeutet. Plazentare 11ß-Dehydrogenase (Typ 2) verwandelt Cortisol zu inaktivem Cortison, was Mutter und Fetus vor überhöhten Cortisolspiegeln bewahrt.
Der Cortisolspiegel steigt durch reduzierte Clearance auf ~40 µg/dl (GesamtCortisol; der größte Teil
wird an Transcortin gebunden). Cortisol bewirkt eine Ausreifung fetaler Systeme (Lunge, Gastrointestinaltrakt) und regt die CRH-Produktion in der Plazenta an, was eine positive
Rückkopplung auf die CRH-ACTH-Cortisol-Achse bedeutet. Plazentare 11ß-Dehydrogenase (Typ 2) verwandelt Cortisol zu inaktivem Cortison, was Mutter und Fetus vor überhöhten Cortisolspiegeln bewahrt. Da
der mütterliche Glucocorticoidspiegel hoch ist, beschützt ein
enzymatischer Mechanismus der Plazenta den Fetus durch Konversion (11β-Dehydrogenase Isozym 2,
Da
der mütterliche Glucocorticoidspiegel hoch ist, beschützt ein
enzymatischer Mechanismus der Plazenta den Fetus durch Konversion (11β-Dehydrogenase Isozym 2,  Abbildung ganz oben).
Abbildung ganz oben).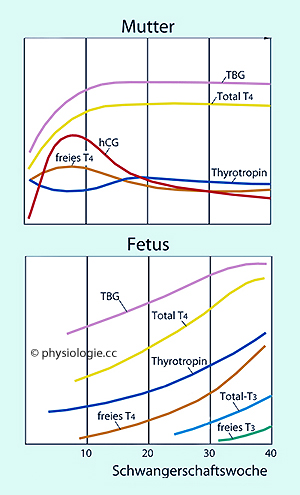
 Abbildung:
Schilddrüsenrelevante Hormone im Blut der Mutter (oben) und des Feten
(unten) als Funktion der Schwangerschaftsdauer
Abbildung:
Schilddrüsenrelevante Hormone im Blut der Mutter (oben) und des Feten
(unten) als Funktion der Schwangerschaftsdauer
 Choriongonadotropin
(hCG) aus der Plazenta wirkt wie LH und unterstützt die luteale
Sekretion von Östrogenen und Progesteron bis zur 12.
Schwangerschaftswoche (SSW). Es ist das wichtigste plazentare Peptidhormon.
Choriongonadotropin
(hCG) aus der Plazenta wirkt wie LH und unterstützt die luteale
Sekretion von Östrogenen und Progesteron bis zur 12.
Schwangerschaftswoche (SSW). Es ist das wichtigste plazentare Peptidhormon.  Plazentares Laktogen (hPL1 und hPL2), auch Chorionsomatomammotropin
(hCS1 und hCS2) genannt, wirkt ähnlich wie das strikturell verwandte
Somatotropin (hGH), das plazentare Wachstumshormon (pcGH) und
Prolaktin. Zusammen mit diesen regt es Wachstum und Milchproduktion der
Brustdrüsen an und koordiniert die Energieversorgung der
fetoplazentaren Einheit..
Plazentares Laktogen (hPL1 und hPL2), auch Chorionsomatomammotropin
(hCS1 und hCS2) genannt, wirkt ähnlich wie das strikturell verwandte
Somatotropin (hGH), das plazentare Wachstumshormon (pcGH) und
Prolaktin. Zusammen mit diesen regt es Wachstum und Milchproduktion der
Brustdrüsen an und koordiniert die Energieversorgung der
fetoplazentaren Einheit..  Die hohen Östrogenspiegel steigern intensiv die Sekretion von Prolaktin
aus der Hypophyse, deren Größe in der Schwangerschaft auf das Doppelte
zunimmt (zusätzliche lactotrope Zellen). Prolaktin fördert zusammen mit
Östrogenen und Progesteron das Brustdrüsenwachstum und die Ausbildung
der Milchgänge. Pränatale Milchsekretion wird durch hohe
Östrogenspiegel gehemmt.
Die hohen Östrogenspiegel steigern intensiv die Sekretion von Prolaktin
aus der Hypophyse, deren Größe in der Schwangerschaft auf das Doppelte
zunimmt (zusätzliche lactotrope Zellen). Prolaktin fördert zusammen mit
Östrogenen und Progesteron das Brustdrüsenwachstum und die Ausbildung
der Milchgänge. Pränatale Milchsekretion wird durch hohe
Östrogenspiegel gehemmt. Oxytozin
wird reflektorisch freigesetzt, wenn der Geburtskanal (unterer Uterus,
Zervix) durch den tiefertretenden Kopf des Babys gedehnt wird - das
unterstützt die Wehentätigkeit (Ferguson-Reflex).
Die Dehnung führt zu weiterer Steigerung der Oxytozinausschüttung
(positive Rückkopplung, Selbstverstärkung der Wehentätigkeit).
Oxytozin
wird reflektorisch freigesetzt, wenn der Geburtskanal (unterer Uterus,
Zervix) durch den tiefertretenden Kopf des Babys gedehnt wird - das
unterstützt die Wehentätigkeit (Ferguson-Reflex).
Die Dehnung führt zu weiterer Steigerung der Oxytozinausschüttung
(positive Rückkopplung, Selbstverstärkung der Wehentätigkeit).  Der Serumspiegel der Schilddrüsenhormone
folgt spezifischen Mustern (
Der Serumspiegel der Schilddrüsenhormone
folgt spezifischen Mustern ( Abbildung).
Östriol regt in der Leber die Synthese zusätzlichen thyroxinbindenden
Globulins (TBG) an, so kann mehr T3/T4 gebunden werden. Negative
Rückkopplung erhöht darauf auch die Sekretion von Schilddrüsenhormon.
So nehmen nehmen
die TBG- und T4-Werte
im Blut der Mutter im ersten Trimenon bis auf das Doppelte zu - bei
gleichbleibender Konzentration an freiem (ungebundenem) Hormon, da die Produktion an Thyroxinbindendem Globulin (TBG) ebenfalls ansteigt - und
bleiben erhöht, während alle einschlägigen Hormonwerte beim Feten im
Verlauf der Schwangerschaft bis zum Termin fortlaufend ansteigen. hCG
stimuliert die Produktion der Schilddrüsenhormone, und der Jodbedarf nimmt zu (über die Folgen eines Jodmangels
Abbildung).
Östriol regt in der Leber die Synthese zusätzlichen thyroxinbindenden
Globulins (TBG) an, so kann mehr T3/T4 gebunden werden. Negative
Rückkopplung erhöht darauf auch die Sekretion von Schilddrüsenhormon.
So nehmen nehmen
die TBG- und T4-Werte
im Blut der Mutter im ersten Trimenon bis auf das Doppelte zu - bei
gleichbleibender Konzentration an freiem (ungebundenem) Hormon, da die Produktion an Thyroxinbindendem Globulin (TBG) ebenfalls ansteigt - und
bleiben erhöht, während alle einschlägigen Hormonwerte beim Feten im
Verlauf der Schwangerschaft bis zum Termin fortlaufend ansteigen. hCG
stimuliert die Produktion der Schilddrüsenhormone, und der Jodbedarf nimmt zu (über die Folgen eines Jodmangels  s. dort).
s. dort).  Calcium und Parathormon.
Die Mutter verliert viel Calcium an den wachsenden Fetus - der
Serumspiegel an ionisiertem Calcium nimmt in der Schwangerschaft ab -
und kann dies
nicht vollständig durch gesteigerte Resorption aus der Nahrung
kompensieren. Der sinkende Ca++-Spiegel führt zu verstärkter Sekretion von Parathormon.
Dieses mobilisiert Calcium aus dem mütterlichen Skelettsystem (die
Resorption von Knochensubstanz nimmt zu), in den Nieren steigt die
Rückresorption von Ca++, und Vitamin D wird aktiviert - der Blutspiegel an 1,25(OH2D3 nimmt in der Schwangerschaft zu.
Calcium und Parathormon.
Die Mutter verliert viel Calcium an den wachsenden Fetus - der
Serumspiegel an ionisiertem Calcium nimmt in der Schwangerschaft ab -
und kann dies
nicht vollständig durch gesteigerte Resorption aus der Nahrung
kompensieren. Der sinkende Ca++-Spiegel führt zu verstärkter Sekretion von Parathormon.
Dieses mobilisiert Calcium aus dem mütterlichen Skelettsystem (die
Resorption von Knochensubstanz nimmt zu), in den Nieren steigt die
Rückresorption von Ca++, und Vitamin D wird aktiviert - der Blutspiegel an 1,25(OH2D3 nimmt in der Schwangerschaft zu. Prostaglandin F2α und Oxytozin
steigern die Öffnungswahrscheinlichkeit von Typ-L-Calciumkanälen bei
Depolarisation der Uterusmuskulatur und unterstützen so die
Wehentätigkeit. Umgekehrt fördert Dehnung der Uteruswand die Prostaglandinbildung. Die Prostaglandine E2 und F2 (und andere Zytokine) erhöhen die uterine Motilität und verstärken die Wehentätigkeit.
Prostaglandin F2α und Oxytozin
steigern die Öffnungswahrscheinlichkeit von Typ-L-Calciumkanälen bei
Depolarisation der Uterusmuskulatur und unterstützen so die
Wehentätigkeit. Umgekehrt fördert Dehnung der Uteruswand die Prostaglandinbildung. Die Prostaglandine E2 und F2 (und andere Zytokine) erhöhen die uterine Motilität und verstärken die Wehentätigkeit. Thrombinzeit ~19 → ~22 s
Thrombinzeit ~19 → ~22 s
 Fibrinogen ~ 2,6 → 4,7 g/l (+80%)
Fibrinogen ~ 2,6 → 4,7 g/l (+80%)
 Faktor VII ~ +80%
Faktor VII ~ +80%
 Faktor X und XII ~ +50%
Faktor X und XII ~ +50%
 Plasminogen ~ +40%
Plasminogen ~ +40%
 Protein C ~ -20%
Protein C ~ -20%
 Protein S -30% (verringerte antikoagulatorische Wirkung!)
Protein S -30% (verringerte antikoagulatorische Wirkung!) Die Haut
neigt bei 9 von 10 Schwangeren zu vermehrter Pigmenteinlagerung (chloasma uterinum
Die Haut
neigt bei 9 von 10 Schwangeren zu vermehrter Pigmenteinlagerung (chloasma uterinum  ),
deren Ursache vermutlich in einer Kombination erhöhter Spiegel an MSH, Östrogenen, Progesteron und ß-Endorphin besteht. Die Hyperpigmentierung manifestiert sich an den Brustwarzen, im Vulva-
und Analbereich, der Mittellinie oberhalb und unterhalb
des Nabels (linea
fusca
),
deren Ursache vermutlich in einer Kombination erhöhter Spiegel an MSH, Östrogenen, Progesteron und ß-Endorphin besteht. Die Hyperpigmentierung manifestiert sich an den Brustwarzen, im Vulva-
und Analbereich, der Mittellinie oberhalb und unterhalb
des Nabels (linea
fusca  : dunkle Färbung der linea alba), sowie als braune
schmetterlingsähnliche Färbung des Gesichts. Die Schweißsekretion
nimmt zu, die Haut ist stark durchblutet (warme Hände).
: dunkle Färbung der linea alba), sowie als braune
schmetterlingsähnliche Färbung des Gesichts. Die Schweißsekretion
nimmt zu, die Haut ist stark durchblutet (warme Hände).  Das Bindegewebe neigt zu Einrissen an
Brust, Bauchdecken, Gesäß und Oberschenkeln: Striae
gravidarum - vor der Geburt blau, dann weißlich (regelmäßige Massage als Prophylaxe!).
Das Bindegewebe neigt zu Einrissen an
Brust, Bauchdecken, Gesäß und Oberschenkeln: Striae
gravidarum - vor der Geburt blau, dann weißlich (regelmäßige Massage als Prophylaxe!). Das Fettgewebe nimmt bei der graviden Frau meist um 4-8 kg zu; die Rückkehr zur normalen Fettmasse nach der Geburt benötigt etwa 6 Monate.
Das Fettgewebe nimmt bei der graviden Frau meist um 4-8 kg zu; die Rückkehr zur normalen Fettmasse nach der Geburt benötigt etwa 6 Monate. Dosierung von Pharmaka: Während der Schwangerschaft können Medikamente außer von der Leber der
Mutter auch von der Plazenta und (beginnend mit 6-8 Wochen) von der
fetalen Leber metabolisiert werden. Das kann zu einer erhöhten
Clearance von Arzneimitteln führen und Dosiserhöhungen notwendig machen.
Dosierung von Pharmaka: Während der Schwangerschaft können Medikamente außer von der Leber der
Mutter auch von der Plazenta und (beginnend mit 6-8 Wochen) von der
fetalen Leber metabolisiert werden. Das kann zu einer erhöhten
Clearance von Arzneimitteln führen und Dosiserhöhungen notwendig machen. Abbildung). Zur Erhaltung der Schwangerschaft sind die typisch stark erhöhten
Geschlechtshormonspiegel im Blut der Mutter notwendig (Progesteron,
Östrogene). Die Blutwerte gehen weit über die im Laufe des Zyklus
erreichten Spitzenwerte ("peaks") hinaus.
Abbildung). Zur Erhaltung der Schwangerschaft sind die typisch stark erhöhten
Geschlechtshormonspiegel im Blut der Mutter notwendig (Progesteron,
Östrogene). Die Blutwerte gehen weit über die im Laufe des Zyklus
erreichten Spitzenwerte ("peaks") hinaus. 
 Abbildung: Synthese von Geschlechtshormonen durch die feto-plazentare Einheit
Abbildung: Synthese von Geschlechtshormonen durch die feto-plazentare Einheit
 Plazenta: Transport- und Schrankenfunktion
Plazenta: Transport- und Schrankenfunktion  Plazentarer Stoffaustausch
Plazentarer Stoffaustausch Abbildung.
Abbildung. Trophoblastenzellen
umgeben sich mit einer Mucoproteinhülle, und sie verlieren nach der
Implantation viele ihrer MHC-Eigenschaften. Auf diese Weise verlieren
sie an Immunogenität.
Trophoblastenzellen
umgeben sich mit einer Mucoproteinhülle, und sie verlieren nach der
Implantation viele ihrer MHC-Eigenschaften. Auf diese Weise verlieren
sie an Immunogenität.  Durch die Chorion-Trennschicht können mütterliche Lymphozyten und Antikörper nur schwer in den fetalen Kreislauf gelangen.
Durch die Chorion-Trennschicht können mütterliche Lymphozyten und Antikörper nur schwer in den fetalen Kreislauf gelangen. Der
Dottersack bildet im Rahmen der Implantation immunsuppressive Stoffe
(α-Fetoprotein, Progesteron), die vor allem die zelluläre Immunität
supprimieren.
Der
Dottersack bildet im Rahmen der Implantation immunsuppressive Stoffe
(α-Fetoprotein, Progesteron), die vor allem die zelluläre Immunität
supprimieren. Das
Chorion fungiert als Barriere, die den Übertritt von Mikroorganismen
auf den Fetus verhindern kann. Allerdings können insbesondere Viren
diese Barriere überwinden und müssen dann via IgG der Mutter bekämpft
werden (für diese Immunglobulinklasse ist die Plazentarschranke
durchlässig).
Das
Chorion fungiert als Barriere, die den Übertritt von Mikroorganismen
auf den Fetus verhindern kann. Allerdings können insbesondere Viren
diese Barriere überwinden und müssen dann via IgG der Mutter bekämpft
werden (für diese Immunglobulinklasse ist die Plazentarschranke
durchlässig).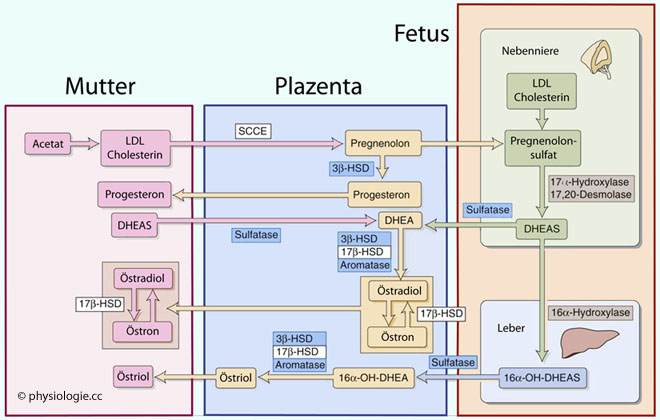
 Abbildung: Zusammenwirken von Plazenta, mütterlichem und fetalem Organismus bei der Synthese von Geschlechtshormonen
Abbildung: Zusammenwirken von Plazenta, mütterlichem und fetalem Organismus bei der Synthese von Geschlechtshormonen
 Abbildung unten) und dann durch Orifizien in der Basalplatte in
venöse Abflüsse. Das fetale
Blut strömt (desoxygeniert) über die Nabelarterien durch die
Chorionplatte zu Chorionzotten, durch kapilläre Netzwerke und über die
Nabelvene (oxygeniert) zum Feten.
Abbildung unten) und dann durch Orifizien in der Basalplatte in
venöse Abflüsse. Das fetale
Blut strömt (desoxygeniert) über die Nabelarterien durch die
Chorionplatte zu Chorionzotten, durch kapilläre Netzwerke und über die
Nabelvene (oxygeniert) zum Feten. (am Ende der Schwangerschaft ca. 1 Liter) erfüllt
mehrere Aufgaben: Sie bietet dem Feten mechanischen Schutz vor äußeren
Kräften, erlaubt ihm gleichzeitig freie Beweglichkeit, dient der
Ausscheidung von metabolischen Endprodukten (vor allem Harnstoff),
nimmt Hautschuppen und Haare des Feten auf und enthält auch etwas
Kohlenhydrate und Proteine. Sie wird von Feten "geatmet" und geschluckt.
(am Ende der Schwangerschaft ca. 1 Liter) erfüllt
mehrere Aufgaben: Sie bietet dem Feten mechanischen Schutz vor äußeren
Kräften, erlaubt ihm gleichzeitig freie Beweglichkeit, dient der
Ausscheidung von metabolischen Endprodukten (vor allem Harnstoff),
nimmt Hautschuppen und Haare des Feten auf und enthält auch etwas
Kohlenhydrate und Proteine. Sie wird von Feten "geatmet" und geschluckt.
 Chorion-Gonadotropin (hCG, human Chorion-Gonadotropin) ist ein Glykoprotein, bestehend aus einem α-Glykoprotein (α-glykoprotein subunit, α-GSU)
und einer hormonspezifischen ß-Untereinheit (ß-hCG), die durch
Nachweisantikörper erkannt wird (Schwangerschaftstests). Das Hormon
bindet mit hoher Affinität an LH-Rezeptoren. hCG aus der frühen Plazenta verhindert aufgrund seiner LH-Wirkung die Abstoßung der eingenisteten Blastenzellen.
hCG wird vor allem während des ersten Trimenons gebildet (
Chorion-Gonadotropin (hCG, human Chorion-Gonadotropin) ist ein Glykoprotein, bestehend aus einem α-Glykoprotein (α-glykoprotein subunit, α-GSU)
und einer hormonspezifischen ß-Untereinheit (ß-hCG), die durch
Nachweisantikörper erkannt wird (Schwangerschaftstests). Das Hormon
bindet mit hoher Affinität an LH-Rezeptoren. hCG aus der frühen Plazenta verhindert aufgrund seiner LH-Wirkung die Abstoßung der eingenisteten Blastenzellen.
hCG wird vor allem während des ersten Trimenons gebildet ( Abbildung oben) und steigert die Progesteronsynthese im corpus luteum.
Abbildung oben) und steigert die Progesteronsynthese im corpus luteum.| hCG (Choriongonadotropin aus der feto-plazentaren Einheit) fördert die Progesteronsynthese |
 Zur Wirkung der Gonadotropine s. dort
Zur Wirkung der Gonadotropine s. dort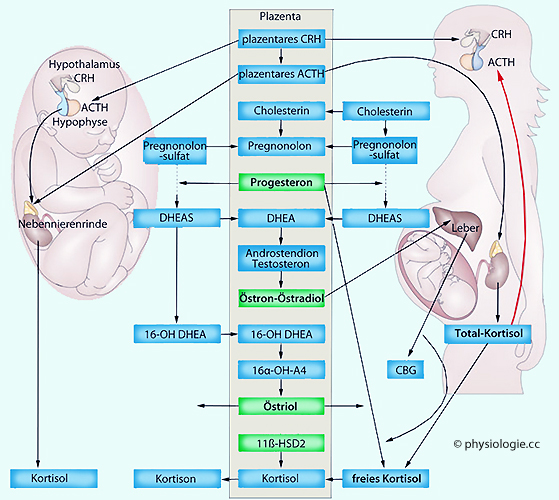
 Abbildung: Feto-plazentare Einheit
Abbildung: Feto-plazentare Einheit CRH, Corticoliberin
CRH, Corticoliberin  DHEA, Dehydroepiandrosteron
DHEA, Dehydroepiandrosteron  DHEAS, Dehydroepiandrosteronsulfat
DHEAS, Dehydroepiandrosteronsulfat
 / Fetus
/ Fetus  und Plazenta eine funktionelle Gesamtheit, die feto-plazentare Einheit (
und Plazenta eine funktionelle Gesamtheit, die feto-plazentare Einheit ( Abbildung).
Diese ist zum Teil komplementär organisiert, ihre Komponenten können sich bei metabolischen Aufgaben ergänzen.
Abbildung).
Diese ist zum Teil komplementär organisiert, ihre Komponenten können sich bei metabolischen Aufgaben ergänzen. Die Plazenta bildet zahlreiche Hormone, was für den Erhalt der
Gravidität wichtig ist:
Die Plazenta bildet zahlreiche Hormone, was für den Erhalt der
Gravidität wichtig ist: Peptidhormone wie hCG, glandotrope Hormone, Endorphine, Oxytozin, und (auch vom corpus luteum synthetisierte) Relaxine, die - über Wirkung an Relaxinrezeptoren
(beim Menschen 4 bekannt) - bei der Geburt den Uterushals durch
Nachgeben des Bandapparates entspannen und so den Geburtskanal
erweitern. Relaxine erhöhen auch das Herzminutenvolumen, die Nierendurchblutung und die arterielle Compliance.
Peptidhormone wie hCG, glandotrope Hormone, Endorphine, Oxytozin, und (auch vom corpus luteum synthetisierte) Relaxine, die - über Wirkung an Relaxinrezeptoren
(beim Menschen 4 bekannt) - bei der Geburt den Uterushals durch
Nachgeben des Bandapparates entspannen und so den Geburtskanal
erweitern. Relaxine erhöhen auch das Herzminutenvolumen, die Nierendurchblutung und die arterielle Compliance. Plazentares Laktogen (hPL) - auch human chorionic somatomammotropin
(HCS) genannt - wirkt ähnlich wie Wachstumshormon und Prolactin, und fördert
Differenzierung und beginnende Milchbildung in der Brustdrüse. Die
hPL-Bildung beginnt erst, wenn die Schwangerschaft gesichert ist.
Plazentares Laktogen (hPL) - auch human chorionic somatomammotropin
(HCS) genannt - wirkt ähnlich wie Wachstumshormon und Prolactin, und fördert
Differenzierung und beginnende Milchbildung in der Brustdrüse. Die
hPL-Bildung beginnt erst, wenn die Schwangerschaft gesichert ist. Cortisol spielt eine führende Rolle für die Synthese von Surfactant
in der fetalen Lunge - zusammen mit Wachstumsfaktoren wie EGF,
Schilddrüsenhormonen, Prolactin. Mit der 24. SSW beginnen
Typ-II-Pneumozyten mit der Produktion von Surfactant; etwa ab der 32.
SSW stimuliert Cortisol in den
Pneumozyten mehrere Enzyme zur Produktion des Surfactant, was die Lunge
dehnungsfähiger macht und für die postnatale Entfaltung der Lunge entscheidend ist. Produktion und Blutspiegel fetalen
Cortisols nehmen ab dem ersten Trimenon bis vor der Geburt stetig zu;
es stellt etwa 2/3 des Cortisols im fetalen Blut, 1/3 kommt von der
Mutter.
Cortisol spielt eine führende Rolle für die Synthese von Surfactant
in der fetalen Lunge - zusammen mit Wachstumsfaktoren wie EGF,
Schilddrüsenhormonen, Prolactin. Mit der 24. SSW beginnen
Typ-II-Pneumozyten mit der Produktion von Surfactant; etwa ab der 32.
SSW stimuliert Cortisol in den
Pneumozyten mehrere Enzyme zur Produktion des Surfactant, was die Lunge
dehnungsfähiger macht und für die postnatale Entfaltung der Lunge entscheidend ist. Produktion und Blutspiegel fetalen
Cortisols nehmen ab dem ersten Trimenon bis vor der Geburt stetig zu;
es stellt etwa 2/3 des Cortisols im fetalen Blut, 1/3 kommt von der
Mutter.  Weiters bilden plazentare Zellen Geschlechtshormone, Monoamine
(Katecholamine, Serotonin u.a.) sowie zahlreiche Neuropeptide (Tabelle).
Weiters bilden plazentare Zellen Geschlechtshormone, Monoamine
(Katecholamine, Serotonin u.a.) sowie zahlreiche Neuropeptide (Tabelle).  Von der Plazenta produzierte Neuropeptide und Hormone  Modifiziert nach Wilkinson / Brown, An Introduction to Neuroendocrinology, 2nd ed. 2015. Cambridge University Press |
|||
| Neuropeptide |
Peptidhormone |
Steroide |
Monoamine |
| CRH TRH GnRH Melatonin Cholecystokinin Metenkephalin Dynorphin Neurotensin VIP Galanin Somatostatin CGRP Neuropeptid Y Substanz P Endothelin ANP Angiotensin Urocortin |
hCG ACTH TSH SH hPL Inhibin LH FSH ß-Endorphin Prolaktin Oxytozin Leptin Activin Follistatin Relaxin |
Progesteron Östradiol Östron Ostriol Pregnenolon u.a. |
Adrenalin Noradrenalin Dopamin Serotonin Adrenomedullin |
 Progesteron: Der Synzytiotrophoblast exprimiert CYP11A1 und eine plazentaspezifische Dehydrogenase (3ß-HSD1), Enzyme, die zur Progesteronbildung benötigt werden. Auch verfügen diese Zellen über LDL-Rezeptoren,
was für die Aufnahme von Cholesterin aus dem Blut der Mutter gebraucht
wird. Das hier synthetisierte Progesteron gelangt in den Kreislauf der
Mutter und stellt das Myometrium ruhig (wichtig für einen ungestörten
Schwangerschaftsverlauf). Auch wirkt es auf die Brust (Wachstum,
Differenzierung) und regt später die fetale Cortisolbildung an.
Progesteron: Der Synzytiotrophoblast exprimiert CYP11A1 und eine plazentaspezifische Dehydrogenase (3ß-HSD1), Enzyme, die zur Progesteronbildung benötigt werden. Auch verfügen diese Zellen über LDL-Rezeptoren,
was für die Aufnahme von Cholesterin aus dem Blut der Mutter gebraucht
wird. Das hier synthetisierte Progesteron gelangt in den Kreislauf der
Mutter und stellt das Myometrium ruhig (wichtig für einen ungestörten
Schwangerschaftsverlauf). Auch wirkt es auf die Brust (Wachstum,
Differenzierung) und regt später die fetale Cortisolbildung an. Östrogene:
Der Synzytiotrophoblast verfügt nicht über das Enzym CYP17 und benötigt
daher für die Östrogensynthese metabolische Zwischenschritte (über
DHEAS,
Östrogene:
Der Synzytiotrophoblast verfügt nicht über das Enzym CYP17 und benötigt
daher für die Östrogensynthese metabolische Zwischenschritte (über
DHEAS,  Abbildung oben) im Feten (androgenproduzierende Zellen in
den Nebennierenrinde). Aus diesem Grund spricht man von einer
feto-plazentaren Einheit. Die DHEAS-Produktion der fetalen Nebenniere
ist gegen Ende des ersten Trimenons völlig von fetalem ACTH abhängig.
Abbildung oben) im Feten (androgenproduzierende Zellen in
den Nebennierenrinde). Aus diesem Grund spricht man von einer
feto-plazentaren Einheit. Die DHEAS-Produktion der fetalen Nebenniere
ist gegen Ende des ersten Trimenons völlig von fetalem ACTH abhängig. hat bei der Geburt eine Austauschoberfläche von ~11 m2.
Stoffe passieren die Chorionzotten über Diffusion (Atemgase, Wasser,
Elektrolyte), Transporter (Glucose, Aminosäuren etc) und Pinozytose
(Proteine).
hat bei der Geburt eine Austauschoberfläche von ~11 m2.
Stoffe passieren die Chorionzotten über Diffusion (Atemgase, Wasser,
Elektrolyte), Transporter (Glucose, Aminosäuren etc) und Pinozytose
(Proteine).  ist die am weitesten außen liegende Membran, die den Feten umhüllt und
den fetalen vom mütterlichen Gewebe separiert. Zusammen mit dem Amnion (das
zusammen mit der Amnionflüssigkeit den Embryo schützt) bildet es den
Amnionsack, in dem sich der Fetus relativ frei bewegen kann.
ist die am weitesten außen liegende Membran, die den Feten umhüllt und
den fetalen vom mütterlichen Gewebe separiert. Zusammen mit dem Amnion (das
zusammen mit der Amnionflüssigkeit den Embryo schützt) bildet es den
Amnionsack, in dem sich der Fetus relativ frei bewegen kann.
 Abbildung: Plazenta
Abbildung: Plazenta
 Abbildung).
Abbildung).  Abbildung) stellt
keine absolute Barriere gegenüber Wirkstoffen physiologischer,
pharmakologischer oder toxischer Natur dar; der Fetus ist z.B.
gegenüber Medikamenten, die der Mutter verabreicht wurden, mehr oder
weniger exponiert. Das Blut des Feten ist saurer (pH 7,0-7,2) als das
der Mutter, sodass basische Pharmaka auf der fetalen Seite angereichert
werden (Ionenfalle, ion trapping).
Abbildung) stellt
keine absolute Barriere gegenüber Wirkstoffen physiologischer,
pharmakologischer oder toxischer Natur dar; der Fetus ist z.B.
gegenüber Medikamenten, die der Mutter verabreicht wurden, mehr oder
weniger exponiert. Das Blut des Feten ist saurer (pH 7,0-7,2) als das
der Mutter, sodass basische Pharmaka auf der fetalen Seite angereichert
werden (Ionenfalle, ion trapping).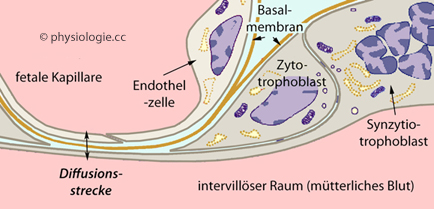
 Abbildung: Plazentarschranke
Abbildung: Plazentarschranke
| Die O2-Sättigung des fetalen Blutes ist in der Umbilikalvene am höchsten |
 Abbildung oben):
Abbildung oben):  Den verzweigten Chorionzotten
mit umbilikalen Blutgefäßen und einer Hülle aus Synzytiotrophoblasten,
die an den feinsten Aufzweigungen eine flache einzellige Schichte
bilden, durch die Stoffe zwischen dem Blut der Mutter und dem des Embry
bzw. Feten ausgetauscht werden (plazentare, "vaskulo-synzytiale" Membran)
Den verzweigten Chorionzotten
mit umbilikalen Blutgefäßen und einer Hülle aus Synzytiotrophoblasten,
die an den feinsten Aufzweigungen eine flache einzellige Schichte
bilden, durch die Stoffe zwischen dem Blut der Mutter und dem des Embry
bzw. Feten ausgetauscht werden (plazentare, "vaskulo-synzytiale" Membran) Dem intervillösen Raum, in den mütterliches Blut durch Spiralarterien einströmt und aus dem es durch endometrielle Venen abfließt
Dem intervillösen Raum, in den mütterliches Blut durch Spiralarterien einströmt und aus dem es durch endometrielle Venen abfließt Der Dezidua basalis.
Diese zytotrophoblastische "Schale" sitzt dem Myometrium auf und bildet
die Basis für plazentare Septen, welche die intervillösen Räume (in
diese "tauchen" die Chorionzotten ein) begrenzen. Die decidua basalis
bildet die Matrix für die mütterlichen Gefäße: durch sie winden sich
Spiralarterien (Zufluss) einerseits, endometriale Venen (Abfluss) andererseits.
Der Dezidua basalis.
Diese zytotrophoblastische "Schale" sitzt dem Myometrium auf und bildet
die Basis für plazentare Septen, welche die intervillösen Räume (in
diese "tauchen" die Chorionzotten ein) begrenzen. Die decidua basalis
bildet die Matrix für die mütterlichen Gefäße: durch sie winden sich
Spiralarterien (Zufluss) einerseits, endometriale Venen (Abfluss) andererseits. Welche Faktoren beeinflussen die Sauerstoffversorgung des Feten? Es sind dies die O2-Verfügbarkeit auf der mütterlichen Seite, der Transfer über die Plazentarschranke und die fetale Transportkapazität:
Welche Faktoren beeinflussen die Sauerstoffversorgung des Feten? Es sind dies die O2-Verfügbarkeit auf der mütterlichen Seite, der Transfer über die Plazentarschranke und die fetale Transportkapazität: Sauerstoffgradient. Das intervillöse Blut hat einen pO2 von ~6,7 kPa, das fetale Nabelschnurblut von ~2,7 kPa - der Gradient beträgt daher etwa 4 kPa (30 mmHg).
Sauerstoffgradient. Das intervillöse Blut hat einen pO2 von ~6,7 kPa, das fetale Nabelschnurblut von ~2,7 kPa - der Gradient beträgt daher etwa 4 kPa (30 mmHg). Bindungsaffinität.
Fetales Hämoglobin bindet Sauerstoff wesentlich stärker als adultes
(maternales) und nimmt den Sauerstoff bei Partialdrucken auf, bei denen
HbA diesen bereits abdissoziiert. Die Plazenta produziert außerdem
2,3-DPG, das die Bindungskurve von HbA (nicht aber HbF) nach rechts
verschiebt (Abbildungen).
Bindungsaffinität.
Fetales Hämoglobin bindet Sauerstoff wesentlich stärker als adultes
(maternales) und nimmt den Sauerstoff bei Partialdrucken auf, bei denen
HbA diesen bereits abdissoziiert. Die Plazenta produziert außerdem
2,3-DPG, das die Bindungskurve von HbA (nicht aber HbF) nach rechts
verschiebt (Abbildungen).  Doppelter Bohr-Effekt.
Doppelter Bohr-Effekt.  Fetus: Mit sinkendem pCO2 verschiebt sich die HbF-Bindungskurve nach links - Sauerstoff wird noch stärker gebunden.
Fetus: Mit sinkendem pCO2 verschiebt sich die HbF-Bindungskurve nach links - Sauerstoff wird noch stärker gebunden. Mutter: Mit steigendem pCO2 verschiebt sich die HbA-Bindungskurve nach rechts - Sauerstoff wird noch besser an den Feten abgegeben.
Mutter: Mit steigendem pCO2 verschiebt sich die HbA-Bindungskurve nach rechts - Sauerstoff wird noch besser an den Feten abgegeben.  der doppelte Haldane.Effekt:
der doppelte Haldane.Effekt: Mutter: Wird HbA desoxygeniert, steigt seine CO2-Bindungskapazität, mütterliches Blut kann kann mehr CO2 aufnehmen
Mutter: Wird HbA desoxygeniert, steigt seine CO2-Bindungskapazität, mütterliches Blut kann kann mehr CO2 aufnehmen Fetus: Wird HbF oxygeniert, sinkt seine CO2-Bindungskapazität, fetales Blut kann mehr CO2 abgeben
Fetus: Wird HbF oxygeniert, sinkt seine CO2-Bindungskapazität, fetales Blut kann mehr CO2 abgeben
 Abbildung: Sauerstoffbindungskurve HbA und HbF
Abbildung: Sauerstoffbindungskurve HbA und HbF
 Abbildung oben), d.h. bei ein und demselben Partialdruck wandert
Sauerstoff vom mütterlichen in das fetale Blut und steht dem Fetus (der
an relativ hypoxische Bedingungen angepasst ist) zur Verfügung. So ist
das mütterliche Blut bei einem pO2 von 30 mmHg (mit diesem Partialdruck verlässt das Blut den intervillösen Raum) nur zu 57% sauerstoffgesättigt, während das Blut des Feten bei diesem pO2 noch zu 85% gesättigt ist (Tabelle) und mit dieser "Ausbeute" via Nabelvene in den fetalen Kreislauf
einmündet. Dazu kommt noch ein Anstieg der fetalen
Hämoglobinkonzentration, die pränatal um ~50% über dem Normwert von
Erwachsenen liegt.
Abbildung oben), d.h. bei ein und demselben Partialdruck wandert
Sauerstoff vom mütterlichen in das fetale Blut und steht dem Fetus (der
an relativ hypoxische Bedingungen angepasst ist) zur Verfügung. So ist
das mütterliche Blut bei einem pO2 von 30 mmHg (mit diesem Partialdruck verlässt das Blut den intervillösen Raum) nur zu 57% sauerstoffgesättigt, während das Blut des Feten bei diesem pO2 noch zu 85% gesättigt ist (Tabelle) und mit dieser "Ausbeute" via Nabelvene in den fetalen Kreislauf
einmündet. Dazu kommt noch ein Anstieg der fetalen
Hämoglobinkonzentration, die pränatal um ~50% über dem Normwert von
Erwachsenen liegt.| Der Sauerstoffpartialdruck ist im fetalem Blut niedriger als im Blut der Mutter |
| Hämatokrit, Ery-Zahl und Hb-Konzentration sind bei Feten höher als bei Erwachsenen |
 Abbildung).
Abbildung).
| 2,3-DPG beeinflusst die Sauerstoffbindung am fetalen Hämoglobin nur geringgradig |
| pO2 (mmHg) |
Hämoglobin- Sättigung (%) | pCO2 (mmHg) |
||
| Mütterliche Seite |
Uterine Arterien | ~100 |
97-98 | 32 |
| Intervillöser Raum | 30-35 |
57-67 | ||
| Uterine Venen |
~30 |
~57 | 43 |
|
| Fetale Seite |
Nabelarterien |
~20 |
~25 | 48 |
| Nabelvene |
~30 |
~85 | 43 |
|
| Die Hämoglobinkonzentration ist bei der Mutter im letzten Schwangerschaftsdrittel niedriger als beim Feten |
 Diffusion (Gase, Harnstoff, Steroide, Kreatinin, Lipide)
Diffusion (Gase, Harnstoff, Steroide, Kreatinin, Lipide)  Erleichterte Diffusion mittels Transportproteinen (z.B. Glucose: Insulin-unabhängig über GLUT1, GLUT3)
Erleichterte Diffusion mittels Transportproteinen (z.B. Glucose: Insulin-unabhängig über GLUT1, GLUT3) Aktiver Transport mittels Transportproteinen (z.B. Elektrolyte)
Aktiver Transport mittels Transportproteinen (z.B. Elektrolyte) Sekundär aktiver Transport mittels Transportproteinen (z.B. Aminosäuren)
Sekundär aktiver Transport mittels Transportproteinen (z.B. Aminosäuren) Pinozytose
(rezeptor-mediierte Endozytose, z.B. IgG, Insulin, Transferrin, LDL) / Transzytose. So verleiht die Mutter über ihre
Antikörper vom Typ IgG dem fetalen Organismus einen adaptiven
Immunschutz (der die aktuellen mikrobiellen Herausforderungen
widerspiegelt) - dieser Schutz hält dann noch einige Monate nach der
Geburt an, bis das Baby seine eigene spezifische Immunprotektion
aufgebaut hat. So können unter Umständen (Rhesus-Inkompatibilität) auch
Isoagglutinine des Typs Anti-D über die Plazentarschranke gelangen - solche der AB-Blutgruppen (Typ IgM) nicht.
Pinozytose
(rezeptor-mediierte Endozytose, z.B. IgG, Insulin, Transferrin, LDL) / Transzytose. So verleiht die Mutter über ihre
Antikörper vom Typ IgG dem fetalen Organismus einen adaptiven
Immunschutz (der die aktuellen mikrobiellen Herausforderungen
widerspiegelt) - dieser Schutz hält dann noch einige Monate nach der
Geburt an, bis das Baby seine eigene spezifische Immunprotektion
aufgebaut hat. So können unter Umständen (Rhesus-Inkompatibilität) auch
Isoagglutinine des Typs Anti-D über die Plazentarschranke gelangen - solche der AB-Blutgruppen (Typ IgM) nicht.| Stoffaustausch zwischen fetalem und mütterlichem Kreislauf Nach Carlson BM, Human Embryology and Developmental Biology, 7th ed. 2024 |
|
| Von Mutter zu Fetus |
Von Fetus zu Mutter |
| Sauerstoff Wasser Elektrolyte Nährstoffe Hormone Antikörper Vitamine Spurenelemente Medikamente / Giftstoffe |
Kohlendioxid Wasser Elektrolyte Harnstoff Harnsäure Kreatinin Bilirubin Hormone Ery-Antigene |
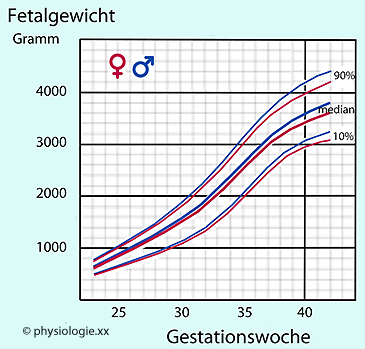
 Abbildung:
Fetales Körpergewicht als Funktion des Gestationsalters
Abbildung:
Fetales Körpergewicht als Funktion des Gestationsalters
 Das embryonale Herz
beginnt mit der 3.-4. SSW zu schlagen.
Das embryonale Herz
beginnt mit der 3.-4. SSW zu schlagen. Ab der 5. SSW treten reaktive Bewegungen auf Berührungsreize im Gesichtsbereich auf, d.h. der Tastsinn ist bereits entwickelt.
Ab der 5. SSW treten reaktive Bewegungen auf Berührungsreize im Gesichtsbereich auf, d.h. der Tastsinn ist bereits entwickelt.  Mit der 8. SSW bildet der Fetus Leukozyten
(Thymus,
Milz - das rote Knochenmark wird erst später zur Hauptbildungsttätte
der weißen Blutkörperchen). Mit der 12. SSW beginnt der
Fetus mit der Produktion von Insulin.
Mit der 8. SSW bildet der Fetus Leukozyten
(Thymus,
Milz - das rote Knochenmark wird erst später zur Hauptbildungsttätte
der weißen Blutkörperchen). Mit der 12. SSW beginnt der
Fetus mit der Produktion von Insulin.  Ab der 15. SSW beginnt der Fetus, an seinem Daumen zu saugen (schon
vorher berührt er Gesicht und Kopf und übt dadurch die Haptik), was als
Training für die später lebensnotwendige Motorik der Nahrungsaufnahme
(Stillen!) von großer Bedeutung ist. Zu diesem Zeitpunkt arbeitet das
taktile System bereits, alle anderen Sinnessysteme funktionieren noch
nicht.
Ab der 15. SSW beginnt der Fetus, an seinem Daumen zu saugen (schon
vorher berührt er Gesicht und Kopf und übt dadurch die Haptik), was als
Training für die später lebensnotwendige Motorik der Nahrungsaufnahme
(Stillen!) von großer Bedeutung ist. Zu diesem Zeitpunkt arbeitet das
taktile System bereits, alle anderen Sinnessysteme funktionieren noch
nicht. 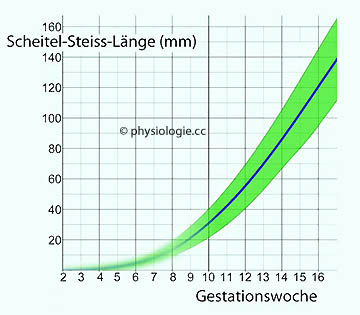
 Abbildung: Körpergröße des Feten (Scheitel-Steiss-Länge, crown-rump length) als Funktion des Alters (Schwangerschaftswoche)
Abbildung: Körpergröße des Feten (Scheitel-Steiss-Länge, crown-rump length) als Funktion des Alters (Schwangerschaftswoche)
 Die - in der 13.-16. SSW entstehende - Lanugobehaarung
trägt sensible Rezeptoren, sodass der Fetus durch Bewegungen des
Fruchtwassers ständig neuronal stimuliert wird - und damit die
Entwicklung des Nervensystems.
Die - in der 13.-16. SSW entstehende - Lanugobehaarung
trägt sensible Rezeptoren, sodass der Fetus durch Bewegungen des
Fruchtwassers ständig neuronal stimuliert wird - und damit die
Entwicklung des Nervensystems. Ab Woche 18 öffnet und schließt der Fetus seinen Mund und
verschluckt
Fruchtwasser, der Geschmackssinn beginnt zu funktionieren, das
Verdauungssystem entwickelt sich weiter.
Ab Woche 18 öffnet und schließt der Fetus seinen Mund und
verschluckt
Fruchtwasser, der Geschmackssinn beginnt zu funktionieren, das
Verdauungssystem entwickelt sich weiter.  Die neokortikalen Neuronen entwickeln sich vor allem zwischen der 5. und 20. SSW (vgl. dort). Die Großhirnrinde kann ab
der 20. SSW Erfahrungen (unterbewusst) abspeichern.
Die neokortikalen Neuronen entwickeln sich vor allem zwischen der 5. und 20. SSW (vgl. dort). Die Großhirnrinde kann ab
der 20. SSW Erfahrungen (unterbewusst) abspeichern. Die Lungenstruktur zeigt ab der 24. SSW Alveolen, diese
bilden ab der ~30. SSW Surfactant - wenn auch noch nicht ausreichend,
um bei Frühgeburt ohne Probleme atmen zu können (
Die Lungenstruktur zeigt ab der 24. SSW Alveolen, diese
bilden ab der ~30. SSW Surfactant - wenn auch noch nicht ausreichend,
um bei Frühgeburt ohne Probleme atmen zu können ( s. dort).
s. dort). Ab der ~25. Woche ist das Gehörorgan
so weit ausgebildet, dass der
Fetus Herzschlag und Atemgeräusche der Mutter wahrnehmen kann, und der
Fetus kann Töne bis zu einer Frequenz von 300 Hz wahrnehmen. Ab dem
7. Monat erkennt er die Stimme der Mutter.
Ab der ~25. Woche ist das Gehörorgan
so weit ausgebildet, dass der
Fetus Herzschlag und Atemgeräusche der Mutter wahrnehmen kann, und der
Fetus kann Töne bis zu einer Frequenz von 300 Hz wahrnehmen. Ab dem
7. Monat erkennt er die Stimme der Mutter.  In der 26. SSW ist das periphere Gehörsystem bereits voll ausgebildet.
In der 26. SSW ist das periphere Gehörsystem bereits voll ausgebildet.
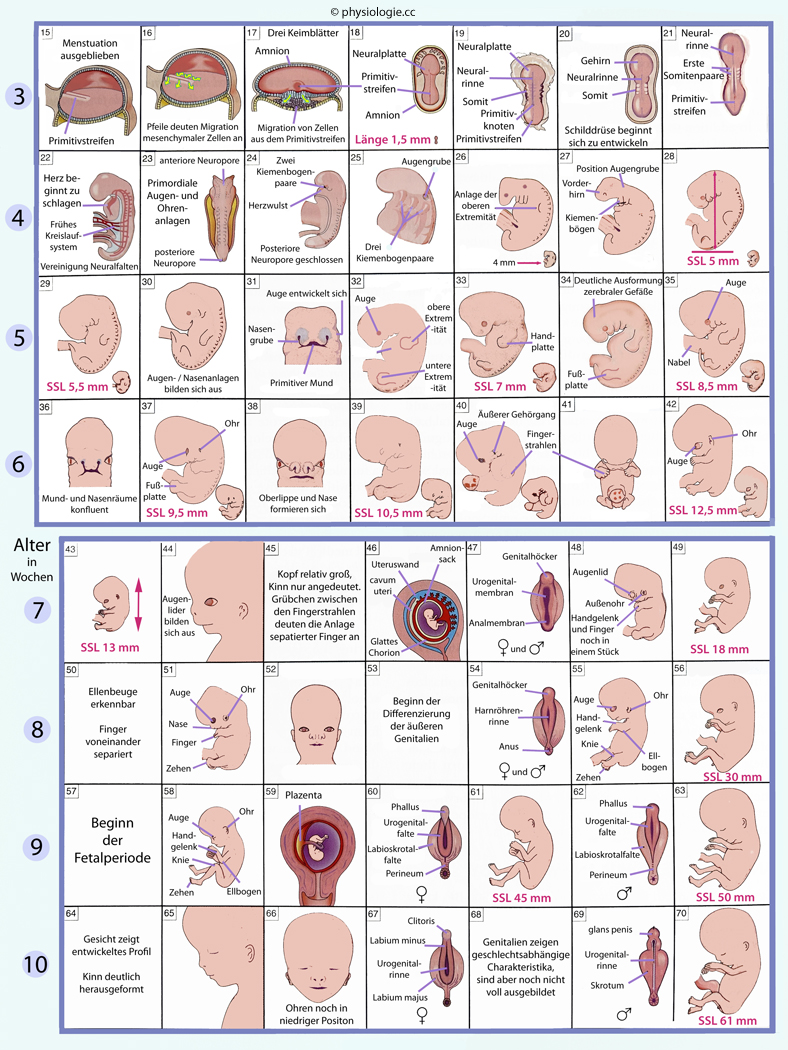

 Mit SSW 34 ist der Fetus
komplett entwickelt, bis zur Geburt wächst er weiter und nimmt an
Gewicht zu. Das Körpergewicht steigt
bis zur 37. SSW leicht
exponentiell an und dann bis zum Termin etwas geringer.
Knaben sind etwas schwerer als Mädchen. Mit Erreichen der 40. SSW ist das Geburtsgewicht von durchschnittlich 3,5 kg
erreicht; die 90%-Perzentile liegt in unseren Breiten bei 4 kg oder
etwas darüber, die 10%-Perzentile bei etwa 3 kg. Das bedeutet, dass die
meisten Neugeborenen zwischen 3 und 4 kg wiegen.
Mit SSW 34 ist der Fetus
komplett entwickelt, bis zur Geburt wächst er weiter und nimmt an
Gewicht zu. Das Körpergewicht steigt
bis zur 37. SSW leicht
exponentiell an und dann bis zum Termin etwas geringer.
Knaben sind etwas schwerer als Mädchen. Mit Erreichen der 40. SSW ist das Geburtsgewicht von durchschnittlich 3,5 kg
erreicht; die 90%-Perzentile liegt in unseren Breiten bei 4 kg oder
etwas darüber, die 10%-Perzentile bei etwa 3 kg. Das bedeutet, dass die
meisten Neugeborenen zwischen 3 und 4 kg wiegen. Entwicklung des fetalen Hormonsystems Modifiziert nach Endocrine and Reproductive Physiology, 5th ed., Mosby 2019 |
||
| Hormondrüse |
Zeitfenster |
Bemerkungen |
| Hypothalamus / Hypophyse |
Alle mit 12 Wochen |
Pfortadersystem mit 18 Wochen funktional |
| Schilddrüse |
T4 mit 10-12 Wochen |
Frühe Gehirnentwicklung abhängig von T3 der Mutter Fetales T3 steigt mit 30 Wochen (Typ I-Dejodinase) Fetus vor mütterlichem Hyperthyreoidismus durch plazentare Dejodinase geschützt |
| Nebenschilddrüsen |
Drüsen mit 8-10 Wochen ausgebildet, Parathormonbildung inhibiert durch relativ hypercalcämischen Status |
Deziduales Vit-D3-Hormon fördert Calciumresorption im Darm der Mutter PTHrP regt plazentaren Ca++-Transfer zum Fetus an |
| Langerhans-Inseln |
Mit 15 Wochen werden Insulin und Glukagon synthetisiert |
Plazentares Glucoseangebot bestimmt fetalen Blutzuckerspiegel stärker als pankreatische Hormone |
| Nebennieren |
DHEAS in fetaler Nebenniere mit 7 Wochen Cortisol in 2. Hälfte der Schwangerschaft Aldosteron kurz vor der Geburt |
Cortisol steuert Surfactant-Synthese |
 Weil das rechte und linke Herz beim Feten teilweise parallel
statt in Serie geschaltet sind - ihre Schlagvolumina mischen sich (ductus arteriosus und foramen ovale wirken als Shunts) -,
wird die Summe der rechts- und der linksventrikulären Förderleistung
als kombiniertes Herzzeitvolumen (combined cardiac output CCO) betrachtet und definiert. Es dient als Indikator für die fetale Gesundheit und kann Doppler-echokardiographisch
abgeschätzt werden. Der fetale CCO beträgt in der zweiten
Schwangerschaftshälfte ungefähr 400-450 ml/min/kg (zum Vergleich: Das
Ruhe-Herzzeitvolumen beträgt bei erwachsenen Personen etwa 80-90
ml/min/kg).
Weil das rechte und linke Herz beim Feten teilweise parallel
statt in Serie geschaltet sind - ihre Schlagvolumina mischen sich (ductus arteriosus und foramen ovale wirken als Shunts) -,
wird die Summe der rechts- und der linksventrikulären Förderleistung
als kombiniertes Herzzeitvolumen (combined cardiac output CCO) betrachtet und definiert. Es dient als Indikator für die fetale Gesundheit und kann Doppler-echokardiographisch
abgeschätzt werden. Der fetale CCO beträgt in der zweiten
Schwangerschaftshälfte ungefähr 400-450 ml/min/kg (zum Vergleich: Das
Ruhe-Herzzeitvolumen beträgt bei erwachsenen Personen etwa 80-90
ml/min/kg). Fetale Herzfrequenzen unter 100/min oder über 180/min, die länger als
10 Minuten andauern, sind ernste Stresszeichen und deuten auf Probleme
(insbesondere Sauerstoffmangel) hin.
Fetale Herzfrequenzen unter 100/min oder über 180/min, die länger als
10 Minuten andauern, sind ernste Stresszeichen und deuten auf Probleme
(insbesondere Sauerstoffmangel) hin.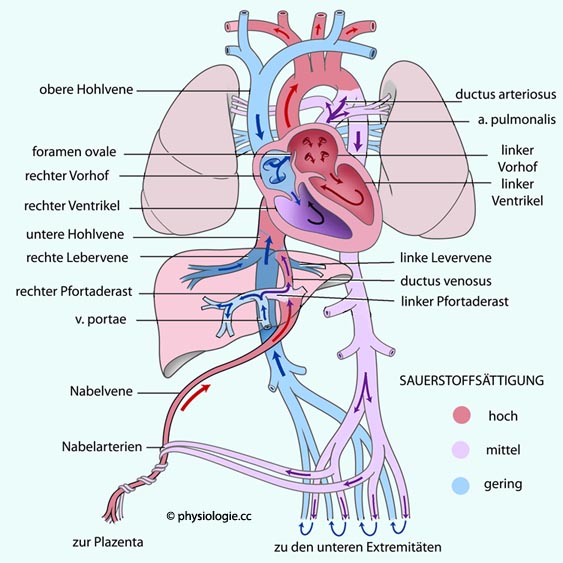
 Abbildung: Fetalkreislauf
Abbildung: Fetalkreislauf
 Vorhandensein der Plazenta.
Diese übernimmt Funktionen der Lunge (Gasaustausch), des
Gastrointestinaltrakts (Ernährung), der Leber (Entgiftung /
Ausscheidung / Ernährung), und der Nieren (Salz-Wasser-Homöostase,
Ausscheidung).
Vorhandensein der Plazenta.
Diese übernimmt Funktionen der Lunge (Gasaustausch), des
Gastrointestinaltrakts (Ernährung), der Leber (Entgiftung /
Ausscheidung / Ernährung), und der Nieren (Salz-Wasser-Homöostase,
Ausscheidung).  Abbildung) gelangt über die Aa. umbilicales
(Nabelarterien) zur Plazenta (der Gastrointestinaltrakt, die Leber und
die Nieren benötigen nur relativ geringe Perfusion - die Plazenta
übernimmt die Aufgaben, die sie postpartal erfüllen müssen).
Abbildung) gelangt über die Aa. umbilicales
(Nabelarterien) zur Plazenta (der Gastrointestinaltrakt, die Leber und
die Nieren benötigen nur relativ geringe Perfusion - die Plazenta
übernimmt die Aufgaben, die sie postpartal erfüllen müssen).  Der Partialdruckunterschied von ca. 10 mmHg
reicht für eine ausreichende Oxygenierung bereits aus, da in diesem
Partialdruckfeld der steile Bereich der Bindungskurve des fetalen
Hämoglobins (s. unten) vorliegt.
Der Partialdruckunterschied von ca. 10 mmHg
reicht für eine ausreichende Oxygenierung bereits aus, da in diesem
Partialdruckfeld der steile Bereich der Bindungskurve des fetalen
Hämoglobins (s. unten) vorliegt. | Blut in der Nabelvene hat die höchste Sauerstoffsättigung im fetalen Kreislauf |
 Weitere Shunts: Das
aus der Plazenta stammende Blut gelangt zu ~40% in die Leber des Feten,
60% strömen hingegen an der Leber vorbei (via ductus venosus Arantii) zur
unteren Hohlvene (~60% des kombinierten Herzzeitvolumens). In der Aorta des Feten beträgt die Sauerstoffsättigung nur ~60%.
Weitere Shunts: Das
aus der Plazenta stammende Blut gelangt zu ~40% in die Leber des Feten,
60% strömen hingegen an der Leber vorbei (via ductus venosus Arantii) zur
unteren Hohlvene (~60% des kombinierten Herzzeitvolumens). In der Aorta des Feten beträgt die Sauerstoffsättigung nur ~60%.| Der ductus venous Arantii bringt sauerstoffreiches Blut aus der Plazenta in die untere Hohlvene |

 Abbildung: Fetaler Kreislauf und Sauerstoffsättigung des Blutes
Abbildung: Fetaler Kreislauf und Sauerstoffsättigung des Blutes
| Der Blutdruck ist beim Fetus im rechten Vorhof höher als im linken Das Herz des Feten kann ohne wesentliche Pumpleistung des linken Ventrikels auskommen |

 Abbildung: Fetaler Kreislauf: Aufteilung der Perfusion
Abbildung: Fetaler Kreislauf: Aufteilung der Perfusion Unmittelbar nach der Geburt startet die Atmung und expandiert die Lunge, was den pulmonalen Strömungswiderstand senkt, und zwar auf ein Fünftel des pränatalen Wertes. Durch die Lungen strömen postpartal 100% des Herzzeitvolumens (präpartal nur 10%). Präpartal hält der niedrige pulmonale pO2 einen hohen Tonus der Pulmonalgefäße aufrecht (hypoxische Vasokonstriktion,
Euler-Liljestrand-Mechanismus); mit der postpartalen Füllung der
Alveolen mit Luft (und damit Sauerstoff) wird dieser Perfusionsblock
aufgehoben.
Unmittelbar nach der Geburt startet die Atmung und expandiert die Lunge, was den pulmonalen Strömungswiderstand senkt, und zwar auf ein Fünftel des pränatalen Wertes. Durch die Lungen strömen postpartal 100% des Herzzeitvolumens (präpartal nur 10%). Präpartal hält der niedrige pulmonale pO2 einen hohen Tonus der Pulmonalgefäße aufrecht (hypoxische Vasokonstriktion,
Euler-Liljestrand-Mechanismus); mit der postpartalen Füllung der
Alveolen mit Luft (und damit Sauerstoff) wird dieser Perfusionsblock
aufgehoben. Prostaglandin-Synthesehemmer (wie Indometacin) werden eingesetzt, um
nach der Geburt die Kontraktion der Wandmuskulatur eines
persistierenden ductus arteriosus (PDA) anzuregen und ihn so zu
verschließen.
Prostaglandin-Synthesehemmer (wie Indometacin) werden eingesetzt, um
nach der Geburt die Kontraktion der Wandmuskulatur eines
persistierenden ductus arteriosus (PDA) anzuregen und ihn so zu
verschließen.| Die Herzfrequenz des Feten beträgt präpartal deutlich über 100/min |

 Abbildung: Schutz von Mutter, Fetus und Keimzellen
Abbildung: Schutz von Mutter, Fetus und Keimzellen Pharmaka, Toxine: Die erhöhte Nierendurchblutung und glomeruläre Filtration bedingt eine verstärkte renale Ausscheidung von Medikamenten. Es gibt Medikamente, deren Applikation / Einnahme wegen Nebenwirkungen während der Schwangerschaft verboten ist. So können ACE-Hemmer Wachstum und Entwicklung des Fetus gravierend stören.
Pharmaka, Toxine: Die erhöhte Nierendurchblutung und glomeruläre Filtration bedingt eine verstärkte renale Ausscheidung von Medikamenten. Es gibt Medikamente, deren Applikation / Einnahme wegen Nebenwirkungen während der Schwangerschaft verboten ist. So können ACE-Hemmer Wachstum und Entwicklung des Fetus gravierend stören.  Von Alkoholgenuss und Rauchen während der Schwangerschaft ist strikt
abzusehen, da es zu Schädigungen des Kindes - und in der Keimbahn - kommen kann.
Von Alkoholgenuss und Rauchen während der Schwangerschaft ist strikt
abzusehen, da es zu Schädigungen des Kindes - und in der Keimbahn - kommen kann.  (zusätzliches Auftreten von Krämpfen; betrifft meist Erstgebärende).
Die Therapie richtet sich nach Krankheitsverlauf und Schwere der
Symptome.
(zusätzliches Auftreten von Krämpfen; betrifft meist Erstgebärende).
Die Therapie richtet sich nach Krankheitsverlauf und Schwere der
Symptome. Chorionzottenbiopsie
(Plazentapunktion): Im Rahmen der Pränataldiagnostik können
Chorionzellen entnommen werden, um z.B. auf Stoffwechselerkrankungen
oder chromosomale Aberrationen des Feten zu testen. Diese Untersuchung
gibt schon früher Resultate als die Amniozentese
(15.-18. SSW), einer Entnahme von Fruchtwasser aufgrund analoger
Fragestellungen, auch zwecks Diagnose von
Blutgruppen-Unverträglichkeiten (SSW 30).
Chorionzottenbiopsie
(Plazentapunktion): Im Rahmen der Pränataldiagnostik können
Chorionzellen entnommen werden, um z.B. auf Stoffwechselerkrankungen
oder chromosomale Aberrationen des Feten zu testen. Diese Untersuchung
gibt schon früher Resultate als die Amniozentese
(15.-18. SSW), einer Entnahme von Fruchtwasser aufgrund analoger
Fragestellungen, auch zwecks Diagnose von
Blutgruppen-Unverträglichkeiten (SSW 30).
 Östrogene und Progesteron werden nach einigen Wochen weitgehend von der
Plazenta (Synzytiotrophopblast) hergestellt und dominieren die
graviditätsabhängigen Umstellungen des mütterlichen Organismus. Die
Progesteronbildung der Plazenta verläuft endokrin unreguliert, die
Synthese von DHEAS in der fetalen Nebenniere ist von fetalem ACTH
gesteuert
Östrogene und Progesteron werden nach einigen Wochen weitgehend von der
Plazenta (Synzytiotrophopblast) hergestellt und dominieren die
graviditätsabhängigen Umstellungen des mütterlichen Organismus. Die
Progesteronbildung der Plazenta verläuft endokrin unreguliert, die
Synthese von DHEAS in der fetalen Nebenniere ist von fetalem ACTH
gesteuert Gewicht und Durchblutung des Uterus steigen östrogenbedingt um das
~15-fache an. Die Zervix streckt sich und bildet immunglobulinreiches
muköses Sekret, ihre Gefäße bilden einen Schwellkörper. Die Vagina
verändert sich ebenfalls, ihr Sekret ist reich an Milchsäure (pH
3,5-6,0).
Östrogene, Progesteron, hPL und Prolaktin bewirken Zunahme und
Differenzierung des Brustdrüsengewebes. Relaxine aus Plazenta und
Brustdrüse weichen Ligamente und Gewebe auf (sakroiliakal, Symphyse,
Zervix, gesteigerte arterielle Compliance)
Gewicht und Durchblutung des Uterus steigen östrogenbedingt um das
~15-fache an. Die Zervix streckt sich und bildet immunglobulinreiches
muköses Sekret, ihre Gefäße bilden einen Schwellkörper. Die Vagina
verändert sich ebenfalls, ihr Sekret ist reich an Milchsäure (pH
3,5-6,0).
Östrogene, Progesteron, hPL und Prolaktin bewirken Zunahme und
Differenzierung des Brustdrüsengewebes. Relaxine aus Plazenta und
Brustdrüse weichen Ligamente und Gewebe auf (sakroiliakal, Symphyse,
Zervix, gesteigerte arterielle Compliance) Progesteron senkt den peripheren Widerstand, Herzzeitvolumen und
Herzfrequenz (bis >100 bpm) steigen an. Die Menge an Erythrozyten
nimmt um ~25% (Erythropoetin), das Blutvolumen um ~50% zu (Reserve
gegenüber Blutverlust bei der Geburt), noch stärker das Plasmavolumen
(mit sinkender Proteinkonzentration: 10-15%, aber steigendem
Fibrinogenspiegel: +50%), der Hämatokrit ist reduziert. Bei
Hochschwangeren kann die untere Hohlvene in Rückenlage durch das Baby
komprimiert sein (Vena-cava- Kompressionssyndrom)
Progesteron senkt den peripheren Widerstand, Herzzeitvolumen und
Herzfrequenz (bis >100 bpm) steigen an. Die Menge an Erythrozyten
nimmt um ~25% (Erythropoetin), das Blutvolumen um ~50% zu (Reserve
gegenüber Blutverlust bei der Geburt), noch stärker das Plasmavolumen
(mit sinkender Proteinkonzentration: 10-15%, aber steigendem
Fibrinogenspiegel: +50%), der Hämatokrit ist reduziert. Bei
Hochschwangeren kann die untere Hohlvene in Rückenlage durch das Baby
komprimiert sein (Vena-cava- Kompressionssyndrom) Atmung und Atemgasaustausch nehmen zu: Atemfrequenz bis +15%, Atemtiefe
bis +50% (Geburtstermin); FRC, Residualvolumen und alveoläre
Ventilation steigen ebenfalls (Hypokapnie), bedingt durch gestiegenen
respiratorischen Bedarf und erhöhte CO2-Empfindlichkeit des Atemzentrums (Progesteron). Der arterielle pO2 steigt, der pCO2 sinkt (auf ~4 kPa), was den Gasaustausch mit dem Fetus begünstigt. Das HbF des
Feten bindet Sauerstoff stärker als das HbA der Mutter. Hämatokrit, Ery-Zahl und Hb-Konzentration sind beim Feten erhöht (O2-Transportkapazität) Atmung und Atemgasaustausch nehmen zu: Atemfrequenz bis +15%, Atemtiefe
bis +50% (Geburtstermin); FRC, Residualvolumen und alveoläre
Ventilation steigen ebenfalls (Hypokapnie), bedingt durch gestiegenen
respiratorischen Bedarf und erhöhte CO2-Empfindlichkeit des Atemzentrums (Progesteron). Der arterielle pO2 steigt, der pCO2 sinkt (auf ~4 kPa), was den Gasaustausch mit dem Fetus begünstigt. Das HbF des
Feten bindet Sauerstoff stärker als das HbA der Mutter. Hämatokrit, Ery-Zahl und Hb-Konzentration sind beim Feten erhöht (O2-Transportkapazität) Im Verdauungssystem tritt Tonusverlust, vermehrter Reflux und
Obstipationsneigung auf (Progesteron). Während der Schwangerschaft wird
zusätzlich ca. 1 kg Protein synthetisiert (~500g Fetus und Plazenta,
~500 g Uterus, Brüste und Blut). Der Bedarf an Nahrungseiweiß (+30
g/d), Vitaminen (Folsäure, D3..), Spurenelementen (Eisen, Zink) ist
erhöht. Der Fetus braucht ~30 g Calcium, ~20 g Phosphor, ~0,8 Magnesium
(80% davon während des dritten Trimesters), entsprechend einer
stündlichen Extraktion von 5-10% der im Blut der Mutter vorhandenen
Menge Im Verdauungssystem tritt Tonusverlust, vermehrter Reflux und
Obstipationsneigung auf (Progesteron). Während der Schwangerschaft wird
zusätzlich ca. 1 kg Protein synthetisiert (~500g Fetus und Plazenta,
~500 g Uterus, Brüste und Blut). Der Bedarf an Nahrungseiweiß (+30
g/d), Vitaminen (Folsäure, D3..), Spurenelementen (Eisen, Zink) ist
erhöht. Der Fetus braucht ~30 g Calcium, ~20 g Phosphor, ~0,8 Magnesium
(80% davon während des dritten Trimesters), entsprechend einer
stündlichen Extraktion von 5-10% der im Blut der Mutter vorhandenen
Menge Die Nieren steigern Durchblutung (bis ~75%) und Filtration, die
Harnmenge steigt mit der Ausscheidung von Harnstoff, Kreatinin,
Harnsäure. Steigende Natriumclearance regt das
Renin-Angiotensin-Aldosteron-System an, der Aldosteronspiegel steigt
präpartal bis 5-fach an, Salz-Wasser-Retention begünstigt das Auftreten
von Ödemen. Glucose, Aminosäuren und Proteine werden ausgeschieden
(erhöhte Infektionsgefahr in den Harnwegen). Die osmotische Schwelle
für Durst und Vasopressinsekretion sinkt, die Plasmaosmolalität um ~10
mOsm/kg, die Menge an Flüssigkeit im Körper steigt Die Nieren steigern Durchblutung (bis ~75%) und Filtration, die
Harnmenge steigt mit der Ausscheidung von Harnstoff, Kreatinin,
Harnsäure. Steigende Natriumclearance regt das
Renin-Angiotensin-Aldosteron-System an, der Aldosteronspiegel steigt
präpartal bis 5-fach an, Salz-Wasser-Retention begünstigt das Auftreten
von Ödemen. Glucose, Aminosäuren und Proteine werden ausgeschieden
(erhöhte Infektionsgefahr in den Harnwegen). Die osmotische Schwelle
für Durst und Vasopressinsekretion sinkt, die Plasmaosmolalität um ~10
mOsm/kg, die Menge an Flüssigkeit im Körper steigt  Das extrazelluläre Flüssigkeitsvolumen steigt um bis zu 10 Liter
(Aldosteron), die Blut-Osmolalität nimmt ab (gesenkte
Durstschwelle steigert Vasopressinproduktion), Natrium wird retiniert:
Östrogene steigern die Synthese von Angiotensinogen (Leber)
und Renin (Nieren), es entsteht mehr Angiotensin und Aldosteron.
Progesteron relaxiert den
Uterus; Östrogene, CRH, Prostaglandine, Oxytozin und Relaxine
mobilisieren ihn. Blutzucker- und Insulinspiegel schwanken stark
(postprandiale Hyperglykämie); hohe Blutzuckerspiegel erleichtern die
Glucoseaufnahme des Feten. Das Fettgewebe nimmt um 4-8 kg zu, der
Leptinspiegel ist
erhöht (Leptin wird auch von der Plazenta gebildet). In der zweiten
Schwangerschaftshälfte schaltet der Metabolismus
von anabol (Speicherung) auf katabol (Fettabbau). Längere
Nahrungskarenz der Mutter kann rasch zu Ketose
führen
Das extrazelluläre Flüssigkeitsvolumen steigt um bis zu 10 Liter
(Aldosteron), die Blut-Osmolalität nimmt ab (gesenkte
Durstschwelle steigert Vasopressinproduktion), Natrium wird retiniert:
Östrogene steigern die Synthese von Angiotensinogen (Leber)
und Renin (Nieren), es entsteht mehr Angiotensin und Aldosteron.
Progesteron relaxiert den
Uterus; Östrogene, CRH, Prostaglandine, Oxytozin und Relaxine
mobilisieren ihn. Blutzucker- und Insulinspiegel schwanken stark
(postprandiale Hyperglykämie); hohe Blutzuckerspiegel erleichtern die
Glucoseaufnahme des Feten. Das Fettgewebe nimmt um 4-8 kg zu, der
Leptinspiegel ist
erhöht (Leptin wird auch von der Plazenta gebildet). In der zweiten
Schwangerschaftshälfte schaltet der Metabolismus
von anabol (Speicherung) auf katabol (Fettabbau). Längere
Nahrungskarenz der Mutter kann rasch zu Ketose
führen Die Hypophyse
nimmt an Volumen zu. CRH regt die Wehentätigkeit an, indem es das
Myometrium gegenüber Prostaglandinen und Oxytozin sensibilisiert. ACTH
ist zum Ende der Schwangerschaft mehr als verdoppelt, es stimuliert
Cortisolbildung und fetoplazentare Östrogensynthese. Cortisol steigt an
(reduzierte Clearance) und fördert die Ausreifung von Lunge und
Gastrointestinaltrakt beim Feten. hCG stimuliert die luteale Sekretion
von
Östrogenen und Progesteron bis SSW 12. hPL regt wie GH und Prolaktin
Wachstum und Milchproduktion an. Oxytozin wird bei Dehnung des
Geburtskanals reflektorisch freigesetzt (Ferguson-Reflex).
Prostaglandin F2α und Oxytozin öffnen Typ-L-Calciumkanäle
depolarisierter Uterusmuskulatur und unterstützen die Wehentätigkeit
Die Hypophyse
nimmt an Volumen zu. CRH regt die Wehentätigkeit an, indem es das
Myometrium gegenüber Prostaglandinen und Oxytozin sensibilisiert. ACTH
ist zum Ende der Schwangerschaft mehr als verdoppelt, es stimuliert
Cortisolbildung und fetoplazentare Östrogensynthese. Cortisol steigt an
(reduzierte Clearance) und fördert die Ausreifung von Lunge und
Gastrointestinaltrakt beim Feten. hCG stimuliert die luteale Sekretion
von
Östrogenen und Progesteron bis SSW 12. hPL regt wie GH und Prolaktin
Wachstum und Milchproduktion an. Oxytozin wird bei Dehnung des
Geburtskanals reflektorisch freigesetzt (Ferguson-Reflex).
Prostaglandin F2α und Oxytozin öffnen Typ-L-Calciumkanäle
depolarisierter Uterusmuskulatur und unterstützen die Wehentätigkeit Im
ersten Trimenon ernährt sich der Keim histiotroph (Phagozytose). Die
reife Plazenta ist vom hämochorialen Typ und besteht aus Chorionzotten
(umbilikale Blutgefäße, Synzytiotrophoblasten), intervillösem Raum
(mütterliches Blut) und Dezidua basalis (Zytotrophoblasten, Matrix für
Spiralarterien und endometriale Venen). Der Stoffaustausch erfolgt
durch Diffusion (Gase, Harnstoff, Steroide, Kreatinin, Lipide),
erleichterte Diffusion (z.B. Glucose), aktiven Transport (z.B.
Elektrolyte) und sekundär aktiven Transport (z.B. Aminosäuren).
Rezeptor-mediierte Endozytose ermöglicht den Transfer komplexer
Moleküle (IgG, Insulin, Transferrin, LDL..) und überträgt z.B.
adaptiven Immunschutz (Antikörper), der noch einige Monate nach der
Geburt anhält Im
ersten Trimenon ernährt sich der Keim histiotroph (Phagozytose). Die
reife Plazenta ist vom hämochorialen Typ und besteht aus Chorionzotten
(umbilikale Blutgefäße, Synzytiotrophoblasten), intervillösem Raum
(mütterliches Blut) und Dezidua basalis (Zytotrophoblasten, Matrix für
Spiralarterien und endometriale Venen). Der Stoffaustausch erfolgt
durch Diffusion (Gase, Harnstoff, Steroide, Kreatinin, Lipide),
erleichterte Diffusion (z.B. Glucose), aktiven Transport (z.B.
Elektrolyte) und sekundär aktiven Transport (z.B. Aminosäuren).
Rezeptor-mediierte Endozytose ermöglicht den Transfer komplexer
Moleküle (IgG, Insulin, Transferrin, LDL..) und überträgt z.B.
adaptiven Immunschutz (Antikörper), der noch einige Monate nach der
Geburt anhält Die fetalen pO2- und pH-Werte sind niedrig, das Blut der Nabelvene hat die höchste Sauerstoffsättigung im fetalen
Kreislauf. Durch die steilere HbF-Sauerstoffbindungskurve ist das fetale Hämoglobin auch bei niedrigem pO2 relativ gut gesättigt. Der ductus venous Arantii bringt Blut aus der Plazenta in
die untere Hohlvene. Dieses gelangt durch den ductus venosus
(Arantii) an der Leber vorbei direkt in die untere Hohlvene (~50% des
kombinierten Herzzeitvolumens). Der Blutdruck ist beim Fetus im rechten
Vorhof höher als im linken. In der Aorta des Feten beträgt die
Sauerstoffsättigung nur ~60%
Die fetalen pO2- und pH-Werte sind niedrig, das Blut der Nabelvene hat die höchste Sauerstoffsättigung im fetalen
Kreislauf. Durch die steilere HbF-Sauerstoffbindungskurve ist das fetale Hämoglobin auch bei niedrigem pO2 relativ gut gesättigt. Der ductus venous Arantii bringt Blut aus der Plazenta in
die untere Hohlvene. Dieses gelangt durch den ductus venosus
(Arantii) an der Leber vorbei direkt in die untere Hohlvene (~50% des
kombinierten Herzzeitvolumens). Der Blutdruck ist beim Fetus im rechten
Vorhof höher als im linken. In der Aorta des Feten beträgt die
Sauerstoffsättigung nur ~60% |
