




 Ventilation, Diffusion und Perfusion
Ventilation, Diffusion und Perfusion
 Euler-Liljestrand-Reflex: Ulf v. Euler, Göran Liljestrand
Euler-Liljestrand-Reflex: Ulf v. Euler, Göran Liljestrand| In
den Alveolen kommen sich Luft und Blut sehr nahe: Die Trennwand mißt
zum Teil nur 0,2 µm Durchmesser. Dadurch können Sauerstoff und
Kohlendioxid gut ausgetauscht werden (bei körperlicher
Belastung jeweils bis zu mehrere Liter pro Minute - bei einer
Austauschfläche von ~100 m2). Die Transportgrößen müssen sinnvoll aufeinander abgestimmt sein: Alveoläre Ventilation einerseits, Lungendurchblutung (Herzzeitvolumen) andererseits. Beide sind nicht einfach zu bestimmen: Die alveoläre Ventilation (=Gesamtventilation abzüglich Totraumventilation) wird über Messung von Gesamtventilation (direkt) und Totraum (indirekt: Indikatorverdünnung) ermittelt; das Herzminutenvolumen z.B. über Dopplersonografie. Die Durchblutung der Lunge ist - aus hydrostatischen Gründen - höhenabhängig (am stärksten jeweils unten, am schwächsten jeweils oben - bezogen auf die Körperposition im Schwerefeld, nicht auf die Anatomie). Da die Belüftung weniger stark höhenabhängig ist, ergibt sich "oben" ein hoher (~3) und "unten" ein niedriger Wert (~0,6) für das Verhältnis Belüftung zu Durchblutung (Ventilations-Perfusions-Koeffizient). Daraus folgt: Die Blutgaswerte des aus den jeweiligen Lungenabschnitten zum linken Herzen strömenden Blutes differieren (oben hoher pO2 und niedriger pCO2, unten niedrigerer pO2 und höherer pCO2); oben ist die Arterialisierung des Blutes besonders hoch, unten geringer (wegen der S-förmigen Sauerstoffbindungskurve des Hämoglobins aber immer noch fast 100%). Insgesamt beträgt der Ventilations-Perfusions-Koeffizient etwa 1, d.h. alveoläre Belüftung und Durchblutung haben etwa einen gleich hohen Betrag, z.B. jeweils 5 l/min (bei aufrechter Körperposition). Sind die Gefäße eines Lungenabschnitts verlegt (Embolie), nähern sich hier die Gaspartialdruckwerte denen in der Außenluft an (pO2>100 mmHg, geringer pCO2). Bei blockierten Atemwegen ist es umgekehrt, im Extremfall stellen sich venöse Werte ein (pO2≤40 mmHg, pCO2>45 mmHg). |
 Diffusion von Atemgasen
Diffusion von Atemgasen  Respiratorischer Quotient
Respiratorischer Quotient  Regulation Belüftung / Durchblutung (Ventilations-Perfusions-Koeffizient)
Regulation Belüftung / Durchblutung (Ventilations-Perfusions-Koeffizient)  Bronchokonstriktion und Bronchodilatation
Bronchokonstriktion und Bronchodilatation  Weitere Einflussfaktoren
Weitere Einflussfaktoren
 Diffusionskapazität
Diffusionskapazität
 Core messages
Core messages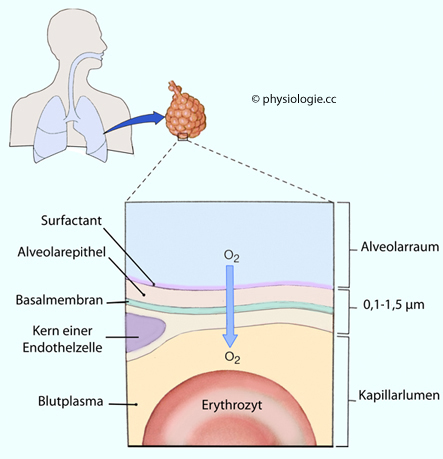
 Abbildung: Übertritt von Sauerstoff aus der Alveolarluft in den Blutkreislauf
Abbildung: Übertritt von Sauerstoff aus der Alveolarluft in den Blutkreislauf
 Abbildung).
Abbildung).
 Abbildung: Gradienten im Atmungssystem
Abbildung: Gradienten im Atmungssystem
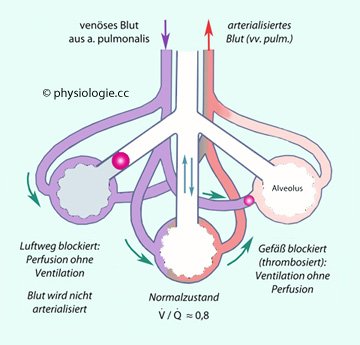
 Abbildung: Ventilation (V, Belüftung) und Perfusion (Q, Durchblutung) müssen aufeinander abgestimmt sein (schematisch)
Abbildung: Ventilation (V, Belüftung) und Perfusion (Q, Durchblutung) müssen aufeinander abgestimmt sein (schematisch)
 Belüftung (Ventilation
Belüftung (Ventilation  ) der Alveolen (alveoläre Ventilation: Gesamtatmung minus Totraumbelüftung) - dazu s. dort
) der Alveolen (alveoläre Ventilation: Gesamtatmung minus Totraumbelüftung) - dazu s. dort Austausch (Diffusion)
zwischen Alveolarluft und Alveolarkapillaren - gestört z.B. bei
interstitiellen Lungenerkrankungen, bei denen die Diffusionsstrecken
erhöht sind
Austausch (Diffusion)
zwischen Alveolarluft und Alveolarkapillaren - gestört z.B. bei
interstitiellen Lungenerkrankungen, bei denen die Diffusionsstrecken
erhöht sind Durchblutung (Perfusion
Durchblutung (Perfusion  ) der Lunge (=Herzzeitvolumen) - angetrieben vom Druckunterschied Pulmonalarterien zu Lungenkapillaren, s. dazu dort
) der Lunge (=Herzzeitvolumen) - angetrieben vom Druckunterschied Pulmonalarterien zu Lungenkapillaren, s. dazu dort| Die Partialdrucke in den Alveolarkapillaren gleichen sich denen der Alveolarluft an Der mittlere pCO2 in den Alveolen beträgt 40 mmHg (5,3 kPa) |
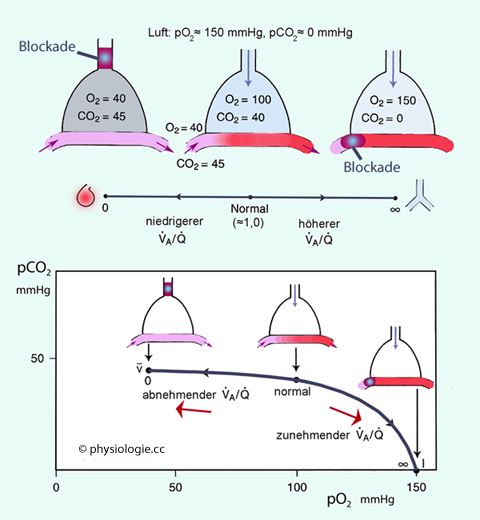
 Abbildung: Verhältnis von alveolärer Ventilation zu Perfusion
Abbildung: Verhältnis von alveolärer Ventilation zu Perfusion ). Aus den Partialdrucken im
arteriellen Blut kann man auf das Belüftungs-Durchblutungs-Verhältnis
der Gesamtlunge rückschließen
). Aus den Partialdrucken im
arteriellen Blut kann man auf das Belüftungs-Durchblutungs-Verhältnis
der Gesamtlunge rückschließen
| Die durchschnittliche Kontaktzeit des Blutes in der Alveolarkapillare beträgt eine halbe Sekunde |
| Die Partialdrucke gleichen sich in den Lungenkapillaren vollständig an jene in der Alveole an (z.B. pCO2 ~40 mmHg / 5,3 kPa) |
 Die Diffusionskapazität (diffusing capacity) gibt an, wie gut ein Gas zwischen
Alveolarluft und Blut diffundiert.
Die Diffusionskapazität (diffusing capacity) gibt an, wie gut ein Gas zwischen
Alveolarluft und Blut diffundiert. | arteriell |
venös | Unterschied |
|
| pO2 | ~100 mmHg |
~40 mmHg |
60 mmHg |
| pCO2 | ~40 mmHg |
~46 mmHg |
6 mmHg |
| CO2 diffundiert 20-mal besser durch die Alveolarmembran als O2 (bezogen auf gleiche Bedingungen, insb. Partialdruckunterschied) |
 Bei
körperlicher Ruhe enthalten die Alveolarkapillaren nur ein Drittel
ihres Fassungsvermögens; mit zunehmender Steigerung des
Herzminutenvolumens nimmt diese Füllung zu, und die Diffusionsfläche
erhöht sich bis zum
Dreifachen des Ruhewertes. Der Strömungswiderstand im Lungenkreislauf nimmt dadurch ab (größere Gesamt-Querschnittsfläche).
Bei
körperlicher Ruhe enthalten die Alveolarkapillaren nur ein Drittel
ihres Fassungsvermögens; mit zunehmender Steigerung des
Herzminutenvolumens nimmt diese Füllung zu, und die Diffusionsfläche
erhöht sich bis zum
Dreifachen des Ruhewertes. Der Strömungswiderstand im Lungenkreislauf nimmt dadurch ab (größere Gesamt-Querschnittsfläche).  Im Ruhezustand
werden je Minute 5 Liter Alveolarluft erneuert (alveoläre Belüftung),
und 5 Liter Blut fließen durch die Lungen (Durchschnittswerte für
Erwachsene). Das Belüftungs-Durchblutungs-Verhältnis
(Ventilations-Perfusions-Quotient
Im Ruhezustand
werden je Minute 5 Liter Alveolarluft erneuert (alveoläre Belüftung),
und 5 Liter Blut fließen durch die Lungen (Durchschnittswerte für
Erwachsene). Das Belüftungs-Durchblutungs-Verhältnis
(Ventilations-Perfusions-Quotient  ) beträgt in diesem Fall 1 (5/5).
) beträgt in diesem Fall 1 (5/5).  Bei
körperlicher Belastung nimmt
die Belüftung (alveoläre Ventilation) stärker (bis 20fach) zu als die
Durchblutung (Herzminutenvolumen: bis 5fach), das
Ventilations-Perfusions-Verhältnis steigt
dann auf ~4 (20/5) an - bei Hochtrainierten auch auf höhere Werte. Bei
zunehmender Belastung nimmt der Unterschied zwischen
Sauerstoffpartialdruck in Alveolen und Kapillaren zu, die
Sauerstoffsättigung des Hämoglobins ab (
Bei
körperlicher Belastung nimmt
die Belüftung (alveoläre Ventilation) stärker (bis 20fach) zu als die
Durchblutung (Herzminutenvolumen: bis 5fach), das
Ventilations-Perfusions-Verhältnis steigt
dann auf ~4 (20/5) an - bei Hochtrainierten auch auf höhere Werte. Bei
zunehmender Belastung nimmt der Unterschied zwischen
Sauerstoffpartialdruck in Alveolen und Kapillaren zu, die
Sauerstoffsättigung des Hämoglobins ab ( Abbildung).
Abbildung).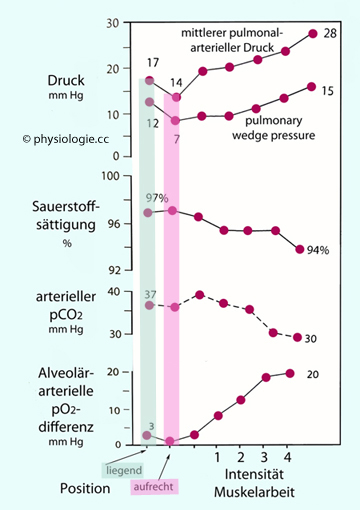
 Abbildung: Auswirkung von Positionswechsel (Aufstehen) und körperlicher Arbeit auf Drucke, O2-Sättigung, pACO2 und Partialdruckgefälle
Abbildung: Auswirkung von Positionswechsel (Aufstehen) und körperlicher Arbeit auf Drucke, O2-Sättigung, pACO2 und Partialdruckgefälle
| Gesteigerte Atmung (bei unveränderter Atemtiefe) erhöht den pCO2 in der Ausatemluft |
 Störungen der Hämoglobinbildung (Mangel an
Eisen, Vitamin-B-Komplex, Nahrungseiweiß) oder
Störungen der Hämoglobinbildung (Mangel an
Eisen, Vitamin-B-Komplex, Nahrungseiweiß) oder  starkem Blutverlust
starkem Blutverlust  Das Zahlenverhältnis CO2-Abgabe / O2-Aufnahme heißt respiratorischer Quotient (RQ); sein Betrag
hängt vom Stoffwechselzustand ab. Im theoretischen Fall, dass der
Energiestoffwechsel ausschließlich Kohlenhydrate oxydiert, beträgt der
RQ 1,0, was aus der Gleichung
Das Zahlenverhältnis CO2-Abgabe / O2-Aufnahme heißt respiratorischer Quotient (RQ); sein Betrag
hängt vom Stoffwechselzustand ab. Im theoretischen Fall, dass der
Energiestoffwechsel ausschließlich Kohlenhydrate oxydiert, beträgt der
RQ 1,0, was aus der Gleichung 6 CO2 + 6 H2O
6 CO2 + 6 H2O| Kennt man das Herzminutenvolumen und die arterio-venöse Sauerstoffdifferenz, ergibt sich daraus die Sauerstoffaufnahme des Körpers |
 Der Betrag der alveolären Ventilation (nicht der Gesamtatmung) bestimmt die Höhe des arteriellen pCO2
Der Betrag der alveolären Ventilation (nicht der Gesamtatmung) bestimmt die Höhe des arteriellen pCO2 Bei gegebener Stoffwechselleistung reduziert eine Verdopplung von VA den paCO2 um 50% (und vice versa)
Bei gegebener Stoffwechselleistung reduziert eine Verdopplung von VA den paCO2 um 50% (und vice versa) Steigt die CO2-Produktion im Stoffwechsel, ohne dass die alveoläre Ventilation entsprechend zunimmt, tritt Hyperkapnie auf.
Steigt die CO2-Produktion im Stoffwechsel, ohne dass die alveoläre Ventilation entsprechend zunimmt, tritt Hyperkapnie auf.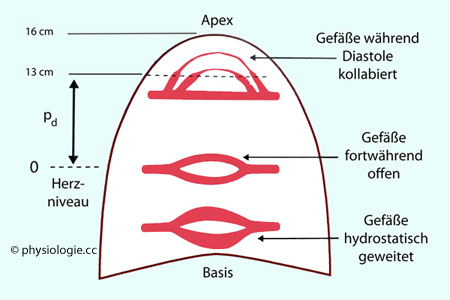
 Abbildung: Perfusionsgradient in der Lunge in aufrechter Körperposition
Abbildung: Perfusionsgradient in der Lunge in aufrechter Körperposition
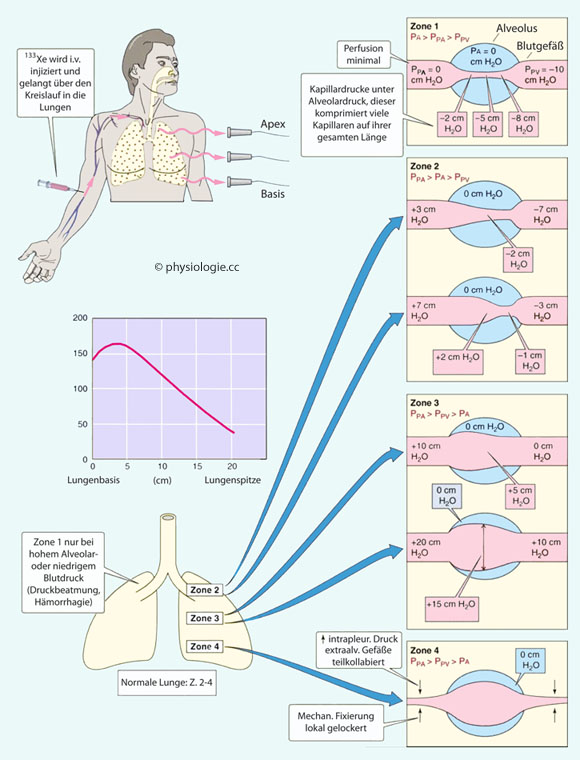
 Abbildung: Zonen der pulmonalen Durchblutung
Abbildung: Zonen der pulmonalen Durchblutung

 Abbildung: Wie sich der Perfusionsdruck auf die Hämodynamik in der Lunge auswirkt
Abbildung: Wie sich der Perfusionsdruck auf die Hämodynamik in der Lunge auswirkt
 Abbildung): Blutprobenanalysen
aus verschiedenen Lungenabschnitten geben Auskunft über deren jeweiliges
Belüftungs- Durchblutungs- Verhältnis:
Abbildung): Blutprobenanalysen
aus verschiedenen Lungenabschnitten geben Auskunft über deren jeweiliges
Belüftungs- Durchblutungs- Verhältnis: Basal liegende Lungengefäße sind bei aufrechter Körperlage
besser durchblutet, weil sie dem erhöhten (hydrostatischen) Druck nachgeben (Gefäße vom
"Lungen"- oder P-Typ)
und das Blut weite Gefäße bevorzugt (geringerer
Strömungswiderstand). Der arterielle und venöse Blutdruck ist hier
höher als der alveoläre, die Gefäße sind immer geöffnet. Dieses unten
liegende Lungenareal mit stets offenen Gefäßen wird als Zone III bezeichnet.
Basal liegende Lungengefäße sind bei aufrechter Körperlage
besser durchblutet, weil sie dem erhöhten (hydrostatischen) Druck nachgeben (Gefäße vom
"Lungen"- oder P-Typ)
und das Blut weite Gefäße bevorzugt (geringerer
Strömungswiderstand). Der arterielle und venöse Blutdruck ist hier
höher als der alveoläre, die Gefäße sind immer geöffnet. Dieses unten
liegende Lungenareal mit stets offenen Gefäßen wird als Zone III bezeichnet.  Apikal liegende Lungengefäße sind bei aufrechter Körperlage aus hydrostatischen Gründen nur während der systolischen Druckspitzen durchblutet - der (transmurale) Druck ist gering, die Gefäße
eng (hoher
Strömungswiderstand) oder kollabiert. Dieses oben liegende Lungenareal mit kollabierten Gefäßen wird als Zone I bezeichnet. Die Alveolen sind hier geweitet, daher weniger dehnbar, und weniger gut belüftet.
Apikal liegende Lungengefäße sind bei aufrechter Körperlage aus hydrostatischen Gründen nur während der systolischen Druckspitzen durchblutet - der (transmurale) Druck ist gering, die Gefäße
eng (hoher
Strömungswiderstand) oder kollabiert. Dieses oben liegende Lungenareal mit kollabierten Gefäßen wird als Zone I bezeichnet. Die Alveolen sind hier geweitet, daher weniger dehnbar, und weniger gut belüftet.Regionale Unterschiede bei aufrechter Körperlage Nach West JB: Ventilation / blood flow and gas exchange. Oxford, UK, Blackwell 1989 |
||||||
| Ort |
Anteil am Lungen- volumen |
Ventilations- Perfusions- Koeffizient |
pO2 (mmHg) |
pCO2 (mmHg) | pH |
Perfusion (l/min) |
| Apex |
7% |
3,3 |
132 |
28 |
7,55 |
0,07 |
| Basis |
13% |
0,6 |
89 |
42 |
7,38 |
1,3 |
| gesamt |
100% |
0,84 |
100 |
40 |
7,40 |
5,0 |
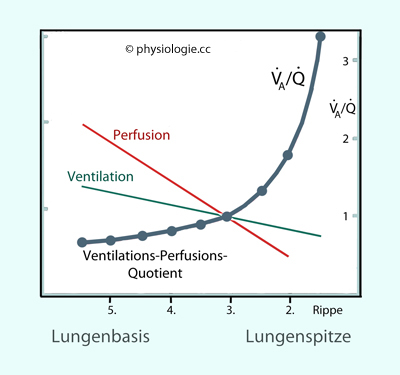
 Abbildung:
Belüftung und Durchblutung in verschiedenen Lungenabschnitten bei aufrechter Körperlage
Abbildung:
Belüftung und Durchblutung in verschiedenen Lungenabschnitten bei aufrechter Körperlage Zu hydrostatischen Druckschichtungen im Kreislauf s. dort
Zu hydrostatischen Druckschichtungen im Kreislauf s. dort
| Bei aufrechter Körperlage sinkt das Ventilations-Perfusions-Verhältnis (VA/Q)
von der Lungenspitze zur Lungenbasis ab - die Lungenspitzen sind am
schwächsten, die Lungenbasis ist am stärksten durchblutet Grund ist der hydrostatische Druckunterschied und der Umstand, dass sich die Lungengefäße druckpassiv verhalten (Typ P) |

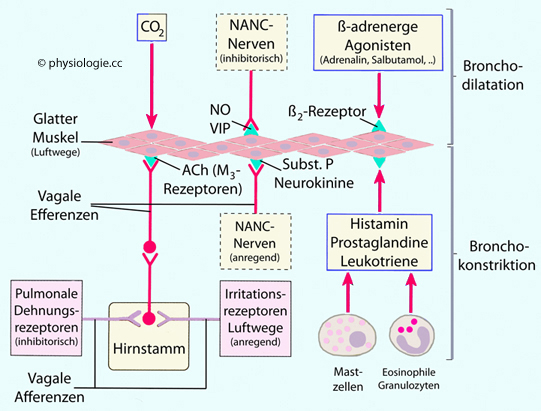
 Abbildung: Autonom-nervöse Steuerung der Bronchienweite
Abbildung: Autonom-nervöse Steuerung der Bronchienweite
 Bronchodilatation: Nimmt der Durchmesser der Bronchien zu, sinkt der Atemwegwiderstand, die Atmung wird erleichtert, allerdings auf Kosten einer vorübergehenden Senkung der Schutz- und Reinigungsfunktion (mukoziliäre Clearance). Folgende Faktoren reduzieren den Tonus der Bronchialmuskulatur (
Bronchodilatation: Nimmt der Durchmesser der Bronchien zu, sinkt der Atemwegwiderstand, die Atmung wird erleichtert, allerdings auf Kosten einer vorübergehenden Senkung der Schutz- und Reinigungsfunktion (mukoziliäre Clearance). Folgende Faktoren reduzieren den Tonus der Bronchialmuskulatur ( Abbildung):
Abbildung):  Abnehmender pO2
und / oder steigender pCO2 (direkte Wirkung auf die Bronchialmuskulatur)
Abnehmender pO2
und / oder steigender pCO2 (direkte Wirkung auf die Bronchialmuskulatur) NO, VIP über hemmende nicht-noradrenerge / nicht-cholinerge (NANC) Nerven
NO, VIP über hemmende nicht-noradrenerge / nicht-cholinerge (NANC) Nerven Langsam
adaptierende Dehnungsrezeptoren in den Luftwegen reduzieren die Wirkung
parasympathisch vermittelter Bronchokonstriktion
Langsam
adaptierende Dehnungsrezeptoren in den Luftwegen reduzieren die Wirkung
parasympathisch vermittelter Bronchokonstriktion Die Bronchialmuskulatur verfügt über eine relativ geringe Zahl an β2-Rezeptoren, Katecholamine (vor allem zirkulierendes Adrenalin aus dem Nebennierenmark) oder Pharmaka (wie Salbutamol) können so den Tonus der glatten Muskelzellen der Atemwege senken.
Die Bronchialmuskulatur verfügt über eine relativ geringe Zahl an β2-Rezeptoren, Katecholamine (vor allem zirkulierendes Adrenalin aus dem Nebennierenmark) oder Pharmaka (wie Salbutamol) können so den Tonus der glatten Muskelzellen der Atemwege senken.  Bronchokonstriktion: Nimmt der Durchmesser der Bronchien ab, steigt der Atemwegwiderstand. Parasympathische
(muskarinische) Efferenzen regen die Bronchialmuskulatur an, wie auch
einige NANC-Nerven. Folgende Faktoren erhöhen den Tonus der
Bronchialmuskulatur und können günstigenfalls die Schutz- und Reinigungsfunktion der Lunge unterstützen (
Bronchokonstriktion: Nimmt der Durchmesser der Bronchien ab, steigt der Atemwegwiderstand. Parasympathische
(muskarinische) Efferenzen regen die Bronchialmuskulatur an, wie auch
einige NANC-Nerven. Folgende Faktoren erhöhen den Tonus der
Bronchialmuskulatur und können günstigenfalls die Schutz- und Reinigungsfunktion der Lunge unterstützen ( Abbildung):
Abbildung):  Substanz P, Neurokinine über exzitatorische nicht-noradrenerge / nicht-cholinerge (NANC) Nerven
Substanz P, Neurokinine über exzitatorische nicht-noradrenerge / nicht-cholinerge (NANC) Nerven Reiz- bzw. Schadstoffe (z.B. Ozon, SO2) sowie von Leukozyten (Mastzellen, eosinophilen Granulozyten) freigesetzte bronchokonstriktorische Substanzen wie Histamin und verschiedene Eikosanoide
Reiz- bzw. Schadstoffe (z.B. Ozon, SO2) sowie von Leukozyten (Mastzellen, eosinophilen Granulozyten) freigesetzte bronchokonstriktorische Substanzen wie Histamin und verschiedene Eikosanoide Ansammlung von Schleim (Hypersekretion), Abschilferungen (Epithel), oder andere die Luftwege verengende Materialien
Ansammlung von Schleim (Hypersekretion), Abschilferungen (Epithel), oder andere die Luftwege verengende Materialien ), schlecht belüftete Lungenabschnitte sind
gering durchblutet. Dadurch wird Blut in besser belüftete
Lungenabschnitte umgeleitet.
), schlecht belüftete Lungenabschnitte sind
gering durchblutet. Dadurch wird Blut in besser belüftete
Lungenabschnitte umgeleitet. | Pulmonale Arteriolen reagieren auf sinkenden pO2 in den von ihnen versorgten Alveolen mit Vasokonstriktion (Durchblutung sinkt) |
 Kritische Sättigung 12 Vol-%, Normalwert 19-20 Vol-%) und erhöht über
pulmonale Vasokonstriktion (Pumonalgefäße kontrahieren bei sinkendem pO2) den Blutdruck
in der Lunge.
Kritische Sättigung 12 Vol-%, Normalwert 19-20 Vol-%) und erhöht über
pulmonale Vasokonstriktion (Pumonalgefäße kontrahieren bei sinkendem pO2) den Blutdruck
in der Lunge.
| Aufenthalt
in großer Höhe steigert den pulmonalen Strömungswiderstand (hypoxische
Vasokonstriktion von Gefäßen des Typs P) und den pulmonalen Blutdruck
(Rechtsherzbelastung) |
 s. dort).
s. dort). Einfluss der Körperlage auf Durchblutung und Arterialisierung: Im Sitzen und
Stehen kommt aus der Lungenspitze wenig, aber sauerstoffreiches Blut,
aus der Lungenbasis viel, aber etwas sauerstoffärmeres Blut. (Dies gilt für aufrechte Körperhaltung, also Orthostase. Bei
Seitenlage ist die Situation
anders - z.B. kommt bei rechter Seitenlage sauerstoffreicheres Blut aus
der linken (oberen) Lunge, bei linker Seitenlage aus der rechten.
Einfluss der Körperlage auf Durchblutung und Arterialisierung: Im Sitzen und
Stehen kommt aus der Lungenspitze wenig, aber sauerstoffreiches Blut,
aus der Lungenbasis viel, aber etwas sauerstoffärmeres Blut. (Dies gilt für aufrechte Körperhaltung, also Orthostase. Bei
Seitenlage ist die Situation
anders - z.B. kommt bei rechter Seitenlage sauerstoffreicheres Blut aus
der linken (oberen) Lunge, bei linker Seitenlage aus der rechten. Bei körperlicher Belastung
steigen sowohl die Belüftung (bis ~20-fach) als auch die Durchblutung
(Herzminutenvolumen bis 4-5fach) an, und es verringert sich der
Ventilations-Perfusions-"Mismatch" - der
Sauerstoffpartialdruckunterschied Lungenspitze - Lungenbasis nimmt ab. (Ähnliches gilt für den schwerelosen Zustand.)
Bei körperlicher Belastung
steigen sowohl die Belüftung (bis ~20-fach) als auch die Durchblutung
(Herzminutenvolumen bis 4-5fach) an, und es verringert sich der
Ventilations-Perfusions-"Mismatch" - der
Sauerstoffpartialdruckunterschied Lungenspitze - Lungenbasis nimmt ab. (Ähnliches gilt für den schwerelosen Zustand.)
 Pathologische Veränderungen des Ventilations / Perfusions- Koeffizienten:
Pathologische Veränderungen des Ventilations / Perfusions- Koeffizienten: Pneumothorax
Pneumothorax Atelektasen
Atelektasen Emphysem
Emphysem Verlegung der oberen Luftwege
Verlegung der oberen Luftwege Aspiration
Aspiration Pulmonalembolie
Pulmonalembolie reduziertem rechtsventrikulärem Fördervolumen (Hypovolämie, rechtsventrikulärer Infarkt, Herzbeuteltamponade)
reduziertem rechtsventrikulärem Fördervolumen (Hypovolämie, rechtsventrikulärer Infarkt, Herzbeuteltamponade) Der Lungenkreislauf ist in der Lage, kleine Thromben,
die über den venösen Rückstrom aus der Peripherie eingeschwemmt wurden
- z.B. nach Knochenbrüchen oder anderen Traumen, oder aus Venen, die
schlecht durchblutet werden (Varizen) - in der Mikrozirkulation der
Lunge abzufangen und
fibrinolytisch abzubauen. Bleiben die betroffenen Lungengebiete klein
genug, verläuft dieser Vorgang asymptomatisch, schützt aber vor einem
Eindringen der Thromben in den arteriellen Kreislauf, wo sie zu
Embolien führen können.
Der Lungenkreislauf ist in der Lage, kleine Thromben,
die über den venösen Rückstrom aus der Peripherie eingeschwemmt wurden
- z.B. nach Knochenbrüchen oder anderen Traumen, oder aus Venen, die
schlecht durchblutet werden (Varizen) - in der Mikrozirkulation der
Lunge abzufangen und
fibrinolytisch abzubauen. Bleiben die betroffenen Lungengebiete klein
genug, verläuft dieser Vorgang asymptomatisch, schützt aber vor einem
Eindringen der Thromben in den arteriellen Kreislauf, wo sie zu
Embolien führen können.| Lungenembolie führt zu Erhöhung des rechtsventrikulären Drucks |
 Sauerstoffbeatmung kann dazu dienen, ein Diffusionshindernis in der Lunge zu überwinden. (Diffusion nimmt mit dem Partialdruckunterschied zu: Diffusionsgesetz.)
Sauerstoffbeatmung kann dazu dienen, ein Diffusionshindernis in der Lunge zu überwinden. (Diffusion nimmt mit dem Partialdruckunterschied zu: Diffusionsgesetz.) Tabakrauch!).
Tabakrauch!).  Als gesundheitsgefährdend gelten CO-Werte ab 100 ppm
(ergibt ~4% COHb), als Arbeitsplatzgrenzwert wurden 30 ppm festgelegt;
bei Patienten mit Herz-Kreislauf-Erkrankungen liegen die tolerierbaren
Grenzwerte generell niedriger.
Als gesundheitsgefährdend gelten CO-Werte ab 100 ppm
(ergibt ~4% COHb), als Arbeitsplatzgrenzwert wurden 30 ppm festgelegt;
bei Patienten mit Herz-Kreislauf-Erkrankungen liegen die tolerierbaren
Grenzwerte generell niedriger.

 Belüftung (VA) und
Durchblutung (Q) der Alveolen müssen aufeinander abgestimmt sein, um
optimalen Gasaustausch zu erzielen. Die Kontaktzeit zwischen Blut und Alveolarluft beträgt <1s (bei körperlicher Ausbelastung
~0,3s). Die Partialdrucke in den Kapillaren gleichen sich denen in der Alveolarluft an. Der Ventilations /
Perfusions-Quotient (VA/Q) liegt
im Ruhezustand bei oder etwas unter 1,0, bei maximaler Belastung bei ~4 (20/5). Bei Ruhe ist nur ein Teil der
Alveolarkapillaren
durchblutet (funktionelle Reserve), bei
steigendem Herzzeitvolumen nimmt ihre Perfusion zu. Hochtrainierte
haben eine homogenere Durchblutungsverteilung in der Lunge als Untrainierte
Belüftung (VA) und
Durchblutung (Q) der Alveolen müssen aufeinander abgestimmt sein, um
optimalen Gasaustausch zu erzielen. Die Kontaktzeit zwischen Blut und Alveolarluft beträgt <1s (bei körperlicher Ausbelastung
~0,3s). Die Partialdrucke in den Kapillaren gleichen sich denen in der Alveolarluft an. Der Ventilations /
Perfusions-Quotient (VA/Q) liegt
im Ruhezustand bei oder etwas unter 1,0, bei maximaler Belastung bei ~4 (20/5). Bei Ruhe ist nur ein Teil der
Alveolarkapillaren
durchblutet (funktionelle Reserve), bei
steigendem Herzzeitvolumen nimmt ihre Perfusion zu. Hochtrainierte
haben eine homogenere Durchblutungsverteilung in der Lunge als Untrainierte Die Diffusionskapazität gibt an, wie gut ein Gas zwischen Alveolarluft und Blut diffundiert (O2: 15-20, CO2: ~200 ml/min/mmHg).
Ihr Betrag steigt bei körperlicher Belastung (3-facher Anstieg der
Austauschoberfläche, 4-5facher der Durchblutung, sinkender
Strömungswiderstand im Lungenkreislauf). Das Gas in den
Alveolen ist je nach dem Verhältnis von Atmung und Durchblutung
unterschiedlich zusammengesetzt. In
schlecht durchbluteten, aber gut belüfteten Lungenabschnitten sind die
Gaspartialdrucke ähnlich der in der Einatmungsluft (Resultat: wenig,
aber sauerstoffreiches Blut). Gut durchblutete, aber gering belüftete Lungenabschnitte produzieren mäßig arterialisiertes Blut (viel, aber unvollständig arterialisiertes Blut) Die Diffusionskapazität gibt an, wie gut ein Gas zwischen Alveolarluft und Blut diffundiert (O2: 15-20, CO2: ~200 ml/min/mmHg).
Ihr Betrag steigt bei körperlicher Belastung (3-facher Anstieg der
Austauschoberfläche, 4-5facher der Durchblutung, sinkender
Strömungswiderstand im Lungenkreislauf). Das Gas in den
Alveolen ist je nach dem Verhältnis von Atmung und Durchblutung
unterschiedlich zusammengesetzt. In
schlecht durchbluteten, aber gut belüfteten Lungenabschnitten sind die
Gaspartialdrucke ähnlich der in der Einatmungsluft (Resultat: wenig,
aber sauerstoffreiches Blut). Gut durchblutete, aber gering belüftete Lungenabschnitte produzieren mäßig arterialisiertes Blut (viel, aber unvollständig arterialisiertes Blut)  In Ruhe braucht eine erwachsene Person ~0,3 l Sauerstoff und gibt ~0,25 l CO2 ab. Der respiratorischer Quotient (RQ) ist das Zahlenverhältnis von CO2-Abgabe zu O2-Aufnahme,
sein Betrag hängt vom Stoffwechselzustand ab. Werden ausschließlich
Kohlenhydrate oxydiert, beträgt er 1,0, sind es ausschließlich Fette, 0,7. Bei
gemischter Energiegewinnung (normale Kost) ergibt sich ein RQ von ~0,83
(0,25/0,3). Bei körperlicher Belastung verändern Einflüsse auf den
Säure-Basen-Haushalt den RQ-Wert (Pufferung saurer Valenzen, Abatmung
von CO2 als respiratorische Kompensation) In Ruhe braucht eine erwachsene Person ~0,3 l Sauerstoff und gibt ~0,25 l CO2 ab. Der respiratorischer Quotient (RQ) ist das Zahlenverhältnis von CO2-Abgabe zu O2-Aufnahme,
sein Betrag hängt vom Stoffwechselzustand ab. Werden ausschließlich
Kohlenhydrate oxydiert, beträgt er 1,0, sind es ausschließlich Fette, 0,7. Bei
gemischter Energiegewinnung (normale Kost) ergibt sich ein RQ von ~0,83
(0,25/0,3). Bei körperlicher Belastung verändern Einflüsse auf den
Säure-Basen-Haushalt den RQ-Wert (Pufferung saurer Valenzen, Abatmung
von CO2 als respiratorische Kompensation) Schwerkraftbedingt
ist der Druck im Pleuraspalt in oben gelegenen Abschnitten stärker
negativ als in unten gelegenen, etwa -0,8 vs. -0,3 kPa ("oben" und "unten" bezieht sich jeweils auf die Richtung der Schwerkraft). Dadurch sind oben gelegene Alveolen stärker aufgedehnt und werden bei der Einatmung geringer geweitet als
unten gelegene; unten gelegene werden besser belüftet. Analoges gilt
für die Durchblutung: Pulmonale Blutgefäße (vom "passiven" P-Typ) sind
unten stärker geweitet und besser durchblutet als oben: Bei aufrechter Körperlage sind die Lungenspitzen am schwächsten, die Lungenbasis am stärksten durchblutet. Die
höhenabhängige Änderung der Durchblutung ist stärker als die der
Belüftung, daher ist der Ventilations- Perfusions- Quotient oben hoch (~3,0), unten niedrig
(~0,6). Blutprobenanalysen aus verschiedenen Lungenabschnitten geben
Auskunft über deren jeweiliges Belüftungs- Durchblutungs- Verhältnis:
Blut aus "oberen" Lungenabschnitten ist besonders gut arterialisiert. Bei
körperlicher Belastung steigen sowohl Belüftung (bis ~20-fach) als auch
Durchblutung (bis 4-5fach) an, und es verringert sich der
Ventilations-Perfusions-"Mismatch" - der
Sauerstoffpartialdruckunterschied Lungenspitze - Lungenbasis nimmt ab Schwerkraftbedingt
ist der Druck im Pleuraspalt in oben gelegenen Abschnitten stärker
negativ als in unten gelegenen, etwa -0,8 vs. -0,3 kPa ("oben" und "unten" bezieht sich jeweils auf die Richtung der Schwerkraft). Dadurch sind oben gelegene Alveolen stärker aufgedehnt und werden bei der Einatmung geringer geweitet als
unten gelegene; unten gelegene werden besser belüftet. Analoges gilt
für die Durchblutung: Pulmonale Blutgefäße (vom "passiven" P-Typ) sind
unten stärker geweitet und besser durchblutet als oben: Bei aufrechter Körperlage sind die Lungenspitzen am schwächsten, die Lungenbasis am stärksten durchblutet. Die
höhenabhängige Änderung der Durchblutung ist stärker als die der
Belüftung, daher ist der Ventilations- Perfusions- Quotient oben hoch (~3,0), unten niedrig
(~0,6). Blutprobenanalysen aus verschiedenen Lungenabschnitten geben
Auskunft über deren jeweiliges Belüftungs- Durchblutungs- Verhältnis:
Blut aus "oberen" Lungenabschnitten ist besonders gut arterialisiert. Bei
körperlicher Belastung steigen sowohl Belüftung (bis ~20-fach) als auch
Durchblutung (bis 4-5fach) an, und es verringert sich der
Ventilations-Perfusions-"Mismatch" - der
Sauerstoffpartialdruckunterschied Lungenspitze - Lungenbasis nimmt ab Hypoxie bewirkt
pulmonale Vasokonstriktion (Euler-Liljestrand- Mechanismus: schlecht
belüftete Lungenabschnitte sind gering durchblutet, Blut fließt in
besser belüftete Lungenabschnitte). Generelle Hypoxie führt zu
pulmonaler Hypertonie, der Kapillardruck steigt, Flüssigkeit tritt in
das Interstitium aus, bei noch höherem Druck in die Alveolen
(Lungenödem) Hypoxie bewirkt
pulmonale Vasokonstriktion (Euler-Liljestrand- Mechanismus: schlecht
belüftete Lungenabschnitte sind gering durchblutet, Blut fließt in
besser belüftete Lungenabschnitte). Generelle Hypoxie führt zu
pulmonaler Hypertonie, der Kapillardruck steigt, Flüssigkeit tritt in
das Interstitium aus, bei noch höherem Druck in die Alveolen
(Lungenödem) Adrenalin senkt über β2-Rezeptoren den Tonus der Bronchien, der Atemwegwiderstand sinkt, die Atmung wird erleichtert (Stress, Belastung) Adrenalin senkt über β2-Rezeptoren den Tonus der Bronchien, der Atemwegwiderstand sinkt, die Atmung wird erleichtert (Stress, Belastung) |
