
 Abbildung: Atmung und Kreislauf
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Abbildung: Atmung und Kreislauf
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Oben: Äußere Atmung, Diffusion der Atemgase über die Alveolarwände; Mitte: Atemgastransport über den Kreislauf; unten:
Mitochondrien sind der Ort, an dem innere Atmung stattfindet. Der stufenweise Abfall des pO2
von der Außenluft (21 kPa) über Luftwege, Alveolen, Alveolarkapillaren,
Arterien (13 kPa) bis zu den Mitochondrien (1 kPa) wird als
Sauerstoffkaskade (oxygen cascade) bezeichnet.
Das
Atmunssystem hat folgende Schlüsselkomponenten: Transportsystem für
Atemluft (Atemwege), Transportsystem für Atemgase im Blut
(kardiovaskuläres System, Hämoglobin), große Austauschflächen
(Alveolen, Kapillarsysteme), lokale Regulationsmechanismen (Verteilung
von Ventilation und Perfusion), zentrale Atemregulation (Atemzentrum).
Diffusion von Sauerstoff aus der Alveolarluft in das Blut des Pulmonalkreislaufs, Transport über den arteriellen Kreislauf, Diffusion von O2 aus dem Blut ins Gewebe, Abgabe von Kohlendioxid an das Blut, Transport über den venösen Kreislauf, Diffusion von CO2 aus dem Blut in die Alveolarluft. Hb = Hämoglobin (Sauerstofftransporter und Blutpuffer)
Die
Diffusionsstrecke für die Atemgase liegt in den Lungenalveolen bei 0,2-0,6 µm; etwa 300
Millionen Alveolen (Durchmesser: 75-300 µm) bieten in der Lunge einer erwachsenen Person eine
Diffusionsfläche von etwa 70 (50-100) m2.
Der Atemgasaustausch wird durch das Atemzentrum des Hirnstamms reguliert, der sich an Blutgaswerten (pO2, pCO2, pH) orientiert. Die äußere Atmung tauscht Atemgase mit der Umwelt aus, die innere Atmung mit dem Zellstoffwechsel

Luftzusammensetzung und Gasaustausch
 Referenzwerte s. dort
Referenzwerte s. dort
Atemgasvolumina und ihre Zusammensetzung werden für entsprechende physikalische Randbedingungen (Druck, Temperatur, Feuchtigkeit) quantifiziert, denn sinnvolle Interpretationen sind nur möglich, wenn diese Werte
zusammen mit den Volumima angegeben werden. Daher wird das Volumen einer Gasprobe für Umgebungsdruck und Umgebungstemperatur (ambient) oder für die im Körper (body) herrschenden Bedingungen angegeben - entweder getrocknet (dry) oder (wie in der Lunge) im wasserdampfgesättigten Zustand (saturated).
 Bei
der Passage trockener Einatmungsluft durch die Luftwege (Bedingungen: ATPD - ambient temperature and pressure, dry) -
Bei
der Passage trockener Einatmungsluft durch die Luftwege (Bedingungen: ATPD - ambient temperature and pressure, dry) - Stickstoff 78%, Sauerstoff 21%, Argon 1% -
wird diese
angefeuchtet (6% des Volumens besteht dann bei Körpertemperatur aus Wasserdampf, der Partialdruck p
H2O beträgt ~6 kPa bzw. 47 mmHg
), der Partialdruck der anderen Gase nimmt entsprechend ab:
 Wasserdampfgesättigte Einatemluft (ATPS - ambient temperature and pressure, saturated) weist folgende Zusammensertzung auf: Etwa 73% Stickstoff, 20% Sauerstoff (pO2 ~150 mmHg), 6% H2O, 1% Ar.
Wasserdampfgesättigte Einatemluft (ATPS - ambient temperature and pressure, saturated) weist folgende Zusammensertzung auf: Etwa 73% Stickstoff, 20% Sauerstoff (pO2 ~150 mmHg), 6% H2O, 1% Ar.
 Ausgeatmete Luft (BTPS - body temperature and pressure, saturated) unterliegt Bedingungen, wie sie in der Lunge herrschen: Umgebungsdruck, Körpertemperatur, H2O-gesättigt. Das ergibt bei einem Luftdruck von 760 mmHg (
Ausgeatmete Luft (BTPS - body temperature and pressure, saturated) unterliegt Bedingungen, wie sie in der Lunge herrschen: Umgebungsdruck, Körpertemperatur, H2O-gesättigt. Das ergibt bei einem Luftdruck von 760 mmHg (~
Meereshöhe) etwa folgende Werte (bei H
2O-Sättigung und 37°C)
:

73% Stickstoff (pN
2 555 mmHg / ~73 kPa),


15% Sauerstoff (pO
2 115 mmHg / ~15 kPa),


5% Kohlendioxid (pCO
2 40 mmHg / ~5 kPa),


6% Wasserdampf (p
H2O 47 mmHg / ~6 kPa),


1% Argon (p
Ar 8 mmHg / ~1 kPa).
Spirometrisch
ermittelte Gasvolumina (exspirierte Luftproben) werden üblicherweise
unter ATPS-Bedingungen bestimmt. Die ATPS-Werte können durch
entsprechende Konversionsfaktoren in BTPS-Werte übergeführt werden (und
umgekehrt).
BTPS sind die physiologischen Bedingungen, wie sie im Alveolarraum herrschen: 37°C, Wasserdampfsättigung (pH2O = 6,3 kPa), Umgebungsdruck
|
Wasserverlust durch die Atemtätigkeit: Dieser stellt einen Teil der perspiratio insensibilis
dar (Verdampfung von Wasser aus physiologischen Quellen ohne aktiver
Schweißproduktion - nicht schwitzende Haut, Schleimhäute mit Verbindung
zur Außenwelt, z.B. die Lunge mit einer Gesamtoberfläche von ~70 m2).
Der Verlust von Wasser durch die Atmung beträgt bei erwachsenen Personen normalerweise etwa ein Drittel Liter pro Tag (15-20 ml/h), kann aber auf ein Mehrfaches dieses Wertes ansteigen, z.B. auf ~70 ml/h bei körperlicher Belastung, insbesondere bei trockener Atemluft.
Der Volumenanteil H2O-Dampf in der Alveolarluft beträgt etwa 6%
|
 Luft unter Standardbedingungen (STPD - standard temperature, pressure, dry): Normbedingungen: Druck 760 mmHg, Temperatur 0°C, trocken (pH2O
= 0). Diese Bedingungen entsprechen weder denen im Körper noch denen im
Spirometer, sind aber einheitlich (Standard-Atmosphärendruck, kein
Wasserdampf).
Luft unter Standardbedingungen (STPD - standard temperature, pressure, dry): Normbedingungen: Druck 760 mmHg, Temperatur 0°C, trocken (pH2O
= 0). Diese Bedingungen entsprechen weder denen im Körper noch denen im
Spirometer, sind aber einheitlich (Standard-Atmosphärendruck, kein
Wasserdampf).
Zusammensetzung trockener Atmosphärenluft etwa: 21% O
2, 78% N
2, 1% Ar.
Die unterschiedlichen Werte (Inspirationsluft →
Exspirationsluft) erklären sich einerseits durch Anfeuchtung
(Wasserdampfsättigung), andererseits durch den Atemgasaustsusch (Aufnahme von O2, Abgabe von CO2).
Die folgende Tabelle zeigt zum Vergleich Anteils- (Fraktion) und
Partialdruckwerte in trockener und wasserdampfgesättigter Luft bei 37°C:
| nach Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
|
trocken
|
feucht
|
Gas
|
Fraktion
(%)
|
Partialdruck
(mmHg)
|
Fraktion
(%) |
Partialdruck
(mmHg) |
Stickstoff
|
78,09
|
593,48
|
73,26
|
556,78
|
Sauerstoff
|
20,95
|
159,22
|
19,65
|
149,37
|
CO2
|
0,03
|
0,23
|
0,03
|
0,21
|
Argon
|
0,93
|
7,07
|
0,87
|
6,63
|
Wasser
|
0
|
0
|
6,18
|
47
|
gesamt
|
100
|
760
|
100
|
760
|
Die Exspirationsluft
kann (in Spuren, aber z.B. elektrochemisch oder mittels
Massenspektrometrie gut nachweisbar) weitere Bestandteile von Interesse
enthalten, z.B.
 Wasserstoff (H2-Atemtest): Normalerweise enthält die Atemluft keine nennenswerte Menge an Wasserstoff, aber Dickdarmbakterien können Kohlenhydrate metabolisieren, die im Dünndarm nicht resorbiert wurden (bei Zuckerresorptionsstörungen wie z.B. Lactasemangel oder Fructosemalabsorption - Überforderung des GLUT5-Systems). Dabei entsteht neben Lactat, Acetat und CO2 auch H2;
Wasserstoff (H2-Atemtest): Normalerweise enthält die Atemluft keine nennenswerte Menge an Wasserstoff, aber Dickdarmbakterien können Kohlenhydrate metabolisieren, die im Dünndarm nicht resorbiert wurden (bei Zuckerresorptionsstörungen wie z.B. Lactasemangel oder Fructosemalabsorption - Überforderung des GLUT5-Systems). Dabei entsteht neben Lactat, Acetat und CO2 auch H2;
 über Haut oder Schleimhäute aufgenommene Fremdstoffe (z.B. Medikamente).
über Haut oder Schleimhäute aufgenommene Fremdstoffe (z.B. Medikamente).
Je rascher Luft
durch Hohlräume strömt, desto geringer wird der Lateraldruck
(Bernoulli-Phänomen) und desto eher droht ein Kollaps der Wände.
Der Rachen ist der erste
entsprechende Abschnitt bei einer Einatmung; er wird inspiratorisch
durch mehrere Muskelpartien offen gehalten: Der m. genioglossus führt die Zunge nach vorne, die Palatinalmuskulatur stützt Gaumen, Zunge und Pharynx und strafft die Uvula, und mehrere Muskeln - wie der m. geniohyoideus (Kinn-Zungenbein- Muskel) - richten das Hyoid aus.
Im Schlaf lässt der Tonus dieser Muskeln nach, was zu inspiratorischer
Verengung des Rachenraumes und zum Schnarchen führen kann, vor allem im
Non-REM-Schlaf - bis hin zu obstruktiver Schlafapnoe (obstructive sleep apnoea, OSA).
Der Kehlkopf (Larynx) stellt die Stimmbänder während der Einatmung in eine abduzierte Stellung, um den Atemwiderstand zu minimieren. In der Ausatmung erschlaffen die Stimmbänder, was einen physiologischen Druckanstieg (PEEP: positive end-exspiratory pressure) in der Höhe von 0,3-0,4 kPa (3-4 cm H2O) bedingt - nutzbar für Vokalisation und die Vermeidung alveolärer Kollapse.
Luftröhre (Trachea - Oberrand Höhe 6. Halswirbel, Unterrand Höhe T4/5) und Bronchien (bis
Generation 11, s.  Abbildung) sind durch Knorpelringe (bei der
Trachea offen C-förmig, mit einer posterioren Muskelschicht) vor
inspiratorischem Kollaps geschützt (jedenfalls bei intakter
Wandstruktur). Da der rechte Hauptbronchus weniger abgewinkelt aus der
Trachea abzweigt als der linke, gelangen in ihn inhalierte Partikel
(oder ein Endotrachealtubus) mit höherer Wahrscheinlichkeit als in den
linken.
Abbildung) sind durch Knorpelringe (bei der
Trachea offen C-förmig, mit einer posterioren Muskelschicht) vor
inspiratorischem Kollaps geschützt (jedenfalls bei intakter
Wandstruktur). Da der rechte Hauptbronchus weniger abgewinkelt aus der
Trachea abzweigt als der linke, gelangen in ihn inhalierte Partikel
(oder ein Endotrachealtubus) mit höherer Wahrscheinlichkeit als in den
linken.
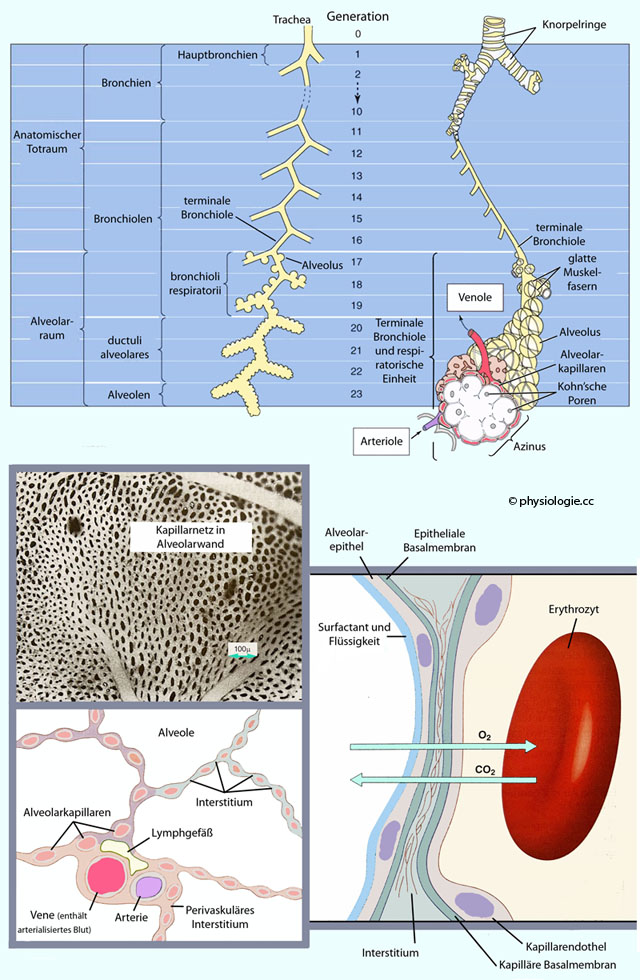

Abbildung: Bronchialbaum, Alveolen
Nach Vorlagen in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021, und Guyton and Hall, Textbook of Medical Physiology, 15th ed. Elsevier 2026
Oben: Sukzessive Aufteilungen der Luftwege bezeichnet man als Generationen (Trachea: 0, Bronchien 1-11, Bronchiolen 12-22 beim Menschen, nach
Weibel). Kapillärer Gasaustausch (Alveolarluft - Blut) erfolgt ab Generation 17
(bronchioli respiratorii). Die Querschnittsfläche beträgt in der Trachea ~2,5 cm
2, in den Bronchiolen (gesamt) 100 bis 5000, in den Alveolen ~eine Million cm
2.
Mit steigender
Generationszahl nehmen Ziliendichte, Anzahl von Mukuszellen und
submukösen Drüsen sowie Knorpelgewebe ab. Bronchien verfügen über
Knorpelringe, Bronchiolen nicht (aber über glatte Muskulatur, welche sie verengen kann - Bronchokonstriktion). Die Strömungsgeschwindigkeit nimmt (ab Generation 3) mit zunehmender Aufteilungszahl kontinuierlich ab ( Abbildung unten). Der Gesamtquerschnitt steigt vor allem in Abschnitten, wo Gasaustausch erfolgt.
Niedrigere Generationen
(bis bronchioli terminales) dienen der Luftleitung durch Strömung (Konstriktion durch kalte Luft, Histamin, Irritantien, parasympathische Wirkung, Dilatation durch ß2-Sympathikuswirkung), darunter (ab Generation 17) überwiegt der Gastransport durch Diffusion. Respiratorische Einheit (Versorgungsgebiet einer terminalen Bronchiole). Ein Acinus
ist die Struktur distal einer terminalen Bronchiole (Endbronchiole); er
besteht aus bronchioli respiratorii (Äste des bronchiolus
respiratorius), ductus alveolares (Alveolargängen) und Alveolen. Im
Acinus erfolgt Gasaustausch mit dem Blut.
Unten:
Lungenbläschen (Alveolen). Das Kapillarnetz in der Alveolarwand ist so
dicht gewebt, dass das Blut (wenn die Kapillaren nicht kollabiert sind)
wie durch einen flachen Spaltraum mit Säulen fließt (sheet flow). Getrieben durch den jeweiligen Partialdruckgradienten, diffundiert Sauerstoff in das Blut und CO2
in die Alveolen. Folgende Schichten werden dabei passiert: Surfactant
und Flüssigkeit, Alveolarepithel, alveoläre Basalmembran, Interstitium,
endotheliale Basalmembran, Kapillarendothel
Abbildung unten). Der Gesamtquerschnitt steigt vor allem in Abschnitten, wo Gasaustausch erfolgt.
Niedrigere Generationen
(bis bronchioli terminales) dienen der Luftleitung durch Strömung (Konstriktion durch kalte Luft, Histamin, Irritantien, parasympathische Wirkung, Dilatation durch ß2-Sympathikuswirkung), darunter (ab Generation 17) überwiegt der Gastransport durch Diffusion. Respiratorische Einheit (Versorgungsgebiet einer terminalen Bronchiole). Ein Acinus
ist die Struktur distal einer terminalen Bronchiole (Endbronchiole); er
besteht aus bronchioli respiratorii (Äste des bronchiolus
respiratorius), ductus alveolares (Alveolargängen) und Alveolen. Im
Acinus erfolgt Gasaustausch mit dem Blut.
Unten:
Lungenbläschen (Alveolen). Das Kapillarnetz in der Alveolarwand ist so
dicht gewebt, dass das Blut (wenn die Kapillaren nicht kollabiert sind)
wie durch einen flachen Spaltraum mit Säulen fließt (sheet flow). Getrieben durch den jeweiligen Partialdruckgradienten, diffundiert Sauerstoff in das Blut und CO2
in die Alveolen. Folgende Schichten werden dabei passiert: Surfactant
und Flüssigkeit, Alveolarepithel, alveoläre Basalmembran, Interstitium,
endotheliale Basalmembran, Kapillarendothel

Bei jeder Aufzweigung ist die Summe der Querschnitte der
Tochterbronchien größer als der Querschnitt des Mutterbronchus. Der Gesamtquerschnitt der Atemwege (Trachea etwa 2,5 cm2) nimmt mit zunehmender Generation zu: Zuerst (Bronchien) moderat, dann (Bronchiolen) steil ab Generation 12 bis 14, auf ~100 cm2 bei Generation 15 und bis ~500 cm2 bei Generation 18 (kumulierte Werte jeweils pro Generation).
Anmerkung:
Über die Anzahl der Aufteilungsgenerationen in der Lunge des Menschen
bestehen unterschiedliche Auffassungen. Manche Autoren kommen auf bis
zu 28 Generationen, meistens geht man von 23 aus.
Das bedeutet auch, dass die Strömungsgeschwindigkeit der Luft von Generation zu Generation abnimmt
(am schnellsten strömt die Luft in der Trachea), parallel zur Zunahme
des Gesamtquerschnitts. Die niedrige Strömungsgeschwindigkeit im Übergangsbereich zwischen Bronchien und ductuli alveolares fördert die Deposition eingeatmeter Mikropartikel (Reinigungsfunktion).
Bronchien liefern den Hauptanteil des Strömungswiderstandes
(Luftwege mit >2 mm
Durchmesser tragen weit über die Hälfte zum gesamten pulmonalen
Strömungswiderstand bei). Bronchien verfügen über Knorpelringe und sind
dadurch vor einem Verschluss bei hohen Strömungsgeschwindigkeiten (dynamische Atemwegskompression) geschützt.
Bronchiolen
tragen nur einen kleinen Teil zum gesamten Strömungswiderstand bei -
Erkrankungen in diesem Bereich sind schwierig über den Widerstand
zu detektieren.
Der Strömungswiderstand (in cm H2O/l/s) beträgt normalerweise

im Rachenbereich (Pharynx und Larynx) 0,6,

in Luftwegen >2 mm Durchmesser 0,6,

in Luftwegen <2 mm Durchmesser 0,3 (gesamt: 1,5).

 Abbildung: Strömungswiderstand der Luftwege (jeweils auf die Teilungsgeneration bezogen)
Nach Thien FCK: Measuring and imaging small airways dysfunction in asthma. Asia Pacific Allergy 2013; 3:224-30
Abbildung: Strömungswiderstand der Luftwege (jeweils auf die Teilungsgeneration bezogen)
Nach Thien FCK: Measuring and imaging small airways dysfunction in asthma. Asia Pacific Allergy 2013; 3:224-30
Der
Strömungswiderstand in den Atemwegen (kumuliert je Teilungsgeneration) gipfelt im Bereich der 4. Teilungsgeneration. Das hat mit der Geometrie der Luftwege und wahrscheinlich
auch mit Strömungsprofilen zu tun.
Die Zone der 4. bis 8. Teilungen bietet den höchsten Strömungswiderstand und wird auch als "choke point" der Atemdynamik bezeichnet, der wesentlich das Ergebnis von maximaler Strömung ( PEF) und Sekundenstoßtest (peak exspiratory flowforced exspiratory volume, 1st second - FEV1) beeinflusst

Bei einer COPD
(chronisch-obstruktiver Lungenerkrankung) kann der Widerstand in
Luftwegen >2 mm Durchmesser auf 0,9, in solchen <2 mm Durchmesser
auf 3,5 cmH2O/l/s ansteigen (und sich der Gesamtwiderstand von 1,5 auf 5 cmH2O/l/s mehr als verdreifachen).
Trachea und Bronchien
sind mit knorpeligen Ringen ausgestattet, sie enthalten (neben Flimmerepithel, über das auch Bronchiolen verfügen)
Schleimdrüsen, glatte Muskelzellen und schleimbildende Zellen (übernächste  Abbildung). Die Knorpelringe sind
notwendig, um diesen Strukturen die nötige Festigkeit zu verleihen.
Das
hat mit dem Bernoulli-Effekt
Abbildung). Die Knorpelringe sind
notwendig, um diesen Strukturen die nötige Festigkeit zu verleihen.
Das
hat mit dem Bernoulli-Effekt zu tun:
Strömt Gas (oder Flüssigkeit) entlang einer Struktur (z.B. der
Wand eines Bronchus), nimmt mit zunehmender Geschwindigkeit der Druck
senkrecht zur Strömungsrichtung ab. (Das erklärt z.B., warum ein
Flugzeug abhebt, wenn die Luft an der Oberseite der Flügel rascher
strömt als an der Unterseite, weil dann die nach oben gerichtete Kraft
größer ist als die nach unten gerichtete).
zu tun:
Strömt Gas (oder Flüssigkeit) entlang einer Struktur (z.B. der
Wand eines Bronchus), nimmt mit zunehmender Geschwindigkeit der Druck
senkrecht zur Strömungsrichtung ab. (Das erklärt z.B., warum ein
Flugzeug abhebt, wenn die Luft an der Oberseite der Flügel rascher
strömt als an der Unterseite, weil dann die nach oben gerichtete Kraft
größer ist als die nach unten gerichtete).
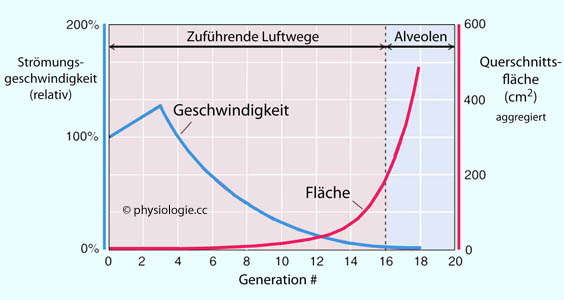
 Abbildung: Geschwindigkeit der Luftströmung und kumulierte Querschnittsfläche in verschiedenen Abschnitten der Luftwege
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Abbildung: Geschwindigkeit der Luftströmung und kumulierte Querschnittsfläche in verschiedenen Abschnitten der Luftwege
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Im
Bereich der 3. Aufteilungsgeneration (s. oben) strömt die Luft mit der
höchsten Relativgeschwindigkeit durch die Luftwege, danach nimmt die
Geschwindigkeit (entsprechend der zunehmenden Gesamtfläche) immer mehr
ab (blaue Kurve).
Die kumulierte
Querschnittsfläche (Trachea ~2,5 cm2) nimmt von Generation zu Generation in nichtlinearer
Weise zu (Generation 18: ~400 cm2), der Strömungswiderstand entsprechend ab ( Abbildung oben)
Abbildung oben)

In den Luftwegen bedeutet dieser Effekt, dass die Luft an Engstellen
einen Sogeffekt auf die Wand der Luftwege ausübt und ein Kollaps dieses
Abschnittes droht (dynamische Atemwegskompression,  s. dort).
Bei Anstieg der Strömungsgeschwindigkeit steigt also die
Wahrscheinlichkeit einer Obstruktion der betroffenen Luftwege. Durch
die Verengung reißt die Strömung ab, der Vorgang wiederholt sich, und
es kann zu Oszillationen der Wand kommen (z.B. bei "bellendem" Husten).
Bronchiolen hingegen haben keine Knorpelringe, sind am umgebenden
Gewebe befestigt und werden von diesem im eingeatmeten Zustand geweitet ("aufgespreizt"). Das trägt dazu bei, dass der Betrag des Atemwiderstandes stark von der Atemlage abhängt (
s. dort).
Bei Anstieg der Strömungsgeschwindigkeit steigt also die
Wahrscheinlichkeit einer Obstruktion der betroffenen Luftwege. Durch
die Verengung reißt die Strömung ab, der Vorgang wiederholt sich, und
es kann zu Oszillationen der Wand kommen (z.B. bei "bellendem" Husten).
Bronchiolen hingegen haben keine Knorpelringe, sind am umgebenden
Gewebe befestigt und werden von diesem im eingeatmeten Zustand geweitet ("aufgespreizt"). Das trägt dazu bei, dass der Betrag des Atemwiderstandes stark von der Atemlage abhängt ( s. dort): Mit der Inspiration werden die Luftwege weiter, der Strömungswiderstand geringer.
s. dort): Mit der Inspiration werden die Luftwege weiter, der Strömungswiderstand geringer.
 Die
Strömungsgeschwindigkeit der Luft ist in der Trachea am höchsten, in
den Bronchiolen am niedrigsten (umgekehrt proportional zum
Gesamtquerschnitt).
Zentrale Stenosen - im Larynx- bis Hauptbronchusbereich - führen zu massiver Widerstandserhöhung.
Bei Verengung der kleinen Bronchien findet man hingegen oft einen
unauffälligen Resistance-Betrag. Emphyseme zerstören das stützende
Gewebe um die Bronchiolen und erhöhen deren Kollapsneigung.
Die
Strömungsgeschwindigkeit der Luft ist in der Trachea am höchsten, in
den Bronchiolen am niedrigsten (umgekehrt proportional zum
Gesamtquerschnitt).
Zentrale Stenosen - im Larynx- bis Hauptbronchusbereich - führen zu massiver Widerstandserhöhung.
Bei Verengung der kleinen Bronchien findet man hingegen oft einen
unauffälligen Resistance-Betrag. Emphyseme zerstören das stützende
Gewebe um die Bronchiolen und erhöhen deren Kollapsneigung.

 Abbildung: Morphologie der Luftwege von Trachea bis Alveole
Nach einer Vorlage bei Fishman AP: Fishman’s Pulmonary Diseases and Disorders, 4th ed. McGraw Hill Medical 2008
Abbildung: Morphologie der Luftwege von Trachea bis Alveole
Nach einer Vorlage bei Fishman AP: Fishman’s Pulmonary Diseases and Disorders, 4th ed. McGraw Hill Medical 2008
Große
luftführende Strukturen (Trachea, Hauptbronchien, Lappen- und
Segmentbronchien) verfügen über knorpelige Abstützungsringe und Drüsen,
das innere Epithel ist hochzylindrisch und verfügt über ein hochaktives
Flimmerepithel (links).
Die Strömungsgeschwindigkeit nimmt mit zunehmender Aufteilung stetig ab, der Strömungswiderstand steigt bei den ersten Teilungsgenerationen zunächst etwas an und sinkt anschließend kontinuierlich ab (Abbildung oben). Durch insgesamt
23 Aufteilungsschritte vergrößert sich die Oberfläche in der Lunge um
drei Zehnerpotenzen, von ~0,1 auf 50-100 m2

Die Verteilung der Luft im Bereich der bronchioli respiratorii und der ductuli alveolares - die wegen der großen Anzahl (mehrere 106) und dem Gesamtquerschnitt kaum zum Strömungswiderstand beitragen - ist vorwiegend über die Dehnbarkeit
seiner Komponenten bestimmt: Je größer die Compliance, desto besser die
Belüftung. Da die Compliance mit dem Durchmesser des betreffenden
Luftweges abnimmt (je stärker gedehnt, desto steifer die Wand), werden
gering gefüllte Teile (mit schlaffer Wand) besonders gut belüftet (z.B.
in der Lungenbasis bei aufrechter Körperlage,
 s. dort).
Automatischer Angleich der alveolaren Dehnung:
Dieser Mechanismus trägt zur gleichmäßigen Luftfüllung in benachbarten
Lungenabschnitten bei (je geringer der Luftinhalt, desto leichter
füllen sich die Alveolen). Unterstützt wird dieser
"Nachbarschaftsabgleich" durch die Anwesenheit interalveolärer
Öffnungen (Kohn-sche Poren
s. dort).
Automatischer Angleich der alveolaren Dehnung:
Dieser Mechanismus trägt zur gleichmäßigen Luftfüllung in benachbarten
Lungenabschnitten bei (je geringer der Luftinhalt, desto leichter
füllen sich die Alveolen). Unterstützt wird dieser
"Nachbarschaftsabgleich" durch die Anwesenheit interalveolärer
Öffnungen (Kohn-sche Poren ,
,  Abbildung oben),
welche benachbarte Alveolen eines Lungenlappens untereinander
verbinden. Auf diesem Wege können auch Alveolen belüftet werden, deren
ductulus alveolaris obstruiert ist.
Mechanische Stabilisierung:
Benachbarte Alveolen teilen sich bienenwabenartig gemeinsame Wände und
sind mittels Kollagen- und Elastinfasern an benachbarten Luftwegen
befestigt. Diese Architektur verteilt auftretende Kräfte stabilisierend
auf das Gerüstwerk und verhindert den Kollaps einzelner Alveolen. Dazu
kommt der Effekt der "Surfactant-Bremse" (
Abbildung oben),
welche benachbarte Alveolen eines Lungenlappens untereinander
verbinden. Auf diesem Wege können auch Alveolen belüftet werden, deren
ductulus alveolaris obstruiert ist.
Mechanische Stabilisierung:
Benachbarte Alveolen teilen sich bienenwabenartig gemeinsame Wände und
sind mittels Kollagen- und Elastinfasern an benachbarten Luftwegen
befestigt. Diese Architektur verteilt auftretende Kräfte stabilisierend
auf das Gerüstwerk und verhindert den Kollaps einzelner Alveolen. Dazu
kommt der Effekt der "Surfactant-Bremse" ( s. dort).
s. dort).
Die Alveolen sind mit zwei Typen von Epithelzellen (Pneumozyten) ausgekleidet:
 Typ-I-Alveolarzellen
- der dominierende Zelltyp - sind außerordentlich flach und bilden die
Barriere zwischen Alveolarluft und Kapillarblut. Sie bedecken 90-95%
der Alveolaroberfläche. Die Diffusionsstrecke für die Atemgase beträgt
in diesem Bereich 0,15-0,3 µm (Pneumozyt plus Endothelzelle).
Typ-I-Alveolarzellen
- der dominierende Zelltyp - sind außerordentlich flach und bilden die
Barriere zwischen Alveolarluft und Kapillarblut. Sie bedecken 90-95%
der Alveolaroberfläche. Die Diffusionsstrecke für die Atemgase beträgt
in diesem Bereich 0,15-0,3 µm (Pneumozyt plus Endothelzelle).
 Die eher würfelförmigen, in Gruppen auftretenden Typ-II-Alveolarzellen (5-10% der Alveolaroberfläche) ragen in die Alveolarhöhle hinein und bilden das oberflächenaktive Surfactant. Sie scheinen auch an Reparaturvorgängen beteiligt zu sein.
Alveolarmakrophagen (Staubzellen) stammen von Blutmonozyten ab und entfernen Fremdkörper aus der Alveole.
Die Funktionen der alveolär-kapillären Barriere sind die folgenden:
Die eher würfelförmigen, in Gruppen auftretenden Typ-II-Alveolarzellen (5-10% der Alveolaroberfläche) ragen in die Alveolarhöhle hinein und bilden das oberflächenaktive Surfactant. Sie scheinen auch an Reparaturvorgängen beteiligt zu sein.
Alveolarmakrophagen (Staubzellen) stammen von Blutmonozyten ab und entfernen Fremdkörper aus der Alveole.
Die Funktionen der alveolär-kapillären Barriere sind die folgenden:
 Gasaustausch
Gasaustausch
 Verhinderung eines Übertritts von Blut oder Trassudat in den Alveolarraum
Verhinderung eines Übertritts von Blut oder Trassudat in den Alveolarraum
 Zurückhalten allfälliger Gasbläschen (Vermeidung einer Gasembolie)
Zurückhalten allfälliger Gasbläschen (Vermeidung einer Gasembolie)
Atemgase (O2, CO2) lösen sich in den
Körperflüssigkeiten entsprechend ihrem Partialdruck und ihrer
spezifischen Löslichkeit. Nach dem Henry-Gesetz  ist die Konzentration c eines in einer Flüssigkeit gelösten Gases proportional zu dessen Partialdruck p mal dem Betrag des Löslichkeitskoeffizienten H:
ist die Konzentration c eines in einer Flüssigkeit gelösten Gases proportional zu dessen Partialdruck p mal dem Betrag des Löslichkeitskoeffizienten H:
Der Betrag von H ist spezifisch für das jeweilige Paar
Gas-Flüssigkeit. Beispielsweise ist die Löslichkeit von CO2 in Körperflüssigkeiten wesentlich höher als diejenige von Sauerstoff,  s.
s.  Abbildung und dort.
Abbildung und dort.
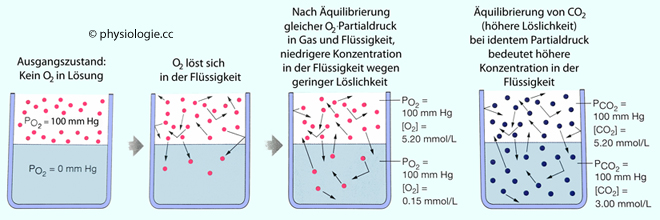
 Abbildung: Lösung von Gasen (Sauerstoff und Kohlendioxid) in Wasser
Nach einer Vorlage bei Silverthorn, Human Physiology - an integrated approach, 4th ed. Pearson International 2007
Abbildung: Lösung von Gasen (Sauerstoff und Kohlendioxid) in Wasser
Nach einer Vorlage bei Silverthorn, Human Physiology - an integrated approach, 4th ed. Pearson International 2007
Von links nach rechts:
Ein Gasgemisch mit einem pO2 = 100 mmHg (weiß) kommt mit Wasser (blau),
das keinen Sauerstoff enthält, in Berührung (Ausgangszustand).
Sauerstoffmoleküle diffundieren in die Flüssigkeit (Pfeile deuten die Bewegung der Moleküle an) und werden dort gelöst.
Bei Sätigung
ist die Zahl der Moleküle, die in die Flüssigkeit eintreten, gleich
derjeniger, die sie wieder verlassen (Äquilibrierung). Der
Sauerstoffpartialdruck in beiden Phasen ist gleich groß. Wieviel Gas
sich in der Flüssigkeit befindet, hängt von seiner
Löslichkeitskonstanten (für die betreffende Flüssigkeit) ab.
Kohlendioxid hat eine höhere Löslichkeitskonstante als Sauerstoff, bei Äquilibrierung ist die Zahl der CO2-Moleküle höher als die der O2-Moleküle bei gleichem Partialdruck
 Eine erwachsene Person verbraucht im Ruhezustand pro Minute ~0,3 Liter Sauerstoff für den (oxidativen) Energiestoffwechsel. Gleichzeitig werden etwa 0,25 Liter Kohlendioxid abgeatmet.
Eine erwachsene Person verbraucht im Ruhezustand pro Minute ~0,3 Liter Sauerstoff für den (oxidativen) Energiestoffwechsel. Gleichzeitig werden etwa 0,25 Liter Kohlendioxid abgeatmet.
 Das Zahlenverhältnis CO2-Abgabe / O2-Aufnahme des Organismus (bezogen auf dieselbe Zeitspanne) heißt respiratorischer Quotient (RQ, respiratory quotient, respiratory coefficient).
Sein Wert (unter steady state-Bedingungen) hängt von Ernährung und Stoffwechselzustand ab
(0,7, wenn der Metabolismus ausschließlich Fette oxidiert, 1,0, wenn es
nur Kohlenhydrate sind, 0,8-0,85 bei Abbau durchschnittlicher
gemischter Kost) - im Schnitt beträgt der Wert ~0,82.
Der Betrag des RQ ergibt sich aus der Kohlendioxidabgabe in den Alveolarraum (hier beträgt der CO2-Anteil etwa 5%, Frischluft hat 0,04%)
einerseits, gebrochen durch die Sauerstoffaufnahme aus dem Alveolarraum
andererseits (mindestens 1/4 des mit der Inspirationsluft zugeführten Sauerstoffs
verschwindet aus den Alveolen in den Kreislauf):
Das Zahlenverhältnis CO2-Abgabe / O2-Aufnahme des Organismus (bezogen auf dieselbe Zeitspanne) heißt respiratorischer Quotient (RQ, respiratory quotient, respiratory coefficient).
Sein Wert (unter steady state-Bedingungen) hängt von Ernährung und Stoffwechselzustand ab
(0,7, wenn der Metabolismus ausschließlich Fette oxidiert, 1,0, wenn es
nur Kohlenhydrate sind, 0,8-0,85 bei Abbau durchschnittlicher
gemischter Kost) - im Schnitt beträgt der Wert ~0,82.
Der Betrag des RQ ergibt sich aus der Kohlendioxidabgabe in den Alveolarraum (hier beträgt der CO2-Anteil etwa 5%, Frischluft hat 0,04%)
einerseits, gebrochen durch die Sauerstoffaufnahme aus dem Alveolarraum
andererseits (mindestens 1/4 des mit der Inspirationsluft zugeführten Sauerstoffs
verschwindet aus den Alveolen in den Kreislauf):
RQ = [CO2]Alveolarluft / ([O2]Inspirationsluft - [O2]Alveolarluft)
|
wobei [ ] den Volumenanteil des Gases in der jeweiligen Gasprobe bedeutet (z.B. [O2]Inspirationsluft 21%, [O2]Alveolarluft 16%). Der Betrag des Terms
([O2]Inspirationsluft - [O2]Alveolarluft) entspricht der Sauerstoffaufnahme in den Körper.
Der respiratorische Quotient (RQ) ist definiert als CO2-Produktion gebrochen durch O2-Aufnahme des Körpers. Sein Betrag errechnet sich aus
[CO2]Alveolarluft dividiert durch ([O2]Inspirationsluft - [O2]Alveolarluft) |
Atmung erfolgt durch Druckschwankungen in der Lunge
Der
direkte physikalische Grund für Luftströmung in die (Inspiration) oder
aus der Lunge (Expiration) ist ein Druckunterschied zwischen Außenwelt
(pB: Barometrischer Druck) und Druck in den Alveolen (pA).
Am Vorgang der Atmung nehmen folgende Akteure teil ( Abbildung):
Abbildung):
 Der knöcherne Thorax (mit seiner
spezifischen Volumendehnbarkeit),
Der knöcherne Thorax (mit seiner
spezifischen Volumendehnbarkeit),
 die Atemmuskulatur (vor allem für
die Inspiration),
die Atemmuskulatur (vor allem für
die Inspiration),
 die Luftwege (Verbindung zwischen Außenluft und
Alveolen),
die Luftwege (Verbindung zwischen Außenluft und
Alveolen),
 die Pleura
die Pleura  (der Spalt zwischen den Pleurablättern unterliegt
die meiste Zeit einem subatmosphärischen Druck),
(der Spalt zwischen den Pleurablättern unterliegt
die meiste Zeit einem subatmosphärischen Druck),
 der zuständige Teil
des Nervensystems (Atemzentrum und übergeordnete Hirnteile, afferente und efferente Nerven, Rezeptoren).
der zuständige Teil
des Nervensystems (Atemzentrum und übergeordnete Hirnteile, afferente und efferente Nerven, Rezeptoren).

 Abbildung: Das Ventilationssystem
Abbildung: Das Ventilationssystem
Nach
einer Vorlage bei Schwartzstein / Parker, Respiratory Physiology: A
Clinical Approach. Lippincott Williams & Wilkins 2006
Das
Bild zeigt die Schlüsselelemente des Atmungsapparates. Die Innervation
des Diaphragma erfolgt aus den Halssegmenten C3-C5 (bei tieferen
Rückenmarksläsionen bleibt die Zwerchfellatmung aufrecht). Die
Interkostalmuskeln werden aus dem Thorakalmark innerviert, die
Bauchmuskulatur aus unterem Brust- sowie Lendenmark

Ventilation
 ist die Belüftung der lufthältigen Räume (Luftwege: Trachea, Bronchien
ist die Belüftung der lufthältigen Räume (Luftwege: Trachea, Bronchien  ,
Bronchiolen, Alveolen). In ausgeatmeter Ruhelage befindet sich in der Lunge eine Luftmenge, die als funktionelle Residualkapazität bezeichnet wird. Die Luftmenge, die pro Zeit geatmet wird, heißt
Atemzeitvolumen.
Eingeatmete Luft gelangt
durch die zuführenden Luftwege (Rachen, Kehlkopf, Bronchien, Bronchiolen) in
die Lungenbläschen (Alveolen), wo der Atemgasaustausch mittels Diffusion stattfindet.
,
Bronchiolen, Alveolen). In ausgeatmeter Ruhelage befindet sich in der Lunge eine Luftmenge, die als funktionelle Residualkapazität bezeichnet wird. Die Luftmenge, die pro Zeit geatmet wird, heißt
Atemzeitvolumen.
Eingeatmete Luft gelangt
durch die zuführenden Luftwege (Rachen, Kehlkopf, Bronchien, Bronchiolen) in
die Lungenbläschen (Alveolen), wo der Atemgasaustausch mittels Diffusion stattfindet.
 Die Zufuhr frischer Atemluft an die Alveolen wird als alveoläre Ventilation
bezeichnet. Sie ist für den Austausch der Atemgase maßgeblich und ergibt sich aus insgesamt geatmeter Frischluft
minus der Totraumbelüftung. Macht z.B. das Inspirationsvolumen
600 ml und der Totraum 25% der eingeatmeten Luftmenge aus (150 ml),
verbleiben bei diesem Atemzug 75% (also 450 ml) für die alveoläre Frischluftzufuhr (alveoläre Ventilation).
Erhöhung der Atemfrequenz und/oder Vertiefung der Atmung verstärkt den venösen Rückstrom (venous return) und damit (über den Starling-Mechanismus) das Herzzeitvolumen. Umgekehrt kann untypische Atmung wie z.B. Atmen gegen einen Widerstand (Valsalva-Versuch) den umgekehrten Effekt haben und die Auswurfleistung des Herzens (vorübergehend) reduzieren.
Die Zufuhr frischer Atemluft an die Alveolen wird als alveoläre Ventilation
bezeichnet. Sie ist für den Austausch der Atemgase maßgeblich und ergibt sich aus insgesamt geatmeter Frischluft
minus der Totraumbelüftung. Macht z.B. das Inspirationsvolumen
600 ml und der Totraum 25% der eingeatmeten Luftmenge aus (150 ml),
verbleiben bei diesem Atemzug 75% (also 450 ml) für die alveoläre Frischluftzufuhr (alveoläre Ventilation).
Erhöhung der Atemfrequenz und/oder Vertiefung der Atmung verstärkt den venösen Rückstrom (venous return) und damit (über den Starling-Mechanismus) das Herzzeitvolumen. Umgekehrt kann untypische Atmung wie z.B. Atmen gegen einen Widerstand (Valsalva-Versuch) den umgekehrten Effekt haben und die Auswurfleistung des Herzens (vorübergehend) reduzieren.
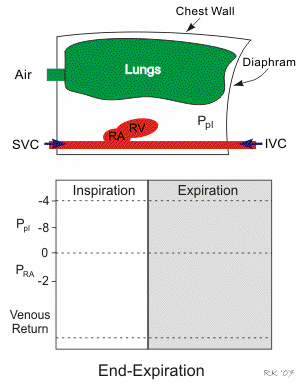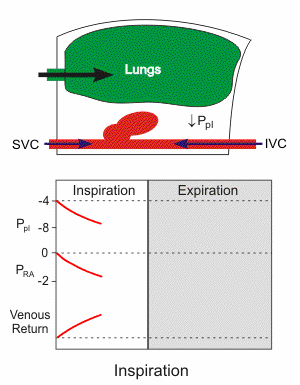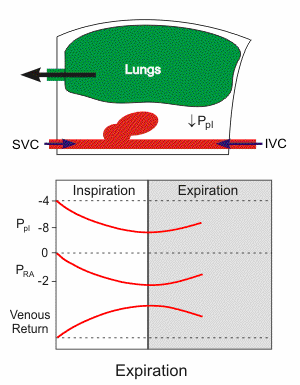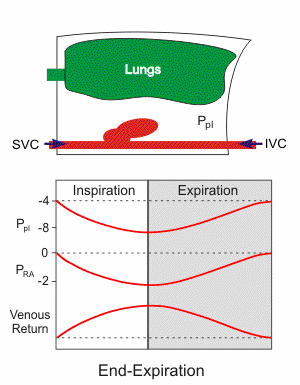

Animation: Atempumpe
Quelle: cvphysiology.com/Cardiac Function
Einatmung
senkt den Druck im Brustraum. Dadurch strömt einerseits Luft in die
Lunge, andererseits auch vermehrt Blut in den Brustraum, mit der Folge
besserer diastolischer Füllung des rechten Ventrikels.
Ppl = intrapleuraler Druck  pRA = Druck im rechten Vorhof (Zentralvenendruck)
pRA = Druck im rechten Vorhof (Zentralvenendruck)  RA, RV = rechter Vorhof / Ventrikel
RA, RV = rechter Vorhof / Ventrikel  SVC, IVC = obere / untere Hohlvene
SVC, IVC = obere / untere Hohlvene

Erhöhter Druck im rechten Vorhof erschwert den Bluteinstrom aus
der Peripherie zum Herzen, und verringert so den venösen Rückstrom
(z.B. beim Pressen) - umgekehrt nimmt der venöse Blutfluss bei reduziertem Vorhofdruck zu
(z.B. bei tiefer Einatmung).
Auch beeinflusst die Atmung den Durchmesser der Hohlvenen und
Herzräume (steigt bei Einatmung), was sich auf den venösen Rückfluss direkt (z.B. durch
Kompression der v. cava) oder indirekt (über die Vorlast des Herzens)
auswirkt.
 Als intrapleuralen Druck pip bezeichnet
man den Druck im Pleuraspalt, also zwischen pleura visceralis (der
Lunge aufliegend) und pleura parietalis (Innenseite der Thoraxwand,
Oberseite des Diaphragma). [pip]
ist in Atemruhelage geringer als der Außendruck (ca. -0,5 kPa), weil
die Lunge auf den Pleuraspalt einen nach innen gerichteten Zug ausübt
(elastische Fasern, Oberflächenspannung).
Als intrapleuralen Druck pip bezeichnet
man den Druck im Pleuraspalt, also zwischen pleura visceralis (der
Lunge aufliegend) und pleura parietalis (Innenseite der Thoraxwand,
Oberseite des Diaphragma). [pip]
ist in Atemruhelage geringer als der Außendruck (ca. -0,5 kPa), weil
die Lunge auf den Pleuraspalt einen nach innen gerichteten Zug ausübt
(elastische Fasern, Oberflächenspannung).
In Atemruhelage ist der intrapleurale Druck subatmosphärisch.
Er beträgt im exspirierten Zustand etwa -0,5 kPa, bei normaler Inspirationsstellung -0,7 bis -0,8 kPa
|
Normalerweise befinden sich etwa 10 ml (5-15 ml) Pleuraflüssigkeit - eine transzelluläre Flüssigkeit - im Pleuraspalt. Pleuraflüssigkeit entsteht durch kapilläre Filtration
der parietalen Pleurablätter an der Innenseite der Thoraxwand, der
Abfluss erfolgt über Lymphgefäße der (dem Lungengewebe direkt aufliegenden) pleura visceralis. Die Bildungsrate beträgt 0,01 ml/h/ kg
Körpergewicht, also bei einer 70 kg schweren Person etwa 0,7 ml/h (7%) - die
gesamte Pleuraflüssigkeit wird in weniger als einem Tag erneuert.
Überwiegt die Filtration den Abtransport, sammelt sich Flüssigkeit im
Pleuraraum an (Pleuraerguss, pleural effusion).
Die Pleuraflüssigkeit erleichtert die Scherbewegung der Pleurablätter gegeneinander, die bei der Atmung auftritt. Diese
Relativbewegung wird durch entzündliches Verkleben der Pleurablätter
(Pleuritis) behindert, was die Atmung schmerzhaft macht und behindert.
 Die Pleuraflüssigkeit hält die Lunge dicht an der Brustwand und reduziert den Reibungswiderstand.
Die Pleuraflüssigkeit hält die Lunge dicht an der Brustwand und reduziert den Reibungswiderstand.
Der intrapleurale Druck wirkt sich auf den Druck im Niederdrucksystem des Kreislaufs aus: Einatmung erweitert den
Brustraum und macht [pip]
stärker subatmosphärisch ("negativ"), was Lunge, Venen und rechtes Herz expandieren lässt und den Druck in diesen Räumen
senkt. Der transmurale Druck im rechten Ventrikel nimmt zu, weil der Innendruck weniger stark abnimmt als der
intrapleurale.
 Als transmuralen Druck bezeichnet man den radiären Druckgradienten bei einem Hohlorgan (Herzkammer, Gefäß, Luftweg, Alveole..), d.h. die Differenz zwischen dem Innen- und Außendruck (z.B. hydrostatischer Druck in einer Vene minus umgebender Gewebedruck).
Als transmuralen Druck bezeichnet man den radiären Druckgradienten bei einem Hohlorgan (Herzkammer, Gefäß, Luftweg, Alveole..), d.h. die Differenz zwischen dem Innen- und Außendruck (z.B. hydrostatischer Druck in einer Vene minus umgebender Gewebedruck).
Ein Sonderfall ist der transpulmonale Druck,
das ist die Differenz intraalveolärer minus intrapleuraler Druck (der
Pleuradruck ist für die Alveole funktionell der "Außendruck"). Ein
positiver Druckbetrag hält das Hohlorgan offen, ein negativer lässt es
kollabieren (z.B. Atelektasen in der Lunge).
Transpulmonaler Druck
Ptp = PA - PIP
|
PA = Alveolardruck, PIP = interpleuraler Druck. Ein positiver Druckbetrag ergibt sich
z.B. bei Atemruhe und offener Glottis durch den
"negativen"intrapleuralen Druck. Er kann aber auch durch
Überdruckbeatmung erreicht werden (PAP positive airway pressure ventilation - APAP automatic, BPAP bilevel, CPAP continuous, EPAP expiratory).
Der inspiratorische Anstieg des transmuralen Drucks weitet die Herzkammer, begünstigt den Bluteinstrom und erhöht so die Füllung des rechten Ventrikels (kardiale Vorlast). Das vermehrt das Schlagvolumen
in der Systole (Frank-Starling-Mechanismus). Darüber hinaus begünstigt ein reduzierter Vorhofdruck den venösen Rückstrom von der Kreislaufperipherie
zum Herzen (erhöhtes Druckgefälle).
Bei der Exspiration ergeben sich entgegengesetzte Effekte geringeren Ausmaßes; der Nettoeffekt der Atmung ist eine Stärkung des Blutflusses durch den zentralen Kreislauf (Herz und Lunge).
Das linke Herz reagiert
auf den
Atemzyklus anders: Inspiration erhöht das Blutvolumen in der Lunge (siehe oben), was
vorübergehend den Einstrom von Blut in den linken Vorhof reduziert.
Also sinkt
die Auswurfleistung des linken Ventrikels während der Einatmung. Die
Ausatmung zeitigt einen (kleineren) entgegengesetzten Effekt, und insgesamt bewirkt Erhöhung
der Atemfrequenz und/oder Vertiefung der Atmung auch im linken Herzen
eine Erhöhung von Schlagvolumen und Herzzeitvolumen.

 Abbildung: Volumen- und transpulmonaler Druckverlauf eines Respirationszyklus
Abbildung: Volumen- und transpulmonaler Druckverlauf eines Respirationszyklus
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 3rd ed., Elsevier 2016
Links: Zustand "a" und "b" im Atemzyklus mit zugehörigen Werten des transpulmonalen Drucks (Zustand "c" und "d" s. nächstes Bild). pB = Luftdruck (außen bzw. Ganzkörper- Plethysmographiekammer), pIP = intrapleuraler Druck, ptp = transpulmonaler Druck, pA = Alveolardruck (Drucke in cm H2O relativ zu pB).
Rechts oben: Änderungen des
Lungenvolumens während eines Atemzyklus. FRC = funktionelle
Residualkapazität (=das bei ausgeatmetem Ruhezustand in der Lunge
befindliche Luftvolumen, in diesem Fall 3,2 l).
Rechts unten: Zeitverlauf des intrapleuralen und transpulmonalen Drucks während eines Atemzyklus. Inset: Statisches
Druck-Volumen-Verhältnis (Volumenänderung als Funktion des
transpulmonalen Drucks). Der Unterschied zwischen dem transpulmonalen
und dem Pleuradruck (b-b', d'-d) ergibt sich aus der Atemdynamik: Alveolardruck und Luftströmung folgen dem Pleuradruck mit Verzögerung nach (s. nächste Abbildung)

Die beiden Abbildungen "Respirationszyklus" illustrieren - in vereinfachter Darstellung -, dass der intrapleurale Druck zwei Komponenten aufweist:
 Eine statische, welche das Lungenvolumen bestimmt (transpulmonaler Druck ptp: Alveolardruck PA - Pleuradruck PIP);
Eine statische, welche das Lungenvolumen bestimmt (transpulmonaler Druck ptp: Alveolardruck PA - Pleuradruck PIP);


eine
dynamische, welche den Luftstrom steuert (Druckgefälle: Alveolardruck p
A - Außendruck p
B).
Mit zunehmender Einatmungstiefe nimmt der intrapleurale Druck konstant weiter ab (elastische Rückstellkräfte nehmen zu), der Alveolardruck
nur vorübergehend (soferne ein Druckausgleich mit "außen" über offene
Luftwege möglich ist). Die Punkte in den Abbildungen bedeuten:
 a: Vor Beginn der Inspiration; statische Bedingungen, die Lunge enthält die FRC
a: Vor Beginn der Inspiration; statische Bedingungen, die Lunge enthält die FRC
 b: Inspiration zur Hälfte abgeschlossen; dynamische Bedingungen
b: Inspiration zur Hälfte abgeschlossen; dynamische Bedingungen
 c: Inspiration abgeschlossen. Lungen beinhalten FRC + AZV
c: Inspiration abgeschlossen. Lungen beinhalten FRC + AZV
 d: Exspiration zur Hälfte abgeschlossen; dynamische Bedingungen
d: Exspiration zur Hälfte abgeschlossen; dynamische Bedingungen
 e: Vor Beginn der nächsten Inspiration; statische Bedingungen
e: Vor Beginn der nächsten Inspiration; statische Bedingungen
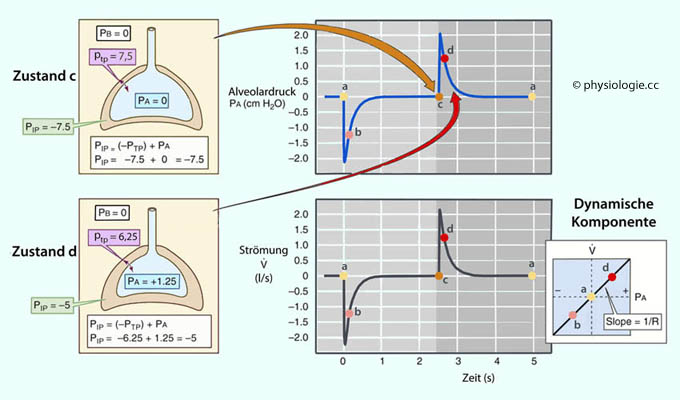
 Abbildung: Alveolardruck- und Strömungsverlauf eines Respirationszyklus
Abbildung: Alveolardruck- und Strömungsverlauf eines Respirationszyklus
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 3rd ed., Elsevier 2016
Links: Zustand "c" und "d" im Atemzyklus mit zugehörigen Druckwerten (Zustand "a" und "b" s. vorhergehendes Bild). pB = Luftdruck (außen bzw. Kammer für die Ganzkörperplethysmographie), pIP = intrapleuraler Druck, ptp = transpulmonaler Druck, pA = Alveolardruck (Drucke in cm H2O relativ zu pB).
Rechts oben: Änderungen des Alveolardrucks während eines Atemzyklus.
Rechts unten: Luftströmung während eines Atemzyklus. Inset: Dynamisches Druck-Volumen-Verhältnis
(Strömung als Funktion des alveolären Drucks).
Die Steilheit der
Geraden (slope) entspricht dem Kehrwert des Atemwegwiderstandes, ist also umso
größer, je leichter die Luft durch die Bronchien strömt
(Bronchodilatation, Zustand bei hohem Sympathikustonus)
Als Atempumpe kann insgesamt das Zusammenwirken von


Atemzentrum (Störung: z.B.
Schlafapnoe),

Nerven (Störung: z.B.
Phrenikusparese),

Atemmuskulatur (Störung: z.B.
neuromuskuläre Probleme) und

Skelettsystem (Störung: z.B.
Kyphoskoliose)

bezeichnet werden.
Atmung überwindet mechanische und dynamische Widerstände

Bei der Atmung müssen zwei Arten von Widerstand (Resistance) überwunden werden:
 Der Atemwegwiderstand (Druck pro Strömung), der bei der Luftströmung durch die Atemwege auftritt, und
Der Atemwegwiderstand (Druck pro Strömung), der bei der Luftströmung durch die Atemwege auftritt, und
 der Gewebewiderstand, der bei der Atmung auftritt (Dehnung der Lunge, Reibung der Pleurablätter, Verformung von Gewebe).
der Gewebewiderstand, der bei der Atmung auftritt (Dehnung der Lunge, Reibung der Pleurablätter, Verformung von Gewebe).


Abbildung: Atemwiderstand als Funktion des Lungenvolumens
Nach John Hopkins School of Medicine's Interactive Respiratory Physiology 1995
Bei
zunehmender Inspiration weiten sich die Atemwege (vor allem im Bereich
der Bronchiolen), der Innenradius steigt, und der Atemwegwiderstand (Resistance)
nimmt in nichlinearer Weise ab (blaue Kurve).
Zwischen tiefer Ein- (wenige Zehntel cmH2O/l/s) und
Ausatmung (~5 cmH2O/l/s) liegt ein Unterschied des Strömungswiderstandes um einen Faktor >10

Der Atemwegwiderstand ist physiologischerweise der führende Anteil, er macht ~85% des Gesamtwiderstandes aus. Sein Betrag hängt stark von der Atemtiefe ab: Der Atemwegwiderstand ist am höchsten bei tiefer Exspiration (enge Atemwege, geringer Innendurchmesser).
Bei
zunehmender Inspiration weiten sich die Atemwege (vor allem im Bereich
der Bronchiolen), der Innendurchmesser steigt, und der Atemwegwiderstand
nimmt in nichlinearer Weise ab ( Abbildung).
Zwischen tiefer Ein- und
Ausatmung liegt ein Unterschied des Strömungswiderstandes um etwa eine
Zehnerpotenz. Ein weiterer Mechanismus ist das gegenseitige Aufdehnen
der miteinander verbundenen Alveolen und der in diesem
wabenförmigen "Netz" verankerten Bronchien (Prinzip der Interdependenz,
s. dort).
Normalerweise beansprucht die
Atmung nur einen sehr kleinen Teil des Gesamt-Energieverbrauchs des
Organismus. Je enger die Bronchien sind (Innendurchmesser), umso größer
ist der Strömungswiderstand und umso schwerer erfolgt die Ventilation.
Abbildung).
Zwischen tiefer Ein- und
Ausatmung liegt ein Unterschied des Strömungswiderstandes um etwa eine
Zehnerpotenz. Ein weiterer Mechanismus ist das gegenseitige Aufdehnen
der miteinander verbundenen Alveolen und der in diesem
wabenförmigen "Netz" verankerten Bronchien (Prinzip der Interdependenz,
s. dort).
Normalerweise beansprucht die
Atmung nur einen sehr kleinen Teil des Gesamt-Energieverbrauchs des
Organismus. Je enger die Bronchien sind (Innendurchmesser), umso größer
ist der Strömungswiderstand und umso schwerer erfolgt die Ventilation.
 Mehr zum Atemwegwiderstand s. dort
Mehr zum Atemwegwiderstand s. dort
Histamin und Leukotriene (LTC4, LTD4) sowie Acetylcholin (muskarinerg - Entspannungszustand, rest and digest) regen eine Kontraktion der Muskelwand der Bronchien an und verengen sie (Bronchokonstriktion) - der Strömungswiderstand steigt an. Das ist im Ruhezustand problemlos; die Konstriktion der Bronchien vertieft die Einfaltungen ihrer Schleimhaut, was vermutlich der Reinigung der Einatemluft von Partikeln, Pathogenen u.a. zugutekommt.
Umgekehrt rufen Katecholamine (insbesondere Adrenalin, das besonders stark an ß2-Rezeptoren andockt) eine
Bronchodilatation bewirken und den Luftstrom erleichtern - der Strömungswiderstand sinkt ab (Stresssituation).
Sympathikuswirkung / Adrenalin erschlafft über ß2-Rezeptoren und cAMP-Anstieg die glatte Muskulatur der Bronchienwände (Bronchodilatation) und senkt so den Atemwegwiderstand
|
ß2-Rezeptoren reagieren vor allem auf Adrenalin und aktivieren über G-Proteine die Adenylatzyklase der Zielzellen - die Konzentration an cAMP steigt an und dilatiert die Bronchien. Phosphodiesterase baut cAMP ab und reduziert dadurch die Adrenalinwirkung.
 Phosphodiesterasehemmer
(z.B. Theophyllin) unterstützen die Adrenalinwirkung (sie erhöhen den
cAMP-Spiegel in Zielzellen), wirken also bronchodilatierend und können
zur Behandlung obstruktiver Ventilationsstörungen eingesetzt werden.
Phosphodiesterasehemmer
(z.B. Theophyllin) unterstützen die Adrenalinwirkung (sie erhöhen den
cAMP-Spiegel in Zielzellen), wirken also bronchodilatierend und können
zur Behandlung obstruktiver Ventilationsstörungen eingesetzt werden.
Phosphodiesterasehemmer senken den Atemwegwiderstand
|
Widerstand ( s. dort) und Dehnbarkeit (Compliance: Volumen pro Druck: ΔV / ΔpTP
s. dort) und Dehnbarkeit (Compliance: Volumen pro Druck: ΔV / ΔpTP)
des Atemapparats bestimmen, wieviel Energie für Strömung und Verformung
aufgebracht werden muss.
Bei sehr langsamer (quasistatischer) Atmung ist der Effekt des
Widerstandes auf die Beziehung zwischen transpulmonalem Druck (pTP) und
Volumen (V) vernachlässigbar gering, und das Volumen nimmt bei
einem Anstieg des transpulmonalen Drucks (Druckunterschied zwischen
Pleuraspalt - für die Lunge "außen" - und Alveolarraum, also "innen") so gut wie linear zu, entsprechend dem Betrag der Compliance (ΔV / ΔpTP) des Atemapparates bei der betreffenden Atemlage.
Bei
rascher Einatmung hingegen
muss zunächst ein Anstieg des transpulmonalen Drucks den Atemwiderstand
überwinden, die Druck-Volumen-Beziehung "kurvt" von einer Linie zu
einem Bogen aus, bevor im Druck-Volumen-Diagramm derselbe Punkt
erreicht wird wie bei quasistatischer Einatmung. Bei der Ausatmung gilt
analog: Der transmurale Druck muss zunächst abnehmen, um die Luftsäule
in die Gegenrichtung zu beschleunigen, dann folgt das Volumen nach. Das
Druck-Volumen-Profil beschreibt eine
Hysterese (

s.
dort).
Der pulmonale
Gefäßwiderstand hat
in mittlerer Atemlage ein Minimum:
 Tief exspiratorisch
Tief exspiratorisch sind die Gefäße außerhalb des
Alveolarbereichs komprimiert (niedriges
Lungenvolumen),
 tief inspiratorisch
tief inspiratorisch (hohes Volumen) sind die Kapillaren der jetzt aufgedehnten Alveolen abgeplattet.
In
beiden Fällen ist ein Teil des Gefäßbaumes
verengt (erhöhter
Strömungswiderstand); in Atem-Mittellage hingegen sind beide
Gefäßpopulationen gut geöffnet und bieten
einen geringen Strömungswiderstand.

Kräftegleichgewicht und Strömungswiderstand: Der Atemwegwiderstand ist umso größer, je enger die Bronchien sind ( Abbildung); diese werden
Abbildung); diese werden
 erweitert
erweitert durch strukturelle Rückstellkräfte vor allem der Knorpelspangen (exspiratorisch), andererseits
 verengt
verengt durch Kontraktion der Bronchien (Bronchokonstriktion steigt durch
parasympathischen, sinkt durch
sympathischen Einfluss).

 Bronchokonstriktion (wie durch cholinergen bzw. parasympathischen Einfluss) erschwert daher die Atmung, Bronchodilatation hingegen (adrenerg hervorgerufen, wie bei körperlicher Belastung) senkt den Atemwegwiderstand und erleichtert die Ventilation.
Bronchokonstriktion (wie durch cholinergen bzw. parasympathischen Einfluss) erschwert daher die Atmung, Bronchodilatation hingegen (adrenerg hervorgerufen, wie bei körperlicher Belastung) senkt den Atemwegwiderstand und erleichtert die Ventilation.
Die Reinigung der Luftwege erfolgt andererseits (ceteris paribus) durch
Bronchokonstriktion wegen stärkerer Wirbelbildung gründlicher
(Impaktation eingeatmeter Partikel), bei Bronchodilatation hingegen
weniger effizient. Die Einstellung der optimalen Bronchienweite trägt - im Sinne eines Kompromisses - beiden Anforderungen Rechnung.

 Abbildung: Mechanik der Einatmung
Nach einer Vorlage bei Thibodeau / Patton, Anatomy & Physiology (6th ed), Mosby Elsevier 2007
Abbildung: Mechanik der Einatmung
Nach einer Vorlage bei Thibodeau / Patton, Anatomy & Physiology (6th ed), Mosby Elsevier 2007
Der
wichtigste Einatemmuskel ist das Zwerchfell (Diaphragma  ); es erweitert
den Thorakalraum zum Abdomen, die äußeren Interkostalmuskeln erweitern den Thorakalraum nach vorne
und seitlich.
Kohäsionskräfte sichern das Aneinanderhaften der Pleurablätter
); es erweitert
den Thorakalraum zum Abdomen, die äußeren Interkostalmuskeln erweitern den Thorakalraum nach vorne
und seitlich.
Kohäsionskräfte sichern das Aneinanderhaften der Pleurablätter


 Abbildung: Mechanik der Ausatmung
Abbildung: Mechanik der Ausatmung
Nach einer Vorlage bei Thibodeau / Patton, Anatomy & Physiology (6th ed), Mosby Elsevier 2007
Die Ausatmung erfolgt bei Ruheatmung ausschließlich durch elastische Retraktion der
Lunge

Die Atemarbeit kann graphisch - über Druck-Volumen- Diagramme
- dargestellt werden (Arbeit = Druck mal Volumen). Die in solchen
Diagrammen von Hysteresen umstrichenen Flächen entsprechen der zur
Überwindung von Widerständen aufgebrachten Energie. Während einer
Einatmung aufgebrachte Energie, die im Laufe der Ausatmung nicht
zurückgewonnen wurde, geht dem System als Wärme verloren.
Bei körperlicher Leistung müssen zusätzlich exponentiell anwachsende
Widerstände überwunden werden, der Aufwand nimmt zu (bis über 10% des Sauerstoffverbrauchs des Körpers). Die Ausdauer der
Atemmuskulatur kann die Leistungsgrenze insgesamt bestimmen.
Der Betrag der insgesamt
geleisteten Atmungsarbeit ist aus Druck-Volumen-Kurven der
respiratorischen Aktivität ersichtlich (vgl.
Herzarbeit): Druck (Dimension: Kraft / L2) mal Volumen (L3) = Kraft x Weg, also Arbeit.
Bei pathologischer Atmung
(z.B. asthma bronchiale) kommt es aufgrund des erhöhten zu
überwindenden Widerstands zu gesteigertem metabolischem Bedarf durch
die Atemarbeit.
 Zur Messung des Atemwegwiderstands s. dort.
Zur Messung des Atemwegwiderstands s. dort.
Strömung in den Luftwegen: Laminar oder turbulent?
Wie sieht das Strömungsprofil der Luft in den Luftwegen aus? Wie im Kapitel Kreislauf
dargelegt, unterscheidet man laminare von turbulenter Strömung, und die
Reynolds-Zahl (Re) lässt abschätzen, wann die eine in die andere
Strömungscharakteristik umschlägt (d = Innendurchmesser, ν = mittlere Strömungsgeschwindigkeit, ρ = Massendichte, η = Viskosität):
Man geht davon aus, dass bei einem [Re]
unter 2000 die Strömung laminar erfolgt und ab einem [Re] von 3000
turbulenten Charakter annimmt. Zwischen diesen beiden Werten neigt die
Strömung dazu, instabil zu sein und zwischen den beiden Mustern hin-
und herzuwechseln (laminar-turbulent transition). Diese Grenzwerte gelten allerdings nur für gerade, lange, glattwandige und unverzweigte Röhren.
Der Bronchialbaum
zeichnet sich hingegen durch kurze, gekrümmte, unregelmäßig geformte
und verzweigte Strukturen aus, und es resultiert ein unregelmäßiges
(transitionales) Strömungsprofil. In der Trachea
können hohe Strömungsgeschwindigkeiten auftreten (insbesondere bei
körperlicher Belastung, Husten, Niesen) - das Strömungsprofil wird dann
wirklich turbulent.
Bei laminarer Strömung (niedriger Strömungsgeschwindigkeit) ist der Strömungswiderstand gering, und es gilt
das Hagen-Poiseuille-Gesetz,
wonach die Durchlässigkeit eines Rohres mit der vierten Potenz des
Radius zunimmt:
wobei
Q = Strömung, ∂p = Druckdifferenz, r = Innenradius, η = Viskosität des
Atemgases und l = Länge eines (unverzweigten) Luftwegabschnittes.
Vierte Potenz des Radius: Anders formuliert, ändert sich der Strömungswiderstand proportional zu (1/r4).
Das bedeutet, dass z.B. eine Halbierung des Radius einen Anstieg des
Widerstandes um den Faktor 16 ergibt. Zwar erfolgt ein beträchtlicher
Teil der Strömung in den Luftwegen
nicht-laminar und das Hagen-Poiseuille-Gesetz verliert
einen Teil seiner Gültigkeit, aber der Widerstand nimmt jedenfalls
umgekehrt proportional zum Innendurchmesser eines Luftweges
beträchtlich zu.
Der effektive Widerstand nimmt von laminar über transitional bis zu wirklich turbulent immer mehr zu. Bei laminarer Strömung nimmt die Strömung proportional zur Druckdifferenz (vor vs. hinter dem Widerstand) zu (∆p), bei turbulenter
hingegen proportional zur Wurzel dieser Differenz (√∆p) - es bedarf
dann eines höheren Druckgradienten, um die Luft durch das System zu
befördern (erhöhte Atemarbeit).
Die kleinsten Luftwege tragen zum Strömungswiderstand nur geringgradig
bei (zumindest in der gesunden Lunge); der Widerstand ist (kumuliert)
auf der Höhe der großen Bronchien (etwa 4. Teilungsgeneration) am
höchsten (s. oben).
Boyle-Mariotte-Gesetz: Druck mal Volumen
Das Boyle-Mariotte-Gesetz
 (Spezialfall der allgemeinen Gasgleichung bzw. thermischen Zustandsgleichung idealer Gase) besagt, dass - bei
gleich bleibender Temperatur - das Produkt aus Volumen (V) und Druck (p) einer
gegebenen Gasmenge konstant ist:
(Spezialfall der allgemeinen Gasgleichung bzw. thermischen Zustandsgleichung idealer Gase) besagt, dass - bei
gleich bleibender Temperatur - das Produkt aus Volumen (V) und Druck (p) einer
gegebenen Gasmenge konstant ist:
p1.V1 = p2.V2
[p x V] bleibt unverändert
|
 Abbildung: Bolye-Mariotte-Gesetz
Abbildung: Bolye-Mariotte-Gesetz
Nach einer Vorlage bei Silverthorn, Human Physiology - an integrated approach, 4th ed. Pearson International 2007
Das
Produkt aus Druck (p, pressure) und Volumen (V)
eines Gases ist konstant
(soferne sich die Temperatur nicht ändert - steigt sie an, erhöht das
die Bewegungsenergie der Teilchen und damit den Druck und / oder das
Volumen).
In diesem Beispiel: 1 x 100 = 0,5 x 200

Erhöht man den
Druck auf eine gegebene (eingeschlossene) Gasmenge, verkleinert sich in
entsprechendem Ausmaß das Volumen - und umgekehrt. Je enger der Raum,
in den die Gasmoleküle gebracht werden, umso größer wird die kinetische
Energie ihrer Wärmebewegung - und damit der Druck, den sie auf die Wand
ausüben. Das Produkt aus beiden Größen bleibt dabei konstant.
Übertragen auf die Lungenfunktion
bedeutet das:
 Erweitern die Inspirationsmuskeln den Thoraxraum (Volumenzunahme), dann
sinkt der Druck in der Lunge. Damit entsteht ein Druckgradient, der Luft in die Lunge stömen lässt (Einatmung).
Erweitern die Inspirationsmuskeln den Thoraxraum (Volumenzunahme), dann
sinkt der Druck in der Lunge. Damit entsteht ein Druckgradient, der Luft in die Lunge stömen lässt (Einatmung).
| Während der Einatmung ist der intrapulmonale Druck geringer ("negativ"), während der Ausatmung höher als der Außendruck ("positiv")
|
 Bei
der Ausatmung zieht sich die (nicht weiter durch Muskelzug erweiterte) Lunge wieder zusammen, bedingt durch Rückstellkräfte (elastische Fasern
im Lungengewebe, Oberflächenspannung in den Alveolen), welche die vorangegangene Inspiration erhöht hat. Der
Gradient dreht sich um: Das Volumen nimmt ab und der Druck zu, Luft strömt aus der Lunge.
Bei
der Ausatmung zieht sich die (nicht weiter durch Muskelzug erweiterte) Lunge wieder zusammen, bedingt durch Rückstellkräfte (elastische Fasern
im Lungengewebe, Oberflächenspannung in den Alveolen), welche die vorangegangene Inspiration erhöht hat. Der
Gradient dreht sich um: Das Volumen nimmt ab und der Druck zu, Luft strömt aus der Lunge.
Die Atemruhelage
besteht bei entspannter Mittelstellung von Lunge und Thorax (ohne
Kraftaufwand). Man erreicht sie am Ende einer normalen Exspiration
|
Der Totraum reinigt, befeuchtet und bringt auf Körpertemperatur

zuerst Luft aus
dem
Totraum, die von der vorangegangenen Einatmung "übriggeblieben" ist (fast kein CO
2, pO
2 wie in der Außenluft, ~150 mmHg),

anschließend
Alveolarluft - ihre Ankunft ist durch Anstieg des pCO
2 (von ~0 auf ~40 mmHg, entsprechend ~5 Vol-%) und Absinken des pO
2 (von ~150 auf ~100 mmHg) gekennzeichnet.





 Respirationssystem, Atemarbeit, Totraum
Respirationssystem, Atemarbeit, Totraum

 Stellung und Struktur des Respirationssystems
Stellung und Struktur des Respirationssystems  Luftzusammensetzung & Gasaustausch
Luftzusammensetzung & Gasaustausch  Luftwege
Luftwege  Löslichkeit & Henry-Gesetz
Löslichkeit & Henry-Gesetz  Ventilation, Atemmechanik, Atemarbeit
Ventilation, Atemmechanik, Atemarbeit  Atemwegwiderstand
Atemwegwiderstand  Strömung in den Luftwegen
Strömung in den Luftwegen  Boyle-Mariotte-Gesetz
Boyle-Mariotte-Gesetz  Totraum & alveoläre Ventilation
Totraum & alveoläre Ventilation  Alveolärer Gasaustausch und Partialdrucke
Alveolärer Gasaustausch und Partialdrucke  Alveolo-arterielle Sauerstoffdruckdifferenz
Alveolo-arterielle Sauerstoffdruckdifferenz
 Respiratorischer Quotient
Respiratorischer Quotient  Alveoläre Ventilation
Alveoläre Ventilation  Intrapleuraler Druck
Intrapleuraler Druck  Transmuraler / transpulmonaler Druck
Transmuraler / transpulmonaler Druck  Totraum
Totraum  Anatomischer, alveolärer, funktioneller Totraum
Anatomischer, alveolärer, funktioneller Totraum 
 Core messages
Core messages
 Abbildung: Aufbau des respiratorischen Systems
Abbildung: Aufbau des respiratorischen Systems
 Lunge: idg. Wurzel *le(n)gh- = leicht (Lunge als leichtes Organ)
Lunge: idg. Wurzel *le(n)gh- = leicht (Lunge als leichtes Organ)  Ventilation ist die Strömung von Luft durch die Luftwege, Respiration der Austausch der Atemgase (O2, CO2) zwischen Blut und Außenwelt. Während äußere Atmung den
Vorgang des Transportes von Sauerstoff zu den, und von Kohlendioxid von
den Zellen (Mitochondrien) zu Alveolen und Außenwelt darstellt,
versteht man unter innerer Atmung die oxidative Phosophorylierung, die in den Mitochondrien stattfindet.
Ventilation ist die Strömung von Luft durch die Luftwege, Respiration der Austausch der Atemgase (O2, CO2) zwischen Blut und Außenwelt. Während äußere Atmung den
Vorgang des Transportes von Sauerstoff zu den, und von Kohlendioxid von
den Zellen (Mitochondrien) zu Alveolen und Außenwelt darstellt,
versteht man unter innerer Atmung die oxidative Phosophorylierung, die in den Mitochondrien stattfindet. haben eine Oberfläche von bis zu ~100 m2 (zum Vergleich: Hautoberfläche etwa 2 m2). Die Trennwand zwischen Luft und Blut
ist äußerst dünn (0,2-0,6 µm), das erleichtert die Diffusion (je geringer die Diffusionsstrecke, desto intensiver der Austausch: Diffusionsgesetz).
haben eine Oberfläche von bis zu ~100 m2 (zum Vergleich: Hautoberfläche etwa 2 m2). Die Trennwand zwischen Luft und Blut
ist äußerst dünn (0,2-0,6 µm), das erleichtert die Diffusion (je geringer die Diffusionsstrecke, desto intensiver der Austausch: Diffusionsgesetz).  Der Olfaktion, also dem Riechen ("Beschnüffeln" von Nahrung etc);
Der Olfaktion, also dem Riechen ("Beschnüffeln" von Nahrung etc);  der Aufbereitung (Befeuchtung, Anwärmen) und
der Aufbereitung (Befeuchtung, Anwärmen) und  Reinigung der Einatemluft (Abwehrfunktion);
Reinigung der Einatemluft (Abwehrfunktion);  der Entfernung kleiner Thromben aus dem Kreislauf (Filterfunktion);
der Entfernung kleiner Thromben aus dem Kreislauf (Filterfunktion);  der Aktivierung von Angiotensin II aus Angiotensin I durch ACE (angiotensin converting enzyme).
der Aktivierung von Angiotensin II aus Angiotensin I durch ACE (angiotensin converting enzyme).
 Abbildung: Atmung und Kreislauf
Abbildung: Atmung und Kreislauf
 Referenzwerte s. dort
Referenzwerte s. dort Bei
der Passage trockener Einatmungsluft durch die Luftwege (Bedingungen: ATPD - ambient temperature and pressure, dry) - Stickstoff 78%, Sauerstoff 21%, Argon 1% - wird diese
angefeuchtet (6% des Volumens besteht dann bei Körpertemperatur aus Wasserdampf, der Partialdruck pH2O beträgt ~6 kPa bzw. 47 mmHg), der Partialdruck der anderen Gase nimmt entsprechend ab:
Bei
der Passage trockener Einatmungsluft durch die Luftwege (Bedingungen: ATPD - ambient temperature and pressure, dry) - Stickstoff 78%, Sauerstoff 21%, Argon 1% - wird diese
angefeuchtet (6% des Volumens besteht dann bei Körpertemperatur aus Wasserdampf, der Partialdruck pH2O beträgt ~6 kPa bzw. 47 mmHg), der Partialdruck der anderen Gase nimmt entsprechend ab:  Wasserdampfgesättigte Einatemluft (ATPS - ambient temperature and pressure, saturated) weist folgende Zusammensertzung auf: Etwa 73% Stickstoff, 20% Sauerstoff (pO2 ~150 mmHg), 6% H2O, 1% Ar.
Wasserdampfgesättigte Einatemluft (ATPS - ambient temperature and pressure, saturated) weist folgende Zusammensertzung auf: Etwa 73% Stickstoff, 20% Sauerstoff (pO2 ~150 mmHg), 6% H2O, 1% Ar. Ausgeatmete Luft (BTPS - body temperature and pressure, saturated) unterliegt Bedingungen, wie sie in der Lunge herrschen: Umgebungsdruck, Körpertemperatur, H2O-gesättigt. Das ergibt bei einem Luftdruck von 760 mmHg (~Meereshöhe) etwa folgende Werte (bei H2O-Sättigung und 37°C):
Ausgeatmete Luft (BTPS - body temperature and pressure, saturated) unterliegt Bedingungen, wie sie in der Lunge herrschen: Umgebungsdruck, Körpertemperatur, H2O-gesättigt. Das ergibt bei einem Luftdruck von 760 mmHg (~Meereshöhe) etwa folgende Werte (bei H2O-Sättigung und 37°C):  73% Stickstoff (pN2 555 mmHg / ~73 kPa),
73% Stickstoff (pN2 555 mmHg / ~73 kPa),
 15% Sauerstoff (pO2 115 mmHg / ~15 kPa),
15% Sauerstoff (pO2 115 mmHg / ~15 kPa),
 5% Kohlendioxid (pCO2 40 mmHg / ~5 kPa),
5% Kohlendioxid (pCO2 40 mmHg / ~5 kPa), 
 6% Wasserdampf (pH2O 47 mmHg / ~6 kPa),
6% Wasserdampf (pH2O 47 mmHg / ~6 kPa), 
 1% Argon (pAr 8 mmHg / ~1 kPa).
1% Argon (pAr 8 mmHg / ~1 kPa). Luft unter Standardbedingungen (STPD - standard temperature, pressure, dry): Normbedingungen: Druck 760 mmHg, Temperatur 0°C, trocken (pH2O
= 0). Diese Bedingungen entsprechen weder denen im Körper noch denen im
Spirometer, sind aber einheitlich (Standard-Atmosphärendruck, kein
Wasserdampf).
Luft unter Standardbedingungen (STPD - standard temperature, pressure, dry): Normbedingungen: Druck 760 mmHg, Temperatur 0°C, trocken (pH2O
= 0). Diese Bedingungen entsprechen weder denen im Körper noch denen im
Spirometer, sind aber einheitlich (Standard-Atmosphärendruck, kein
Wasserdampf).  Wasserstoff (H2-Atemtest): Normalerweise enthält die Atemluft keine nennenswerte Menge an Wasserstoff, aber Dickdarmbakterien können Kohlenhydrate metabolisieren, die im Dünndarm nicht resorbiert wurden (bei Zuckerresorptionsstörungen wie z.B. Lactasemangel oder Fructosemalabsorption - Überforderung des GLUT5-Systems). Dabei entsteht neben Lactat, Acetat und CO2 auch H2;
Wasserstoff (H2-Atemtest): Normalerweise enthält die Atemluft keine nennenswerte Menge an Wasserstoff, aber Dickdarmbakterien können Kohlenhydrate metabolisieren, die im Dünndarm nicht resorbiert wurden (bei Zuckerresorptionsstörungen wie z.B. Lactasemangel oder Fructosemalabsorption - Überforderung des GLUT5-Systems). Dabei entsteht neben Lactat, Acetat und CO2 auch H2; über Haut oder Schleimhäute aufgenommene Fremdstoffe (z.B. Medikamente).
über Haut oder Schleimhäute aufgenommene Fremdstoffe (z.B. Medikamente). Abbildung) sind durch Knorpelringe (bei der
Trachea offen C-förmig, mit einer posterioren Muskelschicht) vor
inspiratorischem Kollaps geschützt (jedenfalls bei intakter
Wandstruktur). Da der rechte Hauptbronchus weniger abgewinkelt aus der
Trachea abzweigt als der linke, gelangen in ihn inhalierte Partikel
(oder ein Endotrachealtubus) mit höherer Wahrscheinlichkeit als in den
linken.
Abbildung) sind durch Knorpelringe (bei der
Trachea offen C-förmig, mit einer posterioren Muskelschicht) vor
inspiratorischem Kollaps geschützt (jedenfalls bei intakter
Wandstruktur). Da der rechte Hauptbronchus weniger abgewinkelt aus der
Trachea abzweigt als der linke, gelangen in ihn inhalierte Partikel
(oder ein Endotrachealtubus) mit höherer Wahrscheinlichkeit als in den
linken.
 Abbildung: Bronchialbaum, Alveolen
Abbildung: Bronchialbaum, Alveolen Abbildung unten). Der Gesamtquerschnitt steigt vor allem in Abschnitten, wo Gasaustausch erfolgt.
Abbildung unten). Der Gesamtquerschnitt steigt vor allem in Abschnitten, wo Gasaustausch erfolgt.
 im Rachenbereich (Pharynx und Larynx) 0,6,
im Rachenbereich (Pharynx und Larynx) 0,6, in Luftwegen >2 mm Durchmesser 0,6,
in Luftwegen >2 mm Durchmesser 0,6, in Luftwegen <2 mm Durchmesser 0,3 (gesamt: 1,5).
in Luftwegen <2 mm Durchmesser 0,3 (gesamt: 1,5).
 Abbildung: Strömungswiderstand der Luftwege (jeweils auf die Teilungsgeneration bezogen)
Abbildung: Strömungswiderstand der Luftwege (jeweils auf die Teilungsgeneration bezogen) 
 Abbildung). Die Knorpelringe sind
notwendig, um diesen Strukturen die nötige Festigkeit zu verleihen.
Abbildung). Die Knorpelringe sind
notwendig, um diesen Strukturen die nötige Festigkeit zu verleihen.  zu tun:
zu tun:
 Abbildung: Geschwindigkeit der Luftströmung und kumulierte Querschnittsfläche in verschiedenen Abschnitten der Luftwege
Abbildung: Geschwindigkeit der Luftströmung und kumulierte Querschnittsfläche in verschiedenen Abschnitten der Luftwege  Abbildung oben)
Abbildung oben)
 s. dort).
Bei Anstieg der Strömungsgeschwindigkeit steigt also die
Wahrscheinlichkeit einer Obstruktion der betroffenen Luftwege. Durch
die Verengung reißt die Strömung ab, der Vorgang wiederholt sich, und
es kann zu Oszillationen der Wand kommen (z.B. bei "bellendem" Husten).
s. dort).
Bei Anstieg der Strömungsgeschwindigkeit steigt also die
Wahrscheinlichkeit einer Obstruktion der betroffenen Luftwege. Durch
die Verengung reißt die Strömung ab, der Vorgang wiederholt sich, und
es kann zu Oszillationen der Wand kommen (z.B. bei "bellendem" Husten). s. dort): Mit der Inspiration werden die Luftwege weiter, der Strömungswiderstand geringer.
s. dort): Mit der Inspiration werden die Luftwege weiter, der Strömungswiderstand geringer. Die
Strömungsgeschwindigkeit der Luft ist in der Trachea am höchsten, in
den Bronchiolen am niedrigsten (umgekehrt proportional zum
Gesamtquerschnitt).
Die
Strömungsgeschwindigkeit der Luft ist in der Trachea am höchsten, in
den Bronchiolen am niedrigsten (umgekehrt proportional zum
Gesamtquerschnitt).
 Abbildung: Morphologie der Luftwege von Trachea bis Alveole
Abbildung: Morphologie der Luftwege von Trachea bis Alveole
 s. dort).
s. dort). ,
,  Abbildung oben),
welche benachbarte Alveolen eines Lungenlappens untereinander
verbinden. Auf diesem Wege können auch Alveolen belüftet werden, deren
ductulus alveolaris obstruiert ist.
Abbildung oben),
welche benachbarte Alveolen eines Lungenlappens untereinander
verbinden. Auf diesem Wege können auch Alveolen belüftet werden, deren
ductulus alveolaris obstruiert ist. s. dort).
s. dort). Typ-I-Alveolarzellen
- der dominierende Zelltyp - sind außerordentlich flach und bilden die
Barriere zwischen Alveolarluft und Kapillarblut. Sie bedecken 90-95%
der Alveolaroberfläche. Die Diffusionsstrecke für die Atemgase beträgt
in diesem Bereich 0,15-0,3 µm (Pneumozyt plus Endothelzelle).
Typ-I-Alveolarzellen
- der dominierende Zelltyp - sind außerordentlich flach und bilden die
Barriere zwischen Alveolarluft und Kapillarblut. Sie bedecken 90-95%
der Alveolaroberfläche. Die Diffusionsstrecke für die Atemgase beträgt
in diesem Bereich 0,15-0,3 µm (Pneumozyt plus Endothelzelle). Die eher würfelförmigen, in Gruppen auftretenden Typ-II-Alveolarzellen (5-10% der Alveolaroberfläche) ragen in die Alveolarhöhle hinein und bilden das oberflächenaktive Surfactant. Sie scheinen auch an Reparaturvorgängen beteiligt zu sein.
Die eher würfelförmigen, in Gruppen auftretenden Typ-II-Alveolarzellen (5-10% der Alveolaroberfläche) ragen in die Alveolarhöhle hinein und bilden das oberflächenaktive Surfactant. Sie scheinen auch an Reparaturvorgängen beteiligt zu sein. Gasaustausch
Gasaustausch Verhinderung eines Übertritts von Blut oder Trassudat in den Alveolarraum
Verhinderung eines Übertritts von Blut oder Trassudat in den Alveolarraum Zurückhalten allfälliger Gasbläschen (Vermeidung einer Gasembolie)
Zurückhalten allfälliger Gasbläschen (Vermeidung einer Gasembolie) ist die Konzentration c eines in einer Flüssigkeit gelösten Gases proportional zu dessen Partialdruck p mal dem Betrag des Löslichkeitskoeffizienten H:
ist die Konzentration c eines in einer Flüssigkeit gelösten Gases proportional zu dessen Partialdruck p mal dem Betrag des Löslichkeitskoeffizienten H: s.
s.  Abbildung und dort.
Abbildung und dort.
 Abbildung: Lösung von Gasen (Sauerstoff und Kohlendioxid) in Wasser
Abbildung: Lösung von Gasen (Sauerstoff und Kohlendioxid) in Wasser
 Das Zahlenverhältnis CO2-Abgabe / O2-Aufnahme des Organismus (bezogen auf dieselbe Zeitspanne) heißt respiratorischer Quotient (RQ, respiratory quotient, respiratory coefficient).
Das Zahlenverhältnis CO2-Abgabe / O2-Aufnahme des Organismus (bezogen auf dieselbe Zeitspanne) heißt respiratorischer Quotient (RQ, respiratory quotient, respiratory coefficient).  Abbildung):
Abbildung): Der knöcherne Thorax (mit seiner
spezifischen Volumendehnbarkeit),
Der knöcherne Thorax (mit seiner
spezifischen Volumendehnbarkeit),  die Atemmuskulatur (vor allem für
die Inspiration),
die Atemmuskulatur (vor allem für
die Inspiration),  die Luftwege (Verbindung zwischen Außenluft und
Alveolen),
die Luftwege (Verbindung zwischen Außenluft und
Alveolen),  die Pleura
die Pleura  (der Spalt zwischen den Pleurablättern unterliegt
die meiste Zeit einem subatmosphärischen Druck),
(der Spalt zwischen den Pleurablättern unterliegt
die meiste Zeit einem subatmosphärischen Druck), der zuständige Teil
des Nervensystems (Atemzentrum und übergeordnete Hirnteile, afferente und efferente Nerven, Rezeptoren).
der zuständige Teil
des Nervensystems (Atemzentrum und übergeordnete Hirnteile, afferente und efferente Nerven, Rezeptoren).
 Abbildung: Das Ventilationssystem
Abbildung: Das Ventilationssystem
 ist die Belüftung der lufthältigen Räume (Luftwege: Trachea, Bronchien
ist die Belüftung der lufthältigen Räume (Luftwege: Trachea, Bronchien  ,
Bronchiolen, Alveolen). In ausgeatmeter Ruhelage befindet sich in der Lunge eine Luftmenge, die als funktionelle Residualkapazität bezeichnet wird. Die Luftmenge, die pro Zeit geatmet wird, heißt
Atemzeitvolumen.
,
Bronchiolen, Alveolen). In ausgeatmeter Ruhelage befindet sich in der Lunge eine Luftmenge, die als funktionelle Residualkapazität bezeichnet wird. Die Luftmenge, die pro Zeit geatmet wird, heißt
Atemzeitvolumen.  Die Zufuhr frischer Atemluft an die Alveolen wird als alveoläre Ventilation
bezeichnet. Sie ist für den Austausch der Atemgase maßgeblich und ergibt sich aus insgesamt geatmeter Frischluft
minus der Totraumbelüftung. Macht z.B. das Inspirationsvolumen
600 ml und der Totraum 25% der eingeatmeten Luftmenge aus (150 ml),
verbleiben bei diesem Atemzug 75% (also 450 ml) für die alveoläre Frischluftzufuhr (alveoläre Ventilation).
Die Zufuhr frischer Atemluft an die Alveolen wird als alveoläre Ventilation
bezeichnet. Sie ist für den Austausch der Atemgase maßgeblich und ergibt sich aus insgesamt geatmeter Frischluft
minus der Totraumbelüftung. Macht z.B. das Inspirationsvolumen
600 ml und der Totraum 25% der eingeatmeten Luftmenge aus (150 ml),
verbleiben bei diesem Atemzug 75% (also 450 ml) für die alveoläre Frischluftzufuhr (alveoläre Ventilation).
 Animation: Atempumpe
Animation: Atempumpe pRA = Druck im rechten Vorhof (Zentralvenendruck)
pRA = Druck im rechten Vorhof (Zentralvenendruck)  RA, RV = rechter Vorhof / Ventrikel
RA, RV = rechter Vorhof / Ventrikel  SVC, IVC = obere / untere Hohlvene
SVC, IVC = obere / untere Hohlvene


 Als intrapleuralen Druck pip bezeichnet
man den Druck im Pleuraspalt, also zwischen pleura visceralis (der
Lunge aufliegend) und pleura parietalis (Innenseite der Thoraxwand,
Oberseite des Diaphragma). [pip]
ist in Atemruhelage geringer als der Außendruck (ca. -0,5 kPa), weil
die Lunge auf den Pleuraspalt einen nach innen gerichteten Zug ausübt
(elastische Fasern, Oberflächenspannung).
Als intrapleuralen Druck pip bezeichnet
man den Druck im Pleuraspalt, also zwischen pleura visceralis (der
Lunge aufliegend) und pleura parietalis (Innenseite der Thoraxwand,
Oberseite des Diaphragma). [pip]
ist in Atemruhelage geringer als der Außendruck (ca. -0,5 kPa), weil
die Lunge auf den Pleuraspalt einen nach innen gerichteten Zug ausübt
(elastische Fasern, Oberflächenspannung). Die Pleuraflüssigkeit hält die Lunge dicht an der Brustwand und reduziert den Reibungswiderstand.
Die Pleuraflüssigkeit hält die Lunge dicht an der Brustwand und reduziert den Reibungswiderstand. Als transmuralen Druck bezeichnet man den radiären Druckgradienten bei einem Hohlorgan (Herzkammer, Gefäß, Luftweg, Alveole..), d.h. die Differenz zwischen dem Innen- und Außendruck (z.B. hydrostatischer Druck in einer Vene minus umgebender Gewebedruck).
Als transmuralen Druck bezeichnet man den radiären Druckgradienten bei einem Hohlorgan (Herzkammer, Gefäß, Luftweg, Alveole..), d.h. die Differenz zwischen dem Innen- und Außendruck (z.B. hydrostatischer Druck in einer Vene minus umgebender Gewebedruck). 
 Abbildung: Volumen- und transpulmonaler Druckverlauf eines Respirationszyklus
Abbildung: Volumen- und transpulmonaler Druckverlauf eines Respirationszyklus
 Eine statische, welche das Lungenvolumen bestimmt (transpulmonaler Druck ptp: Alveolardruck PA - Pleuradruck PIP);
Eine statische, welche das Lungenvolumen bestimmt (transpulmonaler Druck ptp: Alveolardruck PA - Pleuradruck PIP); 
 eine dynamische, welche den Luftstrom steuert (Druckgefälle: Alveolardruck pA - Außendruck pB).
eine dynamische, welche den Luftstrom steuert (Druckgefälle: Alveolardruck pA - Außendruck pB). a: Vor Beginn der Inspiration; statische Bedingungen, die Lunge enthält die FRC
a: Vor Beginn der Inspiration; statische Bedingungen, die Lunge enthält die FRC b: Inspiration zur Hälfte abgeschlossen; dynamische Bedingungen
b: Inspiration zur Hälfte abgeschlossen; dynamische Bedingungen c: Inspiration abgeschlossen. Lungen beinhalten FRC + AZV
c: Inspiration abgeschlossen. Lungen beinhalten FRC + AZV d: Exspiration zur Hälfte abgeschlossen; dynamische Bedingungen
d: Exspiration zur Hälfte abgeschlossen; dynamische Bedingungen e: Vor Beginn der nächsten Inspiration; statische Bedingungen
e: Vor Beginn der nächsten Inspiration; statische Bedingungen
 Abbildung: Alveolardruck- und Strömungsverlauf eines Respirationszyklus
Abbildung: Alveolardruck- und Strömungsverlauf eines Respirationszyklus
 Atemzentrum (Störung: z.B. Schlafapnoe),
Atemzentrum (Störung: z.B. Schlafapnoe), Nerven (Störung: z.B. Phrenikusparese),
Nerven (Störung: z.B. Phrenikusparese), Atemmuskulatur (Störung: z.B. neuromuskuläre Probleme) und
Atemmuskulatur (Störung: z.B. neuromuskuläre Probleme) und Skelettsystem (Störung: z.B. Kyphoskoliose)
Skelettsystem (Störung: z.B. Kyphoskoliose)
 Der Atemwegwiderstand (Druck pro Strömung), der bei der Luftströmung durch die Atemwege auftritt, und
Der Atemwegwiderstand (Druck pro Strömung), der bei der Luftströmung durch die Atemwege auftritt, und  der Gewebewiderstand, der bei der Atmung auftritt (Dehnung der Lunge, Reibung der Pleurablätter, Verformung von Gewebe).
der Gewebewiderstand, der bei der Atmung auftritt (Dehnung der Lunge, Reibung der Pleurablätter, Verformung von Gewebe). 
 Abbildung: Atemwiderstand als Funktion des Lungenvolumens
Abbildung: Atemwiderstand als Funktion des Lungenvolumens
 Abbildung).
Zwischen tiefer Ein- und
Ausatmung liegt ein Unterschied des Strömungswiderstandes um etwa eine
Zehnerpotenz. Ein weiterer Mechanismus ist das gegenseitige Aufdehnen
der miteinander verbundenen Alveolen und der in diesem
wabenförmigen "Netz" verankerten Bronchien (Prinzip der Interdependenz,
s. dort).
Abbildung).
Zwischen tiefer Ein- und
Ausatmung liegt ein Unterschied des Strömungswiderstandes um etwa eine
Zehnerpotenz. Ein weiterer Mechanismus ist das gegenseitige Aufdehnen
der miteinander verbundenen Alveolen und der in diesem
wabenförmigen "Netz" verankerten Bronchien (Prinzip der Interdependenz,
s. dort).  Mehr zum Atemwegwiderstand s. dort
Mehr zum Atemwegwiderstand s. dort Phosphodiesterasehemmer
(z.B. Theophyllin) unterstützen die Adrenalinwirkung (sie erhöhen den
cAMP-Spiegel in Zielzellen), wirken also bronchodilatierend und können
zur Behandlung obstruktiver Ventilationsstörungen eingesetzt werden.
Phosphodiesterasehemmer
(z.B. Theophyllin) unterstützen die Adrenalinwirkung (sie erhöhen den
cAMP-Spiegel in Zielzellen), wirken also bronchodilatierend und können
zur Behandlung obstruktiver Ventilationsstörungen eingesetzt werden. s. dort) und Dehnbarkeit (Compliance: Volumen pro Druck: ΔV / ΔpTP)
des Atemapparats bestimmen, wieviel Energie für Strömung und Verformung
aufgebracht werden muss.
s. dort) und Dehnbarkeit (Compliance: Volumen pro Druck: ΔV / ΔpTP)
des Atemapparats bestimmen, wieviel Energie für Strömung und Verformung
aufgebracht werden muss.  s. dort).
s. dort). Tief exspiratorisch sind die Gefäße außerhalb des
Alveolarbereichs komprimiert (niedriges
Lungenvolumen),
Tief exspiratorisch sind die Gefäße außerhalb des
Alveolarbereichs komprimiert (niedriges
Lungenvolumen),  tief inspiratorisch (hohes Volumen) sind die Kapillaren der jetzt aufgedehnten Alveolen abgeplattet.
tief inspiratorisch (hohes Volumen) sind die Kapillaren der jetzt aufgedehnten Alveolen abgeplattet. 
 Abbildung); diese werden
Abbildung); diese werden erweitert durch strukturelle Rückstellkräfte vor allem der Knorpelspangen (exspiratorisch), andererseits
erweitert durch strukturelle Rückstellkräfte vor allem der Knorpelspangen (exspiratorisch), andererseits  verengt durch Kontraktion der Bronchien (Bronchokonstriktion steigt durch parasympathischen, sinkt durch sympathischen Einfluss).
verengt durch Kontraktion der Bronchien (Bronchokonstriktion steigt durch parasympathischen, sinkt durch sympathischen Einfluss).
 Bronchokonstriktion (wie durch cholinergen bzw. parasympathischen Einfluss) erschwert daher die Atmung, Bronchodilatation hingegen (adrenerg hervorgerufen, wie bei körperlicher Belastung) senkt den Atemwegwiderstand und erleichtert die Ventilation.
Bronchokonstriktion (wie durch cholinergen bzw. parasympathischen Einfluss) erschwert daher die Atmung, Bronchodilatation hingegen (adrenerg hervorgerufen, wie bei körperlicher Belastung) senkt den Atemwegwiderstand und erleichtert die Ventilation. 
 Abbildung: Mechanik der Einatmung
Abbildung: Mechanik der Einatmung ); es erweitert
den Thorakalraum zum Abdomen, die äußeren Interkostalmuskeln erweitern den Thorakalraum nach vorne
und seitlich.
); es erweitert
den Thorakalraum zum Abdomen, die äußeren Interkostalmuskeln erweitern den Thorakalraum nach vorne
und seitlich.
 sinkt
bei interstitiellen Erkrankungen - das Gewebe läßt sich nur schwer
verformen - und ist
sinkt
bei interstitiellen Erkrankungen - das Gewebe läßt sich nur schwer
verformen - und ist  erhöht bei Lungenemphysem - das rarefizierte Gewebe
leistet kaum Verformungswiderstand.
erhöht bei Lungenemphysem - das rarefizierte Gewebe
leistet kaum Verformungswiderstand. Zur Compliance s. dort
Zur Compliance s. dort Atemarbeit: Die Gesamtarbeit für die Überwindung respiratoricher Widerstände setzt sich aus folgenden Komponenten zusammen:
Atemarbeit: Die Gesamtarbeit für die Überwindung respiratoricher Widerstände setzt sich aus folgenden Komponenten zusammen: Arbeit für Dehnung (Überwindung elastischer Widerstände - elastic work). Bei der Einatmung spielen elastische Faktoren eine Rolle. Diese bestehen aus mehreren Komponenten:
Arbeit für Dehnung (Überwindung elastischer Widerstände - elastic work). Bei der Einatmung spielen elastische Faktoren eine Rolle. Diese bestehen aus mehreren Komponenten: Lungenparenchym (Zug nach innen - muss bei Inspiration überwunden werden)
Lungenparenchym (Zug nach innen - muss bei Inspiration überwunden werden) Oberflächenspannung im Alveolarbereich (Zug nach innen - muss bei Inspiration überwunden werden)
Oberflächenspannung im Alveolarbereich (Zug nach innen - muss bei Inspiration überwunden werden) Brustwand (bei Ruheatmung Zug nach außen)
Brustwand (bei Ruheatmung Zug nach außen) Arbeit für Friktion (Reibung bei Relativbewegungen: Erhöhter Atemwegwiderstand bzw. Gewebewiderstand - resisitive work) muß sowohl bei Ein- als auch Ausatmung geleistet
werden und dissipiert als Wärme. Bei
Ruheatmung ist nur die Einatmung muskelaktiv und nimmt nur einen geringen Anteil (1-2%) des Ruheumsatzes
des Organismus in Anspruch. Mit zunehmender Ventilation steigt auch der
Anteil der Arbeit zur Überwindung von Reibungswiderständen (wachsende
Bedeutung von Turbulenzen, s. unten).
Arbeit für Friktion (Reibung bei Relativbewegungen: Erhöhter Atemwegwiderstand bzw. Gewebewiderstand - resisitive work) muß sowohl bei Ein- als auch Ausatmung geleistet
werden und dissipiert als Wärme. Bei
Ruheatmung ist nur die Einatmung muskelaktiv und nimmt nur einen geringen Anteil (1-2%) des Ruheumsatzes
des Organismus in Anspruch. Mit zunehmender Ventilation steigt auch der
Anteil der Arbeit zur Überwindung von Reibungswiderständen (wachsende
Bedeutung von Turbulenzen, s. unten).
 Abbildung: Mechanik der Ausatmung
Abbildung: Mechanik der Ausatmung
 Zur Messung des Atemwegwiderstands s. dort.
Zur Messung des Atemwegwiderstands s. dort. (Spezialfall der allgemeinen Gasgleichung bzw. thermischen Zustandsgleichung idealer Gase) besagt, dass - bei
gleich bleibender Temperatur - das Produkt aus Volumen (V) und Druck (p) einer
gegebenen Gasmenge konstant ist:
(Spezialfall der allgemeinen Gasgleichung bzw. thermischen Zustandsgleichung idealer Gase) besagt, dass - bei
gleich bleibender Temperatur - das Produkt aus Volumen (V) und Druck (p) einer
gegebenen Gasmenge konstant ist: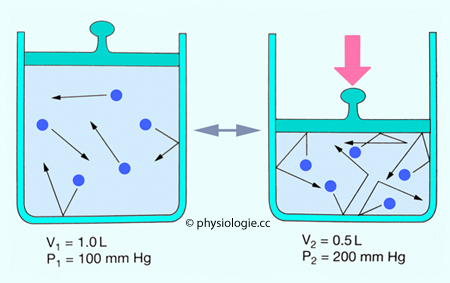
 Abbildung: Bolye-Mariotte-Gesetz
Abbildung: Bolye-Mariotte-Gesetz
 Erweitern die Inspirationsmuskeln den Thoraxraum (Volumenzunahme), dann
sinkt der Druck in der Lunge. Damit entsteht ein Druckgradient, der Luft in die Lunge stömen lässt (Einatmung).
Erweitern die Inspirationsmuskeln den Thoraxraum (Volumenzunahme), dann
sinkt der Druck in der Lunge. Damit entsteht ein Druckgradient, der Luft in die Lunge stömen lässt (Einatmung). Bei
der Ausatmung zieht sich die (nicht weiter durch Muskelzug erweiterte) Lunge wieder zusammen, bedingt durch Rückstellkräfte (elastische Fasern
im Lungengewebe, Oberflächenspannung in den Alveolen), welche die vorangegangene Inspiration erhöht hat. Der
Gradient dreht sich um: Das Volumen nimmt ab und der Druck zu, Luft strömt aus der Lunge.
Bei
der Ausatmung zieht sich die (nicht weiter durch Muskelzug erweiterte) Lunge wieder zusammen, bedingt durch Rückstellkräfte (elastische Fasern
im Lungengewebe, Oberflächenspannung in den Alveolen), welche die vorangegangene Inspiration erhöht hat. Der
Gradient dreht sich um: Das Volumen nimmt ab und der Druck zu, Luft strömt aus der Lunge. Als Totraum (VD: dead space) bezeichnet man ein Volumen, in dem kein Gasaustausch stattfindet. In der Lunge
entspricht das etwa dem Inhalt der zuführenden Luftwege (anatomischer Totraum: Luftmenge zwischen Nase und bronchioli terminales, 120-150 ml beim Erwachsenen). Die kleinsten Bronchien - unmittelbar vor den Alveolen - nehmen am Gasaustausch bereits teil, sie heißen deshalb auch Broncholi respiratorii. Die Totraumventilation reduziert den Anteil der alveolären Ventilation.
Als Totraum (VD: dead space) bezeichnet man ein Volumen, in dem kein Gasaustausch stattfindet. In der Lunge
entspricht das etwa dem Inhalt der zuführenden Luftwege (anatomischer Totraum: Luftmenge zwischen Nase und bronchioli terminales, 120-150 ml beim Erwachsenen). Die kleinsten Bronchien - unmittelbar vor den Alveolen - nehmen am Gasaustausch bereits teil, sie heißen deshalb auch Broncholi respiratorii. Die Totraumventilation reduziert den Anteil der alveolären Ventilation. Der anatomische Totraum ist
definiert als der Inhalt respiratorisch nicht aktiver Luftwege
(Trachea, Bronchien, Bronchiolen). Daneben gibt es auch einen alveolären Totraum: Dieser entspricht dem Inhalt von Alveolen, die nicht durchblutet sind, z.B. in der Lungenspitze bei aufrechter Körperhaltung. Bei einer erwachsenen Person kann dann der alveoläre Totraum zwischen 20 und 50 ml betragen.
Die Summe aus anatomischem und alveolärem Totraum nennt man den funktionellen oder manchmal den physiologischen Totraum
(typischerweise ~175 ml, also um ~10% mehr als der anatomische
Totraum). Sind alle Lungenabschnitte gut durchblutet (wie in liegender
Position), kann der Unterschied zwischen anatomischem und funktionellem
Totraum ganz verschwinden.
Der anatomische Totraum ist
definiert als der Inhalt respiratorisch nicht aktiver Luftwege
(Trachea, Bronchien, Bronchiolen). Daneben gibt es auch einen alveolären Totraum: Dieser entspricht dem Inhalt von Alveolen, die nicht durchblutet sind, z.B. in der Lungenspitze bei aufrechter Körperhaltung. Bei einer erwachsenen Person kann dann der alveoläre Totraum zwischen 20 und 50 ml betragen.
Die Summe aus anatomischem und alveolärem Totraum nennt man den funktionellen oder manchmal den physiologischen Totraum
(typischerweise ~175 ml, also um ~10% mehr als der anatomische
Totraum). Sind alle Lungenabschnitte gut durchblutet (wie in liegender
Position), kann der Unterschied zwischen anatomischem und funktionellem
Totraum ganz verschwinden.  Für den Anteil der Gaserneuerung - also die Ventilation durchbluteter Alveolen
- ist die Differenz aus Atemzugvolumen und funktioneller
Totraumbelüftung entscheidend, beispielsweise 600 - 175 = 425 ml (in
diesem Fall dienen also ~70% der Luftzufuhr dem Atemgasaustausch).
Für den Anteil der Gaserneuerung - also die Ventilation durchbluteter Alveolen
- ist die Differenz aus Atemzugvolumen und funktioneller
Totraumbelüftung entscheidend, beispielsweise 600 - 175 = 425 ml (in
diesem Fall dienen also ~70% der Luftzufuhr dem Atemgasaustausch). Gemessen wird ein Partialdrucksprung, wenn der exspirierten Totraumluft Alveolarluft folgt (aus der der Körper Sauerstoff extrahiert hat und in die er CO2 deponiert).
Gemessen wird ein Partialdrucksprung, wenn der exspirierten Totraumluft Alveolarluft folgt (aus der der Körper Sauerstoff extrahiert hat und in die er CO2 deponiert).  Kohlendioxidmessung erfolgt mittels Infrarot-Spektroskopie: CO2 absorbiert Licht bei 4,3 und 15,6 µm Wellenlänge.
Kohlendioxidmessung erfolgt mittels Infrarot-Spektroskopie: CO2 absorbiert Licht bei 4,3 und 15,6 µm Wellenlänge.  verwendet hingegen zwei Luftproben (
verwendet hingegen zwei Luftproben ( Abbildung):
Abbildung):
 Abbildung: Bohr-Methode zur Totraumbestimmung
Abbildung: Bohr-Methode zur Totraumbestimmung
 aufgestellten Gleichung ("Bohr'sche Formel") liegt das Indikatorverdünnungsprinzip zugrunde:
aufgestellten Gleichung ("Bohr'sche Formel") liegt das Indikatorverdünnungsprinzip zugrunde: Rechenbeispiel: Eine Person wird mit einem Atemzugvolumen von 0,75 Liter beatmet. Die FECO2 beträgt 0,036 und die FACO2 0,066. Welchen Betrag hat das Totraumvolumen?
Rechenbeispiel: Eine Person wird mit einem Atemzugvolumen von 0,75 Liter beatmet. Die FECO2 beträgt 0,036 und die FACO2 0,066. Welchen Betrag hat das Totraumvolumen?
 Abbildung: Fowler-Methode zur Bestimmung des Totraumvolumens
Abbildung: Fowler-Methode zur Bestimmung des Totraumvolumens
 Der anatomische Totraum kann weiters mit der Stickstoff-Auswaschmethode nach W.S. Fowler (single-breath nitrogen washout test, Fowler's method) ermittelt werden, bei der die Probanden reinen Sauerstoff einatmen und dann in der Ausatemluft laufend der N2-Partialdruck gemessen
wird (pN2 als Funktion des exspirierten Luftvolumens,
Der anatomische Totraum kann weiters mit der Stickstoff-Auswaschmethode nach W.S. Fowler (single-breath nitrogen washout test, Fowler's method) ermittelt werden, bei der die Probanden reinen Sauerstoff einatmen und dann in der Ausatemluft laufend der N2-Partialdruck gemessen
wird (pN2 als Funktion des exspirierten Luftvolumens,  Abbildung).
Abbildung).
 Abbildung: Funktioneller und anatomischer Totraum (VD)
Abbildung: Funktioneller und anatomischer Totraum (VD)
 Abbildung).
Abbildung).  Anfeuchtung der eingeatmeten Luft (Schutz vor Austrocknung der Alveolen)
Anfeuchtung der eingeatmeten Luft (Schutz vor Austrocknung der Alveolen)
 Angleichung an die Körpertemperatur
Angleichung an die Körpertemperatur
 Mukoziliäre
Clearance (mucociliary escalator)
Mukoziliäre
Clearance (mucociliary escalator)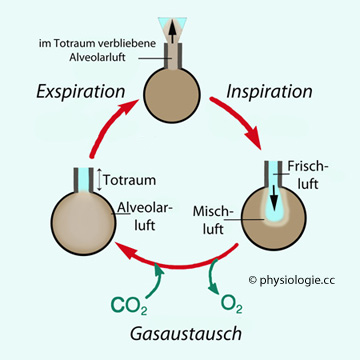
 Abbildung: Totraum und Frischluftzufuhr (schematisch)
Abbildung: Totraum und Frischluftzufuhr (schematisch)

 Totraumbelüftung + alveoläre Belüftung = Gesamtatmung
Totraumbelüftung + alveoläre Belüftung = Gesamtatmung
 zuerst Luft aus
dem Totraum, die von der vorangegangenen Einatmung "übriggeblieben" ist (fast kein CO2, pO2 wie in der Außenluft, ~150 mmHg),
zuerst Luft aus
dem Totraum, die von der vorangegangenen Einatmung "übriggeblieben" ist (fast kein CO2, pO2 wie in der Außenluft, ~150 mmHg),  anschließend Alveolarluft - ihre Ankunft ist durch Anstieg des pCO2 (von ~0 auf ~40 mmHg, entsprechend ~5 Vol-%) und Absinken des pO2 (von ~150 auf ~100 mmHg) gekennzeichnet.
anschließend Alveolarluft - ihre Ankunft ist durch Anstieg des pCO2 (von ~0 auf ~40 mmHg, entsprechend ~5 Vol-%) und Absinken des pO2 (von ~150 auf ~100 mmHg) gekennzeichnet. Abbildung).
Abbildung).
 Abbildung: Wie die alveoläre Ventilation die alveolären Atemgaspartialdrucke beeinflusst
Abbildung: Wie die alveoläre Ventilation die alveolären Atemgaspartialdrucke beeinflusst
 Abbildung).
Abbildung).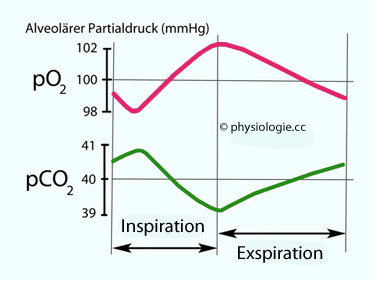
 Abbildung: Zeitverlauf des Sauerstoff- und Kohlendioxidpartialdrucks in den Alveolen während eines normalen Atemzyklus
Abbildung: Zeitverlauf des Sauerstoff- und Kohlendioxidpartialdrucks in den Alveolen während eines normalen Atemzyklus

 Bei
flacher
Atmung ist die alveoläre Belüftung gering und die Totraumbelüftung im
Verhältnis groß.
Bei
flacher
Atmung ist die alveoläre Belüftung gering und die Totraumbelüftung im
Verhältnis groß.  Der Quotient von alveolärer zu Totraumbelüftung nimmt mit der
Atemtiefe zu.
Der Quotient von alveolärer zu Totraumbelüftung nimmt mit der
Atemtiefe zu.
 Abbildung: Kurz- und langfristige Anpassungsstrategien bei Veränderung des pO2 / pCO2
Abbildung: Kurz- und langfristige Anpassungsstrategien bei Veränderung des pO2 / pCO2
 Abbildung):
Abbildung): Das Atemzentrum stellt Atemfrequenz und Atemtiefe so ein, dass die Partialdruckwerte korrigiert werden (kurzdauernd)
Das Atemzentrum stellt Atemfrequenz und Atemtiefe so ein, dass die Partialdruckwerte korrigiert werden (kurzdauernd) Die Zellen verändern ihr Transkriptionsverhalten, auf diese Weise werden Gene anders abgelesen und eine langfristige Anpassung wird erreicht.
Die Zellen verändern ihr Transkriptionsverhalten, auf diese Weise werden Gene anders abgelesen und eine langfristige Anpassung wird erreicht. Zur Höhenanpassung s. dort
Zur Höhenanpassung s. dort Die Alveolo-arterielle Sauerstoffdruckdifferenz (AaDO2, alveolar-(to-)arterial oxygen gradient)
ist die Differenz zwischen alveolärem und arteriellen
Sauerstoffpartialdruck. Der Betrag steigt mit unvollständiger
Durchmischung der Atemluft, (physiologischen) Shunts in der Lunge, körperlicher Belastung; er nimmt auch mit
dem Alter zu.
Die Alveolo-arterielle Sauerstoffdruckdifferenz (AaDO2, alveolar-(to-)arterial oxygen gradient)
ist die Differenz zwischen alveolärem und arteriellen
Sauerstoffpartialdruck. Der Betrag steigt mit unvollständiger
Durchmischung der Atemluft, (physiologischen) Shunts in der Lunge, körperlicher Belastung; er nimmt auch mit
dem Alter zu.
 Tagsüber Schläfrigkeit, Konzentrationsschwächen, Reizbarkeit, Angstzustände, Depressionen
Tagsüber Schläfrigkeit, Konzentrationsschwächen, Reizbarkeit, Angstzustände, Depressionen Stimulierung der Stressachse (ACTH-Cortisol), verringerte Glucosetoleranz, gestörter Fettstoffwechsel
Stimulierung der Stressachse (ACTH-Cortisol), verringerte Glucosetoleranz, gestörter Fettstoffwechsel Bluthochdruck, diverse kardiovaskuläre Störungen (bis hin zu Infarkten)
Bluthochdruck, diverse kardiovaskuläre Störungen (bis hin zu Infarkten) vorgebeugt werden. Die einfachste Maßnahme zur Vergrößerung des
Totraums ist, durch einen schnorchelartigen Zusatz zu atmen, in dem sich
Ein- und Ausatemluft mischen.
vorgebeugt werden. Die einfachste Maßnahme zur Vergrößerung des
Totraums ist, durch einen schnorchelartigen Zusatz zu atmen, in dem sich
Ein- und Ausatemluft mischen.
 Die Atmung versorgt den Körper mit Sauerstoff (400-800 l/d) für
die oxidative Energiegewinnung und gibt Kohlendioxid ab (350-700 l/d).
Die Bedingungen für die Quantifizierung von Atemvolumina sind STPD (Luft unter
Standardbedingungen: Druck 760 mmHg, Temperatur 0°C, trocken); ATPS (wasserdampfgesättigte
Einatemluft); BTPS (ausgeatmete Luft). Die unterschiedlichen Werte
erklären sich durch Anfeuchtung und Atemgasaustsusch
Die Atmung versorgt den Körper mit Sauerstoff (400-800 l/d) für
die oxidative Energiegewinnung und gibt Kohlendioxid ab (350-700 l/d).
Die Bedingungen für die Quantifizierung von Atemvolumina sind STPD (Luft unter
Standardbedingungen: Druck 760 mmHg, Temperatur 0°C, trocken); ATPS (wasserdampfgesättigte
Einatemluft); BTPS (ausgeatmete Luft). Die unterschiedlichen Werte
erklären sich durch Anfeuchtung und Atemgasaustsusch Der Gesamtquerschnitt der Atemwege steigt mit zunehmendem Aufteilungsgrad, die Strömungsgeschwindigkeit nimmt ab. Die niedrige
Strömungsgeschwindigkeit im Bereich zwischen Bronchien und ductuli
alveolares fördert die Reinigungsfunktion. Bronchien (>2 mm Durchmesser mit Knorpelringen: kein Kollaps trotz Bernoulli-Effekt) liefern den Hauptanteil (~80% ) des Strömungswiderstandes, Bronchiolen (am umgebenden Gewebe befestigt und bei Einatmung geweitet) <20%. Im Bereich der bronchioli respiratorii und ductuli
alveolares werden wenig gedehnte Teile (mit schlaffer Wand) besonders gut belüftet (je stärker gedehnt, desto steifer die Wand). So werden die Alveolen automatisch gleichmäßig gefüllt (je geringer das Volumen, desto leichter) - unterstützt durch Öffnungen zwischen benachbarten Alveolen, die
gemeinsame Wände haben und mittels Kollagen- und Elastinfasern an
benachbarten Luftwegen fixiert sind. Dazu kommt der Effekt der
"Surfactant-Bremse"
Der Gesamtquerschnitt der Atemwege steigt mit zunehmendem Aufteilungsgrad, die Strömungsgeschwindigkeit nimmt ab. Die niedrige
Strömungsgeschwindigkeit im Bereich zwischen Bronchien und ductuli
alveolares fördert die Reinigungsfunktion. Bronchien (>2 mm Durchmesser mit Knorpelringen: kein Kollaps trotz Bernoulli-Effekt) liefern den Hauptanteil (~80% ) des Strömungswiderstandes, Bronchiolen (am umgebenden Gewebe befestigt und bei Einatmung geweitet) <20%. Im Bereich der bronchioli respiratorii und ductuli
alveolares werden wenig gedehnte Teile (mit schlaffer Wand) besonders gut belüftet (je stärker gedehnt, desto steifer die Wand). So werden die Alveolen automatisch gleichmäßig gefüllt (je geringer das Volumen, desto leichter) - unterstützt durch Öffnungen zwischen benachbarten Alveolen, die
gemeinsame Wände haben und mittels Kollagen- und Elastinfasern an
benachbarten Luftwegen fixiert sind. Dazu kommt der Effekt der
"Surfactant-Bremse" Funktionelle Residualkapazität ist die Luftmenge, die sich bei ausgeatmeter Ruhelage in der Lunge befindet.
Ventilation ist die Belüftung von Trachea, Bronchien, Bronchiolen, Alveolen - ausgelöst durch Druckunterschiede (barometrischer Druck - Alveolardruck). Belüftung der Alveolen (alveoläre Ventilation) ist Voraussetzung für den Austausch der Atemgase. Inspiration senkt den Druck im Brustraum und erfolgt
aktiv - Kontraktion des Diaphragma (motorische Neuronen in C3-C5) und
Interkostalmuskeln (Thorakalmark) -, Exspiration meist passiv
(Entspannung elastischer Elemente im Atemapparat). Der intrapleurale Druck ist subatmosphärisch (exspiriert -0,5 kPa, bei Inspirationsstellung -0,7 bis -0,8 kPa), was Lunge, Venen und rechtes Herz expandiert und den venösen Rückstrom von der Kreislaufperipherie zum Herzen verbessert. Erhöhung der Atemfrequenz und/oder Vertiefung der Atmung steigert Schlagvolumen und Herzzeitvolumen
Funktionelle Residualkapazität ist die Luftmenge, die sich bei ausgeatmeter Ruhelage in der Lunge befindet.
Ventilation ist die Belüftung von Trachea, Bronchien, Bronchiolen, Alveolen - ausgelöst durch Druckunterschiede (barometrischer Druck - Alveolardruck). Belüftung der Alveolen (alveoläre Ventilation) ist Voraussetzung für den Austausch der Atemgase. Inspiration senkt den Druck im Brustraum und erfolgt
aktiv - Kontraktion des Diaphragma (motorische Neuronen in C3-C5) und
Interkostalmuskeln (Thorakalmark) -, Exspiration meist passiv
(Entspannung elastischer Elemente im Atemapparat). Der intrapleurale Druck ist subatmosphärisch (exspiriert -0,5 kPa, bei Inspirationsstellung -0,7 bis -0,8 kPa), was Lunge, Venen und rechtes Herz expandiert und den venösen Rückstrom von der Kreislaufperipherie zum Herzen verbessert. Erhöhung der Atemfrequenz und/oder Vertiefung der Atmung steigert Schlagvolumen und Herzzeitvolumen  Man unterscheidet den Atemwegwiderstand, der bei der Luftströmung durch die Atemwege auftritt (Druck pro Strömung, ~85% des Gesamtwiderstandes) vom Verformungswiderstand des Gewebes. Der Atemwegwiderstand ist umso größer, je enger die Bronchien sind. Widerstand
und Dehnbarkeit (Compliance: Volumen pro Druck) bestimmen, wie viel
Energie für die Atmung aufgebracht werden muss. Bei langsamer Atmung
ist die Compliance ausschlaggebend für die Atemarbeit (Überwindung elastischer Widerstände), bei rascher Atmung zunehmend auch die Überwindung des Atemwiderstandes. Der pulmonale Gefäßwiderstand
ist in mittlerer Atemlage am geringsten: In tiefer Exspiration sind die
Gefäße außerhalb des Alveolarbereichs komprimiert, bei tiefer Einatmung
die Kapillaren der aufgedehntem Alveolen; in Atem-Mittellage sind beide
gut passierbar (geringer Strömungswiderstand). Ruheatmung nimmt 1-2% des Energieumsatzes des Körpers in Anspruch, bei körperlicher Ausbelastung bis über 10%
Man unterscheidet den Atemwegwiderstand, der bei der Luftströmung durch die Atemwege auftritt (Druck pro Strömung, ~85% des Gesamtwiderstandes) vom Verformungswiderstand des Gewebes. Der Atemwegwiderstand ist umso größer, je enger die Bronchien sind. Widerstand
und Dehnbarkeit (Compliance: Volumen pro Druck) bestimmen, wie viel
Energie für die Atmung aufgebracht werden muss. Bei langsamer Atmung
ist die Compliance ausschlaggebend für die Atemarbeit (Überwindung elastischer Widerstände), bei rascher Atmung zunehmend auch die Überwindung des Atemwiderstandes. Der pulmonale Gefäßwiderstand
ist in mittlerer Atemlage am geringsten: In tiefer Exspiration sind die
Gefäße außerhalb des Alveolarbereichs komprimiert, bei tiefer Einatmung
die Kapillaren der aufgedehntem Alveolen; in Atem-Mittellage sind beide
gut passierbar (geringer Strömungswiderstand). Ruheatmung nimmt 1-2% des Energieumsatzes des Körpers in Anspruch, bei körperlicher Ausbelastung bis über 10%  [p x V] ist konstant (Boyle-Mariotte-Gesetz): Erweiterung des Thoraxraums (Inspirationsmuskulatur) senkt den
Druck in der Lunge → Einatmung. Entspannen sich die Inspirationsmuskeln, zieht sich die Lunge zusammen (elastische Fasern im Lungengewebe, Oberflächenspannung der
Alveolen), der Druck in der Lunge steigt → Ausatmung. Am Ende der Exspiration stellt sich die Atemruhelage ein (Inhalt der Lunge: FRC)
[p x V] ist konstant (Boyle-Mariotte-Gesetz): Erweiterung des Thoraxraums (Inspirationsmuskulatur) senkt den
Druck in der Lunge → Einatmung. Entspannen sich die Inspirationsmuskeln, zieht sich die Lunge zusammen (elastische Fasern im Lungengewebe, Oberflächenspannung der
Alveolen), der Druck in der Lunge steigt → Ausatmung. Am Ende der Exspiration stellt sich die Atemruhelage ein (Inhalt der Lunge: FRC) Der physiologische Totraum
sind die lufthältigen Räume, in denen kein Gasaustausch stattfindet,
der anatomische Totraum befindet sich zwischen Nase und bronchioli
terminales (120-150 ml beim Erwachsenen: Faustregel: 2 ml / kg KG). Die broncholi respiratorii
nehmen am Gasaustausch teil. Der alveoläre Totraum entspricht dem
Inhalt von Alveolen, die nicht durchblutet sind (Lungenspitze bei
aufrechter Körperhaltung, kann 20-50 ml betragen). Die Summe aus
anatomischem und alveolärem Totraum ist der physiologische
(funktionelle) Totraum (~175 ml). Sind alle Lungenabschnitte gut
durchblutet (liegende Position), sind anatomischer und funktioneller
Totraum gleich groß. Der Totraum dient der Anfeuchtung und Reininung (mukoziliäre Clearance) sowie
Temperaturangleich der eingeatneten Luft, sollte aber nicht zu groß
sein (≤30% der Gesamtventilation); bei einem Anteil >60% droht
Hypoxämie. Die Bestimmung des Totraumvolumens erfolgt nach dem
Indikatorprinzip (CO2, N2)
Der physiologische Totraum
sind die lufthältigen Räume, in denen kein Gasaustausch stattfindet,
der anatomische Totraum befindet sich zwischen Nase und bronchioli
terminales (120-150 ml beim Erwachsenen: Faustregel: 2 ml / kg KG). Die broncholi respiratorii
nehmen am Gasaustausch teil. Der alveoläre Totraum entspricht dem
Inhalt von Alveolen, die nicht durchblutet sind (Lungenspitze bei
aufrechter Körperhaltung, kann 20-50 ml betragen). Die Summe aus
anatomischem und alveolärem Totraum ist der physiologische
(funktionelle) Totraum (~175 ml). Sind alle Lungenabschnitte gut
durchblutet (liegende Position), sind anatomischer und funktioneller
Totraum gleich groß. Der Totraum dient der Anfeuchtung und Reininung (mukoziliäre Clearance) sowie
Temperaturangleich der eingeatneten Luft, sollte aber nicht zu groß
sein (≤30% der Gesamtventilation); bei einem Anteil >60% droht
Hypoxämie. Die Bestimmung des Totraumvolumens erfolgt nach dem
Indikatorprinzip (CO2, N2) Der alveoläre pCO2 steigt mit der CO2-Produktion im Körper und sinkt mit der alveolären Ventilation. Der Übertritt von Sauerstoff aus der Alveole in das Blut erfolgt nach dem pO2-Gradienten von der Alveolarluft zum alveolären Kapillarblut. Der pO2-Angleich ist
nicht komplett: Bis zum 30. Lebensjahr soll der Unterschied
<10 mmHg betragen und nimmt dann mit dem Alter um 0,3 mmHg pro Jahr
zu. Sauerstoff diffundiert in die Erythrozyten, Kohlendioxid in die Alveole, die Diffusionsstrecke (0,2-0,5 µm) umfasst den alveolären Flüssigkeits- Surfactant- Film, Alveolarepithel, Interstitium, Kapillarwand, Plasma,
Erythrozytenmembran. ~300
Millionen Alveolen (Durchmesser <0,5 mm) kommen mit jeweils bis zu
1000 Kapilllaren in Kontakt. Die Wände sind so dünn, dass der Luftdruck in der Alveole die Durchblutung der Alveolarkapillaren beeinflusst. Neben dem
Gasaustausch erfolgt in den Alveolen eine Reinigung von Partikeln, die
nicht schon vom Totraum abgefangen worden sind (Alveolarmakrophagen)
Der alveoläre pCO2 steigt mit der CO2-Produktion im Körper und sinkt mit der alveolären Ventilation. Der Übertritt von Sauerstoff aus der Alveole in das Blut erfolgt nach dem pO2-Gradienten von der Alveolarluft zum alveolären Kapillarblut. Der pO2-Angleich ist
nicht komplett: Bis zum 30. Lebensjahr soll der Unterschied
<10 mmHg betragen und nimmt dann mit dem Alter um 0,3 mmHg pro Jahr
zu. Sauerstoff diffundiert in die Erythrozyten, Kohlendioxid in die Alveole, die Diffusionsstrecke (0,2-0,5 µm) umfasst den alveolären Flüssigkeits- Surfactant- Film, Alveolarepithel, Interstitium, Kapillarwand, Plasma,
Erythrozytenmembran. ~300
Millionen Alveolen (Durchmesser <0,5 mm) kommen mit jeweils bis zu
1000 Kapilllaren in Kontakt. Die Wände sind so dünn, dass der Luftdruck in der Alveole die Durchblutung der Alveolarkapillaren beeinflusst. Neben dem
Gasaustausch erfolgt in den Alveolen eine Reinigung von Partikeln, die
nicht schon vom Totraum abgefangen worden sind (Alveolarmakrophagen) Eine wichtige klinische Kenngröße bezüglich der Güte des Gasaustausches
ist die alveolo-arterielle Sauerstoffdruckdifferenz (AaDO2): Die Differenz zwischen alveolärem und arteriellen Sauerstoffpartialdruck
Eine wichtige klinische Kenngröße bezüglich der Güte des Gasaustausches
ist die alveolo-arterielle Sauerstoffdruckdifferenz (AaDO2): Die Differenz zwischen alveolärem und arteriellen Sauerstoffpartialdruck