




| Die miteinander verschalteten Neuronen des hypothalamischen nucleus suprachiasmaticus haben
eine zirkadiane Entladungscharakteristik. Sie zeigen sie auch als
isolierte Zellen: der Rhythmus ist genetisch gesteuert. Mit dieser "master clock"
oszillieren Proteinsynthese und viele systemische Funktionen im
Tagestakt. Die Spontanrhythmik des suprachiasmatischen Kerns wird durch den Helligkeitsrhythmus in der Umwelt synchronisiert; insbesondere blaues Licht regt Melanopsin fotosensitiver Ganglienzellen in der Netzhaut an. Auch Melatonin (Zirbeldrüse) und Serotonin (Raphekerne) wirken anregend bzw. modifizierend auf den nucl. suprachiasmaticus, der seinerseits auf Hypothalamus, Mittelhirn und ganglion cervicale superius projiziert. Zu schlafinduzierenden Stoffen gehören  -- Interleukin 1 (höchste Blutwerte zu Beginn der Schlafphase)  -- Adenosin (hemmt anregende Neurone: serotoninerg - Raphekerne; noradrenerg - locus coeruleus)  -- Stickstoffmonoxid (NO) - regt die Bildung von Adenosin an  -- Melatonin (Licht von <500 nm unterdrückt die Melatoninsynthese). Schlaf erfolgt in verschiedenen Phasen: Man unterscheidet  Tiefschlaf (delta-Rhythmus im EEG, hoher Parasympathikustonus, hohe Weckschwelle)  Traumschlaf (REM: rapid eye movements, Muskelparalyse, hohe sympathische Aktivität). |
 Zentren & zirkadianer Rhythmus
Zentren & zirkadianer Rhythmus  Neurophysiologische Mechanismen
Neurophysiologische Mechanismen  Schlaf und Alter
Schlaf und Alter  Schlafinduktoren
Schlafinduktoren  Zirbeldrüse und Melatonin
Zirbeldrüse und Melatonin  Schlafstadien
Schlafstadien  REM-Schlaf
REM-Schlaf
 Core messages
Core messages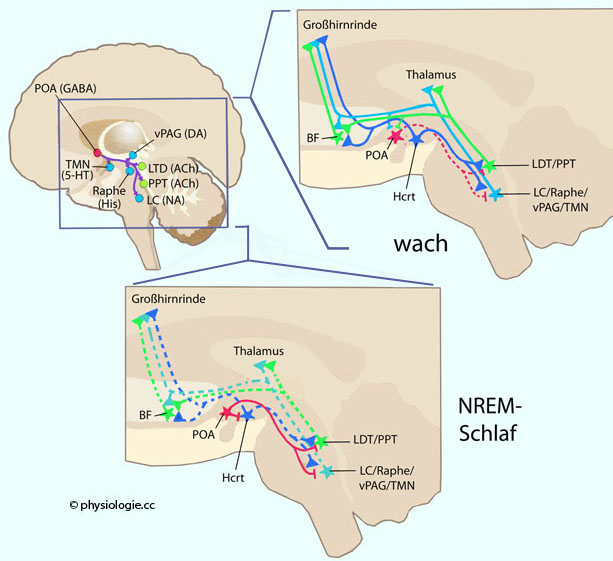
 Abbildung: Steuerung des Wach-Schlaf- Zyklus
Abbildung: Steuerung des Wach-Schlaf- Zyklus Cholinerge (ACh) Neurone im laterodorsalen (LDT) und pedunculopontinen tegmentalen Kerngebiet (PPT),
Cholinerge (ACh) Neurone im laterodorsalen (LDT) und pedunculopontinen tegmentalen Kerngebiet (PPT),  noradrenerge (NA) Neurone des locus coeruleus (LC),
noradrenerge (NA) Neurone des locus coeruleus (LC),  dopaminerge (DA) im ventralen Höhlengrau (vPAG),
dopaminerge (DA) im ventralen Höhlengrau (vPAG),  serotoninerge (5-HT) in den Raphekernen,
serotoninerge (5-HT) in den Raphekernen,  histaminerge (His) im tuberomamillaren Kern (TMN). Diese
Neurone aktivieren den Thalamus und die Großhirnrinde - sowohl direkt
als auch über cholinerge Neuronen des basalen Vorderhirns
(BF). Zusätzlich hemmen sie GABAerge Neuronen (rot) im präoptischen
Areal (POA) des Hypothalamus. Weiters sind Hypocretin-Neurone (Hcrt,
dunkelblau) im Hypothalamus aktiv, diese regen cholinerge und
monoaminerge Neuronen an.
histaminerge (His) im tuberomamillaren Kern (TMN). Diese
Neurone aktivieren den Thalamus und die Großhirnrinde - sowohl direkt
als auch über cholinerge Neuronen des basalen Vorderhirns
(BF). Zusätzlich hemmen sie GABAerge Neuronen (rot) im präoptischen
Areal (POA) des Hypothalamus. Weiters sind Hypocretin-Neurone (Hcrt,
dunkelblau) im Hypothalamus aktiv, diese regen cholinerge und
monoaminerge Neuronen an.

 Änderungen vor, auf die sich Organismen einstellen. Stabile Schlaf-Wach-Struktur
stellt sich auch ohne äußere "Zeitgeber" ein (endogener Rhythmus); diese spontane zirkadiane
Änderungen vor, auf die sich Organismen einstellen. Stabile Schlaf-Wach-Struktur
stellt sich auch ohne äußere "Zeitgeber" ein (endogener Rhythmus); diese spontane zirkadiane  Periodik
hat im Mittel eine Periodendauer von 24,1 Stunden (pro Tag um 6 Minuten
mehr als 24 Stunden). Die zirkadiane Rhythmik wird durch GABAerge
Neurone im hypothalamischen nucleus suprachiasmaticus gesteuert - angeregt durch eine Gruppe von Genen ("clock genes"),
die einen Transkriptions- / Translationszyklus mit einer Periodendauer
von etwa 24 Stunden durchlaufen.
Periodik
hat im Mittel eine Periodendauer von 24,1 Stunden (pro Tag um 6 Minuten
mehr als 24 Stunden). Die zirkadiane Rhythmik wird durch GABAerge
Neurone im hypothalamischen nucleus suprachiasmaticus gesteuert - angeregt durch eine Gruppe von Genen ("clock genes"),
die einen Transkriptions- / Translationszyklus mit einer Periodendauer
von etwa 24 Stunden durchlaufen. 2017 erhielten Jeffrey Hall, Michael Rosbash und Michael Young
den
Nobelpreis für Physiologie oder Medizin „für ihre Entdeckungen
betreffend die molekularen Kontrollmechanismen des circadianen
Rhythmus“ - untersucht an der Fruchtfliege Drosophila melanogaster.
Hall und Rosbach entdeckten, dass sich das Protein PER während der
Nacht im Zellkern akkumuliert und während des Tages abgebaut wird,
synchron mit dem zirkadianen Rhythmus. Sie vermuteten, dass das Protein
seine eigene Synthese hemmt, indem es das Period-Gen
blockiert. Da Proteine im Zytoplasma entstehen, war die Frage, wie PER
in den Zellkern gelangt. Young entdeckte ein zweites Gen (timeless),
welches ein Protein namens TIM codiert und konnte zeigen, dass die
beiden Proteine als Komplex (Dimer) in den Zellkern wandern und das
Period-Gen
blockieren. Beim Menschen wirken die Proteine BMAL1 und CLOCK als die
Proteine, die im Zytoplasma dimerisieren, als Komplex in den Zellkern
gelangen und die Transkription zahlreicher Gene steuern.
2017 erhielten Jeffrey Hall, Michael Rosbash und Michael Young
den
Nobelpreis für Physiologie oder Medizin „für ihre Entdeckungen
betreffend die molekularen Kontrollmechanismen des circadianen
Rhythmus“ - untersucht an der Fruchtfliege Drosophila melanogaster.
Hall und Rosbach entdeckten, dass sich das Protein PER während der
Nacht im Zellkern akkumuliert und während des Tages abgebaut wird,
synchron mit dem zirkadianen Rhythmus. Sie vermuteten, dass das Protein
seine eigene Synthese hemmt, indem es das Period-Gen
blockiert. Da Proteine im Zytoplasma entstehen, war die Frage, wie PER
in den Zellkern gelangt. Young entdeckte ein zweites Gen (timeless),
welches ein Protein namens TIM codiert und konnte zeigen, dass die
beiden Proteine als Komplex (Dimer) in den Zellkern wandern und das
Period-Gen
blockieren. Beim Menschen wirken die Proteine BMAL1 und CLOCK als die
Proteine, die im Zytoplasma dimerisieren, als Komplex in den Zellkern
gelangen und die Transkription zahlreicher Gene steuern. (SCN, suprachiasmatic nucleus) ist ein paariges Organ, hat jeweils nur ~0,25 mm3 Volumen und liegt direkt über der Sehnervenkreuzung (chiasma opticum). Er steuert zirkadiane Rhythmen und die Wirkungen von Licht auf biologische Vorgänge. Der SCN ist während der Tages/Lichtphase am aktivsten und gibt die zirkadiane Spontanrhythmik vor (zirkadianer Oszillator). Seine Neurone sind GABAerg und projizieren auf die in seiner Nähe liegende subparaventrikuläre Zone (nucl. subparaventricularis) im vorderen Hypothalamus. Melatonin (aus der Zirbeldrüse, glandula pinealis) und Serotonin
(Projektion von Raphekernen im Hirnstamm) beeinflussen seine Aktivität.
(SCN, suprachiasmatic nucleus) ist ein paariges Organ, hat jeweils nur ~0,25 mm3 Volumen und liegt direkt über der Sehnervenkreuzung (chiasma opticum). Er steuert zirkadiane Rhythmen und die Wirkungen von Licht auf biologische Vorgänge. Der SCN ist während der Tages/Lichtphase am aktivsten und gibt die zirkadiane Spontanrhythmik vor (zirkadianer Oszillator). Seine Neurone sind GABAerg und projizieren auf die in seiner Nähe liegende subparaventrikuläre Zone (nucl. subparaventricularis) im vorderen Hypothalamus. Melatonin (aus der Zirbeldrüse, glandula pinealis) und Serotonin
(Projektion von Raphekernen im Hirnstamm) beeinflussen seine Aktivität. 
 Abbildung: Eingänge zu, und Ausgänge aus dem nucleus suprachiasmaticus (SCN)
Abbildung: Eingänge zu, und Ausgänge aus dem nucleus suprachiasmaticus (SCN) Afferenz: Die kleinen Neurone des SCN (nucl. suprachiasmaticus) haben sehr
große rezeptive Felder in der Netzhaut, die auf Helligkeit reagieren
(blaues Licht).
Afferenz: Die kleinen Neurone des SCN (nucl. suprachiasmaticus) haben sehr
große rezeptive Felder in der Netzhaut, die auf Helligkeit reagieren
(blaues Licht). 
 Efferenz: Die Neurone des SCN projizieren ihrerseits reziprok auf Epiphyse und Raphekerne (Abbildungen) sowie auf Neurone anderer Hirnregionen, die über Faktoren wie autonome Aktivität, Körpertemperatur, endokrine Faktoren (z.B. Glucocorticoide) oder Nahrungsmittelangebot (postprandial) die zeitabhängige Aktivität peripherer Organe (z.B. der Leber) beeinflussen. Auf diese Weise wird - wenn nötig - die "innere Uhr" entsprechend dem externen
Tag-Nacht-Rhythmus (der sich z.B. bei Reisen in andere Zeitzonen ändern kann) nachjustiert (phase resetting).
Efferenz: Die Neurone des SCN projizieren ihrerseits reziprok auf Epiphyse und Raphekerne (Abbildungen) sowie auf Neurone anderer Hirnregionen, die über Faktoren wie autonome Aktivität, Körpertemperatur, endokrine Faktoren (z.B. Glucocorticoide) oder Nahrungsmittelangebot (postprandial) die zeitabhängige Aktivität peripherer Organe (z.B. der Leber) beeinflussen. Auf diese Weise wird - wenn nötig - die "innere Uhr" entsprechend dem externen
Tag-Nacht-Rhythmus (der sich z.B. bei Reisen in andere Zeitzonen ändern kann) nachjustiert (phase resetting). Spontanrhythmik: Der SCN weist mehrere Eigenschaften auf, die ihn als "master clock" für zirkadiane Rhythmik qualifizieren:
Spontanrhythmik: Der SCN weist mehrere Eigenschaften auf, die ihn als "master clock" für zirkadiane Rhythmik qualifizieren: Die Potentiale
der ~ 50.000 SCN-Neurone oszillieren in einem zirkadianen Rhythmus, was z.T. auf eine
Regulierung der Öffnungswahrscheinlichkeit von Kaliumkanälen, des Kaliumausstroms und damit ihres Ruhepotentials zusammenhängt
Die Potentiale
der ~ 50.000 SCN-Neurone oszillieren in einem zirkadianen Rhythmus, was z.T. auf eine
Regulierung der Öffnungswahrscheinlichkeit von Kaliumkanälen, des Kaliumausstroms und damit ihres Ruhepotentials zusammenhängt Die Neurone sind
untereinander mittels gap junctions verbunden, was die Übertragung elektrischer Potentialänderungen ermöglicht (auch Astrozyten im SCN zeigen zirkadiane Rhythmik ihrer Aktivität), und sind auch über Neuropeptide untereinander funktionell verknüpft
Die Neurone sind
untereinander mittels gap junctions verbunden, was die Übertragung elektrischer Potentialänderungen ermöglicht (auch Astrozyten im SCN zeigen zirkadiane Rhythmik ihrer Aktivität), und sind auch über Neuropeptide untereinander funktionell verknüpft SCN-Neurone haben vielfache synaptische Kommunikation mit umliegenden
(vor allem hypothalamischen) Neuronen und können über diese periphere
Biorhythmen synchronisieren
SCN-Neurone haben vielfache synaptische Kommunikation mit umliegenden
(vor allem hypothalamischen) Neuronen und können über diese periphere
Biorhythmen synchronisieren Zum
Einfluss biologischer Rhythmen und diverser Störfaktoren auf Art und
Betrag verschiedener physiologischer / klinischer Messgrößen s. dort
Zum
Einfluss biologischer Rhythmen und diverser Störfaktoren auf Art und
Betrag verschiedener physiologischer / klinischer Messgrößen s. dort .)
.)

 Ein Vorderhirnsystem (ab dem Mittelhirn), das Tiefschlaf (slow-wave sleep SWS, auch NREM3)
generieren kann, wenn es nicht aus dem Hirnstamm zu Wachsein und
Aufmerksamkeit angeregt wird. Schlaf wird vom basalen Vorderhirn getriggert, einer Region im ventralen Frontallappen und vorderen
Hypothalamus (Läsionen dieses Gebietes führen zu Schlafstörungen,
elektrische Reizung induziert Schlaf). GABAerge (inhibierende)
Projektionen aus diesem Gebiet führen in den posterioren Hypothalamus
(nucl. tuberomamillaris) und das Arousal-System im Hirnstamm.
Ein Vorderhirnsystem (ab dem Mittelhirn), das Tiefschlaf (slow-wave sleep SWS, auch NREM3)
generieren kann, wenn es nicht aus dem Hirnstamm zu Wachsein und
Aufmerksamkeit angeregt wird. Schlaf wird vom basalen Vorderhirn getriggert, einer Region im ventralen Frontallappen und vorderen
Hypothalamus (Läsionen dieses Gebietes führen zu Schlafstörungen,
elektrische Reizung induziert Schlaf). GABAerge (inhibierende)
Projektionen aus diesem Gebiet führen in den posterioren Hypothalamus
(nucl. tuberomamillaris) und das Arousal-System im Hirnstamm. Das aktivierende aszendierende retikuläre System im Hirnstamm - vom tiefen Mittelhirn bis in die medulla oblongata - aktiviert das Vorderhirn. Seine dessen Blockade führt zu Tiefschlaf.
Das aktivierende aszendierende retikuläre System im Hirnstamm - vom tiefen Mittelhirn bis in die medulla oblongata - aktiviert das Vorderhirn. Seine dessen Blockade führt zu Tiefschlaf. Ein pontines System triggert REM-Schlaf ("REM-on"-Neurone). Sein Zentrum
liegt in einer subcoeruleären Region unmittelbar ventral vom nucleus coeruleus.
Seine glutamatergen Projektionen in die medulla oblongata aktivieren
dort GABA- und glyzinerge Neurone, deren Axone motorische
Vorderhornzellen im Rückenmark inhibieren - die Muskeln sind wie
schlaff gelähmt.
Ein pontines System triggert REM-Schlaf ("REM-on"-Neurone). Sein Zentrum
liegt in einer subcoeruleären Region unmittelbar ventral vom nucleus coeruleus.
Seine glutamatergen Projektionen in die medulla oblongata aktivieren
dort GABA- und glyzinerge Neurone, deren Axone motorische
Vorderhornzellen im Rückenmark inhibieren - die Muskeln sind wie
schlaff gelähmt. Ein hypothalamisches System,
das die anderen drei Systeme beeinflusst und über Wach- oder
Schlafeinstellung entscheidet. Im lateralen Hypothalamus finden sich
Neurone, die Hypocretin (Orexin) produzieren (
Ein hypothalamisches System,
das die anderen drei Systeme beeinflusst und über Wach- oder
Schlafeinstellung entscheidet. Im lateralen Hypothalamus finden sich
Neurone, die Hypocretin (Orexin) produzieren ( s. unten)
und auf die oben erwähnten drei Gebiete projizieren. Sie ermöglichen
ein geordnetes Umschalten zwischen Wachzustand, REM- und NREM-Schlaf.
s. unten)
und auf die oben erwähnten drei Gebiete projizieren. Sie ermöglichen
ein geordnetes Umschalten zwischen Wachzustand, REM- und NREM-Schlaf. 
 Abbildung: Schlafsteuerung
Abbildung: Schlafsteuerung
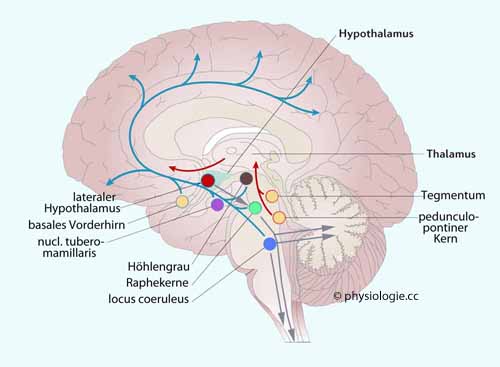
 Abbildung: Schlüsselkomponenten der modulatorischen Systeme für die Regulierung von Wachsein und Schlaf
Abbildung: Schlüsselkomponenten der modulatorischen Systeme für die Regulierung von Wachsein und Schlaf
 (Hypocretin) ist ein im lateralen Hypothalamus gebildetes Neuropeptid,
das in der Form Orexin-A und Orexin-B vorkommt. Orexinproduzierende
Neurone (vorwiegend im lateralen Hypothalamus) projizieren großflächig
in das ZNS - u.a. auf cholinerge, noradrenerge, serotoninerge und
histaminerge Neuronen - und
regulieren verschiedene Verhaltensweisen, u.a. fördert er den Wachzustand (vgl. oben) und wirkt appetitanregend
(daher der Name: orexis = Verlangen, Appetit). Orexin wirkt anregend auf die Gehirnfunktion und gilt als aufmerksamkeitssteigernder Faktor; es stimuliert das ARAS.
(Hypocretin) ist ein im lateralen Hypothalamus gebildetes Neuropeptid,
das in der Form Orexin-A und Orexin-B vorkommt. Orexinproduzierende
Neurone (vorwiegend im lateralen Hypothalamus) projizieren großflächig
in das ZNS - u.a. auf cholinerge, noradrenerge, serotoninerge und
histaminerge Neuronen - und
regulieren verschiedene Verhaltensweisen, u.a. fördert er den Wachzustand (vgl. oben) und wirkt appetitanregend
(daher der Name: orexis = Verlangen, Appetit). Orexin wirkt anregend auf die Gehirnfunktion und gilt als aufmerksamkeitssteigernder Faktor; es stimuliert das ARAS. Abbildung). Noradrenerge (locus coeruleus) und serotoninerge Systeme (Raphekerne) sind im Wachzustand aktiv und halten diesen aufrecht; cholinerge Anteile sind teils im Wachzustand aktiv, teils unterstützen sie REM-Phasen.
Abbildung). Noradrenerge (locus coeruleus) und serotoninerge Systeme (Raphekerne) sind im Wachzustand aktiv und halten diesen aufrecht; cholinerge Anteile sind teils im Wachzustand aktiv, teils unterstützen sie REM-Phasen.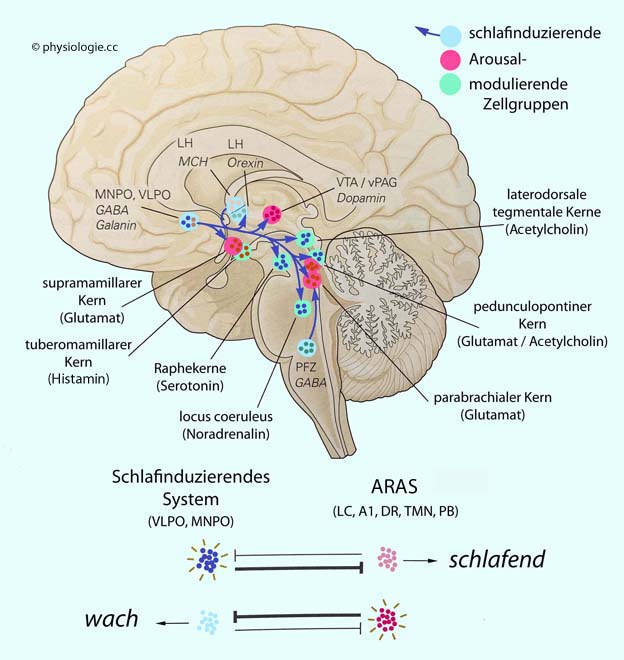
 Abbildung: Schlafauslösende Systeme
Abbildung: Schlafauslösende Systeme
 Der parabrachiale Kernkomplex in der dorsolateralen Brücke (um den oberen Kleinhirnstiel
gelegen, daher der Name) - gegliedert in eine mediale und eine laterale
Gruppe - beeinflusst neben Wachheit (arousal) auch Körpertemperatur
(Afferenzen von peripheren Thermorezeptoren, Efferenzen zur
präoptischen Region), Blutzuckerspiegel (Hypoglykämieschutz) u.a.
Der parabrachiale Kernkomplex in der dorsolateralen Brücke (um den oberen Kleinhirnstiel
gelegen, daher der Name) - gegliedert in eine mediale und eine laterale
Gruppe - beeinflusst neben Wachheit (arousal) auch Körpertemperatur
(Afferenzen von peripheren Thermorezeptoren, Efferenzen zur
präoptischen Region), Blutzuckerspiegel (Hypoglykämieschutz) u.a. Melaninkonzentrierendes Hormon (Melanin-concentrating hormone MCH): Dieses orexigene Neuropeptid ist vor allem im Schlaf - den es anregt - aktiv. Orexin hingegen dominiert den Wachzustand.
Melaninkonzentrierendes Hormon (Melanin-concentrating hormone MCH): Dieses orexigene Neuropeptid ist vor allem im Schlaf - den es anregt - aktiv. Orexin hingegen dominiert den Wachzustand.  Abbildung).
Abbildung). 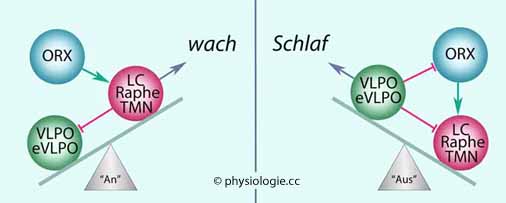
 Abbildung: Modell zur Umschaltung zwischen Schlaf und Wachzustand (flip-flop switch model)
Abbildung: Modell zur Umschaltung zwischen Schlaf und Wachzustand (flip-flop switch model)
 Abbildung).
Die Periodik des Schlafmusters ist bei Kindern besonders deutlich
ausgeprägt; im Alter nimmt dieses Muster an Klarheit ab.
Abbildung).
Die Periodik des Schlafmusters ist bei Kindern besonders deutlich
ausgeprägt; im Alter nimmt dieses Muster an Klarheit ab.
 Abbildung: Schlaf und Lebensalter
Abbildung: Schlaf und Lebensalter

 Abbildung: Schlaf fördert Konsolidierungsvorgänge im Gehirn und Immunsystem
Abbildung: Schlaf fördert Konsolidierungsvorgänge im Gehirn und Immunsystem
 Abbildung). Vor allem der traumlose Tiefschlaf scheint die
Abwehrprozesse anzuregen.
Abbildung). Vor allem der traumlose Tiefschlaf scheint die
Abwehrprozesse anzuregen. Auch Prostaglandine
(PGD2) können im Rahmen einer Immunantwort den Schlaf
beeinflussen. Solche Mechanismen regen wahrscheinlich das
Immungedächtnis an.
Auch Prostaglandine
(PGD2) können im Rahmen einer Immunantwort den Schlaf
beeinflussen. Solche Mechanismen regen wahrscheinlich das
Immungedächtnis an. Adenosin-Rezeptorblocker (Methylxanthine) wirken anregend auf Nervenzellen, indem sie diesen inhibitorischen Effekt durch Adenosin blockieren.
Adenosin-Rezeptorblocker (Methylxanthine) wirken anregend auf Nervenzellen, indem sie diesen inhibitorischen Effekt durch Adenosin blockieren. Das Tryptophanderivat Melatonin
Das Tryptophanderivat Melatonin  wird in
der Epiphyse
wird in
der Epiphyse  (glandula pinealis, Zirbeldrüse
(glandula pinealis, Zirbeldrüse  ) gebildet, Noradrenalin (sympathische Fasern
aus dem oberen Zervikalganglion) regt seine Synthese an - insbesondere
nachts: Die Produktion unterliegt einem zirkadianen Rhythmus - nachts ist sie hoch, tagsüber gehemmt.
) gebildet, Noradrenalin (sympathische Fasern
aus dem oberen Zervikalganglion) regt seine Synthese an - insbesondere
nachts: Die Produktion unterliegt einem zirkadianen Rhythmus - nachts ist sie hoch, tagsüber gehemmt. 
 Abbildung: Helligkeit hemmt die Melatoninproduktion
Abbildung: Helligkeit hemmt die Melatoninproduktion
 Melatonin wird scherzhaft als "Dracula unter den Hormonen" bezeichnet,
weil es in der Dunkelheit auftritt und bei Lichteinfall verschwindet.
Melatonin wird scherzhaft als "Dracula unter den Hormonen" bezeichnet,
weil es in der Dunkelheit auftritt und bei Lichteinfall verschwindet.
 Abbildung oben).
Abbildung oben).| Die Zirbeldrüse bildet - abhängig von der Helligkeit der Umgebung - das schlaffördernde Melatonin |
 Galen
von Pergamon lokalisierte die Epiphyse (Zirbeldrüse) korrekt im Gehirn
als direkt hinter dem III. Ventrikel gelegene zapfenförmige Struktur.
René Descartes
vermutete in der Epiphyse eine Art Reflexzentrum, das (wie er
irrigerweise annahm) nur beim Menschen vorhanden und als
Begegnungsstätte von Körper (materiell) und Geist (nichtmaterielle
Seele - Dualismus) ein Zentrum für das Bewußtsein sei. Aaron Lerner entdeckte im Gewebe von Epiphysen Melatonin und MSH (Intermedine / Melanotropine).
Galen
von Pergamon lokalisierte die Epiphyse (Zirbeldrüse) korrekt im Gehirn
als direkt hinter dem III. Ventrikel gelegene zapfenförmige Struktur.
René Descartes
vermutete in der Epiphyse eine Art Reflexzentrum, das (wie er
irrigerweise annahm) nur beim Menschen vorhanden und als
Begegnungsstätte von Körper (materiell) und Geist (nichtmaterielle
Seele - Dualismus) ein Zentrum für das Bewußtsein sei. Aaron Lerner entdeckte im Gewebe von Epiphysen Melatonin und MSH (Intermedine / Melanotropine). Abbildung).
Abbildung).
 Abbildung: Elektrophysiologische Muster von Wachsein bis Tiefschlaf
Abbildung: Elektrophysiologische Muster von Wachsein bis Tiefschlaf  einer gesunden jungen Person. REM-Phasen treten etwa alle 90 Minuten
auf, ihre Dauer nimmt mit der Schlafzeit zu. N = non-REM-Phasen (1-3)
einer gesunden jungen Person. REM-Phasen treten etwa alle 90 Minuten
auf, ihre Dauer nimmt mit der Schlafzeit zu. N = non-REM-Phasen (1-3)
 Stadium N1 (Einschlafen) ist charakterisiert durch langsame
sinusähnliche Augenbewegungen, Abnahme der EEG-Frequenz und
Muskelaktivität;
Stadium N1 (Einschlafen) ist charakterisiert durch langsame
sinusähnliche Augenbewegungen, Abnahme der EEG-Frequenz und
Muskelaktivität;  Stadium
N2 (mitteltiefer Schlaf) durch Schlafspindeln (12-14 Hz, bis 3/min) und
K-Komplexe (bis 0,2 mV Amplitude);
Stadium
N2 (mitteltiefer Schlaf) durch Schlafspindeln (12-14 Hz, bis 3/min) und
K-Komplexe (bis 0,2 mV Amplitude);  Stadium N3 (Tiefschlaf) durch δ-Wellen (0,5-3/s) im EEG (slow-wave-sleep SWS) und weiteres Absinken des Muskeltonus (Atonie).
Stadium N3 (Tiefschlaf) durch δ-Wellen (0,5-3/s) im EEG (slow-wave-sleep SWS) und weiteres Absinken des Muskeltonus (Atonie). In den ersten Stunden des Nachtschlafs kann auch ein besonders tiefes Stadium N4 auftreten (in der Abbildung nicht gezeigt).
In den ersten Stunden des Nachtschlafs kann auch ein besonders tiefes Stadium N4 auftreten (in der Abbildung nicht gezeigt).
| Im Tiefchlaf tritt im EEG ein δ-Rhythmus auf (0,5 bis 3 Wellen pro Sekunde) |
| Rhythmus |
Frequenz (Wellen pro Sekunde) |
| ß |
14 - 30 |
| α |
8 - 13 |
| ϑ |
4 - 7 |
| δ |
10,5 - 3 |

 Abbildung: Entstehung oszillatorischer Rhythmen im Non-REM-Schlaf
Abbildung: Entstehung oszillatorischer Rhythmen im Non-REM-Schlaf
| Im (Non-REM-) Schlaf sind Blutdruck, Puls- und Atemfrequenz niedriger als im Wachzustand Der systolische Druck ist bei gesunden Personen nachts niedriger als am Tag |
 (Faktoren, welche die korrekte Faltung neu synthetisierter Proteine
in der Zelle unterstützen). Die Zahl
fehlgebildeter Proteine nimmt mit der Dauer des Wachzustandes zu.
(Faktoren, welche die korrekte Faltung neu synthetisierter Proteine
in der Zelle unterstützen). Die Zahl
fehlgebildeter Proteine nimmt mit der Dauer des Wachzustandes zu.| Im REM-Schlaf steigen Herzfrequenz und arterieller Blutdruck an |

 Abbildung: Ein- und Ausschalten des REM-Schlafs
Abbildung: Ein- und Ausschalten des REM-Schlafs
| Im REM-Schlaf ist die mittlere Frequenz der EEG-Wellen höher als im non-REM-Schlaf |
 Abbildung) auf inhibitorische Interneurone
im Rückenmark; diese hyperpolarisieren motorische Vorderhornzellen und
stellen dadurch die Muskeln still (Atonie).
Abbildung) auf inhibitorische Interneurone
im Rückenmark; diese hyperpolarisieren motorische Vorderhornzellen und
stellen dadurch die Muskeln still (Atonie).| REM-Schlaf verursacht eine starke Erniedrigung des Muskeltonus (Atonie) |

 Während einer REM-Phase (Dauer ~10-50 min, am längsten gegen Ende der
Nachtschlafperiode) treten häufig Träume auf. Diese Phasen
sind durch rasche
Augenbewegungen (REM) gekennzeichnet. Im REM-Schlaf leitet der Thalamus sensorische Information
nicht zum Cortex weiter; der präfrontale Cortex ist außer Funktion
(Realitätskonnex inaktiv, irrationale, schwer deutbare Trauminhalte).
Während einer REM-Phase (Dauer ~10-50 min, am längsten gegen Ende der
Nachtschlafperiode) treten häufig Träume auf. Diese Phasen
sind durch rasche
Augenbewegungen (REM) gekennzeichnet. Im REM-Schlaf leitet der Thalamus sensorische Information
nicht zum Cortex weiter; der präfrontale Cortex ist außer Funktion
(Realitätskonnex inaktiv, irrationale, schwer deutbare Trauminhalte).  In westlichen Ländern leidet jede fünfte Person unter Schlafstörungen.
Die neurophysiologischen Hintergründe sind nicht bekannt. Patienten mit
chronischen Schlafstörungen (insomnia) zeigen eine erhöhte Aktivität
des ARAS (PET) und zeigen höherfrequente Anteile im EEG, ähnlich wie im Wachzustand.
In westlichen Ländern leidet jede fünfte Person unter Schlafstörungen.
Die neurophysiologischen Hintergründe sind nicht bekannt. Patienten mit
chronischen Schlafstörungen (insomnia) zeigen eine erhöhte Aktivität
des ARAS (PET) und zeigen höherfrequente Anteile im EEG, ähnlich wie im Wachzustand. Insomnien (Ein- und Durchschlafstörungen, z.B. Schlafapnoe)
Insomnien (Ein- und Durchschlafstörungen, z.B. Schlafapnoe) Parasomnien (Verhaltensauffälligkeiten während des Schlafs, z.B. Schlafwandeln)
Parasomnien (Verhaltensauffälligkeiten während des Schlafs, z.B. Schlafwandeln) Hypersomnien (Schlafsucht, z.B. Narkolepsie)
Hypersomnien (Schlafsucht, z.B. Narkolepsie) Gestörte Schlaf-Wach-Rhythmen (z.B. Schichtarbeit, Jet-Lag)
Gestörte Schlaf-Wach-Rhythmen (z.B. Schichtarbeit, Jet-Lag)  Schlaf tritt in einem Rhythmus auf, der vom nucleus suprachiasmaticus
vorgegeben wird. Die Periodizität wird von der Belichtung von
Melanopsin in der Netzhaut synchronisiert, deren Ganglienzellen auf den
nucleus suprachiasmaticus glutaminerg projizieren. Der nucleus
suprachiasmaticus beeinflusst den Schlaf - wie auch Körpertemperatur,
endokrine Aktivität u.a. - über Projektionen auf Hypothalamus und
mediale präoptische Region
Schlaf tritt in einem Rhythmus auf, der vom nucleus suprachiasmaticus
vorgegeben wird. Die Periodizität wird von der Belichtung von
Melanopsin in der Netzhaut synchronisiert, deren Ganglienzellen auf den
nucleus suprachiasmaticus glutaminerg projizieren. Der nucleus
suprachiasmaticus beeinflusst den Schlaf - wie auch Körpertemperatur,
endokrine Aktivität u.a. - über Projektionen auf Hypothalamus und
mediale präoptische Region Mehrere interagierende Hirnregionen steuern das Schlafgeschehen: Mehrere interagierende Hirnregionen steuern das Schlafgeschehen: -- Das basale Vorderhirn lässt Tiefschlaf (slow-wave sleep) zu, wenn es nicht aus dem Hirnstamm zu Wachsein und Aufmerksamkeit angeregt wird, und inhibiert seinerseits das Arousal-System im Hirnstamm -- Die formatio reticularis aktiviert das Vorderhirn (arousal); seine Blockade führt zu Tiefschlaf -- Ein pontines System in der subcoeruleären Region kann REM-Schlaf (rapid eye movements) triggern. Es projiziert glutamaterg in die medulla oblongata und aktiviert dort GABA- und glyzinerge Neurone, deren Axone motorische Vorderhornzellen im Rückenmark hemmen (Muskelatonie). -- Neurone des lateralen Hypothalamus nutzen Orexin als Neurotransmitter, mit dem sie das monoaminerge Wecksystem anregen, den REM-Schlaf unterdrücken und motorische Verhaltensmuster steuern. Ohne Orexinwirkung kommt es zu Narkolepsie  Monoaminerge (weckende: noradrenerg, serotoninerg, cholinerg) und
schlafinduzierende ventrolateral-präoptische Kerne hemmen sich
gegenseitig. Vor dem Aufwachen oder bei Steigerung der Aufmerksamkeit
beginnen monoaminerge Neuronen vermehrt zu feuern und regen Thalamus
und Hirnrinde an
Monoaminerge (weckende: noradrenerg, serotoninerg, cholinerg) und
schlafinduzierende ventrolateral-präoptische Kerne hemmen sich
gegenseitig. Vor dem Aufwachen oder bei Steigerung der Aufmerksamkeit
beginnen monoaminerge Neuronen vermehrt zu feuern und regen Thalamus
und Hirnrinde an Schlafinduzierend wirken Interleukin 1 (Gliazellen), Melatonin
(Zirbeldrüse), Adenosin (Belastung), Stickstoffmonoxid (Schlafmangel),
Cortistatine (Großhirnrinde)
Schlafinduzierend wirken Interleukin 1 (Gliazellen), Melatonin
(Zirbeldrüse), Adenosin (Belastung), Stickstoffmonoxid (Schlafmangel),
Cortistatine (Großhirnrinde) Der non-REM-Schlaf (orthodoxer Schlaf, Tiefschlaf, NREM-Schlaf) baut
sich mit zunehmender Schlaftiefe stufenweise auf: α-Wellen treten beim
Dösen auf, ϑ-Wellen im leichten Schlaf, δ-Wellen im Tiefschlaf. In
diesem Stadium blockieren niederfrequente thalamische Entladungen die
Übermittlung sensorischer Information an den Cortex
Der non-REM-Schlaf (orthodoxer Schlaf, Tiefschlaf, NREM-Schlaf) baut
sich mit zunehmender Schlaftiefe stufenweise auf: α-Wellen treten beim
Dösen auf, ϑ-Wellen im leichten Schlaf, δ-Wellen im Tiefschlaf. In
diesem Stadium blockieren niederfrequente thalamische Entladungen die
Übermittlung sensorischer Information an den Cortex Im Non-REM-Schlaf sind Blutdruck, Puls- und Atemfrequenz niedriger als im Wachzustand Im Non-REM-Schlaf sind Blutdruck, Puls- und Atemfrequenz niedriger als im Wachzustand Im REM-Schlaf
steigen Herzfrequenz und arterieller Blutdruck bei minimalem
Muskeltonus an, die mittlere Frequenz der EEG-Wellen ist höher als im
Tiefschlaf. Während
REM-Phasen treten häufig Träume auf. Der Thalamus leitet sensorische
Information nicht zum Cortex weiter; der präfrontale Cortex ist außer
Funktion Im REM-Schlaf
steigen Herzfrequenz und arterieller Blutdruck bei minimalem
Muskeltonus an, die mittlere Frequenz der EEG-Wellen ist höher als im
Tiefschlaf. Während
REM-Phasen treten häufig Träume auf. Der Thalamus leitet sensorische
Information nicht zum Cortex weiter; der präfrontale Cortex ist außer
Funktion |
