

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert

Netzhaut
© H. Hinghofer-Szalkay

Amakrine Zelle: a- = un-, μακρός = groß, ἴνες = Fasern (Zelle mit kurzen Fortsätzen)
Bruch'sche Membran: Carl W.L. Bruch
Candela: lat. Kerze
Chiasma opticum: χίασμα = Kreuzung (nach der Form des Buchstabens χ)
Chromophor: χρῶμα = Farbe, φορός = tragend
Deuteranopie: δεύτερος = der Zweite, ἁν = Verneinung, ὤψ = Auge
Glaukom: γλαυκός = hell, glänzend‚ bläulich (abgeleitet von blau-grauer Verfärbung der Iris bei chronischer Entzündung)
Goldmann-Perimeter: Hans Goldmann
Hemianopsie: ἡμι = halb,
ἀ(v) = Verneinung, ὤψ = Auge
Horopter: ὅρος = Grenze, ὀπτήρ = Späher
Kohlrausch-scher Knick: Arnt Kohlrausch
Koniozelluläres System: κονῖα = Staub, Sand, Asche ("Zellen so klein wie Staub")
Müller-Zellen: Heinrich Müller
Panum-Raum: Peter Panum
Parvozelluläres System: parvus (lat) = klein
Photo-: φῶς / φωτός = Licht
Protanopie: πρῶτος = der Erste, ἁν = Verneinung, ὤψ = Auge
Purkinje-Effekt: Jan E. Purkinje
Retina: rete = Netz (Netzhaut)
Rhodopsin: ρόδον = Rose (rosenrot ... "Sehpurpur")
Skotom: σκὁτος = Dunkelheit
Tritanopie: τρίτος = der Dritte, ἁν = Verneinung, ὤψ = Auge
Der Anpassungsbereich an wechselnde Lichtstärke
(Leuchtdichtenbereich) erstreckt sich über sechs Größenordnungen. Helladaptation erfolgt
innerhalb einer Minute, vollständige Dunkeladaptation kann über eine
halbe Stunde dauern; Zapfen adaptieren rascher als Stäbchen
(unterschiedliche Adaptationskurven).
Die (farbempfindlichen, auf hohen Lichtfluss eingerichteten) Zapfen
konzentrieren sich zur fovea centralis (Stelle des schärfsten Sehens)
hin, in der sie - dicht gepackt - die einzigen Photorezeptoren sind.
Hier entspricht jeder Rezeptorzelle eine eigene Faser im Sehnerv (kleine rezeptive Felder, hohe Auflösung). Bei niedrigem
Lichtfluss besteht zentral ein "blinder Fleck", da es hier nur Zapfen
gibt, die bei geringem Lichtfluss nicht erregt werden (Mondlicht: Lesen unmöglich).
Die (hochempfindlichen) Stäbchen
überwiegen in der Netzhautperipherie. Die Information zahlreicher
Stäbchen kann auf jeweils wenige Sehnervneuronen zusammengeschaltet
werden (große rezeptive Felder), damit steigt die
Lichtempfindlichkeit - bei geringem Auflösungsvermögen.
In der Netzhautperipherie detektierte Veränderungen im Gesichtsfeld (Bewegung, Helligkeitsschwankung) veranlassen die Blickmotorik, die
Augenachsen mittels ruckartiger Okulomotorik (Sakkade) so einzustellen, dass die "Neuigkeit" auf die foveae projiziert und eine genauere (bewusste) visuelle Analyse möglich wird.
Die Netzhaut enthält verschiedene Arten von Ganglienzellen: 80% gehören zum farbempfindlichen parvozellulären System
mit kleinen rezeptiven Feldern (hohes räumliches Auflösungsvermögen) -
sie erkennen das WAS. Etwa 10% gehören zum farbunempfindlichen,
adaptationsfreudigen magnozellulären System
mit großen rezeptiven Feldern und hoher zeitlicher Auflösung - sie sind
auf Position (WO?) und Bewegung (WOHIN?) spezialisiert. 10% sind
photosensitive Ganglienzellen (Melanopsin).
Räumliches Sehen beruht auf Abweichungen (Querdisparation) der Netzhautbilder in der x-Achse (Verbindungslinie der Augen). Eine Kurve in der Umgebung, deren Punkte auf korrespondierende (deckungsgleiche) Netzhautstellen projizieren, heisst Horopter(kreis).
Die Untersuchung des Gesichtsfeldes nennt man Perimetrie.
Man kann mit ihr die Ausbreitung des Gesichtsfeldes, fleckförmige
Ausfälle (Skotome), Halbseitenausfälle
(Hemianopsien) und Farbwahrnehmungsbereiche feststellen und Störungen zuordnen
(Netzhautdefekte, Glaukom, Hypophysentumor..)
.
|
Netzhaut, Rezeptorverteilung und Lichtfluss
 Photosensitive Zellen
Photosensitive Zellen  Phototransduktion
Phototransduktion  Pigmentepithel
Pigmentepithel  Adaptation
Adaptation  Physiologie der Retina
Physiologie der Retina  P-, M- und koniozelluläres System
P-, M- und koniozelluläres System  Sehnervenkreuzung
Sehnervenkreuzung  Räumliches Sehen
Räumliches Sehen  Perimetrie
Perimetrie  Elektroretinographie
Elektroretinographie

Macula, Fovea, Foveola  Lichtstärke
Lichtstärke  Photopsine, Iodopsine, Skotopsine
Photopsine, Iodopsine, Skotopsine  Rezeptives Feld
Rezeptives Feld  Gesichtsfeld
Gesichtsfeld

 Core messages
Core messages
Die Netzhaut (Retina  ) ist ein dünner (0,2 mm) vorgelagerter Teil des Gehirns, mit dem sie über den II. Hirnnerven (N. opticus)
verbunden ist. Ihre Ganglienzellen senden Impulse zum Thalamus.
Zwischen den Rezeptorzellen (Photorezeptoren: Stäbchen, Zapfen) liegen
meist mehrere Schichten von Begleitzellen für "vertikale" und
"horizontale" Verschaltungen, die aber so gut wie durchsichtig sind und
die Entstehung des Netzhautbildes kaum beeinflussen. Auch zieht ein
Netzwerk von Blutgefäßen durch die Netzhaut, was die optische
Wahrnehmung der Umwelt ebenfalls nicht stört. Eine Stelle ("blinder
Fleck") verfügt über gar keine Photorezeptoren, das Gehirn rechnet für
diese Fläche einfach die optischen Eigenschaften der Nachbarbezirke
hoch - es entsteht der Eindruck eines durchgehenden Bildes (perceptual interpolation).
) ist ein dünner (0,2 mm) vorgelagerter Teil des Gehirns, mit dem sie über den II. Hirnnerven (N. opticus)
verbunden ist. Ihre Ganglienzellen senden Impulse zum Thalamus.
Zwischen den Rezeptorzellen (Photorezeptoren: Stäbchen, Zapfen) liegen
meist mehrere Schichten von Begleitzellen für "vertikale" und
"horizontale" Verschaltungen, die aber so gut wie durchsichtig sind und
die Entstehung des Netzhautbildes kaum beeinflussen. Auch zieht ein
Netzwerk von Blutgefäßen durch die Netzhaut, was die optische
Wahrnehmung der Umwelt ebenfalls nicht stört. Eine Stelle ("blinder
Fleck") verfügt über gar keine Photorezeptoren, das Gehirn rechnet für
diese Fläche einfach die optischen Eigenschaften der Nachbarbezirke
hoch - es entsteht der Eindruck eines durchgehenden Bildes (perceptual interpolation).
Die Aufgabe des visuellen Systems besteht nicht nur darin, eine
verlässliche Repräsentation der Umwelt darzustellen; es extrahiert vor
allem auch biologisch wichtige Charakteristika wie Größe, Tiefe,
Bewegung, Farbe von Objekten, deren Bild auf die Netzhaut fällt. Die
Netzhaut ist zu einer ersten Bildanalyse fähig: Irrelevante Information
findet kaum den Weg zum Gehirn, relevante umso mehr.
Die Netzhaut enthält Sehsysteme mit unterschiedlichen Arbeitsbereichen und Funktionen
Rezeptorzellen in der Netzhaut
können Licht im Wellenlängenbereich zwischen 390 und 670 nm in
Änderungen ihres Membranpotentials umsetzen. Diese Sinneszellen heißen Zapfen und Stäbchen. Sie liegen in der äußersten Zellschichte der Netzhaut ( Abbildung unten), d.h. das Licht durchdringt
alle anderen, bevor es an die Außensegmente der Zapfen und Stäbchen
gelangt. Dazu kommen fotosensible Ganglienzellen in der Innenschicht der Retina.
Abbildung unten), d.h. das Licht durchdringt
alle anderen, bevor es an die Außensegmente der Zapfen und Stäbchen
gelangt. Dazu kommen fotosensible Ganglienzellen in der Innenschicht der Retina.
Die Mehrzahl der in die Signalverarbeitung der Retina involvierten
Zellen operiert mit lokalen Schwankungen ihres Membranpotentials (elektrotonisch); nur Ganglienzellen (retinal ganglion cells,
RGCs) und einige amakrine Zellen bilden Aktionspotentiale. Der Vorteil
liegt im größeren Informationsgehalt abgestufter (analoger)
Potentialschwankungen, die Anzahl exozytierter synaptischer Vesikel
variiert je nach Grad einer Potentialänderung (Aktionspotentiale übertragen Alles-oder-Nichts-Information).
Die Nachteile der elektrotonischen Ausbreitung (geringe
Geschwindigkeit, Signalabschwächung) spielen angesichts der geringen
Entfernungen zwischen kooperierenden Zellen in der Netzhaut so gut wie
keine Rolle. Erst die (aufgearbeitete) in den Sehnerv eingespeiste
Information wird "digital" (über Aktionspotentialfrequenzen) übertragen
und überwindet die Distanz zum Gehirn entsprechend rasch (mehrere m/s).
Die Verteilung der Photorezeptoren in der Netzhaut ist sehr
unterschiedlich. Zapfen (farbempfindlich) konzentrieren sich auf den
zentralen (mit hohem Auflösungsvermögen ausgestatteten) Teil der
Netzhaut, Stäbchen (sehr lichtempfindlich) verteilen sich über die
gesamte Netzhaut (außer die foveola), besonders dicht in einer
ringförmigen Zone etwa 20-30 Bogengrade um die fovea ( Abbildung):
Abbildung):
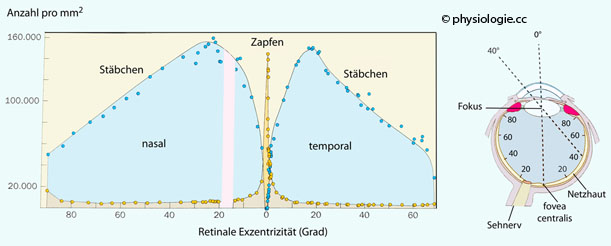
 Abbildung: Verteilung von Rezeptorzellen auf der Netzhaut
Nach einer Vorlage in Liqun Luo, Principles of Neurobiology, 2nd ed. CRC Press 2021
Abbildung: Verteilung von Rezeptorzellen auf der Netzhaut
Nach einer Vorlage in Liqun Luo, Principles of Neurobiology, 2nd ed. CRC Press 2021
Links:
Verteilung der Dichte an Photorezeptoren in einem horizontalen
Netzhautprofil (Schnittlinie durch fovea centralis und discus opticus).
Größte
Zapfendichte (>105/mm2) im
Bereich der fovea centralis,
größte Stäbchendichte bei ungefähr 20-30°. Im Bereich des discus opticus
(Durchtritt der Ganglienzell-Axone zum Sehnerven in der nasal liegenden
Netzhaut) gibt es keine Photorezeptoren, was den "blinden Fleck" im
temporalen Gesichtsfeld (bei etwa 15-20°) zur Folge hat (Bereich rosa
angedeutet).
In der Mitte der fovea centralis (an der Stelle der foveola: foveal pit) weichen die Ganglienzellen der Netzhaut auseinander und geben dem (vom Fixationspunkt kommenden) zentralen
Lichtstrahl (0°) den Weg frei direkt zu den Zapfen, die hier am engsten
angeordnet sind (höchstes Auflösungsvermögen).
Rechts: Darstellung der
retinalen Exzentrizität. Etwa 50% der Neurone im
Sehnerv bringen Information aus dem Bereich der
fovea centralis (Kreisfläche entsprechend etwa einem Bogengrad), die
andere Hälfte aus der gesamten Netzhautperipherie.
Je größer die retinale Exzentrizität,
desto schwieriger wird
die Erkennung von Gegenständen, die auf die entsprechende
Netzhautstelle projiziert werden. Treten hier neue / unerwartete Reize
(wie Bewegungen, Lichtblitze) auf, steuert die Okulomotorik die Augen
auf diesen neuen Fixationspunkt zu (Sakkaden), sodass er im Detail
analysiert werden kann
 Die macula lutea (der
gelbe Fleck, "anatomische Makula") ist ein querovaler Bezirk
(Gesamtdurchmesser 5,5 mm, entspricht 18 Bogengraden) der Netzhaut, der
in rotfreiem Licht gelblich erscheint (Carotinoide). Die macula besteht
aus der fovea centralis ("Netzhautgrube",
"klinische Makula", 1,5-1,9 mm Durchmesser - entspricht knapp 5
Bogengraden Ausdehnung, ungefähr 15° bis 20° nasal von der Stelle des
schärfsten Sehens gelegen) mit der zentralen foveola (Stelle des schärfsten Sehens, Durchmesser 0,35 mm, avaskulär, enthält nur - einzeln innervierte - Zapfen sowie Müller-Zellen), welche die kleinsten rezeptiven Felder aufweist; einem 0,5 mm breiten umgebenden Ring (Parafovea) mit einem Zapfen/Stäbchen-Verhältnis von ~1:1; und einer äußeren Randzone, der Perifovea, mit wesentlich geringerer Zapfendichte.
Die macula lutea (der
gelbe Fleck, "anatomische Makula") ist ein querovaler Bezirk
(Gesamtdurchmesser 5,5 mm, entspricht 18 Bogengraden) der Netzhaut, der
in rotfreiem Licht gelblich erscheint (Carotinoide). Die macula besteht
aus der fovea centralis ("Netzhautgrube",
"klinische Makula", 1,5-1,9 mm Durchmesser - entspricht knapp 5
Bogengraden Ausdehnung, ungefähr 15° bis 20° nasal von der Stelle des
schärfsten Sehens gelegen) mit der zentralen foveola (Stelle des schärfsten Sehens, Durchmesser 0,35 mm, avaskulär, enthält nur - einzeln innervierte - Zapfen sowie Müller-Zellen), welche die kleinsten rezeptiven Felder aufweist; einem 0,5 mm breiten umgebenden Ring (Parafovea) mit einem Zapfen/Stäbchen-Verhältnis von ~1:1; und einer äußeren Randzone, der Perifovea, mit wesentlich geringerer Zapfendichte.
Der Arbeitsbereich der Sehrezeptoren - gemessen an den
Extremen der Lichtstärke - erstreckt sich von 10-7 bis zu 106 Candela, also über 13 Zehnerpotenzen.
 Unter Lichtstärke (luminous intensity) versteht man den von einer Lichtquelle ausgehenden Lichtstrom
("Helligkeit", Strahlungsfluss, Strahlungsleistung: Energie pro Zeit,
Einheit Watt), bezogen auf den Raumwinkel.
Unter Lichtstärke (luminous intensity) versteht man den von einer Lichtquelle ausgehenden Lichtstrom
("Helligkeit", Strahlungsfluss, Strahlungsleistung: Energie pro Zeit,
Einheit Watt), bezogen auf den Raumwinkel.
Die SI-Einheit für die
Lichtstärke ist das Candela (Cd) : 1 Cd = 1 Lumen (lm) pro Steradiant (sr).
: 1 Cd = 1 Lumen (lm) pro Steradiant (sr).
1 Lumen entspricht einem Photonenstrom von 4,1.1015
Photonen pro Sekunde bei 555 nm Wellenlänge; 1 Steradiant ist der
Raumwinkel, den (aus dem Kugelmittelpunkt heraus betrachtet) eine
Kalotte mit der Fläche r2 auf der Kugeloberfläche einnimmt (dadurch ist der Raumwinkel unabhängig vom Radius).
 Luminanz ist ein Maß für die Helligkeit: Entspricht der Leuchtdichte - Candela / m2. Beispiel: Eine typische 15-W-Leuchtstoffröhre liefert etwa
650 Lumen und eine Leuchtdichte von 7000 cd / m2.
Luminanz ist ein Maß für die Helligkeit: Entspricht der Leuchtdichte - Candela / m2. Beispiel: Eine typische 15-W-Leuchtstoffröhre liefert etwa
650 Lumen und eine Leuchtdichte von 7000 cd / m2.
Rezeptoren in der Netzhaut: Die insgesamt über 120 Millionen Rezeptorzellen (6 Millionen davon Zapfen) sind unterschiedlich auf die Netzhaut verteilt
( Abbildung):
Abbildung):

Im Bereich der fovea centralis
(Stelle des höchsten Auflösungsvermögens, d.h. des schärfsten Sehens)
findet man nur Zapfen (dicht gepackt - etwa 140.000 pro mm
2);

die höchste Stäbchendichte liegt bei ~20° um die
fovea.
Weiters sind die Rezeptoren unterschiedlich stark zu Einheiten
zusammengeschaltet, die jeweils zu einer Ganglienzelle konvergieren
(rezeptive Felder: ~1:1 in der fovea, ~1000:1 in der
Netzhautperipherie). So gibt es >108 retinale Rezeptorzellen, aber nur <106 afferente Nervenfasern im N. opticus.
 Dass auf der Netzhaut ein umgekehrtes Bild der Umwelt entsteht, wird schon 1604 von Johannes Kepler beschrieben. Einige Jahre später entwickelt Christoph Scheiner
optische Geräte, die u.a. mittels Doppelbildern zur Klärung des
Strahlenganges im Auge beitragen ("Scheiner'sche Latte"). 1876 entdeckt
Franz Boll das Rhodopsin. Shinobu Ishihara veröffentlicht 1916 einen aus 38 Tafeln bestehenden Test zur Prüfung auf Farbenblindheit ("Ishihara-Tafeln").
Dass auf der Netzhaut ein umgekehrtes Bild der Umwelt entsteht, wird schon 1604 von Johannes Kepler beschrieben. Einige Jahre später entwickelt Christoph Scheiner
optische Geräte, die u.a. mittels Doppelbildern zur Klärung des
Strahlenganges im Auge beitragen ("Scheiner'sche Latte"). 1876 entdeckt
Franz Boll das Rhodopsin. Shinobu Ishihara veröffentlicht 1916 einen aus 38 Tafeln bestehenden Test zur Prüfung auf Farbenblindheit ("Ishihara-Tafeln").
Photosensitive Zellen: Stäbchen arbeiten weniger empfindlich, aber schneller als Zapfen
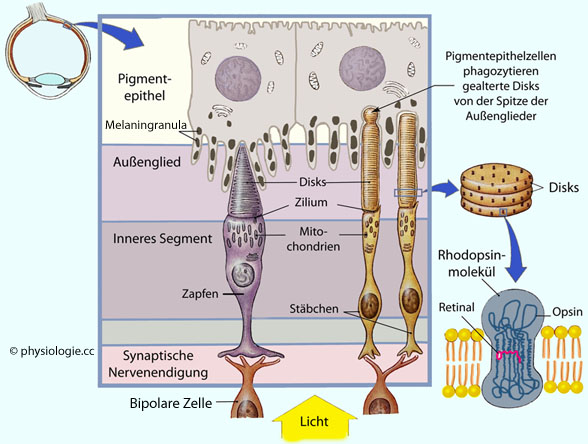

Abbildung: Photorezeptoren in der Netzhaut
Nach einer Vorlage in Silverthorn, Human Physiology, an integrated approach, 4th Int'l ed. 2007, Pearson / Benjamin Cummings
Die Transduktion (Licht
→
elektrophysiologische Reaktion) findet im Außenglied der Rezeptorzellen
statt. Lichteinfall führt zur Dissoziation von Retinal und Opsin,
letzteres aktiviert Transduzin, was zu Absinken des [cGMP] im
Zytoplasma des Außenglieds führt. Darauf reagieren Natriumkanäle mit
niedriger Öffnungswahrscheinlichkeit, und das Membranpotential der
Zelle steuigt von -40 auf -70 mV. Dadurch sinkt die Freisetzung von
Glutamat an der synaptischen Endigung (s. unten).
Pigmentepithelzellen enthalten Melaningranula und "schatten" damit den
Lichtfluss ab. Das reduziert die Wirkung von Streulicht und verbessert
die retinale Abbildungsqualität. Außerdem können
Pigmentepithelzellen gealterte Disks phagozytieren.
Die
(beleuchtungsabhängigen) Änderungen des Membranpotentials der Zapfen-
bzw. Stäbchenzelle verändert die Freisetzung des Neurotransmitters
(Glutamat) zur bipolaren Netzhautzelle, die zwischen Photorezeptor- und
retinale Ganglienzelle geschaltet ist

I
n
der Netzhaut des Menschen gibt es drei Arten lichtempfindlicher Zellen mit unterschiedlicher spektraler Empfindlichkeit:
 Zapfen (cones) - S-Zapfen bei ~420, M-Zapfen bei ~530, L-Zapfen bei ~560 nm (photopisches Sehen insgesamt bei ~550 nm). Sehpigment ist S-, M- und L-Photopsin
Zapfen (cones) - S-Zapfen bei ~420, M-Zapfen bei ~530, L-Zapfen bei ~560 nm (photopisches Sehen insgesamt bei ~550 nm). Sehpigment ist S-, M- und L-Photopsin
 Stäbchen (rods) für skotopisches Sehen bei ~500 nm. Sehpigment ist das Rhodopsin
Stäbchen (rods) für skotopisches Sehen bei ~500 nm. Sehpigment ist das Rhodopsin
 Photosensitive Ganglienzellen (intrinsically photoreceptive retinal ganglion cells, ipRGCs) - Melanopsin verleiht ihnen die größte Empfindlichkeit bei 460-480 nm.
Photosensitive Ganglienzellen (intrinsically photoreceptive retinal ganglion cells, ipRGCs) - Melanopsin verleiht ihnen die größte Empfindlichkeit bei 460-480 nm.
 Zur Bedeutung der ipRGCs für die Justierung zirkadianer Rhythmen s. dort
Zur Bedeutung der ipRGCs für die Justierung zirkadianer Rhythmen s. dort

 Abbildung: Spektrale Empfindlichkeit von Zapfen und Stäbchen
Abbildung: Spektrale Empfindlichkeit von Zapfen und Stäbchen
Nach Blume C, Garbazza C, Spitschan N. Effects of light on human circadian rhythms, sleep ans mood. Somnologie (Berl) 2019; 23: 147-56
Jede
Sinneszellpopulation hat ein bestimmtes spektrales
Empfindlichkeitsverhalten. Stäbchen reagieren am stärksten auf Licht
von ~500 nm Wellenlänge. Blau-(S-) Zapfen haben ihr
Empfindlichkeitsmaximum um ~420, ipRGCs (Melanopsin) bei 460-480, Grün- (M-) Rezeptoren um ~540, Rot- (L-)
Sensoren um ~570 nm

Zapfen
sind um ca. zwei Zehnerpotenzen weniger lichtempfindlich als Stäbchen,
reagieren dafür dreimal schneller auf Lichtblitze (maximale Antwort in
50 ms) als Stäbchen (150 ms) und stellen das Ausgangspotential rascher
wieder her, arbeiten also mit besserer Zeitauflösung (was für die
Wahrnehmung von Bewegungen wichtig ist). Das hat mehrere Gründe, u.a.
eine relativ große Membranoberfläche (Fläche / Volumen-Quotient), was
den Austausch von Calciumionen beschleunigt.
Photorezeptoren bestehen aus mehreren Teilen ( Abbildung unten):
Abbildung unten):
 Einem pigmentepithelnahen Außensegment (outer segment) - einem stark modifizierten Zilium - mit bis zu 1000 membranösen Scheiben (discs), an denen die visuelle Signaltransduktion stattfindet,
Einem pigmentepithelnahen Außensegment (outer segment) - einem stark modifizierten Zilium - mit bis zu 1000 membranösen Scheiben (discs), an denen die visuelle Signaltransduktion stattfindet,
 einem Verbindungsteil (connecting cilium),
einem Verbindungsteil (connecting cilium),
 einem metabolisch besonders aktiven Innensegment (inner segment) mit
zahlreichen Mitochondrien, welche der Energieversorgung der Zelle
dienen, und endoplasmatischem Retikulum, das Proteine nachsynthetisiert,
einem metabolisch besonders aktiven Innensegment (inner segment) mit
zahlreichen Mitochondrien, welche der Energieversorgung der Zelle
dienen, und endoplasmatischem Retikulum, das Proteine nachsynthetisiert,
 einer - über ein kurzes Axon mit dem Innensegment verbundene - Endzone mit synaptischen Endigungen (mit bandförmigen ribbon synapses), an denen der Transmitter an die angeschlossene(n) Bipolarzelle(n) freigesetzt wird.
einer - über ein kurzes Axon mit dem Innensegment verbundene - Endzone mit synaptischen Endigungen (mit bandförmigen ribbon synapses), an denen der Transmitter an die angeschlossene(n) Bipolarzelle(n) freigesetzt wird.
 Zapfen (cones) sind für hohe Lichtstärke (photopisches
Zapfen (cones) sind für hohe Lichtstärke (photopisches  Sehen - gleichzeitig Farberkennen). Das Sehpigment der Zapfen sind die Photopsine - Proteine, die ein Chromophor
Sehen - gleichzeitig Farberkennen). Das Sehpigment der Zapfen sind die Photopsine - Proteine, die ein Chromophor
 (einen farbgebenden Stoff) gebunden haben, und zwar 11-cis-Retinal.
Ihre Absorptionsmaxima liegen (
(einen farbgebenden Stoff) gebunden haben, und zwar 11-cis-Retinal.
Ihre Absorptionsmaxima liegen ( Abbildung)
Abbildung)
 bei ~560 nm (rot-sensitives L-Iodopsin mit
L-Photopsin; L für Long wave),
bei ~560 nm (rot-sensitives L-Iodopsin mit
L-Photopsin; L für Long wave),
 bei ~530 nm (grün-sensitives M-Iodopsin mit M-Photopsin; M für Medium wave) und
bei ~530 nm (grün-sensitives M-Iodopsin mit M-Photopsin; M für Medium wave) und
 bei ~420 nm (blau-sensitives S-Iodopsin mit S-Photopsin; S für Short wave).
bei ~420 nm (blau-sensitives S-Iodopsin mit S-Photopsin; S für Short wave).
Insgesamt liegt das Empfindlichkeitsmaximum des photopischen (Zapfen-) Sehens bei ~550 nm ("gelb").
 Stäbchen
(rods) für niedrige Lichtstärke (skotopisches
Stäbchen
(rods) für niedrige Lichtstärke (skotopisches  Sehen - "unbunt", ohne
Farbunterscheidung) zuständig. Das Sehpigment der Stäbchen ist das Rhodopsin
Sehen - "unbunt", ohne
Farbunterscheidung) zuständig. Das Sehpigment der Stäbchen ist das Rhodopsin  (
( Abbildung) - ebenfalls ein Protein, das mit 11-cis-Retinal kombiniert ist; das Absorptionsmaximum liegt bei ~500 nm (exakt: 498 nm).
Abbildung) - ebenfalls ein Protein, das mit 11-cis-Retinal kombiniert ist; das Absorptionsmaximum liegt bei ~500 nm (exakt: 498 nm).
Opsin ist ein (aus 348 Aminosäuren bestehendes) heptahelikales
Membanprotein der Scheiben in den Außensegmenten der Photorezeptoren,
das an einer definierten Stelle (Rhodopsin: Lysin an der Position 296)
den
Anhaftungspunkt für das Sehpigment
(Retinal) trägt ( Abbildung). Dessen "Flop" von der 11-cis- zur
11-trans-Konfiguration ist der einzige lichtabhängige Schritt der
Phototransduktion.
Abbildung). Dessen "Flop" von der 11-cis- zur
11-trans-Konfiguration ist der einzige lichtabhängige Schritt der
Phototransduktion.

 Abbildung: Sehpigment in Stäbchen
Abbildung: Sehpigment in Stäbchen
Nach einer Vorlage in Kandel / Koester / Mack / Siegelbaum (eds), Principles of Neural Sciences, 6th ed. 2021 (McGraw Hill)
Opsin besteht aus 348 Aminosäuren und bildet einen heptahelikalen
Komplex in der Membran der Scheiben im Außensegment der Stäbchen (s. unten).
Das lichtabsorbierende Retinal bindet an Aminosäure #296 (roter Punkt).
Nimmt es durch Lichteinfluss die All-trans-Konfiguration an, triggert
das die Vorgänge der Phototransduktion

 Abbildung), was die spektrale Empfindlichkeit
des Photopsins beeinflusst. Der "Flop" von der 11-cis- zur
All-Trans-Konfiguration
des Retinals ist der einzige lichtabhängige Schritt der
Phototransduktion.
Abbildung), was die spektrale Empfindlichkeit
des Photopsins beeinflusst. Der "Flop" von der 11-cis- zur
All-Trans-Konfiguration
des Retinals ist der einzige lichtabhängige Schritt der
Phototransduktion.
 Zapfen-Opsine werden im ungebundenen Zustand Photopsine genannt, an Retinal gebunden heißen sie Iodopsine (Jodopsine). Stäbchen-Opsine werden im ungebundenen Zustand Skotopsine genannt, an Retinal gebunden heißen sie Rhodopsine (auch Porphyropsine).
Zapfen-Opsine werden im ungebundenen Zustand Photopsine genannt, an Retinal gebunden heißen sie Iodopsine (Jodopsine). Stäbchen-Opsine werden im ungebundenen Zustand Skotopsine genannt, an Retinal gebunden heißen sie Rhodopsine (auch Porphyropsine).
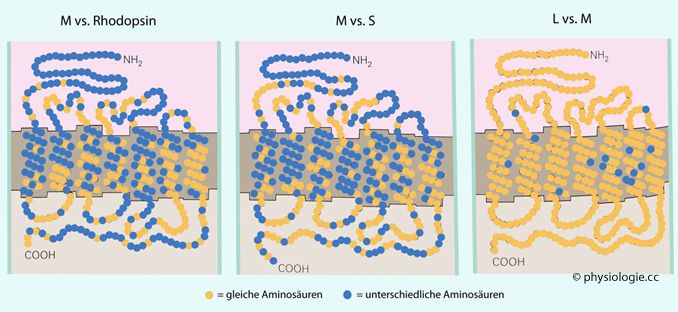
 Abbildung: Vergleich der Aminosäuresequenzen des Opsins
Abbildung: Vergleich der Aminosäuresequenzen des Opsins
Nach einer Vorlage in Kandel / Koester / Mack / Siegelbaum (eds), Principles of Neural Sciences, 6th ed. 2021 (McGraw Hill)
Während sich das Grün- (M-) vom Rot- (L-) Pigment nur in wenigen Aminosäuren unterscheidet (rechts), ist der Unterschied zum Blau (S-) Photopsin wesentlich größer (Mitte). Sehr ausgeprägt ist auch der Unterschied zum Stäbchenpigment Rhodopsin (links)

Zuordnung der Farbe: Rezeptoren
können auf Grund ihrer glockenförmigen Empfindlichkeitskurve auf
unterschiedliche Lichtfrequenzen gleich stark ansprechen (z.B.
Rotrezeptoren gleich stark auf Licht mit 520 und 600 nm, maximal auf 560 nm,  Abbildung). Das Gehirn
kann das aber auseinanderhalten und "verwechselt" nicht 520 mit 600 nm: Es ordnet die Farben korrekt zu, indem es die Gesamtheit
der Information von der Netzhaut berücksichtigt (auch die
Erregungsmuster der Grün- und Blau- Rezeptoren).
Abbildung). Das Gehirn
kann das aber auseinanderhalten und "verwechselt" nicht 520 mit 600 nm: Es ordnet die Farben korrekt zu, indem es die Gesamtheit
der Information von der Netzhaut berücksichtigt (auch die
Erregungsmuster der Grün- und Blau- Rezeptoren).
Ausfall des
L-Systems bedingt Protanopie, des M-Systems Deuteranopie und des
S-Systems Tritanopie (s. unten).
 Das Gehirn integriert verschiedene Reizkomponenten zu einem
durch Analyse mehrfacher Sinnesinputs "abgesicherten" Ensemble.
Das Gehirn integriert verschiedene Reizkomponenten zu einem
durch Analyse mehrfacher Sinnesinputs "abgesicherten" Ensemble.
Der Unterschied des spektralen Empfindlichkeitsmaximums (photopisch 550 nm, skotopisch 500 nm) erklärt
den Purkinje-Effekt:

 In sehr lichtschwacher Umgebung (nur Stäbchen: skotopisches
Sehen)
empfindet man grünliche Gegenstände als
die hellsten (Empfindlichkeitsmaximum bei 500 nm - die Farbe erkennt man aber nicht, weil Zapfen bei dieser Lichtintensität nicht erregt werden).
In sehr lichtschwacher Umgebung (nur Stäbchen: skotopisches
Sehen)
empfindet man grünliche Gegenstände als
die hellsten (Empfindlichkeitsmaximum bei 500 nm - die Farbe erkennt man aber nicht, weil Zapfen bei dieser Lichtintensität nicht erregt werden).
 Steigt die Beleuchtungsstärke (Zapfen werden aktiv: photopisches Sehen),
erscheinen gelbliche Objekte als die hellsten (spektrales Empfindlichkeitsmaximum des Zapfensystems bei 550 nm: Purkinje-Verschiebung um ca. 50 nm).
Steigt die Beleuchtungsstärke (Zapfen werden aktiv: photopisches Sehen),
erscheinen gelbliche Objekte als die hellsten (spektrales Empfindlichkeitsmaximum des Zapfensystems bei 550 nm: Purkinje-Verschiebung um ca. 50 nm).
Das skotopische System hat ein von "gelb" zu "grün" verschobenes Empfindlichkeitsmaximum
|
Licht von ~500 nm wird bei skotopischem Sehen heller wahrgenommen als Licht anderer Wellenlängen
Diese Wellenlänge liegt zwischen dem Absorptionsmaximum der Blau- und dem der Grün-Sensoren
|
Rotes Licht (Wellenlänge ~670 nm) wird von Stäbchen
(Empfindlichkeitsmaximum bei 500 nm) kaum wahrgenommen; das Rhodopsin
bleibt weitgehend stabil, die Dunkeladaptation bleibt beim Tragen einer Rotbrille weitgehend erhalten.
 Eine dritte Gruppe von Sinneszellen liegt im Gegensatz zu Zapfen und Stäbchen in der innersten Zellschichte der Netzhaut. Es sind Ganglienzellen (photosensitive Ganglienzellen, intrinsically photosensitive retinal ganglion cells ipRGC, Empfindlichkeitsmaximum bei ca. 470 nm). Diese speziellen Neuronen verwenden als Sehpigment Melanopsin (Empfindlichkeitsmaximum bei 475 nm, also im Blaubereich des Spektrums). Die Signalkette geht über ein Gq-Protein, Phospholipase C, IP3 / DAG und TRP-Kanäle; diese öffnen und depolarisieren die Zelle.
Eine dritte Gruppe von Sinneszellen liegt im Gegensatz zu Zapfen und Stäbchen in der innersten Zellschichte der Netzhaut. Es sind Ganglienzellen (photosensitive Ganglienzellen, intrinsically photosensitive retinal ganglion cells ipRGC, Empfindlichkeitsmaximum bei ca. 470 nm). Diese speziellen Neuronen verwenden als Sehpigment Melanopsin (Empfindlichkeitsmaximum bei 475 nm, also im Blaubereich des Spektrums). Die Signalkette geht über ein Gq-Protein, Phospholipase C, IP3 / DAG und TRP-Kanäle; diese öffnen und depolarisieren die Zelle.
Photosensitive
Ganglienzellen beteiligen sich an der Bildanalyse der Netzhaut wie auch
andere Ganglienzellen. Wie diese erstrecken sich auch ihre Dendriten in
die innere plexiforme Schicht und erhalten über Bipolarzellen
Information von Zapfen und Stäbchen, und sie senden auch Axone an
übliche Ziele anderer Ganglienzellen, wie das corpus geniculatum
laterale des Thalamus (das weiter auf den visuellen Cortex projiziert).
Um Aktionspotentiale zu bilden, benötigen photosensitive Ganglienzellen
allerdings wesentlich (um Größenordnungen) intensiveren Lichteinfall als Zapfen.
Für den Aufbau ihrer Erregung braucht es mehrere Sekunden, so können sie Lichtsignale über längere Zeitspannen integrieren. Bei
kontinuierlichem Lichteinfall (über Stunden) adaptieren sie aber kaum.
Im Gegensatz zu "gewöhnlichen" retinalen Ganglienzellen projizieren die
Neurite der ipRGCs (intrinsisch photorezeptiven Ganglienzellen) vorwiegend zu nicht-visuellen Gehirnarealen
und sind direkt mit dem nucleus suprachiasmaticus des Hypothalamus
verbunden. Sie hemmen die Produktion von Melatonin in der Epiphyse. Photosensitive Ganglienzellen erfüllen so Funktionen des visuellen
Systems, die unabhängig von der Bildübertragung sind: Der
suprachiasmatische Kern steuert bzw. synchronisiert zirkadiane Rhythmen
und die Gemütslage, und orientiert sich dabei am Lichteinfall ins Auge (wobei kurzwelliges
Licht den stärksten Effekt hat).
Lichtempfindliche Ganglienzellen enthalten Melanopsin. Sie beteiligen sich an der Steuerung zirkadianer Rhythmen, indem sie die Aktivität des nucleus suprachiasmaticus beeinflussen
|
Mit steigender Leuchtdichte nimmt auch das Tempo der Erregungsvorgänge in den lichtempfindlichen Zellen zu: Die Verschmelzungsfrequenz
beträgt beim skotopischen (Stäbchen-, unbunten) Sehen um die 24
Lichtreize pro Sekunde, beim photopischen (Zapfen-, Farben-) Sehen - je
nach Helligkeit - bis zu 80 Bilder / s (Filmtechnik!).

 Abbildung:
Testung des Farbsehvermögens (Sehprobentafel: Beispiel)
Abbildung:
Testung des Farbsehvermögens (Sehprobentafel: Beispiel)
Protanope Personen erkennen das farbcodierte Muster "35" nicht

Das
Farbsehen lässt sich als Konstruktion aus drei Farbempfindlichkeiten
darstellen: (1) rot, (2) grün, (3) blau.
 Rot
Rot-(L)-Zapfen (
L für langwellig) haben die größte spektrale
Empfindlichkeit bei 564 nm (Nanometer = Millionstel Millimeter) - stärkste Lichtabsorption bei
560-570 nm.
Ein
Ausfall des Rotsinns heißt
Protanopie 
oder
Rotblindheit (Häufigkeit 1% der Bevölkerung), eine Schwächung
Protanomalie oder Rotschwäche (1%).
 Grün
Grün-(M)-Zapfen (
M für mittlere Wellenlänge) bei 533 nm - stärkste Lichtabsorption bei
530-540 nm.
Ein Ausfall des Grünsinns heißt
Deuteranopie 
oder
Grünblindheit (1%), eine Schwächung
Deuteranomalie oder Grünschwäche (
5% - häufigste Farbsinnstörung).
 Blau
Blau-(K)-Zapfen (
K für kurzwellig) bei 437 nm - stärkste Lichtabsorption bei
430-440 nm. K-Zapfen machen nur etwa 10% aller Zapfen aus; in der fovea centralis fehlen sie ganz.
Ein Ausfall des Blausinns heißt
Tritanopie 
oder
Blau-Gelb-Blindheit, eine Schwächung
Tritanomalie oder Blau-Gelb-Schwäche (beide Formen sind selten).
Angeborene Farbsinnstörungen betreffen 8% der Männer, aber nur 0,4%
der Frauen, weil die entsprechenden Gene X-chromosomal codiert sind und
daher Defekte X-chromosomal vererbt werden.
Die Testung des Farbsinns erfolgt u.a. mit
 pseudoisochromatischen Tafeln
(nach Ishihara oder nach Stilling-Velhagen), die aus Punkten aus
"Verwechslungsfarben" bestehen (
pseudoisochromatischen Tafeln
(nach Ishihara oder nach Stilling-Velhagen), die aus Punkten aus
"Verwechslungsfarben" bestehen ( Abbildung), sodass betroffene
Personen farbcodierte Zahlen oder Buchstaben - die Farbtüchtige spontan
erkennen - in diesem Muster nicht sehen können
Abbildung), sodass betroffene
Personen farbcodierte Zahlen oder Buchstaben - die Farbtüchtige spontan
erkennen - in diesem Muster nicht sehen können
 Anomaloskopen:
Geräten, welche die Mischung spektraler Grundfarben (Rot, Grün) auf
subjektive Eindrucksgleichheit mit einer monochromatischen Bezugsfarbe
(spektrales Gelb) erlauben. Das Mischungsverhältnis, das Normalsichtige
zur Erzielung des Eindrucks "gelb" wählen, dient als Bezugsgröße.
Beispielsweise braucht eine protanomale Person mehr "Rot", um (mit
ihrem geschwächten Rotsinn) den Eindruck "gelb" zu erzielen.
Anomaloskopen:
Geräten, welche die Mischung spektraler Grundfarben (Rot, Grün) auf
subjektive Eindrucksgleichheit mit einer monochromatischen Bezugsfarbe
(spektrales Gelb) erlauben. Das Mischungsverhältnis, das Normalsichtige
zur Erzielung des Eindrucks "gelb" wählen, dient als Bezugsgröße.
Beispielsweise braucht eine protanomale Person mehr "Rot", um (mit
ihrem geschwächten Rotsinn) den Eindruck "gelb" zu erzielen.
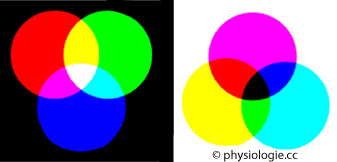
Farbenmischung: Additiv (links), subtraktiv (rechts)
Anders bei der subtraktiven Farbenmischung: Wird ein Gegenstand mit einem breiten Spektrum an Wellenlängen (Sonnenlicht: "weiß") beleuchtet,
dessen Pigmente nur eine bestimmte Wellenlänge reflektieren, ist das
zurückgeworfene Licht an Wellenlängen verarmt - man sieht den
Gegenstand in seiner "Eigenfarbe". Werden Pigmente gemischt aufgebracht
(wie z.B. in der Malerei),
werden nur Wellenlängen reflektiert, die von keinem der beteiligten
Pigmente (ganz) absorbiert wird; das resultierende Farbspektrum ist
kleiner als die Ausgangsspektren (der Beleuchtung). Werden alle
Wellenlängen absorbiert, ist das Ergebnis der Eindruck "schwarz"
(Abbildung rechts).
Die Phototransduktion findet in den Außensegmenten der Sinneszellen
statt: Hier befindet sich lichtsensitives Pigment (Rhodopsin bzw.
Jodopsin), das aus zwei Komponenten besteht: Einem Chromophor (Retinal, molekulare Masse ~0,5 kDa) und einem septahelikalen Membranprotein (Opsin, molekulare Masse ~41 kDa, s. oben). 11-cis-Retinal ist ein Aldehyd des Vitamin A.
Jedes Stäbchen enthält etwa eine Milliarde Rhodopsinmoleküle.
Absorbiert nur eines davon ein Photon, führt das bereits zu einer
Abnahme des "Dunkelstroms" (Natriumeinstrom in Disks) um etwa 2% und
einer messbaren Verstärkung des Membranpotentials der Zelle
(Hyperpolarisation). Als Folge nimmt die Freisetzung des Transmitters
Glutamat an den Synapsen zu Bipolarzellen ab.
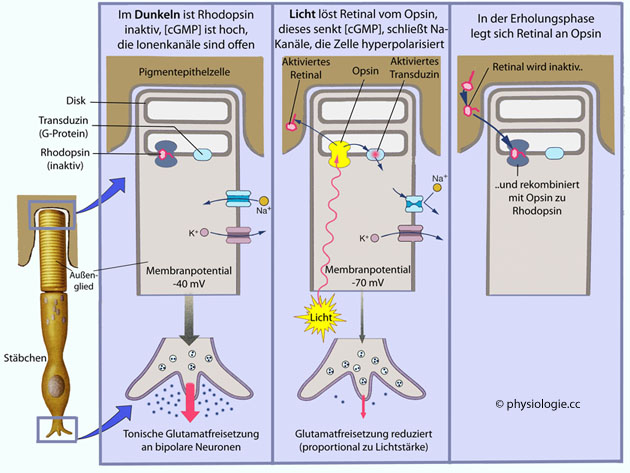
 Abbildung: Phototransduktion
Modifiziert nach einer Vorlage in Silverthorn, Human Physiology, an integrated approach, 4th Int'l ed. 2007, Pearson / Benjamin Cummings
Abbildung: Phototransduktion
Modifiziert nach einer Vorlage in Silverthorn, Human Physiology, an integrated approach, 4th Int'l ed. 2007, Pearson / Benjamin Cummings
In Dunkelheit erzeugt eine konstitutiv aktive Guanylatzyklase des
Außensegments laufend cGMP. Dieses hält Kationenkanäle offen, durch die
Na+ einströmt ("Dunkelstrom") und
die Zelle auf etwa -40 mV depolarisiert. Dadurch wird der Transmitter Glutamat (tonisch) freigesetzt. Aus dem Innensegment strömt K+ durch Kanäle aus, die nicht lichtempfindlich sind.
Bei Reizung (Belichtung) steigt das Membranpotential (bis auf etwa -80 mV), weil der
Natriumeinstrom versiegt (Aktivierung Transduzin → Abbau cGMP → Schließung
CNG-Kanal, s. nächste  Abbildung), die Glutamatfreisetzung nimmt ab
Abbildung), die Glutamatfreisetzung nimmt ab

Der Mechanismus der Phototransduktion funktioniert folgendermaßen (

Abbildung):
 In
Dunkelheit dringen durch CNG-Kanäle
(cyclic-nucleotide gated ion channels) der photorezeptiven Außensegmente laufend Kationen (Na+, Ca++) ein (Dunkelstrom, dark current) und depolarisieren sie
dadurch auf ~ -40mV. Durch die konstitutive Aktivität von Guanylatzyklase wird fortwährend cGMP gebildet, das an die CNG-Kanäle bindet und diese offen hält.
In
Dunkelheit dringen durch CNG-Kanäle
(cyclic-nucleotide gated ion channels) der photorezeptiven Außensegmente laufend Kationen (Na+, Ca++) ein (Dunkelstrom, dark current) und depolarisieren sie
dadurch auf ~ -40mV. Durch die konstitutive Aktivität von Guanylatzyklase wird fortwährend cGMP gebildet, das an die CNG-Kanäle bindet und diese offen hält.
 Glutamat wird von den Photorezeptoren im Dunkeln laufend von ihren präsynaptischen Endigungen freigesetzt.
Glutamat wird von den Photorezeptoren im Dunkeln laufend von ihren präsynaptischen Endigungen freigesetzt.
Die durch die CNG-Kanäle eingedrungenen Ca++-Ionen werden durch einen Antiporter (NCKX) wieder aus der Zelle befördert, der Na+ gegen Ca++ und K+ austauscht ( Abbildung):
Abbildung):

 Abbildung: Signaltransduktion in einem Stäbchen
Abbildung: Signaltransduktion in einem Stäbchen
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Rhodopsin
(Sehpurpur) ist ein lichtsensitives Rezeptorprotein in der Membran von
Scheiben (Disks) der Stäbchen. Es besteht aus dem Membranprotein Opsin
und einem lichtreaktiven Chromophor (11-cis-Retinal, rot angedeutet).
Eine konstitutiv aktive Guanylatzyklase
sorgt für die Produktion von cGMP (aus GTP), solange Dunkelheit
herrscht. cGMP hält Natriumkanäle offen, was zu einem laufenden Na+-Einstrom
(Dunkelstrom), Depolarisierung des Rezeptors und Freisetzung von
Glutamat von den synaptischen Endigungen des Stäbchens führt.
Bei Absorption
eines Photons entsteht das Isomer all-trans-Retinal. Das führt zu
Konformationsänderungen im Opsin (rosarotes Rhodopsin wird zu
blassgelbem Opsin: bleaching), Dissoziation der α-Komponente (jetzt mit GTP) des G-Proteins Transducin vom Opsin, Diffusion entlang der Disk-Membran zu einem Molekül Phosphodiesterase, das aktiviert wird.
Der Abbau von cGMP führt zu Schließung von Kationenkanälen und Stop des Einstroms für ~106 Natriumionen - die Zelle lädt sich auf, die Transmitterfreisetzung sistiert.
Absinken des [Ca
++i] (blaue Rechtecke) erhöht die Aktivität der
Guanylatzyklase und hemmt die Phosphodiesterase, was den
lichtinduzierten Abfall des [cGMP] limitiert.
NCKX, Natrium-Calcium-Kalium-Austauscher (transportiert in die Zelle eingedrungenes Ca++ wieder aus ihr hinaus)

 Lichteinfall hebt das Rhodopsinmolekül auf eine höhere Energiestufe, es kommt zu Stereoisomerisation (Gestaltsveränderung) von 11-cis zu all-trans-Retinal. Über Zwischenstufen entsteht die
kurzlebige Zwischenform Metarhodopsin.
Lichteinfall hebt das Rhodopsinmolekül auf eine höhere Energiestufe, es kommt zu Stereoisomerisation (Gestaltsveränderung) von 11-cis zu all-trans-Retinal. Über Zwischenstufen entsteht die
kurzlebige Zwischenform Metarhodopsin.
| Licht isomerisiert 11-cis- zu all-trans-Retinal, Rhodopsin wird dabei zu Metarhodopsin
|
Metarhodopsin löst sich vom Opsin und diffundiert in der Membran der Scheiben (discs) der Photorezeptoren, bis es auf G-Proteine namens Transduzin trifft: Es aktiviert Transduzin
- und zwar hunderte Moleküle davon (Signalverstärkung). Die Absorption
eines Photons aktiviert ein Molekül Metarhodopsin, und dieses kann
innerhalb einer Zehntelsekunde ~700 Transducinmoleküle aktivieren. "Eingeschaltetes" Transduzin bildet einen Komplex mit Phosphodiesterase
und aktiviert es dadurch. Phosphodiesterase baut cGMP zu GMP
ab - das intrazelluläre [cGMP] nimmt ab.
Jedes Transducinmolekül kann in weiterer Folge die Hydrolyse von cGMP um einen Faktor ~102 verstärken. Resultat ist das Schließen hunderter Natriumkanäle und die Verhinderung des Einstroms von etwa 106 Natriumionen in die Zelle (dieser Natriumeinstrom depolarisiert nicht belichtete Photorezeptorzellen, s.  Abbildung).
Abbildung).

 Abbildung: Kationenströme durch einen Photorezeptor bei Dunkelheit
Abbildung: Kationenströme durch einen Photorezeptor bei Dunkelheit
Nach einer Vorlage bei Guyton and Hall, Textbook of Medical Physiology, 15th ed. Elsevier 2026
Die Membranen der Außensegmente (oben) und der Innensegmente (unten) von Photorezeptoren unterscheiden sich in ihrer Ausstattung mit Ionenkanälen:
 cGMP-gesteuerte Kationenkanäle (CNG-Kanäle) im Außensegment werden bei geringer Belichtung der Photorezeptorzelle durch hohes intrazelluläres [cGMP] offen gehalten, was zum Enstrom von Ca++ und vor allem von Na+ führt - eine für das Außensegment von Stäbchen und Zapfen spezifische Ausstattung.
cGMP-gesteuerte Kationenkanäle (CNG-Kanäle) im Außensegment werden bei geringer Belichtung der Photorezeptorzelle durch hohes intrazelluläres [cGMP] offen gehalten, was zum Enstrom von Ca++ und vor allem von Na+ führt - eine für das Außensegment von Stäbchen und Zapfen spezifische Ausstattung.
 Die Membran des Innensegments ist - wie auch in anderen Zellen üblich - mit Na/K-ATPasen (diese halten die Ionenkonzentrationen in der Zelle stabil) und Kaliumkanälen ausgestattet (durch sie strömen Kaliumionen aus der Zelle und laden sie auf).
Die Membran des Innensegments ist - wie auch in anderen Zellen üblich - mit Na/K-ATPasen (diese halten die Ionenkonzentrationen in der Zelle stabil) und Kaliumkanälen ausgestattet (durch sie strömen Kaliumionen aus der Zelle und laden sie auf).
Durch die
ständige Depolarisierung durch den Natriumeinstrom im Außensegment
gering stimulierter Photorezeptoren (auf etwa -40 mV) statt wie sonst
für das Ruhepotential der meisten sensorischen Rezeptorzellen üblich
(-70 bis -80 mV) schließt sich zwischen den beiden ein ausgleichender
Stromkreis (Pfeile)

Hat der Vorgang sein Maximum erreicht, hat ein Photon zur Hydrolyse von ~1400 cGMP-Molekülen geführt, was die [cGMP] im Zytoplasma um die aktivierte Scheibe um ~8% senkt und etwa 2% (230 von insgesamt 11.000) der in Dunkelheit offenen cGMP-Kanäle des Stäbchens schließt. Dies lässt den Dunkelstrom um 2% absinken
(entspricht dem Einstrom von einer Million weniger Natriumionen). So
erklärt sich die Empfindlichkeit dieses Systems, die an der Grenze des
physikalisch Möglichen liegt.
Erhöhung des Lichtflusses: Das Absinken der intrazelluläre Konzentration an cGMP hat zur Folge, dass
 die CNG-Kanäle nicht weiter aktiviert werden,
die CNG-Kanäle nicht weiter aktiviert werden,
 der
Kationeneinstrom in die Zelle versiegt,
der
Kationeneinstrom in die Zelle versiegt,
 die intrazelluläre Na+- und Ca++-Konzentration sinkt, und
die intrazelluläre Na+- und Ca++-Konzentration sinkt, und
 das Membranpotential
von ~ -40 mV auf bis zu ~ -80 mV steigt (hyperpolarisierendes Rezeptorpotential - eine Eigenheit von Photorezeptorzellen). Das
Rezeptorpotential setzt sich elektrotonisch vom Außen- zum Innensegment
fort (
das Membranpotential
von ~ -40 mV auf bis zu ~ -80 mV steigt (hyperpolarisierendes Rezeptorpotential - eine Eigenheit von Photorezeptorzellen). Das
Rezeptorpotential setzt sich elektrotonisch vom Außen- zum Innensegment
fort ( Abbildung)
Abbildung)
 Die Freisetzung von Glutamat an den Synapsen mit Bipolarzellen nimmt ab - das ist das neuronale Signal.
Die Freisetzung von Glutamat an den Synapsen mit Bipolarzellen nimmt ab - das ist das neuronale Signal.
 Schon ein einzelnes Photon kann eine meßbare Antwort an einer einzelnen Rezeptorzelle auslösen.
Um einen Sinneseindruck auszulösen, reicht eine Veränderung des
Lichtflusses um einige Dutzend Photonen (entsprechend dem
Zusammenwirken von 5-7 Photonen, die jeweils einen Photorezeptor
reizen).
Schon ein einzelnes Photon kann eine meßbare Antwort an einer einzelnen Rezeptorzelle auslösen.
Um einen Sinneseindruck auszulösen, reicht eine Veränderung des
Lichtflusses um einige Dutzend Photonen (entsprechend dem
Zusammenwirken von 5-7 Photonen, die jeweils einen Photorezeptor
reizen).
Die Hyperpolarisation benötigt etwa 0,2 Sekunden bis zu
ihrer stärksten Ausprägung. Am Kontakt zu bipolaren Retina-Neuronen reduziert sich die Freisetzung des Transmitters
Glutamat.

Das erscheint paradox: Photorezeptoren sind in der Dunkelheit
depolarisiert und bei Reizung durch Licht
steigt das Membranpotential und die Transmitterfreisetzung
sinkt - bei fast allen erregbaren Zellen folgt auf einen adäquaten Reiz eine
Depolarisation. Daher wurde der Ausdruck
"umgekehrte Lichtantwort"
geprägt. (Die nachgeschalteten Horizontal- und Bipolarzellen
"verstehen" die Botschaft und reagieren mit entsprechender Veränderung
ihrer Membranpotentiale.)
Belichtung eines Photosensors senkt über Aktivierung der Phosphodiesterase dessen intrazelluläre cGMP- und damit auch Ca++-Konzentration, die Glutamatfreisetzung nimmt ab
|
Inaktivierung:
Die Lichtreaktion der Photorezeptoren ist limitiert, um
sie für weitere Photonen wieder empfänglich zu machen. Metarhodopsin II
wird durch eine Rhodopsinkinase phosphoryliert und anschließend an ein lösliches Protein (Arrestin)
gebunden, dadurch wird die Interaktion mit Transduzin blockiert. Die
cGMP-Konzentration im Photorezeptor steigt wieder an, das
Membranpotential sinkt auf das "Dunkelpotential" von ca. -40 mV.
Lichteinfall und elektrisches Potential des Auges: Ändert
sich die Beleuchtung der Netzhaut, kommt es zu einer mehrphasigen
Veränderung (im Bereich von Zehnteln Millivolt) des vom Auge ableitbaren
Bestandspotentials (üblicherweise von Hornhaut zu Gesichtshaut
abgeleitet; Elektroretinogramm, ERG).
Das (beim Menschen braun gefärbte) Pigmentepithel (RPE: retinal pigment epithelium) hat mehrere Aufgaben:
 Regeneration des entstandenen All-trans-Retinols zu 11-cis-Retinal. Das bei der Phototransduktion entstandene All-trans-Retinal wird von Zellen des Pigmentepithels zu All-trans-Retinol (Vitamin A) reduziert. Dieses ist die Vorstufe des 11-cis-Retinal und wird an die Stäbchen retourniert. Der Regenerierungszyklus dauert einige Minuten.
Regeneration des entstandenen All-trans-Retinols zu 11-cis-Retinal. Das bei der Phototransduktion entstandene All-trans-Retinal wird von Zellen des Pigmentepithels zu All-trans-Retinol (Vitamin A) reduziert. Dieses ist die Vorstufe des 11-cis-Retinal und wird an die Stäbchen retourniert. Der Regenerierungszyklus dauert einige Minuten.
 Phagozytose von Membranmaterial der Photorezeptoren: Die oxidative Wirkung des Lichts auf die Außensegmente der Photorezeptorzellen unterwirft sie starkem Verschleiß. Pigmentepithelzellen umgreifen diese mit fingerartigen Fortsätzen (
Phagozytose von Membranmaterial der Photorezeptoren: Die oxidative Wirkung des Lichts auf die Außensegmente der Photorezeptorzellen unterwirft sie starkem Verschleiß. Pigmentepithelzellen umgreifen diese mit fingerartigen Fortsätzen ( Abbildung) und nehmen deren Membranmaterial auf (Recycling).
Abbildung) und nehmen deren Membranmaterial auf (Recycling).
 Abbildung: Pigmentepithelzelle (schematisch)
Nach Jarrett SG, Lewin A, Boulton ME. The Role of Mitochondrial Oxidative Stress in Retinal Dysfunction. In: Stratton et al. (eds.), Studies on Retinal and Choroidal Disorders, Springer 2012
Abbildung: Pigmentepithelzelle (schematisch)
Nach Jarrett SG, Lewin A, Boulton ME. The Role of Mitochondrial Oxidative Stress in Retinal Dysfunction. In: Stratton et al. (eds.), Studies on Retinal and Choroidal Disorders, Springer 2012
Photorezeptoren und
Pigmentepithelzellen bilden eine funktionelle Einheit und sind hohem
oxidativem Stress durch Licht und Sauerstoff in arterialisiertem Blut
ausgesetzt. Melanin und Lipofuszin gehören zu den Chromophoren
(Moleküle, die Farbe verleihen) der Netzhaut, sie bilden Radikale wie
Superoxid und Wasserstoffperoxid. Dazu kommen ungesättigte Fettsäuren
aus phazozytierten Außensegmenten der Photorezeptoren.
Pigmentepithelzellen müssen hohe antioxidative Kapazität aufweisen.
Reicht diese nicht aus, drohen degenerative Veränderungen der Netzhaut

 Lichtabsorption.
Pigmentepithelzellen fangen mittels ihrer Melanosomen Streulicht ein
und erhöhen dadurch einerseits die optische Qualität des
Netzhautbildes. Andererseits senken sie die oxidative Wirkung des
Lichts, das insbesondere im Makulabereich (der auch stark durchblutet
ist) konzentriert auf die Netzhaut trifft.
Lichtabsorption.
Pigmentepithelzellen fangen mittels ihrer Melanosomen Streulicht ein
und erhöhen dadurch einerseits die optische Qualität des
Netzhautbildes. Andererseits senken sie die oxidative Wirkung des
Lichts, das insbesondere im Makulabereich (der auch stark durchblutet
ist) konzentriert auf die Netzhaut trifft.
 Metabolische Stabilisierung. Pigmentepithelzellen
verleihen antioxidativen Schutz und transportieren Ionen, die bei der
Phototransduktion zwischen intra- und extrazellulärem Kompartiment
ausgetauscht werden.
Metabolische Stabilisierung. Pigmentepithelzellen
verleihen antioxidativen Schutz und transportieren Ionen, die bei der
Phototransduktion zwischen intra- und extrazellulärem Kompartiment
ausgetauscht werden.
 Stoffaustausch. Das Pigmentepithel versorgt Photorezeptoren
mit Nährstoffen. Die basale Membran der
Pigmentepithelzellen ist zwecks besserem Stoffaustausch mit den Blutgefäßen der Chorioidea gefaltet (
Stoffaustausch. Das Pigmentepithel versorgt Photorezeptoren
mit Nährstoffen. Die basale Membran der
Pigmentepithelzellen ist zwecks besserem Stoffaustausch mit den Blutgefäßen der Chorioidea gefaltet ( Abbildung).
Abbildung).
 Beteiligung am Immunprivileg des Auges:
Das Pigmentepithel baut eine dichte Barriere gegenüber dem
Blutkreislauf auf und kann mit dem Immunsystem in einer Weise
kommunizieren, dass es im gesunden Auge Immunaggression verhindert und
im Erkrankungsfall die Immunabwehr aktiviert.
Beteiligung am Immunprivileg des Auges:
Das Pigmentepithel baut eine dichte Barriere gegenüber dem
Blutkreislauf auf und kann mit dem Immunsystem in einer Weise
kommunizieren, dass es im gesunden Auge Immunaggression verhindert und
im Erkrankungsfall die Immunabwehr aktiviert.
Lösen sich retinale Zellen vom Pigmentepithel ab (Netzhautablösung, z.B. infolge von Blutungen wie
bei diabetischer Retinopathie), gehen sie zugrunde (Erblindung).
Adaptation: Anpassung an unterschiedliche Lichtstärken
Die Anpassung an unterschiedliche
Lichtstärke beruht auf Pupillenreflex und Netzhautadaptation:
 Pupillenreflex:
Dieser Mechanismus greift rasch (Zehntelsekunden).
Der Pupillendurchmesser kann zwischen ~1,5 (Miosis: Aktivität des m.
sphincter pupillae) und ~7,5 mm (Mydriasis: Aktivität des m. dilatator
pupillae) schwanken. Da Fläche = r2π,
entspricht das einem Flächenunterschied für den Lichtdurchtritt
(zwischen kompletter Miosis und Mydriasis) von 1:25.
Pupillenreflex:
Dieser Mechanismus greift rasch (Zehntelsekunden).
Der Pupillendurchmesser kann zwischen ~1,5 (Miosis: Aktivität des m.
sphincter pupillae) und ~7,5 mm (Mydriasis: Aktivität des m. dilatator
pupillae) schwanken. Da Fläche = r2π,
entspricht das einem Flächenunterschied für den Lichtdurchtritt
(zwischen kompletter Miosis und Mydriasis) von 1:25.
Der Lichtstrom in das Auge kann also durch den Pupillenreflex um etwa eine
Größenordnung
modifiziert werden. (Beispiele: Beträgt der kleinste Pupillendurchmesser 2 statt 1,5 mm, reduziert sich diese Bandbreite auf einen Faktor von ~14. Hat
die Pupille einen Ausgangsdurchmesser von 4 mm, kann sie durch
Reduktion auf 1,5 mm den Lichtfluss um einen Faktor 7 reduzieren.)
 Näheres zum Pupillenreflex s. dort
Näheres zum Pupillenreflex s. dort
 Retinale Adaptation: Hier wirken mehrere Mechanismen zusammen:
Retinale Adaptation: Hier wirken mehrere Mechanismen zusammen:

Nutzung von Stäbchen (
skotopisches Sehen, niedrige Lichtintensität) und Zapfen (
photopisches Sehen, Farberkennung, hohe Lichtintensität) je nach Beleuchtungsstärke, zusätzlich
neuronale Anpassung via Verschaltung über Horizontalzellen (von Zapfen- auf Stäbchensystem)

Photorezeptorzellen adaptieren über cGMP-Empfindlichkeit der
CNG-Kanäle und veränderte Ca
++-Wirkung
an Rhodopsinkinase: Die intrazelluläre Calciumkonzentration nimmt ab (cGMP-Kanäle schließen). Die volle Adaptation (von
hell auf dunkel) des skotopischen Systems (Zapfen) kann bis zu 30 Minuten in Anspruch nehmen

In dunkler Umgebung wird weniger Photopigment verbraucht, seine Konzentration ist
hoch und die Empfindlichkeit steigt
(photochemische Adaptation). Stärkere Beleuchtung führt zu Verbrauch ("Ausbleichen") von Sehfarbstoff und reduzierter Lichtempfindlichkeit. Niedriges [Ca
++i]
erhöht die Aktivität der
Guanylatzyklase und hemmt die Phosphodiesterase, was den
lichtinduzierten Abfall des [cGMP] limitiert. So passt sich das
Photorezeptorsystem an höheren Lichtfluss an, reagiert aber dennoch
auch auf geringe Helligkeitsänderungen.

Räumliche
Summation:
Die Zentralzonen rezeptiver Felder vergrößern sich (auf Kosten der
Peripherie), wodurch größere Rezeptorzahlen zusammengeschaltet werden
und die Lichtempfindlichkeit steigt (auf Kosten des Auflösungsvermögens)

Zeitliche
Summation: Verlängerung der Reizdauer macht auch schwächere Lichtreize überschwellig und damit wahrnehmbar
Bei Vitamin-A-Mangel wird
der Sehpurpur der Stäbchen nicht ausreichend gebildet, Folge ist
mangelhafte Adaptation auf niedrige Lichtintensitäten ("Nachtblindheit" =
Hemeralopie: Stäbchenapparat und damit Wahrnehmung niedriger Lichtintensitäten sind gestört).

 Abbildung: Adaptationsverhalten des menschlichen Auges
Abbildung: Adaptationsverhalten des menschlichen Auges
Nach Sheard C, Dark Adaptation: Some Physical, Physiological, Clinical, and Aeromedical Considerations. J Opt Soc Amer 1944; 34: 464-508
Ordinate:
Intensität des Schwellenwertes (logarithmische Skala, Basis 10),
Abszisse: Adaptationsdauer in Minuten. Die rosa / rote Kurve gibt den
Zeitverlauf der Schwellenwerte des skotopischen, die dunkelblau /
hellgraue Kurve diejenige des photopischen Systems an.
Ausgehend
vom vollständig helladaptierten Zustand wird die Versuchsperson in einen abgedunkelten
Raum gebracht. Mit kurzen Lichtreizen wird bestimmt, welche
Lichtintensitäten gerade noch wahrgenommen werden (Schwellenwerte). Die ermittelten Werte
werden als Funktion der fortlaufenden Zeit dargestellt (dunkelblau /
rote Kurve). Die Adaptationsleistung überspannt in diesem Beispiel sechs Zehnerpotenzen (106 zu 1).
Helladaptation
erfolgt viel rascher (vollständig nach wenigen Minuten) als die
Dunkeladaptation (vollständig nach ~40 min). Zuerst
adaptiert das Zapfensystem rasch, aber nur bis zu seiner
Schwelle; dann übernimmt das Stäbchensystem - langsamer, aber
wesentlich geringere Schwellenwerte erreichend. Der
Zeitverlauf weist an der Stelle, wo das (komplett adaptierte)
photopische System vom weiter adaptierenden skotopischen System
"überholt" wird, einen markanten Knick auf (K, Kohlrausch'scher Knick).
Bei
der Testung kommt zunächst nur das rasch adaptierende Zapfensystem zur
Wirkung (blauer Kurvenanteil), später nur das langsamere, aber im
Dämmerlicht weiter adaptierende Stäbchensystem (roter Kurvenanteil).
Die Abbildung zeigt auch den zunächst nicht zur Wirkung kommenden
(dahinterliegenden) frühen Adaptationsverlauf der Stäbchen (hellrosa)
sowie die - stationär bleibende - Empfindlichkeit der vollständig
adaptierten Zapfen (grau)

Die
Lichtempfindlichkeit des Auges kann Intensitätsunterschiede von bis zu 10
Zehnerpotenzen tolerieren. Die unterschiedliche
Anpassungsgeschwindigkeit des (raschen) Zapfen- und des (langsameren)
Stäbchensystems macht sich im Zeitverlauf als markante Abwinkelung (Kohlrausch'scher Knick  ) bemerkbar (
) bemerkbar ( Abbildung).
Abbildung).
(Adaptierte) Stäbchen sind um mehrere Zehnerpotenzen lichtempfindlicher als (adaptierte) Zapfen
|
Fallen die Stäbchen (skotopisches
System) bei funktionierendem Zapfensystem aus, dann läuft die
Adaptationskurve auf der Höhe der maximalen Zapfenadaptation aus, und
der "Kohlrausch-Knick" verschwindet. Das passiert bei retinitis pigmentosa,
einer meist genetisch bedingten Erkrankung, bei der die Stäbchen
degenerieren. Bei niedrigen Lichtintensitäten (z.B. sternenklare Nacht)
ist dann kein Sehen mehr möglich. Außerdem wird das Gesichtsfeld so eng
(fovea centralis und <5° perifoveal), dass die Orientierung im Raum
nicht mehr möglich ist - betroffene Personen gelten als erblindet.
Physiologie der Netzhaut
Die
Netzhautrezeptoren sind wie Punkte eines Rasters angeordnet; auf sie
wird ein Bild von der Umwelt projiziert. Sehschärfe und
Auflösungsvermögen sind durch die Feinheit dieses Rasters und die
Verschaltung zum Gehirn (Grad der Konvergenz, Güte der Kontrastierung) bestimmt.
Dazu kommt eine umfangreiche "Vorverarbeitung" der retinalen
Reizmuster. Eigenschaften wie Helligkeit, Farbe, Kontrast, Form,
Orientierung, Bewegung / Richtung werden nicht nur im Gehirn, sondern
schon in der Netzhaut "sortiert" (visual processing)
- und zwar parallel, also zeitgleich. Die neuronalen Schaltkreise in
der Retina halten etwa 20 Kriterien auseinander (z.B. hell vs. dunkel,
gelb vs. blau etc). Das Ergebnis dieser Analyseschritte fließt den
retinalen Ganglienzellen zu, und gelangt damit über den Sehnerv zum
Gehirn.
 Abbildung: Netzhaut
Nach einer Vorlage bei Boron / Boulpaep, Medical Physiology, 1st ed., Saunders 2003
Abbildung: Netzhaut
Nach einer Vorlage bei Boron / Boulpaep, Medical Physiology, 1st ed., Saunders 2003
Die 2-4 µm dicke und aus 5 Schichten bestehende Bruch'sche Membran bietet dem Ziliarkörper Verankerung und lässt Nährstoffe zwischen
Aderhaut und Pigmentepithel passieren. Mit zunehmendem Alter verdickt
sie sich und ihre Durchlässigkeit nimmt ab
bietet dem Ziliarkörper Verankerung und lässt Nährstoffe zwischen
Aderhaut und Pigmentepithel passieren. Mit zunehmendem Alter verdickt
sie sich und ihre Durchlässigkeit nimmt ab.
Das
Pigmentepithel
regeneriert
all-trans-Retinol zu 11-cis-Retinal und phagozytiert sequestrierte
Endstücke von Außensegmenten von Stäbchen und Zapfen. Außerdem enthält
es Melaningranula, dadurch wird die Lichtstreuung reduziert.
Bipolare Zellen (hellblau - man unterscheidet mehr als 10 verschiedene Typen) dienen der Umschaltung der Information von Photorezeptor- auf Ganglienzellen (vgl. nächstes Bild).
Amakrine und Horizontalzellen dienen der horizontalen
Informationsverarbeitung (z.B. Kontrastierung durch Aufbau von
"Hemmungshöfen", s. auch Abbildung unten).
Die Gliazellen der Netzhaut heißen Müller-Zellen  - sie nehmen z.B. Kalium auf, das bei der Aktivität neuronaler Zellen frei wird
- sie nehmen z.B. Kalium auf, das bei der Aktivität neuronaler Zellen frei wird

An der Stelle des schärfsten Sehens,
der fovea centralis im gelben Fleck, ist das Auflösungsvermögen am
höchsten, weil hier die Rezeptoren (nur L- und M-Zapfen; keine S-Zapfen, keine Stäbchen) besonders eng
nebeneinander stehen (Abstand weniger als ein Erythrozytendurchmesser).
Fixierte Gegenstandspunkte werden automatisch auf die Fovea projiziert (Reflexe, kortikale Steuerung).
Die fovea centralis (Durchmesser ca. 1,5 mm) enthält etwa 140.000
Zapfen pro Quadratmillimeter (hohe Auflösung von ~1 Bogenminute), sie
ist nachtblind (keine Stäbchen: Skotopisches Zentralskotom).
Sehen am Tag bzw. in hell beleuchteter Umgebung (photopisches Sehen) ist mit der Peripherie der Netzhaut möglich, aber auch die
perifovealen Regionen enthalten Zapfen ( Abbildung ganz oben) und
erlauben Farbunterscheidung (Farbperimetrie: Rot geringstes, blau
größtes Gesichtsfeld).
Abbildung ganz oben) und
erlauben Farbunterscheidung (Farbperimetrie: Rot geringstes, blau
größtes Gesichtsfeld).
Photorezeptoren (retinale Sinneszellen) geben an den synaptischen
Kontakten zu Bipolar- und Horizontalzellen kontinuierlich Glutamat ab -
je weniger sie belichtet werden, desto mehr (s. oben). Da die Distanzen so kurz sind, bilden sie keine Aktionspotentiale (das tun nur Ganglienzellen und
einige amakrine Zellen), sondern verändern ihr Membranpotential
proportional zum Lichtfluss.
Die Polarität des Effekts, den Zapfen an nachgeschalteten Zellen auslösen, hängt von deren Ausstattung mit Glutamatrezeptoren ab.
Bipolarzellen werden entweder de- oder hyperpolarisiert, je nach den
Glutamatrezeptoren, über die sie verfügen:
 ON-Bipolarzellen tragen metabotrope Glutamatrezeptoren
(mGluR) in ihrer Membran, die Aktivierung der G-Protein-Kaskade
resultiert dann in einem Schließen von Kationenkanälen, und es findet
eine Umkehr des Effekts auf das Membranpotential statt: Lichteinfluss
(der den Photorezeptor hyperpolarisiert) führt zu Depolarisierung der Bipolarzelle.
ON-Bipolarzellen tragen metabotrope Glutamatrezeptoren
(mGluR) in ihrer Membran, die Aktivierung der G-Protein-Kaskade
resultiert dann in einem Schließen von Kationenkanälen, und es findet
eine Umkehr des Effekts auf das Membranpotential statt: Lichteinfluss
(der den Photorezeptor hyperpolarisiert) führt zu Depolarisierung der Bipolarzelle.
 OFF-Bipolarzellen exprimieren ionotrope Glutamatrezeptoren
(iGluR) und werden von Glutamat depolarisiert. Die "Vorzeichenumkehr"
bei der Verschaltung der Photorezeptor- auf die Bipolarzelle bleibt
aus, Lichteinfluss auf den Photorezeptor hyperpolarisiert auch die
Bipolarzelle.
OFF-Bipolarzellen exprimieren ionotrope Glutamatrezeptoren
(iGluR) und werden von Glutamat depolarisiert. Die "Vorzeichenumkehr"
bei der Verschaltung der Photorezeptor- auf die Bipolarzelle bleibt
aus, Lichteinfluss auf den Photorezeptor hyperpolarisiert auch die
Bipolarzelle.
Der Transmitter der Zapfen ist Glutamat.
ON-Bipolarzellen exprimieren metabotrope,
OFF-Bipolarzellen ionotrope
Glutamatrezeptoren
|
 Die Verbindung zu Bipolarzellen erfolgt
an speziellen Synapsen (ribbon synapses). Bipolarzellen verbinden Photorezeptorzellen und Ganglienzellen in radiärer
Richtung, was in der Netzhautperipherie eine starke Konvergenz
ermöglicht (Zahlenverhältnis insgesamt 100:1). Die Verschaltung zu
retinalen Ganglienzellen erfolgt in einer Weise,
dass sich sensorische (rezeptive) Felder ergeben. Bipolarzellen
sind glutamaterg, sie aktivieren ionotrope Rezeptoren auf
Ganglienzellen: Depolarisation von Bipolarzellen führt immer zur
Depolarisation angekoppelter Ganglienzellen.
Die Verbindung zu Bipolarzellen erfolgt
an speziellen Synapsen (ribbon synapses). Bipolarzellen verbinden Photorezeptorzellen und Ganglienzellen in radiärer
Richtung, was in der Netzhautperipherie eine starke Konvergenz
ermöglicht (Zahlenverhältnis insgesamt 100:1). Die Verschaltung zu
retinalen Ganglienzellen erfolgt in einer Weise,
dass sich sensorische (rezeptive) Felder ergeben. Bipolarzellen
sind glutamaterg, sie aktivieren ionotrope Rezeptoren auf
Ganglienzellen: Depolarisation von Bipolarzellen führt immer zur
Depolarisation angekoppelter Ganglienzellen.
 Horizontalzellen
bauen laterale Verbindungen zwischen Photorezeptoren (Zapfen und
Stäbchen) auf (
Horizontalzellen
bauen laterale Verbindungen zwischen Photorezeptoren (Zapfen und
Stäbchen) auf ( Abbildung), also in äußeren
Retinagebieten. Diese Verschaltungen dienen der Interaktion
benachbarter Zellen in der Netzhaut, insbesondere der
Kontrastverstärkung (laterale Hermmung:
Aktivierte hemmen die Erregung benachbarter Zellen).
Horizontalzellen teilen mit Nachbarzellen nicht nur chemische Synapsen,
sie sind auch über gap junctions miteinander verbunden. So "mitteln"
sie die Luminanz, die auf ihr rezeptives Feld auf der Netzhaut
einwirkt. Dazu kommt, dass die Interaktion zwischen Photorezeptor-,
bipolaren und Horizontalzellen bei Stäbchen anders organisiert ist als
bei Zapfen.
Abbildung), also in äußeren
Retinagebieten. Diese Verschaltungen dienen der Interaktion
benachbarter Zellen in der Netzhaut, insbesondere der
Kontrastverstärkung (laterale Hermmung:
Aktivierte hemmen die Erregung benachbarter Zellen).
Horizontalzellen teilen mit Nachbarzellen nicht nur chemische Synapsen,
sie sind auch über gap junctions miteinander verbunden. So "mitteln"
sie die Luminanz, die auf ihr rezeptives Feld auf der Netzhaut
einwirkt. Dazu kommt, dass die Interaktion zwischen Photorezeptor-,
bipolaren und Horizontalzellen bei Stäbchen anders organisiert ist als
bei Zapfen.
 Innere
Netzhautareale enthalten amakrine Zellen
Innere
Netzhautareale enthalten amakrine Zellen  ,
von denen etwa 40 verschiedene Typen bekannt sind. Ihre Verzweigungen
beschränken sich auf die innere plexiforme Schicht (
,
von denen etwa 40 verschiedene Typen bekannt sind. Ihre Verzweigungen
beschränken sich auf die innere plexiforme Schicht ( Abbildung
oben). Sie erhalten von Bipolarzellen exzitatorische glutamaterge
Impulse und modulieren die Aktivität der Umschaltungen von Bipolar- auf Ganglienzellen via GABA- und glycinergen Synapsen.
Abbildung
oben). Sie erhalten von Bipolarzellen exzitatorische glutamaterge
Impulse und modulieren die Aktivität der Umschaltungen von Bipolar- auf Ganglienzellen via GABA- und glycinergen Synapsen.
Spezifische Verschaltungsmuster zwischen spezialisierten Zellen der Netzhaut korrespondieren mit Informationen zu
 Größe,
Größe,
 Bewegung (Richtungsselektivität wird durch asymmetrische Hemmung durch Amakrinzellen aufgebaut),
Bewegung (Richtungsselektivität wird durch asymmetrische Hemmung durch Amakrinzellen aufgebaut),
 Kontrast,
Kontrast,
 Farbe (Vergleich der Signale von Zapfen unterschiedlicher spektraler Empfindlichkeit).
Farbe (Vergleich der Signale von Zapfen unterschiedlicher spektraler Empfindlichkeit).
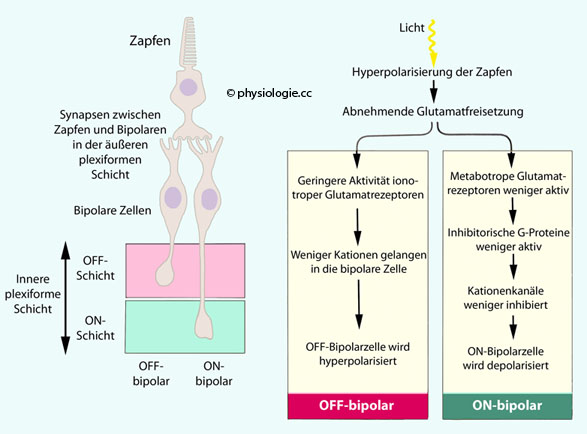
 Abbildung: OFF- und ON-Neurone reagieren auf Licht in entgegengesetzter Weise
Abbildung: OFF- und ON-Neurone reagieren auf Licht in entgegengesetzter Weise
Nach einer Vorlage in Liqun Luo, Principles of Neurobiology, 2nd ed. CRC Press 2021
Links:
Schema der Umschaltung von Zapfen auf Bipolarzellen. Zapfen projizieren
auf ON- und OFF-Schichten der inneren plexiformen Schicht (vgl. oben).
Rechts: Reaktion der OFF- und
ON-Bipolarzellen auf abnehmende Glutamatfreisetzung der Zapfen bei
erhöhtem Lichtfluss. OFF-Bipolarzellen mit ionotropen
Glutamatrezeptoren behalten die Polarität bei (sie werden wie die
Photorezeptoren hyperpolarisiert), ON-Bipolarzellen mit metabotropen
Glutamatrezeptoren dehen sie um (sie werden depolarisiert).
Depolarisieren Bipolarzellen ("ON"), werden angeschlossene Ganglienzellen angeregt, ihre Aktionspotentialfrequenz nimmt zu.
Phototransduktion s. oben

 Ganglienzellen
sind die "Endabnehmer" der in der Netzhaut
aufbereiteten Information. Erst hier entstehen Aktionspotentiale, die
dann über den Sehnerven zum Gehirn geleitet werden. Ganglienzellen
fallen in zwei Kategorien: Solche, die auf Verstärkung des
Lichteinfalls in ihrem rezeptiven Bereich depolarisieren (ON-Neurone) und solche, die auf sinkenden Lichtstrom mit Depolarisierung reagieren (OFF-Neurone).
Ganglienzellen
sind die "Endabnehmer" der in der Netzhaut
aufbereiteten Information. Erst hier entstehen Aktionspotentiale, die
dann über den Sehnerven zum Gehirn geleitet werden. Ganglienzellen
fallen in zwei Kategorien: Solche, die auf Verstärkung des
Lichteinfalls in ihrem rezeptiven Bereich depolarisieren (ON-Neurone) und solche, die auf sinkenden Lichtstrom mit Depolarisierung reagieren (OFF-Neurone).
Bei ausreichender Lichtintensität operieren ON- und OFF-Ganglienzellen mit zwei konzentrische Zonen
unterschiedlichen Ansprechverhaltens auf variierende Ausleuchtung.
ON-Ganglienzellen reduzieren ihr Membranpotential bei Beleuchtung ihres
Zentrums, erhöhen es hingegen bei Beleuchtung der Peripherie ihres
rezeptiven Feldes. Bei OFF-Ganglienzellen verhält es sich umgekehrt (Abbildungen).
 Zum Vergleich der Verschaltungen in Netzhaut und bulbus olfactorius s. dort
Zum Vergleich der Verschaltungen in Netzhaut und bulbus olfactorius s. dort
Bei ausreichendem Lichtfluss sind die rezeptiven Felder von Ganglienzellen der Netzhaut also funktionell gegliedert (center-surround receptive fields). Erklärbar ist dieses Phänom durch laterale Inhibition
durch Horizontalzellen, die zur Seite hin Kontakt zu zahlreichen
Photorezeptoren aufbauen und mit ihren Dendriten inhibitorische
Potentiale sowohl auffangen als auch senden können:
 ON-Zentrum, OFF-Peripherie: ON-Neurone reagieren auf Erhöhung des Lichtflusses ihrer zentralen Zone mit steigender Erregung (Aktionspotentialfrequenz), bei Beleuchtung der Peripherie des rezeptiven Feldes hingegen mit Senkung der Aktionspotentialfrequenz.
ON-Zentrum, OFF-Peripherie: ON-Neurone reagieren auf Erhöhung des Lichtflusses ihrer zentralen Zone mit steigender Erregung (Aktionspotentialfrequenz), bei Beleuchtung der Peripherie des rezeptiven Feldes hingegen mit Senkung der Aktionspotentialfrequenz.
Skotopisches Sehen (Stäbchen) funktioniert generell über ON-Neurone.
 OFF-Zentrum, ON-Peripherie: OFF-Neurone reagieren auf Erhöhung des Lichtflusses in ihrer zentralen Zone mit sinkender Erregung (Aktionspotentialfrequenz), bei Beleuchtung der Peripherie des rezeptiven Feldes hingegen mit Steigerung der Aktionspotentialfrequenz.
OFF-Zentrum, ON-Peripherie: OFF-Neurone reagieren auf Erhöhung des Lichtflusses in ihrer zentralen Zone mit sinkender Erregung (Aktionspotentialfrequenz), bei Beleuchtung der Peripherie des rezeptiven Feldes hingegen mit Steigerung der Aktionspotentialfrequenz.
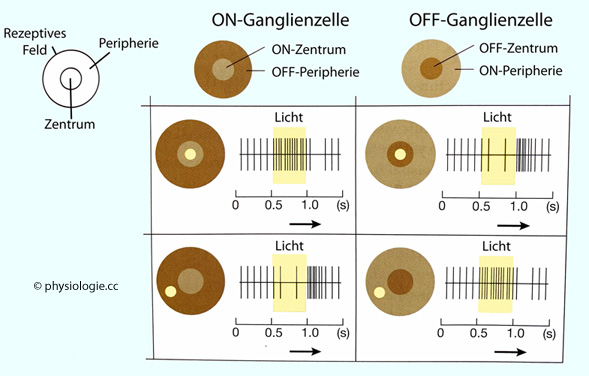
 Abbildung: Reaktion von ON- und OFF-Ganglienzellen
Abbildung: Reaktion von ON- und OFF-Ganglienzellen
Nach einer Vorlage in Carlson NR / Birkett MA, Physiology of Behavior, 12th ed. Pearson 2017
Ableitungen von
Axonen im Sehnerven. Bei gleichbleibender (mittlerer) Lichtintensität
feuern beide Neuronentypen mit niedriger Frequenz (Beginn der
Registrierungen).
Links:
Trifft (zusätzliches) Licht auf das Zentrum des rezeptiven Feldes einer
ON-Ganglienzelle, erhöht sich die Frequenz der Aktionspotentiale, die
sie an das Gehirn weiterleitet. Umgekehrt sinkt die Frequenz, wenn der
Lichtfleck auf die Peripherie des rezeptiven Feldes trifft.
Rechts: Trifft
(zusätzliches) Licht auf das Zentrum des rezeptiven Feldes einer
OFF-Ganglienzelle, nimmt die Frequenz der Aktionspotentiale ab, die
sie an das Gehirn weiterleitet. Umgekehrt steigt die Frequenz, wenn der
Lichtfleck auf die Peripherie des rezeptiven Feldes trifft

Die Abbildung zeigt auch, dass es nach Verschwinden des Lichtreizes Rebound-Effekte
gibt: So sinkt nach Ausschalten der Beleuchtung des zentralen Feldes
eines ON-Ganglions die Aktionspotentialfrequenz auf einen niedrigeren
Wert als vor dem Einschalten, und die Erregungsgröße ist nach
Ausschalten der Beleuchtung der Peripherie besonders hoch (linker
Teil). Bei OFF-Ganglien ist es umgekehrt (rechter Teil der Abbildung):
Nach Ausschalten der Beleuchtung eines Zentrums steigt die
Erregungsgröße vorübergehend stark an (hohe Aktionspotentialfrequenz),
bei Verschwinden des Lichtflecks aus der Peripherie hingegen bleiben
die Aktionspotentiale vorübergehend ganz aus ( Abbildung).
Abbildung).
Auf diese Weise kann über das Auftauchen dunkler optischer Merkmale
viel empfindlicher reagiert werden als durch Absinken der Aktivität von
ON-Neuronen alleine. Insgesamt liegt die Betonung auf der
Signalisierung von Bewegungen:
Ein stehendes Bild auf der Netzhaut "verschwindet" innerhalb von
Sekunden, wird also nach kurzer Zeit nicht mehr wahrgenommen. Sowohl das parvozelluläre
als auch das magnozelluläre (P-, M-) System verfügt über On- und Off-Neurone.
Das Mosaik von ON- und OFF-Feldern erklärt auch das Phänomen der
Kontrastbildung, das an Grenzen von Flächen unterschiedlicher
Helligkeit (subjektiv) auftritt ( Abbildung):
Abbildung):
 Abbildung: Kontrastverstärkung (vereinfachtes Schema)
Nach einer Vorlage in Carlson NR / Birkett MA, Physiology of Behavior, 12th ed. Pearson 2017
Abbildung: Kontrastverstärkung (vereinfachtes Schema)
Nach einer Vorlage in Carlson NR / Birkett MA, Physiology of Behavior, 12th ed. Pearson 2017
An
der Grenze zweier Felder, von denen unterschiedliche Lichtstärke
ausgeht (helles und dunkles Feld), erscheint der Helligkeitsunterschied
verstärkt zu sein (die helle Fläche heller, die dunkle dünkler als die
Restflächen). Dieses Kontrastphänomen hat mit der Anordnung rezeptiver
Felder zu tun:
In diesem Beispiel senden die Ganlienzellen mit teilweise im dünkleren
Feld liegender Peripherie höhere Erregung als andere Felder, die
gleichmäßig ausgeleuchtet sind. Von ohnen geht also eine höhere
Aktionspotentialfrequenz aus als von benachbarten Ganglienzellen.
Die Abbildung
berücksichtigt nur ON-Felder (über der dunkleren Fläche gilt Analoges
für OFF-Felder), die Felder sind der Einfachheit separat gezeigt (in
Wirklichkeit zeigen sie Überlappungen)

Wie auch das Beispiel in der  Abbildung
zeigt, bewirkt das Arrangement von ON- und OFF- Feldern / Neuronen mit
entgegengesetzt reagierenden Anteilen (Zentrum / Peripherie) erhöhte
Aktivität (Aktionspotentialfrequenz) der jeweiligen Anteile sowohl bei
Erhöhung als auch Verringerung des Lichtflusses an betreffenden
Netzhautstellen. Dies löst entsprechende Effekte an Hell-Dunkel-Grenzen
(Kontrastierung) und bei Verlagerung von Bildelementen über die
Netzhaut (Bewegungsanalyse) aus.
Abbildung
zeigt, bewirkt das Arrangement von ON- und OFF- Feldern / Neuronen mit
entgegengesetzt reagierenden Anteilen (Zentrum / Peripherie) erhöhte
Aktivität (Aktionspotentialfrequenz) der jeweiligen Anteile sowohl bei
Erhöhung als auch Verringerung des Lichtflusses an betreffenden
Netzhautstellen. Dies löst entsprechende Effekte an Hell-Dunkel-Grenzen
(Kontrastierung) und bei Verlagerung von Bildelementen über die
Netzhaut (Bewegungsanalyse) aus.
Die Netzhaut enthält - neben unbunt funktionierenden black-and-white detectors - farbsensitive Ganglienzellen:
Für rot/grün und für blau/gelb, je nach Verschaltung entsprechend
farbsensitiver Photorezeptoren mit Bipolar- und Ganglienzellen. Ihre
Felder können auf einen stärkeren Anteil von gelb oder blau, bzw. von
rot oder grün mit erhöhter Erregung reagieren. Die Ganglienzellen arbeiten mit einem Gegenfarbensystem: Sie reagieren spezifisch auf Paare von Primärfarben, wobei jeweils die eine Farbe die Aktivität des Neurons anregt und die Gegenfarbe sie unterdrückt
(Rot-ON, Grün-OFF; Grün-ON, Rot-OFF; Gelb-ON, Blau-OFF; Blau-ON,
Gelb-OFF).
Einige von diesen Ganglienzellen zeigen ebenfalls eine Zentrum / Peripherie- Funktion:
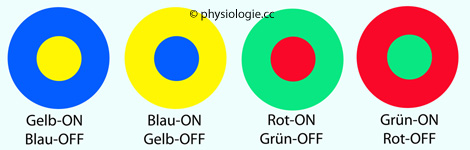
 Abbildung: Rezeptive Felder farbempfindlicher Ganglienzellen
Abbildung: Rezeptive Felder farbempfindlicher Ganglienzellen
Nach einer Vorlage in Carlson NR / Birkett MA, Physiology of Behavior, 12th ed. Pearson 2017
Wird das
jeweils gezeigte Feld eines rezeptiven Feldes mit der gezeigten Farbe
beleuchtet, steigt die Aktionspotentialfrequenz des betreffenden
Neurons. Wird es mit der komplementären Farbe beleuchtet, nimmt die Aktionspotentialfrequenz ab

 Gelb-ON, blau-OFF:
Diese rezeptiven Felder bzw. Ganglienzellen reagieren auf vermehrte
Beleuchtung ihres Zentrums mit gelbem Licht mit Depolarisierung bzw. erhöhter Erregung ("Gelb-ON"),
bei Beleuchtung ihrer Peripherie mit gelbem Licht mit
Hyperpolarisierung bzw. reduzierter Erregung. Beleuchtet man das Zentrum mit der Gegenfarbe
blau, sinkt die Aktionspotentialfrequenz ("Blau-OFF"), beleuchtet man
die Peripherie mit blauem Licht, nimmt sie zu.
Gelb-ON, blau-OFF:
Diese rezeptiven Felder bzw. Ganglienzellen reagieren auf vermehrte
Beleuchtung ihres Zentrums mit gelbem Licht mit Depolarisierung bzw. erhöhter Erregung ("Gelb-ON"),
bei Beleuchtung ihrer Peripherie mit gelbem Licht mit
Hyperpolarisierung bzw. reduzierter Erregung. Beleuchtet man das Zentrum mit der Gegenfarbe
blau, sinkt die Aktionspotentialfrequenz ("Blau-OFF"), beleuchtet man
die Peripherie mit blauem Licht, nimmt sie zu.
 Blau-ON, gelb-OFF: Diese
rezeptiven Felder bzw. Ganglienzellen reagieren auf vermehrte
Beleuchtung ihres Zentrums mit blauem Licht mit Depolarisierung bzw. erhöhter Erregung ("Blau-ON"),
bei Beleuchtung ihrer Peripherie mit blauem Licht mit
Hyperpolarisieruing bzw. reduzierter Erregung. Beleuchtet man das Zentrum mit der Gegenfarbe
gelb, sinkt die Aktionspotentialfrequenz ("Gelb-OFF"), beleuchtet man
die Peripherie mit gelbem Licht, steigt sie an.
Blau-ON, gelb-OFF: Diese
rezeptiven Felder bzw. Ganglienzellen reagieren auf vermehrte
Beleuchtung ihres Zentrums mit blauem Licht mit Depolarisierung bzw. erhöhter Erregung ("Blau-ON"),
bei Beleuchtung ihrer Peripherie mit blauem Licht mit
Hyperpolarisieruing bzw. reduzierter Erregung. Beleuchtet man das Zentrum mit der Gegenfarbe
gelb, sinkt die Aktionspotentialfrequenz ("Gelb-OFF"), beleuchtet man
die Peripherie mit gelbem Licht, steigt sie an.
 Rot-ON, grün-OFF: Diese
rezeptiven Felder bzw. Ganglienzellen reagieren auf vermehrte
Beleuchtung ihres Zentrums mit rotem Licht mit Depolarisierung bzw. erhöhter Erregung ("Rot-ON"),
bei Beleuchtung ihrer Peripherie mit rotem Licht mit
Hyperoplarisation bzw. reduzierter Erregung. Beleuchtet man das Zentrum mit der Gegenfarbe
grün, sinkt die Aktionspotentialfrequenz ("Grün-OFF"), beleuchtet man
die Peripherie mit grünem Licht, steigt sie an.
Rot-ON, grün-OFF: Diese
rezeptiven Felder bzw. Ganglienzellen reagieren auf vermehrte
Beleuchtung ihres Zentrums mit rotem Licht mit Depolarisierung bzw. erhöhter Erregung ("Rot-ON"),
bei Beleuchtung ihrer Peripherie mit rotem Licht mit
Hyperoplarisation bzw. reduzierter Erregung. Beleuchtet man das Zentrum mit der Gegenfarbe
grün, sinkt die Aktionspotentialfrequenz ("Grün-OFF"), beleuchtet man
die Peripherie mit grünem Licht, steigt sie an.
 Grün-ON, rot-OFF: Diese
rezeptiven Felder bzw. Ganglienzellen reagieren auf vermehrte
Beleuchtung ihres Zentrums mit grünem Licht mit Depolarisierung bzw. erhöhter Erregung ("Grün-ON"),
bei Beleuchtung ihrer Peripherie mit grünem Licht mit Hyperpolarisierung bzw. reduzierter Erregung. Beleuchtet man das Zentrum mit der Gegenfarbe
rot, sinkt die Aktionspotentialfrequenz ("Rot-OFF"), beleuchtet man
die Peripherie mit rotem Licht, steigt sie an.
Grün-ON, rot-OFF: Diese
rezeptiven Felder bzw. Ganglienzellen reagieren auf vermehrte
Beleuchtung ihres Zentrums mit grünem Licht mit Depolarisierung bzw. erhöhter Erregung ("Grün-ON"),
bei Beleuchtung ihrer Peripherie mit grünem Licht mit Hyperpolarisierung bzw. reduzierter Erregung. Beleuchtet man das Zentrum mit der Gegenfarbe
rot, sinkt die Aktionspotentialfrequenz ("Rot-OFF"), beleuchtet man
die Peripherie mit rotem Licht, steigt sie an.
(Anmerkung:
Farben sind subjektive Wahrnehmungen. Licht ist an sich weder "gelb"
noch "blau", sondern enthält Anteile von Strahlung mit entsprechender
Wellenlänge. Statt z.B. "rotes Licht" müsste es korrekt heißen "Licht
mit hohem Anteil langwelliger Strahlung" oder so ähnlich - hier wurde
der Einfachheit halber eine weniger Korrekte Formulierung gewählt.)
Wie all diese Information in entsprechende - vom Sehnerven übertragene - Signale umgesetzt wird, zeigt die nächste  Abbildung.
Abbildung.
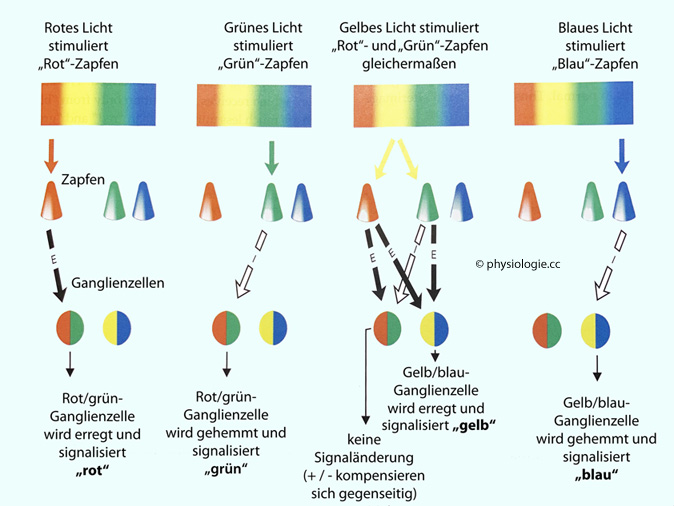
 Abbildung: Farbcodierung in der Netzhaut
Nach einer Vorlage in Carlson NR / Birkett MA, Physiology of Behavior, 12th ed. Pearson 2017
Abbildung: Farbcodierung in der Netzhaut
Nach einer Vorlage in Carlson NR / Birkett MA, Physiology of Behavior, 12th ed. Pearson 2017
Das parvozelluläre System überträgt Information von Grün- und Rot-Zapfen, das koniozelluläre zusätzliche von Blau-Zapfen. Die Information von den Zapfen wird auf
Ganglienzellen umcodiert - schwarze Pfeile: exzitatorische (E), weiße
Pfeile: inhibitorische Umschaltungen.
Links: Rotes Licht erregt "Rot"-Zapfen und Rot-grün- Ganglienzellen, es entsteht das Netzhautsignal "rot"
Daneben: Grünes Licht erregt "Grün"-Zapfen und hemmt Rot-grün- Ganglienzellen, es entsteht das Netzhautsignal "grün"
Daneben: Gelbes
Licht regt "Rot"- und "Grün"-Zapfen gleichermaßen an. Das bewirkt
gegenseitige Aufhebung exzitatorischer und inhibitorischer Einflüsse
auf Rot-grün- Ganglienzellen und Erregung von Gelb-blau-
Ganglienzellen, es entsteht das Netzhautsignal "gelb"
Rechts: Blaues Licht erregt "Blau"-Zapfen, das inhibiert Gelb-blau- Ganglienzellen, es entsteht das Nethautsignal "blau"

 Als rezeptives Feld bezeichnet
man in der Physiologie des Auges diejenige spezifische Region des visuellen Raums, von der aus Reize
auf informationsübertragende Zellen des visuellen Systems - retinale
Photorezeptoren und Ganglienzellen, Neurone in der Sehbahn -
konvergieren. Gegenüber Lichteinfluss auf Gebiete außerhalb ihres rezeptiven Feldes verhalten sich die Zellen "blind". Photosensitive
Zellen der Netzhaut haben ein eng umschriebenes rezeptives Feld: Sie
reagieren auf Licht, das direkt auf sie trifft. Retinale Ganglienzellen reagieren auf Inputs photosensitiver Zellen, mit denen sie synaptisch verbunden sind. Rezeptive Felder der Netzhaut
Als rezeptives Feld bezeichnet
man in der Physiologie des Auges diejenige spezifische Region des visuellen Raums, von der aus Reize
auf informationsübertragende Zellen des visuellen Systems - retinale
Photorezeptoren und Ganglienzellen, Neurone in der Sehbahn -
konvergieren. Gegenüber Lichteinfluss auf Gebiete außerhalb ihres rezeptiven Feldes verhalten sich die Zellen "blind". Photosensitive
Zellen der Netzhaut haben ein eng umschriebenes rezeptives Feld: Sie
reagieren auf Licht, das direkt auf sie trifft. Retinale Ganglienzellen reagieren auf Inputs photosensitiver Zellen, mit denen sie synaptisch verbunden sind. Rezeptive Felder der Netzhaut
 sind kreisförmig bis oval,
sind kreisförmig bis oval,
 haben
einen zur Peripherie hin zunehmenden Durchmesser - von ~einer
Bogenminute in der fovea centralis bis zu ~4 Bogengrade in der
Netzhautperipherie (ein mehr als 200-facher Unterschied),
haben
einen zur Peripherie hin zunehmenden Durchmesser - von ~einer
Bogenminute in der fovea centralis bis zu ~4 Bogengrade in der
Netzhautperipherie (ein mehr als 200-facher Unterschied),
 in zapfenabhängigen rezeptiven Feldern depolarisieren die Zellen bei Erhöhung oder
Erniedrigung der Belichtung ihres Zentrums ("On"- oder "Off"-Neurone), Stäbchen nutzen nur einen "On"-Mechanismus .
in zapfenabhängigen rezeptiven Feldern depolarisieren die Zellen bei Erhöhung oder
Erniedrigung der Belichtung ihres Zentrums ("On"- oder "Off"-Neurone), Stäbchen nutzen nur einen "On"-Mechanismus .
Die Verschaltungsstrategie rezeptiver Felder bewirkt eine
weitgehende Unabhängigkeit ihres Ansprechverhaltens von der absoluten
Lichtstärke: Ganglienzellen reagieren vor allem auf Kontraste
zwischen Zentrum und Peripherie ihres rezeptiven Feldes.
 Abbildung: Zapfenabhängiges rezeptives Feld
Nach einer Vorlage in Banich / Compton, Cognitive Neuroscience, 4th ed. 2018, Cambridge Univ. Press
Abbildung: Zapfenabhängiges rezeptives Feld
Nach einer Vorlage in Banich / Compton, Cognitive Neuroscience, 4th ed. 2018, Cambridge Univ. Press
Horizontalzellen (s. auch folgende Abbildung) wirken auf Photorezeptoren im Sinne eines negativen Feedback (Hyperpolarisierung von Zapfen im Zentrum des rezeptiven Feldes → Hyperpolarisierung von Horizontalzellen → Depolarisierung von Zapfen in der Peripherie des rezeptiven Feldes): In Dunkelheit von Photorezeptoren freigesetztes Glutamat
depolarisiert (erregt) Horizontalzellen; depolarisierte
Horizontalzellen ihrerseits hyperpolarisieren (hemmen) Photorezeptoren
in ihrem Einflussbereich (der Transmittermechanismus ist nicht eindeutig geklärt). Beleuchtung von Photorezeptoren bewirkt das
Gegenteil.
Bipolarzellen werden ebenfalls
von Photorezeptorzellen beeinflusst. In Dunkelheit von Photorezeptoren
freigesetztes Glutamat hyperpolarisiert On-Bipolarzellen und
depolarisiert Off-Bipolarzellen. Bei Lichteinfluss dreht sich das
Muster um. Zapfen-Bipolarzellen schalten direkt auf Ganglienzellen,
Stäbchen-Bipolarzellen nur indirekt - über amakrine Zellen (im Bild
nicht gezeigt), und zwar via gap junctions auf On-Bipolarzellen sowie via Glycin auf Off-Bipolarzellen.
Rezeptive Felder können also funktionell in zwei Zonen gegliedert sein (center-surround receptive fields), was der Kontrastverstärkung zugute kommt. Bei einem "On-Zentrum mit Off-Peripherie" hemmt Reizung von Zapfen in der Peripherie des rezeptiven Feldes den Signalfluss aus dem Zentrum
(bei Off-Zentren mit On-Peripherie ist es umgekehrt). Die
Organisation in zwei Zonen erfolgt bei insgesamt hohem Lichtfluss
(Tageslicht); bei geringem Lichtfluss kann das gesamte rezeptive Feld
auf "On" bzw. "Off" schalten

 On-Bipolarzellen werden durch Glutamat, das Zapfen im Dunkeln vermehrt
freisetzten, hyperpolarisiert, während Off-Bipolarzellen durch Glutamat depolarisiert werden. Der Unterschied in der Reaktion erklärt sich durch den unterschiedlichen Besatz an Glutamatrezeptoren:
On-Bipolarzellen werden durch Glutamat, das Zapfen im Dunkeln vermehrt
freisetzten, hyperpolarisiert, während Off-Bipolarzellen durch Glutamat depolarisiert werden. Der Unterschied in der Reaktion erklärt sich durch den unterschiedlichen Besatz an Glutamatrezeptoren:
 On-Bipolarzellen haben metabotrope (G-Protein → Abbau von cGMP → Schließen von Kationen-Kanälen → Hyperpolarisierung),
On-Bipolarzellen haben metabotrope (G-Protein → Abbau von cGMP → Schließen von Kationen-Kanälen → Hyperpolarisierung),
 Off-Bipolarzellen haben ionotrope AMPA / Kainat- Rezeptoren
(Depolarisierung). Glutamat wirkt hier depolarisierend.
Off-Bipolarzellen haben ionotrope AMPA / Kainat- Rezeptoren
(Depolarisierung). Glutamat wirkt hier depolarisierend.
On-Bipolarzellen drehen die Information von den
Zapfen sozusagen nochmals um, bei erhöhtem Lichtfluss steigt die
anregende Wirkung auf "On"-Ganglienzellen, mit denen sie verschaltet
sind; Off-Bipolarzellen hingegen geben den "Umkehreffekt" der Zapfen an
ihre Ganglienzellen weiter. Bipolarzellen bilden mit amakrinen und mit Ganglienzellen spezielle synaptische Verschaltungen.
Fazit: "On"-Ganglienzellen reagieren auf vermehrten Lichtfluss an
"ihren" Zapfen mit erhöhter, "Off"-Ganglienzellen mit reduzierter
Aktionspotentialfrequenz.
Bei niedrigem Lichtfluss reagiert das gesamte rezeptive Feld in
gleicher Weise, bei ausreichender Helligkeit schaltet es mittels lateraler Hemmung auf Kontrast: "On-Zentrum" mit
"Off-Peripherie" - die Erregungsgröße der Ganglienzelle geht
zurück, wenn die Peripherie ihres rezeptiven Feldes stärker beleuchtet
wird. Umgekehrt bei einem "Off-Zentrum" mit "On"-Peripherie: Die Ganglienzelle erhöht ihre Aktionspotentialfrequenz, wenn die Peripherie ihres
rezeptiven Feldes stärker beleuchtet wird. Hier spielen Amakrinzellen eine tragende Rolle: Sie etablieren laterale Verknüpfungen zwischen bipolaren und Ganglienzellen ( Abbildung). Man kennt an die 40 verschiedene Typen mit unterschiedlicher synaptischer Struktur und verwendeten Transmittern.
Abbildung). Man kennt an die 40 verschiedene Typen mit unterschiedlicher synaptischer Struktur und verwendeten Transmittern.
 Abbildung: Verschaltung retinaler Neurone
Nach einer Vorlage bei Massey / Cunniffe / Noorani, Carpenter's Neurophysiology - A Conceptual Approach, 6th ed. CRC Press Taylor & Francis Group 2022
Abbildung: Verschaltung retinaler Neurone
Nach einer Vorlage bei Massey / Cunniffe / Noorani, Carpenter's Neurophysiology - A Conceptual Approach, 6th ed. CRC Press Taylor & Francis Group 2022
Photorezeptorzellen (C, Zapfen und
Stäbchen) sind mit bipolaren Nervenzellen (B) und Horizontalzellen (H)
synaptisch verknüpft, Bipolare mit amakrinen Zellen (A) und
Ganglienzellen (G). Letztere haben Axone, welche den Sehnerven aufbauen.
Nur Ganglienzellen und amakrine Zellen bilden Aktionspotentiale;
Rezeptor-, bipolare und Horizontalzellen nicht, ihnen "genügt"
elektrotonische Informationsleitung ohne aktive Signalbildung.
Diese schematische Darstellung ist eine Vereinfachung in Wirklichkeit komplexerer Verschaltungen. So kommunizieren an Stäbchen
geschaltete Bipolarzellen mit "ihren" Ganglienzellen
indirekt über amakrine Zellen vom Typ II (AII), welche ihrerseits die
Ganglienzelle nur indirekt - über Endfortsätze anderer Bipolarzellen, die an Zapfen gekoppelt sind - erreichen. Bipolarzellen der Zapfen wiederum gibt es in zwei Ausführungen - "invaginating", welche die belichtungsabhängige Potentialänderung der Zapfen umkehren (über diese wirken AII- amakrine Zellen) und "flat", welche das nicht tun

Ganglienzellen können farbkodierend fungieren (parvozelluläres System) - ihr rezeptives Feld ist farbantagonistisch organisiert - oder helligkeitskodierend (magnozelluläres System) - diese verstärken die Helligkeitskontraste:
P-, M- und koniozelluläres System
P-System  M-System
M-System  Koniozelluläres System (bistratified cells)
Koniozelluläres System (bistratified cells)
Die Netzhaut enthält Ganglienzellen des parvozellulären  Systems, des magnozellulären Systems, sowie einer heterogenen Gruppe (Zellen der Puppillenreflexbahnen; koniozelluläres
Systems, des magnozellulären Systems, sowie einer heterogenen Gruppe (Zellen der Puppillenreflexbahnen; koniozelluläres  System) (vgl. dort). Das parvozelluläre System erhält Information von Grün- bzw. Rot-Rezeptoren, das koniozelluläre überträgt zusätzliche Information von Blau-Rezeptoren.
System) (vgl. dort). Das parvozelluläre System erhält Information von Grün- bzw. Rot-Rezeptoren, das koniozelluläre überträgt zusätzliche Information von Blau-Rezeptoren.
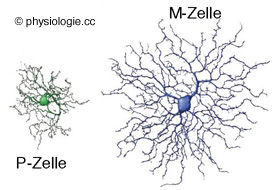
 Abbildung: P (parvozelluläre)- und M- (magnozelluläre) Ganglienzelle
Nach Watanabe M, Rodieck RW. Parasol and midget ganglion cells of the primate retina. J Comp Neurol 1989;289: 434-54
Abbildung: P (parvozelluläre)- und M- (magnozelluläre) Ganglienzelle
Nach Watanabe M, Rodieck RW. Parasol and midget ganglion cells of the primate retina. J Comp Neurol 1989;289: 434-54
Jede
fünfte Ganglienzelle der Netzhaut gehört zum M-System (parasol cells): Großer
Dendritenbaum (große rezeptive Felder), hohe zeitliche Auflösung,
rasche Adaptation; sie sind sehr bewegungssensitiv, aber
farbunempfindlich.
Die kleineren
P-Zellen (midget cells) überwiegen an der Zahl. Sie haben kleine rezeptive Felder,
hohes räumliches Auflösungsvermögen, und verhalten sich farbempfindlich

Sowohl das P- als auch das M-System verfügt über ON- und OFF-Neurone (s. oben).
 Zum parvozellulären System gehören 70-80% der retinalen Ganglienzellen (P-Zellen oder midget cells). Seine rezeptiven Felder sind klein, sie sind farbempfindlich (Rot / Grün), reagieren langsam, adaptieren nur wenig, haben aber ein hohes räumliches Auflösungsvermögen. Ihre Neurone projizieren in das corpus geniculatum laterale (
Zum parvozellulären System gehören 70-80% der retinalen Ganglienzellen (P-Zellen oder midget cells). Seine rezeptiven Felder sind klein, sie sind farbempfindlich (Rot / Grün), reagieren langsam, adaptieren nur wenig, haben aber ein hohes räumliches Auflösungsvermögen. Ihre Neurone projizieren in das corpus geniculatum laterale ( s. dort), wo sie an Zellen des parvozellulären
Systems - an den dorsal gelegenen Kernschichten 3 bis 6 - enden. Das angekoppelte visuelle Verarbeitungssystem ist auf
räumliche Auflösung, Detail, Farbe und Objekterkennung spezialisiert.
s. dort), wo sie an Zellen des parvozellulären
Systems - an den dorsal gelegenen Kernschichten 3 bis 6 - enden. Das angekoppelte visuelle Verarbeitungssystem ist auf
räumliche Auflösung, Detail, Farbe und Objekterkennung spezialisiert.
P-Zellen sind farbempfindlich, lösen örtlich besser auf und adaptieren weniger als M-Zellen
|
 Zum (phylogenetisch älteren) magnozellulären System gehören ~10% der retinalen Ganglienzellen, die groß sind und einen umfangreichen Dendritenapparat aufweisen (M-Zellen oder parasol cells). Seine rezeptiven Felder sind groß (ihr Auflösungsvermögen relativ gering), sie sind nicht farbempfindlich, adaptieren rasch und sind zu hoher zeitlicher Auflösung fähig. Auch ihre Neurone projizieren in das corpus geniculatum laterale, sie enden an Zellen des magnozellulären
Systems, d.h. an den ventral gelegenen Kernschichten 1 und 2. Diese
Zellen senden überwiegend an obere parietale Areale und sind auf die
Analyse von Position und Bewegung spezialisiert.
Zum (phylogenetisch älteren) magnozellulären System gehören ~10% der retinalen Ganglienzellen, die groß sind und einen umfangreichen Dendritenapparat aufweisen (M-Zellen oder parasol cells). Seine rezeptiven Felder sind groß (ihr Auflösungsvermögen relativ gering), sie sind nicht farbempfindlich, adaptieren rasch und sind zu hoher zeitlicher Auflösung fähig. Auch ihre Neurone projizieren in das corpus geniculatum laterale, sie enden an Zellen des magnozellulären
Systems, d.h. an den ventral gelegenen Kernschichten 1 und 2. Diese
Zellen senden überwiegend an obere parietale Areale und sind auf die
Analyse von Position und Bewegung spezialisiert.
M-Zellen lösen zeitlich rascher auf, sind bewegungs- und kontrastempfindlicher als P-Zellen
|
 Zweischichtige Ganglienzellen
in der Netzhaut (bistratified cells) machen 8-10% der Ganglienzellen in der Netzhaut aus. Sie erhalten ihre Inputs von bipolaren und amakrinen Zellen und
projizieren auf koniozelluläre Neuronen des corpus geniculatum laterale thalami- zwischen Schichten des P- und des M-Systems. Das koniozelluläre System überträgt Information von Blau-Zapfen der Netzhaut, trägt zur Helligkeits- und Farbkontrastwahrnehmung bei, weiters zur Steuerung von Auganbewegungen.
Zweischichtige Ganglienzellen
in der Netzhaut (bistratified cells) machen 8-10% der Ganglienzellen in der Netzhaut aus. Sie erhalten ihre Inputs von bipolaren und amakrinen Zellen und
projizieren auf koniozelluläre Neuronen des corpus geniculatum laterale thalami- zwischen Schichten des P- und des M-Systems. Das koniozelluläre System überträgt Information von Blau-Zapfen der Netzhaut, trägt zur Helligkeits- und Farbkontrastwahrnehmung bei, weiters zur Steuerung von Auganbewegungen.
Eigenschaften vom Übertragungswegen im visuellen System

Nach Carlson NR / Birkett MA, Physiology of Behavior, 12th ed. Pearson 2017
|
Charakteristik
|
Magnozellulär
|
Parvozellulär
|
Koniozellulär
|
Farbe
|
nein
|
von Rot- und Grün-Zapfen
|
von Blau-Zapfen
|
Kontrast-
sensitivität
|
hoch
|
gering
|
gering |
Auflösung von Details
|
gering
|
hoch
|
hoch
|
Zeitliche Auflösung
|
rasch / flüchtig
|
langsam / nachhaltig
|
langsam / nachhaltig |
Die Diversität der Ganglienzellen geht noch weiter. So unterscheidet man large (-field) bistratified ganglion cells (LBC) und small (-field) bistratified ganglion cells (SBC).
Die Anwesenheit mehrerer differenzierter Ganglienzelltypen weist auf
eine hohe Komplexität der retinalen Informationsverarbeitung hin.

 Abbildung: Netzhautstruktur (Übersicht)
Nach einer Vorlage bei Guyton and Hall, Textbook of Medical Physiology, 15th ed. Elsevier 2026
Abbildung: Netzhautstruktur (Übersicht)
Nach einer Vorlage bei Guyton and Hall, Textbook of Medical Physiology, 15th ed. Elsevier 2026
 Weiterverarbeitung der Information aus den Netzhäuten: Die Information von der Netzhaut gelangt über Verarbeitung in den seitlichen Kniehöckern (corpora geniculata lateralia) zur Sehrinde; hier reagieren Neurone in CO-Blobs
der Sehrindenmodule komplementär auf Farben, wie auch Zellen des parvo
/ koniozellulären Systems. Dabei kommt es zum Phänomen der Farbkonstanz
(color constancy):
Die wahrgenommenen Farben der betrachteten Gegenstände bleiben mehr
oder weniger unabhängig von der Beleuchtung (Tages- vs. künstliches
Licht, Farbe des Hintergrunds), je nach Bedingungen kommt es zu
entsprechender Kompensation.
Weiterverarbeitung der Information aus den Netzhäuten: Die Information von der Netzhaut gelangt über Verarbeitung in den seitlichen Kniehöckern (corpora geniculata lateralia) zur Sehrinde; hier reagieren Neurone in CO-Blobs
der Sehrindenmodule komplementär auf Farben, wie auch Zellen des parvo
/ koniozellulären Systems. Dabei kommt es zum Phänomen der Farbkonstanz
(color constancy):
Die wahrgenommenen Farben der betrachteten Gegenstände bleiben mehr
oder weniger unabhängig von der Beleuchtung (Tages- vs. künstliches
Licht, Farbe des Hintergrunds), je nach Bedingungen kommt es zu
entsprechender Kompensation.
Zerebrale Achromatopsie:
Läsionen extrastriataler Regionen des visuellen Cortex können zu einem
Ausfall des Farbempfindens und auch des Farbgedächtnisses führen.
Der dorsale (parietale) Pfad der visuellen Informationsverarbeitung erhält vor allem Impulse aus dem magnozellulären, der ventrale (temporale) etwa zu gleichen Teilen aus dem magnozellulären und dem parvo / koniozellulären System.
 Wir brauchen unsere Augen für drei hauptsächliche Zwecke visueller Erkennung:
Wir brauchen unsere Augen für drei hauptsächliche Zwecke visueller Erkennung:
Drei Typen visueller Information

Nach Massey / Cunniffe / Noorani, Carpenter's Neurophysiology - A Conceptual Approach, 6th ed. CRC Press Taylor & Francis Group 2022
|
Erkennung
|
lateraler Kniehöcker
Großhirnrinde
|
Neurone reagieren auf spezielle Merkmale eines Reizes, weniger auf deren Ort
|
Lokalisierung
|
obere Vierhügel
Großhirnrinde
|
Neurone reagieren auf die Anwesenheit eines Reizes an einem bestimmten Ort, unabhängig von seinen Merkmalen
|
Propriozeption
|
Prätectum
Brücke
|
Neurone reagieren auf Bewegungen in eine bestimmte Richtung
|
Um Objekte in unserer Umwelt zu erkennen (hauptsächlich über das Großhirn), sie zu orten
(vor allem über die colliculi superiores) sowie um die Position unseres
Körpers relativ zur Umwelt zu identifizieren (Propriozeption via Prätectum und mit diesem verknüpfte Strukturen im Hirnstamm).
Dazu kommt visuell ausgelöste Motivation über die Involvierung des Hypothalamus und anderer Teile des limbischen Systems.
Der wichtigste Beitrag des Sehens zur Propriozeption
ist es, das Gehirn über die Geschwindigkeit zu informieren, mit der die
Abbildung von Gegenständen in der Umgebung des Körpers über die
Netzhaut gleiten (retinal slip velocity)
- was (in einer natürlichen Welt) praktisch immer durch Eigenbewegung
des Kopfes / Körpers erfolgt und daher zur motorischen Rückkopplung
herangezogen werden kann. Dieses Feedback erfolgt durch Zentren im
Hirnstamm, die insgesamt als visuelles propriozeptives System (VPS) bezeichnet werden (Prätectum, pontine Neuronengruppen u.a.).
Neurone des VPS haben typischerweise sehr große rezeptive Felder und
reagieren vor allem dann, wenn sich eine Vielzahl von Netzhautbildern
in dieselbe Richtung bewegt (wie das bei somatomotorischen Abläufen der
Fall ist). Diese Information wird auf die Aktivität von Vestibulariskernen und Kleinhirn
(wo Signale aus dem Innenohr entsprechend kalibriert werden)
rückgekoppelt. Ergebnis ist die Korrektur entsprechender Motorik der
Muskulatur (Stamm, Gliedmaßen, Hals / Kopf, äußere Augenmuskeln).
Sehnervenkreuzung (chiasma opticum)
Seitenkreuzung: Das Netzhautbild
der Umwelt wird in Aktionspotentialmuster umgewandelt, die über den
Sehnerv (nervus opticus vor dem chiasma, tractus opticus dahinter) ins Gehirn gelangen. Bilder des rechten Gesichtsfeldes werden in die linke
Großhirnhemisphäre geleitet und umgekehrt.
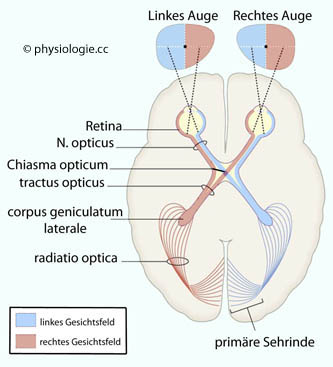
 Abbildung
Abbildung: Zentrale Sehbahn
Nach einer Vorlage bei clinicalgate.com
Die
Gesichtsfelder beider Augen sind getrennt dargestellt, überlappen
einander aber in Wirklichkeit zu einem hohen Anteil (Augen blicken nach
vorne, nicht zur Seite). Das ermöglicht binokuläres Sehen (Abgleich der
beiden Netzhautbilder), zerebrale Fusion und Tiefenwahrnehmung.
Bei der
(monokulären) Testung des Gesichtsfeldes (Perimetrie)
lassen sich die Leistungen der linksseitigen und rechtsseitigen Sehbahn
getrennt untersuchen

Die Sehnervenkreuzung liegt auf dem diaphragma sellae (Dach des
Türkensattels).
Hypophysenadenom:
Drückt ein Tumor (die Hypophyse liegt in der sella
turcica) auf die medianen Bündel im chiasma
opticum, sind vor allem kreuzende Fasern betroffen. Diese stammen von
den nasalen Netzhauthälften, auf welche die temporalen
Gesichtsfeldhälften abbilden. Der Gesichtsfeldausfall beginnt
bitemporal oben und kann sich zu einer kompletten bitemporalen Hemianopsie  ("Scheuklappenblindheit") ausbreiten.
("Scheuklappenblindheit") ausbreiten.
Kraniopharyngeom: Diese Tumoren
entstehen aus Versprengseln der Rathke-schen Tasche und drücken von
hinten-oben aus das Chiasma. Der Gesichtsfeldausfall beginnt
inferiotemporal und kann sich auf das gesamte temporale Feld ausbreiten.
Carotisaneurysma: Lateral
ist die Sehnervenkreuzung durch die a. carotis interna begrenzt.
Erweiterungen (Aneurysmen) dieser Arterie können die Fasern im Chiasma
von lateral her komprimieren und einen (zuerst halbseitigen, dann auch
kontralateralen) nasalen Gesichtsfeldausfall bewirken.
Räumliches Sehen (stereopsis)
Binokularsehen und räumlicher Eindruck: Das auf die Netzhäute beider Augen projizierte Bild der Umwelt ist (aus geometrischen Gründen,  Abbildung) meist nicht ident. Lediglich auf einer gekrümmten horizontalen Linie, dem sogenannten Horopter
Abbildung) meist nicht ident. Lediglich auf einer gekrümmten horizontalen Linie, dem sogenannten Horopter  ,
liegen diejenigen Punkte, die auf Netzhautpunkten abgebildet werden,
die von der fovea centralis (im gleichen Winkel) gleich weit entfernt sind (der
Fixationspunkt wird auf die fovea centralis projiziert). Solche deckungsgleichen Orte auf der Retina nennt man korrespondierend.
,
liegen diejenigen Punkte, die auf Netzhautpunkten abgebildet werden,
die von der fovea centralis (im gleichen Winkel) gleich weit entfernt sind (der
Fixationspunkt wird auf die fovea centralis projiziert). Solche deckungsgleichen Orte auf der Retina nennt man korrespondierend.
Das bedeutet definitionsgemäß, dass auf dem Horopter liegende
Gegenstandspunkte auf korrespondierende Netzhautpunkte projiziert
werden. Legt man (fiktiv) die Netzhautbilder solcher Punkte übereinander,
sind sie deckungsgleich.
Andere Umgebungspunkte bilden sich nicht auf korrespondierende
Netzhautstellen ab; sie weisen eine Abweichung in ihrer Entfernung von
der fovea centralis auf, eine sogenannte Querdisparation (binocular / retinal disparity) (quer, weil in der x-Achse gelegen - die Augen liegen nebeneinander; disparat (lat) = abgesondert, getrennt) - s. Abbildung:
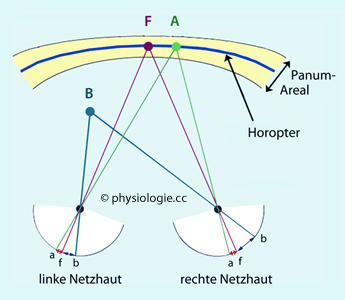
 Abbildung: Horopter, Querdisparation, Panum-Raum
Nach einer Vorlage in Levine / Shefner, Fundamentals of Sensation and Perception. Brooks/Cole Publishing Co 1991
Abbildung: Horopter, Querdisparation, Panum-Raum
Nach einer Vorlage in Levine / Shefner, Fundamentals of Sensation and Perception. Brooks/Cole Publishing Co 1991
Im
Panum-Raum (Panum-Areal) gelegene Querdisparationen führen (über Fusionierung im
Gehirn) zu dreidimensionalen Eindrücken (Raumwahrnehmung), außerhalb
liegende Punkte ergeben Doppelbilder.
A und F liegen - im Gegensatz zu B - am Horopter.
Korrespondierende Netzhautpunkte: Roter Doppelpfeil (gleicher Abstand a-f)
Disparate Netzhautpunkte: Blauer Doppelpfeil (ungleicher Abstand f-b)

Die Punkte F (Fixationspunkt) und A liegen auf dem (theoretisch kreisförmigen und durch beide Augen laufenden) Horopter (plane of fixation). Ihre
Projektionspunkte auf der Netzhaut (f = fovea, a) sind links und rechts
gleich weit voneinander entfernt (korrespondierend; rote Doppelpfeile).
Um den Horopter liegt eine Zone von Gegenstandspunkten (Panum-Areal  ),
bei deren Abbildung auf der Netzhaut nur eine geringe Querdisparation
auftritt, sodass das Gehirn diese Information zu einem räumlichen
Eindruck verschmelzen kann und kein Doppelbild wahrgenommen wird
("Fusionszwang" für das Gehirn, stereoskopisches Sehen).
),
bei deren Abbildung auf der Netzhaut nur eine geringe Querdisparation
auftritt, sodass das Gehirn diese Information zu einem räumlichen
Eindruck verschmelzen kann und kein Doppelbild wahrgenommen wird
("Fusionszwang" für das Gehirn, stereoskopisches Sehen).
Für alle anderen Gegenstandspunkte (z.B. B in der Abbildung) gilt: Die
Querdisparation ihrer Abbildungspunkte (b) ist so stark (vgl. blaue
Doppelpfeile), dass das Gehirn sie nicht mehr fusioniert und in der
Wahrnehmung ein Doppelbild entsteht (Diplopie). Für bestimmte Bereiche der
retinalen Querdisparation (Gegenstand vor oder hinter dem Horopter)
reagieren Neurone der Sehrinde auf Punkte, die vor (near cells) oder hinter dem Horopter liegen (far cells) und unterstützen so die Tiefebwahrnehmung.
Die Querdisparation steht mit der Tiefenwahrnehmung
optischer Reizmuster in Zusammenhang. Dabei spielt einerseits die
Distanz des betrachteten Gegenstandes, andererseits der Augenabstand
(Interpupillardistanz, ca. 5-8 cm) eine Rolle. Künstliche
Erhöhung der Querdisparation (z.B. stereoskopische Bilder,
3D-Filme, Scherenfernrohr) verstärkt den räumlichen Eindruck.
Die optischen Hirnrindenareale V1 und V2 enthalten binokulare Neurone, die Information von korrespondierenden
Netzhautpunkten (corresponding positions) erhalten. Sie werden maximal aktiviert, wenn auf die
entsprechenden rezeptiven Felder Gegenstandspunkte projiziert werden,
die auf dem jeweils aktuellen Horopter liegen. Daneben gibt es
Neurone, die am stärksten ansprechen, wenn die Abbildung auf nicht-korrespondierende Netzhautstellen erfolgt. Offensichtlich wirken diese Neuronenpopulationen bei der räumlichen Tiefenwahrnehmung zusammen.


 Abbildung: Goldmann-Hohlkugelperimeter
Abbildung: Goldmann-Hohlkugelperimeter 
Die
untersuchte Person legt das Kinn auf die Stütze (der Kopf ist dadurch
stabilisiert) und blickt mit dem untersuchten Auge (das andere ist
abgedeckt) in die Mitte der Hohlkugel. Es wird getestet, welche (auf
die weiße Fläche projizierten) optischen Reize wahrgenommen werden
(Position, Größe, Lichtstärke, Farbe).
Der Untersucher sitzt auf der
Gegenseite und kontrolliert die Position der Pupille (fixiert die
untersuchte Person tatsächlich den Mittelpunkt der Hohlkugel?)
 Der bei
unbewegtem Blick wahrnehmbare Teil der Umwelt wird als
Gesichtsfeld (visual field) bezeichnet. Die Bestimmung des Gesichtsfeldes heißt
Perimetrie. Sie
kann im einfachsten Fall mit Fingern und Händen des Untersuchers
erfolgen. Das Hohlkugelperimeter (
Der bei
unbewegtem Blick wahrnehmbare Teil der Umwelt wird als
Gesichtsfeld (visual field) bezeichnet. Die Bestimmung des Gesichtsfeldes heißt
Perimetrie. Sie
kann im einfachsten Fall mit Fingern und Händen des Untersuchers
erfolgen. Das Hohlkugelperimeter ( Abbildung) erlaubt exakte Bestimmungen in Bezug
auf Ort, Größe, Helligkeit und Farbe eines optischen Stimulus.
Abbildung) erlaubt exakte Bestimmungen in Bezug
auf Ort, Größe, Helligkeit und Farbe eines optischen Stimulus.
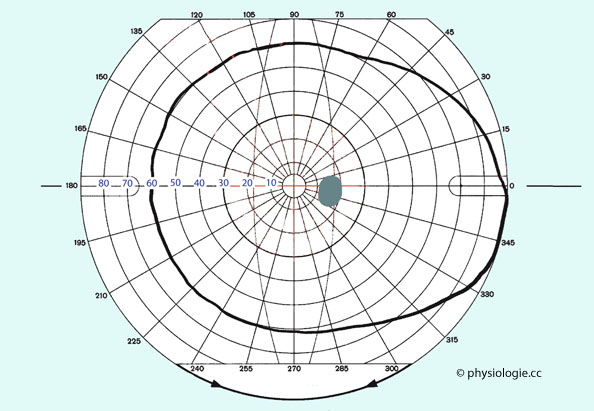
 Abbildung: Perimetrieblatt
Abbildung: Perimetrieblatt
Auf einem solchen Formular wird das Ergebnis einer perimetrischen Untersuchung dokumentiert.
Das Gesichtsfeld umfasst radial 360 Grad (schwarze Zahlen; temporal =
0°, nasal = 180°). Die blauen Zahlen geben in Bogengrad den Abstand vom
Fixationspunkt (Projektion auf die fovea centralis) an.
Das normale Gesichtsfeld ist mit der dicken Linie angedeutet (~60°
nasal, ~90° temporal), das Areal des blinden Flecks mit dem grünen Oval
(temporal 10-20°)
 Abbildung) aufgezeichnet. Getestet wird u.a. auf erforderliche
Lichtintensität oder Größe des für einen wahrnehmbaren Eindruck
notwendigen Lichtflecks. Neben dem allgemeinen (unbunten) Gesichtsfeld
kann auch die Ausbreitung der Farbsinne quantifiziert werden (rot mit dem engsten, blau mit dem weitesten
Gesichtsfeld).
Abbildung) aufgezeichnet. Getestet wird u.a. auf erforderliche
Lichtintensität oder Größe des für einen wahrnehmbaren Eindruck
notwendigen Lichtflecks. Neben dem allgemeinen (unbunten) Gesichtsfeld
kann auch die Ausbreitung der Farbsinne quantifiziert werden (rot mit dem engsten, blau mit dem weitesten
Gesichtsfeld).
Der "blinde Fleck" entspricht
der papilla N. optici, an der sich die Nervenfasern von den
Ganglienzellen in der Netzhaut bündeln und in den Sehnerv übergehen.
Hier gibt es keine Photorezeptoren. Der blinde Fleck liegt 10-20° nasal
zur Stelle des schärfsten Sehens (macula lutea mit fovea centralis), in der perimetrischen Untersuchung entsprechend ~15 Bogengrad temporal vom Fixationspunkt (<Abbildung).
Davon kann man sich mittels einfacher Schaubilder überzeugen, die
monokular betrachtet werden ("Verschwinden" eines schwarzen Flecks, der
bei ~15° temporal vom Fixationspunkt zu liegen kommt).
Der blinde Fleck liegt 15 Bogengrade nasal von der Stelle des schärfsten Sehens (fovea centralis)
In der perimetrischen Untersuchung liegt er folglich 15° temporal zum Fixationspunkt
|
 Abbildung: Visuelles Feld entlang der Sehbahn
Nach einer Vorlage in Kandel / Koester / Mack / Siegelbaum (eds), Principles of Neural Sciences, 6th ed. 2021 (McGraw Hill)
Abbildung: Visuelles Feld entlang der Sehbahn
Nach einer Vorlage in Kandel / Koester / Mack / Siegelbaum (eds), Principles of Neural Sciences, 6th ed. 2021 (McGraw Hill)
Innerhalb der binokulären Zone ist die Umwelt über die Netzhäute binokular repräsentiert - bis auf die "monokularen Halbmonde" (monocular crescents).
Das Bild zeigt das Ausmaß von Gesichtsfeldausfällen (dunkelgrau) bei kompletter Durchtrennung an den numerierten Stellen.
Halbseitige Ausfälle des Gesichtsfeldes nennt man Hemianopsien, Ausfälle eines Viertels des Gesichtsfeldes Quadrantenanopsien (z.B. bei Beschädigung der Meyer'schen Schleife)
Ausfälle der Leitung an bestimmten Stellen
führen zu typischen Ausfällen im Gesichtsfeld. So führt Druck auf die
Sehnervenkreuzung infolge eines Hypophysentumors (Chiasma opticum über der Hypophyse!) zu Ausfall der
seitlichen (lateralen) Gesichtsfeldhälften (bitemporale Hemianopsie,
“Scheuklappenblindheit”).
Skotome (fleckförmige Ausfälle, z.B. bei Glaukom) können präzise verortet werden.
(fleckförmige Ausfälle, z.B. bei Glaukom) können präzise verortet werden.
Gesichtsfeldausfälle werden oft unbewusst
kompensiert und bleiben vom Patienten lange Zeit unbemerkt. Betrifft ein Ausfall nur ein Auge, liegt die Schädigung im Bereich der Netzzhaut oder im N. opticus.
Ist die Störung ipsilateral nasal und kontralateral temporal, liegt eine Läsion des tractus opticus vor, also hinter der Sehnervenkreuzung (Abbildung).
Ist die Sehnervenkreuzung von median komprimiert (Hypophysentumor),
fallen die beiden temporalen Gesichtsfelder aus
("Scheuklappenblindheit"). Druck von lateral (Carotisaneurysma) wirkt
sich als (bi)nasale Hemianopsie aus.
 Elektroretinographie
(ERG) wird angewendet, um die elektrische Summenantwort der Netzhaut
auf einen (schwachen) Lichtreiz zu ermitteln. Normalerweise kommt es
innerhalb von weniger als einer Zehntelsekunde (je intensiver der
Lichtreiz, desto rascher) zu einer ein- (schwacher Lichtreiz) bis zweiphasigen Veränderung des
(mittels Kontaktlinsenelektroden) registrierten Potentials über dem
Augapfel. Dies spiegelt die Aktivität der Zellen in der Netzhaut wider.
Elektroretinographie
(ERG) wird angewendet, um die elektrische Summenantwort der Netzhaut
auf einen (schwachen) Lichtreiz zu ermitteln. Normalerweise kommt es
innerhalb von weniger als einer Zehntelsekunde (je intensiver der
Lichtreiz, desto rascher) zu einer ein- (schwacher Lichtreiz) bis zweiphasigen Veränderung des
(mittels Kontaktlinsenelektroden) registrierten Potentials über dem
Augapfel. Dies spiegelt die Aktivität der Zellen in der Netzhaut wider.
 Abbildung: Normales Elektroretinogramm nach hellem Lichtreiz (single flash)
Abbildung: Normales Elektroretinogramm nach hellem Lichtreiz (single flash)
Nach Niemeyer G, Das Elektroretinogramm: Nützlich und nicht kompliziert. Schweizer Fachzschr Augenärztliche Med 2004(5):7-13
A-Welle durch Aktivität der Photorezeptoren, oszillatorische Wellen durch amakrine Zellen, B-Welle durch Entladungen von bipolaren und Ganglienzellen verursacht
Man führt die Untersuchung bei hell- oder dunkeladaptierten Probanden
durch (photopische bzw. skotopische Bedingungen), um das Zapfen- bzw.
Stäbchensystem zu testen. Die Amplitude dieser Reaktionen kann mehr als
0,1 mV betragen ( Abbildung).
Abbildung).
Netzhautschädigungen können sich in veränderter Lichtreaktion im ERG äußern. So zeigen Patienten, die unter retinitis pigmentosa leiden, im ERG stark abgeschwächte oder fehlende Potentialschwankungen nach Testreizen.


 Retinale Rezeptorzellen sind Zapfen für hohe Lichtstärke (photopisches Sehen) mit unterschiedlicher Farbempfindlichkeit (Photopsine), für geringe Lichtstärke (skotopisches Sehen) mit einem Empfindlichkeitsmaximum bei ~550 nm (Rhodopsin), und Stäbchenfotosensible Ganglienzellen (ipRGC) für die Steuerung zirkadianer Rhythmen über den nucleus suprachiasmaticus (Melanopsin) Retinale Rezeptorzellen sind Zapfen für hohe Lichtstärke (photopisches Sehen) mit unterschiedlicher Farbempfindlichkeit (Photopsine), für geringe Lichtstärke (skotopisches Sehen) mit einem Empfindlichkeitsmaximum bei ~550 nm (Rhodopsin), und Stäbchenfotosensible Ganglienzellen (ipRGC) für die Steuerung zirkadianer Rhythmen über den nucleus suprachiasmaticus (Melanopsin)
 Das skotopische System ist bei ~500 nm am empfindlichsten. Diese
Wellenlänge
liegt zwischen dem Absorptionsmaximum der Blau- und dem der
Grün-Sensoren, während das kollektive Empfindlichkeitsmaximum des
photopischen Systems bei ~550 nm liegt. Das bedingt den Purkinje-Effekt
Das skotopische System ist bei ~500 nm am empfindlichsten. Diese
Wellenlänge
liegt zwischen dem Absorptionsmaximum der Blau- und dem der
Grün-Sensoren, während das kollektive Empfindlichkeitsmaximum des
photopischen Systems bei ~550 nm liegt. Das bedingt den Purkinje-Effekt
 Rot-(L)-Zapfen sind am empfindlichsten bei ~565 nm, ihr Ausfall heißt
Protanopie (Rotblindheit); Grün-(M)-Zapfen bei ~535 nm, ihr
Ausfall heißt Deuteranopie (Grünblindheit); Blau-(K)-Zapfen bei ~420
nm, ihr Ausfall heißt Tritanopie (Blau-Gelb-Blindheit).
Farbsinnstörungen betreffen 8% der Männer, 0,4% der Frauen (Gene
X-chromosomal codiert). Eine Testung des Farbsinns erfolgt mit
pseudoisochromatischen Tafeln (Ishihara, Stilling-Velhagen) oder
Anomaloskopen
Rot-(L)-Zapfen sind am empfindlichsten bei ~565 nm, ihr Ausfall heißt
Protanopie (Rotblindheit); Grün-(M)-Zapfen bei ~535 nm, ihr
Ausfall heißt Deuteranopie (Grünblindheit); Blau-(K)-Zapfen bei ~420
nm, ihr Ausfall heißt Tritanopie (Blau-Gelb-Blindheit).
Farbsinnstörungen betreffen 8% der Männer, 0,4% der Frauen (Gene
X-chromosomal codiert). Eine Testung des Farbsinns erfolgt mit
pseudoisochromatischen Tafeln (Ishihara, Stilling-Velhagen) oder
Anomaloskopen
 Phototransduktion: Im Dunkeln depolarisiert Kationeneinstrom durch
CNG-Kanäle (Guanylatzyklase bildet kontinuierlich cGMP) das
Außensegment der Sinneszellen (Dunkelstrom), die Synapse zur
Nervenzelle setzt Glutamat frei. Licht verwandelt 11-cis-
zu all-trans-Retinal, Rhodopsin wird zu Metarhodopsin, dieses aktiviert
das G-Protein Transduzin, cGMP wird abgebaut, das sinkende
[cGMP] verringert den Kationeneinstrom, das Membranpotential steigt von ~-40 auf ~-80mV, was sich elektrotonisch auf die Kontaktstelle zum bipolaren Retina-Neuron auswirkt: die Glutamatfreisetzung nimmt ab
Phototransduktion: Im Dunkeln depolarisiert Kationeneinstrom durch
CNG-Kanäle (Guanylatzyklase bildet kontinuierlich cGMP) das
Außensegment der Sinneszellen (Dunkelstrom), die Synapse zur
Nervenzelle setzt Glutamat frei. Licht verwandelt 11-cis-
zu all-trans-Retinal, Rhodopsin wird zu Metarhodopsin, dieses aktiviert
das G-Protein Transduzin, cGMP wird abgebaut, das sinkende
[cGMP] verringert den Kationeneinstrom, das Membranpotential steigt von ~-40 auf ~-80mV, was sich elektrotonisch auf die Kontaktstelle zum bipolaren Retina-Neuron auswirkt: die Glutamatfreisetzung nimmt ab
 Signalverstärkung: Photorezeptoren absorbieren ~20% der eintreffenden
Photonen. Jedes absorbiertes Photon führt zum Eintritt von >106 Kationen, ~1mV Potentialanstieg und einer meßbaren Antwort am Rezeptor (Signalverstärkung). Variationen
des Lichtflusses um einige Dutzend Photonen können bereits Sinneseindrücke verändern
Signalverstärkung: Photorezeptoren absorbieren ~20% der eintreffenden
Photonen. Jedes absorbiertes Photon führt zum Eintritt von >106 Kationen, ~1mV Potentialanstieg und einer meßbaren Antwort am Rezeptor (Signalverstärkung). Variationen
des Lichtflusses um einige Dutzend Photonen können bereits Sinneseindrücke verändern
 Retinale Adaptation entsteht durch das Zusammenwirken mehrerer
Mechanismen: Photochemische Adaptation, unterschiedlicher Einsatz von
Stäbchen und Zapfen (adaptierte Stäbchen sind um mehrere Zehnerpotenzen
lichtempfindlicher als adaptierte Zapfen), neuronale Anpassung,
räumliche und zeitliche Summation
Retinale Adaptation entsteht durch das Zusammenwirken mehrerer
Mechanismen: Photochemische Adaptation, unterschiedlicher Einsatz von
Stäbchen und Zapfen (adaptierte Stäbchen sind um mehrere Zehnerpotenzen
lichtempfindlicher als adaptierte Zapfen), neuronale Anpassung,
räumliche und zeitliche Summation
 Fixierte Gegenstandspunkte werden auf der fovea centralis abgebildet (Auflösung ~1
Bogenminute) - diese enthält nur Zapfen (skotopisches Zentralskotom).
Die Signalübertragung auf bipolare und Ganglienzellen ergibt rezeptive
Felder, definiert als die kreisförmige bis ovale Netzhautfläche, von
der aus Einflüsse auf eine Ganglienzelle konvergieren. Der Durchmesser
rezeptiver Felder nimmt von einer
Bogenminute (fovea) bis zu ~4 Bogengrade (Netzhautperipherie) zu.
Zapfendominierte rezeptive Felder haben "On-" oder "Off"-Neurone - die
Ganglienzelle reagiert auf Kontraste zwischen Zentrum und Peripherie
ihres Feldes Fixierte Gegenstandspunkte werden auf der fovea centralis abgebildet (Auflösung ~1
Bogenminute) - diese enthält nur Zapfen (skotopisches Zentralskotom).
Die Signalübertragung auf bipolare und Ganglienzellen ergibt rezeptive
Felder, definiert als die kreisförmige bis ovale Netzhautfläche, von
der aus Einflüsse auf eine Ganglienzelle konvergieren. Der Durchmesser
rezeptiver Felder nimmt von einer
Bogenminute (fovea) bis zu ~4 Bogengrade (Netzhautperipherie) zu.
Zapfendominierte rezeptive Felder haben "On-" oder "Off"-Neurone - die
Ganglienzelle reagiert auf Kontraste zwischen Zentrum und Peripherie
ihres Feldes
 On-Bipolarzellen werden durch Glutamat gehemmt (G-Protein → Abbau von cGMP → Hyperpolarisierung),
Off-Bipolarzellen angeregt
(ionotrope Glutamatrezeptoren → Depolarisierung). Stäbchen nutzen nur
einen "On"-Mechanismus. Rezeptive Felder können farbantagonistisch
(parvozelluläres System)
oder helligkeitskodierend (magnozelluläres System) organisiert sein.
Horizontalzellen bauen zur Kontrastverstärkung Querverbindungen
zwischen Photorezeptoren auf (laterale Hermmung), Amakrinzellen laterale Verknüpfungen zwischen bipolaren und
Ganglienzellen On-Bipolarzellen werden durch Glutamat gehemmt (G-Protein → Abbau von cGMP → Hyperpolarisierung),
Off-Bipolarzellen angeregt
(ionotrope Glutamatrezeptoren → Depolarisierung). Stäbchen nutzen nur
einen "On"-Mechanismus. Rezeptive Felder können farbantagonistisch
(parvozelluläres System)
oder helligkeitskodierend (magnozelluläres System) organisiert sein.
Horizontalzellen bauen zur Kontrastverstärkung Querverbindungen
zwischen Photorezeptoren auf (laterale Hermmung), Amakrinzellen laterale Verknüpfungen zwischen bipolaren und
Ganglienzellen
 Die Netzhaut enthält Ganglienzellen des parvozellulären (P-Zellen, ~80%
der retinalen Ganglienzellen), des magnozellulären (M-Zellen, ~10%) und
des koniozellulären Systems. Das parvozelluläre
System hat kleine, farbempfindliche, schwach adaptierende rezeptive
Felder mit hohem räumlichem Auflösungsvermögen; es projiziert auf
dorsale Kernschichten (3 bis 6) des corpus geniculatum laterale und
dient räumlicher Auflösung, Detail-, Farben- und Objekterkennung). Das magnozelluläre System hat große, nicht farbempfindliche, rasch adaptierende rezeptive Felder mit
hohem zeitlichem Auflösungsvermögen; es projiziert auf ventrale Kernschichten (1 und 2) des corpus
geniculatum laterale und dient der Analyse von Position und Bewegung
Die Netzhaut enthält Ganglienzellen des parvozellulären (P-Zellen, ~80%
der retinalen Ganglienzellen), des magnozellulären (M-Zellen, ~10%) und
des koniozellulären Systems. Das parvozelluläre
System hat kleine, farbempfindliche, schwach adaptierende rezeptive
Felder mit hohem räumlichem Auflösungsvermögen; es projiziert auf
dorsale Kernschichten (3 bis 6) des corpus geniculatum laterale und
dient räumlicher Auflösung, Detail-, Farben- und Objekterkennung). Das magnozelluläre System hat große, nicht farbempfindliche, rasch adaptierende rezeptive Felder mit
hohem zeitlichem Auflösungsvermögen; es projiziert auf ventrale Kernschichten (1 und 2) des corpus
geniculatum laterale und dient der Analyse von Position und Bewegung
 Räumliches Sehen wird u.a. durch Binokularsehen unterstützt. Die auf
die Netzhaut beider Augen projizierten Bilder der Umwelt sind
unterschiedlich. Nur auf dem Horopter (einer gekrümmten horizontalen
Linie) liegen Punkte, die auf korrespondierende Netzhautpunkte
(deckungsgleich) abgebildet werden. Alle anderen fallen auf nicht
korrespondierende Netzhautstellen (unterschiedliche Entfernung von der
fovea centralis): Sie sind querdisparat. Aus dem Ausmaß der
Querdisparation - soferne diese nicht zu stark ist (Panum-Areal um den
Horopter) - rechnet das Gehirn in räumliche Tiefe um; ist die
Querdisparation zu stark, entstehen Doppelbilder
Räumliches Sehen wird u.a. durch Binokularsehen unterstützt. Die auf
die Netzhaut beider Augen projizierten Bilder der Umwelt sind
unterschiedlich. Nur auf dem Horopter (einer gekrümmten horizontalen
Linie) liegen Punkte, die auf korrespondierende Netzhautpunkte
(deckungsgleich) abgebildet werden. Alle anderen fallen auf nicht
korrespondierende Netzhautstellen (unterschiedliche Entfernung von der
fovea centralis): Sie sind querdisparat. Aus dem Ausmaß der
Querdisparation - soferne diese nicht zu stark ist (Panum-Areal um den
Horopter) - rechnet das Gehirn in räumliche Tiefe um; ist die
Querdisparation zu stark, entstehen Doppelbilder
 Gesichtsfeld heißt der bei unbewegtem Blick wahrnehmbare Teil der
Umwelt; seine Bestimmung heißt Perimetrie. Mit einem Hohlkugelperimeter
werden exakte Bestimmungen in Bezug auf Ort, Größe, Helligkeit und
Farbe eines optischen Reizes vorgenommen, das Ergebnis auf einem
Perimetrieblatt aufgezeichnet. So lassen sich fleckförmige (Skotome),
Halbseiten- (nasal, temporal) und andere Ausfälle präzisieren. Der
blinde Fleck liegt 15 Bogengrade nasal von der fovea centralis (in der
perimetrischen Untersuchung 15° temporal zum Fixationspunkt)
Gesichtsfeld heißt der bei unbewegtem Blick wahrnehmbare Teil der
Umwelt; seine Bestimmung heißt Perimetrie. Mit einem Hohlkugelperimeter
werden exakte Bestimmungen in Bezug auf Ort, Größe, Helligkeit und
Farbe eines optischen Reizes vorgenommen, das Ergebnis auf einem
Perimetrieblatt aufgezeichnet. So lassen sich fleckförmige (Skotome),
Halbseiten- (nasal, temporal) und andere Ausfälle präzisieren. Der
blinde Fleck liegt 15 Bogengrade nasal von der fovea centralis (in der
perimetrischen Untersuchung 15° temporal zum Fixationspunkt)
 Elektroretinographie (ERG) zeigt die elektrische Summenantwort (~0,1
mV) der Netzhaut auf einen Lichtreiz (ein- bis zweiphasige
Potentialschwankung je nach Lichtintensität) bei hell- oder
dunkeladaptierten Probanden zwecks Testung des Zapfen- bzw.
Stäbchensystems. Netzhautschädigungen können veränderte
ERG-Lichtreaktionen bedingen
Elektroretinographie (ERG) zeigt die elektrische Summenantwort (~0,1
mV) der Netzhaut auf einen Lichtreiz (ein- bis zweiphasige
Potentialschwankung je nach Lichtintensität) bei hell- oder
dunkeladaptierten Probanden zwecks Testung des Zapfen- bzw.
Stäbchensystems. Netzhautschädigungen können veränderte
ERG-Lichtreaktionen bedingen |

 Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.
Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.





 Photosensitive Zellen
Photosensitive Zellen  Phototransduktion
Phototransduktion  Pigmentepithel
Pigmentepithel  Adaptation
Adaptation  Physiologie der Retina
Physiologie der Retina  P-, M- und koniozelluläres System
P-, M- und koniozelluläres System  Sehnervenkreuzung
Sehnervenkreuzung  Räumliches Sehen
Räumliches Sehen  Perimetrie
Perimetrie  Elektroretinographie
Elektroretinographie
 Lichtstärke
Lichtstärke  Photopsine, Iodopsine, Skotopsine
Photopsine, Iodopsine, Skotopsine  Rezeptives Feld
Rezeptives Feld  Gesichtsfeld
Gesichtsfeld
 Core messages
Core messages ) ist ein dünner (0,2 mm) vorgelagerter Teil des Gehirns, mit dem sie über den II. Hirnnerven (N. opticus)
verbunden ist. Ihre Ganglienzellen senden Impulse zum Thalamus.
Zwischen den Rezeptorzellen (Photorezeptoren: Stäbchen, Zapfen) liegen
meist mehrere Schichten von Begleitzellen für "vertikale" und
"horizontale" Verschaltungen, die aber so gut wie durchsichtig sind und
die Entstehung des Netzhautbildes kaum beeinflussen. Auch zieht ein
Netzwerk von Blutgefäßen durch die Netzhaut, was die optische
Wahrnehmung der Umwelt ebenfalls nicht stört. Eine Stelle ("blinder
Fleck") verfügt über gar keine Photorezeptoren, das Gehirn rechnet für
diese Fläche einfach die optischen Eigenschaften der Nachbarbezirke
hoch - es entsteht der Eindruck eines durchgehenden Bildes (perceptual interpolation).
) ist ein dünner (0,2 mm) vorgelagerter Teil des Gehirns, mit dem sie über den II. Hirnnerven (N. opticus)
verbunden ist. Ihre Ganglienzellen senden Impulse zum Thalamus.
Zwischen den Rezeptorzellen (Photorezeptoren: Stäbchen, Zapfen) liegen
meist mehrere Schichten von Begleitzellen für "vertikale" und
"horizontale" Verschaltungen, die aber so gut wie durchsichtig sind und
die Entstehung des Netzhautbildes kaum beeinflussen. Auch zieht ein
Netzwerk von Blutgefäßen durch die Netzhaut, was die optische
Wahrnehmung der Umwelt ebenfalls nicht stört. Eine Stelle ("blinder
Fleck") verfügt über gar keine Photorezeptoren, das Gehirn rechnet für
diese Fläche einfach die optischen Eigenschaften der Nachbarbezirke
hoch - es entsteht der Eindruck eines durchgehenden Bildes (perceptual interpolation).  Abbildung unten), d.h. das Licht durchdringt
alle anderen, bevor es an die Außensegmente der Zapfen und Stäbchen
gelangt. Dazu kommen fotosensible Ganglienzellen in der Innenschicht der Retina.
Abbildung unten), d.h. das Licht durchdringt
alle anderen, bevor es an die Außensegmente der Zapfen und Stäbchen
gelangt. Dazu kommen fotosensible Ganglienzellen in der Innenschicht der Retina. Abbildung):
Abbildung):
 Abbildung: Verteilung von Rezeptorzellen auf der Netzhaut
Abbildung: Verteilung von Rezeptorzellen auf der Netzhaut Die macula lutea (der
gelbe Fleck, "anatomische Makula") ist ein querovaler Bezirk
(Gesamtdurchmesser 5,5 mm, entspricht 18 Bogengraden) der Netzhaut, der
in rotfreiem Licht gelblich erscheint (Carotinoide). Die macula besteht
aus der fovea centralis ("Netzhautgrube",
"klinische Makula", 1,5-1,9 mm Durchmesser - entspricht knapp 5
Bogengraden Ausdehnung, ungefähr 15° bis 20° nasal von der Stelle des
schärfsten Sehens gelegen) mit der zentralen foveola (Stelle des schärfsten Sehens, Durchmesser 0,35 mm, avaskulär, enthält nur - einzeln innervierte - Zapfen sowie Müller-Zellen), welche die kleinsten rezeptiven Felder aufweist; einem 0,5 mm breiten umgebenden Ring (Parafovea) mit einem Zapfen/Stäbchen-Verhältnis von ~1:1; und einer äußeren Randzone, der Perifovea, mit wesentlich geringerer Zapfendichte.
Die macula lutea (der
gelbe Fleck, "anatomische Makula") ist ein querovaler Bezirk
(Gesamtdurchmesser 5,5 mm, entspricht 18 Bogengraden) der Netzhaut, der
in rotfreiem Licht gelblich erscheint (Carotinoide). Die macula besteht
aus der fovea centralis ("Netzhautgrube",
"klinische Makula", 1,5-1,9 mm Durchmesser - entspricht knapp 5
Bogengraden Ausdehnung, ungefähr 15° bis 20° nasal von der Stelle des
schärfsten Sehens gelegen) mit der zentralen foveola (Stelle des schärfsten Sehens, Durchmesser 0,35 mm, avaskulär, enthält nur - einzeln innervierte - Zapfen sowie Müller-Zellen), welche die kleinsten rezeptiven Felder aufweist; einem 0,5 mm breiten umgebenden Ring (Parafovea) mit einem Zapfen/Stäbchen-Verhältnis von ~1:1; und einer äußeren Randzone, der Perifovea, mit wesentlich geringerer Zapfendichte. Unter Lichtstärke (luminous intensity) versteht man den von einer Lichtquelle ausgehenden Lichtstrom
("Helligkeit", Strahlungsfluss, Strahlungsleistung: Energie pro Zeit,
Einheit Watt), bezogen auf den Raumwinkel.
Unter Lichtstärke (luminous intensity) versteht man den von einer Lichtquelle ausgehenden Lichtstrom
("Helligkeit", Strahlungsfluss, Strahlungsleistung: Energie pro Zeit,
Einheit Watt), bezogen auf den Raumwinkel.  : 1 Cd = 1 Lumen (lm) pro Steradiant (sr).
: 1 Cd = 1 Lumen (lm) pro Steradiant (sr).  Luminanz ist ein Maß für die Helligkeit: Entspricht der Leuchtdichte - Candela / m2. Beispiel: Eine typische 15-W-Leuchtstoffröhre liefert etwa
650 Lumen und eine Leuchtdichte von 7000 cd / m2.
Luminanz ist ein Maß für die Helligkeit: Entspricht der Leuchtdichte - Candela / m2. Beispiel: Eine typische 15-W-Leuchtstoffröhre liefert etwa
650 Lumen und eine Leuchtdichte von 7000 cd / m2. Abbildung):
Abbildung):  Im Bereich der fovea centralis
(Stelle des höchsten Auflösungsvermögens, d.h. des schärfsten Sehens)
findet man nur Zapfen (dicht gepackt - etwa 140.000 pro mm2);
Im Bereich der fovea centralis
(Stelle des höchsten Auflösungsvermögens, d.h. des schärfsten Sehens)
findet man nur Zapfen (dicht gepackt - etwa 140.000 pro mm2);  die höchste Stäbchendichte liegt bei ~20° um die
fovea.
die höchste Stäbchendichte liegt bei ~20° um die
fovea.  Dass auf der Netzhaut ein umgekehrtes Bild der Umwelt entsteht, wird schon 1604 von Johannes Kepler beschrieben. Einige Jahre später entwickelt Christoph Scheiner
optische Geräte, die u.a. mittels Doppelbildern zur Klärung des
Strahlenganges im Auge beitragen ("Scheiner'sche Latte"). 1876 entdeckt
Franz Boll das Rhodopsin. Shinobu Ishihara veröffentlicht 1916 einen aus 38 Tafeln bestehenden Test zur Prüfung auf Farbenblindheit ("Ishihara-Tafeln").
Dass auf der Netzhaut ein umgekehrtes Bild der Umwelt entsteht, wird schon 1604 von Johannes Kepler beschrieben. Einige Jahre später entwickelt Christoph Scheiner
optische Geräte, die u.a. mittels Doppelbildern zur Klärung des
Strahlenganges im Auge beitragen ("Scheiner'sche Latte"). 1876 entdeckt
Franz Boll das Rhodopsin. Shinobu Ishihara veröffentlicht 1916 einen aus 38 Tafeln bestehenden Test zur Prüfung auf Farbenblindheit ("Ishihara-Tafeln").
 Abbildung: Photorezeptoren in der Netzhaut
Abbildung: Photorezeptoren in der Netzhaut
 Zapfen (cones) - S-Zapfen bei ~420, M-Zapfen bei ~530, L-Zapfen bei ~560 nm (photopisches Sehen insgesamt bei ~550 nm). Sehpigment ist S-, M- und L-Photopsin
Zapfen (cones) - S-Zapfen bei ~420, M-Zapfen bei ~530, L-Zapfen bei ~560 nm (photopisches Sehen insgesamt bei ~550 nm). Sehpigment ist S-, M- und L-Photopsin Stäbchen (rods) für skotopisches Sehen bei ~500 nm. Sehpigment ist das Rhodopsin
Stäbchen (rods) für skotopisches Sehen bei ~500 nm. Sehpigment ist das Rhodopsin Photosensitive Ganglienzellen (intrinsically photoreceptive retinal ganglion cells, ipRGCs) - Melanopsin verleiht ihnen die größte Empfindlichkeit bei 460-480 nm.
Photosensitive Ganglienzellen (intrinsically photoreceptive retinal ganglion cells, ipRGCs) - Melanopsin verleiht ihnen die größte Empfindlichkeit bei 460-480 nm.
 Abbildung: Spektrale Empfindlichkeit von Zapfen und Stäbchen
Abbildung: Spektrale Empfindlichkeit von Zapfen und Stäbchen
 Abbildung unten):
Abbildung unten):  Einem pigmentepithelnahen Außensegment (outer segment) - einem stark modifizierten Zilium - mit bis zu 1000 membranösen Scheiben (discs), an denen die visuelle Signaltransduktion stattfindet,
Einem pigmentepithelnahen Außensegment (outer segment) - einem stark modifizierten Zilium - mit bis zu 1000 membranösen Scheiben (discs), an denen die visuelle Signaltransduktion stattfindet, einem Verbindungsteil (connecting cilium),
einem Verbindungsteil (connecting cilium), einem metabolisch besonders aktiven Innensegment (inner segment) mit
zahlreichen Mitochondrien, welche der Energieversorgung der Zelle
dienen, und endoplasmatischem Retikulum, das Proteine nachsynthetisiert,
einem metabolisch besonders aktiven Innensegment (inner segment) mit
zahlreichen Mitochondrien, welche der Energieversorgung der Zelle
dienen, und endoplasmatischem Retikulum, das Proteine nachsynthetisiert, einer - über ein kurzes Axon mit dem Innensegment verbundene - Endzone mit synaptischen Endigungen (mit bandförmigen ribbon synapses), an denen der Transmitter an die angeschlossene(n) Bipolarzelle(n) freigesetzt wird.
einer - über ein kurzes Axon mit dem Innensegment verbundene - Endzone mit synaptischen Endigungen (mit bandförmigen ribbon synapses), an denen der Transmitter an die angeschlossene(n) Bipolarzelle(n) freigesetzt wird. Zapfen (cones) sind für hohe Lichtstärke (photopisches
Zapfen (cones) sind für hohe Lichtstärke (photopisches  Sehen - gleichzeitig Farberkennen). Das Sehpigment der Zapfen sind die Photopsine - Proteine, die ein Chromophor
Sehen - gleichzeitig Farberkennen). Das Sehpigment der Zapfen sind die Photopsine - Proteine, die ein Chromophor
 (einen farbgebenden Stoff) gebunden haben, und zwar 11-cis-Retinal.
Ihre Absorptionsmaxima liegen (
(einen farbgebenden Stoff) gebunden haben, und zwar 11-cis-Retinal.
Ihre Absorptionsmaxima liegen ( Abbildung)
Abbildung) bei ~560 nm (rot-sensitives L-Iodopsin mit
L-Photopsin; L für Long wave),
bei ~560 nm (rot-sensitives L-Iodopsin mit
L-Photopsin; L für Long wave),  bei ~530 nm (grün-sensitives M-Iodopsin mit M-Photopsin; M für Medium wave) und
bei ~530 nm (grün-sensitives M-Iodopsin mit M-Photopsin; M für Medium wave) und
 bei ~420 nm (blau-sensitives S-Iodopsin mit S-Photopsin; S für Short wave).
bei ~420 nm (blau-sensitives S-Iodopsin mit S-Photopsin; S für Short wave).  Stäbchen
(rods) für niedrige Lichtstärke (skotopisches
Stäbchen
(rods) für niedrige Lichtstärke (skotopisches  Sehen - "unbunt", ohne
Farbunterscheidung) zuständig. Das Sehpigment der Stäbchen ist das Rhodopsin
Sehen - "unbunt", ohne
Farbunterscheidung) zuständig. Das Sehpigment der Stäbchen ist das Rhodopsin  (
( Abbildung) - ebenfalls ein Protein, das mit 11-cis-Retinal kombiniert ist; das Absorptionsmaximum liegt bei ~500 nm (exakt: 498 nm).
Abbildung) - ebenfalls ein Protein, das mit 11-cis-Retinal kombiniert ist; das Absorptionsmaximum liegt bei ~500 nm (exakt: 498 nm). Abbildung). Dessen "Flop" von der 11-cis- zur
11-trans-Konfiguration ist der einzige lichtabhängige Schritt der
Phototransduktion.
Abbildung). Dessen "Flop" von der 11-cis- zur
11-trans-Konfiguration ist der einzige lichtabhängige Schritt der
Phototransduktion.
 Abbildung: Sehpigment in Stäbchen
Abbildung: Sehpigment in Stäbchen
 Abbildung), was die spektrale Empfindlichkeit
des Photopsins beeinflusst. Der "Flop" von der 11-cis- zur
All-Trans-Konfiguration
des Retinals ist der einzige lichtabhängige Schritt der
Phototransduktion.
Abbildung), was die spektrale Empfindlichkeit
des Photopsins beeinflusst. Der "Flop" von der 11-cis- zur
All-Trans-Konfiguration
des Retinals ist der einzige lichtabhängige Schritt der
Phototransduktion. Zapfen-Opsine werden im ungebundenen Zustand Photopsine genannt, an Retinal gebunden heißen sie Iodopsine (Jodopsine). Stäbchen-Opsine werden im ungebundenen Zustand Skotopsine genannt, an Retinal gebunden heißen sie Rhodopsine (auch Porphyropsine).
Zapfen-Opsine werden im ungebundenen Zustand Photopsine genannt, an Retinal gebunden heißen sie Iodopsine (Jodopsine). Stäbchen-Opsine werden im ungebundenen Zustand Skotopsine genannt, an Retinal gebunden heißen sie Rhodopsine (auch Porphyropsine).
 Abbildung: Vergleich der Aminosäuresequenzen des Opsins
Abbildung: Vergleich der Aminosäuresequenzen des Opsins
 Abbildung). Das Gehirn
kann das aber auseinanderhalten und "verwechselt" nicht 520 mit 600 nm: Es ordnet die Farben korrekt zu, indem es die Gesamtheit
der Information von der Netzhaut berücksichtigt (auch die
Erregungsmuster der Grün- und Blau- Rezeptoren).
Abbildung). Das Gehirn
kann das aber auseinanderhalten und "verwechselt" nicht 520 mit 600 nm: Es ordnet die Farben korrekt zu, indem es die Gesamtheit
der Information von der Netzhaut berücksichtigt (auch die
Erregungsmuster der Grün- und Blau- Rezeptoren).  Das Gehirn integriert verschiedene Reizkomponenten zu einem
durch Analyse mehrfacher Sinnesinputs "abgesicherten" Ensemble.
Das Gehirn integriert verschiedene Reizkomponenten zu einem
durch Analyse mehrfacher Sinnesinputs "abgesicherten" Ensemble.
 In sehr lichtschwacher Umgebung (nur Stäbchen: skotopisches
Sehen)
empfindet man grünliche Gegenstände als
die hellsten (Empfindlichkeitsmaximum bei 500 nm - die Farbe erkennt man aber nicht, weil Zapfen bei dieser Lichtintensität nicht erregt werden).
In sehr lichtschwacher Umgebung (nur Stäbchen: skotopisches
Sehen)
empfindet man grünliche Gegenstände als
die hellsten (Empfindlichkeitsmaximum bei 500 nm - die Farbe erkennt man aber nicht, weil Zapfen bei dieser Lichtintensität nicht erregt werden).  Steigt die Beleuchtungsstärke (Zapfen werden aktiv: photopisches Sehen),
erscheinen gelbliche Objekte als die hellsten (spektrales Empfindlichkeitsmaximum des Zapfensystems bei 550 nm: Purkinje-Verschiebung um ca. 50 nm).
Steigt die Beleuchtungsstärke (Zapfen werden aktiv: photopisches Sehen),
erscheinen gelbliche Objekte als die hellsten (spektrales Empfindlichkeitsmaximum des Zapfensystems bei 550 nm: Purkinje-Verschiebung um ca. 50 nm). Eine dritte Gruppe von Sinneszellen liegt im Gegensatz zu Zapfen und Stäbchen in der innersten Zellschichte der Netzhaut. Es sind Ganglienzellen (photosensitive Ganglienzellen, intrinsically photosensitive retinal ganglion cells ipRGC, Empfindlichkeitsmaximum bei ca. 470 nm). Diese speziellen Neuronen verwenden als Sehpigment Melanopsin (Empfindlichkeitsmaximum bei 475 nm, also im Blaubereich des Spektrums). Die Signalkette geht über ein Gq-Protein, Phospholipase C, IP3 / DAG und TRP-Kanäle; diese öffnen und depolarisieren die Zelle.
Eine dritte Gruppe von Sinneszellen liegt im Gegensatz zu Zapfen und Stäbchen in der innersten Zellschichte der Netzhaut. Es sind Ganglienzellen (photosensitive Ganglienzellen, intrinsically photosensitive retinal ganglion cells ipRGC, Empfindlichkeitsmaximum bei ca. 470 nm). Diese speziellen Neuronen verwenden als Sehpigment Melanopsin (Empfindlichkeitsmaximum bei 475 nm, also im Blaubereich des Spektrums). Die Signalkette geht über ein Gq-Protein, Phospholipase C, IP3 / DAG und TRP-Kanäle; diese öffnen und depolarisieren die Zelle.
 Abbildung:
Testung des Farbsehvermögens (Sehprobentafel: Beispiel)
Abbildung:
Testung des Farbsehvermögens (Sehprobentafel: Beispiel)
 Rot-(L)-Zapfen (L für langwellig) haben die größte spektrale
Empfindlichkeit bei 564 nm (Nanometer = Millionstel Millimeter) - stärkste Lichtabsorption bei 560-570 nm.
Rot-(L)-Zapfen (L für langwellig) haben die größte spektrale
Empfindlichkeit bei 564 nm (Nanometer = Millionstel Millimeter) - stärkste Lichtabsorption bei 560-570 nm.  oder Rotblindheit (Häufigkeit 1% der Bevölkerung), eine Schwächung Protanomalie oder Rotschwäche (1%).
oder Rotblindheit (Häufigkeit 1% der Bevölkerung), eine Schwächung Protanomalie oder Rotschwäche (1%).  Grün-(M)-Zapfen (M für mittlere Wellenlänge) bei 533 nm - stärkste Lichtabsorption bei 530-540 nm.
Grün-(M)-Zapfen (M für mittlere Wellenlänge) bei 533 nm - stärkste Lichtabsorption bei 530-540 nm.  oder Grünblindheit (1%), eine Schwächung Deuteranomalie oder Grünschwäche (5% - häufigste Farbsinnstörung).
oder Grünblindheit (1%), eine Schwächung Deuteranomalie oder Grünschwäche (5% - häufigste Farbsinnstörung). Blau-(K)-Zapfen (K für kurzwellig) bei 437 nm - stärkste Lichtabsorption bei 430-440 nm. K-Zapfen machen nur etwa 10% aller Zapfen aus; in der fovea centralis fehlen sie ganz.
Blau-(K)-Zapfen (K für kurzwellig) bei 437 nm - stärkste Lichtabsorption bei 430-440 nm. K-Zapfen machen nur etwa 10% aller Zapfen aus; in der fovea centralis fehlen sie ganz.  oder Blau-Gelb-Blindheit, eine Schwächung Tritanomalie oder Blau-Gelb-Schwäche (beide Formen sind selten).
oder Blau-Gelb-Blindheit, eine Schwächung Tritanomalie oder Blau-Gelb-Schwäche (beide Formen sind selten). pseudoisochromatischen Tafeln
(nach Ishihara oder nach Stilling-Velhagen), die aus Punkten aus
"Verwechslungsfarben" bestehen (
pseudoisochromatischen Tafeln
(nach Ishihara oder nach Stilling-Velhagen), die aus Punkten aus
"Verwechslungsfarben" bestehen ( Abbildung), sodass betroffene
Personen farbcodierte Zahlen oder Buchstaben - die Farbtüchtige spontan
erkennen - in diesem Muster nicht sehen können
Abbildung), sodass betroffene
Personen farbcodierte Zahlen oder Buchstaben - die Farbtüchtige spontan
erkennen - in diesem Muster nicht sehen können Anomaloskopen:
Geräten, welche die Mischung spektraler Grundfarben (Rot, Grün) auf
subjektive Eindrucksgleichheit mit einer monochromatischen Bezugsfarbe
(spektrales Gelb) erlauben. Das Mischungsverhältnis, das Normalsichtige
zur Erzielung des Eindrucks "gelb" wählen, dient als Bezugsgröße.
Beispielsweise braucht eine protanomale Person mehr "Rot", um (mit
ihrem geschwächten Rotsinn) den Eindruck "gelb" zu erzielen.
Anomaloskopen:
Geräten, welche die Mischung spektraler Grundfarben (Rot, Grün) auf
subjektive Eindrucksgleichheit mit einer monochromatischen Bezugsfarbe
(spektrales Gelb) erlauben. Das Mischungsverhältnis, das Normalsichtige
zur Erzielung des Eindrucks "gelb" wählen, dient als Bezugsgröße.
Beispielsweise braucht eine protanomale Person mehr "Rot", um (mit
ihrem geschwächten Rotsinn) den Eindruck "gelb" zu erzielen.

 Abbildung: Phototransduktion
Abbildung: Phototransduktion Abbildung), die Glutamatfreisetzung nimmt ab
Abbildung), die Glutamatfreisetzung nimmt ab
 Abbildung):
Abbildung): In
Dunkelheit dringen durch CNG-Kanäle
(cyclic-nucleotide gated ion channels) der photorezeptiven Außensegmente laufend Kationen (Na+, Ca++) ein (Dunkelstrom, dark current) und depolarisieren sie
dadurch auf ~ -40mV. Durch die konstitutive Aktivität von Guanylatzyklase wird fortwährend cGMP gebildet, das an die CNG-Kanäle bindet und diese offen hält.
In
Dunkelheit dringen durch CNG-Kanäle
(cyclic-nucleotide gated ion channels) der photorezeptiven Außensegmente laufend Kationen (Na+, Ca++) ein (Dunkelstrom, dark current) und depolarisieren sie
dadurch auf ~ -40mV. Durch die konstitutive Aktivität von Guanylatzyklase wird fortwährend cGMP gebildet, das an die CNG-Kanäle bindet und diese offen hält.  Glutamat wird von den Photorezeptoren im Dunkeln laufend von ihren präsynaptischen Endigungen freigesetzt.
Glutamat wird von den Photorezeptoren im Dunkeln laufend von ihren präsynaptischen Endigungen freigesetzt. Abbildung):
Abbildung): 
 Abbildung: Signaltransduktion in einem Stäbchen
Abbildung: Signaltransduktion in einem Stäbchen
 Lichteinfall hebt das Rhodopsinmolekül auf eine höhere Energiestufe, es kommt zu Stereoisomerisation (Gestaltsveränderung) von 11-cis zu all-trans-Retinal. Über Zwischenstufen entsteht die
kurzlebige Zwischenform Metarhodopsin.
Lichteinfall hebt das Rhodopsinmolekül auf eine höhere Energiestufe, es kommt zu Stereoisomerisation (Gestaltsveränderung) von 11-cis zu all-trans-Retinal. Über Zwischenstufen entsteht die
kurzlebige Zwischenform Metarhodopsin. Abbildung).
Abbildung).
 Abbildung: Kationenströme durch einen Photorezeptor bei Dunkelheit
Abbildung: Kationenströme durch einen Photorezeptor bei Dunkelheit cGMP-gesteuerte Kationenkanäle (CNG-Kanäle) im Außensegment werden bei geringer Belichtung der Photorezeptorzelle durch hohes intrazelluläres [cGMP] offen gehalten, was zum Enstrom von Ca++ und vor allem von Na+ führt - eine für das Außensegment von Stäbchen und Zapfen spezifische Ausstattung.
cGMP-gesteuerte Kationenkanäle (CNG-Kanäle) im Außensegment werden bei geringer Belichtung der Photorezeptorzelle durch hohes intrazelluläres [cGMP] offen gehalten, was zum Enstrom von Ca++ und vor allem von Na+ führt - eine für das Außensegment von Stäbchen und Zapfen spezifische Ausstattung. Die Membran des Innensegments ist - wie auch in anderen Zellen üblich - mit Na/K-ATPasen (diese halten die Ionenkonzentrationen in der Zelle stabil) und Kaliumkanälen ausgestattet (durch sie strömen Kaliumionen aus der Zelle und laden sie auf).
Die Membran des Innensegments ist - wie auch in anderen Zellen üblich - mit Na/K-ATPasen (diese halten die Ionenkonzentrationen in der Zelle stabil) und Kaliumkanälen ausgestattet (durch sie strömen Kaliumionen aus der Zelle und laden sie auf). 
 die CNG-Kanäle nicht weiter aktiviert werden,
die CNG-Kanäle nicht weiter aktiviert werden,  der
Kationeneinstrom in die Zelle versiegt,
der
Kationeneinstrom in die Zelle versiegt,  die intrazelluläre Na+- und Ca++-Konzentration sinkt, und
die intrazelluläre Na+- und Ca++-Konzentration sinkt, und  das Membranpotential
von ~ -40 mV auf bis zu ~ -80 mV steigt (hyperpolarisierendes Rezeptorpotential - eine Eigenheit von Photorezeptorzellen). Das
Rezeptorpotential setzt sich elektrotonisch vom Außen- zum Innensegment
fort (
das Membranpotential
von ~ -40 mV auf bis zu ~ -80 mV steigt (hyperpolarisierendes Rezeptorpotential - eine Eigenheit von Photorezeptorzellen). Das
Rezeptorpotential setzt sich elektrotonisch vom Außen- zum Innensegment
fort ( Abbildung)
Abbildung) Die Freisetzung von Glutamat an den Synapsen mit Bipolarzellen nimmt ab - das ist das neuronale Signal.
Die Freisetzung von Glutamat an den Synapsen mit Bipolarzellen nimmt ab - das ist das neuronale Signal. Schon ein einzelnes Photon kann eine meßbare Antwort an einer einzelnen Rezeptorzelle auslösen.
Um einen Sinneseindruck auszulösen, reicht eine Veränderung des
Lichtflusses um einige Dutzend Photonen (entsprechend dem
Zusammenwirken von 5-7 Photonen, die jeweils einen Photorezeptor
reizen).
Schon ein einzelnes Photon kann eine meßbare Antwort an einer einzelnen Rezeptorzelle auslösen.
Um einen Sinneseindruck auszulösen, reicht eine Veränderung des
Lichtflusses um einige Dutzend Photonen (entsprechend dem
Zusammenwirken von 5-7 Photonen, die jeweils einen Photorezeptor
reizen).  Das erscheint paradox: Photorezeptoren sind in der Dunkelheit depolarisiert und bei Reizung durch Licht steigt das Membranpotential und die Transmitterfreisetzung sinkt - bei fast allen erregbaren Zellen folgt auf einen adäquaten Reiz eine Depolarisation. Daher wurde der Ausdruck "umgekehrte Lichtantwort"
geprägt. (Die nachgeschalteten Horizontal- und Bipolarzellen
"verstehen" die Botschaft und reagieren mit entsprechender Veränderung
ihrer Membranpotentiale.)
Das erscheint paradox: Photorezeptoren sind in der Dunkelheit depolarisiert und bei Reizung durch Licht steigt das Membranpotential und die Transmitterfreisetzung sinkt - bei fast allen erregbaren Zellen folgt auf einen adäquaten Reiz eine Depolarisation. Daher wurde der Ausdruck "umgekehrte Lichtantwort"
geprägt. (Die nachgeschalteten Horizontal- und Bipolarzellen
"verstehen" die Botschaft und reagieren mit entsprechender Veränderung
ihrer Membranpotentiale.) Regeneration des entstandenen All-trans-Retinols zu 11-cis-Retinal. Das bei der Phototransduktion entstandene All-trans-Retinal wird von Zellen des Pigmentepithels zu All-trans-Retinol (Vitamin A) reduziert. Dieses ist die Vorstufe des 11-cis-Retinal und wird an die Stäbchen retourniert. Der Regenerierungszyklus dauert einige Minuten.
Regeneration des entstandenen All-trans-Retinols zu 11-cis-Retinal. Das bei der Phototransduktion entstandene All-trans-Retinal wird von Zellen des Pigmentepithels zu All-trans-Retinol (Vitamin A) reduziert. Dieses ist die Vorstufe des 11-cis-Retinal und wird an die Stäbchen retourniert. Der Regenerierungszyklus dauert einige Minuten. Phagozytose von Membranmaterial der Photorezeptoren: Die oxidative Wirkung des Lichts auf die Außensegmente der Photorezeptorzellen unterwirft sie starkem Verschleiß. Pigmentepithelzellen umgreifen diese mit fingerartigen Fortsätzen (
Phagozytose von Membranmaterial der Photorezeptoren: Die oxidative Wirkung des Lichts auf die Außensegmente der Photorezeptorzellen unterwirft sie starkem Verschleiß. Pigmentepithelzellen umgreifen diese mit fingerartigen Fortsätzen ( Abbildung) und nehmen deren Membranmaterial auf (Recycling).
Abbildung) und nehmen deren Membranmaterial auf (Recycling). 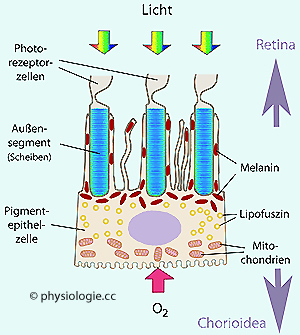
 Abbildung: Pigmentepithelzelle (schematisch)
Abbildung: Pigmentepithelzelle (schematisch)
 Lichtabsorption.
Pigmentepithelzellen fangen mittels ihrer Melanosomen Streulicht ein
und erhöhen dadurch einerseits die optische Qualität des
Netzhautbildes. Andererseits senken sie die oxidative Wirkung des
Lichts, das insbesondere im Makulabereich (der auch stark durchblutet
ist) konzentriert auf die Netzhaut trifft.
Lichtabsorption.
Pigmentepithelzellen fangen mittels ihrer Melanosomen Streulicht ein
und erhöhen dadurch einerseits die optische Qualität des
Netzhautbildes. Andererseits senken sie die oxidative Wirkung des
Lichts, das insbesondere im Makulabereich (der auch stark durchblutet
ist) konzentriert auf die Netzhaut trifft. Metabolische Stabilisierung. Pigmentepithelzellen
verleihen antioxidativen Schutz und transportieren Ionen, die bei der
Phototransduktion zwischen intra- und extrazellulärem Kompartiment
ausgetauscht werden.
Metabolische Stabilisierung. Pigmentepithelzellen
verleihen antioxidativen Schutz und transportieren Ionen, die bei der
Phototransduktion zwischen intra- und extrazellulärem Kompartiment
ausgetauscht werden.  Stoffaustausch. Das Pigmentepithel versorgt Photorezeptoren
mit Nährstoffen. Die basale Membran der
Pigmentepithelzellen ist zwecks besserem Stoffaustausch mit den Blutgefäßen der Chorioidea gefaltet (
Stoffaustausch. Das Pigmentepithel versorgt Photorezeptoren
mit Nährstoffen. Die basale Membran der
Pigmentepithelzellen ist zwecks besserem Stoffaustausch mit den Blutgefäßen der Chorioidea gefaltet ( Abbildung).
Abbildung).  Beteiligung am Immunprivileg des Auges:
Das Pigmentepithel baut eine dichte Barriere gegenüber dem
Blutkreislauf auf und kann mit dem Immunsystem in einer Weise
kommunizieren, dass es im gesunden Auge Immunaggression verhindert und
im Erkrankungsfall die Immunabwehr aktiviert.
Beteiligung am Immunprivileg des Auges:
Das Pigmentepithel baut eine dichte Barriere gegenüber dem
Blutkreislauf auf und kann mit dem Immunsystem in einer Weise
kommunizieren, dass es im gesunden Auge Immunaggression verhindert und
im Erkrankungsfall die Immunabwehr aktiviert. Pupillenreflex:
Dieser Mechanismus greift rasch (Zehntelsekunden).
Der Pupillendurchmesser kann zwischen ~1,5 (Miosis: Aktivität des m.
sphincter pupillae) und ~7,5 mm (Mydriasis: Aktivität des m. dilatator
pupillae) schwanken. Da Fläche = r2π,
entspricht das einem Flächenunterschied für den Lichtdurchtritt
(zwischen kompletter Miosis und Mydriasis) von 1:25.
Pupillenreflex:
Dieser Mechanismus greift rasch (Zehntelsekunden).
Der Pupillendurchmesser kann zwischen ~1,5 (Miosis: Aktivität des m.
sphincter pupillae) und ~7,5 mm (Mydriasis: Aktivität des m. dilatator
pupillae) schwanken. Da Fläche = r2π,
entspricht das einem Flächenunterschied für den Lichtdurchtritt
(zwischen kompletter Miosis und Mydriasis) von 1:25.  Retinale Adaptation: Hier wirken mehrere Mechanismen zusammen:
Retinale Adaptation: Hier wirken mehrere Mechanismen zusammen: Nutzung von Stäbchen (skotopisches Sehen, niedrige Lichtintensität) und Zapfen (photopisches Sehen, Farberkennung, hohe Lichtintensität) je nach Beleuchtungsstärke, zusätzlich neuronale Anpassung via Verschaltung über Horizontalzellen (von Zapfen- auf Stäbchensystem)
Nutzung von Stäbchen (skotopisches Sehen, niedrige Lichtintensität) und Zapfen (photopisches Sehen, Farberkennung, hohe Lichtintensität) je nach Beleuchtungsstärke, zusätzlich neuronale Anpassung via Verschaltung über Horizontalzellen (von Zapfen- auf Stäbchensystem) Photorezeptorzellen adaptieren über cGMP-Empfindlichkeit der CNG-Kanäle und veränderte Ca++-Wirkung
an Rhodopsinkinase: Die intrazelluläre Calciumkonzentration nimmt ab (cGMP-Kanäle schließen). Die volle Adaptation (von
hell auf dunkel) des skotopischen Systems (Zapfen) kann bis zu 30 Minuten in Anspruch nehmen
Photorezeptorzellen adaptieren über cGMP-Empfindlichkeit der CNG-Kanäle und veränderte Ca++-Wirkung
an Rhodopsinkinase: Die intrazelluläre Calciumkonzentration nimmt ab (cGMP-Kanäle schließen). Die volle Adaptation (von
hell auf dunkel) des skotopischen Systems (Zapfen) kann bis zu 30 Minuten in Anspruch nehmen In dunkler Umgebung wird weniger Photopigment verbraucht, seine Konzentration ist
hoch und die Empfindlichkeit steigt (photochemische Adaptation). Stärkere Beleuchtung führt zu Verbrauch ("Ausbleichen") von Sehfarbstoff und reduzierter Lichtempfindlichkeit. Niedriges [Ca++i]
erhöht die Aktivität der
Guanylatzyklase und hemmt die Phosphodiesterase, was den
lichtinduzierten Abfall des [cGMP] limitiert. So passt sich das
Photorezeptorsystem an höheren Lichtfluss an, reagiert aber dennoch
auch auf geringe Helligkeitsänderungen.
In dunkler Umgebung wird weniger Photopigment verbraucht, seine Konzentration ist
hoch und die Empfindlichkeit steigt (photochemische Adaptation). Stärkere Beleuchtung führt zu Verbrauch ("Ausbleichen") von Sehfarbstoff und reduzierter Lichtempfindlichkeit. Niedriges [Ca++i]
erhöht die Aktivität der
Guanylatzyklase und hemmt die Phosphodiesterase, was den
lichtinduzierten Abfall des [cGMP] limitiert. So passt sich das
Photorezeptorsystem an höheren Lichtfluss an, reagiert aber dennoch
auch auf geringe Helligkeitsänderungen.  Räumliche Summation:
Die Zentralzonen rezeptiver Felder vergrößern sich (auf Kosten der
Peripherie), wodurch größere Rezeptorzahlen zusammengeschaltet werden
und die Lichtempfindlichkeit steigt (auf Kosten des Auflösungsvermögens)
Räumliche Summation:
Die Zentralzonen rezeptiver Felder vergrößern sich (auf Kosten der
Peripherie), wodurch größere Rezeptorzahlen zusammengeschaltet werden
und die Lichtempfindlichkeit steigt (auf Kosten des Auflösungsvermögens) Zeitliche Summation: Verlängerung der Reizdauer macht auch schwächere Lichtreize überschwellig und damit wahrnehmbar
Zeitliche Summation: Verlängerung der Reizdauer macht auch schwächere Lichtreize überschwellig und damit wahrnehmbar
 Abbildung: Adaptationsverhalten des menschlichen Auges
Abbildung: Adaptationsverhalten des menschlichen Auges
 ) bemerkbar (
) bemerkbar ( Abbildung).
Abbildung). Abbildung: Netzhaut
Abbildung: Netzhaut bietet dem Ziliarkörper Verankerung und lässt Nährstoffe zwischen
Aderhaut und Pigmentepithel passieren. Mit zunehmendem Alter verdickt
sie sich und ihre Durchlässigkeit nimmt ab.
bietet dem Ziliarkörper Verankerung und lässt Nährstoffe zwischen
Aderhaut und Pigmentepithel passieren. Mit zunehmendem Alter verdickt
sie sich und ihre Durchlässigkeit nimmt ab. - sie nehmen z.B. Kalium auf, das bei der Aktivität neuronaler Zellen frei wird
- sie nehmen z.B. Kalium auf, das bei der Aktivität neuronaler Zellen frei wird
 Abbildung ganz oben) und
erlauben Farbunterscheidung (Farbperimetrie: Rot geringstes, blau
größtes Gesichtsfeld).
Abbildung ganz oben) und
erlauben Farbunterscheidung (Farbperimetrie: Rot geringstes, blau
größtes Gesichtsfeld). ON-Bipolarzellen tragen metabotrope Glutamatrezeptoren
(mGluR) in ihrer Membran, die Aktivierung der G-Protein-Kaskade
resultiert dann in einem Schließen von Kationenkanälen, und es findet
eine Umkehr des Effekts auf das Membranpotential statt: Lichteinfluss
(der den Photorezeptor hyperpolarisiert) führt zu Depolarisierung der Bipolarzelle.
ON-Bipolarzellen tragen metabotrope Glutamatrezeptoren
(mGluR) in ihrer Membran, die Aktivierung der G-Protein-Kaskade
resultiert dann in einem Schließen von Kationenkanälen, und es findet
eine Umkehr des Effekts auf das Membranpotential statt: Lichteinfluss
(der den Photorezeptor hyperpolarisiert) führt zu Depolarisierung der Bipolarzelle. OFF-Bipolarzellen exprimieren ionotrope Glutamatrezeptoren
(iGluR) und werden von Glutamat depolarisiert. Die "Vorzeichenumkehr"
bei der Verschaltung der Photorezeptor- auf die Bipolarzelle bleibt
aus, Lichteinfluss auf den Photorezeptor hyperpolarisiert auch die
Bipolarzelle.
OFF-Bipolarzellen exprimieren ionotrope Glutamatrezeptoren
(iGluR) und werden von Glutamat depolarisiert. Die "Vorzeichenumkehr"
bei der Verschaltung der Photorezeptor- auf die Bipolarzelle bleibt
aus, Lichteinfluss auf den Photorezeptor hyperpolarisiert auch die
Bipolarzelle. Die Verbindung zu Bipolarzellen erfolgt
an speziellen Synapsen (ribbon synapses). Bipolarzellen verbinden Photorezeptorzellen und Ganglienzellen in radiärer
Richtung, was in der Netzhautperipherie eine starke Konvergenz
ermöglicht (Zahlenverhältnis insgesamt 100:1). Die Verschaltung zu
retinalen Ganglienzellen erfolgt in einer Weise,
dass sich sensorische (rezeptive) Felder ergeben. Bipolarzellen
sind glutamaterg, sie aktivieren ionotrope Rezeptoren auf
Ganglienzellen: Depolarisation von Bipolarzellen führt immer zur
Depolarisation angekoppelter Ganglienzellen.
Die Verbindung zu Bipolarzellen erfolgt
an speziellen Synapsen (ribbon synapses). Bipolarzellen verbinden Photorezeptorzellen und Ganglienzellen in radiärer
Richtung, was in der Netzhautperipherie eine starke Konvergenz
ermöglicht (Zahlenverhältnis insgesamt 100:1). Die Verschaltung zu
retinalen Ganglienzellen erfolgt in einer Weise,
dass sich sensorische (rezeptive) Felder ergeben. Bipolarzellen
sind glutamaterg, sie aktivieren ionotrope Rezeptoren auf
Ganglienzellen: Depolarisation von Bipolarzellen führt immer zur
Depolarisation angekoppelter Ganglienzellen. Horizontalzellen
bauen laterale Verbindungen zwischen Photorezeptoren (Zapfen und
Stäbchen) auf (
Horizontalzellen
bauen laterale Verbindungen zwischen Photorezeptoren (Zapfen und
Stäbchen) auf ( Abbildung), also in äußeren
Retinagebieten. Diese Verschaltungen dienen der Interaktion
benachbarter Zellen in der Netzhaut, insbesondere der
Kontrastverstärkung (laterale Hermmung:
Aktivierte hemmen die Erregung benachbarter Zellen).
Horizontalzellen teilen mit Nachbarzellen nicht nur chemische Synapsen,
sie sind auch über gap junctions miteinander verbunden. So "mitteln"
sie die Luminanz, die auf ihr rezeptives Feld auf der Netzhaut
einwirkt. Dazu kommt, dass die Interaktion zwischen Photorezeptor-,
bipolaren und Horizontalzellen bei Stäbchen anders organisiert ist als
bei Zapfen.
Abbildung), also in äußeren
Retinagebieten. Diese Verschaltungen dienen der Interaktion
benachbarter Zellen in der Netzhaut, insbesondere der
Kontrastverstärkung (laterale Hermmung:
Aktivierte hemmen die Erregung benachbarter Zellen).
Horizontalzellen teilen mit Nachbarzellen nicht nur chemische Synapsen,
sie sind auch über gap junctions miteinander verbunden. So "mitteln"
sie die Luminanz, die auf ihr rezeptives Feld auf der Netzhaut
einwirkt. Dazu kommt, dass die Interaktion zwischen Photorezeptor-,
bipolaren und Horizontalzellen bei Stäbchen anders organisiert ist als
bei Zapfen. Innere
Netzhautareale enthalten amakrine Zellen
Innere
Netzhautareale enthalten amakrine Zellen  ,
von denen etwa 40 verschiedene Typen bekannt sind. Ihre Verzweigungen
beschränken sich auf die innere plexiforme Schicht (
,
von denen etwa 40 verschiedene Typen bekannt sind. Ihre Verzweigungen
beschränken sich auf die innere plexiforme Schicht ( Abbildung
oben). Sie erhalten von Bipolarzellen exzitatorische glutamaterge
Impulse und modulieren die Aktivität der Umschaltungen von Bipolar- auf Ganglienzellen via GABA- und glycinergen Synapsen.
Abbildung
oben). Sie erhalten von Bipolarzellen exzitatorische glutamaterge
Impulse und modulieren die Aktivität der Umschaltungen von Bipolar- auf Ganglienzellen via GABA- und glycinergen Synapsen.  Größe,
Größe,  Bewegung (Richtungsselektivität wird durch asymmetrische Hemmung durch Amakrinzellen aufgebaut),
Bewegung (Richtungsselektivität wird durch asymmetrische Hemmung durch Amakrinzellen aufgebaut),  Kontrast,
Kontrast, Farbe (Vergleich der Signale von Zapfen unterschiedlicher spektraler Empfindlichkeit).
Farbe (Vergleich der Signale von Zapfen unterschiedlicher spektraler Empfindlichkeit).
 Abbildung: OFF- und ON-Neurone reagieren auf Licht in entgegengesetzter Weise
Abbildung: OFF- und ON-Neurone reagieren auf Licht in entgegengesetzter Weise
 Ganglienzellen
sind die "Endabnehmer" der in der Netzhaut
aufbereiteten Information. Erst hier entstehen Aktionspotentiale, die
dann über den Sehnerven zum Gehirn geleitet werden. Ganglienzellen
fallen in zwei Kategorien: Solche, die auf Verstärkung des
Lichteinfalls in ihrem rezeptiven Bereich depolarisieren (ON-Neurone) und solche, die auf sinkenden Lichtstrom mit Depolarisierung reagieren (OFF-Neurone).
Ganglienzellen
sind die "Endabnehmer" der in der Netzhaut
aufbereiteten Information. Erst hier entstehen Aktionspotentiale, die
dann über den Sehnerven zum Gehirn geleitet werden. Ganglienzellen
fallen in zwei Kategorien: Solche, die auf Verstärkung des
Lichteinfalls in ihrem rezeptiven Bereich depolarisieren (ON-Neurone) und solche, die auf sinkenden Lichtstrom mit Depolarisierung reagieren (OFF-Neurone). 
 Abbildung: Reaktion von ON- und OFF-Ganglienzellen
Abbildung: Reaktion von ON- und OFF-Ganglienzellen
 Abbildung).
Abbildung). Abbildung):
Abbildung):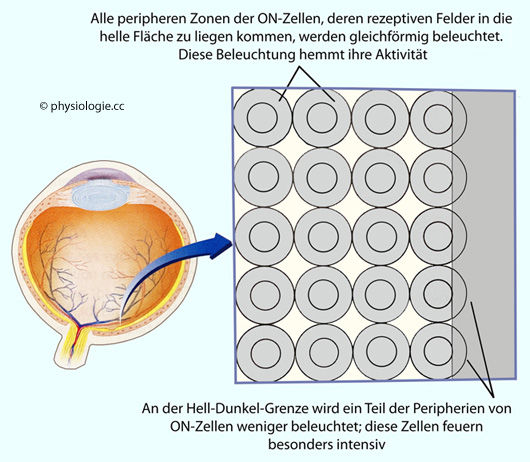
 Abbildung: Kontrastverstärkung (vereinfachtes Schema)
Abbildung: Kontrastverstärkung (vereinfachtes Schema)
 Abbildung
zeigt, bewirkt das Arrangement von ON- und OFF- Feldern / Neuronen mit
entgegengesetzt reagierenden Anteilen (Zentrum / Peripherie) erhöhte
Aktivität (Aktionspotentialfrequenz) der jeweiligen Anteile sowohl bei
Erhöhung als auch Verringerung des Lichtflusses an betreffenden
Netzhautstellen. Dies löst entsprechende Effekte an Hell-Dunkel-Grenzen
(Kontrastierung) und bei Verlagerung von Bildelementen über die
Netzhaut (Bewegungsanalyse) aus.
Abbildung
zeigt, bewirkt das Arrangement von ON- und OFF- Feldern / Neuronen mit
entgegengesetzt reagierenden Anteilen (Zentrum / Peripherie) erhöhte
Aktivität (Aktionspotentialfrequenz) der jeweiligen Anteile sowohl bei
Erhöhung als auch Verringerung des Lichtflusses an betreffenden
Netzhautstellen. Dies löst entsprechende Effekte an Hell-Dunkel-Grenzen
(Kontrastierung) und bei Verlagerung von Bildelementen über die
Netzhaut (Bewegungsanalyse) aus.
 Abbildung: Rezeptive Felder farbempfindlicher Ganglienzellen
Abbildung: Rezeptive Felder farbempfindlicher Ganglienzellen
 Abbildung.
Abbildung. 
 Abbildung: Farbcodierung in der Netzhaut
Abbildung: Farbcodierung in der Netzhaut
 Als rezeptives Feld bezeichnet
man in der Physiologie des Auges diejenige spezifische Region des visuellen Raums, von der aus Reize
auf informationsübertragende Zellen des visuellen Systems - retinale
Photorezeptoren und Ganglienzellen, Neurone in der Sehbahn -
konvergieren. Gegenüber Lichteinfluss auf Gebiete außerhalb ihres rezeptiven Feldes verhalten sich die Zellen "blind". Photosensitive
Zellen der Netzhaut haben ein eng umschriebenes rezeptives Feld: Sie
reagieren auf Licht, das direkt auf sie trifft. Retinale Ganglienzellen reagieren auf Inputs photosensitiver Zellen, mit denen sie synaptisch verbunden sind. Rezeptive Felder der Netzhaut
Als rezeptives Feld bezeichnet
man in der Physiologie des Auges diejenige spezifische Region des visuellen Raums, von der aus Reize
auf informationsübertragende Zellen des visuellen Systems - retinale
Photorezeptoren und Ganglienzellen, Neurone in der Sehbahn -
konvergieren. Gegenüber Lichteinfluss auf Gebiete außerhalb ihres rezeptiven Feldes verhalten sich die Zellen "blind". Photosensitive
Zellen der Netzhaut haben ein eng umschriebenes rezeptives Feld: Sie
reagieren auf Licht, das direkt auf sie trifft. Retinale Ganglienzellen reagieren auf Inputs photosensitiver Zellen, mit denen sie synaptisch verbunden sind. Rezeptive Felder der Netzhaut sind kreisförmig bis oval,
sind kreisförmig bis oval, haben
einen zur Peripherie hin zunehmenden Durchmesser - von ~einer
Bogenminute in der fovea centralis bis zu ~4 Bogengrade in der
Netzhautperipherie (ein mehr als 200-facher Unterschied),
haben
einen zur Peripherie hin zunehmenden Durchmesser - von ~einer
Bogenminute in der fovea centralis bis zu ~4 Bogengrade in der
Netzhautperipherie (ein mehr als 200-facher Unterschied), in zapfenabhängigen rezeptiven Feldern depolarisieren die Zellen bei Erhöhung oder
Erniedrigung der Belichtung ihres Zentrums ("On"- oder "Off"-Neurone), Stäbchen nutzen nur einen "On"-Mechanismus .
in zapfenabhängigen rezeptiven Feldern depolarisieren die Zellen bei Erhöhung oder
Erniedrigung der Belichtung ihres Zentrums ("On"- oder "Off"-Neurone), Stäbchen nutzen nur einen "On"-Mechanismus .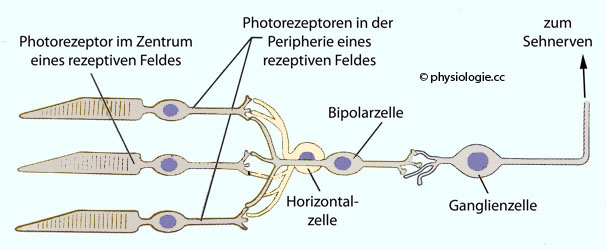
 Abbildung: Zapfenabhängiges rezeptives Feld
Abbildung: Zapfenabhängiges rezeptives Feld
 On-Bipolarzellen werden durch Glutamat, das Zapfen im Dunkeln vermehrt
freisetzten, hyperpolarisiert, während Off-Bipolarzellen durch Glutamat depolarisiert werden. Der Unterschied in der Reaktion erklärt sich durch den unterschiedlichen Besatz an Glutamatrezeptoren:
On-Bipolarzellen werden durch Glutamat, das Zapfen im Dunkeln vermehrt
freisetzten, hyperpolarisiert, während Off-Bipolarzellen durch Glutamat depolarisiert werden. Der Unterschied in der Reaktion erklärt sich durch den unterschiedlichen Besatz an Glutamatrezeptoren:
 On-Bipolarzellen haben metabotrope (G-Protein → Abbau von cGMP → Schließen von Kationen-Kanälen → Hyperpolarisierung),
On-Bipolarzellen haben metabotrope (G-Protein → Abbau von cGMP → Schließen von Kationen-Kanälen → Hyperpolarisierung),  Off-Bipolarzellen haben ionotrope AMPA / Kainat- Rezeptoren
(Depolarisierung). Glutamat wirkt hier depolarisierend.
Off-Bipolarzellen haben ionotrope AMPA / Kainat- Rezeptoren
(Depolarisierung). Glutamat wirkt hier depolarisierend. Abbildung). Man kennt an die 40 verschiedene Typen mit unterschiedlicher synaptischer Struktur und verwendeten Transmittern.
Abbildung). Man kennt an die 40 verschiedene Typen mit unterschiedlicher synaptischer Struktur und verwendeten Transmittern. Abbildung: Verschaltung retinaler Neurone
Abbildung: Verschaltung retinaler Neurone
 M-System
M-System  Koniozelluläres System (bistratified cells)
Koniozelluläres System (bistratified cells) Systems, des magnozellulären Systems, sowie einer heterogenen Gruppe (Zellen der Puppillenreflexbahnen; koniozelluläres
Systems, des magnozellulären Systems, sowie einer heterogenen Gruppe (Zellen der Puppillenreflexbahnen; koniozelluläres  System) (vgl. dort). Das parvozelluläre System erhält Information von Grün- bzw. Rot-Rezeptoren, das koniozelluläre überträgt zusätzliche Information von Blau-Rezeptoren.
System) (vgl. dort). Das parvozelluläre System erhält Information von Grün- bzw. Rot-Rezeptoren, das koniozelluläre überträgt zusätzliche Information von Blau-Rezeptoren.
 Abbildung: P (parvozelluläre)- und M- (magnozelluläre) Ganglienzelle
Abbildung: P (parvozelluläre)- und M- (magnozelluläre) Ganglienzelle
 Zum parvozellulären System gehören 70-80% der retinalen Ganglienzellen (P-Zellen oder midget cells). Seine rezeptiven Felder sind klein, sie sind farbempfindlich (Rot / Grün), reagieren langsam, adaptieren nur wenig, haben aber ein hohes räumliches Auflösungsvermögen. Ihre Neurone projizieren in das corpus geniculatum laterale (
Zum parvozellulären System gehören 70-80% der retinalen Ganglienzellen (P-Zellen oder midget cells). Seine rezeptiven Felder sind klein, sie sind farbempfindlich (Rot / Grün), reagieren langsam, adaptieren nur wenig, haben aber ein hohes räumliches Auflösungsvermögen. Ihre Neurone projizieren in das corpus geniculatum laterale ( s. dort), wo sie an Zellen des parvozellulären
Systems - an den dorsal gelegenen Kernschichten 3 bis 6 - enden. Das angekoppelte visuelle Verarbeitungssystem ist auf
räumliche Auflösung, Detail, Farbe und Objekterkennung spezialisiert.
s. dort), wo sie an Zellen des parvozellulären
Systems - an den dorsal gelegenen Kernschichten 3 bis 6 - enden. Das angekoppelte visuelle Verarbeitungssystem ist auf
räumliche Auflösung, Detail, Farbe und Objekterkennung spezialisiert. Zum (phylogenetisch älteren) magnozellulären System gehören ~10% der retinalen Ganglienzellen, die groß sind und einen umfangreichen Dendritenapparat aufweisen (M-Zellen oder parasol cells). Seine rezeptiven Felder sind groß (ihr Auflösungsvermögen relativ gering), sie sind nicht farbempfindlich, adaptieren rasch und sind zu hoher zeitlicher Auflösung fähig. Auch ihre Neurone projizieren in das corpus geniculatum laterale, sie enden an Zellen des magnozellulären
Systems, d.h. an den ventral gelegenen Kernschichten 1 und 2. Diese
Zellen senden überwiegend an obere parietale Areale und sind auf die
Analyse von Position und Bewegung spezialisiert.
Zum (phylogenetisch älteren) magnozellulären System gehören ~10% der retinalen Ganglienzellen, die groß sind und einen umfangreichen Dendritenapparat aufweisen (M-Zellen oder parasol cells). Seine rezeptiven Felder sind groß (ihr Auflösungsvermögen relativ gering), sie sind nicht farbempfindlich, adaptieren rasch und sind zu hoher zeitlicher Auflösung fähig. Auch ihre Neurone projizieren in das corpus geniculatum laterale, sie enden an Zellen des magnozellulären
Systems, d.h. an den ventral gelegenen Kernschichten 1 und 2. Diese
Zellen senden überwiegend an obere parietale Areale und sind auf die
Analyse von Position und Bewegung spezialisiert. Zweischichtige Ganglienzellen
in der Netzhaut (bistratified cells) machen 8-10% der Ganglienzellen in der Netzhaut aus. Sie erhalten ihre Inputs von bipolaren und amakrinen Zellen und
projizieren auf koniozelluläre Neuronen des corpus geniculatum laterale thalami- zwischen Schichten des P- und des M-Systems. Das koniozelluläre System überträgt Information von Blau-Zapfen der Netzhaut, trägt zur Helligkeits- und Farbkontrastwahrnehmung bei, weiters zur Steuerung von Auganbewegungen.
Zweischichtige Ganglienzellen
in der Netzhaut (bistratified cells) machen 8-10% der Ganglienzellen in der Netzhaut aus. Sie erhalten ihre Inputs von bipolaren und amakrinen Zellen und
projizieren auf koniozelluläre Neuronen des corpus geniculatum laterale thalami- zwischen Schichten des P- und des M-Systems. Das koniozelluläre System überträgt Information von Blau-Zapfen der Netzhaut, trägt zur Helligkeits- und Farbkontrastwahrnehmung bei, weiters zur Steuerung von Auganbewegungen. 

 Abbildung: Netzhautstruktur (Übersicht)
Abbildung: Netzhautstruktur (Übersicht)
 Wir brauchen unsere Augen für drei hauptsächliche Zwecke visueller Erkennung:
Wir brauchen unsere Augen für drei hauptsächliche Zwecke visueller Erkennung:

 Abbildung: Zentrale Sehbahn
Abbildung: Zentrale Sehbahn
 ("Scheuklappenblindheit") ausbreiten.
("Scheuklappenblindheit") ausbreiten.  Abbildung) meist nicht ident. Lediglich auf einer gekrümmten horizontalen Linie, dem sogenannten Horopter
Abbildung) meist nicht ident. Lediglich auf einer gekrümmten horizontalen Linie, dem sogenannten Horopter  ,
liegen diejenigen Punkte, die auf Netzhautpunkten abgebildet werden,
die von der fovea centralis (im gleichen Winkel) gleich weit entfernt sind (der
Fixationspunkt wird auf die fovea centralis projiziert). Solche deckungsgleichen Orte auf der Retina nennt man korrespondierend.
,
liegen diejenigen Punkte, die auf Netzhautpunkten abgebildet werden,
die von der fovea centralis (im gleichen Winkel) gleich weit entfernt sind (der
Fixationspunkt wird auf die fovea centralis projiziert). Solche deckungsgleichen Orte auf der Retina nennt man korrespondierend.
 Abbildung: Horopter, Querdisparation, Panum-Raum
Abbildung: Horopter, Querdisparation, Panum-Raum
 ),
bei deren Abbildung auf der Netzhaut nur eine geringe Querdisparation
auftritt, sodass das Gehirn diese Information zu einem räumlichen
Eindruck verschmelzen kann und kein Doppelbild wahrgenommen wird
("Fusionszwang" für das Gehirn, stereoskopisches Sehen).
),
bei deren Abbildung auf der Netzhaut nur eine geringe Querdisparation
auftritt, sodass das Gehirn diese Information zu einem räumlichen
Eindruck verschmelzen kann und kein Doppelbild wahrgenommen wird
("Fusionszwang" für das Gehirn, stereoskopisches Sehen).
 Der bei
unbewegtem Blick wahrnehmbare Teil der Umwelt wird als
Gesichtsfeld (visual field) bezeichnet. Die Bestimmung des Gesichtsfeldes heißt
Perimetrie. Sie
kann im einfachsten Fall mit Fingern und Händen des Untersuchers
erfolgen. Das Hohlkugelperimeter (
Der bei
unbewegtem Blick wahrnehmbare Teil der Umwelt wird als
Gesichtsfeld (visual field) bezeichnet. Die Bestimmung des Gesichtsfeldes heißt
Perimetrie. Sie
kann im einfachsten Fall mit Fingern und Händen des Untersuchers
erfolgen. Das Hohlkugelperimeter ( Abbildung) erlaubt exakte Bestimmungen in Bezug
auf Ort, Größe, Helligkeit und Farbe eines optischen Stimulus.
Abbildung) erlaubt exakte Bestimmungen in Bezug
auf Ort, Größe, Helligkeit und Farbe eines optischen Stimulus.

 Abbildung: Perimetrieblatt
Abbildung: Perimetrieblatt
 Abbildung) aufgezeichnet. Getestet wird u.a. auf erforderliche
Lichtintensität oder Größe des für einen wahrnehmbaren Eindruck
notwendigen Lichtflecks. Neben dem allgemeinen (unbunten) Gesichtsfeld
kann auch die Ausbreitung der Farbsinne quantifiziert werden (rot mit dem engsten, blau mit dem weitesten
Gesichtsfeld).
Abbildung) aufgezeichnet. Getestet wird u.a. auf erforderliche
Lichtintensität oder Größe des für einen wahrnehmbaren Eindruck
notwendigen Lichtflecks. Neben dem allgemeinen (unbunten) Gesichtsfeld
kann auch die Ausbreitung der Farbsinne quantifiziert werden (rot mit dem engsten, blau mit dem weitesten
Gesichtsfeld).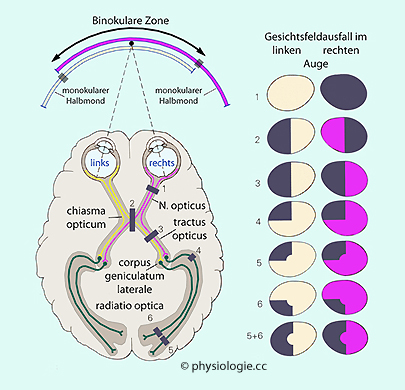
 Abbildung: Visuelles Feld entlang der Sehbahn
Abbildung: Visuelles Feld entlang der Sehbahn
 (fleckförmige Ausfälle, z.B. bei Glaukom) können präzise verortet werden.
(fleckförmige Ausfälle, z.B. bei Glaukom) können präzise verortet werden. Elektroretinographie
(ERG) wird angewendet, um die elektrische Summenantwort der Netzhaut
auf einen (schwachen) Lichtreiz zu ermitteln. Normalerweise kommt es
innerhalb von weniger als einer Zehntelsekunde (je intensiver der
Lichtreiz, desto rascher) zu einer ein- (schwacher Lichtreiz) bis zweiphasigen Veränderung des
(mittels Kontaktlinsenelektroden) registrierten Potentials über dem
Augapfel. Dies spiegelt die Aktivität der Zellen in der Netzhaut wider.
Elektroretinographie
(ERG) wird angewendet, um die elektrische Summenantwort der Netzhaut
auf einen (schwachen) Lichtreiz zu ermitteln. Normalerweise kommt es
innerhalb von weniger als einer Zehntelsekunde (je intensiver der
Lichtreiz, desto rascher) zu einer ein- (schwacher Lichtreiz) bis zweiphasigen Veränderung des
(mittels Kontaktlinsenelektroden) registrierten Potentials über dem
Augapfel. Dies spiegelt die Aktivität der Zellen in der Netzhaut wider.

 Abbildung: Normales Elektroretinogramm nach hellem Lichtreiz (single flash)
Abbildung: Normales Elektroretinogramm nach hellem Lichtreiz (single flash)
 Abbildung).
Abbildung). 

 Retinale Rezeptorzellen sind Zapfen für hohe Lichtstärke (photopisches Sehen) mit unterschiedlicher Farbempfindlichkeit (Photopsine), für geringe Lichtstärke (skotopisches Sehen) mit einem Empfindlichkeitsmaximum bei ~550 nm (Rhodopsin), und Stäbchenfotosensible Ganglienzellen (ipRGC) für die Steuerung zirkadianer Rhythmen über den nucleus suprachiasmaticus (Melanopsin)
Retinale Rezeptorzellen sind Zapfen für hohe Lichtstärke (photopisches Sehen) mit unterschiedlicher Farbempfindlichkeit (Photopsine), für geringe Lichtstärke (skotopisches Sehen) mit einem Empfindlichkeitsmaximum bei ~550 nm (Rhodopsin), und Stäbchenfotosensible Ganglienzellen (ipRGC) für die Steuerung zirkadianer Rhythmen über den nucleus suprachiasmaticus (Melanopsin) Das skotopische System ist bei ~500 nm am empfindlichsten. Diese
Wellenlänge
liegt zwischen dem Absorptionsmaximum der Blau- und dem der
Grün-Sensoren, während das kollektive Empfindlichkeitsmaximum des
photopischen Systems bei ~550 nm liegt. Das bedingt den Purkinje-Effekt
Das skotopische System ist bei ~500 nm am empfindlichsten. Diese
Wellenlänge
liegt zwischen dem Absorptionsmaximum der Blau- und dem der
Grün-Sensoren, während das kollektive Empfindlichkeitsmaximum des
photopischen Systems bei ~550 nm liegt. Das bedingt den Purkinje-Effekt Rot-(L)-Zapfen sind am empfindlichsten bei ~565 nm, ihr Ausfall heißt
Protanopie (Rotblindheit); Grün-(M)-Zapfen bei ~535 nm, ihr
Ausfall heißt Deuteranopie (Grünblindheit); Blau-(K)-Zapfen bei ~420
nm, ihr Ausfall heißt Tritanopie (Blau-Gelb-Blindheit).
Farbsinnstörungen betreffen 8% der Männer, 0,4% der Frauen (Gene
X-chromosomal codiert). Eine Testung des Farbsinns erfolgt mit
pseudoisochromatischen Tafeln (Ishihara, Stilling-Velhagen) oder
Anomaloskopen
Rot-(L)-Zapfen sind am empfindlichsten bei ~565 nm, ihr Ausfall heißt
Protanopie (Rotblindheit); Grün-(M)-Zapfen bei ~535 nm, ihr
Ausfall heißt Deuteranopie (Grünblindheit); Blau-(K)-Zapfen bei ~420
nm, ihr Ausfall heißt Tritanopie (Blau-Gelb-Blindheit).
Farbsinnstörungen betreffen 8% der Männer, 0,4% der Frauen (Gene
X-chromosomal codiert). Eine Testung des Farbsinns erfolgt mit
pseudoisochromatischen Tafeln (Ishihara, Stilling-Velhagen) oder
Anomaloskopen Phototransduktion: Im Dunkeln depolarisiert Kationeneinstrom durch
CNG-Kanäle (Guanylatzyklase bildet kontinuierlich cGMP) das
Außensegment der Sinneszellen (Dunkelstrom), die Synapse zur
Nervenzelle setzt Glutamat frei. Licht verwandelt 11-cis-
zu all-trans-Retinal, Rhodopsin wird zu Metarhodopsin, dieses aktiviert
das G-Protein Transduzin, cGMP wird abgebaut, das sinkende
[cGMP] verringert den Kationeneinstrom, das Membranpotential steigt von ~-40 auf ~-80mV, was sich elektrotonisch auf die Kontaktstelle zum bipolaren Retina-Neuron auswirkt: die Glutamatfreisetzung nimmt ab
Phototransduktion: Im Dunkeln depolarisiert Kationeneinstrom durch
CNG-Kanäle (Guanylatzyklase bildet kontinuierlich cGMP) das
Außensegment der Sinneszellen (Dunkelstrom), die Synapse zur
Nervenzelle setzt Glutamat frei. Licht verwandelt 11-cis-
zu all-trans-Retinal, Rhodopsin wird zu Metarhodopsin, dieses aktiviert
das G-Protein Transduzin, cGMP wird abgebaut, das sinkende
[cGMP] verringert den Kationeneinstrom, das Membranpotential steigt von ~-40 auf ~-80mV, was sich elektrotonisch auf die Kontaktstelle zum bipolaren Retina-Neuron auswirkt: die Glutamatfreisetzung nimmt ab Signalverstärkung: Photorezeptoren absorbieren ~20% der eintreffenden
Photonen. Jedes absorbiertes Photon führt zum Eintritt von >106 Kationen, ~1mV Potentialanstieg und einer meßbaren Antwort am Rezeptor (Signalverstärkung). Variationen
des Lichtflusses um einige Dutzend Photonen können bereits Sinneseindrücke verändern
Signalverstärkung: Photorezeptoren absorbieren ~20% der eintreffenden
Photonen. Jedes absorbiertes Photon führt zum Eintritt von >106 Kationen, ~1mV Potentialanstieg und einer meßbaren Antwort am Rezeptor (Signalverstärkung). Variationen
des Lichtflusses um einige Dutzend Photonen können bereits Sinneseindrücke verändern Retinale Adaptation entsteht durch das Zusammenwirken mehrerer
Mechanismen: Photochemische Adaptation, unterschiedlicher Einsatz von
Stäbchen und Zapfen (adaptierte Stäbchen sind um mehrere Zehnerpotenzen
lichtempfindlicher als adaptierte Zapfen), neuronale Anpassung,
räumliche und zeitliche Summation
Retinale Adaptation entsteht durch das Zusammenwirken mehrerer
Mechanismen: Photochemische Adaptation, unterschiedlicher Einsatz von
Stäbchen und Zapfen (adaptierte Stäbchen sind um mehrere Zehnerpotenzen
lichtempfindlicher als adaptierte Zapfen), neuronale Anpassung,
räumliche und zeitliche Summation Fixierte Gegenstandspunkte werden auf der fovea centralis abgebildet (Auflösung ~1
Bogenminute) - diese enthält nur Zapfen (skotopisches Zentralskotom).
Die Signalübertragung auf bipolare und Ganglienzellen ergibt rezeptive
Felder, definiert als die kreisförmige bis ovale Netzhautfläche, von
der aus Einflüsse auf eine Ganglienzelle konvergieren. Der Durchmesser
rezeptiver Felder nimmt von einer
Bogenminute (fovea) bis zu ~4 Bogengrade (Netzhautperipherie) zu.
Zapfendominierte rezeptive Felder haben "On-" oder "Off"-Neurone - die
Ganglienzelle reagiert auf Kontraste zwischen Zentrum und Peripherie
ihres Feldes
Fixierte Gegenstandspunkte werden auf der fovea centralis abgebildet (Auflösung ~1
Bogenminute) - diese enthält nur Zapfen (skotopisches Zentralskotom).
Die Signalübertragung auf bipolare und Ganglienzellen ergibt rezeptive
Felder, definiert als die kreisförmige bis ovale Netzhautfläche, von
der aus Einflüsse auf eine Ganglienzelle konvergieren. Der Durchmesser
rezeptiver Felder nimmt von einer
Bogenminute (fovea) bis zu ~4 Bogengrade (Netzhautperipherie) zu.
Zapfendominierte rezeptive Felder haben "On-" oder "Off"-Neurone - die
Ganglienzelle reagiert auf Kontraste zwischen Zentrum und Peripherie
ihres Feldes On-Bipolarzellen werden durch Glutamat gehemmt (G-Protein → Abbau von cGMP → Hyperpolarisierung),
Off-Bipolarzellen angeregt
(ionotrope Glutamatrezeptoren → Depolarisierung). Stäbchen nutzen nur
einen "On"-Mechanismus. Rezeptive Felder können farbantagonistisch
(parvozelluläres System)
oder helligkeitskodierend (magnozelluläres System) organisiert sein.
Horizontalzellen bauen zur Kontrastverstärkung Querverbindungen
zwischen Photorezeptoren auf (laterale Hermmung), Amakrinzellen laterale Verknüpfungen zwischen bipolaren und
Ganglienzellen
On-Bipolarzellen werden durch Glutamat gehemmt (G-Protein → Abbau von cGMP → Hyperpolarisierung),
Off-Bipolarzellen angeregt
(ionotrope Glutamatrezeptoren → Depolarisierung). Stäbchen nutzen nur
einen "On"-Mechanismus. Rezeptive Felder können farbantagonistisch
(parvozelluläres System)
oder helligkeitskodierend (magnozelluläres System) organisiert sein.
Horizontalzellen bauen zur Kontrastverstärkung Querverbindungen
zwischen Photorezeptoren auf (laterale Hermmung), Amakrinzellen laterale Verknüpfungen zwischen bipolaren und
Ganglienzellen Die Netzhaut enthält Ganglienzellen des parvozellulären (P-Zellen, ~80%
der retinalen Ganglienzellen), des magnozellulären (M-Zellen, ~10%) und
des koniozellulären Systems. Das parvozelluläre
System hat kleine, farbempfindliche, schwach adaptierende rezeptive
Felder mit hohem räumlichem Auflösungsvermögen; es projiziert auf
dorsale Kernschichten (3 bis 6) des corpus geniculatum laterale und
dient räumlicher Auflösung, Detail-, Farben- und Objekterkennung). Das magnozelluläre System hat große, nicht farbempfindliche, rasch adaptierende rezeptive Felder mit
hohem zeitlichem Auflösungsvermögen; es projiziert auf ventrale Kernschichten (1 und 2) des corpus
geniculatum laterale und dient der Analyse von Position und Bewegung
Die Netzhaut enthält Ganglienzellen des parvozellulären (P-Zellen, ~80%
der retinalen Ganglienzellen), des magnozellulären (M-Zellen, ~10%) und
des koniozellulären Systems. Das parvozelluläre
System hat kleine, farbempfindliche, schwach adaptierende rezeptive
Felder mit hohem räumlichem Auflösungsvermögen; es projiziert auf
dorsale Kernschichten (3 bis 6) des corpus geniculatum laterale und
dient räumlicher Auflösung, Detail-, Farben- und Objekterkennung). Das magnozelluläre System hat große, nicht farbempfindliche, rasch adaptierende rezeptive Felder mit
hohem zeitlichem Auflösungsvermögen; es projiziert auf ventrale Kernschichten (1 und 2) des corpus
geniculatum laterale und dient der Analyse von Position und Bewegung Räumliches Sehen wird u.a. durch Binokularsehen unterstützt. Die auf
die Netzhaut beider Augen projizierten Bilder der Umwelt sind
unterschiedlich. Nur auf dem Horopter (einer gekrümmten horizontalen
Linie) liegen Punkte, die auf korrespondierende Netzhautpunkte
(deckungsgleich) abgebildet werden. Alle anderen fallen auf nicht
korrespondierende Netzhautstellen (unterschiedliche Entfernung von der
fovea centralis): Sie sind querdisparat. Aus dem Ausmaß der
Querdisparation - soferne diese nicht zu stark ist (Panum-Areal um den
Horopter) - rechnet das Gehirn in räumliche Tiefe um; ist die
Querdisparation zu stark, entstehen Doppelbilder
Räumliches Sehen wird u.a. durch Binokularsehen unterstützt. Die auf
die Netzhaut beider Augen projizierten Bilder der Umwelt sind
unterschiedlich. Nur auf dem Horopter (einer gekrümmten horizontalen
Linie) liegen Punkte, die auf korrespondierende Netzhautpunkte
(deckungsgleich) abgebildet werden. Alle anderen fallen auf nicht
korrespondierende Netzhautstellen (unterschiedliche Entfernung von der
fovea centralis): Sie sind querdisparat. Aus dem Ausmaß der
Querdisparation - soferne diese nicht zu stark ist (Panum-Areal um den
Horopter) - rechnet das Gehirn in räumliche Tiefe um; ist die
Querdisparation zu stark, entstehen Doppelbilder Gesichtsfeld heißt der bei unbewegtem Blick wahrnehmbare Teil der
Umwelt; seine Bestimmung heißt Perimetrie. Mit einem Hohlkugelperimeter
werden exakte Bestimmungen in Bezug auf Ort, Größe, Helligkeit und
Farbe eines optischen Reizes vorgenommen, das Ergebnis auf einem
Perimetrieblatt aufgezeichnet. So lassen sich fleckförmige (Skotome),
Halbseiten- (nasal, temporal) und andere Ausfälle präzisieren. Der
blinde Fleck liegt 15 Bogengrade nasal von der fovea centralis (in der
perimetrischen Untersuchung 15° temporal zum Fixationspunkt)
Gesichtsfeld heißt der bei unbewegtem Blick wahrnehmbare Teil der
Umwelt; seine Bestimmung heißt Perimetrie. Mit einem Hohlkugelperimeter
werden exakte Bestimmungen in Bezug auf Ort, Größe, Helligkeit und
Farbe eines optischen Reizes vorgenommen, das Ergebnis auf einem
Perimetrieblatt aufgezeichnet. So lassen sich fleckförmige (Skotome),
Halbseiten- (nasal, temporal) und andere Ausfälle präzisieren. Der
blinde Fleck liegt 15 Bogengrade nasal von der fovea centralis (in der
perimetrischen Untersuchung 15° temporal zum Fixationspunkt) Elektroretinographie (ERG) zeigt die elektrische Summenantwort (~0,1
mV) der Netzhaut auf einen Lichtreiz (ein- bis zweiphasige
Potentialschwankung je nach Lichtintensität) bei hell- oder
dunkeladaptierten Probanden zwecks Testung des Zapfen- bzw.
Stäbchensystems. Netzhautschädigungen können veränderte
ERG-Lichtreaktionen bedingen
Elektroretinographie (ERG) zeigt die elektrische Summenantwort (~0,1
mV) der Netzhaut auf einen Lichtreiz (ein- bis zweiphasige
Potentialschwankung je nach Lichtintensität) bei hell- oder
dunkeladaptierten Probanden zwecks Testung des Zapfen- bzw.
Stäbchensystems. Netzhautschädigungen können veränderte
ERG-Lichtreaktionen bedingen