




 Akne: ἀκμή = Spitze (Pubertät?)
Akne: ἀκμή = Spitze (Pubertät?)| Eine erwachsene Person ist von etwa 1014 Bakterien besiedelt. Sie finden sich vor allem im Darm, aber auch auf der Haut, im Respirations- und Urogenitaltrakt, vereinzelt sogar im Kreislauf. Dieses Mikrobiom
ist biologisch hochaktiv und beeinflusst zahlreiche Körperfunktionen,
stellt aber auch eine potentielle Gefahr für die Gesundheit seines
Trägers dar. Bei Infektionen treten größere Zahlen über physiologische Barrieren in Gewebe über und können sich dort rasch vermehren, wenn sie das Immunsystem nicht erfolgreich bekämpft. Eine primäre Schutzbarriere aus intakter Haut, unverletzten Schleimhäuten und der auf ihnen wirkenden Komponenten der Immunabwehr hält normalerweise den Großteil der Mikroorganismen (Bakterien, Viren, Parasiten) davon ab, in das "eigentliche Innere" des Körpers vorzudringen. Mikroorganismen, die es schaffen, in Gewebe, Lymphe und Blutbahn vorzudringen, werden von der sekundären Barriere angegriffen: Ein hochkomplexes System aus teils angeborenen (Phagozyten, NK-Zellen, Komplementsystem), teils adaptiven ("spezifischen") Komponenten - etwa 1012 Lymphozyten, 1019 Antikörpermoleküle u.a. Das Immunsystem orientiert sich an individualspezifischen Markermolekülen an der Oberfläche der Körperzellen einerseits (MHC-System: Major histocompatibility complex), an mikrobiellen Molekülen andererseits (PAMPs: Pathogen-associated molecular patterns). Auf diese Weise können einerseits Mikroorganismen anhand ihrer Erkennungsmoleküle, andererseits defekte oder virusbefallene eigene Zellen (MHC in Kombination mit Virusprodukten) erkannt und abgetötet werden. Die Zahl an involvierten (gegenseitig bindenden) Molekülen ist groß, die Erkennungsmechanismen komplex und die Konsequenzen eines "falschen Alarms" gravierend (Überempfindlichkeitsreaktionen, Autoimmunerkrankungen). Auch die Folgen mangelnder Abwehrstärke sind fatal (potentiell tödliche Immunschwäche). |
 Mikrobiom
Mikrobiom  Positionierung des Immunsystems
Positionierung des Immunsystems  Immunrezeptoren
Immunrezeptoren  Mustererkennungsrezeptoren (PRRs)
Mustererkennungsrezeptoren (PRRs)  PAMPs und angeborene Abwehr
PAMPs und angeborene Abwehr  Rezeptoren der adaptiven Abwehr
Rezeptoren der adaptiven Abwehr  Rezeptordiversität und somatische Rekombination
Rezeptordiversität und somatische Rekombination Immunogenität und Immunantwort
Immunogenität und Immunantwort  Immunsystem und Gesamtorganismus
Immunsystem und Gesamtorganismus  CD (cluster of differentiation)
CD (cluster of differentiation)  Lymphatische Schutzbarrieren und immunprivilegierte Gewebe
Lymphatische Schutzbarrieren und immunprivilegierte Gewebe

 Entzündung
Entzündung  PRRs, PAMPs, MAMPs, DAMPs
PRRs, PAMPs, MAMPs, DAMPs  Aktivierung
Aktivierung  RIG-I, MDA5
RIG-I, MDA5  Lymphatische Gewebe
Lymphatische Gewebe  Effektorzellen
Effektorzellen  Lektine, MBL
Lektine, MBL  ITAM, ITIM
ITAM, ITIM  Costimulator
Costimulator  RAG1, RAG2
RAG1, RAG2
 , Bakterien
, Bakterien ,
Protozoen
,
Protozoen , Pilze, manchmal auch Würmer, Giftstoffe, zusehends auch Veränderungen an
körpereigenen (gestressten oder Krebszellen) ausgesetzt. Schutz vor diesen potentiellen Bedrohungen bietet das Immunsystem. Dessen Zellen stammen von lymphoiden
, Pilze, manchmal auch Würmer, Giftstoffe, zusehends auch Veränderungen an
körpereigenen (gestressten oder Krebszellen) ausgesetzt. Schutz vor diesen potentiellen Bedrohungen bietet das Immunsystem. Dessen Zellen stammen von lymphoiden  und myeloiden
und myeloiden  Vorläuferzellen ab (
Vorläuferzellen ab ( Abbildung),
die zum Großteil auf angeborene oder adaptive Mechanismen spezialisiert
sind. Manche spielen in beiden Systemen eine tragende Rolle
(dendritische Zellen, Makrophagen).
Abbildung),
die zum Großteil auf angeborene oder adaptive Mechanismen spezialisiert
sind. Manche spielen in beiden Systemen eine tragende Rolle
(dendritische Zellen, Makrophagen).
 Abbildung: Hämatopoetischer "Stammbaum" und Immunzellen
Abbildung: Hämatopoetischer "Stammbaum" und Immunzellen s. dort.
s. dort.
 Identifikation eines Materials als gefährlich bzw. fremd (z.B. durch dendritische Zellen)
Identifikation eines Materials als gefährlich bzw. fremd (z.B. durch dendritische Zellen) Angeborene Reaktion (ohne Verzögerung)
Angeborene Reaktion (ohne Verzögerung) Adaptive Reaktion (langsamer, spezifisch)
Adaptive Reaktion (langsamer, spezifisch) Verstärkung, fallweise Begrenzung der Reaktion(en)
Verstärkung, fallweise Begrenzung der Reaktion(en) Bei adaptiver Antwort: Immunologisches Gedächtnis, raschere und stärkere Zweitreaktion
Bei adaptiver Antwort: Immunologisches Gedächtnis, raschere und stärkere Zweitreaktion  über die Luftwege (Atmung),
über die Luftwege (Atmung), über die Haut (Kontakt),
über die Haut (Kontakt), über den Gastrointestinaltrakt (Nahrung / Getränke),
über den Gastrointestinaltrakt (Nahrung / Getränke), über den Urogentitaltrakt (Sexualkontakt u.a.).
über den Urogentitaltrakt (Sexualkontakt u.a.).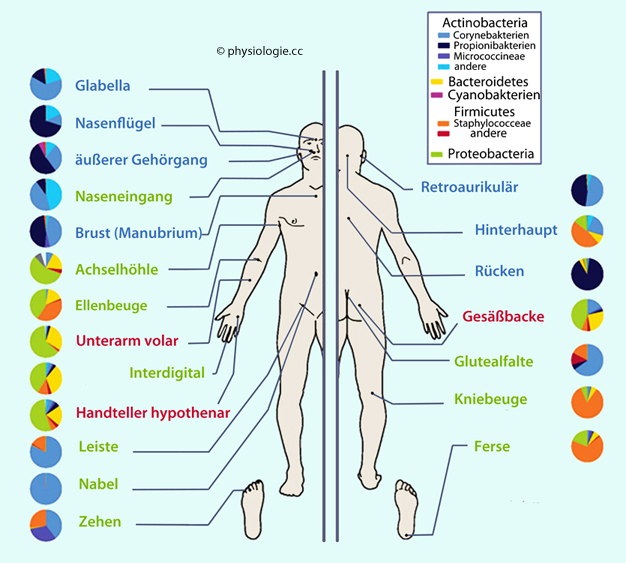
 Abbildung: Mikrobiom der menschlichen Haut
Abbildung: Mikrobiom der menschlichen Haut
 Mikrobielle Umgebung des menschlichen Körpers  Nach Doan / Lievano / Swanson-Mungerson / Viselli, Immunology, (3rd ed. Wolters Kluwer 2022 |
||
| Ort |
Zahl relativ |
Zahl insgesamt |
| Haut |
103/cm2 |
1012 |
| Kopfhaut |
106/cm2 | -- |
| Nasenschleim |
107/g | -- |
| Speichel |
108/g | -- |
| Mund | -- |
1010 |
| Gastro- intestinaltrakt |
-- | 1014 |
| Stuhl |
>108/g | -- |

 Abbildung: Haut und Schleimhäute als "erste Verteidigungslinie"
Abbildung: Haut und Schleimhäute als "erste Verteidigungslinie"
 Bakterien stimulieren das Immunsystem
Bakterien stimulieren das Immunsystem Bakterielle Stoffwechselprodukte werden von Epithelzellen verwendet, die sie für ihren Metabolismus benötigen
Bakterielle Stoffwechselprodukte werden von Epithelzellen verwendet, die sie für ihren Metabolismus benötigen Bakterielle Enzyme nützen Nährstoffe, z.B. verwandeln Bakterien im
Mundraum Nitrate (Obst, Gemüse) zu Nitrit, das zu blutdrucksenkendem Stickstoffmonoxid wird
Bakterielle Enzyme nützen Nährstoffe, z.B. verwandeln Bakterien im
Mundraum Nitrate (Obst, Gemüse) zu Nitrit, das zu blutdrucksenkendem Stickstoffmonoxid wird  Anaerobe Bakterien produzieren Vitamin K (Dickdarm)
Anaerobe Bakterien produzieren Vitamin K (Dickdarm) Bakterien können entgiftend wirken (z.B. auf kanzerogene Substanzen)
Bakterien können entgiftend wirken (z.B. auf kanzerogene Substanzen)
 Abbildung: Das lymphatische Gewebe als "zweite Verteidigungslinie"
Abbildung: Das lymphatische Gewebe als "zweite Verteidigungslinie"
 Residente (obligate) Mikroorganismen
sind solche, die ständig auf der Haut vorhanden sind und sich dort auch
vermehren. Es sind hauptsächlich grampositive Bakterien, die sich auf
wenige Gruppen beschränken (Staphylokokken
Residente (obligate) Mikroorganismen
sind solche, die ständig auf der Haut vorhanden sind und sich dort auch
vermehren. Es sind hauptsächlich grampositive Bakterien, die sich auf
wenige Gruppen beschränken (Staphylokokken  , Corynebakterien
, Corynebakterien  , Propionibakterien -- u.a. Aknebakterien
, Propionibakterien -- u.a. Aknebakterien  --, Mikrokokken u.a.) sowie Hefen
(Pityrosporum auf der Kopfhaut). Acinetobakterien gehören zu den wenigen
gramnegativen residenten Hautbewohnern.
--, Mikrokokken u.a.) sowie Hefen
(Pityrosporum auf der Kopfhaut). Acinetobakterien gehören zu den wenigen
gramnegativen residenten Hautbewohnern.  Transitorische Mikroorganismen sind solche, die
gelegentlich auf die Haut gelangen, dort aber üblicherweise sich weder
vermehren noch dauerhaft verbleiben können.
Transitorische Mikroorganismen sind solche, die
gelegentlich auf die Haut gelangen, dort aber üblicherweise sich weder
vermehren noch dauerhaft verbleiben können. Zur Bakterienwand und Gram-Färbung
Zur Bakterienwand und Gram-Färbung s.
s.  Abbildung
Abbildung Abbildung: Struktur der Bakterienwand
Abbildung: Struktur der Bakterienwand vgl. dort
vgl. dort
 Das
Immunsystem schützt den Organismus und wahrt seine Integrität, indem es
Das
Immunsystem schützt den Organismus und wahrt seine Integrität, indem es bei Schädigung von Zellen und Geweben reparative Maßnahmen ergreift,
bei Schädigung von Zellen und Geweben reparative Maßnahmen ergreift, das Eindringen von Infektionserregern (pathogenen
Mikroben) bekämpft.
das Eindringen von Infektionserregern (pathogenen
Mikroben) bekämpft.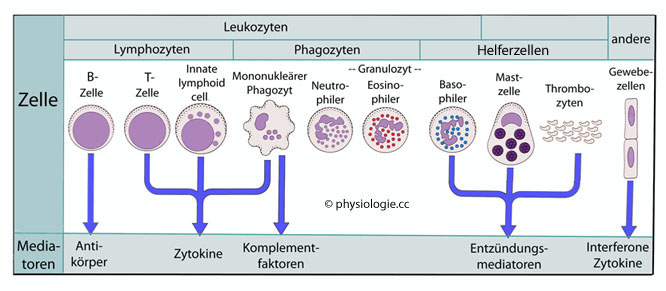

 Abbildung: Komponenten des Immunsystems
Abbildung: Komponenten des Immunsystems
 B-Zellen produzieren Antikörper;
B-Zellen produzieren Antikörper; 
 T-Zellen, lymphoide Zellen der angeborenen Immunantwort (ILC, innate lymphoid cells) und mononukleäre Phagozyten (Monozyten, Makrophagen) sezernieren Zytokine;
T-Zellen, lymphoide Zellen der angeborenen Immunantwort (ILC, innate lymphoid cells) und mononukleäre Phagozyten (Monozyten, Makrophagen) sezernieren Zytokine;
 Monozyten / Makrophagen bilden darüber hinaus Komplementfaktoren
(C1-C4, Faktor B) und exprimieren auch Komplementrezeptoren (Komplementfaktoren entstehen vor allem in der Leber);
Monozyten / Makrophagen bilden darüber hinaus Komplementfaktoren
(C1-C4, Faktor B) und exprimieren auch Komplementrezeptoren (Komplementfaktoren entstehen vor allem in der Leber);
 Basophile Granulozyten, Mastzellen und angeregte Thrombozyten setzen Entzündungsmediatoren frei;
Basophile Granulozyten, Mastzellen und angeregte Thrombozyten setzen Entzündungsmediatoren frei;
 verschiedene Gewebezellen produzieren fallweise Zytokine und Interferone.
verschiedene Gewebezellen produzieren fallweise Zytokine und Interferone.
 , Bakterien
, Bakterien  , Parasiten
, Parasiten  oder Pilze in den
Körper einzudringen drohen? Um dies zu verstehen, muss man sich vergegenwärtigen, dass die Haut nur zu einem kleinen Teil
(Erwachsener: ~2 m2)
zur Oberfläche gegen die Außenwelt
beiträgt. Die äußerste Schichte der (je nach Lage 0,05 bis 1,5 mm
dicken) Haut besteht aus abgestorbenen Zellen (Keratinozyten - stratum
corneum), die laufend abschuppen. Sie ist meist relativ trocken, wasserdicht und
haltet Mikroben zurück. Die Haut produziert antimikrobielle Peptide
(wie Defensine, Cathelicidin), Fettsäuren (die Bakterienwachstum
behindern), DNasen (Desoxyribonukleasen) und RNasen. Schweiß enthält Lysozyme (sie
spalten Peptidoglycan, das in der Zellwand der meisten Bakterien
vorkommt).
oder Pilze in den
Körper einzudringen drohen? Um dies zu verstehen, muss man sich vergegenwärtigen, dass die Haut nur zu einem kleinen Teil
(Erwachsener: ~2 m2)
zur Oberfläche gegen die Außenwelt
beiträgt. Die äußerste Schichte der (je nach Lage 0,05 bis 1,5 mm
dicken) Haut besteht aus abgestorbenen Zellen (Keratinozyten - stratum
corneum), die laufend abschuppen. Sie ist meist relativ trocken, wasserdicht und
haltet Mikroben zurück. Die Haut produziert antimikrobielle Peptide
(wie Defensine, Cathelicidin), Fettsäuren (die Bakterienwachstum
behindern), DNasen (Desoxyribonukleasen) und RNasen. Schweiß enthält Lysozyme (sie
spalten Peptidoglycan, das in der Zellwand der meisten Bakterien
vorkommt).
 Abbildung: Wie Mikroben vom Körperinneren ferngehalten werden
Abbildung: Wie Mikroben vom Körperinneren ferngehalten werden
 Primäre Barriere: Haut und
Schleimhäute schützen den Körper vor physikalischen und chemischen
Belastungen (Verletzungen durch mechanische, thermische, chemische
Einflüsse), und vor dem Eindringen von Krankheitserregern (
Primäre Barriere: Haut und
Schleimhäute schützen den Körper vor physikalischen und chemischen
Belastungen (Verletzungen durch mechanische, thermische, chemische
Einflüsse), und vor dem Eindringen von Krankheitserregern ( Abbildung). Epithelien schützen mehrfach vor dem Eintritt von Mikroben in das Körperinnere:
Abbildung). Epithelien schützen mehrfach vor dem Eintritt von Mikroben in das Körperinnere: Sie bilden eine physikalische Barriere, indem sie zwischen den luminalen und basolateralen Teilen mittels interzellulärer Schlussleisten eine Abdichtung aufbauen, die für Mikroben normalerweise undurchdringlich ist
Sie bilden eine physikalische Barriere, indem sie zwischen den luminalen und basolateralen Teilen mittels interzellulärer Schlussleisten eine Abdichtung aufbauen, die für Mikroben normalerweise undurchdringlich ist Sie bilden antibiotisch wirksame Peptide (Defensine u.a.), die Mikroben abtöten können
Sie bilden antibiotisch wirksame Peptide (Defensine u.a.), die Mikroben abtöten können Intraepitheliale Lymphozyten (T-Zellen und andere) bilden ebenfalls
Antibiotika, erkennen mittels T-Zell-Rezeptoren mikrobielle Antigene
und können Mikroben sowie infizierte Zellen eliminieren.
Intraepitheliale Lymphozyten (T-Zellen und andere) bilden ebenfalls
Antibiotika, erkennen mittels T-Zell-Rezeptoren mikrobielle Antigene
und können Mikroben sowie infizierte Zellen eliminieren. s. auch dort):
Abschuppung keratinisierten Epithels, Fettsäuren, Talg, mikrobizide
Moleküle, (saure) DNasen, RNasen, residente Hautflora (Commensalen)
s. auch dort):
Abschuppung keratinisierten Epithels, Fettsäuren, Talg, mikrobizide
Moleküle, (saure) DNasen, RNasen, residente Hautflora (Commensalen) s. auch dort): Nasenhaare, Nasenmuscheln, Zilien, Schleim (Mucin aus Becherzellen), mikrobizide Moleküle (u.a. IgA)
s. auch dort): Nasenhaare, Nasenmuscheln, Zilien, Schleim (Mucin aus Becherzellen), mikrobizide Moleküle (u.a. IgA) s. auch dort): pH, Schleim (Mucin), Enzyme (Verdauungsenzyme), mikrobizide Moleküle (Defensine, Lysozyme,IgA,..), Peristaltik, Commensalen
s. auch dort): pH, Schleim (Mucin), Enzyme (Verdauungsenzyme), mikrobizide Moleküle (Defensine, Lysozyme,IgA,..), Peristaltik, Commensalen s. unten): pH, Schleim, mikrobizide Moleküle, Peristaltik / Harnströmung
s. unten): pH, Schleim, mikrobizide Moleküle, Peristaltik / Harnströmung  Sekundäre Barriere: Überwinden
Mikroben / Antigene die natürlichen epithelialen Barrieren
(Haut, Schleimhäute), reagieren periphere (sekundäre) lymphatische
Organe mit entsprechenden Immunantworten (
Sekundäre Barriere: Überwinden
Mikroben / Antigene die natürlichen epithelialen Barrieren
(Haut, Schleimhäute), reagieren periphere (sekundäre) lymphatische
Organe mit entsprechenden Immunantworten ( Abbildung). Mehrere Abwehrmechanismen kommen ins Spiel: Angeborene und adaptive,
zelluläre und humorale. Dazu verfügt das Immunsystem über zwei
Flanken, die eine komplementäre Rolle spielen, d.h. sich in ihrer
Wirkung gegenseitig ergänzen:
Abbildung). Mehrere Abwehrmechanismen kommen ins Spiel: Angeborene und adaptive,
zelluläre und humorale. Dazu verfügt das Immunsystem über zwei
Flanken, die eine komplementäre Rolle spielen, d.h. sich in ihrer
Wirkung gegenseitig ergänzen: Periphere lymphatische Organe / Gewebe
umfassen Lymphknoten, Milz und mukosa-assoziiertes Gewebe (z.B.
Peyer'sche Plaques im Darm). Hier werden adaptive Immunreaktionen
gestartet.
Periphere lymphatische Organe / Gewebe
umfassen Lymphknoten, Milz und mukosa-assoziiertes Gewebe (z.B.
Peyer'sche Plaques im Darm). Hier werden adaptive Immunreaktionen
gestartet.
 Abbildung: Leukozyten auf Patrouille
Abbildung: Leukozyten auf Patrouille PSGL1,
P-Selektin Glycoprotein-Ligand 1, wird von allen Leukozyten exprimiert,
induziert deren Interaktion mit dem Endothel
PSGL1,
P-Selektin Glycoprotein-Ligand 1, wird von allen Leukozyten exprimiert,
induziert deren Interaktion mit dem Endothel
 LFA1, leukocyte funtion-associated antigen 1, ein Integrin auf Leukozyten, an mehreren Immunfunktionen beteiligt
LFA1, leukocyte funtion-associated antigen 1, ein Integrin auf Leukozyten, an mehreren Immunfunktionen beteiligt
 ICAM1, intercellular adhesion molecule 1,
in Leukozyten und Endothelzellen immer vorhanden, durch IL-1 und TNF
hinaufregulierbar - Leukozyten binden dann an das Endothel
ICAM1, intercellular adhesion molecule 1,
in Leukozyten und Endothelzellen immer vorhanden, durch IL-1 und TNF
hinaufregulierbar - Leukozyten binden dann an das Endothel
 VLA4, very late antigen 1, ein Integrin, das von Lymphozyten, NK-Zellen, Monozyten und eosinophilen Granulozyten exprimiert wird
VLA4, very late antigen 1, ein Integrin, das von Lymphozyten, NK-Zellen, Monozyten und eosinophilen Granulozyten exprimiert wird
 VCAM1, vascular cell-adhesion molecule 1, fördert die Anheftung von eosinophilen / basophilen Granulozyten, Lymphozyten sowie Monozyten an das Endothel
VCAM1, vascular cell-adhesion molecule 1, fördert die Anheftung von eosinophilen / basophilen Granulozyten, Lymphozyten sowie Monozyten an das Endothel
 MAdCAM1, mucosal vascular addressin cell-adhesion molecule 1, wird von mukösen Endothelzellen exprimiert und regt die Rezirkulation von T-Gedächtniszellen an
MAdCAM1, mucosal vascular addressin cell-adhesion molecule 1, wird von mukösen Endothelzellen exprimiert und regt die Rezirkulation von T-Gedächtniszellen an
 Mac-1, Makrophagen-Antigen 1, ein aus zwei Integrinen bestehender Komplementrezeptor (CR3), der als Mustererkennungsrezeptor wirkt und von Lymphozyten, Granulozyten, NK-Zellen und Makrophagen exprimiert wird
Mac-1, Makrophagen-Antigen 1, ein aus zwei Integrinen bestehender Komplementrezeptor (CR3), der als Mustererkennungsrezeptor wirkt und von Lymphozyten, Granulozyten, NK-Zellen und Makrophagen exprimiert wird
 CD31, CD99, CD157, Gewebemarker
CD31, CD99, CD157, Gewebemarker
 JAM, junctional adhesion molecule (JAM-1 erleichtert die Transmigration von Leukozyten)
JAM, junctional adhesion molecule (JAM-1 erleichtert die Transmigration von Leukozyten)

 Unter Aktivierung von Leukozyten versteht man die Transformation vom Ruhezustand zu einem funktionell aktiven (Effektor-) Zustand.
Unter Aktivierung von Leukozyten versteht man die Transformation vom Ruhezustand zu einem funktionell aktiven (Effektor-) Zustand. Transport von Leukozyten der myeloiden Reihe (hauptsächlich Neutrophile und Monozyten) zu Orten der Infektion oder Verletzung (Schutz, Pathogenbekämpfung, Reparatur)
Transport von Leukozyten der myeloiden Reihe (hauptsächlich Neutrophile und Monozyten) zu Orten der Infektion oder Verletzung (Schutz, Pathogenbekämpfung, Reparatur) Transport von z.T. "naiven" Lymphozyten
(solchen, die noch nie einem Antigen ausgesetzt waren) vom Ort ihrer Reifung (Knochenmark, Thymus) zu sekundärem lymphatischem
Gewebe (z.B. Lymphknoten) in der Peripherie (Antigenerkennung,
Proliferation, Differenzierung in Effektor- und Gedächtniszellen)
Transport von z.T. "naiven" Lymphozyten
(solchen, die noch nie einem Antigen ausgesetzt waren) vom Ort ihrer Reifung (Knochenmark, Thymus) zu sekundärem lymphatischem
Gewebe (z.B. Lymphknoten) in der Peripherie (Antigenerkennung,
Proliferation, Differenzierung in Effektor- und Gedächtniszellen) Transport von Effektorlymphozyten von sekundärem lymphatischem Gewebe zu Infektionsherden überall im Organismus (spezifische Abwehr).
Transport von Effektorlymphozyten von sekundärem lymphatischem Gewebe zu Infektionsherden überall im Organismus (spezifische Abwehr). Effektorzellen
führen spezifische Funktionen einer Immunantwort aus: So sezernieren
Helfer-T-Zellen Zytokine, töten Makrophagen Mikroben, bilden B-Zellen bzw. Plasmazellen Antikörper. Diese Effektormechanismen stehen oft unter dem Einfluss regulierender Zellen; diese produzieren Zytokine wie Interleukine, Interferone oder Chemokine als lösliche Signalstoffe im Dienste solcher Steuerungen.
Effektorzellen
führen spezifische Funktionen einer Immunantwort aus: So sezernieren
Helfer-T-Zellen Zytokine, töten Makrophagen Mikroben, bilden B-Zellen bzw. Plasmazellen Antikörper. Diese Effektormechanismen stehen oft unter dem Einfluss regulierender Zellen; diese produzieren Zytokine wie Interleukine, Interferone oder Chemokine als lösliche Signalstoffe im Dienste solcher Steuerungen.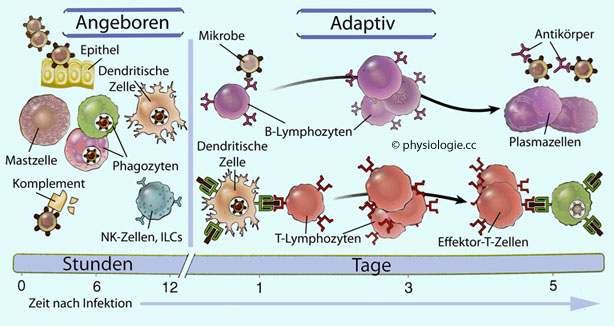
 Abbildung: Komponenten der angeborenen und der adaptiven Immunität
Abbildung: Komponenten der angeborenen und der adaptiven Immunität
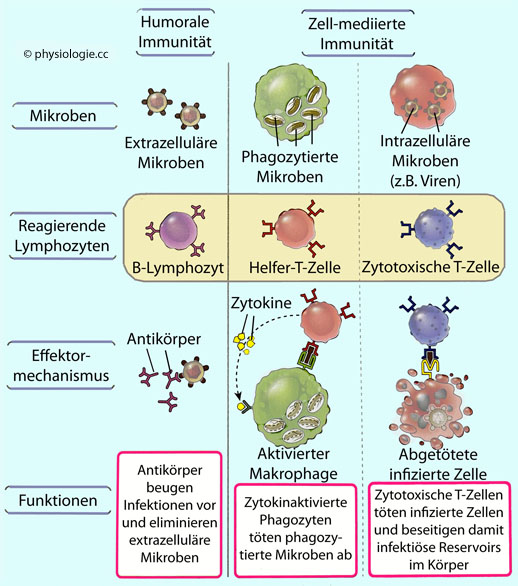
 Abbildung: Typen adaptiver Immunität
Abbildung: Typen adaptiver Immunität
Angeborenes vs. adaptives Immunsystem Nach Abbas / Lichtman / Pillai, Cellular and Molecular Immunology, 9th ed. Elsevier 2018 |
||
| Charakteristika | Angeboren |
Adaptiv |
| Spezifität |
Für gruppenspezifische mikrobielle Moleküle / Moleküle aus beschädigten Zellen |
Für mikrobielle und nichtmikrobielle Antikörper |
| Diversität |
Begrenzt Durch Gene codierte Erkennungsmoleküle |
Sehr groß Rezeptorgene durch somatische Rekombination lymphozytärer Gensegmente |
| Gedächtnis |
Keines / begrenzt |
Ja |
| Nicht selbstreaktiv |
Ja |
Ja |
| Komponenten |
||
| Zelluläre und chemische Barrieren |
Haut, Schleimhäute Antimikrobielle Moleküle |
Lymphozyten in Epithelien An epithelialen Oberflächen sezernierte Antikörper |
| Proteine im Kreislauf |
Komplement Lektine Agglutinine |
Antikörper |
| Zellen |
Phagozyten (Makrophagen, Neutrophile) Dendritische Zellen  Natürliche Killerzellen  Mastzellen  Lymphoide Zellen |
Lymphozyten |
 nur auf körpereigenen Zellen vorhanden sind (Selbsterkennung, "SELF"): Dadurch wird festgestellt, dass eine Interaktion zwischen Zellen im Organismus sicher
ist (um bestimmte physiologische Aufgaben gemeinsam wahrzunehmen).
Solche Strukturen sollten auf Mikroben, körperfremden oder auch
abnormen körpereigenen Zellen (z.B. Krebszellen) nicht vorhanden sein;
nur auf körpereigenen Zellen vorhanden sind (Selbsterkennung, "SELF"): Dadurch wird festgestellt, dass eine Interaktion zwischen Zellen im Organismus sicher
ist (um bestimmte physiologische Aufgaben gemeinsam wahrzunehmen).
Solche Strukturen sollten auf Mikroben, körperfremden oder auch
abnormen körpereigenen Zellen (z.B. Krebszellen) nicht vorhanden sein; nur auf Fremdzellen vorhanden sind (Fremderkennung, "NON-SELF"): Das funktioniert entweder über genetisch vorgegebene Mustererkennungsrezeptoren (PRRs) oder das Komplementsystem, oder über Rezeptoren /Antikörper, die von Lymphozyten (T- oder B-Zellen) gebildet werden,
wenn sie durch Begegnung mit einem
entsprechen "passenden" Antigen zur Teilung veranlasst wurden
(Klonselektion). Im ersten Fall ist die Abwehr unmittelbar, aber auf
relativ wenige Merkmale (ca. 102) beschränkt und nicht
lernfähig (angeboren); im zweiten Fall ist sie hochspezifisch, mit
ungeheurer Variabilität und einem "Gedächtnis" versehen, braucht aber
mehrere Tage, um wirksam werden zu können (adaptiv).
nur auf Fremdzellen vorhanden sind (Fremderkennung, "NON-SELF"): Das funktioniert entweder über genetisch vorgegebene Mustererkennungsrezeptoren (PRRs) oder das Komplementsystem, oder über Rezeptoren /Antikörper, die von Lymphozyten (T- oder B-Zellen) gebildet werden,
wenn sie durch Begegnung mit einem
entsprechen "passenden" Antigen zur Teilung veranlasst wurden
(Klonselektion). Im ersten Fall ist die Abwehr unmittelbar, aber auf
relativ wenige Merkmale (ca. 102) beschränkt und nicht
lernfähig (angeboren); im zweiten Fall ist sie hochspezifisch, mit
ungeheurer Variabilität und einem "Gedächtnis" versehen, braucht aber
mehrere Tage, um wirksam werden zu können (adaptiv). Auch die Abwesenheit eines Selbst-Merkmals (ABSENCE OF SELF) kann einen Angriff auf die betreffende Zelle veranlassen, z.B. durch NK-Zellen.
Diese stellen fest, ob die Zahl an MHC-I Molekülen (die von jeder
kernhaltigen Zelle exprimiert werden) auf der potentiellen Zielzelle
gesunken ist (wie das bei virusinfizierten oder Krebszellen passiert) -
nur dann töten sie die Zelle ab.
Auch die Abwesenheit eines Selbst-Merkmals (ABSENCE OF SELF) kann einen Angriff auf die betreffende Zelle veranlassen, z.B. durch NK-Zellen.
Diese stellen fest, ob die Zahl an MHC-I Molekülen (die von jeder
kernhaltigen Zelle exprimiert werden) auf der potentiellen Zielzelle
gesunken ist (wie das bei virusinfizierten oder Krebszellen passiert) -
nur dann töten sie die Zelle ab.
 Lektine (lectins)
Lektine (lectins)
 sind Proteine, die bestimmte Kohlenhydratstrukturen spezifisch binden
können. Beim Menschen vermitteln zirkulierende Lektine die Bindung
zahlreicher Pathogene an Zielstrukturen des Immunsystems (Lektinweg der Komplementaktivierung).
Einige Lektine in der Zellmembran (Dectine) erkennen spezifisch Glucane
in Pilzwänden, andere (Mannoserezeptoren) terminale Mannosereste in
Bakterienwänden; sie beteiligen sich am Mechanismus der Phagozytose
dieser Mikroben sowie an der Auslösung entzündlicher Reaktionen.
sind Proteine, die bestimmte Kohlenhydratstrukturen spezifisch binden
können. Beim Menschen vermitteln zirkulierende Lektine die Bindung
zahlreicher Pathogene an Zielstrukturen des Immunsystems (Lektinweg der Komplementaktivierung).
Einige Lektine in der Zellmembran (Dectine) erkennen spezifisch Glucane
in Pilzwänden, andere (Mannoserezeptoren) terminale Mannosereste in
Bakterienwänden; sie beteiligen sich am Mechanismus der Phagozytose
dieser Mikroben sowie an der Auslösung entzündlicher Reaktionen. Einige
dieser Rezeptoren prüfen ihre Umgebung auf die allfällige Anwesenheit pathogener Eindringlinge.
Einige
dieser Rezeptoren prüfen ihre Umgebung auf die allfällige Anwesenheit pathogener Eindringlinge.  Andere zielen darauf ab, nach Bindung des Liganden Signale zwischen Zellen auszutauschen.
Andere zielen darauf ab, nach Bindung des Liganden Signale zwischen Zellen auszutauschen.  Wieder andere stellen fest, ob Nachbarzellen gesunde Zellen des eigenen Organismus sind oder (wenn nicht) eine Gefahr darstellen (Krebszellen).
Wieder andere stellen fest, ob Nachbarzellen gesunde Zellen des eigenen Organismus sind oder (wenn nicht) eine Gefahr darstellen (Krebszellen). präformiert sein (angeborenes Immunsystem), sind also schon vor einem Antigenkontakt vorhanden: Mustererkennungsrezeptoren (PRRs), NK-Zell-Aktivatoren (KARs: Killer activation receptors), NK-Zell-Inhibitoren (KIRs: Killer inhibition receptors), Komplementrezeptoren, Fc-Rezeptoren). Solche Rezeptoren sind genetisch fix vorgegeben, ändern sich nicht und sind Bestandteil der angeborenen Immunität;
präformiert sein (angeborenes Immunsystem), sind also schon vor einem Antigenkontakt vorhanden: Mustererkennungsrezeptoren (PRRs), NK-Zell-Aktivatoren (KARs: Killer activation receptors), NK-Zell-Inhibitoren (KIRs: Killer inhibition receptors), Komplementrezeptoren, Fc-Rezeptoren). Solche Rezeptoren sind genetisch fix vorgegeben, ändern sich nicht und sind Bestandteil der angeborenen Immunität; somatisch generiert
werden (adaptives Immunsystem), d.h. individuell (in jeder Person anders) in B- und
T-Lymphozyten - je Zelle bzw. Klon unterschiedlich - aus dem
"genetischen Arsenal" neu rekombiniert.
Je nach mikrobiologischer Herausforderung vermehren sich Lymphozyten
mit passenden Rezeptoren und ermöglichen dadurch eine adaptive
Immunabwehr.
somatisch generiert
werden (adaptives Immunsystem), d.h. individuell (in jeder Person anders) in B- und
T-Lymphozyten - je Zelle bzw. Klon unterschiedlich - aus dem
"genetischen Arsenal" neu rekombiniert.
Je nach mikrobiologischer Herausforderung vermehren sich Lymphozyten
mit passenden Rezeptoren und ermöglichen dadurch eine adaptive
Immunabwehr. Pattern recognition receptors (PRRs): Diese erkennen Strukturen, die auf beschädigten
Strukturen sowie Mikroben / Pathogenen, nicht aber auf
gesunden körpereigenen Zellen vorkommen.
Pattern recognition receptors (PRRs): Diese erkennen Strukturen, die auf beschädigten
Strukturen sowie Mikroben / Pathogenen, nicht aber auf
gesunden körpereigenen Zellen vorkommen. Killer activation receptors (KARs) auf NK-Zellen
detektieren von gestressten Zellen sezernierte Moleküle,
was zu Anlagerung und Abtötung dieser körpereigenen gestressten Zellen
führt.
Killer activation receptors (KARs) auf NK-Zellen
detektieren von gestressten Zellen sezernierte Moleküle,
was zu Anlagerung und Abtötung dieser körpereigenen gestressten Zellen
führt. Killer inhibition receptors
(KIRs): Diese NK-Zell-Rezeptoren erkennen MHC-I-Moleküle an
körpereigenen Zellen. Nur wenn diese zu wenig HMC-I erkennen lassen,
kommt es zur Abtötung der Zielzelle.
Killer inhibition receptors
(KIRs): Diese NK-Zell-Rezeptoren erkennen MHC-I-Moleküle an
körpereigenen Zellen. Nur wenn diese zu wenig HMC-I erkennen lassen,
kommt es zur Abtötung der Zielzelle. Komplementrezeptoren
auf Phagozyten und B-Lymphozyten binden Komplementfragmente und lösen
dann den Abbau "markierter" Mikroben aus (s. dort).
Komplementrezeptoren
auf Phagozyten und B-Lymphozyten binden Komplementfragmente und lösen
dann den Abbau "markierter" Mikroben aus (s. dort). Fc-Rezeptoren: s. dort.
Fc-Rezeptoren: s. dort. Mustererkennungsrezeptoren (PRRs: pattern recognition receptors) erlauben dem angeborenen Immunsystem die Detektion von Mikroben (MAMPs: Mikroben-assoziierten molekulare Muster, microbe-asssociated molecular patterns bzw. PAMPs: Pathogen-assoziierte, pathogen-asssociated molecular patterns) und von beschädigten Körperzellen (DAMPs: damage-asssociated molecular patterns). Vita-PAMPs
werden von aktiven Mikroorganismen gebildet und rasch abgebaut,
wenn sie nicht mehr vital sind; auf diese Weise kann das Immunsystem
zwischen lebendigen und toten Erregern unterscheiden und reagiert vor
allem auf erstere.
Mustererkennungsrezeptoren (PRRs: pattern recognition receptors) erlauben dem angeborenen Immunsystem die Detektion von Mikroben (MAMPs: Mikroben-assoziierten molekulare Muster, microbe-asssociated molecular patterns bzw. PAMPs: Pathogen-assoziierte, pathogen-asssociated molecular patterns) und von beschädigten Körperzellen (DAMPs: damage-asssociated molecular patterns). Vita-PAMPs
werden von aktiven Mikroorganismen gebildet und rasch abgebaut,
wenn sie nicht mehr vital sind; auf diese Weise kann das Immunsystem
zwischen lebendigen und toten Erregern unterscheiden und reagiert vor
allem auf erstere. Im Falle verletzter körpereigener Strukturen
treten Moleküle im Extrazellulärraum auf, die aus intrazellulären
Kompartimenten (z.B. Hitzeschockproteine, ATP aus Mitochondrien, Histone aus dem Zellkern..) oder vom Abbau extrazellulärer Matrix (Proteoglykanpeptide) stammen und
Gewebeschädigung signalisieren; man nennt sie daher DAMPs.
Im Falle verletzter körpereigener Strukturen
treten Moleküle im Extrazellulärraum auf, die aus intrazellulären
Kompartimenten (z.B. Hitzeschockproteine, ATP aus Mitochondrien, Histone aus dem Zellkern..) oder vom Abbau extrazellulärer Matrix (Proteoglykanpeptide) stammen und
Gewebeschädigung signalisieren; man nennt sie daher DAMPs. Die molekularen Merkmale auf Mikroorganismen, die vom angeborenen Immunsystem erkannt werden, nennt man PAMPs. Diese pathogenassoziierten molekularen Muster sind entwicklungsgeschichtlich
hoch konserviert und weit verbreitet. PAMPs
sind Strukturen auf Mikroben, die vom angeborenen Immunsystem erkannt
und durch sie stimuliert werden (Teile
von Proteinen, Lipiden, Polysacchariden oder Nukleinsäuren). Mustererkennungsrezeptoren des angeborenen Systems erkennen PAMPs und
regen Immunreaktionen an. Beispiele: Toll-like Rezeptoren (Zellmembran), NOD-like
Rezeptoren (intrazellulär). PAMPs werden von Mustererkennungsrezeptoren gebunden, sind aber nicht für krankheitsverursachende Mikroorganismen spezifisch.
Die molekularen Merkmale auf Mikroorganismen, die vom angeborenen Immunsystem erkannt werden, nennt man PAMPs. Diese pathogenassoziierten molekularen Muster sind entwicklungsgeschichtlich
hoch konserviert und weit verbreitet. PAMPs
sind Strukturen auf Mikroben, die vom angeborenen Immunsystem erkannt
und durch sie stimuliert werden (Teile
von Proteinen, Lipiden, Polysacchariden oder Nukleinsäuren). Mustererkennungsrezeptoren des angeborenen Systems erkennen PAMPs und
regen Immunreaktionen an. Beispiele: Toll-like Rezeptoren (Zellmembran), NOD-like
Rezeptoren (intrazellulär). PAMPs werden von Mustererkennungsrezeptoren gebunden, sind aber nicht für krankheitsverursachende Mikroorganismen spezifisch. Mustererkennungsrezeptoren Pattern recognition receptors  Nach Doan / Lievano / Swanson-Mungerson / Viselli, Immunology (3rd ed). Lippincott Illustrated Reviews, Wolters Kluwer 2022 |
||||
| Rezeptor |
Erkennt folgende PAMPs: |
Aktiviert folgenden Transkriptionsfaktor: |
Aktiviert folgende Zytokine / Zelltypen: |
Schützt vor: |
| CLR |
extrazelluläre (Kohlenhydrate) |
NF-κB |
Th17-Zellen (Produktion von IL-17) |
Pilzen und Mykobakterien |
| NLR |
intrazelluläre (Peptidoglycane) |
n/a |
IL-1ß und IL-18 |
Bakterien |
| RIG-1 |
zytoplasmatische |
IRF-3 und NF-κB | Typ-I-Interferone und IL-1ß |
Viren |
| TLR 2, 5 |
extrazelluläre (Lipopeptide, Peptidoglycan, Flagellin) |
NF-κB | Typ-I-Interferone und IL-1ß | Bakterien und Pilzen |
| TLR 3 |
intrazelluläre (ssRNA und dsRNA) |
IRF-3 (vorwiegend) |
Typ-I-Interferone und proinflammatorische Zytokine |
Viren |
| TLR 7,8,9 |
intrazelluläre (RNA, DNA, CpG) |
NF-κB | proinflammatorische Zytokine |
Viren (RNA/DNA), CpG-Motive auf DNA von Bakterien oder Pilzen |
| TLR 4 |
extrazelluläre (LPS), ENV Proteine von RSV |
IRF-3 und NF-κB | Typ-I-Interferone und proinflammatorische Zytokine | Bakterien, Pilze, RSV |
 CpG = DNA-Stelle mit Cytosin-Guanin in 5'-3'-Richtung
CpG = DNA-Stelle mit Cytosin-Guanin in 5'-3'-Richtung  dsRNA = doppelsträngige RNA
dsRNA = doppelsträngige RNA  ENV = = envelope (virales Protein)
ENV = = envelope (virales Protein)  IL = Interleukin
IL = Interleukin  IRF-3 = interferon regulatory factor 3 (ein Transkriptionsfaktor)
IRF-3 = interferon regulatory factor 3 (ein Transkriptionsfaktor)  LPS = Lipopolysaccharid
LPS = Lipopolysaccharid  NLR = NOD-like Rezeptor
NLR = NOD-like Rezeptor  PAMPs = pathogen-accociated molecular patterns
PAMPs = pathogen-accociated molecular patterns  RIG-1 = retinoid acid-inducible gene 1
RIG-1 = retinoid acid-inducible gene 1  RSV = respiratory syncytial virus (RNA-Viren, die den oberen Respirationstrakt infizieren)
RSV = respiratory syncytial virus (RNA-Viren, die den oberen Respirationstrakt infizieren)  ssRNA = einzelsträngige RNA
ssRNA = einzelsträngige RNA  Th17 = T17-Helferzelle
Th17 = T17-Helferzelle  TLR = toll-like receptor
TLR = toll-like receptor Zu PAMPs zählen z.B. Lipopolysaccharide (LPS), wie sie sich in der Außenmembran Gram-negativer Bakterien finden. LPS können von mehreren Rezeptorarten erkannt
werden, darunter das Lipopolysaccharid-bindende Protein (LBP) oder
Toll-like-Rezeptoren (TLR). LPS aktivieren schon in geringer
Konzentration Makrophagen und Monozyten, was zur Freisetzung entzündungsfördernder (inflammatorischer) Zytokine führt. LPS gelten als sehr wirksame Endotoxine, sie wirken pyrogen (fiebererzeugend).
Zu PAMPs zählen z.B. Lipopolysaccharide (LPS), wie sie sich in der Außenmembran Gram-negativer Bakterien finden. LPS können von mehreren Rezeptorarten erkannt
werden, darunter das Lipopolysaccharid-bindende Protein (LBP) oder
Toll-like-Rezeptoren (TLR). LPS aktivieren schon in geringer
Konzentration Makrophagen und Monozyten, was zur Freisetzung entzündungsfördernder (inflammatorischer) Zytokine führt. LPS gelten als sehr wirksame Endotoxine, sie wirken pyrogen (fiebererzeugend).  Auch formylierte Proteine
- charakteristisch für bakterielle Proteinsynthese und auch von
beschädigten Mitochondrien freigesetzt - werden von PRR des
Immunsystems erkannt (FPR: formyl peptide receptors). Sowohl Bakterien als auch Mitochondrien nutzen Formylmethionin als Starter-Aminosäure
ihrer Proteinsynthese (Körperzellen hingegen nutzen Methionin als
Starter). Damit kann das Immunsystem über formylierte Proteinmoleküle
einerseits die Anwesenheit von Bakterien (MAMPs / PAMPs), andererseits
mitochondrialer Eiweiße im Extrazellulärraum (DAMPs: Mithchondrien aus
verletzten Zellen) detektieren.
Auch formylierte Proteine
- charakteristisch für bakterielle Proteinsynthese und auch von
beschädigten Mitochondrien freigesetzt - werden von PRR des
Immunsystems erkannt (FPR: formyl peptide receptors). Sowohl Bakterien als auch Mitochondrien nutzen Formylmethionin als Starter-Aminosäure
ihrer Proteinsynthese (Körperzellen hingegen nutzen Methionin als
Starter). Damit kann das Immunsystem über formylierte Proteinmoleküle
einerseits die Anwesenheit von Bakterien (MAMPs / PAMPs), andererseits
mitochondrialer Eiweiße im Extrazellulärraum (DAMPs: Mithchondrien aus
verletzten Zellen) detektieren. Weiters sind körperfremde DNA / RNA
bedrohlich - solche Nukleinsäuren sind Überträger potentiell
gefährlicher Information. Die Unterscheidung zwischen fremder und
eigener Nukleinsäure gelingt durch das Zusammenwirken mehrerer PRRs,
wie TLR3 auf der Zellmembran; TLR3, 7, 8 und 9 auf Endozytosevesikeln
und zahlreichen weiteren Nukleinsäuresensoren im Zytoplasma. Sowohl der
Ort als auch die Struktur der DNA sind wesentlich: Die Anwesenheit
außerhalb des Zellkerns deutet auf Zellschädigung hin; die Basenfolge
spielt eine Rolle für die Erkennung mikrobiellen Ursprungs. Zur
Erkennung intrazellulärer Fremdnukleotide dienen zelluläre
(körpereigene) Proteine, die mikrobielle RNA (RLRs, RIG-like receptors, und MDA5, melanoma differentiation-associated protein 5) oder DNA erkennen (CDSs, cytosolic DNA sensors).
Weiters sind körperfremde DNA / RNA
bedrohlich - solche Nukleinsäuren sind Überträger potentiell
gefährlicher Information. Die Unterscheidung zwischen fremder und
eigener Nukleinsäure gelingt durch das Zusammenwirken mehrerer PRRs,
wie TLR3 auf der Zellmembran; TLR3, 7, 8 und 9 auf Endozytosevesikeln
und zahlreichen weiteren Nukleinsäuresensoren im Zytoplasma. Sowohl der
Ort als auch die Struktur der DNA sind wesentlich: Die Anwesenheit
außerhalb des Zellkerns deutet auf Zellschädigung hin; die Basenfolge
spielt eine Rolle für die Erkennung mikrobiellen Ursprungs. Zur
Erkennung intrazellulärer Fremdnukleotide dienen zelluläre
(körpereigene) Proteine, die mikrobielle RNA (RLRs, RIG-like receptors, und MDA5, melanoma differentiation-associated protein 5) oder DNA erkennen (CDSs, cytosolic DNA sensors). RIG-I (retinoid acid-inducible gene 1)-Rezeptoren (RLRs) sind intrazelluläre PRRs. Es sind Hekilasen zur
Erkennung von kurzen doppelsträngigen viralen RNA-Sequenzen (dsRNA).
Sie können Typ I-Interferon-Antworten auslösen und sind ein
essentieller Faktor der angeborenen Abwehr. RLRs werden von zahlreichen
Zelltypen exprimiert, die zu Infektion durch RNA-Viren neigen.
RIG-I (retinoid acid-inducible gene 1)-Rezeptoren (RLRs) sind intrazelluläre PRRs. Es sind Hekilasen zur
Erkennung von kurzen doppelsträngigen viralen RNA-Sequenzen (dsRNA).
Sie können Typ I-Interferon-Antworten auslösen und sind ein
essentieller Faktor der angeborenen Abwehr. RLRs werden von zahlreichen
Zelltypen exprimiert, die zu Infektion durch RNA-Viren neigen.  Kohlenhydrate werden von Immunrezeptoren nach ihrem Glykosylierungsmuster
klassifiziert; beispielsweise sind Mannose (Bakterien) oder ß-Glukan
(pathogene Pilze) Hinweise auf die Anwesenheit körperfremder
Oberflächen.
Kohlenhydrate werden von Immunrezeptoren nach ihrem Glykosylierungsmuster
klassifiziert; beispielsweise sind Mannose (Bakterien) oder ß-Glukan
(pathogene Pilze) Hinweise auf die Anwesenheit körperfremder
Oberflächen. Rezeptoren auf Phagozyten (Scavangerrezeptoren) erkennen unterschiedliche Liganden und vermitteln Aufnahme und lysosomalen Abbau der gebundenen Merkmale.
Rezeptoren auf Phagozyten (Scavangerrezeptoren) erkennen unterschiedliche Liganden und vermitteln Aufnahme und lysosomalen Abbau der gebundenen Merkmale. Mustererkennungsrezeptoren (PRRs) auf und in Phagozyten, dendritischen Zellen, B-Lymphozyten, Endothel- und vielen anderen Zellen, und
Mustererkennungsrezeptoren (PRRs) auf und in Phagozyten, dendritischen Zellen, B-Lymphozyten, Endothel- und vielen anderen Zellen, und Anregung zur Phagozytose (Opsonisierung) und Antigenpräsentation.
Anregung zur Phagozytose (Opsonisierung) und Antigenpräsentation.
 Abbildung: Mustererkennungsrezeptoren
Abbildung: Mustererkennungsrezeptoren  BCL-10, B-cell lymphoma/leukemia 10, CARD-hältiges Protein
BCL-10, B-cell lymphoma/leukemia 10, CARD-hältiges Protein  CARD9, Caspase recruitment domain-containing protein 9, Adapterprotein
CARD9, Caspase recruitment domain-containing protein 9, Adapterprotein  Caspasen s. dort
Caspasen s. dort  IRAK, Interleukin-1 receptor-associated kinases, Proteinkinasen
IRAK, Interleukin-1 receptor-associated kinases, Proteinkinasen  IRF3, Interferon regulatory factor 3, spielt eine wichtige Rolle bei der angeborenen Viren
IRF3, Interferon regulatory factor 3, spielt eine wichtige Rolle bei der angeborenen Viren  MALT1, Mucosa-associated lymphoid tissue lymphoma translocation protein 1, Paracaspase
MALT1, Mucosa-associated lymphoid tissue lymphoma translocation protein 1, Paracaspase  MKK, MAP-Kinase-Kinase
MKK, MAP-Kinase-Kinase  MyD88, Myeloid differentiation primary response 88, Adapterprotein
MyD88, Myeloid differentiation primary response 88, Adapterprotein  Ras/Raf-System:
Ras sind normalerweise inaktive Proteine an Tyrosinkinasemolekülen der
Zellmembran, sie werden durch Bindung eines Signalstoffs an den
Rezeptor "eingeschaltet" und aktivieren intrazelluläre Proteine, die
wiederum die Transkription entsprechender Genabschnitte induzieren
Ras/Raf-System:
Ras sind normalerweise inaktive Proteine an Tyrosinkinasemolekülen der
Zellmembran, sie werden durch Bindung eines Signalstoffs an den
Rezeptor "eingeschaltet" und aktivieren intrazelluläre Proteine, die
wiederum die Transkription entsprechender Genabschnitte induzieren  Syk (Spleen tyrosine kinase), Tyrosinkinase
Syk (Spleen tyrosine kinase), Tyrosinkinase  TRAF, TNF receptor associated factors, Signaltransduktionsproteine
TRAF, TNF receptor associated factors, Signaltransduktionsproteine  TRIF, TIR-domain-containing adapter-inducing interferon-β, Adapterprotein
TRIF, TIR-domain-containing adapter-inducing interferon-β, Adapterprotein
 mit
Zellen assoziierte Rezeptoren (in der Zellmembran, in
Phagozytosevesikeln und im Zytoplasma - überall, wo Mikroben sein
können) wie Toll-like Rezeptoren (TLRs), intrazelluläre Nod-like receptors (NLRs), Scavenger receptors u.a., sowie
mit
Zellen assoziierte Rezeptoren (in der Zellmembran, in
Phagozytosevesikeln und im Zytoplasma - überall, wo Mikroben sein
können) wie Toll-like Rezeptoren (TLRs), intrazelluläre Nod-like receptors (NLRs), Scavenger receptors u.a., sowie lösliche Faktoren, wie Collectine, Ficoline, Pentraxine oder Komplementfaktoren.
lösliche Faktoren, wie Collectine, Ficoline, Pentraxine oder Komplementfaktoren. Nukleinsäuren (z.B. Doppelstrang-RNA),
Nukleinsäuren (z.B. Doppelstrang-RNA), Proteine (z.B. Flagellin, erkannt durch TLR5; Pilin),
Proteine (z.B. Flagellin, erkannt durch TLR5; Pilin),  Zellwandlipide (z.B. Lipopolysaccharid, erkannt durch TLR4; Lipoteichonsäuren) und
Zellwandlipide (z.B. Lipopolysaccharid, erkannt durch TLR4; Lipoteichonsäuren) und Kohlenhydrate (z.B. Glucane, Mannane).
Kohlenhydrate (z.B. Glucane, Mannane). Das angeborene Immunsystem erkennt auch Produkte von beschädigten Zellen (DAMPs):
Das angeborene Immunsystem erkennt auch Produkte von beschädigten Zellen (DAMPs): Stressinduzierte Proteine (z.B. Hitzeschockprotein),
Stressinduzierte Proteine (z.B. Hitzeschockprotein), Kristalle (z.B. Harnsäure),
Kristalle (z.B. Harnsäure), Matrixproteine (z.B. Proteoglykanpeptide),
Matrixproteine (z.B. Proteoglykanpeptide), Mitochondrien bzw. deren Komponenten (z.B. formylierte Proteine),
Mitochondrien bzw. deren Komponenten (z.B. formylierte Proteine), Kernproteine (z.B. Histone).
Kernproteine (z.B. Histone). Das Erkennen von MAMPs
/ PAMPs / DAMPs aktiviert Signaltransduktionswege mit dem
Ziel antimikrobieller und entzündungsfördernder Aktivität.
Das Erkennen von MAMPs
/ PAMPs / DAMPs aktiviert Signaltransduktionswege mit dem
Ziel antimikrobieller und entzündungsfördernder Aktivität. Eine Entzündung (inflammation) ist
eine Reaktion gefäßhaltigen
Gewebes auf Gewebeschäden. Sie erhöht die Durchlässigkeit der
Gefäßwände und erleichtert dadurch den Übertritt von Antikörpern, Komplementfaktoren und Leukozyten in irritiertes Gewebe (
Eine Entzündung (inflammation) ist
eine Reaktion gefäßhaltigen
Gewebes auf Gewebeschäden. Sie erhöht die Durchlässigkeit der
Gefäßwände und erleichtert dadurch den Übertritt von Antikörpern, Komplementfaktoren und Leukozyten in irritiertes Gewebe ( Abbildung). Sowohl die Zytokinfreisetzung als auch die Expression von Zytokinrezeptoren nimmt dabei stark zu. Angeborene Abwehrmechanismen führen
generell, adaptive gelegentlich zu akuten Entzündungen.
Abbildung). Sowohl die Zytokinfreisetzung als auch die Expression von Zytokinrezeptoren nimmt dabei stark zu. Angeborene Abwehrmechanismen führen
generell, adaptive gelegentlich zu akuten Entzündungen. 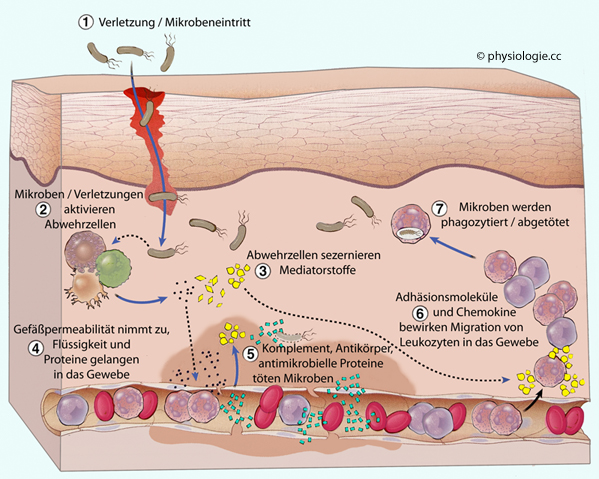
 Abbildung: Akute Entzündung
Abbildung: Akute Entzündung
 Vasodilatation und erhöhen dadurch die Durchblutung (Rötung, Erwärmung des entzündeten Gewebes - rubor, calor),
Vasodilatation und erhöhen dadurch die Durchblutung (Rötung, Erwärmung des entzündeten Gewebes - rubor, calor), Austritt (Exsudation) von Proteinen und dadurch (kolloidosmotischer Effekt) Schwellung (tumor).
Austritt (Exsudation) von Proteinen und dadurch (kolloidosmotischer Effekt) Schwellung (tumor). Abbildung) gehören (Ig = Immunglobulin).
Abbildung) gehören (Ig = Immunglobulin).
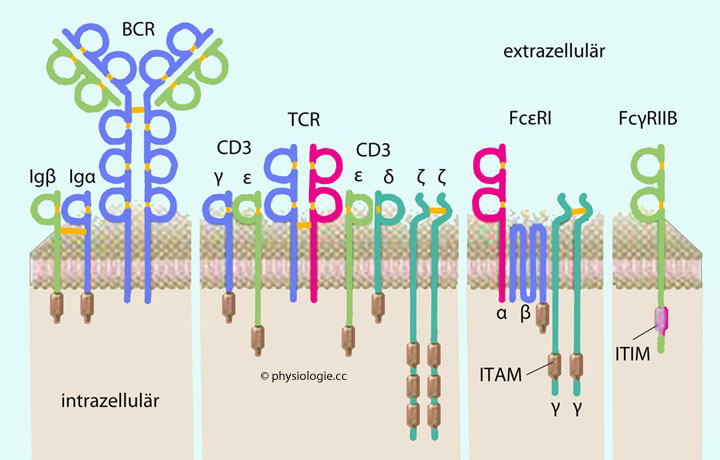
 Abbildung: Mitglieder der Immunrezeptorfamilie (Auswahl)
Abbildung: Mitglieder der Immunrezeptorfamilie (Auswahl) Einem mit extrazellulären
Erkennungsdomänen (BCR = B-Zell-Rezeptor, TCR = T-Zell-Rezeptor, FcεRI
= IgE-Rezeptor) und
Einem mit extrazellulären
Erkennungsdomänen (BCR = B-Zell-Rezeptor, TCR = T-Zell-Rezeptor, FcεRI
= IgE-Rezeptor) und  einem assoziierten mit intrazellulären ITAMs (Immunoreceptor Tyrosin-based Activation Motifs). Auf intrazelluläre Signalwege inaktivierend wirken ITIMs (Immunoreceptor Tyrosin-based Inhibitory Motifs) - wie beim inhibitorischen Rezeptor FcγRIIB.
einem assoziierten mit intrazellulären ITAMs (Immunoreceptor Tyrosin-based Activation Motifs). Auf intrazelluläre Signalwege inaktivierend wirken ITIMs (Immunoreceptor Tyrosin-based Inhibitory Motifs) - wie beim inhibitorischen Rezeptor FcγRIIB.
 Abbildung) durch Phosphatase-Aktivität.
Abbildung) durch Phosphatase-Aktivität.  Ein ITAM (Immunoreceptor Tyrosin-based Activation Motif) ist
ein Proteinmotiv in der Membran von Immunzellen, in der Nachbarschaft
diverser anderer Membranproteine (Immunglobuline, Fc-Rezeptoren, CD3
u.a). Binden betreffende Rezeptoren ihre Liganden, werden ITAMs an
Tyrosinresten phosphoryliert und bewirken die Produktion von Zytokinen,
Exozytose zytotoxischer Granula u.a.
Ein ITAM (Immunoreceptor Tyrosin-based Activation Motif) ist
ein Proteinmotiv in der Membran von Immunzellen, in der Nachbarschaft
diverser anderer Membranproteine (Immunglobuline, Fc-Rezeptoren, CD3
u.a). Binden betreffende Rezeptoren ihre Liganden, werden ITAMs an
Tyrosinresten phosphoryliert und bewirken die Produktion von Zytokinen,
Exozytose zytotoxischer Granula u.a.  Abbildung). Sie tragen ein für
die Aktivierung benötigtes "zweites Signal" (second signal) bei (die Antigenerkennung ist das erste Signal).
Abbildung). Sie tragen ein für
die Aktivierung benötigtes "zweites Signal" (second signal) bei (die Antigenerkennung ist das erste Signal). Ein Costimulator ist ein von antigenpräsentierenden Zellen exprimiertes Molekül. Zusätzlich zum Antigenreiz
vermittelt er ein Signal zur
Aktivierung einer naiven T-Zelle.
Ein Costimulator ist ein von antigenpräsentierenden Zellen exprimiertes Molekül. Zusätzlich zum Antigenreiz
vermittelt er ein Signal zur
Aktivierung einer naiven T-Zelle.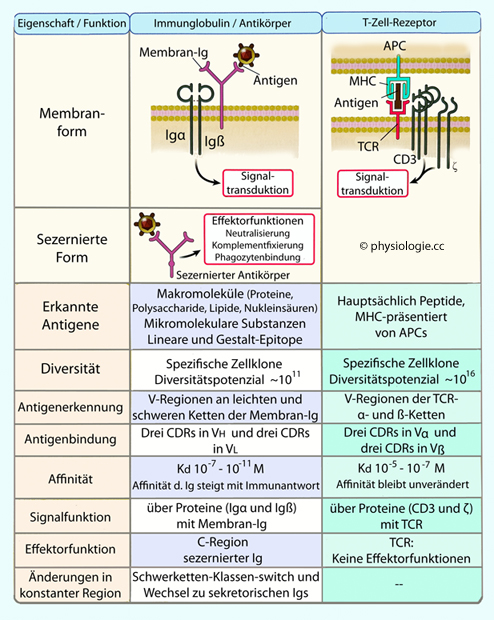
 Abbildung: Charakteristika von Immunrezeptoren
Abbildung: Charakteristika von Immunrezeptoren
 Sowohl Immunglobuline / Antikörper als auch T-Zell-Rezeptoren (TCR) verfügen über variable (V) sowie
phylogenetisch konservierte (C) Regionen. Innerhalb der V-Regionen gibt
es relativ kurze epitoperkennende hypervariable Regionen (CDRs, complementarity-determining regions).
Sie sind komplementär, indem sie einen "Abdruck" der Form des Epitpos
darstellen (Schlüssel-Schloss-Prinzip). Hohe Variabilität ihrer
Zusammensetzung ergibt die Vielfalt an Epitopen, die vom adaptiven
Immunsystem spezifisch erkannt werden können.
Sowohl Immunglobuline / Antikörper als auch T-Zell-Rezeptoren (TCR) verfügen über variable (V) sowie
phylogenetisch konservierte (C) Regionen. Innerhalb der V-Regionen gibt
es relativ kurze epitoperkennende hypervariable Regionen (CDRs, complementarity-determining regions).
Sie sind komplementär, indem sie einen "Abdruck" der Form des Epitpos
darstellen (Schlüssel-Schloss-Prinzip). Hohe Variabilität ihrer
Zusammensetzung ergibt die Vielfalt an Epitopen, die vom adaptiven
Immunsystem spezifisch erkannt werden können. B-Lymphozyten erkennen über ihre membrangebundenen Immunglobuline (Ig)
zahlreiche verschiedene Stoffklassen, während T-Zell-Rezeptoren (TCR)
ausschließlich MHC-gebundene Peptide binden.
B-Lymphozyten erkennen über ihre membrangebundenen Immunglobuline (Ig)
zahlreiche verschiedene Stoffklassen, während T-Zell-Rezeptoren (TCR)
ausschließlich MHC-gebundene Peptide binden. Die Antigenrezeptoren von B-Zellen erkennen die Gestalt (Form, conformation)
der Epitope (Proteine, Nukleinsäuren, Kohlenhydraten, kleineren
Molekülen); TCR erkennen MHC-gebundene Peptide nur über deren
Aminosäuresequenz ("lineare" Epitope).
Die Antigenrezeptoren von B-Zellen erkennen die Gestalt (Form, conformation)
der Epitope (Proteine, Nukleinsäuren, Kohlenhydraten, kleineren
Molekülen); TCR erkennen MHC-gebundene Peptide nur über deren
Aminosäuresequenz ("lineare" Epitope). Antigenrezeptoren kooperieren mit weiteren Membranproteinen, über
welche - nach Bindung eines Antigens - Signale an das Zellinnere
vermittelt werden (Antikörper: Igα, Igß; TCR: CD3, ζ). Die
resultierenden Proteingruppen heißen B-Zell-Rezeptorkomplex bzw.
TCR-Komplex. Anregung dieser Molekülkomplexe durch Bindung von Antigen führt zur Aktivierung von
Tyrosinkinasen sowie zu Transkription und
Synthese verschiedener Proteine. Das bewirkt entsprechende Reaktionen
des Lymphozyten - Differenzierung, Zellteilung, Aktivierung von
Effektorfunktionen, machmal auch Apoptose.
Antigenrezeptoren kooperieren mit weiteren Membranproteinen, über
welche - nach Bindung eines Antigens - Signale an das Zellinnere
vermittelt werden (Antikörper: Igα, Igß; TCR: CD3, ζ). Die
resultierenden Proteingruppen heißen B-Zell-Rezeptorkomplex bzw.
TCR-Komplex. Anregung dieser Molekülkomplexe durch Bindung von Antigen führt zur Aktivierung von
Tyrosinkinasen sowie zu Transkription und
Synthese verschiedener Proteine. Das bewirkt entsprechende Reaktionen
des Lymphozyten - Differenzierung, Zellteilung, Aktivierung von
Effektorfunktionen, machmal auch Apoptose. Abbildung:
Abbildung: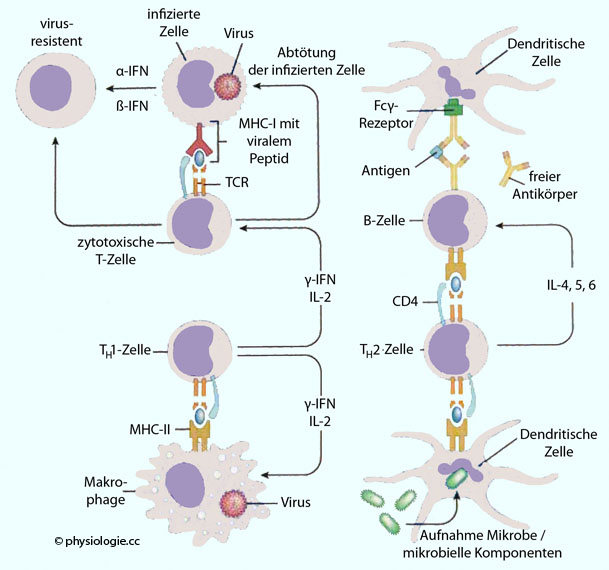
 Abbildung: Immunantwort
Abbildung: Immunantwort
 Man schätzt, dass der Mensch die Kapazität zur Erkennung / spezifischen Bindung von 1015 (~einer Billiarde) unterschiedlicher Epitope hat.
Man schätzt, dass der Mensch die Kapazität zur Erkennung / spezifischen Bindung von 1015 (~einer Billiarde) unterschiedlicher Epitope hat. Chromosom 2 (κ-Leichtkette),
Chromosom 2 (κ-Leichtkette),  Chromosom 14 (schwere Kette) und
Chromosom 14 (schwere Kette) und  Chromosom 22 (λ-Leichtkette) (
Chromosom 22 (λ-Leichtkette) ( Abbildung).
Abbildung). 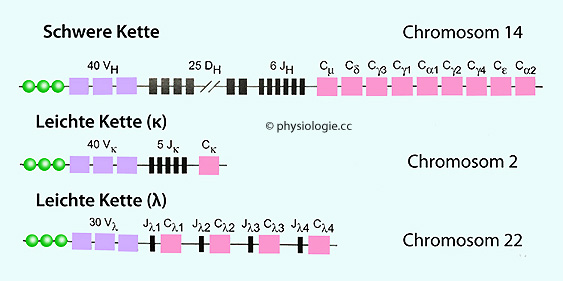
 Abbildung: Chromosomale Genorte für Immunglobuline
Abbildung: Chromosomale Genorte für Immunglobuline Mehr zu B-Lymphozyten und Rezeptordiversität s. dort
Mehr zu B-Lymphozyten und Rezeptordiversität s. dort für die β- und γ-Ketten auf Chromosom 7,
für die β- und γ-Ketten auf Chromosom 7,  für α- und δ-Ketten auf Chromosom 14 (
für α- und δ-Ketten auf Chromosom 14 ( Abbildung).
Abbildung). 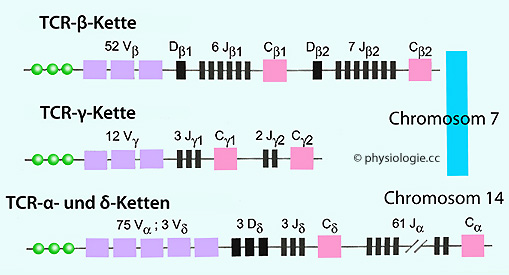
 Abbildung: Chromosomale Genorte für T-Zell-Rezeptoren (TCR)
Abbildung: Chromosomale Genorte für T-Zell-Rezeptoren (TCR) Mehr zu T-Lymphozyten und Rezeptordiversität s. dort
Mehr zu T-Lymphozyten und Rezeptordiversität s. dort

 RAG1 und RAG2 sind
Gene (RAG: Recombination activating gene), die den Bauplan für VDJ-Rekombinasen (wie Rag-1, Rag-2) codieren. Sie werden von
sich entwickelnden B- und T-Lymphozyten exprimiert. Dadurch können
diese reifen und durch genetische Rekombination funktionsfähige Immunglobuline bzw. T-Zell-Rezeptoren
ausbilden.
RAG1 und RAG2 sind
Gene (RAG: Recombination activating gene), die den Bauplan für VDJ-Rekombinasen (wie Rag-1, Rag-2) codieren. Sie werden von
sich entwickelnden B- und T-Lymphozyten exprimiert. Dadurch können
diese reifen und durch genetische Rekombination funktionsfähige Immunglobuline bzw. T-Zell-Rezeptoren
ausbilden.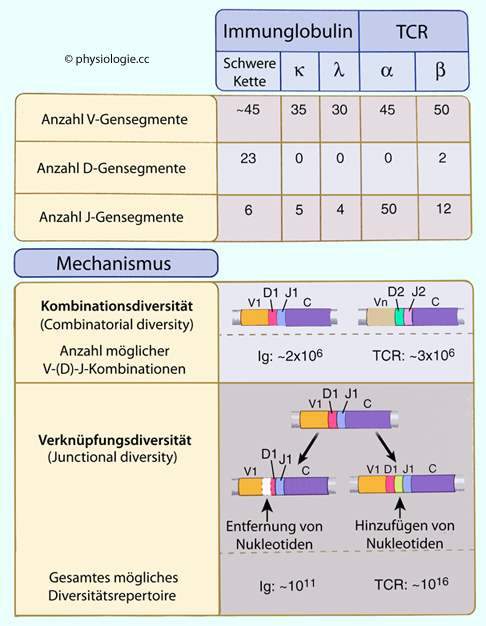
 Abbildung: Wie Diversität in Antigenrezeptoren entsteht
Abbildung: Wie Diversität in Antigenrezeptoren entsteht
 Unterschiedliche Mischungen von V-, D- und J-Genen in verschiedenen Lymphozytenklonen ergibt hohe Kombinationsdiversität (combinatorial diversity). Das Ausmaß dieser Diversität ist durch die Zahl der verfügbaren V-, D- und J-Sehmente limitiert.
Unterschiedliche Mischungen von V-, D- und J-Genen in verschiedenen Lymphozytenklonen ergibt hohe Kombinationsdiversität (combinatorial diversity). Das Ausmaß dieser Diversität ist durch die Zahl der verfügbaren V-, D- und J-Sehmente limitiert. Abbildung). Dabei
werden die Verbindungen zwischen den Genblöcken nicht präzise
zusammengestellt, und diese Form der Diversität ergibt praktisch
unbegrenzt viele Möglichkeiten. Allerdings können im Rahmen dieses
Mechanismus Transkriptionsraster verschoben werden (drei Nukleotide → eine Aminosäure) und "Nonsense"-Proteine auftreten.
Abbildung). Dabei
werden die Verbindungen zwischen den Genblöcken nicht präzise
zusammengestellt, und diese Form der Diversität ergibt praktisch
unbegrenzt viele Möglichkeiten. Allerdings können im Rahmen dieses
Mechanismus Transkriptionsraster verschoben werden (drei Nukleotide → eine Aminosäure) und "Nonsense"-Proteine auftreten.  Mit
junktionaler Diversität erhöht sich die Zahl möglicher Muster bei
Antikörpern auf ~5.1013, bei T-Zell-Rezeptoren auf ~1018.
Mit
junktionaler Diversität erhöht sich die Zahl möglicher Muster bei
Antikörpern auf ~5.1013, bei T-Zell-Rezeptoren auf ~1018. Abbildung):
Abbildung):  Exonukleasen entfernen Nukleotide von V-, D- und J-Genen an der Rekombinationsstelle
Exonukleasen entfernen Nukleotide von V-, D- und J-Genen an der Rekombinationsstelle Desoxyribonukleotidtransferase (terminal deoxynucleotidyl transferase TdT) fügt Nukleotide zwischen V-, D- und J- Segmenten an. TdT kann bei der Rekombination bis zu 20 Nukleotide hinzufügen
bzw. abtrennen, was die Zahl möglicher finaler Rezeptorstrukturen um
mehrere Zehnerpotenzern erhöht.
Desoxyribonukleotidtransferase (terminal deoxynucleotidyl transferase TdT) fügt Nukleotide zwischen V-, D- und J- Segmenten an. TdT kann bei der Rekombination bis zu 20 Nukleotide hinzufügen
bzw. abtrennen, was die Zahl möglicher finaler Rezeptorstrukturen um
mehrere Zehnerpotenzern erhöht. Im Zuge von DNA-Reparaturen erzeugt das
Enzym ARTEMIS asymmetrische Schleifenanteile, in die neue Nukleotide
(P-Nukleotide) eingefügt werden - dadurch entstehen neue DNA-Sequenzen.
Im Zuge von DNA-Reparaturen erzeugt das
Enzym ARTEMIS asymmetrische Schleifenanteile, in die neue Nukleotide
(P-Nukleotide) eingefügt werden - dadurch entstehen neue DNA-Sequenzen. Erkennung des fraglichen Materials als fremd bzw. gefährlich
Erkennung des fraglichen Materials als fremd bzw. gefährlich Frühe (angeborene) Reaktion auf die Erkennung
Frühe (angeborene) Reaktion auf die Erkennung Langsamere spezifische Reaktion auf ein bestimmtes Antigen (adaptive Antwort)
Langsamere spezifische Reaktion auf ein bestimmtes Antigen (adaptive Antwort) Verstärkung dieser Antwort
Verstärkung dieser Antwort Immunologisches Gedächtnis
Immunologisches Gedächtnis Als Antigene bezeichnet
man Moleküle, die von Antikörpern und/oder Lymphozyten über Rezeptoren spezifisch erkannt und gebunden werden. Die
kleinsten individuell erkennbaren Teile von Antigenen (minimum recognition unit), die von
Immunrezeptoren gebunden werden können (in diesen Rezeptor "passen"),
nennt man Epitope (jedes Antigen enthält ein oder mehrere Epitope) oder antigene Determinanten (vermutlich 4-6 Aminosäuren; oft ist die Verwendung der Begriffe "Antigen" und "Epitop" auf das adaptive System beschränkt).
Als Antigene bezeichnet
man Moleküle, die von Antikörpern und/oder Lymphozyten über Rezeptoren spezifisch erkannt und gebunden werden. Die
kleinsten individuell erkennbaren Teile von Antigenen (minimum recognition unit), die von
Immunrezeptoren gebunden werden können (in diesen Rezeptor "passen"),
nennt man Epitope (jedes Antigen enthält ein oder mehrere Epitope) oder antigene Determinanten (vermutlich 4-6 Aminosäuren; oft ist die Verwendung der Begriffe "Antigen" und "Epitop" auf das adaptive System beschränkt). 
 Solche, deren Produktion eine Beteiligung von T-Lymphozyten erfordert (thymus-dependent antigens), z.B. die meisten Proteine; und
Solche, deren Produktion eine Beteiligung von T-Lymphozyten erfordert (thymus-dependent antigens), z.B. die meisten Proteine; und  solche, welche spezifische B-Lymphozyten direkt anregen können (thymus-independent antigens), z.B. bakterielle Polysaccharide.
Letztere benötigen zur Antikörperbildung keine Kooperation mit
T-Zellen, vernetzen direkt B-Zell-Rezeptoren an der Oberfläche von
B-Zellen, produzieren vor allem IgM und IgG2-Antikörper und lassen nur schwach ausgeprägtes immunologisches Gedächtnis zurück.
solche, welche spezifische B-Lymphozyten direkt anregen können (thymus-independent antigens), z.B. bakterielle Polysaccharide.
Letztere benötigen zur Antikörperbildung keine Kooperation mit
T-Zellen, vernetzen direkt B-Zell-Rezeptoren an der Oberfläche von
B-Zellen, produzieren vor allem IgM und IgG2-Antikörper und lassen nur schwach ausgeprägtes immunologisches Gedächtnis zurück. Immunogene lösen nicht nur eine Antwort des Immunsystems aus, sondern diese Antwort ist auch spezifisch gegen sie gerichtet. Im angeborenen
System erfolgt die Antwort sofort, bei wiederholter Exposition des
Körpers wiederholt sich der Vorgang immer in gleicher Weise. Im adaptiven
System hingegen erfolgt auf die erstmalige Konfrontation des Körpers
eine Klonselektion, die Zahl der spezifisch gegen das Epitop / Antigen
gerichteten Zellen vermehrt sich (und damit die Intensität der -
verzögerten - spezifischen Abwehr), einige Gedächtniszellen bleiben für
lange Zeit im Körper und erlauben bei einer nächsten Konfrontation mit
demselben Epitop / Antigen eine raschere spezifische Abwehrreaktion.
Immunogene lösen nicht nur eine Antwort des Immunsystems aus, sondern diese Antwort ist auch spezifisch gegen sie gerichtet. Im angeborenen
System erfolgt die Antwort sofort, bei wiederholter Exposition des
Körpers wiederholt sich der Vorgang immer in gleicher Weise. Im adaptiven
System hingegen erfolgt auf die erstmalige Konfrontation des Körpers
eine Klonselektion, die Zahl der spezifisch gegen das Epitop / Antigen
gerichteten Zellen vermehrt sich (und damit die Intensität der -
verzögerten - spezifischen Abwehr), einige Gedächtniszellen bleiben für
lange Zeit im Körper und erlauben bei einer nächsten Konfrontation mit
demselben Epitop / Antigen eine raschere spezifische Abwehrreaktion. Haptene sind
kleine Moleküle (meist
nicht-biologischen Ursprungs: z.B. Dinitrophenol, Nickel,..), die sich
wie synthetische Epitope verhalten. Alleine sind sie nicht in der Lage,
eine Immunreaktion auszulösen, können aber mit bereits existierenden
Antikörpern reagieren: Sind sie an ein Immunogen (hier
auch als Carrier bezeichnet -
insbesondere körpereigene Proteine) gebunden, können Immunantworten
sowohl gegen dieses als auch gegen das Hapten ausgelöst werden
(Sensibilisierung). Wiederholte Exposition mit einem solchen
Immunogen-Hapten-Komplex führt zu entzündlichen Reaktionen und u.U.
Autoimmunität.
Haptene sind
kleine Moleküle (meist
nicht-biologischen Ursprungs: z.B. Dinitrophenol, Nickel,..), die sich
wie synthetische Epitope verhalten. Alleine sind sie nicht in der Lage,
eine Immunreaktion auszulösen, können aber mit bereits existierenden
Antikörpern reagieren: Sind sie an ein Immunogen (hier
auch als Carrier bezeichnet -
insbesondere körpereigene Proteine) gebunden, können Immunantworten
sowohl gegen dieses als auch gegen das Hapten ausgelöst werden
(Sensibilisierung). Wiederholte Exposition mit einem solchen
Immunogen-Hapten-Komplex führt zu entzündlichen Reaktionen und u.U.
Autoimmunität. Tolerogene
lösen immunologische Toleranz gegen sie aus. Das können körpereigene
Merkmale sein, gegen die das Immunsystem im Zuge der Entwicklung des
immunologischen Repertoirs lernt, nicht zu reagieren (immunologische Toleranz) oder auch Antigene, die oral aufgenommen werden (Nahrungsbestandteile).
Tolerogene
lösen immunologische Toleranz gegen sie aus. Das können körpereigene
Merkmale sein, gegen die das Immunsystem im Zuge der Entwicklung des
immunologischen Repertoirs lernt, nicht zu reagieren (immunologische Toleranz) oder auch Antigene, die oral aufgenommen werden (Nahrungsbestandteile).
 Abbildung: Aufbereitung und Präsentation von antigenen Peptiden
Abbildung: Aufbereitung und Präsentation von antigenen Peptiden
 Molekülgröße (Proteine >10 kDa sind meist immunogener als kleinere),
Molekülgröße (Proteine >10 kDa sind meist immunogener als kleinere),  Komplexität des Moleküls (zahlreichere Epitope möglich),
Komplexität des Moleküls (zahlreichere Epitope möglich),  Konformation (räumliche Anordnung - Epitope müssen zugänglich sein für den immunologischen Erkennungsmechanismus),
Konformation (räumliche Anordnung - Epitope müssen zugänglich sein für den immunologischen Erkennungsmechanismus),  chemischen Eigenschaften: Phagozyten
chemischen Eigenschaften: Phagozyten  bauen das Immunogen enzymatisch ab und "präsentieren" Spaltprudukte (
bauen das Immunogen enzymatisch ab und "präsentieren" Spaltprudukte ( Abbildung oben) als potenzielle Epitope an Lymphozyten. Polypeptide aus
L-Aminosäuren sind der Proteolyse zugänglich, gut abbaubar und
immunogen; Lipide, Steroide, viele Kohlenhydrate sind hingegen kaum immunogen.
Abbildung oben) als potenzielle Epitope an Lymphozyten. Polypeptide aus
L-Aminosäuren sind der Proteolyse zugänglich, gut abbaubar und
immunogen; Lipide, Steroide, viele Kohlenhydrate sind hingegen kaum immunogen.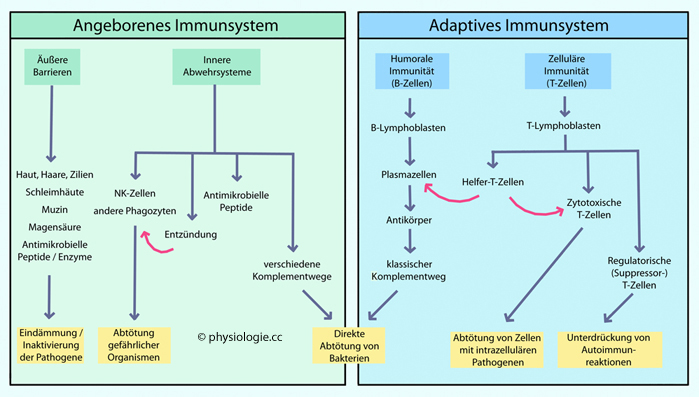
 Abbildung: Angeborenes und adaptives System
Abbildung: Angeborenes und adaptives System

 Abbildung: PAMPs und DAMPs
Abbildung: PAMPs und DAMPs
 Bewertung des pathogenen Potentials: Mikrobielle
Merkmale finden sich nicht nur auf pathogenen Mikroorganismen, sondern auch
auf Kommensalen
Bewertung des pathogenen Potentials: Mikrobielle
Merkmale finden sich nicht nur auf pathogenen Mikroorganismen, sondern auch
auf Kommensalen , d.h. Mitgliedern der Normalflora - sogenannte
Mikrobiotope:
, d.h. Mitgliedern der Normalflora - sogenannte
Mikrobiotope: Ektokommensalen auf äußeren Oberflächen (z.B.
Haut).
Ektokommensalen auf äußeren Oberflächen (z.B.
Haut).  Endokommensalen
auf inneren Oberflächen (z.B. Darm).
Endokommensalen
auf inneren Oberflächen (z.B. Darm).  Immunreaktion / Abwehr: Der Identifikation betreffender Merkmale (DAMPs, PAMPs / MAMPs) folgen verschiedene
Wirk- bzw. Abtötungsmechanismen (auch Fremdsubstanzen können gelegentlich Immunantworten auslösen).
Die Antwort der Immunzelle kann Zellteilung und Differenzierung,
Entleerung von Granula, Zytokinbildung, oder auch Apoptose sein. Bei
der "Übersetzung" des Reizes an der Membran zur zellulären Reaktion
spielen Enzyme, second messengers, Transkriptionsfaktoren u.a. eine
tragende Rolle (vgl. Zellphysiologie).
Immunreaktion / Abwehr: Der Identifikation betreffender Merkmale (DAMPs, PAMPs / MAMPs) folgen verschiedene
Wirk- bzw. Abtötungsmechanismen (auch Fremdsubstanzen können gelegentlich Immunantworten auslösen).
Die Antwort der Immunzelle kann Zellteilung und Differenzierung,
Entleerung von Granula, Zytokinbildung, oder auch Apoptose sein. Bei
der "Übersetzung" des Reizes an der Membran zur zellulären Reaktion
spielen Enzyme, second messengers, Transkriptionsfaktoren u.a. eine
tragende Rolle (vgl. Zellphysiologie). Unterschiede zwischen Bakterien und Viren:
Unterschiede zwischen Bakterien und Viren: Bakterien sind Zellen, Viren nicht
Bakterien sind Zellen, Viren nicht Bakterien können sich selbständig vermehren, Viren nur im Körper mit Hilfe von Zellen
Bakterien können sich selbständig vermehren, Viren nur im Körper mit Hilfe von Zellen  Antikörper können Bakterien abtöten, Viren nur neutralisieren (d.h. diese verlieren die Fähigkeit, Zellen zu infizieren)
Antikörper können Bakterien abtöten, Viren nur neutralisieren (d.h. diese verlieren die Fähigkeit, Zellen zu infizieren) Eindämmung immunologischer Abwehrmechanismen:
Immunologische Abwehrmechanismen
unterliegen selbst einer strengen Kontrolle, damit sie nicht
ausufern und mehr Schaden als Nutzen anrichten. Beispielsweise wirken
Gewebemakrophagen entzündungshemmend und können so Immunreaktionen
limitieren; Lymphozyten bauen negative Rückkopplungskreise auf; etc.
(Manche sagen, die eine Hälfte des Immunsystems dient dazu, die andere
Hälfte im Zaum zu halten.)
Eindämmung immunologischer Abwehrmechanismen:
Immunologische Abwehrmechanismen
unterliegen selbst einer strengen Kontrolle, damit sie nicht
ausufern und mehr Schaden als Nutzen anrichten. Beispielsweise wirken
Gewebemakrophagen entzündungshemmend und können so Immunreaktionen
limitieren; Lymphozyten bauen negative Rückkopplungskreise auf; etc.
(Manche sagen, die eine Hälfte des Immunsystems dient dazu, die andere
Hälfte im Zaum zu halten.) Abbildung). So verändern Zytokine neuroendokrine Funktionen (das
äußert sich z.B. in Schlafstörungen, herabgesetztem Antrieb,
Gewichtsverlust, "Krankheitsverhalten") und beeinflussen zerebrale
Stressmechanismen (beispielsweise aktiviert ACTH die Freisetzung von Cortisol aus Lymphozyten).
Abbildung). So verändern Zytokine neuroendokrine Funktionen (das
äußert sich z.B. in Schlafstörungen, herabgesetztem Antrieb,
Gewichtsverlust, "Krankheitsverhalten") und beeinflussen zerebrale
Stressmechanismen (beispielsweise aktiviert ACTH die Freisetzung von Cortisol aus Lymphozyten). 
 Abbildung: Neuroimmunachse
Abbildung: Neuroimmunachse
| Lymphozyten: Anzahl (in Milliarden, gerundet)  Nach Abbas / Lichtman / Pillai, Cellular and Molecular Immunology, 9th ed. 2018; Bröker / Schütt / Fleischer, Grundwissen Immunologie, Springer Spektrum, 4. Aufl. 2019 |
|||
| Lymphknoten |
190-200 |
Lunge |
30 |
| Milz |
70 |
Haut |
20 |
| Knochenmark |
50 |
Leber |
10 |
| Darm |
50 |
Blut |
10 |
 CD steht für Cluster of differentiation.
Das CD-System wurde aufgebaut, um Ordnung in die Vielzahl von
monoklonalen Antikörpern zu bringen, die weltweit in verschiedenen
Labors hergestellt wurden, um Epitope auf der Zelloberfläche von
Leukozyten nachzuweisen. Beispielsweise bedeutet "CD2" das entsprechende Epitop (Molekül) und
"CD2 Ab" einen Antikörper (antibody), der CD2 spezifisch bindet. Die Charakterisierung definierter CD-Epitope auf Zellen werden
sowohl als wissenschaftliches als auch diagnostisches Instrument genutzt.
CD steht für Cluster of differentiation.
Das CD-System wurde aufgebaut, um Ordnung in die Vielzahl von
monoklonalen Antikörpern zu bringen, die weltweit in verschiedenen
Labors hergestellt wurden, um Epitope auf der Zelloberfläche von
Leukozyten nachzuweisen. Beispielsweise bedeutet "CD2" das entsprechende Epitop (Molekül) und
"CD2 Ab" einen Antikörper (antibody), der CD2 spezifisch bindet. Die Charakterisierung definierter CD-Epitope auf Zellen werden
sowohl als wissenschaftliches als auch diagnostisches Instrument genutzt. CD-Liste (Human Cell Differentiation Molecules)
CD-Liste (Human Cell Differentiation Molecules) | CD-Nummer |
Wichtigste zelluläre Expression |
Funktion(en) |
| CD1a-e |
Dendritische Zellen Thymozyten |
Antigenpräsentation von Lipiden / Glycolipiden an einige iNKT-Zellen |
| CD4 |
MHC-II-restringierte T-Zellen, einige Makrophagen |
Corezeptor bei MHC II-restringierter antigeninduzierter T-Zell-Aktivierung; Thymozytenentwicklung |
| CD40 |
Antigenpräsentierende Zellen (B-Zellen, Makrophagen, dendritische Zellen, Endothelzellen) |
Bindet CD154 (=CD40L) aktiviert dadurch T-Zell-vermittelt antigenpräsentierende Zellen |
| CD45 (LCA: Leukocyte common antigen) |
Hämatopoetische Zellen |
Tyrosinphosphatase, reguliert B- und T-Zell-Aktivierung |
| CD46 (MCP: Membrane- cofactor protein) |
Leukozyten, Epithelzellen, Fibroblasten |
Regulierung der Komplementaktivierung |
| CD206 (Mannoserezeptor) |
Makrophagen |
Bindet mannosereiche Glykoproteine an Pathogenen, beeinflusst Phagozytose |
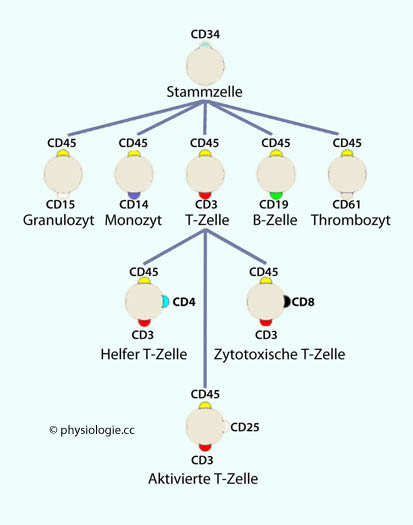
 Abbildung: Clusters of Differentiation (CD): Differenzierungsantigene und Lymphozytenreifung
Abbildung: Clusters of Differentiation (CD): Differenzierungsantigene und Lymphozytenreifung
 Abbildung).
Abbildung).
 So bindet CD4 das Membranmerkmal MHC-II, das sich auf antigenpräsentierenden Zellen befindet und Produkte der Phagozytose zur immunologischen Überprüfung vorweist;
So bindet CD4 das Membranmerkmal MHC-II, das sich auf antigenpräsentierenden Zellen befindet und Produkte der Phagozytose zur immunologischen Überprüfung vorweist; CD8 hingegen bindet MHC-I,
das von allen kernhaltigen Zellen exprimiert wird und intrazelluläre
Abbauprodukte präsentiert (diese können u.a. viraler Herkunft sein und
einen Virenbefall der betreffenden Zelle signalisieren).
CD8 hingegen bindet MHC-I,
das von allen kernhaltigen Zellen exprimiert wird und intrazelluläre
Abbauprodukte präsentiert (diese können u.a. viraler Herkunft sein und
einen Virenbefall der betreffenden Zelle signalisieren). Epithelien, die geringe Durchgängigkeit aufweisen und Mucin, Defensine, IgA u.a. sezernieren
Epithelien, die geringe Durchgängigkeit aufweisen und Mucin, Defensine, IgA u.a. sezernieren Unter der Mukosa liegendes regionales lymphatisches Gewebe
Unter der Mukosa liegendes regionales lymphatisches Gewebe Fortwährende Sammlung von Antigenen durch Immunzellen an der epithelialen Oberfläche
Fortwährende Sammlung von Antigenen durch Immunzellen an der epithelialen Oberfläche  Mikrobielle Produkte binden an dendritische und Epithelzellen und generieren regulatorische Signale
Mikrobielle Produkte binden an dendritische und Epithelzellen und generieren regulatorische Signale IgA-vermittelte spezifische Abwehr verhindert im Idealfall ein Eindringen von Mikroben in das "eigentliche Innere" des Körpers
IgA-vermittelte spezifische Abwehr verhindert im Idealfall ein Eindringen von Mikroben in das "eigentliche Innere" des Körpers Dendritische Zellen regen spezifisch Effektor- und regulatorische T-Zellen an
Dendritische Zellen regen spezifisch Effektor- und regulatorische T-Zellen an Die Schleimschicht,
welche die meisten Mikroorganismen vom mukösen Epithel fernhält. Ein
durch Mucine aufgebauter, weniger als 1 mm dicker Gelfilm hält
Mikroorganismen vom Epithel fern, das außerdem über eine Glykokalyx
verfügt. Der menschliche Darm produziert jeden Tag mehrere Liter
Schleim;
Die Schleimschicht,
welche die meisten Mikroorganismen vom mukösen Epithel fernhält. Ein
durch Mucine aufgebauter, weniger als 1 mm dicker Gelfilm hält
Mikroorganismen vom Epithel fern, das außerdem über eine Glykokalyx
verfügt. Der menschliche Darm produziert jeden Tag mehrere Liter
Schleim; Von Epithelzellen produzierte antibiotische Peptide - diese töten Pathogene bzw. reduzieren ihr Eindringen in das Epithel;
Von Epithelzellen produzierte antibiotische Peptide - diese töten Pathogene bzw. reduzieren ihr Eindringen in das Epithel; "Sekretorische Immunität": IgA
aus Plasmazellen der Mukosa, das Pathogene im Darmlumen sowie Toxine bindet und neutralisiert,
bevor sie durch das Epithel dringen können (IgA gelangt auch
mit der Muttermilch in den Darm des Säuglings). An die sekretorische Komponente des IgA gebundene Glykane
reduzieren das Andockvermögen von Mikroben an die Schleimhaut. Daneben
werden auch andere Immunglobuline (IgM, IgG) über die Mukosa sezerniert.
"Sekretorische Immunität": IgA
aus Plasmazellen der Mukosa, das Pathogene im Darmlumen sowie Toxine bindet und neutralisiert,
bevor sie durch das Epithel dringen können (IgA gelangt auch
mit der Muttermilch in den Darm des Säuglings). An die sekretorische Komponente des IgA gebundene Glykane
reduzieren das Andockvermögen von Mikroben an die Schleimhaut. Daneben
werden auch andere Immunglobuline (IgM, IgG) über die Mukosa sezerniert.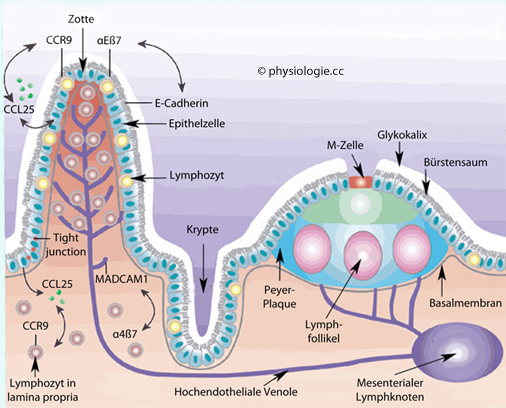
 Abbildung: Dünndarm als Teil des Immunapparats
Abbildung: Dünndarm als Teil des Immunapparats E-Cadherin dient der Zellkommunikation
E-Cadherin dient der Zellkommunikation  Addressin oder MAdCAM-1 ist ebenfalls ein Zelladhäsionsmolekül
Addressin oder MAdCAM-1 ist ebenfalls ein Zelladhäsionsmolekül  Tight junctions dichten den Raum zwischen Epithelzellen ab
Tight junctions dichten den Raum zwischen Epithelzellen ab
 Abbildung) auf der Oberfläche (am Dom) intestinaler Lymphfollikel
ist der Transport von Antigenen (Viren, Bakterien, löslichen Stoffe) zu
darunter gelegenen dendritischen Zellen und B-Lymphozyten.
Abbildung) auf der Oberfläche (am Dom) intestinaler Lymphfollikel
ist der Transport von Antigenen (Viren, Bakterien, löslichen Stoffe) zu
darunter gelegenen dendritischen Zellen und B-Lymphozyten.  Die Mehrzahl aller Lymphozyten befinden sich in Lymphknoten und mukösem Gewebe (vorwiegend GALT, BALT); viele davon sind Gedächtniszellen.
Die Mehrzahl aller Lymphozyten befinden sich in Lymphknoten und mukösem Gewebe (vorwiegend GALT, BALT); viele davon sind Gedächtniszellen. und
Ausbildung von Gedächtnis- sowie Effektorzellen führt einige
Tage nach dem 'Erstkontakt' zu gezielter spezifischer Abwehr mit dem Ziel einer Überwindung
der Erkrankung.
und
Ausbildung von Gedächtnis- sowie Effektorzellen führt einige
Tage nach dem 'Erstkontakt' zu gezielter spezifischer Abwehr mit dem Ziel einer Überwindung
der Erkrankung. 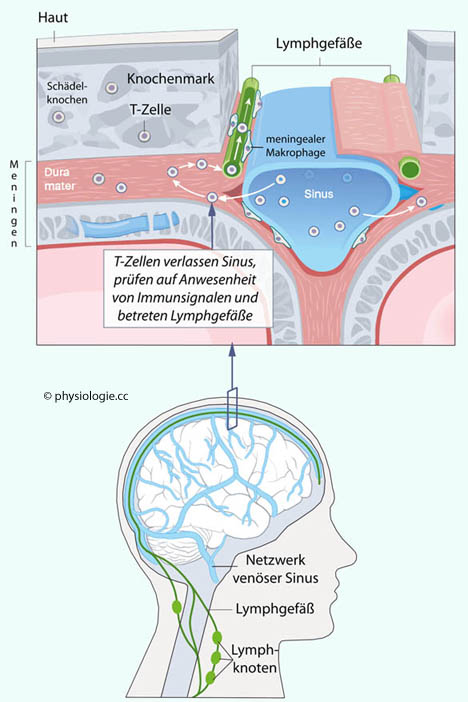
 Abbildung: Zerebrales Immunsystem
Abbildung: Zerebrales Immunsystem
 Näheres dazu s. dort
Näheres dazu s. dort
 Als Mikrobiom bezeichnet man die Gesamtheit der einen Organismus
besiedelnden Mikroorganismen. Insbesondere die residente Darmflora
stimuliert das Immunsystem, liefert Stoffwechselprodukte für
Darmepithelzellen, wirkt antitoxisch und vitaminbildend. Mikroben können aber auch pathogen werden
Als Mikrobiom bezeichnet man die Gesamtheit der einen Organismus
besiedelnden Mikroorganismen. Insbesondere die residente Darmflora
stimuliert das Immunsystem, liefert Stoffwechselprodukte für
Darmepithelzellen, wirkt antitoxisch und vitaminbildend. Mikroben können aber auch pathogen werden Das Immunsystem repariert beschädigtes Gewebe und bekämpft Infektionen. Dazu erkennt es "verdächtige" Moleküle (Gefahrensignale) - einerseits aus verletzten Zellen (DAMPs: damage-asssociated molecular patterns),
andererseits auf Mikroben (PAPMs: pathogen-assoziierte molekulare
Muster). Mikroben bleiben meist harmlos,
solange sie auf intakte Oberflächen beschränkt bleiben ("primäre
Barriere") Das Immunsystem repariert beschädigtes Gewebe und bekämpft Infektionen. Dazu erkennt es "verdächtige" Moleküle (Gefahrensignale) - einerseits aus verletzten Zellen (DAMPs: damage-asssociated molecular patterns),
andererseits auf Mikroben (PAPMs: pathogen-assoziierte molekulare
Muster). Mikroben bleiben meist harmlos,
solange sie auf intakte Oberflächen beschränkt bleiben ("primäre
Barriere") Sekundäre
Barriere: Haut und Schleimhäute (Darm, Bronchien, Nase, Speicheldrüsen, Bindehaut, Tränenwege, Ohrtrompete, Kehlkopf) verfügen über einen besonderen Immunschutz. Epithelien sezernieren Mucin, Defensine, IgA; IgA-vermittelte spezifische Abwehr erschwert ein Eindringen von Mikroben; mikrobielle Produkte generieren regulatorische Signale; Immunzellen sammeln Antigene und transportieren sie an Lymphknoten weiter; dendritische Zellen regen spezifisch Effektor- und regulatorische T-Zellen an Sekundäre
Barriere: Haut und Schleimhäute (Darm, Bronchien, Nase, Speicheldrüsen, Bindehaut, Tränenwege, Ohrtrompete, Kehlkopf) verfügen über einen besonderen Immunschutz. Epithelien sezernieren Mucin, Defensine, IgA; IgA-vermittelte spezifische Abwehr erschwert ein Eindringen von Mikroben; mikrobielle Produkte generieren regulatorische Signale; Immunzellen sammeln Antigene und transportieren sie an Lymphknoten weiter; dendritische Zellen regen spezifisch Effektor- und regulatorische T-Zellen an Man unterscheidet angeborene und
adaptive, zelluläre und humorale Abwehr. Das humorale System schützt vor extrazellulären Angreifern
(Toxinen, Mikroorganismen, Pollen etc), das zelluläre erkennt intrazelluläre Antigene (z.B. Viren)
sowie Tumorzellen und Protozoen Man unterscheidet angeborene und
adaptive, zelluläre und humorale Abwehr. Das humorale System schützt vor extrazellulären Angreifern
(Toxinen, Mikroorganismen, Pollen etc), das zelluläre erkennt intrazelluläre Antigene (z.B. Viren)
sowie Tumorzellen und Protozoen Das
angeborene System nutzt ~100 verschiedene Rezeptoren zur Erkennung von
~1000 invarianten mikrobiellen Molekülmustern; das adaptive erkennt
spezifisch mehr als 10 Millionen verschiedene Antigene mittels
Immunglobulinen und T-Zell-Rezeptoren. Der Teil eines Antigens, den Lymphozyten bzw. Antikörper spezifisch erkennen und binden, heißt antigene Determinante oder Epitop. Somatische Rekombination ("Genpuzzle") erklärt die große Zahl spezifischer lymphozytärer Rezeptoren und Antikörper Das
angeborene System nutzt ~100 verschiedene Rezeptoren zur Erkennung von
~1000 invarianten mikrobiellen Molekülmustern; das adaptive erkennt
spezifisch mehr als 10 Millionen verschiedene Antigene mittels
Immunglobulinen und T-Zell-Rezeptoren. Der Teil eines Antigens, den Lymphozyten bzw. Antikörper spezifisch erkennen und binden, heißt antigene Determinante oder Epitop. Somatische Rekombination ("Genpuzzle") erklärt die große Zahl spezifischer lymphozytärer Rezeptoren und Antikörper Immunität ist systemisch: Immunzellen und Immunmoleküle patrouillieren
durch Kreislauf und Gewebe und schützen alle Gewebe, unabhängig vom Ort
des Primärkontakts mit Krankheitserregern. Neutrophile und Monozyten
gelangen zu Orten der Infektion oder Verletzung zwecks Schutz,
Pathogenbekämpfung, Reparatur; "naive" Lymphozyten wandern zu
sekundärem lymphatischem Gewebe (z.B. Lymphknoten) zwecks
Antigenerkennung, Proliferation, Differenzierung in Effektor- und
Gedächtniszellen; Effektorlymphozyten wandern zu Infektionsherden
überall im Organismus zwecks spezifischer Abwehr
Immunität ist systemisch: Immunzellen und Immunmoleküle patrouillieren
durch Kreislauf und Gewebe und schützen alle Gewebe, unabhängig vom Ort
des Primärkontakts mit Krankheitserregern. Neutrophile und Monozyten
gelangen zu Orten der Infektion oder Verletzung zwecks Schutz,
Pathogenbekämpfung, Reparatur; "naive" Lymphozyten wandern zu
sekundärem lymphatischem Gewebe (z.B. Lymphknoten) zwecks
Antigenerkennung, Proliferation, Differenzierung in Effektor- und
Gedächtniszellen; Effektorlymphozyten wandern zu Infektionsherden
überall im Organismus zwecks spezifischer Abwehr Zu den Membranproteinen, die Zellen (z.B. Leukozyten) spezifisch und je
nach Art und Entwicklungsphase exprimieren, gehören auch mehrere
hundert CD-Moleküle (Cluster of differentiation). Diese lassen sich
mittels monoklonaler Antikörper bestimmen und erlauben eine
funktionelle Zuordnung von Immunzellen (als Rezeptoren, Enzyme,
Aktivatoren, zur Zelladhäsion u.a.)
Zu den Membranproteinen, die Zellen (z.B. Leukozyten) spezifisch und je
nach Art und Entwicklungsphase exprimieren, gehören auch mehrere
hundert CD-Moleküle (Cluster of differentiation). Diese lassen sich
mittels monoklonaler Antikörper bestimmen und erlauben eine
funktionelle Zuordnung von Immunzellen (als Rezeptoren, Enzyme,
Aktivatoren, zur Zelladhäsion u.a.) Immunprivilegierte" Organe erfahren einen spezifisch restringierten Immunschutz. Die Blut-Hirn-Schranke schränkt den Durchtritt von löslichen Faktoren und Immunzellen ein; das Auge hat spezielle entzündungshemmende Mechanismen (Blut-Augen-Schranke); Sertoli-Zellen bilden eine Schranke zwischen Spermatogonien und Spermatozyten (Blut-Hoden-Schranke) Immunprivilegierte" Organe erfahren einen spezifisch restringierten Immunschutz. Die Blut-Hirn-Schranke schränkt den Durchtritt von löslichen Faktoren und Immunzellen ein; das Auge hat spezielle entzündungshemmende Mechanismen (Blut-Augen-Schranke); Sertoli-Zellen bilden eine Schranke zwischen Spermatogonien und Spermatozyten (Blut-Hoden-Schranke) Immunologische Abwehrmechanismen unterliegen strenger Selbstkontrolle
und Limitation. Eine wichtige Rolle spielen dabei inhibitorische
Rezeptoren auf Lymphozyten und natürlichen Killerzellen
Immunologische Abwehrmechanismen unterliegen strenger Selbstkontrolle
und Limitation. Eine wichtige Rolle spielen dabei inhibitorische
Rezeptoren auf Lymphozyten und natürlichen Killerzellen |
