



 Chemokin: χημεία = Gießerei (im Sinne von „Umwandlung“), κίνἔω = antreiben, bewegen
Chemokin: χημεία = Gießerei (im Sinne von „Umwandlung“), κίνἔω = antreiben, bewegen| Antigenpräsentierende Zellen zeigen T-Lymphozyten mit ihren MHC-II-Rezeptoren Peptide, die aus der Phagozytose von Antigenen stammen. -- Dendritische Zellen triggern Immunvorgänge, indem sie "naive" Lymphozyten aktivieren. Langerhans-Zellen in der Haut binden mit "mustererkennenden" Rezeptoren Antigenträger, aktivieren T-Zellen und siedeln sich dann in Lymphknoten an. Andere dendritische Zellen in Lymphknoten und Milz präsentieren an - und selektionieren - B-Zellen. -- Makrophagen verstärken eine schon aktivierte Immunabwehr. -- Aktivierte B-Lymphozyten können Gedächtniszellen aktivieren; sie konzentrieren an der Zellmembran Peptide aus dem Antigenabbau, dadurch ermöglichen sie die Aktivierung von Helferzellen auch bei niedriger Antigenkonzentration. Die Rolle von Immunzellen im Gehirn übernimmt die Mikroglia: Sie prüft ihre Umgebung auf Intaktheit, bildet neurotrophe Schutzfaktoren, dämpft neuronale Hyperaktivität und eliminiert potenziell pathogene Substanzen aus dem Gewebe. |
 Immunologische Spezifika des Nervensystems
Immunologische Spezifika des Nervensystems  Mikroglia
Mikroglia
 Professionelle antigenpräsentierende Zellen
Professionelle antigenpräsentierende Zellen
 Als antigenpräsentierend bezeichnet man eine Zelle (antigen presenting cell
APC), die intrazelluläre Peptidfragmente in Verbindung mit
MHC-Molekülen an ihrer Oberfläche an den Extrazellulärraum "präsentiert".
Damit können antigenspezifische Vorgänge angeregt werden - durch
Kontakt mit speziellen Zellen, die mit passenden Rezeptoren
ausgestattet sind.
Als antigenpräsentierend bezeichnet man eine Zelle (antigen presenting cell
APC), die intrazelluläre Peptidfragmente in Verbindung mit
MHC-Molekülen an ihrer Oberfläche an den Extrazellulärraum "präsentiert".
Damit können antigenspezifische Vorgänge angeregt werden - durch
Kontakt mit speziellen Zellen, die mit passenden Rezeptoren
ausgestattet sind.  T-Lymphozyten
reagieren nicht direkt auf die Anwesenheit von Antigenen: Sie benötigen
die Präsentation des Antigens durch andere Zellen - T-Zellen erkennen Antigene nur in Kombination mit MHC (MHC-Restriktion,
T-Lymphozyten
reagieren nicht direkt auf die Anwesenheit von Antigenen: Sie benötigen
die Präsentation des Antigens durch andere Zellen - T-Zellen erkennen Antigene nur in Kombination mit MHC (MHC-Restriktion,  Abbildung) zusammen mit Hilfsfaktoren.
Abbildung) zusammen mit Hilfsfaktoren. 
 Abbildung: Erkennung proteolytischer Fragmente über MHC-TCR-Interaktion
Abbildung: Erkennung proteolytischer Fragmente über MHC-TCR-Interaktion
 Antigenpräsentation wird durch die Anwesenheit von Mikroben verstärkt - das ist einer der Gründe, warum das Immunsystem auf Mikroben stärker reagiert als auf (harmlose) nichtmikrobielle Stoffe.
So exprimieren viele antigenpräsentierende Zellen Sensormoleküle wie TLRs
und fahren bei Mikrobenkontakt die Ausbildung von MHC- und Costimulatormolekülen hoch. Dazu kommen noch weitere Mechanismen,
welche die Immunantwort auf mikrobielle Reize intensivieren. Dieser
komplexe Aktivierungsmechanismus erklärt auch die Wirkung von Adjuvantien, das sind Stoffe, welche die lymphozytäre Reaktionen auf (gereinigte) Protein-Antigene verstärken.
Antigenpräsentation wird durch die Anwesenheit von Mikroben verstärkt - das ist einer der Gründe, warum das Immunsystem auf Mikroben stärker reagiert als auf (harmlose) nichtmikrobielle Stoffe.
So exprimieren viele antigenpräsentierende Zellen Sensormoleküle wie TLRs
und fahren bei Mikrobenkontakt die Ausbildung von MHC- und Costimulatormolekülen hoch. Dazu kommen noch weitere Mechanismen,
welche die Immunantwort auf mikrobielle Reize intensivieren. Dieser
komplexe Aktivierungsmechanismus erklärt auch die Wirkung von Adjuvantien, das sind Stoffe, welche die lymphozytäre Reaktionen auf (gereinigte) Protein-Antigene verstärken. Professionelle APCs (professional antigen-presenting cells)
können Antigene rasch phagozytieren (dendritische Zellen, Makrophagen) oder rezeptorvermittelt endozytieren (B-Zellen)
und zu Fragmenten (Peptiden, auch Lipiden) abbauen. Professionelle APCs exprimieren (außer MHC-I) auch MHC-II: Damit sind
sie auf die Präsentation dieser Fragmente an T-Lymphozyten spezialisiert, die über entsprechende Rezeptorsysteme sowie Begleitfaktoren verfügen. So können Helfer- (CD4+) Lymphozyten aktiviert werden. Zusätzliche Wirkfaktoren der APCs sind Costimulatoren (diese sind, wie MHC, membrangebunden) und Zytokine wie z.B. Interferone. Zu professionellen APCs zählen auch Endothel- und einige
Epithelzellen (Thymus).
Professionelle APCs (professional antigen-presenting cells)
können Antigene rasch phagozytieren (dendritische Zellen, Makrophagen) oder rezeptorvermittelt endozytieren (B-Zellen)
und zu Fragmenten (Peptiden, auch Lipiden) abbauen. Professionelle APCs exprimieren (außer MHC-I) auch MHC-II: Damit sind
sie auf die Präsentation dieser Fragmente an T-Lymphozyten spezialisiert, die über entsprechende Rezeptorsysteme sowie Begleitfaktoren verfügen. So können Helfer- (CD4+) Lymphozyten aktiviert werden. Zusätzliche Wirkfaktoren der APCs sind Costimulatoren (diese sind, wie MHC, membrangebunden) und Zytokine wie z.B. Interferone. Zu professionellen APCs zählen auch Endothel- und einige
Epithelzellen (Thymus).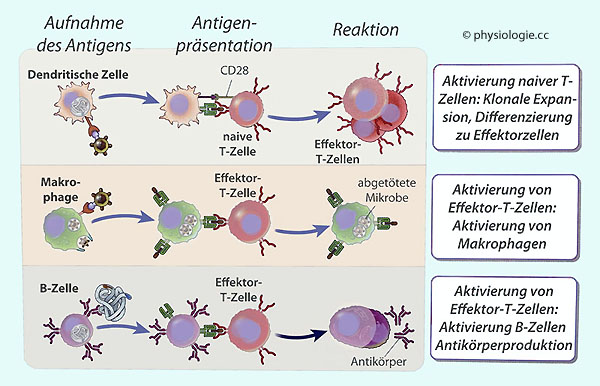
 Abbildung: Funktionen professioneller antigenpräsentierender Zellen
Abbildung: Funktionen professioneller antigenpräsentierender Zellen
Antigenpräsentierende Zellen (APCs): Eigenschaften und Aufgaben Nach Abbas / Lichtman / Pillai, Cellular and Molecular Immunology, 9th ed 2018 |
|||
| Zelltyp |
Expression von MHC-II |
Expression von Kostimulatoren |
Hauptfunktion |
| Dendritische Zellen |
konstitutiv mit Reifung zunehmend |
konstitutiv verstärkt durch TLR-Signale |
Priming: Naive T-Zellen werden zu T-Zell-Antwort veranlasst |
| Makrophagen |
sehr gering, durch IFN-γ und T-Zellen (CD40-CD40L) angeregt |
angeregt durch TLR-Signale, IFN-γ, CD40-CD40L- Interaktion |
Antigenpräsentation an Effektor-CD4+- Zellen (Abtötung phagozytierter Mikroben) |
| B-Lymphozyten |
konstitutiv steigt mit IL-4, Verknüpfung von Antigenrezeptoren, CD40-CD40L- Interaktion |
Steigt mit CD40-CD40L- Interaktion, Verknüpfung von Antigenrezeptoren |
Antigenpräsentation an Helfer-CD4+- Zellen (Interaktion Helfer-T- / B- Zellen) |
| Gefäßendothel Mesenchym einige Epithelien |
konstitutiv durch IFN-γ anregbar |
niedrig oder nicht vorhanden |
Aktivierung antigenspezifischer T-Zellen (?) |
 Virusinfizierte oder Krebszellen aktivieren zytotoxische Lymphozyten (CD8+), professionelle
antigenpräsentierende Zellen aktivieren Helfer-T-Zellen (CD4+).
Virusinfizierte oder Krebszellen aktivieren zytotoxische Lymphozyten (CD8+), professionelle
antigenpräsentierende Zellen aktivieren Helfer-T-Zellen (CD4+). (DC, dendritic cells) "fangen" Mikroben und Protein-Antigene ein, die durch epitheliale Barrieren in
den Körper gelangt sind, bauen sie zu Peptidfragmenten ab und
präsentieren diese anschließend - im zuständigen lymphatischen Gewebe -
über MHC-Proteine an
T-Lymphozyten. Diese teils mobilen, teils stationären Zellen finden sich vor allem in lymphatischem Gewebe,
Schleimhäuten und Organparenchym. Sie präsentieren Antigene an naive T-Zellen, modulieren deren Differenzierung und verfügen im Vergleich zu Makrophagen nur über eine geringe lysosomale Abbaukapazität.
(DC, dendritic cells) "fangen" Mikroben und Protein-Antigene ein, die durch epitheliale Barrieren in
den Körper gelangt sind, bauen sie zu Peptidfragmenten ab und
präsentieren diese anschließend - im zuständigen lymphatischen Gewebe -
über MHC-Proteine an
T-Lymphozyten. Diese teils mobilen, teils stationären Zellen finden sich vor allem in lymphatischem Gewebe,
Schleimhäuten und Organparenchym. Sie präsentieren Antigene an naive T-Zellen, modulieren deren Differenzierung und verfügen im Vergleich zu Makrophagen nur über eine geringe lysosomale Abbaukapazität. Während der Embrygenese und postnatal wandern Vorläuferzellen in
nicht-lymphatische Gewebe aus (äußere und innere Oberflächen,
Organgewebe) und werden zu unreifen DC (immature dendritic cells).
Während der Embrygenese und postnatal wandern Vorläuferzellen in
nicht-lymphatische Gewebe aus (äußere und innere Oberflächen,
Organgewebe) und werden zu unreifen DC (immature dendritic cells). Unreife DC sammeln Antigene ein: Über ihre Verästelungen nehmen sie fortlaufend
gelöste Proteine via Makropinozytose auf - mittels aktinreicher Membraneinstülpungen (cytoplasmic ruffles), die sich über den pinozytierten Molekülen schließen (Bildung von Phagolysosomen) - und verarbeiten diese.
Unreife DC sammeln Antigene ein: Über ihre Verästelungen nehmen sie fortlaufend
gelöste Proteine via Makropinozytose auf - mittels aktinreicher Membraneinstülpungen (cytoplasmic ruffles), die sich über den pinozytierten Molekülen schließen (Bildung von Phagolysosomen) - und verarbeiten diese.  Dendritische Zellen überprüfen
pro Stunde etwa das Vierfache ihres eigenen Zellvolumens.
Dendritische Zellen überprüfen
pro Stunde etwa das Vierfache ihres eigenen Zellvolumens. Dann reifen sie (mature dendritic cells), entweder durch ein inneres Programm oder durch das Erkennen pathogener molekularer Muster.
Dann reifen sie (mature dendritic cells), entweder durch ein inneres Programm oder durch das Erkennen pathogener molekularer Muster. Dabei werden sie mobiler und exprimieren Zytokinrezeptoren (wie CCR7:
Chemokinrezeptor 7). Bindung von Liganden (wie CCL21: Chemokinligand
21) ermöglicht ihnen den Eintritt in Lymphgefäße und Lymphknoten (in
den T-Zell-reichen Parakortex).
Dabei werden sie mobiler und exprimieren Zytokinrezeptoren (wie CCR7:
Chemokinrezeptor 7). Bindung von Liganden (wie CCL21: Chemokinligand
21) ermöglicht ihnen den Eintritt in Lymphgefäße und Lymphknoten (in
den T-Zell-reichen Parakortex). Hier präsentieren sie "ihren" Antikörper an T-Zellen, was Abwehr
(Entzündung) oder Toleranz, sowie die Bildung von Gedächtniszellen
anregt.
Hier präsentieren sie "ihren" Antikörper an T-Zellen, was Abwehr
(Entzündung) oder Toleranz, sowie die Bildung von Gedächtniszellen
anregt. Angeregte T-Zellen begeben sich u.a. zum Ursprung der Antigene (homing)
und regen die Bereitstellung weiterer DC an - das verstärkt den
jeweiligen immunologischen Vorgang.
Angeregte T-Zellen begeben sich u.a. zum Ursprung der Antigene (homing)
und regen die Bereitstellung weiterer DC an - das verstärkt den
jeweiligen immunologischen Vorgang.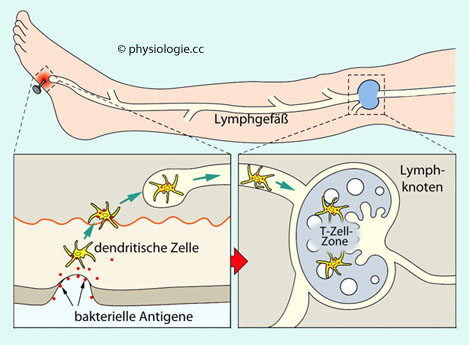
 Abbildung: Dendritische Zellen im Einsatz
Abbildung: Dendritische Zellen im Einsatz
 Abbildung). Dabei steigern dendritische Zellen
nicht nur die Expression von MHC, sondern sie bilden auch Costimulatoren,
die zur Auslösung lymphozytärer Reaktionen erforderlich sind.
Abbildung). Dabei steigern dendritische Zellen
nicht nur die Expression von MHC, sondern sie bilden auch Costimulatoren,
die zur Auslösung lymphozytärer Reaktionen erforderlich sind.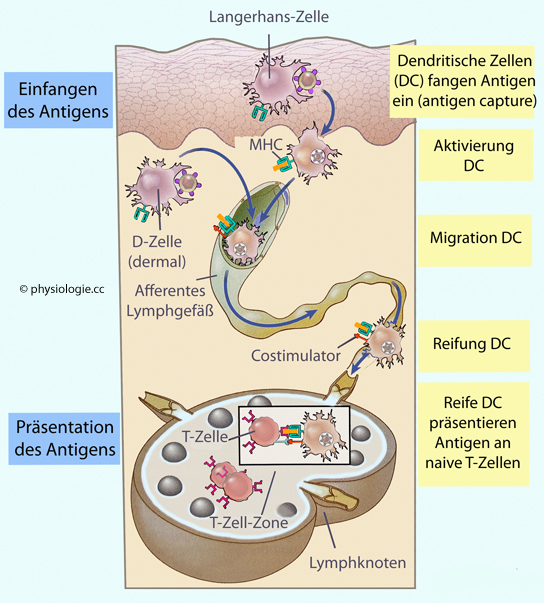
 Abbildung: Dendritische Zellen: Phagozytose und Antigenpräsentation
Abbildung: Dendritische Zellen: Phagozytose und Antigenpräsentation
 Dendritische Zellen präsentieren Antigene sowohl an Helfer- als auch an zytotoxische
T-Zellen. Ihre Wirkung trägt auch zum Schutz vor Autoimmunität bei: Unreif gebliebene dendritische Zellen (iDC: immature dendritic cells)
produzieren im lymphatischen Gewebe
entzündungshemmende Zytokine (TGF-ß, IL-10) und fördern die Entwicklung
von Treg-Zellen - das erhält und vertieft die immunologische Selbsttoleranz.
Dendritische Zellen präsentieren Antigene sowohl an Helfer- als auch an zytotoxische
T-Zellen. Ihre Wirkung trägt auch zum Schutz vor Autoimmunität bei: Unreif gebliebene dendritische Zellen (iDC: immature dendritic cells)
produzieren im lymphatischen Gewebe
entzündungshemmende Zytokine (TGF-ß, IL-10) und fördern die Entwicklung
von Treg-Zellen - das erhält und vertieft die immunologische Selbsttoleranz. Klassische
(konventionelle) dendritische Zellen sind der führende Typus. Sie
suchen ihre Umgebung konstant nach mikrobiellen Proteinen ab, die durch
Epithelien gedrungen sind, oder mittels Pseudopodien durch
Epithelbarrieren hindurch (z.B. im Darmlumen), verarbeiten diese und
präsentieren Antigene an T-Zellen, was sehr effiziente Reaktionen
auslöst. Dendritische Zellen werden durch eine Kombination von
Rezeptorsignalen und Zytokinen aktiviert, was sie u.a. zu Migration
veranlasst. Klassische dendritische Zellen zeigen verschiedene Expressionsmuster ihrer Marker, was weitere Spezifizierung ermöglicht.
Klassische
(konventionelle) dendritische Zellen sind der führende Typus. Sie
suchen ihre Umgebung konstant nach mikrobiellen Proteinen ab, die durch
Epithelien gedrungen sind, oder mittels Pseudopodien durch
Epithelbarrieren hindurch (z.B. im Darmlumen), verarbeiten diese und
präsentieren Antigene an T-Zellen, was sehr effiziente Reaktionen
auslöst. Dendritische Zellen werden durch eine Kombination von
Rezeptorsignalen und Zytokinen aktiviert, was sie u.a. zu Migration
veranlasst. Klassische dendritische Zellen zeigen verschiedene Expressionsmuster ihrer Marker, was weitere Spezifizierung ermöglicht. Plasmazellähnliche (plasmazytoide) dendritische
Zellen nehmen in aktivierter Form
eine ähnliche Gestalt wie Plasmazellen an (daher der Name), sie finden sich in Blut und Geweben. Ihre Vorläufer stammen ebenfalls aus dem Knochenmark. Plasmazytoide dendritische
Zellen exprimieren Toll-like
und andere mustererkennende Rezeptoren, an die mikrobielle Produkte
binden und die Zellen stimulieren. Wenn sie Kontakt mit Viren haben,
produzieren sie Typ-I-Interferone (sie
sind die führenden Interferon-I-Produzenten im Körper). Eingefangene Mikroben und Antigene bringen sie zur Milz, präsentieren sie an naive T-Zellen und initiieren adaptive Immunantworten auf
Proteinantigene. Sie sind mit einer hohen Dichte an MHC in ihrer
Membran wirksamer als andere antigenpräsentierende Zellen (wie
Monozyten oder B-Zellen).
Plasmazellähnliche (plasmazytoide) dendritische
Zellen nehmen in aktivierter Form
eine ähnliche Gestalt wie Plasmazellen an (daher der Name), sie finden sich in Blut und Geweben. Ihre Vorläufer stammen ebenfalls aus dem Knochenmark. Plasmazytoide dendritische
Zellen exprimieren Toll-like
und andere mustererkennende Rezeptoren, an die mikrobielle Produkte
binden und die Zellen stimulieren. Wenn sie Kontakt mit Viren haben,
produzieren sie Typ-I-Interferone (sie
sind die führenden Interferon-I-Produzenten im Körper). Eingefangene Mikroben und Antigene bringen sie zur Milz, präsentieren sie an naive T-Zellen und initiieren adaptive Immunantworten auf
Proteinantigene. Sie sind mit einer hohen Dichte an MHC in ihrer
Membran wirksamer als andere antigenpräsentierende Zellen (wie
Monozyten oder B-Zellen).  Ruhende (unreife) klassische dendritische Zellen vermitteln - über unterschiedliche Mechanismen - Toleranz gegen Selbst-Antigene.
Ruhende (unreife) klassische dendritische Zellen vermitteln - über unterschiedliche Mechanismen - Toleranz gegen Selbst-Antigene. 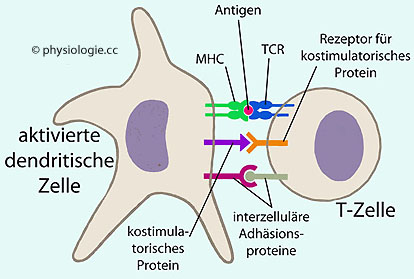
 Abbildung: Dendritische Zellen aktivieren T-Zellen
Abbildung: Dendritische Zellen aktivieren T-Zellen
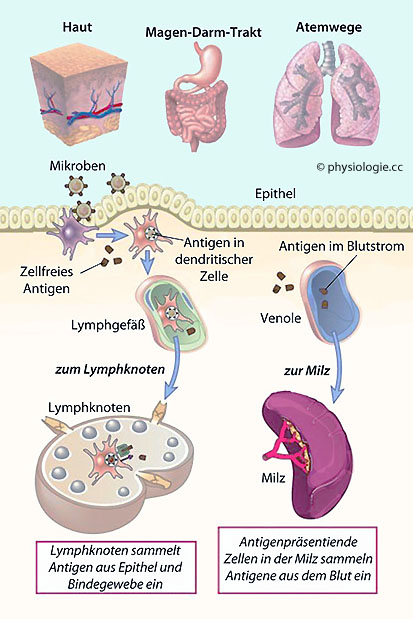
 Abbildung: Wege, auf denen das Antigen das "eigentliche Innere" des Körpers betritt
Abbildung: Wege, auf denen das Antigen das "eigentliche Innere" des Körpers betritt
 Abbildung). Mikrobielle Antigene können natürlich auch aus infiziertem Gewebe in die Blutbahn gelangt sein.
Abbildung). Mikrobielle Antigene können natürlich auch aus infiziertem Gewebe in die Blutbahn gelangt sein. ),
mit denen sie Mikroben bzw. deren Proteine binden und endozytieren,
aber kaum zur T-Zell-Aktivierung geeignete Moleküle; ihre
MHC-II-Moleküle (etwa eine Million an der Zahl) haben eine
Halbwertszeit von ca. 10 Stunden.
),
mit denen sie Mikroben bzw. deren Proteine binden und endozytieren,
aber kaum zur T-Zell-Aktivierung geeignete Moleküle; ihre
MHC-II-Moleküle (etwa eine Million an der Zahl) haben eine
Halbwertszeit von ca. 10 Stunden.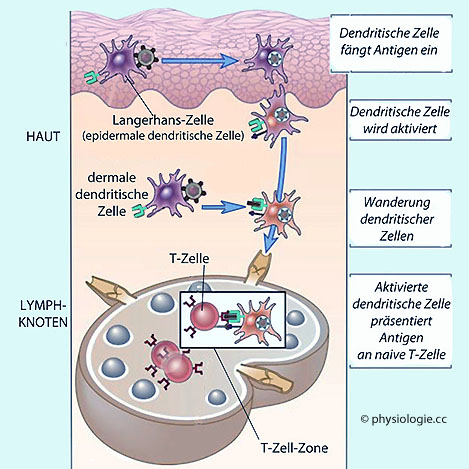
 Abbildung: Dendritische Zellen fangen Antigene ein und präsentieren sie
Abbildung: Dendritische Zellen fangen Antigene ein und präsentieren sie
 Abbildung).
Abbildung).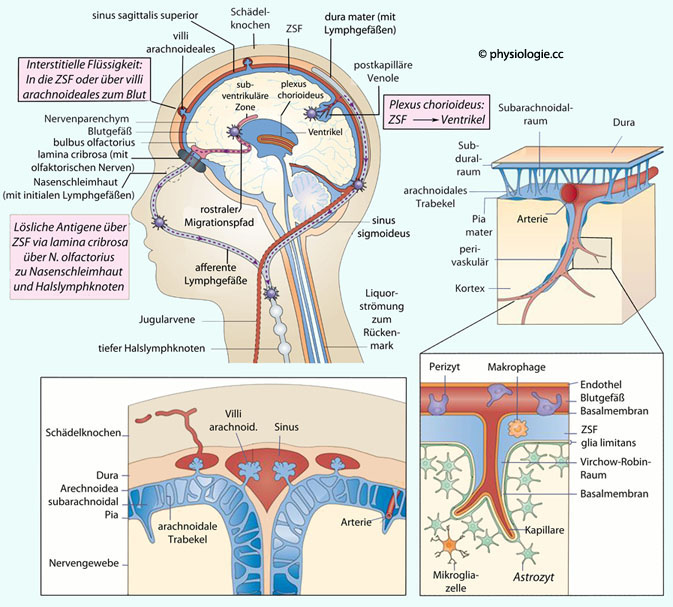
 Abbildung: Antigene aus dem Gehirn gelangen zu Stationen der Immunabwehr
Abbildung: Antigene aus dem Gehirn gelangen zu Stationen der Immunabwehr
 VIP findet sich im Gehirn und in einigen vegetativen Nerven. So spielt es eine wichtige Rolle im nucl. suprachiasmaticus,
wo die "zirkadiane Uhr" des Körpers sitzt und VIP an der
Synchronisierung dieses cirdadian pacemaker mit dem
Hell-Dunkel-Zyklus der Umwelt beteiligt ist.
VIP findet sich im Gehirn und in einigen vegetativen Nerven. So spielt es eine wichtige Rolle im nucl. suprachiasmaticus,
wo die "zirkadiane Uhr" des Körpers sitzt und VIP an der
Synchronisierung dieses cirdadian pacemaker mit dem
Hell-Dunkel-Zyklus der Umwelt beteiligt ist.  MSH
(Melanotropine) befinden sich in Hypothalamus und
Hypophysenzwischenlappen, sie regulieren die Melaninsynthese, begrenzen
aber auch die pyrogene Reaktion (Fieber) und sind an diversen
hypothalamischen Funktionen (sexuell, trophisch) beteiligt. MSH und
ACTH haben ein gemeinsames Vorläufermolekül: Pro-opiomelanocortin (POMC).
MSH
(Melanotropine) befinden sich in Hypothalamus und
Hypophysenzwischenlappen, sie regulieren die Melaninsynthese, begrenzen
aber auch die pyrogene Reaktion (Fieber) und sind an diversen
hypothalamischen Funktionen (sexuell, trophisch) beteiligt. MSH und
ACTH haben ein gemeinsames Vorläufermolekül: Pro-opiomelanocortin (POMC). und freien
Radikalen in Makrophagen und Mikroglia, das Zielgewebe wird so vor
Entzündung und zytotoxischen Wirkungen geschützt.
und freien
Radikalen in Makrophagen und Mikroglia, das Zielgewebe wird so vor
Entzündung und zytotoxischen Wirkungen geschützt.  (auch Hortega-Zellen
(auch Hortega-Zellen  oder Mesoglia) ist
ein sehr mobiler (durch das Gehirn patrouillierender) Teil des
Immunsystems; sie macht ~20% aller Gliazellen aus.
oder Mesoglia) ist
ein sehr mobiler (durch das Gehirn patrouillierender) Teil des
Immunsystems; sie macht ~20% aller Gliazellen aus. 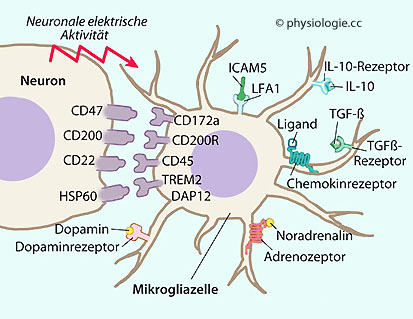
 Abbildung: Neuron und Mikrogliazelle
Abbildung: Neuron und Mikrogliazelle Chemokine
Chemokine  DAP12, DNAX activation protein of 12 kDa, ein Adaptermolekül, das an zahlreiche Rezeptoren bindet
DAP12, DNAX activation protein of 12 kDa, ein Adaptermolekül, das an zahlreiche Rezeptoren bindet  HSP, Hitzeschockprotein
HSP, Hitzeschockprotein  ICAM, Intercellular adhesion molecule
ICAM, Intercellular adhesion molecule  IL, Interleukin
IL, Interleukin  LFA, Lymphocyte function-associated antigen
LFA, Lymphocyte function-associated antigen  TGF
TGF  TREM, Triggering receptor expressed on myeloid cells
TREM, Triggering receptor expressed on myeloid cells
 Abbildung), und
Nervenzellen können Gliazellen über Transmitter (rot), Zytokine und
freie Adhäsionsmoleküle (grün) und direkten spezifischen Kontakt
hemmen (violett). Mikrogliazellen exprimieren auch den Rezeptor CSF1R, über den der Wachstumsfaktor M-CSF - sowie Interleukin 34 - das Wachstum und Überleben der Mikroglia ermöglichen.
Abbildung), und
Nervenzellen können Gliazellen über Transmitter (rot), Zytokine und
freie Adhäsionsmoleküle (grün) und direkten spezifischen Kontakt
hemmen (violett). Mikrogliazellen exprimieren auch den Rezeptor CSF1R, über den der Wachstumsfaktor M-CSF - sowie Interleukin 34 - das Wachstum und Überleben der Mikroglia ermöglichen. Mikrogliazellen überprüfen Neuronen fortlaufend auf
Intaktheit, ihre Fortsätze verändern in Minutenschnelle ihre Position,
Schäden werden behoben, abgestorbene Zellfragmente entsorgt. So erkennt
und entfernt die Mikroglia potentiell pathogene Substanzen aus dem
Nervengewebe. Neurotrophe
Substanzen werden gebildet und unterstützen gefährdete Nervenzellen;
ein Übermaß neuronaler Erregung wird abgepuffert.
Mikrogliazellen überprüfen Neuronen fortlaufend auf
Intaktheit, ihre Fortsätze verändern in Minutenschnelle ihre Position,
Schäden werden behoben, abgestorbene Zellfragmente entsorgt. So erkennt
und entfernt die Mikroglia potentiell pathogene Substanzen aus dem
Nervengewebe. Neurotrophe
Substanzen werden gebildet und unterstützen gefährdete Nervenzellen;
ein Übermaß neuronaler Erregung wird abgepuffert. 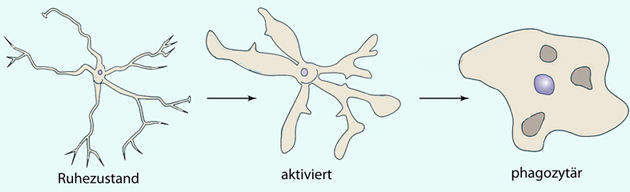
 Abbildung: Mikrogliazellen - Status und Morphologie
Abbildung: Mikrogliazellen - Status und Morphologie
  MHC-Restriktion: T-Zellen erkennen Antigene in Kombination mit MHC.
Alle kernhaltigen Zellen "präsentieren" Produkte aus ihrem zellulären
Proteinabbau auf diese Weise über MHC-I an zytotoxische (CD8+)
Lymphozyten. So werden sie kontinuierlich auf mögliche Infekte oder
krebsassoziierte Mutationen gescannt und - wenn dies zutrifft - durch
CD8+-Zellen eliminiert
MHC-Restriktion: T-Zellen erkennen Antigene in Kombination mit MHC.
Alle kernhaltigen Zellen "präsentieren" Produkte aus ihrem zellulären
Proteinabbau auf diese Weise über MHC-I an zytotoxische (CD8+)
Lymphozyten. So werden sie kontinuierlich auf mögliche Infekte oder
krebsassoziierte Mutationen gescannt und - wenn dies zutrifft - durch
CD8+-Zellen eliminiert "Antigenpräsentierend" im engeren Sinne (APC) sind Immunzellen; sie präsentieren Helfer- (CD4+)
Zellen lysosomale Abbauprodukte über MHC-II und veranlassen Lymphozyten
mit passenden Rezeptoren zu Effektorfunktionen. Dazu sind auch
membrangebundene Kostimulatoren sowie Zytokine erforderlich. Signale
von aktivierten T-Zellen verstärken ihrerseits bei Anwesenheit von
Mikroben die
Antigenpräsentation "Antigenpräsentierend" im engeren Sinne (APC) sind Immunzellen; sie präsentieren Helfer- (CD4+)
Zellen lysosomale Abbauprodukte über MHC-II und veranlassen Lymphozyten
mit passenden Rezeptoren zu Effektorfunktionen. Dazu sind auch
membrangebundene Kostimulatoren sowie Zytokine erforderlich. Signale
von aktivierten T-Zellen verstärken ihrerseits bei Anwesenheit von
Mikroben die
Antigenpräsentation Dendritische Zellen binden Mikroben und Antigene, die durch epitheliale
Barrieren gedrungen sind - stündlich überprüfen sie mittels
mustererkennender Rezeptoren ein Mehrfaches ihres eigenen Zellvolumens.
Sie präsentieren diese in lymphatischem Gewebe ("Melderzellen") an
naive T-Zellen, die zu Effektorzellen heranreifen, falls ihre
Rezeptoren mit dem präsentierten Antigen zusammenpassen. Aktivierte
dendritische Zellen leben nur wenige Tage (Selbstbegrenzung)
Dendritische Zellen binden Mikroben und Antigene, die durch epitheliale
Barrieren gedrungen sind - stündlich überprüfen sie mittels
mustererkennender Rezeptoren ein Mehrfaches ihres eigenen Zellvolumens.
Sie präsentieren diese in lymphatischem Gewebe ("Melderzellen") an
naive T-Zellen, die zu Effektorzellen heranreifen, falls ihre
Rezeptoren mit dem präsentierten Antigen zusammenpassen. Aktivierte
dendritische Zellen leben nur wenige Tage (Selbstbegrenzung) Die Blut-Hirn-Schranke gestattet nur einen sehr limitierten Durchtritt
von Stoffen zwischen den Endothelzellen des ZNS (Schutzfunktion). Tight
junctions zwischen diesen verhindern parazellulären Transport. Bei
antigener Stimulation oder Entzündung setzen T-Helferzellen und
Makrophagen Neurotransmitter wie VIP und MSH frei, diese bewirken
Immuntoleranz und hemmen Autoaggression
Die Blut-Hirn-Schranke gestattet nur einen sehr limitierten Durchtritt
von Stoffen zwischen den Endothelzellen des ZNS (Schutzfunktion). Tight
junctions zwischen diesen verhindern parazellulären Transport. Bei
antigener Stimulation oder Entzündung setzen T-Helferzellen und
Makrophagen Neurotransmitter wie VIP und MSH frei, diese bewirken
Immuntoleranz und hemmen Autoaggression Antikörper können die Blut-Hirn-Schranke nicht passieren, daher ist das
Gehirn auf spezielle Immunität angewiesen: Zellen der Mikroglia
partoullieren durch das Nervengewebe, überprüfen Neuronen (mit denen
sie intensiven Signalaustausch pflegen) auf Intaktheit (Rezeptoren),
entfernen Zelltrümmer, haben Reparaturfunktion und bilden neurotrophe
Faktoren
Antikörper können die Blut-Hirn-Schranke nicht passieren, daher ist das
Gehirn auf spezielle Immunität angewiesen: Zellen der Mikroglia
partoullieren durch das Nervengewebe, überprüfen Neuronen (mit denen
sie intensiven Signalaustausch pflegen) auf Intaktheit (Rezeptoren),
entfernen Zelltrümmer, haben Reparaturfunktion und bilden neurotrophe
Faktoren |
