Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert

Grundlagen und Methoden der Physiologie; molekulare und zelluläre Aspekte

 Membransysteme, Zellorganellen, Rezeptoren, Apoptose
Membransysteme, Zellorganellen, Rezeptoren, Apoptose
© Hinghofer-Szalkay

Anion: ἀνά = hinauf, ἰόν = das Wandernde (ἰέναι = gehen)
Apoptose: ἀπό- = ab-, πτωσις = Fall (abfallen)
Biomembran: βίος = Leben, membrana = Häutchen
Caspase: Cystein-Protease, die nach Aspartat schneidet
Clathrin: clatratus = wie ein Gitter (clatri)
Diffusion: (lat) diffundere = ausgießen
Gibbs-Donnan-Effekt: Josiah W. Gibbs, Frederick G. Donnan
Endozytose: ἔνδον = innen, κύτος = Gefäß (Zelle)
Fas: first apoptosis signal
Fick-sches Gesetz: Adolf Fick
Glykokalyx: γλῦκ = süß, καλυξ = Hülse, Kapsel, Schmuck
Karyoplasma: ϰάρυον = Nuss, Fruchtkern; πλάσμα = Gebilde
Kation: κατά = herab, ἰόν = das Wandernde
Kompartiment: com-parare = zusammenstellen, verbinden
Ligand: ligare = binden
Osmose: ὠσμός = Antrieb, Stoß, Eindringen (hier: von Molekülen)
Pendrin: Vaughan Pendred
Permease: permeare = durchdringen
Phagozytose: φαγεῖν = fressen, κύτος = Höhlung, Gefäß
Pinozytose: πῑ́νω = trinken
Plasma: πλάσμα = Gebilde (von πλάσω = formen, gestalten)
Rezeptor: recipere (lat) = erlangen, empfangen, aufnehmen
Svedberg-Einheit: Theodor Svedberg
Tachyphylaxie: ταχύς = rasch, φύλαξις = Schutz
Transport: trans-portare (lat) = hinübertragen
Zytoplasma: κύτος = Höhlung, Gefäß, πλάσμα = Gebilde
Apoptose: ἀπό- = ab-, πτωσις = Fall (abfallen)
Biomembran: βίος = Leben, membrana = Häutchen
Caspase: Cystein-Protease, die nach Aspartat schneidet
Clathrin: clatratus = wie ein Gitter (clatri)
Diffusion: (lat) diffundere = ausgießen
Gibbs-Donnan-Effekt: Josiah W. Gibbs, Frederick G. Donnan
Endozytose: ἔνδον = innen, κύτος = Gefäß (Zelle)
Fas: first apoptosis signal
Fick-sches Gesetz: Adolf Fick
Glykokalyx: γλῦκ = süß, καλυξ = Hülse, Kapsel, Schmuck
Karyoplasma: ϰάρυον = Nuss, Fruchtkern; πλάσμα = Gebilde
Kation: κατά = herab, ἰόν = das Wandernde
Kompartiment: com-parare = zusammenstellen, verbinden
Ligand: ligare = binden
Osmose: ὠσμός = Antrieb, Stoß, Eindringen (hier: von Molekülen)
Pendrin: Vaughan Pendred
Permease: permeare = durchdringen
Phagozytose: φαγεῖν = fressen, κύτος = Höhlung, Gefäß
Pinozytose: πῑ́νω = trinken
Plasma: πλάσμα = Gebilde (von πλάσω = formen, gestalten)
Rezeptor: recipere (lat) = erlangen, empfangen, aufnehmen
Svedberg-Einheit: Theodor Svedberg
Tachyphylaxie: ταχύς = rasch, φύλαξις = Schutz
Transport: trans-portare (lat) = hinübertragen
Zytoplasma: κύτος = Höhlung, Gefäß, πλάσμα = Gebilde
| Kompartimentierung bedeutet Aufbau und Erhaltung definierter Funktionsräume im Körper. So kann die Zelle
als Kompartiment gesehen werden: Die Zellmembran - sie besteht hautpsächlich aus Lipiden - trennt
den intrazellulären vom extrazellulären Raum. Extra- und intrazelluläre
gelöste Stoffe können meist nur über spezielle Mechanismen ("Kanäle",
Transporter, "Pumpen") durch die Lipidschichte
der Membran treten. Der zelluläre Stoffwechsel läuft auf diese Weise geschützt vor unerwünschten Durchmischungseffekten ab; Konzentrationsgradienten entstehen und werden erhalten, sie treiben Diffusion und sekundäre Transportvorgänge an. Die Diffusion von Substanzen kann genützt werden, um Begleitstoffe "huckepack" mitzutransportieren (Symport, z.B. Glucose mit Natrium); oder sie werden gegeneinander über Membranproteine ausgetauscht (Antiport). Stoffe können auch unter Energieverbrauch (ATP) durch eine "Pumpe" (ATPase) gegen ihren Konzentrationsgradienten durch Membranen geschleust werden, z.B. Natrium und Kalium mittels der Na-K-Pumpe - Kalium in die und Natrium aus der Zelle. Die Zellmembran verfügt über Rezeptormoleküle: Diese binden Signalmoleküle (Hormone, Transmitter,..) und dies löst sekundäre Vorgänge aus - wie Ionenfluss durch die Membran (z.B. Natriumeinstrom) oder intrazelluläre Sekundäreffekte (Enzymwirkung, Auftreten von Folge-Signalstoffen, Wirkung auf Genablesung im Zellkern..). Steht das Überleben einer Zelle in Frage (etwa wenn sie überflüssig geworden oder pathologisch verändert ist), kann ein geordneter Absterbeprozess (Apoptose) aktiviert werden. Die Zellfragmente werden im Anschluss im Rahmen eines vorgegebenen Vorgangs entsorgt, ihre chemischen Bestandteile wiederverwertet. |
Einführung  Organisation des Transports, Kompartimentierung, Polarität von Zellen
Organisation des Transports, Kompartimentierung, Polarität von Zellen  Zellmembran
Zellmembran  Rezeptoren
Rezeptoren
 Rezeptoraktivität, Rezeptorzahl
Rezeptoraktivität, Rezeptorzahl  Passage durch Membranen
Passage durch Membranen  Intrazelluläre / extrazelluläre Flüssigkeit
Intrazelluläre / extrazelluläre Flüssigkeit  Zellorganellen
Zellorganellen  Apoptose
Apoptose


Zytoplasma, Zytosol, Karyoplasma Diffusion
Diffusion  Permeabilität
Permeabilität  Osmose
Osmose  Endozytose, Phagozytose, Pinozytose, Transzytose
Endozytose, Phagozytose, Pinozytose, Transzytose  Rezeptor
Rezeptor  Aquaporine
Aquaporine  Aktivität
Aktivität  Apoptose
Apoptose  Caspasen
Caspasen  Fas (CD95)
Fas (CD95)

Praktische Aspekte Core messages
Core messages
 Organisation des Transports, Kompartimentierung, Polarität von Zellen
Organisation des Transports, Kompartimentierung, Polarität von Zellen  Zellmembran
Zellmembran  Rezeptoren
Rezeptoren
 Rezeptoraktivität, Rezeptorzahl
Rezeptoraktivität, Rezeptorzahl  Passage durch Membranen
Passage durch Membranen  Intrazelluläre / extrazelluläre Flüssigkeit
Intrazelluläre / extrazelluläre Flüssigkeit  Zellorganellen
Zellorganellen  Apoptose
Apoptose

Zytoplasma, Zytosol, Karyoplasma
 Diffusion
Diffusion  Permeabilität
Permeabilität  Osmose
Osmose  Endozytose, Phagozytose, Pinozytose, Transzytose
Endozytose, Phagozytose, Pinozytose, Transzytose  Rezeptor
Rezeptor  Aquaporine
Aquaporine  Aktivität
Aktivität  Apoptose
Apoptose  Caspasen
Caspasen  Fas (CD95)
Fas (CD95)
Praktische Aspekte
 Core messages
Core messagesDer Körper des Menschen besteht aus Zellen (~65%) und extrazellulären Anteilen (~35% der Körpermasse).
Wächst ein Organismus heran, steuern Zellen nicht
nur ihr eigenes Wachstum, sondern auch das ihrer Umgebung
(z.B. des "Gewebegerüsts", das seinerseits wachsenden Zellen als
Leitstruktur dienen kann). Eine der
grundlegenden Fragen der
Physiologie ist, wie Zellen funktionieren und wie der
Körper ihre Funktionen unterstützt.
Leben baut auf der Funktion von Zellen auf
 cella (lat) = (Vorrats-) Kammer, Stübchen, Klause
cella (lat) = (Vorrats-) Kammer, Stübchen, Klause
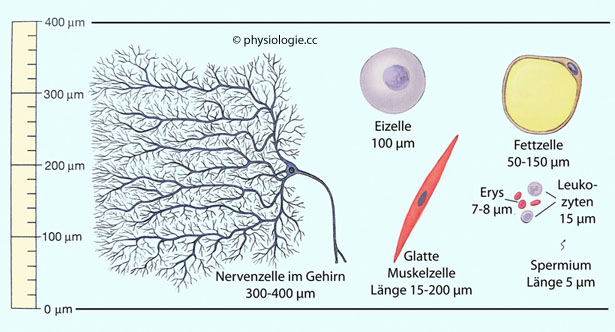
 Abbildung: Verschiedene Zellgrößen
Abbildung: Verschiedene Zellgrößen
Nach einer Vorlage bei Silverthorn, Human Physiology, an integrated approach, 4th Int'l ed. 2007, Pearson / Benjamin Cummings

Man schätzt die Zahl der körpereigenen Zellen einer erwachsenen Person auf ~3.1013 (dreißig Billionen - alleine die Zahl der roten Blutkörperchen macht ~25 Billionen aus: ~5 Millionen pro µl Blut), und jede Sekunde entstehen viele Millionen Körperzellen neu. Dazu kommt eine noch höhere Zahl (1014-1015) an Bakterien und Viren, die sich hauptsächlich auf der Haut, auf Schleimhäuten (Verdauungssystem, Atemwege, Urogenitaltrakt) und Dickdarm (Stuhl) befinden (Mikrobiom) und mit dem Organismus in vielfältiger Weise interagieren.
Wie lange lebt eine Zelle? Einige Epithelzellen und weiße Blutkörperchen haben nur wenige Tage Lebensdauer, andere Zellen können Jahre oder Jahrzehnte überdauern, bevor sie ihre Funktion einstellen und ihre Komponenten wiederverwertet werden. Zwei Beispiele: Einige Leukozyten sind "Kampfzellen", die auch für den Körper selbst gefährlich werden können und nur wenige Tage überdauern; Neuronen speichern Information und bleiben meist zeitlebens erhalten.
Zellen interagieren mit ihrer Umwelt über den Austausch von Signalen (cell signaling) - endo-, para-, auto- oder juxtakrin. In einem vielzelligen Organismus stimmen sie damit ihre Funktion - einschließlich Zellteilung, Wachstum und Differenzierung - mit derjeniger anderer Körperzellen ab. Bei Signalstoffen involviert das mehrere Schritte:
 Synthese und Freisetzung von Signalmolekülen auf einen bestimmten Reiz
hin. Meist handelt es sich dabei um wasserlösliche Moleküle, z.B.
Wachstumsfaktoren, Proteohormone etc; fettlöslich sind z.B. Steroidhormone, Schilddrüsenhormone, Retinoide
Synthese und Freisetzung von Signalmolekülen auf einen bestimmten Reiz
hin. Meist handelt es sich dabei um wasserlösliche Moleküle, z.B.
Wachstumsfaktoren, Proteohormone etc; fettlöslich sind z.B. Steroidhormone, Schilddrüsenhormone, Retinoide
 Transport (typischerweise in der Nachbarschaft durch das Interstitium,
oder über den Blutkreislauf) zu Zielzellen, wo die Signalmoleküle an
spezifische Rezeptoren binden (auf oder in der Zelle)
Transport (typischerweise in der Nachbarschaft durch das Interstitium,
oder über den Blutkreislauf) zu Zielzellen, wo die Signalmoleküle an
spezifische Rezeptoren binden (auf oder in der Zelle)
 Der Komplex Rezeptor-Signalmolekül aktiviert oder hemmt Vorgänge,
welche zelluläre Funktionen (Stoffwechsel, Genexpression etc) steuern
Der Komplex Rezeptor-Signalmolekül aktiviert oder hemmt Vorgänge,
welche zelluläre Funktionen (Stoffwechsel, Genexpression etc) steuern
 Löst sich das Signalmolekül vom Rezeptor, oder werden diese Moleküle entfernt, endet auch das betreffende Signal.
Löst sich das Signalmolekül vom Rezeptor, oder werden diese Moleküle entfernt, endet auch das betreffende Signal.
 cella (lat) = (Vorrats-) Kammer, Stübchen, Klause
cella (lat) = (Vorrats-) Kammer, Stübchen, Klause
 Abbildung: Verschiedene Zellgrößen
Abbildung: Verschiedene ZellgrößenNach einer Vorlage bei Silverthorn, Human Physiology, an integrated approach, 4th Int'l ed. 2007, Pearson / Benjamin Cummings
Spermien
sind 5 µm lang, Eizellen haben einen Durchmesser von etwa 100 µm,
Neuronen haben einen Dendritenbaum von mehreren hundert µm Ausdehnung sowie Neuriten, die elektrische Impulse (Aktionspotentiale) z.B. über eine Distanz von einem Meter in einer Hundertstelsekunde übermitteln können

Man schätzt die Zahl der körpereigenen Zellen einer erwachsenen Person auf ~3.1013 (dreißig Billionen - alleine die Zahl der roten Blutkörperchen macht ~25 Billionen aus: ~5 Millionen pro µl Blut), und jede Sekunde entstehen viele Millionen Körperzellen neu. Dazu kommt eine noch höhere Zahl (1014-1015) an Bakterien und Viren, die sich hauptsächlich auf der Haut, auf Schleimhäuten (Verdauungssystem, Atemwege, Urogenitaltrakt) und Dickdarm (Stuhl) befinden (Mikrobiom) und mit dem Organismus in vielfältiger Weise interagieren.
Wie lange lebt eine Zelle? Einige Epithelzellen und weiße Blutkörperchen haben nur wenige Tage Lebensdauer, andere Zellen können Jahre oder Jahrzehnte überdauern, bevor sie ihre Funktion einstellen und ihre Komponenten wiederverwertet werden. Zwei Beispiele: Einige Leukozyten sind "Kampfzellen", die auch für den Körper selbst gefährlich werden können und nur wenige Tage überdauern; Neuronen speichern Information und bleiben meist zeitlebens erhalten.
Zellen interagieren mit ihrer Umwelt über den Austausch von Signalen (cell signaling) - endo-, para-, auto- oder juxtakrin. In einem vielzelligen Organismus stimmen sie damit ihre Funktion - einschließlich Zellteilung, Wachstum und Differenzierung - mit derjeniger anderer Körperzellen ab. Bei Signalstoffen involviert das mehrere Schritte:
 Synthese und Freisetzung von Signalmolekülen auf einen bestimmten Reiz
hin. Meist handelt es sich dabei um wasserlösliche Moleküle, z.B.
Wachstumsfaktoren, Proteohormone etc; fettlöslich sind z.B. Steroidhormone, Schilddrüsenhormone, Retinoide
Synthese und Freisetzung von Signalmolekülen auf einen bestimmten Reiz
hin. Meist handelt es sich dabei um wasserlösliche Moleküle, z.B.
Wachstumsfaktoren, Proteohormone etc; fettlöslich sind z.B. Steroidhormone, Schilddrüsenhormone, Retinoide Transport (typischerweise in der Nachbarschaft durch das Interstitium,
oder über den Blutkreislauf) zu Zielzellen, wo die Signalmoleküle an
spezifische Rezeptoren binden (auf oder in der Zelle)
Transport (typischerweise in der Nachbarschaft durch das Interstitium,
oder über den Blutkreislauf) zu Zielzellen, wo die Signalmoleküle an
spezifische Rezeptoren binden (auf oder in der Zelle) Der Komplex Rezeptor-Signalmolekül aktiviert oder hemmt Vorgänge,
welche zelluläre Funktionen (Stoffwechsel, Genexpression etc) steuern
Der Komplex Rezeptor-Signalmolekül aktiviert oder hemmt Vorgänge,
welche zelluläre Funktionen (Stoffwechsel, Genexpression etc) steuern Löst sich das Signalmolekül vom Rezeptor, oder werden diese Moleküle entfernt, endet auch das betreffende Signal.
Löst sich das Signalmolekül vom Rezeptor, oder werden diese Moleküle entfernt, endet auch das betreffende Signal.
 Abbildung: Zellen und Kreislauf
Abbildung: Zellen und KreislaufModifiziert nach einer Vorlage in Mohrman DE / Heller LJ, Cardiovascular Physiology, 8th ed. McGraw Hill 2014
Austausch (Pfeile): Zellen nehmen aus der extrazellulären Flüssigkeit (dem Interstitium) Aminosäuren, Zucker, Salze,
Spurenelemente, Signalstoffe, Sauerstoff etc. auf. Andere Stoffe - Substrate, Hormone,
Transmitter, Kohlendioxid usw. - werden an die extrazelluläre
Flüssigkeit abgegeben.
Zwischen Umwelt und Lungenbläschen erfolgt der Atemgasaustausch über Luftströmung (Konvektion), zwischen Luft und Blut über Diffusion (Alveolarwand), zwischen Lunge und Kapillaren über Blutströmung (Perfusion), schließlich (Blut bis Zelle) hauptsächlich über Diffusion

Diffusionsgesetz


 Abbildung: Diffusion durch eine permeable Barriere
Abbildung: Diffusion durch eine permeable Barriere
Nach einer Vorlage in Butler / Brown / Stephenson / Speakman, Animal Physiology - An Environmental Perspective, Oxford University Press 2021
Eine durchlässige Barriere trennt ein Medium 1 von einem Medium 2 (links). Unterscheidet sich die Konzentration (c) einer Substanz bzw. der Gaspartialdruck (p) eines Gases in den beiden Medien, diffundiert der betreffende Stoff durch die Barriere.
Ist c1>c2 bzw. p1>p2 (wie in der Abbildung), dann erfolgt die Diffusion aus dem Medium 1 in das Medium 2 (und vice versa). Die Intensität der Diffusion (Menge pro Zeit - Diffusionsstrom J) steigt entsprechend der oben angegebenen Formel (Diffusionsgesetz) mit zunehmendem Krogh'schem Diffusionskoeffizienten (D), zunehmender Austauschfläche (A), abnehmender Barrierendicke (d) sowie (rechts) zunehmender Konzentrations- bzw. Partialdruckdifferenz (c1-c2 bzw. p1-p2)

Eine ebenfalls häufig verwendete Formulierung (Prüfung!) lautet wie folgt:

 Abbildung: Tonizität und Osmose
Abbildung: Tonizität und Osmose
Nach einer Vorlage bei Guyton & Hall, Textbook of Medical Physiology, 10th ed, Saunders Philadelphia 2000

 Viele Zellorganellen bilden mit ihrem Membranen Kompartimente, in denen biochemische Vorgänge von ihrer Umgebung abgeschirmt ablaufen können - dies unterstützt geordneten
Stoffwechsel und strukturierte Informationsübertragung.
Viele Zellorganellen bilden mit ihrem Membranen Kompartimente, in denen biochemische Vorgänge von ihrer Umgebung abgeschirmt ablaufen können - dies unterstützt geordneten
Stoffwechsel und strukturierte Informationsübertragung.
 1974 erhielten Albert Claude, Christian de Duve und Georg E. Palade den Nobelpreis für Physiologie oder Medizin "für ihre
Entdeckungen zur strukturellen und funktionellen Organisation der
Zelle". Sie
stellten mittels elektronenmikroskopischer Untersuchungen Details
zellulärer Strukturen dar, was die Aufklärung ihrer Rolle im
Zellstoffwechsel wesentlich erweiterte.
1974 erhielten Albert Claude, Christian de Duve und Georg E. Palade den Nobelpreis für Physiologie oder Medizin "für ihre
Entdeckungen zur strukturellen und funktionellen Organisation der
Zelle". Sie
stellten mittels elektronenmikroskopischer Untersuchungen Details
zellulärer Strukturen dar, was die Aufklärung ihrer Rolle im
Zellstoffwechsel wesentlich erweiterte.
 Abbildung: Membran-Recycling von Endo- bis Exozytose
Abbildung: Membran-Recycling von Endo- bis Exozytose
Nach einer Vorlage bei Silverthorn, Human Physiology, an integrated approach, 4th Int'l ed. 2007, Pearson / Benjamin Cummings

Zellmembran: Panta rhei
Zwischen Umwelt und Lungenbläschen erfolgt der Atemgasaustausch über Luftströmung (Konvektion), zwischen Luft und Blut über Diffusion (Alveolarwand), zwischen Lunge und Kapillaren über Blutströmung (Perfusion), schließlich (Blut bis Zelle) hauptsächlich über Diffusion

Zellen bestehen
zu
70% aus Wasser, 15-20% Eiweiß, ~10% Nukleinsäuren, Elektrolyten, sowie
weiteren Stoffen in vergleichsweise geringer Konzentration. Membranen erlauben den
geordneten
Austausch dieser Stoffe innerhalb der Zelle sowie mit ihrer Umgebung und begrenzen zelluläre Reaktionsräume. Das Zytoplasma enthält (lichtmikroskopisch ungeformtes) Zytosol und darin eingelagerte Zellorganellen sowie
Filamente (Zytoskelett) für Stabilisierung und Verankerung - deren
Ausprägung hängt von der spezifischen Funktion der jeweiligen
Zelle ab. So dient z.B. das rauhe endoplasmatische Retikulum der
Proteinsynthese - und diese unterliegt wiederum der Steuerung aus dem
Zellkern, d.h. der jeweils aktiven Gene.
 Zytoplasma ist der gesamte Inhalt einer Zelle minus dem Zellkern (Erythrozyten sind kernlos und enthalten nur Zytoplasma). Zytosol ist die amorphe gelartige intrazelluläre Masse des Zytoplasma, in der Zellorganellen,
Filamente, Mikrotubuli und sonstige korpuskuläre Einschlüsse
suspendiert sind. Die dem Zytosol analoge Substanz im Zellkern heißt Karyoplasma, es enthält den Nucleolus, Chromosomen, Kernkörperchen u.a.
Zytoplasma ist der gesamte Inhalt einer Zelle minus dem Zellkern (Erythrozyten sind kernlos und enthalten nur Zytoplasma). Zytosol ist die amorphe gelartige intrazelluläre Masse des Zytoplasma, in der Zellorganellen,
Filamente, Mikrotubuli und sonstige korpuskuläre Einschlüsse
suspendiert sind. Die dem Zytosol analoge Substanz im Zellkern heißt Karyoplasma, es enthält den Nucleolus, Chromosomen, Kernkörperchen u.a.
Zellen sind von einer Zellmembran umgeben, die einerseits der Abgrenzung gegenüber der "Außenwelt" - oder in der Zelle gegenüber anderen Reaktionsräumen - dient (Lipid-Doppellamelle), andererseits der Kommunikation (Rezeptoren) und dem gezielten Stoffaustausch, der teils "passiv" (Permeasen), teils "aktiv", d.h. gegen Konzentrationsgefälle erfolgt ("Pumpen"). In verschiedenen Verteilungsräumen (Kompartimenten) ergeben sich unterschiedliche Stoffkonzentrationen (z.B. hoher Kaliumspiegel im intrazellulären, hoher Natriumspiegel im extrazellulären Raum usw). Hydrophile Moleküle bedürfen für die transmembranale Passage besonderer Transporter, z.B. gelangen Wassermoleküle über Aquaporine, Ionen über "Ionenkanäle" durch Biomembranen.
Die Grundlage aller Membranen in der Zelle ist eine Phospholipid-Doppellamelle. Der Grund, dass sich automatisch Doppellamellen bilden, liegt darin, dass sich die Schwanzteile der Phospholipidmoleküle (die lipophil / hydrophob sind) spontan aneinanderlegen und sich so vor Kontakt mit Wassermolekülen "schützen". Die (hydrophilen / lipophoben) Kopfteile der Phospholipide haben umgekehrt Kontakt mit wasserreichen Kompartimenten (z.B. bei der Zellmembran: Intra- und Extrazellulärraum) - s. weiter unten. So bilden sich Membransysteme, und diese dienen der Separierung von Reaktionsräumen.
Membransysteme in der Zelle bestehen immer aus Doppellamellen - entweder aus einer (Zellmembran, endoplasmatisches Retikulum, Golgi-Apparat, Vesikel, Lysosomen, Peroxisomen) oder zwei Doppellamellen (Zellkern, Mitochondrien - diese Organellen umgrenzen so mit einer äußeren und einer inneren Membran einen eigenen Spaltraum).
 Zellen zeigen räumliche Spezialisierung:
So haben epitheliale Zellen, die sich entlang von Oberflächen
organisieren (Haut, Schleimhäute, Auskleidung von Hohlorganen, Tubuli
in der Niere,..), einerseits einen apikalen Pol mit einer entsprechenden Membran, andererseits eine basolaterale Membran, die z.T. auf einer Basalmembran aufsitzen kann. Diese beiden Membranen sind spezialisiert auf unterschiedliche Aufgaben - entsprechend mit Membranmolekülen (Rezeptoren, Permeasen etc) ausgestattet - und durch Sperrmoleküle (die den Übertritt der eingelagerten Moleküle in die jeweils andere Zone verhindern) gegeneinander abgegrenzt.
Zellen zeigen räumliche Spezialisierung:
So haben epitheliale Zellen, die sich entlang von Oberflächen
organisieren (Haut, Schleimhäute, Auskleidung von Hohlorganen, Tubuli
in der Niere,..), einerseits einen apikalen Pol mit einer entsprechenden Membran, andererseits eine basolaterale Membran, die z.T. auf einer Basalmembran aufsitzen kann. Diese beiden Membranen sind spezialisiert auf unterschiedliche Aufgaben - entsprechend mit Membranmolekülen (Rezeptoren, Permeasen etc) ausgestattet - und durch Sperrmoleküle (die den Übertritt der eingelagerten Moleküle in die jeweils andere Zone verhindern) gegeneinander abgegrenzt.
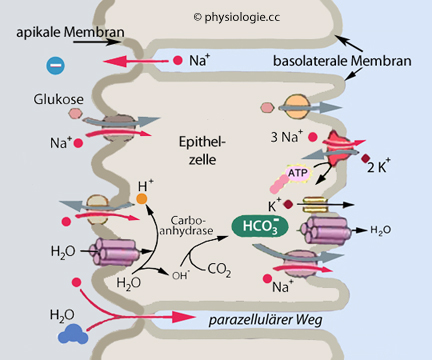
So haben Epithelzellen in Darmschleimhaut und Nierentubuli eine als luminal (an das "Lumen", d.h. den Rohrinhalt angrenzende) bezeichnete apikale, und eine zur Seite bzw. zum Interstitium gerichtete basolaterale Membran. Soll z.B. eine Aminosäure aus dem Tubulus zum Blut befördert werden, muss die luminale Seite diese in die Zelle hinein und die basolaterale aus der Zelle heraus bringen, was unterschiedliche molekulare Transportmechanismen erfordert.
An der Etablierung der Zellpolarität (oben - unten, vorne - hinten, apikal - basolateral) nimmt zu einem wesentlichen Teil das Zytoskelett (Aktin- und Intermediärfilamente sowie Mikrotubuli) teil. Auch wenn die Geometrie der Zelle u.U. auf lange Zeit unverändert anhält, werden die Moleküle des Zytoskeletts ständig ausgetauscht und erneuert (Turnover-Zeit etwa 2 Tage).
 Zytoplasma ist der gesamte Inhalt einer Zelle minus dem Zellkern (Erythrozyten sind kernlos und enthalten nur Zytoplasma). Zytosol ist die amorphe gelartige intrazelluläre Masse des Zytoplasma, in der Zellorganellen,
Filamente, Mikrotubuli und sonstige korpuskuläre Einschlüsse
suspendiert sind. Die dem Zytosol analoge Substanz im Zellkern heißt Karyoplasma, es enthält den Nucleolus, Chromosomen, Kernkörperchen u.a.
Zytoplasma ist der gesamte Inhalt einer Zelle minus dem Zellkern (Erythrozyten sind kernlos und enthalten nur Zytoplasma). Zytosol ist die amorphe gelartige intrazelluläre Masse des Zytoplasma, in der Zellorganellen,
Filamente, Mikrotubuli und sonstige korpuskuläre Einschlüsse
suspendiert sind. Die dem Zytosol analoge Substanz im Zellkern heißt Karyoplasma, es enthält den Nucleolus, Chromosomen, Kernkörperchen u.a.Zellen sind von einer Zellmembran umgeben, die einerseits der Abgrenzung gegenüber der "Außenwelt" - oder in der Zelle gegenüber anderen Reaktionsräumen - dient (Lipid-Doppellamelle), andererseits der Kommunikation (Rezeptoren) und dem gezielten Stoffaustausch, der teils "passiv" (Permeasen), teils "aktiv", d.h. gegen Konzentrationsgefälle erfolgt ("Pumpen"). In verschiedenen Verteilungsräumen (Kompartimenten) ergeben sich unterschiedliche Stoffkonzentrationen (z.B. hoher Kaliumspiegel im intrazellulären, hoher Natriumspiegel im extrazellulären Raum usw). Hydrophile Moleküle bedürfen für die transmembranale Passage besonderer Transporter, z.B. gelangen Wassermoleküle über Aquaporine, Ionen über "Ionenkanäle" durch Biomembranen.
Die Grundlage aller Membranen in der Zelle ist eine Phospholipid-Doppellamelle. Der Grund, dass sich automatisch Doppellamellen bilden, liegt darin, dass sich die Schwanzteile der Phospholipidmoleküle (die lipophil / hydrophob sind) spontan aneinanderlegen und sich so vor Kontakt mit Wassermolekülen "schützen". Die (hydrophilen / lipophoben) Kopfteile der Phospholipide haben umgekehrt Kontakt mit wasserreichen Kompartimenten (z.B. bei der Zellmembran: Intra- und Extrazellulärraum) - s. weiter unten. So bilden sich Membransysteme, und diese dienen der Separierung von Reaktionsräumen.
Membransysteme in der Zelle bestehen immer aus Doppellamellen - entweder aus einer (Zellmembran, endoplasmatisches Retikulum, Golgi-Apparat, Vesikel, Lysosomen, Peroxisomen) oder zwei Doppellamellen (Zellkern, Mitochondrien - diese Organellen umgrenzen so mit einer äußeren und einer inneren Membran einen eigenen Spaltraum).
 Zellen zeigen räumliche Spezialisierung:
So haben epitheliale Zellen, die sich entlang von Oberflächen
organisieren (Haut, Schleimhäute, Auskleidung von Hohlorganen, Tubuli
in der Niere,..), einerseits einen apikalen Pol mit einer entsprechenden Membran, andererseits eine basolaterale Membran, die z.T. auf einer Basalmembran aufsitzen kann. Diese beiden Membranen sind spezialisiert auf unterschiedliche Aufgaben - entsprechend mit Membranmolekülen (Rezeptoren, Permeasen etc) ausgestattet - und durch Sperrmoleküle (die den Übertritt der eingelagerten Moleküle in die jeweils andere Zone verhindern) gegeneinander abgegrenzt.
Zellen zeigen räumliche Spezialisierung:
So haben epitheliale Zellen, die sich entlang von Oberflächen
organisieren (Haut, Schleimhäute, Auskleidung von Hohlorganen, Tubuli
in der Niere,..), einerseits einen apikalen Pol mit einer entsprechenden Membran, andererseits eine basolaterale Membran, die z.T. auf einer Basalmembran aufsitzen kann. Diese beiden Membranen sind spezialisiert auf unterschiedliche Aufgaben - entsprechend mit Membranmolekülen (Rezeptoren, Permeasen etc) ausgestattet - und durch Sperrmoleküle (die den Übertritt der eingelagerten Moleküle in die jeweils andere Zone verhindern) gegeneinander abgegrenzt.So haben Epithelzellen in Darmschleimhaut und Nierentubuli eine als luminal (an das "Lumen", d.h. den Rohrinhalt angrenzende) bezeichnete apikale, und eine zur Seite bzw. zum Interstitium gerichtete basolaterale Membran. Soll z.B. eine Aminosäure aus dem Tubulus zum Blut befördert werden, muss die luminale Seite diese in die Zelle hinein und die basolaterale aus der Zelle heraus bringen, was unterschiedliche molekulare Transportmechanismen erfordert.
An der Etablierung der Zellpolarität (oben - unten, vorne - hinten, apikal - basolateral) nimmt zu einem wesentlichen Teil das Zytoskelett (Aktin- und Intermediärfilamente sowie Mikrotubuli) teil. Auch wenn die Geometrie der Zelle u.U. auf lange Zeit unverändert anhält, werden die Moleküle des Zytoskeletts ständig ausgetauscht und erneuert (Turnover-Zeit etwa 2 Tage).
Wie bewegen sich Moleküle und Ionen durch die Zelle?
Über die Angabe von Stoffmengen (Gramm, mol) und Stoffkonzentrationen s. dort
s. dort
Diffusion Osmose
Osmose  Kompartimente
Kompartimente  Strukturen und treibende Kräfte
Strukturen und treibende Kräfte  Endozytose
Endozytose  Transzytose
Transzytose
Über die Angabe von Stoffmengen (Gramm, mol) und Stoffkonzentrationen
 s. dort
s. dortDiffusion
 Osmose
Osmose  Kompartimente
Kompartimente  Strukturen und treibende Kräfte
Strukturen und treibende Kräfte  Endozytose
Endozytose  Transzytose
TranszytoseLiegt ein (frei beweglicher) Stoff an
einer Stelle im Raum in höherer Konzentration vor als in der
Umgebung dieser Stelle, ist es wahrscheinlicher, dass seine Teilchen
sich (im Rahmen der zufallsgesteuerten "Brown'schen Molekularbewegung")
von hier wegbewegen als in der Gegenrichtung (zunehmende Entropie → Zweiter Hauptsatz der Thermodynamik).
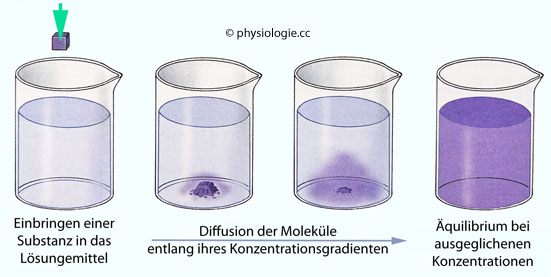
 Abbildung: Diffusion
Abbildung: Diffusion
Nach einer Vorlage bei Silverthorn, Human Physiology - an integrated approach, 4th ed. Pearson International 2007
 Diese den Regeln der Wahrscheinlichkeit folgende Netto-Bewegung in die Richtung abnehmender Konzentration des betreffenden Stoffes heißt Diffusion
Diese den Regeln der Wahrscheinlichkeit folgende Netto-Bewegung in die Richtung abnehmender Konzentration des betreffenden Stoffes heißt Diffusion  .
Diffusion ist die Bewegung von Teilchen von Orten ihrer höheren Konzentration zu Orten ihrer geringeren Konzentration.
Sie gleicht also Konzentrationsunterschiede aus, soferne
diese nicht durch zusätzliche Transportprozesse (weiter) aufrecht erhalten werden (wie z.B. eine Ionenpumpe in der Zellmembran).
.
Diffusion ist die Bewegung von Teilchen von Orten ihrer höheren Konzentration zu Orten ihrer geringeren Konzentration.
Sie gleicht also Konzentrationsunterschiede aus, soferne
diese nicht durch zusätzliche Transportprozesse (weiter) aufrecht erhalten werden (wie z.B. eine Ionenpumpe in der Zellmembran).
Diffusion kann passiv erfolgen (der Stoff wandert entsprechend seinem Konzentrationsgradienten durch Zellmembranen - wenn er fettlöslich ist, direkt, wenn er wasserlöslich ist, durch Permeasen), oder erleichtert (facilitated), d.h. über Anlagerung an Trägerproteine in der Membran (transmembrane carrier proteins).

 Abbildung: Konzentrationsabhängige Passage eines Stoffes durch eine Zellmembran
Abbildung: Konzentrationsabhängige Passage eines Stoffes durch eine Zellmembran


 Abbildung: Diffusion
Abbildung: DiffusionNach einer Vorlage bei Silverthorn, Human Physiology - an integrated approach, 4th ed. Pearson International 2007
Links: Ein Farbstoff wird in ein Gefäß mit Wasser eingebracht.
Verdünnungseffekt: Im Rahmen der Wärmebewegung gelangen die Farbstoffmoleküle insgesamt aus diesem Areal heraus (Diffusion), weil ihre Bewegung in Richtung ihrer abnehmenden Konzentration am höchsten ist. Das gilt auch für die Wassermoleküle, diese wandern in die umgekehrte Richtung (dabei lösen sie den Farbstoffblock auf).
Rechts: Nach kompletter Durchmischung (und Abwesenheit zusätzlicher "Ordnungskräfte") ist die Bewegungwahrscheinlichkeit der Moleküle in allen Richtungen identisch und ihre Konzentration überall gleich groß (Äquilibrium)
Verdünnungseffekt: Im Rahmen der Wärmebewegung gelangen die Farbstoffmoleküle insgesamt aus diesem Areal heraus (Diffusion), weil ihre Bewegung in Richtung ihrer abnehmenden Konzentration am höchsten ist. Das gilt auch für die Wassermoleküle, diese wandern in die umgekehrte Richtung (dabei lösen sie den Farbstoffblock auf).
Rechts: Nach kompletter Durchmischung (und Abwesenheit zusätzlicher "Ordnungskräfte") ist die Bewegungwahrscheinlichkeit der Moleküle in allen Richtungen identisch und ihre Konzentration überall gleich groß (Äquilibrium)
 Diese den Regeln der Wahrscheinlichkeit folgende Netto-Bewegung in die Richtung abnehmender Konzentration des betreffenden Stoffes heißt Diffusion
Diese den Regeln der Wahrscheinlichkeit folgende Netto-Bewegung in die Richtung abnehmender Konzentration des betreffenden Stoffes heißt Diffusion  .
Diffusion ist die Bewegung von Teilchen von Orten ihrer höheren Konzentration zu Orten ihrer geringeren Konzentration.
Sie gleicht also Konzentrationsunterschiede aus, soferne
diese nicht durch zusätzliche Transportprozesse (weiter) aufrecht erhalten werden (wie z.B. eine Ionenpumpe in der Zellmembran).
.
Diffusion ist die Bewegung von Teilchen von Orten ihrer höheren Konzentration zu Orten ihrer geringeren Konzentration.
Sie gleicht also Konzentrationsunterschiede aus, soferne
diese nicht durch zusätzliche Transportprozesse (weiter) aufrecht erhalten werden (wie z.B. eine Ionenpumpe in der Zellmembran).Diffusion kann passiv erfolgen (der Stoff wandert entsprechend seinem Konzentrationsgradienten durch Zellmembranen - wenn er fettlöslich ist, direkt, wenn er wasserlöslich ist, durch Permeasen), oder erleichtert (facilitated), d.h. über Anlagerung an Trägerproteine in der Membran (transmembrane carrier proteins).
Voraussetzung
für diese einfache Abhängigkeit der Stoffbewegung von einer
Konzentrationsdifferenz (falls vorhanden) ist, dass keine zusätzliche
Kraft wirksam ist, die das Gleichgewicht der Kräfte verschiebt. Wie
etwa eine elektrische Potentialdifferenz, die auf Ladungsträger (Ionen,
z.B. Na+, K+,..) wirkt. In diesem Fall würde nicht die Konzentrationsdifferenz (eines Ions) alleine (z.B. zwischen beiden Seiten einer Zellmembran), sondern auch das Membranpotential (an dieser Membran) die Netto-Bewegung der Ionen beeinflussen ( s. Gleichgewichtspotential).
s. Gleichgewichtspotential).
 s. Gleichgewichtspotential).
s. Gleichgewichtspotential).
 Abbildung: Konzentrationsabhängige Passage eines Stoffes durch eine Zellmembran
Abbildung: Konzentrationsabhängige Passage eines Stoffes durch eine ZellmembranLinks: Der Stoff liegt nur auf einer Seite der Membran vor.
Mitte: Wärmebewegung lässt den Stoff durch die Membran treten. Der roter Pfeil deutet die wahrscheinlichere Bewegungsrichtung - vom Ort höherer zum Ort niedrigerer Konzentration des betreffenden Stoffes - an.
Rechts: Nach Konzentrationsausgleich bewegen sich gleiche Mengen des Stoffes in die ursprünfliche Richtung wie zurück (rote Pfeile), ein Gleichgewichtszustand stellt sich ein. Das ist die Situation an einer Zellmembran, wenn die osmotische Balance zwischen Intra- und Extrazellulärraum ausgeglichen ist
Mitte: Wärmebewegung lässt den Stoff durch die Membran treten. Der roter Pfeil deutet die wahrscheinlichere Bewegungsrichtung - vom Ort höherer zum Ort niedrigerer Konzentration des betreffenden Stoffes - an.
Rechts: Nach Konzentrationsausgleich bewegen sich gleiche Mengen des Stoffes in die ursprünfliche Richtung wie zurück (rote Pfeile), ein Gleichgewichtszustand stellt sich ein. Das ist die Situation an einer Zellmembran, wenn die osmotische Balance zwischen Intra- und Extrazellulärraum ausgeglichen ist

Diffusion spielt überall im Körper eine Rolle, beispielsweise
 In jeder Zelle, wo Stoffe zwischen Zellkompartimenten ihrem Konzentrationsgefälle folgend hin- und herwandern,
In jeder Zelle, wo Stoffe zwischen Zellkompartimenten ihrem Konzentrationsgefälle folgend hin- und herwandern,
 im Gewebe, z.B. diffundieren Nährstoffe in Richung Zellen
(die sie einlagern oder verbrauchen) und Stoffwechselprodukte von
Zellen (die sie produzieren) fort,
im Gewebe, z.B. diffundieren Nährstoffe in Richung Zellen
(die sie einlagern oder verbrauchen) und Stoffwechselprodukte von
Zellen (die sie produzieren) fort,
 zwischen
Blutgefäßen und Gewebe (kapillärer Stoffaustausch), wobei sehr unterschiedliche Permeabilitäten vorliegen - z.B. Blut-Hirn-Schranke, Chorioidea und Netzhaut (Bruch'sche Membran
im Auge),
zwischen
Blutgefäßen und Gewebe (kapillärer Stoffaustausch), wobei sehr unterschiedliche Permeabilitäten vorliegen - z.B. Blut-Hirn-Schranke, Chorioidea und Netzhaut (Bruch'sche Membran
im Auge),
 zwischen Atemluft und Blut (Lunge).
zwischen Atemluft und Blut (Lunge).
Besteht an einer Membran ein Konzentrationsunterschied für einen Stoff (für den die Membran durchlässig ist), so ist auch hier die Zahl der Moleküle, die sich in Richtung der niedrigeren Konzentration bewegen, größer als die Zahl der Moleküle, die in die Gegenrichtung streben (soferne nicht ein entgegengesetzter Transportmechanismus - eine molekulare "Pumpe" - wirksam ist).
Überall im Körper finden sich unterschiedliche Konzentrationen - etwa was intra- vs. extrazelluläre Flüssigkeit betrifft. Warum gleichen die Gesetze der Diffusion diese Unterschiede nicht aus? Die Erklärung ist in den Lebensvorgängen selbst begründet: Solche Konzentrationsunterschiede sind das Ergebnis vorausgegangener gerichteter Transportvorgänge (z.B. in Form von Na/K-Pumpen) durch die Membran, welche diese Unterschiede etabliert haben, Energie verbrauchen (kein Widerspruch zu Gesetzen der Thermodynamik) und durch physiologische Regulation stabilisiert sind.
Diffusionsgesetz: Je größer die verfügbare Austauschfläche, je geringer der Durchmesser eines allfälligen Hindernisses (z.B. Zellmembran) und je größer dessen Durchlässigkeit (Permeabilität), desto intensiver kann die Diffusion erfolgen.
 Die mittlere Diffusionszeit nimmt im Verhältnis zum Quadrat der Diffusionsstrecke zu:
Die mittlere Diffusionszeit nimmt im Verhältnis zum Quadrat der Diffusionsstrecke zu:
 In jeder Zelle, wo Stoffe zwischen Zellkompartimenten ihrem Konzentrationsgefälle folgend hin- und herwandern,
In jeder Zelle, wo Stoffe zwischen Zellkompartimenten ihrem Konzentrationsgefälle folgend hin- und herwandern, im Gewebe, z.B. diffundieren Nährstoffe in Richung Zellen
(die sie einlagern oder verbrauchen) und Stoffwechselprodukte von
Zellen (die sie produzieren) fort,
im Gewebe, z.B. diffundieren Nährstoffe in Richung Zellen
(die sie einlagern oder verbrauchen) und Stoffwechselprodukte von
Zellen (die sie produzieren) fort, zwischen
Blutgefäßen und Gewebe (kapillärer Stoffaustausch), wobei sehr unterschiedliche Permeabilitäten vorliegen - z.B. Blut-Hirn-Schranke, Chorioidea und Netzhaut (Bruch'sche Membran
im Auge),
zwischen
Blutgefäßen und Gewebe (kapillärer Stoffaustausch), wobei sehr unterschiedliche Permeabilitäten vorliegen - z.B. Blut-Hirn-Schranke, Chorioidea und Netzhaut (Bruch'sche Membran
im Auge), zwischen Atemluft und Blut (Lunge).
zwischen Atemluft und Blut (Lunge).Besteht an einer Membran ein Konzentrationsunterschied für einen Stoff (für den die Membran durchlässig ist), so ist auch hier die Zahl der Moleküle, die sich in Richtung der niedrigeren Konzentration bewegen, größer als die Zahl der Moleküle, die in die Gegenrichtung streben (soferne nicht ein entgegengesetzter Transportmechanismus - eine molekulare "Pumpe" - wirksam ist).
Überall im Körper finden sich unterschiedliche Konzentrationen - etwa was intra- vs. extrazelluläre Flüssigkeit betrifft. Warum gleichen die Gesetze der Diffusion diese Unterschiede nicht aus? Die Erklärung ist in den Lebensvorgängen selbst begründet: Solche Konzentrationsunterschiede sind das Ergebnis vorausgegangener gerichteter Transportvorgänge (z.B. in Form von Na/K-Pumpen) durch die Membran, welche diese Unterschiede etabliert haben, Energie verbrauchen (kein Widerspruch zu Gesetzen der Thermodynamik) und durch physiologische Regulation stabilisiert sind.
Diffusionsgesetz: Je größer die verfügbare Austauschfläche, je geringer der Durchmesser eines allfälligen Hindernisses (z.B. Zellmembran) und je größer dessen Durchlässigkeit (Permeabilität), desto intensiver kann die Diffusion erfolgen.
 Die mittlere Diffusionszeit nimmt im Verhältnis zum Quadrat der Diffusionsstrecke zu:
Die mittlere Diffusionszeit nimmt im Verhältnis zum Quadrat der Diffusionsstrecke zu: Mittlere Diffusionszeit von Glucosemolekülen  Nach Albert Einstein 1905 |
||
| Strecke |
Zeit |
In-vivo-Beispiel |
| 0,1 µm |
0,000005 s |
Spaltraum an der motorischen Endplatte |
| 1 µm |
0,0005 s |
Kapillarwand |
| 10 µm |
0,05 s |
Strecke Kapillare - Zelle |
| 1 mm |
~9 min | Arterienwand |
| 1 cm |
~15 h | Wand des linken Ventrikels |
Über
mikroskopisch kleine Distanzen - wie zwischen Kapillaren und Zellen im
Gewebe (in der Tabelle werden 10 µm angenommen) - können Stoffe
(Atemgase, Nährstoffe etc) via Diffusion bewegt werden; effektiver Austausch über größere Strecken bedarf eines Systems zum konvektiven Transport (Blutkreislauf, Atemapparat).
Diffusionsgesetz
Die Menge
eines Stoffes, der in einer bestimmten Zeit über eine Grenzfläche
(physiologisch: Kompartmentgrenze, "Membran") diffundiert
(Diffusionsstrom J), ist proportional der Austauschfläche (A) und dem
Konzentrationsgrandienten (Δc) sowie umgekehrt proportional der
Diffusionsstrecke (Membrandicke d). Zusätzlich erlaubt eine Stoffkonstante
(Krogh'scher Diffusionskoeffizient D) - spezifisch für die Materialien, also
jeweils für diffundierende und Membransubstanz - eine direkte molare
Berechnung (Stoffmenge pro Zeit).
Dieser Zusammenhang wird als Fick'sches Diffusionsgesetz (nach Adolf Fick ) bezeichnet:
) bezeichnet:
Dieser Zusammenhang wird als Fick'sches Diffusionsgesetz (nach Adolf Fick
 ) bezeichnet:
) bezeichnet:
Die
Art und Weise, wie dieser fundamentale und biologisch wichtige
Zusammenhang formuliert wird, variiert beträchtlich, der Grundgedanke
ist aber immer der gleiche ( Abbildung).
Abbildung).
 Abbildung).
Abbildung).
 Abbildung: Diffusion durch eine permeable Barriere
Abbildung: Diffusion durch eine permeable BarriereNach einer Vorlage in Butler / Brown / Stephenson / Speakman, Animal Physiology - An Environmental Perspective, Oxford University Press 2021
Eine durchlässige Barriere trennt ein Medium 1 von einem Medium 2 (links). Unterscheidet sich die Konzentration (c) einer Substanz bzw. der Gaspartialdruck (p) eines Gases in den beiden Medien, diffundiert der betreffende Stoff durch die Barriere.
Ist c1>c2 bzw. p1>p2 (wie in der Abbildung), dann erfolgt die Diffusion aus dem Medium 1 in das Medium 2 (und vice versa). Die Intensität der Diffusion (Menge pro Zeit - Diffusionsstrom J) steigt entsprechend der oben angegebenen Formel (Diffusionsgesetz) mit zunehmendem Krogh'schem Diffusionskoeffizienten (D), zunehmender Austauschfläche (A), abnehmender Barrierendicke (d) sowie (rechts) zunehmender Konzentrations- bzw. Partialdruckdifferenz (c1-c2 bzw. p1-p2)

Eine ebenfalls häufig verwendete Formulierung (Prüfung!) lautet wie folgt:
| Jdiff = A . D . (∆c / ∆x) [mol/s] |
Hier steht ∆x für die Membrandicke und ∆c für die Konzentrationsdifferenz.

Der Diffusionskoeffizient (D) hängt -
abgesehen von der Temperatur (mit der er steigt) - ab vom Radius der
diffundierenden Teilchen (je kleiner desto besser) und den Eigenschaften
(Viskosität) des Lösungsmittels (Stokes-Einstein-Gleichung).
 Die Permeabilität (P) einer
Membran (durch die Diffusion stattfindet) kann definiert werden als
diffusionsstreckenabhängiger Diffusionskoeffizient, oder: P = D / d.
Die Permeabilität gibt an, wie rasch ein Stoff durch eine Membran
hindurch gelangen kann; ihre Dimension ist Weg / Zeit.
Die Permeabilität (P) einer
Membran (durch die Diffusion stattfindet) kann definiert werden als
diffusionsstreckenabhängiger Diffusionskoeffizient, oder: P = D / d.
Die Permeabilität gibt an, wie rasch ein Stoff durch eine Membran
hindurch gelangen kann; ihre Dimension ist Weg / Zeit.
Lipidlösliche Substanzen gelangen leicht durch Lipid-Doppellamellen, die Permeabilität ist ihnen gegenüber hoch; umgekehrt ist die Permeabilität gering für Ionen bzw. große Moleküle. Einige Beispiele zeigt die folgende Tabelle (die Zeitkonstante gibt an, wie rasch Diffusion durch die Membran den Konzentrationsunterschied ausgleicht):
 Die Permeabilität (P) einer
Membran (durch die Diffusion stattfindet) kann definiert werden als
diffusionsstreckenabhängiger Diffusionskoeffizient, oder: P = D / d.
Die Permeabilität gibt an, wie rasch ein Stoff durch eine Membran
hindurch gelangen kann; ihre Dimension ist Weg / Zeit.
Die Permeabilität (P) einer
Membran (durch die Diffusion stattfindet) kann definiert werden als
diffusionsstreckenabhängiger Diffusionskoeffizient, oder: P = D / d.
Die Permeabilität gibt an, wie rasch ein Stoff durch eine Membran
hindurch gelangen kann; ihre Dimension ist Weg / Zeit.Lipidlösliche Substanzen gelangen leicht durch Lipid-Doppellamellen, die Permeabilität ist ihnen gegenüber hoch; umgekehrt ist die Permeabilität gering für Ionen bzw. große Moleküle. Einige Beispiele zeigt die folgende Tabelle (die Zeitkonstante gibt an, wie rasch Diffusion durch die Membran den Konzentrationsunterschied ausgleicht):
Permeabilität einer reinen Lipid-Doppellamelle gegenüber gelösten Stoffen Nach Blaustein / Kao / Matteson, Cellular Physiology and Neurophysiology. 3rd ed. 2019 (Mosby's Physiology Monography) |
||
| Stoff |
P (cm/s) |
Zeitkonstante |
| Wasser |
10-4 - 10-3 |
0,5 - 5 s |
| Harnstoff |
10-6 |
~8 min |
| Glucose Aminosäuren |
10-7 |
~1,4 h |
| Chloridionen |
10-11 |
~1,6 a |
| Natrium-, Kaliumionen | 10-13 |
~160 a |
In die Membran
eingelagerte Transportsysteme beeinflussen
die Membranpermeabilität ganz wesentlich; verschiedene Einflüsse wie
Membranpotential oder Bindung von Signalstoffen können sie verändern (Öffnungswahrscheinlichkeit von "Permeasen").

Osmose
 Osmose (
Osmose ( s. auch dort)
ist die Strömung von Lösungsmittel (im Organismus: Wasser) durch eine
Membran, die für das Lösungsmittel, nicht aber für gelöste
(größere)
Moleküle durchgängig ist - und zwar in die Richtung, in der die
Konzentration des Lösungsmittels niedriger (d.h. die Konzentration der
gelösten Stoffe höher) ist.
s. auch dort)
ist die Strömung von Lösungsmittel (im Organismus: Wasser) durch eine
Membran, die für das Lösungsmittel, nicht aber für gelöste
(größere)
Moleküle durchgängig ist - und zwar in die Richtung, in der die
Konzentration des Lösungsmittels niedriger (d.h. die Konzentration der
gelösten Stoffe höher) ist.

 Osmose (
Osmose ( s. auch dort)
ist die Strömung von Lösungsmittel (im Organismus: Wasser) durch eine
Membran, die für das Lösungsmittel, nicht aber für gelöste
(größere)
Moleküle durchgängig ist - und zwar in die Richtung, in der die
Konzentration des Lösungsmittels niedriger (d.h. die Konzentration der
gelösten Stoffe höher) ist.
s. auch dort)
ist die Strömung von Lösungsmittel (im Organismus: Wasser) durch eine
Membran, die für das Lösungsmittel, nicht aber für gelöste
(größere)
Moleküle durchgängig ist - und zwar in die Richtung, in der die
Konzentration des Lösungsmittels niedriger (d.h. die Konzentration der
gelösten Stoffe höher) ist. 
 Abbildung: Tonizität und Osmose
Abbildung: Tonizität und OsmoseNach einer Vorlage bei Guyton & Hall, Textbook of Medical Physiology, 10th ed, Saunders Philadelphia 2000
Gelangt
eine Zelle in hypotone Flüssigkeit (z.B. Schweiss), schwillt sie an
(links unten), gerät sie in hypertone Umgebung (z.B. im Nierenmark), schrumpft sie (rechts unten).
Isoton ist eine Flüssigkeit, wenn sie die gleiche osmotische Konzentration hat wie Blutplasma (~285 mosm/l)
Isoton ist eine Flüssigkeit, wenn sie die gleiche osmotische Konzentration hat wie Blutplasma (~285 mosm/l)

Das hat zur Folge, dass z.B. Zellen in
hypotoner Umgebung anschwellen (Wasserkonzentration außen größer als
innen) und in hypertoner schrumpfen (Wasserkonzentration innen größer
als außen,  Abbildung).
Abbildung).
Physiologische Membranen sind im Allgemeinen für Wasser nur schwer permeabel, es sei denn, sie haben Aquaporine eingelagert.
 Abbildung).
Abbildung).Physiologische Membranen sind im Allgemeinen für Wasser nur schwer permeabel, es sei denn, sie haben Aquaporine eingelagert.
Lipidmembranen trennen Reaktionsräume (compartments) voneinander,
deren unterschiedlichen Stoffkonzentrationen erforderlich
sind, um den Metabolismus von Zellen und Geweben
aufrechtzuerhalten.
Andererseits lassen Zellmembranen einen kontrollierten, selektiven
Austausch zwischen diesen Räumen zu, was unabdingbar für
Lebensfunktionen ist.
 Viele Zellorganellen bilden mit ihrem Membranen Kompartimente, in denen biochemische Vorgänge von ihrer Umgebung abgeschirmt ablaufen können - dies unterstützt geordneten
Stoffwechsel und strukturierte Informationsübertragung.
Viele Zellorganellen bilden mit ihrem Membranen Kompartimente, in denen biochemische Vorgänge von ihrer Umgebung abgeschirmt ablaufen können - dies unterstützt geordneten
Stoffwechsel und strukturierte Informationsübertragung.  1974 erhielten Albert Claude, Christian de Duve und Georg E. Palade den Nobelpreis für Physiologie oder Medizin "für ihre
Entdeckungen zur strukturellen und funktionellen Organisation der
Zelle". Sie
stellten mittels elektronenmikroskopischer Untersuchungen Details
zellulärer Strukturen dar, was die Aufklärung ihrer Rolle im
Zellstoffwechsel wesentlich erweiterte.
1974 erhielten Albert Claude, Christian de Duve und Georg E. Palade den Nobelpreis für Physiologie oder Medizin "für ihre
Entdeckungen zur strukturellen und funktionellen Organisation der
Zelle". Sie
stellten mittels elektronenmikroskopischer Untersuchungen Details
zellulärer Strukturen dar, was die Aufklärung ihrer Rolle im
Zellstoffwechsel wesentlich erweiterte.  Abbildung: Membran-Recycling von Endo- bis Exozytose
Abbildung: Membran-Recycling von Endo- bis ExozytoseNach einer Vorlage bei Silverthorn, Human Physiology, an integrated approach, 4th Int'l ed. 2007, Pearson / Benjamin Cummings
Rezeptoren binden
Signalmoleküle (Liganden), was einerseits zu
spezifischen Reaktionen der Zelle, andererseits zu Endozytose (Reduktion der Zahl ansprechbarer Rezeptoren) führt.
Clathrinmoleküle lagern sich in Membranflächen ein, die zur Endozytose herangezogen werden, umgeben nach Einschnürung (Invagination) das entstandene Vesikel und stabilisieren es vorübergehend. Der Inhalt der Vesikel wird abgebaut oder wiederverwertet.
Verlagerung von Hormonrezeptoren nach intrazellulär (Endozytose) senkt die Hormonempfindlichkeit der Zelle (receptor downregulation), der umgekehrte Vorgang (Exozytose) erhöht sie (receptor upregulation).
Der Golgi-Komplex baut Membranmaterial um, bildet sekretorische Vesikel und Lysosomen. Lysosomen sind Vesikel mit hoher H+-Konzentration (niedrigem pH-Wert) ihres Inhalts.
Exozytose kann - durch Verschmelzen von Vesikeln mit der Zellmembran - Stoffe aus der Zelle befördern.
Clathrinmoleküle lagern sich in Membranflächen ein, die zur Endozytose herangezogen werden, umgeben nach Einschnürung (Invagination) das entstandene Vesikel und stabilisieren es vorübergehend. Der Inhalt der Vesikel wird abgebaut oder wiederverwertet.
Verlagerung von Hormonrezeptoren nach intrazellulär (Endozytose) senkt die Hormonempfindlichkeit der Zelle (receptor downregulation), der umgekehrte Vorgang (Exozytose) erhöht sie (receptor upregulation).
Der Golgi-Komplex baut Membranmaterial um, bildet sekretorische Vesikel und Lysosomen. Lysosomen sind Vesikel mit hoher H+-Konzentration (niedrigem pH-Wert) ihres Inhalts.
Exozytose kann - durch Verschmelzen von Vesikeln mit der Zellmembran - Stoffe aus der Zelle befördern.

Die Zellmembran
unterliegt ständigem Auf-, Um- und Abbau und kann zwischen äußerer und innerer Verortung wechseln ( Abbildung). Bei der Endozytose ermöglichen Clathrine, die Membran einzustülpen (Invagination) und die entstehenden Vesikel (coated vesicles) vorübergehend zu stabilisieren. Vesikulär gespeicherte Stoffe können via Exozytose aus der Zelle befördert werden (transmembranale Transporter sind dazu nicht notwendig).
Abbildung). Bei der Endozytose ermöglichen Clathrine, die Membran einzustülpen (Invagination) und die entstehenden Vesikel (coated vesicles) vorübergehend zu stabilisieren. Vesikulär gespeicherte Stoffe können via Exozytose aus der Zelle befördert werden (transmembranale Transporter sind dazu nicht notwendig).
 Über Proteine s. auch dort
Über Proteine s. auch dort
 Zur Exozytose s. u.a. dort
Zur Exozytose s. u.a. dort
 Endozytose
ist die Internalisierung von Teilen der Zellmembran und an diese
gebundener Stoffe. Es
entstehen Membraneinstülpungen, die sich mitsamt dem aufzunehmenden
Inhalt abschnüren und Resorptionsvakuolen bilden. Dabei kommen mit Clathrinen oder Caveolinen (
Endozytose
ist die Internalisierung von Teilen der Zellmembran und an diese
gebundener Stoffe. Es
entstehen Membraneinstülpungen, die sich mitsamt dem aufzunehmenden
Inhalt abschnüren und Resorptionsvakuolen bilden. Dabei kommen mit Clathrinen oder Caveolinen ( Abbildung) besetzte Membranflächen zum Einsatz, um die Absprossung nach innen zu erleichtern. Caveoline sind Membranproteine, die rezeptorunabhängige Endozytose unterstützen. Dabei bilden sich 50 nm
große, mit Caveolinmonomeren ausgekleidete Einstülpungen der
Zellmembran (Caveolae), welche u.a. in Endo- und Transzytose invoviert
sein können.
Abbildung) besetzte Membranflächen zum Einsatz, um die Absprossung nach innen zu erleichtern. Caveoline sind Membranproteine, die rezeptorunabhängige Endozytose unterstützen. Dabei bilden sich 50 nm
große, mit Caveolinmonomeren ausgekleidete Einstülpungen der
Zellmembran (Caveolae), welche u.a. in Endo- und Transzytose invoviert
sein können.
Die Zelle kann den aufgenommenen Vesikelinhalt verwerten, insbesondere nach der Fusion des endozytotischen Vesikels mit Lysosomen. Im Gegensatz zur Phagozytose stülpt sich die Membran nach innen ein und die durch Abschnürung resultierenden Vesikel sind kleiner als die bei Phagozytose entstehenden.
 Pinozytose
Pinozytose  (pinocytosis, fluid-phase endocytosis) ist die Aufnahme ultrakleiner Partikel (bis 0,2 µm Durchmesser), wie Fetttröpfchen oder flüssigkeitsgefüllte Tropfen. Die Zellmembran bildet pinozytotische Vesikel. Pinozytose ist unspezifisch und bedarf keiner speziellen Rezeptoren für das aufzunehmende Partikel. Sie kann von fast allen Zellen des Körpers vorgenommen werden (Makropinozytose s. dort).
(pinocytosis, fluid-phase endocytosis) ist die Aufnahme ultrakleiner Partikel (bis 0,2 µm Durchmesser), wie Fetttröpfchen oder flüssigkeitsgefüllte Tropfen. Die Zellmembran bildet pinozytotische Vesikel. Pinozytose ist unspezifisch und bedarf keiner speziellen Rezeptoren für das aufzunehmende Partikel. Sie kann von fast allen Zellen des Körpers vorgenommen werden (Makropinozytose s. dort).
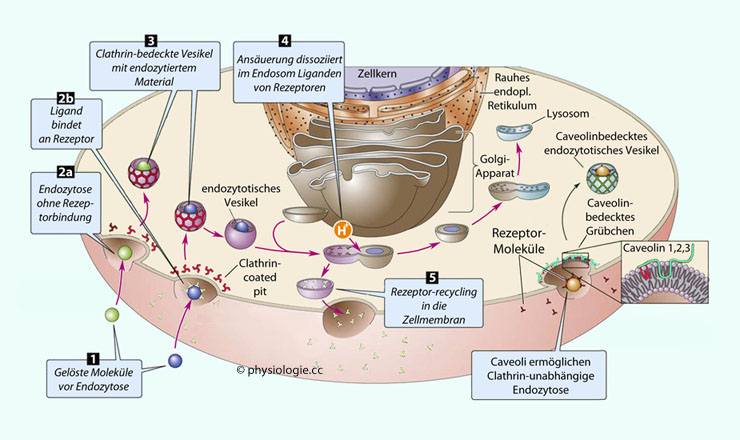
 Abbildung: Formen der Endozytose
Abbildung: Formen der Endozytose
Nach einer Vorlage in Boron W, Boulpaep E: Medical Physiology, 3rd ed., Elsevier 2016

Endozytose steht im Dienst mehrerer Funktionen:
 Aufnahme von Nährstoffen, für welche die Zellmembran keinen einfachen Permease-Mechanismus verfügbar hat - z.B. Eisen auf Transferrin
Aufnahme von Nährstoffen, für welche die Zellmembran keinen einfachen Permease-Mechanismus verfügbar hat - z.B. Eisen auf Transferrin
 Begrenzung hormoneller Anregung durch Verlagerung der Hormonrezeptoren nach intrazellulär (Herunterregulierung, receptor downregulation)
Begrenzung hormoneller Anregung durch Verlagerung der Hormonrezeptoren nach intrazellulär (Herunterregulierung, receptor downregulation)
 Recycling und Erneuerung von Membranmaterial via Golgi-Apparat
Recycling und Erneuerung von Membranmaterial via Golgi-Apparat
 Extrazelluläre Proteine, die für den Abbau bestimmt
sind (auch Pathogene), können durch Endozytose in die Zelle aufgenommen werden.
Extrazelluläre Proteine, die für den Abbau bestimmt
sind (auch Pathogene), können durch Endozytose in die Zelle aufgenommen werden.
Endozytose und Exoytose erlauben eine hohe Dynamik der Bestandteile der Zellmembran: Sie sind z.B. Transporteure für Proteine, die aus der Zelle in die Membran eingelagert oder aus der Membran wieder in die Zelle befördert werden sollen (protein trafficking). Das ist beispielsweise notwendig, wenn die Ausstattung einer Epithelzelle mit Transportmolekülen an wechselnde Bedingungen angepasst werden muss (z.B. im Nierentubulus bei sich änderndem Salzangebot).
 Phagozytose
Phagozytose (phagocytosis, receptor-mediated endocytosis) (
(phagocytosis, receptor-mediated endocytosis) ( Abbildung) ermöglicht die Endozytose wesentlich größerer (>0,5µm) Teilchen (Bakterien,
Zellen, Gewebestücke, mehrere µm) - mittels spezieller Rezeptoren. Das können nur spezialisierte Zellen ("professionelle" Phagozyten: Dendritische Zellen, Leukozyten, Gewebsmakrophagen).
Abbildung) ermöglicht die Endozytose wesentlich größerer (>0,5µm) Teilchen (Bakterien,
Zellen, Gewebestücke, mehrere µm) - mittels spezieller Rezeptoren. Das können nur spezialisierte Zellen ("professionelle" Phagozyten: Dendritische Zellen, Leukozyten, Gewebsmakrophagen).
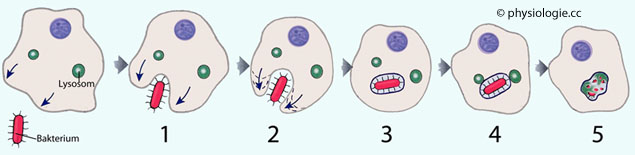
 Abbildung: Phagozytose
Abbildung: Phagozytose
Nach einer Vorlage bei Silverthorn, Human Physiology - an integrated approach, 4th ed. Pearson International 2007
1: Ein Phagozyt (z.B. Leukozyt) bindet eine Mikrobe rezeptorvermittelt an seine Zellmembran.
2: Mittels seines Zytoskeletts wirft der Phagozyt einen seitlichen Wall um das Bakterium auf (Pfeile), der zur Bildung eines Phagosoms führt.
3: Das Phagosom trennt sich von der Zellmembran ab und rückt in das Zytoplasma.
4: Hier verschmilzt es mit Lysosomen, die Enzyme für den Abbau des phagozytierten Partikels enthalten.
5: Das Bakterium wird abgetötet und verdaut

Das Zytoskelett wirft um die Resorptionsstelle herum einen Wall auf, der sich um das aufgenommene Partikel herum zu einer großen Resorptionsvakule schließt. Durch ringförmige Einstülpung um das Partikel, das aufgenommen wird, und Ablösung der Zellmembran bilden sich Phagosomen, die reifen und mit Lysosomen fusionieren - es entstehen Phagolysosomen. Dadurch erniedrigt sich nicht nur der vakuoläre pH-Wert, auch lysosomale Enzyme beteiligen sich am Abbau des Vesikelinhalts.

Der Transport der Vesikel durch die Zelle erfordert ein funktionierendes System an Mikrotubuli. Die Steuerung der einzelnen Schritte der Transzytose erfolgt je nach Zelle und Transportgut unterschiedlich, es existieren gewebespezifische Mechanismen.
Transzytotisch durch Zellen gebracht werden z.B.

 Transferrin (Eisentransport),
Transferrin (Eisentransport),

 Lipoproteine,
Lipoproteine,

 Hormone
(Insulin),
Hormone
(Insulin),

 Immunglobuline (IgA), aber auch
Immunglobuline (IgA), aber auch

 Gifte (z.B. Botulinustoxin)
Gifte (z.B. Botulinustoxin)
Transzytose erfolgt vor allem in Epithelzellen (Nierentubuli, Schleimhäute etc.), Endothelien, weiters im Knochen (Osteoklasten), in M-Zellen des Darms oder in Nervenzellen.
 erleichtern die Diffusion (facilitated diffusion),
erleichtern die Diffusion (facilitated diffusion),
 lassen Kombinationen von Stoffen durch die Membran treten (Symport, z.B. Natrium und Glucose),
lassen Kombinationen von Stoffen durch die Membran treten (Symport, z.B. Natrium und Glucose),
 tauschen Stoffe zwischen innen und außen aus (Antiport, z.B. Natrium- gegen Wasserstoffionen),
tauschen Stoffe zwischen innen und außen aus (Antiport, z.B. Natrium- gegen Wasserstoffionen),
 oder befördern Stoffe gegen einen Konzentrationsgradienten, wie die Natrium-Kalium-ATPase ("Na+-K+-Pumpe"
- sie bringt Kaliumionen in die Zelle und Natriumionen aus ihr heraus).
Die resultierenden Konzentrationsunterschiede können
wiederum zu Diffusion der ungleich verteilten Ionen durch die Membranen
führen (Diffusion
läuft immer in Richtung Konzentrationsausgleich).
oder befördern Stoffe gegen einen Konzentrationsgradienten, wie die Natrium-Kalium-ATPase ("Na+-K+-Pumpe"
- sie bringt Kaliumionen in die Zelle und Natriumionen aus ihr heraus).
Die resultierenden Konzentrationsunterschiede können
wiederum zu Diffusion der ungleich verteilten Ionen durch die Membranen
führen (Diffusion
läuft immer in Richtung Konzentrationsausgleich).
 (1) Konzentrationsunterschied
- die Substanz wandert entsprechend einem Konzentrationsgefälle im Sinne der Diffusion
(1) Konzentrationsunterschied
- die Substanz wandert entsprechend einem Konzentrationsgefälle im Sinne der Diffusion
 (2) Elektrisches Potential - Zellmembranen sich meist elektrisch aufgeladen, z.B. um 70 mV (innen negativ, außen positiv, "Ruhepotential").
Das beeinflusst die Bewegungswahrscheinlichkeit elektrisch geladener
Teilchen (Ionen), wie z.B. Na+, K+, Ca++, Mg++, H+, Cl-, HCO3-, Phosphat, organische Ionen.
(2) Elektrisches Potential - Zellmembranen sich meist elektrisch aufgeladen, z.B. um 70 mV (innen negativ, außen positiv, "Ruhepotential").
Das beeinflusst die Bewegungswahrscheinlichkeit elektrisch geladener
Teilchen (Ionen), wie z.B. Na+, K+, Ca++, Mg++, H+, Cl-, HCO3-, Phosphat, organische Ionen.
Die Summe der Effekte (1) und (2) ergibt - jeweils für ein bestimmtes Ion bei einer bestimmten Membranladung - ein elektrochemisches Potential für diese Substanz.
 (3) Durchlässigkeit (Permeabilität)
der betreffenden Membran (Struktur) für den jeweiligen Stoff.
(3) Durchlässigkeit (Permeabilität)
der betreffenden Membran (Struktur) für den jeweiligen Stoff.
Apolare (fettlösliche, lipophile) Stoffe - wie Steroidhormone, Gase (CO2, O2, NO etc), Endocannabinoide - dringen leicht durch Lipidmembranen, soferne sie sich zwischen deren Molekülen relativ frei bewegen können. Transzelluläre Passage ohne Transportsysteme (ihrem Konzentrationsgefälle folgend) steht auch kleinen hydrophilen Nichtelektrolyten wie Harnstoff (0,2 nm Molekülradius) offen - der virtuelle Porenradius beträgt z.B. im Dünndarmepithel 0,3-0,4 nm.
Polare Moleküle - wie Ionen (Elektrolyte), Glucose, Aminosäuren - benötigen für den Membran-Durchtritt aus Proteinen aufgebaute "Kanäle" (Permeasen, Transporter). Die Gene für diese Proteine nehmen einen erheblichen Anteil der Erbinformation in Anspruch.
Wandern Stoffe durch eine Zelle (z.B. vom Darmlumen durch eine Epithelzelle in das Interstitium des Darms), spricht man von einer transzellulären Bewegung. Moleküle können epitheliale Strukturen (z.B. Darmschleimhaut, Nierentubulus) auch parazellulär (zwischen den Zellen) durchdringen, abhängig von der Durchlässigkeit der interzellulären Befestigungsstrukturen (Schlussleisten, Desmosomen).
 Abbildung: Überwindung von Epithelzellbarrieren
Abbildung: Überwindung von Epithelzellbarrieren
Nach einer Vorlage in Boron W, Boulpaep E: Medical Physiology (1st ed.). Philadelphia, Saunders, 2003

 Abbildung). Bei der Endozytose ermöglichen Clathrine, die Membran einzustülpen (Invagination) und die entstehenden Vesikel (coated vesicles) vorübergehend zu stabilisieren. Vesikulär gespeicherte Stoffe können via Exozytose aus der Zelle befördert werden (transmembranale Transporter sind dazu nicht notwendig).
Abbildung). Bei der Endozytose ermöglichen Clathrine, die Membran einzustülpen (Invagination) und die entstehenden Vesikel (coated vesicles) vorübergehend zu stabilisieren. Vesikulär gespeicherte Stoffe können via Exozytose aus der Zelle befördert werden (transmembranale Transporter sind dazu nicht notwendig). Über Proteine s. auch dort
Über Proteine s. auch dort Zur Exozytose s. u.a. dort
Zur Exozytose s. u.a. dort Endozytose
ist die Internalisierung von Teilen der Zellmembran und an diese
gebundener Stoffe. Es
entstehen Membraneinstülpungen, die sich mitsamt dem aufzunehmenden
Inhalt abschnüren und Resorptionsvakuolen bilden. Dabei kommen mit Clathrinen oder Caveolinen (
Endozytose
ist die Internalisierung von Teilen der Zellmembran und an diese
gebundener Stoffe. Es
entstehen Membraneinstülpungen, die sich mitsamt dem aufzunehmenden
Inhalt abschnüren und Resorptionsvakuolen bilden. Dabei kommen mit Clathrinen oder Caveolinen ( Abbildung) besetzte Membranflächen zum Einsatz, um die Absprossung nach innen zu erleichtern. Caveoline sind Membranproteine, die rezeptorunabhängige Endozytose unterstützen. Dabei bilden sich 50 nm
große, mit Caveolinmonomeren ausgekleidete Einstülpungen der
Zellmembran (Caveolae), welche u.a. in Endo- und Transzytose invoviert
sein können.
Abbildung) besetzte Membranflächen zum Einsatz, um die Absprossung nach innen zu erleichtern. Caveoline sind Membranproteine, die rezeptorunabhängige Endozytose unterstützen. Dabei bilden sich 50 nm
große, mit Caveolinmonomeren ausgekleidete Einstülpungen der
Zellmembran (Caveolae), welche u.a. in Endo- und Transzytose invoviert
sein können. Die Zelle kann den aufgenommenen Vesikelinhalt verwerten, insbesondere nach der Fusion des endozytotischen Vesikels mit Lysosomen. Im Gegensatz zur Phagozytose stülpt sich die Membran nach innen ein und die durch Abschnürung resultierenden Vesikel sind kleiner als die bei Phagozytose entstehenden.
 Pinozytose
Pinozytose  (pinocytosis, fluid-phase endocytosis) ist die Aufnahme ultrakleiner Partikel (bis 0,2 µm Durchmesser), wie Fetttröpfchen oder flüssigkeitsgefüllte Tropfen. Die Zellmembran bildet pinozytotische Vesikel. Pinozytose ist unspezifisch und bedarf keiner speziellen Rezeptoren für das aufzunehmende Partikel. Sie kann von fast allen Zellen des Körpers vorgenommen werden (Makropinozytose s. dort).
(pinocytosis, fluid-phase endocytosis) ist die Aufnahme ultrakleiner Partikel (bis 0,2 µm Durchmesser), wie Fetttröpfchen oder flüssigkeitsgefüllte Tropfen. Die Zellmembran bildet pinozytotische Vesikel. Pinozytose ist unspezifisch und bedarf keiner speziellen Rezeptoren für das aufzunehmende Partikel. Sie kann von fast allen Zellen des Körpers vorgenommen werden (Makropinozytose s. dort). 
 Abbildung: Formen der Endozytose
Abbildung: Formen der EndozytoseNach einer Vorlage in Boron W, Boulpaep E: Medical Physiology, 3rd ed., Elsevier 2016
Endozytose ist die Aufnahme fester Partikel (auch Zellfragmente, Bakterien),
Pinozytose die Aufnahme gelöster Teilchen. Clathrin und Caveolin sind Hilfsmoleküle der Endozytose.
Aufgenommene Stoffe oder Partikel können in Lysosomen gelangen und dort abgebaut werden. Vorher führt die Ansäuerung (pH<6) zur Ablösung endozytierter Proteine (z.B. LDL) von ihrem Rezeptor (4), und die freien Rezeptoren werden wieder in die Zellmembran eingebracht (5), d.h. sie werden wiederverwertet.
Aufgenommene Stoffe oder Partikel können in Lysosomen gelangen und dort abgebaut werden. Vorher führt die Ansäuerung (pH<6) zur Ablösung endozytierter Proteine (z.B. LDL) von ihrem Rezeptor (4), und die freien Rezeptoren werden wieder in die Zellmembran eingebracht (5), d.h. sie werden wiederverwertet.

 Aufnahme von Nährstoffen, für welche die Zellmembran keinen einfachen Permease-Mechanismus verfügbar hat - z.B. Eisen auf Transferrin
Aufnahme von Nährstoffen, für welche die Zellmembran keinen einfachen Permease-Mechanismus verfügbar hat - z.B. Eisen auf Transferrin Begrenzung hormoneller Anregung durch Verlagerung der Hormonrezeptoren nach intrazellulär (Herunterregulierung, receptor downregulation)
Begrenzung hormoneller Anregung durch Verlagerung der Hormonrezeptoren nach intrazellulär (Herunterregulierung, receptor downregulation) Recycling und Erneuerung von Membranmaterial via Golgi-Apparat
Recycling und Erneuerung von Membranmaterial via Golgi-Apparat Extrazelluläre Proteine, die für den Abbau bestimmt
sind (auch Pathogene), können durch Endozytose in die Zelle aufgenommen werden.
Extrazelluläre Proteine, die für den Abbau bestimmt
sind (auch Pathogene), können durch Endozytose in die Zelle aufgenommen werden.Endozytose und Exoytose erlauben eine hohe Dynamik der Bestandteile der Zellmembran: Sie sind z.B. Transporteure für Proteine, die aus der Zelle in die Membran eingelagert oder aus der Membran wieder in die Zelle befördert werden sollen (protein trafficking). Das ist beispielsweise notwendig, wenn die Ausstattung einer Epithelzelle mit Transportmolekülen an wechselnde Bedingungen angepasst werden muss (z.B. im Nierentubulus bei sich änderndem Salzangebot).
 Phagozytose
Phagozytose (phagocytosis, receptor-mediated endocytosis) (
(phagocytosis, receptor-mediated endocytosis) ( Abbildung) ermöglicht die Endozytose wesentlich größerer (>0,5µm) Teilchen (Bakterien,
Zellen, Gewebestücke, mehrere µm) - mittels spezieller Rezeptoren. Das können nur spezialisierte Zellen ("professionelle" Phagozyten: Dendritische Zellen, Leukozyten, Gewebsmakrophagen).
Abbildung) ermöglicht die Endozytose wesentlich größerer (>0,5µm) Teilchen (Bakterien,
Zellen, Gewebestücke, mehrere µm) - mittels spezieller Rezeptoren. Das können nur spezialisierte Zellen ("professionelle" Phagozyten: Dendritische Zellen, Leukozyten, Gewebsmakrophagen).

 Abbildung: Phagozytose
Abbildung: PhagozytoseNach einer Vorlage bei Silverthorn, Human Physiology - an integrated approach, 4th ed. Pearson International 2007
1: Ein Phagozyt (z.B. Leukozyt) bindet eine Mikrobe rezeptorvermittelt an seine Zellmembran.
2: Mittels seines Zytoskeletts wirft der Phagozyt einen seitlichen Wall um das Bakterium auf (Pfeile), der zur Bildung eines Phagosoms führt.
3: Das Phagosom trennt sich von der Zellmembran ab und rückt in das Zytoplasma.
4: Hier verschmilzt es mit Lysosomen, die Enzyme für den Abbau des phagozytierten Partikels enthalten.
5: Das Bakterium wird abgetötet und verdaut

Das Zytoskelett wirft um die Resorptionsstelle herum einen Wall auf, der sich um das aufgenommene Partikel herum zu einer großen Resorptionsvakule schließt. Durch ringförmige Einstülpung um das Partikel, das aufgenommen wird, und Ablösung der Zellmembran bilden sich Phagosomen, die reifen und mit Lysosomen fusionieren - es entstehen Phagolysosomen. Dadurch erniedrigt sich nicht nur der vakuoläre pH-Wert, auch lysosomale Enzyme beteiligen sich am Abbau des Vesikelinhalts.
Transzytose
 Transzytose (Cytopempsis) ist der Transport von Stoffen - insbesondere Makromolekülen (z.B. Proteinen) - durch Zellen, ohne dass diese dabei abgebaut werden. Die Makromoleküle gelangen durch Endozytose
in die Zelle (z.B. apikal), werden vesikulär durch die Zelle
transportiert und (auf der gegenüberliegenden Seite der Zelle) mittels Exozytose wieder abgegeben (z.B. basolateral). So können Stoffe von einem Kompartiment
gezielt in ein benachbartes befördert werden, z.B. über eine Schicht von
Epithelzellen (Darm, Niere etc - diese sind durch ein Schlussleistensystem voneinander separiert) (
Transzytose (Cytopempsis) ist der Transport von Stoffen - insbesondere Makromolekülen (z.B. Proteinen) - durch Zellen, ohne dass diese dabei abgebaut werden. Die Makromoleküle gelangen durch Endozytose
in die Zelle (z.B. apikal), werden vesikulär durch die Zelle
transportiert und (auf der gegenüberliegenden Seite der Zelle) mittels Exozytose wieder abgegeben (z.B. basolateral). So können Stoffe von einem Kompartiment
gezielt in ein benachbartes befördert werden, z.B. über eine Schicht von
Epithelzellen (Darm, Niere etc - diese sind durch ein Schlussleistensystem voneinander separiert) ( Abbildung):
Abbildung):
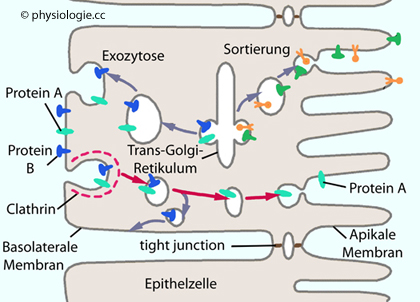
 Abbildung: Sortierungswege in einer Epithelzelle
Abbildung: Sortierungswege in einer Epithelzelle
Nach einer Vorlage bei Lodish / Berk / Kaiser / Krieger / Bretscher / Ploegh / Amon / Martin, Molecular Cell Biology (8th ed 2016)
 Transzytose (Cytopempsis) ist der Transport von Stoffen - insbesondere Makromolekülen (z.B. Proteinen) - durch Zellen, ohne dass diese dabei abgebaut werden. Die Makromoleküle gelangen durch Endozytose
in die Zelle (z.B. apikal), werden vesikulär durch die Zelle
transportiert und (auf der gegenüberliegenden Seite der Zelle) mittels Exozytose wieder abgegeben (z.B. basolateral). So können Stoffe von einem Kompartiment
gezielt in ein benachbartes befördert werden, z.B. über eine Schicht von
Epithelzellen (Darm, Niere etc - diese sind durch ein Schlussleistensystem voneinander separiert) (
Transzytose (Cytopempsis) ist der Transport von Stoffen - insbesondere Makromolekülen (z.B. Proteinen) - durch Zellen, ohne dass diese dabei abgebaut werden. Die Makromoleküle gelangen durch Endozytose
in die Zelle (z.B. apikal), werden vesikulär durch die Zelle
transportiert und (auf der gegenüberliegenden Seite der Zelle) mittels Exozytose wieder abgegeben (z.B. basolateral). So können Stoffe von einem Kompartiment
gezielt in ein benachbartes befördert werden, z.B. über eine Schicht von
Epithelzellen (Darm, Niere etc - diese sind durch ein Schlussleistensystem voneinander separiert) ( Abbildung):
Abbildung):
 Abbildung: Sortierungswege in einer Epithelzelle
Abbildung: Sortierungswege in einer EpithelzelleNach einer Vorlage bei Lodish / Berk / Kaiser / Krieger / Bretscher / Ploegh / Amon / Martin, Molecular Cell Biology (8th ed 2016)
Das Bild zeigt die Bewegung von Molekülen durch das Membransystem einer Epithelzelle. Neu gebildete Proteine werden vom Trans-Golgi-Retikulum zu der entsprechenden Membran (apikal oder basolateral)
gebracht und dort eingelagert. Sie können zwischen diesen (voneinander
separierten) Membranen durch Transzytose ausgetauscht werden - in diesem Beispiel das in die basolaterale Membran "verirrte" Protein A von basolateral nach apikal. (Protein B ist ein für die basolaterale Membran bestimmtes Protein und wird hier nach seiner Aufnahme in ein clathrin -coated pit in "seine" Membran recycelt.)
Transzytose (rote Pfeile) ermöglicht auch den Transport aus dem Extrazellulärraum angelagerter Moleküle (z.B. Transporter, Hormone, Immunglobuline) durch die Zelle hindurch zum gegenüberliegenden Zellpol
Transzytose (rote Pfeile) ermöglicht auch den Transport aus dem Extrazellulärraum angelagerter Moleküle (z.B. Transporter, Hormone, Immunglobuline) durch die Zelle hindurch zum gegenüberliegenden Zellpol

Der Transport der Vesikel durch die Zelle erfordert ein funktionierendes System an Mikrotubuli. Die Steuerung der einzelnen Schritte der Transzytose erfolgt je nach Zelle und Transportgut unterschiedlich, es existieren gewebespezifische Mechanismen.
Transzytotisch durch Zellen gebracht werden z.B.

 Transferrin (Eisentransport),
Transferrin (Eisentransport), 
 Lipoproteine,
Lipoproteine, 
 Hormone
(Insulin),
Hormone
(Insulin),
 Immunglobuline (IgA), aber auch
Immunglobuline (IgA), aber auch 
 Gifte (z.B. Botulinustoxin)
Gifte (z.B. Botulinustoxin) Transzytose erfolgt vor allem in Epithelzellen (Nierentubuli, Schleimhäute etc.), Endothelien, weiters im Knochen (Osteoklasten), in M-Zellen des Darms oder in Nervenzellen.
Membranpassage
 Einige kleine neutrale (ungeladene) Moleküle wie Sauerstoff,
Kohlendioxid, Wasser (und Äthanol) können
die Zellmembran leicht passieren. (Wasser dringt relativ leicht durch
reine Lipidlamellen, Cholesterin verlangsamt die Passage von H2O; Aquaporine können sie wesentlich beschleunigen.) Fettlösliche
Substanzen, wie Steroide, können sich in die (aus Lipiden bestehende)
Zellmembran einfügen und sie direkt überqueren, alle anderen biologisch relevanten
Moleküle / Ionen benötigen für die transmembranale Diffusion spezielle Membranproteine. Aus ihnen aufgebaute aufwendige Strukturen (Proteinkomplexe)
Einige kleine neutrale (ungeladene) Moleküle wie Sauerstoff,
Kohlendioxid, Wasser (und Äthanol) können
die Zellmembran leicht passieren. (Wasser dringt relativ leicht durch
reine Lipidlamellen, Cholesterin verlangsamt die Passage von H2O; Aquaporine können sie wesentlich beschleunigen.) Fettlösliche
Substanzen, wie Steroide, können sich in die (aus Lipiden bestehende)
Zellmembran einfügen und sie direkt überqueren, alle anderen biologisch relevanten
Moleküle / Ionen benötigen für die transmembranale Diffusion spezielle Membranproteine. Aus ihnen aufgebaute aufwendige Strukturen (Proteinkomplexe)
 Einige kleine neutrale (ungeladene) Moleküle wie Sauerstoff,
Kohlendioxid, Wasser (und Äthanol) können
die Zellmembran leicht passieren. (Wasser dringt relativ leicht durch
reine Lipidlamellen, Cholesterin verlangsamt die Passage von H2O; Aquaporine können sie wesentlich beschleunigen.) Fettlösliche
Substanzen, wie Steroide, können sich in die (aus Lipiden bestehende)
Zellmembran einfügen und sie direkt überqueren, alle anderen biologisch relevanten
Moleküle / Ionen benötigen für die transmembranale Diffusion spezielle Membranproteine. Aus ihnen aufgebaute aufwendige Strukturen (Proteinkomplexe)
Einige kleine neutrale (ungeladene) Moleküle wie Sauerstoff,
Kohlendioxid, Wasser (und Äthanol) können
die Zellmembran leicht passieren. (Wasser dringt relativ leicht durch
reine Lipidlamellen, Cholesterin verlangsamt die Passage von H2O; Aquaporine können sie wesentlich beschleunigen.) Fettlösliche
Substanzen, wie Steroide, können sich in die (aus Lipiden bestehende)
Zellmembran einfügen und sie direkt überqueren, alle anderen biologisch relevanten
Moleküle / Ionen benötigen für die transmembranale Diffusion spezielle Membranproteine. Aus ihnen aufgebaute aufwendige Strukturen (Proteinkomplexe) erleichtern die Diffusion (facilitated diffusion),
erleichtern die Diffusion (facilitated diffusion),
 lassen Kombinationen von Stoffen durch die Membran treten (Symport, z.B. Natrium und Glucose),
lassen Kombinationen von Stoffen durch die Membran treten (Symport, z.B. Natrium und Glucose),  tauschen Stoffe zwischen innen und außen aus (Antiport, z.B. Natrium- gegen Wasserstoffionen),
tauschen Stoffe zwischen innen und außen aus (Antiport, z.B. Natrium- gegen Wasserstoffionen),  oder befördern Stoffe gegen einen Konzentrationsgradienten, wie die Natrium-Kalium-ATPase ("Na+-K+-Pumpe"
- sie bringt Kaliumionen in die Zelle und Natriumionen aus ihr heraus).
Die resultierenden Konzentrationsunterschiede können
wiederum zu Diffusion der ungleich verteilten Ionen durch die Membranen
führen (Diffusion
läuft immer in Richtung Konzentrationsausgleich).
oder befördern Stoffe gegen einen Konzentrationsgradienten, wie die Natrium-Kalium-ATPase ("Na+-K+-Pumpe"
- sie bringt Kaliumionen in die Zelle und Natriumionen aus ihr heraus).
Die resultierenden Konzentrationsunterschiede können
wiederum zu Diffusion der ungleich verteilten Ionen durch die Membranen
führen (Diffusion
läuft immer in Richtung Konzentrationsausgleich).
Atemgase und
fettlösliche Substanzen können direkt durch die
Zellmembran diffundieren; Stoffe wie Wasser, Ammoniak oder Harnstoff in
gewissem Maße (auch abhängig vom Muster an Lipiden, welche die
jeweilige Membran aufbauen); andere bedürfen dazu eigener Permeasen /
Transporter (s. Übersicht):
 Poren und Kanäle
erlauben den "passiven" (konzentrationsabhängigen) Durchtritt von
bestimmten Ionen / Elektrolyten (Ionenkanäle), Wasser-
(Aquaporine) und auch gelegentlich größeren Molekülen
Poren und Kanäle
erlauben den "passiven" (konzentrationsabhängigen) Durchtritt von
bestimmten Ionen / Elektrolyten (Ionenkanäle), Wasser-
(Aquaporine) und auch gelegentlich größeren Molekülen
 Carrier (Transporter) erleichtern den Durchtritt spezifischer Stoffe (facilitated diffusion) oder koppeln den Durchtritt mit der Passage eines anderen Stoffes (sekundär aktiver Transport: z.B. Na/Glucose-Cotransport)
Carrier (Transporter) erleichtern den Durchtritt spezifischer Stoffe (facilitated diffusion) oder koppeln den Durchtritt mit der Passage eines anderen Stoffes (sekundär aktiver Transport: z.B. Na/Glucose-Cotransport)
 Pumpen
sind Enzyme, die bestimmte Stoffe gegen deren Konzentrationsgefälle
unter Verbrauch von Stoffwechselenergie (ATP) durch die Membran
befördern (ATPasen), z.B. Na/K-Pumpe
Pumpen
sind Enzyme, die bestimmte Stoffe gegen deren Konzentrationsgefälle
unter Verbrauch von Stoffwechselenergie (ATP) durch die Membran
befördern (ATPasen), z.B. Na/K-Pumpe
Der Stoffaustausch durch Barrieren (Membranen) hängt im Wesentlichen von folgenden Faktoren ab:
 Poren und Kanäle
erlauben den "passiven" (konzentrationsabhängigen) Durchtritt von
bestimmten Ionen / Elektrolyten (Ionenkanäle), Wasser-
(Aquaporine) und auch gelegentlich größeren Molekülen
Poren und Kanäle
erlauben den "passiven" (konzentrationsabhängigen) Durchtritt von
bestimmten Ionen / Elektrolyten (Ionenkanäle), Wasser-
(Aquaporine) und auch gelegentlich größeren Molekülen  Carrier (Transporter) erleichtern den Durchtritt spezifischer Stoffe (facilitated diffusion) oder koppeln den Durchtritt mit der Passage eines anderen Stoffes (sekundär aktiver Transport: z.B. Na/Glucose-Cotransport)
Carrier (Transporter) erleichtern den Durchtritt spezifischer Stoffe (facilitated diffusion) oder koppeln den Durchtritt mit der Passage eines anderen Stoffes (sekundär aktiver Transport: z.B. Na/Glucose-Cotransport) Pumpen
sind Enzyme, die bestimmte Stoffe gegen deren Konzentrationsgefälle
unter Verbrauch von Stoffwechselenergie (ATP) durch die Membran
befördern (ATPasen), z.B. Na/K-Pumpe
Pumpen
sind Enzyme, die bestimmte Stoffe gegen deren Konzentrationsgefälle
unter Verbrauch von Stoffwechselenergie (ATP) durch die Membran
befördern (ATPasen), z.B. Na/K-PumpeDer Stoffaustausch durch Barrieren (Membranen) hängt im Wesentlichen von folgenden Faktoren ab:
 (1) Konzentrationsunterschied
- die Substanz wandert entsprechend einem Konzentrationsgefälle im Sinne der Diffusion
(1) Konzentrationsunterschied
- die Substanz wandert entsprechend einem Konzentrationsgefälle im Sinne der Diffusion (2) Elektrisches Potential - Zellmembranen sich meist elektrisch aufgeladen, z.B. um 70 mV (innen negativ, außen positiv, "Ruhepotential").
Das beeinflusst die Bewegungswahrscheinlichkeit elektrisch geladener
Teilchen (Ionen), wie z.B. Na+, K+, Ca++, Mg++, H+, Cl-, HCO3-, Phosphat, organische Ionen.
(2) Elektrisches Potential - Zellmembranen sich meist elektrisch aufgeladen, z.B. um 70 mV (innen negativ, außen positiv, "Ruhepotential").
Das beeinflusst die Bewegungswahrscheinlichkeit elektrisch geladener
Teilchen (Ionen), wie z.B. Na+, K+, Ca++, Mg++, H+, Cl-, HCO3-, Phosphat, organische Ionen. Die Summe der Effekte (1) und (2) ergibt - jeweils für ein bestimmtes Ion bei einer bestimmten Membranladung - ein elektrochemisches Potential für diese Substanz.
 (3) Durchlässigkeit (Permeabilität)
der betreffenden Membran (Struktur) für den jeweiligen Stoff.
(3) Durchlässigkeit (Permeabilität)
der betreffenden Membran (Struktur) für den jeweiligen Stoff.Apolare (fettlösliche, lipophile) Stoffe - wie Steroidhormone, Gase (CO2, O2, NO etc), Endocannabinoide - dringen leicht durch Lipidmembranen, soferne sie sich zwischen deren Molekülen relativ frei bewegen können. Transzelluläre Passage ohne Transportsysteme (ihrem Konzentrationsgefälle folgend) steht auch kleinen hydrophilen Nichtelektrolyten wie Harnstoff (0,2 nm Molekülradius) offen - der virtuelle Porenradius beträgt z.B. im Dünndarmepithel 0,3-0,4 nm.
Polare Moleküle - wie Ionen (Elektrolyte), Glucose, Aminosäuren - benötigen für den Membran-Durchtritt aus Proteinen aufgebaute "Kanäle" (Permeasen, Transporter). Die Gene für diese Proteine nehmen einen erheblichen Anteil der Erbinformation in Anspruch.
Wandern Stoffe durch eine Zelle (z.B. vom Darmlumen durch eine Epithelzelle in das Interstitium des Darms), spricht man von einer transzellulären Bewegung. Moleküle können epitheliale Strukturen (z.B. Darmschleimhaut, Nierentubulus) auch parazellulär (zwischen den Zellen) durchdringen, abhängig von der Durchlässigkeit der interzellulären Befestigungsstrukturen (Schlussleisten, Desmosomen).
 Abbildung: Überwindung von Epithelzellbarrieren
Abbildung: Überwindung von EpithelzellbarrierenNach einer Vorlage in Boron W, Boulpaep E: Medical Physiology (1st ed.). Philadelphia, Saunders, 2003
Apikale (an das Lumen des Darms, Tubulus, Azinus, Ausführungsganges.. angrenzende) Zellmembran (dunkelbraun) links, basolaterale (an das Interstitium angrenzende / Blutseite) rechts (hellbraun).
Moleküle können Zellbarrieren auf unterschiedlichen Wegen passieren. Hier ist eine Epithelzellbarriere im Querschnitt gezeigt: Die Zellen sind seitlich über tight junctions miteinander verknüpft. Moleküle können solche Barrieren (z.B. im Darm oder in der Niere) auf zwei Wegen durchdringen:
Transzellulär (durch die Zelle): Die Zellmembran beinhaltet Kanäle (z.B. für Wasser, Kalium) bzw. Transportproteine (Na/Glucose-Cotransport, Na/H-Antiport, Na/K-Pumpe). So können Ionen / Moleküle in die Zelle hinein oder aus ihr hinausgelangen.
Der Besatz mit Permeasen / Transportern ist je nach Membranabschnitt verschieden: In der apikalen (links: luminalen - z.B. zur inneren Darm- oder Nierentubulusoberfläche gerichteten) anders als in der basolateralen Membran (rechts: zur Blutseite gerichtet).
Parazellulär (zwischen Zellen), hier die Wanderung von Natriumionen (elektrisch angetrieben) in das, und von Wasser (osmotisch angetrieben) und Na+ (durch solvent drag) aus dem Lumen
Moleküle können Zellbarrieren auf unterschiedlichen Wegen passieren. Hier ist eine Epithelzellbarriere im Querschnitt gezeigt: Die Zellen sind seitlich über tight junctions miteinander verknüpft. Moleküle können solche Barrieren (z.B. im Darm oder in der Niere) auf zwei Wegen durchdringen:
Transzellulär (durch die Zelle): Die Zellmembran beinhaltet Kanäle (z.B. für Wasser, Kalium) bzw. Transportproteine (Na/Glucose-Cotransport, Na/H-Antiport, Na/K-Pumpe). So können Ionen / Moleküle in die Zelle hinein oder aus ihr hinausgelangen.
Der Besatz mit Permeasen / Transportern ist je nach Membranabschnitt verschieden: In der apikalen (links: luminalen - z.B. zur inneren Darm- oder Nierentubulusoberfläche gerichteten) anders als in der basolateralen Membran (rechts: zur Blutseite gerichtet).
Parazellulär (zwischen Zellen), hier die Wanderung von Natriumionen (elektrisch angetrieben) in das, und von Wasser (osmotisch angetrieben) und Na+ (durch solvent drag) aus dem Lumen

Die  Abbildung zeigt Beispiele für
transmembranalen / transzellulären sowie für parazellulären Transport. Für den transmembranalen Weg stehen mehr als 99% (für den parazellulären Weg <1%) der Gesamtfläche zur Verfügung. Epithelzellen (z.B. im Darm oder in der Niere) haben eine zum Lumen (apikale) und eine zum Interstitium gerichtete (basolaterale) Seite, die unterschiedlich mit Permeasen / Transportern ausgestattet sind (Spezialisierung der Transportwege). Schlussleistensysteme
trennen apikale und basolaterale Membranen, hier eingelagerte Kanäle
und Transporter sind dadurch auf ihr Kompartiment eingeschränkt. So
kommen beispielsweise Na/K-Pumpen in den meisten Epithelien nur in der basolateralen Membran vor.
Abbildung zeigt Beispiele für
transmembranalen / transzellulären sowie für parazellulären Transport. Für den transmembranalen Weg stehen mehr als 99% (für den parazellulären Weg <1%) der Gesamtfläche zur Verfügung. Epithelzellen (z.B. im Darm oder in der Niere) haben eine zum Lumen (apikale) und eine zum Interstitium gerichtete (basolaterale) Seite, die unterschiedlich mit Permeasen / Transportern ausgestattet sind (Spezialisierung der Transportwege). Schlussleistensysteme
trennen apikale und basolaterale Membranen, hier eingelagerte Kanäle
und Transporter sind dadurch auf ihr Kompartiment eingeschränkt. So
kommen beispielsweise Na/K-Pumpen in den meisten Epithelien nur in der basolateralen Membran vor.
Vergrößerung resorbierender Membranfläche: Die apikale Membranfläche ist in vielen Epithelien stark vergrößert: Submikroskopisch feine Ausstülpungen, sogenannte Mikrovilli, sind ~0,1 µm dick und - je nach Zellart - bis zu 2 µm lang. Sie können die Oberfläche bis um den Faktor 20 vergrößern und spielen an Orten intensiven Stoffaustauschs - z.B. in der Darmschleimhaut oder in Nierentubuli - eine entscheidende Rolle. Ihre Membran enthält reichlich Enzyme und Transporter für die Aufnahme von Kohlenhydraten, Aminosäuren, Peptiden, Elektrolyten u.a.
Auch die basolaterale Membran kann Einfaltungen aufweisen, was z.B. die Zahl in der Membran untergebrachter Na/K-Pumpen wesentlich erhöhen kann.
Ionisationsgrad: Mit dem Ionisationsgrad eines Stoffes, der eine biologische Barriere überwinden will, sinken seine apolaren (lipophilen) Eigenschaften. So diffundieren organische Säuren oder Basen im nichtionisierten Zustand durch Zellmembranen (non-ionic diffusion). Das kann bei der Verteilung zwischen Kompartimenten unterschiedlichen pH-Wertes eine Rolle spielen - die Ionisierung ist pH-abhängig, und ein diffusibler Ausgleich wird durch Apolarität des betreffenden Stoffes erleichtert (bei seinem pK-Wert ist die Hälfte des betreffenden Stoffes dissoziiert, die andere Hälfte liegt in apolarer Form vor).
 Abbildung zeigt Beispiele für
transmembranalen / transzellulären sowie für parazellulären Transport. Für den transmembranalen Weg stehen mehr als 99% (für den parazellulären Weg <1%) der Gesamtfläche zur Verfügung. Epithelzellen (z.B. im Darm oder in der Niere) haben eine zum Lumen (apikale) und eine zum Interstitium gerichtete (basolaterale) Seite, die unterschiedlich mit Permeasen / Transportern ausgestattet sind (Spezialisierung der Transportwege). Schlussleistensysteme
trennen apikale und basolaterale Membranen, hier eingelagerte Kanäle
und Transporter sind dadurch auf ihr Kompartiment eingeschränkt. So
kommen beispielsweise Na/K-Pumpen in den meisten Epithelien nur in der basolateralen Membran vor.
Abbildung zeigt Beispiele für
transmembranalen / transzellulären sowie für parazellulären Transport. Für den transmembranalen Weg stehen mehr als 99% (für den parazellulären Weg <1%) der Gesamtfläche zur Verfügung. Epithelzellen (z.B. im Darm oder in der Niere) haben eine zum Lumen (apikale) und eine zum Interstitium gerichtete (basolaterale) Seite, die unterschiedlich mit Permeasen / Transportern ausgestattet sind (Spezialisierung der Transportwege). Schlussleistensysteme
trennen apikale und basolaterale Membranen, hier eingelagerte Kanäle
und Transporter sind dadurch auf ihr Kompartiment eingeschränkt. So
kommen beispielsweise Na/K-Pumpen in den meisten Epithelien nur in der basolateralen Membran vor.Vergrößerung resorbierender Membranfläche: Die apikale Membranfläche ist in vielen Epithelien stark vergrößert: Submikroskopisch feine Ausstülpungen, sogenannte Mikrovilli, sind ~0,1 µm dick und - je nach Zellart - bis zu 2 µm lang. Sie können die Oberfläche bis um den Faktor 20 vergrößern und spielen an Orten intensiven Stoffaustauschs - z.B. in der Darmschleimhaut oder in Nierentubuli - eine entscheidende Rolle. Ihre Membran enthält reichlich Enzyme und Transporter für die Aufnahme von Kohlenhydraten, Aminosäuren, Peptiden, Elektrolyten u.a.
Auch die basolaterale Membran kann Einfaltungen aufweisen, was z.B. die Zahl in der Membran untergebrachter Na/K-Pumpen wesentlich erhöhen kann.
Ionisationsgrad: Mit dem Ionisationsgrad eines Stoffes, der eine biologische Barriere überwinden will, sinken seine apolaren (lipophilen) Eigenschaften. So diffundieren organische Säuren oder Basen im nichtionisierten Zustand durch Zellmembranen (non-ionic diffusion). Das kann bei der Verteilung zwischen Kompartimenten unterschiedlichen pH-Wertes eine Rolle spielen - die Ionisierung ist pH-abhängig, und ein diffusibler Ausgleich wird durch Apolarität des betreffenden Stoffes erleichtert (bei seinem pK-Wert ist die Hälfte des betreffenden Stoffes dissoziiert, die andere Hälfte liegt in apolarer Form vor).
Zellmembran: Panta rhei
Biomembranen gibt es
in lebenden Strukturen seit
Milliarden Jahren, sie sind in der Evolution sehr früh entstanden und
stellen das Grundelement biologischer Trennflächen in der Zelle dar. Sie sind nur wenige Nanometer
dick und bilden die äußere Zellmembran genauso wie die zahlreicher Zellorganellen. Ihr Ursprung liegt im endoplasmatischen Retikulum, das Lipide und Membranproteine fortlaufend neu synthetisiert und mit Begleitmolekülen ausstattet.
gibt es
in lebenden Strukturen seit
Milliarden Jahren, sie sind in der Evolution sehr früh entstanden und
stellen das Grundelement biologischer Trennflächen in der Zelle dar. Sie sind nur wenige Nanometer
dick und bilden die äußere Zellmembran genauso wie die zahlreicher Zellorganellen. Ihr Ursprung liegt im endoplasmatischen Retikulum, das Lipide und Membranproteine fortlaufend neu synthetisiert und mit Begleitmolekülen ausstattet.
Je nach ihrer speziellen Funktion sind Membranen unterschiedlich zusammengesetzt. Tragender Baustein sind Lipide, insbesondere Phospholipide (s. weiter unten), Sphingolipide und Cholesterin. Aufgrund ihrer hydrophoben Eigenschaft sind sie ideal für die Separation von Funktionsräumen geeignet. Die meisten "Passagiere" der Membran - wie Salze, Kohlenhydrate, Aminosäuren - sind hydrophil (wasser-, nicht fettlöslich) und können diese daher nicht ohne spezielle Öffnungen bzw. Transportechanismen durchdringen.
 Membrankomponenten können die Identität von Zellorganellen signalisieren (z.B. Zellkern - außen Zytoplasma, innen Karyoplasma -, endoplasmatisches Retikulum, Mitochondrien, Lysosomen etc) und ihren Transport beeinflussen. Sie können im endoplasmatischen Retikulum neu synthetisiert oder wiederverwendet werden (recycling).
Membrankomponenten können die Identität von Zellorganellen signalisieren (z.B. Zellkern - außen Zytoplasma, innen Karyoplasma -, endoplasmatisches Retikulum, Mitochondrien, Lysosomen etc) und ihren Transport beeinflussen. Sie können im endoplasmatischen Retikulum neu synthetisiert oder wiederverwendet werden (recycling).
 Das gesamte Membranmaterial in den Zellen des Körpers wird innerhalb von ~3 Wochen vollständig erneuert (
Das gesamte Membranmaterial in den Zellen des Körpers wird innerhalb von ~3 Wochen vollständig erneuert ( Abbildung):
Abbildung):
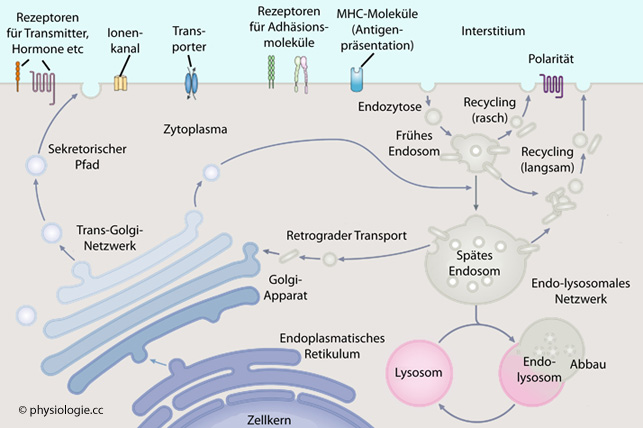
 Abbildung: Membranrecycling
Abbildung: Membranrecycling
Nach Cullen PJ, Steinberg F. To degrade or not to degrade: mechanisms and significance of endocytic recycling. Nature Rev Mol Cell Biol 2018; 19: 679-96
Membranmaterial wird ständig zwischen Zelloberfläche und membtanbegrenzten Zellorganellen ausgetauscht. Dabei werden u.a. Membranptoreine nach deren Endozytose wieder in die Aupenmembran eingelagert, oder sie werden abgebaut und Aminosäuren für Proteinsynthese wiederverwendet. Membranlipide (u.a. Phospholipide) werden ebenfalls recycelt, zum Teil im endoplasmatischen Retikulum neu aufgebaut.
Man schätzt, dass in einem Zeitraum von etwa 3 Wochen das gesamte Membranmaterial in den Zellen des Körpers vollständig erneuert ist

Die Zellmembran umschließt die Zelle als Ganzes und ist aus zwei Lamellen aufgebaut:
 Die äußere Lamelle besteht vorwiegend aus Phosphatidylcholinen, die u.a. Signale aus der Membran vermitteln und Enzyme aktivieren können. Hier finden sich auch Glykoproteine und neutrale Lipide (Lecithin, Sphingomyelin). Die Moleküle der Außenlamelle signalisieren
u.a. die Spezifität der Zelle (Epithelzelle, Nervenzelle..), was auch eine
Voraussetzung für die geordnete Bildung von Gewebsverbänden darstellt.
Die äußere Lamelle besteht vorwiegend aus Phosphatidylcholinen, die u.a. Signale aus der Membran vermitteln und Enzyme aktivieren können. Hier finden sich auch Glykoproteine und neutrale Lipide (Lecithin, Sphingomyelin). Die Moleküle der Außenlamelle signalisieren
u.a. die Spezifität der Zelle (Epithelzelle, Nervenzelle..), was auch eine
Voraussetzung für die geordnete Bildung von Gewebsverbänden darstellt.
 In der inneren
(zytoplasmatischen) Lamelle finden sich Lipide wie Phosphatidylserin und Phosphatidylinositol. Phosphatidylserin
spielt eine Schlüsselrolle für den Zellzyklus, insbesondere - wenn es
in der Außenmembran auftritt (was normalerweise nicht der Fall ist) im
Rahmen der Apoptose. Phosphatidylinositol (PI) hat zahlreiche Funktionen (wie Interaktion mit Pathogenen, second messenger- Mechanismen). Es ist der Ausgangsstoff für die Bildung von Phosphoinositiden (PIPs).
In der inneren
(zytoplasmatischen) Lamelle finden sich Lipide wie Phosphatidylserin und Phosphatidylinositol. Phosphatidylserin
spielt eine Schlüsselrolle für den Zellzyklus, insbesondere - wenn es
in der Außenmembran auftritt (was normalerweise nicht der Fall ist) im
Rahmen der Apoptose. Phosphatidylinositol (PI) hat zahlreiche Funktionen (wie Interaktion mit Pathogenen, second messenger- Mechanismen). Es ist der Ausgangsstoff für die Bildung von Phosphoinositiden (PIPs).
PIPs (mehrere Formen mit unterschiedlicher Funktion sind bekannt, z.B. IP3) sind phosphorylierte PIs, sie entstehen durch Einwirkung spezifischer Enzyme (Kinasen / Phosporylasen) auf die membrangebundenen PIs und beeinflussen Vorgänge sowohl in als auch außerhalb der Membran.
 gibt es
in lebenden Strukturen seit
Milliarden Jahren, sie sind in der Evolution sehr früh entstanden und
stellen das Grundelement biologischer Trennflächen in der Zelle dar. Sie sind nur wenige Nanometer
dick und bilden die äußere Zellmembran genauso wie die zahlreicher Zellorganellen. Ihr Ursprung liegt im endoplasmatischen Retikulum, das Lipide und Membranproteine fortlaufend neu synthetisiert und mit Begleitmolekülen ausstattet.
gibt es
in lebenden Strukturen seit
Milliarden Jahren, sie sind in der Evolution sehr früh entstanden und
stellen das Grundelement biologischer Trennflächen in der Zelle dar. Sie sind nur wenige Nanometer
dick und bilden die äußere Zellmembran genauso wie die zahlreicher Zellorganellen. Ihr Ursprung liegt im endoplasmatischen Retikulum, das Lipide und Membranproteine fortlaufend neu synthetisiert und mit Begleitmolekülen ausstattet. Je nach ihrer speziellen Funktion sind Membranen unterschiedlich zusammengesetzt. Tragender Baustein sind Lipide, insbesondere Phospholipide (s. weiter unten), Sphingolipide und Cholesterin. Aufgrund ihrer hydrophoben Eigenschaft sind sie ideal für die Separation von Funktionsräumen geeignet. Die meisten "Passagiere" der Membran - wie Salze, Kohlenhydrate, Aminosäuren - sind hydrophil (wasser-, nicht fettlöslich) und können diese daher nicht ohne spezielle Öffnungen bzw. Transportechanismen durchdringen.
 Membrankomponenten können die Identität von Zellorganellen signalisieren (z.B. Zellkern - außen Zytoplasma, innen Karyoplasma -, endoplasmatisches Retikulum, Mitochondrien, Lysosomen etc) und ihren Transport beeinflussen. Sie können im endoplasmatischen Retikulum neu synthetisiert oder wiederverwendet werden (recycling).
Membrankomponenten können die Identität von Zellorganellen signalisieren (z.B. Zellkern - außen Zytoplasma, innen Karyoplasma -, endoplasmatisches Retikulum, Mitochondrien, Lysosomen etc) und ihren Transport beeinflussen. Sie können im endoplasmatischen Retikulum neu synthetisiert oder wiederverwendet werden (recycling).  Das gesamte Membranmaterial in den Zellen des Körpers wird innerhalb von ~3 Wochen vollständig erneuert (
Das gesamte Membranmaterial in den Zellen des Körpers wird innerhalb von ~3 Wochen vollständig erneuert ( Abbildung):
Abbildung):
 Abbildung: Membranrecycling
Abbildung: MembranrecyclingNach Cullen PJ, Steinberg F. To degrade or not to degrade: mechanisms and significance of endocytic recycling. Nature Rev Mol Cell Biol 2018; 19: 679-96
Membranmaterial wird ständig zwischen Zelloberfläche und membtanbegrenzten Zellorganellen ausgetauscht. Dabei werden u.a. Membranptoreine nach deren Endozytose wieder in die Aupenmembran eingelagert, oder sie werden abgebaut und Aminosäuren für Proteinsynthese wiederverwendet. Membranlipide (u.a. Phospholipide) werden ebenfalls recycelt, zum Teil im endoplasmatischen Retikulum neu aufgebaut.
Man schätzt, dass in einem Zeitraum von etwa 3 Wochen das gesamte Membranmaterial in den Zellen des Körpers vollständig erneuert ist

Die Zellmembran umschließt die Zelle als Ganzes und ist aus zwei Lamellen aufgebaut:
 Die äußere Lamelle besteht vorwiegend aus Phosphatidylcholinen, die u.a. Signale aus der Membran vermitteln und Enzyme aktivieren können. Hier finden sich auch Glykoproteine und neutrale Lipide (Lecithin, Sphingomyelin). Die Moleküle der Außenlamelle signalisieren
u.a. die Spezifität der Zelle (Epithelzelle, Nervenzelle..), was auch eine
Voraussetzung für die geordnete Bildung von Gewebsverbänden darstellt.
Die äußere Lamelle besteht vorwiegend aus Phosphatidylcholinen, die u.a. Signale aus der Membran vermitteln und Enzyme aktivieren können. Hier finden sich auch Glykoproteine und neutrale Lipide (Lecithin, Sphingomyelin). Die Moleküle der Außenlamelle signalisieren
u.a. die Spezifität der Zelle (Epithelzelle, Nervenzelle..), was auch eine
Voraussetzung für die geordnete Bildung von Gewebsverbänden darstellt. In der inneren
(zytoplasmatischen) Lamelle finden sich Lipide wie Phosphatidylserin und Phosphatidylinositol. Phosphatidylserin
spielt eine Schlüsselrolle für den Zellzyklus, insbesondere - wenn es
in der Außenmembran auftritt (was normalerweise nicht der Fall ist) im
Rahmen der Apoptose. Phosphatidylinositol (PI) hat zahlreiche Funktionen (wie Interaktion mit Pathogenen, second messenger- Mechanismen). Es ist der Ausgangsstoff für die Bildung von Phosphoinositiden (PIPs).
In der inneren
(zytoplasmatischen) Lamelle finden sich Lipide wie Phosphatidylserin und Phosphatidylinositol. Phosphatidylserin
spielt eine Schlüsselrolle für den Zellzyklus, insbesondere - wenn es
in der Außenmembran auftritt (was normalerweise nicht der Fall ist) im
Rahmen der Apoptose. Phosphatidylinositol (PI) hat zahlreiche Funktionen (wie Interaktion mit Pathogenen, second messenger- Mechanismen). Es ist der Ausgangsstoff für die Bildung von Phosphoinositiden (PIPs). PIPs (mehrere Formen mit unterschiedlicher Funktion sind bekannt, z.B. IP3) sind phosphorylierte PIs, sie entstehen durch Einwirkung spezifischer Enzyme (Kinasen / Phosporylasen) auf die membrangebundenen PIs und beeinflussen Vorgänge sowohl in als auch außerhalb der Membran.
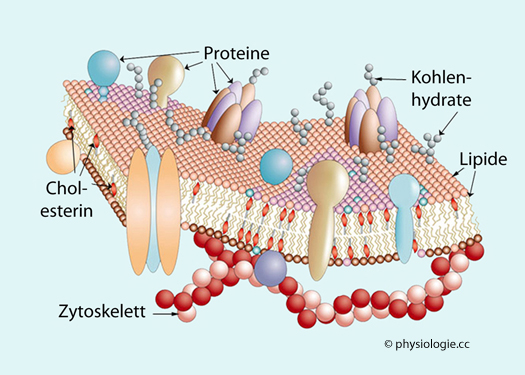
 Abbildung: Flüssigmosaikmodell der Zellmembran
Abbildung: Flüssigmosaikmodell der ZellmembranNach: Pietzsch J. Mind the membrane. Horizon Symposia: Living Frontier, 1-4 (2004). Nature Publishing Co
Die
Zellmembran ist eine komplexe Struktur aus Lipiden,
Eiweißen und Kohlenhydraten. Der Anteil dieser Komponenten
ist von Membran zu Membran unterschiedlich, je nach Erfordernissen. Ein Beispiel sind Merkmale, die als CD-System bezeichnet werden.
Die Membran enthält unterschiedliche Arten von Lipiden:
Phospholipide sind der Hauptbestandteil (  Abbildung unten).
Abbildung unten).
Cholesterin mit seinem starren Steroidgerüst ist sehr lipophil. Es lagert sich zwischen die Kohlenwasserstoffketten der Phospholipide und kann innerhalb der Membran von einer Schichte zur anderen wechseln.
Glykolipide sind zusammen mit Glykoproteinen Bestandteile der Glykokalix, der "Außenhaut" der Zelle
 Abbildung unten).
Abbildung unten).Cholesterin mit seinem starren Steroidgerüst ist sehr lipophil. Es lagert sich zwischen die Kohlenwasserstoffketten der Phospholipide und kann innerhalb der Membran von einer Schichte zur anderen wechseln.
Glykolipide sind zusammen mit Glykoproteinen Bestandteile der Glykokalix, der "Außenhaut" der Zelle

Membranproteine sind fixer Bestandteil der Zellmembran (integrale
Proteine), indem sie
 in die Membran "gesteckt" (membrandurchspannende hydrophobe α-helikale Sequenzen aus ~20 Aminosäuren enthalten Aminosäuren mit lipophilen Seitenketten*) oder direkt bzw. über Oligosaccharide an Membranlipide
gebunden sind;
in die Membran "gesteckt" (membrandurchspannende hydrophobe α-helikale Sequenzen aus ~20 Aminosäuren enthalten Aminosäuren mit lipophilen Seitenketten*) oder direkt bzw. über Oligosaccharide an Membranlipide
gebunden sind;
 oder sie sind an ein integrales (peripheres oder intrazelluläres)
Protein angelagert und können von diesem wieder gelöst werden.
oder sie sind an ein integrales (peripheres oder intrazelluläres)
Protein angelagert und können von diesem wieder gelöst werden.
Membranproteine
 bilden
Ankerpunkte für das Zytoskelett oder die extrazelluläre Matrix,
bilden
Ankerpunkte für das Zytoskelett oder die extrazelluläre Matrix,
 können Ionenkanäle und
Transportsysteme bilden,
können Ionenkanäle und
Transportsysteme bilden,
 können als Enzyme wirken,
können als Enzyme wirken,
 als Rezeptoren
für extrazelluläre Signalstoffe dienen.
als Rezeptoren
für extrazelluläre Signalstoffe dienen.
Membrantopologie beschreibt das Muster, nach dem α-Helices zu Gesamtproteinen der Membran zusammengesetzt sind. Diese Helices enthalten vorwiegend nonpolare (hydrophobe) bzw. ungeladene Aminosäuren in einer Anordnung, die einerseits eine lipophile Außenfläche (Verankerung in der Zellmembran), andererseits eine Innenpore ergeben, durch welche gegebenenfalls polare Substanzen diffundieren können (hier finden sich vorwiegend polare Aminosäurereste).
Membranproteine sind - soferne sie nicht an extra- (Matrix) oder intrazelluläre Strukturen (Zytoskelett) stationär fixiert sind - in der Membran frei beweglich; ihre Lateraldiffusion erfolgt allerdings um Größenordnungen langsamer als die von Phospholipiden. Auch können Membranproteine von intrazellulären Motorproteinen aktiv entlang der Membranfläche gezogen werden; die Topologie des Proteins (d.h. seine Zuordnung in der Membranstruktur) bleibt dabei erhalten.
Neben Glykoproteinen finden sich in der Zellmembran - vor allem im Nervengewebe - auch Glykolipide (mit Sphingosin als Rückgrat: z.B. Cerebroside, Ganglioside). Der Zuckeranteil (meist <15 Zuckerreste - Glucose, Galactose, Mannose, Fucose, Aminozucker) wird in endoplasmatischem Retikulum und Golgi-Apparat an Eiweiß bzw. Phospholipid angehängt.
Da eine enorme Zahl molekularer Kombinationen dieses Arrangements möglich ist, fungieren Glykolipide und Glykoporoteine als Erkennungsmoleküle. Sie bauen die Glykokalyx ("Zuckerhülle") auf, ein System von "Antennen", die signalisieren, welche Spezifität (Nerven-, Muskel- Epithelzelle..) und Differenzierung die
jeweilige Zelle hat (die Glykokalyx kann einen größeren
Durchmesser haben als die Lipid-Doppelschicht). Bei der Ausbildung von
Gewebsverbänden erkennen sich gleiche Zellen
(sie tragen an ihrer Oberfläche sozusagen einen "Glykokalyx-Ausweis").
("Zuckerhülle") auf, ein System von "Antennen", die signalisieren, welche Spezifität (Nerven-, Muskel- Epithelzelle..) und Differenzierung die
jeweilige Zelle hat (die Glykokalyx kann einen größeren
Durchmesser haben als die Lipid-Doppelschicht). Bei der Ausbildung von
Gewebsverbänden erkennen sich gleiche Zellen
(sie tragen an ihrer Oberfläche sozusagen einen "Glykokalyx-Ausweis").
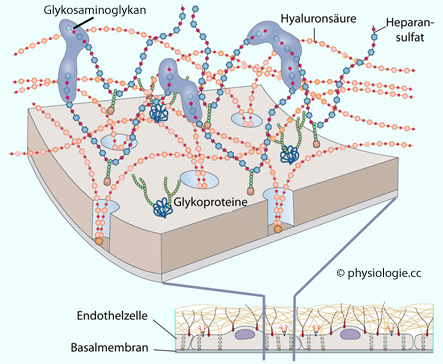

 Abbildung: Glykokalyx
Abbildung: Glykokalyx
Nach Rabelink TJ, de Zeeuw D. The glycocalyx - linking albuminuria with renal and cardiovascular disease. Nature Rev Nephrol 2015; 11: 667-76
Gezeigt ist ein Ausschnitt aus der Kapillarwand eines Glomerulumendothels in der Niere.
In Glykoproteinen sind Kohlenhydratketten (grün) über Serin / Threonin oder Asparagin an ein membranständiges Protein gebunden. Hyaluronsäure (Hyaluronan) ist aus Glucosederivaten (Glucuronsäure, Acetylglucosamin) aufgebaut und hat extreme Wasserbindungskapazität. Heparansulfat ist ein Glykosaminoglykan und gehört zur Gruppe der Heparine

Eine Glykokalyx tragen vor allem
 Endothelzellen (Kapillaren und größere Blutgefäße) an ihrer Luminalseite (
Endothelzellen (Kapillaren und größere Blutgefäße) an ihrer Luminalseite ( Abbildung)
- bis zu 11 µm dick. Die Glykokalyx enthält zahlreiche Enzyme und
andere Proteine, welche die Anhaftung von Leukozyten (weißen
Blutkörperchen) und Thrombozyten (Blutplättehcn) beeinflussen und eine
Schutzfunktion ausüben.
Abbildung)
- bis zu 11 µm dick. Die Glykokalyx enthält zahlreiche Enzyme und
andere Proteine, welche die Anhaftung von Leukozyten (weißen
Blutkörperchen) und Thrombozyten (Blutplättehcn) beeinflussen und eine
Schutzfunktion ausüben.
 Apikale
Membranen resorbierender Epithelzellen auf Mikrovilli im Darm (vor
allem Dünndarm). Diese Schicht ist nur 0,3 µm dick und hat Enzyme
gebunden haben, was die endgültige Digestion von Zuckern und Peptiden
unterstützt.
Apikale
Membranen resorbierender Epithelzellen auf Mikrovilli im Darm (vor
allem Dünndarm). Diese Schicht ist nur 0,3 µm dick und hat Enzyme
gebunden haben, was die endgültige Digestion von Zuckern und Peptiden
unterstützt.
Die Glykokalyx hat folgende Hauptfunktionen:

 Schutz: Die Kohlenhydrathülle schützt vor mechanischen oder verfrühter enzymatischer Aktivität
Schutz: Die Kohlenhydrathülle schützt vor mechanischen oder verfrühter enzymatischer Aktivität
 Anhaftung: Die Adhäsion anderer Zellen wird gezielt beeinflusst
Anhaftung: Die Adhäsion anderer Zellen wird gezielt beeinflusst
 Identifikation: Die Glykokalyx hilft bei der Unterscheidung gesunder von erkrankten oder fremden Zellen
Identifikation: Die Glykokalyx hilft bei der Unterscheidung gesunder von erkrankten oder fremden Zellen
Glykoproteine sind darüber hinaus Strukturträger von interzellulären Verbindungen wie gap junctions, bauen Rezeptormoleküle mit auf, und fungieren als immunologische Signalstrukturen (z.B. Blutgruppensubstanzen).
 in die Membran "gesteckt" (membrandurchspannende hydrophobe α-helikale Sequenzen aus ~20 Aminosäuren enthalten Aminosäuren mit lipophilen Seitenketten*) oder direkt bzw. über Oligosaccharide an Membranlipide
gebunden sind;
in die Membran "gesteckt" (membrandurchspannende hydrophobe α-helikale Sequenzen aus ~20 Aminosäuren enthalten Aminosäuren mit lipophilen Seitenketten*) oder direkt bzw. über Oligosaccharide an Membranlipide
gebunden sind;  oder sie sind an ein integrales (peripheres oder intrazelluläres)
Protein angelagert und können von diesem wieder gelöst werden.
oder sie sind an ein integrales (peripheres oder intrazelluläres)
Protein angelagert und können von diesem wieder gelöst werden.* Alanin, Valin, Leucin, Isoleucin, Prolin, Phenylalanin, Tryptophan, Methionin
Membranproteine
 bilden
Ankerpunkte für das Zytoskelett oder die extrazelluläre Matrix,
bilden
Ankerpunkte für das Zytoskelett oder die extrazelluläre Matrix,  können Ionenkanäle und
Transportsysteme bilden,
können Ionenkanäle und
Transportsysteme bilden,  können als Enzyme wirken,
können als Enzyme wirken,  als Rezeptoren
für extrazelluläre Signalstoffe dienen.
als Rezeptoren
für extrazelluläre Signalstoffe dienen.Membrantopologie beschreibt das Muster, nach dem α-Helices zu Gesamtproteinen der Membran zusammengesetzt sind. Diese Helices enthalten vorwiegend nonpolare (hydrophobe) bzw. ungeladene Aminosäuren in einer Anordnung, die einerseits eine lipophile Außenfläche (Verankerung in der Zellmembran), andererseits eine Innenpore ergeben, durch welche gegebenenfalls polare Substanzen diffundieren können (hier finden sich vorwiegend polare Aminosäurereste).
Membranproteine sind - soferne sie nicht an extra- (Matrix) oder intrazelluläre Strukturen (Zytoskelett) stationär fixiert sind - in der Membran frei beweglich; ihre Lateraldiffusion erfolgt allerdings um Größenordnungen langsamer als die von Phospholipiden. Auch können Membranproteine von intrazellulären Motorproteinen aktiv entlang der Membranfläche gezogen werden; die Topologie des Proteins (d.h. seine Zuordnung in der Membranstruktur) bleibt dabei erhalten.
Neben Glykoproteinen finden sich in der Zellmembran - vor allem im Nervengewebe - auch Glykolipide (mit Sphingosin als Rückgrat: z.B. Cerebroside, Ganglioside). Der Zuckeranteil (meist <15 Zuckerreste - Glucose, Galactose, Mannose, Fucose, Aminozucker) wird in endoplasmatischem Retikulum und Golgi-Apparat an Eiweiß bzw. Phospholipid angehängt.
Da eine enorme Zahl molekularer Kombinationen dieses Arrangements möglich ist, fungieren Glykolipide und Glykoporoteine als Erkennungsmoleküle. Sie bauen die Glykokalyx
 ("Zuckerhülle") auf, ein System von "Antennen", die signalisieren, welche Spezifität (Nerven-, Muskel- Epithelzelle..) und Differenzierung die
jeweilige Zelle hat (die Glykokalyx kann einen größeren
Durchmesser haben als die Lipid-Doppelschicht). Bei der Ausbildung von
Gewebsverbänden erkennen sich gleiche Zellen
(sie tragen an ihrer Oberfläche sozusagen einen "Glykokalyx-Ausweis").
("Zuckerhülle") auf, ein System von "Antennen", die signalisieren, welche Spezifität (Nerven-, Muskel- Epithelzelle..) und Differenzierung die
jeweilige Zelle hat (die Glykokalyx kann einen größeren
Durchmesser haben als die Lipid-Doppelschicht). Bei der Ausbildung von
Gewebsverbänden erkennen sich gleiche Zellen
(sie tragen an ihrer Oberfläche sozusagen einen "Glykokalyx-Ausweis"). 

 Abbildung: Glykokalyx
Abbildung: GlykokalyxNach Rabelink TJ, de Zeeuw D. The glycocalyx - linking albuminuria with renal and cardiovascular disease. Nature Rev Nephrol 2015; 11: 667-76
Gezeigt ist ein Ausschnitt aus der Kapillarwand eines Glomerulumendothels in der Niere.
In Glykoproteinen sind Kohlenhydratketten (grün) über Serin / Threonin oder Asparagin an ein membranständiges Protein gebunden. Hyaluronsäure (Hyaluronan) ist aus Glucosederivaten (Glucuronsäure, Acetylglucosamin) aufgebaut und hat extreme Wasserbindungskapazität. Heparansulfat ist ein Glykosaminoglykan und gehört zur Gruppe der Heparine

Eine Glykokalyx tragen vor allem
 Endothelzellen (Kapillaren und größere Blutgefäße) an ihrer Luminalseite (
Endothelzellen (Kapillaren und größere Blutgefäße) an ihrer Luminalseite ( Abbildung)
- bis zu 11 µm dick. Die Glykokalyx enthält zahlreiche Enzyme und
andere Proteine, welche die Anhaftung von Leukozyten (weißen
Blutkörperchen) und Thrombozyten (Blutplättehcn) beeinflussen und eine
Schutzfunktion ausüben.
Abbildung)
- bis zu 11 µm dick. Die Glykokalyx enthält zahlreiche Enzyme und
andere Proteine, welche die Anhaftung von Leukozyten (weißen
Blutkörperchen) und Thrombozyten (Blutplättehcn) beeinflussen und eine
Schutzfunktion ausüben. Apikale
Membranen resorbierender Epithelzellen auf Mikrovilli im Darm (vor
allem Dünndarm). Diese Schicht ist nur 0,3 µm dick und hat Enzyme
gebunden haben, was die endgültige Digestion von Zuckern und Peptiden
unterstützt.
Apikale
Membranen resorbierender Epithelzellen auf Mikrovilli im Darm (vor
allem Dünndarm). Diese Schicht ist nur 0,3 µm dick und hat Enzyme
gebunden haben, was die endgültige Digestion von Zuckern und Peptiden
unterstützt.Die Glykokalyx hat folgende Hauptfunktionen:

 Schutz: Die Kohlenhydrathülle schützt vor mechanischen oder verfrühter enzymatischer Aktivität
Schutz: Die Kohlenhydrathülle schützt vor mechanischen oder verfrühter enzymatischer Aktivität Anhaftung: Die Adhäsion anderer Zellen wird gezielt beeinflusst
Anhaftung: Die Adhäsion anderer Zellen wird gezielt beeinflusst Identifikation: Die Glykokalyx hilft bei der Unterscheidung gesunder von erkrankten oder fremden Zellen
Identifikation: Die Glykokalyx hilft bei der Unterscheidung gesunder von erkrankten oder fremden ZellenGlykoproteine sind darüber hinaus Strukturträger von interzellulären Verbindungen wie gap junctions, bauen Rezeptormoleküle mit auf, und fungieren als immunologische Signalstrukturen (z.B. Blutgruppensubstanzen).

 Abbildung: Phospholipidmolekül (Glycerophospholipid) in der Zellmembran
Abbildung: Phospholipidmolekül (Glycerophospholipid) in der ZellmembranMembranlipide
haben fett- und wasserlösliche Enden. Als Doppelschicht sind sie zu
Membranen (rechts unten) gruppiert, deren Oberflächen wasserlöslich (hydrophil, polar)
sind, die Innenseiten sind lipophil (nichtpolar).
Phospholipide bestehen aus jeweils zwei Fettsäuren (hydrophob), die an ein Glycerin (Glycerophospholipide) oder ein Sphingosin gebunden sind (Sphingophospholipide) und am Glycerin bzw. Sphingosin Phosphat mit einer "Kopfgruppe" gebunden haben (hydrophil). Phospholipide bilden den Hauptanteil der Membranbausteine.
Die häufigsten an Phosphat gekoppelten Kopfgruppenmoleküle sind Ethanolamin, Cholin und Inositol, die häufigsten Fettsäuren Palmitinsäure (C16, gesättigt) und Ölsäure (C18, ungesättigt)
Phospholipide bestehen aus jeweils zwei Fettsäuren (hydrophob), die an ein Glycerin (Glycerophospholipide) oder ein Sphingosin gebunden sind (Sphingophospholipide) und am Glycerin bzw. Sphingosin Phosphat mit einer "Kopfgruppe" gebunden haben (hydrophil). Phospholipide bilden den Hauptanteil der Membranbausteine.
Die häufigsten an Phosphat gekoppelten Kopfgruppenmoleküle sind Ethanolamin, Cholin und Inositol, die häufigsten Fettsäuren Palmitinsäure (C16, gesättigt) und Ölsäure (C18, ungesättigt)

Phospholipide sind Grundelement und Hauptbestandteil (mindestens 50%) der Zellmembran. Sie sind amphipathisch, d.h. sie weisen lipophile (nonpolarer Schwanzteil) und hydrophile Enden (polarer Kopfteil) auf ( Abbildung).
Abbildung).
In wässriger Lösung richten sich Phospholipide so aus, dass zuerst Monolayer, in höherer Konzentration Mizellen mit zweischichtigen Membranen entstehen:
 Außen liegt je eine hydrophile (polare, d.h. elektrisch asymmetrische),
Außen liegt je eine hydrophile (polare, d.h. elektrisch asymmetrische),
 in der Mitte eine lipophile (apolare) Zone.
in der Mitte eine lipophile (apolare) Zone.
Diese Anordnung ergibt sich von selbst, die apolaren Gruppen (Fettsäuren) sind energiesparend vor einer Interaktion mit dem Lösungsmittel Wasser geschützt.

 Die hydrophilen "Kopfteile" der Phospholipide in Zellmembranen grenzen
beiderseits der Membran an wasserreiche Räume und bestimmen die
hydrophilen Oberflächen der Membran.
Die hydrophilen "Kopfteile" der Phospholipide in Zellmembranen grenzen
beiderseits der Membran an wasserreiche Räume und bestimmen die
hydrophilen Oberflächen der Membran.
 Die hydrophoben "Schwanzteile" (Fettsäuren) bauen die Innenschicht der Membranen auf, die wasserabweisend / lipophil ist.
Die hydrophoben "Schwanzteile" (Fettsäuren) bauen die Innenschicht der Membranen auf, die wasserabweisend / lipophil ist.
Zellmembranen ermöglichen so die Separation verschiedener Reaktionsräume (Kompartimentierung), sowohl zwischen der Zelle und ihrer Umgebung (Zellmembran) wie auch in der Zelle: Organellen können Schichtform (flächenhafte Grenzstruktur: Zellmembran, Kernmembran, Mitochondrienmembran) oder Bläschenform annehmen (d.h. sie umschließen einen mehr oder weniger kugelförmigen Innenraum, der hauptsächlich aus Wasser besteht). In den dadurch aufgebauten Kompartimenten können Stoffe angereichert, oder aus ihnen evakuiert werden.
Sauerstoff-, Kohlendioxid-, Ammoniak- und zu einem gewissen Grad auch Wassermoleküle können die Zellmembran direkt passieren (vermutlich durch kurzfristig auftretende Spaltbildungen zwischen den Lipidketten). Die Durchgängigkeit der Membran für diese Moleküle ist biologisch äußerst bedeutsam (z.B. Atemgasautsausch), ihr Grad (Diffusionskonstante) hängt stark von der Zusammensetzung der jeweiligen Membran ab; Zellmembranen mit niedriger Fluidität (s. weiter unten) haben niedrige H2O-Permeabilität.
Zu den Phospholipiden gehören Glycerophosphatide (Abbildungen) und Sphingosinderivate (hier verankert der zweiwertige Aminoalkohol Sphingosin Fettsäuren, Phosphate und Zucker). Die Zusammensetzung der Membranen aus diesen Elementen bestimmt ihre physikalischen (z.B. Dicke, Flexibilität) und chemischen Eigenschaften. Während Proteine gar nicht, und einzelne Lipidmoleküle wegen des hohen erforderlichen Energieaufwands nur sehr selten von einer Membranschicht in die andere wechseln, sind die Moleküle innerhalb ihrer Schicht frei beweglich: So kann in der Erythrozytenmembran ein Lipidmolekül durch Lateralbewegung die gesamte Zelle in wenigen Sekunden vollständig umrunden. Das Ausmaß dieser Lateraldiffusion steigt mit der Temperatur an.
Ein Wechsel von Lipiden von einer Membranschicht in die andere (flip-flop) ist wegen der hydrophilen Kopfteile von Membranlipiden durch die hydrophobe Mittelschicht nur schwer zu bewerkstelligen (hoher Energieaufwand). Daher bedarf es spezieller Enzyme (Flippasen), das sind Transmembran- Transporterproteine, die eine Verlagerung von Phospholipiden zwischen den beiden Schichten einer Zellmembran erleichtern - was im Rahmen von Wachstums- und Mobilitätsvorgängen notwendig werden kann. Einige Flippasen arbeiten energieunabhängig in beiden Richtungen, andere energieabhängig (ATPasen) unidirektional. Transporter von der zytosolischen zur exoplasmatischen Seite der Membran werden auch als "Floppasen" bezeichnet.
Viele Zellen verteilen das Muster ihrer Phospholipide unterschiedlich (zytosolisch vs. exoplasmatisch), und eine Angleichung dieser biochemischen Zusammensetzung kann als Apoptosemarker fungieren.

 Abbildung: Phasenübergang in Lipid-Doppellamelle
Abbildung: Phasenübergang in Lipid-Doppellamelle
Nach Stein WD, Litman T, in: Channels, Carriers, and Pumps, 2nd ed 2015
 Bei der sogenannten Übergangstemperatur Tm (melting oder transition temperature) - deren Betrag von der Zusammensetzung der Membran abhängt - wechselt der Zustand der Membran zwischen einem eher festen Gel- und einem eher flüssigen Solzustand (
Bei der sogenannten Übergangstemperatur Tm (melting oder transition temperature) - deren Betrag von der Zusammensetzung der Membran abhängt - wechselt der Zustand der Membran zwischen einem eher festen Gel- und einem eher flüssigen Solzustand ( Abbildung).
Bei Temperaturen unter [Tm] wird die Membran rigide (semikristallin).
Abbildung).
Bei Temperaturen unter [Tm] wird die Membran rigide (semikristallin).
Die Übergangstemperatur kann je nach Länge der Fettsäuren über oder unter der Körpertemperatur liegen. Allerdings ist bei komplexer Zusammensetzung der Membran keine klare Übergangstemperatur definierbar, vielmehr ergibt sich ein Temperaturbereich, in dem der Sol-Gel-Zustand kontinuierlich variiert, und gel-ähnliche mit benachbarten sol-ähnlichen Zonen koexistieren können.
Sowohl Muster als auch Konzentration ihrer Bestandteile bestimmt die Fluidität der Membran:
 Ist sie reich an Phospholipiden
mit langen, weitgehend oder gänzlich gesättigten Fettsäuren (wenige bis
keine Doppelbindungen), dann ist sie dicht gepackt, weniger beweglich,
weist geringe Fluidität auf und läßt wenig Wassermoleküle passieren.
Steigender Anteil
an Doppelbindungen (ungesättigte Fettsäuren) und/oder kürzere
Fettsäureketten verschieben den
Zustand in Richtung höherer Fluidität, die Membran wird nachgiebiger
und gleichzeitig durchlässiger für Wassermoleküle.
Ist sie reich an Phospholipiden
mit langen, weitgehend oder gänzlich gesättigten Fettsäuren (wenige bis
keine Doppelbindungen), dann ist sie dicht gepackt, weniger beweglich,
weist geringe Fluidität auf und läßt wenig Wassermoleküle passieren.
Steigender Anteil
an Doppelbindungen (ungesättigte Fettsäuren) und/oder kürzere
Fettsäureketten verschieben den
Zustand in Richtung höherer Fluidität, die Membran wird nachgiebiger
und gleichzeitig durchlässiger für Wassermoleküle.
 Cholesterin
mit seinem rigiden Steroidring senkt (in mäßiger Konzentration) die Fluidität und trägt zur Festigkeit der Membran bei. Bei Membranen mit einem hohen Anteil an ungesättigten Fettsäuren steigert Cholesterin andererseits die (ohnehin hohe) Membranfluidität, indem es sich in
Lücken zwischen den Lipidschweifen einlagert. Insgesamt reduziert
Cholesterin temperaturbedingte Änderungen der Membranfluidität.
Cholesterin
mit seinem rigiden Steroidring senkt (in mäßiger Konzentration) die Fluidität und trägt zur Festigkeit der Membran bei. Bei Membranen mit einem hohen Anteil an ungesättigten Fettsäuren steigert Cholesterin andererseits die (ohnehin hohe) Membranfluidität, indem es sich in
Lücken zwischen den Lipidschweifen einlagert. Insgesamt reduziert
Cholesterin temperaturbedingte Änderungen der Membranfluidität.

 Gesättigte Fettsäuren senken, ungesättigte steigern die Fluidität der Membran.
Gesättigte Fettsäuren senken, ungesättigte steigern die Fluidität der Membran.
 Cholesterin in einer fluiden Membran senkt die Fluidität, in einer rigiden Membran steigert es sie.
Cholesterin in einer fluiden Membran senkt die Fluidität, in einer rigiden Membran steigert es sie.
 Liegt die Temperatur unter dem Betrag von Tm, ist die Membran rigide (semikristallin); liegt sie deutlich darüber, wird die Membran zu flüssig.
Liegt die Temperatur unter dem Betrag von Tm, ist die Membran rigide (semikristallin); liegt sie deutlich darüber, wird die Membran zu flüssig.
Wasser ist ein Stoff, dessen Moleküle - obwohl leicht polar - klein genug sind, um direkt durch Phospholipid-Doppellamellen zu dringen (Permeabilität ~102-fach höher als für Glycerin und ~105-fach höher als für Glucose). Cholesterin erhöht die Durchlässigkeit von Lipid-Doppelschichten für Wasser, wahrscheinlich durch Disruption der Interaktion von Phospholipiden. Auf diese Weise steigt die Permeabilität der Zellmembran für Wasser, wenn ihr Cholesterinanteil erhöht wird. Schließlich steigt die Wasserpermeabilität durch Einlagerung von Aquaporinen ganz wesentlich, z.B. in resorbierenden Epithelien.
Die Zellmembran - als Trennfläche zwischen zellulärer "Außenwelt" (Interstitium) und "Innenwelt" (Zytoplasma) - enthält Proteinkomplexe für unterschiedliche Aufgaben:
 Mechanische
Interaktion mit ihrer Umgebung (Verankerung, Kraftübertragung)
Mechanische
Interaktion mit ihrer Umgebung (Verankerung, Kraftübertragung)
 Erkennung (immunologisch, über freie oder zellständige Rezeptoren)
Erkennung (immunologisch, über freie oder zellständige Rezeptoren)
 Signalvermittlung in die Zelle (über Rezeptoren, z.B. für Hormone, Transmitterstoffe; oder an gap junctions)
Signalvermittlung in die Zelle (über Rezeptoren, z.B. für Hormone, Transmitterstoffe; oder an gap junctions)
 Passage verschiedener Stoffe durch die Membran (Permeasen, Transporter, "Pumpen").
Passage verschiedener Stoffe durch die Membran (Permeasen, Transporter, "Pumpen").
Zellen müssen Information untereinander austauschen, um eine sinnvolle Interaktion zu erzielen. Dies kann elektrisch, oder mittels Informationsmolekülen im Rahmen eines direkten Zellkontaktes (juxtakrin), über kurze Distanz (in die Nachbarschaft der Zelle, z.B. über Neurotransmitter bzw. parakrin) oder über die Blutbahn auf größere Distanzen (endokrin) erfolgen. Voraussetzung für die Wirkung ist die Verfügbarkeit spezifischer Rezeptormoleküle, welche den Signalstoff binden und entsprechende Folgereaktionen auslösen können ( vgl. dort).
vgl. dort).
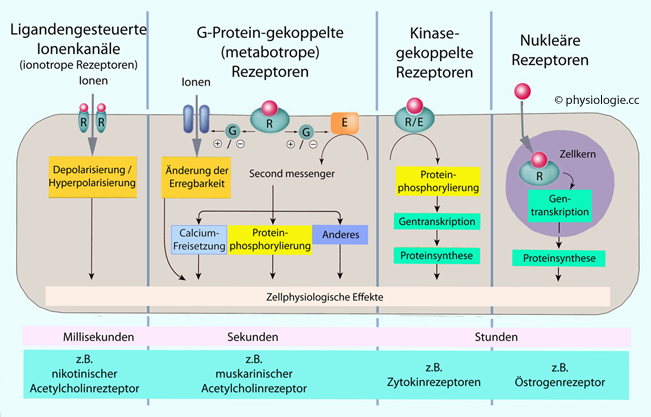
 Abbildung: Rezeptortypen
Abbildung: Rezeptortypen
Nach einer Vorlage in Rang & Dale's Pharmacology, 9th ed. 2020 (Elsevier)
Man unterscheidet nach ihrer grundsätzlichen Funktioneweise vier Rezeptorfamilien:
Ionenkanalgekoppelte (links): Bindung des Signalstoffs öffnet den Ionenkanal, es kommt zu Ioneneinstrom und Ladungsveränderung der Membran. Diese triggert innerhalb von Millisekunden zellphysiologische Effekte.
G-Protein-gekoppelte (daneben): Die (heptahelikalen Rezeptoren (mehrere hundert Arten bekannt) aktivieren das G-Protein-System und dieses "zweite Botenstoffe" (second messenger: cAMP, DG, IP3), welche über Ca++, Phosphorylierung von Zielproteinen o.a. innerhalb von Sekunden den Effekt auslösen.
Kinasegekoppelte Rezeptoren: Bindung des Signalstoffs führt zu Di- oder Tetramerisierung der Rezeptormoleküle, die selbst (Tyrosin-, Serin-, Threonin-) Kinase-Aktivität haben oder bei Aktivierung Tyrosinkinase anlagern. Sie phosphorylieren zelluläres Protein (Rezeptor- Proteinkinase, aktivieren Gene und Proteinsynthese. Dieser Vorgang nimmt Stunden in Anspruch.
Nukleäre (intrazelluläre) Rezeptoren: Signalstoffe (z.B. ein Steroid) diffundieren durch die Zellmembran und binden an intrazelluläre Rezeptoren, diese aktivieren DNA-Ablesung und Proteinsynthese

 Einen extrazellulären mit der ligandenbindenden Domäne, welche in den Extrazellulärraum vorragt und den Signalstoff (z.B. Peptid, Transmitter) bindet
Einen extrazellulären mit der ligandenbindenden Domäne, welche in den Extrazellulärraum vorragt und den Signalstoff (z.B. Peptid, Transmitter) bindet
 Einen transmembranalen
Teil (bei G-Protein-Rezeptoren 7 lipophile Aminosäuresequenzen), der
den Rezeptor in der Zellmembran verankert (bei ionenkanalgekoppelten
Rezeptoren enthält dieser Teil einen zentral gelegenen Kanal)
Einen transmembranalen
Teil (bei G-Protein-Rezeptoren 7 lipophile Aminosäuresequenzen), der
den Rezeptor in der Zellmembran verankert (bei ionenkanalgekoppelten
Rezeptoren enthält dieser Teil einen zentral gelegenen Kanal)
 Einen intrazellulären Teil mit seiner Effektordomäne, die ein Second-messenger-System aktivieren kann (Ausnahme Ionenkanal)
Einen intrazellulären Teil mit seiner Effektordomäne, die ein Second-messenger-System aktivieren kann (Ausnahme Ionenkanal)
Nach dem Wirkungsmechanismus unterscheidet man ligandenaktivierte Ionenkanäle, G-Protein-gekoppelte Rezeptoren und Kinasen ( s. dort).
s. dort).
 Intrazelluläre Rezeptoren binden den extrazellulären Signalstoff in der Zelle, binden dann ihrerseits an hormone response elements (HRE) der Zielgene und beeinflussen die Ablesung genetischer Information (Transkription).
Intrazelluläre Rezeptoren binden den extrazellulären Signalstoff in der Zelle, binden dann ihrerseits an hormone response elements (HRE) der Zielgene und beeinflussen die Ablesung genetischer Information (Transkription).
Die regulatorische Wirkung der Rezeptoraktivierung kann direkt an intrazellulären Zielmolekülen, an Enzymen, oder vermittels intrazellulärer Transducer (second messenger) erfolgen. Die Gesamtheit der involvierten Ionen und Moleküle wird als Signaltransduktionsweg oder Rezeptor-Effektor-System bezeichnet. Zahlreiche "Gerüst-" bzw. "Verankerungsproteine" begrenzen den Verbreitungs- bzw. Aktionsradius involvierter second messenger-Moleküle - z.B. von Calciumionen - auf einen eng begrenzten Raum in der Zelle (Kompartmentalisierung).
Viele Zielproteine werden bei Aktivierung der Signalkaskade phosphoryliert (ein Werk von Kinasen), und diese Phosphorylierung ist reversibel. So können zelluläre Funktionen je nach Bedarf gesteuert, der Phosphorylierungsgrad adaptiv eingestellt werden. Die Phosphorylierung wirkt entweder direkt auf Regulatorproteine (diese stellen die gewünschte Funktion ein), oder indirekt auf Transkriptionsfaktoren (diese steuern die Expression entsprechender Gene).

 Abbildung: Die zentrale Bedeutung von Kinasen in der Signaltransduktion
Abbildung: Die zentrale Bedeutung von Kinasen in der Signaltransduktion
Nach einer Vorlage in Ritter / Flower / Henderson / Loke / MacEwan / Rang, Rang & Dale's Pharmacology, 9th ed. Elsevier 2020

Eine wichtige Eigenschaft dieser Anordnungen ist die Möglichkeit zur Signalverstärkung. Extrazelluläre Liganden (z.B. Hormone) haben oft eine sehr geringe Konzentration (nano- bis mikromolar), und intrazelluläre Enzymkaskaden können eine molekulare Verstärkung über mehrere Zehnerpotenzen ergeben.
Die folgende Tabelle gibt Beispiele für Rezeptoren, ihre Zuordnung, Aktivatoren (Bindungspartner, Liganden) und second-messenger-Mechanismen (Effektoren):
Regulierung der Zahl und des Zustands von Rezeptoren
Zeitabhängigkeit. Zellen verändern ihr Funktionsprofil abhängig von Zeitablauf, vorhergehendem Zustand und anderen (vor allem äußeren) Begleitumständen. Das erklärt u.a. rhythmische Phänomene (Spontanentladung, biologische Rhythmen, Schlaf-Wach-Folge, fluktuierende Aufmerksamkeit, prä- vs. postprandialer Stoffwechsel ..). Die Hormonempfindlichkeit vieler Zellen ist zustands- und zeitabhängig: so werden hypophysäre Hormone nicht kontinuierlich, sondern "gepulst" an das Blut abgegeben und dadurch eine "frequenzmodulierte" Übereinstimmung mit der zeitabhängigen Empfindlichkeit der Zielzellen erreicht.
Hinauf- und Hinunterregulierung der Rezeptorzahl kann außer durch Endo- / Exozytose auch durch Veränderung der Proteinsynthese (Translation) beeinflusst werden (z.B. nimmt in Zellen schwangerer Frauen die GH-Rezeptor-mRNS-Konzentration zu). Der Rezeptor kann auch von der second-messenger-Kette entkoppelt und dadurch inaktiv gemacht werden (z.B. durch intrazelluläre Bindung von Arrestin an phosphorylierte Betarezeptoren). In jedem Fall nimmt die Empfindlichkeit der Zelle gegenüber dem betreffenden Signalstoff zu, wenn die Rezeptordichte / Rezeptoraktivität in der Membran steigt (z.B. die Dopaminrezeptordichte bei Mb. Parkinson: Sensitivierung) - oder sie nimmt ab, wenn die Rezeptordichte / Rezeptoraktivität sinkt (z.B. die Wachstumshormon-Rezeptorzahl bei niedrigem Blutzuckerspiegel: Desensitivierung).
Rezeptoren sind am Prozess der Endozytose beteiligt: Binden Stoffe (Liganden) an Rezeptoren, können diese eine Einstülpung der Membran (Clathrin-Mechanismus ) und Aufnahme des Liganden in die
Zelle bewirken (rezeptormediierte Endozytose). Beispielsweise erfolgt die Aufnahme von Eisen über Transferrinrezeptoren oder die von Lipiden über LDL-Rezeptoren.
Auch am Mechanismus der Übertragung hormoneller Signale an das
Zellinnere kann rezeptormediierte Endozytose beteiligt sein. Der
Mechanismus ist von der Zahl verfügbarer Rezeptoren abhängig und daher
sättigbar, andererseits werden endozytierte
Rezeptormoleküle an die Zelloberfläche recycelt.
) und Aufnahme des Liganden in die
Zelle bewirken (rezeptormediierte Endozytose). Beispielsweise erfolgt die Aufnahme von Eisen über Transferrinrezeptoren oder die von Lipiden über LDL-Rezeptoren.
Auch am Mechanismus der Übertragung hormoneller Signale an das
Zellinnere kann rezeptormediierte Endozytose beteiligt sein. Der
Mechanismus ist von der Zahl verfügbarer Rezeptoren abhängig und daher
sättigbar, andererseits werden endozytierte
Rezeptormoleküle an die Zelloberfläche recycelt.
Einige Rezeptoren sprechen auf intrazelluläre Signale an, wie Kaliumkanäle, die z.B. durch Ca++ oder durch sinkende ATP-Konzentration aktiviert werden. So kontrollieren IP3- und Ryanodin-Rezeptoren in der Membran des endoplasmatischen Retikulums die Mobilisierung intrazellulärer Ca++-Speicher.
Folgereaktionen: Signalstoffbindung an Rezeptoren löst Reaktionen der Zelle aus, wie z.B.
 Änderung der elektrischen
Ladung der Zellmembran
Änderung der elektrischen
Ladung der Zellmembran
 Bewegung
Bewegung
 Wachstum
Wachstum
 Zellteilung
Zellteilung
 Selbstentsorgung
(Apoptose)
Selbstentsorgung
(Apoptose)
 Abbildung).
Abbildung).In wässriger Lösung richten sich Phospholipide so aus, dass zuerst Monolayer, in höherer Konzentration Mizellen mit zweischichtigen Membranen entstehen:
 Außen liegt je eine hydrophile (polare, d.h. elektrisch asymmetrische),
Außen liegt je eine hydrophile (polare, d.h. elektrisch asymmetrische), in der Mitte eine lipophile (apolare) Zone.
in der Mitte eine lipophile (apolare) Zone. Diese Anordnung ergibt sich von selbst, die apolaren Gruppen (Fettsäuren) sind energiesparend vor einer Interaktion mit dem Lösungsmittel Wasser geschützt.

 Die hydrophilen "Kopfteile" der Phospholipide in Zellmembranen grenzen
beiderseits der Membran an wasserreiche Räume und bestimmen die
hydrophilen Oberflächen der Membran.
Die hydrophilen "Kopfteile" der Phospholipide in Zellmembranen grenzen
beiderseits der Membran an wasserreiche Räume und bestimmen die
hydrophilen Oberflächen der Membran. Die hydrophoben "Schwanzteile" (Fettsäuren) bauen die Innenschicht der Membranen auf, die wasserabweisend / lipophil ist.
Die hydrophoben "Schwanzteile" (Fettsäuren) bauen die Innenschicht der Membranen auf, die wasserabweisend / lipophil ist.Zellmembranen ermöglichen so die Separation verschiedener Reaktionsräume (Kompartimentierung), sowohl zwischen der Zelle und ihrer Umgebung (Zellmembran) wie auch in der Zelle: Organellen können Schichtform (flächenhafte Grenzstruktur: Zellmembran, Kernmembran, Mitochondrienmembran) oder Bläschenform annehmen (d.h. sie umschließen einen mehr oder weniger kugelförmigen Innenraum, der hauptsächlich aus Wasser besteht). In den dadurch aufgebauten Kompartimenten können Stoffe angereichert, oder aus ihnen evakuiert werden.
Sauerstoff-, Kohlendioxid-, Ammoniak- und zu einem gewissen Grad auch Wassermoleküle können die Zellmembran direkt passieren (vermutlich durch kurzfristig auftretende Spaltbildungen zwischen den Lipidketten). Die Durchgängigkeit der Membran für diese Moleküle ist biologisch äußerst bedeutsam (z.B. Atemgasautsausch), ihr Grad (Diffusionskonstante) hängt stark von der Zusammensetzung der jeweiligen Membran ab; Zellmembranen mit niedriger Fluidität (s. weiter unten) haben niedrige H2O-Permeabilität.
Zu den Phospholipiden gehören Glycerophosphatide (Abbildungen) und Sphingosinderivate (hier verankert der zweiwertige Aminoalkohol Sphingosin Fettsäuren, Phosphate und Zucker). Die Zusammensetzung der Membranen aus diesen Elementen bestimmt ihre physikalischen (z.B. Dicke, Flexibilität) und chemischen Eigenschaften. Während Proteine gar nicht, und einzelne Lipidmoleküle wegen des hohen erforderlichen Energieaufwands nur sehr selten von einer Membranschicht in die andere wechseln, sind die Moleküle innerhalb ihrer Schicht frei beweglich: So kann in der Erythrozytenmembran ein Lipidmolekül durch Lateralbewegung die gesamte Zelle in wenigen Sekunden vollständig umrunden. Das Ausmaß dieser Lateraldiffusion steigt mit der Temperatur an.
Ein Wechsel von Lipiden von einer Membranschicht in die andere (flip-flop) ist wegen der hydrophilen Kopfteile von Membranlipiden durch die hydrophobe Mittelschicht nur schwer zu bewerkstelligen (hoher Energieaufwand). Daher bedarf es spezieller Enzyme (Flippasen), das sind Transmembran- Transporterproteine, die eine Verlagerung von Phospholipiden zwischen den beiden Schichten einer Zellmembran erleichtern - was im Rahmen von Wachstums- und Mobilitätsvorgängen notwendig werden kann. Einige Flippasen arbeiten energieunabhängig in beiden Richtungen, andere energieabhängig (ATPasen) unidirektional. Transporter von der zytosolischen zur exoplasmatischen Seite der Membran werden auch als "Floppasen" bezeichnet.
Viele Zellen verteilen das Muster ihrer Phospholipide unterschiedlich (zytosolisch vs. exoplasmatisch), und eine Angleichung dieser biochemischen Zusammensetzung kann als Apoptosemarker fungieren.

 Abbildung: Phasenübergang in Lipid-Doppellamelle
Abbildung: Phasenübergang in Lipid-DoppellamelleNach Stein WD, Litman T, in: Channels, Carriers, and Pumps, 2nd ed 2015
Übergang vom geordneten gelartigen (links) zum eher ungeordneten solartigen Zustand (rechts).
Bei der Übergangstemperatur Tm "schmilzt" die Membran, in diesem Temperaturbeeich koexistieren beide Phasen
Bei der Übergangstemperatur Tm "schmilzt" die Membran, in diesem Temperaturbeeich koexistieren beide Phasen

 Abbildung).
Bei Temperaturen unter [Tm] wird die Membran rigide (semikristallin).
Abbildung).
Bei Temperaturen unter [Tm] wird die Membran rigide (semikristallin).Die Übergangstemperatur kann je nach Länge der Fettsäuren über oder unter der Körpertemperatur liegen. Allerdings ist bei komplexer Zusammensetzung der Membran keine klare Übergangstemperatur definierbar, vielmehr ergibt sich ein Temperaturbereich, in dem der Sol-Gel-Zustand kontinuierlich variiert, und gel-ähnliche mit benachbarten sol-ähnlichen Zonen koexistieren können.
Sowohl Muster als auch Konzentration ihrer Bestandteile bestimmt die Fluidität der Membran:
 Ist sie reich an Phospholipiden
mit langen, weitgehend oder gänzlich gesättigten Fettsäuren (wenige bis
keine Doppelbindungen), dann ist sie dicht gepackt, weniger beweglich,
weist geringe Fluidität auf und läßt wenig Wassermoleküle passieren.
Steigender Anteil
an Doppelbindungen (ungesättigte Fettsäuren) und/oder kürzere
Fettsäureketten verschieben den
Zustand in Richtung höherer Fluidität, die Membran wird nachgiebiger
und gleichzeitig durchlässiger für Wassermoleküle.
Ist sie reich an Phospholipiden
mit langen, weitgehend oder gänzlich gesättigten Fettsäuren (wenige bis
keine Doppelbindungen), dann ist sie dicht gepackt, weniger beweglich,
weist geringe Fluidität auf und läßt wenig Wassermoleküle passieren.
Steigender Anteil
an Doppelbindungen (ungesättigte Fettsäuren) und/oder kürzere
Fettsäureketten verschieben den
Zustand in Richtung höherer Fluidität, die Membran wird nachgiebiger
und gleichzeitig durchlässiger für Wassermoleküle. Cholesterin
mit seinem rigiden Steroidring senkt (in mäßiger Konzentration) die Fluidität und trägt zur Festigkeit der Membran bei. Bei Membranen mit einem hohen Anteil an ungesättigten Fettsäuren steigert Cholesterin andererseits die (ohnehin hohe) Membranfluidität, indem es sich in
Lücken zwischen den Lipidschweifen einlagert. Insgesamt reduziert
Cholesterin temperaturbedingte Änderungen der Membranfluidität.
Cholesterin
mit seinem rigiden Steroidring senkt (in mäßiger Konzentration) die Fluidität und trägt zur Festigkeit der Membran bei. Bei Membranen mit einem hohen Anteil an ungesättigten Fettsäuren steigert Cholesterin andererseits die (ohnehin hohe) Membranfluidität, indem es sich in
Lücken zwischen den Lipidschweifen einlagert. Insgesamt reduziert
Cholesterin temperaturbedingte Änderungen der Membranfluidität. 
 Gesättigte Fettsäuren senken, ungesättigte steigern die Fluidität der Membran.
Gesättigte Fettsäuren senken, ungesättigte steigern die Fluidität der Membran. Cholesterin in einer fluiden Membran senkt die Fluidität, in einer rigiden Membran steigert es sie.
Cholesterin in einer fluiden Membran senkt die Fluidität, in einer rigiden Membran steigert es sie. Liegt die Temperatur unter dem Betrag von Tm, ist die Membran rigide (semikristallin); liegt sie deutlich darüber, wird die Membran zu flüssig.
Liegt die Temperatur unter dem Betrag von Tm, ist die Membran rigide (semikristallin); liegt sie deutlich darüber, wird die Membran zu flüssig.Wasser ist ein Stoff, dessen Moleküle - obwohl leicht polar - klein genug sind, um direkt durch Phospholipid-Doppellamellen zu dringen (Permeabilität ~102-fach höher als für Glycerin und ~105-fach höher als für Glucose). Cholesterin erhöht die Durchlässigkeit von Lipid-Doppelschichten für Wasser, wahrscheinlich durch Disruption der Interaktion von Phospholipiden. Auf diese Weise steigt die Permeabilität der Zellmembran für Wasser, wenn ihr Cholesterinanteil erhöht wird. Schließlich steigt die Wasserpermeabilität durch Einlagerung von Aquaporinen ganz wesentlich, z.B. in resorbierenden Epithelien.
Die Zellmembran - als Trennfläche zwischen zellulärer "Außenwelt" (Interstitium) und "Innenwelt" (Zytoplasma) - enthält Proteinkomplexe für unterschiedliche Aufgaben:
 Mechanische
Interaktion mit ihrer Umgebung (Verankerung, Kraftübertragung)
Mechanische
Interaktion mit ihrer Umgebung (Verankerung, Kraftübertragung) Erkennung (immunologisch, über freie oder zellständige Rezeptoren)
Erkennung (immunologisch, über freie oder zellständige Rezeptoren) Signalvermittlung in die Zelle (über Rezeptoren, z.B. für Hormone, Transmitterstoffe; oder an gap junctions)
Signalvermittlung in die Zelle (über Rezeptoren, z.B. für Hormone, Transmitterstoffe; oder an gap junctions) Passage verschiedener Stoffe durch die Membran (Permeasen, Transporter, "Pumpen").
Passage verschiedener Stoffe durch die Membran (Permeasen, Transporter, "Pumpen"). Zellen müssen Information untereinander austauschen, um eine sinnvolle Interaktion zu erzielen. Dies kann elektrisch, oder mittels Informationsmolekülen im Rahmen eines direkten Zellkontaktes (juxtakrin), über kurze Distanz (in die Nachbarschaft der Zelle, z.B. über Neurotransmitter bzw. parakrin) oder über die Blutbahn auf größere Distanzen (endokrin) erfolgen. Voraussetzung für die Wirkung ist die Verfügbarkeit spezifischer Rezeptormoleküle, welche den Signalstoff binden und entsprechende Folgereaktionen auslösen können (
 vgl. dort).
vgl. dort).Rezeptormoleküle ermöglichen die Entschlüsselung extrazellulärer Information
 Unter Rezeptoren
Unter Rezeptoren  im
zellphysiologischen / pharmakologischen Sinne versteht man Moleküle
oder Molekülkomplexe, die spezifisch körpereigene (Hormone,
Transmitter, Mediatoren, Zytokine) oder von außen in den Organismus
eingebrachte Signalstoffe (Pharmaka) binden und auf die Bindung mit der
Aktivierung eines intrazellulären Signalweges reagieren.
im
zellphysiologischen / pharmakologischen Sinne versteht man Moleküle
oder Molekülkomplexe, die spezifisch körpereigene (Hormone,
Transmitter, Mediatoren, Zytokine) oder von außen in den Organismus
eingebrachte Signalstoffe (Pharmaka) binden und auf die Bindung mit der
Aktivierung eines intrazellulären Signalweges reagieren.
Sowohl die Interaktion von Rezeptoren mit ihren Bindungspartnern (auf den Rezeptor einwirkender Reiz, "Input") als auch die Wirkungen, die sie in der Zelle auslösen ("Output" des Rezeptors), sind vielfältig. Es gibt eine Fülle von Kombinationsmöglichkeiten, wie einerseits ein bestimmter Signalstoff auf diverse Rezeptoren (meist unterschiedlich) wirkt und andererseits Rezeptoren von verschiedenen Signalstoffen beeinflusst werden.
Die Bindung eines Liganden an einen Rezeptor "besetzt" diesen (occupancy); die Affinität bestimmt den Grad der "Belegung" des Rezeptors durch den Liganden. Die Anlagerung kann den Rezeptor aktivieren (d.h. sie löst eine zelluläre Antwort aus), muss es aber nicht (wenn der Ligand keine intrinsische Aktivität zur Folge hat). So unterscheidet man - was die Wirkung des Liganden (z.B. ein Hormonmolekül) auf den Rezepor betrifft -
 die Affinität, d.h. die Tendenz zum Aufbau einer Ligand-Rezeptor-Bindung (je nach Ligand-Rezeptor-Kombination verschieden), von der
die Affinität, d.h. die Tendenz zum Aufbau einer Ligand-Rezeptor-Bindung (je nach Ligand-Rezeptor-Kombination verschieden), von der
 intrinsischen Aktivität (auch efficacy),
ein Maß für die Wirkintensität (z.B. Freisetzung "sekundärer"
Botenstoffe), die auf die Ligandenbindung an den Rezeptor folgt. Diese
Wirkung kann unterschiedlich stark ausfallen, je nach der Zahl
aktivierter Rezeptoren, der Art gebundener Signalstoffe (Agonisten) und
sonstigen Begleitumständen. Man kann die intrinsische Aktivität
quantifizieren (e) als den Kehrwert der Rezeptorbelegung, bei der 50% der maximalen biologischen Wirkung auftrittt, zum Beispiel:
intrinsischen Aktivität (auch efficacy),
ein Maß für die Wirkintensität (z.B. Freisetzung "sekundärer"
Botenstoffe), die auf die Ligandenbindung an den Rezeptor folgt. Diese
Wirkung kann unterschiedlich stark ausfallen, je nach der Zahl
aktivierter Rezeptoren, der Art gebundener Signalstoffe (Agonisten) und
sonstigen Begleitumständen. Man kann die intrinsische Aktivität
quantifizieren (e) als den Kehrwert der Rezeptorbelegung, bei der 50% der maximalen biologischen Wirkung auftrittt, zum Beispiel:
 Die Hälfte der maximalen Wirkung tritt bei einer Rezeptorbelegung von 4% auf. Der Betrag für e ist dann 25 (1/0,04).
Die Hälfte der maximalen Wirkung tritt bei einer Rezeptorbelegung von 4% auf. Der Betrag für e ist dann 25 (1/0,04).
Die biologische Wirkung ist sowohl von der Affinität am Rezeptor als auch vom Betrag der intrinsischen Aktivität (efficacy) bestimmt. Untersucht man nur das Bindungsverhalten eines Signalstoffs an seine Rezeptoren, ohne dass man die intrinsische Aktivität kennt, läßt sich daraus noch kein quantitativer Aufschluss über Effekte auf physiologische Größen wie z.B. Blutdruck, Darmmotorik, Bronchienweite usw. gewinnen.
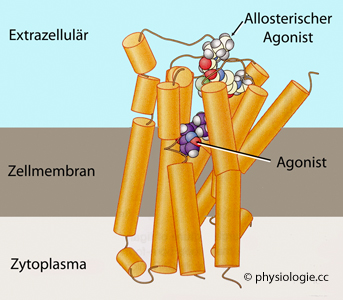
 Abbildung: Muskarinischer Rezeptor (M2)
Abbildung: Muskarinischer Rezeptor (M2)
Modifiziert nach einer Vorlage in Ritter / Flower / Henderson / Loke / MacEwan / Rang, Rang & Dale's Pharmacology, 9th ed. Elsevier 2020

Auch kommt es oft zu einem Wettstreit verschiedener Liganden um einen Rezeptor (Kompetition um die Bindungsstelle). Meist sind mehrere potenzielle Bindungspartner für Rezeptoren vorhanden (das Bindungsmuster hängt von mehreren Faktoren ab), und die Zahl der Rezeptoren fluktuiert ebenfalls (z.B. kann die Zahl freier Rezeptoren in der Zellmembran hinauf- oder hinunterreguliert und damit das Ansprechverhalten der Zelle verändert werden).
Beispielsweise nimmt die Zahl der Acetylcholinrezeptoren an der motorischen Endplatte bei Wegfall regelmäßiger Nervenentladungen zu (Denervierungs-Hypersensibilität). Oder es nimmt die Zahl von Hormonrezeptoren von Zellen ab, die für längere Zeit hoher Hormonkonzentration ausgesetzt sind (Desensibilisierung durch Herunterregulierung der Zahl verfügbarer Rezeptoren). Solche adaptiven Mechanismen bestehen sowohl gegenüber physiologischen Signalstoffen als auch gegenüber Medikamenten.
Liganden (an den Rezeptor koppelnde Stoffe) können zelluläre Reaktionen fördern oder auch hemmen:
 Agonisten sind Liganden, welche die erzielte (erwartete) Wirkung in der Zelle hervorrufen. "Traditionelle" Agonisten docken an eine bestimmte Bindungsstelle des Rezeptormoleküls (orthosterisch) an. An diese Stelle binden auch
Agonisten sind Liganden, welche die erzielte (erwartete) Wirkung in der Zelle hervorrufen. "Traditionelle" Agonisten docken an eine bestimmte Bindungsstelle des Rezeptormoleküls (orthosterisch) an. An diese Stelle binden auch
 Antagonisten,
das sind Liganden, die ebenfalls orthosterisch binden, aber den
Rezeptor nicht aktivieren (und durch die Besetzung des Rezeptors die
Signalübertragung blockieren). Der Grund
für die Wirkungslosigkeit des Antagonisten kann unterschiedlich
sein (manche Liganden können - je nach Umständen - einmal als Agonisten, einmal
als Antagonisten wirken).
Antagonisten,
das sind Liganden, die ebenfalls orthosterisch binden, aber den
Rezeptor nicht aktivieren (und durch die Besetzung des Rezeptors die
Signalübertragung blockieren). Der Grund
für die Wirkungslosigkeit des Antagonisten kann unterschiedlich
sein (manche Liganden können - je nach Umständen - einmal als Agonisten, einmal
als Antagonisten wirken).
Moleküle können auch andere Bindungsstellen des Rezeptors nutzen (allosterisch) als dies Agonisten / Antagonisten tun (orthosterisch) - und gegebenenfalls auch von hier aus zelluläre Wirkung ausüben ( Abbildung).
Abbildung).

 Abbildung: Allosterische Modulation
Abbildung: Allosterische Modulation
Nach einer Vorlage in Ritter / Flower / Henderson / Loke / MacEwan / Rang, Rang & Dale's Pharmacology, 9th ed. Elsevier 2020

 Pharmaka wirken in aller Regel über Rezeptoren. Hochwirksame Medikamente zeigen eine hohe Affinität
für "ihren" Rezeptor (sie besetzen schon bei niedriger Konzentration
einen entsprechend hohen Anteil der Rezeptoren) und entfalten dabei
maximale intrinsische Wirksamkeit - man nennt sie volle Agonisten (full agonist). Pharmaka, die bei hoher Rezeptorbesetzung nur einen Teil der biologischen Maximalwirkung auslösen, nennt man dagegen Teilagonisten (partial agonist). Pharmaka, welche die Signalübertragung am Rezeptor blockieren, sind Antagonisten.
Pharmaka wirken in aller Regel über Rezeptoren. Hochwirksame Medikamente zeigen eine hohe Affinität
für "ihren" Rezeptor (sie besetzen schon bei niedriger Konzentration
einen entsprechend hohen Anteil der Rezeptoren) und entfalten dabei
maximale intrinsische Wirksamkeit - man nennt sie volle Agonisten (full agonist). Pharmaka, die bei hoher Rezeptorbesetzung nur einen Teil der biologischen Maximalwirkung auslösen, nennt man dagegen Teilagonisten (partial agonist). Pharmaka, welche die Signalübertragung am Rezeptor blockieren, sind Antagonisten.
Rezeptoren wirken sich oft auf mehr als nur einen intrazellulären Second-messenger-Mechanismus aus. Unterschiedliche Liganden können dabei - über den gleichen Rezeptor - unterschiedliche Beiträge dieser Signalwege zur zellulären Reizantwort bewirken. Sie haben dann eine "Vorliebe" für die Aktivierung eines bestimmten intrazellulären Signalweges (biased agonism).
Manchmal üben Rezeptoren zelluläre Effekte aus, ohne dass sie Liganden gebunden haben. Man nennt diese Form der "spontanen" Aktivierung eines Signalweges konstitutiv.
Rezeptormoleküle können jeweils einer Rezeptor-Superfamilie zugeordnet werden. Sie sind in der Zellmembran oder intrazellulär positioniert und lösen in Folge der Bindung eines Agonisten bestimmte Wirkungen in der Zelle aus ( Abbildung).
Abbildung).
 Unter Rezeptoren
Unter Rezeptoren  im
zellphysiologischen / pharmakologischen Sinne versteht man Moleküle
oder Molekülkomplexe, die spezifisch körpereigene (Hormone,
Transmitter, Mediatoren, Zytokine) oder von außen in den Organismus
eingebrachte Signalstoffe (Pharmaka) binden und auf die Bindung mit der
Aktivierung eines intrazellulären Signalweges reagieren.
im
zellphysiologischen / pharmakologischen Sinne versteht man Moleküle
oder Molekülkomplexe, die spezifisch körpereigene (Hormone,
Transmitter, Mediatoren, Zytokine) oder von außen in den Organismus
eingebrachte Signalstoffe (Pharmaka) binden und auf die Bindung mit der
Aktivierung eines intrazellulären Signalweges reagieren. Sowohl die Interaktion von Rezeptoren mit ihren Bindungspartnern (auf den Rezeptor einwirkender Reiz, "Input") als auch die Wirkungen, die sie in der Zelle auslösen ("Output" des Rezeptors), sind vielfältig. Es gibt eine Fülle von Kombinationsmöglichkeiten, wie einerseits ein bestimmter Signalstoff auf diverse Rezeptoren (meist unterschiedlich) wirkt und andererseits Rezeptoren von verschiedenen Signalstoffen beeinflusst werden.
Die Bindung eines Liganden an einen Rezeptor "besetzt" diesen (occupancy); die Affinität bestimmt den Grad der "Belegung" des Rezeptors durch den Liganden. Die Anlagerung kann den Rezeptor aktivieren (d.h. sie löst eine zelluläre Antwort aus), muss es aber nicht (wenn der Ligand keine intrinsische Aktivität zur Folge hat). So unterscheidet man - was die Wirkung des Liganden (z.B. ein Hormonmolekül) auf den Rezepor betrifft -
 die Affinität, d.h. die Tendenz zum Aufbau einer Ligand-Rezeptor-Bindung (je nach Ligand-Rezeptor-Kombination verschieden), von der
die Affinität, d.h. die Tendenz zum Aufbau einer Ligand-Rezeptor-Bindung (je nach Ligand-Rezeptor-Kombination verschieden), von der intrinsischen Aktivität (auch efficacy),
ein Maß für die Wirkintensität (z.B. Freisetzung "sekundärer"
Botenstoffe), die auf die Ligandenbindung an den Rezeptor folgt. Diese
Wirkung kann unterschiedlich stark ausfallen, je nach der Zahl
aktivierter Rezeptoren, der Art gebundener Signalstoffe (Agonisten) und
sonstigen Begleitumständen. Man kann die intrinsische Aktivität
quantifizieren (e) als den Kehrwert der Rezeptorbelegung, bei der 50% der maximalen biologischen Wirkung auftrittt, zum Beispiel:
intrinsischen Aktivität (auch efficacy),
ein Maß für die Wirkintensität (z.B. Freisetzung "sekundärer"
Botenstoffe), die auf die Ligandenbindung an den Rezeptor folgt. Diese
Wirkung kann unterschiedlich stark ausfallen, je nach der Zahl
aktivierter Rezeptoren, der Art gebundener Signalstoffe (Agonisten) und
sonstigen Begleitumständen. Man kann die intrinsische Aktivität
quantifizieren (e) als den Kehrwert der Rezeptorbelegung, bei der 50% der maximalen biologischen Wirkung auftrittt, zum Beispiel: Die Hälfte der maximalen Wirkung tritt bei einer Rezeptorbelegung von 4% auf. Der Betrag für e ist dann 25 (1/0,04).
Die Hälfte der maximalen Wirkung tritt bei einer Rezeptorbelegung von 4% auf. Der Betrag für e ist dann 25 (1/0,04).Die biologische Wirkung ist sowohl von der Affinität am Rezeptor als auch vom Betrag der intrinsischen Aktivität (efficacy) bestimmt. Untersucht man nur das Bindungsverhalten eines Signalstoffs an seine Rezeptoren, ohne dass man die intrinsische Aktivität kennt, läßt sich daraus noch kein quantitativer Aufschluss über Effekte auf physiologische Größen wie z.B. Blutdruck, Darmmotorik, Bronchienweite usw. gewinnen.

 Abbildung: Muskarinischer Rezeptor (M2)
Abbildung: Muskarinischer Rezeptor (M2)Modifiziert nach einer Vorlage in Ritter / Flower / Henderson / Loke / MacEwan / Rang, Rang & Dale's Pharmacology, 9th ed. Elsevier 2020
Der Agonist
(hier: Acetylcholin) koppelt an die "klassische" (orthosterische)
Bindungsstelle, Modulatoren - wie in diesem Beispiel ein Agonist -
wirken an "allosterischen" Orten des Rezeptors (s. weiter unten).
Das Bild zeigt einen Ausschnitt des Rezeptormoleküls (den mittleren, vor allem transmembranalen Abschnitt, nicht die vollen N- (extrazellulär) und C-terminalen (intrazellulär) Domänen und auch nicht den 3. intrazellulären Loop)
Das Bild zeigt einen Ausschnitt des Rezeptormoleküls (den mittleren, vor allem transmembranalen Abschnitt, nicht die vollen N- (extrazellulär) und C-terminalen (intrazellulär) Domänen und auch nicht den 3. intrazellulären Loop)

Auch kommt es oft zu einem Wettstreit verschiedener Liganden um einen Rezeptor (Kompetition um die Bindungsstelle). Meist sind mehrere potenzielle Bindungspartner für Rezeptoren vorhanden (das Bindungsmuster hängt von mehreren Faktoren ab), und die Zahl der Rezeptoren fluktuiert ebenfalls (z.B. kann die Zahl freier Rezeptoren in der Zellmembran hinauf- oder hinunterreguliert und damit das Ansprechverhalten der Zelle verändert werden).
Beispielsweise nimmt die Zahl der Acetylcholinrezeptoren an der motorischen Endplatte bei Wegfall regelmäßiger Nervenentladungen zu (Denervierungs-Hypersensibilität). Oder es nimmt die Zahl von Hormonrezeptoren von Zellen ab, die für längere Zeit hoher Hormonkonzentration ausgesetzt sind (Desensibilisierung durch Herunterregulierung der Zahl verfügbarer Rezeptoren). Solche adaptiven Mechanismen bestehen sowohl gegenüber physiologischen Signalstoffen als auch gegenüber Medikamenten.
Liganden (an den Rezeptor koppelnde Stoffe) können zelluläre Reaktionen fördern oder auch hemmen:
 Agonisten sind Liganden, welche die erzielte (erwartete) Wirkung in der Zelle hervorrufen. "Traditionelle" Agonisten docken an eine bestimmte Bindungsstelle des Rezeptormoleküls (orthosterisch) an. An diese Stelle binden auch
Agonisten sind Liganden, welche die erzielte (erwartete) Wirkung in der Zelle hervorrufen. "Traditionelle" Agonisten docken an eine bestimmte Bindungsstelle des Rezeptormoleküls (orthosterisch) an. An diese Stelle binden auch Antagonisten,
das sind Liganden, die ebenfalls orthosterisch binden, aber den
Rezeptor nicht aktivieren (und durch die Besetzung des Rezeptors die
Signalübertragung blockieren). Der Grund
für die Wirkungslosigkeit des Antagonisten kann unterschiedlich
sein (manche Liganden können - je nach Umständen - einmal als Agonisten, einmal
als Antagonisten wirken).
Antagonisten,
das sind Liganden, die ebenfalls orthosterisch binden, aber den
Rezeptor nicht aktivieren (und durch die Besetzung des Rezeptors die
Signalübertragung blockieren). Der Grund
für die Wirkungslosigkeit des Antagonisten kann unterschiedlich
sein (manche Liganden können - je nach Umständen - einmal als Agonisten, einmal
als Antagonisten wirken).Nach dem "Zwei-Zustands-Modell" (two-state model) liegen Rezeptoren in einer von zwei Konformationen vor - entweder in einem Ruhezustand (resting state) oder in einem aktivierten Zustand (activated state).
Zwischen diesen beiden Zustanden gibt es ein Äquilibrium. Ohne die
Anwesenheit eines Liganden liegt das Zustandsgleichgewicht beim
Ruhezustand. Agonisten haben nach diesem Modell höhere Affinität zum aktivierten Rezeptor, inverse Agonisten zum Rezeptor im Ruhezustand. Ein sogenannter neutraler Antagonist
hat dieser Vorstellung zufolge zu beiden Zuständen gleiche Affinität,
blockiert aber durch seine Anwesenheit kompetitiv die Bindung anderer
Liganden an den Rezeptor.
Moleküle können auch andere Bindungsstellen des Rezeptors nutzen (allosterisch) als dies Agonisten / Antagonisten tun (orthosterisch) - und gegebenenfalls auch von hier aus zelluläre Wirkung ausüben (
 Abbildung).
Abbildung).
 Abbildung: Allosterische Modulation
Abbildung: Allosterische ModulationNach einer Vorlage in Ritter / Flower / Henderson / Loke / MacEwan / Rang, Rang & Dale's Pharmacology, 9th ed. Elsevier 2020
Als Agonisten (grün) bezeichnete Signalstoffe koppeln an eine "klassische", sogenannte orthosterische Bindungsstelle des Rezeptors und üben von dort "orthosterischen Agonismus" aus.
"Allosterische" Liganden (rot) nutzen andere Bindungsstellen am Rezeptormolekül. Von dort aus können sie allosterischen Agonismus auf die Zellfunktionen ausüben, aber auch die Wirkung des Agonisten beeinflussen, indem sie die Affinität seiner Bindung an den Rezeptor oder seine intrinsische Aktivität (efficacy) beeinflussen
"Allosterische" Liganden (rot) nutzen andere Bindungsstellen am Rezeptormolekül. Von dort aus können sie allosterischen Agonismus auf die Zellfunktionen ausüben, aber auch die Wirkung des Agonisten beeinflussen, indem sie die Affinität seiner Bindung an den Rezeptor oder seine intrinsische Aktivität (efficacy) beeinflussen

 Pharmaka wirken in aller Regel über Rezeptoren. Hochwirksame Medikamente zeigen eine hohe Affinität
für "ihren" Rezeptor (sie besetzen schon bei niedriger Konzentration
einen entsprechend hohen Anteil der Rezeptoren) und entfalten dabei
maximale intrinsische Wirksamkeit - man nennt sie volle Agonisten (full agonist). Pharmaka, die bei hoher Rezeptorbesetzung nur einen Teil der biologischen Maximalwirkung auslösen, nennt man dagegen Teilagonisten (partial agonist). Pharmaka, welche die Signalübertragung am Rezeptor blockieren, sind Antagonisten.
Pharmaka wirken in aller Regel über Rezeptoren. Hochwirksame Medikamente zeigen eine hohe Affinität
für "ihren" Rezeptor (sie besetzen schon bei niedriger Konzentration
einen entsprechend hohen Anteil der Rezeptoren) und entfalten dabei
maximale intrinsische Wirksamkeit - man nennt sie volle Agonisten (full agonist). Pharmaka, die bei hoher Rezeptorbesetzung nur einen Teil der biologischen Maximalwirkung auslösen, nennt man dagegen Teilagonisten (partial agonist). Pharmaka, welche die Signalübertragung am Rezeptor blockieren, sind Antagonisten.Rezeptoren wirken sich oft auf mehr als nur einen intrazellulären Second-messenger-Mechanismus aus. Unterschiedliche Liganden können dabei - über den gleichen Rezeptor - unterschiedliche Beiträge dieser Signalwege zur zellulären Reizantwort bewirken. Sie haben dann eine "Vorliebe" für die Aktivierung eines bestimmten intrazellulären Signalweges (biased agonism).
Manchmal üben Rezeptoren zelluläre Effekte aus, ohne dass sie Liganden gebunden haben. Man nennt diese Form der "spontanen" Aktivierung eines Signalweges konstitutiv.
Rezeptormoleküle können jeweils einer Rezeptor-Superfamilie zugeordnet werden. Sie sind in der Zellmembran oder intrazellulär positioniert und lösen in Folge der Bindung eines Agonisten bestimmte Wirkungen in der Zelle aus (
 Abbildung).
Abbildung).
 Abbildung: Rezeptortypen
Abbildung: RezeptortypenNach einer Vorlage in Rang & Dale's Pharmacology, 9th ed. 2020 (Elsevier)
Ionenkanalgekoppelte (links): Bindung des Signalstoffs öffnet den Ionenkanal, es kommt zu Ioneneinstrom und Ladungsveränderung der Membran. Diese triggert innerhalb von Millisekunden zellphysiologische Effekte.
G-Protein-gekoppelte (daneben): Die (heptahelikalen Rezeptoren (mehrere hundert Arten bekannt) aktivieren das G-Protein-System und dieses "zweite Botenstoffe" (second messenger: cAMP, DG, IP3), welche über Ca++, Phosphorylierung von Zielproteinen o.a. innerhalb von Sekunden den Effekt auslösen.
Kinasegekoppelte Rezeptoren: Bindung des Signalstoffs führt zu Di- oder Tetramerisierung der Rezeptormoleküle, die selbst (Tyrosin-, Serin-, Threonin-) Kinase-Aktivität haben oder bei Aktivierung Tyrosinkinase anlagern. Sie phosphorylieren zelluläres Protein (Rezeptor- Proteinkinase, aktivieren Gene und Proteinsynthese. Dieser Vorgang nimmt Stunden in Anspruch.
Nukleäre (intrazelluläre) Rezeptoren: Signalstoffe (z.B. ein Steroid) diffundieren durch die Zellmembran und binden an intrazelluläre Rezeptoren, diese aktivieren DNA-Ablesung und Proteinsynthese

Man unterscheidet am
Rezeptor zwei Domänen: Eine ligandenbindende (sie erkennt und bindet spezifisch Signalstoffe) und eine Effektordomäne
(ihre Aktivierung führt zum entsprechenden zellulären Effekt -  Abbildung). Bei membrangebundenen Rezeptoren befindet sich die
ligandenbindende Domäne auf der extrazellulären Seite der Zellmembran; die Effektordomäne liegt immer intrazellulär. (Bei intrazellulären Rezeptoren befiunden sich naturgemäß beide Teile in der Zelle.)
Abbildung). Bei membrangebundenen Rezeptoren befindet sich die
ligandenbindende Domäne auf der extrazellulären Seite der Zellmembran; die Effektordomäne liegt immer intrazellulär. (Bei intrazellulären Rezeptoren befiunden sich naturgemäß beide Teile in der Zelle.)
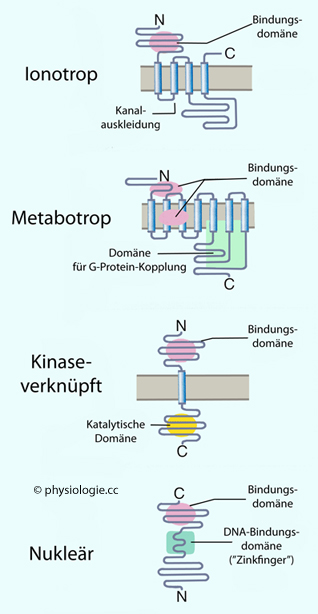
 Abbildung: Generelle Struktur der vier Rezeptorfamilien
Abbildung: Generelle Struktur der vier Rezeptorfamilien
Nach einer Vorlage in Rang & Dale's Pharmacology, 9th ed. 2020 (Elsevier)
 Membranständige Rezeptoren verfügen über drei Teile:
Membranständige Rezeptoren verfügen über drei Teile:
 Abbildung). Bei membrangebundenen Rezeptoren befindet sich die
ligandenbindende Domäne auf der extrazellulären Seite der Zellmembran; die Effektordomäne liegt immer intrazellulär. (Bei intrazellulären Rezeptoren befiunden sich naturgemäß beide Teile in der Zelle.)
Abbildung). Bei membrangebundenen Rezeptoren befindet sich die
ligandenbindende Domäne auf der extrazellulären Seite der Zellmembran; die Effektordomäne liegt immer intrazellulär. (Bei intrazellulären Rezeptoren befiunden sich naturgemäß beide Teile in der Zelle.)
 Abbildung: Generelle Struktur der vier Rezeptorfamilien
Abbildung: Generelle Struktur der vier RezeptorfamilienNach einer Vorlage in Rang & Dale's Pharmacology, 9th ed. 2020 (Elsevier)
Alle Rezeptoren sind Proteine. Die blau gefärbten Zylinder symbolisieren α-helikale (hydrophobe) Aminosäuresequenzen (~20 AS), die sich in die Zellmembran einlagern (s. oben) und den Rezeptor hier verankern.
Ionotrope Rezeptoren sind ligandenaktivierte Ionenkanäle (das gezeigte Beispiel entspricht dem nikotinischen Acetylcholinrezeptor). Die Rezeptoren können tri-, tetra- oder pentamer sein (aus 3-5 Proteinmolekülen bestehen), d.h. es liegen pro Ionenkanal bis zu 20 membranüberspannende Sequenzen vor.
Metabotrope Rezeptoren funktionieren G-Protein-gekoppelt (GPCRs: G protein-coupled receptors). Die Bindungsdomäne kann eine von zwei verschiedenen Positionen im Molekül einnehmen (beide gleichzeitig dargestellt): Peptide binden eher an die extrazelluläre, kleine Signalmoleküle eher an die intramembranale Domäne. Die Domäne für die Bindung des G-Proteins liegt auf der intrazellulären Molekülseite.
Kinaseverknüpfte Rezeptoren beherbergen oft eine Bindungsdomäne (extrazellulär) und eine katalytische Domäne (intrazellulär) im selben Molekül, z.B. Wachstumsfaktoren. Hingegen haben Zytokinrezeptoren keine eigene Kinasedomäne, sondern aktivieren Enzyme aus dem Zytoplasma.
Nukleäre Rezeptoren aktivieren - soferne sie "ihren" Signalstoff binden - die Ablesung von Genen im Zellkern
Ionotrope Rezeptoren sind ligandenaktivierte Ionenkanäle (das gezeigte Beispiel entspricht dem nikotinischen Acetylcholinrezeptor). Die Rezeptoren können tri-, tetra- oder pentamer sein (aus 3-5 Proteinmolekülen bestehen), d.h. es liegen pro Ionenkanal bis zu 20 membranüberspannende Sequenzen vor.
Metabotrope Rezeptoren funktionieren G-Protein-gekoppelt (GPCRs: G protein-coupled receptors). Die Bindungsdomäne kann eine von zwei verschiedenen Positionen im Molekül einnehmen (beide gleichzeitig dargestellt): Peptide binden eher an die extrazelluläre, kleine Signalmoleküle eher an die intramembranale Domäne. Die Domäne für die Bindung des G-Proteins liegt auf der intrazellulären Molekülseite.
Kinaseverknüpfte Rezeptoren beherbergen oft eine Bindungsdomäne (extrazellulär) und eine katalytische Domäne (intrazellulär) im selben Molekül, z.B. Wachstumsfaktoren. Hingegen haben Zytokinrezeptoren keine eigene Kinasedomäne, sondern aktivieren Enzyme aus dem Zytoplasma.
Nukleäre Rezeptoren aktivieren - soferne sie "ihren" Signalstoff binden - die Ablesung von Genen im Zellkern
 Membranständige Rezeptoren verfügen über drei Teile:
Membranständige Rezeptoren verfügen über drei Teile:  Einen extrazellulären mit der ligandenbindenden Domäne, welche in den Extrazellulärraum vorragt und den Signalstoff (z.B. Peptid, Transmitter) bindet
Einen extrazellulären mit der ligandenbindenden Domäne, welche in den Extrazellulärraum vorragt und den Signalstoff (z.B. Peptid, Transmitter) bindet Einen transmembranalen
Teil (bei G-Protein-Rezeptoren 7 lipophile Aminosäuresequenzen), der
den Rezeptor in der Zellmembran verankert (bei ionenkanalgekoppelten
Rezeptoren enthält dieser Teil einen zentral gelegenen Kanal)
Einen transmembranalen
Teil (bei G-Protein-Rezeptoren 7 lipophile Aminosäuresequenzen), der
den Rezeptor in der Zellmembran verankert (bei ionenkanalgekoppelten
Rezeptoren enthält dieser Teil einen zentral gelegenen Kanal) Einen intrazellulären Teil mit seiner Effektordomäne, die ein Second-messenger-System aktivieren kann (Ausnahme Ionenkanal)
Einen intrazellulären Teil mit seiner Effektordomäne, die ein Second-messenger-System aktivieren kann (Ausnahme Ionenkanal)Nach dem Wirkungsmechanismus unterscheidet man ligandenaktivierte Ionenkanäle, G-Protein-gekoppelte Rezeptoren und Kinasen (
 s. dort).
s. dort). Intrazelluläre Rezeptoren binden den extrazellulären Signalstoff in der Zelle, binden dann ihrerseits an hormone response elements (HRE) der Zielgene und beeinflussen die Ablesung genetischer Information (Transkription).
Intrazelluläre Rezeptoren binden den extrazellulären Signalstoff in der Zelle, binden dann ihrerseits an hormone response elements (HRE) der Zielgene und beeinflussen die Ablesung genetischer Information (Transkription).Die regulatorische Wirkung der Rezeptoraktivierung kann direkt an intrazellulären Zielmolekülen, an Enzymen, oder vermittels intrazellulärer Transducer (second messenger) erfolgen. Die Gesamtheit der involvierten Ionen und Moleküle wird als Signaltransduktionsweg oder Rezeptor-Effektor-System bezeichnet. Zahlreiche "Gerüst-" bzw. "Verankerungsproteine" begrenzen den Verbreitungs- bzw. Aktionsradius involvierter second messenger-Moleküle - z.B. von Calciumionen - auf einen eng begrenzten Raum in der Zelle (Kompartmentalisierung).
Viele Zielproteine werden bei Aktivierung der Signalkaskade phosphoryliert (ein Werk von Kinasen), und diese Phosphorylierung ist reversibel. So können zelluläre Funktionen je nach Bedarf gesteuert, der Phosphorylierungsgrad adaptiv eingestellt werden. Die Phosphorylierung wirkt entweder direkt auf Regulatorproteine (diese stellen die gewünschte Funktion ein), oder indirekt auf Transkriptionsfaktoren (diese steuern die Expression entsprechender Gene).

 Abbildung: Die zentrale Bedeutung von Kinasen in der Signaltransduktion
Abbildung: Die zentrale Bedeutung von Kinasen in der SignaltransduktionNach einer Vorlage in Ritter / Flower / Henderson / Loke / MacEwan / Rang, Rang & Dale's Pharmacology, 9th ed. Elsevier 2020
Kinase-Kaskaden können durch G-Protein-gekoppelte (GPCR), cGMP-generierende oder Kinase-verknüpfte Rezeptoren aktiviert werden.
Die Kinasen regulieren (aktivieren oder inaktivieren) Zielproteine, was kurz- bis langfristige Effekte zeitigt.
CaM-Kinasen = Ca++/Calmodulin-abhängige Kinasen DAG = Diacylglycerol
DAG = Diacylglycerol  GRK = GPCR-Kinase
GRK = GPCR-Kinase  IP3 = Inositoltriphosphat
IP3 = Inositoltriphosphat  PKA = Proteinkinase A
PKA = Proteinkinase A  PKC = Proteinkinase C
PKC = Proteinkinase C  PKG = cGMP-abhängige Proteinkinase
PKG = cGMP-abhängige Proteinkinase
Die Kinasen regulieren (aktivieren oder inaktivieren) Zielproteine, was kurz- bis langfristige Effekte zeitigt.
CaM-Kinasen = Ca++/Calmodulin-abhängige Kinasen
 DAG = Diacylglycerol
DAG = Diacylglycerol  GRK = GPCR-Kinase
GRK = GPCR-Kinase  IP3 = Inositoltriphosphat
IP3 = Inositoltriphosphat  PKA = Proteinkinase A
PKA = Proteinkinase A  PKC = Proteinkinase C
PKC = Proteinkinase C  PKG = cGMP-abhängige Proteinkinase
PKG = cGMP-abhängige Proteinkinase 
Regulierung der Aktivität von Proteinen:
Die Zelle kann Proteine (Rezeptoren, Ionenkanäle, Enzyme,
Transportproteine u.a.) aktivieren oder inaktivieren und dadurch ihre
Funktion regulieren. Diese Aufgabe übernehmen Kinasen (phosphorylieren Zielproteine) und Phosphatasen (dephosphorylieren
Zielproteine) - die ihrerseits durch (De-) Phosphorylierung reguliert
werden können (Phosphorylierung kann Proteine aktivieren oder auch
inaktivieren). Proteine können auch durch Kopplung an einen Inhibitor
"ausgeschaltet" sein - der Inhibitor seinerseits kann durch
Kinasewirkung entkoppeln und das Protein (durch Disinhibition)
"einschalten" (z.B. können Transkriptionsfaktoren auf diese Weise aktiv werden).
Oft führt die Bindung eines Liganden (Hormon, Transmitter, Mediator) zur Dimerisierung von Rezeptormolekülen (jeweils zwei lagern sich aneinander an) und gegenseitige Autophosphorylierung intrazellulärer Tyrosinreste, die dann ihrerseits Proteine anlagern und eine Kaskade der Signaltransduktion auslösen. Ein wichtiges Beispiel solcher Zielproteine sind SH2-Domäne-Proteine (die SH2-Domäne ist eine - phylogenetisch hochkonservierte - aus etwa 100 Aminosäuren bestehende Sequenz, die vor allem Peptide mit Phosphotyrosin - phosphoryliertes Tyrosin - erkennen). SH2-Domäne-Proteine erkennen oft spezifisch Rezeptormoleküle. Viele von ihnen sind Enzyme (Kinasen, Phospholipasen,..). Ein Beispiel für SH2-Domäne-Proteine sind Stats (eine Familie von Transkriptionsfaktoren).
Oft führt die Bindung eines Liganden (Hormon, Transmitter, Mediator) zur Dimerisierung von Rezeptormolekülen (jeweils zwei lagern sich aneinander an) und gegenseitige Autophosphorylierung intrazellulärer Tyrosinreste, die dann ihrerseits Proteine anlagern und eine Kaskade der Signaltransduktion auslösen. Ein wichtiges Beispiel solcher Zielproteine sind SH2-Domäne-Proteine (die SH2-Domäne ist eine - phylogenetisch hochkonservierte - aus etwa 100 Aminosäuren bestehende Sequenz, die vor allem Peptide mit Phosphotyrosin - phosphoryliertes Tyrosin - erkennen). SH2-Domäne-Proteine erkennen oft spezifisch Rezeptormoleküle. Viele von ihnen sind Enzyme (Kinasen, Phospholipasen,..). Ein Beispiel für SH2-Domäne-Proteine sind Stats (eine Familie von Transkriptionsfaktoren).
Eine wichtige Eigenschaft dieser Anordnungen ist die Möglichkeit zur Signalverstärkung. Extrazelluläre Liganden (z.B. Hormone) haben oft eine sehr geringe Konzentration (nano- bis mikromolar), und intrazelluläre Enzymkaskaden können eine molekulare Verstärkung über mehrere Zehnerpotenzen ergeben.
Die folgende Tabelle gibt Beispiele für Rezeptoren, ihre Zuordnung, Aktivatoren (Bindungspartner, Liganden) und second-messenger-Mechanismen (Effektoren):
| Rezeptoren Modifiziert nach Hilal-Dandan / Brunton, Goodman & Gilman's Manual of Pharmacology and Therapautics, 2nd ed. McGraw Hill 2014 |
|||
| Strukturell |
Funktionell |
Ligand(en) |
Effektoren / Transducer |
| GPCR (G-Protein- gekoppelte Rezeptoren) |
ß-Adrenozeptoren |
Katecholamine |
Gs, AC (Adenylylcyclase) |
| Muskarinische cholinerge Rezeptoren |
Acetylcholin |
Gi, Gq, AC, Ionenkanäle, PLC |
|
| Eikosanoid- rezeptoren |
Prostaglandine, Leukotriene, Thromboxane |
Gs, Gi, Gq |
|
| Ionenkanäle |
Ligandengesteuert |
Acetylcholin (M2) GABA Histamin |
Permeasewirkung für Na+, Ca++, K+, Cl- |
| Transmembranale Enzyme |
Rezeptor- Tyrosinkinase |
Insulin EGF, PDGF, VEGF |
Proteine mit Bindungsdomänen |
| Membrangebundene Guanylatzyklase |
Natriuretische Peptide |
cGMP |
|
| Transmembranal, Nicht-Enzyme |
Zytokinrezeptoren |
Interleukine u.a. |
Jak/STAT lösliche Tyrosinkinasen |
| Toll-like Rezeptoren |
Bakterielle Produkte Lipopolysaccharide |
z.B. NF-κB |
|
| Nukleäre Rezeptoren |
Steroidrezeptoren |
z.B. Östrogene Testosteron |
Co-Aktivatoren |
| Thyroidhormon- rezeptoren |
T3 / T4 |
||
| Intrazelluläre Enzyme |
Lösliche Guanylatzyklase |
NO, Ca++ |
cGMP |
Regulierung der Zahl und des Zustands von Rezeptoren
Rezeptoren beeinflussen die verschiedensten Funktionen in der Zelle, sind aber selbst ebenfalls Ziel regulatorischer Einflüsse. Sowohl ihr Zustand als auch ihre Anzahl in der Zellmembran (z.B. durchschnittlich ~104 Hormonrezeptoren) sind
veränderlich. Diese Dynamik ermöglicht Anpassungen an die jeweils
herrschenden funktionellen Szenarien.
Verursacht wird dies meist durch einen Mix an Mechanismen:
 Absinken der Konzentration eines Botenstoffes ("Erschöpfung")
Absinken der Konzentration eines Botenstoffes ("Erschöpfung")
 Rascher Abbau des Liganden (stoffwechselbedingt)
Rascher Abbau des Liganden (stoffwechselbedingt)
 Zustandswechsel von Rezeptoren (z.B. an der motorischen Endplatte):
Allosterisch, wobei der Ligand fester gebunden
wird und der Ionenkanal nicht mehr öffnet; oder durch Phosphorylierung
des intrazellulären Anteils des Rezeptors, wodurch dieser die
Second-messenger-Kaskade nicht mehr aktiviert. Bei konstanter bzw. hochfrequenter Anwesenheit eines Liganden
an "seinem" Rezeptor kann der Effekt auf die Zelle bzw. das Gewebe
abnehmen oder ganz verschwinden. Dieses Phänomen nennt man
Desensitivierung oder Tachyphylaxie
Zustandswechsel von Rezeptoren (z.B. an der motorischen Endplatte):
Allosterisch, wobei der Ligand fester gebunden
wird und der Ionenkanal nicht mehr öffnet; oder durch Phosphorylierung
des intrazellulären Anteils des Rezeptors, wodurch dieser die
Second-messenger-Kaskade nicht mehr aktiviert. Bei konstanter bzw. hochfrequenter Anwesenheit eines Liganden
an "seinem" Rezeptor kann der Effekt auf die Zelle bzw. das Gewebe
abnehmen oder ganz verschwinden. Dieses Phänomen nennt man
Desensitivierung oder Tachyphylaxie , wenn es rasch (über Sekunden bis Minuten) auftritt, und als Toleranz, wenn es erst im Laufe von Stunden bis Monaten auftritt
, wenn es rasch (über Sekunden bis Minuten) auftritt, und als Toleranz, wenn es erst im Laufe von Stunden bis Monaten auftritt
 Ein Beispiel für Tachyphylaxie ist die sinkende bronchodilatatorische Wirkung von
ß-Rezeptor-Agonisten infolge wiederholter Applikation (Asthmapatienten)
Ein Beispiel für Tachyphylaxie ist die sinkende bronchodilatatorische Wirkung von
ß-Rezeptor-Agonisten infolge wiederholter Applikation (Asthmapatienten)
 Ist der Signalweg blockiert (Refrakterität
/ refractoriness
= vorübergehende Unempfindlichkeit
gegenüber einem Reiz), kann es Minuten
bis Stunden dauern, bis die Übertragung von Signalen durch Hormone,
Transmitter oder andere Signalstoffe wieder in voller Stärke möglich
ist
Ist der Signalweg blockiert (Refrakterität
/ refractoriness
= vorübergehende Unempfindlichkeit
gegenüber einem Reiz), kann es Minuten
bis Stunden dauern, bis die Übertragung von Signalen durch Hormone,
Transmitter oder andere Signalstoffe wieder in voller Stärke möglich
ist
 Translokation von Rezeptoren. Endozytose von der Außenmembran in das endoplasmatische Retikulum (Internalisierung) bewirkt, dass
der Rezeptor nicht mehr für extrazelluläre Liganden zugänglich ist (typisch für Hormone) - auch als downregulation bezeichnet.
Anschließend exportiert die Zelle wieder Rezeptoren in die
Außenmembran, sie ist für den Liganden wieder ansprechbar (Exozytose: Supersensitivity, receptor upregulation)
Translokation von Rezeptoren. Endozytose von der Außenmembran in das endoplasmatische Retikulum (Internalisierung) bewirkt, dass
der Rezeptor nicht mehr für extrazelluläre Liganden zugänglich ist (typisch für Hormone) - auch als downregulation bezeichnet.
Anschließend exportiert die Zelle wieder Rezeptoren in die
Außenmembran, sie ist für den Liganden wieder ansprechbar (Exozytose: Supersensitivity, receptor upregulation)
 Erhöhte Sensibilität durch Hinaufregulierung der Rezeptorzahl tritt nach
längerer Rezeptorblockade auf, z.B. nach Langzeitbehandlung mit
ß-Blockern wie Metoprolol, das u.a. gegen Herzrhythmusstörungen
eingesetzt wird. Setzt man das Pharmakon ab, ist der physiologische
Effekt der Rezeptorreizung besonders intensiv
Erhöhte Sensibilität durch Hinaufregulierung der Rezeptorzahl tritt nach
längerer Rezeptorblockade auf, z.B. nach Langzeitbehandlung mit
ß-Blockern wie Metoprolol, das u.a. gegen Herzrhythmusstörungen
eingesetzt wird. Setzt man das Pharmakon ab, ist der physiologische
Effekt der Rezeptorreizung besonders intensiv
 Steigerung oder Absenken der Rezeptorexpression durch Einfluss auf Transkription (Ablesung von Genen) und Proteinsynthese
Steigerung oder Absenken der Rezeptorexpression durch Einfluss auf Transkription (Ablesung von Genen) und Proteinsynthese
 Physiologische Adaptation (durch eine homöostatische Reaktion des
Körpers hervorgerufen, z.B. wenn durch veränderte Genexpression die
Konzentration regulatorischer Stoffe variiert)
Physiologische Adaptation (durch eine homöostatische Reaktion des
Körpers hervorgerufen, z.B. wenn durch veränderte Genexpression die
Konzentration regulatorischer Stoffe variiert)
Verursacht wird dies meist durch einen Mix an Mechanismen:
 , wenn es rasch (über Sekunden bis Minuten) auftritt, und als Toleranz, wenn es erst im Laufe von Stunden bis Monaten auftritt
, wenn es rasch (über Sekunden bis Minuten) auftritt, und als Toleranz, wenn es erst im Laufe von Stunden bis Monaten auftritt Ein Beispiel für Tachyphylaxie ist die sinkende bronchodilatatorische Wirkung von
ß-Rezeptor-Agonisten infolge wiederholter Applikation (Asthmapatienten)
Ein Beispiel für Tachyphylaxie ist die sinkende bronchodilatatorische Wirkung von
ß-Rezeptor-Agonisten infolge wiederholter Applikation (Asthmapatienten) Erhöhte Sensibilität durch Hinaufregulierung der Rezeptorzahl tritt nach
längerer Rezeptorblockade auf, z.B. nach Langzeitbehandlung mit
ß-Blockern wie Metoprolol, das u.a. gegen Herzrhythmusstörungen
eingesetzt wird. Setzt man das Pharmakon ab, ist der physiologische
Effekt der Rezeptorreizung besonders intensiv
Erhöhte Sensibilität durch Hinaufregulierung der Rezeptorzahl tritt nach
längerer Rezeptorblockade auf, z.B. nach Langzeitbehandlung mit
ß-Blockern wie Metoprolol, das u.a. gegen Herzrhythmusstörungen
eingesetzt wird. Setzt man das Pharmakon ab, ist der physiologische
Effekt der Rezeptorreizung besonders intensivZeitabhängigkeit. Zellen verändern ihr Funktionsprofil abhängig von Zeitablauf, vorhergehendem Zustand und anderen (vor allem äußeren) Begleitumständen. Das erklärt u.a. rhythmische Phänomene (Spontanentladung, biologische Rhythmen, Schlaf-Wach-Folge, fluktuierende Aufmerksamkeit, prä- vs. postprandialer Stoffwechsel ..). Die Hormonempfindlichkeit vieler Zellen ist zustands- und zeitabhängig: so werden hypophysäre Hormone nicht kontinuierlich, sondern "gepulst" an das Blut abgegeben und dadurch eine "frequenzmodulierte" Übereinstimmung mit der zeitabhängigen Empfindlichkeit der Zielzellen erreicht.
Hinauf- und Hinunterregulierung der Rezeptorzahl kann außer durch Endo- / Exozytose auch durch Veränderung der Proteinsynthese (Translation) beeinflusst werden (z.B. nimmt in Zellen schwangerer Frauen die GH-Rezeptor-mRNS-Konzentration zu). Der Rezeptor kann auch von der second-messenger-Kette entkoppelt und dadurch inaktiv gemacht werden (z.B. durch intrazelluläre Bindung von Arrestin an phosphorylierte Betarezeptoren). In jedem Fall nimmt die Empfindlichkeit der Zelle gegenüber dem betreffenden Signalstoff zu, wenn die Rezeptordichte / Rezeptoraktivität in der Membran steigt (z.B. die Dopaminrezeptordichte bei Mb. Parkinson: Sensitivierung) - oder sie nimmt ab, wenn die Rezeptordichte / Rezeptoraktivität sinkt (z.B. die Wachstumshormon-Rezeptorzahl bei niedrigem Blutzuckerspiegel: Desensitivierung).
Rezeptoren sind am Prozess der Endozytose beteiligt: Binden Stoffe (Liganden) an Rezeptoren, können diese eine Einstülpung der Membran (Clathrin-Mechanismus
 ) und Aufnahme des Liganden in die
Zelle bewirken (rezeptormediierte Endozytose). Beispielsweise erfolgt die Aufnahme von Eisen über Transferrinrezeptoren oder die von Lipiden über LDL-Rezeptoren.
Auch am Mechanismus der Übertragung hormoneller Signale an das
Zellinnere kann rezeptormediierte Endozytose beteiligt sein. Der
Mechanismus ist von der Zahl verfügbarer Rezeptoren abhängig und daher
sättigbar, andererseits werden endozytierte
Rezeptormoleküle an die Zelloberfläche recycelt.
) und Aufnahme des Liganden in die
Zelle bewirken (rezeptormediierte Endozytose). Beispielsweise erfolgt die Aufnahme von Eisen über Transferrinrezeptoren oder die von Lipiden über LDL-Rezeptoren.
Auch am Mechanismus der Übertragung hormoneller Signale an das
Zellinnere kann rezeptormediierte Endozytose beteiligt sein. Der
Mechanismus ist von der Zahl verfügbarer Rezeptoren abhängig und daher
sättigbar, andererseits werden endozytierte
Rezeptormoleküle an die Zelloberfläche recycelt. Einige Rezeptoren sprechen auf intrazelluläre Signale an, wie Kaliumkanäle, die z.B. durch Ca++ oder durch sinkende ATP-Konzentration aktiviert werden. So kontrollieren IP3- und Ryanodin-Rezeptoren in der Membran des endoplasmatischen Retikulums die Mobilisierung intrazellulärer Ca++-Speicher.
Folgereaktionen: Signalstoffbindung an Rezeptoren löst Reaktionen der Zelle aus, wie z.B.
 Änderung der elektrischen
Ladung der Zellmembran
Änderung der elektrischen
Ladung der Zellmembran Bewegung
Bewegung Wachstum
Wachstum Zellteilung
Zellteilung Selbstentsorgung
(Apoptose)
Selbstentsorgung
(Apoptose)Passage durch Membranen
 Orientierung: Passagesysteme
Orientierung: Passagesysteme
 Aktiver Transport (uphill) kann erfolgen
Aktiver Transport (uphill) kann erfolgen
 durch direkten Verbrauch (Hydrolyse) von ATP - primär aktiver Transport; Beispiel: Die allgegenwärtige Na/K-Pumpe;
durch direkten Verbrauch (Hydrolyse) von ATP - primär aktiver Transport; Beispiel: Die allgegenwärtige Na/K-Pumpe;
 unter Nutzung einer vorher (aktiv) schon aufgebauten
Konzentrationsdifferenz eines Stoffes, der für einen Mittransport (Symport) oder Austausch (Antiport) des zu transportierenden Stoffes durch die Membran genützt wird (sekundär aktiver Transport).
unter Nutzung einer vorher (aktiv) schon aufgebauten
Konzentrationsdifferenz eines Stoffes, der für einen Mittransport (Symport) oder Austausch (Antiport) des zu transportierenden Stoffes durch die Membran genützt wird (sekundär aktiver Transport).
 Orientierung: Passagesysteme
Orientierung: PassagesystemeVor allem wasserlösliche Stoffe brauchen
für ihre Passage durch Biomembranen mehr oder weniger zylinderförmige
Proteinkomplexe (Permeasen ), die in der Zellmembran stecken und
ihrem Substrat den Wechsel zwischen Intra- und Extrazellulärraum
erlauben. Dabei können diese unterschiedlich funktionieren: Der Durchtritt des Stoffes (Ions, Moleküls) kann entweder
), die in der Zellmembran stecken und
ihrem Substrat den Wechsel zwischen Intra- und Extrazellulärraum
erlauben. Dabei können diese unterschiedlich funktionieren: Der Durchtritt des Stoffes (Ions, Moleküls) kann entweder
 ohne zusätzlichen
Energieaufwand mit seinem chemischen / elektrochemischen Gradienten erfolgen, also durch Diffusion - Passiver (downhill) Transport:
ohne zusätzlichen
Energieaufwand mit seinem chemischen / elektrochemischen Gradienten erfolgen, also durch Diffusion - Passiver (downhill) Transport:
 Ungeladene Stoffe wandern entsprechend ihrem chemischen (Konzentrations-), Ionen entsprechend ihrem elektrochemischen Gradienten (zwei Gradienten: einerseits Konzentration, andererseits elektrische Spannung) - oder
Ungeladene Stoffe wandern entsprechend ihrem chemischen (Konzentrations-), Ionen entsprechend ihrem elektrochemischen Gradienten (zwei Gradienten: einerseits Konzentration, andererseits elektrische Spannung) - oder
 unter Energieaufwand - direkt oder indirekt - gegen seinen chemischen / elektrochemischen Gradienten: Aktiver (uphill) Transport.
unter Energieaufwand - direkt oder indirekt - gegen seinen chemischen / elektrochemischen Gradienten: Aktiver (uphill) Transport.
 Ungeladene Stoffe werden gegen ihren Konzentrationsgradienten, Ionen gegen ihren elektrochemischen Gradienten befördert.
Ungeladene Stoffe werden gegen ihren Konzentrationsgradienten, Ionen gegen ihren elektrochemischen Gradienten befördert.
 Ionenkanäle
haben tunnelartige Poren (Radius meist <1 nm). Ihre Konfiguration kann
zwischen den Zuständen "geschlossen" oder "offen" (allosterisch)
wechseln, und zwar unter dem Einfluss verschiedener Faktoren:
Ionenkanäle
haben tunnelartige Poren (Radius meist <1 nm). Ihre Konfiguration kann
zwischen den Zuständen "geschlossen" oder "offen" (allosterisch)
wechseln, und zwar unter dem Einfluss verschiedener Faktoren:
 Membranspannung (spannungsgesteuerte Kanäle, voltage-gated channels): Diese Ionenkanäle öffnen / schließen entsprechend dem Betrag des Membranpotentials. Sie
unterscheiden sich in ihrer Spezifität, d.h. Durchgängigkeit für
(bestimmte) Kationen
Membranspannung (spannungsgesteuerte Kanäle, voltage-gated channels): Diese Ionenkanäle öffnen / schließen entsprechend dem Betrag des Membranpotentials. Sie
unterscheiden sich in ihrer Spezifität, d.h. Durchgängigkeit für
(bestimmte) Kationen und / oder Anionen
und / oder Anionen . Die meisten öffnen bei Depolarisierung der Zellmembran (man findet solche Kanäle in erregbaren Zellen, z.B. Neuronen oder Herzmuskelzellen). Bei HCN-Kanälen ist es umgekehrt, diese öffnen bei Hyperpolarisierung der Membran.
. Die meisten öffnen bei Depolarisierung der Zellmembran (man findet solche Kanäle in erregbaren Zellen, z.B. Neuronen oder Herzmuskelzellen). Bei HCN-Kanälen ist es umgekehrt, diese öffnen bei Hyperpolarisierung der Membran.
 Anlagerung eines Signalstoffes (ligandengesteuerte Kanäle, ligand-gated channels):
Binden diese Ionenkanäle einen Signalstoff (z.B. Hormon oder
Neurotransmitter), geben sie für bestimmte Ionen die Membranpassage
entsprechend ihrem Konzentrationsgradienten frei. Koppelt der Signalstoff vom Rezeptor ab, schließt sich dieser wieder. Ligandengesteuerte Kanäle können auch auf intrazelluläre Signale reagieren (z.B. Kinasen).
Anlagerung eines Signalstoffes (ligandengesteuerte Kanäle, ligand-gated channels):
Binden diese Ionenkanäle einen Signalstoff (z.B. Hormon oder
Neurotransmitter), geben sie für bestimmte Ionen die Membranpassage
entsprechend ihrem Konzentrationsgradienten frei. Koppelt der Signalstoff vom Rezeptor ab, schließt sich dieser wieder. Ligandengesteuerte Kanäle können auch auf intrazelluläre Signale reagieren (z.B. Kinasen).
 Oder es handelt sich um Carrier (Transporter),
die einen zu transportierenden Stoff (auf der einen Seite der Membran)
binden, eine Konformationsänderung durchlaufen (allosterischer Effekt),
durchgängig werden und den Stoff (auf der anderen Seite der Membran)
wieder dissoziieren. Solche Carrier
Oder es handelt sich um Carrier (Transporter),
die einen zu transportierenden Stoff (auf der einen Seite der Membran)
binden, eine Konformationsänderung durchlaufen (allosterischer Effekt),
durchgängig werden und den Stoff (auf der anderen Seite der Membran)
wieder dissoziieren. Solche Carrier
 erlauben entweder transmembranale
Netto-Strömung entsprechend einer vorhandenen Konzentrationsdifferenz
(erleichterte Diffusion), oder
erlauben entweder transmembranale
Netto-Strömung entsprechend einer vorhandenen Konzentrationsdifferenz
(erleichterte Diffusion), oder
 nutzen das Konzentrationsgefälle
einer anderen Substanz (z.B. von Natriumionen oder H+), mit der zusammen der "eigentlich"
transportierte Stoff (z.B. Glucose, Aminosäuren..) bewegt wird - entweder in dieselbe Richtung
(Cotransport, Symport) oder in die Gegenrichtung (Austausch, Antiport).
Das genutzte Konzentrationsgefälle der "anderen" Substanz wird
typischerweise durch primär-aktiven Transport aufrechterhalten (ATPasen
s. folgender Absatz).
nutzen das Konzentrationsgefälle
einer anderen Substanz (z.B. von Natriumionen oder H+), mit der zusammen der "eigentlich"
transportierte Stoff (z.B. Glucose, Aminosäuren..) bewegt wird - entweder in dieselbe Richtung
(Cotransport, Symport) oder in die Gegenrichtung (Austausch, Antiport).
Das genutzte Konzentrationsgefälle der "anderen" Substanz wird
typischerweise durch primär-aktiven Transport aufrechterhalten (ATPasen
s. folgender Absatz).
Transporter sind spezifisch, d.h. sie transportieren nur bestimmte Stoffe; sie sind sättigbar, d.h. mit zunehmender Konzentrationsdifferenz nimmt die Geschwindigkeit des Transportes zunächst steil, mit zunehmender Sättigung immer weniger zu; und ihre Expression (Synthese) wird von der Zelle reguliert, d.h. dem Bedarf angepasst.
 Der
Transport kann auch direkt energieverbrauchend erfolgen (primär-aktiv: ATPase, "Pumpe", z.B. Na+/K+-Pumpe in der - bei epithelialen Zellen basolateralen - Membran aller Zellen, oder Ca++-Pumpe in der Zellmembran der meisten Körperzellen und in der Membran des sarkoplasmatischen Retikulums von Muskelzellen). Ohne ATP-Verbrauch ist mit solchen Systemen keine Membranpassage möglich.
Der
Transport kann auch direkt energieverbrauchend erfolgen (primär-aktiv: ATPase, "Pumpe", z.B. Na+/K+-Pumpe in der - bei epithelialen Zellen basolateralen - Membran aller Zellen, oder Ca++-Pumpe in der Zellmembran der meisten Körperzellen und in der Membran des sarkoplasmatischen Retikulums von Muskelzellen). Ohne ATP-Verbrauch ist mit solchen Systemen keine Membranpassage möglich.
Die meisten biologisch relevanten Ionen (wie Na+, K+, Ca++, Cl-, HCO3-)
und gelösten Substanzen (wie Zucker, Aminosäuren etc) lösen sich nicht
in der Lipidphase von Zellmembranen. Daher gelangen sie auch nicht
durch einfache Diffusion durch diese Barrieren (Kompartimentierung) -
zur Passage benötigen sie spezielle Proteine, die von der Zelle je nach
Bedarf exprimiert und in die betreffenden Membranen integriert werden. Diese Proteine bilden
 Poren in Membranen (die immer offen sind; z.B. Porine
in der äußeren Mitochondrienmembran, durch welche Moleküle bis 5 kDa
frei diffundieren können. Poren ermöglichen den Durchtritt von bis zu
2.109 Teilchen pro Sekunde.
Poren in Membranen (die immer offen sind; z.B. Porine
in der äußeren Mitochondrienmembran, durch welche Moleküle bis 5 kDa
frei diffundieren können. Poren ermöglichen den Durchtritt von bis zu
2.109 Teilchen pro Sekunde.
Aquaporine stehen für den Durchtritt von Wasser bereit und werden an verschiedenen Stellen des Körpers bedarfsabhängig exprimiert. Kernporen ermöglichen den Durchtritt eher kleiner (bis 45 kDa) Moleküle zwischen Zellplasma und Zellkern, und sind Bestandteil eines komplexen Schleusensystems. Perforine bilden offene "Löcher" in der Membran von Zellen, die durch Wirkung zytotoxischer T-Lymphozyten angegriffen werden.
 Kanäle, die offen oder durch ein "Tor"verschlossen sein können (gated channels), z.B. für Na+, Cl-, K+, Ca++ - ihr Öffnungszustand oszilliert.
Beim Wechsel zwischen geöffnetem und geschlossenem Zustand durchlaufen
Kanäle eine Konformationsänderung; der geöffnete Zustand kann
unterschiedlich lang andauern. Kanäle lassen in geöffnetem Zustand 106 bis 108 Teilchen pro Sekunde hindurchtreten, also um 2-3 Größenordnungen weniger als Poren.
Kanäle, die offen oder durch ein "Tor"verschlossen sein können (gated channels), z.B. für Na+, Cl-, K+, Ca++ - ihr Öffnungszustand oszilliert.
Beim Wechsel zwischen geöffnetem und geschlossenem Zustand durchlaufen
Kanäle eine Konformationsänderung; der geöffnete Zustand kann
unterschiedlich lang andauern. Kanäle lassen in geöffnetem Zustand 106 bis 108 Teilchen pro Sekunde hindurchtreten, also um 2-3 Größenordnungen weniger als Poren.
Darüber hinaus verfügen Kanäle über Sensoren, die auf die chemische (extrazelluläre Liganden, intrazelluläre second messenger) oder elektrische Signale (Membranpotential) mit einer Änderung ihrer Öffnungswahrscheinlichkeit reagieren. Schließlich haben Kanäle einen Selektivitätsfilter, der bestimmt, welche Ionen passieren können. Meist sind Kanäle für ein bestimmtes Ion ziemlich durchgängig ("Kaliumkanal", "Natriumkanal" usw). Dabei beeinflusst das Aminosäuremuster der Domänen (Helices), aus denen die Pore aufgebaut ist, deren Transporteigenschaften (hydrophob vs. hydrophil) und -spezifitäten (welches Ion wird unter welchen Bedinungen wie stark durchgelassen?).
 Carrier
(Transporter), die über ein äußeres und ein inneres Tor verfügen, die
alternartiv geöffnet werden - sie durchlaufen jeweils einen definierten Funktionszyklus. Dadurch ist es möglich, im Rahmen eines
mehrschrittigen Verfahrens Ionen auf einer Seite "einzufangen" und dann
auf der anderen Seite der Membran wieder freizusetzen. Carrier "schaffen" pro Sekunde allerdings nur 200 bis 5.104 Teilchen, um Zehnerpotenzen weniger als Kanäle.
Carrier
(Transporter), die über ein äußeres und ein inneres Tor verfügen, die
alternartiv geöffnet werden - sie durchlaufen jeweils einen definierten Funktionszyklus. Dadurch ist es möglich, im Rahmen eines
mehrschrittigen Verfahrens Ionen auf einer Seite "einzufangen" und dann
auf der anderen Seite der Membran wieder freizusetzen. Carrier "schaffen" pro Sekunde allerdings nur 200 bis 5.104 Teilchen, um Zehnerpotenzen weniger als Kanäle.
Carrier sind nie durchgängig offen, ein Tor (das äußere oder das innere) ist immer verschlossen. Einige Carrier ermöglichen Diffusion kleiner gelöster Stoffe, wie z.B. Glucose (erleichterte Diffusion). Im Gegensatz zu einfacher Diffusion (deren Intensität linear mit der Konzentrationsdifferenz des diffundierenden Stoffes ansteigt) unterliegt der Transport bei erleichterter Diffusion einer Sättigungskinetik (nichtlinear: Mit zunehmender Konzentrationsdifferenz wird die Zunahme der Diffusion immer geringer).
Poren bestehen aus ß-Faltblattstrukturen (sie stehen immer offen); Ionenkanäle (die nur oszillierend öffnen) sind aus helikalen Strukturen aufgebaut, die parallel zueinander in die Membran "gesteckt" erscheinen. So kann z.B. ein Kaliumkanal aus vier Untereinheiten aufgebaut sein, die ihrerseits aus 2-6 transmembranalen α-Helices bestehen.
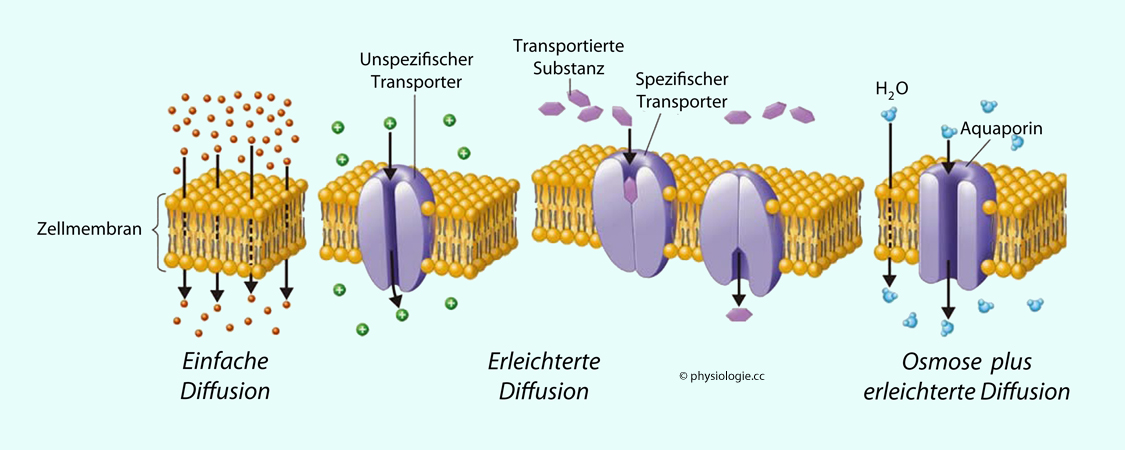
 Abbildung: Diffusion, Osmose und passiver Transport
Abbildung: Diffusion, Osmose und passiver Transport
Nach einer Vorlage bei Pearson Education 2010
 Ionenkanäle erlauben den mehr oder weniger spezifischen Durchtritt von Ionen, der Mechanismus der Selektivität ist nicht
vollständig geklärt (
Ionenkanäle erlauben den mehr oder weniger spezifischen Durchtritt von Ionen, der Mechanismus der Selektivität ist nicht
vollständig geklärt ( Abbildung). Ihre Eigenschaften - z.B. die
Beziehung zwischen Spannung und Stromstärke - lassen sich mit der Patch-clamp-Methode
untersuchen, bei der ein Stück Zellmembran mit nur wenigen oder nur einem einzelnen
Ionenkanal an die Spitze einer Mikropipette gebracht und so separiert
studiert werden kann.
Abbildung). Ihre Eigenschaften - z.B. die
Beziehung zwischen Spannung und Stromstärke - lassen sich mit der Patch-clamp-Methode
untersuchen, bei der ein Stück Zellmembran mit nur wenigen oder nur einem einzelnen
Ionenkanal an die Spitze einer Mikropipette gebracht und so separiert
studiert werden kann.
Zur Selektivität von Ionenkanälen s. die nächste Abbildung (Beispiel Natrium vs. Kalium)::
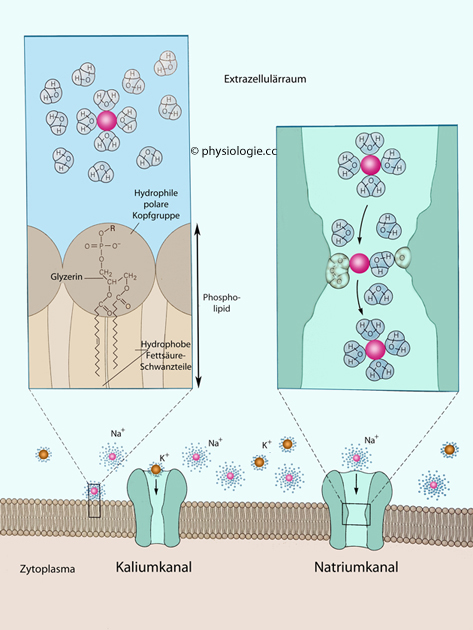
 Abbildung: Selektive Ionenpermeabilität der Zellmembran
Abbildung: Selektive Ionenpermeabilität der Zellmembran
Nach einer Vorlage in Kandel / Koester / Mack / Siegelbaum (eds), Principles of Neural Sciences, 6th ed. 2021 (McGraw Hill)
Links oben: Ionen sind in Lösung von einem Wassermantel umgeben, z.B. lagern sich an Kationen negativ geladene Sauerstoffpole von H2O-Molekülen an. Der entstehende Hydratmantel macht eine Interaktion der Ionen mit Phospholipiden in der Zellmembran unwahrscheinlich.
Links unten: Natriumionen sind kleiner als Kaliumionen, haben aber (wegen höherer Feldstärke) einen größeren Hydratmantel. Die engeren Kaliumkanäle (effektiver Poren- Innendurchmesser 0,3 nm) lassen Kalium, nicht aber Natrium passieren. Dabei "hüpfen" Kaliumionen vermutlich paarweise hintereinander, durch Wassermoleküle getrennt, jeweils im Abstand einer leerbleibenden Bindungsstelle durch den Kanal (nicht gezeigt)
Rechts: Natriumkanäle zeigen selektives Filterverhalten: Vermutlich lagern aktive Stellen in der Kanalwand (negativ geladene Partien von Aminosäuren) vorübergehend Na+ und einzelne Wassermoleküle (am Wasserstoffpol) an, der Hydratmantel "zerreißt" für kurze Zeit (<1 µs), hinter der Engstelle formiert er sich wieder um das Na+. Für K+ (mit seinem größeren Durchmesser) funktioniert das nicht, es bleibt von der Passage (weitgehend) ausgeschlossen
 Ionenkanäle können in zwei Zuständen vorliegen,
"geschlossen" oder "offen" (ein dritter Zustand, "inaktiviert",
entspricht permeabilitätsmäßig dem geschlossenen). Das Kippen zwischen
diesen Zuständen erfolgt typischerweise 106 bis 108-mal
pro Sekunde, entsprechend ausgiebig (bis zu 108 Ionen pro Sekunde) kann der Transport ausfallen. Die (über die Zeit
gemittelte) Wahrscheinlichkeit, mit der die "offene" Form vorliegt,
entscheidet über die Permeabilität des Kanals für seine Passagiere (Natriumionen, Kaliumionen etc).
Ionenkanäle können in zwei Zuständen vorliegen,
"geschlossen" oder "offen" (ein dritter Zustand, "inaktiviert",
entspricht permeabilitätsmäßig dem geschlossenen). Das Kippen zwischen
diesen Zuständen erfolgt typischerweise 106 bis 108-mal
pro Sekunde, entsprechend ausgiebig (bis zu 108 Ionen pro Sekunde) kann der Transport ausfallen. Die (über die Zeit
gemittelte) Wahrscheinlichkeit, mit der die "offene" Form vorliegt,
entscheidet über die Permeabilität des Kanals für seine Passagiere (Natriumionen, Kaliumionen etc).
Die Wahrscheinlichkeit des "Offen"-Zustandes von Ionenkanälen kann beeinflusst werden durch die Anlagerung von Signalstoffen (interzellulären Mediatoren, wie Hormonen, Transmittern etc) (ligand gated), Änderungen des Membranpotentials (voltage gated), mechanische Kräfte (stretch activated), Temperatur (temperature activated), Status intrazellulärer Speicher (store activated). Obwohl Ionenkanäle relativ hohe Transportwerte ermöglichen, sind sie auch sättigbar in dem Sinne, dass ihre Zahl und Transportrate begrenzt sind.
Bei spannungsabhängigen Ionenkanälen (voltage gated ion channels) bilden positiv geladene Aminosäureketten im Ionenkanal Spannungssensoren, die ihre Position je nach Membranpotential verändern. Diese Konformationsschwankungen öffnen bzw. schließen den Ionenkanal. Unabhängig davon kann ein zusätzlicher Abschnitt des Rezeptorkomplexes von die Innenseite aus die Passage durch den Ionenkanal verschließen (wie ein "Stöpsel" - "ball and chain inactivation", vgl. dort), auch bei ligandenaktivierten Kanälen (ligand gated ion channels); dann
ist der Kanal "inaktiviert" (spannungsabhängige Kanäle) oder
"desensitisiert" (ligandengesteuerte Kanäle) und für Ionen
vorübergehend unpassierbar. Erst die Entfernung des "Stöpsels" aus dem
intrazellulären Kanaleingang macht den Kanal wieder aktivierbar.
vgl. dort), auch bei ligandenaktivierten Kanälen (ligand gated ion channels); dann
ist der Kanal "inaktiviert" (spannungsabhängige Kanäle) oder
"desensitisiert" (ligandengesteuerte Kanäle) und für Ionen
vorübergehend unpassierbar. Erst die Entfernung des "Stöpsels" aus dem
intrazellulären Kanaleingang macht den Kanal wieder aktivierbar.
Mehrere Isoformen von Ionenkanälen für Natrium, Kalium, Calcium und Chlorid finden sich in der Membran aller Zellen. Kaliumkanäle weisen eine besonders große Diversität auf. Spannungsgesteuerte Na+- und Ca++-Kanäle bestehen aus kanalbildenden und regulatorischen Untereinheiten, sie ermöglichen Aktionspotentiale bzw. deren Verlängerung, und Calciumeinstrom in Neurone vermittelt deren Transmitterfreigabe. Ligandengesteuerte Kanäle sind z.B. (exzitatorisch wirkende) cholinerge und glutamaterge, oder (inhibitorsich wirkende) glycinerge und GABAerge Kanäle.
Kanalproteine sind auch Aquaporine ("Wasserkanäle") sowie junktionale Kanäle in interzellulären Verbindungsstrukturen (gap junctions, wohl auch tight junctions).
 Transporter (Carrier), die das zu transportierende Molekül vorübergehend anlagern, um über eine Konformationsänderung seinen Durchtritt
zu ermöglichen, können ~1 bis
103
Konformationsänderungen pro Sekunde durchlaufen. Dieser Transport
erfolgt ebenfalls ohne Energieaufwand,
entsprechend dem elektrochemischen bzw. Konzentrationsgradienten des Transportgutes. Der
Mechanismus ist nicht nur sättigbar, er kann auch durch Substrat-Analoge gehemmt
werden (Transportkinetik).
Transporter (Carrier), die das zu transportierende Molekül vorübergehend anlagern, um über eine Konformationsänderung seinen Durchtritt
zu ermöglichen, können ~1 bis
103
Konformationsänderungen pro Sekunde durchlaufen. Dieser Transport
erfolgt ebenfalls ohne Energieaufwand,
entsprechend dem elektrochemischen bzw. Konzentrationsgradienten des Transportgutes. Der
Mechanismus ist nicht nur sättigbar, er kann auch durch Substrat-Analoge gehemmt
werden (Transportkinetik).
Beispiel: Glucosetransporter (GLUT), ein sogenannter Uniporter-Mechanismus (singulärer Transport eines Substratmoleküls nach seinem Konzentrationsgradienten).
 ), die in der Zellmembran stecken und
ihrem Substrat den Wechsel zwischen Intra- und Extrazellulärraum
erlauben. Dabei können diese unterschiedlich funktionieren: Der Durchtritt des Stoffes (Ions, Moleküls) kann entweder
), die in der Zellmembran stecken und
ihrem Substrat den Wechsel zwischen Intra- und Extrazellulärraum
erlauben. Dabei können diese unterschiedlich funktionieren: Der Durchtritt des Stoffes (Ions, Moleküls) kann entweder  ohne zusätzlichen
Energieaufwand mit seinem chemischen / elektrochemischen Gradienten erfolgen, also durch Diffusion - Passiver (downhill) Transport:
ohne zusätzlichen
Energieaufwand mit seinem chemischen / elektrochemischen Gradienten erfolgen, also durch Diffusion - Passiver (downhill) Transport:  Ungeladene Stoffe wandern entsprechend ihrem chemischen (Konzentrations-), Ionen entsprechend ihrem elektrochemischen Gradienten (zwei Gradienten: einerseits Konzentration, andererseits elektrische Spannung) - oder
Ungeladene Stoffe wandern entsprechend ihrem chemischen (Konzentrations-), Ionen entsprechend ihrem elektrochemischen Gradienten (zwei Gradienten: einerseits Konzentration, andererseits elektrische Spannung) - oder unter Energieaufwand - direkt oder indirekt - gegen seinen chemischen / elektrochemischen Gradienten: Aktiver (uphill) Transport.
unter Energieaufwand - direkt oder indirekt - gegen seinen chemischen / elektrochemischen Gradienten: Aktiver (uphill) Transport.  Ungeladene Stoffe werden gegen ihren Konzentrationsgradienten, Ionen gegen ihren elektrochemischen Gradienten befördert.
Ungeladene Stoffe werden gegen ihren Konzentrationsgradienten, Ionen gegen ihren elektrochemischen Gradienten befördert. Membranspannung (spannungsgesteuerte Kanäle, voltage-gated channels): Diese Ionenkanäle öffnen / schließen entsprechend dem Betrag des Membranpotentials. Sie
unterscheiden sich in ihrer Spezifität, d.h. Durchgängigkeit für
(bestimmte) Kationen
Membranspannung (spannungsgesteuerte Kanäle, voltage-gated channels): Diese Ionenkanäle öffnen / schließen entsprechend dem Betrag des Membranpotentials. Sie
unterscheiden sich in ihrer Spezifität, d.h. Durchgängigkeit für
(bestimmte) Kationen und / oder Anionen
und / oder Anionen . Die meisten öffnen bei Depolarisierung der Zellmembran (man findet solche Kanäle in erregbaren Zellen, z.B. Neuronen oder Herzmuskelzellen). Bei HCN-Kanälen ist es umgekehrt, diese öffnen bei Hyperpolarisierung der Membran.
. Die meisten öffnen bei Depolarisierung der Zellmembran (man findet solche Kanäle in erregbaren Zellen, z.B. Neuronen oder Herzmuskelzellen). Bei HCN-Kanälen ist es umgekehrt, diese öffnen bei Hyperpolarisierung der Membran. Anlagerung eines Signalstoffes (ligandengesteuerte Kanäle, ligand-gated channels):
Binden diese Ionenkanäle einen Signalstoff (z.B. Hormon oder
Neurotransmitter), geben sie für bestimmte Ionen die Membranpassage
entsprechend ihrem Konzentrationsgradienten frei. Koppelt der Signalstoff vom Rezeptor ab, schließt sich dieser wieder. Ligandengesteuerte Kanäle können auch auf intrazelluläre Signale reagieren (z.B. Kinasen).
Anlagerung eines Signalstoffes (ligandengesteuerte Kanäle, ligand-gated channels):
Binden diese Ionenkanäle einen Signalstoff (z.B. Hormon oder
Neurotransmitter), geben sie für bestimmte Ionen die Membranpassage
entsprechend ihrem Konzentrationsgradienten frei. Koppelt der Signalstoff vom Rezeptor ab, schließt sich dieser wieder. Ligandengesteuerte Kanäle können auch auf intrazelluläre Signale reagieren (z.B. Kinasen).  erlauben entweder transmembranale
Netto-Strömung entsprechend einer vorhandenen Konzentrationsdifferenz
(erleichterte Diffusion), oder
erlauben entweder transmembranale
Netto-Strömung entsprechend einer vorhandenen Konzentrationsdifferenz
(erleichterte Diffusion), oder  nutzen das Konzentrationsgefälle
einer anderen Substanz (z.B. von Natriumionen oder H+), mit der zusammen der "eigentlich"
transportierte Stoff (z.B. Glucose, Aminosäuren..) bewegt wird - entweder in dieselbe Richtung
(Cotransport, Symport) oder in die Gegenrichtung (Austausch, Antiport).
Das genutzte Konzentrationsgefälle der "anderen" Substanz wird
typischerweise durch primär-aktiven Transport aufrechterhalten (ATPasen
s. folgender Absatz).
nutzen das Konzentrationsgefälle
einer anderen Substanz (z.B. von Natriumionen oder H+), mit der zusammen der "eigentlich"
transportierte Stoff (z.B. Glucose, Aminosäuren..) bewegt wird - entweder in dieselbe Richtung
(Cotransport, Symport) oder in die Gegenrichtung (Austausch, Antiport).
Das genutzte Konzentrationsgefälle der "anderen" Substanz wird
typischerweise durch primär-aktiven Transport aufrechterhalten (ATPasen
s. folgender Absatz).Transporter sind spezifisch, d.h. sie transportieren nur bestimmte Stoffe; sie sind sättigbar, d.h. mit zunehmender Konzentrationsdifferenz nimmt die Geschwindigkeit des Transportes zunächst steil, mit zunehmender Sättigung immer weniger zu; und ihre Expression (Synthese) wird von der Zelle reguliert, d.h. dem Bedarf angepasst.
|
Der elektrochemische Gradient ΔG
ergibt sich - als die Summe des chemischen und des elektrischen Effekts
- aus Konzentrationsverhältnis des betreffenden Ions (extrazellulär: ce, intrazellulär: ci) und dem aktuellen Membranpotential:
ΔG = RT ln (ci/ce) + zFU
wobei R = Gaskonstante, T = absolute Temperatur, z = Wertigkeit des Ions, F = Faradaykonstante (Ladung eines mols einwertiger Ionen), U = Spannung (Membranpotential). Bei gegebenen Werten (Körpertemperatur: 310 K etc) und Umrechnung auf den dekadischen Logarithmus (=Hochzahl auf der Basis 10) lässt sich ein Membranpotential E (Gleichgewichtspotential) errechnen (bei dem kein transmembranaler Ionenstrom stattfindet): E = (61,5 mV / z) log (ce/ci) Diese Formulierung entspricht der Nernst'schen Gleichung. Weicht das aktuelle Membranpotential von [E] für das betreffende Ion ab, ergibt sich ein elektrochemischer Gradient, dem entsprechend das Ion durch die Membran diffundiert. |
 Poren in Membranen (die immer offen sind; z.B. Porine
in der äußeren Mitochondrienmembran, durch welche Moleküle bis 5 kDa
frei diffundieren können. Poren ermöglichen den Durchtritt von bis zu
2.109 Teilchen pro Sekunde.
Poren in Membranen (die immer offen sind; z.B. Porine
in der äußeren Mitochondrienmembran, durch welche Moleküle bis 5 kDa
frei diffundieren können. Poren ermöglichen den Durchtritt von bis zu
2.109 Teilchen pro Sekunde.Aquaporine stehen für den Durchtritt von Wasser bereit und werden an verschiedenen Stellen des Körpers bedarfsabhängig exprimiert. Kernporen ermöglichen den Durchtritt eher kleiner (bis 45 kDa) Moleküle zwischen Zellplasma und Zellkern, und sind Bestandteil eines komplexen Schleusensystems. Perforine bilden offene "Löcher" in der Membran von Zellen, die durch Wirkung zytotoxischer T-Lymphozyten angegriffen werden.
 Kanäle, die offen oder durch ein "Tor"verschlossen sein können (gated channels), z.B. für Na+, Cl-, K+, Ca++ - ihr Öffnungszustand oszilliert.
Beim Wechsel zwischen geöffnetem und geschlossenem Zustand durchlaufen
Kanäle eine Konformationsänderung; der geöffnete Zustand kann
unterschiedlich lang andauern. Kanäle lassen in geöffnetem Zustand 106 bis 108 Teilchen pro Sekunde hindurchtreten, also um 2-3 Größenordnungen weniger als Poren.
Kanäle, die offen oder durch ein "Tor"verschlossen sein können (gated channels), z.B. für Na+, Cl-, K+, Ca++ - ihr Öffnungszustand oszilliert.
Beim Wechsel zwischen geöffnetem und geschlossenem Zustand durchlaufen
Kanäle eine Konformationsänderung; der geöffnete Zustand kann
unterschiedlich lang andauern. Kanäle lassen in geöffnetem Zustand 106 bis 108 Teilchen pro Sekunde hindurchtreten, also um 2-3 Größenordnungen weniger als Poren.Darüber hinaus verfügen Kanäle über Sensoren, die auf die chemische (extrazelluläre Liganden, intrazelluläre second messenger) oder elektrische Signale (Membranpotential) mit einer Änderung ihrer Öffnungswahrscheinlichkeit reagieren. Schließlich haben Kanäle einen Selektivitätsfilter, der bestimmt, welche Ionen passieren können. Meist sind Kanäle für ein bestimmtes Ion ziemlich durchgängig ("Kaliumkanal", "Natriumkanal" usw). Dabei beeinflusst das Aminosäuremuster der Domänen (Helices), aus denen die Pore aufgebaut ist, deren Transporteigenschaften (hydrophob vs. hydrophil) und -spezifitäten (welches Ion wird unter welchen Bedinungen wie stark durchgelassen?).
 Carrier
(Transporter), die über ein äußeres und ein inneres Tor verfügen, die
alternartiv geöffnet werden - sie durchlaufen jeweils einen definierten Funktionszyklus. Dadurch ist es möglich, im Rahmen eines
mehrschrittigen Verfahrens Ionen auf einer Seite "einzufangen" und dann
auf der anderen Seite der Membran wieder freizusetzen. Carrier "schaffen" pro Sekunde allerdings nur 200 bis 5.104 Teilchen, um Zehnerpotenzen weniger als Kanäle.
Carrier
(Transporter), die über ein äußeres und ein inneres Tor verfügen, die
alternartiv geöffnet werden - sie durchlaufen jeweils einen definierten Funktionszyklus. Dadurch ist es möglich, im Rahmen eines
mehrschrittigen Verfahrens Ionen auf einer Seite "einzufangen" und dann
auf der anderen Seite der Membran wieder freizusetzen. Carrier "schaffen" pro Sekunde allerdings nur 200 bis 5.104 Teilchen, um Zehnerpotenzen weniger als Kanäle.Carrier sind nie durchgängig offen, ein Tor (das äußere oder das innere) ist immer verschlossen. Einige Carrier ermöglichen Diffusion kleiner gelöster Stoffe, wie z.B. Glucose (erleichterte Diffusion). Im Gegensatz zu einfacher Diffusion (deren Intensität linear mit der Konzentrationsdifferenz des diffundierenden Stoffes ansteigt) unterliegt der Transport bei erleichterter Diffusion einer Sättigungskinetik (nichtlinear: Mit zunehmender Konzentrationsdifferenz wird die Zunahme der Diffusion immer geringer).
Poren bestehen aus ß-Faltblattstrukturen (sie stehen immer offen); Ionenkanäle (die nur oszillierend öffnen) sind aus helikalen Strukturen aufgebaut, die parallel zueinander in die Membran "gesteckt" erscheinen. So kann z.B. ein Kaliumkanal aus vier Untereinheiten aufgebaut sein, die ihrerseits aus 2-6 transmembranalen α-Helices bestehen.

 Abbildung: Diffusion, Osmose und passiver Transport
Abbildung: Diffusion, Osmose und passiver TransportNach einer Vorlage bei Pearson Education 2010
Links: Einfache passive Diffusion durch eine Zellmembran (Gase, kleine polare Moleküle wie Harnstoff
oder Ethanol). Die Transportrate nimmt (bis zu einer Obergrenze) linear mit der Konzentrationsdifferenz zu.
Mitte: Erleichterte Diffusion (facilitated diffusion), d.h. durch ein Kanalprotein - spezifisch oder unspezifisch. Bei sättigbaren Mechanismen ("Carrier", "Pumpe") nimmt die Transportrate mit zunehmender Konzentrationsdifferenz immer weniger zu (Michaelis-Menten-Kinetik). Erleichterte Diffusion kann auch über Symport (z.B. Na/K/2Cl) oder Antiport (z.B. Cl/Bicarbonat-Austausch) erfolgen.
Rechts: Wasser diffundiert einfach (Osmose = Diffusion des Lösungsmittels) und durch Aquaporine erleichtert
Mitte: Erleichterte Diffusion (facilitated diffusion), d.h. durch ein Kanalprotein - spezifisch oder unspezifisch. Bei sättigbaren Mechanismen ("Carrier", "Pumpe") nimmt die Transportrate mit zunehmender Konzentrationsdifferenz immer weniger zu (Michaelis-Menten-Kinetik). Erleichterte Diffusion kann auch über Symport (z.B. Na/K/2Cl) oder Antiport (z.B. Cl/Bicarbonat-Austausch) erfolgen.
Rechts: Wasser diffundiert einfach (Osmose = Diffusion des Lösungsmittels) und durch Aquaporine erleichtert

 Abbildung). Ihre Eigenschaften - z.B. die
Beziehung zwischen Spannung und Stromstärke - lassen sich mit der Patch-clamp-Methode
untersuchen, bei der ein Stück Zellmembran mit nur wenigen oder nur einem einzelnen
Ionenkanal an die Spitze einer Mikropipette gebracht und so separiert
studiert werden kann.
Abbildung). Ihre Eigenschaften - z.B. die
Beziehung zwischen Spannung und Stromstärke - lassen sich mit der Patch-clamp-Methode
untersuchen, bei der ein Stück Zellmembran mit nur wenigen oder nur einem einzelnen
Ionenkanal an die Spitze einer Mikropipette gebracht und so separiert
studiert werden kann.Zur Selektivität von Ionenkanälen s. die nächste Abbildung (Beispiel Natrium vs. Kalium)::

 Abbildung: Selektive Ionenpermeabilität der Zellmembran
Abbildung: Selektive Ionenpermeabilität der ZellmembranNach einer Vorlage in Kandel / Koester / Mack / Siegelbaum (eds), Principles of Neural Sciences, 6th ed. 2021 (McGraw Hill)
Links oben: Ionen sind in Lösung von einem Wassermantel umgeben, z.B. lagern sich an Kationen negativ geladene Sauerstoffpole von H2O-Molekülen an. Der entstehende Hydratmantel macht eine Interaktion der Ionen mit Phospholipiden in der Zellmembran unwahrscheinlich.
Links unten: Natriumionen sind kleiner als Kaliumionen, haben aber (wegen höherer Feldstärke) einen größeren Hydratmantel. Die engeren Kaliumkanäle (effektiver Poren- Innendurchmesser 0,3 nm) lassen Kalium, nicht aber Natrium passieren. Dabei "hüpfen" Kaliumionen vermutlich paarweise hintereinander, durch Wassermoleküle getrennt, jeweils im Abstand einer leerbleibenden Bindungsstelle durch den Kanal (nicht gezeigt)
Rechts: Natriumkanäle zeigen selektives Filterverhalten: Vermutlich lagern aktive Stellen in der Kanalwand (negativ geladene Partien von Aminosäuren) vorübergehend Na+ und einzelne Wassermoleküle (am Wasserstoffpol) an, der Hydratmantel "zerreißt" für kurze Zeit (<1 µs), hinter der Engstelle formiert er sich wieder um das Na+. Für K+ (mit seinem größeren Durchmesser) funktioniert das nicht, es bleibt von der Passage (weitgehend) ausgeschlossen

Die Wahrscheinlichkeit des "Offen"-Zustandes von Ionenkanälen kann beeinflusst werden durch die Anlagerung von Signalstoffen (interzellulären Mediatoren, wie Hormonen, Transmittern etc) (ligand gated), Änderungen des Membranpotentials (voltage gated), mechanische Kräfte (stretch activated), Temperatur (temperature activated), Status intrazellulärer Speicher (store activated). Obwohl Ionenkanäle relativ hohe Transportwerte ermöglichen, sind sie auch sättigbar in dem Sinne, dass ihre Zahl und Transportrate begrenzt sind.
Bei spannungsabhängigen Ionenkanälen (voltage gated ion channels) bilden positiv geladene Aminosäureketten im Ionenkanal Spannungssensoren, die ihre Position je nach Membranpotential verändern. Diese Konformationsschwankungen öffnen bzw. schließen den Ionenkanal. Unabhängig davon kann ein zusätzlicher Abschnitt des Rezeptorkomplexes von die Innenseite aus die Passage durch den Ionenkanal verschließen (wie ein "Stöpsel" - "ball and chain inactivation",
 vgl. dort), auch bei ligandenaktivierten Kanälen (ligand gated ion channels); dann
ist der Kanal "inaktiviert" (spannungsabhängige Kanäle) oder
"desensitisiert" (ligandengesteuerte Kanäle) und für Ionen
vorübergehend unpassierbar. Erst die Entfernung des "Stöpsels" aus dem
intrazellulären Kanaleingang macht den Kanal wieder aktivierbar.
vgl. dort), auch bei ligandenaktivierten Kanälen (ligand gated ion channels); dann
ist der Kanal "inaktiviert" (spannungsabhängige Kanäle) oder
"desensitisiert" (ligandengesteuerte Kanäle) und für Ionen
vorübergehend unpassierbar. Erst die Entfernung des "Stöpsels" aus dem
intrazellulären Kanaleingang macht den Kanal wieder aktivierbar.Mehrere Isoformen von Ionenkanälen für Natrium, Kalium, Calcium und Chlorid finden sich in der Membran aller Zellen. Kaliumkanäle weisen eine besonders große Diversität auf. Spannungsgesteuerte Na+- und Ca++-Kanäle bestehen aus kanalbildenden und regulatorischen Untereinheiten, sie ermöglichen Aktionspotentiale bzw. deren Verlängerung, und Calciumeinstrom in Neurone vermittelt deren Transmitterfreigabe. Ligandengesteuerte Kanäle sind z.B. (exzitatorisch wirkende) cholinerge und glutamaterge, oder (inhibitorsich wirkende) glycinerge und GABAerge Kanäle.
Kanalproteine sind auch Aquaporine ("Wasserkanäle") sowie junktionale Kanäle in interzellulären Verbindungsstrukturen (gap junctions, wohl auch tight junctions).
 Transporter (Carrier), die das zu transportierende Molekül vorübergehend anlagern, um über eine Konformationsänderung seinen Durchtritt
zu ermöglichen, können ~1 bis
103
Konformationsänderungen pro Sekunde durchlaufen. Dieser Transport
erfolgt ebenfalls ohne Energieaufwand,
entsprechend dem elektrochemischen bzw. Konzentrationsgradienten des Transportgutes. Der
Mechanismus ist nicht nur sättigbar, er kann auch durch Substrat-Analoge gehemmt
werden (Transportkinetik).
Transporter (Carrier), die das zu transportierende Molekül vorübergehend anlagern, um über eine Konformationsänderung seinen Durchtritt
zu ermöglichen, können ~1 bis
103
Konformationsänderungen pro Sekunde durchlaufen. Dieser Transport
erfolgt ebenfalls ohne Energieaufwand,
entsprechend dem elektrochemischen bzw. Konzentrationsgradienten des Transportgutes. Der
Mechanismus ist nicht nur sättigbar, er kann auch durch Substrat-Analoge gehemmt
werden (Transportkinetik).Beispiel: Glucosetransporter (GLUT), ein sogenannter Uniporter-Mechanismus (singulärer Transport eines Substratmoleküls nach seinem Konzentrationsgradienten).
 Aktiver Transport (uphill) kann erfolgen
Aktiver Transport (uphill) kann erfolgen  durch direkten Verbrauch (Hydrolyse) von ATP - primär aktiver Transport; Beispiel: Die allgegenwärtige Na/K-Pumpe;
durch direkten Verbrauch (Hydrolyse) von ATP - primär aktiver Transport; Beispiel: Die allgegenwärtige Na/K-Pumpe; unter Nutzung einer vorher (aktiv) schon aufgebauten
Konzentrationsdifferenz eines Stoffes, der für einen Mittransport (Symport) oder Austausch (Antiport) des zu transportierenden Stoffes durch die Membran genützt wird (sekundär aktiver Transport).
unter Nutzung einer vorher (aktiv) schon aufgebauten
Konzentrationsdifferenz eines Stoffes, der für einen Mittransport (Symport) oder Austausch (Antiport) des zu transportierenden Stoffes durch die Membran genützt wird (sekundär aktiver Transport).| Passiver Transport (downhill) mit (elektro-) chemischen Gradienten |
Aktiver Transport (uphill) gegen (elektro-) chemische Gradienten |
|
| Kanäle Transporter (Carrier) erleichterte Diffusion z.B. Kaliumkanal Glucosetransporter |
ATPasen primär aktiv z.B. Na/K-Pumpe |
|
| Symporter sekundär aktiv z.B. Natrium-Glucose- Cotransporter |
Antiporter sekundär aktiv z.B. Natrium-Calcium- Austauscher |
|
Solche Einteilungen sind bis zu einem gewissen Grad immer willkürlich, denn woher kommt beim "passiven" Transport der
elektrochemische Gradient, der diesen antreibt? Er muss ebenfalls
durch "aktive" Prozesse entstanden sein, z.B. durch
die Tätigkeit von Na/K-ATPasen.
Die Geschwindigkeit des Austausches von Stoffen über Membranen ist von mehreren Faktoren abhängig, wie
 von bestehenden Konzentrationsdifferenzen;
von bestehenden Konzentrationsdifferenzen;
 von elektrischen Ladungen, die sich durch Transportvorgänge aufbauen (Membranpotential);
von elektrischen Ladungen, die sich durch Transportvorgänge aufbauen (Membranpotential);
 von der Zahl verfügbarer Transporter (allfällige Sättigung
des Transportsystems mit dem "Passagier");
von der Zahl verfügbarer Transporter (allfällige Sättigung
des Transportsystems mit dem "Passagier");
 allenfalls von
gleichzeitiger Anwesenheit anderer Komponenten, die um den Transport
über ein und dasselbe System konkurrieren (Kompetition);
allenfalls von
gleichzeitiger Anwesenheit anderer Komponenten, die um den Transport
über ein und dasselbe System konkurrieren (Kompetition);
 von der Verfügbarkeit des Energieträgers (wenn der Transport energieverbrauchend ist; meist ATP).
von der Verfügbarkeit des Energieträgers (wenn der Transport energieverbrauchend ist; meist ATP).
 von bestehenden Konzentrationsdifferenzen;
von bestehenden Konzentrationsdifferenzen;  von elektrischen Ladungen, die sich durch Transportvorgänge aufbauen (Membranpotential);
von elektrischen Ladungen, die sich durch Transportvorgänge aufbauen (Membranpotential);  von der Zahl verfügbarer Transporter (allfällige Sättigung
des Transportsystems mit dem "Passagier");
von der Zahl verfügbarer Transporter (allfällige Sättigung
des Transportsystems mit dem "Passagier");  allenfalls von
gleichzeitiger Anwesenheit anderer Komponenten, die um den Transport
über ein und dasselbe System konkurrieren (Kompetition);
allenfalls von
gleichzeitiger Anwesenheit anderer Komponenten, die um den Transport
über ein und dasselbe System konkurrieren (Kompetition);  von der Verfügbarkeit des Energieträgers (wenn der Transport energieverbrauchend ist; meist ATP).
von der Verfügbarkeit des Energieträgers (wenn der Transport energieverbrauchend ist; meist ATP).
| Passage / passiver Transport (downhill) elektrochemischen Gradienten folgend |
Aktiver Transport (uphill) gegen elektrochemische Gradienten (primär aktiv) |
|||
| Permeasen / Transporter erleichterte Diffusion |
Ionen- kanäle |
Natrium | ATPasen | |
| Kalium | P-Typ |
|||
| Calcium | F-Typ |
|||
| Chlorid | V-Typ |
|||
| Aquaporine |
H2O |
ABC-Transporter | ||
| Ionen- kanäle |
Glutamatrezeptor |
|||
| CNG | Cotransport (sekundär aktiv) | |||
| HCN | Antiporter | |||
| TRP |
||||
| Solute carrier, OAT, OCT | ||||
Transporter, die in anderen Teilen dieser Website erklärt werden:
| Passiver Transport (downhill) elektrochemischen Gradienten folgend |
||
| Permeasen / Transporter erleichterte Diffusion |
Ionen- kanäle |
TRP-Kanäle (Ca++, Na+, Mg++, Zn++, Fe++) |
| Nikotinischer Rezeptor | ||
| Purinerg-ionotroper Rezeptor (P2XR) |
||
| Glyzinrezeptor | ||
| GABA-Rezeptor | ||
| Ionotroper Glutamatrezeptor |
||
| Solute carrier |
GLUT | |
| Harnstofftransporter (UT) | ||
| Transportsysteme in Hepatozyten |
||
Aquaporine
 Aquaporine ("Wasserkanäle") sind
Komplexe aus jeweils 6 transmembranalen α-Domänen, die (polare!) Wassermoleküle rascher durch Zellmembranen
diffundieren lassen als durch die Phospholipidschichte alleine (je mehr
Aquaporine eine Membran enthält, umso raschen kann Wasser sie
passieren). Einige (sogenannte Aquaglyzeroporine) erleichtern auch den Durchtritt apolarer Moleküle wie CO2, Ammoniak und Harnstoff.
Aquaporine ("Wasserkanäle") sind
Komplexe aus jeweils 6 transmembranalen α-Domänen, die (polare!) Wassermoleküle rascher durch Zellmembranen
diffundieren lassen als durch die Phospholipidschichte alleine (je mehr
Aquaporine eine Membran enthält, umso raschen kann Wasser sie
passieren). Einige (sogenannte Aquaglyzeroporine) erleichtern auch den Durchtritt apolarer Moleküle wie CO2, Ammoniak und Harnstoff. Unterschiedliche Gewebe exprimieren unterschiedliche Aquaporine (AQP0, AQP1 etc - in der Biologie kennt man über 200 verschiedene Aquaporine, bei Säugetieren 13) mit unterschiedlichen funktionellen Eigenschaften. Meist sind es homologe Tetramere (vier idente Untereinheiten à 6 miteinander verbundenen transmembranalen α-Helices). Der Gesamtkomplex bildet einen gemeinsamen größeren Kanal mit speziellen funktionellen Eigenschaften (Porenweite, Durchlässigkeit etc). Die Regulation ihrer Zahl in der Zellmembran erfolgt (beim Menschen) zum Großteil durch Verlagerung der Tetramere zwischen intrazellulärer und externer Membranposition (trafficking).
Aquaporine werden vor allem von Zellen exprimiert, durch die reger Wasseraustausch stattfindet (Nierentubuli, exokrine Drüsen, Erythrozyten, Kapillarwände, Lungenalveolen, Gallenblase). Stark belastete Muskelzellen geben Lactat und Kalium an ihre Umgebung ab, was hier die Osmolalität steigert und Wasser (durch Aquaporin-1-Kanäle) aus der Blutbahn in das Interstitium saugt (der aktive Muskel schwillt an).
Wasser kann im Gewebe zwischen (parazellulär, z.B. durch Systeme von Schlussleisten) oder durch Zellen (transzellulär, insbesondere vermittels Aquaporinen) gelangen. Der Mechanismus, der das Wasser befördert, kann eine Strömung sein - konvektiv, entsprechend (hydrostatischen) Druckgradienten, wie bei der kapillären Filtration oder dem Lymphfluss; entsprechend einer Konzentrationsdifferenz (durch Diffusion oder Osmose) auf die Seite geringerer Wasserkonzentration.
Die Durchlässigkeit einer Grenzfläche - z.B. Zellmembran, Kapillarwand - gegenüber einer Wasserströmung nennt man ihre hydraulische Leitfähigkeit. Die Konzentration von Wasser (~56.000 mM) ändert sich umgekehrt proportional zur Osmolalität einer Körperflüssigkeit (meist knapp 300 mOsm).

 Abbildung: Aquaporin als "Wasserkanal" in der Zellmembran
Abbildung: Aquaporin als "Wasserkanal" in der ZellmembranNach einer Vorlage bei nobelprize.org
Gezeigt
ist ein Aquaporin1-Kanal. Die positive Ladung in seiner Mitte verhindert den Durchtritt von H3O+ und damit von Wasserstoffionen
(Sauerstoffatome rot, Wasserstoffatome weiß dargestellt).
Die zentrale Engstelle des "sanduhrförmigen" Kanals (bei AQP1 ~3 nm) ist so beschaffen, dass sie selektiv H2O-Moleküle durchtreten lässt, wahrscheinlich über Wasserstoffbrückenbindungen zu speziellen Aminosäuren in der Kanalenge. Die Durchtrittsquote beträgt z.B. bei AQP1 etwa 109 Moleküle pro Sekunde
Die zentrale Engstelle des "sanduhrförmigen" Kanals (bei AQP1 ~3 nm) ist so beschaffen, dass sie selektiv H2O-Moleküle durchtreten lässt, wahrscheinlich über Wasserstoffbrückenbindungen zu speziellen Aminosäuren in der Kanalenge. Die Durchtrittsquote beträgt z.B. bei AQP1 etwa 109 Moleküle pro Sekunde

Aquaporine erlauben die Passage der Wassermoleküle
in einer Weise, dass bis zur Mitte der Pore das Sauerstoffatom, dann
die Wasserstoffatome "vorwärts" gerichtet sind ( Abbildung).
Protonen werden dadurch an der Passage ausgeschlossen, was für die
Erhaltung der zellulären Homöostase wichtig ist (Protonen "reiten"
gerne auf Wassermolekülen mit - "proton wire").
Abbildung).
Protonen werden dadurch an der Passage ausgeschlossen, was für die
Erhaltung der zellulären Homöostase wichtig ist (Protonen "reiten"
gerne auf Wassermolekülen mit - "proton wire").
Orthodoxe Aquaporine (AQP 0, 1, 2, 4, 5, 8) lassen nur Wasser passieren, Aquaglyceroporine (AQP 3, 7, 9) auch u.a. Glycerin und Harnstoff.
 Aquaporin 0 in der Augenlinse (auch AQP1 und AQP5)
Aquaporin 0 in der Augenlinse (auch AQP1 und AQP5)

 Aquaporin 1: Erythrozyten sowie die apikale und basale Membran von Zellen im proximalen Tubulus und im absteigenden Schenkel der Henle-Schleife sind konstitutiv (von der Anlage her) mit Aquaporin 1 ausgestattet
Aquaporin 1: Erythrozyten sowie die apikale und basale Membran von Zellen im proximalen Tubulus und im absteigenden Schenkel der Henle-Schleife sind konstitutiv (von der Anlage her) mit Aquaporin 1 ausgestattet

 Aquaporin 2 (die apikale Membran von Sammelrohrepithelzellen lagert unter der Wirkung von Vasopressin Aquaporin ein)
Aquaporin 2 (die apikale Membran von Sammelrohrepithelzellen lagert unter der Wirkung von Vasopressin Aquaporin ein)

 Aquaporin 3 (basolaterale Membran von Sammelrohrepithelzellen)
Aquaporin 3 (basolaterale Membran von Sammelrohrepithelzellen)

 Aquaporin 4 (basolaterale Membran von Sammelrohrepithelzellen; beteiligt an der Blut-Hirn-Schranke)
Aquaporin 4 (basolaterale Membran von Sammelrohrepithelzellen; beteiligt an der Blut-Hirn-Schranke)

 Aquaporin 5 (Azinuszellen der Speicheldrüsen)
Aquaporin 5 (Azinuszellen der Speicheldrüsen)
 Existenz
und Struktur der Aquaporine wurde in den 1980er-Jahren durch
Forschungen des Teams um den US-amerikanischen Biochemiker Peter Agre ergründet, wofür er 2003 den Nobelpreis für Chemie erhielt.
Existenz
und Struktur der Aquaporine wurde in den 1980er-Jahren durch
Forschungen des Teams um den US-amerikanischen Biochemiker Peter Agre ergründet, wofür er 2003 den Nobelpreis für Chemie erhielt.
 Abbildung).
Protonen werden dadurch an der Passage ausgeschlossen, was für die
Erhaltung der zellulären Homöostase wichtig ist (Protonen "reiten"
gerne auf Wassermolekülen mit - "proton wire").
Abbildung).
Protonen werden dadurch an der Passage ausgeschlossen, was für die
Erhaltung der zellulären Homöostase wichtig ist (Protonen "reiten"
gerne auf Wassermolekülen mit - "proton wire").Orthodoxe Aquaporine (AQP 0, 1, 2, 4, 5, 8) lassen nur Wasser passieren, Aquaglyceroporine (AQP 3, 7, 9) auch u.a. Glycerin und Harnstoff.
 Aquaporin 0 in der Augenlinse (auch AQP1 und AQP5)
Aquaporin 0 in der Augenlinse (auch AQP1 und AQP5)
 Aquaporin 1: Erythrozyten sowie die apikale und basale Membran von Zellen im proximalen Tubulus und im absteigenden Schenkel der Henle-Schleife sind konstitutiv (von der Anlage her) mit Aquaporin 1 ausgestattet
Aquaporin 1: Erythrozyten sowie die apikale und basale Membran von Zellen im proximalen Tubulus und im absteigenden Schenkel der Henle-Schleife sind konstitutiv (von der Anlage her) mit Aquaporin 1 ausgestattet
 Aquaporin 2 (die apikale Membran von Sammelrohrepithelzellen lagert unter der Wirkung von Vasopressin Aquaporin ein)
Aquaporin 2 (die apikale Membran von Sammelrohrepithelzellen lagert unter der Wirkung von Vasopressin Aquaporin ein)
 Aquaporin 3 (basolaterale Membran von Sammelrohrepithelzellen)
Aquaporin 3 (basolaterale Membran von Sammelrohrepithelzellen)
 Aquaporin 4 (basolaterale Membran von Sammelrohrepithelzellen; beteiligt an der Blut-Hirn-Schranke)
Aquaporin 4 (basolaterale Membran von Sammelrohrepithelzellen; beteiligt an der Blut-Hirn-Schranke)
 Aquaporin 5 (Azinuszellen der Speicheldrüsen)
Aquaporin 5 (Azinuszellen der Speicheldrüsen) Existenz
und Struktur der Aquaporine wurde in den 1980er-Jahren durch
Forschungen des Teams um den US-amerikanischen Biochemiker Peter Agre ergründet, wofür er 2003 den Nobelpreis für Chemie erhielt.
Existenz
und Struktur der Aquaporine wurde in den 1980er-Jahren durch
Forschungen des Teams um den US-amerikanischen Biochemiker Peter Agre ergründet, wofür er 2003 den Nobelpreis für Chemie erhielt.
Das Genom
des Menschen enthält zahlreiche Baupläne für Varianten von
Ionenkanälen: 9 Gene für spannungsgesteuerte Natriumkanäle, 10 Gene für Calciumkanäle, mehr als ein Dutzend Chloridkanäle, 70 für
ligandengesteuerte Kanäle, 80 Gene für Kaliumkanäle. Diese Gene kann
man Genfamilien und Gen-Superfamilien zuordnen, mit ähnlichem Aufbau
und analoger Funktion der Kanäle.

Abbildung: Ionentransportsysteme in Zellmembranen
Nach einer Vorlage in Boron W, Boulpaep E: Medical Physiology, 1st ed., Saunders 2003

Ionenkanäle (Abbildung) haben meist eindeutige Präferenz für ein bestimmtes Ion. Sie können (in)aktiviert werden durch
 Bindung von Liganden
Bindung von Liganden  (ligandengesteuerter Kanal, "ionotroper" Rezeptor) oder durch
(ligandengesteuerter Kanal, "ionotroper" Rezeptor) oder durch
 Änderung des Membranpotentials (spannungsgesteuerter Ionenkanal). So fördern z.B. spannungsabhängige Calciumkanäle (Voltage dependent calcium channels, VDCC) Einstrom von Calciumionen in die Zelle.
Änderung des Membranpotentials (spannungsgesteuerter Ionenkanal). So fördern z.B. spannungsabhängige Calciumkanäle (Voltage dependent calcium channels, VDCC) Einstrom von Calciumionen in die Zelle.
 Ionenkanäle und damit die Zellfunktion können in vielfacher Weise durch
Medikamente beeinflusst
werden - beispielsweise ligandengesteuerte durch Nikotin (ahmt Acetylcholinwirkung an nikotinergen Rezeptoren nach),
spannungsgesteuerte durch Lidokain (ein Lokalanästhetikum, verhindert
das Entstehen von Aktionspotentialen).
Ionenkanäle und damit die Zellfunktion können in vielfacher Weise durch
Medikamente beeinflusst
werden - beispielsweise ligandengesteuerte durch Nikotin (ahmt Acetylcholinwirkung an nikotinergen Rezeptoren nach),
spannungsgesteuerte durch Lidokain (ein Lokalanästhetikum, verhindert
das Entstehen von Aktionspotentialen).

Abbildung: Ionentransportsysteme in Zellmembranen
Nach einer Vorlage in Boron W, Boulpaep E: Medical Physiology, 1st ed., Saunders 2003
Transportsysteme
finden sich in der Plasmamembran sowie der Membran von Zellorganellen.
Sie sind im folgenden Abschnitt beschrieben.
In der Abbildung sind typische Kanäle / Austauscher / Pumpen nebeneinander dargestellt. Zellen exprimieren diese je nach Bedarf an bestimmten Orten, unterschiedlich z.B. zwischen apikaler und basolateraler Membran sowie verschiedenen Organellen
In der Abbildung sind typische Kanäle / Austauscher / Pumpen nebeneinander dargestellt. Zellen exprimieren diese je nach Bedarf an bestimmten Orten, unterschiedlich z.B. zwischen apikaler und basolateraler Membran sowie verschiedenen Organellen

Ionenkanäle (Abbildung) haben meist eindeutige Präferenz für ein bestimmtes Ion. Sie können (in)aktiviert werden durch
 Bindung von Liganden
Bindung von Liganden  (ligandengesteuerter Kanal, "ionotroper" Rezeptor) oder durch
(ligandengesteuerter Kanal, "ionotroper" Rezeptor) oder durch  Änderung des Membranpotentials (spannungsgesteuerter Ionenkanal). So fördern z.B. spannungsabhängige Calciumkanäle (Voltage dependent calcium channels, VDCC) Einstrom von Calciumionen in die Zelle.
Änderung des Membranpotentials (spannungsgesteuerter Ionenkanal). So fördern z.B. spannungsabhängige Calciumkanäle (Voltage dependent calcium channels, VDCC) Einstrom von Calciumionen in die Zelle.| Freie Calciumionen (Ca++) liegen außerhalb der Zelle (Interstitium, Extrazellulärraum) um >3 Zehnerpotenzen konzentrierter vor als im Zytoplasma Dieses hohe extra / intrazelluläre Konzentrationsverhältnis bedingt einen intensiven Calciumgradienten in die Zelle (Gleichgewichtspotential ca. +150 mV) |
 Ionenkanäle und damit die Zellfunktion können in vielfacher Weise durch
Medikamente beeinflusst
werden - beispielsweise ligandengesteuerte durch Nikotin (ahmt Acetylcholinwirkung an nikotinergen Rezeptoren nach),
spannungsgesteuerte durch Lidokain (ein Lokalanästhetikum, verhindert
das Entstehen von Aktionspotentialen).
Ionenkanäle und damit die Zellfunktion können in vielfacher Weise durch
Medikamente beeinflusst
werden - beispielsweise ligandengesteuerte durch Nikotin (ahmt Acetylcholinwirkung an nikotinergen Rezeptoren nach),
spannungsgesteuerte durch Lidokain (ein Lokalanästhetikum, verhindert
das Entstehen von Aktionspotentialen).
 Abbildung: Natrium- und Kalium-Permease ("Kanal")
Abbildung: Natrium- und Kalium-Permease ("Kanal")Nach Bohnen MS et al, Molecular Pathophysiology of Congenital Long QT Syndrome. Physiol Rev 2016; 97: 89-134
Ionenkanäle erlauben mehr oder weniger selektive Passage von z.B. Natrium- oder Kaliumionen durch die Zellmembran - entsprechend ihrem elektrochemischen Gradienten (erleichterte Diffusion). Das Konzentrationsgefälle für Kalium (innen ~150, außen 4-5 mM) und Natrium (außen 140-145, innen 8-30 mM) wird durch eine ATPase ("Na/K-Pumpe") hergestellt. Die Zellmembran ist ansonsten für Ionen weitgehend undurchlässig.
Öffnungswahrscheinlichkeit und damit Durchlässigkeit der Permeasen hängen von den Begleitumständen (z.B. Membranpotential) ab

Natriumkanäle funktionieren auf verschiedene Weise:
 Spannungsabhängige Natriumkanäle (Nav, voltage gated sodium channels)
finden sich in der Membran aller Nervenzellen, wo sie insbesondere für
den Aufstrich des Aktionspotentials sorgen - Depolarisation öffnet sie (
Spannungsabhängige Natriumkanäle (Nav, voltage gated sodium channels)
finden sich in der Membran aller Nervenzellen, wo sie insbesondere für
den Aufstrich des Aktionspotentials sorgen - Depolarisation öffnet sie ( s. auch dort). Diese Natriumkanäle sind aus einer α-Untereinheit - einer langen Peptidkette, bestehend aus vier identen (homologen) Domänen ("repeats", genannt α-I bis α-IV) - sowie zwei kleineren ß-Untereinheiten
- diese können die Öffnungswahrscheinlichkeit des Kanals beeinflussen -
zusammengesetzt. Die vier Domänen der α-Untereinheit sind wiederum aus
Segmenten (S1 bis S6) aufgebaut, wobei jeweils die Segmente S4 spannungssensitiv sind. Diese S4-Segmente sind mit einem "Aktivierungstor" (activation gate) assoziiert; ein "Inaktivierungstor" (inactivation gate) - das man sich wie einen beweglichen Verschlussball vorstellen kann (
s. auch dort). Diese Natriumkanäle sind aus einer α-Untereinheit - einer langen Peptidkette, bestehend aus vier identen (homologen) Domänen ("repeats", genannt α-I bis α-IV) - sowie zwei kleineren ß-Untereinheiten
- diese können die Öffnungswahrscheinlichkeit des Kanals beeinflussen -
zusammengesetzt. Die vier Domänen der α-Untereinheit sind wiederum aus
Segmenten (S1 bis S6) aufgebaut, wobei jeweils die Segmente S4 spannungssensitiv sind. Diese S4-Segmente sind mit einem "Aktivierungstor" (activation gate) assoziiert; ein "Inaktivierungstor" (inactivation gate) - das man sich wie einen beweglichen Verschlussball vorstellen kann ( Abbildung) - liegt zwischen den Domänen α-III (S6) und α-IV (S1). Der Natriumkanal ist für Na+ gesperrt, wenn entweder das Aktivierungtor oder das Inaktivierungstor (oder beide) geschlossen ist (sind).
Abbildung) - liegt zwischen den Domänen α-III (S6) und α-IV (S1). Der Natriumkanal ist für Na+ gesperrt, wenn entweder das Aktivierungtor oder das Inaktivierungstor (oder beide) geschlossen ist (sind).Spannungsgesteuerte Natriumkanäle finden sich außer an Neuronen auch in der Membran von Muskel-, Glia- oder Epithelzellen.

 Abbildung: Spannungssensitiver Natriumkanal (Modellvorstellung)
Abbildung: Spannungssensitiver Natriumkanal (Modellvorstellung)Nach einer Vorlage bei Costanzo LS, Physiology, 7th ed. Elsevier 2022
Spannungsgesteuerte Natriumkanäle in der Membran von Nervenzellen sind aus jeweils 4 (fast identen) Domänen aufgebaut und reagieren auf den Betrag des Membranpotentials.
Oben: Der Natriumkanal verfügt über ein "Aktivierungstor" sowie ein auf der Membraninnenseite liegendes "Inaktivierungstor". Beide Tore blockieren im geschlossenen Zustand den Einstrom von Natriumionen in die Zelle.
Unten: Im Ruhezustand ist das Aktivierungstor geschlossen (1), der Natriumkanal blockiert den Na+-Einstrom, die Membran ist aufgeladen (Ruhepotential). In diesem Zustand ist die Zelle erregbar. Überschwellige Reize führen zu einer Konformationsänderung der Natriumkanäle: Das Aktivierungstor reagiert zuerst, es öffnet und Natrium strömt in die Zelle (2). ~1 ms später reagiert auch das Inaktivierungstor, es schließt, der Natriumeinstrom stoppt und der Kanal gelangt in einen dritten, inaktivierten Zustand (3), in dem er nicht erregbar (refraktär) ist.
Schließlich ist die Zelle repolarisiert, der Zustand (1) der Natriumkanäle stellt sich wieder her

Spannungsgesteuerte Natriumkanäle können in unterschiedlichen Zuständen vorliegen:
 Geschlossen / aktivierbar (resting),
dieser Zustand ist bei einem Membranpotential von über -60 mV (Bereich
des Ruhepotentials) der wahrscheinlichste. In dieser Phase ist das
Aktivierungstor geschlossen und das Inaktivierungstor offen; der Kanal
ist geschlossen (reprimed, deactivated)
Geschlossen / aktivierbar (resting),
dieser Zustand ist bei einem Membranpotential von über -60 mV (Bereich
des Ruhepotentials) der wahrscheinlichste. In dieser Phase ist das
Aktivierungstor geschlossen und das Inaktivierungstor offen; der Kanal
ist geschlossen (reprimed, deactivated) Bei einer Verringerung des Membranpotentials unter -50 mV (unmittelbar nach einer depolarisierenden Reizung - Erregung der Zelle) öffnet das Aktivierungstor (das Inaktivierungstor ist schon offen), und der Kanal ist geöffnet (open / activated), Na+ strömt in die Zelle ein
Bei einer Verringerung des Membranpotentials unter -50 mV (unmittelbar nach einer depolarisierenden Reizung - Erregung der Zelle) öffnet das Aktivierungstor (das Inaktivierungstor ist schon offen), und der Kanal ist geöffnet (open / activated), Na+ strömt in die Zelle ein Bewegt sich das Membranpotential über die Nulllinie bzw. bleibt die Membran für ~2 ms über -45 mV hinaus depolarisiert, schließt das Inaktivierungstor (bei noch offenem Aktivierungstor) und der Kanal ist inaktiviert
(inactivated)
Bewegt sich das Membranpotential über die Nulllinie bzw. bleibt die Membran für ~2 ms über -45 mV hinaus depolarisiert, schließt das Inaktivierungstor (bei noch offenem Aktivierungstor) und der Kanal ist inaktiviert
(inactivated) Wenn die Membran auf über -60 mV repolarisiert, stellt sich wieder der Zustand "geschlossen / aktivierbar"
ein.
Wenn die Membran auf über -60 mV repolarisiert, stellt sich wieder der Zustand "geschlossen / aktivierbar"
ein.Diese Zustandswechsel laufen blitzartig ab; der Übergang von "geschlossen" zu "geöffnet" erfolgt (bei überschwelliger Reizung) in <1 ms, derjenige von "geöffnet" zu "inaktiviert" in <2 ms, derjenige von "inaktiviert" zu "geschlossen" dauert etwas länger (Refraktärität).
 Neurotoxine: Tetrodotoxin
ist ein bakterielles Gift, das von manchen - resistenten - Tierarten
(z.B. Kugelfischen - japanische Delikatesse) in ihrem Körper (beim
Kugelfisch in den Ovarien) konzentriert werden kann. Es blockiert selektiv den spannungsabhängigen Natriumkanal
(nicht andere Ionenkanäle in erregbaren Zellen) und wird daher in der
Forschung verwendet. (Bei mit diesem Gift gelähmten Beutetieren ist die
Generierung von Aktionspotentialen in Nerven- und Muskelzellen
blockiert.) Auch das aus Muscheln stammende Saxitoxin blockiert den spannungsabhängigen Natriumkanal.
Neurotoxine: Tetrodotoxin
ist ein bakterielles Gift, das von manchen - resistenten - Tierarten
(z.B. Kugelfischen - japanische Delikatesse) in ihrem Körper (beim
Kugelfisch in den Ovarien) konzentriert werden kann. Es blockiert selektiv den spannungsabhängigen Natriumkanal
(nicht andere Ionenkanäle in erregbaren Zellen) und wird daher in der
Forschung verwendet. (Bei mit diesem Gift gelähmten Beutetieren ist die
Generierung von Aktionspotentialen in Nerven- und Muskelzellen
blockiert.) Auch das aus Muscheln stammende Saxitoxin blockiert den spannungsabhängigen Natriumkanal. Das Froschalkaloid Batrachotoxin wirkt ebenfalls lähmend, aber indem es selektiv den spannungsabhängigen Natriumkanal dauerhaft offenhält.
 Ligandengesteuerte (ligand gated)
Natriumkanäle - z.B. an der motorischen Endplatte; ihre Öffnungswahrscheinlichkeit
hängt von der Bindung eines Transmitters (wie Acetylcholin) an den
Rezeptor ab.
Ligandengesteuerte (ligand gated)
Natriumkanäle - z.B. an der motorischen Endplatte; ihre Öffnungswahrscheinlichkeit
hängt von der Bindung eines Transmitters (wie Acetylcholin) an den
Rezeptor ab. Manche Ionenkanäle sind speziell auf bestimmten Zellen zu finden, z.B. der epitheliale Natriumkanal (ENaC;
Manche Ionenkanäle sind speziell auf bestimmten Zellen zu finden, z.B. der epitheliale Natriumkanal (ENaC;  Abbildung) in der Apikalmembran polarer Epithelzellen in Niere, Lunge, Harnblase, Colon, Speichel- und Schweißdrüsen, Geschmacksrezeptoren (Salzgeschmack).
Abbildung) in der Apikalmembran polarer Epithelzellen in Niere, Lunge, Harnblase, Colon, Speichel- und Schweißdrüsen, Geschmacksrezeptoren (Salzgeschmack).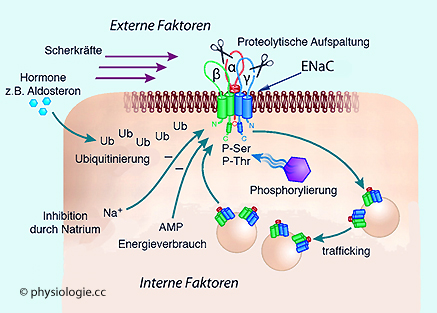
 Abbildung: Regulation eines epithelialen Natriumkanals (ENaC)
Abbildung: Regulation eines epithelialen Natriumkanals (ENaC)Nach Bhalla V, Hallows KR, Mechanisms of ENaC regulation and clinical implications. JASN 2008; 19: 1845-54
ENaCs bestehen aus α,
β und γ-Untereinheiten; jeweils mit zwei membrandurchspannenden
Domänen (rot, grün, blau). Sowohl die N- als auch die C-Enden liegen intrazellulär.
Die Regulation erfolgt über externe (Hormonwirkung, Scherkräfte, proteolytische Spaltung) und interne Faktoren (Natriumionen, Ubiquitinierung, Kinasen u.a.).
AMP, Adenosinmonophosphat Thr, Aminosäuren (Serin, Threonin)
Thr, Aminosäuren (Serin, Threonin)  P, Phosphat
P, Phosphat  Ubiquitine
(Ub) sind kleine Proteine, das an andere Proteine reversibel binden und
deren Eigenschaften (Funktion, Lebenszeit, Verteilung) verändern
Ubiquitine
(Ub) sind kleine Proteine, das an andere Proteine reversibel binden und
deren Eigenschaften (Funktion, Lebenszeit, Verteilung) verändern
Die Regulation erfolgt über externe (Hormonwirkung, Scherkräfte, proteolytische Spaltung) und interne Faktoren (Natriumionen, Ubiquitinierung, Kinasen u.a.).
AMP, Adenosinmonophosphat
 Thr, Aminosäuren (Serin, Threonin)
Thr, Aminosäuren (Serin, Threonin)  P, Phosphat
P, Phosphat  Ubiquitine
(Ub) sind kleine Proteine, das an andere Proteine reversibel binden und
deren Eigenschaften (Funktion, Lebenszeit, Verteilung) verändern
Ubiquitine
(Ub) sind kleine Proteine, das an andere Proteine reversibel binden und
deren Eigenschaften (Funktion, Lebenszeit, Verteilung) verändern
ENaC sind am Transport von
Natriumionen (zusammen mit der Na-K-Pumpe) beteiligt; durch ihren
Einfluss auf die Natriumresorption in Niere und Darm sind sie wichtig
für die Aufrechterhaltung der Na+- und K+-Konzentration in Blut und Gewebe.
 Expression und Aktivität der ENaC werden durch Aldosteron
beeinflusst und können pharmazeutisch blockiert werden (z.B. Amilorid,
ein kaliumsparendes Diuretikum; ENaCs bezeichnet man daher als amiloridempfindlich).
Expression und Aktivität der ENaC werden durch Aldosteron
beeinflusst und können pharmazeutisch blockiert werden (z.B. Amilorid,
ein kaliumsparendes Diuretikum; ENaCs bezeichnet man daher als amiloridempfindlich). Mechanosensitiv (stretch gated) sind Ionenkanäle, die ihre Permeabilität bei Dehnung der Membran erhöhen, z.B. in Sensoren der Oberflächensensitivität. Sie sind nicht nur für Natriumionen, sondern auch für andere Kationen (Kalium, Calcium) permeabel.
Mechanosensitiv (stretch gated) sind Ionenkanäle, die ihre Permeabilität bei Dehnung der Membran erhöhen, z.B. in Sensoren der Oberflächensensitivität. Sie sind nicht nur für Natriumionen, sondern auch für andere Kationen (Kalium, Calcium) permeabel. ASICs (acid-sensing ion channels) sind Natriumkanäle an Nervenzellen, deren Durchlässigkeit durch extrazelluläres H+ ansteigt.
Die so bewirkte Depolarisation triggert Sekundäraktivitäten wie
Phosphorylierungen oder Schmerzimpulse und können spannungsabhängige Calciumkanäle (Voltage-dependent calcium channels, VDCCs) aktivieren.
ASICs (acid-sensing ion channels) sind Natriumkanäle an Nervenzellen, deren Durchlässigkeit durch extrazelluläres H+ ansteigt.
Die so bewirkte Depolarisation triggert Sekundäraktivitäten wie
Phosphorylierungen oder Schmerzimpulse und können spannungsabhängige Calciumkanäle (Voltage-dependent calcium channels, VDCCs) aktivieren.Kaliumkanäle - codiert von ~80 verschiedenen Genen für porenbildende Untereinheiten (>60) und ~20 Hilfseinheiten - gehören zur größten Familie
der spannungsgesteuerten Ionenkanäle in der Zellmembran. Man
unterscheidet mehrere Gruppen, je nach ihrer funktionellen
Charakteristik: Spannungsgesteuerte, "einwärtsgerichtete" und
zweiporige Kaliumkanäle.

 Abbildung: Aufbau von Kaliumkanälen
Abbildung: Aufbau von KaliumkanälenNach Pardo LA, Stühmer W. The roles of K+ channels in cancer. Nature Rev Cancer 2014; 14: 39-48
Kaliumkanäle
bestehen aus Untereinheiten (links und Mitte), die aus transmembranalen
(helikalen) Sequenzen (zylinderförmig dargestellt) und
dazwischen liegenden Aminosäureschleifen (dunkelblau) bestehen. “Inwardly rectifying“ Kaliumkanäle Kir haben je Untereinheit 2 (links), spannungsgesteuerte (voltage gated) Kaliumkanäle Kv je
Untereinheit 6 α-Helices (Mitte).
Die Untereinheiten sind jeweils zu Vierergruppen zu einem Kanalkomplex angeordnet (rechts, Ansicht auf die Membran). S4- Aminosäureschleifen fungieren als Spannungsdetektoren
Die Untereinheiten sind jeweils zu Vierergruppen zu einem Kanalkomplex angeordnet (rechts, Ansicht auf die Membran). S4- Aminosäureschleifen fungieren als Spannungsdetektoren

 Spannungsgesteuerte Kaliumkanäle Kv (voltage gated,
Spannungsgesteuerte Kaliumkanäle Kv (voltage gated,  Abbildung) bestehen aus vier α-Untereinheiten - der Kanal hat eine tetramere Struktur um die Ionenpore - mit
jeweils 6 transmembranalen Helices (Segmente S1 bis S6), das positiv
geladene S4-Segment dient jeweils als Spannungssensor (wie bei
spannungsabhängigen Natriumkanälen, s. oben). Beim Menschen gibt es 40 verschiedene Typen von α-Untereinheiten, die in 12 Klassen eingeteilt werden.
Abbildung) bestehen aus vier α-Untereinheiten - der Kanal hat eine tetramere Struktur um die Ionenpore - mit
jeweils 6 transmembranalen Helices (Segmente S1 bis S6), das positiv
geladene S4-Segment dient jeweils als Spannungssensor (wie bei
spannungsabhängigen Natriumkanälen, s. oben). Beim Menschen gibt es 40 verschiedene Typen von α-Untereinheiten, die in 12 Klassen eingeteilt werden.Diese Kaliumkanäle bewirken Repolarisierung (outward-rectifyer K channels) und begrenzen die maximale Entladungsfrequenz ihrer Zellen. Ihre Öffnungswahrscheinlichkeit steigt, wenn die Membran depolarisiert ist. Sie können rasch aktiviert werden und das Aktionspotential kurz halten (Nervenfasern, Muskelfasern) oder dies langsam tun und lange Aktionspotentiale bewirken (Herzmuskel). Solche Eigenschaften werden durch auxiliäre ß-Untereinheiten beeinflusst, die oft zusätzlich zu den porenbildenden α-Untereinheiten vorhanden sind.
 ROMK (Renal Outer Medullary Potassium channel) in der luminalen (apikalen) Membran von Tubulus- und Sammelrohrzellen der Niere spielen für die Ausscheidung von Kalium eine tragende Rolle.
ROMK (Renal Outer Medullary Potassium channel) in der luminalen (apikalen) Membran von Tubulus- und Sammelrohrzellen der Niere spielen für die Ausscheidung von Kalium eine tragende Rolle. "Einwärtsgerichtete" Kaliumkanäle Kir (inwardly rectifying, anomalous rectifier) haben 2 transmembranale
Helices und eine porenbildende Aminosäureschleife. Sie lassen
Kaliumionen leichter in die Zelle als aus ihr heraus diffundieren
(daher die Bezeichnung - auch wenn der Kaliumstrom meist aus der Zelle, nicht in sie hinein erfolgt). Sie sind durch Interaktion mit G-Proteinen reguliert (GIRK: G protein-coupled inward-rectifyer potassium channel) und vermitteln inhibitorische Effekte zahlreicher Liganden, die über GPC-Rezeptoren wirken - z.B. an Kardiomyozyten. Depolarisierung reduziert die Öffnungswahrscheinlichkeit dieser Kanäle (durch Anlagerung von Mg++ oder Polyaminen an der Kanalinnenseite).
"Einwärtsgerichtete" Kaliumkanäle Kir (inwardly rectifying, anomalous rectifier) haben 2 transmembranale
Helices und eine porenbildende Aminosäureschleife. Sie lassen
Kaliumionen leichter in die Zelle als aus ihr heraus diffundieren
(daher die Bezeichnung - auch wenn der Kaliumstrom meist aus der Zelle, nicht in sie hinein erfolgt). Sie sind durch Interaktion mit G-Proteinen reguliert (GIRK: G protein-coupled inward-rectifyer potassium channel) und vermitteln inhibitorische Effekte zahlreicher Liganden, die über GPC-Rezeptoren wirken - z.B. an Kardiomyozyten. Depolarisierung reduziert die Öffnungswahrscheinlichkeit dieser Kanäle (durch Anlagerung von Mg++ oder Polyaminen an der Kanalinnenseite). Zu dieser Gruppe gehören auch ATP-sensitive Kanäle KATP, vorwiegend in der Zellmembran, aber auch in Sarkolemm (sarcKATP), Mitochiondrien- (mitoKATP) oder Kernmembran (nucKATP), werden von intrazellulären Nukleotiden (ATP, ADP) reguliert. Man findet sie in quergestreifter Muskulatur, Neuronen, pankreatischen ß-Zellen, renalen Tubuluszellen.
 Zweiporige Kaliumkanäle (two-pore / tandem pore domain channels) haben 4 transmembranale Helices und zwei porenbildende Schleifen. Sie wirken als outward-rectifyer K channels
und daher repolarisierend (erregungshemmend) auf die Zellmembran. Es
existieren zahlreiche Untergruppen (TWIK, TREK, TWAAK etc). Einige
stehen meist offen und tragen zur Aufladung der Zelle bei, die meisten
sind nicht spannungsempfindlich.
Zweiporige Kaliumkanäle (two-pore / tandem pore domain channels) haben 4 transmembranale Helices und zwei porenbildende Schleifen. Sie wirken als outward-rectifyer K channels
und daher repolarisierend (erregungshemmend) auf die Zellmembran. Es
existieren zahlreiche Untergruppen (TWIK, TREK, TWAAK etc). Einige
stehen meist offen und tragen zur Aufladung der Zelle bei, die meisten
sind nicht spannungsempfindlich. Calciumaktivierte Kaliumkanäle (KCa channels) reagieren auf steigende zytoplasmatische Calciumkonzentration, öffnen bei Bindung von Ca++, z.B. im Herzmuskel, an Gefäßen, Leberzellen oder im Innenohr. Sie finden sich in mehreren (beim Menschen mindestens 8) Varianten, z.B.
Calciumaktivierte Kaliumkanäle (KCa channels) reagieren auf steigende zytoplasmatische Calciumkonzentration, öffnen bei Bindung von Ca++, z.B. im Herzmuskel, an Gefäßen, Leberzellen oder im Innenohr. Sie finden sich in mehreren (beim Menschen mindestens 8) Varianten, z.B. SK-Kanäle SKCa (small conductance calcium-activated potassium channels) sind (im Gegensatz zu den anschließend genannten) nicht spannungsempfindlich - sie öffnen nur bei Erhöhung der intrazellulären [Ca++].
SK-Kanäle SKCa (small conductance calcium-activated potassium channels) sind (im Gegensatz zu den anschließend genannten) nicht spannungsempfindlich - sie öffnen nur bei Erhöhung der intrazellulären [Ca++]. BK-Kanäle BKCa (big conductance potassium channels) beteiligen sich an der Regulierung von Neuronenaktivität und Transmitterfreisetzung.
BK-Kanäle BKCa (big conductance potassium channels) beteiligen sich an der Regulierung von Neuronenaktivität und Transmitterfreisetzung. IK-Kanäle IKCa (intermediate conductance potassium channels) finden sich in zahlreichen Geweben, wo sie spezifische Funktionen ausüben.
IK-Kanäle IKCa (intermediate conductance potassium channels) finden sich in zahlreichen Geweben, wo sie spezifische Funktionen ausüben.Die Subtypen sind pharmakologisch unterschiedlich ansprechbar.
 Hypoxieempfindliche Kaliumkanäle befinden sich in Chemorezeptorzellen, sie zeigen bei sinkendem pO2 reduzierte Öffnungswahrscheinlichkeit, der Kaliumausstrom nimmt ab, die Zelle depolarisiert.
Hypoxieempfindliche Kaliumkanäle befinden sich in Chemorezeptorzellen, sie zeigen bei sinkendem pO2 reduzierte Öffnungswahrscheinlichkeit, der Kaliumausstrom nimmt ab, die Zelle depolarisiert.CNG-Kanäle (CNGC, Cyclic nucleotide-gated ion channels) sind nichtselektive Kationenkanäle,
die auf die Bindung zyklischer Nukleotide (cGMP, cAMP) mit Öffnung
reagieren. Sie
lassen - auch abhängig von Calciumionen und Phosphorylierungsgrad - Kationen durch die
Zellmembran (je nach elektrochemischem Gradienten ein- oder aus-) treten, was die Membran de- oder hyperpolarisiert. Sie
kommen in verschiedenen Geweben vor (Sinnesorganen, Herzmuskel,
Nierenepithel, Gonaden, Nervenzellen) und dienen unterschiedlichen Funktionen, wie Sehen (Mutationen können u.a. zu Farbenblindheit führen), Riechen, Freisetzung von
Hormonen, Elektrolyt- und Flüssigkeitstransport in Nierentubuli, Chemotaxis, akrosomale Reaktion von Spermien, zelluläre Entwicklung.

 Abbildung: CNG-Kanal (CNGC)
Abbildung: CNG-Kanal (CNGC)
Nach Podda MV, Grassi C: New perspectives in cyclic nucleotide-mediated functions in the CNS: the emerging role of cyclic nucleotide-gated (NGC) channels. Eur J Physiol 2014; 466: 1241-57
Adenylylcyclase (Adenylatzyklase - angeregt durch von GPCRs freigesetzte stimulierende G-Proteine, Gs) macht aus ATP cAMP, Guanylatzyklase aus GTP cGMP. Beide second messenger haben Wirkungen auf Ionenkanäle (HCN, Kir) und Proteinkinasen (PKA, PKG) und binden auch an CNG-Kanäle, die (dem Spannungsgradienten folgend) Kationen durch die Membran diffundieren lassen
Epac = exchange protein, activated by cAMP (ein multifunktionales Protein) NO = Stickstoffmonoxid
NO = Stickstoffmonoxid  sGC = lösliche Guanylatzyklase
sGC = lösliche Guanylatzyklase
 CNG-Kanäle
sind komplex aufgebaut: Sie bestehen aus vier Untereinheiten mit je 6
transmembranalen Domänen / Segmenten (S1-S6) und zusätzlichen
Aminosäureschleifen, die zusammen u.a. zyklische Nukleotide binden (cyclic nucleotide binding domain CNBD). Die jeweilige Struktur bestimmt die entsprechende Funktion.
CNG-Kanäle
sind komplex aufgebaut: Sie bestehen aus vier Untereinheiten mit je 6
transmembranalen Domänen / Segmenten (S1-S6) und zusätzlichen
Aminosäureschleifen, die zusammen u.a. zyklische Nukleotide binden (cyclic nucleotide binding domain CNBD). Die jeweilige Struktur bestimmt die entsprechende Funktion.

 Abbildung: CNG-Kanal (CNGC)
Abbildung: CNG-Kanal (CNGC)Nach Podda MV, Grassi C: New perspectives in cyclic nucleotide-mediated functions in the CNS: the emerging role of cyclic nucleotide-gated (NGC) channels. Eur J Physiol 2014; 466: 1241-57
Adenylylcyclase (Adenylatzyklase - angeregt durch von GPCRs freigesetzte stimulierende G-Proteine, Gs) macht aus ATP cAMP, Guanylatzyklase aus GTP cGMP. Beide second messenger haben Wirkungen auf Ionenkanäle (HCN, Kir) und Proteinkinasen (PKA, PKG) und binden auch an CNG-Kanäle, die (dem Spannungsgradienten folgend) Kationen durch die Membran diffundieren lassen
Epac = exchange protein, activated by cAMP (ein multifunktionales Protein)
 NO = Stickstoffmonoxid
NO = Stickstoffmonoxid  sGC = lösliche Guanylatzyklase
sGC = lösliche Guanylatzyklase
HCN-Kanäle
Anmerkung: Die Abkürzung HCN hat hier nichts mit Cyanwasserstoff (Blausäure) zu tun (Formel: HCN)
Anmerkung: Die Abkürzung HCN hat hier nichts mit Cyanwasserstoff (Blausäure) zu tun (Formel: HCN)
HCN-Kanäle (Hyperpolarization-activated cyclic nucleotide-gated cation channels) sind Ionenkanäle, die je nach Lage des entsprechenden
Gleichgewichtspotentials Kationen (Na+, K+)
durch
die Zellmembran strömen lassen. Man zählt sie zur Superfamilie
spannungsgesteuerter Kalium- (Kv) und zyklische-Nukleotid-gesteuerter (CNG-) Kanäle (letztere wurden soeben besprochen), da beide ähnlich aufgebaut sind (vier Untereinheiten zu je 6 transmembranalen Domänen / Segmenten: S1-S6). HCN-Kanäle werden durch Hyperpolarisierung
(S4 dient möglicherweise als Spannungssensor) und/oder zyklische Nukleotide geöffnet (CNBD) und schließen bei
Depolarisierung der Membran.
Wie der Name schon andeutet, haben HCN-Kanäle die unübliche Eigenschaft, durch Hyperpolarisierung aktiviert zu werden (daher nennt man den Ionenstrom durch diese Kanäle - Natrium und Kalium - "funny" current If). Es gibt sie gibt in verschiedenen Ausführungen: HCN1 (schnellere Aktivierung, weniger sensitiv gegenüber cAMP) bis HCN4 (langsamere Aktivierung, hohe Empfindlichkeit gegenüber cAMP). Liegt das Membranpotential nahe dem Ruhepotential, sind HCN-Kanäle mit hoher Wahrscheinlichkeit geöffnet.
HCN-Kanäle spielen eine Schlüsselrolle bei der Beeinflussung der Erregbarkeit von Nerven- und Herzmuskelzellen ("Schrittmacherkanäle", "pacemaker channels"):
 Im Sinusknoten des Herzens beteiligen sich HCN-Kanäle an dessen rhythmusgenerierenden Funktion; die führende Isoform ist hier HCN4. Die Aktivierung erfolgt durch cAMP und cCMP (zyklisches Cytidin-Monophosphat).
Im Sinusknoten des Herzens beteiligen sich HCN-Kanäle an dessen rhythmusgenerierenden Funktion; die führende Isoform ist hier HCN4. Die Aktivierung erfolgt durch cAMP und cCMP (zyklisches Cytidin-Monophosphat).
 Neuronen im Zentralnervensystem
exprimieren alle Isoformen des HCN-Kanals und beteiligen sich an
verschiedenen Funktionen (Hinterhorn, Atemzentrum, Basalganglien,
Hippocampus, Großhirnrinde).
Neuronen im Zentralnervensystem
exprimieren alle Isoformen des HCN-Kanals und beteiligen sich an
verschiedenen Funktionen (Hinterhorn, Atemzentrum, Basalganglien,
Hippocampus, Großhirnrinde).
Wie der Name schon andeutet, haben HCN-Kanäle die unübliche Eigenschaft, durch Hyperpolarisierung aktiviert zu werden (daher nennt man den Ionenstrom durch diese Kanäle - Natrium und Kalium - "funny" current If). Es gibt sie gibt in verschiedenen Ausführungen: HCN1 (schnellere Aktivierung, weniger sensitiv gegenüber cAMP) bis HCN4 (langsamere Aktivierung, hohe Empfindlichkeit gegenüber cAMP). Liegt das Membranpotential nahe dem Ruhepotential, sind HCN-Kanäle mit hoher Wahrscheinlichkeit geöffnet.
HCN-Kanäle spielen eine Schlüsselrolle bei der Beeinflussung der Erregbarkeit von Nerven- und Herzmuskelzellen ("Schrittmacherkanäle", "pacemaker channels"):
 Im Sinusknoten des Herzens beteiligen sich HCN-Kanäle an dessen rhythmusgenerierenden Funktion; die führende Isoform ist hier HCN4. Die Aktivierung erfolgt durch cAMP und cCMP (zyklisches Cytidin-Monophosphat).
Im Sinusknoten des Herzens beteiligen sich HCN-Kanäle an dessen rhythmusgenerierenden Funktion; die führende Isoform ist hier HCN4. Die Aktivierung erfolgt durch cAMP und cCMP (zyklisches Cytidin-Monophosphat). Neuronen im Zentralnervensystem
exprimieren alle Isoformen des HCN-Kanals und beteiligen sich an
verschiedenen Funktionen (Hinterhorn, Atemzentrum, Basalganglien,
Hippocampus, Großhirnrinde).
Neuronen im Zentralnervensystem
exprimieren alle Isoformen des HCN-Kanals und beteiligen sich an
verschiedenen Funktionen (Hinterhorn, Atemzentrum, Basalganglien,
Hippocampus, Großhirnrinde).Freie Calciumionen können die Zellmembran über vier Wege passieren und in das Zytoplasma eindringen (wo ihre Konzentration um Zehnerpotenzen niedriger als im Extrazellulärraum ist):
 Spannungsgesteuerte (voltage-gated) Ca++-Kanäle, die im Prinzip wie spannungsgesteuerte Natriumkanäle aufgebaut sind - aus einer langen Peptidkette (α1-Untereinheit), bestehend aus vier homologen repeat-Domänen,
jede mit 6 transmembranalen Sequenzen (das Segment S4 ist jeweils
potentialsensitiv) und einer porenbildenden Aminosäurenschleife. Beim Menschen kennt man 10 verschiedene Gene, die Isoformen der α1-Untereinheit codieren. Zusätzliche Untereinheiten (α2, β, γ, δ) verleihem dem Kanal spezielle Eigenschaften.
Spannungsgesteuerte (voltage-gated) Ca++-Kanäle, die im Prinzip wie spannungsgesteuerte Natriumkanäle aufgebaut sind - aus einer langen Peptidkette (α1-Untereinheit), bestehend aus vier homologen repeat-Domänen,
jede mit 6 transmembranalen Sequenzen (das Segment S4 ist jeweils
potentialsensitiv) und einer porenbildenden Aminosäurenschleife. Beim Menschen kennt man 10 verschiedene Gene, die Isoformen der α1-Untereinheit codieren. Zusätzliche Untereinheiten (α2, β, γ, δ) verleihem dem Kanal spezielle Eigenschaften. Über Austausch mit Natrium (NCX: Na/Ca-Austauscher) funktionierende Ca++-Kanäle übernehmen sie eine breite Palette von Funktionen, z.B.
elektromechanische (Kontraktion) und elektrosekretorische Koppelung
(Flüssigkeitsabsonderung), Signaltransduktion (Wirkung von Hormonen,
Transmittern, Wachstumsfaktoren, Zytokinen..).
Über Austausch mit Natrium (NCX: Na/Ca-Austauscher) funktionierende Ca++-Kanäle übernehmen sie eine breite Palette von Funktionen, z.B.
elektromechanische (Kontraktion) und elektrosekretorische Koppelung
(Flüssigkeitsabsonderung), Signaltransduktion (Wirkung von Hormonen,
Transmittern, Wachstumsfaktoren, Zytokinen..). Speicherbetriebene Calciumkanäle (Store-operated calcium channels, SOCs
-
Speicherbetriebene Calciumkanäle (Store-operated calcium channels, SOCs
-  Abbildung) öffnen - unabhängig vom Membranpotential - bei
Erschöpfung intrazellulärer Calciumspeicher und sind dadurch eine
wichtige Ca++-Quelle sowohl in erregbaren als auch nicht-erregbaren Zellen.
Abbildung) öffnen - unabhängig vom Membranpotential - bei
Erschöpfung intrazellulärer Calciumspeicher und sind dadurch eine
wichtige Ca++-Quelle sowohl in erregbaren als auch nicht-erregbaren Zellen. 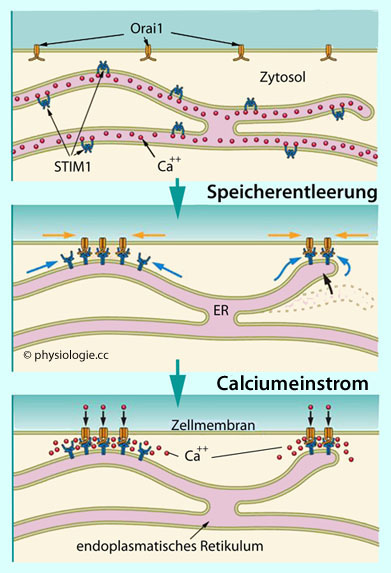
 Abbildung: Mechanismus des speicherbetriebenen Calciumeinstroms
Abbildung: Mechanismus des speicherbetriebenen CalciumeinstromsNach Prakriya M, Lewis RS, Store-Operated Calcium Channels. Physiol Rev 2015; 95: 1383-436

Eine eigene Gruppe (mit keiner anderen Ionenkanalgruppe homolog) sind die Orai1 (Calcium release-activated calcium channel protein 1) der Zellmembran, die durch Entleerung intrazellulärer Ca++-Speicher angeregt werden. Sie können durch direkte Interaktion mit Stim1 aktiviert werden (
 Abbildung).
Abbildung). Stim1 (Stromal interaction molecule 1) ist ein Calciumsensor des endoplasmatischen Retikulums (EPR). Dieses Protein ist direkt mit dem Kanalprotein Orai1der Zellmembran verknüpft (
 Abbildung). Sinkt
der Calciumspeicher im endoplasmatischen Retikulum, akkumulieren die
Stim1-Moleküle an den Kontaktstellen zwischen Zell- und EPR-Membran,
"fangen" Orai1-Kanäle ein und regen sie zur Calciumpassage an.
Abbildung). Sinkt
der Calciumspeicher im endoplasmatischen Retikulum, akkumulieren die
Stim1-Moleküle an den Kontaktstellen zwischen Zell- und EPR-Membran,
"fangen" Orai1-Kanäle ein und regen sie zur Calciumpassage an. Dieser Mechanismus des Nachschubs notwendigen Calciums in das endoplasmatische (sarkoplasmatische) Retikulum wird als speicherbetriebener Calciumeinstrom (SOCE: store-operated calcium entry) bezeichnet.
 Mitochondriale Calcium-Uniporter (MCU) ermöglichen Mitochondrien die Aufnahme von Ca++,
abhängig von der zytoplasmatischen Calciumkonzentration und dem
Potential der inneren Mitochondrienmembran (das intramitochondriale Potential ist stark negativ wegen der Extrusion von H+). Dadurch reichert sich hier Ca++ an, und ein [Ca++] von 5-10 µM ist nötig, um Calciumionen weiter einströmen zu lassen. Das gelingt durch enge Nachbarschaft zum endoplasmatischen Retikulum (IP3-getriggerte
Kontaktstellen). Bei ATP-Mangel (Hypoxie) kann die Negativität des
mitochondrialen Spaltraums nicht weiter aufrecht erhalten werden,
Calciumionen gelangen aus dem mitochondrialen Speicher in das
Zytoplasma.
Mitochondriale Calcium-Uniporter (MCU) ermöglichen Mitochondrien die Aufnahme von Ca++,
abhängig von der zytoplasmatischen Calciumkonzentration und dem
Potential der inneren Mitochondrienmembran (das intramitochondriale Potential ist stark negativ wegen der Extrusion von H+). Dadurch reichert sich hier Ca++ an, und ein [Ca++] von 5-10 µM ist nötig, um Calciumionen weiter einströmen zu lassen. Das gelingt durch enge Nachbarschaft zum endoplasmatischen Retikulum (IP3-getriggerte
Kontaktstellen). Bei ATP-Mangel (Hypoxie) kann die Negativität des
mitochondrialen Spaltraums nicht weiter aufrecht erhalten werden,
Calciumionen gelangen aus dem mitochondrialen Speicher in das
Zytoplasma. Spannungsabhängige und ligandenaktivierte Ca++-Kanäle:
Spannungsabhängige und ligandenaktivierte Ca++-Kanäle:| Spannungsgesteuerte Ca++-Kanäle (Voltage dependent Calcium channels VDCC) |
|||
| Typ |
erforderliche Spannung |
Vorkommen / Funktion |
|
| L-Typ Ca++-Kanal (Long-lasting) |
hoch (HVA = high voltage activated) |
Herzmuskel, Skelettmuskel, glatter Muskel, Osteoblasten, Dendriten / Spines Kontraktion / neuronale Aktivität |
|
| P-Typ Ca++-Kanal (Purkinje) |
hoch |
Purkinje-Zellen, Körnerzellen (Kleinhirnrinde) Transmitterfreisetzung |
|
| N-Typ Ca++-Kanal (Neural) |
hoch |
gesamtes Nervensystem Transmitterfreisetzung |
|
| R-Typ Ca++-Kanal (Residual) |
mittel |
Körnerzellen (Kleinhirnrinde) Steuerung der Aktivität (firing patterns) |
|
| T-Typ Ca++-Kanal (Transient) |
niedrig |
Schrittmacherzellen, Osteozyten, Thalamusneurone Steuerung der Aktivität (firing patterns) |
|
| Ligandenaktivierte Ca++-Kanäle | |||
| aktiviert durch |
Lage |
Funktion |
|
| IP3-Rezeptor |
IP3 |
endo- / sarkoplasmatisches Retikulum (ER/SR) |
IP3-induzierte Ca++-Freisetzung aus ER/SR |
| Ryanodin-Rezeptor |
Dihydropyridin-Rezeptoren in T-Tubuli / intrazellulärer Ca++-Anstieg (CICR) |
ER/SR | Ca++-induzierte Ca++-Freisetzung in Muskelzellen (CICR) |
| Zweiporenkanal |
NADDP Nicotinsäure-adenin- dinukleotid-phosphat |
endo- / lysosomale Membran |
NADDP-induzierter Ca++-Transport über Membran von Endo- / Lysosomen |
| Kationenkanal in Spermien |
Ca++ (CICR) |
Spermien (Flagella) |
Ca++-aktivierte Orientierung von Spermien |
| SOCs |
Ca++-Entspeicherung | Plasmamembran |
Ca++-Signal an Zytoplasma |
Spannungsgesteuerte Ca++-Kanäle sind auch durchgängig für Natriumionen ("Ca/Na-Kanäle"), wenn auch um drei Zehnerpotenzen geringer (der chemische Ca++-Gradient über die Zellmembran ist andererseits um mindestens zwei Zehnerpotenzen größer als der Na+-Gradient).
Calciumkanäle können unterschiedliche Eigenschaften und Funktionen haben, zum Beispiel
 Mechanosensible Calciumkanäle bewirken z.B. den Bayliss-Effekt.
Mechanosensible Calciumkanäle bewirken z.B. den Bayliss-Effekt. Ca++-ATPasen befördern - primär aktiv, also unter Energieverbrauch - Calciumionen aus dem Zytoplasma - Plasmamembran Ca++-ATPase (PMCA) pumpt Calcium aus der Zelle, Sarkoplasmatisches-Retikulum-Ca++-ATPase (SERCA) in das endoplasmatische Retikulum.
Ca++-ATPasen befördern - primär aktiv, also unter Energieverbrauch - Calciumionen aus dem Zytoplasma - Plasmamembran Ca++-ATPase (PMCA) pumpt Calcium aus der Zelle, Sarkoplasmatisches-Retikulum-Ca++-ATPase (SERCA) in das endoplasmatische Retikulum. TRPV6 (ein transient receptor potential cation channel) ist vor allem für die Calciumresorption aus dem Darm erforderlich und wird auch als Epithelialer Calciumkanal ECaC (epithelial calcium channel) bezeichnet. Über TRP-Kanäle s. dort.
TRPV6 (ein transient receptor potential cation channel) ist vor allem für die Calciumresorption aus dem Darm erforderlich und wird auch als Epithelialer Calciumkanal ECaC (epithelial calcium channel) bezeichnet. Über TRP-Kanäle s. dort. Über spannungsgesteuerte L-Typ) Calciumkanäle (zu denen der Ryanodinrezeptor gehört) s. dort.
Über spannungsgesteuerte L-Typ) Calciumkanäle (zu denen der Ryanodinrezeptor gehört) s. dort. Über den calciumsensitiven Rezeptor (CaSR) s. dort.
Über den calciumsensitiven Rezeptor (CaSR) s. dort.Chloridkanäle (ClC, Chloride channels) stellen eine Superfamilie von Ionenkanälen dar, die mehr oder weniger
spezifisch für Chlorid sind und spannungs- (Ruhepotential, Zellvolumen)
oder linagnengesteuert funktionieren. Sie spielen eine Rolle für die
Volumenregulation der Zellen, Stabilität des pH-Wertes, den Transport
organischer Stoffe, sowie für Bewegung, Wachstum und Differenzierung.
Chloridkanäle finden sich z.B. im Zusammenhang mit Rezeptoren inhibitorischer Neurotransmitter (GABA, Glyzin), in der Lunge, in Nierentubuli, in Speicheldrüsen und Pankreas, in Gallengängen, im Magen (Belegzellen), im Darm. Chloridkanäle stabilisieren auch das Membranpotential in Skelettmuskelzellen.
Man kennt nach Aufbau (nur teilweise bekannt) und Funktion verschiedene Gruppen von Chloridkanälen:
 Spannungsgesteuerte (voltage-gated) Chloridkanäle
stabilisieren Ruhepotential (Ausgleich des Chloridstroms, der während
des Aktionspotentials erfolgt) und Zellvolumen. Der Ionenkanal kann
zwischen 1 und 12 membrandurchspannende Segmente enthalten und außer
Chlorid auch den Durchtritt weiterer Anionen (z.B. Bicarbonat, Nitrat)
erlauben.
Spannungsgesteuerte (voltage-gated) Chloridkanäle
stabilisieren Ruhepotential (Ausgleich des Chloridstroms, der während
des Aktionspotentials erfolgt) und Zellvolumen. Der Ionenkanal kann
zwischen 1 und 12 membrandurchspannende Segmente enthalten und außer
Chlorid auch den Durchtritt weiterer Anionen (z.B. Bicarbonat, Nitrat)
erlauben.
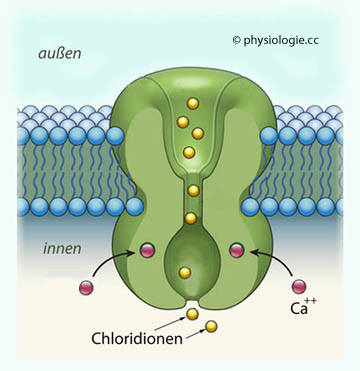
 Abbildung: Ca++-gesteuerter Chloridkanal
Abbildung: Ca++-gesteuerter Chloridkanal
Nach Whorton M. Structural biology: Calcium-activated proteins visualized. Nature 2014; 516: 176-8

 Chloridkanäle können Calcium-gesteuert sein (Ca-ClC: Calcium-Dependent Chloride Channels, CaCCs: Calcium-activated Chloride Channels).
Diese ligandengesteuerten Kanäle sind weit verbreitet und erfüllen
verschiedene Aufgaben, z.B. in Epithelzellen (Sekretion), Sinneszellen
(Transduktion), Nerven- und Herzmuskelzellen (Erregung),
Gefäßmuskelzellen (Vasotonus), Netzhaut (Bestrophine,
Chloridkanäle können Calcium-gesteuert sein (Ca-ClC: Calcium-Dependent Chloride Channels, CaCCs: Calcium-activated Chloride Channels).
Diese ligandengesteuerten Kanäle sind weit verbreitet und erfüllen
verschiedene Aufgaben, z.B. in Epithelzellen (Sekretion), Sinneszellen
(Transduktion), Nerven- und Herzmuskelzellen (Erregung),
Gefäßmuskelzellen (Vasotonus), Netzhaut (Bestrophine,  Abbildung), Thrombozyten (Aktivierung: Anoctamine).
Abbildung), Thrombozyten (Aktivierung: Anoctamine).
Mutationen des Bestrophingens führen zu degenerativen Netzhauterkrankungen.
 Epitheliale Chloridkanäle werden als Epithelial Chloride Channel (E-ClC) bezeichnet. Der Mensch verfügt über neun Isoformen (ClC1 bis ClC9), die
unterschiedlich exprimiert werden - teils in der Zellmembran, teils intrazellulär (Chloride Intracellular Ion Channels, CLICs).
Epitheliale Chloridkanäle werden als Epithelial Chloride Channel (E-ClC) bezeichnet. Der Mensch verfügt über neun Isoformen (ClC1 bis ClC9), die
unterschiedlich exprimiert werden - teils in der Zellmembran, teils intrazellulär (Chloride Intracellular Ion Channels, CLICs).
 Es gibt volumensensitive Anionenkanäle (VRAC: Volume-regulated anion channels),
sie regulieren das Zellvolumen, indem sie Chlorid- und andere Anionen
(Glutamat, Taurin) durch die Zellmembran passieren lassen. Ihre
Funktion besteht in der Beeinflussung des Zellvolumens im Rahmen von
Endo- und Exozytose, Wachstum, Fortbewegung und Apoptose.
Es gibt volumensensitive Anionenkanäle (VRAC: Volume-regulated anion channels),
sie regulieren das Zellvolumen, indem sie Chlorid- und andere Anionen
(Glutamat, Taurin) durch die Zellmembran passieren lassen. Ihre
Funktion besteht in der Beeinflussung des Zellvolumens im Rahmen von
Endo- und Exozytose, Wachstum, Fortbewegung und Apoptose.
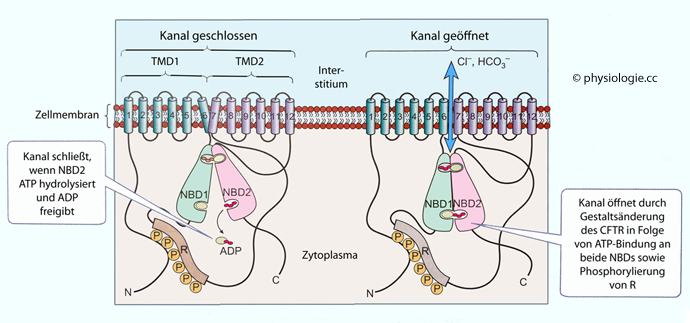
 Abbildung: CFTR-Chloridkanal
Abbildung: CFTR-Chloridkanal
Nach einer Vorlage in Butler / Brown / Stephenson / Speakman, Animal physiology - An environmental perspective. Oxford University Press 2021
Der Kanal bildet aus 12 transmembranalen Helices zwei transmembranale Domänen (TMD1 und TMD2). Intrazellulär liegen zwei nukelotidbindende Domänen (NBD1 - diese bindet ATP - und NBD2). Eine regulatorische Domäne (R) steuert Phosphoryliserungsorte (P). Der Öffnungszustand des Kanals hängt von der Phosphorylierung der NBDs ab - die genaue Natur der Konformationsänderungen wird noch untersucht

 Der Cystic Fibrosis Transmembrane Conductance Regulator (CFTR) an Epithelzellen (
Der Cystic Fibrosis Transmembrane Conductance Regulator (CFTR) an Epithelzellen ( Abbildung) ist cAMP-reguliert und wird auch zu den ATP-bindenden ABC-Transportern
gezählt; er reguliert den transmembranalen Salztransport (Chlorid
gelangt durch den CFTR aus der Zelle, Wasser folgt osmotisch nach). Er
kann neben Chlorid auch andere Anionen transportieren, wie Bicarbonat
(über einen CFTR verlässt Bicarbonat Ausführungsgangs-Epithelzellen von
Speicheldrüsen Richtung Lumen).
Abbildung) ist cAMP-reguliert und wird auch zu den ATP-bindenden ABC-Transportern
gezählt; er reguliert den transmembranalen Salztransport (Chlorid
gelangt durch den CFTR aus der Zelle, Wasser folgt osmotisch nach). Er
kann neben Chlorid auch andere Anionen transportieren, wie Bicarbonat
(über einen CFTR verlässt Bicarbonat Ausführungsgangs-Epithelzellen von
Speicheldrüsen Richtung Lumen).
CFTR ist ein Schlüsselmolekül für den Chloridtransport. Man findet ihn u.a. in Epithelien der Luftwege (Bildung von Bronchialsekret), des Colons (Resorption von Flüssigkeit), des exokrinen Pankreas (Sekretion). Ob CFTR der Resorption oder Sekretion von Flüssigkeit dient, hängt von seiner Positionierung in der Zellmembran (apikal / basolateral) ab.
Genmutationen am CFTR-Kanal können zum Krankheitsbild der zystischen Fibrose (Mukoviszidose) führen.
Chloridkanäle finden sich z.B. im Zusammenhang mit Rezeptoren inhibitorischer Neurotransmitter (GABA, Glyzin), in der Lunge, in Nierentubuli, in Speicheldrüsen und Pankreas, in Gallengängen, im Magen (Belegzellen), im Darm. Chloridkanäle stabilisieren auch das Membranpotential in Skelettmuskelzellen.
Man kennt nach Aufbau (nur teilweise bekannt) und Funktion verschiedene Gruppen von Chloridkanälen:
 Spannungsgesteuerte (voltage-gated) Chloridkanäle
stabilisieren Ruhepotential (Ausgleich des Chloridstroms, der während
des Aktionspotentials erfolgt) und Zellvolumen. Der Ionenkanal kann
zwischen 1 und 12 membrandurchspannende Segmente enthalten und außer
Chlorid auch den Durchtritt weiterer Anionen (z.B. Bicarbonat, Nitrat)
erlauben.
Spannungsgesteuerte (voltage-gated) Chloridkanäle
stabilisieren Ruhepotential (Ausgleich des Chloridstroms, der während
des Aktionspotentials erfolgt) und Zellvolumen. Der Ionenkanal kann
zwischen 1 und 12 membrandurchspannende Segmente enthalten und außer
Chlorid auch den Durchtritt weiterer Anionen (z.B. Bicarbonat, Nitrat)
erlauben.
 Abbildung: Ca++-gesteuerter Chloridkanal
Abbildung: Ca++-gesteuerter ChloridkanalNach Whorton M. Structural biology: Calcium-activated proteins visualized. Nature 2014; 516: 176-8
Bestrophin 1, ein Calcium-gesteuerter Chloridkanal in der Netzhaut, der volumenregulatorisch wirken kann: Bindung von Calciumionen öffnet die Pore für Chloridionen unabhängig vom Membranpotential.
Die Ladungsverteilung innerhalb des Kanals unterstützt dessen Selektivität
Die Ladungsverteilung innerhalb des Kanals unterstützt dessen Selektivität

 Chloridkanäle können Calcium-gesteuert sein (Ca-ClC: Calcium-Dependent Chloride Channels, CaCCs: Calcium-activated Chloride Channels).
Diese ligandengesteuerten Kanäle sind weit verbreitet und erfüllen
verschiedene Aufgaben, z.B. in Epithelzellen (Sekretion), Sinneszellen
(Transduktion), Nerven- und Herzmuskelzellen (Erregung),
Gefäßmuskelzellen (Vasotonus), Netzhaut (Bestrophine,
Chloridkanäle können Calcium-gesteuert sein (Ca-ClC: Calcium-Dependent Chloride Channels, CaCCs: Calcium-activated Chloride Channels).
Diese ligandengesteuerten Kanäle sind weit verbreitet und erfüllen
verschiedene Aufgaben, z.B. in Epithelzellen (Sekretion), Sinneszellen
(Transduktion), Nerven- und Herzmuskelzellen (Erregung),
Gefäßmuskelzellen (Vasotonus), Netzhaut (Bestrophine,  Abbildung), Thrombozyten (Aktivierung: Anoctamine).
Abbildung), Thrombozyten (Aktivierung: Anoctamine).Mutationen des Bestrophingens führen zu degenerativen Netzhauterkrankungen.
 Epitheliale Chloridkanäle werden als Epithelial Chloride Channel (E-ClC) bezeichnet. Der Mensch verfügt über neun Isoformen (ClC1 bis ClC9), die
unterschiedlich exprimiert werden - teils in der Zellmembran, teils intrazellulär (Chloride Intracellular Ion Channels, CLICs).
Epitheliale Chloridkanäle werden als Epithelial Chloride Channel (E-ClC) bezeichnet. Der Mensch verfügt über neun Isoformen (ClC1 bis ClC9), die
unterschiedlich exprimiert werden - teils in der Zellmembran, teils intrazellulär (Chloride Intracellular Ion Channels, CLICs).  Es gibt volumensensitive Anionenkanäle (VRAC: Volume-regulated anion channels),
sie regulieren das Zellvolumen, indem sie Chlorid- und andere Anionen
(Glutamat, Taurin) durch die Zellmembran passieren lassen. Ihre
Funktion besteht in der Beeinflussung des Zellvolumens im Rahmen von
Endo- und Exozytose, Wachstum, Fortbewegung und Apoptose.
Es gibt volumensensitive Anionenkanäle (VRAC: Volume-regulated anion channels),
sie regulieren das Zellvolumen, indem sie Chlorid- und andere Anionen
(Glutamat, Taurin) durch die Zellmembran passieren lassen. Ihre
Funktion besteht in der Beeinflussung des Zellvolumens im Rahmen von
Endo- und Exozytose, Wachstum, Fortbewegung und Apoptose.
 Abbildung: CFTR-Chloridkanal
Abbildung: CFTR-ChloridkanalNach einer Vorlage in Butler / Brown / Stephenson / Speakman, Animal physiology - An environmental perspective. Oxford University Press 2021
Der Kanal bildet aus 12 transmembranalen Helices zwei transmembranale Domänen (TMD1 und TMD2). Intrazellulär liegen zwei nukelotidbindende Domänen (NBD1 - diese bindet ATP - und NBD2). Eine regulatorische Domäne (R) steuert Phosphoryliserungsorte (P). Der Öffnungszustand des Kanals hängt von der Phosphorylierung der NBDs ab - die genaue Natur der Konformationsänderungen wird noch untersucht

 Der Cystic Fibrosis Transmembrane Conductance Regulator (CFTR) an Epithelzellen (
Der Cystic Fibrosis Transmembrane Conductance Regulator (CFTR) an Epithelzellen ( Abbildung) ist cAMP-reguliert und wird auch zu den ATP-bindenden ABC-Transportern
gezählt; er reguliert den transmembranalen Salztransport (Chlorid
gelangt durch den CFTR aus der Zelle, Wasser folgt osmotisch nach). Er
kann neben Chlorid auch andere Anionen transportieren, wie Bicarbonat
(über einen CFTR verlässt Bicarbonat Ausführungsgangs-Epithelzellen von
Speicheldrüsen Richtung Lumen).
Abbildung) ist cAMP-reguliert und wird auch zu den ATP-bindenden ABC-Transportern
gezählt; er reguliert den transmembranalen Salztransport (Chlorid
gelangt durch den CFTR aus der Zelle, Wasser folgt osmotisch nach). Er
kann neben Chlorid auch andere Anionen transportieren, wie Bicarbonat
(über einen CFTR verlässt Bicarbonat Ausführungsgangs-Epithelzellen von
Speicheldrüsen Richtung Lumen).CFTR ist ein Schlüsselmolekül für den Chloridtransport. Man findet ihn u.a. in Epithelien der Luftwege (Bildung von Bronchialsekret), des Colons (Resorption von Flüssigkeit), des exokrinen Pankreas (Sekretion). Ob CFTR der Resorption oder Sekretion von Flüssigkeit dient, hängt von seiner Positionierung in der Zellmembran (apikal / basolateral) ab.
Genmutationen am CFTR-Kanal können zum Krankheitsbild der zystischen Fibrose (Mukoviszidose) führen.
SLC-Transporter (solute carrier) ist ein Sammelbegriff für etwa 50 Familien von
Transportproteinen, die an die 400 SLC-Gene des menschlichen Erbguts
repräsentieren. Transportgut können dabei Ionen (Ionenkanäle) oder
organische Moleküle (organische Kationen-Transporter OCT, organische
Anionen-Transporter OAT) sein.

 Abbildung: SLC-Transporter eines T-Lymphozyten
Abbildung: SLC-Transporter eines T-Lymphozyten
Nach Chen R, Chen L, Solute carrier transporters: emerging central players in tumor immunotherapy. Trends Cell Biol 2022; 32: 186-201


 Abbildung: SLC-Transporter eines T-Lymphozyten
Abbildung: SLC-Transporter eines T-LymphozytenNach Chen R, Chen L, Solute carrier transporters: emerging central players in tumor immunotherapy. Trends Cell Biol 2022; 32: 186-201
Das Beispiel zeigt eine Vielzahl organischer Transportermoleküle (für
Glucose, Lactat, Aminosäuren und deren Derivate, Creatin, GABA)
und ihre Involvierung in Zellstoffwechsel, Transkription / Translation
und Immunantworten eines weißen Blutkörperchens (Lymphozyt).
Ag = Antigen CPT1 = Carnitin Palmitoyltransferase, ein mitochondrielles Enzym, das
Acylgruppen von langkettigem Fettsäure-CoA auf Carnitin überträgt
CPT1 = Carnitin Palmitoyltransferase, ein mitochondrielles Enzym, das
Acylgruppen von langkettigem Fettsäure-CoA auf Carnitin überträgt
 FA = Fettsäure
FA = Fettsäure  Kyn = Kynurenin (aus dem Tryptophanabbau)
Kyn = Kynurenin (aus dem Tryptophanabbau)  TCR = T-Zell-Rezeptor
TCR = T-Zell-Rezeptor
Ag = Antigen
 CPT1 = Carnitin Palmitoyltransferase, ein mitochondrielles Enzym, das
Acylgruppen von langkettigem Fettsäure-CoA auf Carnitin überträgt
CPT1 = Carnitin Palmitoyltransferase, ein mitochondrielles Enzym, das
Acylgruppen von langkettigem Fettsäure-CoA auf Carnitin überträgt
 FA = Fettsäure
FA = Fettsäure  Kyn = Kynurenin (aus dem Tryptophanabbau)
Kyn = Kynurenin (aus dem Tryptophanabbau)  TCR = T-Zell-Rezeptor
TCR = T-Zell-Rezeptor
 OATs, organische Anionentransporter. Diese SLC-Proteine befördern organische Anionen im Austausch gegen eine Dicarbonsäure (wie z.B. Glutarsäure) in die Zelle. Das funktioniert, solange die
Zelle über einen entsprechenden "Vorrat" an (endogenen) Dicarbonsäuren verfügt -
daher gibt es Membransysteme, die Dicarbonsäure im Austausch gegen Na+ wieder in die Zelle bringen. OATs finden sich u.a. im Gehirn, den Nieren, Augen, glatter Muskulatur oder in der Plazenta.
OATs, organische Anionentransporter. Diese SLC-Proteine befördern organische Anionen im Austausch gegen eine Dicarbonsäure (wie z.B. Glutarsäure) in die Zelle. Das funktioniert, solange die
Zelle über einen entsprechenden "Vorrat" an (endogenen) Dicarbonsäuren verfügt -
daher gibt es Membransysteme, die Dicarbonsäure im Austausch gegen Na+ wieder in die Zelle bringen. OATs finden sich u.a. im Gehirn, den Nieren, Augen, glatter Muskulatur oder in der Plazenta. OCTs, organische Kationentransporter (SLC-Unterfamilie 22). Sie transportieren u.a. biogene Amine und Harnsäure.
OCTs, organische Kationentransporter (SLC-Unterfamilie 22). Sie transportieren u.a. biogene Amine und Harnsäure.Organische Ionentransporter finden sich z.B. in den Nierentubuli. Ihre Membranstrukturen ermöglichen den Durchtritt wenig lipophiler (d.h. polarer, wasserlöslicher) Moleküle; "Ionenkanäle" erlauben den (zum Teil selektiven) Durchtritt von Ionen (Na+, K+, Ca++, Cl--Kanäle, etc.).
Für die Aufnahme von Aminosäuren über die Zellmembran stehen 14 unterschiedliche Transportsysteme zur Verfügung; diese befördern eine oder meist mehrere Arten von Aminosäuren - teilweise natriumabhängig (
 s. dort).
s. dort).Ist eines dieser Systeme beschädigt, resultiert eine Aminosäuretransportstörung, die betreffenden Aminosäuren werden z.B. in Niere oder Darm nicht ausreichend resorbiert; Folge sind Mangelerkrankungen (Cystinurie, Glycinurie, Hartnup-Krankheit).
Energieverbrauchende Transporter (ATPasen)
P-Typ ATPasenEine Reihe von Transportern verbrauchen
direkt Stoffwechselenergie, um einen bestimmten Transportvorgang gegen
ein thermodynamisches bzw. elektrochemisches Gefälle zu ermöglichen.
Prototypisch ist der ATP-betriebene Austausch von Natrium gegen Kalium
(Na/K-Pumpe, Na+-K+-induzierbare ATPase).
Diese Enzyme bestehen aus mehreren Untereinheiten, die einerseits die korrekte Lokalisierung in der Membran steuern, andererseits ATPase-Aktivität aufweisen. Sie transportieren Stoffe durch Membranen aus dem, oder in das, jeweilige zelluläre Kompartiment spezifisch und energieverbrauchend (ATP). Kinetik und Gewebeverteilung hängen von den jeweiligen Isoformen der Transporterelemente ab.
Während Ionenkanäle typischerweise 107 bis 108 Ionen pro Sekunde passieren lassen, ist die Transportrate bei ATPasen wegen der komplexeren Funktionsweise (Konformationsänderungen, alternierendes Öffnen und Schließen eines äußeren und eines inneren "Schleusentors", Bewegung der Ionen in unterschiedliche Richtungen) mindestens um einen Faktor 104 langsamer.
ATPasen teilt man ein in
 P-Typ ATPasen: Na/K-Pumpe, Calciumpumpen, Protonenpumpen
P-Typ ATPasen: Na/K-Pumpe, Calciumpumpen, Protonenpumpen
 F-Typ ATPasen: Mitochondrielle ATP-Synthase
F-Typ ATPasen: Mitochondrielle ATP-Synthase
 V-Typ ATPasen: Vakuoläre ATPase
V-Typ ATPasen: Vakuoläre ATPase
 ABC Transporter
ABC Transporter
Diese Enzyme bestehen aus mehreren Untereinheiten, die einerseits die korrekte Lokalisierung in der Membran steuern, andererseits ATPase-Aktivität aufweisen. Sie transportieren Stoffe durch Membranen aus dem, oder in das, jeweilige zelluläre Kompartiment spezifisch und energieverbrauchend (ATP). Kinetik und Gewebeverteilung hängen von den jeweiligen Isoformen der Transporterelemente ab.
Während Ionenkanäle typischerweise 107 bis 108 Ionen pro Sekunde passieren lassen, ist die Transportrate bei ATPasen wegen der komplexeren Funktionsweise (Konformationsänderungen, alternierendes Öffnen und Schließen eines äußeren und eines inneren "Schleusentors", Bewegung der Ionen in unterschiedliche Richtungen) mindestens um einen Faktor 104 langsamer.
ATPasen teilt man ein in
 P-Typ ATPasen: Na/K-Pumpe, Calciumpumpen, Protonenpumpen
P-Typ ATPasen: Na/K-Pumpe, Calciumpumpen, Protonenpumpen  F-Typ ATPasen: Mitochondrielle ATP-Synthase
F-Typ ATPasen: Mitochondrielle ATP-Synthase V-Typ ATPasen: Vakuoläre ATPase
V-Typ ATPasen: Vakuoläre ATPase ABC Transporter
ABC TransporterDieser ATPase-Typ ist nach der Fähigkeit zur Autophosphorylierung - Übertragung von Phosphorylgruppen (–PO32-) aus ATP - bezeichnet worden. Sie werden nach ihren beiden Konformationen auch als E1-E2-ATPasen bezeichnet (Zustand "E1" nach innen, Zustand "E2" nach außen geöffnet) und finden sich überall in der Biosphäre. Zu ihnen gehören die Na+/K+-ATPase, die H+/K+-ATPase und die Ca++-ATPase.
 Die Natrium-Kalium-Pumpe (Na+-K+-induzierbare
ATPase,
Die Natrium-Kalium-Pumpe (Na+-K+-induzierbare
ATPase,  Abbildung) fördert unter Energieverbrauch (ATP → ADP +
Phosphat) 3 Natrium- (nach außen) gegen 2 Kaliumionen (nach innen). Das
heißt, die Pumpe arbeitet nicht elektroneutral, sondern es überwiegt
der Transport von Kationen nach außen.
Abbildung) fördert unter Energieverbrauch (ATP → ADP +
Phosphat) 3 Natrium- (nach außen) gegen 2 Kaliumionen (nach innen). Das
heißt, die Pumpe arbeitet nicht elektroneutral, sondern es überwiegt
der Transport von Kationen nach außen.
 Die Natrium-Kalium-Pumpe (Na+-K+-induzierbare
ATPase,
Die Natrium-Kalium-Pumpe (Na+-K+-induzierbare
ATPase,  Abbildung) fördert unter Energieverbrauch (ATP → ADP +
Phosphat) 3 Natrium- (nach außen) gegen 2 Kaliumionen (nach innen). Das
heißt, die Pumpe arbeitet nicht elektroneutral, sondern es überwiegt
der Transport von Kationen nach außen.
Abbildung) fördert unter Energieverbrauch (ATP → ADP +
Phosphat) 3 Natrium- (nach außen) gegen 2 Kaliumionen (nach innen). Das
heißt, die Pumpe arbeitet nicht elektroneutral, sondern es überwiegt
der Transport von Kationen nach außen.
 Abbildung: Na+-K+-induzierbare ATPase (Natrium-Kalium-Pumpe)
Abbildung: Na+-K+-induzierbare ATPase (Natrium-Kalium-Pumpe)Nach Crepalde MA, Faria-Campos AC, Campos FVA. Modeling and analysis of cell membrane systems with probabilistic model checking. Genomics 2011; 12: S14
Schematische Darstellung. Diese
ATPase befördert pro Zustandszyklus zwei Kaliumionen in die Zelle und
drei Natriumionen aus ihr heraus. Den Zustandswechsel kann man sich aus
sechs Phasen bestehend vorstellen:
A: Nach innen offen (Zustand E1). ATP bindet an das Enzym, drei aus dem Zytosol stammende Natriumionen haben sich an die Kanalwand eingelagert.
B: Diese Konstellation regt die ATP-Hydrolyse an (roter Blitz zwischen dem ersten und dem zweiten Phosphat, Energie wird für die Konformationsänderung der Na/K-Pumpe gewonnen), der Kanal ist vorübergehend phosphoryliert.
C: Zustand E2: Nach außen offen. Die Natriumionen koppeln ab und diffundieren in den Extrazellulärraum, die Na/K-Pumpe erlangt hohe Affinität für Kaliumionen.
D bis F: Zwei Kaliumionen aus dem Extrazellulärraum binden an den Kanal, von dem Phosphat abdissoziiert. Die Konformation wechselt auf "nach innen offen", Kaliumionen koppeln ab und diffundieren in die Zelle. Der Kanal lagert Natriumionen aus dem Intrazellulärraum ein und bindet neues ATP, der Zustand A ist wieder hergestellt, der Zyklus beginnt von neuem
A: Nach innen offen (Zustand E1). ATP bindet an das Enzym, drei aus dem Zytosol stammende Natriumionen haben sich an die Kanalwand eingelagert.
B: Diese Konstellation regt die ATP-Hydrolyse an (roter Blitz zwischen dem ersten und dem zweiten Phosphat, Energie wird für die Konformationsänderung der Na/K-Pumpe gewonnen), der Kanal ist vorübergehend phosphoryliert.
C: Zustand E2: Nach außen offen. Die Natriumionen koppeln ab und diffundieren in den Extrazellulärraum, die Na/K-Pumpe erlangt hohe Affinität für Kaliumionen.
D bis F: Zwei Kaliumionen aus dem Extrazellulärraum binden an den Kanal, von dem Phosphat abdissoziiert. Die Konformation wechselt auf "nach innen offen", Kaliumionen koppeln ab und diffundieren in die Zelle. Der Kanal lagert Natriumionen aus dem Intrazellulärraum ein und bindet neues ATP, der Zustand A ist wieder hergestellt, der Zyklus beginnt von neuem

Die Na/K-Pumpe hat 10 transmembranale Segmente und besteht aus einer
mit einem intrazellulär liegenden Anteil versehenen α- ("Motor" des Moleküls mit einer Nukleotiddomäne zur
ATP-Bindung, einer Phosphorylierungs- und einer dephosphorylierenden
Aktuator-Domäne) und einer separaten, zu einem beträchtlichen Anteil extrazellulär liegenden
β-Untereinheit (kümmert sich um richtige Einlagerung und Faltung der
α-Untereinheit). Die α-Untereinheit erscheint im transmembranalen Abschnitt wie in die ß-Untereinheit "gesteckt".
α- und β-Untereinheiten kommen in mehreren Isoformen vor, je nach Gewebe unterschiedlich exprimiert und mit verschiedenen kinetischen Eigenschaften.
 Die Na/K-Pumpe ist das erste Enzym, von dem
nachgewiesen wurde, dass es Ionen transportiert (Nobelpreis für Chemie
an den dänischen Mediziner Jens Skou
1997).
Die Na/K-Pumpe ist das erste Enzym, von dem
nachgewiesen wurde, dass es Ionen transportiert (Nobelpreis für Chemie
an den dänischen Mediziner Jens Skou
1997).
In den meisten Epithelzellen sind die Na/K-Pumpen auf die basolaterale Membran beschränkt - die apikale Membran übt ihre Transport- und Austauschfunktionen unter Nutzung vorhandener Konzentrationsdifferenzen aus, ohne dass sie Na/K-Pumpen dazu einlagern müsste.
Die höhere intrazelluläre Konzentration nicht-permeabler Anionen (Proteine) lockt Kationen in die Zelle (was die intrazelluläre Osmolalität steigern würde); Anionen wandern hingegen aus der Zelle. Die ungleiche Ionenverteilung führt zu einem Gibbs-Donnan-Potential , welches das Membranpüotential um 1-2 mV erhöht.
, welches das Membranpüotential um 1-2 mV erhöht.
α- und β-Untereinheiten kommen in mehreren Isoformen vor, je nach Gewebe unterschiedlich exprimiert und mit verschiedenen kinetischen Eigenschaften.
 Die Na/K-Pumpe ist das erste Enzym, von dem
nachgewiesen wurde, dass es Ionen transportiert (Nobelpreis für Chemie
an den dänischen Mediziner Jens Skou
1997).
Die Na/K-Pumpe ist das erste Enzym, von dem
nachgewiesen wurde, dass es Ionen transportiert (Nobelpreis für Chemie
an den dänischen Mediziner Jens Skou
1997).In den meisten Epithelzellen sind die Na/K-Pumpen auf die basolaterale Membran beschränkt - die apikale Membran übt ihre Transport- und Austauschfunktionen unter Nutzung vorhandener Konzentrationsdifferenzen aus, ohne dass sie Na/K-Pumpen dazu einlagern müsste.
Die höhere intrazelluläre Konzentration nicht-permeabler Anionen (Proteine) lockt Kationen in die Zelle (was die intrazelluläre Osmolalität steigern würde); Anionen wandern hingegen aus der Zelle. Die ungleiche Ionenverteilung führt zu einem Gibbs-Donnan-Potential
 , welches das Membranpüotential um 1-2 mV erhöht.
, welches das Membranpüotential um 1-2 mV erhöht. Der Gibbs-Donnan-Effekt
beruht auf dem Umstand, dass die Zelle eine hohe Konzentration
vorwiegend negativ geladener Proteine aufweist. Diese können die Zelle
wegen ihrer Größe nicht verlassen. Das erzeugt einerseits einen kolloidosmotischen
Effekt (Wasser strömt in die Zelle), andererseits einen elektrischen,
der den Eintritt von Kationen (+) in die Zelle begünstigt.
Die Aktivität der Na/K-Pumpe wirkt einem Anschwellen der Zelle (das aus unbalanciertem Einströmen von Wasser und Kationen resultieren würde) entgegen - sie befördert mehr Kationen aus der Zelle (3 Na+) als in sie hinein (2 K+).
Die Aktivität der Na/K-Pumpe wirkt einem Anschwellen der Zelle (das aus unbalanciertem Einströmen von Wasser und Kationen resultieren würde) entgegen - sie befördert mehr Kationen aus der Zelle (3 Na+) als in sie hinein (2 K+).
| Die Na/K-ATPase befördert Kaliumionen in die Zelle Ausfall ATP-betriebener Transporter wie der Na/K-Pumpe führt zu Anreicherung von Kationen in der Zelle und osmotischen Wassereinstrom |
 Ca++-ATPasen:
Ca++-ATPasen: 
 Abbildung: Beispiel einer PMCA
Abbildung: Beispiel einer PMCANach Stafford N, Wilson C, Oceandy D, Neyes L, Cartwright EJ. The Plasma Membrane Calcium ATPases and Their Role as Major New Players in Human Disease. Physiol Rev 2017; 97: 1089-125
Regulierung des Calciumspuegels im Zytoplasma einer erregbaren Zelle. Linien / Pfeile: Erhöhung der [Ca++], rote Linien / Pfeile: Senkung der [Ca++] im Zytosol.
IP3R = Inositol-Triphosphat-Rezeptor, NCX = Na/Ca-Austauscher, PMCA = Calciumexportpumpe, ROCC = rezeptorbetriebener Calciumkanal, Ryr = Ryanodinrezeptor, SERCS = Sarko (endo) plasmatisches Retikulum, VOCC = spannungsbetriebener Calciumkanal

IP3R = Inositol-Triphosphat-Rezeptor, NCX = Na/Ca-Austauscher, PMCA = Calciumexportpumpe, ROCC = rezeptorbetriebener Calciumkanal, Ryr = Ryanodinrezeptor, SERCS = Sarko (endo) plasmatisches Retikulum, VOCC = spannungsbetriebener Calciumkanal

 Calciumexportpumpen (plasma membrane calcium ATPases, PMCAs,
Calciumexportpumpen (plasma membrane calcium ATPases, PMCAs,  Abbildung) finden sich in der Zellmembran so gut wie aller Zellen. Sie sind ebenfalls ATP-betrieben und bringen Ca++
aus der Zelle, jeweils ein Ion im Austausch gegen ein oder mehrere Proton(en). Sie haben
hohe Affinität (0.2–0.5 μM) und sind dadurch in der Lage, Calcium aus
der Zelle über ein Konzentrationsgefälle von mindestens zwei
Zehnerpotenzen (!) in den Extrazellulärraum ([Ca++] >1mM) zu transportieren.
Abbildung) finden sich in der Zellmembran so gut wie aller Zellen. Sie sind ebenfalls ATP-betrieben und bringen Ca++
aus der Zelle, jeweils ein Ion im Austausch gegen ein oder mehrere Proton(en). Sie haben
hohe Affinität (0.2–0.5 μM) und sind dadurch in der Lage, Calcium aus
der Zelle über ein Konzentrationsgefälle von mindestens zwei
Zehnerpotenzen (!) in den Extrazellulärraum ([Ca++] >1mM) zu transportieren. Die physiologische Bedeutung dieser Pumpen ist aus mehreren Erkrankungen ersichtlich, die auf PMCA-Defeken beruhen (Ataxie, Taubheit, Autismus, Bluthochdruck, Präeklampsie, koronare Herzkrankheit, Myokardinfarkt u.a.).
 Zelluläre Speicherung: Calciumpumpen stellen auch innerhalb der Zelle Ca++-Konzentrationsgradienten her. Die Aufnahme freier Ca++-Ionen aus dem Zytoplasma in das endoplasmatische Retikulum - speziell das sarkoplasmatische Retikulum verschiedenster Muskelzellen - erfolgt über
SERCA (Sarcoplasmic / endoplasmic reticulum calcium ATPase), eine
energieabhängige Calciumpumpe (ATPase) in der Membran des
sarkoplasmatischen Retikulums. Die Aktivität dieses Systems ermöglicht
die Entspannung des Muskels (vgl. Lusitropie am Herzmuskel).
Zelluläre Speicherung: Calciumpumpen stellen auch innerhalb der Zelle Ca++-Konzentrationsgradienten her. Die Aufnahme freier Ca++-Ionen aus dem Zytoplasma in das endoplasmatische Retikulum - speziell das sarkoplasmatische Retikulum verschiedenster Muskelzellen - erfolgt über
SERCA (Sarcoplasmic / endoplasmic reticulum calcium ATPase), eine
energieabhängige Calciumpumpe (ATPase) in der Membran des
sarkoplasmatischen Retikulums. Die Aktivität dieses Systems ermöglicht
die Entspannung des Muskels (vgl. Lusitropie am Herzmuskel). Die H+-K+-ATPase (Protonen-Kalium-Pumpe) - ähnlich wie die Na/K-Pumpe aus mehreren Isoformen von α- und ß-Untereinheiten aufgebaut - findet sich an der basolateralen Membran so gut wie
aller Epithelzellen, wie auch in der Zellmembran nichtpolarer Zellen.
Die katalytische
Funktion hat die α-Untereinheit, die β-Untereinheit weiß, wo es
hingeht: Sie "steuert" das Enzym in die apikale Membran. Zur vollen
Aktivität bedarf diese ATPase beider Einheiten.
Die H+-K+-ATPase (Protonen-Kalium-Pumpe) - ähnlich wie die Na/K-Pumpe aus mehreren Isoformen von α- und ß-Untereinheiten aufgebaut - findet sich an der basolateralen Membran so gut wie
aller Epithelzellen, wie auch in der Zellmembran nichtpolarer Zellen.
Die katalytische
Funktion hat die α-Untereinheit, die β-Untereinheit weiß, wo es
hingeht: Sie "steuert" das Enzym in die apikale Membran. Zur vollen
Aktivität bedarf diese ATPase beider Einheiten. Dieser
Transporter befördert energieabhängig (unter ATP-Verbrauch)
Wasserstoffionen aus der Zelle. Dadurch steigt der intrazelluläre pH-Wert an

Besonders bekannt ist die Protonen-Kalium-Pumpe in den Belegzellen des Magens, welche Salzsäure produzieren - sie extrudieren Wasserstoffionen durch die apikale Membran in das Lumen und befördert die Kaliumaufnahme. (Vermutlich werden pro 1 mol ATP 2 mol H+ und 2 mol K+ transportiert.)
 H+-Transporter: Protonenpumpen (
H+-Transporter: Protonenpumpen ( Abbildung) finden sich u.a. in der "sealed zone" von Osteoklasten (sie erzeugen ein saures Milieu, dadurch löst sich der Knochen auf), im Epithel der Nebenhodengänge (verhindern eine vorzeitige Aktivierung von Spermien), in präsynaptischen Vesikeln (Herstellung von Protonengradienten, die für die Aufnahme von Neurotransmittern erforderlich ist) oder in der inneren Mitochondrienmembran (Elektronentransport zur Energiegewinnung).
Abbildung) finden sich u.a. in der "sealed zone" von Osteoklasten (sie erzeugen ein saures Milieu, dadurch löst sich der Knochen auf), im Epithel der Nebenhodengänge (verhindern eine vorzeitige Aktivierung von Spermien), in präsynaptischen Vesikeln (Herstellung von Protonengradienten, die für die Aufnahme von Neurotransmittern erforderlich ist) oder in der inneren Mitochondrienmembran (Elektronentransport zur Energiegewinnung).In diese Gruppe gehört auch Thermogenin (UPC1, uncoupling protein 1), das ausschließlich in braunem Fettgewebe nachgewiesen worden ist und und dort durch Entkopplung im Mechanismus der ATP-Energieübertragung Wärme entstehen lässt.
F-Typ ATPasen
Die innere Membran von Mitochondrien
(also deren "eigentliche" Zellmembran) verfügt über F-Typ ATPase (benannt nach bindenden Fraktionen - Fo, F1 - des Moleküls),
welche den letzten Schritt der ATP-Synthesekette bewerkstelligt (ATP-Synthase).
F-Typ ATPasen sind ein aus mehreren Teilen aufgebauter Komplex mit einer Gesamtmasse von ~500 kDa, der während seines Arbeitszyklus eine 120°-Rotationsbewegung vollführt. H+ wandert dabei wie durch eine sich drehende Turbine in das Mitochondrion (wo die Atmungskette einen Elektronengradienten aufgebaut hat) und treibt die ATPase-Funktion an. H+ reagiert mit Sauerstoff, es entsteht H2O; der Durchtritt von jeweils 10 Wasserstoffionen ermöglicht die Synthese von jeweils 3 Molekülen ATP.
F-Typ ATPasen sind ein aus mehreren Teilen aufgebauter Komplex mit einer Gesamtmasse von ~500 kDa, der während seines Arbeitszyklus eine 120°-Rotationsbewegung vollführt. H+ wandert dabei wie durch eine sich drehende Turbine in das Mitochondrion (wo die Atmungskette einen Elektronengradienten aufgebaut hat) und treibt die ATPase-Funktion an. H+ reagiert mit Sauerstoff, es entsteht H2O; der Durchtritt von jeweils 10 Wasserstoffionen ermöglicht die Synthese von jeweils 3 Molekülen ATP.
V-Typ ATPasen ("V-ATPasen")
Dieser vakuoläre
ATPase-Typ (daher die Bezeichnung V-Typ) seknt den pH-Wert in
verschiedenen intrazellulären Organellen. V-ATPasen koppeln Energie,
die beim Abbau von ATP gewonnen wird, mit dem Transport von H+ über Zellmembran und intrazelluläre Membranen. (In Mitochondrien nutzt die ATP-Synthase umgekehrt [H+]-Gradienten zur Bildung von ATP.)

 Abbildung: Aufbau einer V-Typ ATPase
Abbildung: Aufbau einer V-Typ ATPaseNach einer Vorlage in Butler / Brown / Stephenson / Speakman, Animal physiology - An environmental perspective. Oxford University Press 2021
Der transmembranale Sektor (V0, unten) befördert Wasserstoffionen durch Lipidmembranen. Er ist aus einer a-, einer d- und 6 c-Einheiten aufgebaut und mit der ATP-spaltenden intrazellulären Komponente (V1) verbunden. Diese besteht aus den Untereinheiten A bis H. Die Untereinheit A hydrolysiert ATP

V-Typ ATPasen sind komplex aufgebaut (8 Untereinheiten - A bis H, großteils in der zytoplasmatischen Komponete, genannt V1, teils in der transmembranalen Komponente, genannt V0). V1 kümmert sich um die ATP-Hydrolyse, V0 um den Protonentransport, der einen Konzentrationsgradienten von 100:1 (oder mehr) aufbauen kann.
Manche Zellen verfügen über V-Typ ATPase in der Zellmembran (z.B. einige Tubuluszellen in der Niere in deren apikaler Membran), sie entfernen H+ aus der Zelle. Anders als die Protonenpumpe im Magen arbeiten sie unabhängig von Kalium; sie funktionieren eher analog zu den F-Typ ATPasen.
ABC-Transporter
ABC (ATP binding cassette) -Transporter
gehören zu einer in der Natur weit verbreiteten Superfamilie (von
Prokaryoten bis Wirbeltieren). ABC-Transporter nutzen die Energie von
ATP für den Transport verschiedener Stoffe durch Zellmembranen - bei
Eukaryoten nur nach außen (Export). Zahlreiche Erkrankungen - z.B. Immunschwäche, zystische Fibrose, Cholestase usw - beruhen auf Polymorphismen von ABC-Genen.
ABC-Transporter finden sich beim Menschen vor allem in sezernierenden Geweben (Leber, Nieren, Darm, Blut-Hirn-Schranke), sie bringen meist hydrophobe Moleküle aus der Zelle (Exporter) und dienen dabei typischerweise der Entgiftung. Ein Beispiel ist die Familie der MDRs (multidrug resistance transporters), die kationische Stoffwechselprodukte und bestimmte Medikamente aus Leber-, Nieren- oder Darmschleimhautzellen befördern.
ABC-Transporter finden sich beim Menschen vor allem in sezernierenden Geweben (Leber, Nieren, Darm, Blut-Hirn-Schranke), sie bringen meist hydrophobe Moleküle aus der Zelle (Exporter) und dienen dabei typischerweise der Entgiftung. Ein Beispiel ist die Familie der MDRs (multidrug resistance transporters), die kationische Stoffwechselprodukte und bestimmte Medikamente aus Leber-, Nieren- oder Darmschleimhautzellen befördern.
Sekundär aktiver Transport
Cotransport (auch sekundär-aktiver Transport): Die transmembranale Diffusion eines
"primären" Diffusionspartners kann genutzt werden, um einen
"sekundären" Partner mit durch die Membran zu bewegen.
Die Mehrzahl der Cotransportsysteme verwendet den Natriumgradienten für den Transport sekundärer "Passagiere" ( Abbildung): Na/K-ATPasen
verbringen Natriumionen fortlaufend in den Extrazellulärraum ([Na+] >140 mM), und diese diffundieren wo immer möglich in die
Zelle ([Na+] ~ 15 mM).
Abbildung): Na/K-ATPasen
verbringen Natriumionen fortlaufend in den Extrazellulärraum ([Na+] >140 mM), und diese diffundieren wo immer möglich in die
Zelle ([Na+] ~ 15 mM).
Die Mehrzahl der Cotransportsysteme verwendet den Natriumgradienten für den Transport sekundärer "Passagiere" (
 Abbildung): Na/K-ATPasen
verbringen Natriumionen fortlaufend in den Extrazellulärraum ([Na+] >140 mM), und diese diffundieren wo immer möglich in die
Zelle ([Na+] ~ 15 mM).
Abbildung): Na/K-ATPasen
verbringen Natriumionen fortlaufend in den Extrazellulärraum ([Na+] >140 mM), und diese diffundieren wo immer möglich in die
Zelle ([Na+] ~ 15 mM). 
 Abbildung: Sekundär-aktiver Transport
Abbildung: Sekundär-aktiver TransportNach einer Vorlage in studyblue.com
Zellaußenseite oben, Innenseite unten. Natriumgradient (roter Pfeil): außen 145 mM,
innen 8-30 mM, s. Tabelle.
Der Natriumgradient (erzeugt durch Na/K-Pumpen) ermöglicht energetisch sekundäre Transportvorgänge, z.B. (links) Auswärtstransport von Ca++ (Na+/Ca++-Antiporter) oder H+ (Na+/H+-Antiporter), oder Einwärtstransport von Glucose (SGLT1) oder Aminosäuren (Symport, rechts).
Weitere wichrtige Beispiele für sekundär aktiven Symport (s. folgenden Text): Na+/K+/2Cl--Cotransporter, K+/Cl--Cotransporter, Na+/Neurotransmitter-Cotransporter
Der Natriumgradient (erzeugt durch Na/K-Pumpen) ermöglicht energetisch sekundäre Transportvorgänge, z.B. (links) Auswärtstransport von Ca++ (Na+/Ca++-Antiporter) oder H+ (Na+/H+-Antiporter), oder Einwärtstransport von Glucose (SGLT1) oder Aminosäuren (Symport, rechts).
Weitere wichrtige Beispiele für sekundär aktiven Symport (s. folgenden Text): Na+/K+/2Cl--Cotransporter, K+/Cl--Cotransporter, Na+/Neurotransmitter-Cotransporter

Aber auch andere
Konzentrationsgradienten, wie für Kalium oder Wasserstoffionen, können
für einen Mittransport genutzt werden - entweder in derselben Richtung
(Symport) oder in der Gegenrichtung, gewissermaßen im Austausch (Antiport).
Symport Natrium, Kalium, Protonen zusammen mit
Natrium, Kalium, Protonen zusammen mit  Chlorid, Bicarbonat, Phosphat, Aminosäuren, Peptiden, zweiwertigen Metallen.
Chlorid, Bicarbonat, Phosphat, Aminosäuren, Peptiden, zweiwertigen Metallen. Natriumabhängig funktionieren:
Natriumabhängig funktionieren: Natrium-Glucose-Cotransporter (SGLT: Sodium glucose transporter,
Natrium-Glucose-Cotransporter (SGLT: Sodium glucose transporter,  Abbildung) - dieser große Komplex (670 Aminosäuren) bringt Glucose gegen ihr Konzentrationsgefälle ("bergauf") in die Zelle, angetrieben durch den Natriumgradienten in die Zelle und damit energetisch durch die Na+/K+-ATPase
"befeuert" (sekundär aktiver Transport).
Abbildung) - dieser große Komplex (670 Aminosäuren) bringt Glucose gegen ihr Konzentrationsgefälle ("bergauf") in die Zelle, angetrieben durch den Natriumgradienten in die Zelle und damit energetisch durch die Na+/K+-ATPase
"befeuert" (sekundär aktiver Transport). 
 Abbildung: Modell eines Na/Glucose-Symporters
Abbildung: Modell eines Na/Glucose-SymportersNach Gyimesi G, Pujol-Gimenez J, Kanai Y, Hediger MA. Sodium-coupled glucose transport, the SLC5 family, and therapeutically relevant inhibitors: from molecular discovery to clinical application. Eur J Physiol 2020; 472: 1177-206
Im Ruhezustand ist der Kanal geschlossen (1).
Nach Öffnung des Kanals nach außen binden zunächst zwei Natriumionen
(2), gefolgt von einer weiteren Öffnung des äußeren Gate und Anlagerung
des Glucosemoleküls in einer taschenförmigen Mulde (3). Dann öffnet das
innere Gate (4), Glucose und Natriumionen verlassen den Kanal Richtung
Zytoplasma (5).
Die blauen Doppelpfeile deuten an, dass der Transportprozess reversibel ist. Es besteht aber eine Asymmetrie in der Kinetik zugunsten der Aufnahme von Glucose in die Zelle
Die blauen Doppelpfeile deuten an, dass der Transportprozess reversibel ist. Es besteht aber eine Asymmetrie in der Kinetik zugunsten der Aufnahme von Glucose in die Zelle

Natrium-Glucose-Cotransport findet über den Bürstensaum mehrerer epithelialer Zellen statt: SGLT stellt eine Familie von Glucosetransportern dar: SGLT1 findet sich vor allem in der Darmmukosa (Resorption der Nahrungsglucose in Duodenum und Jejunum), SGLT2 in Nierentubuli (Rückresorption von Glucose aus dem Filtrat). Die Funktion von SGLT3 (das weit verbreitet vorkommt) ist unklar (glucoseabhängiger Ionenkanal, Glucosesensor?).
 Natrium-Kalium-Chlorid-Cotransporter (Na+/K+/2Cl-, NKCC, NK2Cl cotransporter,
Natrium-Kalium-Chlorid-Cotransporter (Na+/K+/2Cl-, NKCC, NK2Cl cotransporter,  Abbildung) findet sich (NKCC1) in verschiedenen nichtepithelialen,
sowie in zahlreichen Epithelzellen, z.B. in den Azinusepithelien der Speicheldrüsen, im Dünn- und Dickdarm, im Pankreas, oder der stria vascularis des Innenohrs. In der Henle'schen Schleife der Niere findet sich NKCC2.
Abbildung) findet sich (NKCC1) in verschiedenen nichtepithelialen,
sowie in zahlreichen Epithelzellen, z.B. in den Azinusepithelien der Speicheldrüsen, im Dünn- und Dickdarm, im Pankreas, oder der stria vascularis des Innenohrs. In der Henle'schen Schleife der Niere findet sich NKCC2.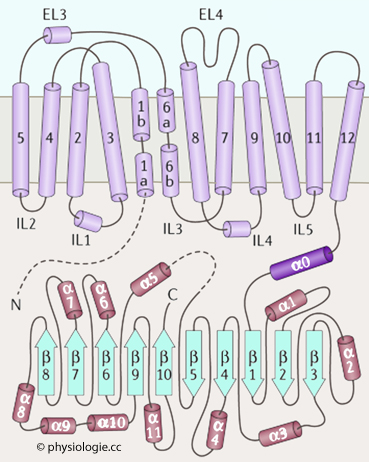
 Abbildung: Natrium-Kalium-Chlorid-Cotransporter
Abbildung: Natrium-Kalium-Chlorid-CotransporterNach Garneau AP, Isenring P. The structure of Na+-K+-Cl- cotransporter 1. Nature Rev Nephrol 2019; 15: 732-4
Ein komplex aufgebauter Cotransporter mit 12 membrandurchspannenden sowie zahlreichen intrazellulären Aminosäuresequenzen. Er befördert mit je einem Natrium- ein Kalium- und zwei Chloridionen aus dem Extrazellulärraum in die Zelle.
EL = extrazellulärer, IL = intrazellulärer Loop

NKCCs sind durch Furosemid hemmbar. NKCC können an der Regulation des Zellvolumens teilnehmen (regulatory volume increase RVI).
 Natrium-Chlorid-Cotransporter (NCC), z.B. in distalen Nierentubuli. Sie sind kalium-unabhängig und durch Thiazid-Diuretika hemmbar.
Natrium-Chlorid-Cotransporter (NCC), z.B. in distalen Nierentubuli. Sie sind kalium-unabhängig und durch Thiazid-Diuretika hemmbar. Natrium-Aminosäure-Cotransporter (z.B. Glutamat)
Natrium-Aminosäure-Cotransporter (z.B. Glutamat) Natrium-Cholin-Cotransporter (z.B. in cholinergen Varikositäten)
Natrium-Cholin-Cotransporter (z.B. in cholinergen Varikositäten) Natrium-Chlorid-Serotonin-Transporter (SERT)
Natrium-Chlorid-Serotonin-Transporter (SERT) Natrium-Gallensäure-Cotransporter (Ileal sodium / bile acid cotransporter)
Natrium-Gallensäure-Cotransporter (Ileal sodium / bile acid cotransporter) Natrium-Taurocholat-Cotransporter (NTCP, Natrium-taurocholate cotransporting peptide)
Natrium-Taurocholat-Cotransporter (NTCP, Natrium-taurocholate cotransporting peptide) Natrium-Phosphat-Cotransporter (NPT) im Dünndarm und im proximalen Nierentubulus (resorbiert 70-80% des angebotenen / filtrierten Phosphats, 3 Na+ mit 1 Phosphat)
Natrium-Phosphat-Cotransporter (NPT) im Dünndarm und im proximalen Nierentubulus (resorbiert 70-80% des angebotenen / filtrierten Phosphats, 3 Na+ mit 1 Phosphat) Natrium-Bicarbonat-Cotransporter (NBC), z.B. im proximalen Nierentubulus
Natrium-Bicarbonat-Cotransporter (NBC), z.B. im proximalen Nierentubulus Natrium-Jodid-Cotransporter (NIS, Natrium-Jodid-Symporter) in den Follikelepithelzellen der Schilddrüse
Natrium-Jodid-Cotransporter (NIS, Natrium-Jodid-Symporter) in den Follikelepithelzellen der Schilddrüse Von Protonengradienten angetrieben sind:
Von Protonengradienten angetrieben sind: Der Wasserstoffionen-Oligopeptid-Cotransporter (PepT) resorbiert in Nierentubuli und im Darm kleine (2-4 Aminosäuren) Peptide, angetrieben vom H+-Gradienten (Lumen zu Zelle).
Der Wasserstoffionen-Oligopeptid-Cotransporter (PepT) resorbiert in Nierentubuli und im Darm kleine (2-4 Aminosäuren) Peptide, angetrieben vom H+-Gradienten (Lumen zu Zelle). Wasserstoffionen-Monocarboxylat-Cotransporter (MCT 1, 2, ...) transportieren (H+-abhängig) Monocarboxylate (wie Lactat, Pyruvat, Acetessigsäure u.a.) z.B.
Wasserstoffionen-Monocarboxylat-Cotransporter (MCT 1, 2, ...) transportieren (H+-abhängig) Monocarboxylate (wie Lactat, Pyruvat, Acetessigsäure u.a.) z.B. aus Erythrozyten, die Lactat produzieren,
aus Erythrozyten, die Lactat produzieren, von der innersten Myelinlage (Oligidendrozyten) Lactat und Pyruvat in das entsprechende Axon.
von der innersten Myelinlage (Oligidendrozyten) Lactat und Pyruvat in das entsprechende Axon. Wasserstoffionen-divalente Kationen-Cotransporter (DCT)
- auch: Divalent metal transporter (DMT), Natural
resistance-associated macrophage protein (NRAMP) - bindet und
transportiert zweiwertige Kationen wie Eisen (Fe++), Zink, Kupfer, Mangan,
Cadmium. DCT werden vor allem von Zellen in Nierentubuli und Darmschleimhaut exprimiert
Wasserstoffionen-divalente Kationen-Cotransporter (DCT)
- auch: Divalent metal transporter (DMT), Natural
resistance-associated macrophage protein (NRAMP) - bindet und
transportiert zweiwertige Kationen wie Eisen (Fe++), Zink, Kupfer, Mangan,
Cadmium. DCT werden vor allem von Zellen in Nierentubuli und Darmschleimhaut exprimiert
 Abbildung: Passiver ("Kanäle", "Carrier") und aktiver Transport ("Pumpen", gekoppelter Transport) durch die Zellmembran
Abbildung: Passiver ("Kanäle", "Carrier") und aktiver Transport ("Pumpen", gekoppelter Transport) durch die ZellmembranNach Purves et al., Life: The Science of Biology, 4th Ed. Sinauer Associates & WH Freeman
Uniport: Diffusion durch Membranporen.
Symport (Cotransport): Diffusion eines Stoffes treibt energetisch den Mittransport eines anderen an.
Antiport (Austausch): Diffusion eines Stoffes treibt energetisch den Transport eines anderen in die Gegenrichtung an
Symport (Cotransport): Diffusion eines Stoffes treibt energetisch den Mittransport eines anderen an.
Antiport (Austausch): Diffusion eines Stoffes treibt energetisch den Transport eines anderen in die Gegenrichtung an

 Weitere Cotransporter (Symporter):
Weitere Cotransporter (Symporter): Chlorid-Bicarbonat-Cotransporter bringen z.B. in Speicheldrüsen-Azini Cl- und HCO3-
über die akipale Membran in das Lumen (wodurch dieses negativ
aufgeladen wird, dadurch werden Natriumionen parazellulär in das Lumen
verbracht).
Chlorid-Bicarbonat-Cotransporter bringen z.B. in Speicheldrüsen-Azini Cl- und HCO3-
über die akipale Membran in das Lumen (wodurch dieses negativ
aufgeladen wird, dadurch werden Natriumionen parazellulär in das Lumen
verbracht). Kalium-Chlorid-Cotransporter (KCC) bewirken Ausstrom von Cl- zusammen mit K+ , z.B. in Nervenzellen (zur Aufrechterhaltung niedriger intrazellulärer Chloridkonzentrationen), im proximalen Nierentubulus und Darmschleimhautzellen (transportieren rückresorbiertes Chlorid über die basolaterale Membran).
Kalium-Chlorid-Cotransporter (KCC) bewirken Ausstrom von Cl- zusammen mit K+ , z.B. in Nervenzellen (zur Aufrechterhaltung niedriger intrazellulärer Chloridkonzentrationen), im proximalen Nierentubulus und Darmschleimhautzellen (transportieren rückresorbiertes Chlorid über die basolaterale Membran).| Der
K/Cl-Symporter schafft Chlorid- mit Kaliumionen aus der Zelle und wirkt
dadurch einer Zellschwellung (durch Anstieg der intrazellulären
Osmolarität) entgegen |
Austausch (exchanger, Antiport) - sekundär energieverbrauchend, ein bestehender elektrochemischer
Gradient wird für den Austausch mit einer zweiten Molekülart (in
die Gegenrichtung) genutzt. Hier werden verschiedene Kombinationen von "Passagieren" gegeneinander durch die Zellmembran ausgetauscht, wie z.B.
 Natrium, Chlorid, Natrium plus Bicarbonat gegen
Natrium, Chlorid, Natrium plus Bicarbonat gegen
 Calcium, Bicarbonat, Protonen, Formiat, Oxalat, Chlorid
Calcium, Bicarbonat, Protonen, Formiat, Oxalat, Chlorid
Antiport- (Austausch-) Systeme sind z.B.
 Natrium, Chlorid, Natrium plus Bicarbonat gegen
Natrium, Chlorid, Natrium plus Bicarbonat gegen Calcium, Bicarbonat, Protonen, Formiat, Oxalat, Chlorid
Calcium, Bicarbonat, Protonen, Formiat, Oxalat, ChloridAntiport- (Austausch-) Systeme sind z.B.
 Der Natrium-Calcium-Austauscher (NCX, ) kommt fast ubiquitär vor, z.B. im Skelettmuskel, im Herzmuskel, in der Dünndarmschleimhaut, in distalen Tubulusepithelzellen der Niere, oder in Photorezeptoren in der Netzhaut des Auges.
Der Natrium-Calcium-Austauscher (NCX, ) kommt fast ubiquitär vor, z.B. im Skelettmuskel, im Herzmuskel, in der Dünndarmschleimhaut, in distalen Tubulusepithelzellen der Niere, oder in Photorezeptoren in der Netzhaut des Auges. 
 Abbildung: Wirkungsweise eines Na+/Ca++-Austauschers
Abbildung: Wirkungsweise eines Na+/Ca++-AustauschersNach einer Vorlage in Augustine / Groh / Huettel / LaMantia / White (eds), Neuroscience. Intl 7th ed. Oxford University Press 2024
Schematische Darstellung. Die nach außen (zum Interstitium) offene Form (2, 3) gibt ein vorher (1) gebundenes Ca++-Ion an den Extrazellulärraum ab und bindet drei Na+-Ionen, die nach innen (zum Zytoplasma) offene Form (4, 1) gibt die vorher gebundenen Natriumionen an das Zellinnere ab und bindet ein Calciumion. Die Bindungsereignisse triggern das Kippen zwischen den beiden Formen des Ionenkanals (horizontale Doppelpfeile), mit dem eine Veränderung der Bindungspräferenzen (vertikale Doppelpfeile) einhergeht.
Das Calcium wird so gegen seinen Konzentrationsgradienten (mehrere Zehnerpotenzen) in den Extrazellulärraum gebracht, der Austausch wird energetisch über den Natriumgradienten in die Zelle angetrieben (sekundär aktiver Transport: Der Konzentrationsgradient des Natriums ist ein Effekt der allgegenwärtigen Na/K-ATPase)

Der Na+/Ca++-Austauscher hat 10 die Zellmembran durchspannende α-Helices, von denen einige an der Bildung des zentralen Ionenkanals beteiligt sind. Diese Struktur tauscht Na+ gegen Ca++ meist im Verhältnis 3 Na+ gegen 1 Ca++ aus, d.h. sie arbeitet elektrogen (pro Austausch eine positive Ladung in Na+-Richtung, also zum Zellinneren). Dabei werden Calciumionen aus dem Zytoplasma der Zelle entfernt, wo die [Ca++] um Zehnerpotenzen niedriger ist (meist <10-7 M) als im Extrazellulärraum (2-3 mM, davon die Hälfte freie Ionen).
 Der Natrium-Wasserstoffionen-Austauscher (NHE) ist ein sehr wichtiger Natriumtransporter, der von fast allen Zellen des Körpers exprimiert wird, z.B. in Nierentubuli (der NHE der proximalen Tubuli ist Angiotensin-gesteuert), Darmepithel, Leber oder Gallenblase (Natriumresorption, Säuresekretion). Sie spielen eine wichtige Rolle bei der Stabilisierung von Zellvolumen und pH-Wert.
Der Natrium-Wasserstoffionen-Austauscher (NHE) ist ein sehr wichtiger Natriumtransporter, der von fast allen Zellen des Körpers exprimiert wird, z.B. in Nierentubuli (der NHE der proximalen Tubuli ist Angiotensin-gesteuert), Darmepithel, Leber oder Gallenblase (Natriumresorption, Säuresekretion). Sie spielen eine wichtige Rolle bei der Stabilisierung von Zellvolumen und pH-Wert. Chlorid-Bicarbonat-Antiporter (AE, anion exchanger) tauschen an Zellmembranen Cl- gegen HCO3- aus, z.B. in den Ausführungsgängen der Speicheldrüsen, des Pankreas, in der basolateralen Membran von Belegzellen im Magen und von Epithelzellen der dicken aufsteigenden Tubuli der Henle-Schleife, in der apikalen Membran von Dickdarmmukosazellen, oder in der Membran von Erythrozyten (Hamburger-Effekt).
Chlorid-Bicarbonat-Antiporter (AE, anion exchanger) tauschen an Zellmembranen Cl- gegen HCO3- aus, z.B. in den Ausführungsgängen der Speicheldrüsen, des Pankreas, in der basolateralen Membran von Belegzellen im Magen und von Epithelzellen der dicken aufsteigenden Tubuli der Henle-Schleife, in der apikalen Membran von Dickdarmmukosazellen, oder in der Membran von Erythrozyten (Hamburger-Effekt). Pendrin
Pendrin ist ein Anionenaustauscher (Chlorid, Bicarbonat, Sulfat, Jodid,
Formiat), der von Zellen in Niere, Schilddrüse und Innenohr exprimiert
wird. Im proximalen Teil der Henle´schen Schleife der Niere tauscht Pendrin Anionen aus, in der Schilddrüse extrudiert es Jodid über die apikale Membran in das Kolloid; seine Funktion im Innenohr ist unklar (vielleicht pH- oder [Ca++]- regulierend).
ist ein Anionenaustauscher (Chlorid, Bicarbonat, Sulfat, Jodid,
Formiat), der von Zellen in Niere, Schilddrüse und Innenohr exprimiert
wird. Im proximalen Teil der Henle´schen Schleife der Niere tauscht Pendrin Anionen aus, in der Schilddrüse extrudiert es Jodid über die apikale Membran in das Kolloid; seine Funktion im Innenohr ist unklar (vielleicht pH- oder [Ca++]- regulierend). Natriumbetriebener Chlorid-Bicarbonat-Antiporter
tauschen Natrium und Bicarbonat (das auf diese Weise in die Zelle
gelangt und den intrazellulären pH-Wert anhebt) gegen zwei Chloridionen
aus.
Natriumbetriebener Chlorid-Bicarbonat-Antiporter
tauschen Natrium und Bicarbonat (das auf diese Weise in die Zelle
gelangt und den intrazellulären pH-Wert anhebt) gegen zwei Chloridionen
aus. Sulfat-Antiporter (SAT)
tauschen Sulfat gegen zwei Anionen. Sie kommen in Dünndarm und
Nierentubuli vor, wo sie die Resorption von Sulfat unterstützen.
Sulfat-Antiporter (SAT)
tauschen Sulfat gegen zwei Anionen. Sie kommen in Dünndarm und
Nierentubuli vor, wo sie die Resorption von Sulfat unterstützen. Renale Organic Anion Transporter (OAT) tauschen z.B. PAH gegen Ketoglutarat.
Renale Organic Anion Transporter (OAT) tauschen z.B. PAH gegen Ketoglutarat. Chlorid-Formiat-Antiporter tauschen Cl- gegen COO-.
Chlorid-Formiat-Antiporter tauschen Cl- gegen COO-. Chlorid-Oxalat-Austauscher (Cl- gegen C2O4--) in der apikalen Membran proximaler Tubuluszellen in der Niere unterstützen die Resorption von Chlorid.
Chlorid-Oxalat-Austauscher (Cl- gegen C2O4--) in der apikalen Membran proximaler Tubuluszellen in der Niere unterstützen die Resorption von Chlorid.
Die Zusammensetzung der Flüssigkeit im Zytosol hängt wesentlich von der
Art der Zelle ab. So ist die Chloridkonzentration in Epithelzellen
höher als in Nervenzellen. (Messtechnisch wird nicht die Konzentration, sondern die Aktivität
von Ionen im Zytosol bestimmt und aus ihr die
Konzentration ermittelt.)
 Als Aktivität bezeichnet man die wirksame Konzentration
gelöster Teilchen: In konzentrierten Lösungen machen sich
Wechselwirkungen zwischen gelösten Teilchen (insbesondere zwischen
Ionen) bemerkbar und schränken ihre Beweglichkeit ein. Die wirksame
Konzentration (Aktivität A) ist daher geringer als die tatsächliche,
quantifiziert wird sie als das Produkt aus tatsächlicher Konzentration
(c) und einem als Aktivitätskoeffizient (f) bezeichneten Faktor
(seinerseits eine Funktion der Ionenstärke):
Als Aktivität bezeichnet man die wirksame Konzentration
gelöster Teilchen: In konzentrierten Lösungen machen sich
Wechselwirkungen zwischen gelösten Teilchen (insbesondere zwischen
Ionen) bemerkbar und schränken ihre Beweglichkeit ein. Die wirksame
Konzentration (Aktivität A) ist daher geringer als die tatsächliche,
quantifiziert wird sie als das Produkt aus tatsächlicher Konzentration
(c) und einem als Aktivitätskoeffizient (f) bezeichneten Faktor
(seinerseits eine Funktion der Ionenstärke):
Die Tabelle zeigt neben intrazellulären Referenzwerten (Zytosol) Vergleichswerte für die extrazelluläre (interstitielle) Flüssigkeit bzw. das Blutplasma:
 Als Aktivität bezeichnet man die wirksame Konzentration
gelöster Teilchen: In konzentrierten Lösungen machen sich
Wechselwirkungen zwischen gelösten Teilchen (insbesondere zwischen
Ionen) bemerkbar und schränken ihre Beweglichkeit ein. Die wirksame
Konzentration (Aktivität A) ist daher geringer als die tatsächliche,
quantifiziert wird sie als das Produkt aus tatsächlicher Konzentration
(c) und einem als Aktivitätskoeffizient (f) bezeichneten Faktor
(seinerseits eine Funktion der Ionenstärke):
Als Aktivität bezeichnet man die wirksame Konzentration
gelöster Teilchen: In konzentrierten Lösungen machen sich
Wechselwirkungen zwischen gelösten Teilchen (insbesondere zwischen
Ionen) bemerkbar und schränken ihre Beweglichkeit ein. Die wirksame
Konzentration (Aktivität A) ist daher geringer als die tatsächliche,
quantifiziert wird sie als das Produkt aus tatsächlicher Konzentration
(c) und einem als Aktivitätskoeffizient (f) bezeichneten Faktor
(seinerseits eine Funktion der Ionenstärke):A = c . f
Die Tabelle zeigt neben intrazellulären Referenzwerten (Zytosol) Vergleichswerte für die extrazelluläre (interstitielle) Flüssigkeit bzw. das Blutplasma:
|
Zusammensetzung physiologischer Flüssigkeiten
 Gerundete Mittelwerte und Normbereiche nach verschiedenen Quellen |
|||
| Intrazelluläre Flüssigkeit |
Extrazelluläre Flüssigkeit |
||
| Interstitium | Blutplasma * | ||
| Na+ |
15 mM (8-30) | 144 mM | 142 mM |
| K+ | 140 mM (120-150) | 4,5 mM | 4,4 mM |
| Ca++ | 10-4 - 10-7 mM | 1,3 mM (ionisiert) | 2,5 mM (gesamt) 1,2 mM (ionisiert) |
| Mg++ | 18 mM (gesamt) 1 mM (ionisiert) |
0,6 mM (ionisiert) | 1 mM |
| Kationen |
~153 mM | ~150 mM | |
| Cl- | 4-20 mM | 116 mM | 103 mM |
| HCO3- | 12 mM (8-15) | 25 mM | 24 mM (venös) |
| SO4-- |
? |
0,5 mM | 0,5 mM |
| Phosphat (primär und sekundär) |
29 mM (gesamt) 0,7 mM (frei) |
2 mM (gesamt) 0,8 mM (ionisiert) |
0,8-1,5 mM (gesamt) 0,7 mM (ionisiert) |
| Organisch- saure Salze |
54 mM | 4 mM | 4 mM (davon Aminosäuren ~2,4, Urat ~0,3 mM) |
| Glucose |
sehr niedrig |
5,9 mM | 5,5 mM |
| Proteine | 54 mM ~30 g/dl |
~5 mM >1 g/dl |
14 mM (Ladungsäquivalente) |
| Anionen |
~153 mM | ~150 mM | |
| pH |
~7,2 |
7,4 |
7,4 |
| Osmolalität |
290 mosm/kg | 290 mosm/kg | 291 mosm/kg |
*
6% des Plasmavolumens werden von Proteinen beansprucht. Im Plasmawasser
(Ultrafiltrat, z.B. glomerulär) sind die Konzentrationswerte für
Mikrostoffe daher um ~6% höher als im Blutplasma
Auffallend ist der Reichtum an Kochsalz
(NaCl) in den extrazellulären Flüssigkeiten sowie die hohe
intrazelluläre Calciumkonzentration. Die Konzentration an Calciumionen
(Ca++) ist extrazellulär um Zehnerpotenzen höher als in der Zelle, wo sie entscheidene Signalfunktionen ausüben. Die osmotische Konzentration
der meisten Körperflüssigkeiten ist so gut wie gleich hoch (um 290
mOsm/kg - "isotone" Flüssigkeiten), Ausnahmen machen insbesondere Schweiß (hypoton) und Harn (hypo-, iso- oder hyperton).

 Abbildung: Zusammensetzung von Körperflüssigkeiten
Abbildung: Zusammensetzung von Körperflüssigkeiten Nach einer Vorlage bei Silverthorn, Human Physiology - an integrated approach, 4th ed. Pearson International 2007
Nur die Anteile der führenden gelösten Stoffe (Solute) in den wichtigsten Kompartimenten - P = Blutplasma, I = interstitielle Flüssigkeit, C = intrazelluläre Flüsigkeit - sind gezeigt. Man erkennt die hohe Konzentration (typische Durchschnittswerte) von Kochsalz (Na+, Cl-) in den extrazellulären (P + I), und von Kaliumsalzen (K+) in den intrazellulären (C) Flüssigkeiten. Bikarbonat liegt in der Zelle in geringerer Konzentration vor als außerhalb
| Im Blutplasma (und in der extrazellulären Flüssigkeit) ist Natrium das Kation, Chlorid das Anion mit der höchsten Konzentration Im Zytoplasma ist Kalium das Kation mit der höchsten Konzentration |
Die wesentlich höhere Kaliumkonzentration im Zytosol - verglichen mit dem
Extrazellulärraum, ein Ergebnis der Aktivität der
Natrium-Kalium-Pumpe - ist der Motor für die permanente
Auswärtsdiffusion von
Kaliumionen, was wiederum die Zellmembran auflädt (Ruhepotential).
Umgekehrt ist die Natriumkonzentration außerhalb der Zelle höher als
innerhalb (ebenfalls wegen der Na-K-ATPase), und gelegentliche Öffnung von Natriumkanälen (bei Erregung der Zelle)
führt zum Einströmen von Natriumionen und temporärem Zusammenbrechen des
Ruhepotentials (Aktionspotential).
Ein besonders hoher Konzentrationsunterschied liegt für Calciumionen vor; extrazellulär ist [Ca++] um etwa drei Zehnerpotenzen höher als intrazellulär. Calciumionen haben besonders vielfältige Bedeutung für die Physiologie der Zelle (Signalvermittlung, Erregung, Kontraktion etc).
Der pH-Wert des Intrazellulärraums beträgt um den Wert 7,1, d.h. leicht basisch (der Neutralpunkt bei 37°C liegt bei pH=6,8; Blut hat pH=7,4). Zellen produzieren fortlaufend saure Valenzen, die Stabilisierung bei pH 7,2 erfolgt über zwei Mechanismen:
 Metabolische Pufferung: Enzymsysteme sind teils H+-Produzenten, teils verbrauchen sie H+.
Dementsprechend wird ihre Aktivität bei Imbalancen des zellulären pH
hoch- oder heruntergefahren. Saure Substanzen (Lactat, Pyruvat etc)
können in Glucose (neutral) und CO2 umgewandelt werden, letzteres wird abgeatmet und so aus dem Körper entfernt
Metabolische Pufferung: Enzymsysteme sind teils H+-Produzenten, teils verbrauchen sie H+.
Dementsprechend wird ihre Aktivität bei Imbalancen des zellulären pH
hoch- oder heruntergefahren. Saure Substanzen (Lactat, Pyruvat etc)
können in Glucose (neutral) und CO2 umgewandelt werden, letzteres wird abgeatmet und so aus dem Körper entfernt

 Transport von sauren / basischen Stoffen durch die Zellmembran: Der Na+-H+-Austauscher
erlaubt die Entfernung von Protonen aus der Zelle unter dem Antrieb des
Natriumgradienten. Er wird durch zelluläre Acidose stimuliert (durch
interstitielle - extrazelluläre - Azidose hingegen gehemmt). Dazu kommen in speziellen Zellen weitere Protonentransportsysteme, die z.T. aktiv als ATPasen wirken.
Transport von sauren / basischen Stoffen durch die Zellmembran: Der Na+-H+-Austauscher
erlaubt die Entfernung von Protonen aus der Zelle unter dem Antrieb des
Natriumgradienten. Er wird durch zelluläre Acidose stimuliert (durch
interstitielle - extrazelluläre - Azidose hingegen gehemmt). Dazu kommen in speziellen Zellen weitere Protonentransportsysteme, die z.T. aktiv als ATPasen wirken.
Ein besonders hoher Konzentrationsunterschied liegt für Calciumionen vor; extrazellulär ist [Ca++] um etwa drei Zehnerpotenzen höher als intrazellulär. Calciumionen haben besonders vielfältige Bedeutung für die Physiologie der Zelle (Signalvermittlung, Erregung, Kontraktion etc).
Der pH-Wert des Intrazellulärraums beträgt um den Wert 7,1, d.h. leicht basisch (der Neutralpunkt bei 37°C liegt bei pH=6,8; Blut hat pH=7,4). Zellen produzieren fortlaufend saure Valenzen, die Stabilisierung bei pH 7,2 erfolgt über zwei Mechanismen:
 Metabolische Pufferung: Enzymsysteme sind teils H+-Produzenten, teils verbrauchen sie H+.
Dementsprechend wird ihre Aktivität bei Imbalancen des zellulären pH
hoch- oder heruntergefahren. Saure Substanzen (Lactat, Pyruvat etc)
können in Glucose (neutral) und CO2 umgewandelt werden, letzteres wird abgeatmet und so aus dem Körper entfernt
Metabolische Pufferung: Enzymsysteme sind teils H+-Produzenten, teils verbrauchen sie H+.
Dementsprechend wird ihre Aktivität bei Imbalancen des zellulären pH
hoch- oder heruntergefahren. Saure Substanzen (Lactat, Pyruvat etc)
können in Glucose (neutral) und CO2 umgewandelt werden, letzteres wird abgeatmet und so aus dem Körper entfernt
 Transport von sauren / basischen Stoffen durch die Zellmembran: Der Na+-H+-Austauscher
erlaubt die Entfernung von Protonen aus der Zelle unter dem Antrieb des
Natriumgradienten. Er wird durch zelluläre Acidose stimuliert (durch
interstitielle - extrazelluläre - Azidose hingegen gehemmt). Dazu kommen in speziellen Zellen weitere Protonentransportsysteme, die z.T. aktiv als ATPasen wirken.
Transport von sauren / basischen Stoffen durch die Zellmembran: Der Na+-H+-Austauscher
erlaubt die Entfernung von Protonen aus der Zelle unter dem Antrieb des
Natriumgradienten. Er wird durch zelluläre Acidose stimuliert (durch
interstitielle - extrazelluläre - Azidose hingegen gehemmt). Dazu kommen in speziellen Zellen weitere Protonentransportsysteme, die z.T. aktiv als ATPasen wirken.
Zellorganellen

 "Orgänchen", ὄργανον = Werkzeug
"Orgänchen", ὄργανον = Werkzeug
Zytoplasma und Zytoskelett Zellkern
Zellkern  Ribosomen
Ribosomen  Endoplasmatisches Retikulum
Endoplasmatisches Retikulum  Vesikel
Vesikel  Golgi-Apparat
Golgi-Apparat  Mitochondrien
Mitochondrien  Lysosomen, Peroxisomen, Sekretionsgranula
Lysosomen, Peroxisomen, Sekretionsgranula

 "Orgänchen", ὄργανον = Werkzeug
"Orgänchen", ὄργανον = WerkzeugZellorganellen
( Abbildung) stellen spezialisierte Reaktionsräume
in der Zelle dar
und werden durch Biomembranen von ihrer Umgebung abgetrennt.
Endoplasmatisches Retikulum, Golgi-Apparat, Vesikel, Peroxisomen und
Lysosomen verfügen an ihrer Außenseite über eine einfache, Mitochondrien und der Zellkern über eine doppelte
Lipid-Doppellamelle. Mitochondrien verfügen dadurch über einen eigenen
Intermembranraum (zwischen äußerer und innerer Mitochondrienmembran),
wie auch der Zellkern (perinukleärer Spalt zwischen äußerer und innerer
Kernmembran). Alle mit einer Membran eingehüllten Strukturen der Zelle
werden als Zellorganellen eingestuft.
Abbildung) stellen spezialisierte Reaktionsräume
in der Zelle dar
und werden durch Biomembranen von ihrer Umgebung abgetrennt.
Endoplasmatisches Retikulum, Golgi-Apparat, Vesikel, Peroxisomen und
Lysosomen verfügen an ihrer Außenseite über eine einfache, Mitochondrien und der Zellkern über eine doppelte
Lipid-Doppellamelle. Mitochondrien verfügen dadurch über einen eigenen
Intermembranraum (zwischen äußerer und innerer Mitochondrienmembran),
wie auch der Zellkern (perinukleärer Spalt zwischen äußerer und innerer
Kernmembran). Alle mit einer Membran eingehüllten Strukturen der Zelle
werden als Zellorganellen eingestuft.
 Abbildung) stellen spezialisierte Reaktionsräume
in der Zelle dar
und werden durch Biomembranen von ihrer Umgebung abgetrennt.
Endoplasmatisches Retikulum, Golgi-Apparat, Vesikel, Peroxisomen und
Lysosomen verfügen an ihrer Außenseite über eine einfache, Mitochondrien und der Zellkern über eine doppelte
Lipid-Doppellamelle. Mitochondrien verfügen dadurch über einen eigenen
Intermembranraum (zwischen äußerer und innerer Mitochondrienmembran),
wie auch der Zellkern (perinukleärer Spalt zwischen äußerer und innerer
Kernmembran). Alle mit einer Membran eingehüllten Strukturen der Zelle
werden als Zellorganellen eingestuft.
Abbildung) stellen spezialisierte Reaktionsräume
in der Zelle dar
und werden durch Biomembranen von ihrer Umgebung abgetrennt.
Endoplasmatisches Retikulum, Golgi-Apparat, Vesikel, Peroxisomen und
Lysosomen verfügen an ihrer Außenseite über eine einfache, Mitochondrien und der Zellkern über eine doppelte
Lipid-Doppellamelle. Mitochondrien verfügen dadurch über einen eigenen
Intermembranraum (zwischen äußerer und innerer Mitochondrienmembran),
wie auch der Zellkern (perinukleärer Spalt zwischen äußerer und innerer
Kernmembran). Alle mit einer Membran eingehüllten Strukturen der Zelle
werden als Zellorganellen eingestuft.Zytoplasma und Zytoskelett
 Zellkern
Zellkern  Ribosomen
Ribosomen  Endoplasmatisches Retikulum
Endoplasmatisches Retikulum  Vesikel
Vesikel  Golgi-Apparat
Golgi-Apparat  Mitochondrien
Mitochondrien  Lysosomen, Peroxisomen, Sekretionsgranula
Lysosomen, Peroxisomen, Sekretionsgranula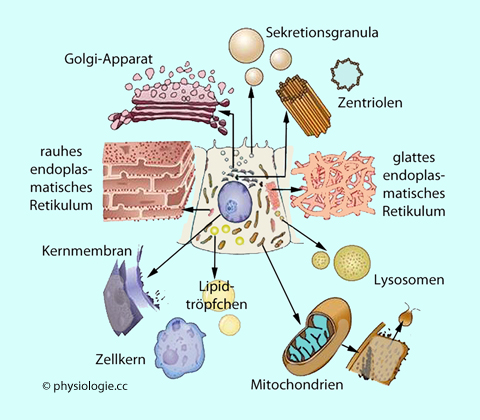
 Abbildung: Zellorganellen
Abbildung: ZellorganellenUltramikroskopisch darstellbare, räumlich strukturierte Funktionsträger der Zelle mit hoher molekularer Dynamik

Das Zellplasma enthält in seinem Zytosol verschiedenste gelöste Stoffe, Zellorganellen sowie das Zytoskelett.
Dieses besteht aus mehreren Arten von Filamenten, die alle aus
spezifischen Proteinmolekülen aufgebaut sind. Einzeln (monomer) sind
sie gut beweglich und leicht durch das Zytoplasma transportierbar.
Aktinfilamente
 Intermediärfilamente
Intermediärfilamente  Mikrotubuli
Mikrotubuli  Spektrine
Spektrine Dünne (Aktin-) Filamente
(microfilaments, doppelhelikal angeordnet, ~8 nm Durchmesser) sind flexibel, helikal aufgebaut, bilden netzartige
Strukturen (gerade Bündel, Netze oder Gele) und stabilisieren die
Zellmembran (stress fibers),
insbesondere direkt unter ihr ("Zellrinde"), sowie auch in Mikrovilli
(zusammen mit Begleitproteinen, wie Villin, Fimbrin, Myosin). Sie vermitteln
zelluläre Fortbewegung, befestigen membranständige Proteine, beteiligen
sich an der Ausbildung interzellulärer (fokaler Adhäsions-) Kontakte
und am Stofftransport in der Zelle sowie Kontraktionen (zusammen mit
Myosin: → Muskelkontraktion) und Verformungen. Stereozilien im Innenohr erlangen durch sie Festigkeit.
Dünne (Aktin-) Filamente
(microfilaments, doppelhelikal angeordnet, ~8 nm Durchmesser) sind flexibel, helikal aufgebaut, bilden netzartige
Strukturen (gerade Bündel, Netze oder Gele) und stabilisieren die
Zellmembran (stress fibers),
insbesondere direkt unter ihr ("Zellrinde"), sowie auch in Mikrovilli
(zusammen mit Begleitproteinen, wie Villin, Fimbrin, Myosin). Sie vermitteln
zelluläre Fortbewegung, befestigen membranständige Proteine, beteiligen
sich an der Ausbildung interzellulärer (fokaler Adhäsions-) Kontakte
und am Stofftransport in der Zelle sowie Kontraktionen (zusammen mit
Myosin: → Muskelkontraktion) und Verformungen. Stereozilien im Innenohr erlangen durch sie Festigkeit.
 Abbildung: Zytoskelett
Abbildung: ZytoskelettNach einer Vorlage bei Guyton and Hall, Textbook of Medical Physiology, 15th ed. Elsevier 2026
Mikrotubuli - lang, relativ umfangreich (Durchmesser 25 nm), innen hohl und aus dem Protein Tubulin aufgebaut - sind in der Zelle für räumliche Anordnung und intrazellulären Transport unverzichtbar. Sie sind an einem Ende am Zentrosom befestigt, das nahe dem Zellkern liegt und zwei rechtwinklig zueinander angeordnete Zentriolen enthält.
Intermediärfilamente (Durchmesser im ungedehnten Zustand 8-12 nm) sind dehnbare Strukturen, welche die Zelle durchspannen und Kräfte elastisch übertragen. Ihr Bauelement sind di- bzw. tetramere Proteine, die stark dehnbar sind. Sie dienen u.a. der Zelladhäsion (über Desmosomen) an Muskel- und Epithelzellen.
Mikrofilamente (Durchmesser 7 nm) sind Aktinfilamente, bestehen hauptsächlich aus Aktinmolekülen und interagieren mit zahlreichen anderen Proteinen (insbesondere Myosin) im Rahmen von Zellbewegung bzw. Kontraktion (Zytokinese, amöboide Bewegung, Muskelkontraktion)

Aktinfilamente (fibrilläres F-Aktin) setzen sich aus Aktinmolekülen (kugelförmiges G-Aktin: globular) zusammen. Wirbeltiere verfügen über drei Isoformen: α-Aktin findet sich in Muskelzellen, β- und γ-Aktin in anderen Zellen. Diese können - unter ATP-Verbrauch - rasch aus G-Aktin zu F-Aktin polymerisieren; das "Plus-Ende" wächst dabei rascher als das "Minus-Ende", das sich auch wieder verkürzen kann. So bilden sich funktionsabhängig verschiedene dynamische Strukturen in der Zelle, teils in paralleler Anordnung (dichte Filamentbündel in Filopodien - schmalen, länglichen Zellfortsätzen -, kontraktile Stressfasern) oder Netzwerke (gelartig in der aktinreichen Zellrinde, die Zellmembran und darunter liegendes Zytoplasma und Organellen voneinander trennt, oder dendritisch in Lamellipodien, blattförmigen Zellausstülpungen, die bei der Zellwanderung über Oberflächen auftreten).
Gesteuert werden diese Formationen durch bündelnde bzw. gelbildende Proteine. Bündelnde Proteine bestimmen auch den Abstand der Aktinfilamente zueinander und schließen sich gegenseitig aus (Fimbrin führt zu enger paralleler Anordnung der Aktinfilamente, während α-Aktinin die Filamente - mit gegensätzlicher Polarisierung - auf Abstand hält und die Einlagerung von Myosin ermöglicht, wodurch die Bündel kontraktil werden). Gelartige Netze aus Aktinfilamenten entstehen z.B. unter der Einwirkung des Proteins Filamin (z.B. in Lamellipodien, also flachen "Scheinfüßchen" der Zelle).
Für die Regulierung der Dynamik von Aktinfilamenten spielen mehrere Faktoren eine Rolle: Ihr Verhalten in der Zelle hängt ab von der Konzentration energiereicher Nukleotide (ATP / ADP), der Konzentration (Verfügbarkeit) monomerer Aktinmoleküle, der Konzentration von Elektrolyten, sowie der Anwesenheit aktinbindender Hilfsproteine: So bildet Formin einen "Kondensationskern" für die Entstehung neuer Filamente (und verbleibt am Plus-Ende); Thymosin behindert diesen Aufbau, während Profilin das Wachstum fördert (und mit Thymosin um Bindungsstellen konkurriert); kappenbildendes Protein bremst die Dynamik am Plus-Ende, Tropomodulin am Minus-Ende; Tropomyosin stabilisiert das Aktinfilament; usw.
Filamente können sowohl am Plus- als auch am Minus-Ende wachsen, und Hilfsproteine bestimmen ihre räumliche Anordnung, indem sie entweder seitlich binden (z.B. Tropomyosin an mehreren Aktinfilamenten gleichzeitig, was die Filamente versteift und die Bindung anderer Proteine behindert) oder an den Enden (was Wachstum bzw. Abbau der Filamente beeinflusst). Wieder andere Proteine regulieren die Depolymerisation der Filamente - wie die aktinspaltenden Gelsoline, die durch zytosolisches Ca++ aktiviert werden.
Der Abbau (die Depolymerisation) von Aktinfilamenten kann durch Phalloidin, ein Gift des grünen Knollenblätterpilzes, gehemmt werden (Phalloidin dringt allerdings nicht durch die Zellmembran; gefährlich ist der Pilz wegen eines anderen Giftes, nämlich des lebertoxischen Amanitins)
Im Sarkomer der quergestreiften Muskulatur stecken die Plus-Enden der Aktinfilamente im Z-Streifen (der aus CapZ- und α-Aktinin besteht und die Depolymerisation der Aktinfilamente verhindert), die zur Sarkomermitte gerichteten Minus-Enden tragen eine Kappe aus Tropomodulin. Weiters umhüllt ein riesiges Protein - Nebulin - spiralig das Aktinfilament und bestimmt dessen Länge (die im Sarkomer gleich bleibt).
Sogenannte dicke Filamente (ca. 10 nm Durchmesser) sind aus Myosin aufgebaut (von dem es verschiedene Varianten gibt) und - wie Aktinfilamente - in fast jeder Zelle vorhanden. Myosinmoleküle bestehen aus einem ATP-konsumierenden globulären Kopfteil, dessen Winkel zum gestreckten Körper (Schwanzteil) scharnierartig veränderbar ist (die Basis für Verformung, Bewegung und Kontraktion). Wie Dynein und Kinesin an Mikrotubuli, können Myosinmoleküle sich an Aktinfilamenten entlang bewegen. Diese Filamente enthalten etwa 300 Myosinköpfe, die ATP hydrolysieren und die gewonnene Energie dazu nutzen, sich an einem Aktinfilament in Richtung dessen Plus-Endes (mit jedem Bewegungszyklus - freigeben, verformen, anheften, Kraft erzeugen - um ca. 5 nm) fortzubewegen - vergleichbar mit einer Person, die sich an einem Seil entlang hantelt.
 Intermediärfilamente (intermediate filaments, 8-12 nm Durchmesser) bestehen aus unterschiedlichen fibrillären Molekülen aus derselben Genfamilie, sind sehr stabil (zugfest, "seilartig") und können relativ große mechanische
Kräfte übertragen bzw. Belastungen auffangen.
Intermediärfilamente (intermediate filaments, 8-12 nm Durchmesser) bestehen aus unterschiedlichen fibrillären Molekülen aus derselben Genfamilie, sind sehr stabil (zugfest, "seilartig") und können relativ große mechanische
Kräfte übertragen bzw. Belastungen auffangen.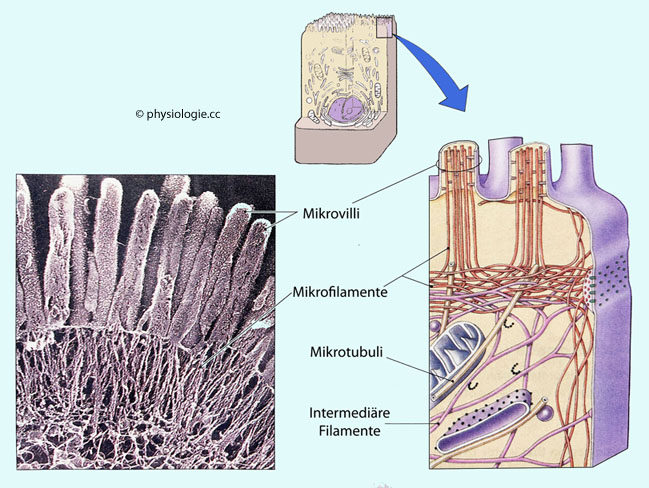
 Abbildung: Elemente des Zytoskeletts
Abbildung: Elemente des ZytoskelettsNach einer Vorlage bei Silverthorn, Human Physiology - an integrated approach, 4th ed. Pearson International 2007
Mikrofilamente
sind die schmälsten des Zytoskeletts (3-6 nm Durchmesser), sie sind
üblicherweise in der Längsachse der Zelle orientiert, können sich
aneinander vorbeibewegen und als "Muskeln" der Zelle fungieren (insbesondere in Muskelzellen).
Intermediärfilamente sind etwas dicker, sie sind als dreidimensionales Gerüstwerk in der Zelle ausgespannt.
Mikrotubuli sind Hohlzylinder und wirken als "Transportsystem" der Zelle (Vesikel, Mitochondrien u.a. werden von A nach B gebracht), sie können die Zelle auch insgesamt in ihrer Umgebung beweglich machen.
Die Anordnung der Filamente - die ständigem Auf-, Um- und Abbau unterliegen - passt sich den jeweils bestehenden Anforderungen an Stütz- und Transportfunktionen der Zelle dynamisch an
Intermediärfilamente sind etwas dicker, sie sind als dreidimensionales Gerüstwerk in der Zelle ausgespannt.
Mikrotubuli sind Hohlzylinder und wirken als "Transportsystem" der Zelle (Vesikel, Mitochondrien u.a. werden von A nach B gebracht), sie können die Zelle auch insgesamt in ihrer Umgebung beweglich machen.
Die Anordnung der Filamente - die ständigem Auf-, Um- und Abbau unterliegen - passt sich den jeweils bestehenden Anforderungen an Stütz- und Transportfunktionen der Zelle dynamisch an

Intermediärfilamente treten gewebespezifisch auf - als Keratin- (Epithelzellen), Vimentin- (Fibroblasten, Endothel, Leukozyten, Muskelzellen, Gliazellen) oder Neurofilamente (Neuronen, vor allem im Axon), nukleäre Lamine (sie umhüllen den Zellkern innerhalb der Kernmembran als "Schutzkäfig" für die DNA, an ihnen ist chromosomale DNA befestigt) oder saures Gliafaserprotein (glial fibrillary acidic protein), das exquisit nur in Gliazellen vorkommt.
Intermediärfilamente bestehen aus insgesamt 32 spiralig strukturierten Monomeren, die sich zu Tetrameren zusammenlagern (die Tetramere gruppieren sich dann zum fertigen Filament), sind also seilähnlich aufgebaut. Sie können bis zum Dreifachen ihrer Ruhelänge gedehnt werden, bevor sie reißen - das verleiht der Zelle hohe mechanische Festigkeit (Beispiel Keratine). Mit ihrer Umgebung sind sie über Linkerproteine am übrigen Zytoskelett verankert - bausteinartige, große Eiweißmoleküle, die als Plakine bezeichnet werden (Plektin, Desmoplakin und viele mehr).
 Mikrotubuli
(microtubules) sind lange, steife Hohlzylinder (Abbildungen - mehrere µm lang, ~25 nm Durchmesser, aufgebaut aus Protofilamenten - aufgebaut aus α- und β-Tubulin mit 5 nm Durchmesser), sie stützen die
Zelle ebenfalls und transportieren intrazellulär Moleküle
und Zellorganellen. Sie binden GTP (Guanosintriphosphat, ein energiereiches Nukleotid) und können (wie
Aktinfilamente) bedarfsabhängig schnell auf- und abgebaut werden.
Mikrotubuli
(microtubules) sind lange, steife Hohlzylinder (Abbildungen - mehrere µm lang, ~25 nm Durchmesser, aufgebaut aus Protofilamenten - aufgebaut aus α- und β-Tubulin mit 5 nm Durchmesser), sie stützen die
Zelle ebenfalls und transportieren intrazellulär Moleküle
und Zellorganellen. Sie binden GTP (Guanosintriphosphat, ein energiereiches Nukleotid) und können (wie
Aktinfilamente) bedarfsabhängig schnell auf- und abgebaut werden. 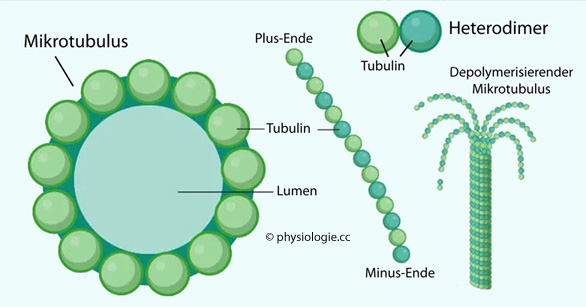
 Abbildung: Mikrotubuli
Abbildung: MikrotubuliNach Banya S: Microtubules: Definition, structure, composition, functions. The Biology Notes 2023
Eines ihrer Enden ist oft an einem Zentrosom (in dem ein Zentriolenpaar eingeschlossen ist - dieses organisiert eine perizentrioläre Matrix, an der Polymerisationsursprünge für Mikrotubuli liegen - Spindelpolkörper, s. Mitose) oder Basalkörper fixiert (MTOC: Microtubule organizing center), an dem sie zu wachsen beginnen und durch laufenden Auf- und Abbau ihre zelluläre Umgebung "erforschen". Das MTOC dient sozusagen als Mittelpunkt der Zelle (bei polaren Zellen kann es auch exzentrisch liegen), die nach allen Richtungen ausstrahlenden Mikrotubuli bilden eine Art Koordinatensystem für die Positionierung von Zellorganellen.
Mikrotubuli sind dynamisch instabil: Trägt ihr Endstück eine "Kappe" aus GTP, neigt es zum Polymerisieren, d.h. es kann wachsen; trägt das Ende GDP (Guanosindiphosphat), depolymerisiert es um einen Faktor 102 rascher und neigt zum Schrumpfen. Auf diese Weise können Mikrotubuli bedarfsabhängig zwischen Phasen raschen Abbaus und langsamen Wachstums oszillieren. Proteine, die Mikrotubuli binden (MAPs: Microtubule-associated proteins), können das Verhalten von Mikrotubuli steuern, indem sie diese stabilisieren oder ihre Beziehung zu anderen zellulären Elementen beeinflussen.
 Über Mikrotubuli, Dynamik und GTP / GDP sowie den Mechanismus des Zilienschlags in Flimmerepithelien s. auch dort
Über Mikrotubuli, Dynamik und GTP / GDP sowie den Mechanismus des Zilienschlags in Flimmerepithelien s. auch dortMikrotubuli bilden u.a. den Spindelapparat der Zellteilung (hier werden sie von Zentrosomen aus gebildet) und kommen in Zilien (z.B. des Flimmerepithels in der Lunge, im Ependym des Gehirns, im Eileiter - extrazelluläre Transportfunktion) vor. Sie sind polarisiert, d.h. sie haben ein "Plus"- (peripher) und ein "Minus"- (zentral) Ende; ihr Wachstum (aus Tubulin-Hetero-Dimeren) erfolgt am Plus-Ende. Sie tragen wesentlich zu Zellform und Zellpolarität bei.
 Spektrine
(spectrins)
sind Proteinkomplexe der Zellmembran. Zusammen
mit anderen Proteinen (wie z.B. Ankyrin oder Protein 4.1) bilden sie fünf-
oder sechseckig angeordnete Maschenwerke, welche die Zelle "aufspannen"
und stabilisieren. Im menschlichen Körper findet man sie in
Erythrozyten (wenn diese aufbrechen - Hämolyse -, entstehen "Blutschatten" - englisch spectre oder "Gespenster" -, die Spektrine enthalten, daher ihr Name) und auch in anderen Zellen (z.B. als Dystrophin in der Membran von Muskelzellen, das der Kraftübertagung zwischen kontraktilem Apparat und der Umgebung der Zelle dient).
Spektrine
(spectrins)
sind Proteinkomplexe der Zellmembran. Zusammen
mit anderen Proteinen (wie z.B. Ankyrin oder Protein 4.1) bilden sie fünf-
oder sechseckig angeordnete Maschenwerke, welche die Zelle "aufspannen"
und stabilisieren. Im menschlichen Körper findet man sie in
Erythrozyten (wenn diese aufbrechen - Hämolyse -, entstehen "Blutschatten" - englisch spectre oder "Gespenster" -, die Spektrine enthalten, daher ihr Name) und auch in anderen Zellen (z.B. als Dystrophin in der Membran von Muskelzellen, das der Kraftübertagung zwischen kontraktilem Apparat und der Umgebung der Zelle dient). Die Leitstrukturen des Zytoskeletts werden von Dutzenden verschiedener Motorproteine genutzt, um an ihnen entlang zu gleiten und Transportfunktionen zu übernehmen. Dabei unterscheiden sie sich in der Transportrichtung, der Art der Bindungspartner (Aktin, Tubulin) und ihrer Fracht - Moleküle, Vesikel, Mitochondrien u.a. (
 s. auch dort).
Dabei können sich auch Verformungen oder Bewegungen der Zelle auslösen.
Zwei Hauptklassen von Motorproteinen sind auf Mikrotubuli unterwegs:
Kinesine und (die besonders raschen) Dyneine (
s. auch dort).
Dabei können sich auch Verformungen oder Bewegungen der Zelle auslösen.
Zwei Hauptklassen von Motorproteinen sind auf Mikrotubuli unterwegs:
Kinesine und (die besonders raschen) Dyneine ( s. dort).
Viele Kinesine beteiligen sich nicht nur an der allgemeinen
Organisation des Zytoskeletts, sondern auch an der Bildung der
Mitosespindel.
s. dort).
Viele Kinesine beteiligen sich nicht nur an der allgemeinen
Organisation des Zytoskeletts, sondern auch an der Bildung der
Mitosespindel. Die
Komponenten des Zytoskeletts - Aktin- und Intermediärfilamente,
Mikrotubuli, Myosin und zahlreiche Hilfsproteine - müssen in
koordinierter Weise zusammenwirken, um Struktur, Form und Bewegung von
Zellen zu ermöglichen.
Die
Komponenten des Zytoskeletts - Aktin- und Intermediärfilamente,
Mikrotubuli, Myosin und zahlreiche Hilfsproteine - müssen in
koordinierter Weise zusammenwirken, um Struktur, Form und Bewegung von
Zellen zu ermöglichen. Kernplasma (Karyoplasma, nucleoplasm, Äquivalent zum Zytosol),
Kernplasma (Karyoplasma, nucleoplasm, Äquivalent zum Zytosol), darin eingelagerten Strukturen, wie Nucleolus, kondensiertem Chromatin, Kernkörperchen u.a.,
darin eingelagerten Strukturen, wie Nucleolus, kondensiertem Chromatin, Kernkörperchen u.a.,  der Kernmembran (Kernhülle, nuclear envelope),
einem Membransystem, das einerseits den Kern vom Zytoplasma separiert,
als zweifache Doppellamelle andererseits - via Kernporen in der
Kernhülle - direkte Zugänge zwischen perinukleärem Spaltraum und
endoplasmatischem Retikulum ermöglicht.
der Kernmembran (Kernhülle, nuclear envelope),
einem Membransystem, das einerseits den Kern vom Zytoplasma separiert,
als zweifache Doppellamelle andererseits - via Kernporen in der
Kernhülle - direkte Zugänge zwischen perinukleärem Spaltraum und
endoplasmatischem Retikulum ermöglicht.
Die Kernmembran ist aus zwei Lipid-Doppelschichten aufgebaut: Die Außenmembran ist eine Fortsetzung des rauhen endoplasmatischen Retikulums (sie enthält Ribosomen), die Innenmembran ist "glatt" und kernseitig von einer fibrillären (aus Laminen aufgebauten) Proteinhaut überzogen (s. dort). Die Kernmembran hat runde Öffnungen (Kernporen,
 Abbildung),
die eine (teils regulierte) Passage von Stoffen zwischen Karyo- und
Zytoplasma erlaubt. Die Innen- und Außenmembran gehen an den Kernporen
ineinander über, behalten aber ihre Identität - außer während
einer Mitose.
Abbildung),
die eine (teils regulierte) Passage von Stoffen zwischen Karyo- und
Zytoplasma erlaubt. Die Innen- und Außenmembran gehen an den Kernporen
ineinander über, behalten aber ihre Identität - außer während
einer Mitose.
 Abbildung: Kernpore
Abbildung: KernporeNach Lin DH, Hoelz A: Infographic: The Nuclear Pore Complex. The Scientist, December 2016
Kernporen haben einen Außendurchmesser von 100-120 nm, der Innenkanal hat kaum mehr als 5 nm Durchmesser (ein mRNS-Strang ist ≤1 nm dick) und eine Tiefe von ~45 nm. Sie lassen kleinere Moleküle passieren (Diffusion) und befördern Proteine und Nukleinsäuren; dabei helfen Rezeptoren, Importine beim Eintritt in den und Exportine beim Austritt aus dem Zellkern

Kernporen (nuclear pores, ca. 2.104 pro Zellkern) sind Kanäle, die das Karyoplasma mit dem Zytoplasma verbinden. Sie sind Teil eines Kernporenkomplexes (NPC, nuclear pore complex), der (je NPC) aus mehr als 450 einzelnen Proteinen (vor allem sogenannten Nukleoporinen) besteht, etwa 0,1
µm Außendurchmesser hat und einige hundert Proteine (mehr als 30
verschiedene Arten) enthält, die acht Untereinheiten bilden. Diese formen
einen Innenring und zwei Außenringe sowie Begleitstrukturen (Filamente
außen, Kernporenkörbchen innen). Die Permeabilität der NPC ist reguliert, die Poren können sich selektiv öffnen oder schließen.
Diese komplizierte Konstruktion ermöglicht strukturelle Stabilität, Stoffaustausch - kleine Moleküle durch Diffusion, größere durch selektiven Transport über Vermittlung nukleärer Lokalisationssequenzen (nuclear localization sequences, bestehend aus einigen Aminosäuren) - sowie Interaktion (Chromatin, Transkriptionsapparat). Durch Kernporen müssen z.B. Proteine, darunter zytoplasmatische Signalmoleküle, welche die Transkription beeinflussen wollen, in das Karyoplasma eintreten; umgekehrt verlassen hier z.B. RNS-Moleküle den Kern auf dem Weg zur Transkription.
Diese komplizierte Konstruktion ermöglicht strukturelle Stabilität, Stoffaustausch - kleine Moleküle durch Diffusion, größere durch selektiven Transport über Vermittlung nukleärer Lokalisationssequenzen (nuclear localization sequences, bestehend aus einigen Aminosäuren) - sowie Interaktion (Chromatin, Transkriptionsapparat). Durch Kernporen müssen z.B. Proteine, darunter zytoplasmatische Signalmoleküle, welche die Transkription beeinflussen wollen, in das Karyoplasma eintreten; umgekehrt verlassen hier z.B. RNS-Moleküle den Kern auf dem Weg zur Transkription.
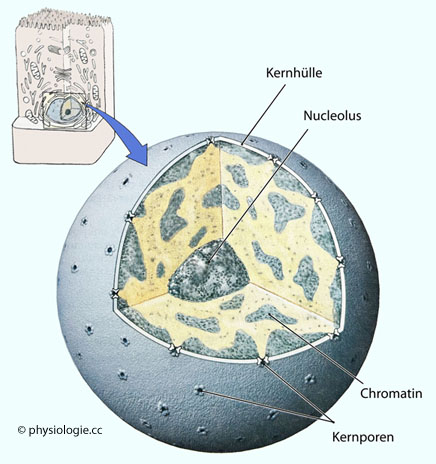
 Abbildung: Zellkern und Nucleolus
Abbildung: Zellkern und NucleolusNach einer Vorlage bei Silverthorn, Human Physiology - an integrated approach, 4th ed. 2007 (Pearson International)
Die Kernhülle besteht aus zwei Membranen (doppelten Lipidlamellen) und separiert den Zelklkern vom Zytoplasma.
Kernporen erlauben die freie Diffusion kleinerer Moleküle (bis 5 kDa) und den Transport von RNA aus dem sowie von Proteinen in den Zellkern.
Der Nucleolus besteht aus drei Komponenten: Dicht fibrillär (dense fibrillar component DFC), fibrilläres Zentrum (fibrillar center FC), granuläre Komponente (granular component GC). Im FC erfolgt die Transkription von ribosomaler DNA; die DFC bearbeitet frisch transkribierte ribosomale RNS und enthält ribosomales Protein; die GC ist am Aufbau der Ribosomen beteiligt.
 Zum Chromatin s. dort
Zum Chromatin s. dort
Kernporen erlauben die freie Diffusion kleinerer Moleküle (bis 5 kDa) und den Transport von RNA aus dem sowie von Proteinen in den Zellkern.
Der Nucleolus besteht aus drei Komponenten: Dicht fibrillär (dense fibrillar component DFC), fibrilläres Zentrum (fibrillar center FC), granuläre Komponente (granular component GC). Im FC erfolgt die Transkription von ribosomaler DNA; die DFC bearbeitet frisch transkribierte ribosomale RNS und enthält ribosomales Protein; die GC ist am Aufbau der Ribosomen beteiligt.
 Zum Chromatin s. dort
Zum Chromatin s. dort
Die vor allem aus Nukleinsäuren und Proteinen bestehenden Nucleoli
( Abbildung) produzieren Ribosomen; ribosomale Proteine und RNS
(18S, 28S, 5S-r u.a.) werden via Kernporen aus dem Zytosol zu den
Nucleoli gebracht, hier entstehen kleine (40S) und große (60S)
Ribosomen-Untereinheiten.
Diese gelangen anschließend in das
Zytoplasma, kondensieren zu 80S-Ribosomen und produzieren Eiweiße.
Abbildung) produzieren Ribosomen; ribosomale Proteine und RNS
(18S, 28S, 5S-r u.a.) werden via Kernporen aus dem Zytosol zu den
Nucleoli gebracht, hier entstehen kleine (40S) und große (60S)
Ribosomen-Untereinheiten.
Diese gelangen anschließend in das
Zytoplasma, kondensieren zu 80S-Ribosomen und produzieren Eiweiße.
 Abbildung) produzieren Ribosomen; ribosomale Proteine und RNS
(18S, 28S, 5S-r u.a.) werden via Kernporen aus dem Zytosol zu den
Nucleoli gebracht, hier entstehen kleine (40S) und große (60S)
Ribosomen-Untereinheiten.
Diese gelangen anschließend in das
Zytoplasma, kondensieren zu 80S-Ribosomen und produzieren Eiweiße.
Abbildung) produzieren Ribosomen; ribosomale Proteine und RNS
(18S, 28S, 5S-r u.a.) werden via Kernporen aus dem Zytosol zu den
Nucleoli gebracht, hier entstehen kleine (40S) und große (60S)
Ribosomen-Untereinheiten.
Diese gelangen anschließend in das
Zytoplasma, kondensieren zu 80S-Ribosomen und produzieren Eiweiße. Ribosomen (Durchmesser ~20 nm, typischerweise 105-107 pro eukaryotischer Zelle), an denen die Translation und damit die Synthese von Eiweißen abläuft (Geschwindigkeit: ≥2 Aminosäuren pro Sekunde). Jedes Ribosom besteht aus mehr als 50 verschiedenen ribosomalen Proteinen sowie mehreren ribosomalen RNS-Molekülen.
Ribosomen sind aus zwei Einheiten aufgebaut: 60S und 40S. Diese werden im Nukleolus aus rRNS (die hier entsteht) und Proteinen (aus dem Zytoplasma) zusammengesetzt und dann separat durch Poren der Kernmembran in das Zytoplasma exportiert. Bei Anwesenheit von mRNS setzen sich außerhalb des Zellkerns komplette (80S-)Ribosomen zusammen.
 Proteine, die im Zytosol verbleiben sollen, werden hier synthetisiert. Das Zytoplasma einer typischen Zelle enthält Millionen Ribosomen.
Proteine, die im Zytosol verbleiben sollen, werden hier synthetisiert. Das Zytoplasma einer typischen Zelle enthält Millionen Ribosomen. Proteine, die für Lysosomen, als Membranproteine
oder für den "Export" bestimmt sind, werden von Ribosomen des rauhen
endoplasmatischen Retikulums gebildet und gelangen zwecks "Reifung"
(Modifikation) zum Golgi-Apparat.
Proteine, die für Lysosomen, als Membranproteine
oder für den "Export" bestimmt sind, werden von Ribosomen des rauhen
endoplasmatischen Retikulums gebildet und gelangen zwecks "Reifung"
(Modifikation) zum Golgi-Apparat.
 Abbildung: Dynamik der Membran (1)
Abbildung: Dynamik der Membran (1)Modifiziert nach einer Vorlage bei Alberts et al, Molecular Biology of the Cell, Garland 2008
Die membranös umschlossenen Kompartimente kommunizieren miteinander und können z.T. ineinander übergehen.
Grün: endozytotische Wege, rot: sekretorische Wege, blau: Rücktransportwege

Vakuolärer Apparat
Der vakuloläre Apparat der Zelle umfasst verschiedene Strukturen, die von einer Doppellipidlamelle umgrenzt sind. Dazu gehören das endoplasmatische Retikulum, Vesikel, der Golgi-Apparat, Mitochondrien, Lysosomen, Peroxisomen. Gemeinsam ist ihnen, dass ihre innere Lipidlamelle mit der äußeren der Zellmembran korrespondiert (s. Endozytose, Exozytose,
 Abbildung) - topologisch entspricht ihr Lumen dem extrazellulären
Raum - und dementsprechend zusammengesetzt ist.
Abbildung) - topologisch entspricht ihr Lumen dem extrazellulären
Raum - und dementsprechend zusammengesetzt ist. Abbildung oben) und
fettlösliche Substanzen auf-, um- und abbaut. Man unterscheidet raues und glattes
EPR, die ineinander übergehen können:
Abbildung oben) und
fettlösliche Substanzen auf-, um- und abbaut. Man unterscheidet raues und glattes
EPR, die ineinander übergehen können: 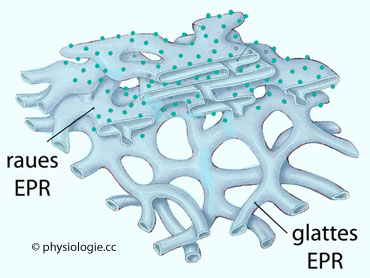
 Abbildung: Raues und glattes endoplasmatisches Retikulum
Abbildung: Raues und glattes endoplasmatisches RetikulumNach einer Vorlage in Silverthorn, Human Physiology - an integrated approach, 4th ed. 2007 (Pearson International)
Ribosomen liegen auf der zytosolischen Seite der EPR-Membran und sind hier als grüne Punkte dargestellt

Am rauen EPR (
 Abbildung) sind Ribosomen
angelagert (Proteinsynthese), das glatte EPR bildet vor allem
Membranmoleküle (Phospholipide, Cholesterin..) und Steroide (so sind
Zellen der Nebennierenrinde reich an glattem endoplasmatischen
Retikulum).
Abbildung) sind Ribosomen
angelagert (Proteinsynthese), das glatte EPR bildet vor allem
Membranmoleküle (Phospholipide, Cholesterin..) und Steroide (so sind
Zellen der Nebennierenrinde reich an glattem endoplasmatischen
Retikulum). Glattes endoplasmatisches Retikulum synthetisiert neues Membranmaterial, indem es Fettsäuren nutzt, um (an seiner zytoplasmatischen Seite) Phospholipide zu produzieren. Glattes endoplasmatisches Retikulum speichert weiters Calciumionen (z.B. in Muskelzellen), komplettiert die Gluconeogenese, vollführt Biotransformationsschritte (Leberzelle), bildet und glucuroniert Bilirubin (ebenfalls Leberzelle), kann Fettsäuren bilden u.a.
Das endoplasmatische Retikulum speichert Ca++-Ionen, die es mittels einer Calciumpumpe (SERCA: Sarcoplasmic / endoplasmic reticulum calcium ATPase - einer ATPase vom P-Typ) aus dem Zytoplasma (typische Konzentration ~10-7 molar) aufnimmt und so eine etwa zehntausendfache Anreicherung (auf ~10-3 M) ermöglicht. Der Ausstrom von Ca++-Ionen aus dem endoplasmatischen Retikulum erfolgt durch ligandenaktivierte Ca++-Kanäle - Ca++-sensitive Ca++-Kanäle (Ryanodinrezeptoren) oder IP3-Rezeptoren.
Ca++-Ionen spielen in der Zelle eine vielfache Rolle als Signalübeträger, z.B. im Rahmen der elektromechanischen Koppelung, als second messsenger, der Regulierung der Transkription (Genexpression), der Beeinflussung enzymatischer Aktivitäten usw.
Intrazelluläre Vesikel dienen der Speicherung (z.B. von präformiertem Transmitter an präsynaptischen Nervenendigungen), der Modifikation ihres Inhalts, oder dem Transport; ihre Wand besteht aus einer Lipid-Doppellamelle. Sie entstammen der Zellmembran (Endozytose) oder dem endoplasmatischen Retikulum (Abschnürung, anschließende Verschmelzung mit Zisternen des Golgi-Apparates, Modifikation des Inhalts - z.B. Glykosylierung von Proteinen; Sortierung, Verteilung auf bestimmte Kompartimente). Der Inhalt von Vesikeln kann an den Extrazellulärraum abgegeben werden (Exozytose).
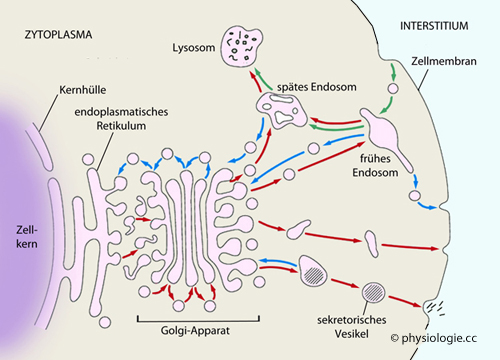
 Abbildung: Dynamik der Membran (2)
Abbildung: Dynamik der Membran (2)Modifiziert nach einer Vorlage bei Alberts et al, Molecular Biology of the Cell, Garland 2008
Grün: endozytotische Wege, rot: sekretorische Wege, blau:
Rücktransportwege. Die Pfeile deuten die Dynamik der
Membranbewegungen an

Kompartimentierung und Kinetik:
Der Transport von Inhaltsstoffen über Vesikel, die von einem
Membranraum abknospen ( Abbildung), ist ein Zeichen des Übergangs von einem
Kompartiment zu einem nächsten (z.B. vom endoplasmatischen Retikulum
zum Golgi-Apparat oder von letzterem zu sekretorischen Vesikeln und zum
Extrazellulärraum). Lösliche Proteine wechseln zum Inhalt des nächsten
Kompartiments, membranständige Proteine gehen den Weg der entsprechenden
Doppellamelle.
Abbildung), ist ein Zeichen des Übergangs von einem
Kompartiment zu einem nächsten (z.B. vom endoplasmatischen Retikulum
zum Golgi-Apparat oder von letzterem zu sekretorischen Vesikeln und zum
Extrazellulärraum). Lösliche Proteine wechseln zum Inhalt des nächsten
Kompartiments, membranständige Proteine gehen den Weg der entsprechenden
Doppellamelle.
Der Inhalt der Vesikelsysteme ist vom Zytoplasma isoliert, auch während der Wanderung der Vesikel findet kein Austausch mit dem Zytoplasma statt. Der Transport der Vesikel durch die Zelle wird durch das Zytoskelett bewerkstelligt. Sekretorische Vesikel können die Strecke vom rauhen endoplasmatischen Retikulum zur Zellmembran - wo Membranfusion und Exozytose des Inhalts erfolgen - in weniger als einer Stunde zurücklegen.
Die Membranen sind in ständigem Fluss und werden zum Teil recycelt; die Syntheserate ist niedriger als der Umsatz der Membranpartien zwischen den Kompartimenten (Zellmembran, Endozytosevesikel, endoplasmatisches Retikulum, Golgi-System, Sekretionsvesikel, Zellmembran). Spezifische Proteine, die für bestimmte Membransysteme typisch sind und ihre Funktion mitbestimmen, nehmen am interkompartimentellen Fluß der Membranlipide nicht teil, sondern bleiben ihrem Kompartiment (z.B. dem Golgi-Apparat) erhalten, was z.T. über "retrograde" Transportvesikel bewerkstelligt wird.
Posttranslationale Modifikation und Reifung: Einige der neu synthetisierten Proteine werden im rauhen endoplasmatischen Retikulum glykosyliert, Disulfidbrücken werden aufgebaut, eine tertiäre Struktur bildet sich aus. Im Golgi-Apparat erfolgt dann eine postsynthetische Reifung, wie durch Umbau von Zuckerketten, Sulfatierung und komplexe Glykosylierung. So entstehen z.B. sulfatierte Proteoglycane, wie sie in Schleim und extrazellulärer Matrix, aber auch an Zelloberflächen vorkommen.
Exozytose involviert die Fusion der Vesikel- mit der Zellmembran. Sie kann
 konstitutiv
sein - das ist der fortwährende Prozess der Verschmelzung von Vesikeln
aus dem Golgi-Apparat mit der Zellmembran, deren Lipide und Proteine
dadurch erneuert werden. Dieser unregulierte Mechanismus findet sich bei den meisten Zelltypen; oder
konstitutiv
sein - das ist der fortwährende Prozess der Verschmelzung von Vesikeln
aus dem Golgi-Apparat mit der Zellmembran, deren Lipide und Proteine
dadurch erneuert werden. Dieser unregulierte Mechanismus findet sich bei den meisten Zelltypen; oder
 reguliert
erfolgen - ein kontrollierter Vorgang in Zellen, die - vorgefertigte und zwischengespeicherte - Proteine (Hormone, Transmitter, Zytokine, Enzyme, Mucine) an ihre
Umgebung abgeben.
reguliert
erfolgen - ein kontrollierter Vorgang in Zellen, die - vorgefertigte und zwischengespeicherte - Proteine (Hormone, Transmitter, Zytokine, Enzyme, Mucine) an ihre
Umgebung abgeben.
Oft sind die Vesikel dabei von einem Proteinkörbchen (meist Clathrin) umgeben (vgl. Endozytose). Regulierte Sekretion wird über Signalstoffe wie Ca++ oder IP3 ausgelöst.
 Abbildung), ist ein Zeichen des Übergangs von einem
Kompartiment zu einem nächsten (z.B. vom endoplasmatischen Retikulum
zum Golgi-Apparat oder von letzterem zu sekretorischen Vesikeln und zum
Extrazellulärraum). Lösliche Proteine wechseln zum Inhalt des nächsten
Kompartiments, membranständige Proteine gehen den Weg der entsprechenden
Doppellamelle.
Abbildung), ist ein Zeichen des Übergangs von einem
Kompartiment zu einem nächsten (z.B. vom endoplasmatischen Retikulum
zum Golgi-Apparat oder von letzterem zu sekretorischen Vesikeln und zum
Extrazellulärraum). Lösliche Proteine wechseln zum Inhalt des nächsten
Kompartiments, membranständige Proteine gehen den Weg der entsprechenden
Doppellamelle.Der Inhalt der Vesikelsysteme ist vom Zytoplasma isoliert, auch während der Wanderung der Vesikel findet kein Austausch mit dem Zytoplasma statt. Der Transport der Vesikel durch die Zelle wird durch das Zytoskelett bewerkstelligt. Sekretorische Vesikel können die Strecke vom rauhen endoplasmatischen Retikulum zur Zellmembran - wo Membranfusion und Exozytose des Inhalts erfolgen - in weniger als einer Stunde zurücklegen.
Die Membranen sind in ständigem Fluss und werden zum Teil recycelt; die Syntheserate ist niedriger als der Umsatz der Membranpartien zwischen den Kompartimenten (Zellmembran, Endozytosevesikel, endoplasmatisches Retikulum, Golgi-System, Sekretionsvesikel, Zellmembran). Spezifische Proteine, die für bestimmte Membransysteme typisch sind und ihre Funktion mitbestimmen, nehmen am interkompartimentellen Fluß der Membranlipide nicht teil, sondern bleiben ihrem Kompartiment (z.B. dem Golgi-Apparat) erhalten, was z.T. über "retrograde" Transportvesikel bewerkstelligt wird.
Posttranslationale Modifikation und Reifung: Einige der neu synthetisierten Proteine werden im rauhen endoplasmatischen Retikulum glykosyliert, Disulfidbrücken werden aufgebaut, eine tertiäre Struktur bildet sich aus. Im Golgi-Apparat erfolgt dann eine postsynthetische Reifung, wie durch Umbau von Zuckerketten, Sulfatierung und komplexe Glykosylierung. So entstehen z.B. sulfatierte Proteoglycane, wie sie in Schleim und extrazellulärer Matrix, aber auch an Zelloberflächen vorkommen.
Exozytose involviert die Fusion der Vesikel- mit der Zellmembran. Sie kann
 konstitutiv
sein - das ist der fortwährende Prozess der Verschmelzung von Vesikeln
aus dem Golgi-Apparat mit der Zellmembran, deren Lipide und Proteine
dadurch erneuert werden. Dieser unregulierte Mechanismus findet sich bei den meisten Zelltypen; oder
konstitutiv
sein - das ist der fortwährende Prozess der Verschmelzung von Vesikeln
aus dem Golgi-Apparat mit der Zellmembran, deren Lipide und Proteine
dadurch erneuert werden. Dieser unregulierte Mechanismus findet sich bei den meisten Zelltypen; oder  reguliert
erfolgen - ein kontrollierter Vorgang in Zellen, die - vorgefertigte und zwischengespeicherte - Proteine (Hormone, Transmitter, Zytokine, Enzyme, Mucine) an ihre
Umgebung abgeben.
reguliert
erfolgen - ein kontrollierter Vorgang in Zellen, die - vorgefertigte und zwischengespeicherte - Proteine (Hormone, Transmitter, Zytokine, Enzyme, Mucine) an ihre
Umgebung abgeben. Oft sind die Vesikel dabei von einem Proteinkörbchen (meist Clathrin) umgeben (vgl. Endozytose). Regulierte Sekretion wird über Signalstoffe wie Ca++ oder IP3 ausgelöst.
Der Golgi-Apparat ist in ein kernnahes
"Cis-Golgi-Netzwerk", einen "Golgi-Stapel" und ein zellmembranseitiges
"Trans-Golgi-Netzwerk" organisiert ( Abbildung). Er verteilt und modifiziert Membran- und sekretorische Proteine auf verschiedene subzelluläre Destinationen und kann sie glykosylieren (die Galactosyl-Transferase gilt als Leitenzym des Golgi-Apparates), sulfatieren oder mit Lipidgruppen anreichern (posttranslationale Prozessierung).
Er produziert sekretorische Bläschen (für Sekretvesikel) und lysosomales Eiweiß. Wird mehr
Membranmaterial für den Golgi-Apparat benötigt, liefert das
endoplasmatische Retikulum dieses nach.
Abbildung). Er verteilt und modifiziert Membran- und sekretorische Proteine auf verschiedene subzelluläre Destinationen und kann sie glykosylieren (die Galactosyl-Transferase gilt als Leitenzym des Golgi-Apparates), sulfatieren oder mit Lipidgruppen anreichern (posttranslationale Prozessierung).
Er produziert sekretorische Bläschen (für Sekretvesikel) und lysosomales Eiweiß. Wird mehr
Membranmaterial für den Golgi-Apparat benötigt, liefert das
endoplasmatische Retikulum dieses nach.

 Abbildung: Golgi-Komplex
Abbildung: Golgi-Komplex
Nach einer Vorlage in Boron W, Boulpaep E: Medical Physiology, 3rd ed., Elsevier 2016
Aus dem rauhen endoplasmatischen Retikulum gelangen Proteine zur Modifikation und Sortierung in den Golgi-Apparat, der sie an Vesikelsysteme weitergibt.
In dieser Abbildung ist beispielhaft die Aufbereitung der Lysosomhydrolase gezeigt: Mit Mannose verknüpft kommt sie als Vorstufe aus dem endoplasmatischen Retikulum (1), wird im Cis-.Netzwerk phosphoryliert (2), im Trans-Netzwerk an einen Mannosephosphat-Rezeptor gebunden (3), mittels abgesprossener Transportvesikel zu Endosomen gebracht (4), wo eine Protonenpumpe den pH-Wert senkt (5) und das Enzym dephosphoryliert wird (6). Der Rezeptor wird recycelt (7,8)

Diese ellipsoiden Zellorganellen gelten als die Kraftwerke der Zelle, sie bilden ATP
(Adenosintriphosphat) durch aeroben Stoffwechsel. Sie verfügen über
zwei Membranen (für Zellorganellen unüblich, aber durch ihre
endosymbiotische Herkuft erklärbar -
sie entstammen sauerstoffkonsumierenden Archaebakterien, die von frühen
Zellen aufgenommen wurden und deren oxidative Kapazität nutzten), was zwei getrennte Kompartimente mit unterschiedlicher Funktion ergibt:

Abbildung: Mitochondrium
Nach einer Vorlage in Carlson NR / Birkett MA, Physiology of Behavior, 12th ed. Pearson 2017
Oben: Membranen und Kompartimente. Mitochondrien bestehen aus einer zentralen Matrix (sozusagen das Zellplasma der Mitochondrien), umgeben von der inneren Membran mit einer durch Einstülpungen (cristae) vergrößerten Oberfläche. Zwischen der inneren und der äußeren Membran (hier fängt das Zytoplasma an) liegt der Intermembranraum; hier werden Wasserstoffionen aus dem System der Elektronentransportkette konzentriert und treiben die ATPasen in der inneren Mitochondrienmembran an.
Unten: Funktionen. Mitochondrien vollführen den Citratzyklus, ß-Oxidation von Fettsäuren, Teile des Harnstoffzyklus und der Hämsynthese, und beinhalten Pyruvatdehydrogenase (diese produziert aus Aminosäuren Acetyl-Coenzym A für den Citratzyklus). Auch speichert die Matrix Calciumionen und enthält mitochondrielle DNA. Die innere Membran trägt die Komponenten der oxidativen Phosphorylierung. Der Intermembranraum ist reich an H+, enthält Nukleoside und Kreatinkinase

 Die äußere Mitochondrienmembran trennt das Mitochondriensystem vom Zytoplasma. Sie enthält Porine, transmembranale Proteine mit einem Kanal, der <5kDa-Moleküle
passieren lässt (z.B. Aminosäuren, kurzkettige Fettsäuren, Pyruvat) und
so den Austausch essentieller Moleküle (z.B. ATP) zwischen Zelle und
Mitochondrium erlaubt.
Die äußere Mitochondrienmembran trennt das Mitochondriensystem vom Zytoplasma. Sie enthält Porine, transmembranale Proteine mit einem Kanal, der <5kDa-Moleküle
passieren lässt (z.B. Aminosäuren, kurzkettige Fettsäuren, Pyruvat) und
so den Austausch essentieller Moleküle (z.B. ATP) zwischen Zelle und
Mitochondrium erlaubt.
 Der Intermembranraum liegt zwischen äußerer und innerer Membran. In diesen Raum gelangen Wasserstoffionen aus dem Mitochondrium - über die Elektronentransportkette des oxidativen Systems (oxidative Phorphorylierung). H+-Einstrom durch die ATP-Synthase in der inneren Mitochondrienmembran treibt die ATP-Synthese an.
Der Intermembranraum liegt zwischen äußerer und innerer Membran. In diesen Raum gelangen Wasserstoffionen aus dem Mitochondrium - über die Elektronentransportkette des oxidativen Systems (oxidative Phorphorylierung). H+-Einstrom durch die ATP-Synthase in der inneren Mitochondrienmembran treibt die ATP-Synthese an.
 Die innere Mitochondrienmembran
ist der Ort, an dem die Elektronen transportierenden Proteine des
energiebildenden Systems untergebracht ist (Komplexe I bis V der
"Atmungskette", respiratory chain).
Sie ist nur für wenige kleine Moleküle direkt durchgängig (Atemgase,
Wasser, Ammoniak), alles andere muss via spezifische
Transporterproteine zwischen Matrix und Intermembranraum ausgetauscht
werden.
Die innere Mitochondrienmembran
ist der Ort, an dem die Elektronen transportierenden Proteine des
energiebildenden Systems untergebracht ist (Komplexe I bis V der
"Atmungskette", respiratory chain).
Sie ist nur für wenige kleine Moleküle direkt durchgängig (Atemgase,
Wasser, Ammoniak), alles andere muss via spezifische
Transporterproteine zwischen Matrix und Intermembranraum ausgetauscht
werden.
 Die Mitochondrienmatrix
enthält zahlreiche Enzyme des
Citratzyklus, Fettsäuremetabolismus (ß-Oxidation), der Ketonkörpersynthese, des Harnstoffzyklus, der Hämsynthese. Die H+-Konzentration ist geringer (der pH-Wert höher) als im Intermembranraum, sodass H+ dazu tendiert, aus diesem durch die innere Membran in die Matrix zu diffundieren.
Das treibt ein Enzym (ATP-Synthase) an, das ADP phosphoryliert - das
Produkt ist der universelle Energieträger ATP, der durch die äußere
Mitochondrienmembran zum Zytoplasma der Zelle diffundiert und
verschiedenste Stoffwechselprozesse antreibt. Die Matrix dient außerdem
als Ca++-Speicher.
Die Mitochondrienmatrix
enthält zahlreiche Enzyme des
Citratzyklus, Fettsäuremetabolismus (ß-Oxidation), der Ketonkörpersynthese, des Harnstoffzyklus, der Hämsynthese. Die H+-Konzentration ist geringer (der pH-Wert höher) als im Intermembranraum, sodass H+ dazu tendiert, aus diesem durch die innere Membran in die Matrix zu diffundieren.
Das treibt ein Enzym (ATP-Synthase) an, das ADP phosphoryliert - das
Produkt ist der universelle Energieträger ATP, der durch die äußere
Mitochondrienmembran zum Zytoplasma der Zelle diffundiert und
verschiedenste Stoffwechselprozesse antreibt. Die Matrix dient außerdem
als Ca++-Speicher.
In der Mitochondrienmatrix findet sich auch mitochondriale DNA (mtDNA), die mit 16,6 kb (Kilobasen) auf einem einzigen zirkulären Molekül 37 Gene enthält (13 davon codieren Proteine, 24 RNA-Moleküle - 2 rRNA, 22 tRNA). Der genetische Code der Mitochondrien unterscheidet sich nur minimal von dem der Maschinerie im Zellkern (4 Codone werden anders interpretiert). Nur 13 der 80 Proteine, die für die oxidative Phosphorylierung in den Mitochondrien benötigt werden, codiert das mitochondrielle Genom - der Großteil der von den Mitochondrien benötigten Gene muss im Zellkern abgelesen werden.
Bei der Ablesung (von beiden DNA-Strängen) entstehen multigene Transkripte, die anschließend in einzelne mRNA zerteilt werden (mitochondriale DNA hat keine Introns). Die Transkription erfolgt mittels mitochondrialer Ribosomen unter Verwendung mitochondrialer tRNA.
mtDNA wird ausschließlich von Müttern (über befruchtete Eizellen) weitervererbt (die Mitochondrien der Samenzellen bleiben "außen vor").
Mitochondrien ( vgl. dort)
vgl. dort)
 nutzen
Sauerstoff zur Energiegewinnung (Atmungskette) - die meisten Gene für
die Synthese der dazu benötigten Proteine sitzen in der nukleären,
nicht der mitochondrialen DNA,
nutzen
Sauerstoff zur Energiegewinnung (Atmungskette) - die meisten Gene für
die Synthese der dazu benötigten Proteine sitzen in der nukleären,
nicht der mitochondrialen DNA,
 speichern Calciumionen (Ca++-Homöostase),
speichern Calciumionen (Ca++-Homöostase),
 vermitteln
spezielle Stoffwechselschritte (etwa 99% der mitochondrialen
Enzymausstattung sind von nukleärer DNA codiert - entsprechend ca. 1700
Genen) und
vermitteln
spezielle Stoffwechselschritte (etwa 99% der mitochondrialen
Enzymausstattung sind von nukleärer DNA codiert - entsprechend ca. 1700
Genen) und
 können programmierten Zelltod (Apoptose)
mitverursachen.
können programmierten Zelltod (Apoptose)
mitverursachen.
Die Anzahl pro Zelle (meist um die 103 pro Zelle, entsprechend ~1/5 des Zellvolumens) hängt von deren Funktion ab - Muskelzellen mit ihrem besonders hohen Energiedurchsatz (mechanische Arbeit) enthalten viele, Fettzellen (Speicherfunktion) wenig, Erythrozyten (hohe Verformbarkeit) überhaupt keine Mitochondrien.
Mitochondrien verfügen über eigene zirkuläre - mitochondriale - mtDNA (kodiert 13 mitochondriale Enzyme; der Bauplan der restlichen ~85% aller mitochondrial benötigten Enzyme ist im Zellkern kodiert) und eigene mt-Ribosomen (bestehend aus 70S- unsd 30S-Einheiten, typisch für Prokaryonten) für die Translation der mitochondriell kodierten Proteine.
Mitochondrien entstehen ständig neu, nach 10-20 Tagen Lebensdauer werden sie lysosomal abgebaut. Mitochondrien stammen ausschließlich von denjenigen der Mutter ab, da Mitochondrien der Spermien bei der Befruchtung nicht in die Eizelle eindringen.
 Lysosomen und Peroxisomen (microbodies;
jeweils mehrere hundert pro Zelle) bilden den "Magen der Zelle". Sie
bauen
zelleigene (Autophagie) oder endozytierte (Heterophagie), potentiell
giftige Substanzen ab - deren Komponenten können im Zytosol
wiederverwertet werden (andernfalls bleiben Residualkörper bestehen).
Lysosomen und Peroxisomen (microbodies;
jeweils mehrere hundert pro Zelle) bilden den "Magen der Zelle". Sie
bauen
zelleigene (Autophagie) oder endozytierte (Heterophagie), potentiell
giftige Substanzen ab - deren Komponenten können im Zytosol
wiederverwertet werden (andernfalls bleiben Residualkörper bestehen).
 Lysosomen
bauen gealterte Zellorganellen sowie Bakterien ab. Lysosomen sind Abspaltungen aus dem Golgi-Apparat und enthalten saure
Hydrolasen - Glykosidasen, Lipasen, Proteasen, Nukleasen, Phosphatasen
(Leitenzym saure Phosphatase), Sulfatasen, Lysozym. Protonenpumpen in
ihrer Membran stellen ein saures Milieu her (pH~5). Sie können
zelleigene Komponenten (wie denaturierte Proteine) oder auch
endozytierte Fremdstoffe abbauen, z.B. in
Granulozyten. Man kann sie als die "Müllverbrennungsanlage" der Zelle
sehen. Der Abbeu zelleigener Organellen (bzw. derer Komponenten) wird
als Autophagie bezeichnet (dabei wird auch Stoffwechselenergie gewonnen).
Lysosomen
bauen gealterte Zellorganellen sowie Bakterien ab. Lysosomen sind Abspaltungen aus dem Golgi-Apparat und enthalten saure
Hydrolasen - Glykosidasen, Lipasen, Proteasen, Nukleasen, Phosphatasen
(Leitenzym saure Phosphatase), Sulfatasen, Lysozym. Protonenpumpen in
ihrer Membran stellen ein saures Milieu her (pH~5). Sie können
zelleigene Komponenten (wie denaturierte Proteine) oder auch
endozytierte Fremdstoffe abbauen, z.B. in
Granulozyten. Man kann sie als die "Müllverbrennungsanlage" der Zelle
sehen. Der Abbeu zelleigener Organellen (bzw. derer Komponenten) wird
als Autophagie bezeichnet (dabei wird auch Stoffwechselenergie gewonnen).
 Peroxisomen können sich teilen (sie stammen nicht aus dem Golgi-Apparat). Sie entziehen Zielmolekülen - u.a. Fettsäuren -
Wasserstoffatome, indem sie diese oxidieren (daher der Name). Dazu
nützen sie Wasserstoffperoxid (H2O2), das durch Katalase (Leitenzym der Peroxisomen) wieder abgebaut wird. Die Notwendigkeit der Kompartimentierung (Abtrennung von Reaktionsräumen) ist angesichts der Aggressivität der peroxisomalen Reaktionen besonders evident. Hepatozyten und
Nierenepithelzellen sind reich an Peroxisomen (Entgiftungsfunktion).
Peroxisomen können sich teilen (sie stammen nicht aus dem Golgi-Apparat). Sie entziehen Zielmolekülen - u.a. Fettsäuren -
Wasserstoffatome, indem sie diese oxidieren (daher der Name). Dazu
nützen sie Wasserstoffperoxid (H2O2), das durch Katalase (Leitenzym der Peroxisomen) wieder abgebaut wird. Die Notwendigkeit der Kompartimentierung (Abtrennung von Reaktionsräumen) ist angesichts der Aggressivität der peroxisomalen Reaktionen besonders evident. Hepatozyten und
Nierenepithelzellen sind reich an Peroxisomen (Entgiftungsfunktion).
 Sekretionsgranula
finden sich in sekretorischen (z.B. endokrin aktiven) Zellen, wo
chemische Modifikationen ("Reifung") der zu sezernierenden Moleküle
stattfindet. Ihr Durchmesser beträgt <1 µm.
Sekretionsgranula
finden sich in sekretorischen (z.B. endokrin aktiven) Zellen, wo
chemische Modifikationen ("Reifung") der zu sezernierenden Moleküle
stattfindet. Ihr Durchmesser beträgt <1 µm.
Die Membranen der Zellorganellen haben eine große Oberfläche: So enthält 1 ml Lungengewebe eine intrazelluläre Membran-Gesamtfläche von 10 m2.
 Abbildung). Er verteilt und modifiziert Membran- und sekretorische Proteine auf verschiedene subzelluläre Destinationen und kann sie glykosylieren (die Galactosyl-Transferase gilt als Leitenzym des Golgi-Apparates), sulfatieren oder mit Lipidgruppen anreichern (posttranslationale Prozessierung).
Er produziert sekretorische Bläschen (für Sekretvesikel) und lysosomales Eiweiß. Wird mehr
Membranmaterial für den Golgi-Apparat benötigt, liefert das
endoplasmatische Retikulum dieses nach.
Abbildung). Er verteilt und modifiziert Membran- und sekretorische Proteine auf verschiedene subzelluläre Destinationen und kann sie glykosylieren (die Galactosyl-Transferase gilt als Leitenzym des Golgi-Apparates), sulfatieren oder mit Lipidgruppen anreichern (posttranslationale Prozessierung).
Er produziert sekretorische Bläschen (für Sekretvesikel) und lysosomales Eiweiß. Wird mehr
Membranmaterial für den Golgi-Apparat benötigt, liefert das
endoplasmatische Retikulum dieses nach.
 Abbildung: Golgi-Komplex
Abbildung: Golgi-KomplexNach einer Vorlage in Boron W, Boulpaep E: Medical Physiology, 3rd ed., Elsevier 2016
Aus dem rauhen endoplasmatischen Retikulum gelangen Proteine zur Modifikation und Sortierung in den Golgi-Apparat, der sie an Vesikelsysteme weitergibt.
In dieser Abbildung ist beispielhaft die Aufbereitung der Lysosomhydrolase gezeigt: Mit Mannose verknüpft kommt sie als Vorstufe aus dem endoplasmatischen Retikulum (1), wird im Cis-.Netzwerk phosphoryliert (2), im Trans-Netzwerk an einen Mannosephosphat-Rezeptor gebunden (3), mittels abgesprossener Transportvesikel zu Endosomen gebracht (4), wo eine Protonenpumpe den pH-Wert senkt (5) und das Enzym dephosphoryliert wird (6). Der Rezeptor wird recycelt (7,8)

Das Trans-Netzwerk übernimmt die
Sortierung und Weiterleitung verschiedener Eiweiße - auch je nachdem,
ob das Protein in der Membran verbleibt oder sezerniert werden soll.
Dabei bilden sich Gruppen (Cluster) von Vesikeln, die an bestimmte
Zielorganellen "versendet" werden sollen.
Dynamik und Umfang: Der Golgi-Apparat einer Leberzelle nimmt etwa 2% des gesamten Zellvolumens in Anspruch; eine Zelle kann über 200 Golgi-Felder enthalten, und nach ~20 Minuten ist ein Golgi-Apparat durch Neubildung vollständig ersetzt.
Dynamik und Umfang: Der Golgi-Apparat einer Leberzelle nimmt etwa 2% des gesamten Zellvolumens in Anspruch; eine Zelle kann über 200 Golgi-Felder enthalten, und nach ~20 Minuten ist ein Golgi-Apparat durch Neubildung vollständig ersetzt.

Abbildung: Mitochondrium
Nach einer Vorlage in Carlson NR / Birkett MA, Physiology of Behavior, 12th ed. Pearson 2017
Oben: Membranen und Kompartimente. Mitochondrien bestehen aus einer zentralen Matrix (sozusagen das Zellplasma der Mitochondrien), umgeben von der inneren Membran mit einer durch Einstülpungen (cristae) vergrößerten Oberfläche. Zwischen der inneren und der äußeren Membran (hier fängt das Zytoplasma an) liegt der Intermembranraum; hier werden Wasserstoffionen aus dem System der Elektronentransportkette konzentriert und treiben die ATPasen in der inneren Mitochondrienmembran an.
Unten: Funktionen. Mitochondrien vollführen den Citratzyklus, ß-Oxidation von Fettsäuren, Teile des Harnstoffzyklus und der Hämsynthese, und beinhalten Pyruvatdehydrogenase (diese produziert aus Aminosäuren Acetyl-Coenzym A für den Citratzyklus). Auch speichert die Matrix Calciumionen und enthält mitochondrielle DNA. Die innere Membran trägt die Komponenten der oxidativen Phosphorylierung. Der Intermembranraum ist reich an H+, enthält Nukleoside und Kreatinkinase

 Die äußere Mitochondrienmembran trennt das Mitochondriensystem vom Zytoplasma. Sie enthält Porine, transmembranale Proteine mit einem Kanal, der <5kDa-Moleküle
passieren lässt (z.B. Aminosäuren, kurzkettige Fettsäuren, Pyruvat) und
so den Austausch essentieller Moleküle (z.B. ATP) zwischen Zelle und
Mitochondrium erlaubt.
Die äußere Mitochondrienmembran trennt das Mitochondriensystem vom Zytoplasma. Sie enthält Porine, transmembranale Proteine mit einem Kanal, der <5kDa-Moleküle
passieren lässt (z.B. Aminosäuren, kurzkettige Fettsäuren, Pyruvat) und
so den Austausch essentieller Moleküle (z.B. ATP) zwischen Zelle und
Mitochondrium erlaubt.  Der Intermembranraum liegt zwischen äußerer und innerer Membran. In diesen Raum gelangen Wasserstoffionen aus dem Mitochondrium - über die Elektronentransportkette des oxidativen Systems (oxidative Phorphorylierung). H+-Einstrom durch die ATP-Synthase in der inneren Mitochondrienmembran treibt die ATP-Synthese an.
Der Intermembranraum liegt zwischen äußerer und innerer Membran. In diesen Raum gelangen Wasserstoffionen aus dem Mitochondrium - über die Elektronentransportkette des oxidativen Systems (oxidative Phorphorylierung). H+-Einstrom durch die ATP-Synthase in der inneren Mitochondrienmembran treibt die ATP-Synthese an. Die innere Mitochondrienmembran
ist der Ort, an dem die Elektronen transportierenden Proteine des
energiebildenden Systems untergebracht ist (Komplexe I bis V der
"Atmungskette", respiratory chain).
Sie ist nur für wenige kleine Moleküle direkt durchgängig (Atemgase,
Wasser, Ammoniak), alles andere muss via spezifische
Transporterproteine zwischen Matrix und Intermembranraum ausgetauscht
werden.
Die innere Mitochondrienmembran
ist der Ort, an dem die Elektronen transportierenden Proteine des
energiebildenden Systems untergebracht ist (Komplexe I bis V der
"Atmungskette", respiratory chain).
Sie ist nur für wenige kleine Moleküle direkt durchgängig (Atemgase,
Wasser, Ammoniak), alles andere muss via spezifische
Transporterproteine zwischen Matrix und Intermembranraum ausgetauscht
werden. Die Mitochondrienmatrix
enthält zahlreiche Enzyme des
Citratzyklus, Fettsäuremetabolismus (ß-Oxidation), der Ketonkörpersynthese, des Harnstoffzyklus, der Hämsynthese. Die H+-Konzentration ist geringer (der pH-Wert höher) als im Intermembranraum, sodass H+ dazu tendiert, aus diesem durch die innere Membran in die Matrix zu diffundieren.
Das treibt ein Enzym (ATP-Synthase) an, das ADP phosphoryliert - das
Produkt ist der universelle Energieträger ATP, der durch die äußere
Mitochondrienmembran zum Zytoplasma der Zelle diffundiert und
verschiedenste Stoffwechselprozesse antreibt. Die Matrix dient außerdem
als Ca++-Speicher.
Die Mitochondrienmatrix
enthält zahlreiche Enzyme des
Citratzyklus, Fettsäuremetabolismus (ß-Oxidation), der Ketonkörpersynthese, des Harnstoffzyklus, der Hämsynthese. Die H+-Konzentration ist geringer (der pH-Wert höher) als im Intermembranraum, sodass H+ dazu tendiert, aus diesem durch die innere Membran in die Matrix zu diffundieren.
Das treibt ein Enzym (ATP-Synthase) an, das ADP phosphoryliert - das
Produkt ist der universelle Energieträger ATP, der durch die äußere
Mitochondrienmembran zum Zytoplasma der Zelle diffundiert und
verschiedenste Stoffwechselprozesse antreibt. Die Matrix dient außerdem
als Ca++-Speicher.In der Mitochondrienmatrix findet sich auch mitochondriale DNA (mtDNA), die mit 16,6 kb (Kilobasen) auf einem einzigen zirkulären Molekül 37 Gene enthält (13 davon codieren Proteine, 24 RNA-Moleküle - 2 rRNA, 22 tRNA). Der genetische Code der Mitochondrien unterscheidet sich nur minimal von dem der Maschinerie im Zellkern (4 Codone werden anders interpretiert). Nur 13 der 80 Proteine, die für die oxidative Phosphorylierung in den Mitochondrien benötigt werden, codiert das mitochondrielle Genom - der Großteil der von den Mitochondrien benötigten Gene muss im Zellkern abgelesen werden.
Bei der Ablesung (von beiden DNA-Strängen) entstehen multigene Transkripte, die anschließend in einzelne mRNA zerteilt werden (mitochondriale DNA hat keine Introns). Die Transkription erfolgt mittels mitochondrialer Ribosomen unter Verwendung mitochondrialer tRNA.
mtDNA wird ausschließlich von Müttern (über befruchtete Eizellen) weitervererbt (die Mitochondrien der Samenzellen bleiben "außen vor").
Mitochondrien (
 vgl. dort)
vgl. dort) nutzen
Sauerstoff zur Energiegewinnung (Atmungskette) - die meisten Gene für
die Synthese der dazu benötigten Proteine sitzen in der nukleären,
nicht der mitochondrialen DNA,
nutzen
Sauerstoff zur Energiegewinnung (Atmungskette) - die meisten Gene für
die Synthese der dazu benötigten Proteine sitzen in der nukleären,
nicht der mitochondrialen DNA,  speichern Calciumionen (Ca++-Homöostase),
speichern Calciumionen (Ca++-Homöostase),  vermitteln
spezielle Stoffwechselschritte (etwa 99% der mitochondrialen
Enzymausstattung sind von nukleärer DNA codiert - entsprechend ca. 1700
Genen) und
vermitteln
spezielle Stoffwechselschritte (etwa 99% der mitochondrialen
Enzymausstattung sind von nukleärer DNA codiert - entsprechend ca. 1700
Genen) und  können programmierten Zelltod (Apoptose)
mitverursachen.
können programmierten Zelltod (Apoptose)
mitverursachen. Die Anzahl pro Zelle (meist um die 103 pro Zelle, entsprechend ~1/5 des Zellvolumens) hängt von deren Funktion ab - Muskelzellen mit ihrem besonders hohen Energiedurchsatz (mechanische Arbeit) enthalten viele, Fettzellen (Speicherfunktion) wenig, Erythrozyten (hohe Verformbarkeit) überhaupt keine Mitochondrien.
Mitochondrien verfügen über eigene zirkuläre - mitochondriale - mtDNA (kodiert 13 mitochondriale Enzyme; der Bauplan der restlichen ~85% aller mitochondrial benötigten Enzyme ist im Zellkern kodiert) und eigene mt-Ribosomen (bestehend aus 70S- unsd 30S-Einheiten, typisch für Prokaryonten) für die Translation der mitochondriell kodierten Proteine.
Mitochondrien entstehen ständig neu, nach 10-20 Tagen Lebensdauer werden sie lysosomal abgebaut. Mitochondrien stammen ausschließlich von denjenigen der Mutter ab, da Mitochondrien der Spermien bei der Befruchtung nicht in die Eizelle eindringen.
 Lysosomen und Peroxisomen (microbodies;
jeweils mehrere hundert pro Zelle) bilden den "Magen der Zelle". Sie
bauen
zelleigene (Autophagie) oder endozytierte (Heterophagie), potentiell
giftige Substanzen ab - deren Komponenten können im Zytosol
wiederverwertet werden (andernfalls bleiben Residualkörper bestehen).
Lysosomen und Peroxisomen (microbodies;
jeweils mehrere hundert pro Zelle) bilden den "Magen der Zelle". Sie
bauen
zelleigene (Autophagie) oder endozytierte (Heterophagie), potentiell
giftige Substanzen ab - deren Komponenten können im Zytosol
wiederverwertet werden (andernfalls bleiben Residualkörper bestehen).  Lysosomen
bauen gealterte Zellorganellen sowie Bakterien ab. Lysosomen sind Abspaltungen aus dem Golgi-Apparat und enthalten saure
Hydrolasen - Glykosidasen, Lipasen, Proteasen, Nukleasen, Phosphatasen
(Leitenzym saure Phosphatase), Sulfatasen, Lysozym. Protonenpumpen in
ihrer Membran stellen ein saures Milieu her (pH~5). Sie können
zelleigene Komponenten (wie denaturierte Proteine) oder auch
endozytierte Fremdstoffe abbauen, z.B. in
Granulozyten. Man kann sie als die "Müllverbrennungsanlage" der Zelle
sehen. Der Abbeu zelleigener Organellen (bzw. derer Komponenten) wird
als Autophagie bezeichnet (dabei wird auch Stoffwechselenergie gewonnen).
Lysosomen
bauen gealterte Zellorganellen sowie Bakterien ab. Lysosomen sind Abspaltungen aus dem Golgi-Apparat und enthalten saure
Hydrolasen - Glykosidasen, Lipasen, Proteasen, Nukleasen, Phosphatasen
(Leitenzym saure Phosphatase), Sulfatasen, Lysozym. Protonenpumpen in
ihrer Membran stellen ein saures Milieu her (pH~5). Sie können
zelleigene Komponenten (wie denaturierte Proteine) oder auch
endozytierte Fremdstoffe abbauen, z.B. in
Granulozyten. Man kann sie als die "Müllverbrennungsanlage" der Zelle
sehen. Der Abbeu zelleigener Organellen (bzw. derer Komponenten) wird
als Autophagie bezeichnet (dabei wird auch Stoffwechselenergie gewonnen). Peroxisomen können sich teilen (sie stammen nicht aus dem Golgi-Apparat). Sie entziehen Zielmolekülen - u.a. Fettsäuren -
Wasserstoffatome, indem sie diese oxidieren (daher der Name). Dazu
nützen sie Wasserstoffperoxid (H2O2), das durch Katalase (Leitenzym der Peroxisomen) wieder abgebaut wird. Die Notwendigkeit der Kompartimentierung (Abtrennung von Reaktionsräumen) ist angesichts der Aggressivität der peroxisomalen Reaktionen besonders evident. Hepatozyten und
Nierenepithelzellen sind reich an Peroxisomen (Entgiftungsfunktion).
Peroxisomen können sich teilen (sie stammen nicht aus dem Golgi-Apparat). Sie entziehen Zielmolekülen - u.a. Fettsäuren -
Wasserstoffatome, indem sie diese oxidieren (daher der Name). Dazu
nützen sie Wasserstoffperoxid (H2O2), das durch Katalase (Leitenzym der Peroxisomen) wieder abgebaut wird. Die Notwendigkeit der Kompartimentierung (Abtrennung von Reaktionsräumen) ist angesichts der Aggressivität der peroxisomalen Reaktionen besonders evident. Hepatozyten und
Nierenepithelzellen sind reich an Peroxisomen (Entgiftungsfunktion).  Sekretionsgranula
finden sich in sekretorischen (z.B. endokrin aktiven) Zellen, wo
chemische Modifikationen ("Reifung") der zu sezernierenden Moleküle
stattfindet. Ihr Durchmesser beträgt <1 µm.
Sekretionsgranula
finden sich in sekretorischen (z.B. endokrin aktiven) Zellen, wo
chemische Modifikationen ("Reifung") der zu sezernierenden Moleküle
stattfindet. Ihr Durchmesser beträgt <1 µm.Die Membranen der Zellorganellen haben eine große Oberfläche: So enthält 1 ml Lungengewebe eine intrazelluläre Membran-Gesamtfläche von 10 m2.
Apoptose: Die Zelle gibt sich auf
Im Körper des Menschen sterben jede Sekunde etwa 105 Zellen ab. Die meisten davon werden durch Neubildung ersetzt. Der Zelluntergang kann als Reaktion auf Beschädigung, Sauerstoff- oder Nährstoffmangel erfolgen; werden Zellen ungenügend versorgt, beschädigt (z.B. Hämolyse)
oder anderweitig verletzt, werden sie nekrotisch, schwellen
an, platzen, und der in die Umgebung gelangte Inhalt bewirkt eine Entzündung,
die Auswirkungen auf die lokale Durchblutung und allenfalls auf den
gesamten Körper hat.
Im Gegensatz dazu steht der durch spezifische Signale ausgelöste, geordnete, wohlkoordinierte programmierte Zelltod (PCD, programmed cell death), ausgelöst durch das Auftreten oder Ausbleiben spezifischer Faktoren. Dabei bestimmt das Gleichgewicht von Faktoren, die für "Überleben" oder "Tod" stehen, das Schicksal der Zelle; es tritt keine Entzündung auf (wie das bei einer Nekrose der Fall wäre).
Programmierter Zelltod dient der gezielten Entfernung unerwünschter, funktionsloser oder gefährlicher Zellen, mit anderen Worten der zellulären Qualitätskontrolle. Im Rahmen der ontogenetischen Entwicklung tauschen benachbarte Zellen ständig Signale aus, die einerseits das Überleben von Zellen fördern (survival factors), sie andererseits zu programmiertem Absterben veranlassen (death signals). Die Fähigkeit zu programmiertem Zelltod bleibt zeitlebens erhalten.
Man unterscheidet mehrere Formen des programmierten Zelltods - Apoptose, Autophagie u.a. Dabei können defekte Zellen entfernt werden (z.B. unreife Lymphozyten), gefährliche (virusinfizierte Zellen, autoaggressive T-Zellen, Zellen mit beschädigter DNA) oder unnötige / überflüssige Zellen abgetötet werden (während der Embryogenese, z.B. überzählige Neuronen oder interdigitale Zellen).
Apoptose (Typ I-PCD) ist
eine von mehreren Formen des programmierten Zelltodes. Sie betrifft
einzelne (nicht Gruppen von) Zellen, die im Laufe des Vorgangs - der
durch heftige Bewegungen charakterisiert ist (die Zelle "kocht") -
nicht anschwellen, sondern schrumpfen (das Chromatin im Zellkern
kondensiert dabei). Schließlich entstehen membranumhüllte Bruchstücke
der Zelle (apoptotic bodies), die von Phagozyten (z.T. makropinozytotisch) aufgenommen und abgebaut werden.
(Typ I-PCD) ist
eine von mehreren Formen des programmierten Zelltodes. Sie betrifft
einzelne (nicht Gruppen von) Zellen, die im Laufe des Vorgangs - der
durch heftige Bewegungen charakterisiert ist (die Zelle "kocht") -
nicht anschwellen, sondern schrumpfen (das Chromatin im Zellkern
kondensiert dabei). Schließlich entstehen membranumhüllte Bruchstücke
der Zelle (apoptotic bodies), die von Phagozyten (z.T. makropinozytotisch) aufgenommen und abgebaut werden.
 Apoptose ist
der Suizid einer Zelle, bewirkt durch einen genetisch
programmierten Mechanismus der geordneten Zerstörung und gekennzeichnet
durch eine spezifische Abfolge biochemischer Vorgänge. Sie erlaubt das
Aussortieren redundanter Zellen (embryogenetische Organausformung,
Abschilferung von Epithelzellen, Entsorgung ausgedienter Leukozyten) -
etwa 1010 Zellen pro Tag.
Apoptose ist
der Suizid einer Zelle, bewirkt durch einen genetisch
programmierten Mechanismus der geordneten Zerstörung und gekennzeichnet
durch eine spezifische Abfolge biochemischer Vorgänge. Sie erlaubt das
Aussortieren redundanter Zellen (embryogenetische Organausformung,
Abschilferung von Epithelzellen, Entsorgung ausgedienter Leukozyten) -
etwa 1010 Zellen pro Tag.

 Abbildung: Apoptose
Abbildung: Apoptose
Modifiziert nach einer Vorlage in Kumar / Abbas / Fausto: Robbins and Cotran Pathologic Basis of Disease, 7th ed. Saunders 2004
 Zellen brauchen für ihre Funktionalität die Anwesenheit nicht nur von
Nährstoffen, Elektrolyten, Sauerstoff etc, sondern auch die Anregung durch gewebespezifische trophische Faktoren, Zytokine, Hormone oder interzelluläre Kontakte (Integrine, Adhäsionsmoleküle). Diese
wirken jeweils nur in definierten Mustern auf eine bestimmte Zellart,
sie sind nicht austauschbar. Bringt man eine Zelle aus ihrer
physiologischen Umgebung, trifft sie auf andere (oder kein) Muster
anregender Stoffe und stellt ihre Funktionen ein, sie stirbt.
Zellen brauchen für ihre Funktionalität die Anwesenheit nicht nur von
Nährstoffen, Elektrolyten, Sauerstoff etc, sondern auch die Anregung durch gewebespezifische trophische Faktoren, Zytokine, Hormone oder interzelluläre Kontakte (Integrine, Adhäsionsmoleküle). Diese
wirken jeweils nur in definierten Mustern auf eine bestimmte Zellart,
sie sind nicht austauschbar. Bringt man eine Zelle aus ihrer
physiologischen Umgebung, trifft sie auf andere (oder kein) Muster
anregender Stoffe und stellt ihre Funktionen ein, sie stirbt.
"Überlebensfaktoren" wirken über Rezeptoren in der Zellmembran und aktivieren kontinuierlich antiapoptotische Substanzen in der Zelle. Apoptose erfolgt automatisch (als default response), wenn solche stimulierende Faktoren aus der Umwelt der Zelle ausbleiben (death by neglect).
Neben der Abwesenheit von Überlebensfaktoren ist die Aktivierung sogenannter Todesrezeptoren eine zweite Möglichkeit für die Auslösung einer Apoptose. Dabei handelt es sich meist um Mitglieder der TNF-Rezeptorfamilie (TNFR, tumor necrosis factor receptors), auch als Fas-Rezeptoren bezeichnet (nach "FS-7-associated surface antigen" - auch CD95). Der entsprechende Bindungspartner des Rezeptors heißt dann Fas-Ligand ( Abbildung unten). Daneben gibt es zahlreiche weitere "Todesrezeptoren", z.B. PD-1 (nach "programmed cell death"), ein Immuncheckpoint-Rezeptor, der auf T-Lymphozyten aktiviert werden kann.
Abbildung unten). Daneben gibt es zahlreiche weitere "Todesrezeptoren", z.B. PD-1 (nach "programmed cell death"), ein Immuncheckpoint-Rezeptor, der auf T-Lymphozyten aktiviert werden kann.
Apoptosemarker: Zellen, die in die Apoptose eintreten, schichten einige Membranbestandteile um (durch ein Enzym namens Scramblase, ein Mitglied der Flippase-Lipidtransporter-Proteinfamilie) und lassen so ihre Bereitschaft für programmierten Zelltod erkennen. Dafür gibt es eine Reihe unterschiedlicher Rezeptoren, über die Phagozyten apoptotische Zellen erkennen. Einige Beispiele:
 Phosphatidylserin (PS) - ein physiologischer Bestandteil von Zellmembranen (~15% der Phospholipide in Zellen des Gehirns) - liegt fast nur in der (zytoplasmatischen) Innenlamelle der Membran gesunder Zellen vor. Apoptotische Zellen zeigen es vermehrt (>10%) auch in ihrer Außenlamelle, was
von Phagozyten und anderen Zellen (dendritischen Zellen, Fibroblasten,
Epithelzellen) über Phosphatidylserinrezeptoren erkannt wird und den Abbau der apoptotischen Zelle fördert. Gleichzeitig produzieren die betreffenden Phagozyten entzündungshemmende Mediatoren (insbesondere TGFß), was die Freisetzung proinflammatorischer Chemokine und Zytokine hemmt (die Apoptose braucht keine Entzündung).
Phosphatidylserin (PS) - ein physiologischer Bestandteil von Zellmembranen (~15% der Phospholipide in Zellen des Gehirns) - liegt fast nur in der (zytoplasmatischen) Innenlamelle der Membran gesunder Zellen vor. Apoptotische Zellen zeigen es vermehrt (>10%) auch in ihrer Außenlamelle, was
von Phagozyten und anderen Zellen (dendritischen Zellen, Fibroblasten,
Epithelzellen) über Phosphatidylserinrezeptoren erkannt wird und den Abbau der apoptotischen Zelle fördert. Gleichzeitig produzieren die betreffenden Phagozyten entzündungshemmende Mediatoren (insbesondere TGFß), was die Freisetzung proinflammatorischer Chemokine und Zytokine hemmt (die Apoptose braucht keine Entzündung).
 Zahlreiche weitere Rezeptoren erkennen eine Apoptose, wie Scavenger-Rezeptoren und T-Zell-Rezeptoren sowie verschiedene lösliche Substanzen (z.B. der Komplementfaktor C1q). Diese beteiligen sich auf verschiedenen Wegen an der Erkennung eines 'eat-me'-Signals.
Zahlreiche weitere Rezeptoren erkennen eine Apoptose, wie Scavenger-Rezeptoren und T-Zell-Rezeptoren sowie verschiedene lösliche Substanzen (z.B. der Komplementfaktor C1q). Diese beteiligen sich auf verschiedenen Wegen an der Erkennung eines 'eat-me'-Signals.
Das Entfernen abgestorbener Zellen wird als Efferocytose bezeichnet, dabei werden die Zellen phagozytiert, bevor ihre Membranen für toxische Inhaltsstoffe durchlässig werden und diese in die Umgebung freigeben.
Apoptose eliminiert unerwünschte Zellen,
 wenn diese nicht mehr benötigt werden (z.B. im Rahmen ontogenetischer
Entwicklungsschritte; im Rahmen der Gehirnentwicklung sterben ~50%
der ursprünglich angelegten Zellen apoptotisch ab);
wenn diese nicht mehr benötigt werden (z.B. im Rahmen ontogenetischer
Entwicklungsschritte; im Rahmen der Gehirnentwicklung sterben ~50%
der ursprünglich angelegten Zellen apoptotisch ab);
 wenn Zellen am Ende ihrer physiologischen Lebensspanne stehen (Erneuerung z.B. von
Blutkörperchen, Gewebsregeneration z.B. in Epithelien);
wenn Zellen am Ende ihrer physiologischen Lebensspanne stehen (Erneuerung z.B. von
Blutkörperchen, Gewebsregeneration z.B. in Epithelien);
 bei Zelldefekten
(z.B. nach allzu fehlerhafter mitotischer DNA-Replikation).
bei Zelldefekten
(z.B. nach allzu fehlerhafter mitotischer DNA-Replikation).
Ablauf und Faktoren: Bei zunächst intakter Zellmembran und intakten Zellorganellen kommt es zu Abrundung der Zelle, Schrumpfung des Zytoplasmas, Kondensierung des Kernmaterials, das Zytoskelett verliert seine Struktur, die Kernhülle löst sich auf, das Chromatin zerbricht und die DNA wird durch Endonukleasen abgebaut, und es entstehen von Zellmembran umhüllte Fragmente (apoptotische Körperchen). Nachbargewebe bleibt unbeschädigt.
Die Schlüsselenzyme, welche Apoptose der Zelle durchführen, sind spezielle Proteasen, die normalerweise in inaktiver Form (als Procaspasen) vorliegen und - wenn durch Schlüsselreize "scharf gemacht" - mit Cystein in ihrem aktiven Zentrum Zielproteine am C-Ende von Aspartatresten aufschneiden: Man hat sie daher Caspasen genannt . Caspasen spalten sehr spezifisch Zielproteine (Strukturelelemente, Enzyme) an definierten Aminosäuresequenzen - einige Proteine werden dadurch inaktiviert, andere aktiviert. Dabei laufen Sequenzen über mehrere (etwa 9) Caspasen ab - einige lösen die Apoptose aus, andere leiten ihre Endphase ein.
Procaspasen kommen in der Zelle als natürliche Bestandteile vor. Sie verfügen über eine N-terminale Prodomäne, deren Abspaltung sie aktiviert. Man teilt sie in zwei Hauptklassen ein, Initiator- und Effektor-Procaspasen ( Abbildung unten):
Abbildung unten):
 Initiator-Procaspasen
(z.B. Caspase 8, 9) finden sich im Zytoplasma in monomerer Form, in der
sie inaktiv sind (einmal aktiviert, können sie sich selbst weiter
aktivieren - Autoaktivierung). Taucht ein apoptotisches Signal
auf - entweder von außen ("Todesrezeptoren") oder von innen
(mitochondrial) ausgelöst -, lagern diese sich über Wirkung von
Adapterproteinen zu Komplexen zusammen, die (durch gegenseitige
enzymatische Wirkung) zu aktiver Caspase werden und Effektor-Procaspase
aktivieren.
Initiator-Procaspasen
(z.B. Caspase 8, 9) finden sich im Zytoplasma in monomerer Form, in der
sie inaktiv sind (einmal aktiviert, können sie sich selbst weiter
aktivieren - Autoaktivierung). Taucht ein apoptotisches Signal
auf - entweder von außen ("Todesrezeptoren") oder von innen
(mitochondrial) ausgelöst -, lagern diese sich über Wirkung von
Adapterproteinen zu Komplexen zusammen, die (durch gegenseitige
enzymatische Wirkung) zu aktiver Caspase werden und Effektor-Procaspase
aktivieren.
 Effektor-Procaspasen
(z.B. Caspase 3, 6, 7) liegen normalerweise in dimerer Form vor, die inaktiv
ist. Die Aktivierung erfolgt durch "gezündete" Initiator-Caspasen. Als
Ziele kommen über 103 verschiedene zelluläre Proteine in
Frage - u.a. interzelluläre Adhäsionseiweiße (Ablösung vom
Zellverband), Bestandteile des Zytoskeletts (Formverlust) oder der Hülle des Zellkerns (Abbau nukleärer Lamine, das sind Intermediärfilamente der Kernmembran). Auch zytoplasmatische DNase wird durch Effektorcaspasen aktiviert (durch Spaltung eines Inhibitor-Proteins).
Effektor-Procaspasen
(z.B. Caspase 3, 6, 7) liegen normalerweise in dimerer Form vor, die inaktiv
ist. Die Aktivierung erfolgt durch "gezündete" Initiator-Caspasen. Als
Ziele kommen über 103 verschiedene zelluläre Proteine in
Frage - u.a. interzelluläre Adhäsionseiweiße (Ablösung vom
Zellverband), Bestandteile des Zytoskeletts (Formverlust) oder der Hülle des Zellkerns (Abbau nukleärer Lamine, das sind Intermediärfilamente der Kernmembran). Auch zytoplasmatische DNase wird durch Effektorcaspasen aktiviert (durch Spaltung eines Inhibitor-Proteins).
 Caspasen
sind intrazelluläre Proteasen, deren aktives Zentrum Cystein enthält
und die am C-Terminus ihrer Zielproteine an Aspartat schneiden. Die
meisten sind Bestandteile enzymatischer Kaskaden, an deren Ende die
Apoptose der Zelle steht.
Caspasen
sind intrazelluläre Proteasen, deren aktives Zentrum Cystein enthält
und die am C-Terminus ihrer Zielproteine an Aspartat schneiden. Die
meisten sind Bestandteile enzymatischer Kaskaden, an deren Ende die
Apoptose der Zelle steht.
Im Gegensatz dazu steht der durch spezifische Signale ausgelöste, geordnete, wohlkoordinierte programmierte Zelltod (PCD, programmed cell death), ausgelöst durch das Auftreten oder Ausbleiben spezifischer Faktoren. Dabei bestimmt das Gleichgewicht von Faktoren, die für "Überleben" oder "Tod" stehen, das Schicksal der Zelle; es tritt keine Entzündung auf (wie das bei einer Nekrose der Fall wäre).
Programmierter Zelltod dient der gezielten Entfernung unerwünschter, funktionsloser oder gefährlicher Zellen, mit anderen Worten der zellulären Qualitätskontrolle. Im Rahmen der ontogenetischen Entwicklung tauschen benachbarte Zellen ständig Signale aus, die einerseits das Überleben von Zellen fördern (survival factors), sie andererseits zu programmiertem Absterben veranlassen (death signals). Die Fähigkeit zu programmiertem Zelltod bleibt zeitlebens erhalten.
Man unterscheidet mehrere Formen des programmierten Zelltods - Apoptose, Autophagie u.a. Dabei können defekte Zellen entfernt werden (z.B. unreife Lymphozyten), gefährliche (virusinfizierte Zellen, autoaggressive T-Zellen, Zellen mit beschädigter DNA) oder unnötige / überflüssige Zellen abgetötet werden (während der Embryogenese, z.B. überzählige Neuronen oder interdigitale Zellen).
Apoptose
 (Typ I-PCD) ist
eine von mehreren Formen des programmierten Zelltodes. Sie betrifft
einzelne (nicht Gruppen von) Zellen, die im Laufe des Vorgangs - der
durch heftige Bewegungen charakterisiert ist (die Zelle "kocht") -
nicht anschwellen, sondern schrumpfen (das Chromatin im Zellkern
kondensiert dabei). Schließlich entstehen membranumhüllte Bruchstücke
der Zelle (apoptotic bodies), die von Phagozyten (z.T. makropinozytotisch) aufgenommen und abgebaut werden.
(Typ I-PCD) ist
eine von mehreren Formen des programmierten Zelltodes. Sie betrifft
einzelne (nicht Gruppen von) Zellen, die im Laufe des Vorgangs - der
durch heftige Bewegungen charakterisiert ist (die Zelle "kocht") -
nicht anschwellen, sondern schrumpfen (das Chromatin im Zellkern
kondensiert dabei). Schließlich entstehen membranumhüllte Bruchstücke
der Zelle (apoptotic bodies), die von Phagozyten (z.T. makropinozytotisch) aufgenommen und abgebaut werden. Apoptose ist
der Suizid einer Zelle, bewirkt durch einen genetisch
programmierten Mechanismus der geordneten Zerstörung und gekennzeichnet
durch eine spezifische Abfolge biochemischer Vorgänge. Sie erlaubt das
Aussortieren redundanter Zellen (embryogenetische Organausformung,
Abschilferung von Epithelzellen, Entsorgung ausgedienter Leukozyten) -
etwa 1010 Zellen pro Tag.
Apoptose ist
der Suizid einer Zelle, bewirkt durch einen genetisch
programmierten Mechanismus der geordneten Zerstörung und gekennzeichnet
durch eine spezifische Abfolge biochemischer Vorgänge. Sie erlaubt das
Aussortieren redundanter Zellen (embryogenetische Organausformung,
Abschilferung von Epithelzellen, Entsorgung ausgedienter Leukozyten) -
etwa 1010 Zellen pro Tag.
 Abbildung: Apoptose
Abbildung: ApoptoseModifiziert nach einer Vorlage in Kumar / Abbas / Fausto: Robbins and Cotran Pathologic Basis of Disease, 7th ed. Saunders 2004
Links intrinsischer Weg (mitochondrial), rechts extrinsischer (Todesrezeptor- mediierter) Mechanismus.
Caspasen werden aktiviert, die Zelle spaltet sich in Komponenten auf, Ausbuchtungen (blobs) werden zu Apoptosekörperchen und diese von Makrophagen oder anderen Nachbarzellen erkannt und phagozytiert.
Die Effektorproteine Bax und Bak öffnen mitochondielle spannungsabhängige Anionenkanäle (VDAC, voltage-dependent anion channels), was zu Freisetzung von Cytochrom c führt - sind Mitglieder der Bcl2-Proteinfamilie und als solche Regulatoren der Apoptose
Caspasen werden aktiviert, die Zelle spaltet sich in Komponenten auf, Ausbuchtungen (blobs) werden zu Apoptosekörperchen und diese von Makrophagen oder anderen Nachbarzellen erkannt und phagozytiert.
Die Effektorproteine Bax und Bak öffnen mitochondielle spannungsabhängige Anionenkanäle (VDAC, voltage-dependent anion channels), was zu Freisetzung von Cytochrom c führt - sind Mitglieder der Bcl2-Proteinfamilie und als solche Regulatoren der Apoptose
 Zellen brauchen für ihre Funktionalität die Anwesenheit nicht nur von
Nährstoffen, Elektrolyten, Sauerstoff etc, sondern auch die Anregung durch gewebespezifische trophische Faktoren, Zytokine, Hormone oder interzelluläre Kontakte (Integrine, Adhäsionsmoleküle). Diese
wirken jeweils nur in definierten Mustern auf eine bestimmte Zellart,
sie sind nicht austauschbar. Bringt man eine Zelle aus ihrer
physiologischen Umgebung, trifft sie auf andere (oder kein) Muster
anregender Stoffe und stellt ihre Funktionen ein, sie stirbt.
Zellen brauchen für ihre Funktionalität die Anwesenheit nicht nur von
Nährstoffen, Elektrolyten, Sauerstoff etc, sondern auch die Anregung durch gewebespezifische trophische Faktoren, Zytokine, Hormone oder interzelluläre Kontakte (Integrine, Adhäsionsmoleküle). Diese
wirken jeweils nur in definierten Mustern auf eine bestimmte Zellart,
sie sind nicht austauschbar. Bringt man eine Zelle aus ihrer
physiologischen Umgebung, trifft sie auf andere (oder kein) Muster
anregender Stoffe und stellt ihre Funktionen ein, sie stirbt."Überlebensfaktoren" wirken über Rezeptoren in der Zellmembran und aktivieren kontinuierlich antiapoptotische Substanzen in der Zelle. Apoptose erfolgt automatisch (als default response), wenn solche stimulierende Faktoren aus der Umwelt der Zelle ausbleiben (death by neglect).
Neben der Abwesenheit von Überlebensfaktoren ist die Aktivierung sogenannter Todesrezeptoren eine zweite Möglichkeit für die Auslösung einer Apoptose. Dabei handelt es sich meist um Mitglieder der TNF-Rezeptorfamilie (TNFR, tumor necrosis factor receptors), auch als Fas-Rezeptoren bezeichnet (nach "FS-7-associated surface antigen" - auch CD95). Der entsprechende Bindungspartner des Rezeptors heißt dann Fas-Ligand (
 Abbildung unten). Daneben gibt es zahlreiche weitere "Todesrezeptoren", z.B. PD-1 (nach "programmed cell death"), ein Immuncheckpoint-Rezeptor, der auf T-Lymphozyten aktiviert werden kann.
Abbildung unten). Daneben gibt es zahlreiche weitere "Todesrezeptoren", z.B. PD-1 (nach "programmed cell death"), ein Immuncheckpoint-Rezeptor, der auf T-Lymphozyten aktiviert werden kann.Apoptosemarker: Zellen, die in die Apoptose eintreten, schichten einige Membranbestandteile um (durch ein Enzym namens Scramblase, ein Mitglied der Flippase-Lipidtransporter-Proteinfamilie) und lassen so ihre Bereitschaft für programmierten Zelltod erkennen. Dafür gibt es eine Reihe unterschiedlicher Rezeptoren, über die Phagozyten apoptotische Zellen erkennen. Einige Beispiele:
 Phosphatidylserin (PS) - ein physiologischer Bestandteil von Zellmembranen (~15% der Phospholipide in Zellen des Gehirns) - liegt fast nur in der (zytoplasmatischen) Innenlamelle der Membran gesunder Zellen vor. Apoptotische Zellen zeigen es vermehrt (>10%) auch in ihrer Außenlamelle, was
von Phagozyten und anderen Zellen (dendritischen Zellen, Fibroblasten,
Epithelzellen) über Phosphatidylserinrezeptoren erkannt wird und den Abbau der apoptotischen Zelle fördert. Gleichzeitig produzieren die betreffenden Phagozyten entzündungshemmende Mediatoren (insbesondere TGFß), was die Freisetzung proinflammatorischer Chemokine und Zytokine hemmt (die Apoptose braucht keine Entzündung).
Phosphatidylserin (PS) - ein physiologischer Bestandteil von Zellmembranen (~15% der Phospholipide in Zellen des Gehirns) - liegt fast nur in der (zytoplasmatischen) Innenlamelle der Membran gesunder Zellen vor. Apoptotische Zellen zeigen es vermehrt (>10%) auch in ihrer Außenlamelle, was
von Phagozyten und anderen Zellen (dendritischen Zellen, Fibroblasten,
Epithelzellen) über Phosphatidylserinrezeptoren erkannt wird und den Abbau der apoptotischen Zelle fördert. Gleichzeitig produzieren die betreffenden Phagozyten entzündungshemmende Mediatoren (insbesondere TGFß), was die Freisetzung proinflammatorischer Chemokine und Zytokine hemmt (die Apoptose braucht keine Entzündung). Zahlreiche weitere Rezeptoren erkennen eine Apoptose, wie Scavenger-Rezeptoren und T-Zell-Rezeptoren sowie verschiedene lösliche Substanzen (z.B. der Komplementfaktor C1q). Diese beteiligen sich auf verschiedenen Wegen an der Erkennung eines 'eat-me'-Signals.
Zahlreiche weitere Rezeptoren erkennen eine Apoptose, wie Scavenger-Rezeptoren und T-Zell-Rezeptoren sowie verschiedene lösliche Substanzen (z.B. der Komplementfaktor C1q). Diese beteiligen sich auf verschiedenen Wegen an der Erkennung eines 'eat-me'-Signals.Das Entfernen abgestorbener Zellen wird als Efferocytose bezeichnet, dabei werden die Zellen phagozytiert, bevor ihre Membranen für toxische Inhaltsstoffe durchlässig werden und diese in die Umgebung freigeben.
Apoptose eliminiert unerwünschte Zellen,
 wenn diese nicht mehr benötigt werden (z.B. im Rahmen ontogenetischer
Entwicklungsschritte; im Rahmen der Gehirnentwicklung sterben ~50%
der ursprünglich angelegten Zellen apoptotisch ab);
wenn diese nicht mehr benötigt werden (z.B. im Rahmen ontogenetischer
Entwicklungsschritte; im Rahmen der Gehirnentwicklung sterben ~50%
der ursprünglich angelegten Zellen apoptotisch ab); wenn Zellen am Ende ihrer physiologischen Lebensspanne stehen (Erneuerung z.B. von
Blutkörperchen, Gewebsregeneration z.B. in Epithelien);
wenn Zellen am Ende ihrer physiologischen Lebensspanne stehen (Erneuerung z.B. von
Blutkörperchen, Gewebsregeneration z.B. in Epithelien); bei Zelldefekten
(z.B. nach allzu fehlerhafter mitotischer DNA-Replikation).
bei Zelldefekten
(z.B. nach allzu fehlerhafter mitotischer DNA-Replikation).Ablauf und Faktoren: Bei zunächst intakter Zellmembran und intakten Zellorganellen kommt es zu Abrundung der Zelle, Schrumpfung des Zytoplasmas, Kondensierung des Kernmaterials, das Zytoskelett verliert seine Struktur, die Kernhülle löst sich auf, das Chromatin zerbricht und die DNA wird durch Endonukleasen abgebaut, und es entstehen von Zellmembran umhüllte Fragmente (apoptotische Körperchen). Nachbargewebe bleibt unbeschädigt.
Die Schlüsselenzyme, welche Apoptose der Zelle durchführen, sind spezielle Proteasen, die normalerweise in inaktiver Form (als Procaspasen) vorliegen und - wenn durch Schlüsselreize "scharf gemacht" - mit Cystein in ihrem aktiven Zentrum Zielproteine am C-Ende von Aspartatresten aufschneiden: Man hat sie daher Caspasen genannt . Caspasen spalten sehr spezifisch Zielproteine (Strukturelelemente, Enzyme) an definierten Aminosäuresequenzen - einige Proteine werden dadurch inaktiviert, andere aktiviert. Dabei laufen Sequenzen über mehrere (etwa 9) Caspasen ab - einige lösen die Apoptose aus, andere leiten ihre Endphase ein.
Procaspasen kommen in der Zelle als natürliche Bestandteile vor. Sie verfügen über eine N-terminale Prodomäne, deren Abspaltung sie aktiviert. Man teilt sie in zwei Hauptklassen ein, Initiator- und Effektor-Procaspasen (
 Abbildung unten):
Abbildung unten): Initiator-Procaspasen
(z.B. Caspase 8, 9) finden sich im Zytoplasma in monomerer Form, in der
sie inaktiv sind (einmal aktiviert, können sie sich selbst weiter
aktivieren - Autoaktivierung). Taucht ein apoptotisches Signal
auf - entweder von außen ("Todesrezeptoren") oder von innen
(mitochondrial) ausgelöst -, lagern diese sich über Wirkung von
Adapterproteinen zu Komplexen zusammen, die (durch gegenseitige
enzymatische Wirkung) zu aktiver Caspase werden und Effektor-Procaspase
aktivieren.
Initiator-Procaspasen
(z.B. Caspase 8, 9) finden sich im Zytoplasma in monomerer Form, in der
sie inaktiv sind (einmal aktiviert, können sie sich selbst weiter
aktivieren - Autoaktivierung). Taucht ein apoptotisches Signal
auf - entweder von außen ("Todesrezeptoren") oder von innen
(mitochondrial) ausgelöst -, lagern diese sich über Wirkung von
Adapterproteinen zu Komplexen zusammen, die (durch gegenseitige
enzymatische Wirkung) zu aktiver Caspase werden und Effektor-Procaspase
aktivieren. Effektor-Procaspasen
(z.B. Caspase 3, 6, 7) liegen normalerweise in dimerer Form vor, die inaktiv
ist. Die Aktivierung erfolgt durch "gezündete" Initiator-Caspasen. Als
Ziele kommen über 103 verschiedene zelluläre Proteine in
Frage - u.a. interzelluläre Adhäsionseiweiße (Ablösung vom
Zellverband), Bestandteile des Zytoskeletts (Formverlust) oder der Hülle des Zellkerns (Abbau nukleärer Lamine, das sind Intermediärfilamente der Kernmembran). Auch zytoplasmatische DNase wird durch Effektorcaspasen aktiviert (durch Spaltung eines Inhibitor-Proteins).
Effektor-Procaspasen
(z.B. Caspase 3, 6, 7) liegen normalerweise in dimerer Form vor, die inaktiv
ist. Die Aktivierung erfolgt durch "gezündete" Initiator-Caspasen. Als
Ziele kommen über 103 verschiedene zelluläre Proteine in
Frage - u.a. interzelluläre Adhäsionseiweiße (Ablösung vom
Zellverband), Bestandteile des Zytoskeletts (Formverlust) oder der Hülle des Zellkerns (Abbau nukleärer Lamine, das sind Intermediärfilamente der Kernmembran). Auch zytoplasmatische DNase wird durch Effektorcaspasen aktiviert (durch Spaltung eines Inhibitor-Proteins). Caspasen
sind intrazelluläre Proteasen, deren aktives Zentrum Cystein enthält
und die am C-Terminus ihrer Zielproteine an Aspartat schneiden. Die
meisten sind Bestandteile enzymatischer Kaskaden, an deren Ende die
Apoptose der Zelle steht.
Caspasen
sind intrazelluläre Proteasen, deren aktives Zentrum Cystein enthält
und die am C-Terminus ihrer Zielproteine an Aspartat schneiden. Die
meisten sind Bestandteile enzymatischer Kaskaden, an deren Ende die
Apoptose der Zelle steht.
 Abbildung: Wege der Apoptose
Abbildung: Wege der ApoptoseNach einer Vorlage in Strachan / Read, Human Molecular Genetics, 5th ed. 2020 (CRC Press)
Der extrinsische Weg der Apoptose involviert die Aktivierung eines "Todesrezeptors" (Fas) an der Zelloberfläche durch einen Liganden auf einer benachbarten Zelle (links oben angedeutet). Dabei wird der normalerweise in monomerer Form vorliegende Fas-Rezeptor trimerisiert (durch den trimeren Liganden). Clustering des Fas-Rezeptors rekrutiert ein FADD-Adapterprotein (Fas-associated death domain protein). FADD dient als "Schablone" zur Rekrutierung und Autoaktivierung von Procaspase 8.
Der intrinsische Weg der Apoptose wird durch Belastung / Beschädigung zellulärer Organe (z.B. Hypoxie, Chemikalien, ionisierende Strahlung) über Komponenten von Mitochondrien oder des endoplasmatischen Retikulums aktiviert. So entstehen in der äußeren Mitochondrienmembran aus proapoptotischen Faktoren wie Bax-Oligomeren (BAX: Bcl-1 associated X protein) Poren, durch welche Cytochrom c in das Zytoplasma entweicht und Apaf1 (apoptotic protease-activating factor 1) aktiviert. Cytochrom c löst die Formierung eines Apoptosoms aus, das Procaspase und schließlich die selben Effektorcaspasen aktiviert (Caspase 3, 6, 7) wie der extrinsische Weg

 Von außen ausgelöste (extrinsische, rezeptormediierte) Apoptose (Todesrezeptor- Signalweg): Bestimmte Liganden können den Zell-Suizid von außen triggern, z.B.
Von außen ausgelöste (extrinsische, rezeptormediierte) Apoptose (Todesrezeptor- Signalweg): Bestimmte Liganden können den Zell-Suizid von außen triggern, z.B. Zytokine wie TNF (zahlreiche "Todesrezeptoren" gehören zur TNF-Superfamilie - z.B. Fas, s.
Zytokine wie TNF (zahlreiche "Todesrezeptoren" gehören zur TNF-Superfamilie - z.B. Fas, s.  Abbildung)
Abbildung) Retinsäure,
Retinsäure,  Glucocorticoide
u.a.
Glucocorticoide
u.a. Solche Liganden binden an die extrazelluläre Domäne von Todesrezeptoren, die intrazellulär eine Todesdomäne (death domain) haben, welche das Apoptoseprogramm starten können. Diese Rezeptoren gehören zur TNF-Rezeptorfamilie, zu der auch der Todesrezeptor Fas
 (CD95) gehört. Letzterer wird durch Fas-Liganden auf zytotoxischen T-Zellen aktiviert.
(CD95) gehört. Letzterer wird durch Fas-Liganden auf zytotoxischen T-Zellen aktiviert.  Fas (CD95) ist ein "Todesrezeptor". Er vermittelt u.a. die Apoptose von Lymphozyten im Rahmen der Selbsttoleranz. Der Fas-Ligand (CD95-Ligand) wird von zytotoxischen (CD8+) Lymphozyten exprimiert, er bindet an Fas und führt zur Apoptose der Fas-tragenden Zelle.
Fas (CD95) ist ein "Todesrezeptor". Er vermittelt u.a. die Apoptose von Lymphozyten im Rahmen der Selbsttoleranz. Der Fas-Ligand (CD95-Ligand) wird von zytotoxischen (CD8+) Lymphozyten exprimiert, er bindet an Fas und führt zur Apoptose der Fas-tragenden Zelle.Mutationen des FAS-Gens führen zu systemischen Autoimmunerkrankungen.
Bindet der Fas-Ligand an den Fas-Rezeptor anderer Zellen, führt dies zu deren Apoptose, was für die T-Zell-Homöostase bedeutsam zu sein scheint (
 s. dort).
s. dort). Ist die Todesdomäne aktiviert, triggert sie Adapterproteine, die ihrerseits Initiator-Caspasen "einschalten". Dies lässt aus Todesrezeptoren todesinduzierende Signalkomplexe (death-inducing signaling complex DISC) entstehen, und diese aktivieren Effektor-Caspasen.
Extrinsische Apoptose ist für die Entwicklung / Funktion einiger Gewebe / Organe erforderlich, wie in der Embryogenese: So unterziehen sich Zellen der Handanlage zwischen den Fingern einer Apoptose, es entstehen die Fingerstrahlen; zahlreiche Neuronen im sich entwickelnden Gehirn "beschließen" zu sterben.
 Von innen ausgelöste (endogene) Apoptose
(intrinsischer / mitochondrialer Weg, Stressor-Stimulation): Starke Belastung oder Beschädigung zellulärer Schlüsselsysteme lösen programmierten Zelluntergang aus. Beispielsweise das endoplasmatische Retikulum: Hier kann eine länger dauernde Störung der Ca++-Homöostase
(eine Hauptfunktion des EPR) oder eine Anhäufung falsch gefalteter
Proteine (deren Entfernung zu den Aufgaben des EPR gehört) Apoptose
triggern. Oder Mitochondrien, die bei entsprechender Reizung Cytochrom c in das Zytosol austreten lassen.
Von innen ausgelöste (endogene) Apoptose
(intrinsischer / mitochondrialer Weg, Stressor-Stimulation): Starke Belastung oder Beschädigung zellulärer Schlüsselsysteme lösen programmierten Zelluntergang aus. Beispielsweise das endoplasmatische Retikulum: Hier kann eine länger dauernde Störung der Ca++-Homöostase
(eine Hauptfunktion des EPR) oder eine Anhäufung falsch gefalteter
Proteine (deren Entfernung zu den Aufgaben des EPR gehört) Apoptose
triggern. Oder Mitochondrien, die bei entsprechender Reizung Cytochrom c in das Zytosol austreten lassen.Dieser Mechanismus unterliegt einer komplexen Kontrolle, z.B. durch Bcl-2-Proteine (nach B-cell lymphoma), die sich gegenseitig beeinflussen können. Diese regulatorischen Proteine wirken unterschiedlich auf den Apoptoseverlauf: Antiapoptotische bremsen, proapoptotische fördern ihn. Es sind die ersten Regulatorproteine, deren Wirkung auf die Apoptose nachgewiesen wurde.
Verschiedene Probleme in der Zelle können den intrinsischen Weg auslösen, wie
 Hitze,
Hitze,  Strahlung (inklusive UV-Licht),
Strahlung (inklusive UV-Licht),  Gifte (z.B. Zytostatika),
Gifte (z.B. Zytostatika),  Sauerstoffmangel,
Sauerstoffmangel,  Schäden an der DNA (nach der S-Phase).
Schäden an der DNA (nach der S-Phase).
So hat z.B. Cytochrom c - normalerweise im mitochondriellen Intermembranraum zu Hause - nichts im Zellplasma zu suchen. Vermehrte Durchlässigkeit beschädigter Mitochondrien führt zur Freisetzung des Cytochrom c in das Zytoplasma, es wirkt dann als pro-apoptotisches Molekül (death inducer). Die Freisetzung von Cytochrom c kann durch Faktoren der Mitochondrienmembran verhindert werden.
Apoptose läuft im Rahmen einer proteolytischen Kaskade ab und unterliegt mehrfacher Regulierung. So verteidigen apoptose-hemmende Proteine (IAPs: Inhibitors of apoptosis proteins) die Integrität der Zelle, indem sie Caspasen hemmen, manchmal auch zum Abbau freigeben.

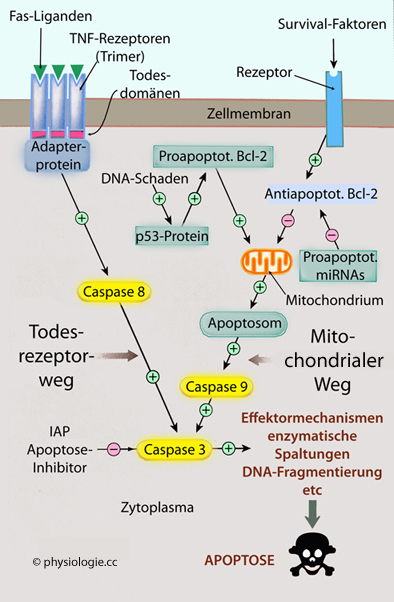
 Abbildung: Die zwei Signalwege der Apoptose (vgl. Abbildung oben)
Abbildung: Die zwei Signalwege der Apoptose (vgl. Abbildung oben)Nach einer Vorlage in Ritter / Flower / Henderson / Loke / MacEwan / Rang, Rang & Dale's Pharmacology, 9th ed. Elsevier 2020
Der "Todesrezeptorweg" (death receptor pathway, links)
wird über Bindung entsprechender Liganden (z.B. TNF; "Fas-Ligand") an seine
Rezeptoren aktiviert. Das stößt über Adapterproteine die Aktivierung
von Initiatorcaspasen an (z.B. Caspase 8), die wiederum
Effektorcaspasen (z.B. Caspase 3) aktivieren.
Den mitochondrialen Weg (mitochondrial pathway, rechts) aktivieren verschiedene Reize, u.a. irreparable Schäden an der DNA. Das p53-Protein bewirkt die Freisetzung von Cytochrom c aus Mitochondrien, und über die Initiatorcaspase 9 wird die Apoptose aktiviert.
Proteine der Bcl-2-Familie (Bcl-2 von B-cell lymphoma 2) können pro- oder antiapoptotische Wirkung haben - letzteres in Zusammenhang mit dem Einfluss von "Überlebensfaktoren" (trophische Faktoren, Wachstumsfaktoren, Adhäsionsmoleküle, Integrine etc), der über entsprechende Rezeptoren erfolgt.
Mikro-RNAs (miRNA) sind "nicht-codierend" und hemmen die Transkription zahlreicher (etwa 30% aller proteincodierenden) Gene. Durch Inhibition der Transkription antiapoptotischer Bcl-2 können sie die Apoptose anregen
Den mitochondrialen Weg (mitochondrial pathway, rechts) aktivieren verschiedene Reize, u.a. irreparable Schäden an der DNA. Das p53-Protein bewirkt die Freisetzung von Cytochrom c aus Mitochondrien, und über die Initiatorcaspase 9 wird die Apoptose aktiviert.
Proteine der Bcl-2-Familie (Bcl-2 von B-cell lymphoma 2) können pro- oder antiapoptotische Wirkung haben - letzteres in Zusammenhang mit dem Einfluss von "Überlebensfaktoren" (trophische Faktoren, Wachstumsfaktoren, Adhäsionsmoleküle, Integrine etc), der über entsprechende Rezeptoren erfolgt.
Mikro-RNAs (miRNA) sind "nicht-codierend" und hemmen die Transkription zahlreicher (etwa 30% aller proteincodierenden) Gene. Durch Inhibition der Transkription antiapoptotischer Bcl-2 können sie die Apoptose anregen

 Apoptose wird durch extrazelluläre Überlebensfaktoren gehemmt.
Meist binden diese an Rezeptoren an der Zellmembran und aktivieren so
Signalwege, die eine Apoptose zu verhindern helfen (Abbildungen). Gesunde Zellen
verhindern auch durch eigene Signalproteine, von
Phagozyten attackiert zu werden, indem sie an inhibierende Rezeptoren
in der Makrophagenmembran binden.
Apoptose wird durch extrazelluläre Überlebensfaktoren gehemmt.
Meist binden diese an Rezeptoren an der Zellmembran und aktivieren so
Signalwege, die eine Apoptose zu verhindern helfen (Abbildungen). Gesunde Zellen
verhindern auch durch eigene Signalproteine, von
Phagozyten attackiert zu werden, indem sie an inhibierende Rezeptoren
in der Makrophagenmembran binden.Umgekehrt kann das Fehlen von Wachstumsfaktoren Apoptose triggern. Antiapoptotische Bcl-2-Proteine werden über Rezeptoren angeregt, die durch extrazelluläre "Überlebensfaktoren" (survival factors, s.
 Abbildung) - z.B. Neurotrophine (das sind Proteine, die Überleben, Wachstum und Differenzierung von Nervenzellen betreiben) - stimuliert werden.
Bestimmte hormonsensitive Zellen gehen zugrunde, wenn sie keine anregenden Signale empfangen (Beispiele: Lymphozyten ohne Antigen- / Zytokinreiz, Neurone ohne NGF).
Die Abwesenheit dieser für die betreffenden Zellen essentiellen
Faktoren löst bei ihnen intrinsische Apoptose aus - ein physiologischer
Bestandteil immunologischer Auslese und mehrerer Vorgänge im Rahmen der Ontogenese (Rückbildung von Strukturen der "phylogenetischen Erinnerung").
Abbildung) - z.B. Neurotrophine (das sind Proteine, die Überleben, Wachstum und Differenzierung von Nervenzellen betreiben) - stimuliert werden.
Bestimmte hormonsensitive Zellen gehen zugrunde, wenn sie keine anregenden Signale empfangen (Beispiele: Lymphozyten ohne Antigen- / Zytokinreiz, Neurone ohne NGF).
Die Abwesenheit dieser für die betreffenden Zellen essentiellen
Faktoren löst bei ihnen intrinsische Apoptose aus - ein physiologischer
Bestandteil immunologischer Auslese und mehrerer Vorgänge im Rahmen der Ontogenese (Rückbildung von Strukturen der "phylogenetischen Erinnerung"). Ein zentrales Auslösermolekül ist das Tumorsuppressor-Protein p53, das in einer gesunden Zelle nur in geringer Konzentration vorliegt und als Kontrollfaktor im Zellzyklusfungiert. Bei Vorliegen von Schäden (z.B. irreparablen DNA-Defekten) tritt es vermehrt auf und trägt zur Eliminierung von Zellen bei, die u.a. potentiell zu Krebszellen werden könnten. Schaltet die Zelle auf "Apoptose", aktiviert p53 das (ebenfalls für die Steuerung des Zellzyklus entscheidende) Protein p21 und proapoptotische Bcl-2-Proteine (Bid) - Bid (BH3 interacting-domain death agonist), Bax (Bcl-2-associated X protein), Bak (Bcl-2 homologous antagonist killer).

 Abbildung: Apoptosom
Abbildung: ApoptosomNach Yuan S et al. Structure of an apoptosome-procaspase 9 CARD complex. Structure 2010; 18: 571-83
Blick auf eine heptamere Form eines Apoptosoms in einer menschlichen Zelle. Um eine zentrale radnabenförmige Ringstruktur (hub) sind je sieben armförmige Fortsätze angeordnet, mit daran befestigten regulatorischen Regionen, auf denen Cytochrom c zu liegen kommt.
Eine Apaf-1-Region ist türkis umrahmt dargestellt
NBD, nucleotide binding domain; HD1, first helical domain; WHD, winged helix domain; HD2, second helical domain

 Abbildung), ein multimolekularer (heptamerer) Enzymkomplex, der die Aktivierung von Caspasen im intrinsischen Apoptoseweg auslöst.
Abbildung), ein multimolekularer (heptamerer) Enzymkomplex, der die Aktivierung von Caspasen im intrinsischen Apoptoseweg auslöst.Zellen, die einer Apoptose unterlaufen, verlieren den Kontakt zu ihren Nachbarzellen und stülpen ihre Membran so um, dass sie die Zellbestandteile in Vesikel einschließen, die dann von Makrophagen (Histiozyten) "entsorgt" werden können - ohne dass es zu einer Entzündungsreaktion kommt. Dabei wird auch das Genom geordnet abgebaut (Caspase-aktivierte Desoxyribonuklease, CAD).
Channelopathien (Ionenkanalerkrankungen) sind genetisch bedingte Abnormitäten in Form und Funktion von Ionenkanälen. So können Veränderungen an Natriumkanälen Krämpfe, Muskel- und Herzerkrankungen bedingen; an Chloridkanälen
Bewegungsstörungen, Nierenfunktionsprobleme und Taubheit. Verschiedene
Ionenkanalerkrankungen können auch Epilepsieneigung zur Folge haben.
Hypothalamisch bedingte Unfruchtbarkeit kann durch diskontinuierliche Gabe von Gonadotropin behandelt werden. Die Frequenz der hypothalamischen Hormonfreisetzung ist auf die Dauer der Refrakterität an den Empfängerzellen abgestimmt. Dauerinfusion des Hormons hätte nur geringen Effekt (Reduktion der Rezeptorzahl, receptor downregulation).
Tuberkelbakterien (Mycobacterium tuberculosis, Erreger der Tuberkulose) verhindern die Fusion der Phagosomen (in die sie von Makrophagen aufgenommen wurden) mit Lysosomen und können so in der Zelle überleben, obwohl sie phagozytiert wurden.
 Der Aufbau von Mikrotubuli kann durch Spindelgifte behindert werden. Beispielsweise wird Colchicin zur
Behandlung akuter Gichtanfälle genutzt, weil es die Wanderung von
neutrophilen Granulozyten und damit den akuten Entzündungsprozess
hemmt.
Der Aufbau von Mikrotubuli kann durch Spindelgifte behindert werden. Beispielsweise wird Colchicin zur
Behandlung akuter Gichtanfälle genutzt, weil es die Wanderung von
neutrophilen Granulozyten und damit den akuten Entzündungsprozess
hemmt.
Ein weiteres Beispiel: Zytostatika wie Vincristin und Vinblastin führen zum Zerfall von Mikrotubuli, was vor allem Zellen mit hoher Teilungsrate betrifft und damit Tumorwachstum eindämmt - allerdings auch den Mikrotubulus-Mechanismus der Nervenzellen, was die neurotoxischen Nebenwirkungen erklärt.

Hypothalamisch bedingte Unfruchtbarkeit kann durch diskontinuierliche Gabe von Gonadotropin behandelt werden. Die Frequenz der hypothalamischen Hormonfreisetzung ist auf die Dauer der Refrakterität an den Empfängerzellen abgestimmt. Dauerinfusion des Hormons hätte nur geringen Effekt (Reduktion der Rezeptorzahl, receptor downregulation).
Tuberkelbakterien (Mycobacterium tuberculosis, Erreger der Tuberkulose) verhindern die Fusion der Phagosomen (in die sie von Makrophagen aufgenommen wurden) mit Lysosomen und können so in der Zelle überleben, obwohl sie phagozytiert wurden.
 Der Aufbau von Mikrotubuli kann durch Spindelgifte behindert werden. Beispielsweise wird Colchicin zur
Behandlung akuter Gichtanfälle genutzt, weil es die Wanderung von
neutrophilen Granulozyten und damit den akuten Entzündungsprozess
hemmt.
Der Aufbau von Mikrotubuli kann durch Spindelgifte behindert werden. Beispielsweise wird Colchicin zur
Behandlung akuter Gichtanfälle genutzt, weil es die Wanderung von
neutrophilen Granulozyten und damit den akuten Entzündungsprozess
hemmt. Ein weiteres Beispiel: Zytostatika wie Vincristin und Vinblastin führen zum Zerfall von Mikrotubuli, was vor allem Zellen mit hoher Teilungsrate betrifft und damit Tumorwachstum eindämmt - allerdings auch den Mikrotubulus-Mechanismus der Nervenzellen, was die neurotoxischen Nebenwirkungen erklärt.

 Der Körper besteht zur Hälfte seiner Masse aus Zellen - bestehend zu
70% aus Wasser, 15-20% Eiweiß, ~10% Nukleinsäuren, Elektrolyten u.a.
Teilweise sind sie polar
aufgebaut, z.B. Epithelzellen mit einer apikalen und einer
basolateralen Membran, gegeneinander abgedichtet und
funktionsabhängig mit unterschiedlichen Membranproteinen ausgestattet.
Gase gelangen direkt,
Wassermoleküle über Aquaporine, Elektrolyte über Ionenkanäle; Glucose,
Aminosäuren u.a. über Transporter durch Biomembranen. Stoffe
können auch über Endozytose in die, über Exozytose aus der Zelle
gelangen (Transzytose: durch die Zelle hindurch). Extrazellulärer
Stoffaustausch ist zwischen Zellen möglich (parazellulärer Transport),
die keine extrazelluläre Abdichtung (Schlussleisten) aufbauen
Der Körper besteht zur Hälfte seiner Masse aus Zellen - bestehend zu
70% aus Wasser, 15-20% Eiweiß, ~10% Nukleinsäuren, Elektrolyten u.a.
Teilweise sind sie polar
aufgebaut, z.B. Epithelzellen mit einer apikalen und einer
basolateralen Membran, gegeneinander abgedichtet und
funktionsabhängig mit unterschiedlichen Membranproteinen ausgestattet.
Gase gelangen direkt,
Wassermoleküle über Aquaporine, Elektrolyte über Ionenkanäle; Glucose,
Aminosäuren u.a. über Transporter durch Biomembranen. Stoffe
können auch über Endozytose in die, über Exozytose aus der Zelle
gelangen (Transzytose: durch die Zelle hindurch). Extrazellulärer
Stoffaustausch ist zwischen Zellen möglich (parazellulärer Transport),
die keine extrazelluläre Abdichtung (Schlussleisten) aufbauen Zellmembranen
grenzen ab - gegen andere intrazelluläre Kompartimente oder den
Extrazellulärraum -, lassen aber gezielten Stoffaustausch und
Kommunikation zu - über Rezeptoren, Permeasen, Austauscher, Cotransporter, Pumpen oder andere Strukturen, die zum Großteil aus
Protein bestehen. Gase und lipophile Stoffe können direkt durch die
Membran diffundieren. Grundbaustein von Zellmembranen sind
Phospholipide (>50%), sie wirken
hydrophob und separieren (hydrophile) Funktionsräume. Die Ausstattung
mit Lipiden, Proteinen und Kohlenhydraten ist seiten-, kompartiment-
und zellspezifisch. Das gesamte Membranmaterial wird innerhalb von ~3
Wochen vollständig erneuert
Zellmembranen
grenzen ab - gegen andere intrazelluläre Kompartimente oder den
Extrazellulärraum -, lassen aber gezielten Stoffaustausch und
Kommunikation zu - über Rezeptoren, Permeasen, Austauscher, Cotransporter, Pumpen oder andere Strukturen, die zum Großteil aus
Protein bestehen. Gase und lipophile Stoffe können direkt durch die
Membran diffundieren. Grundbaustein von Zellmembranen sind
Phospholipide (>50%), sie wirken
hydrophob und separieren (hydrophile) Funktionsräume. Die Ausstattung
mit Lipiden, Proteinen und Kohlenhydraten ist seiten-, kompartiment-
und zellspezifisch. Das gesamte Membranmaterial wird innerhalb von ~3
Wochen vollständig erneuert Integrale Proteine sind in Membranen verankert, meist mittels
α-helikaler Sequenzen aus ~20 vorwiegend hydrophoben Aminosäuren.
Permeasen,
Transporter, Pumpen haben Innenporen mit vorwiegend hydrophilen
Aminosäuren.
Der transmembranale Stoffaustausch hängt ab vom Konzentrationsgefälle
für die jeweilige Substanz, vom elektrischem Potential an der Membran
(Ionen), und der Permeabilität der Membran für den
jeweiligen Stoff. Proteine sind in der Membran frei
beweglich (Lateraldiffusion), können aber auch Ansatzpunkt für extra-
und intrazelluläre Gerüststrukturen sein. Sie wirken z.B. als Enzyme,
Rezeptoren, Erkennungsstrukturen (Glykolipide, Glykoproteine,
"Glykokalyx-Ausweis")
Integrale Proteine sind in Membranen verankert, meist mittels
α-helikaler Sequenzen aus ~20 vorwiegend hydrophoben Aminosäuren.
Permeasen,
Transporter, Pumpen haben Innenporen mit vorwiegend hydrophilen
Aminosäuren.
Der transmembranale Stoffaustausch hängt ab vom Konzentrationsgefälle
für die jeweilige Substanz, vom elektrischem Potential an der Membran
(Ionen), und der Permeabilität der Membran für den
jeweiligen Stoff. Proteine sind in der Membran frei
beweglich (Lateraldiffusion), können aber auch Ansatzpunkt für extra-
und intrazelluläre Gerüststrukturen sein. Sie wirken z.B. als Enzyme,
Rezeptoren, Erkennungsstrukturen (Glykolipide, Glykoproteine,
"Glykokalyx-Ausweis")  Diffusion ist die Verteilung von Teilchen nach ihrem
Konzentrationsgefälle (das durch Transportprozesse aufgebaut wurde).
Die Menge eines Stoffes, der über eine Grenzfläche diffundiert, ist
proportional der Austauschfläche und dem Konzentrationsgrandienten
sowie umgekehrt proportional der Diffusionsstrecke (Fick'sches Gesetz).
Der Krogh'sche Diffusionskoeffizient kennzeichnet die spezifische
Beweglichkeit (Permeabilität) der Substanz in der Matrix. Osmose ist
die Strömung von Wasser durch Grenzflächen (Zellmembranen), die für
gelöste Moleküle schwer passierbar ist - in Richtung der höheren
Konzentration der gelösten Teilchen. Die
Osmolarität gibt die Konzentration gelöster Stofe an; isoton nennt man
Flüssigkeiten mit gleicher osmotischer Konzentration wie Blutplasma
(~285 mOsm/l)
Diffusion ist die Verteilung von Teilchen nach ihrem
Konzentrationsgefälle (das durch Transportprozesse aufgebaut wurde).
Die Menge eines Stoffes, der über eine Grenzfläche diffundiert, ist
proportional der Austauschfläche und dem Konzentrationsgrandienten
sowie umgekehrt proportional der Diffusionsstrecke (Fick'sches Gesetz).
Der Krogh'sche Diffusionskoeffizient kennzeichnet die spezifische
Beweglichkeit (Permeabilität) der Substanz in der Matrix. Osmose ist
die Strömung von Wasser durch Grenzflächen (Zellmembranen), die für
gelöste Moleküle schwer passierbar ist - in Richtung der höheren
Konzentration der gelösten Teilchen. Die
Osmolarität gibt die Konzentration gelöster Stofe an; isoton nennt man
Flüssigkeiten mit gleicher osmotischer Konzentration wie Blutplasma
(~285 mOsm/l)  Stoffe diffundieren nach ihrem elektrochemischen Gradienten ("passiv"),
werden mit dem Gradienten eines anderen gegen ihren eigenen Gradienten
mitgenommen (Cotransport) oder ausgetauscht (Antiport - sekundär
aktiv), oder unter Energieaufwand (ATP) befördert (primär aktiver
Transport). Permeasen können "geschlossen", "offen" oder "inaktiviert"
sein. Der Zustand wechselt 1-100 mal pro Mikrosekunde (Transporter
wechseln ihre Konformation höchstens einmal pro Millisekunde). Die
Wahrscheinlichkeit des "Offen"-Zustandes bestimmt die Permeabilität,
sie kann durch verschiedene Faktoren (z.B. Transmitter) beeinflusst
werden.
Ist eine Permease für ein Ion selektiv durchgängig, wird sie nach dem
Ion benannt ("Kaliumkanal", "Natriumkanal"). Das
Gleichgewichtspotential für ein Ion ist die Membranspannung, welche
seine Diffusion verhindert
Stoffe diffundieren nach ihrem elektrochemischen Gradienten ("passiv"),
werden mit dem Gradienten eines anderen gegen ihren eigenen Gradienten
mitgenommen (Cotransport) oder ausgetauscht (Antiport - sekundär
aktiv), oder unter Energieaufwand (ATP) befördert (primär aktiver
Transport). Permeasen können "geschlossen", "offen" oder "inaktiviert"
sein. Der Zustand wechselt 1-100 mal pro Mikrosekunde (Transporter
wechseln ihre Konformation höchstens einmal pro Millisekunde). Die
Wahrscheinlichkeit des "Offen"-Zustandes bestimmt die Permeabilität,
sie kann durch verschiedene Faktoren (z.B. Transmitter) beeinflusst
werden.
Ist eine Permease für ein Ion selektiv durchgängig, wird sie nach dem
Ion benannt ("Kaliumkanal", "Natriumkanal"). Das
Gleichgewichtspotential für ein Ion ist die Membranspannung, welche
seine Diffusion verhindert In Blutplasma und anderen extrazellulären Flüssigkeitn ist Natrium das
Kation, Chlorid das Anion mit der höchsten Konzentration. Im Zytoplasma
ist Kalium das Kation mit der höchsten Konzentration. Ausfall
ATP-betriebener Transporter wie der Na-K-Pumpe führt zu Anreicherung
von Kationen in der Zelle sowie zu osmotischem Wassereinstrom
(Schwellung)
In Blutplasma und anderen extrazellulären Flüssigkeitn ist Natrium das
Kation, Chlorid das Anion mit der höchsten Konzentration. Im Zytoplasma
ist Kalium das Kation mit der höchsten Konzentration. Ausfall
ATP-betriebener Transporter wie der Na-K-Pumpe führt zu Anreicherung
von Kationen in der Zelle sowie zu osmotischem Wassereinstrom
(Schwellung) Das Zytoskelett
hat
Aktinfilamente, Intermediärfilamente (belastbar,
über Adhäsionspunkte / Desmosomen mit Nachbarzellen verbunden),
Myosinfilamente (Verformung, Bewegung, Kontraktion), Mikrotubuli
(Hohlzylinder aus Tubulin für intrazellulären Transport, als
Spindelapparat der Zellteilung). Koordinierte Aktivität von Aktin- und
Intermediärfilamenten, Mikrotubuli, Myosin und zahlreichen
Hilfsproteinen ermöglicht stabile Struktur, Form und Bewegung von
Zellen. Der Zellkern
hat den Großteil der genetischen Information (typischerweise ~10%
des Zellvolumens), Nucleoli produzieren Ribosomen, Kernporen erlauben
selektiven Moleküldurchtritt. Das glatte endoplasmatische Retikulum speichert Ca++,
nimmt an Biotransformation teil, glukuroniert Biliruin, synthetisiert
Membranmoleküle, Fettsäuren und Steroide; das rauhe bildet Proteine
(Translation). Vesikel separieren, speichern, modifizieren, sortieren und transportieren ihren Inhalt. Der
modifiziert, transportiert und verteilt seinen Inhalt; er besteht aus
einem kernnahen "Cis-Golgi-Netzwerk", einem "Golgi-Stapel" und einem
zellmembranseitigen "Trans-Golgi-Netzwerk". Innerhalb von ~20 Minuten
kann ein Golgi-Apparat vollständig neu gebildet werden, eine Zelle kann
über 200 Golgi-Apparate enthalten. Golgi-ApparatMitochondrien (meist ~103 pro Zelle, ~1/5 des Zellvolumens, Lebensdauer 10-20 Tage) nutzen Sauerstoff zur Energiegewinnung (Atmungskette), speichern Ca++,
sind enzymatisch aktiv und können Apoptose triggern. Lysosomen und
Peroxisomen bauen zelleigene (Autophagie) oder endozytierte
(Heterophagie) Stoffe ab Das Zytoskelett
hat
Aktinfilamente, Intermediärfilamente (belastbar,
über Adhäsionspunkte / Desmosomen mit Nachbarzellen verbunden),
Myosinfilamente (Verformung, Bewegung, Kontraktion), Mikrotubuli
(Hohlzylinder aus Tubulin für intrazellulären Transport, als
Spindelapparat der Zellteilung). Koordinierte Aktivität von Aktin- und
Intermediärfilamenten, Mikrotubuli, Myosin und zahlreichen
Hilfsproteinen ermöglicht stabile Struktur, Form und Bewegung von
Zellen. Der Zellkern
hat den Großteil der genetischen Information (typischerweise ~10%
des Zellvolumens), Nucleoli produzieren Ribosomen, Kernporen erlauben
selektiven Moleküldurchtritt. Das glatte endoplasmatische Retikulum speichert Ca++,
nimmt an Biotransformation teil, glukuroniert Biliruin, synthetisiert
Membranmoleküle, Fettsäuren und Steroide; das rauhe bildet Proteine
(Translation). Vesikel separieren, speichern, modifizieren, sortieren und transportieren ihren Inhalt. Der
modifiziert, transportiert und verteilt seinen Inhalt; er besteht aus
einem kernnahen "Cis-Golgi-Netzwerk", einem "Golgi-Stapel" und einem
zellmembranseitigen "Trans-Golgi-Netzwerk". Innerhalb von ~20 Minuten
kann ein Golgi-Apparat vollständig neu gebildet werden, eine Zelle kann
über 200 Golgi-Apparate enthalten. Golgi-ApparatMitochondrien (meist ~103 pro Zelle, ~1/5 des Zellvolumens, Lebensdauer 10-20 Tage) nutzen Sauerstoff zur Energiegewinnung (Atmungskette), speichern Ca++,
sind enzymatisch aktiv und können Apoptose triggern. Lysosomen und
Peroxisomen bauen zelleigene (Autophagie) oder endozytierte
(Heterophagie) Stoffe ab Apoptose ist die komplex regulierte "Selbstaufgabe" der Zelle, wenn
diese überflüssig oder nicht funktionstüchtig geworden ist. Sie kann
durch innere (DNA-Schäden, falsch gefaltete Proteine,
Fehlen von Wachstumsfaktoren) oder äußere Signale (z.B.
TNF-α) ausgelöst werden: Endogene (intrinsischer / mitochondrialer Weg
- Sauerstoffmangel, Strahlung, Hitze, Gifte) vs. extrinsische
(rezeptormediierte) Apoptose (Todesrezeptor-Signalweg). Caspase ist
eines der beteiligten Enzyme. Zytoplasma und
Kern schrumpfen und werden abgebaut, die Zelle wird fragmentiert und
verliert den Kontakt zu ihren Nachbarzellen; Nachbargewebe bleibt
unbeschädigt. Manche Zellen gehen zugrunde, wenn sie keine anregenden
Signale empfangen (Wachstumsfaktoren, Zytokine, Antigen). Es gibt
proapoptotische und antiapoptotische Faktoren; wird deren
Gleichgewicht zugunsten des Zelluntergangs verschoben, resultiert
Apoptose
Apoptose ist die komplex regulierte "Selbstaufgabe" der Zelle, wenn
diese überflüssig oder nicht funktionstüchtig geworden ist. Sie kann
durch innere (DNA-Schäden, falsch gefaltete Proteine,
Fehlen von Wachstumsfaktoren) oder äußere Signale (z.B.
TNF-α) ausgelöst werden: Endogene (intrinsischer / mitochondrialer Weg
- Sauerstoffmangel, Strahlung, Hitze, Gifte) vs. extrinsische
(rezeptormediierte) Apoptose (Todesrezeptor-Signalweg). Caspase ist
eines der beteiligten Enzyme. Zytoplasma und
Kern schrumpfen und werden abgebaut, die Zelle wird fragmentiert und
verliert den Kontakt zu ihren Nachbarzellen; Nachbargewebe bleibt
unbeschädigt. Manche Zellen gehen zugrunde, wenn sie keine anregenden
Signale empfangen (Wachstumsfaktoren, Zytokine, Antigen). Es gibt
proapoptotische und antiapoptotische Faktoren; wird deren
Gleichgewicht zugunsten des Zelluntergangs verschoben, resultiert
Apoptose |