




 Tubuläre Sekretion, distale Tubuli und Sammelrohre
Tubuläre Sekretion, distale Tubuli und Sammelrohre
 Diabetes insipidus: διαβαίνειν = hindurchfließen, insipidus = geschmacklos (sapor = Geschmack)
Diabetes insipidus: διαβαίνειν = hindurchfließen, insipidus = geschmacklos (sapor = Geschmack)
| Die
distalen Tubuli beteiligen sich zusammen mit den Sammelrohren an
der Feinabstimmung des Elektrolythaushalts. Sie resorbieren im
Schnitt jeweils etwa 5% der glomerulär filtrierten Kochsalzmenge,
abhängig vom Natriumstatus; Kalium wird vom distalen Tubulus nur bei
extrem kaliumarmer Ernährung resorbiert (~2%), sonst sezerniert
(bis ~180% der glomerulär filtrierten Menge). Zellen (z.B. im distalen peripheren Tubulus: Hauptzellen: Na+, K+; Zwischenzellen: H+) sind mit ihrer - apikalen und basolateralen - Membran auf bestimmte Aufgaben spezialisiert. Sie verfügen über unterschiedliche Transportsysteme, z.B. Na+/Cl--Cotransporter (NCC) und epitheliale Natriumkanäle (ENaC) apikal, Na+/K+-ATPase und Cl--Kanäle basolateral. Auch der Weg zwischen Tubuluszellen (parazellulär) steht für bestimmte Ionen offen, z.B. für Chloridionen. Die Einlagerung von Aquaporinen in die Zellmembran von Tubulusepithelzellen erleichtert den (osmotisch angetriebenen) transzellulären Durchtritt von Wasser. Die Einlagerung von Aquaporin 2 in die apikale Membran von Sammelrohrepithelzellen ist abhängig von Vasopressin (V2-Rezeptoren). Das Handling der Elektrolyte steht z.T. unter hormonellem Einfluss (Natrium, Kalium: Aldosteron; Calcium: Parathormon). Dabei können unterschiedliche Mechanismen wirken, wie bei der Natriumrückresorption durch Aldosteron. Diese erfolgen dann zeitversetzt: Zuerst (rasch) über direkte Anregung des Na+/H+-Austausches; dann (verzögert) durch Expression von Natriumkanälen in der apikalen Membran; schließlich (langfristig) durch Expression von Na+/K+-ATPase in der basolateralen Membran. |
 Calciumresorption
Calciumresorption  Hormonelle Steuerung
Hormonelle Steuerung  Tubuläre Sekretion
Tubuläre Sekretion  Kalium
Kalium
 Core messages
Core messages Zu den Leistungen des distalen Tubulus s. auch dort
Zu den Leistungen des distalen Tubulus s. auch dort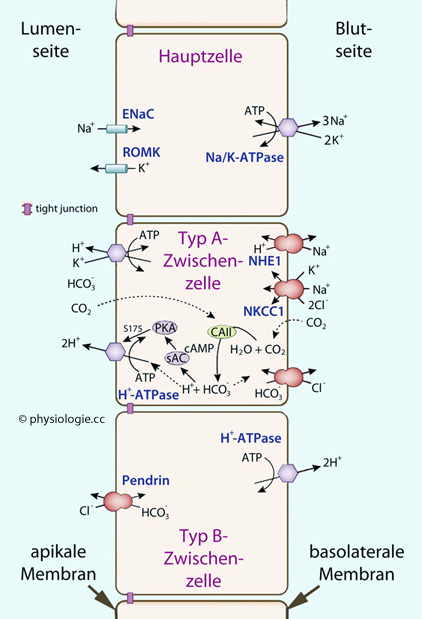
 Abbildung: Ionentransport im Sammelrohrsystem
Abbildung: Ionentransport im Sammelrohrsystem
 Abbildung):
Abbildung): In der luminalen (apikalen, harnseitigen) Membran der Hauptzellen befinden sich epitheliale Natriumkanäle (ENaC), der Einbau letzterer in die Membran wird durch Aldosteron
gefördert ("Salzsparhormon").
In der luminalen (apikalen, harnseitigen) Membran der Hauptzellen befinden sich epitheliale Natriumkanäle (ENaC), der Einbau letzterer in die Membran wird durch Aldosteron
gefördert ("Salzsparhormon"). | Na+-Einstrom durch epitheliale
Natriumkanäle (ENaC) in der apikalen Membran (Lumenseite) depolarisiert die Hauptzellen und fördert den K+-Ausstrom Epitheliale Natriumkanäle (ENaC) dominieren die Natriumresorption im Sammelrohr |
 Na+-K+-ATPase in der basolateralen Membran wird ebenfalls durch Aldosteron gefördert. Sie ist die treibende Kraft für die Kochsalzresorption aus dem Sammelrohr. Sie hält die niedrige Na+-Konzentration in der Tubuluszelle aufrecht. Öffnen sich luminale Natriumkanäle, diffundiert Na+ in die Zelle; die Na/K-ATPase "übernimmt" und schleust
Natrium durch die basolaterale Membran in das Interstitium (Richtung Kreislauf). Dieser Einstrom von Na+ ist elektrogen, er ladet den Tubulus auf (lumennegatives transepitheliales Potential); dies treibt wiederum Chloridionen in Richtung Interstitium.
Na+-K+-ATPase in der basolateralen Membran wird ebenfalls durch Aldosteron gefördert. Sie ist die treibende Kraft für die Kochsalzresorption aus dem Sammelrohr. Sie hält die niedrige Na+-Konzentration in der Tubuluszelle aufrecht. Öffnen sich luminale Natriumkanäle, diffundiert Na+ in die Zelle; die Na/K-ATPase "übernimmt" und schleust
Natrium durch die basolaterale Membran in das Interstitium (Richtung Kreislauf). Dieser Einstrom von Na+ ist elektrogen, er ladet den Tubulus auf (lumennegatives transepitheliales Potential); dies treibt wiederum Chloridionen in Richtung Interstitium.| Einbau und Aktivität der ENaC (apikal) und der Na/K-ATPase (basolateral) wird durch Aldosteron angeregt |
 Na+ und K+
strömen durch Ionenkanäle der luminalen Membran von Hauptzellen in den
Sammelrohren entsprechend ihren elektrochemischen Gradienten; diese
werden durch die Aktivität der basolateral gelegenen Na/K-ATPasen
aufrecht erhalten.
Na+ und K+
strömen durch Ionenkanäle der luminalen Membran von Hauptzellen in den
Sammelrohren entsprechend ihren elektrochemischen Gradienten; diese
werden durch die Aktivität der basolateral gelegenen Na/K-ATPasen
aufrecht erhalten. Typ A- oder α-Zellen dienen der Sekretion von H+ (Protonenpumpe H+-ATPase apikal, Na+-H+-Austauscher NHE1 basolateral). Die luminale Membran der säureproduzierenden Typ-A-Zwischenzellen der Rinden- und äußeren Markzone (type A intercalated cells, A-IC) hat H+-ATPase und H+/K+-ATPase, die basolaterale Membran Chlorid-Bicarbonat-Austauscher. Die Zelle verfügt über einen Bicarbonatsensor (sAC: soluble adenylyl cyclase) und Proteinkinase A (PKA), diese regulieren die H+-ATPase, die Wasserstoffionen in das Lumen ausscheidet.
Typ A- oder α-Zellen dienen der Sekretion von H+ (Protonenpumpe H+-ATPase apikal, Na+-H+-Austauscher NHE1 basolateral). Die luminale Membran der säureproduzierenden Typ-A-Zwischenzellen der Rinden- und äußeren Markzone (type A intercalated cells, A-IC) hat H+-ATPase und H+/K+-ATPase, die basolaterale Membran Chlorid-Bicarbonat-Austauscher. Die Zelle verfügt über einen Bicarbonatsensor (sAC: soluble adenylyl cyclase) und Proteinkinase A (PKA), diese regulieren die H+-ATPase, die Wasserstoffionen in das Lumen ausscheidet. Typ B- oder ß-Zellen bewerkstelligen den Austausch von HCO3- gegen Cl- (Pendrin). Der Chlorid-Bicarbonat-Austauscher Pendrin in der luminalen Membran von Typ-B-Zwischenzellen (type B intercalated cells, B-IC) sezerniert Bicarbonat, eine basolaterale H+-ATPase sezerniert Wasserstoffionen in das Interstitium. Diese Zellen sezernieren also saure Valenzen Richtung Blut.
Typ B- oder ß-Zellen bewerkstelligen den Austausch von HCO3- gegen Cl- (Pendrin). Der Chlorid-Bicarbonat-Austauscher Pendrin in der luminalen Membran von Typ-B-Zwischenzellen (type B intercalated cells, B-IC) sezerniert Bicarbonat, eine basolaterale H+-ATPase sezerniert Wasserstoffionen in das Interstitium. Diese Zellen sezernieren also saure Valenzen Richtung Blut. Bei Hypokaliämie resorbieren
Schaltzellen Kalium aus dem Tubulus. Im Austausch sezernieren sie
Wasserstoffionen in den Tubulus, was den Harn ansäuert und den Blut-pH
ansteigen lässt.
Bei Hypokaliämie resorbieren
Schaltzellen Kalium aus dem Tubulus. Im Austausch sezernieren sie
Wasserstoffionen in den Tubulus, was den Harn ansäuert und den Blut-pH
ansteigen lässt. s. dort).
s. dort). Der apikale Na-Cl-Cotransporter kann durch Thiaziddiuretika (z.B. Bendroflumethiazid) gehemmt werden; das verringert die Salz-Rückresorption und erhöht die Ausscheidung. Das kaliumsparende Amilorid hemmt die Natriumresorption über den Natriumkanal ENaC und wird meist kombiniert mit einem Thiazid eingesetzt.
Der apikale Na-Cl-Cotransporter kann durch Thiaziddiuretika (z.B. Bendroflumethiazid) gehemmt werden; das verringert die Salz-Rückresorption und erhöht die Ausscheidung. Das kaliumsparende Amilorid hemmt die Natriumresorption über den Natriumkanal ENaC und wird meist kombiniert mit einem Thiazid eingesetzt.
 Abbildung):
Abbildung): 
 Abbildung: Resorption von Ca++ und Mg++ aus dem distalen Tubulus / pars convoluta (Modell)
Abbildung: Resorption von Ca++ und Mg++ aus dem distalen Tubulus / pars convoluta (Modell)

 Calciumionen werden über einen epithelialen Ca-Kanal (TRPV-Transporter)
apikal aufgenommen und
Calciumionen werden über einen epithelialen Ca-Kanal (TRPV-Transporter)
apikal aufgenommen und  an Calbindin gebunden (gedämpfter
[Ca++]-Anstieg) bzw.
an Calbindin gebunden (gedämpfter
[Ca++]-Anstieg) bzw.  in Mitochondrien
und endoplasmatischem Retikulum deponiert.
in Mitochondrien
und endoplasmatischem Retikulum deponiert.  Dann erfolgt der Transport über die basolaterale Membran: Ein Na+/Ca++-Austauscher sowie
eine Ca++-ATPase ermöglichen den Übertritt von Ca++ in das Interstitium
bzw. in die Blutbahn.
Dann erfolgt der Transport über die basolaterale Membran: Ein Na+/Ca++-Austauscher sowie
eine Ca++-ATPase ermöglichen den Übertritt von Ca++ in das Interstitium
bzw. in die Blutbahn.| Die basolaterale Membran distaler Tubulusepithelzellen befördert Calciumionen über einen Na+/Ca++-Austauscher in das Interstitium |
 Genaueres s. dort
Genaueres s. dort
 Abbildung: Aquaporine, Vasopressin, Wassertransport in Sammelrohren
Abbildung: Aquaporine, Vasopressin, Wassertransport in Sammelrohren
 ).
).
 Diese bewirken über cAMP und Proteinkinase A, dass tubuläre Hauptzellen Aquaporin-2-hältige zytoplasmatische Vesikel
in ihre luminale Membran integrieren (
Diese bewirken über cAMP und Proteinkinase A, dass tubuläre Hauptzellen Aquaporin-2-hältige zytoplasmatische Vesikel
in ihre luminale Membran integrieren ( Abbildung) und damit Aquaporinmoleküle wirksam werden lassen.
Abbildung) und damit Aquaporinmoleküle wirksam werden lassen.
 Zusätzlich fördert Vasopressin die Transkription / Synthese neuer Aquaporin-2-Moleküle.
Zusätzlich fördert Vasopressin die Transkription / Synthese neuer Aquaporin-2-Moleküle. Aquaporine sind komplexe Membranproteine, welche
die Permeabilität der Zellmembran stark
erhöhen. Sie ermöglichen es Wassermolekülen, dem osmotischen Gradienten folgend aus den Sammelrohren in das hypertone Nierenmark zu diffundieren (Osmose).
Aquaporine sind komplexe Membranproteine, welche
die Permeabilität der Zellmembran stark
erhöhen. Sie ermöglichen es Wassermolekülen, dem osmotischen Gradienten folgend aus den Sammelrohren in das hypertone Nierenmark zu diffundieren (Osmose). 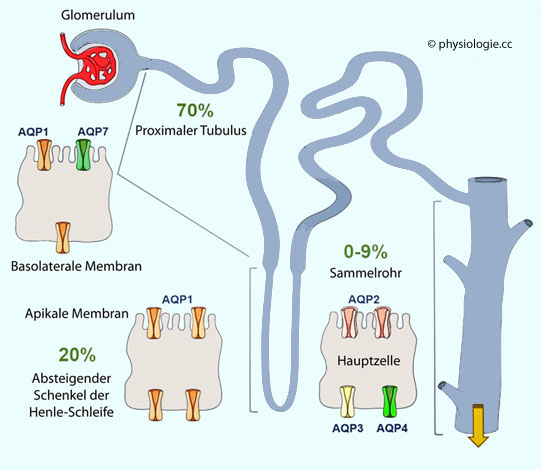
 Abbildung: Verteilung von Aquaporinen im Nephron
Abbildung: Verteilung von Aquaporinen im Nephron
 Aquaporin 1 findet sich in Epithelzellen des proximalen Tubulus
Aquaporin 1 findet sich in Epithelzellen des proximalen Tubulus das vasopressinabhängige Aquaporin 2 in der apikalen Membran von Sammelrohrepithelzellen
das vasopressinabhängige Aquaporin 2 in der apikalen Membran von Sammelrohrepithelzellen Aquaporin 3 und Aquaporin 4 befindet sich immer (konstitutiv) in der basolateralen Membran von Sammelrohrepithelzellen.
Aquaporin 3 und Aquaporin 4 befindet sich immer (konstitutiv) in der basolateralen Membran von Sammelrohrepithelzellen. Abbildung), die bis zu einem Liter Wasser pro Stunde zurückgewinnen kann (maximale Antidiurese).
Abbildung), die bis zu einem Liter Wasser pro Stunde zurückgewinnen kann (maximale Antidiurese).  ("Wasserharnruhr"; Harnausscheidung bis zu >20 l/d). Meist ist das
Aquaporin 2 betroffen, das hormonabhängig in die Tubulusmembran
eingebaut wird (nephrogener Diabetes insipidus).
("Wasserharnruhr"; Harnausscheidung bis zu >20 l/d). Meist ist das
Aquaporin 2 betroffen, das hormonabhängig in die Tubulusmembran
eingebaut wird (nephrogener Diabetes insipidus).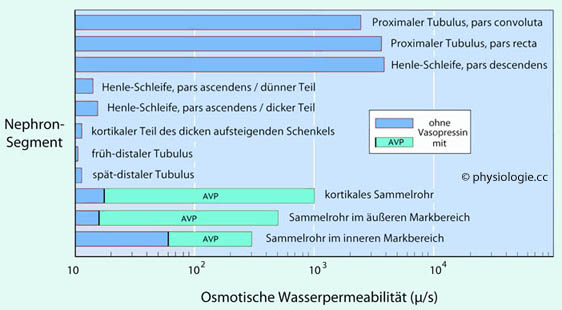
 Abbildung: Unterschiedliche Wasserpermeabilität der Nephronabschnitte
Abbildung: Unterschiedliche Wasserpermeabilität der Nephronabschnitte
 Geringe Diurese reduziert die Harnstoffausscheidung. Bei abnehmendem Harnvolumen - wenn die glomeruläre Filtration abnimmt, oder bei vasopressinbedingter Antidiurese
- gelangt nur eine relativ geringe Flüssigkeitsmenge in das distale
Sammelrohrsystem. Das erhöht hier die Konzentration an Harnstoff,
dessen Rückresorption zunimmt - die Harnstoff-Chlearance nimmt ab. Die
Harnstoffkonzentration im Nierenmark und auch die im Blutplasma nimmt
zu.
Geringe Diurese reduziert die Harnstoffausscheidung. Bei abnehmendem Harnvolumen - wenn die glomeruläre Filtration abnimmt, oder bei vasopressinbedingter Antidiurese
- gelangt nur eine relativ geringe Flüssigkeitsmenge in das distale
Sammelrohrsystem. Das erhöht hier die Konzentration an Harnstoff,
dessen Rückresorption zunimmt - die Harnstoff-Chlearance nimmt ab. Die
Harnstoffkonzentration im Nierenmark und auch die im Blutplasma nimmt
zu.| Antidiurese reduziert die Harnstoffclearance |

 Anregung des Na+/H+-Austausches durch direkte Membranwirkung (obwohl Steroid!), was einen raschen Effekt ermöglicht;
Anregung des Na+/H+-Austausches durch direkte Membranwirkung (obwohl Steroid!), was einen raschen Effekt ermöglicht;  einen
verzögerten Effekt über nukleäre Rezeptoren, deren Aktivierung die
Expression von Natriumkanälen (ENaC) in der apikalen Membran der Tubuluszellen
bewirkt;
einen
verzögerten Effekt über nukleäre Rezeptoren, deren Aktivierung die
Expression von Natriumkanälen (ENaC) in der apikalen Membran der Tubuluszellen
bewirkt; Erhöhung der Zahl (Expression) von Na+-K+-ATPase-Molekülen in der basolateralen Membran
als langfristig wirkender Effekt.
Erhöhung der Zahl (Expression) von Na+-K+-ATPase-Molekülen in der basolateralen Membran
als langfristig wirkender Effekt.
 Abbildung: Vasopressin erlaubt den (osmotisch bedingten) Austritt von Wasser aus dem Sammelrohrsystem
Abbildung: Vasopressin erlaubt den (osmotisch bedingten) Austritt von Wasser aus dem Sammelrohrsystem

 Abbildung: Mongolische Wüstenrennmaus
Abbildung: Mongolische Wüstenrennmaus s. auch dort.
s. auch dort. Organische Säuren werden in der basolateralen Membranvon
zwei (oder mehr) verschiedenen Systemen transportiert (Anionen
natriumabhängig mit OAT1, Kationen membranpotentialabhängig mit OCTs).
Organische Säuren werden in der basolateralen Membranvon
zwei (oder mehr) verschiedenen Systemen transportiert (Anionen
natriumabhängig mit OAT1, Kationen membranpotentialabhängig mit OCTs).  Der Transport von Stoffen durch die apikale Membran der
Tubuluszellen wird durch Mikrovilli erleichtert, die vor allem in den
frühen Abschnitten des proximalen Tubulus zahlreich sind. Organische
Säuren werden mittels OATs, Basen über Kationen-Antiporter (OCTNs - N
für novel) ins Lumen gebracht. Daneben gibt es noch weitere Transportsysteme.
Der Transport von Stoffen durch die apikale Membran der
Tubuluszellen wird durch Mikrovilli erleichtert, die vor allem in den
frühen Abschnitten des proximalen Tubulus zahlreich sind. Organische
Säuren werden mittels OATs, Basen über Kationen-Antiporter (OCTNs - N
für novel) ins Lumen gebracht. Daneben gibt es noch weitere Transportsysteme. Kompetitive Verdrängung: Konkurrieren
mehrere Stoffe um den Transport mit demselben System, kann es zu
entsprechenden Interaktionen kommen. Das kann pharmakologisch von Interesse sein.
Kompetitive Verdrängung: Konkurrieren
mehrere Stoffe um den Transport mit demselben System, kann es zu
entsprechenden Interaktionen kommen. Das kann pharmakologisch von Interesse sein.
 Ammoniumionen werden im proximalen Tubulus und im dicken aufsteigenden Teil der Henle-Schleife sezerniert
Ammoniumionen werden im proximalen Tubulus und im dicken aufsteigenden Teil der Henle-Schleife sezerniert
 Im späten proximalen Tubulus werden u.a. Kreatinin,
Neurotransmitter (Katecholamine, Histamin) sowie diverse Medikamente
sezerniert
Im späten proximalen Tubulus werden u.a. Kreatinin,
Neurotransmitter (Katecholamine, Histamin) sowie diverse Medikamente
sezerniert So kann z.B. die Ausscheidung von Salizylat durch Alkalisierung des Harns wesentlich erhöht werden, während niedriger Harn-pH die Ausscheidung minimiert.
So kann z.B. die Ausscheidung von Salizylat durch Alkalisierung des Harns wesentlich erhöht werden, während niedriger Harn-pH die Ausscheidung minimiert.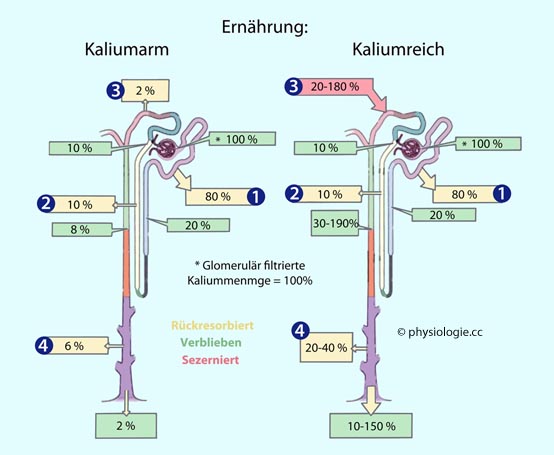
 Abbildung: Kaliumbilanz entlang des Tubulussystems bei geringer (links) und hoher Kaliumzufuhr (rechts)
Abbildung: Kaliumbilanz entlang des Tubulussystems bei geringer (links) und hoher Kaliumzufuhr (rechts)
 Abbildung) - abhängig von der
Kaliumbilanz (z.B. bei Wachstum positiv: Zunahme der Zellen, bei Atrophie negativ).
Abbildung) - abhängig von der
Kaliumbilanz (z.B. bei Wachstum positiv: Zunahme der Zellen, bei Atrophie negativ).  Der Zustand der Kaliumkanäle in der luminalen (apikalen) Membran der Sammelrohr-Epithelzellen ist pH-abhängig. Je geringer die H+-Ionzentration (je höher der pH: Alkalose) im Zytoplasma, desto wahrscheinlicher ist der geöffnete Zustand der K+-Kanäle und umso stärker wird Kalium sezerniert.
Der Zustand der Kaliumkanäle in der luminalen (apikalen) Membran der Sammelrohr-Epithelzellen ist pH-abhängig. Je geringer die H+-Ionzentration (je höher der pH: Alkalose) im Zytoplasma, desto wahrscheinlicher ist der geöffnete Zustand der K+-Kanäle und umso stärker wird Kalium sezerniert.  Auch die Aktivität der Na/K-ATPase ist pH-abhängig - sie ist durch erniedrigten pH-Wert gehemmt (Mechanismus?), die Zelle nimmt weniger Kalium auf.
Auch die Aktivität der Na/K-ATPase ist pH-abhängig - sie ist durch erniedrigten pH-Wert gehemmt (Mechanismus?), die Zelle nimmt weniger Kalium auf.  Plötzliche Erhöhung des Plasma-Kaliumspiegels führt zunächst zu
Kaliumaufnahme in die Zellen des Körpers (Kalium-Puffer, Normalisierung
des Plasmaspiegels); erst nach Stunden steigt die (hormonabhängige)
Kaliumsekretion in der Niere und führt die Kaliummenge zum Ausgangswert
zurück.
Plötzliche Erhöhung des Plasma-Kaliumspiegels führt zunächst zu
Kaliumaufnahme in die Zellen des Körpers (Kalium-Puffer, Normalisierung
des Plasmaspiegels); erst nach Stunden steigt die (hormonabhängige)
Kaliumsekretion in der Niere und führt die Kaliummenge zum Ausgangswert
zurück. 
 Diuretika
Diuretika
 sind harntreibende Stoffe. Sie senken die Rückresorption von Natrium-
(und meist Chlorid-) Ionen, bewirken Natriurese und steigern dadurch
den Wasserverlust. Dies erfolgt entweder durch direkte Wirkung auf
Zellen des Nephron, oder indirekt durch Modifizierung der
Filtratzusammensetzung.
sind harntreibende Stoffe. Sie senken die Rückresorption von Natrium-
(und meist Chlorid-) Ionen, bewirken Natriurese und steigern dadurch
den Wasserverlust. Dies erfolgt entweder durch direkte Wirkung auf
Zellen des Nephron, oder indirekt durch Modifizierung der
Filtratzusammensetzung. Direkte Wirkung auf Zellen des Nephron: Betrifft
Direkte Wirkung auf Zellen des Nephron: Betrifft  den dicken Teil des aufsteigenden Schenkels der Henle-Schleife (Schleifendiuretika wie Furosemid hemmen den Na+/K+/2Cl- -Transporter),
den dicken Teil des aufsteigenden Schenkels der Henle-Schleife (Schleifendiuretika wie Furosemid hemmen den Na+/K+/2Cl- -Transporter), 
 den distalen Tubulus (z.B. Thiazide, Aldosteronantagonisten wie Spironolakton,) und
den distalen Tubulus (z.B. Thiazide, Aldosteronantagonisten wie Spironolakton,) und 
 das Sammelrohrsystem (z.B. Triamteren, Amilorid).
das Sammelrohrsystem (z.B. Triamteren, Amilorid). 
 Thiazide sind Diuretika, welche am - ebenfalls luminalen - Na+-Cl--Cotransporter (NCC) der distalen Tubuli angreifen (s. oben). Sie wirken calciumsparend (
Thiazide sind Diuretika, welche am - ebenfalls luminalen - Na+-Cl--Cotransporter (NCC) der distalen Tubuli angreifen (s. oben). Sie wirken calciumsparend ( s. dort)
s. dort) Modifizierung
der Filtratzusammensetzung: Hierher gehören osmotische Diuretika, wie
Mannitol (bis 15 g i.v. bei akutem Nierenversagen): Sie werden
filtriert, aber nicht rückresorbiert, und nehmen Wasser aus osmotischen
Gründen mit in den Endharn.
Modifizierung
der Filtratzusammensetzung: Hierher gehören osmotische Diuretika, wie
Mannitol (bis 15 g i.v. bei akutem Nierenversagen): Sie werden
filtriert, aber nicht rückresorbiert, und nehmen Wasser aus osmotischen
Gründen mit in den Endharn. | Wirkort |
Mechanismus |
Bemerkungen |
|
| Carboanhydrasehemmer (z.B. Acetazolamid) |
Dicker aufsteigender Schenkel |
Blockade der CAH stoppt Bildung von Kohlensäure Bis ≤30% des filtrierten Bicarbonats werden ausgeschieden (vor allem mit K+) |
Ausscheidung von ≤8% der GFR Bicarbonatverlust Hypokaliämie metabolische Azidose |
| Schleifendiuretika (z.B. Furosemid) |
Dicker aufsteigender Schenkel | Reversible Hemmung des luminalen Na/K/2Cl- Transporters | Ausscheidung von bis zu 25% der GFR Natriumverlust |
| Thiazide (z.B. Hydrochlorothiazid) |
Frühdistaler Tubulus |
Reversible Hemmung des Na/Cl-Cotransports | Ausscheidung von ≤8% der GFR Ca++-sparend |
| Natriumkanalblocker (z.B. Amilorid) |
Spätdistaler Tubulus / Sammelrohr (Hauptzellen) | Reversible Blockade des epithelialen Natriumkanals (luminal) |
Kaliumsparend |
| Aldosteronantagonisten (z.B. Spironolacton) |
Distales Nephron / Sammelrohr (Hauptzellen) | Hemmt Bindung von Aldosteron an Mineralcorticoidrezeptor |
Kaliumsparend |
 Mit zunehmender
Konzentration des Harns im Nierenbecken steigt die Gefahr, dass Stoffe auskristallisieren und
Nierensteine bilden (Nierenkolik bei Steinabgang). Nierensteine können aus Calciumoxalat, Calciumphosphat,
Ammonium-Magnesiumphosphat, Harnsäure oder Zystin bestehen.
Mit zunehmender
Konzentration des Harns im Nierenbecken steigt die Gefahr, dass Stoffe auskristallisieren und
Nierensteine bilden (Nierenkolik bei Steinabgang). Nierensteine können aus Calciumoxalat, Calciumphosphat,
Ammonium-Magnesiumphosphat, Harnsäure oder Zystin bestehen. ).
).

 Distale Tubuli und Sammelrohre resorbieren
~5% der glomerulär filtrierten Kochsalzmenge sowie Ca++ und Mg++
(transzellulär, basolateral via Na/Ca-Austauscher), "titrieren" Kaliumbilanz und Bicarbonatresorption,
und stellen die erforderliche Verdünnung / Konzentrierung des Harns
ein. Der distale Tubulus ist für Wasser undurchlässig, die Sammelrohre
bei Wirkung von Vasopressin wasserdurchlässig (Aquaporineinlagerung). Hauptzellen des Sammelrohrs dienen der Rückgewinnung von Natrium, sie exprimieren
luminal Natrium- (ENaC) und Kaliumkanäle (ROMK). Der Natriumeinstrom
(und die Expression von Na/K-ATPase) wird durch Aldosteron gefördert
und macht das Lumen elektronegativ, das fördert Kaliumausstrom und
Chloridresorption. Typ A-Zwischenzellen sezernieren Säure (H+-ATPase apikal, Na/H-Austauscher basolateral), solche von Typ B Bicarbonat (Bicarbonat-Chlorid- Austauscher Pendrin) Distale Tubuli und Sammelrohre resorbieren
~5% der glomerulär filtrierten Kochsalzmenge sowie Ca++ und Mg++
(transzellulär, basolateral via Na/Ca-Austauscher), "titrieren" Kaliumbilanz und Bicarbonatresorption,
und stellen die erforderliche Verdünnung / Konzentrierung des Harns
ein. Der distale Tubulus ist für Wasser undurchlässig, die Sammelrohre
bei Wirkung von Vasopressin wasserdurchlässig (Aquaporineinlagerung). Hauptzellen des Sammelrohrs dienen der Rückgewinnung von Natrium, sie exprimieren
luminal Natrium- (ENaC) und Kaliumkanäle (ROMK). Der Natriumeinstrom
(und die Expression von Na/K-ATPase) wird durch Aldosteron gefördert
und macht das Lumen elektronegativ, das fördert Kaliumausstrom und
Chloridresorption. Typ A-Zwischenzellen sezernieren Säure (H+-ATPase apikal, Na/H-Austauscher basolateral), solche von Typ B Bicarbonat (Bicarbonat-Chlorid- Austauscher Pendrin) ~15% des glomerulär filtrierten Wassers werden vasopressingesteuert rückresorbiert. Über V2-Rezeptoren → cAMP → Proteinkinase A wird Aquaporin 2 exprimiert, Hauptzellen bauen aquaporinhältige Vesikel in ihre apikale Membran ein. (Immer findet sich Aquaporin 1 im proximalen Tubulus, Aquaporin 3 und 4 basolateral im Sammelrohr.) Starke Vasopressinwirkung bewirkt maximale Antidiurese (Harn
bis ~1200 mOsm, hauptsächlich durch NaCl und Harnstoff), geringe
Vasopressinwirkung vermehrte Wasserdiurese. Defekter
Vasopressinmechanismus (meist Aquaporin 2: nephrogen) führt zu Diabetes insipidus (bis ~20 l/d). Vasopressin
kontrahiert Zellen des
Mesangiums, was den Filtrationskoeffizienten senkt und die
Filtrationsleistung verringert. Auch hemmt Vasopressin die Freisetzung
von Renin. Morgenharn spiegelt die Durstphase der Nacht wider (~900 mOsm). Antidiurese reduziert die Harnstoffclearance: Abnehmendes Harnvolumen erhöht die Harnstoffkonzentration im Nierenmark, Rückresorption und Konzentration im Blut steigen an ~15% des glomerulär filtrierten Wassers werden vasopressingesteuert rückresorbiert. Über V2-Rezeptoren → cAMP → Proteinkinase A wird Aquaporin 2 exprimiert, Hauptzellen bauen aquaporinhältige Vesikel in ihre apikale Membran ein. (Immer findet sich Aquaporin 1 im proximalen Tubulus, Aquaporin 3 und 4 basolateral im Sammelrohr.) Starke Vasopressinwirkung bewirkt maximale Antidiurese (Harn
bis ~1200 mOsm, hauptsächlich durch NaCl und Harnstoff), geringe
Vasopressinwirkung vermehrte Wasserdiurese. Defekter
Vasopressinmechanismus (meist Aquaporin 2: nephrogen) führt zu Diabetes insipidus (bis ~20 l/d). Vasopressin
kontrahiert Zellen des
Mesangiums, was den Filtrationskoeffizienten senkt und die
Filtrationsleistung verringert. Auch hemmt Vasopressin die Freisetzung
von Renin. Morgenharn spiegelt die Durstphase der Nacht wider (~900 mOsm). Antidiurese reduziert die Harnstoffclearance: Abnehmendes Harnvolumen erhöht die Harnstoffkonzentration im Nierenmark, Rückresorption und Konzentration im Blut steigen an  Proximale
Tubuli können Säure- und Basenionen resorbieren /
sezernieren; Ammoniumionen werden auch im dicken aufsteigenden Teil der
Henle-Schleife sezerniert. Das distale Tubulussystem sezerniert organische Säuren und Basen, die z.T. als Kationen / Anionen vorliegen, daher ist ihr Transport pH-abhängig (Diffusion entlang der apikalen Membran leichter im undissoziierten Zustand):
Basolateral Anionen natriumabhängig mittels OAT1, Kationen
membranpotentialabhängig mittels OCTs; apikal Säuren mittels OATs,
Basen über Kationen-Antiporter Proximale
Tubuli können Säure- und Basenionen resorbieren /
sezernieren; Ammoniumionen werden auch im dicken aufsteigenden Teil der
Henle-Schleife sezerniert. Das distale Tubulussystem sezerniert organische Säuren und Basen, die z.T. als Kationen / Anionen vorliegen, daher ist ihr Transport pH-abhängig (Diffusion entlang der apikalen Membran leichter im undissoziierten Zustand):
Basolateral Anionen natriumabhängig mittels OAT1, Kationen
membranpotentialabhängig mittels OCTs; apikal Säuren mittels OATs,
Basen über Kationen-Antiporter Kalium wird zu >90% mit dem Harn aus dem Körper entfernt. Resorbiert wird es im proximalen Tubulus (~80%), im dicken aufsteigenden Teil der Henle-Schleife (~10%), distale Tubuli (2%) und Sammelrohre (6%) können bei Kaliummangel 8% der filtrierten Kaliummenge resorbieren. Im distalen Tubulus kann Kalium aldosteronabhängig sezerniert werden (bei
Kaliumüberschuss ist die ausgeschiedene größer als die glomerulär filtrierte Menge: bis 180%). Je höher der pH, desto stärker die Kaliumsekretion; Azidose kann zu Kaliumretention und Hyperkaliämie führen. Plötzliche
Erhöhung des Plasma-Kaliumspiegels führt zunächst zu Kaliumaufnahme in
die Zellen des Körpers (Kalium-Puffer, Normalisierung des
Plasmaspiegels) und erst verzögert zu renaler Kompensation Kalium wird zu >90% mit dem Harn aus dem Körper entfernt. Resorbiert wird es im proximalen Tubulus (~80%), im dicken aufsteigenden Teil der Henle-Schleife (~10%), distale Tubuli (2%) und Sammelrohre (6%) können bei Kaliummangel 8% der filtrierten Kaliummenge resorbieren. Im distalen Tubulus kann Kalium aldosteronabhängig sezerniert werden (bei
Kaliumüberschuss ist die ausgeschiedene größer als die glomerulär filtrierte Menge: bis 180%). Je höher der pH, desto stärker die Kaliumsekretion; Azidose kann zu Kaliumretention und Hyperkaliämie führen. Plötzliche
Erhöhung des Plasma-Kaliumspiegels führt zunächst zu Kaliumaufnahme in
die Zellen des Körpers (Kalium-Puffer, Normalisierung des
Plasmaspiegels) und erst verzögert zu renaler Kompensation |
