

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert


 Glomeruläre Filtration und tubulo-glomeruläre Balance
Glomeruläre Filtration und tubulo-glomeruläre Balance
© H. Hinghofer-Szalkay
 Bowman-Kapsel: William Bowman
Bowman-Kapsel: William Bowman
glomerulär: glomus = Knäuel
juxtaglomerulär: iuxta = nahe neben, glomus = Knäuel
Mesangium: μέσος = mittig, ανγειον = (Blut)Gefäß
Podozyt: πούς, ποδός = Fuß, κύτος = Zelle
Renin: ren = Niere
Urämie: ούρα = Harn, αἷμα = Blut
vas afferens, efferens: vas = Gefäß, afferre = herbeitragen, efferre = hinaustragen
Der
effektive Filtrationsdruck (Blutdruck minus hydrostatischer
Gegendruck und onkotischer Druck) in den Kapillaren der Nierenglomeruli beträgt 5-15 mmHg und treibt die Bildung des glomerulären Filtrats an. Mit steigendem Druck nimmt die Filtration zu, gedrosselte Durchblutung senkt sie. Eine unterdurchblutete Niere kann nicht ausreichend Harn produzieren.
Der Konstriktionsgrad und damit der Strömungswiderstand der zuführenden (vasa afferentia) und abführenden Arteriolen (vasa efferentia)
ist durch zahlreiche Mediatoren beeinflusst und bestimmt den
glomerulärkapillären Blutdruck. Wird das vas afferens enger, sinken Kapillardruck, Filtration und Durchblutung. Kontrahiert das vas efferens, steigen diese
Werte.
Podozyten auf den Glomerulumkapillaren stützen die kapilläre
Filterstruktur ab, die negativ geladene Basalmembran zwischen Podozyten
und Endothelzellen ist das eigentliche "Sieb" - Ionen und kleinere
Moleküle, auch mittelmolekulare Stoffe (Peptide bis ~14 kDa) gelangen
mit dem Ultrafiltrat in den glomerulären Kapselraum. Plasmaproteine schlüpfen
noch zu ~1% durch die Membran - Größe, Ladung, Gestalt und Verformbarkeit ihrer Moleküle bestimmen das Ausmaß ihrer Filtration.
Der juxtaglomeruläre Apparat
besteht aus reninbildenden epitheloiden (juxtaglomerulären) Myozyten des vas afferens,
Teilen des vas efferens, und der macula densa, gebildet aus Zellen des frühen distalen
Tubulus. Macula-densa-Zellen
registrieren Änderungen der tubulären Kochsalzbeladung und beeinflussen
Reninbildung und Kontraktion des vas afferens. Die Reninfreisetzung
unterliegt auch dem Feedback verschiedener Mediatoren. Renin - ein Enzym - lässt im Blut aus einer Vorstufe (Angiotensinogen) das vasokonstriktorische Angiotensin entstehen.
|

In das Glomerulum mündet eine zuleitende
Arteriole (vas afferens), die sich in 30-40 Glomerulumkapillaren
verzweigt
(die Gesamtlänge aller Glomerulumkapillaren beträgt ~50 km). Die
ableitende Arteriole (vas efferens) stellt dem Blut einen
Strömungswiderstand entgegen, der hoch genug ist, um im Glomerulum
einen für die Filtration ausreichenden Blutdruck aufrecht zu erhalten. 
Ein Nephron besteht aus einem Nierenkörperchen und dem anschließenden Tubulussystem. Ein Nierenkörperchen (renal corpuscle) besteht aus drei Anteilen: Dem Glomerulum, dem Bowman-Raum (Bowman's space) und der Bowman-Kapsel.
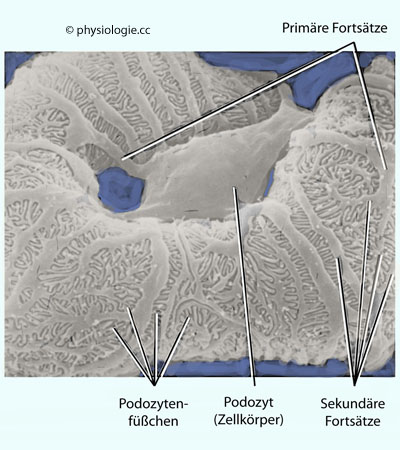
 Abbildung: Glomeruläre Kapillarschleife
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Abbildung: Glomeruläre Kapillarschleife
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Blick vom Kapselraum auf eine Glomerulumkapillare. Diese ist von sich
verästelnden zytoplasmatischen Fortsätzen (primäre, sekundäre,
"Füßchen") eines Podozyten bedeckt.
Podozyten liegen der - zwischen ihnen und Endothelzellen gelegenen -
Basalmembran auf. Ihre Verzweigungen lassen Spalten frei, durch die das
Ultrafiltrat des Blutes dringen kann. Die Basalmembran ist der
eigentliche molekulare Filter, der Makromoleküle (weitgehend) und
Blutkörperchen (vollständig) vor einem Übertritt in den Bowman-Raum - und damit den Tubulus - bewahrt ("Blut-Harn-Schranke")
 Das Ausmaß der Filtration
eines Stoffes hängt von seiner Größe, Ladung, Form und Verformbarkeit
ab (negative Ladung behindert die Passage wegen negativ geladener
Glykoproteine in der Wand des Siebes).
Das Ausmaß der Filtration
eines Stoffes hängt von seiner Größe, Ladung, Form und Verformbarkeit
ab (negative Ladung behindert die Passage wegen negativ geladener
Glykoproteine in der Wand des Siebes).
 Der Siebkoeffizient (S) ist definiert als die Konzentration eines Stoffes im Filtrat (Kf) gebrochen durch die Konzentration im Blutplasma (Kp):
Der Siebkoeffizient (S) ist definiert als die Konzentration eines Stoffes im Filtrat (Kf) gebrochen durch die Konzentration im Blutplasma (Kp):
Der
Betrag des Siebkoeffizienten kann zwischen 0 und 1 liegen (s. Tabelle
unten). Der Wert gibt Aufschluss über die Barrierefunktion der
glomerulären
Barriere gegenüber dieser Substanz: Ist er 1, werden diese Moleküle
frei filtriert, d.h. sie gehen genauso leicht über die glomerulären
Kapillarwände wie Wassermoleküle ([S]=1) und tauchen im Primärharn in
gleicher Konzentration auf wie im Plasma; beträgt er 0, ist die
Filterbarriere für diese Moleküle undurchdringlich, sie gelangen
überhaupt nicht in das Filtrat.

Abbildung: Struktur eines Nierenkörperchens / Glomerulum
Nach einer Vorlage in Kumar / Abbas / Fausto / Aster,
Robbin and Cotran's Pathological Basis of Disease, 8th ed. Saunders /
Elsevier 2010
Das Nierenkörperchen besteht aus Glomerulum, Epithel der Bowman-Kapsel und dem dazwischen liegenden Kapselraum. Ein
Glomerulum hat ~150 µm Durchmesser, ein Erythrozyt ~7 µm.
Die Wanddicke
des Endothels beträgt ~0,1 µm, die der Basalmembran ~0,3 µm

Stoffe mit
niedrigem Molekulargewicht (<5,5 kDa) und geringem effektiven
Molekülradius (z.B. Wasser, Harnstoff, Glucose) haben einen [S] nahe 1.
Bei Molekulargewichten ab etwa 14 kDa (z.B. Lysozym) wird es für den
Stoff zunehmend schwierig, durch die Kapillarbarriere zu gelangen,
[S] nimmt deutlich ab.
Auch die elektrische Ladung der
Moleküle spielt eine wichtige Rolle: Die negativen Ladungen der
Filtermembran halten negativ geladene Teilchen von der Passage ab
( Abbildung unten). Albumin
wird so gut wie nicht mehr filtriert (Tabelle unten): Es ist nicht nur
mit 7 nm Durchmesser ziemlich groß, es ist auch (beim Blut-pH von 7,4)
stark negativ geladen.
Abbildung unten). Albumin
wird so gut wie nicht mehr filtriert (Tabelle unten): Es ist nicht nur
mit 7 nm Durchmesser ziemlich groß, es ist auch (beim Blut-pH von 7,4)
stark negativ geladen.
Erkrankungen der Glomeruli mit Verlust der negativen Ladung der Filtrationsbarriere (Glomerulonephritis) resultieren in Albuminurie (Ausscheidung nennenswerter Mengen Albumin mit dem Harn).
 Mesangiumzellen sind in das Mesangium
Mesangiumzellen sind in das Mesangium  eingebettete Makrophagen; Mesangium ist ein aus
extrazellulärem Matrixmaterial gebildeter Stiel, auf dem glomeruläre
Kapillarschlingen sitzen,
eingebettete Makrophagen; Mesangium ist ein aus
extrazellulärem Matrixmaterial gebildeter Stiel, auf dem glomeruläre
Kapillarschlingen sitzen,  s. auch dort). Mesangiumzellen werden durch vasoaktive Stoffe - inklusive Vasopressin - kontrahiert, was den kapillären Filtrationskoeffizienten und damit die glomeruläre Filtration verringert. Dehnung beantworten Mesangiumzellen mit der Freisetzung mehrerer Wachstumsfaktoren.
s. auch dort). Mesangiumzellen werden durch vasoaktive Stoffe - inklusive Vasopressin - kontrahiert, was den kapillären Filtrationskoeffizienten und damit die glomeruläre Filtration verringert. Dehnung beantworten Mesangiumzellen mit der Freisetzung mehrerer Wachstumsfaktoren.
Einige Mesangiumzellen setzen sich in den extraglomerulären Bereich
fort und tragen dort (mit tubulären macula densa- und vaskulären
granulären Zellen) zum juxtaglomerulären Apparat bei. Die genaue Rolle
der Mesangiumzellen ist noch unklar.
 Podozyten
Podozyten im inneren Blatt der Bowman-Kapsel
im inneren Blatt der Bowman-Kapsel  bestimmen zusammen mit der Basalmembran die Filterfunktion der Nieren: Sie bilden
mit ihren länglichen, mittels des transmembranalen Nephrin
und anderer spezieller Proteine (Abbildungen unten) verbundenen
Fortsätzen "Filtrationsschlitze" mit einer Spaltenbreite von 4 bis 20 nm.
bestimmen zusammen mit der Basalmembran die Filterfunktion der Nieren: Sie bilden
mit ihren länglichen, mittels des transmembranalen Nephrin
und anderer spezieller Proteine (Abbildungen unten) verbundenen
Fortsätzen "Filtrationsschlitze" mit einer Spaltenbreite von 4 bis 20 nm.
 Nephrin ist ein Membranprotein der glomerulären Filtrationsbarriere, das aus mehreren Immunglobulindomänen
sowie Fibronektindomänen besteht. Es wird von Podozyten gebildet und
verknüpft maschenartig benachbarte Zellfortsätze, was zur Limitierung
der Größe filtrierbarer Moleküle beiträgt.
Nephrin ist ein Membranprotein der glomerulären Filtrationsbarriere, das aus mehreren Immunglobulindomänen
sowie Fibronektindomänen besteht. Es wird von Podozyten gebildet und
verknüpft maschenartig benachbarte Zellfortsätze, was zur Limitierung
der Größe filtrierbarer Moleküle beiträgt.
|
Molekulare Masse (kDa)
|
Durchmesser (nm)
|
Sieb-
koeffizient
|
Wasser
|
~0,02
|
0,2
|
1
|
Natrium
|
~0,02
|
0,4
|
1
|
Chlorid
|
~0,04
|
0,35
|
1
|
Harnstoff
|
0,06
|
0,3
|
1
|
Glucose
|
0,18
|
0,7 |
1
|
Inulin
|
5,5
|
~3,0
|
0,98
|
Myoglobin
|
17
|
3,9
|
0,75
|
Hämoglobin
|
68
|
6,5
|
0,03
|
Albumin
(negativ geladen)
|
69
|
7,0
|
<0,01
|
Diese Schlitze erlauben den Durchtritt des durchsickernden Filtrats in
den Bowman-Raum und ergeben sich durch die Abstände zwischen den
fingerförmigen Podozytenfortsätzen, die zusammen ein mechanisches
Korsett für die unter hohem Druck stehenden Kapillaren bilden.
Podozyten und Basalmembran interagieren und bestimmen gemeinsam vor
allem die Permeabilität gegenüber Plasmaeiweißen (s. weiter unten).

 Abbildung: Glomeruläre Filtration
Nach einer Vorlage bei easynotecards.com
Abbildung: Glomeruläre Filtration
Nach einer Vorlage bei easynotecards.com
Die
glomeruläre Filtration wird durch einen relativ hohen Blutdruck in den
Glomerulumkapillaren aufrechterhalten. Dieser (hydrostatische) Druck
beträgt am Beginn der Glomerulumkapillare etwa 55 mmHg - bedingt durch das Widerstandsmuster der vasa
afferentia und efferentia, das sich ändern kann - und bei Verlassen des Glomerulum etwa 50 mmHg.
Gegenkräfte sind der hydrostatische Druck in der Glomerulumkapsel (~15
mmHg) und der onkotische Effekt des Blutplasmas (~25-30 mmHg), der
durch die Filtration von ~20% des glomerulären Plasmavolumens und Konzentration der (nicht filtrierten) Plasmaeiweiße (vor allem Albumin) so lange zunimmt (bis auf ~40 mmHg), bis der effektive Filtrationsdruck Null beträgt (Filtrationsäquilibrium)

Die
"Filtermatte" der Glomeruli enthält mehrere Schichten: Endothel,
Basalmembran und Podozyten. Zusammen bilden sie unter dem Einfluss des
hohen Kapillardrucks (~55 mmHg) ein
Ultrafiltrat des
Blutplasmas. Der dabei entstehende "Primärharn" enthält
mikromolekulare Bestandteile
des Plasmas - Wasser und kleine Ionen gelangen leicht durch die
Filtrationsbarriere.
Diese beginnt bei ~5 kD Molekülmasse; bei Teilchen
dieser Größenklasse spielt die elektrische Ladung eine wichtige Rolle:
Negativ geladene kommen - im Vergleich zu gleich großen ungeladenen -
nur schwer oder gar nicht durch die Filtrationsbarriere. Plasmaproteine
tragen beim pH-Wert des Blutes überwiegend negative Ladungen (ihr
isoelektrischer Punkt liegt im sauren Bereich) und sind von der
Filtration weitgehend ausgeschlossen (Albumin: Siebkoeffizient <1%,
s. Tabelle oben).
Es gelangen also
nicht nur Stoffwechselendprodukte wie Kreatinin, Harnstoff und
Harnsäure in den Primärharn, sondern auch für den Körper wertvolle
Substanzen wie Mineralstoffe (Natrium, Kalium, nicht-proteingebundenes Calcium und
Magnesium), Chlorid, Bicarbonat, Phosphat, Sulfat, Glucose,
Aminosäuren, harnpflichtige Substanzen, Hormone, mittelmolekulare
Stoffe (Peptide bis ~14 kDa: z.B. Lysozym noch zu 4/5), aber kaum
Plasmaeiweiß (<1%; Protein, das durch den glomerulären Filter
schlüpft, wird tubulär resorbiert).
Glucose wird glomerulär frei filtriert
Je höher der Blutzuckerspiegel, desto mehr Glucose gelangt in die Tubuli
|
Die
glomerulären Kapillarwände sind fenestriert, die Lücken haben ~70 nm
Durchmesser und blockieren den Durchtritt von Blutkörperchen (für Makromoleküle sind sie kein Hindernis).
Der effektive Porenradius des glomerulären Filterapparates beträgt
1,5-4,5 nm (vgl. Tabelle oben). Mit zunehmender Molekülgröße nimmt die Fraktion filtrierten
Stoffs ab. An Eiweiß gebundene
Moleküle wie z.B. an Albumin angelagerte freie Fettsäuren sind der
Filtration entzogen, auch wenn sie an sich kleinmolekular sind.

 Abbildung: Die Filtrierbarkeit hängt von Größe und Ladung der Teilchen ab
Abbildung: Die Filtrierbarkeit hängt von Größe und Ladung der Teilchen ab
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Neutrale Dextrane passieren umso leichter die Membran, je kleiner ihre Moleküle sind (rote Kurve). Die relative Clearance (clearance ratio) ist die beobachtete gebrochen durch die Inulinclearance (CX / CIn), sie beträgt hier (und bei kationischem Dextran) bei einem Moleküldurchmesser <2 nm fast 100%.
Dextrane mit positiver Gesamtladung (kationisch, wie Diethylaminoethyl- Dextran, rechtsverschobene blaue Kurve) sind besser filtrierbar, d.h. bei gegebener Molekülgröße gelangt mehr Substanz in den Primärharn.
Dextrane mit negativer Gesamtladung (anionisch, z.B. Dextransulfat, linksverschobene grüne Kurve) werden von der negativ geladenen Filtrationsbarriere abgestoßen und sind erst bei sehr kleinem Moleküldurchmesser filtrierbar

Für die Filtration spielt neben der Molekülgröße deren elektrische Ladung
eine Rolle ( Abbildung): Negativ geladene Moleküle (wie - bei einem
Blut-pH von 7,4 - Proteine, insbesondere das stark negativ geladene
Albumin) gelangen schwerer
durch die Filtrationsbarriere als positiv geladene gleichen
Durchmessers. Der Grund dafür ist, dass
Proteoglykane der Basalmembran negativ geladene Seitenketten aus
Heparansulfat enthalten und die Podozytenfortsätze von einer negativ
geladenen Glykokalix aus Glykolipiden und Glykoproteinen umhüllt
sind.
Abbildung): Negativ geladene Moleküle (wie - bei einem
Blut-pH von 7,4 - Proteine, insbesondere das stark negativ geladene
Albumin) gelangen schwerer
durch die Filtrationsbarriere als positiv geladene gleichen
Durchmessers. Der Grund dafür ist, dass
Proteoglykane der Basalmembran negativ geladene Seitenketten aus
Heparansulfat enthalten und die Podozytenfortsätze von einer negativ
geladenen Glykokalix aus Glykolipiden und Glykoproteinen umhüllt
sind.
Verlässt das Blut die Glomeruli, gelangt es in die vasa efferentia. Die Menge des Blutplasmas, das durch die vasa abströmt, ist im Vergleich zu der über die vasa efferentiaafferentia angefluteten um das Volumen des glomerulär übergetretenen Ultrafiltrats (Primärharns) reduziert; die Konzentration der völlig frei filtrierbaren Substanzen im Blutplasma hat sich nicht verändert (und ist etwa gleich groß wie im Ultrafiltrat).
 Glomeruläre Filtrationsrate
Glomeruläre Filtrationsrate (GFR)
~1,5 ml / Minute / kg Körpergewicht
(beim
Erwachsenen ~100-130 ml/min)
oder:
| GFR ~ 60-70 ml / min / m2 Haut |
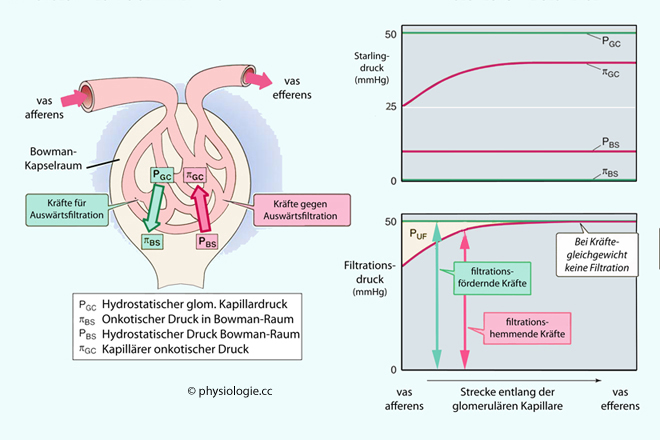
 Abbildung: Glomeruläre Ultrafiltration
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 3rd ed., Elsevier 2016
Abbildung: Glomeruläre Ultrafiltration
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 3rd ed., Elsevier 2016
Links:
Kräfte, welche die glomeruläre Filtration beeinflussen: Hydrostatischer
Druck sowie kolloidosmotischer (onkotischer) Effekt jeweils innerhalb und
außerhalb der Kapillarschleifen. Da normalerweise so gut wie kein Protein
glomerulär filtriert wird, sind Eiweißkonzentration und onkotischer
Druck im Kapselraum vernachlässigbar gering, und es gilt: Effektiver
Filtrationsdruck = kapillärer Blutdruck minus Kapseldruck
(hydrostatisch) minus kolloidosmotischer Druck des Blutplasma.
Rechts: Verlauf der Kräfte
entlang einer glomerulären Kapillare (von vas afferens bis vas
efferens). Durch Ultrafiltration steigt die Proteinkonzentration im
Gefäß, der onkotische Einwärtseffekt nimmt dadurch (von 25 mmHg) zu,
bis ein Kräftegleichgewicht erreicht ist und die Filtration sistiert.
pUF = Netto-Filtrationsdruck (UF = Ultrafiltration): Der Netto-hydrostatische Druck beträgt [pGC - pBS], der Netto-onkotische Sog [πGC - πBS]. GC = glomerular capillary, BS = Bowman's space
Der Blutdruck in den Glomerulumkapillaren beträgt ~50-55 mmHg - doppelt so hoch wie für die meisten Kapillaren des Körpers. Ursache ist der beträchtliche
Flusswiderstand durch die vasa efferentia. Ihm steht der hydrostatische
Druck im Bowman-Raum (~10-15 mmHg) und der kolloidosmotische Druck (≥25
mmHg) entgegen, sodass der effektive Filtrationsdruck am Beginn der Glomerulumkapillaren ~15 mmHg, am Ende 0 mmHg beträgt ( Abbildung).
Abbildung).
Die ultrafiltrationsbedingte Erhöhung der Proteinkonzentration
im Plama der Glomerulumkapillaren bedingt einen relativ hohen
onkotischen Sog in peritubulären Kapillaren (vasa recta), was die
Rückresorption von Flüssigkeit im Tubulusbereich unterstützt (s. auch dort).
 Adäquate
glomeruläre Filtration ist Voraussetzung für die Ausscheidungsfunktion
der Nieren. Ihr Betrag wird über den glomerulären Kapillardruck
reguliert - teils autonom (lokal), teils neurohumoral.
Angriffspunkt dieser Regulation sind die zu- und abführenden
Widerstandsgefäße, d.h. vasa afferentia und efferentia. Der
Filtrationsdruck kann so nicht nur einerseits an wechselnde
Anforderungen angepasst, sondern andererseits auch bei variierendem
arteriellem (System-) Blutdruck stabil gehalten werden (Autoregulation).
Adäquate
glomeruläre Filtration ist Voraussetzung für die Ausscheidungsfunktion
der Nieren. Ihr Betrag wird über den glomerulären Kapillardruck
reguliert - teils autonom (lokal), teils neurohumoral.
Angriffspunkt dieser Regulation sind die zu- und abführenden
Widerstandsgefäße, d.h. vasa afferentia und efferentia. Der
Filtrationsdruck kann so nicht nur einerseits an wechselnde
Anforderungen angepasst, sondern andererseits auch bei variierendem
arteriellem (System-) Blutdruck stabil gehalten werden (Autoregulation).
Abschätzung der renalen Filtrationsleistung. Die Größe der glomerulären Filtration
läßt sich am besten anhand von Stoffen bestimmen, die nur glomerulär
filtriert, aber tubulär weder rückresorbiert noch (zumindest nicht
stark) sezerniert werden. So staut sich das körpereigene Kreatinin bei eingeschränkter renaler Filtrationsleistung einerseits im Blut zurück (erhöhte Plasmakonzentration), andererseits erscheint es in reduzierter Menge im Harn (verringerte Clearance).
Die Serum-Kreatininkonzentration steigt allerdings erst dann deutlich
an, wenn die Filtrationsleistung bereits erheblich (z.B. auf 50% des
Normalwertes) abgesunken ist. Bei weiterer Abnahme der GFR erhöhen sich
die Kreatininwerte im Blut allerdings rapide.
Die glomeruläre Filtrationsrate ist die pro Zeiteinheit renal filtrierte Flüssigkeitsmenge
Sie beträgt bei einer gesunden erwachsenen Person etwa 120 ml/min
|
Die Filtrationsbarriere zwischen dem Kapillarlumen und dem Kapselraum
ist vierlagig - pro Schichte mit jeweils unterschiedlichen
Eigenschaften:
 Eine Glykokalyx auf der luminalen Oberfläche der Endothelzellen,
Eine Glykokalyx auf der luminalen Oberfläche der Endothelzellen,
 fenestrierte (Lücken mit etwa 70 nm Durchmesser) Endothelzellen, fast vollständig eingehüllt durch
fenestrierte (Lücken mit etwa 70 nm Durchmesser) Endothelzellen, fast vollständig eingehüllt durch
 die glomeruläre Basalmembran - dem eigentlichen Filter (Teilchen >1 kDa werden zurückgehalten) - sowie
die glomeruläre Basalmembran - dem eigentlichen Filter (Teilchen >1 kDa werden zurückgehalten) - sowie
 mechanisch widerstandsfähige (druckresistente) Podozyten mit ihren füßchenförmigen interdigitierenden Fortsätzen, die wie ein Stützgitter fungieren.
mechanisch widerstandsfähige (druckresistente) Podozyten mit ihren füßchenförmigen interdigitierenden Fortsätzen, die wie ein Stützgitter fungieren.
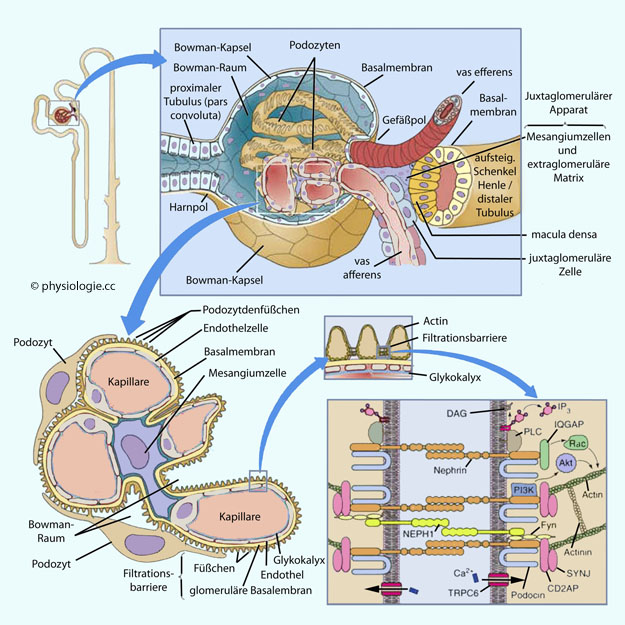
 Abbildung: Glomeruläres Filtersystem
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Abbildung: Glomeruläres Filtersystem
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Oben:
Nierenkörperchen (mit Glomerulum im Bowman-Raum, umgeben von der Bowman-Kapsel). Unten links: Podozyten. Inset Mitte: Komponenten der
Filtrationsbarriere. Unten rechts: Komponenten der Filtermembran
Jede
Niere enthält etwa eine Million Glomeruli, deren Kapillarschleifen den
glomerulären Filter aufbauen.
Diese Barriere besteht aus
(fenestriertem) Endothel, Basalmembran, und Podozyten mit ihren interdigitierenden Fußfortsätzen (Podozytenfüßchen).
Akt, Protein Kinase B  CD2AP, CD2-assoziiertes Protein
CD2AP, CD2-assoziiertes Protein  DAG,
Diacylglycerin
DAG,
Diacylglycerin  Fyn, eine SRC-Kinase
Fyn, eine SRC-Kinase  IP3, Inositoltriphosphat
IP3, Inositoltriphosphat  IQ-GAP,
IQ-Motiv mit GTPase aktivierendem Protein
IQ-GAP,
IQ-Motiv mit GTPase aktivierendem Protein  NEPH1, Mitglied der
NEPH-Protein-Familie, interagiert mit Nephrin
NEPH1, Mitglied der
NEPH-Protein-Familie, interagiert mit Nephrin  PI3K, Phosphatidylinositol 3-Kinase
PI3K, Phosphatidylinositol 3-Kinase  PLC, Phospholipase C
PLC, Phospholipase C  Rac, eine GTPase
Rac, eine GTPase  SYNJ, Synaptojanin
SYNJ, Synaptojanin  TRPC6, transient receptor potential cation channel, subfamily C, member 6
TRPC6, transient receptor potential cation channel, subfamily C, member 6

 Die Glykokalyx hat - bedingt durch Glycosaminoglycane - negative
Ladungen, die wahrscheinlich die Filtration
negativ geladener Teilchen einschränken.
Die Glykokalyx hat - bedingt durch Glycosaminoglycane - negative
Ladungen, die wahrscheinlich die Filtration
negativ geladener Teilchen einschränken.
 Über die Eigenschaften fenestrierten Endothels s. dort.
Über die Eigenschaften fenestrierten Endothels s. dort.
 Der eigentliche Filter ist die Basalmembran zwischen Endothel und Podozyten. Sie ist dreischichtig und negativ geladen (Sialo- und Dicarbonsäuregruppen in Heparansulfat-Proteoglycanen) und behindert den Durchtritt von größeren bzw. negativ geladenen (anionischen) Proteinen. Sie ist aus Typ IV-Kollagen-Triple-Helices
aufgebaut und erlaubt sie den Durchtritt von Partikeln bis zu höchstens
~10 nm Durchmesser (vgl. Tabelle oben. Bei einem Durchmesser von etwa
4-5 nm - etwas größer als Myoglobin - beträgt der Siebkoeffizient noch
~50%).
Der eigentliche Filter ist die Basalmembran zwischen Endothel und Podozyten. Sie ist dreischichtig und negativ geladen (Sialo- und Dicarbonsäuregruppen in Heparansulfat-Proteoglycanen) und behindert den Durchtritt von größeren bzw. negativ geladenen (anionischen) Proteinen. Sie ist aus Typ IV-Kollagen-Triple-Helices
aufgebaut und erlaubt sie den Durchtritt von Partikeln bis zu höchstens
~10 nm Durchmesser (vgl. Tabelle oben. Bei einem Durchmesser von etwa
4-5 nm - etwas größer als Myoglobin - beträgt der Siebkoeffizient noch
~50%).
Ein Verlust der negativen Ladungen der Basalmembran (Glomerulonephritis) mindert die Retention anionischer Bestandteile (wie der
Plasmaeiweiße) bei der glomerulären Filtration.
 Nach außen stülpen sich Fortsätze der anliegenden Podozyten über
die Kapillarwände, die Spalträume zwischen ihnen sind mit einer
dünnen, negativ geladenen Membran bedeckt, die 4-20 nm weite Poren
aufweist ("Schlitzdiaphragma", slit diaphragm).
Körper und Fortsätze der Podozyten sowie das Schlitzdiaphragma sind
von einer Schicht aus negativ geladenen Glycoproteinen bedeckt.
Nach außen stülpen sich Fortsätze der anliegenden Podozyten über
die Kapillarwände, die Spalträume zwischen ihnen sind mit einer
dünnen, negativ geladenen Membran bedeckt, die 4-20 nm weite Poren
aufweist ("Schlitzdiaphragma", slit diaphragm).
Körper und Fortsätze der Podozyten sowie das Schlitzdiaphragma sind
von einer Schicht aus negativ geladenen Glycoproteinen bedeckt.
Molekulare Verschlussmechanismen benachbarter Podozytenmembranen
beteiligen sich am Aufbau der Schlitzdiaphragmen, z.B. mittels spezifischer Bindung der
Proteine Nephrin und NEPH1 aneinander (Abbildungen).


Abbildung: Molekulare Verankerungen der Podozyten
Nach einer Vorlage bei Koepen and Stanton, Berne and Levy's Physiology (6th ed), Mosby / Elsevier 2008
Die Podozytenfüßchen sind über
Verankerungsmoleküle wie Integrine und Dystroglycan verankert: α-Dystroglycan bindet an die Basalmembran, ß-Dystroglycan transmembranal an Proteine des Zytoskeletts.
Das Aktingerüst in Podozyten ist durch α-Aktinin 4 stabilisiert und mittels CD2-assoziiertem Protein (CD2AP) an den Filtrierschlitz befestigt  Nephrin überbrückt den Filtrierschlitz und ist mit Proteinen wie
Podocin verbunden
Nephrin überbrückt den Filtrierschlitz und ist mit Proteinen wie
Podocin verbunden  NEPH1 und NEPH2 sind "KIRREL"-Proteine, deren zytoplasmastische Domänen mit Podocin oder Nephrin interagieren
NEPH1 und NEPH2 sind "KIRREL"-Proteine, deren zytoplasmastische Domänen mit Podocin oder Nephrin interagieren  Protocadherine sind Zelladhäsionsproteine
Protocadherine sind Zelladhäsionsproteine  ZO- 1 (zonula occludens) ist ein Tight-junction-Protein
ZO- 1 (zonula occludens) ist ein Tight-junction-Protein

Diese Anordnung ergibt insgesamt ein aus mehreren Lagen
bestehendes funktionelles Sieb, das bei der Filtration nur kleine
Moleküle, insbesondere Kationen, durchlässt.
Podozyten sind an Aufbau
und Erhaltung dieser Barriere aktiv beteiligt: Sie produzieren
Bestandteile der glomerulären Basalmembran sowie Enzyme, welche die
extrazelluläre Matrix modifizieren können.
Moleküle mit mehr als 80 kD passieren diesen Filter (physiologisch) nicht mehr, Albumin
(67 kD) wird wegen seiner Negativität ebenfalls fast vollständig (zu
99,95%) zurückgehalten - nur 150-200 mg werden pro Tag glomerulär
filtriert (bei einer glomerulären Albuminpassage von ~35.000 g/d!), 90%
davon im Tubulus über Endozytose wieder aufgenommen; 15-20 mg/d erscheinen im Harn
( Grenzwerte s. dort).
Grenzwerte s. dort).
Kleinere Proteine (10-45 kD) filtrieren die Glomeruli zu 1-80%, je nach Größe und Ladung; ihr Anteil im Harn beträgt zwischen 50 und 80 mg/d.
Die
Kapillarschleifen liegen zentralen Mesangiumzellen direkt auf; diese
sind kontraktil, sezernieren extrazelluläre Matrix und setzen sich in
den - zwischen vas afferens, vas efferens und Anfangsteil des distalen Tubulus gelegenen - juxtaglomerulären Apparat fort. Dieser besteht aus Teilen des vas afferens (granuläre reninbildende epitheloide
Myozyten), Beginn des vas efferens, und der macula densa, einem hochepithelialen Teil in der Wand des frühen distalen Tubulus. Seine Aufgabe ist die Stabilisierung des Gleichgewichts zwischen Filtration und Rückresorption im betreffenden Nephron.
fort. Dieser besteht aus Teilen des vas afferens (granuläre reninbildende epitheloide
Myozyten), Beginn des vas efferens, und der macula densa, einem hochepithelialen Teil in der Wand des frühen distalen Tubulus. Seine Aufgabe ist die Stabilisierung des Gleichgewichts zwischen Filtration und Rückresorption im betreffenden Nephron.
Durch seine spezielle Lage ist der juxtaglomeruläre Apparat imstande,
sowohl die glomeruläre Durchblutung als auch die tubuläre
Rückresorption zu registrieren und zu beeinflussen:
 Macula-densa-Zellen reagieren auf eine Reduktion der tubulären Flüssigkeitsströmung mit Reninfreisetzung aus dem vas afferens. Herabgesetzte glomeruläre Filtration (die Ursache verringerter Strömung im Tubulus) deutet auf reduzierte Flüssigkeitsreserven im Körper hin, und Renin stimuliert das Renin-Angiotensin-Aldosteron-System, das Kochsalz - und damit auch Wasser - reklamiert und dabei Blutdruck und Kreislauf stabilisiert.
Macula-densa-Zellen reagieren auf eine Reduktion der tubulären Flüssigkeitsströmung mit Reninfreisetzung aus dem vas afferens. Herabgesetzte glomeruläre Filtration (die Ursache verringerter Strömung im Tubulus) deutet auf reduzierte Flüssigkeitsreserven im Körper hin, und Renin stimuliert das Renin-Angiotensin-Aldosteron-System, das Kochsalz - und damit auch Wasser - reklamiert und dabei Blutdruck und Kreislauf stabilisiert.
Welchen weiteren Faktoren unterliegt die
Reninfreisetzung? Dazu zählen
 neuronale Anregung über sympathische Efferenzen zur Niere
neuronale Anregung über sympathische Efferenzen zur Niere
 ß2-Rezeptor-Agonisten (Reninfreisetzung +)
ß2-Rezeptor-Agonisten (Reninfreisetzung +)
 Prostaglandine (diese bewirken auch eine Dilatation der vasa afferentia, was den Filtrationsdruck erhöht)
Prostaglandine (diese bewirken auch eine Dilatation der vasa afferentia, was den Filtrationsdruck erhöht)
 Angiotensin II (wirkt auf vasa efferentia stärker vasokonstriktorisch als auf vasa afferentia, das erhöht ebenfalls den Filtrationsdruck).
Angiotensin II (wirkt auf vasa efferentia stärker vasokonstriktorisch als auf vasa afferentia, das erhöht ebenfalls den Filtrationsdruck).
Funktionsgleichgewicht vas afferens / vas efferens
Sowohl
vasa afferentia als auch vasa efferentia sind Widerstandsgewäße, beide
Gefäßabschnitte senken den Blutdruck entlang der Passagestrecke. Dieser
ist im Glomerulum (nach dem vas afferens) noch ziemlich hoch (50-55
mmHg), in den peritubulären Kapillaren (nach dem vas efferens) beträgt
er nur noch ≤10 mmHg.
Für die
Durchblutung des Nephrons (bzw. den RPF) ist es einerlei, ob sich vas
afferens oder vas efferens (oder beide) kontrahieren; die Perfusion
nimmt in jedem Fall entsprechend dem
Strömungsgesetz mit steigendem Widerstand ab.
Kontrahieren sich die beiden Widerstandsgefäße jedoch isoliert, wirkt sich dies jeweils
unterschiedlich auf glomerulären Kapillardruck und Filtration aus:

Kontrahiert
das vas
afferens, nimmt der Druck im Glomerulum und die Filtration ab;

umgekehrt
steigen Druck und Filtration bei Verengung des vas
efferens - bis ein
Punkt erreicht ist, an dem die niedrige Durchblutung auch die
Filtration wieder senkt (

Abbildung).

 Abbildung: Auswirkungen isolierter Kontraktion der zuführenden (links) und abführenden Arteriole (rechts) eines Nephrons
Abbildung: Auswirkungen isolierter Kontraktion der zuführenden (links) und abführenden Arteriole (rechts) eines Nephrons
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 1st ed. Saunders 2003
Bei Kontraktion des vas efferens (rechts)
überwiegt zunächst der Effekt des steigenden Kapillardrucks auf die
Filtratbildung (GFR nimmt mit Widerstand des vas efferens zu), bei
höherem Kontraktionsgrad dominiert die Wirkung der sinkenden Perfusion
(GFR nimmt mit Widerstand des vas efferens ab).
In diesem Beispiel betragen die Kontrollwerte für die glomeruläre
Filtration (GFR) ca. 120 ml/min, für den glomerulären Kapillardruck ~60
mmHg, und für die Plasmaströmung durch die Niere (RPF) etwa 700 ml/min.
GRF,
glomeruläre Filtrationsrate;
PGC, glomerulärer Kapillardruck; RPF, renaler Plasmafluss

Sowohl Sympathikustonus als auch Antiotensin II wirken auf
beide Gefäßabschnitte; es gibt aber Situationen, in denen sich die Wirkung vorzugsweise
auf
 das vas afferens (Widerstand sinkt hier z.B. nach Nephrektomie in der verbliebenen Niere, wodurch die Filtration zunimmt) oder
das vas afferens (Widerstand sinkt hier z.B. nach Nephrektomie in der verbliebenen Niere, wodurch die Filtration zunimmt) oder
 das vas efferens konzentriert (z.B. nach Gabe von ACE-Hemmern, z.B. Captopril - sie blockieren ACE (Angiotensin-converting enzyme) und behindern damit die Bildung von Angiotensin).
das vas efferens konzentriert (z.B. nach Gabe von ACE-Hemmern, z.B. Captopril - sie blockieren ACE (Angiotensin-converting enzyme) und behindern damit die Bildung von Angiotensin).
Der sympathische Tonus zur
Niere kann im Rahmen ergotroper Situationen (körperliche Arbeit,
Stress, Schmerz, Trauma) erhöht sein, oder als kardiovaskuläre Antwort
auf Hypovolämie (Blutverlust). Dann geben Nervenfasern Noradrenalin in
das renale Gewebe ab, und es kommt zu Vasokonstriktion an den vasa
afferantia und efferentia. Dadurch nehmen die renale Perfusion und glomeruläre Filtration ab.
Sinkt die Perfusion (RBF) stärker als die Filtration (GFR), dann liegt
das an einem stärkeren vasokonstriktiven Effekt an den vasa efferentia.
Bei maximaler sympathischer Stimulation dreht sich dieses Muster um
(intensivere Verengung der afferenten Gefäße), in beiden Fällen nehmen
sowohl RPF als auch GFR ab.
Für
die glomeruläre Filtration gilt -
wie in allen Kapillaren - das Starling-sche Filtrationsgesetz. Bei
einem effektiven glomerulären Filtrationsdruck von ~10 mmHg werden 20%
des
durchströmenden Plasmavolumens filtriert (Filtrationsfraktion).
Die
Filtrationsleistung ist proportional zur Körperoberfläche, hängt aber
auch von Geschlecht (m>f) und Alter ab:
 Neugeborene zeigen eine
niedrige relative Filtrationsleistung; dann nimmt die (auf die
Körperoberfläche bezogene) Filtrationsleistung um einen Faktor von ~10
zu, und
Neugeborene zeigen eine
niedrige relative Filtrationsleistung; dann nimmt die (auf die
Körperoberfläche bezogene) Filtrationsleistung um einen Faktor von ~10
zu, und
 mit ~6 Monaten übersteigen die Relativwerte diejenigen erwachsener Personen;
mit ~6 Monaten übersteigen die Relativwerte diejenigen erwachsener Personen;
 mit zwei Jahren stellen sich schließlich Werte ein, die für Erwachsene typisch sind, um dann
mit zwei Jahren stellen sich schließlich Werte ein, die für Erwachsene typisch sind, um dann
 mit zunehmendem Alter
wieder abzunehmen (Verlust funktionsfähiger Nephrone).
mit zunehmendem Alter
wieder abzunehmen (Verlust funktionsfähiger Nephrone).

 Abbildung: Filtration, Rückresorption, Sekretion
Abbildung: Filtration, Rückresorption, Sekretion
Nach einer Vorlage in H. Hinghofer-Szalkay: Praktische Physiologie, 3. Aufl. Blackwell Berlin 1994
Wasser wird im Nephron zu ~99% der glomerulär filtrierten Menge, Glucose vollständig rückresorbiert.
Inulin wird nicht rückresorbiert (~100-fach im Endharn konzentriert,
seine Clearance entspricht etwa der GFR); PAH wird zusätzlich tubulär
sezerniert (die Clearance entspricht fast der Plasmaströmung durch die Nieren, d.h. dem RPF-Wert)
 Als Filtrationsfraktion (FF) bezeichnet man denjenigen Anteil des die Nieren durchströmenden Plasmas (RPF), der glomerulär
filtriert wird (GFR). Normalerweise beträgt dieser Anteil ~20% des RPF.
Als Filtrationsfraktion (FF) bezeichnet man denjenigen Anteil des die Nieren durchströmenden Plasmas (RPF), der glomerulär
filtriert wird (GFR). Normalerweise beträgt dieser Anteil ~20% des RPF.
 Der
RPF einer Patientin beträgt 600 ml/min und ihre GFR 84 ml/min. Wie groß
ist die Filtrationsfraktion? - Sie beträgt 0,14 oder 14% (84 / 600).
Der
RPF einer Patientin beträgt 600 ml/min und ihre GFR 84 ml/min. Wie groß
ist die Filtrationsfraktion? - Sie beträgt 0,14 oder 14% (84 / 600).
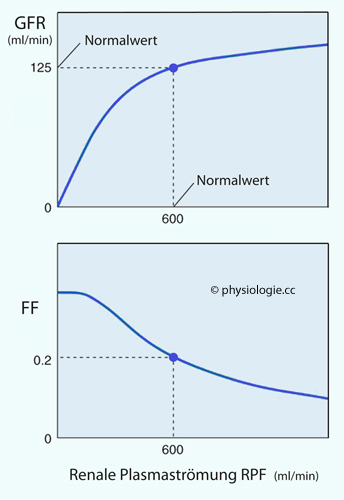
 Abbildung: Glomeruläre Filtration und Filtrationsfraktion als Funktion der renalen Plasmaströmung
Abbildung: Glomeruläre Filtration und Filtrationsfraktion als Funktion der renalen Plasmaströmung
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Der Normalwert
der Plasmaströmung durch beide Nieren (RPF) beträgt etwa 600 ml/min.
Niedrigere Werte senken den Betrag der Filtration (oben) und erhöhen
die Filtrationsfraktion (unten)

Eine Besonderheit des renalen Gefäßsystems liegt darin, dass sowohl
zwei Strömungswiderstände (in vas afferens und efferens) als auch zwei
Kapillarbette (Glomerulum, peritubuläre Kapillaren) nacheinander
angeordnet sind. Daraus ergeben sich mehrere Konsequenzen:
 Der
kombinierte Gefäßwiderstand vas afferens und efferens (die in Serie
liegen) bestimmt den gesamten Strömungswiderstand und damit die
Durchblutung eines Nephrons.
Der
kombinierte Gefäßwiderstand vas afferens und efferens (die in Serie
liegen) bestimmt den gesamten Strömungswiderstand und damit die
Durchblutung eines Nephrons.
 Der Filtrationsdruck im Glomerulum ist relativ hoch, derjenige in den vasa recte niedrig.
Der Filtrationsdruck im Glomerulum ist relativ hoch, derjenige in den vasa recte niedrig.
 Die
Balance zwischen den beiden Widerständen steuert sowohl den
Filtrationsanteil (
Die
Balance zwischen den beiden Widerständen steuert sowohl den
Filtrationsanteil ( Abbildung) als auch die tubuläre Rückresorption.
Abbildung) als auch die tubuläre Rückresorption.
 Mit zunehmender Nierendurchblutung (bzw. RPF)
nimmt die Filtrationsleistung zu (steigendes Flüssigkeitsangebot), die
Filtrationsfraktion hingegen ab, weil diese bei höheren
Durchströmungswerten "gesättigt" wird (
Mit zunehmender Nierendurchblutung (bzw. RPF)
nimmt die Filtrationsleistung zu (steigendes Flüssigkeitsangebot), die
Filtrationsfraktion hingegen ab, weil diese bei höheren
Durchströmungswerten "gesättigt" wird ( Abbildung).
Abbildung).
Wird ein filtrierter Stoff
nicht im selben Ausmaß wie Wasser rückresorbiert, reichert er sich im Nephron an,
seine Konzentration nimmt hier zu. Kreatinin oder Inulin werden gar nicht rückresorbiert; ihre Clearance erlaubt die Abschätzung der
glomerulären Filtrationsleistung (GFR).
Die renale Natriumausscheidung beträgt zwischen 10 und 500 mM/d,
je nach Zufuhr (Nahrung, Getränke, somatische Umbauvorgänge) und
allfälligen Verlusten (Schweiss). Die gesunde Niere kann diese große Regulationsspanne bei gleichbleibendem extrazellulären Volumen bewältigen.
Wie die Durchblutung der Nieren gesteuert wird
Die
Autoregulation der renalen Durchblutung erfolgt über einen weiten
Blutdruckbereich (untere Grenze 70-80, obere 180-200 mmHg), innerhalb dessen die
renale Perfusion praktisch konstant bleibt.
Normalerweise werden ~99% der glomerulär filtrierten Flüssigkeitsmenge tubulär wieder
rückresorbiert (s. Abbildung unten), ~1% verbleibt letztlich im Harn. Die Rückresorption von Wasser erfolgt über den
Transport von Salzen (osmotische Gradienten) teils parazellulär, teils
transzellulär.
Voraussetzung für die normalen Funktionsmuster ist die besondere
Struktur der Nierengefäße, die nacheinander geschaltete Widerstands-
und Austauschgefäße aufweisen:
 Zur Autoregulation der renalen Perfusion s. dort
Zur Autoregulation der renalen Perfusion s. dort
Druckdiurese. Der Filtrationsfraktion-Prozentsatz sinkt mit abnehmendem Blutdruck (<70 mmHg, bei
extremer Hypotonie kann die glomeruläre Filtration zum Erliegen
kommen), umgekehrt führt hoher Blutdruck zu
"Druckdiurese": Die Autoregulation der Durchblutung im Nierenmark schafft es nicht mehr, den osmotischen Gradienten
voll aufrechtzuerhalten ("Auswaschen"), die Konzentrierungsfähigkeit
nimmt ab und das Harnvolumen zu. Damit steigt auch die
Kochsalzausscheidung, das Plasmavolumen sinkt, und letztlich auch der
Blutdruck.
Funktioniert dieser Mechanismus nicht, kann arterielle Hypertonie auftreten.
Die
Autoregulation der renalen Perfusion beruht wohl auf mehreren
Mechanismen, die über die Adjustierung des arteriolären
Widerstandes in der Niere - vermutlich (vor allem) der vasa afferentia - funktionieren. Nach der myogenen Hypothese läuft das über dehnungsabhängige Calciumkanäle: Werden die
Arteriolen durch Blutdruckanstieg geweitet, strömt vermehrt Ca++
in die Muskelzellen in den Gefäßwänden ein, und sie kontrahieren - der
Strömungswiderstand steigt in einem Maße, das die Durchblutung
ausbalanciert und unverändert lässt. Auch nach dem Erklärungsmodell der tubuloglomerulären Rückkopplung spielt der Einstrom von Ca++
in arterioläre Myozyten eine Schlüsselrolle:
Tubulo-glomeruläres Feedback (TGF)


Abbildung: Tubulo-glomeruläres Feedback
Nach einer Vorlage bei Silverthorn, Human Physiology - an integrated approach, 4th ed. Pearson International 2007
Erhöhte
glomeruläre Filtration (1) wird durch Verengung des vas afferens
gegenreguliert: Nimmt die Strömung im distalen Tubulus zu (2, 3),
verbringen Na/2Cl/K-Cotransporter vermehrt Na+- und Cl--Ionen
in Zellen der macula densa. Chloridionen depolarisieren die
basolaterale Membran der macula-densa-Zellen; Ca++-Kanäle öffnen,
Calciumionen strömen in die Zelle ein.
Das
triggert die Freisetzung von Adenosin (4) aus den macula-densa-Zellen, das
lokal (parakrin) zu Verengung afferenter Arteriolen (vasa afferentia)
führt (5) und so insgesamt die renale Perfusion (RBF) und Filtration (GFR) stabilisiert

Der
proximale Tubulus resorbiert u.a. ~65% der glomerulär filtrierten Menge an Wasser und Kochsalz. Tubulo-glomeruläre Rückkopplung (tubulo-glomerular feedback TGF) stabilisiert die Salz- und Wasser- Ausscheidung der Niere: Die Filtrationsleistung steht in Relation zur Kochsalzmenge, die (im distalen Tubulus) am Glomerulus vorbeiströmt (sodium load).
Die Nähe zum vas afferens spielt eine entscheidende Rolle,
denn dieses steuert die Filtrationsgröße des Glomerulum. Auf diese
Weise wird die Perfusion der Glomeruli rasch (Sekundenbereich) und kurzfristig reguliert.
Der (furosemidsensitive) Na/K/2Cl-Cotransporter (NK2Cl cotransporter, NKCC2)
transportiert Ionen konzentrationsabhängig in die Zelle. Dabei spielt die Chloridkonzentration den hauptsächlich steuernden Effekt, da diese im Tubulus 20-60 mM/l beträgt und der Na+/K+/2Cl--Symporter bei einem [Cl-] von ~40 mM halbmaximal angeregt ist. (Für Na+ liegt die halbmaximale Aktivierung des Symporters bei nur 2-3 mM, d.h. der Transporter ist ohnehin immer natriumaktiviert, Na+-Konzentrationsschwankungen ändern seine Kapazität nicht.)
Steigerung der golumerulären Filtration
führt dazu, dass mehr Salz durch die
Henle-Schleife gelangt und zur macula densa gelangt. Mit
steigender Salzbelastung setzen die macula-densa-Zellen basolateral ATP
frei, das durch lokale Enzyme zu Adenosin umgewandelt wird. Dieses führt über
Wirkung an purinergen Rezeptoren (P2) zu Freisetzung von Ca++
und Kontraktion der glatten Muskelzellen in der Wand des betreffenden vas afferens (gap junctions zwischen ihnen verbreiten das
Signal).
Die
Kontraktion des vas afferens limitiert die glomeruläre Filtration,
reduziert damit auch die Kochsalzbelastung (negative Rückkopplung) und stabilisiert glomeruläre Durchblutung und Filtration.
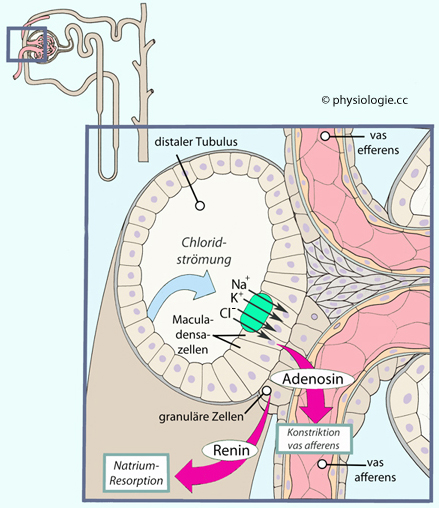
 Abbildung: Macula densa als Strömungsrezeptor
Nach einer Vorlage in Danzinger / Zeidel / Parker:
Renal Physiology - A Clinical Approach. Wolters Kluwer / Lippincott
Williams & Wilkins 2012
Abbildung: Macula densa als Strömungsrezeptor
Nach einer Vorlage in Danzinger / Zeidel / Parker:
Renal Physiology - A Clinical Approach. Wolters Kluwer / Lippincott
Williams & Wilkins 2012
Zunahme der Strömung - insbesondere des
Einstroms von Chloridionen über einen nierenspezifischen Na/K/2Cl-Cotransporter (grün) -
veranlasst Zellen der macula densa im frühdistalen Tubulus zur lokalen
Freisetzung von Adenosin. Dieses bewirkt in Sekundenschnelle eine
Erhöhung des Tonus des vas afferens und reduziert dadurch Druck und
Strömung im Glomerulum.
Über mehrere Minuten anhaltende Reduktion der Strömung im Tubulus beantworten granuläre Zellen mit der Freisetzung von Renin.
Dieses triggert die Bildung von Angiotensin (Vasokonstriktion) und
Aldosteron (Konservierung von Kochsalz); beides stabilisiert den
Kreislauf, erhöht den Blutdruck und stärkt die glomeruläre Filtration
 Der tubulo-glomeruläre Mechanismus umfasst also folgende Schritte:
Der tubulo-glomeruläre Mechanismus umfasst also folgende Schritte:
1. Steigender arterieller Druck erhöht Perfusion und glomeruläre Filtration
2. Erhöhte glomeruläre Filtration steigert das tubuläre Kochsalz- und Wasserangebot an die Zellen der macula densa
3. Zellen der macula densa lagern vermehrt Na und Cl ein (via apikale Na/K/2Cl-Cotransporter)
4. Steigende intrazelluläre Chloridkonzentration depolarisiert (über basolaterale Chloridkanäle) die Zelle
5. Die Depolarisation öffnet basolaterale (nichtselektive) Kationenkanäle, Ca++ strömt in die Zelle ein...
6. ...das aktiviert die Freisetzung von Adenosin (und ATP, das zu Adenosin wird)
7. Adenosin wirkt parakrin: Es bindet an A1-Rezeptoren, glatte Muskelzellen im vas afferens kontrahieren
8. Kontraktion des vas afferens senkt die glomeruläre Filtration (negatives Feedback zu Punkt 1)
 Apikale
Apikale /
basolaterale Membran s.
dort
Diese Vorstellung von der Funktionsweise des tubulo-glomerulären Feedbacks zeigt das folgende Bild:
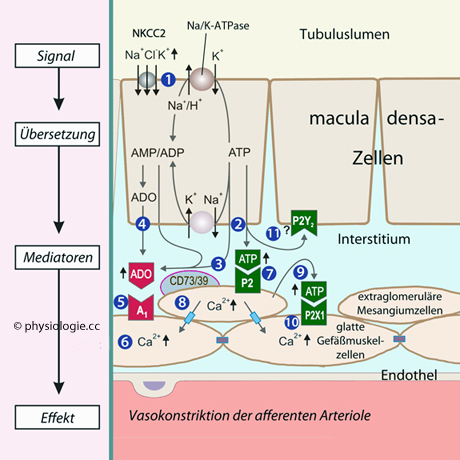

Abbildung: Tubulo-glomeruläres Feedback (Macula-densa-Mechanismus)
Modifiziert nach
Vallon V, Unwin R, Inscho EW, Leipziger J, Kishore BK. Extracellular
Nucleotides and P2 Receptors in Renal Function. Physiol Rev 2020; 100:
211-69
Erhöhte glomeruläre Filtration und damit Kochsalz-Last wird durch Verengung des vas afferens gegenreguliert.
1: Na/K/2Cl-Cotransporter
(NKCC2, Furosemid-sensitiv) in der apikalen Membran von
macula-densa-Zellen steigern konzentrationsabhängig die Aufnahme von Na+, K+ und Cl- ; Na/K-Pumpen befördern Natrium in den Extrazellulärraum
2: An der basolateralen Membran wird sowohl Adenosin (aus ATP-Abbau) als auch ATP in das Interstitium freigesetzt
3, 4: Adenosin (ADO) wird intra- und extrazellulär gebildet, die
extrazelluläre Bildung involviert lokale Enzyme (CD39 und CD73:
Ektonukleosid-Triphosphat-Diphosphohydrolase 1, 5'-Nukleotidase)
5, 6, 8-10: Adenosin aktiviert A1-Adenosinrezeptoren, das erhöht [Ca++]
in extraglomerulären Mesangiumzellen und glatten Muskelzellen in vasa
afferentia, was zu deren Konstriktion führt. Das Calciumsignal wird über gap junctions fortgeleitet
7, 11: extrazelluläres ATP aktiviert P2-Rezeptoren, auch an der basolateralen Membran von macula densa-Zellen (Funktion noch unklar)

 Der Tonus der vasa afferentia ist proportional der Kochsalzpassage an der macula densa. Der sich daraus ergebende Rückkopplungsmechanismus stabilisiert die Filtration auf einem Mittelwert:
Der Tonus der vasa afferentia ist proportional der Kochsalzpassage an der macula densa. Der sich daraus ergebende Rückkopplungsmechanismus stabilisiert die Filtration auf einem Mittelwert:

 Steigt
die Salzmenge
(starke glomeruläre Filtration),
kontrahiert
sich das vas afferens, und die Filtration in das
betreffende Nephron nimmt ab.
Steigt
die Salzmenge
(starke glomeruläre Filtration),
kontrahiert
sich das vas afferens, und die Filtration in das
betreffende Nephron nimmt ab.
 Umgekehrt kommt es bei sinkender Salzbelastung zu Vasodilatation des vas afferens, was Kapillardruck und Filtration steigert.
Umgekehrt kommt es bei sinkender Salzbelastung zu Vasodilatation des vas afferens, was Kapillardruck und Filtration steigert.
Erhöhte Kochsalzkonzentration im distalen Tubulus führt über Adenosin zu Kontraktion des vas afferens.
 Das
optimiert die Verteilung der Durchblutung auf die einzelnen Nephrone
und schützt die Niere insgesamt vor überhöhtem Perfusionsdruck.
Das
optimiert die Verteilung der Durchblutung auf die einzelnen Nephrone
und schützt die Niere insgesamt vor überhöhtem Perfusionsdruck.
Der TGF-Mechanismus ist durch Faktoren wie extrazelluläres Flüssigkeitsvolumen
(EZV) und Eiweißzufuhr beeinflussbar. So sinkt die Empfindlichkeit der
macula densa mit zunehmendem extrazellulären Flüssigkeitsvolumen
(EZV), was die Volumenausscheidung fördert
(und nimmt umgekehrt mit abnehmendem EZV zu, wodurch das extrazelluläre
Volumen konserviert wird). Dieser Effekt steht möglicherweise unter dem
Einfluss von Angiotensin II, das ein wesentlicher Bestandteil des
tubulo-glomerulären Rückkopplungssystems ist.
 Mehrere Faktoren beeinflussen die Empfindlichkeit des tubulo-glomerulären Feedback (Volumenexpansion, proteinreiche Diät, atriale natriuretische Peptide).
Mehrere Faktoren beeinflussen die Empfindlichkeit des tubulo-glomerulären Feedback (Volumenexpansion, proteinreiche Diät, atriale natriuretische Peptide).
 So sinkt die Empfindlichkeit der
macula densa mit zunehmendem extrazellulären Flüssigkeitsvolumen
(EZV), was die Volumenausscheidung fördert
(und nimmt umgekehrt mit abnehmendem EZV zu, wodurch das extrazelluläre
Volumen konserviert wird). Dieser Effekt steht möglicherweise unter dem
Einfluss von Angiotensin II, das ein wesentlicher Bestandteil des
tubulo-glomerulären Rückkopplungssystems ist: Es wirkt sowohl auf afferente als auch efferente Arteriolen und steigert
den renalen Gefäßwiderstand bei gleichzeitiger Stabilisierung des
Filtrationsdrucks im Glomerulum.
So sinkt die Empfindlichkeit der
macula densa mit zunehmendem extrazellulären Flüssigkeitsvolumen
(EZV), was die Volumenausscheidung fördert
(und nimmt umgekehrt mit abnehmendem EZV zu, wodurch das extrazelluläre
Volumen konserviert wird). Dieser Effekt steht möglicherweise unter dem
Einfluss von Angiotensin II, das ein wesentlicher Bestandteil des
tubulo-glomerulären Rückkopplungssystems ist: Es wirkt sowohl auf afferente als auch efferente Arteriolen und steigert
den renalen Gefäßwiderstand bei gleichzeitiger Stabilisierung des
Filtrationsdrucks im Glomerulum.
 Intensive Proteinzufuhr
("Sportlerdiät") kann den TGF-Mechanismus abschwächen und dadurch
glomeruläre Filtration und renale Durchblutung erhöhen. "Proteinmast"
kann so zu verstärkter glomerulärer Belastung und fallweise Schädigung
führen.
Intensive Proteinzufuhr
("Sportlerdiät") kann den TGF-Mechanismus abschwächen und dadurch
glomeruläre Filtration und renale Durchblutung erhöhen. "Proteinmast"
kann so zu verstärkter glomerulärer Belastung und fallweise Schädigung
führen.
 Atriale natriuretische Peptide relaxieren renale Gefäße; sie erhöhen die renale Perfusion und die Harnproduktion.
Atriale natriuretische Peptide relaxieren renale Gefäße; sie erhöhen die renale Perfusion und die Harnproduktion.
Sympathische Efferenzen zur
Niere kontrahieren vor allem vasa efferentia, dadurch stabilisieren sie
den Blutdruck bei gleichzeitiger Unterstützung der glomerulären
Filtration.
Wie wird die Reninsekretion reguliert?
Die Reninfreisetzung ist der
limitierende Schritt der Renin-Angiotensin-Aldosteron-Kaskade. Schon
eine geringe Senkung des arteriellen Drucks (wie z.B. beim
Aufrichten des Körpers aus Liegeposition) stimuliert vermehrte Reninwirkung. Die Freisetzung von
Renin 
aus
juxtaglomerulären Zellen unterliegt hauptsächlich der Kontrolle durch folgende Regulationspfade und
erfolgt in einem langsameren Zeitrahmen (Minuten bis Stunden).

Die Regulierung der Reninfreisetzung erfolgt über die Kochsalzlast
an der macula densa, renale Barorezeptoren und über sympathische
Impulse:
 Zellen der macula densa (
Zellen der macula densa ( Abbildung) nehmen Kochsalz apikal über den Na+/K+/2Cl--Symporter aus dem Tubulus auf. Die Intensität dieser Transportleistung übersetzt sich in mehrere Steuersignale für die Reninfreisetzung:
Abbildung) nehmen Kochsalz apikal über den Na+/K+/2Cl--Symporter aus dem Tubulus auf. Die Intensität dieser Transportleistung übersetzt sich in mehrere Steuersignale für die Reninfreisetzung:
 Erhöhte Kochsalzlast hemmt, erniedrigte aktiviert die Reninfreisetzung. Das entscheidende Signal für die Zellen der macula densa ist also die
Geschwindigkeit, mit der sie von NaCl durchströmt werden, nicht die
NaCl-Konzentration an sich.
Erhöhte Kochsalzlast hemmt, erniedrigte aktiviert die Reninfreisetzung. Das entscheidende Signal für die Zellen der macula densa ist also die
Geschwindigkeit, mit der sie von NaCl durchströmt werden, nicht die
NaCl-Konzentration an sich.

 Abbildung: Steuerung der Reninfreisetzung
Nach einer Vorlage in Hilal-Dandan / Brunton, Goodman
& Gilman's Manual of Pharmacology and Therapeutics, 2nd ed., McGraw
Hill Education 2014
Abbildung: Steuerung der Reninfreisetzung
Nach einer Vorlage in Hilal-Dandan / Brunton, Goodman
& Gilman's Manual of Pharmacology and Therapeutics, 2nd ed., McGraw
Hill Education 2014
Nimmt die Salzzufuhr ab,
steigt die Produktion von Prostaglandinen in macula-densa-Zellen. Diese
regen an juxtaglomerulären Zellen - wie auch Katecholamine - die
Bildung von cAMP und damit die Reninfreisetzung an.
Steigt die Salzzufuhr, verbrauchen macula-densa-Zellen mehr ATP
(Na/K-Pumpe) und es entsteht mehr Adenosin, das die Reninproduktion der
juxtaglomerulären Zellen hemmt.
ATP kann auch direkt (über purinerge Rezeptoren und intrazellulären Ca++-Anstieg) die Reninfreisetzung dämpfen. Ähnlich wirkt Angiotensin II.
A1-R, Adenosinrezeptor  AC, Adenylatzyklase
AC, Adenylatzyklase  AT1-R, Angiotensinrezeptor
AT1-R, Angiotensinrezeptor  ß1-R, adrenerger Beta-1-Rezeptor
ß1-R, adrenerger Beta-1-Rezeptor  COX-2, Zyklooxygenase-2
COX-2, Zyklooxygenase-2  G, G-Protein
G, G-Protein  nNOS, neuronale NO-Synthase
nNOS, neuronale NO-Synthase  P2Y-R, purinerger Rezeptor
P2Y-R, purinerger Rezeptor  PG-R, Prostaglandinrezeptor
PG-R, Prostaglandinrezeptor  PLC, Phospholipase C
PLC, Phospholipase C

 Steigender tubulärer Antransport von NaCl erhöht via ATP-Verbrauch die Produktion von Adenosin,
das über einen Nukleosid-Transporter in den Extrazellulärraum gelangt
und parakrin an den juxtaglomerulären Zellen - über Adenosinrezeptoren
und Gi-Proteine - die Bildung von cAMP und damit die Reninfreisetzung hemmt.
Steigender tubulärer Antransport von NaCl erhöht via ATP-Verbrauch die Produktion von Adenosin,
das über einen Nukleosid-Transporter in den Extrazellulärraum gelangt
und parakrin an den juxtaglomerulären Zellen - über Adenosinrezeptoren
und Gi-Proteine - die Bildung von cAMP und damit die Reninfreisetzung hemmt.
 ATP wird dabei von macula-densa-Zellen freigesetzt und steigert über P2Y-Rezeptoren, Gq-Proteine, Phospholipase C und Inositolphosphat den Ca++-Spiegel in der juxtaglomerulären Zelle. Der erhöhte Ca++-Spiegel hemmt die Reninfreisetzung (was außergewöhnlich ist, ähnlich wie in Epithelkörperchenzellen der Schilddrüse, wo ansteigendes intrazelluläres [Ca++] die Sekretion von Parathormon hemmt).
ATP wird dabei von macula-densa-Zellen freigesetzt und steigert über P2Y-Rezeptoren, Gq-Proteine, Phospholipase C und Inositolphosphat den Ca++-Spiegel in der juxtaglomerulären Zelle. Der erhöhte Ca++-Spiegel hemmt die Reninfreisetzung (was außergewöhnlich ist, ähnlich wie in Epithelkörperchenzellen der Schilddrüse, wo ansteigendes intrazelluläres [Ca++] die Sekretion von Parathormon hemmt).
 Vermehrter tubulärer Antransport von NaCl bremst in macula-densa-Zellen weiters die Bildung (über Zyklooxygenase 2) von Prostaglandinen (PGE2, PGI2), die in juxtaglomerulären Zellen über Prostaglandinrezeptoren, Gs-Proteine, Adenylatzyklase und cAMP die Reninsekretion anregen würden.
Vermehrter tubulärer Antransport von NaCl bremst in macula-densa-Zellen weiters die Bildung (über Zyklooxygenase 2) von Prostaglandinen (PGE2, PGI2), die in juxtaglomerulären Zellen über Prostaglandinrezeptoren, Gs-Proteine, Adenylatzyklase und cAMP die Reninsekretion anregen würden.
 Steigende Druck- bzw. Perfusionswerte im präglomerulären Gefäßbereich
hemmen die Reninfreisetzung (und umgekehrt) - wahrscheinlich
über Dehnungssignale in der Wand des vas afferens (intrarenaler Barorezeptor). Dies könnte über
Prostaglandine mediiert sein.
Steigende Druck- bzw. Perfusionswerte im präglomerulären Gefäßbereich
hemmen die Reninfreisetzung (und umgekehrt) - wahrscheinlich
über Dehnungssignale in der Wand des vas afferens (intrarenaler Barorezeptor). Dies könnte über
Prostaglandine mediiert sein.
 ß1-adrenerge Rezeptoren wirken bei sympathischer Aktivität wie Prostaglandine über Gs-Proteine, Adenylatzyklase und cAMP anregend auf die Reninsekretion.
ß1-adrenerge Rezeptoren wirken bei sympathischer Aktivität wie Prostaglandine über Gs-Proteine, Adenylatzyklase und cAMP anregend auf die Reninsekretion.
Weitere regulierende Faktoren
Dazu kommt die Veränderung der für den transkapillären Flüssigkeitsaustausch relevanten Kräfte infolge der Filtration: Je
stärker ein Glomerulus filtriert, desto mehr nimmt die zurückbleibende
Plasmamenge und damit der Kapillardruck ab,
gleichzeitig wird das zurückbleibende Plasmaprotein konzentriert, der
kolloidosmotische Druck nimmt zu. Auf diese Weise steigt automatisch
die Rückresorption von Flüssigkeit in diesem Nephron (verändertes Starling-Gleichgewicht).

Zur
Durchblutung der Nieren und deren Messung (
RPF) s.
dort
 Prostaglandine (PGE2, PGI2) erhöhen renale
Perfusion (wie auch Dopamin) und glomeruläre Filtration. Wird die Prostaglandinsynthese in der Niere unterdrückt, sinkt die Nierendurchblutung.
Prostaglandine (PGE2, PGI2) erhöhen renale
Perfusion (wie auch Dopamin) und glomeruläre Filtration. Wird die Prostaglandinsynthese in der Niere unterdrückt, sinkt die Nierendurchblutung.
 Natriuretisch wirken Bradykinin (hemmt wie Prostaglandine ENaC-Kanäle), Dopamin (wirkt lokal vasodilatatorisch und damit natriuretisch), und nicht zuletzt natriuretische Peptide.
Natriuretisch wirken Bradykinin (hemmt wie Prostaglandine ENaC-Kanäle), Dopamin (wirkt lokal vasodilatatorisch und damit natriuretisch), und nicht zuletzt natriuretische Peptide.
Die Bestimmung der GFR kann einen Hinweis auf beginnende
pathologische Veränderungen der Niere geben - die meisten
Nierenerkrankungen schädigen zunächst die Glomeruli (z.B.
Glomerulonephritis). Blutwerte (Kreatinin, Harnstoff)
steigen erst bei starkem renalem Funktionsverlust deutlich an.
Viele
Nierenerkrankungen (Nephrosen)
gehen mit einer Abnahme der glomerulären Filtration einher. Das führt
zu Retention harnpflichtiger Substanzen und Anstieg der entsprechenden
Blutwerte (z.B. Ammonium, Harnstoff, Harnsäure, Kalium - Urämie  ). Besonders kennzeichnend ist der Anstieg der Kreatininwerte, die Kreatininclearance kennzeichnet die glomeruläre Filtrationsleistung. (Die Kreatininausscheidung erlaubt normalerweise eine Abschätzung der Muskelmasse.)
). Besonders kennzeichnend ist der Anstieg der Kreatininwerte, die Kreatininclearance kennzeichnet die glomeruläre Filtrationsleistung. (Die Kreatininausscheidung erlaubt normalerweise eine Abschätzung der Muskelmasse.)
Weiters können die Kapillaren ihre
Siebwirkung verlieren, und es wird so viel Eiweiß filtriert, dass es von den
Tubuluszellen nicht rückgewonnen werden kann und im Harn erscheint
(Proteinurie).


 Die glomeruläre
Filterfläche einer Niere beträgt ~1 m2. Die "Filtermatte" der Glomeruli ist dreilagig: Endothel, Basalmembran und Podozyten; Podozyten und Basalmembran bestimmen gemeinsam die Permeabilität gegenüber Plasmaproteinen. Die
glomerulären Kapillarwände sind fenestriert, die Lücken haben ~70 nm
Durchmesser (blockieren den Durchtritt von Blutkörperchen). Wenn Mesangiumzellen kontrahieren (vasoaktive Substanzen wie Vasopressin), sinkt der Filtrationskoeffizient. Das
Ausmaß der Filtration eines Stoffes hängt von seiner Größe, Ladung,
Form und Verformbarkeit ab. Der hydrostatische Druck beträgt am Beginn der Glomerulumkapillare
~55 mmHg, am Ende
~50
mmHg. Gegenkräfte sind der hydrostatische Druck in der Glomerulumkapsel
(~15 mmHg) und der onkotische Effekt des Blutplasmas (~25-30 mmHg), der
durch die Filtration auf ~40 mmHg ansteigt, bis der effektive
Filtrationsdruck (im Mittel ~10 mmHg) Null beträgt (Filtrationsäquilibrium) Die glomeruläre
Filterfläche einer Niere beträgt ~1 m2. Die "Filtermatte" der Glomeruli ist dreilagig: Endothel, Basalmembran und Podozyten; Podozyten und Basalmembran bestimmen gemeinsam die Permeabilität gegenüber Plasmaproteinen. Die
glomerulären Kapillarwände sind fenestriert, die Lücken haben ~70 nm
Durchmesser (blockieren den Durchtritt von Blutkörperchen). Wenn Mesangiumzellen kontrahieren (vasoaktive Substanzen wie Vasopressin), sinkt der Filtrationskoeffizient. Das
Ausmaß der Filtration eines Stoffes hängt von seiner Größe, Ladung,
Form und Verformbarkeit ab. Der hydrostatische Druck beträgt am Beginn der Glomerulumkapillare
~55 mmHg, am Ende
~50
mmHg. Gegenkräfte sind der hydrostatische Druck in der Glomerulumkapsel
(~15 mmHg) und der onkotische Effekt des Blutplasmas (~25-30 mmHg), der
durch die Filtration auf ~40 mmHg ansteigt, bis der effektive
Filtrationsdruck (im Mittel ~10 mmHg) Null beträgt (Filtrationsäquilibrium)
 Der
Siebkoeffizient (S) ist definiert als die Konzentration eines Stoffes
im Filtrat (Kf) in Relation zur Konzentration im Blutplasma (Kp): S
= Kf / Kp. Ist sein Betrag 1, werden Teilchen frei filtriert, beträgt
er 0, gelangen sie nicht in das Filtrat (Albumin: Siebkoeffizient <1%). Durch fingerförmige Podozytenfortsätze gebildete "Filtrationsschlitze" (Spaltenbreite 4-25 nm) erlauben den Durchtritt des Filtrats in den Bowman-Raum. Der eigentliche Filter ist die Basalmembran zwischen Endothel und Podozyten: Der effektive
Porenradius beträgt 1,5-4,5 nm. Mit zunehmender Molekülgröße nimmt die Fraktion
filtrierten Stoffs ab (bei ~70 kDa praktisch Null). Von ~35.000 g Albumin, die an einem Tag die Glomeruli passieren, werden 0,15-0,2
g filtriert, 90% davon im Tubulus endozytiert, 15-20 mg/d erscheinen im
Harn. Kleinere Proteine (bis 45 kD) filtrieren die Glomeruli zu ≤80%,
ihr Anteil im Harn beträgt 50-80 mg/d. An Eiweiß gebundene
Moleküle sind der Filtration entzogen. Negativ geladene Moleküle
gelangen schwerer durch die Filtrationsbarriere als positiv geladene
(negativ geladene Proteoglykane der Basalmembran, negativ geladene
Glykokalix) Der
Siebkoeffizient (S) ist definiert als die Konzentration eines Stoffes
im Filtrat (Kf) in Relation zur Konzentration im Blutplasma (Kp): S
= Kf / Kp. Ist sein Betrag 1, werden Teilchen frei filtriert, beträgt
er 0, gelangen sie nicht in das Filtrat (Albumin: Siebkoeffizient <1%). Durch fingerförmige Podozytenfortsätze gebildete "Filtrationsschlitze" (Spaltenbreite 4-25 nm) erlauben den Durchtritt des Filtrats in den Bowman-Raum. Der eigentliche Filter ist die Basalmembran zwischen Endothel und Podozyten: Der effektive
Porenradius beträgt 1,5-4,5 nm. Mit zunehmender Molekülgröße nimmt die Fraktion
filtrierten Stoffs ab (bei ~70 kDa praktisch Null). Von ~35.000 g Albumin, die an einem Tag die Glomeruli passieren, werden 0,15-0,2
g filtriert, 90% davon im Tubulus endozytiert, 15-20 mg/d erscheinen im
Harn. Kleinere Proteine (bis 45 kD) filtrieren die Glomeruli zu ≤80%,
ihr Anteil im Harn beträgt 50-80 mg/d. An Eiweiß gebundene
Moleküle sind der Filtration entzogen. Negativ geladene Moleküle
gelangen schwerer durch die Filtrationsbarriere als positiv geladene
(negativ geladene Proteoglykane der Basalmembran, negativ geladene
Glykokalix)
 Der
juxtaglomeruläre Apparat besteht aus Teilen des vas afferens
(reninbildende Myozyten), Beginn des vas efferens, und der macula
densa, einem hochepithelialen Teil des frühen distalen Tubulus; er
stabilisiert das Gleichgewicht zwischen Filtration und Rückresorption
im Nephron. Macula-densa-Zellen reagieren auf reduzierte tubuläre
Strömung (deutet auf reduzierte Flüssigkeitsreserven im Körper hin) mit
Reninfreisetzung aus dem vas afferens. Steigender
tubulärer Antransport von NaCl erhöht die Produktion von Adenosin, das
parakrin an den juxtaglomerulären Zellen die Reninfreisetzung hemmt: Erhöhte Kochsalzlast bremst, erniedrigte aktiviert die Reninfreisetzung. Renin stimuliert das
Renin-Angiotensin-Aldosteron- System, das Kochsalz und damit Wasser
zurückhält, Blutdruck und Kreislauf stabilisiert. Renin triggert
die Bildung von Angiotensin (Vasokonstriktion) und Aldosteron
(Konservierung von Kochsalz); beides erhöht
den Blutdruck und stärkt die glomeruläre Filtration Der
juxtaglomeruläre Apparat besteht aus Teilen des vas afferens
(reninbildende Myozyten), Beginn des vas efferens, und der macula
densa, einem hochepithelialen Teil des frühen distalen Tubulus; er
stabilisiert das Gleichgewicht zwischen Filtration und Rückresorption
im Nephron. Macula-densa-Zellen reagieren auf reduzierte tubuläre
Strömung (deutet auf reduzierte Flüssigkeitsreserven im Körper hin) mit
Reninfreisetzung aus dem vas afferens. Steigender
tubulärer Antransport von NaCl erhöht die Produktion von Adenosin, das
parakrin an den juxtaglomerulären Zellen die Reninfreisetzung hemmt: Erhöhte Kochsalzlast bremst, erniedrigte aktiviert die Reninfreisetzung. Renin stimuliert das
Renin-Angiotensin-Aldosteron- System, das Kochsalz und damit Wasser
zurückhält, Blutdruck und Kreislauf stabilisiert. Renin triggert
die Bildung von Angiotensin (Vasokonstriktion) und Aldosteron
(Konservierung von Kochsalz); beides erhöht
den Blutdruck und stärkt die glomeruläre Filtration
 Filtrationsfraktion
(FF) ist der Anteil des die Nieren durchströmenden Plasmas (RPF), der
glomerulär filtriert wird (GFR). Normalerweise beträgt die FF ~20% des
RPF. Im Autoregulationsbereich (80-180 mmHg) ist die Filtrationsfraktion ziemlich konstant, <70
mmHg nimmt er ab, bei extremer Hypotonie kann die glomeruläre Filtration zum
Erliegen kommen. Der Tonus der
vasa afferentia ist proportional der Kochsalzpassage an der macula
densa (die Natriumausscheidung beträgt zwischen 10 und 500 mM/d). Steigt die Salzmenge (starke glomeruläre Filtration),
kontrahiert sich das vas afferens, und die Filtration in das
betreffende Nephron nimmt ab. Umgekehrt dilatiert das vas afferens bei
sinkender Salzbelastung, Kapillardruck und Filtration steigen an Filtrationsfraktion
(FF) ist der Anteil des die Nieren durchströmenden Plasmas (RPF), der
glomerulär filtriert wird (GFR). Normalerweise beträgt die FF ~20% des
RPF. Im Autoregulationsbereich (80-180 mmHg) ist die Filtrationsfraktion ziemlich konstant, <70
mmHg nimmt er ab, bei extremer Hypotonie kann die glomeruläre Filtration zum
Erliegen kommen. Der Tonus der
vasa afferentia ist proportional der Kochsalzpassage an der macula
densa (die Natriumausscheidung beträgt zwischen 10 und 500 mM/d). Steigt die Salzmenge (starke glomeruläre Filtration),
kontrahiert sich das vas afferens, und die Filtration in das
betreffende Nephron nimmt ab. Umgekehrt dilatiert das vas afferens bei
sinkender Salzbelastung, Kapillardruck und Filtration steigen an
|

 Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.
Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.





 Glomeruläre Filtration und tubulo-glomeruläre Balance
Glomeruläre Filtration und tubulo-glomeruläre Balance
 Bowman-Kapsel: William Bowman
Bowman-Kapsel: William Bowman  Filtration
Filtration  Vas afferens vs. vas efferens
Vas afferens vs. vas efferens  Durchblutung, Druckdiurese, Natriumausscheidung
Durchblutung, Druckdiurese, Natriumausscheidung  TGF: Tubulo-glomeruläres Feedback
TGF: Tubulo-glomeruläres Feedback  Steuerung der Reninfreisetzung
Steuerung der Reninfreisetzung
 Nephrin
Nephrin  Filtrationsfraktion
Filtrationsfraktion
 Core messages
Core messages Filtration) - pro Tag 150-200 Liter, mehr als das Zehnfache
des extrazellulären Flüssigkeitsvolumens.
Filtration) - pro Tag 150-200 Liter, mehr als das Zehnfache
des extrazellulären Flüssigkeitsvolumens. 


 Abbildung: Glomeruläre Kapillarschleife
Abbildung: Glomeruläre Kapillarschleife Das Ausmaß der Filtration
eines Stoffes hängt von seiner Größe, Ladung, Form und Verformbarkeit
ab (negative Ladung behindert die Passage wegen negativ geladener
Glykoproteine in der Wand des Siebes).
Das Ausmaß der Filtration
eines Stoffes hängt von seiner Größe, Ladung, Form und Verformbarkeit
ab (negative Ladung behindert die Passage wegen negativ geladener
Glykoproteine in der Wand des Siebes).  Der Siebkoeffizient (S) ist definiert als die Konzentration eines Stoffes im Filtrat (Kf) gebrochen durch die Konzentration im Blutplasma (Kp):
Der Siebkoeffizient (S) ist definiert als die Konzentration eines Stoffes im Filtrat (Kf) gebrochen durch die Konzentration im Blutplasma (Kp):
 Abbildung: Struktur eines Nierenkörperchens / Glomerulum
Abbildung: Struktur eines Nierenkörperchens / Glomerulum
 Abbildung unten). Albumin
wird so gut wie nicht mehr filtriert (Tabelle unten): Es ist nicht nur
mit 7 nm Durchmesser ziemlich groß, es ist auch (beim Blut-pH von 7,4)
stark negativ geladen.
Abbildung unten). Albumin
wird so gut wie nicht mehr filtriert (Tabelle unten): Es ist nicht nur
mit 7 nm Durchmesser ziemlich groß, es ist auch (beim Blut-pH von 7,4)
stark negativ geladen. Mesangiumzellen sind in das Mesangium
Mesangiumzellen sind in das Mesangium  eingebettete Makrophagen; Mesangium ist ein aus
extrazellulärem Matrixmaterial gebildeter Stiel, auf dem glomeruläre
Kapillarschlingen sitzen,
eingebettete Makrophagen; Mesangium ist ein aus
extrazellulärem Matrixmaterial gebildeter Stiel, auf dem glomeruläre
Kapillarschlingen sitzen,  s. auch dort). Mesangiumzellen werden durch vasoaktive Stoffe - inklusive Vasopressin - kontrahiert, was den kapillären Filtrationskoeffizienten und damit die glomeruläre Filtration verringert. Dehnung beantworten Mesangiumzellen mit der Freisetzung mehrerer Wachstumsfaktoren.
s. auch dort). Mesangiumzellen werden durch vasoaktive Stoffe - inklusive Vasopressin - kontrahiert, was den kapillären Filtrationskoeffizienten und damit die glomeruläre Filtration verringert. Dehnung beantworten Mesangiumzellen mit der Freisetzung mehrerer Wachstumsfaktoren.  Podozyten
Podozyten im inneren Blatt der Bowman-Kapsel
im inneren Blatt der Bowman-Kapsel  bestimmen zusammen mit der Basalmembran die Filterfunktion der Nieren: Sie bilden
mit ihren länglichen, mittels des transmembranalen Nephrin
und anderer spezieller Proteine (Abbildungen unten) verbundenen
Fortsätzen "Filtrationsschlitze" mit einer Spaltenbreite von 4 bis 20 nm.
bestimmen zusammen mit der Basalmembran die Filterfunktion der Nieren: Sie bilden
mit ihren länglichen, mittels des transmembranalen Nephrin
und anderer spezieller Proteine (Abbildungen unten) verbundenen
Fortsätzen "Filtrationsschlitze" mit einer Spaltenbreite von 4 bis 20 nm. Nephrin ist ein Membranprotein der glomerulären Filtrationsbarriere, das aus mehreren Immunglobulindomänen
sowie Fibronektindomänen besteht. Es wird von Podozyten gebildet und
verknüpft maschenartig benachbarte Zellfortsätze, was zur Limitierung
der Größe filtrierbarer Moleküle beiträgt.
Nephrin ist ein Membranprotein der glomerulären Filtrationsbarriere, das aus mehreren Immunglobulindomänen
sowie Fibronektindomänen besteht. Es wird von Podozyten gebildet und
verknüpft maschenartig benachbarte Zellfortsätze, was zur Limitierung
der Größe filtrierbarer Moleküle beiträgt. 
 Abbildung: Glomeruläre Filtration
Abbildung: Glomeruläre Filtration

 Abbildung: Die Filtrierbarkeit hängt von Größe und Ladung der Teilchen ab
Abbildung: Die Filtrierbarkeit hängt von Größe und Ladung der Teilchen ab
 Abbildung): Negativ geladene Moleküle (wie - bei einem
Blut-pH von 7,4 - Proteine, insbesondere das stark negativ geladene
Albumin) gelangen schwerer
durch die Filtrationsbarriere als positiv geladene gleichen
Durchmessers. Der Grund dafür ist, dass
Proteoglykane der Basalmembran negativ geladene Seitenketten aus
Heparansulfat enthalten und die Podozytenfortsätze von einer negativ
geladenen Glykokalix aus Glykolipiden und Glykoproteinen umhüllt
sind.
Abbildung): Negativ geladene Moleküle (wie - bei einem
Blut-pH von 7,4 - Proteine, insbesondere das stark negativ geladene
Albumin) gelangen schwerer
durch die Filtrationsbarriere als positiv geladene gleichen
Durchmessers. Der Grund dafür ist, dass
Proteoglykane der Basalmembran negativ geladene Seitenketten aus
Heparansulfat enthalten und die Podozytenfortsätze von einer negativ
geladenen Glykokalix aus Glykolipiden und Glykoproteinen umhüllt
sind. Glomeruläre Filtrationsrate (GFR)
Glomeruläre Filtrationsrate (GFR) 
 Abbildung: Glomeruläre Ultrafiltration
Abbildung: Glomeruläre Ultrafiltration
 Abbildung).
Abbildung). Adäquate
glomeruläre Filtration ist Voraussetzung für die Ausscheidungsfunktion
der Nieren. Ihr Betrag wird über den glomerulären Kapillardruck
reguliert - teils autonom (lokal), teils neurohumoral.
Angriffspunkt dieser Regulation sind die zu- und abführenden
Widerstandsgefäße, d.h. vasa afferentia und efferentia. Der
Filtrationsdruck kann so nicht nur einerseits an wechselnde
Anforderungen angepasst, sondern andererseits auch bei variierendem
arteriellem (System-) Blutdruck stabil gehalten werden (Autoregulation).
Adäquate
glomeruläre Filtration ist Voraussetzung für die Ausscheidungsfunktion
der Nieren. Ihr Betrag wird über den glomerulären Kapillardruck
reguliert - teils autonom (lokal), teils neurohumoral.
Angriffspunkt dieser Regulation sind die zu- und abführenden
Widerstandsgefäße, d.h. vasa afferentia und efferentia. Der
Filtrationsdruck kann so nicht nur einerseits an wechselnde
Anforderungen angepasst, sondern andererseits auch bei variierendem
arteriellem (System-) Blutdruck stabil gehalten werden (Autoregulation). Eine Glykokalyx auf der luminalen Oberfläche der Endothelzellen,
Eine Glykokalyx auf der luminalen Oberfläche der Endothelzellen, fenestrierte (Lücken mit etwa 70 nm Durchmesser) Endothelzellen, fast vollständig eingehüllt durch
fenestrierte (Lücken mit etwa 70 nm Durchmesser) Endothelzellen, fast vollständig eingehüllt durch die glomeruläre Basalmembran - dem eigentlichen Filter (Teilchen >1 kDa werden zurückgehalten) - sowie
die glomeruläre Basalmembran - dem eigentlichen Filter (Teilchen >1 kDa werden zurückgehalten) - sowie mechanisch widerstandsfähige (druckresistente) Podozyten mit ihren füßchenförmigen interdigitierenden Fortsätzen, die wie ein Stützgitter fungieren.
mechanisch widerstandsfähige (druckresistente) Podozyten mit ihren füßchenförmigen interdigitierenden Fortsätzen, die wie ein Stützgitter fungieren.
 Abbildung: Glomeruläres Filtersystem
Abbildung: Glomeruläres Filtersystem CD2AP, CD2-assoziiertes Protein
CD2AP, CD2-assoziiertes Protein  DAG,
Diacylglycerin
DAG,
Diacylglycerin  Fyn, eine SRC-Kinase
Fyn, eine SRC-Kinase  IP3, Inositoltriphosphat
IP3, Inositoltriphosphat  IQ-GAP,
IQ-Motiv mit GTPase aktivierendem Protein
IQ-GAP,
IQ-Motiv mit GTPase aktivierendem Protein  NEPH1, Mitglied der
NEPH-Protein-Familie, interagiert mit Nephrin
NEPH1, Mitglied der
NEPH-Protein-Familie, interagiert mit Nephrin  PI3K, Phosphatidylinositol 3-Kinase
PI3K, Phosphatidylinositol 3-Kinase  PLC, Phospholipase C
PLC, Phospholipase C  Rac, eine GTPase
Rac, eine GTPase  SYNJ, Synaptojanin
SYNJ, Synaptojanin  TRPC6, transient receptor potential cation channel, subfamily C, member 6
TRPC6, transient receptor potential cation channel, subfamily C, member 6
 Die Glykokalyx hat - bedingt durch Glycosaminoglycane - negative
Ladungen, die wahrscheinlich die Filtration
negativ geladener Teilchen einschränken.
Die Glykokalyx hat - bedingt durch Glycosaminoglycane - negative
Ladungen, die wahrscheinlich die Filtration
negativ geladener Teilchen einschränken. Über die Eigenschaften fenestrierten Endothels s. dort.
Über die Eigenschaften fenestrierten Endothels s. dort. Der eigentliche Filter ist die Basalmembran zwischen Endothel und Podozyten. Sie ist dreischichtig und negativ geladen (Sialo- und Dicarbonsäuregruppen in Heparansulfat-Proteoglycanen) und behindert den Durchtritt von größeren bzw. negativ geladenen (anionischen) Proteinen. Sie ist aus Typ IV-Kollagen-Triple-Helices
aufgebaut und erlaubt sie den Durchtritt von Partikeln bis zu höchstens
~10 nm Durchmesser (vgl. Tabelle oben. Bei einem Durchmesser von etwa
4-5 nm - etwas größer als Myoglobin - beträgt der Siebkoeffizient noch
~50%).
Der eigentliche Filter ist die Basalmembran zwischen Endothel und Podozyten. Sie ist dreischichtig und negativ geladen (Sialo- und Dicarbonsäuregruppen in Heparansulfat-Proteoglycanen) und behindert den Durchtritt von größeren bzw. negativ geladenen (anionischen) Proteinen. Sie ist aus Typ IV-Kollagen-Triple-Helices
aufgebaut und erlaubt sie den Durchtritt von Partikeln bis zu höchstens
~10 nm Durchmesser (vgl. Tabelle oben. Bei einem Durchmesser von etwa
4-5 nm - etwas größer als Myoglobin - beträgt der Siebkoeffizient noch
~50%). Nach außen stülpen sich Fortsätze der anliegenden Podozyten über
die Kapillarwände, die Spalträume zwischen ihnen sind mit einer
dünnen, negativ geladenen Membran bedeckt, die 4-20 nm weite Poren
aufweist ("Schlitzdiaphragma", slit diaphragm).
Körper und Fortsätze der Podozyten sowie das Schlitzdiaphragma sind
von einer Schicht aus negativ geladenen Glycoproteinen bedeckt.
Nach außen stülpen sich Fortsätze der anliegenden Podozyten über
die Kapillarwände, die Spalträume zwischen ihnen sind mit einer
dünnen, negativ geladenen Membran bedeckt, die 4-20 nm weite Poren
aufweist ("Schlitzdiaphragma", slit diaphragm).
Körper und Fortsätze der Podozyten sowie das Schlitzdiaphragma sind
von einer Schicht aus negativ geladenen Glycoproteinen bedeckt. 
 Abbildung: Molekulare Verankerungen der Podozyten
Abbildung: Molekulare Verankerungen der Podozyten Nephrin überbrückt den Filtrierschlitz und ist mit Proteinen wie
Podocin verbunden
Nephrin überbrückt den Filtrierschlitz und ist mit Proteinen wie
Podocin verbunden  NEPH1 und NEPH2 sind "KIRREL"-Proteine, deren zytoplasmastische Domänen mit Podocin oder Nephrin interagieren
NEPH1 und NEPH2 sind "KIRREL"-Proteine, deren zytoplasmastische Domänen mit Podocin oder Nephrin interagieren  Protocadherine sind Zelladhäsionsproteine
Protocadherine sind Zelladhäsionsproteine  ZO- 1 (zonula occludens) ist ein Tight-junction-Protein
ZO- 1 (zonula occludens) ist ein Tight-junction-Protein
 Grenzwerte s. dort).
Grenzwerte s. dort).  fort. Dieser besteht aus Teilen des vas afferens (granuläre reninbildende epitheloide
Myozyten), Beginn des vas efferens, und der macula densa, einem hochepithelialen Teil in der Wand des frühen distalen Tubulus. Seine Aufgabe ist die Stabilisierung des Gleichgewichts zwischen Filtration und Rückresorption im betreffenden Nephron.
fort. Dieser besteht aus Teilen des vas afferens (granuläre reninbildende epitheloide
Myozyten), Beginn des vas efferens, und der macula densa, einem hochepithelialen Teil in der Wand des frühen distalen Tubulus. Seine Aufgabe ist die Stabilisierung des Gleichgewichts zwischen Filtration und Rückresorption im betreffenden Nephron.  Macula-densa-Zellen reagieren auf eine Reduktion der tubulären Flüssigkeitsströmung mit Reninfreisetzung aus dem vas afferens. Herabgesetzte glomeruläre Filtration (die Ursache verringerter Strömung im Tubulus) deutet auf reduzierte Flüssigkeitsreserven im Körper hin, und Renin stimuliert das Renin-Angiotensin-Aldosteron-System, das Kochsalz - und damit auch Wasser - reklamiert und dabei Blutdruck und Kreislauf stabilisiert.
Macula-densa-Zellen reagieren auf eine Reduktion der tubulären Flüssigkeitsströmung mit Reninfreisetzung aus dem vas afferens. Herabgesetzte glomeruläre Filtration (die Ursache verringerter Strömung im Tubulus) deutet auf reduzierte Flüssigkeitsreserven im Körper hin, und Renin stimuliert das Renin-Angiotensin-Aldosteron-System, das Kochsalz - und damit auch Wasser - reklamiert und dabei Blutdruck und Kreislauf stabilisiert. neuronale Anregung über sympathische Efferenzen zur Niere
neuronale Anregung über sympathische Efferenzen zur Niere ß2-Rezeptor-Agonisten (Reninfreisetzung +)
ß2-Rezeptor-Agonisten (Reninfreisetzung +) Prostaglandine (diese bewirken auch eine Dilatation der vasa afferentia, was den Filtrationsdruck erhöht)
Prostaglandine (diese bewirken auch eine Dilatation der vasa afferentia, was den Filtrationsdruck erhöht) Angiotensin II (wirkt auf vasa efferentia stärker vasokonstriktorisch als auf vasa afferentia, das erhöht ebenfalls den Filtrationsdruck).
Angiotensin II (wirkt auf vasa efferentia stärker vasokonstriktorisch als auf vasa afferentia, das erhöht ebenfalls den Filtrationsdruck).  Kontrahiert
das vas afferens, nimmt der Druck im Glomerulum und die Filtration ab;
Kontrahiert
das vas afferens, nimmt der Druck im Glomerulum und die Filtration ab;
 umgekehrt
steigen Druck und Filtration bei Verengung des vas efferens - bis ein
Punkt erreicht ist, an dem die niedrige Durchblutung auch die
Filtration wieder senkt (
umgekehrt
steigen Druck und Filtration bei Verengung des vas efferens - bis ein
Punkt erreicht ist, an dem die niedrige Durchblutung auch die
Filtration wieder senkt ( Abbildung).
Abbildung).
 Abbildung: Auswirkungen isolierter Kontraktion der zuführenden (links) und abführenden Arteriole (rechts) eines Nephrons
Abbildung: Auswirkungen isolierter Kontraktion der zuführenden (links) und abführenden Arteriole (rechts) eines Nephrons
 das vas afferens (Widerstand sinkt hier z.B. nach Nephrektomie in der verbliebenen Niere, wodurch die Filtration zunimmt) oder
das vas afferens (Widerstand sinkt hier z.B. nach Nephrektomie in der verbliebenen Niere, wodurch die Filtration zunimmt) oder  das vas efferens konzentriert (z.B. nach Gabe von ACE-Hemmern, z.B. Captopril - sie blockieren ACE (Angiotensin-converting enzyme) und behindern damit die Bildung von Angiotensin).
das vas efferens konzentriert (z.B. nach Gabe von ACE-Hemmern, z.B. Captopril - sie blockieren ACE (Angiotensin-converting enzyme) und behindern damit die Bildung von Angiotensin).  Neugeborene zeigen eine
niedrige relative Filtrationsleistung; dann nimmt die (auf die
Körperoberfläche bezogene) Filtrationsleistung um einen Faktor von ~10
zu, und
Neugeborene zeigen eine
niedrige relative Filtrationsleistung; dann nimmt die (auf die
Körperoberfläche bezogene) Filtrationsleistung um einen Faktor von ~10
zu, und mit ~6 Monaten übersteigen die Relativwerte diejenigen erwachsener Personen;
mit ~6 Monaten übersteigen die Relativwerte diejenigen erwachsener Personen; mit zwei Jahren stellen sich schließlich Werte ein, die für Erwachsene typisch sind, um dann
mit zwei Jahren stellen sich schließlich Werte ein, die für Erwachsene typisch sind, um dann  mit zunehmendem Alter
wieder abzunehmen (Verlust funktionsfähiger Nephrone).
mit zunehmendem Alter
wieder abzunehmen (Verlust funktionsfähiger Nephrone).
 Abbildung: Filtration, Rückresorption, Sekretion
Abbildung: Filtration, Rückresorption, Sekretion Als Filtrationsfraktion (FF) bezeichnet man denjenigen Anteil des die Nieren durchströmenden Plasmas (RPF), der glomerulär
filtriert wird (GFR). Normalerweise beträgt dieser Anteil ~20% des RPF.
Als Filtrationsfraktion (FF) bezeichnet man denjenigen Anteil des die Nieren durchströmenden Plasmas (RPF), der glomerulär
filtriert wird (GFR). Normalerweise beträgt dieser Anteil ~20% des RPF. Der
RPF einer Patientin beträgt 600 ml/min und ihre GFR 84 ml/min. Wie groß
ist die Filtrationsfraktion? - Sie beträgt 0,14 oder 14% (84 / 600).
Der
RPF einer Patientin beträgt 600 ml/min und ihre GFR 84 ml/min. Wie groß
ist die Filtrationsfraktion? - Sie beträgt 0,14 oder 14% (84 / 600). 
 Abbildung: Glomeruläre Filtration und Filtrationsfraktion als Funktion der renalen Plasmaströmung
Abbildung: Glomeruläre Filtration und Filtrationsfraktion als Funktion der renalen Plasmaströmung
 Der
kombinierte Gefäßwiderstand vas afferens und efferens (die in Serie
liegen) bestimmt den gesamten Strömungswiderstand und damit die
Durchblutung eines Nephrons.
Der
kombinierte Gefäßwiderstand vas afferens und efferens (die in Serie
liegen) bestimmt den gesamten Strömungswiderstand und damit die
Durchblutung eines Nephrons. Der Filtrationsdruck im Glomerulum ist relativ hoch, derjenige in den vasa recte niedrig.
Der Filtrationsdruck im Glomerulum ist relativ hoch, derjenige in den vasa recte niedrig. Die
Balance zwischen den beiden Widerständen steuert sowohl den
Filtrationsanteil (
Die
Balance zwischen den beiden Widerständen steuert sowohl den
Filtrationsanteil ( Abbildung) als auch die tubuläre Rückresorption.
Abbildung) als auch die tubuläre Rückresorption. Mit zunehmender Nierendurchblutung (bzw. RPF)
nimmt die Filtrationsleistung zu (steigendes Flüssigkeitsangebot), die
Filtrationsfraktion hingegen ab, weil diese bei höheren
Durchströmungswerten "gesättigt" wird (
Mit zunehmender Nierendurchblutung (bzw. RPF)
nimmt die Filtrationsleistung zu (steigendes Flüssigkeitsangebot), die
Filtrationsfraktion hingegen ab, weil diese bei höheren
Durchströmungswerten "gesättigt" wird ( Abbildung).
Abbildung).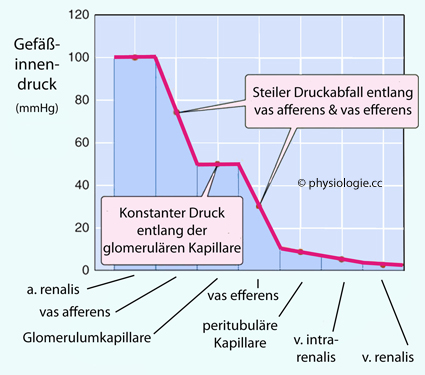
 Abbildung: Druckprofil in den Gefäßen der Niere
Abbildung: Druckprofil in den Gefäßen der Niere
 Abbildung oben).
Abbildung oben).

 Abbildung: Tubulo-glomeruläres Feedback
Abbildung: Tubulo-glomeruläres Feedback

 Abbildung: Macula densa als Strömungsrezeptor
Abbildung: Macula densa als Strömungsrezeptor
 Der tubulo-glomeruläre Mechanismus umfasst also folgende Schritte:
Der tubulo-glomeruläre Mechanismus umfasst also folgende Schritte:
 Abbildung: Tubulo-glomeruläres Feedback (Macula-densa-Mechanismus)
Abbildung: Tubulo-glomeruläres Feedback (Macula-densa-Mechanismus)
 Der Tonus der vasa afferentia ist proportional der Kochsalzpassage an der macula densa. Der sich daraus ergebende Rückkopplungsmechanismus stabilisiert die Filtration auf einem Mittelwert:
Der Tonus der vasa afferentia ist proportional der Kochsalzpassage an der macula densa. Der sich daraus ergebende Rückkopplungsmechanismus stabilisiert die Filtration auf einem Mittelwert:
 Steigt
die Salzmenge
(starke glomeruläre Filtration),
kontrahiert
sich das vas afferens, und die Filtration in das
betreffende Nephron nimmt ab.
Steigt
die Salzmenge
(starke glomeruläre Filtration),
kontrahiert
sich das vas afferens, und die Filtration in das
betreffende Nephron nimmt ab.  Umgekehrt kommt es bei sinkender Salzbelastung zu Vasodilatation des vas afferens, was Kapillardruck und Filtration steigert.
Umgekehrt kommt es bei sinkender Salzbelastung zu Vasodilatation des vas afferens, was Kapillardruck und Filtration steigert.  Das
optimiert die Verteilung der Durchblutung auf die einzelnen Nephrone
und schützt die Niere insgesamt vor überhöhtem Perfusionsdruck.
Das
optimiert die Verteilung der Durchblutung auf die einzelnen Nephrone
und schützt die Niere insgesamt vor überhöhtem Perfusionsdruck. Mehrere Faktoren beeinflussen die Empfindlichkeit des tubulo-glomerulären Feedback (Volumenexpansion, proteinreiche Diät, atriale natriuretische Peptide).
Mehrere Faktoren beeinflussen die Empfindlichkeit des tubulo-glomerulären Feedback (Volumenexpansion, proteinreiche Diät, atriale natriuretische Peptide).
 So sinkt die Empfindlichkeit der
macula densa mit zunehmendem extrazellulären Flüssigkeitsvolumen
(EZV), was die Volumenausscheidung fördert
(und nimmt umgekehrt mit abnehmendem EZV zu, wodurch das extrazelluläre
Volumen konserviert wird). Dieser Effekt steht möglicherweise unter dem
Einfluss von Angiotensin II, das ein wesentlicher Bestandteil des
tubulo-glomerulären Rückkopplungssystems ist: Es wirkt sowohl auf afferente als auch efferente Arteriolen und steigert
den renalen Gefäßwiderstand bei gleichzeitiger Stabilisierung des
Filtrationsdrucks im Glomerulum.
So sinkt die Empfindlichkeit der
macula densa mit zunehmendem extrazellulären Flüssigkeitsvolumen
(EZV), was die Volumenausscheidung fördert
(und nimmt umgekehrt mit abnehmendem EZV zu, wodurch das extrazelluläre
Volumen konserviert wird). Dieser Effekt steht möglicherweise unter dem
Einfluss von Angiotensin II, das ein wesentlicher Bestandteil des
tubulo-glomerulären Rückkopplungssystems ist: Es wirkt sowohl auf afferente als auch efferente Arteriolen und steigert
den renalen Gefäßwiderstand bei gleichzeitiger Stabilisierung des
Filtrationsdrucks im Glomerulum. Intensive Proteinzufuhr
("Sportlerdiät") kann den TGF-Mechanismus abschwächen und dadurch
glomeruläre Filtration und renale Durchblutung erhöhen. "Proteinmast"
kann so zu verstärkter glomerulärer Belastung und fallweise Schädigung
führen.
Intensive Proteinzufuhr
("Sportlerdiät") kann den TGF-Mechanismus abschwächen und dadurch
glomeruläre Filtration und renale Durchblutung erhöhen. "Proteinmast"
kann so zu verstärkter glomerulärer Belastung und fallweise Schädigung
führen. Atriale natriuretische Peptide relaxieren renale Gefäße; sie erhöhen die renale Perfusion und die Harnproduktion.
Atriale natriuretische Peptide relaxieren renale Gefäße; sie erhöhen die renale Perfusion und die Harnproduktion. aus juxtaglomerulären Zellen unterliegt hauptsächlich der Kontrolle durch folgende Regulationspfade und erfolgt in einem langsameren Zeitrahmen (Minuten bis Stunden).
aus juxtaglomerulären Zellen unterliegt hauptsächlich der Kontrolle durch folgende Regulationspfade und erfolgt in einem langsameren Zeitrahmen (Minuten bis Stunden).

 Zellen der macula densa (
Zellen der macula densa ( Abbildung) nehmen Kochsalz apikal über den Na+/K+/2Cl--Symporter aus dem Tubulus auf. Die Intensität dieser Transportleistung übersetzt sich in mehrere Steuersignale für die Reninfreisetzung:
Abbildung) nehmen Kochsalz apikal über den Na+/K+/2Cl--Symporter aus dem Tubulus auf. Die Intensität dieser Transportleistung übersetzt sich in mehrere Steuersignale für die Reninfreisetzung:  Erhöhte Kochsalzlast hemmt, erniedrigte aktiviert die Reninfreisetzung. Das entscheidende Signal für die Zellen der macula densa ist also die
Geschwindigkeit, mit der sie von NaCl durchströmt werden, nicht die
NaCl-Konzentration an sich.
Erhöhte Kochsalzlast hemmt, erniedrigte aktiviert die Reninfreisetzung. Das entscheidende Signal für die Zellen der macula densa ist also die
Geschwindigkeit, mit der sie von NaCl durchströmt werden, nicht die
NaCl-Konzentration an sich. 
 Abbildung: Steuerung der Reninfreisetzung
Abbildung: Steuerung der Reninfreisetzung AC, Adenylatzyklase
AC, Adenylatzyklase  AT1-R, Angiotensinrezeptor
AT1-R, Angiotensinrezeptor  ß1-R, adrenerger Beta-1-Rezeptor
ß1-R, adrenerger Beta-1-Rezeptor  COX-2, Zyklooxygenase-2
COX-2, Zyklooxygenase-2  G, G-Protein
G, G-Protein  nNOS, neuronale NO-Synthase
nNOS, neuronale NO-Synthase  P2Y-R, purinerger Rezeptor
P2Y-R, purinerger Rezeptor  PG-R, Prostaglandinrezeptor
PG-R, Prostaglandinrezeptor  PLC, Phospholipase C
PLC, Phospholipase C
 Steigender tubulärer Antransport von NaCl erhöht via ATP-Verbrauch die Produktion von Adenosin,
das über einen Nukleosid-Transporter in den Extrazellulärraum gelangt
und parakrin an den juxtaglomerulären Zellen - über Adenosinrezeptoren
und Gi-Proteine - die Bildung von cAMP und damit die Reninfreisetzung hemmt.
Steigender tubulärer Antransport von NaCl erhöht via ATP-Verbrauch die Produktion von Adenosin,
das über einen Nukleosid-Transporter in den Extrazellulärraum gelangt
und parakrin an den juxtaglomerulären Zellen - über Adenosinrezeptoren
und Gi-Proteine - die Bildung von cAMP und damit die Reninfreisetzung hemmt. ATP wird dabei von macula-densa-Zellen freigesetzt und steigert über P2Y-Rezeptoren, Gq-Proteine, Phospholipase C und Inositolphosphat den Ca++-Spiegel in der juxtaglomerulären Zelle. Der erhöhte Ca++-Spiegel hemmt die Reninfreisetzung (was außergewöhnlich ist, ähnlich wie in Epithelkörperchenzellen der Schilddrüse, wo ansteigendes intrazelluläres [Ca++] die Sekretion von Parathormon hemmt).
ATP wird dabei von macula-densa-Zellen freigesetzt und steigert über P2Y-Rezeptoren, Gq-Proteine, Phospholipase C und Inositolphosphat den Ca++-Spiegel in der juxtaglomerulären Zelle. Der erhöhte Ca++-Spiegel hemmt die Reninfreisetzung (was außergewöhnlich ist, ähnlich wie in Epithelkörperchenzellen der Schilddrüse, wo ansteigendes intrazelluläres [Ca++] die Sekretion von Parathormon hemmt). Vermehrter tubulärer Antransport von NaCl bremst in macula-densa-Zellen weiters die Bildung (über Zyklooxygenase 2) von Prostaglandinen (PGE2, PGI2), die in juxtaglomerulären Zellen über Prostaglandinrezeptoren, Gs-Proteine, Adenylatzyklase und cAMP die Reninsekretion anregen würden.
Vermehrter tubulärer Antransport von NaCl bremst in macula-densa-Zellen weiters die Bildung (über Zyklooxygenase 2) von Prostaglandinen (PGE2, PGI2), die in juxtaglomerulären Zellen über Prostaglandinrezeptoren, Gs-Proteine, Adenylatzyklase und cAMP die Reninsekretion anregen würden. Steigende Druck- bzw. Perfusionswerte im präglomerulären Gefäßbereich
hemmen die Reninfreisetzung (und umgekehrt) - wahrscheinlich
über Dehnungssignale in der Wand des vas afferens (intrarenaler Barorezeptor). Dies könnte über
Prostaglandine mediiert sein.
Steigende Druck- bzw. Perfusionswerte im präglomerulären Gefäßbereich
hemmen die Reninfreisetzung (und umgekehrt) - wahrscheinlich
über Dehnungssignale in der Wand des vas afferens (intrarenaler Barorezeptor). Dies könnte über
Prostaglandine mediiert sein. ß1-adrenerge Rezeptoren wirken bei sympathischer Aktivität wie Prostaglandine über Gs-Proteine, Adenylatzyklase und cAMP anregend auf die Reninsekretion.
ß1-adrenerge Rezeptoren wirken bei sympathischer Aktivität wie Prostaglandine über Gs-Proteine, Adenylatzyklase und cAMP anregend auf die Reninsekretion. Prostaglandine (PGE2, PGI2) erhöhen renale
Perfusion (wie auch Dopamin) und glomeruläre Filtration. Wird die Prostaglandinsynthese in der Niere unterdrückt, sinkt die Nierendurchblutung.
Prostaglandine (PGE2, PGI2) erhöhen renale
Perfusion (wie auch Dopamin) und glomeruläre Filtration. Wird die Prostaglandinsynthese in der Niere unterdrückt, sinkt die Nierendurchblutung. Natriuretisch wirken Bradykinin (hemmt wie Prostaglandine ENaC-Kanäle), Dopamin (wirkt lokal vasodilatatorisch und damit natriuretisch), und nicht zuletzt natriuretische Peptide.
Natriuretisch wirken Bradykinin (hemmt wie Prostaglandine ENaC-Kanäle), Dopamin (wirkt lokal vasodilatatorisch und damit natriuretisch), und nicht zuletzt natriuretische Peptide. ). Besonders kennzeichnend ist der Anstieg der Kreatininwerte, die Kreatininclearance kennzeichnet die glomeruläre Filtrationsleistung. (Die Kreatininausscheidung erlaubt normalerweise eine Abschätzung der Muskelmasse.)
). Besonders kennzeichnend ist der Anstieg der Kreatininwerte, die Kreatininclearance kennzeichnet die glomeruläre Filtrationsleistung. (Die Kreatininausscheidung erlaubt normalerweise eine Abschätzung der Muskelmasse.)
 Die glomeruläre
Filterfläche einer Niere beträgt ~1 m2. Die "Filtermatte" der Glomeruli ist dreilagig: Endothel, Basalmembran und Podozyten; Podozyten und Basalmembran bestimmen gemeinsam die Permeabilität gegenüber Plasmaproteinen. Die
glomerulären Kapillarwände sind fenestriert, die Lücken haben ~70 nm
Durchmesser (blockieren den Durchtritt von Blutkörperchen). Wenn Mesangiumzellen kontrahieren (vasoaktive Substanzen wie Vasopressin), sinkt der Filtrationskoeffizient. Das
Ausmaß der Filtration eines Stoffes hängt von seiner Größe, Ladung,
Form und Verformbarkeit ab. Der hydrostatische Druck beträgt am Beginn der Glomerulumkapillare
~55 mmHg, am Ende
~50
mmHg. Gegenkräfte sind der hydrostatische Druck in der Glomerulumkapsel
(~15 mmHg) und der onkotische Effekt des Blutplasmas (~25-30 mmHg), der
durch die Filtration auf ~40 mmHg ansteigt, bis der effektive
Filtrationsdruck (im Mittel ~10 mmHg) Null beträgt (Filtrationsäquilibrium)
Die glomeruläre
Filterfläche einer Niere beträgt ~1 m2. Die "Filtermatte" der Glomeruli ist dreilagig: Endothel, Basalmembran und Podozyten; Podozyten und Basalmembran bestimmen gemeinsam die Permeabilität gegenüber Plasmaproteinen. Die
glomerulären Kapillarwände sind fenestriert, die Lücken haben ~70 nm
Durchmesser (blockieren den Durchtritt von Blutkörperchen). Wenn Mesangiumzellen kontrahieren (vasoaktive Substanzen wie Vasopressin), sinkt der Filtrationskoeffizient. Das
Ausmaß der Filtration eines Stoffes hängt von seiner Größe, Ladung,
Form und Verformbarkeit ab. Der hydrostatische Druck beträgt am Beginn der Glomerulumkapillare
~55 mmHg, am Ende
~50
mmHg. Gegenkräfte sind der hydrostatische Druck in der Glomerulumkapsel
(~15 mmHg) und der onkotische Effekt des Blutplasmas (~25-30 mmHg), der
durch die Filtration auf ~40 mmHg ansteigt, bis der effektive
Filtrationsdruck (im Mittel ~10 mmHg) Null beträgt (Filtrationsäquilibrium) Der
Siebkoeffizient (S) ist definiert als die Konzentration eines Stoffes
im Filtrat (Kf) in Relation zur Konzentration im Blutplasma (Kp): S
= Kf / Kp. Ist sein Betrag 1, werden Teilchen frei filtriert, beträgt
er 0, gelangen sie nicht in das Filtrat (Albumin: Siebkoeffizient <1%). Durch fingerförmige Podozytenfortsätze gebildete "Filtrationsschlitze" (Spaltenbreite 4-25 nm) erlauben den Durchtritt des Filtrats in den Bowman-Raum. Der eigentliche Filter ist die Basalmembran zwischen Endothel und Podozyten: Der effektive
Porenradius beträgt 1,5-4,5 nm. Mit zunehmender Molekülgröße nimmt die Fraktion
filtrierten Stoffs ab (bei ~70 kDa praktisch Null). Von ~35.000 g Albumin, die an einem Tag die Glomeruli passieren, werden 0,15-0,2
g filtriert, 90% davon im Tubulus endozytiert, 15-20 mg/d erscheinen im
Harn. Kleinere Proteine (bis 45 kD) filtrieren die Glomeruli zu ≤80%,
ihr Anteil im Harn beträgt 50-80 mg/d. An Eiweiß gebundene
Moleküle sind der Filtration entzogen. Negativ geladene Moleküle
gelangen schwerer durch die Filtrationsbarriere als positiv geladene
(negativ geladene Proteoglykane der Basalmembran, negativ geladene
Glykokalix)
Der
Siebkoeffizient (S) ist definiert als die Konzentration eines Stoffes
im Filtrat (Kf) in Relation zur Konzentration im Blutplasma (Kp): S
= Kf / Kp. Ist sein Betrag 1, werden Teilchen frei filtriert, beträgt
er 0, gelangen sie nicht in das Filtrat (Albumin: Siebkoeffizient <1%). Durch fingerförmige Podozytenfortsätze gebildete "Filtrationsschlitze" (Spaltenbreite 4-25 nm) erlauben den Durchtritt des Filtrats in den Bowman-Raum. Der eigentliche Filter ist die Basalmembran zwischen Endothel und Podozyten: Der effektive
Porenradius beträgt 1,5-4,5 nm. Mit zunehmender Molekülgröße nimmt die Fraktion
filtrierten Stoffs ab (bei ~70 kDa praktisch Null). Von ~35.000 g Albumin, die an einem Tag die Glomeruli passieren, werden 0,15-0,2
g filtriert, 90% davon im Tubulus endozytiert, 15-20 mg/d erscheinen im
Harn. Kleinere Proteine (bis 45 kD) filtrieren die Glomeruli zu ≤80%,
ihr Anteil im Harn beträgt 50-80 mg/d. An Eiweiß gebundene
Moleküle sind der Filtration entzogen. Negativ geladene Moleküle
gelangen schwerer durch die Filtrationsbarriere als positiv geladene
(negativ geladene Proteoglykane der Basalmembran, negativ geladene
Glykokalix) Der
juxtaglomeruläre Apparat besteht aus Teilen des vas afferens
(reninbildende Myozyten), Beginn des vas efferens, und der macula
densa, einem hochepithelialen Teil des frühen distalen Tubulus; er
stabilisiert das Gleichgewicht zwischen Filtration und Rückresorption
im Nephron. Macula-densa-Zellen reagieren auf reduzierte tubuläre
Strömung (deutet auf reduzierte Flüssigkeitsreserven im Körper hin) mit
Reninfreisetzung aus dem vas afferens. Steigender
tubulärer Antransport von NaCl erhöht die Produktion von Adenosin, das
parakrin an den juxtaglomerulären Zellen die Reninfreisetzung hemmt: Erhöhte Kochsalzlast bremst, erniedrigte aktiviert die Reninfreisetzung. Renin stimuliert das
Renin-Angiotensin-Aldosteron- System, das Kochsalz und damit Wasser
zurückhält, Blutdruck und Kreislauf stabilisiert. Renin triggert
die Bildung von Angiotensin (Vasokonstriktion) und Aldosteron
(Konservierung von Kochsalz); beides erhöht
den Blutdruck und stärkt die glomeruläre Filtration
Der
juxtaglomeruläre Apparat besteht aus Teilen des vas afferens
(reninbildende Myozyten), Beginn des vas efferens, und der macula
densa, einem hochepithelialen Teil des frühen distalen Tubulus; er
stabilisiert das Gleichgewicht zwischen Filtration und Rückresorption
im Nephron. Macula-densa-Zellen reagieren auf reduzierte tubuläre
Strömung (deutet auf reduzierte Flüssigkeitsreserven im Körper hin) mit
Reninfreisetzung aus dem vas afferens. Steigender
tubulärer Antransport von NaCl erhöht die Produktion von Adenosin, das
parakrin an den juxtaglomerulären Zellen die Reninfreisetzung hemmt: Erhöhte Kochsalzlast bremst, erniedrigte aktiviert die Reninfreisetzung. Renin stimuliert das
Renin-Angiotensin-Aldosteron- System, das Kochsalz und damit Wasser
zurückhält, Blutdruck und Kreislauf stabilisiert. Renin triggert
die Bildung von Angiotensin (Vasokonstriktion) und Aldosteron
(Konservierung von Kochsalz); beides erhöht
den Blutdruck und stärkt die glomeruläre Filtration Filtrationsfraktion
(FF) ist der Anteil des die Nieren durchströmenden Plasmas (RPF), der
glomerulär filtriert wird (GFR). Normalerweise beträgt die FF ~20% des
RPF. Im Autoregulationsbereich (80-180 mmHg) ist die Filtrationsfraktion ziemlich konstant, <70
mmHg nimmt er ab, bei extremer Hypotonie kann die glomeruläre Filtration zum
Erliegen kommen. Der Tonus der
vasa afferentia ist proportional der Kochsalzpassage an der macula
densa (die Natriumausscheidung beträgt zwischen 10 und 500 mM/d). Steigt die Salzmenge (starke glomeruläre Filtration),
kontrahiert sich das vas afferens, und die Filtration in das
betreffende Nephron nimmt ab. Umgekehrt dilatiert das vas afferens bei
sinkender Salzbelastung, Kapillardruck und Filtration steigen an
Filtrationsfraktion
(FF) ist der Anteil des die Nieren durchströmenden Plasmas (RPF), der
glomerulär filtriert wird (GFR). Normalerweise beträgt die FF ~20% des
RPF. Im Autoregulationsbereich (80-180 mmHg) ist die Filtrationsfraktion ziemlich konstant, <70
mmHg nimmt er ab, bei extremer Hypotonie kann die glomeruläre Filtration zum
Erliegen kommen. Der Tonus der
vasa afferentia ist proportional der Kochsalzpassage an der macula
densa (die Natriumausscheidung beträgt zwischen 10 und 500 mM/d). Steigt die Salzmenge (starke glomeruläre Filtration),
kontrahiert sich das vas afferens, und die Filtration in das
betreffende Nephron nimmt ab. Umgekehrt dilatiert das vas afferens bei
sinkender Salzbelastung, Kapillardruck und Filtration steigen an