




 Katecholamine, natriuretische Peptide, Adrenomedullin
Katecholamine, natriuretische Peptide, Adrenomedullin
 Adrenomedullin: ad = bei, ren = Niere, medulla = Mark (adrenal
medulla: Nebennierenmark)
Adrenomedullin: ad = bei, ren = Niere, medulla = Mark (adrenal
medulla: Nebennierenmark)| Mehrere
Organe kooperieren bei der Einstellung von Salz-Wasser-Haushalt und
Kreislauffunktion, so auch das Herz und das Nebennierenmark: Aus den
Vorhöfen stammen natriuretische Peptide (Atriopeptin), aus dem
Nebennierenmark Katecholamine (Adrenalin, Noradrenalin) und
Adrenomedullin. Natriuretische Peptide stammen vor allem aus Herz und Gehirn; Kardiomyozyten setzen sie bei verstärkter Dehnung frei. Sie wirken an der Niere natriuretisch, diuretisch und vasodilatierend, und hemmen ihre Antagonisten. Der Effekt ist eine Senkung extrazellulärer Volumina und des Blutdrucks (Reduktion der kardialen Vor- und Nachlast), was klinisch Herzschonung bedeutet. Katecholamine hingegen regen das Herz an (alle Herzqualitäten, insbesondere Schlagkraft und -frequenz) und erhöhen den Tonus der meisten Blutgefäße. Somit heben sie den arteriellen Blutdruck an; sie werden (z.B. im Rahmen des Baroreflexes) vermehrt freigesetzt, wenn die Durchblutung kritischer Organe (z.B. Gehirn) abzusinken droht (der Katecholaminspiegel im Blut nimmt nach Wechsel von liegender zu aufrechter Position sofort zu). Adrenomedullin ist ein vasodilatierender und natriuretischer Faktor, der aus dem Nebennierenmark, aber auch aus anderen Geweben stammt und die Adrenalinfreisetzung fördert (umgekehrt regt Adrenalin seine Sekretion an). Zusammen bewirken diese Hormone eine Feineinstellung von Kreislauf und Salz-Wasser-Haushalt. |
 (ANP, 17-28 Aminosäuren) werden in Herzmuskelzellen in Form von Granula vesikulär gespeichert und bei exzessiver Dehnung der Zellen (Volumenüberlastung - auch durch i.v. Infusion von Kochsalzlösung auslösbar) durch Exozytose in den Kreislauf freigesetzt. Sie haben folgende Wirkungen:
(ANP, 17-28 Aminosäuren) werden in Herzmuskelzellen in Form von Granula vesikulär gespeichert und bei exzessiver Dehnung der Zellen (Volumenüberlastung - auch durch i.v. Infusion von Kochsalzlösung auslösbar) durch Exozytose in den Kreislauf freigesetzt. Sie haben folgende Wirkungen: Nieren:
Dilatation der vasa afferentia und - weniger stark - Konstriktion der
vasa efferentia. Insgesamt sinkt der renale Gefäßwiderstand, die
Durchblutung der Nieren steigt an, der Druck in den
Glomerulumkapillaren nimmt zu und damit auch die Filtration und die
Ausscheidung von Kochsalz (daher der
Name). ANPs wirken als ein Gegenspieler des Renin- Angiotensin- Aldosteron-
Systems.
Nieren:
Dilatation der vasa afferentia und - weniger stark - Konstriktion der
vasa efferentia. Insgesamt sinkt der renale Gefäßwiderstand, die
Durchblutung der Nieren steigt an, der Druck in den
Glomerulumkapillaren nimmt zu und damit auch die Filtration und die
Ausscheidung von Kochsalz (daher der
Name). ANPs wirken als ein Gegenspieler des Renin- Angiotensin- Aldosteron-
Systems.  Hypothalamus: Senkung der Vasopressinausschüttung, dadurch vermehrte Wasserausscheidung..
Hypothalamus: Senkung der Vasopressinausschüttung, dadurch vermehrte Wasserausscheidung.. Hirnstamm
(medulla oblongata): Geringere Konstriktion der Arteriolen
(Vasodilatation), Senkung des arteriellen Blutdrucks (antihypertensive
Wirkung).
Hirnstamm
(medulla oblongata): Geringere Konstriktion der Arteriolen
(Vasodilatation), Senkung des arteriellen Blutdrucks (antihypertensive
Wirkung). Nebennieren: Verringerte Aldosteronsekretion (auch durch reduzierte Reninaktivität), dadurch verringerte Resorption von Kochsalz.
Nebennieren: Verringerte Aldosteronsekretion (auch durch reduzierte Reninaktivität), dadurch verringerte Resorption von Kochsalz.
 Abbildung:
Wirkung atrialen natriuretischen Peptids (ANP)
Abbildung:
Wirkung atrialen natriuretischen Peptids (ANP)
 Atriopeptin (ANP:
Atriale natriuretische
Peptide, Cardiodilatin,
Atriopeptin (ANP:
Atriale natriuretische
Peptide, Cardiodilatin,  Abbildung) wird in Herzmuskelzellen (myoendokrinen Zellen) - vor allem im Bereich des rechten Vorhofs, etwas auch im linken Vorhof sowie im Ventrikelmyokard - gebildet und bei Dehnung der Herzräume aus beiden Atrien freigesetzt. Anregend auf die ANP-Sekretion wirken
(Nor)Adrenalin (ß-adrenerg) und Endothelin (via ETB-Rezeptoren).
Abbildung) wird in Herzmuskelzellen (myoendokrinen Zellen) - vor allem im Bereich des rechten Vorhofs, etwas auch im linken Vorhof sowie im Ventrikelmyokard - gebildet und bei Dehnung der Herzräume aus beiden Atrien freigesetzt. Anregend auf die ANP-Sekretion wirken
(Nor)Adrenalin (ß-adrenerg) und Endothelin (via ETB-Rezeptoren). )
zu messbarer Steigerung des ANP-Spiegels im Blut (starke Dehnung der
Herzräume: Der Starling-Mechanismus lässt das Herzzeitvolumen bei
dieser Form des Lagewechsels um ca. 30% ansteigen).
)
zu messbarer Steigerung des ANP-Spiegels im Blut (starke Dehnung der
Herzräume: Der Starling-Mechanismus lässt das Herzzeitvolumen bei
dieser Form des Lagewechsels um ca. 30% ansteigen). BNP (Brain natriuretic peptide) stammt vorwiegend
aus Kardiomyozyten der Ventrikel (entdeckt im Schweinehirn, daher "brain") und wird ebenfalls bei Volumenanstieg freigesetzt (erhöhte
Wandspannung).
BNP (Brain natriuretic peptide) stammt vorwiegend
aus Kardiomyozyten der Ventrikel (entdeckt im Schweinehirn, daher "brain") und wird ebenfalls bei Volumenanstieg freigesetzt (erhöhte
Wandspannung). CNP (C-Typ-natriuretisches Peptid) aus Endothel- und renalen Zellen ist ähnlich wie ANP gefäßwirksam und fördert das Wachstum von Röhrenknochen.
CNP (C-Typ-natriuretisches Peptid) aus Endothel- und renalen Zellen ist ähnlich wie ANP gefäßwirksam und fördert das Wachstum von Röhrenknochen.
 Abbildung: Urodilatin
Abbildung: Urodilatin
 Urodilatin (URO,
Urodilatin (URO,  Abbildung)
ist ein dem ANP homologes natriuretisch wirkendes Peptid, das kaum von
der Aktivität atriopeptid-abbauender renaler Enzyme betroffen ist. Es stammt aus Endothel- und Tubuluszellen der distalen Tubuli und Sammelrohre. Bei erhöhtem Blutdruck / Blutvolumen wird es freigesetzt und steigert - cGMP-abhängig
- die Natriurese / Diurese durch Anregung der renalen Durchblutung
(mindestens so effektiv wie AMP). Unter Normalbedingungen ist seine
physiologische Bedeutung gering. Urodilatin wird mit dem Harn
ausgeschieden.
Abbildung)
ist ein dem ANP homologes natriuretisch wirkendes Peptid, das kaum von
der Aktivität atriopeptid-abbauender renaler Enzyme betroffen ist. Es stammt aus Endothel- und Tubuluszellen der distalen Tubuli und Sammelrohre. Bei erhöhtem Blutdruck / Blutvolumen wird es freigesetzt und steigert - cGMP-abhängig
- die Natriurese / Diurese durch Anregung der renalen Durchblutung
(mindestens so effektiv wie AMP). Unter Normalbedingungen ist seine
physiologische Bedeutung gering. Urodilatin wird mit dem Harn
ausgeschieden.| Akuter Anstieg des Zentralvenendrucks führt zu Atriopeptinfreisetzung |
 NPR-1 oder Guanylatzyklase A (GC-A, bindet ANP und BNP) fördert die Entstehung von cGMP, das als second messenger dient. cGMP stimuliert eine cGMP-abhängige Proteinkinase, die dann die glatte Muskulatur relaxiert und das betreffende Gefäß dilatiert. Die systemische Auswirkung ist eine Reduktion des venösen Rückstroms zum Herzen, also der Vorlast (preload), was Vorhöfe und Kammern entlastet. Die Senkung des peripheren Widerstandes senkt auch die Nachlast (afterload) des Herzens.
NPR-1 oder Guanylatzyklase A (GC-A, bindet ANP und BNP) fördert die Entstehung von cGMP, das als second messenger dient. cGMP stimuliert eine cGMP-abhängige Proteinkinase, die dann die glatte Muskulatur relaxiert und das betreffende Gefäß dilatiert. Die systemische Auswirkung ist eine Reduktion des venösen Rückstroms zum Herzen, also der Vorlast (preload), was Vorhöfe und Kammern entlastet. Die Senkung des peripheren Widerstandes senkt auch die Nachlast (afterload) des Herzens. NPR-2 oder Guanylatzyklase B (GC-B, bindet CNP) wirkt ebenfalls über cGMP-abhängige Proteinkinase vasodilatatorisch und herzentlastend.
NPR-2 oder Guanylatzyklase B (GC-B, bindet CNP) wirkt ebenfalls über cGMP-abhängige Proteinkinase vasodilatatorisch und herzentlastend. NPR-3 oder Guanylatzyklase C (GC-C) bindet alle Atriopeptidformen. NPR-3 hat keine intrazelluläre Enzymaktivität, sondern ist ein Clearance-Rezeptor, der überschüssige natriuretische
Peptide aus dem Kreislauf entfernt.
NPR-3 oder Guanylatzyklase C (GC-C) bindet alle Atriopeptidformen. NPR-3 hat keine intrazelluläre Enzymaktivität, sondern ist ein Clearance-Rezeptor, der überschüssige natriuretische
Peptide aus dem Kreislauf entfernt.| Der ANP-Rezeptor NPR-1 ist eine membranständige Guanylatzyklase |
| Atriopeptin wirkt natriuretisch, indem es die glomeruläre Filtration steigert, die Na+-Rückresorption hemmt und die Aldosteronbildung reduziert |

 Abbildung: Wirkungen atrialer natriuretischer Peptide (Atriopeptin) und einiger Diuretika an der Niere
Abbildung: Wirkungen atrialer natriuretischer Peptide (Atriopeptin) und einiger Diuretika an der Niere Schleifendiuretika wie Furosemid hemmen den Na/K/Cl-Cotransporter
Schleifendiuretika wie Furosemid hemmen den Na/K/Cl-Cotransporter  Thiazide hemmen den Na/Cl-Cotransport im distalen Tubulus
Thiazide hemmen den Na/Cl-Cotransport im distalen Tubulus

 Abbildung), wo bis zu 5% des filtrierten Natriums rückresorbiert
werden können. Hier finden sich zwei Typen von Natriumkanälen: Ein
nichtselektiver amiloridempfindlicher CNG-Kationenkanal, der über cGMP-Anstieg (Guanylatzyklaseanregung) durch ANPs gehemmt werden kann; und ein selektiver, aber weniger konduktiver ENaC-Natriumkanal.
Abbildung), wo bis zu 5% des filtrierten Natriums rückresorbiert
werden können. Hier finden sich zwei Typen von Natriumkanälen: Ein
nichtselektiver amiloridempfindlicher CNG-Kationenkanal, der über cGMP-Anstieg (Guanylatzyklaseanregung) durch ANPs gehemmt werden kann; und ein selektiver, aber weniger konduktiver ENaC-Natriumkanal.
 Abbildung unten) und hat zahlreiche Wirkungen zur Folge:
Abbildung unten) und hat zahlreiche Wirkungen zur Folge: Hypothalamus: Verringerter Salzappetit / Durst
Hypothalamus: Verringerter Salzappetit / Durst Niere: Gesteigerte Natriumausscheidung (Natriurese / Diurese durch Hemmung der Na+-K+-ATPase der Sammelrohr-Tubuluszellen (hier können bis zu 5% der glomerulär filtrierten Natriummenge rückresorbiert werden), die Natrium-Rückresorption wird reduziert)
Niere: Gesteigerte Natriumausscheidung (Natriurese / Diurese durch Hemmung der Na+-K+-ATPase der Sammelrohr-Tubuluszellen (hier können bis zu 5% der glomerulär filtrierten Natriummenge rückresorbiert werden), die Natrium-Rückresorption wird reduziert) Niere: Vasodilatation u.a. an vasa afferentia (durch Aktivierung der Guanylylcyklase
→ Erhöhung des cGMP-Spiegels der glatten Gefäßmuskelzellen), Durchblutung (Rinde und Mark) und
glomeruläre Filtrationsrate steigen an; Hemmung der Sympathikusaktivität
bewirkt Blutdrucksenkung
Niere: Vasodilatation u.a. an vasa afferentia (durch Aktivierung der Guanylylcyklase
→ Erhöhung des cGMP-Spiegels der glatten Gefäßmuskelzellen), Durchblutung (Rinde und Mark) und
glomeruläre Filtrationsrate steigen an; Hemmung der Sympathikusaktivität
bewirkt Blutdrucksenkung Veränderung der
autonom-nervösen Balance zugunsten des Parasympathikus (Erhöhung der
Acetylcholinfreisetzung, Reduktion des Sympathikustonus) mit der Folge
peripherer Vasodilatation, verringerten peripheren Widerstandes, Erhöhung von Herzminutenvolumen und Nierendurchblutung
Veränderung der
autonom-nervösen Balance zugunsten des Parasympathikus (Erhöhung der
Acetylcholinfreisetzung, Reduktion des Sympathikustonus) mit der Folge
peripherer Vasodilatation, verringerten peripheren Widerstandes, Erhöhung von Herzminutenvolumen und Nierendurchblutung Flüssigkeitsverlagerung
aus dem Plasma in das Interstitium durch präkapilläre Vasodilatation
und Erhöhung des Filtrationsdruckes (sowie Anstieg der Permeabilität)
Flüssigkeitsverlagerung
aus dem Plasma in das Interstitium durch präkapilläre Vasodilatation
und Erhöhung des Filtrationsdruckes (sowie Anstieg der Permeabilität) Reduktion von Atriopeptin-Gegenspielern:
Reduktion von Atriopeptin-Gegenspielern: Hemmung der Vasopressinsekretion im Hypophysenhinterlappen (→ Diurese, Blutdrucksenkung)
Hemmung der Vasopressinsekretion im Hypophysenhinterlappen (→ Diurese, Blutdrucksenkung) Hemmung der Aldosteronsynthese in der Nebennierenrinde (→ Natriurese, Blutdrucksenkung)
Hemmung der Aldosteronsynthese in der Nebennierenrinde (→ Natriurese, Blutdrucksenkung) Hemmung der
Reninfreisetzung durch Vasodilatation / Perfusions- und
Filtrationssteigerung in der Niere (→ Diurese, Blutdrucksenkung)
Hemmung der
Reninfreisetzung durch Vasodilatation / Perfusions- und
Filtrationssteigerung in der Niere (→ Diurese, Blutdrucksenkung) Hemmung der Endothelinsekretion (→ Natriurese, Blutdrucksenkung)
Hemmung der Endothelinsekretion (→ Natriurese, Blutdrucksenkung)
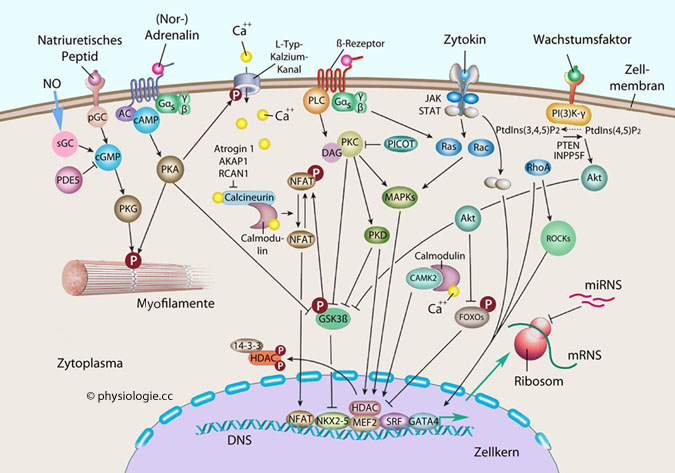
 Abbildung: Wirkpfade für natriuretische Peptide, Katecholamine und andere Signalstoffe
Abbildung: Wirkpfade für natriuretische Peptide, Katecholamine und andere Signalstoffe AKAP1, PKA anchor protein 1, beeinflusst cAMP-abhängige Lokalisierung von PKA
AKAP1, PKA anchor protein 1, beeinflusst cAMP-abhängige Lokalisierung von PKA  Atrogin-1, muskelspezifisches Protein
Atrogin-1, muskelspezifisches Protein  cAMP, zyklisches AMP
cAMP, zyklisches AMP  cGMP, zyklisches Guanosinmonophosphat
cGMP, zyklisches Guanosinmonophosphat  DAG, Diacylglycerin
DAG, Diacylglycerin  FOXOs, Forkhead-box O proteins, Transkriptionsfaktoren
FOXOs, Forkhead-box O proteins, Transkriptionsfaktoren  GATA4, ein Transkriptionsfaktor (bindet an die Sequenz "G-A-T-A")
GATA4, ein Transkriptionsfaktor (bindet an die Sequenz "G-A-T-A")  HDAC, Histondeazetylase, regelt die Transkription
HDAC, Histondeazetylase, regelt die Transkription  INPP5F, Inositol-Polyphosphat-5-Phosphatase F, ein Enzym
INPP5F, Inositol-Polyphosphat-5-Phosphatase F, ein Enzym  InsP3, Inositol-1,4,5-Trisphosphat
InsP3, Inositol-1,4,5-Trisphosphat  JAK, Januskinase
JAK, Januskinase  MAPK, mitogenaktivierte Proteinkinase
MAPK, mitogenaktivierte Proteinkinase  MEF2, Myocyte enhancer factor 2, Transkriptionsfaktor
MEF2, Myocyte enhancer factor 2, Transkriptionsfaktor  mRNS, Boten-Ribonukleinsäure
mRNS, Boten-Ribonukleinsäure  miRNS, Mikro-RNS, kurze nichtcodierende RNS, wichtig für Gen-Silencing
miRNS, Mikro-RNS, kurze nichtcodierende RNS, wichtig für Gen-Silencing  NFAT, Nuclear factor of activated T cells, Transkriptionsfaktor
NFAT, Nuclear factor of activated T cells, Transkriptionsfaktor  NKX2-5, NK2 transcription factor related, locus 5 - Homöoboxprotein, reguliert Genexpression
NKX2-5, NK2 transcription factor related, locus 5 - Homöoboxprotein, reguliert Genexpression  NO, Stickstoffmonoxid
NO, Stickstoffmonoxid  pGC, particulate guanylyl cyclase, Teil der G-Protein-Signalkaskade
pGC, particulate guanylyl cyclase, Teil der G-Protein-Signalkaskade  PICOT, PKC-interacting cousin of thioredoxin
PICOT, PKC-interacting cousin of thioredoxin  PI(3)K-γ, Phosphatidylinositol 3-OH-kinase-γ
PI(3)K-γ, Phosphatidylinositol 3-OH-kinase-γ  PKA, cAMP-abhängige Proteinkinase
PKA, cAMP-abhängige Proteinkinase  PKC, Proteinkinase C
PKC, Proteinkinase C  PKG, Proteinkinase G, mediiert Atriopeptinwirkungen
PKG, Proteinkinase G, mediiert Atriopeptinwirkungen  PDE5, Phosphodiesterase 5, cGMP-spaltendes Enzym
PDE5, Phosphodiesterase 5, cGMP-spaltendes Enzym  PKD, Proteinkinase D, reguliert Carrier-Export an Zelloberfläche
PKD, Proteinkinase D, reguliert Carrier-Export an Zelloberfläche  PLC, Phospholipase C
PLC, Phospholipase C  PtdIns(4,5)P2, Phosphatidylinositol- 4,5-Bisphosphat
PtdIns(4,5)P2, Phosphatidylinositol- 4,5-Bisphosphat  PTEN, Phosphatase and tensin homologue, Tumorsuppressorgen
PTEN, Phosphatase and tensin homologue, Tumorsuppressorgen  RCAN1, Regulator of calcineurin 1, codiert ein Protein, das Calcineurin-abhängige Transkription hemmt
RCAN1, Regulator of calcineurin 1, codiert ein Protein, das Calcineurin-abhängige Transkription hemmt  ROCK, Rho-associated protein kinase, reguliert Form und Bewegung durch Wirkung auf das Zytoskelett
ROCK, Rho-associated protein kinase, reguliert Form und Bewegung durch Wirkung auf das Zytoskelett  sGC, Soluble guanylyl cyclase, NO-Rezeptor
sGC, Soluble guanylyl cyclase, NO-Rezeptor  SRF, Serum response factor, reguliert Genaktivitä
SRF, Serum response factor, reguliert Genaktivitä  STAT, signal transducer and activator of transcription
STAT, signal transducer and activator of transcription
 Atriopeptide werden u.a. von Niere und Lunge (durch die Metalloprotease Neprilysin) abgebaut. Die biologische Halbwertszeit des ANP beträgt 2-3, des BNP ~20 Minuten.
Atriopeptide werden u.a. von Niere und Lunge (durch die Metalloprotease Neprilysin) abgebaut. Die biologische Halbwertszeit des ANP beträgt 2-3, des BNP ~20 Minuten. stammen aus sympathischen
Nervenendigungen (Noradrenalin)
und dem Nebennierenmark
(Adrenalin und etwas Noradrenalin). Der Katecholaminspiegel im Blut ist
ein Maß für die ergotrope Aktivitätslage und steht auch mit
dem Ausmaß von Stresseinwirkung in Zusammenhang.
stammen aus sympathischen
Nervenendigungen (Noradrenalin)
und dem Nebennierenmark
(Adrenalin und etwas Noradrenalin). Der Katecholaminspiegel im Blut ist
ein Maß für die ergotrope Aktivitätslage und steht auch mit
dem Ausmaß von Stresseinwirkung in Zusammenhang. 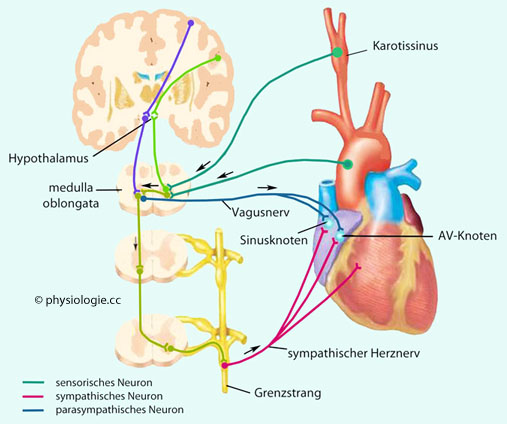
 Abbildung: Autonom-nervöse Steuerung der Herztätigkeit
Abbildung: Autonom-nervöse Steuerung der Herztätigkeit
 Der
Noradrenalinspiegel nimmt in weniger als einer Minute mit zunehmender
Sympathikusaktivität zu (bis zum Mehrfachen des Basiswertes). Unter Stresseinwirkung
steigt auch der Adrenalinspiegel an - bei akuter Extrembelastung bis auf das Zehnfache.
Der
Noradrenalinspiegel nimmt in weniger als einer Minute mit zunehmender
Sympathikusaktivität zu (bis zum Mehrfachen des Basiswertes). Unter Stresseinwirkung
steigt auch der Adrenalinspiegel an - bei akuter Extrembelastung bis auf das Zehnfache.  Adrenalin bewirkt erhöhte physische Belastbarkeit (Kreislauf, Blutzuckerspiegel, im ZNS Zunahme der Erregbarkeit und Aktivierung im Sinne erhöhter Kampf- oder Fluchtbereitschaft).
Adrenalin bewirkt erhöhte physische Belastbarkeit (Kreislauf, Blutzuckerspiegel, im ZNS Zunahme der Erregbarkeit und Aktivierung im Sinne erhöhter Kampf- oder Fluchtbereitschaft). Näheres zur Adrenalinwirkung an Rezeptoren s. dort
Näheres zur Adrenalinwirkung an Rezeptoren s. dort α-Rezeptoren bewirken Vasokonstriktion in Haut und Eingeweiden
α-Rezeptoren bewirken Vasokonstriktion in Haut und Eingeweiden β1-Rezeptoren steigern Kontraktionskraft und Frequenz des Herzens (
β1-Rezeptoren steigern Kontraktionskraft und Frequenz des Herzens ( Abbildung)
Abbildung) β2-Rezeptoren bewirken
Vasodilatation in Muskel- und Koronararterien, Erweiterung der
Bronchien (erleichterte Luftströmung), Erhöhung der Konzentration
energiereicher Moleküle im Blut (Glucose, Lactat, freie Fettsäuren)
β2-Rezeptoren bewirken
Vasodilatation in Muskel- und Koronararterien, Erweiterung der
Bronchien (erleichterte Luftströmung), Erhöhung der Konzentration
energiereicher Moleküle im Blut (Glucose, Lactat, freie Fettsäuren)  (52 Aminosäuren, biologische Halbwertszeit ~20 Minuten) stammt aus dem
Nebennierenmark (daher der Name), aber auch anderen Geweben (Lunge,
Niere, auch Herz u.a.). Es beteiligt sich an der "Feineinstellung" in der Kreislaufregulation, steigert die glomeruläre Filtration und Natriurese. In Situationen,
die zu einer Verstärkung der sympathischen Aktivität führen (z.B. bei Orthostase),
steigt seine Konzentration im Blut an. Das liegt wahrscheinlich daran,
dass sympathische Aktivität zur Freisetzung dieses Hormons führt.
(52 Aminosäuren, biologische Halbwertszeit ~20 Minuten) stammt aus dem
Nebennierenmark (daher der Name), aber auch anderen Geweben (Lunge,
Niere, auch Herz u.a.). Es beteiligt sich an der "Feineinstellung" in der Kreislaufregulation, steigert die glomeruläre Filtration und Natriurese. In Situationen,
die zu einer Verstärkung der sympathischen Aktivität führen (z.B. bei Orthostase),
steigt seine Konzentration im Blut an. Das liegt wahrscheinlich daran,
dass sympathische Aktivität zur Freisetzung dieses Hormons führt.  Kreislauf (Vasodilatation plus Salzverlust: langanhaltender
hypotensiver Effekt, verstärkt durch Hemmung des Durstempfindens)
Kreislauf (Vasodilatation plus Salzverlust: langanhaltender
hypotensiver Effekt, verstärkt durch Hemmung des Durstempfindens) Herz (positiv chronotroper Effekt)
Herz (positiv chronotroper Effekt) Hormonsekretion (negatives Feedback bei Kreislaufbelastung:
gebremste Sekretion von ACTH, Renin-Angiotensin-Aldosteron-System, Endothelin
und Vasopressin)
Hormonsekretion (negatives Feedback bei Kreislaufbelastung:
gebremste Sekretion von ACTH, Renin-Angiotensin-Aldosteron-System, Endothelin
und Vasopressin) Atmung (Bronchodilatation)
Atmung (Bronchodilatation) Salz-Wasserhaushalt (Diurese und Natriurese)
Salz-Wasserhaushalt (Diurese und Natriurese) Autonomes Nervensystem (Steigerung des Sympathikustonus).
Autonomes Nervensystem (Steigerung des Sympathikustonus).

 Myoendokrine
Zellen im Herz (vor allem rechter Vorhof) reagieren auf stark
steigenden Füllungsdruck (z.B. Hinlegen, rasche Kochsalzinfusion) mit
Freisetzung natriuretischer Peptide. Diese wirken vasodilatierend,
natriuretisch, auf das Herz relaxierend (lusitrop), hemmen
Sympathikustonus und antagonistische Hormone und entlasten das Herz:
Extrazelluläres Flüssigkeitsvolumen, Plasmavolumen, kardiale Vorlast
und diastolische Dehnung des Herzmuskels nehmen ab Myoendokrine
Zellen im Herz (vor allem rechter Vorhof) reagieren auf stark
steigenden Füllungsdruck (z.B. Hinlegen, rasche Kochsalzinfusion) mit
Freisetzung natriuretischer Peptide. Diese wirken vasodilatierend,
natriuretisch, auf das Herz relaxierend (lusitrop), hemmen
Sympathikustonus und antagonistische Hormone und entlasten das Herz:
Extrazelluläres Flüssigkeitsvolumen, Plasmavolumen, kardiale Vorlast
und diastolische Dehnung des Herzmuskels nehmen ab Durch Vasodilatation erhöhen natriuretische Peptide kortikale
Perfusion, Kapillardruck und glomeruläre Filtrationsrate in der Niere.
Zu den natriuretischen Peptiden zählen ANP (Atriopeptin, Cardiodilatin)
aus den Herzvorhöfen (Volumenüberlastung), BNP vorwiegend aus dem
Ventrikelgebiet, CNP aus Endothel- und renalen Zellen, Urodilatin aus
Endothel- und Tubuluszellen. Ihr Hauptwirkort sind renale Sammelrohre,
wo bis zu 5% des glomerulär filtrierten Natriums rückresorbiert werden
können - über nichtselektive Kationenkanäle und selektive Natriumkanäle.
NP-Rezeptoren vom Typ A binden ANP und BNP, Typ B bindet CNP, Typ C ist
vermutlich ein Clearance-Rezeptor. Typ-A-Rezeptoren wirken in
Hypothalamus (Durst, verminderte Vasopressinsekretion), Niere (Vasodilatation / Natriurese), Nebenniere (Hemmung der Aldosteronbildung), Endothelien (Hemmung der Endothelinbildung);
extrazelluläres Volumen und Blutdruck nehmen ab. Die Konzentration an
natriuretischen Peptiden im Blutplasma ist normalerweise extrem gering Durch Vasodilatation erhöhen natriuretische Peptide kortikale
Perfusion, Kapillardruck und glomeruläre Filtrationsrate in der Niere.
Zu den natriuretischen Peptiden zählen ANP (Atriopeptin, Cardiodilatin)
aus den Herzvorhöfen (Volumenüberlastung), BNP vorwiegend aus dem
Ventrikelgebiet, CNP aus Endothel- und renalen Zellen, Urodilatin aus
Endothel- und Tubuluszellen. Ihr Hauptwirkort sind renale Sammelrohre,
wo bis zu 5% des glomerulär filtrierten Natriums rückresorbiert werden
können - über nichtselektive Kationenkanäle und selektive Natriumkanäle.
NP-Rezeptoren vom Typ A binden ANP und BNP, Typ B bindet CNP, Typ C ist
vermutlich ein Clearance-Rezeptor. Typ-A-Rezeptoren wirken in
Hypothalamus (Durst, verminderte Vasopressinsekretion), Niere (Vasodilatation / Natriurese), Nebenniere (Hemmung der Aldosteronbildung), Endothelien (Hemmung der Endothelinbildung);
extrazelluläres Volumen und Blutdruck nehmen ab. Die Konzentration an
natriuretischen Peptiden im Blutplasma ist normalerweise extrem gering  Der Katecholaminspiegel im Blut ist ein Maß für die ergotrope Aktivitätslage. Noradrenalin wirkt auf α- (Vasokonstriktion in Haut und Eingeweiden) und ß1-Rezeptoren (Herz), seine Konzentration nimmt mit der Sympathikusaktivität bis zum Mehrfachen des Basiswertes zu. Stress erhöht auch den Adrenalinspiegel (bis 10-fach: Wirkung auch auf β2-Rezeptoren - Vasodilatation in Muskel- und Koronararterien, Bronchodilatation), steigert Glukose, Lactat, freie Fettsäuren im Blut und erhöht physische Belastbarkeit, Kampf- / Fluchtbereitschaft Der Katecholaminspiegel im Blut ist ein Maß für die ergotrope Aktivitätslage. Noradrenalin wirkt auf α- (Vasokonstriktion in Haut und Eingeweiden) und ß1-Rezeptoren (Herz), seine Konzentration nimmt mit der Sympathikusaktivität bis zum Mehrfachen des Basiswertes zu. Stress erhöht auch den Adrenalinspiegel (bis 10-fach: Wirkung auch auf β2-Rezeptoren - Vasodilatation in Muskel- und Koronararterien, Bronchodilatation), steigert Glukose, Lactat, freie Fettsäuren im Blut und erhöht physische Belastbarkeit, Kampf- / Fluchtbereitschaft  Adrenomedullin - ein Peptidhormon aus Nebennierenmark und zahlreichen weiteren Geweben - wirkt vasodilatatorisch, steigert die glomeruläre Filtration und Natriurese. Orthostase und starke körperliche Belastung erhöhen seinen Blutspiegel. Es fördert den Sympathikustonus und regt Kreislauf und Atmung an (Bronchodilatation) Adrenomedullin - ein Peptidhormon aus Nebennierenmark und zahlreichen weiteren Geweben - wirkt vasodilatatorisch, steigert die glomeruläre Filtration und Natriurese. Orthostase und starke körperliche Belastung erhöhen seinen Blutspiegel. Es fördert den Sympathikustonus und regt Kreislauf und Atmung an (Bronchodilatation) |
