
 Herzmechanik
Herzmechanik
© H.
Hinghofer-Szalkay
 Anrep-Effekt: Nach Gleb von Anrep (Russischer Physiologe)
Anrep-Effekt: Nach Gleb von Anrep (Russischer Physiologe)
Arrhythmie: α- = un-, ρυθμός = gleichmäßige Bewegung, Takt
Atrium: Empfangsraum (Vorhof)
Bowditch-Effekt: Henry P. Bowditch
Diastole: διαστολή = Ausdehnung
Ejection fraction: (lat) e = aus, iacere = werfen, fractio = Anteil (Auswurffraktion)
Frank-Starling-Mechanismus: Otto
Frank, Ernest Starling
Mechanismus: μηχανή = Kran, Werkzeug, Maschine
Systole: συστολή = Zusammenziehen
Ventrikel: venter = Bauch (ventriculus = kleiner Bauch)
Wiggers-Diagramm: Carl J. Wiggers
Der Herzmuskel (0,4% der Körpermasse) verbraucht knapp 30 ml Sauerstoff pro Minute - ein Zehntel des Bedarfs für den gesamten (ruhenden) Organismus (~300 ml O2/min). Die myokardiale
Durchblutung (Koronarperfusion) beansprucht ~5% des Herzzeitvolumens - der Ausnützungsgrad des
arteriell angebotenen O2
ist sehr hoch (~75%, der gesamte ruhende Körper nutzt ~25%) und kann kaum gesteigert werden. Bei
körperlicher Belastung nimmt daher vor allem die Durchblutung des
Herzmuskels zu. Der spezifische Sauerstoffverbrauch des Herzmuskels beträgt an die 10 ml O2/min/100g bei körperlicher Ruhe, bei Ausbelastung bis über 50 ml/min/100g.
Bei jedem Herzschlag verursacht die beginnende Kontraktion (Systole) der Herzkammern (Ventrikel) einen kurzen Rückstrom des Blutes, was die Herzklappen zu den Vorhöfen (AV- oder Segelklappen) schließt (das erzeugt den "Muskelton" oder ersten Herzton). Der Ventrikeldruck steigt daraufhin an (Anspannungszeit), bis die Klappen zu Aorta und Pulmonalarterie (Semilunar- oder Taschenklappen) öffnen und ein Teil des gespeicherten Blutes (das Schlagvolumen) aus den Ventrikel in Aorta (links) bzw. a. pulmonalis (rechts) ausströmt (Austreibungszeit).
Ein Restvolumen bleibt im Herzen zurück; unter Auswurffraktion (ejection fraction)
versteht man den Anteil des Schlagvolumens an der enddiastolischen
Füllung (=Restvolumen + Schlagvolumen). Die Auswurffraktion sollte mindestens 50%
der enddiastolischen Füllung betragen.
Es folgt die Phase entspannten Myokards (Diastole):
Der Ventrikeldruck sinkt ab, der Blutstrom wendet sich für einen Augenblick zum Ventrikel
zurück, worauf die Semilunarklappen schließen (das verursacht den
Klappenton oder zweiten Herzton). Kurz sind beide Klappen geschlossen (Entspannungszeit), dann öffnen die AV-Klappen zu den Vorhöfen und lassen Blut aus den Atrien (=Vorhöfen) nachströmen (Füllungszeit).
Die Bedingungen an Einstrom-
(venös) und Ausstromseite (arteriell) bestimmen die Herztätigkeit: Das in der Füllungszeit zuströmende
venöse Blutangebot nennt man Vorlast (preload), den in der Austreibungszeit wirkenden dynamischen Widerstand auf der arteriellen Seite (klinisches Maß: Blutdruck) Nachlast (afterload).
Nimmt die Vorlast zu, erhöht sich die diastolische Füllung und der
Ventrikel wirft mehr Blut aus ("angebotsorientierte Pumpe"); nimmt die
Nachlast zu, sinkt
das Schlagvolumen (vorübergehend) wegen des gesteigerten Widerstandes.
Der Frank-Starling-Mechanismus bewirkt, dass das Herz - autonom - auf erhöhte
Füllung mit vermehrter Pumpleistung reagiert. Damit passt es seine Tätigkeit ohne Zutun des
Nervensystems auf
Veränderungen von Vor- und Nachlast an.
|
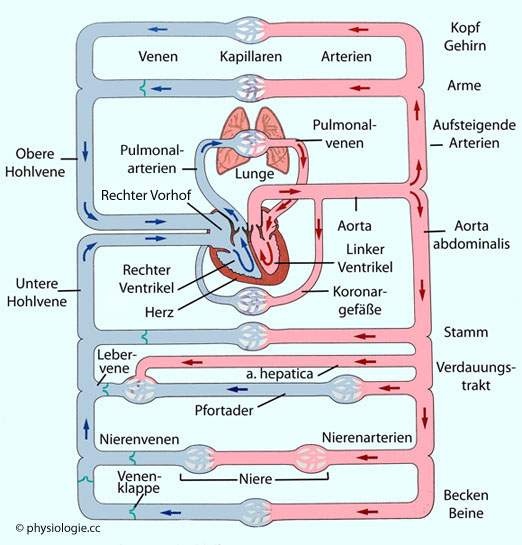
 Abbildung: Herz und Blutkreislauf
Nach einer Vorlage bei Silverthorn, Human Physiology - an integrated approach, 4th ed. Pearson International 2007
Abbildung: Herz und Blutkreislauf
Nach einer Vorlage bei Silverthorn, Human Physiology - an integrated approach, 4th ed. Pearson International 2007
Schema
des kardiovaskulären Systems. Das rechte Herz empfängt venöses
(sauerstoffarmes) Blut aus dem Körper und pumpt dieses durch die Lunge,
wo es arterialisiert (mit Sauerstoff beladen) - und ein Teil des aus
dem Stoffwechsel stammenden Kohlendioxids abgeatmet - wird. Arterielles
Blut wird vom linken Herzen durch den Körper befördert, dazu dient der
arterielle Blutdruck.
Die vom Herzen ausgeworfene Blutmenge pro Zeit ist das Herzzeitvolumen (cardiac output,
gewöhnlich in Liter pro Minute angegeben). Die Durchblutung der
einzelnen Körpergebiete bzw. Organe hängt wesentlich vom
Strömungswiderstand ab, der wiederum von der Weite der jeweiligen
Arteriolensysteme abhängt. Die Austauschgefäße (Kapillaren), aus denen
Sauerstoff und Nährstoffe zum Gewebe austreten, Kohlendioxid und
Stoffwechselendprodukte in das Blut eintreten, und über die
verschiedene andere Stoffe (z.B. Hormone) ausgetauscht werden, sind symbolisch als Gefäßnetze dargestellt
 Das rechte Herz erzeugt Strömung von Blut (das oxygeniert werden soll) aus der Peripherie durch den Lungenkreislauf, das linke generiert Druck, mittels dessen arterielles Blut in den Kreislauf gepumpt wird. Die Menge an gefördertem Blut (das Herzzeitvolumen)
kann an den Bedarf der Gewebe angepasst werden. Zusätzlich ist das Herz
endokrin aktiv, es beteiligt sich an der Regulierung des
Plasmavolumens; intensive Dehnung der Herzräume führt zur Ausschüttung natriuretischer Peptide, die in den Nieren eine vermehrte Salzausscheidung (Natriurese) und damit Reduktion des Blutvolumens bewirken.
Das rechte Herz erzeugt Strömung von Blut (das oxygeniert werden soll) aus der Peripherie durch den Lungenkreislauf, das linke generiert Druck, mittels dessen arterielles Blut in den Kreislauf gepumpt wird. Die Menge an gefördertem Blut (das Herzzeitvolumen)
kann an den Bedarf der Gewebe angepasst werden. Zusätzlich ist das Herz
endokrin aktiv, es beteiligt sich an der Regulierung des
Plasmavolumens; intensive Dehnung der Herzräume führt zur Ausschüttung natriuretischer Peptide, die in den Nieren eine vermehrte Salzausscheidung (Natriurese) und damit Reduktion des Blutvolumens bewirken.
Herz und Kreislauf beeinflussen einander gegenseitig
 Herz: idg. *k[e]rd (→ cor, καρδία), got. hairto (→ engl. heart)
Herz: idg. *k[e]rd (→ cor, καρδία), got. hairto (→ engl. heart)
Mehrere
tausend Liter Blut fördert das Herz einer erwachsenen Person
pro 24 Stunden - etwa 1500-mal den Betrag des Blutvolumens (~5 l). Das ist notwendig, um mittels Konvektion einen ausreichenden Stofftransport im Organismus zu ermöglichen, Sauerstoff an- und Kohlendioxid abzutransportieren und
den Austausch mit anderen Kompartimenten (Interstitium,
intrazelluläre Flüssigkeit u.a.) zu garantieren. Unterstützt durch
periphere Mechanismen (Muskelpumpe, Venenklappen), ist es vor allem das
Herz, das die notwendige Kraftentfaltung (Pump- und Sogwirkung) übernimmt.
Mit
jedem Herzschlag wird aus beiden Herzkammern (Ventrikeln  ) ein Volumen
von je ~70 ml ausgeworfen - gegen einen Druck von ~2 kPa (~15 mmHg) im Lungenkreislauf (rechtes Herz) und ~13
kPa (~100 mmHg) im großen Kreislauf (linkes Herz).
) ein Volumen
von je ~70 ml ausgeworfen - gegen einen Druck von ~2 kPa (~15 mmHg) im Lungenkreislauf (rechtes Herz) und ~13
kPa (~100 mmHg) im großen Kreislauf (linkes Herz).
Pro Herzschlag erbringt der Herzmuskel etwas mehr als 1
Nm Arbeit (1 Nm = 1 J = 1 Ws); die mechanische Leistung beträgt gut 1 Watt. Der Wirkungsgrad des Herzschlags beträgt 20-25%,
der gesamte Energieaufwand daher ~5 W (5% des gesamten Ruheumsatzes des Organismus: ~100 W).
3/4 des Energieverbrauchs gehen in die Kontraktion des Herzens, 1/4 in die Aufrechterhaltung von Membranpotentialen und der Struktur. Der spezifische Sauerstoffverbrauch beträgt in körperlicher Ruhe 8-10 ml O2/min/100g (wie graue Substanz im Gehirn) und kann bei Muskelarbeit bis >50 ml/min/100g steigen (der höchste Wert aller Gewebe). Das Herz ist ein 'hot spot' der
Wärmebildung,  s. dort.
Das
Herz wirkt als Pumpe: Es hat Klappen mit
Ventilwirkung, saugt Blut aus
Niederdruckgefäßen (Hohlvenen, Lungenvenen) und pumpt es -
Schlagvolumen für Schlagvolumen - in arterielle Gefäße
(Lungenschlagader bzw. Aorta). Volumen, Strömung und Druck sind miteinander verknüpft (Gesetze der Hämodynamik).
s. dort.
Das
Herz wirkt als Pumpe: Es hat Klappen mit
Ventilwirkung, saugt Blut aus
Niederdruckgefäßen (Hohlvenen, Lungenvenen) und pumpt es -
Schlagvolumen für Schlagvolumen - in arterielle Gefäße
(Lungenschlagader bzw. Aorta). Volumen, Strömung und Druck sind miteinander verknüpft (Gesetze der Hämodynamik).
Da der rechte Ventrikel mit dem Lungenkreislauf einen verhältnismäßig
geringen Strömungswiderstand vorfindet, kommt er mit einer Wanddicke
von lediglich 3 mm zurecht, um den erforderlichen Druck von maximal 3-4
kPa aufzubauen (linkes Herz: ~40 kPa).
Systole und Diastole, Vorlast und Nachlast
 Über Vorlast und Nachlast s. auch dort
Über Vorlast und Nachlast s. auch dort
Systole (=Kontraktion des
Myokards) und Diastole  (=Erschlaffung des Myokards) wechseln einander ab. Die Dauer der Abschnitte des Herzzyklus ist abhängig von der Schlagfrequenz, auch die relativen Zeitanteile (
(=Erschlaffung des Myokards) wechseln einander ab. Die Dauer der Abschnitte des Herzzyklus ist abhängig von der Schlagfrequenz, auch die relativen Zeitanteile ( Abbildung):
Abbildung):
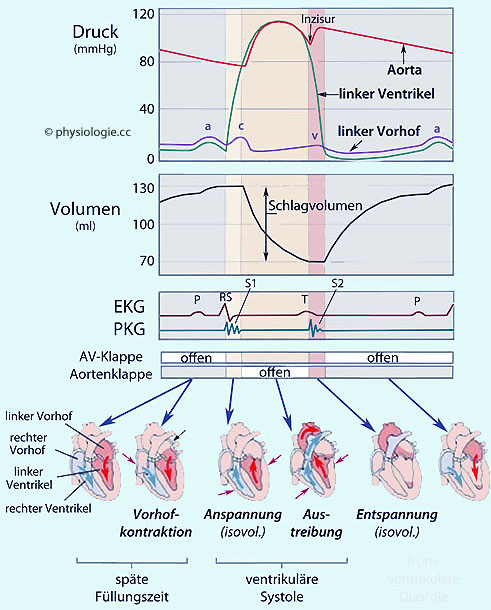
 Abbildung: Wiggers-Diagramm,
Abbildung: Wiggers-Diagramm,  Klappenspiel, Herzzyklus
Nach einer Vorlage bei Pearson Education 2016
Klappenspiel, Herzzyklus
Nach einer Vorlage bei Pearson Education 2016
Das Diagramm zeigt Aortendruck,
Ventrikeldruck, Vorhofdruck, Ventrikelvolumen und EKG; optional auch
PKG und Blutströmung als Funktion der Zeit.
Die Steilheit des Druckanstiegs im Ventrikel während der Anspannungszeit (grüne Kurve im hellgelben Feld) reflektiert seine Kontraktilität.
a, c, v, atriale Druckwellen (Venenpuls)  EKG, Elektrokardiogramm
EKG, Elektrokardiogramm  PKG, Phonokardiogramm
PKG, Phonokardiogramm  S1, S2, Herztöne
S1, S2, Herztöne

Das
bedeutet, mit steigender Pulsfrequenz nimmt vor allem die Dauer der Diastole
ab; diese ist eine zeitliche Reserve für den Fall, dass das Herz hohe Pumpleistung (bei hoher Schlagfrequenz) erbringen muss.
Bezüglich Blutangebot und Druckwerten im Kreislauf ist das Herz mit folgenden mechanischen Bedingungen konfrontiert:
 Einerseits bestimmt die diastolische Füllung (Vorlast)
die Vordehnung und damit die systolische Kraftentfaltung
("angebotsorientierte" Pumpe, Frank-Starling-Mechanismus:
je mehr Füllung, desto stärkere
Pumpaktion).
Einerseits bestimmt die diastolische Füllung (Vorlast)
die Vordehnung und damit die systolische Kraftentfaltung
("angebotsorientierte" Pumpe, Frank-Starling-Mechanismus:
je mehr Füllung, desto stärkere
Pumpaktion).
 Definiert wird die Vorlast (preload)
als die Länge der Herzmuskelfasern zu Beginn einer Systole, oder der
intraluminale Druck, der den Ventrikel zu seiner
enddiastolischen Größe ausdehnt. Diese Länge der
ventrikulären Myozyten bzw. deren Sarkomeren ist in
vivo nicht ermittelbar, daher die Konvention, den diastolischen
Füllungsdruck (Zentralvenendruck) als indirektes Maß für die Dehnung
der Herzmuskelzellen zu nehmen.
Definiert wird die Vorlast (preload)
als die Länge der Herzmuskelfasern zu Beginn einer Systole, oder der
intraluminale Druck, der den Ventrikel zu seiner
enddiastolischen Größe ausdehnt. Diese Länge der
ventrikulären Myozyten bzw. deren Sarkomeren ist in
vivo nicht ermittelbar, daher die Konvention, den diastolischen
Füllungsdruck (Zentralvenendruck) als indirektes Maß für die Dehnung
der Herzmuskelzellen zu nehmen.
 Die Vorlast wurde früher als "vis a tergo"
bezeichnet, also die Kraft, welche von der venösen bzw. Einstromseite
auf die Ventrikelwände wirkt, wenn Blut aus dem Venensystem (rechtes
Herz) bzw. aus der Lunge (linkes Herz) nachströmt und das Myokard dehnt.
Die Vorlast wurde früher als "vis a tergo"
bezeichnet, also die Kraft, welche von der venösen bzw. Einstromseite
auf die Ventrikelwände wirkt, wenn Blut aus dem Venensystem (rechtes
Herz) bzw. aus der Lunge (linkes Herz) nachströmt und das Myokard dehnt.

 Abbildung: Körperposition und Sichtbarkeit der Halsvene
Nach einer Vorlage in Talley & O'Conner: Clinical Examination, 6th ed. Churchill Livingstone 2010
Abbildung: Körperposition und Sichtbarkeit der Halsvene
Nach einer Vorlage in Talley & O'Conner: Clinical Examination, 6th ed. Churchill Livingstone 2010
Unter
normalen Bedingungen (1G Schwerkrafteinfluss, normales Blutvolumen,
gesundes Herz) ist die Jugularvene im Liegen deutlich gefüllt, bei
aufrecht gelagertem Oberkörper hingegen kollabiert (nicht sichtbar).
Bei 45-Grad-Lagerung sind die venösen Pulsationen bis etwa zur halben
Strecke zur Schädelbasis erkennbar, der transmurale Druck pendelt um den Nullwert

Normalerweise
verschwinden die - in liegender oder halb-aufrechter Körperposition mit
Blut gefüllten - Venen im Halsbereich, wenn sich eine Person aufsetzt
oder aufsteht ( Abbildung).
Bleiben die Venen gefüllt, bedeutet das einen erhöhten venösen Druck -
das kann physiologische Ursachen haben (Pressen, lautes Singen oder
Schreien, Stresssituationen) oder auf eine Herzinsuffizienz hinweisen
(Rückstau des Blutes vor dem rechten Herzen).
Abbildung).
Bleiben die Venen gefüllt, bedeutet das einen erhöhten venösen Druck -
das kann physiologische Ursachen haben (Pressen, lautes Singen oder
Schreien, Stresssituationen) oder auf eine Herzinsuffizienz hinweisen
(Rückstau des Blutes vor dem rechten Herzen).
Als Maß für die Vorlast gilt in der Praxis

der enddiastolische Druck (rechtes Herz: Zentralvenendruck, linkes Herz: Druck im
Pulmonalkreislauf -
pulmonary capillary wegde pressure PWCP, messbar mittels
Rechtsherzkatheter) oder
 das enddiastolische Volumen des linken Ventrikels (LVEDV), das echokardiographisch ermittelt werden kann.
das enddiastolische Volumen des linken Ventrikels (LVEDV), das echokardiographisch ermittelt werden kann.

Andererseits muss
das Herz während der Systole (
Austreibungszeit) den Widerstand
(hydrodynamische Impedanz) des nachgeschalteten Arteriensystems (rechts der Lunge, links des Körpers) überwinden (
Nachlast).

Unter
Nachlast (afteroad)versteht
man die Belastung, mit der es die sich kontrahierenden ventrikulären
Myozyten während der Austreibungszeit zu tun haben und die ihrer
Verkürzung entgegensteht.
Auch für die Abschätzung der Nachlast sind Messungen direkt am Myokard
nicht möglich, und es werden Druckwerte als klinisch praktikables Maß
herangezogen:
Für das rechte Herz ist dies der Pulmonalarteriendruck, für das linke
der
arterielle Blutdruck (jeweils während der Austreibungszeit).
 Die Nachlast wurde früher als "vis a fronte"
bezeichnet, also die Kraft, die das Herz aufbringen muss, um den Druck
im Arteriensystem (linkes Herz) bzw. im Lungenkreislauf (rechtes Herz)
zu überwinden und das Schlagvolumen auszutreiben.
Die Nachlast wurde früher als "vis a fronte"
bezeichnet, also die Kraft, die das Herz aufbringen muss, um den Druck
im Arteriensystem (linkes Herz) bzw. im Lungenkreislauf (rechtes Herz)
zu überwinden und das Schlagvolumen auszutreiben.
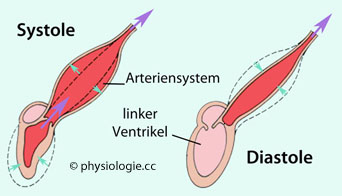
 Abbildung: Windkesseleffekt (schematisch)
Abbildung: Windkesseleffekt (schematisch)
Während
der Systole wird ein Teil des Schlagvolumens zur elastischen Dehnung
der herznahen Gefäße (Aorta) verwendet. Dadurch muss weniger Blut in
die Peripherie beschleunigt werden und der Ventrikel wird entlastet.
In
der Diastole wird die investierte Energie zur weiteren Versorgung der
Peripherie mit Blut verwendet, Blut strömt aus der Aorta Richtung Peripherie - die Perfusion bleibt (wenn auch auf
niedrigerem Niveau) bestehen, obwohl der Zustrom am Eingang des
Arteriensystems sistiert
 vgl. dort
vgl. dort

Die Dehnbarkeit (compliance)
der Aorta spielt für die linkskardiale Nachlast eine besondere Rolle:
Der
Aortenbogen und die unmittelbar vor und nach ihm gelegenen Abschnitte
repräsentieren etwa die Hälfte der Dehnungsfähigkeit des gesamten
Arteriensystems (Windkesselfunktion,  Abbildung).
Die
mechanischen Eigenschaften der herznahen Aortenteile sind daher für die
Nachlast des Herzens von großer Bedeutung: Bei Sklerosierung der Aorta erhöht
sich die Herzarbeit, die zur Beschleunigung einer (bei
Aortenverhärtung funktionell längeren) Blutsäule nötig ist.
Abbildung).
Die
mechanischen Eigenschaften der herznahen Aortenteile sind daher für die
Nachlast des Herzens von großer Bedeutung: Bei Sklerosierung der Aorta erhöht
sich die Herzarbeit, die zur Beschleunigung einer (bei
Aortenverhärtung funktionell längeren) Blutsäule nötig ist.
 Druckbereiche
Druckbereiche
Zentralvenendruck / Druck in rechtem Vorhof (Vorlast rechtes Herz): lageabhängig
(im Liegen 4-8 mmHg, im Sitzen / Stehen um ~5 mmHg niedriger)
Druck in Pulmonalarterie (Nachlast rechtes Herz): systolisch <25 mmHg, diastolisch <10 mmHg
Druck in linkem Vorhof (Vorlast linkes Herz - gemessen über PCWP): <15 mmHg (6-12 mmHg)
Druck in Aorta (Nachlast linkes Herz): systolisch <140 mmHg, diastolisch <90 mmHg

Mitteldruckwerte Herzräume
mmHg, gerundet
Liegende erwachsene Person

Nach Herring / Paterson, Levick's Introduction to Cardiovascular Physiology, 6th ed. 2018
|
|
Rechts
|
Links
|
Vorhof
|
3
|
8
|
Ventrikel enddiastolisch
|
4
|
9
|
Ventrikel endsystolisch
|
25
|
120
|
 Über arterielle Blutdruckmessung s. dort
Über arterielle Blutdruckmessung s. dort

Im EKG bedeuten
 die P-Welle die Erregungsausbreitung über beide Vorhöfe,
die P-Welle die Erregungsausbreitung über beide Vorhöfe,
 der QRS-Komplex die Erregungsausbreitung über beide Ventrikel,
der QRS-Komplex die Erregungsausbreitung über beide Ventrikel,
 die T-Welle die Repolarisation der Ventrikel
die T-Welle die Repolarisation der Ventrikel
Im Venenpuls bedeuten
 die a-Welle den Druckansteg bei der beginnenden Vorhofkontraktion,
die a-Welle den Druckansteg bei der beginnenden Vorhofkontraktion,
 die c-Welle das Vorwölben der AV-Klappen während der Anspannungszeit des Ventrikels,
die c-Welle das Vorwölben der AV-Klappen während der Anspannungszeit des Ventrikels,
 die x-Senke die Verschiebung der Ventilebene zur Herzspitze,
die x-Senke die Verschiebung der Ventilebene zur Herzspitze,
 die v-Welle den frühdiastolischen Druckanstieg (Entspannungszeit),
die v-Welle den frühdiastolischen Druckanstieg (Entspannungszeit),
 die y-Senke den Druckabfall nach Öffnen der AV-Klappen
die y-Senke den Druckabfall nach Öffnen der AV-Klappen
Im Phonokardiogramm bedeuten
 S1 den ersten Herzton (Kontraktion der Ventrikel),
S1 den ersten Herzton (Kontraktion der Ventrikel),
 S2 den zweiten Herzton (Schluss der Taschenklappen)
S2 den zweiten Herzton (Schluss der Taschenklappen)

Die herznahen Teile des Arteriensystems sind relativ dehnungselastisch, was Beschleunigungsarbeit minimiert (Windkesseleffekt:
während der Systole wird etwa die Hälfte des Schlagvolumens herznah
'zwischengespeichert', wie Backen, die man aufbläst) - während der
Diastole fließt dieses Blut peripherwärts weiter.
Dies trägt auch dazu bei, dass der Blutfluss in der Peripherie weniger ruckartig, d.h.
kontinuierlicher abläuft als dies ohne die elastische Dehnbarkeit der
Gefäßwände möglich wäre.
Systolischer Druck und Herzzeitvolumen: Mit steigendem Schlagvolumen (höhere Herzarbeit bei Belastung)
nimmt der systolische Druck zu, weil das Schlagvolumen größer wird
(stärkere Dehnung der Arterien) und die Herzfrequenz steigt.
Andererseits nimmt der Druck diastolisch rascher ab als in Ruhe: Der
periphere Widerstand sinkt, damit fließt das Blut leichter in die
Peripherie ab; das Ergebnis ist ein kaum veränderter diastolischer Druck.
Systolischer Druck und Alter: Je
weniger dehnungsfreudig die Wände der großen Arterien sind, umso
steiler sind die Blutdruckoszillationen mit dem Herzzyklus. Im Alter nimmt
oft die Aortendehnbarkeit ab (mehr Kollagen, weniger Elastin), der
unmittelbar zu beschleunigende Anteil des Schlagvolumens nimmt zu, das
Herz muss mehr Energie aufbringen - und es erhöht sich der systolische
Blutdruck.
Klappenspiel und Herztöne
Herzklappen
haben Ventilfunktion:
 Sie schließen, wenn Blut sich retrograd (gegen die Stromrichtung) bewegt und die Klappe so zudrückt.
Sie schließen, wenn Blut sich retrograd (gegen die Stromrichtung) bewegt und die Klappe so zudrückt.
 Ist der Druck vor der Klappe größer als hinter ihr,
öffnet sie und Blut strömt orthograd (in Stromrichtung) durch den Klappenring.
Ist der Druck vor der Klappe größer als hinter ihr,
öffnet sie und Blut strömt orthograd (in Stromrichtung) durch den Klappenring.

 Abbildung: HerzklappenspielNach einer Vorlage bei Silverthorn, Human Physiology, an integrated approach, 4th Int'l ed. 2007, Pearson / Benjamin Cummings
Abbildung: HerzklappenspielNach einer Vorlage bei Silverthorn, Human Physiology, an integrated approach, 4th Int'l ed. 2007, Pearson / Benjamin Cummings
Links virtueller Blick nach Entfernung von Vorhöfen und arteriellen Gefäßen (Inset: Schnittlinie) auf die Ventrikel, rechts virtueller Blick auf das geöffnete linke Herz.
Während der Ventrikelkontraktion (Austreibungsphase) sind die Papillarmuskeln kontrahiert, die Sehnenfäden
(chordae tendineae) angespannt, was die Segel der Mitralklappe davor
bewahrt, in den Vorhof ausgestülpt zu werden. So bleibt die Klappe
suffizient, ein retrograder Rückstrom von Blut während der
Ventrikelkontraktion wird verhindert. (Analoges gilt für die
Tricuspidalklappe im rechten Ventrikel)

Beim Schließen und Öffnen der Klappen treten Schwingungen auf, die teilweise im hörbaren Frequenzbereich liegen (Herztöne). Der erste Herzton (S1) markiert den Beginn der Systole (Anspannung der Ventrikelwand, Schluss
der Atrioventrikularklappen), der zweite (S2) den Beginn der Diastole
(Entspannung der Ventrikel, Schluss der Aorten- bzw. Pulmonalklappe).
Der zweite Herzton erklingt am Beginn der Entspannungszeit der Ventrikel
|
Ein Herzschlag gliedert sich in vier Funktionsphasen
Systole
 Die
Anspannungszeit (isovolumetric contraction) beginnt mit dem Schließen der Segelklappen und endet
mit dem Öffnen der Taschenklappen. Die
Mitralklappe schließt normalerweise etwas früher als die
Trikuspidalklappe, was in einem "gespaltenen" 1. Herzton resultiert. Die Trikuspidalklappe stülpt sich infolge des Druckanstiegs im rechten Ventrikel vorhofwärts vor, was die c-Welle im Druckverlauf des rechten Vorhofs bzw. der zentralen Venen ("Venenpuls") verursacht.
Sind alle Klappen geschlossen, steigert die Ventrikelkontraktion den Druck in den Kammern. Diese Phase der Systole ist isovolumetrisch, weil sich das Volumen im Ventrikel (=enddistolisches Volumen) nicht ändert.
Die während dieser Zeit gespeicherte potentielle Energie
(Druckaufbau) wird in der Austreibungsphase in kinetische Energie umgesetzt (Beschleunigung des Blutes).
Die
Anspannungszeit (isovolumetric contraction) beginnt mit dem Schließen der Segelklappen und endet
mit dem Öffnen der Taschenklappen. Die
Mitralklappe schließt normalerweise etwas früher als die
Trikuspidalklappe, was in einem "gespaltenen" 1. Herzton resultiert. Die Trikuspidalklappe stülpt sich infolge des Druckanstiegs im rechten Ventrikel vorhofwärts vor, was die c-Welle im Druckverlauf des rechten Vorhofs bzw. der zentralen Venen ("Venenpuls") verursacht.
Sind alle Klappen geschlossen, steigert die Ventrikelkontraktion den Druck in den Kammern. Diese Phase der Systole ist isovolumetrisch, weil sich das Volumen im Ventrikel (=enddistolisches Volumen) nicht ändert.
Die während dieser Zeit gespeicherte potentielle Energie
(Druckaufbau) wird in der Austreibungsphase in kinetische Energie umgesetzt (Beschleunigung des Blutes).
 Die
Austreibungszeit (outflow phase) beginnt mit
dem Öffnen und endet mit dem Schließen der
Taschenklappen.
Die Klappen öffnen, sobald der Druck im Ventrikel
denjenigen in Pulmonalarterien bzw. Aorta übersteigt. In dieser Phase
ändern sich sowohl Druck als auch Volumen im Ventrikel (auxotonische Kontraktion).
Die
Austreibungszeit (outflow phase) beginnt mit
dem Öffnen und endet mit dem Schließen der
Taschenklappen.
Die Klappen öffnen, sobald der Druck im Ventrikel
denjenigen in Pulmonalarterien bzw. Aorta übersteigt. In dieser Phase
ändern sich sowohl Druck als auch Volumen im Ventrikel (auxotonische Kontraktion).
Beim Öffnen der Taschenklappen (Ende Anspannungszeit) beträgt der Druck im linken Ventrikel ~80 mmHg (=diastolischer Aortendruck), im rechten Ventrikel ~10 mmHg (diastolischer Pulmonalisdruck)
|
Das Schlagvolumen (beim Erwachsenen ~80 ml, abhängig z.B. von der Körperlage) wird ausgeworfen, der Rest - das enddiastolische oder Restvolumen, ~60 ml - verbleibt in der Kammer.
Das Schlagvolumen ist die Differenz zwischen enddiastolischem und
endsystolischem Volumen. Beide Größen (und damit die des
Schlagvolumens: [SV] = [EDV] - [ESV]) werden durch mehrere
Eigenschaften des Herzens beeinflusst:
Die Größe des enddiastolischen Volumens (EDV) hängt von folgenden Faktoren ab:
 Füllungsdruck. Steigt der venöse Rückstrom zum Herzen, nehmen Vorhofdruck und ventrikuläre Vorfüllung zu.
Füllungsdruck. Steigt der venöse Rückstrom zum Herzen, nehmen Vorhofdruck und ventrikuläre Vorfüllung zu.
 Füllungszeit. Je länger die Füllungszeit, desto mehr nimmt das enddiastolische Volumen zu.
Füllungszeit. Je länger die Füllungszeit, desto mehr nimmt das enddiastolische Volumen zu.
 Dehnungsfähigkeit des Ventrikels. Mit zunehmender ventrikulärer Compliance nimmt die Kammer pro gegebener Druckzunahme mehr Volumen auf, die EDV steigt an.
Dehnungsfähigkeit des Ventrikels. Mit zunehmender ventrikulärer Compliance nimmt die Kammer pro gegebener Druckzunahme mehr Volumen auf, die EDV steigt an.
Die Größe des endsystolischen Volumens (ESV) hängt von folgenden Faktoren ab:
 Vorlast (preload) - entsprechend dem enddiastolischen Volumen. Der Frank-Starling-Mechanismus erhöht die Schlagkraft mit der Vordehnung (EDV), folglich nimmt [SV] zu, das ESV ab.
Vorlast (preload) - entsprechend dem enddiastolischen Volumen. Der Frank-Starling-Mechanismus erhöht die Schlagkraft mit der Vordehnung (EDV), folglich nimmt [SV] zu, das ESV ab.
 Nachlast (afterload)
- entspricht dem mittleren systemischen (arteriellen) Blutdruck (linkes
Herz) bzw. Pulmonalarteriendruck (rechtes Herz). Steigt die Nachlast,
wird das Schlagvolumen kleiner, das ESV nimmt zu (größeres Restvolumen).
Nachlast (afterload)
- entspricht dem mittleren systemischen (arteriellen) Blutdruck (linkes
Herz) bzw. Pulmonalarteriendruck (rechtes Herz). Steigt die Nachlast,
wird das Schlagvolumen kleiner, das ESV nimmt zu (größeres Restvolumen).
 Herzfrequenz. Mit der Schlagfrequenz nimmt die verfügbare Menge sarkoplasmatischen Calciums zu (Treppenphänomen), die Kontraktilität steigt, [ESV] nimmt ab.
Herzfrequenz. Mit der Schlagfrequenz nimmt die verfügbare Menge sarkoplasmatischen Calciums zu (Treppenphänomen), die Kontraktilität steigt, [ESV] nimmt ab.
 Kontraktilität. Ähnliches gilt für positiv inotrop wirkende Substanzen (Anstieg [Ca++]i), sie senken das ESV. Damit nimmt die ejection fraction zu:
Kontraktilität. Ähnliches gilt für positiv inotrop wirkende Substanzen (Anstieg [Ca++]i), sie senken das ESV. Damit nimmt die ejection fraction zu:
 Das
Verhältnis von Schlagvolumen zu enddiastolischem Volumen - also der Anteil der
diastolischen Füllung, der systolisch weiterbefördert wird - heißt Auswurffraktion (Ejection fraction, EF
Das
Verhältnis von Schlagvolumen zu enddiastolischem Volumen - also der Anteil der
diastolischen Füllung, der systolisch weiterbefördert wird - heißt Auswurffraktion (Ejection fraction, EF ).
Diese sollte mindestens 50% des enddiastolischen Füllungsvolumens
betragen (d.h. der Ventrikel wirft während der Systole mindestens die
Hälfte des enddiastolischen Volumens aus).
).
Diese sollte mindestens 50% des enddiastolischen Füllungsvolumens
betragen (d.h. der Ventrikel wirft während der Systole mindestens die
Hälfte des enddiastolischen Volumens aus).
Auswurffraktion (ejection fraction EF) = Schlagvolumen / enddiastolisches Volumen
|
Die Auswurffraktion ist ein Maß für die Effizienz des Herzschlags (je höher der Prozentsatz, desto effizienter). Sie kann mittels Echokardiographie ermittelt werden.
Die Auswurffraktion beträgt
normalerweise 55-70% des enddiastolischen Füllungsvolumens
|
Während der Austreibungszeit wird der Ventrikel kleiner, und die (geschlossene) AV-Klappe zum
Herzmittelpunkt ("herzspitzenwärts") gezogen. Das erzeugt
einen Sog im Vorhofbereich (x-Senke im Venenpuls, s. Abbildungen) und fördert das Nachströmen von Blut aus dem
Venensystem. Bei der folgenden Füllungszeit nimmt der Ventrikel diese Blutmenge auf, indem die offene AV-Ebene darübergleitet ("Ventilebenenmechanismus",  Abbildung unten).
Abbildung unten).
Das linksventrikuläre Volumen ändert sich zu Beginn der Austreibungszeit am schnellsten (es nimmt rasch ab)
|
Kinetische Energie: Neben der Druck-Volumen-Arbeit (Förderung des Schlagvolumens gegen arterielle Drucke) muß der Ventrikel während der Austreibungszeit Blut beschleunigen
(kinetischc Arbeit). Bei körperlicher Ruhe bringen die Ventrikel ihr
Schlagvolumen auf eine durchschnittliche Geschwindigkeit von ~0,5
m/s. Das erfordert etwa 0,01 J an Energie, entsprechend 1% (linker
Ventrikel) und 5% (rechter Ventrikel) ihres gesamten Energieaufwandes.
(Dieser beträgt ~1,2 W bei Ruhe und bis zu ~8W bei schwerer Arbeit; 1 W = 1 J/s.) Bei
starker körperlicher Belastung steigt der Aufwand für die kinetische
Komponente um eine Zehnerpotenz an - auf etwa 14% für den linken und
50% (!) für den rechten Ventrikel -, um die 5-fache Steigerung der
Blutströmungsgeschwindigkeit auf ca. 2,5 m/s zu bewerkstelligen.
Am Ende der Austreibungszeit wird der Blutstrom in Aorta bzw. Pulmonalis langsamer, bis sich der Druckgradient schließlich umkehrt (Überkreuzung der Druckkurven: Aortendruck
über Ventrikeldruck). Die Strömung dreht folglich kurz ventrikelwärts um, was die Taschenklappen zudrückt.
 Die
Entspannungszeit (isovolumetric relaxation)
beginnt mit dem Schließen der Taschenklappen und endet
mit dem Öffnen der Segelklappen. Die Aortenklappe schließt
normalerweise etwas früher als die Pulmonalklappe. Dieser Unterschied
wird (vor allem bei jungen Menschen) bei Einatmung größer und erzeugt
einen "gespaltenen" 2. Herzton.
Während der Erschlaffungszeit sind
alle Klappen geschlossen, der Ventrikeldruck nimmt ab. Diese Phase erfolgt (wie die Anspannungszeit) isovolumetrisch.
Die
Entspannungszeit (isovolumetric relaxation)
beginnt mit dem Schließen der Taschenklappen und endet
mit dem Öffnen der Segelklappen. Die Aortenklappe schließt
normalerweise etwas früher als die Pulmonalklappe. Dieser Unterschied
wird (vor allem bei jungen Menschen) bei Einatmung größer und erzeugt
einen "gespaltenen" 2. Herzton.
Während der Erschlaffungszeit sind
alle Klappen geschlossen, der Ventrikeldruck nimmt ab. Diese Phase erfolgt (wie die Anspannungszeit) isovolumetrisch.
 Die Füllungszeit (inflow phase) beginnt mit dem Öffnen und endet mit dem Schluss der Atrioventrikularklappen
Die Füllungszeit (inflow phase) beginnt mit dem Öffnen und endet mit dem Schluss der Atrioventrikularklappen  (AV-,
Segelklappen). Zu Beginn der Füllungszeit relaxieren die Ventrikel
noch, der Druck nimmt weiter ab (was die frühe Füllung begünstigt).
(AV-,
Segelklappen). Zu Beginn der Füllungszeit relaxieren die Ventrikel
noch, der Druck nimmt weiter ab (was die frühe Füllung begünstigt).
Blut gelangt aus dem Vorhof- in den Kammerbereich. Die Füllungszeit lauft in drei Phasen ab:
 Zuerst gleitet
die Ventilebene (offene AV-Klappe) über eine Blutsäule hinweg, die sich im Vorhofbereich angesammelt hat - vergleichbar
einem Fisch, der seine Beute mit geöffnetem Maul schluckt
(
Zuerst gleitet
die Ventilebene (offene AV-Klappe) über eine Blutsäule hinweg, die sich im Vorhofbereich angesammelt hat - vergleichbar
einem Fisch, der seine Beute mit geöffnetem Maul schluckt
( Abbildung). Dieser sogenannte Ventilebenenmechanismus trägt wesentlich zur raschen
frühdiastolischen Füllung der Ventrikel bei.
Abbildung). Dieser sogenannte Ventilebenenmechanismus trägt wesentlich zur raschen
frühdiastolischen Füllung der Ventrikel bei.

 Abbildung: Ventilebenenmechanismus
Abbildung: Ventilebenenmechanismus 
Der
Ventrikel "schluckt" zu Beginn der Füllungszeit Blut, das während der Systole im
Vorhof zwischengespeichert wurde - die nun offene Ventilebene gleitet
über dieses Volumen, das dadurch vom Vorhof- in den Ventrikelbereich gelangt

 Anschließend
entspricht der (jetzt langsame) Einstrom etwa dem venösen Blutstrom zum
Herzen (diese Zeitspanne kann bei Erhöhung der Herzfrequenz weitgehend
eingespart werden, s. oben). Insgesamt strömen vor der Vorhofkontraktion etwa 80% des nächsten Schlagvolumens in den Ventrikel ein.
Anschließend
entspricht der (jetzt langsame) Einstrom etwa dem venösen Blutstrom zum
Herzen (diese Zeitspanne kann bei Erhöhung der Herzfrequenz weitgehend
eingespart werden, s. oben). Insgesamt strömen vor der Vorhofkontraktion etwa 80% des nächsten Schlagvolumens in den Ventrikel ein.
 Schließlich
kontrahieren sich die Vorhöfe ("a" in
Abbildungen), der Bluteinstrom beschleunigt sich noch einmal,
was zu ~10-20% der diastolischen Füllung der Ventrikel beiträgt (80-90%
der Füllung erfolgt "passiv" aus den vorgeschalteten Venen).
Schließlich
kontrahieren sich die Vorhöfe ("a" in
Abbildungen), der Bluteinstrom beschleunigt sich noch einmal,
was zu ~10-20% der diastolischen Füllung der Ventrikel beiträgt (80-90%
der Füllung erfolgt "passiv" aus den vorgeschalteten Venen).
Bei
plötzlichem Ausfall der Vorhoffunktion, wie bei Vorhofflimmern, sind
Ventrikelfüllung und Pumpleistung des Herzens zunächst um ~15-20%
reduziert.
Bei
körperlicher Belastung (Muskelarbeit) - die das Fördervolumen des
Herzens bis zu 4-fach steigern kann - nimmt der Beitrag der
Vorhofkontraktion zur diastolischen Ventrikelfüllung auf bis zu 40% zu.
Bei erschwerter passiver Ventrikelfüllung
nimmt die Kraft der Vorhöfe zu (belastungsabhängige Hypertrophie) und kann
bis zu 50% der Pumpleistung des Herzens übernehmen (→ größere P-Welle im
EKG).
Anpassung an Vor- und Nachlast: Frank-Starling-Mechanismus
 Der deutsche Physiologe Otto Frank
beschrieb 1895 folgende Beobachtung: Füllt man ein isoliertes
Froschherz, dessen Aorta abgebunden ist (und das daher isovolumetrische
Kontraktionen durchführt), diastolisch
mit zunehmender Flüssigkeitsmenge ("Vorlast"), dann liegt der
systolische Spitzendruck umso höher über dem Ruhewert, je größer das
Füllungsvolumen ist (bis zu einer Obergrenze). Daraus konnte
geschlossen werden, dass die Kontraktionskraft des Ventrikels mit der
diastolischen Dehnung ansteigt.
Der deutsche Physiologe Otto Frank
beschrieb 1895 folgende Beobachtung: Füllt man ein isoliertes
Froschherz, dessen Aorta abgebunden ist (und das daher isovolumetrische
Kontraktionen durchführt), diastolisch
mit zunehmender Flüssigkeitsmenge ("Vorlast"), dann liegt der
systolische Spitzendruck umso höher über dem Ruhewert, je größer das
Füllungsvolumen ist (bis zu einer Obergrenze). Daraus konnte
geschlossen werden, dass die Kontraktionskraft des Ventrikels mit der
diastolischen Dehnung ansteigt.
Einige Jahre später nutzte der britische Physiologe Ernest Starling
Herz-Lungen-Präparate von Hunden und konnte beobachten, dass die von
Frank entdeckte Eigenschaft auch für das Warmblüterherz gilt - mit dem
Zentralvenendruck als Vorlast für das rechte, und dem
Pulmonalvenendruck für das linke Herz. Weiters variierte Starling die
Nachlast des linken Ventrikels über einen variablen Aortenwiderstand
und konnte zeigen, dass mit der Nachlast zunächst die diastolische
Füllung zunimmt (weil das Schlagvolumen vorübergehend sinkt), und dann
mit steigendem enddiastolischem Volumen wiederum die Schlagkraft
zunimmt.
Zusammengenommen
beweisen diese Experimente, dass das isolierte Herz (also ohne neurale
oder humorale Beeinflussung) seine kontraktile Energie autonom an das
diastolische Volumen anpasst: Es arbeitet als angebotsorientierte Pumpe (Frank-Starling-Mechanismus).
Der Frank-Starling-Mechanismus  sagt aus, dass Herzkammern umso stärker schlagen, je stärker sie gefüllt sind. Die Förderleistung des Herzens passt sich an das Blutangebot an (
sagt aus, dass Herzkammern umso stärker schlagen, je stärker sie gefüllt sind. Die Förderleistung des Herzens passt sich an das Blutangebot an ( Abbildung):
Abbildung):
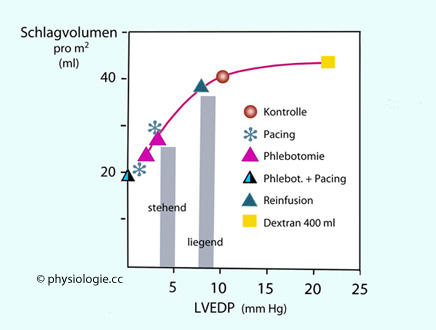
 Abbildung: Das Schlagvolumen nimmt (ceteris paribus) mit dem diastolischen Füllungsdruck zu
Nach Parker JD, Case RB. Normal left ventricular function. Circulation 1979; 60: 4-12
Abbildung: Das Schlagvolumen nimmt (ceteris paribus) mit dem diastolischen Füllungsdruck zu
Nach Parker JD, Case RB. Normal left ventricular function. Circulation 1979; 60: 4-12
Die Kurve beruht auf Daten aus Einzelmessungen an insgesamt 75 Patienten. Das
venöse Blutangebot wurde durch verschiedene Maßnahmen variiert
(Lagewechsel, Blutabnahme, Infusion, Erhöhung des Plasmavolumens mit
Dextranlösung, Schrittmacherwirkung, Vasodilatation durch Nitroglycerin).
Die Auswurfleistung des Ventrikels
nimmt mit der diastolischen Füllung zu (Frank-Starling) - bis zu einem Punkt, ab dem kein
weiterer Anstieg möglich ist. Die Kurve erreicht über 10 mmHg linksventrikulärem Füllungsdruck ein Plateau
- ein weiterer Druckanstieg (bedingt z.B. durch Infusion eines
Plasmaexpanders) bewirkt keine Steigerung des Schlagvolumens mehr.
Bei aufrechter Körperlage (stehend) beträgt der enddiastolische
Füllungsdruck im linken Ventrikel 4-5 mmHg, in Rückenlage (liegend) 8-9
mmHg (orthostatischer
Effekt). Das bedeutet, bei aufrechter Körperposition (Sitzen oder
Stehen) - mit geringer diastolischer Füllung, da ein Teil des
Blutvolumens in die Beine verlagert ist - befindet sich das Herz im
"aufsteigenden" Bereich der Starling-Kurve, in Rückenlage hingegen im
flachen Bereich, in dem weitere diastolische Füllung kaum noch eine
Verstärkung der Systole bewirkt.
X-Achse: Der enddiastolische Druck (messbar mittels Herzkatheter) ist ein Indikator für die Vordehnung der Herzmuskelzellen. Statt des Drucks kann auch das enddiastolische Volumen (abschätzbar über Echokardiographie) als Kriterium dienen. Y-Achse: Das Schlagvolumen (abschätzbar über Echokardiographie) ist
ein brauchbarer Indikator für die kontraktile Energie. Aussagekräftiger
sind kombinierte Kriterien, z.B. das Produkt aus Schlagvolumen und
mittlerem arteriellem Druck.
LVEDP = linksventrikulärer enddiastolischer Druck
Mit steigender Füllung (Vorlast: venöser Füllungsdruck) nimmt
die Schlagkraft des Herzens zu (bis zu einer Obergrenze - darüber hinaus kann das Schlagvolumen nicht weiter gesteigert werden)
|
Unter
physiologischen Bedingungen scheint dieser Mechanismus von untergeordneter Bedeutung zu sein. So nimmt die
Schlagkraft bei gesteigerten Anforderungen an das Fördervolumen
(körperliche Arbeit, Hitzebelastung) in erster Linie durch Sympathikuswirkung zu (positive Inotropie). Die Schlagkraft des Herzens unterliegt also primär einer über das Kreislaufzentrum koordinierten Regulierung.
Der Frank-Starling-Mechanismus repräsentiert eine autonome Eigenschaft des
Herzmuskels und wird
bedeutsamer, wenn übergeordnete Mechanismen nicht ausreichend oder
nicht rasch genug greifen. So beeinflusst der Zeitabstand zur
vorhergehenden Systole unmittelbar
die Schlagkraft: Je länger die Diastole dauert, desto stärker fällt die
Füllung aus (steigt das enddiastolische Volumen) und desto stärker
schlägt das Herz bei der darauf folgenden Systole.
Das spielt auch bei
Unregelmäßigkeiten des Herzrhythmus - wie bei respiratorischer (Sinus-) Arrhythmie  , oder nach ventrikulären
Extrasystolen - eine Rolle: Je kürzer das Intervall zwischen zwei Herzschlägen, desto geringer ist die diastolische Füllung und desto schwächer fällt die nächste Systole aus; umgekehrt steigt mit der Intervallzeit auch Kraft und Schlagvolumen des nächsten Herzschlags.
, oder nach ventrikulären
Extrasystolen - eine Rolle: Je kürzer das Intervall zwischen zwei Herzschlägen, desto geringer ist die diastolische Füllung und desto schwächer fällt die nächste Systole aus; umgekehrt steigt mit der Intervallzeit auch Kraft und Schlagvolumen des nächsten Herzschlags.

Zur Funktionsweise des Frank-Starling-Mechanismus gibt es mehrere Erklärungen:
 Überlappung der kontraktilen Filamente
im Sarkomer:
Überlappung der kontraktilen Filamente
im Sarkomer: Bei normaler enddiastolischer Füllung beträgt die Sarkomerlänge 1,8-2,0 µm. Bei
~1,8 µm greifen einige Myosin-Querbrücken am gegenläufigen Aktinfilament (Länge ~1
µm) an und reduzieren dadurch die Kraftausbeite. (Bei 1,6 µm
Sarkomerlänge stoßen die Myosinfäden außerdem an den Z-Streifen an.)
Wird die Muskelfaser gedehnt, nimmt die Zahl dieser "Irrläufer" ab, die Netto-Kraftausbeute steigt an, und bei ~2,1 µm ist das Optimum an Überlappungmuster und Kraftausbeute erreicht. Das deckt sich mit dem Bereich, in dem Erhöhung der Vordehnung (also der diastolischen Füllung) zu einer Zunahme der Systolenkraft führt ( Abbildung).
Abbildung).
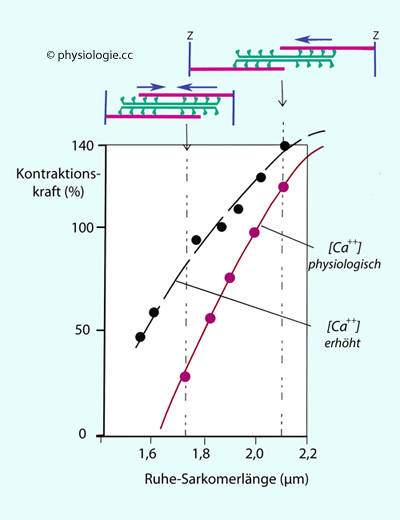
 Abbildung: Kontraktionskraft einer Herzmuskelzelle in Abhängigkeit von ihrer Vordehnung
Modifiziert nach Kentish JC, ter Keurs HEDJ, Ricciardi
L, Bucx JJ, Noble MI. Comparison between the sarcomere length-force
relations of intact and skinned trabeculae from rat right ventricle.
Influence of calcium concentrations on these relations. Circ Res 1986; 58: 755-68
Abbildung: Kontraktionskraft einer Herzmuskelzelle in Abhängigkeit von ihrer Vordehnung
Modifiziert nach Kentish JC, ter Keurs HEDJ, Ricciardi
L, Bucx JJ, Noble MI. Comparison between the sarcomere length-force
relations of intact and skinned trabeculae from rat right ventricle.
Influence of calcium concentrations on these relations. Circ Res 1986; 58: 755-68
In einer isolierten Herzmuskelzelle wurde - ausgehend von unterschiedlicher
Vordehnung (Abszisse: diastolische Sarkomerlänge) - die
Kontraktionskraft ermittelt (Ordinate): Bei
physiologischer (8,9 µM, rote Kurve) oder erhöhter Calciumkonzentration in der Zelle (50 µM, schwarze Kurve).
Die Kraft / Sarkomerlängen-Charakteristik von Myokardzellen mit erhöhten sarkoplasmatischen [Ca++]-Werten
(schwarze Kurve) gleicht der (physiologischen) des Skelettmuskels - in
beiden Fällen sind alle Querbrücken aktiviert. Bei Herzmuskelzellen mit
physiologischem sarkoplasmatischem [Ca++] (rote Kurve) ist
die Kraftausbeute geringer - weil nur ein Teil der Querbrücken
aktiviert ist -, die Kraft / Sarkomerlängen-Charakteristik ist steiler
- weil die Zahl der aktivierten Querbrücken mit der Vordehnung ansteigt.
Inset (oben): Bei ~1,8
µm Sarkomerlänge greifen einige Myosinköpfchen (grün) auf das "falsche"
Aktinfilament (rot) zu, die Kontraktionskraft ist durch diese
gegenläufige Komponente reduziert. Bei 2,1 µm greifen alle
Myosinköpfchen auf das "richtige" Aktinfilament zu, die Kraftausbeute
ist optimiert

 Der Prozentsatz aktivierter Aktin-Myosin-Querbrücken steigt mit der Sarkomerlänge. Bei jeder gegebenen
Der Prozentsatz aktivierter Aktin-Myosin-Querbrücken steigt mit der Sarkomerlänge. Bei jeder gegebenen [Ca
++] nimmt die Kraftausbeute mit Dehnung der Sarkomeren zu
(dehnungsabhängige Aktivierung, length-dependent activation).
Wie dieser Umstand zu erklären ist, bleibt kontroversiell:
 Die Troponinhypothese geht von einer
dehnungsabhängig verbesserten Troponin-Interaktion aus,
Die Troponinhypothese geht von einer
dehnungsabhängig verbesserten Troponin-Interaktion aus,
 die
Kompressionshypothese von
verringerten Aktin-Myosin-Abständen bei reduziertem Zelldurchmesser
(Myosinköpfchen können leicher auf Aktinmoleküle zugreifen - lattice spacing hypothesis),
die
Kompressionshypothese von
verringerten Aktin-Myosin-Abständen bei reduziertem Zelldurchmesser
(Myosinköpfchen können leicher auf Aktinmoleküle zugreifen - lattice spacing hypothesis),
 die Myosinhypothese von querbrückenbeeinflussender Titin-Myosin-Interaktion.
die Myosinhypothese von querbrückenbeeinflussender Titin-Myosin-Interaktion.
 Das Herz in situ
verfügt mit dem Perikardsack auch über eine "Außenstütze"; ein
isoliertes Herz ohne Perikard reagiert anders als ein im
physiologischen Kontext belassenes.
Das Herz in situ
verfügt mit dem Perikardsack auch über eine "Außenstütze"; ein
isoliertes Herz ohne Perikard reagiert anders als ein im
physiologischen Kontext belassenes.
 Schließlich sind auch
Mechanismen der myokardialen Entspannung in der Diastole zu berücksichtigen (Lusitropie ist die Herzqualität, die sich auf rasche und vollständige Erschlaffung des Myokards bezieht). Phosphorylierung von Titin macht den Herzmuskel dehnbarer, und Aktivierung des Sympathikus verflacht die Ruhedehnungskurve des Ventrikels.
Schließlich sind auch
Mechanismen der myokardialen Entspannung in der Diastole zu berücksichtigen (Lusitropie ist die Herzqualität, die sich auf rasche und vollständige Erschlaffung des Myokards bezieht). Phosphorylierung von Titin macht den Herzmuskel dehnbarer, und Aktivierung des Sympathikus verflacht die Ruhedehnungskurve des Ventrikels.
 Der Frank-Starling-Mechanismus spielt eine wichtige Rolle für die automatische Balance zwischen der Förderleistung des rechten und linken Ventrikels: Zwei in Serie geschaltete Pumpen müssen - über Zeiträume, die einige Sekunden überschreiten - eine
idente Volumenförderung leisten, wenn der dazwischenliegende
Gefäßabschnitt weder aufgeblasen noch leergesaugt werden soll. Würde
z.B. der rechte Ventrikel nur um 1% mehr fördern als der linke, käme es
innerhalb von 30 Minuten zu einer katastrophalen pulmonalen Überfüllung
(von ~600 ml auf ~2000 ml). Bei körperlicher Ausbelastung reichten dazu schon wenige Minuten.
Der Frank-Starling-Mechanismus spielt eine wichtige Rolle für die automatische Balance zwischen der Förderleistung des rechten und linken Ventrikels: Zwei in Serie geschaltete Pumpen müssen - über Zeiträume, die einige Sekunden überschreiten - eine
idente Volumenförderung leisten, wenn der dazwischenliegende
Gefäßabschnitt weder aufgeblasen noch leergesaugt werden soll. Würde
z.B. der rechte Ventrikel nur um 1% mehr fördern als der linke, käme es
innerhalb von 30 Minuten zu einer katastrophalen pulmonalen Überfüllung
(von ~600 ml auf ~2000 ml). Bei körperlicher Ausbelastung reichten dazu schon wenige Minuten.
 Der Frank-Starling-Mechanismus löst das Problem von selbst: Steigt die Füllung im Lungenkreislauf, steigt automatisch
auch das rechtsventrikuläre Schlagvolumen - analoges gilt für den
rechten Ventrikel bzw. für eine Abnahme der Füllung einer der beiden
Kammern. Neurohumorale Regulationsmechanismen tun
dann ihr Übriges zur Stabilisierung des Kreislaufs - allerdings
brauchen sie etwas Zeit, um wirksam werden zu können.
Der Frank-Starling-Mechanismus löst das Problem von selbst: Steigt die Füllung im Lungenkreislauf, steigt automatisch
auch das rechtsventrikuläre Schlagvolumen - analoges gilt für den
rechten Ventrikel bzw. für eine Abnahme der Füllung einer der beiden
Kammern. Neurohumorale Regulationsmechanismen tun
dann ihr Übriges zur Stabilisierung des Kreislaufs - allerdings
brauchen sie etwas Zeit, um wirksam werden zu können.
 Steht eine Person beispielsweise auf (Orthostase), sinkt die rechtsventrikuläre Füllung (vgl. dort), die Ventrikel gleichen die Volumina autonom aneinander an (das dauert nur Sekunden). Umgekehrt stabilisiert der
Frank-Starling-Mechanismus die Situation beim Wechsel von aufrechter zu
liegender Position, wo plötzlich das venöse Angebot an das rechte Herz
zunimmt.
Steht eine Person beispielsweise auf (Orthostase), sinkt die rechtsventrikuläre Füllung (vgl. dort), die Ventrikel gleichen die Volumina autonom aneinander an (das dauert nur Sekunden). Umgekehrt stabilisiert der
Frank-Starling-Mechanismus die Situation beim Wechsel von aufrechter zu
liegender Position, wo plötzlich das venöse Angebot an das rechte Herz
zunimmt.
 Auch der Atemzyklus
führt zu kurzen Imbalancen. Besonders deutlich kommt die stabilisierende Wirkung des Frank-Starling-Mechanismus bei extremen intrathorakalen Druckänderungen im Rahmen von inspiratorischen (Müller-Versuch) oder exspiratorischen (Valsalva-Versuch) Manövern zum Tragen.
Auch der Atemzyklus
führt zu kurzen Imbalancen. Besonders deutlich kommt die stabilisierende Wirkung des Frank-Starling-Mechanismus bei extremen intrathorakalen Druckänderungen im Rahmen von inspiratorischen (Müller-Versuch) oder exspiratorischen (Valsalva-Versuch) Manövern zum Tragen.
 Ähnliches gilt für die Kreislaufanpassung bei körperlicher Belastung: Der Frank-Starling-Mechanismus sorgt für "Rechts-links-Ausgleich" der sich stark ändernden ventrikulären Pumpleistungen.
Ähnliches gilt für die Kreislaufanpassung bei körperlicher Belastung: Der Frank-Starling-Mechanismus sorgt für "Rechts-links-Ausgleich" der sich stark ändernden ventrikulären Pumpleistungen.
 Der Frank-Starling-Mechanismus kümmert sich auch um Angleich der reduzierten Auswurfleistungen bei Hypovolämie und Dehydration - oder umgekehrt der erhöhten Volumenförderungen bei Hypervolämie.
Der Frank-Starling-Mechanismus kümmert sich auch um Angleich der reduzierten Auswurfleistungen bei Hypovolämie und Dehydration - oder umgekehrt der erhöhten Volumenförderungen bei Hypervolämie.
Der
Starling-Mechanismus wirkt direkt bei Änderung der diastolischen
Füllung (Vorlast), indem er die systolische Schlagstärke an das
diastolische Volumenangebot anpasst. Er wirkt aber auch bei Änderung
der Nachlast: Steigt z.B. der Aortendruck plötzlich an, wird der
Ventrikel bei der direkt folgenden Systole weniger Blut auswerfen
können als sonst mit der Folge, dass die enddistolische Füllung der
nächsten Systole zunimmt und der Ventrikel nunmehr die Auswurfleistung
steigert.
Anrep-Effekt  : Zusätzlich
zu, und nach dem (sofort wirkenden) Frank-Starling-Mechanismus kommt es
in isoliertem Myokard innerhalb weiterer 5-10 Minuten nach Erhöhung der Vorlast / diastolischen Dehnung zu weiterer direkter Erhöhung der Kontraktilität (slow force response). Der
vermutete Mechanismus hat mehrere Komponenten, die alle zu erhöhtem Calciumeinstrom in Kardiomyozyten führen:
: Zusätzlich
zu, und nach dem (sofort wirkenden) Frank-Starling-Mechanismus kommt es
in isoliertem Myokard innerhalb weiterer 5-10 Minuten nach Erhöhung der Vorlast / diastolischen Dehnung zu weiterer direkter Erhöhung der Kontraktilität (slow force response). Der
vermutete Mechanismus hat mehrere Komponenten, die alle zu erhöhtem Calciumeinstrom in Kardiomyozyten führen:
 Dehnung von Herzmuskelzellen aktiviert
membranständige Na/H-Austauscher, Natriumionen strömen in die Zelle
ein, hemmen intrazellulär Na/Ca-Austauscher und verlängern die Verweildauer von Ca++ im Sarkoplasma.
Dehnung von Herzmuskelzellen aktiviert
membranständige Na/H-Austauscher, Natriumionen strömen in die Zelle
ein, hemmen intrazellulär Na/Ca-Austauscher und verlängern die Verweildauer von Ca++ im Sarkoplasma.
 Dehnung von Herzmuskelzellen aktiviert weiters Calciumkanäle, was ebenfalls vermehrt Ca++ im das Sarkoplasma bringt.
Dehnung von Herzmuskelzellen aktiviert weiters Calciumkanäle, was ebenfalls vermehrt Ca++ im das Sarkoplasma bringt.
 Dehnung von Herzmuskelzellen regt deren Produktion inotroper Stoffe (Angiotensin II, Endothelin I) an. Auch diese erhöhen auto- / parakrin die intrazellulären Calciumspeicher.
Dehnung von Herzmuskelzellen regt deren Produktion inotroper Stoffe (Angiotensin II, Endothelin I) an. Auch diese erhöhen auto- / parakrin die intrazellulären Calciumspeicher.
Das vermehrte intrazelluläre Ca++ aktiviert die SERCA, die sich mit zusätzlichen Calciumionen "vollpumpt" und mittels erhöhter calciuminduzierter Calciumfreisetzung (CICR) verstärkte Kontraktionen bewirkt.
Frequenzinotropie (Bowditch-Effekt)
Als Bowditch-Effekt  (Frequenzinotropie, "Treppenphänomen", staircase phenomenon)
bezeichnet man die Tatsache, dass Erhöhung der Schlagfrequenz eines
Herzmuskelpräparates zu einer Stärkung der einzelnen Systolen führt,
und dass nach Zurückschalten auf niedrigere Frequenz zunächst eine
besonders intensive Kontraktion erfolgt (
(Frequenzinotropie, "Treppenphänomen", staircase phenomenon)
bezeichnet man die Tatsache, dass Erhöhung der Schlagfrequenz eines
Herzmuskelpräparates zu einer Stärkung der einzelnen Systolen führt,
und dass nach Zurückschalten auf niedrigere Frequenz zunächst eine
besonders intensive Kontraktion erfolgt ( Abbildung).
Abbildung).
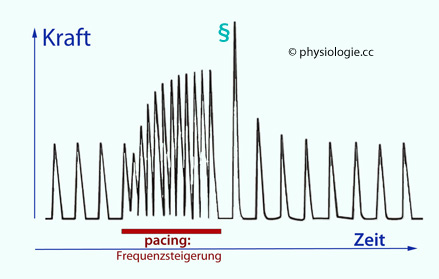
 Abbildung: Treppenphänomen bei einem isolierten Herzmuskelpräparat (Bowditch-Effekt)
Abbildung: Treppenphänomen bei einem isolierten Herzmuskelpräparat (Bowditch-Effekt)
Nach einer Vorlage bei Usman A, Gandhi J, Gupra G. Physiology, Bowditch Effect. StatPearls 2023
Erhöhung der Herzfrequenz (durch künstlichen Schrittmacher: pacing)
steigert die Kontraktionskraft der Kardiomyozyten, ohne äußeren
Einfluss wie Sympathikuswirkung oder Hormone. Verursacht ist diese
Kraftsteigerung durch eine Erhöhung des Calciumspeichers im
sarkoplasmatischen Retikulum - erklärbar durch verkürzte systolische Ca++-Entleerungsdauer des sarkoplasmatischen Retikulums und reduzierten Ca++-Export durch Na/Ca-Austauscher.
Anschließende Senkung der
Stimulationsfrequenz löst eine besonders starke Kontraktion (§) im Sinne einer postextrasystolischen Potenzierung mit längerer Dauer zum Auffüllen der sarkoplasmatischen Calciumspeicher aus.
Der erste Herzschlag nach Erhöhung der Herzfrequenz (pacing)
fällt schwächer aus als die vorhergehenden. Der Grund ist, dass sich
die (für dle elektro-mechanische Kopplung notwendigen) Calciumkanäle
des sarkoplasmatischen Retikulums (calcium release channels, Ryanodinrezeptoren)
nur relativ langsam von ihrem inaktivierten (systolischen) Zustand
erholen und zur Zeitpunkt der künstlichen Stimulation teilweise noch
refraktär sind

Das Phänomen der Kraftsteigerung bei Frequenzzunahme erklärt sich durch eine Erhöhung des Ca++-Speichers im, und der Ca++-Freisetzung aus dem, sarkoplasmatischen Retikulum, bedingt durch folgende Faktoren:
 Bei höherer Herzfrequenz ist die Summe der Plateauzeiten der
Aktionspotentiale pro Zeiteinheit und damit die Dauer des
Calciumeinstroms durch L-Typ-Calciumkanäle erhöht.
Bei höherer Herzfrequenz ist die Summe der Plateauzeiten der
Aktionspotentiale pro Zeiteinheit und damit die Dauer des
Calciumeinstroms durch L-Typ-Calciumkanäle erhöht.

In den (in der Summe verlängerten) Plateauphasen arbeiten die
Na/Ca-Austauscher (NCX) im "reverse mode" und lassen
Ca++ in die Zelle eindringen, statt es zu exportieren.
 Durch beide Mechanismen steigt der sarkoplasmatische Ca++-Spiegel. Das führt zu rascherer Einlagerung von Calcium in das sarkoplasmatische Retikulum, und das geht so:
Durch beide Mechanismen steigt der sarkoplasmatische Ca++-Spiegel. Das führt zu rascherer Einlagerung von Calcium in das sarkoplasmatische Retikulum, und das geht so:
Über Calmodulin (CaM) - an das sich Calciumionen anlagern - und CaM-Kinase II wird Phospholamban phosphoryliert, seine Hemmwirkung auf SERCA2a aufgehoben und so das Zurückpumpen von Ca++-Ionen aus dem Zytosol in das endoplasmatische Retikulum angeregt.
Insgesamt spielt das Treppenphänomen für die Steuerung der
Kontraktionskraft in vivo eine nur mäßige Rolle. Es trägt immerhin dazu
bei, dass z.B. ein vorzeitiger (ektopischer) Herzschlag schwach
ausfällt, und nach einer verlängerten Pause eine verstärkte Systole
erfolgt (postextrasystolische Potenzierung). Letzteres erklärt sich
durch eine Erhöhung der im sarkoplasmatischen Retikulum verfügbaren Ca++-Menge nach einer verlängerten Diastole.
Da der Bowditch-Effekt an isolierten Herzmuskelfasern nachweisbar ist,
hat er - im Gegensatz zum Starling-Mechanismus - nichts mit Effekten
unterschiedlicher Vordehnung bzw. enddiastolischer Füllung zu tun.

Unter Herzinsuffizienz versteht man eine mangelhafte Pumpleistung des (rechten und/oder linken) Ventrikels. Das bewirkt einen Rückstau von Blut im Vorhof und eine Erhöhung des jeweiligen enddistolischen Volumens.
Herzinsuffizienz reduziert das Schlagvolumen und erhöht das enddiastolische Volumen
|
Klappeninsuffizienz bedeutet, dass eine Klappe nicht richtig schließt. So führt eine Aortenklappeninsuffizienzzu
diastolischem Rückfluss des Blutes aus der Aorta in den Ventrikel,
ventrikulärer Volumenbelastung und allenfalls Überlastung
(Herzinsuffizienz). Da das Blut diastolisch durch eine Engstelle
fließt, kann ein abnehmendes Geräusch auftreten, das an den zweiten
Herzton anschließt.
Eine
undichte (insuffiziente) Aortenklappe belastet den linken Ventrikel:
Blut fließt diastolisch in den Ventrikel zurück, nach S2 kann ein
diastolisches Decrescendogeräusch auftreten
|
Klappenstenose bedeutet, dass
eine Klappe nicht vollständig öffnet - sie bleibt während der
Passagezeit verengt, der Strömungswiderstand ist erhöht. So belastet
eine Aortenklappenstenose den linken Ventrikel, der systolisch gegen einen erhöhten Fließwiderstand arbeiten muss; es kommt zu Linksherzhypertrophie.
Verengung
der Mitralklappe (Stenose) erschwert den Einstrom von Blut in den
linken Ventrikel. Der Druck im Pulmonalkreislauf steigt, das
linksventrikuläre enddiastolische Volumen sinkt
Bei einer verengten Aortenklappe (Stenose) ist ein erhöhter
Ventrikeldruck erforderlich, um ausreichend Blut in die Aorta zu
befördern
|


 Das Herz saugt
Blut aus Niederdruckgefäßen (vv. cavae, vv. pulmonales) und pumpt es in
arterielle Gefäße (Lungenschlagader bzw. Aorta). Jeder
Herzschlag fördert aus beiden Herzkammern (Ventrikeln ) je ~70 ml Blut
(Schlagvolumen) gegen einen Druck von 1-2 kPa im
Lungenkreislauf (rechtes Herz) und ~13 kPa im großen
Kreislauf (linkes Herz). Pro Herzschlag erbringt der Herzmuskel etwas
mehr als 1 J, die Leistung beträgt gut 1 W. Der Wirkungsgrad des
Herzschlags beträgt 20-25%, der gesamte Energieaufwand ~5 W
(Ruheumsatz des Organismus ~100 W). 3/4 des Energieverbrauchs
beansprucht die Kontraktion, 1/4 Membranpotentiale und
Strukturerhaltung. Der spezifische Sauerstoffverbrauch - in
körperlicher Ruhe ~10 ml O2/min/100g - kann bei Ausbelastung bis ~50 ml/min/100g steigen Das Herz saugt
Blut aus Niederdruckgefäßen (vv. cavae, vv. pulmonales) und pumpt es in
arterielle Gefäße (Lungenschlagader bzw. Aorta). Jeder
Herzschlag fördert aus beiden Herzkammern (Ventrikeln ) je ~70 ml Blut
(Schlagvolumen) gegen einen Druck von 1-2 kPa im
Lungenkreislauf (rechtes Herz) und ~13 kPa im großen
Kreislauf (linkes Herz). Pro Herzschlag erbringt der Herzmuskel etwas
mehr als 1 J, die Leistung beträgt gut 1 W. Der Wirkungsgrad des
Herzschlags beträgt 20-25%, der gesamte Energieaufwand ~5 W
(Ruheumsatz des Organismus ~100 W). 3/4 des Energieverbrauchs
beansprucht die Kontraktion, 1/4 Membranpotentiale und
Strukturerhaltung. Der spezifische Sauerstoffverbrauch - in
körperlicher Ruhe ~10 ml O2/min/100g - kann bei Ausbelastung bis ~50 ml/min/100g steigen
 Systole (Kontraktion des Myokards) und Diastole (Erschlaffung
des Myokards) wechseln einander ab. In Ruhe (60/min) dauert die
Diastole doppelt so lange wie die Systole; bei maximaler Herzfrequenz
ist es umgekehrt, vor allem die Diastolendauer wird kürzer (zeitliche
Reserve). Die Systole beginnt mit der Anspannungszeit (isovolumetrische Kontraktion, alle Klappen geschlossen, der Ventrikel enthält das enddiastolische Volumen), in der Austreibungszeit wird das Schlagvolumen ausgeworfen (Aorten- und Pulmonalklappe offen), das Restvolumen verbleibt im Ventrikel. Das Verhältnis Schlagvolumen / enddiastolisches Volumen heißt
Auswurffraktion (Ejection fraction, EF) - ein Maß für die Effizienz des Herzschlags (mindestens 50-60% des enddiastolischen Füllungsvolumens)
Systole (Kontraktion des Myokards) und Diastole (Erschlaffung
des Myokards) wechseln einander ab. In Ruhe (60/min) dauert die
Diastole doppelt so lange wie die Systole; bei maximaler Herzfrequenz
ist es umgekehrt, vor allem die Diastolendauer wird kürzer (zeitliche
Reserve). Die Systole beginnt mit der Anspannungszeit (isovolumetrische Kontraktion, alle Klappen geschlossen, der Ventrikel enthält das enddiastolische Volumen), in der Austreibungszeit wird das Schlagvolumen ausgeworfen (Aorten- und Pulmonalklappe offen), das Restvolumen verbleibt im Ventrikel. Das Verhältnis Schlagvolumen / enddiastolisches Volumen heißt
Auswurffraktion (Ejection fraction, EF) - ein Maß für die Effizienz des Herzschlags (mindestens 50-60% des enddiastolischen Füllungsvolumens)
 Die diastolische Füllung (Vorlast) verhält sich
proportional zum diastolischen Druck (rechtes Herz: Zentralvenendruck -
im Liegen ~1 kPa, aufrecht ~0 kPa; linkes Herz: Druck im
Pulmonalkreislauf ~1 kPa). Während der Systole muss der Ventrikel die hydrodynamische Impedanz des
Arteriensystems überwinden (Nachlast) - proportional zum
Pulmonalarteriendruck (systolisch <25 mmHg, diastolisch <10 mmHg) bzw. arteriellen Blutdruck (systolisch <140 mmHg, diastolisch <90 mmHg). Die Kraft der Systole steigt mit der Vorlast (Frank-Starling-Mechanismus): Dieses Pronzip der "angebotsorientierten Pumpe"
gleicht unterschiedliche
Imbalancen aus, bedingt z.B. durch die Atmung oder orthostatische
Änderungen. Je besser dehnbar die Aorta ist (Windkesseleffekt: etwa die Hälfte des Schlagvolumens wird herznah
'zwischengespeichert'), desto geringer ist die Nachlast für das linke Herz Die diastolische Füllung (Vorlast) verhält sich
proportional zum diastolischen Druck (rechtes Herz: Zentralvenendruck -
im Liegen ~1 kPa, aufrecht ~0 kPa; linkes Herz: Druck im
Pulmonalkreislauf ~1 kPa). Während der Systole muss der Ventrikel die hydrodynamische Impedanz des
Arteriensystems überwinden (Nachlast) - proportional zum
Pulmonalarteriendruck (systolisch <25 mmHg, diastolisch <10 mmHg) bzw. arteriellen Blutdruck (systolisch <140 mmHg, diastolisch <90 mmHg). Die Kraft der Systole steigt mit der Vorlast (Frank-Starling-Mechanismus): Dieses Pronzip der "angebotsorientierten Pumpe"
gleicht unterschiedliche
Imbalancen aus, bedingt z.B. durch die Atmung oder orthostatische
Änderungen. Je besser dehnbar die Aorta ist (Windkesseleffekt: etwa die Hälfte des Schlagvolumens wird herznah
'zwischengespeichert'), desto geringer ist die Nachlast für das linke Herz
 Diastole: Die Entspannungszeit beginnt mit dem Schließen der Taschenklappen und endet mit dem Öffnen der Segelklappen. Der Ventrikeldruck nimmt ab, im Ventrikel befindet sich das Restvolumen. Die Füllungszeit
beginnt mit dem Öffnen und endet mit dem Schluss der AV-Klappen, Blut
fließt aus dem Vorhof nach. Zuerst gleitet die offene AV-Klappe über
Vorhofblut (Ventilebenenmechanismus),vor der Vorhofkontraktion strömen
~80%
des nächsten Schlagvolumens in den Ventrikel ein, ~20% der
diastolischen Ventrikelfüllung erfolgt durch die Vorhofkontraktion Diastole: Die Entspannungszeit beginnt mit dem Schließen der Taschenklappen und endet mit dem Öffnen der Segelklappen. Der Ventrikeldruck nimmt ab, im Ventrikel befindet sich das Restvolumen. Die Füllungszeit
beginnt mit dem Öffnen und endet mit dem Schluss der AV-Klappen, Blut
fließt aus dem Vorhof nach. Zuerst gleitet die offene AV-Klappe über
Vorhofblut (Ventilebenenmechanismus),vor der Vorhofkontraktion strömen
~80%
des nächsten Schlagvolumens in den Ventrikel ein, ~20% der
diastolischen Ventrikelfüllung erfolgt durch die Vorhofkontraktion
 Erhöhung der Schlagfrequenz eines Herzmuskelpräparates stärkt die einzelnen Systolen (Bowditch-Effekt,
Frequenzinotropie, Treppenphänomen); nach Zurückschalten auf niedrigere
Frequenz erfolgt zunächst eine besonders intensive Kontraktion. Das
erklärt sich durch Erhöhung des Ca++-Speichers im sarkoplasmatischen Retikulum (kürzere Diastolendauer → weniger Zeit für das Zurückpumpen in das endoplasmatische Retikulum; Erhöhung des intrazellulären [Na+] → Na/Ca-Austausch reduziert). Der Effekt tritt unabhängig von der Vordehnung auf Erhöhung der Schlagfrequenz eines Herzmuskelpräparates stärkt die einzelnen Systolen (Bowditch-Effekt,
Frequenzinotropie, Treppenphänomen); nach Zurückschalten auf niedrigere
Frequenz erfolgt zunächst eine besonders intensive Kontraktion. Das
erklärt sich durch Erhöhung des Ca++-Speichers im sarkoplasmatischen Retikulum (kürzere Diastolendauer → weniger Zeit für das Zurückpumpen in das endoplasmatische Retikulum; Erhöhung des intrazellulären [Na+] → Na/Ca-Austausch reduziert). Der Effekt tritt unabhängig von der Vordehnung auf
|





 Anrep-Effekt: Nach Gleb von Anrep (Russischer Physiologe)
Anrep-Effekt: Nach Gleb von Anrep (Russischer Physiologe) Systole und Diastole, Vorlast und Nachlast
Systole und Diastole, Vorlast und Nachlast  Phasen der Herztätigkeit, Ventilebenenmechanismus
Phasen der Herztätigkeit, Ventilebenenmechanismus  Frank-Starling-Mechanismus
Frank-Starling-Mechanismus  Einfluss der Frequenz: Bowditch-Effekt
Einfluss der Frequenz: Bowditch-Effekt
 Vorlast (preload)
Vorlast (preload)  Nachlast (afterload)
Nachlast (afterload)
 Core messages
Core messages
 Abbildung: Herz und Blutkreislauf
Abbildung: Herz und Blutkreislauf
 Herz: idg. *k[e]rd (→ cor, καρδία), got. hairto (→ engl. heart)
Herz: idg. *k[e]rd (→ cor, καρδία), got. hairto (→ engl. heart) ) ein Volumen
von je ~70 ml ausgeworfen - gegen einen Druck von ~2 kPa (~15 mmHg) im Lungenkreislauf (rechtes Herz) und ~13
kPa (~100 mmHg) im großen Kreislauf (linkes Herz).
) ein Volumen
von je ~70 ml ausgeworfen - gegen einen Druck von ~2 kPa (~15 mmHg) im Lungenkreislauf (rechtes Herz) und ~13
kPa (~100 mmHg) im großen Kreislauf (linkes Herz).  s. dort.
s. dort. (=Erschlaffung des Myokards) wechseln einander ab. Die Dauer der Abschnitte des Herzzyklus ist abhängig von der Schlagfrequenz, auch die relativen Zeitanteile (
(=Erschlaffung des Myokards) wechseln einander ab. Die Dauer der Abschnitte des Herzzyklus ist abhängig von der Schlagfrequenz, auch die relativen Zeitanteile ( Abbildung):
Abbildung): 
 EKG, Elektrokardiogramm
EKG, Elektrokardiogramm  PKG, Phonokardiogramm
PKG, Phonokardiogramm  S1, S2, Herztöne
S1, S2, Herztöne
 Bei einer Ruhefrequenz von 60/min beträgt das zeitliche Verhältnis Systole / Diastole 1:2
Bei einer Ruhefrequenz von 60/min beträgt das zeitliche Verhältnis Systole / Diastole 1:2
 bei ~90/min (etwa die Spontanfrequenz des Sinusknotens ohne äußere Einflüsse) beträgt es 1:1
bei ~90/min (etwa die Spontanfrequenz des Sinusknotens ohne äußere Einflüsse) beträgt es 1:1
 bei maximal erreichbarer Herzfrequenz (meist über 170/min) schließlich 2:1
bei maximal erreichbarer Herzfrequenz (meist über 170/min) schließlich 2:1 Einerseits bestimmt die diastolische Füllung (Vorlast)
die Vordehnung und damit die systolische Kraftentfaltung
("angebotsorientierte" Pumpe, Frank-Starling-Mechanismus:
je mehr Füllung, desto stärkere
Pumpaktion).
Einerseits bestimmt die diastolische Füllung (Vorlast)
die Vordehnung und damit die systolische Kraftentfaltung
("angebotsorientierte" Pumpe, Frank-Starling-Mechanismus:
je mehr Füllung, desto stärkere
Pumpaktion).  Definiert wird die Vorlast (preload)
als die Länge der Herzmuskelfasern zu Beginn einer Systole, oder der
intraluminale Druck, der den Ventrikel zu seiner
enddiastolischen Größe ausdehnt. Diese Länge der
ventrikulären Myozyten bzw. deren Sarkomeren ist in
vivo nicht ermittelbar, daher die Konvention, den diastolischen
Füllungsdruck (Zentralvenendruck) als indirektes Maß für die Dehnung
der Herzmuskelzellen zu nehmen.
Definiert wird die Vorlast (preload)
als die Länge der Herzmuskelfasern zu Beginn einer Systole, oder der
intraluminale Druck, der den Ventrikel zu seiner
enddiastolischen Größe ausdehnt. Diese Länge der
ventrikulären Myozyten bzw. deren Sarkomeren ist in
vivo nicht ermittelbar, daher die Konvention, den diastolischen
Füllungsdruck (Zentralvenendruck) als indirektes Maß für die Dehnung
der Herzmuskelzellen zu nehmen.  Die Vorlast wurde früher als "vis a tergo"
bezeichnet, also die Kraft, welche von der venösen bzw. Einstromseite
auf die Ventrikelwände wirkt, wenn Blut aus dem Venensystem (rechtes
Herz) bzw. aus der Lunge (linkes Herz) nachströmt und das Myokard dehnt.
Die Vorlast wurde früher als "vis a tergo"
bezeichnet, also die Kraft, welche von der venösen bzw. Einstromseite
auf die Ventrikelwände wirkt, wenn Blut aus dem Venensystem (rechtes
Herz) bzw. aus der Lunge (linkes Herz) nachströmt und das Myokard dehnt.

 Abbildung: Körperposition und Sichtbarkeit der Halsvene
Abbildung: Körperposition und Sichtbarkeit der Halsvene
 Abbildung).
Bleiben die Venen gefüllt, bedeutet das einen erhöhten venösen Druck -
das kann physiologische Ursachen haben (Pressen, lautes Singen oder
Schreien, Stresssituationen) oder auf eine Herzinsuffizienz hinweisen
(Rückstau des Blutes vor dem rechten Herzen).
Abbildung).
Bleiben die Venen gefüllt, bedeutet das einen erhöhten venösen Druck -
das kann physiologische Ursachen haben (Pressen, lautes Singen oder
Schreien, Stresssituationen) oder auf eine Herzinsuffizienz hinweisen
(Rückstau des Blutes vor dem rechten Herzen). der enddiastolische Druck (rechtes Herz: Zentralvenendruck, linkes Herz: Druck im
Pulmonalkreislauf - pulmonary capillary wegde pressure PWCP, messbar mittels Rechtsherzkatheter) oder
der enddiastolische Druck (rechtes Herz: Zentralvenendruck, linkes Herz: Druck im
Pulmonalkreislauf - pulmonary capillary wegde pressure PWCP, messbar mittels Rechtsherzkatheter) oder das enddiastolische Volumen des linken Ventrikels (LVEDV), das echokardiographisch ermittelt werden kann.
das enddiastolische Volumen des linken Ventrikels (LVEDV), das echokardiographisch ermittelt werden kann.
 Andererseits muss
das Herz während der Systole (Austreibungszeit) den Widerstand
(hydrodynamische Impedanz) des nachgeschalteten Arteriensystems (rechts der Lunge, links des Körpers) überwinden (Nachlast).
Andererseits muss
das Herz während der Systole (Austreibungszeit) den Widerstand
(hydrodynamische Impedanz) des nachgeschalteten Arteriensystems (rechts der Lunge, links des Körpers) überwinden (Nachlast).
 Unter Nachlast (afteroad)versteht
man die Belastung, mit der es die sich kontrahierenden ventrikulären
Myozyten während der Austreibungszeit zu tun haben und die ihrer
Verkürzung entgegensteht.
Unter Nachlast (afteroad)versteht
man die Belastung, mit der es die sich kontrahierenden ventrikulären
Myozyten während der Austreibungszeit zu tun haben und die ihrer
Verkürzung entgegensteht.  Die Nachlast wurde früher als "vis a fronte"
bezeichnet, also die Kraft, die das Herz aufbringen muss, um den Druck
im Arteriensystem (linkes Herz) bzw. im Lungenkreislauf (rechtes Herz)
zu überwinden und das Schlagvolumen auszutreiben.
Die Nachlast wurde früher als "vis a fronte"
bezeichnet, also die Kraft, die das Herz aufbringen muss, um den Druck
im Arteriensystem (linkes Herz) bzw. im Lungenkreislauf (rechtes Herz)
zu überwinden und das Schlagvolumen auszutreiben. 
 Abbildung: Windkesseleffekt (schematisch)
Abbildung: Windkesseleffekt (schematisch) vgl. dort
vgl. dort
 Abbildung).
Abbildung).
 Druckbereiche
Druckbereiche

 Über arterielle Blutdruckmessung s. dort
Über arterielle Blutdruckmessung s. dort
 die P-Welle die Erregungsausbreitung über beide Vorhöfe,
die P-Welle die Erregungsausbreitung über beide Vorhöfe,
 der QRS-Komplex die Erregungsausbreitung über beide Ventrikel,
der QRS-Komplex die Erregungsausbreitung über beide Ventrikel,
 die T-Welle die Repolarisation der Ventrikel
die T-Welle die Repolarisation der Ventrikel die a-Welle den Druckansteg bei der beginnenden Vorhofkontraktion,
die a-Welle den Druckansteg bei der beginnenden Vorhofkontraktion,
 die c-Welle das Vorwölben der AV-Klappen während der Anspannungszeit des Ventrikels,
die c-Welle das Vorwölben der AV-Klappen während der Anspannungszeit des Ventrikels,
 die x-Senke die Verschiebung der Ventilebene zur Herzspitze,
die x-Senke die Verschiebung der Ventilebene zur Herzspitze,
 die v-Welle den frühdiastolischen Druckanstieg (Entspannungszeit),
die v-Welle den frühdiastolischen Druckanstieg (Entspannungszeit),
 die y-Senke den Druckabfall nach Öffnen der AV-Klappen
die y-Senke den Druckabfall nach Öffnen der AV-Klappen S1 den ersten Herzton (Kontraktion der Ventrikel),
S1 den ersten Herzton (Kontraktion der Ventrikel),
 S2 den zweiten Herzton (Schluss der Taschenklappen)
S2 den zweiten Herzton (Schluss der Taschenklappen)
 Sie schließen, wenn Blut sich retrograd (gegen die Stromrichtung) bewegt und die Klappe so zudrückt.
Sie schließen, wenn Blut sich retrograd (gegen die Stromrichtung) bewegt und die Klappe so zudrückt.  Ist der Druck vor der Klappe größer als hinter ihr,
öffnet sie und Blut strömt orthograd (in Stromrichtung) durch den Klappenring.
Ist der Druck vor der Klappe größer als hinter ihr,
öffnet sie und Blut strömt orthograd (in Stromrichtung) durch den Klappenring. 
 Abbildung: Herzklappenspiel
Abbildung: Herzklappenspiel
 Die
Anspannungszeit (isovolumetric contraction) beginnt mit dem Schließen der Segelklappen und endet
mit dem Öffnen der Taschenklappen. Die
Mitralklappe schließt normalerweise etwas früher als die
Trikuspidalklappe, was in einem "gespaltenen" 1. Herzton resultiert. Die Trikuspidalklappe stülpt sich infolge des Druckanstiegs im rechten Ventrikel vorhofwärts vor, was die c-Welle im Druckverlauf des rechten Vorhofs bzw. der zentralen Venen ("Venenpuls") verursacht.
Die
Anspannungszeit (isovolumetric contraction) beginnt mit dem Schließen der Segelklappen und endet
mit dem Öffnen der Taschenklappen. Die
Mitralklappe schließt normalerweise etwas früher als die
Trikuspidalklappe, was in einem "gespaltenen" 1. Herzton resultiert. Die Trikuspidalklappe stülpt sich infolge des Druckanstiegs im rechten Ventrikel vorhofwärts vor, was die c-Welle im Druckverlauf des rechten Vorhofs bzw. der zentralen Venen ("Venenpuls") verursacht. Die
Austreibungszeit (outflow phase) beginnt mit
dem Öffnen und endet mit dem Schließen der
Taschenklappen.
Die
Austreibungszeit (outflow phase) beginnt mit
dem Öffnen und endet mit dem Schließen der
Taschenklappen.  Füllungsdruck. Steigt der venöse Rückstrom zum Herzen, nehmen Vorhofdruck und ventrikuläre Vorfüllung zu.
Füllungsdruck. Steigt der venöse Rückstrom zum Herzen, nehmen Vorhofdruck und ventrikuläre Vorfüllung zu. Füllungszeit. Je länger die Füllungszeit, desto mehr nimmt das enddiastolische Volumen zu.
Füllungszeit. Je länger die Füllungszeit, desto mehr nimmt das enddiastolische Volumen zu. Dehnungsfähigkeit des Ventrikels. Mit zunehmender ventrikulärer Compliance nimmt die Kammer pro gegebener Druckzunahme mehr Volumen auf, die EDV steigt an.
Dehnungsfähigkeit des Ventrikels. Mit zunehmender ventrikulärer Compliance nimmt die Kammer pro gegebener Druckzunahme mehr Volumen auf, die EDV steigt an. Vorlast (preload) - entsprechend dem enddiastolischen Volumen. Der Frank-Starling-Mechanismus erhöht die Schlagkraft mit der Vordehnung (EDV), folglich nimmt [SV] zu, das ESV ab.
Vorlast (preload) - entsprechend dem enddiastolischen Volumen. Der Frank-Starling-Mechanismus erhöht die Schlagkraft mit der Vordehnung (EDV), folglich nimmt [SV] zu, das ESV ab. Nachlast (afterload)
- entspricht dem mittleren systemischen (arteriellen) Blutdruck (linkes
Herz) bzw. Pulmonalarteriendruck (rechtes Herz). Steigt die Nachlast,
wird das Schlagvolumen kleiner, das ESV nimmt zu (größeres Restvolumen).
Nachlast (afterload)
- entspricht dem mittleren systemischen (arteriellen) Blutdruck (linkes
Herz) bzw. Pulmonalarteriendruck (rechtes Herz). Steigt die Nachlast,
wird das Schlagvolumen kleiner, das ESV nimmt zu (größeres Restvolumen). Herzfrequenz. Mit der Schlagfrequenz nimmt die verfügbare Menge sarkoplasmatischen Calciums zu (Treppenphänomen), die Kontraktilität steigt, [ESV] nimmt ab.
Herzfrequenz. Mit der Schlagfrequenz nimmt die verfügbare Menge sarkoplasmatischen Calciums zu (Treppenphänomen), die Kontraktilität steigt, [ESV] nimmt ab. Kontraktilität. Ähnliches gilt für positiv inotrop wirkende Substanzen (Anstieg [Ca++]i), sie senken das ESV. Damit nimmt die ejection fraction zu:
Kontraktilität. Ähnliches gilt für positiv inotrop wirkende Substanzen (Anstieg [Ca++]i), sie senken das ESV. Damit nimmt die ejection fraction zu: Das
Verhältnis von Schlagvolumen zu enddiastolischem Volumen - also der Anteil der
diastolischen Füllung, der systolisch weiterbefördert wird - heißt Auswurffraktion (Ejection fraction, EF
Das
Verhältnis von Schlagvolumen zu enddiastolischem Volumen - also der Anteil der
diastolischen Füllung, der systolisch weiterbefördert wird - heißt Auswurffraktion (Ejection fraction, EF ).
Diese sollte mindestens 50% des enddiastolischen Füllungsvolumens
betragen (d.h. der Ventrikel wirft während der Systole mindestens die
Hälfte des enddiastolischen Volumens aus).
).
Diese sollte mindestens 50% des enddiastolischen Füllungsvolumens
betragen (d.h. der Ventrikel wirft während der Systole mindestens die
Hälfte des enddiastolischen Volumens aus).  Abbildung unten).
Abbildung unten).  Die
Entspannungszeit (isovolumetric relaxation)
beginnt mit dem Schließen der Taschenklappen und endet
mit dem Öffnen der Segelklappen. Die Aortenklappe schließt
normalerweise etwas früher als die Pulmonalklappe. Dieser Unterschied
wird (vor allem bei jungen Menschen) bei Einatmung größer und erzeugt
einen "gespaltenen" 2. Herzton.
Die
Entspannungszeit (isovolumetric relaxation)
beginnt mit dem Schließen der Taschenklappen und endet
mit dem Öffnen der Segelklappen. Die Aortenklappe schließt
normalerweise etwas früher als die Pulmonalklappe. Dieser Unterschied
wird (vor allem bei jungen Menschen) bei Einatmung größer und erzeugt
einen "gespaltenen" 2. Herzton. Die Füllungszeit (inflow phase) beginnt mit dem Öffnen und endet mit dem Schluss der Atrioventrikularklappen
Die Füllungszeit (inflow phase) beginnt mit dem Öffnen und endet mit dem Schluss der Atrioventrikularklappen  (AV-,
Segelklappen). Zu Beginn der Füllungszeit relaxieren die Ventrikel
noch, der Druck nimmt weiter ab (was die frühe Füllung begünstigt).
(AV-,
Segelklappen). Zu Beginn der Füllungszeit relaxieren die Ventrikel
noch, der Druck nimmt weiter ab (was die frühe Füllung begünstigt). Zuerst gleitet
die Ventilebene (offene AV-Klappe) über eine Blutsäule hinweg, die sich im Vorhofbereich angesammelt hat - vergleichbar
einem Fisch, der seine Beute mit geöffnetem Maul schluckt
(
Zuerst gleitet
die Ventilebene (offene AV-Klappe) über eine Blutsäule hinweg, die sich im Vorhofbereich angesammelt hat - vergleichbar
einem Fisch, der seine Beute mit geöffnetem Maul schluckt
( Abbildung). Dieser sogenannte Ventilebenenmechanismus trägt wesentlich zur raschen
frühdiastolischen Füllung der Ventrikel bei.
Abbildung). Dieser sogenannte Ventilebenenmechanismus trägt wesentlich zur raschen
frühdiastolischen Füllung der Ventrikel bei. 
 Abbildung: Ventilebenenmechanismus
Abbildung: Ventilebenenmechanismus 

 Anschließend
entspricht der (jetzt langsame) Einstrom etwa dem venösen Blutstrom zum
Herzen (diese Zeitspanne kann bei Erhöhung der Herzfrequenz weitgehend
eingespart werden, s. oben). Insgesamt strömen vor der Vorhofkontraktion etwa 80% des nächsten Schlagvolumens in den Ventrikel ein.
Anschließend
entspricht der (jetzt langsame) Einstrom etwa dem venösen Blutstrom zum
Herzen (diese Zeitspanne kann bei Erhöhung der Herzfrequenz weitgehend
eingespart werden, s. oben). Insgesamt strömen vor der Vorhofkontraktion etwa 80% des nächsten Schlagvolumens in den Ventrikel ein.  Schließlich
kontrahieren sich die Vorhöfe ("a" in
Abbildungen), der Bluteinstrom beschleunigt sich noch einmal,
was zu ~10-20% der diastolischen Füllung der Ventrikel beiträgt (80-90%
der Füllung erfolgt "passiv" aus den vorgeschalteten Venen).
Schließlich
kontrahieren sich die Vorhöfe ("a" in
Abbildungen), der Bluteinstrom beschleunigt sich noch einmal,
was zu ~10-20% der diastolischen Füllung der Ventrikel beiträgt (80-90%
der Füllung erfolgt "passiv" aus den vorgeschalteten Venen). Der deutsche Physiologe Otto Frank
beschrieb 1895 folgende Beobachtung: Füllt man ein isoliertes
Froschherz, dessen Aorta abgebunden ist (und das daher isovolumetrische
Kontraktionen durchführt), diastolisch
mit zunehmender Flüssigkeitsmenge ("Vorlast"), dann liegt der
systolische Spitzendruck umso höher über dem Ruhewert, je größer das
Füllungsvolumen ist (bis zu einer Obergrenze). Daraus konnte
geschlossen werden, dass die Kontraktionskraft des Ventrikels mit der
diastolischen Dehnung ansteigt.
Der deutsche Physiologe Otto Frank
beschrieb 1895 folgende Beobachtung: Füllt man ein isoliertes
Froschherz, dessen Aorta abgebunden ist (und das daher isovolumetrische
Kontraktionen durchführt), diastolisch
mit zunehmender Flüssigkeitsmenge ("Vorlast"), dann liegt der
systolische Spitzendruck umso höher über dem Ruhewert, je größer das
Füllungsvolumen ist (bis zu einer Obergrenze). Daraus konnte
geschlossen werden, dass die Kontraktionskraft des Ventrikels mit der
diastolischen Dehnung ansteigt.  sagt aus, dass Herzkammern umso stärker schlagen, je stärker sie gefüllt sind. Die Förderleistung des Herzens passt sich an das Blutangebot an (
sagt aus, dass Herzkammern umso stärker schlagen, je stärker sie gefüllt sind. Die Förderleistung des Herzens passt sich an das Blutangebot an ( Abbildung):
Abbildung):

 Abbildung: Das Schlagvolumen nimmt (ceteris paribus) mit dem diastolischen Füllungsdruck zu
Abbildung: Das Schlagvolumen nimmt (ceteris paribus) mit dem diastolischen Füllungsdruck zu , oder nach ventrikulären
Extrasystolen - eine Rolle: Je kürzer das Intervall zwischen zwei Herzschlägen, desto geringer ist die diastolische Füllung und desto schwächer fällt die nächste Systole aus; umgekehrt steigt mit der Intervallzeit auch Kraft und Schlagvolumen des nächsten Herzschlags.
, oder nach ventrikulären
Extrasystolen - eine Rolle: Je kürzer das Intervall zwischen zwei Herzschlägen, desto geringer ist die diastolische Füllung und desto schwächer fällt die nächste Systole aus; umgekehrt steigt mit der Intervallzeit auch Kraft und Schlagvolumen des nächsten Herzschlags.
 Überlappung der kontraktilen Filamente
im Sarkomer: Bei normaler enddiastolischer Füllung beträgt die Sarkomerlänge 1,8-2,0 µm. Bei ~1,8 µm greifen einige Myosin-Querbrücken am gegenläufigen Aktinfilament (Länge ~1
µm) an und reduzieren dadurch die Kraftausbeite. (Bei 1,6 µm
Sarkomerlänge stoßen die Myosinfäden außerdem an den Z-Streifen an.)
Überlappung der kontraktilen Filamente
im Sarkomer: Bei normaler enddiastolischer Füllung beträgt die Sarkomerlänge 1,8-2,0 µm. Bei ~1,8 µm greifen einige Myosin-Querbrücken am gegenläufigen Aktinfilament (Länge ~1
µm) an und reduzieren dadurch die Kraftausbeite. (Bei 1,6 µm
Sarkomerlänge stoßen die Myosinfäden außerdem an den Z-Streifen an.) Abbildung).
Abbildung).
 Abbildung: Kontraktionskraft einer Herzmuskelzelle in Abhängigkeit von ihrer Vordehnung
Abbildung: Kontraktionskraft einer Herzmuskelzelle in Abhängigkeit von ihrer Vordehnung
 Der Prozentsatz aktivierter Aktin-Myosin-Querbrücken steigt mit der Sarkomerlänge. Bei jeder gegebenen [Ca++] nimmt die Kraftausbeute mit Dehnung der Sarkomeren zu (dehnungsabhängige Aktivierung, length-dependent activation). Wie dieser Umstand zu erklären ist, bleibt kontroversiell:
Der Prozentsatz aktivierter Aktin-Myosin-Querbrücken steigt mit der Sarkomerlänge. Bei jeder gegebenen [Ca++] nimmt die Kraftausbeute mit Dehnung der Sarkomeren zu (dehnungsabhängige Aktivierung, length-dependent activation). Wie dieser Umstand zu erklären ist, bleibt kontroversiell:  Die Troponinhypothese geht von einer
dehnungsabhängig verbesserten Troponin-Interaktion aus,
Die Troponinhypothese geht von einer
dehnungsabhängig verbesserten Troponin-Interaktion aus,  die
Kompressionshypothese von
verringerten Aktin-Myosin-Abständen bei reduziertem Zelldurchmesser
(Myosinköpfchen können leicher auf Aktinmoleküle zugreifen - lattice spacing hypothesis),
die
Kompressionshypothese von
verringerten Aktin-Myosin-Abständen bei reduziertem Zelldurchmesser
(Myosinköpfchen können leicher auf Aktinmoleküle zugreifen - lattice spacing hypothesis), die Myosinhypothese von querbrückenbeeinflussender Titin-Myosin-Interaktion.
die Myosinhypothese von querbrückenbeeinflussender Titin-Myosin-Interaktion. Das Herz in situ
verfügt mit dem Perikardsack auch über eine "Außenstütze"; ein
isoliertes Herz ohne Perikard reagiert anders als ein im
physiologischen Kontext belassenes.
Das Herz in situ
verfügt mit dem Perikardsack auch über eine "Außenstütze"; ein
isoliertes Herz ohne Perikard reagiert anders als ein im
physiologischen Kontext belassenes. Schließlich sind auch
Mechanismen der myokardialen Entspannung in der Diastole zu berücksichtigen (Lusitropie ist die Herzqualität, die sich auf rasche und vollständige Erschlaffung des Myokards bezieht). Phosphorylierung von Titin macht den Herzmuskel dehnbarer, und Aktivierung des Sympathikus verflacht die Ruhedehnungskurve des Ventrikels.
Schließlich sind auch
Mechanismen der myokardialen Entspannung in der Diastole zu berücksichtigen (Lusitropie ist die Herzqualität, die sich auf rasche und vollständige Erschlaffung des Myokards bezieht). Phosphorylierung von Titin macht den Herzmuskel dehnbarer, und Aktivierung des Sympathikus verflacht die Ruhedehnungskurve des Ventrikels. Der Frank-Starling-Mechanismus spielt eine wichtige Rolle für die automatische Balance zwischen der Förderleistung des rechten und linken Ventrikels: Zwei in Serie geschaltete Pumpen müssen - über Zeiträume, die einige Sekunden überschreiten - eine
idente Volumenförderung leisten, wenn der dazwischenliegende
Gefäßabschnitt weder aufgeblasen noch leergesaugt werden soll. Würde
z.B. der rechte Ventrikel nur um 1% mehr fördern als der linke, käme es
innerhalb von 30 Minuten zu einer katastrophalen pulmonalen Überfüllung
(von ~600 ml auf ~2000 ml). Bei körperlicher Ausbelastung reichten dazu schon wenige Minuten.
Der Frank-Starling-Mechanismus spielt eine wichtige Rolle für die automatische Balance zwischen der Förderleistung des rechten und linken Ventrikels: Zwei in Serie geschaltete Pumpen müssen - über Zeiträume, die einige Sekunden überschreiten - eine
idente Volumenförderung leisten, wenn der dazwischenliegende
Gefäßabschnitt weder aufgeblasen noch leergesaugt werden soll. Würde
z.B. der rechte Ventrikel nur um 1% mehr fördern als der linke, käme es
innerhalb von 30 Minuten zu einer katastrophalen pulmonalen Überfüllung
(von ~600 ml auf ~2000 ml). Bei körperlicher Ausbelastung reichten dazu schon wenige Minuten.  Der Frank-Starling-Mechanismus löst das Problem von selbst: Steigt die Füllung im Lungenkreislauf, steigt automatisch
auch das rechtsventrikuläre Schlagvolumen - analoges gilt für den
rechten Ventrikel bzw. für eine Abnahme der Füllung einer der beiden
Kammern. Neurohumorale Regulationsmechanismen tun
dann ihr Übriges zur Stabilisierung des Kreislaufs - allerdings
brauchen sie etwas Zeit, um wirksam werden zu können.
Der Frank-Starling-Mechanismus löst das Problem von selbst: Steigt die Füllung im Lungenkreislauf, steigt automatisch
auch das rechtsventrikuläre Schlagvolumen - analoges gilt für den
rechten Ventrikel bzw. für eine Abnahme der Füllung einer der beiden
Kammern. Neurohumorale Regulationsmechanismen tun
dann ihr Übriges zur Stabilisierung des Kreislaufs - allerdings
brauchen sie etwas Zeit, um wirksam werden zu können.  Steht eine Person beispielsweise auf (Orthostase), sinkt die rechtsventrikuläre Füllung (vgl. dort), die Ventrikel gleichen die Volumina autonom aneinander an (das dauert nur Sekunden). Umgekehrt stabilisiert der
Frank-Starling-Mechanismus die Situation beim Wechsel von aufrechter zu
liegender Position, wo plötzlich das venöse Angebot an das rechte Herz
zunimmt.
Steht eine Person beispielsweise auf (Orthostase), sinkt die rechtsventrikuläre Füllung (vgl. dort), die Ventrikel gleichen die Volumina autonom aneinander an (das dauert nur Sekunden). Umgekehrt stabilisiert der
Frank-Starling-Mechanismus die Situation beim Wechsel von aufrechter zu
liegender Position, wo plötzlich das venöse Angebot an das rechte Herz
zunimmt. Auch der Atemzyklus
führt zu kurzen Imbalancen. Besonders deutlich kommt die stabilisierende Wirkung des Frank-Starling-Mechanismus bei extremen intrathorakalen Druckänderungen im Rahmen von inspiratorischen (Müller-Versuch) oder exspiratorischen (Valsalva-Versuch) Manövern zum Tragen.
Auch der Atemzyklus
führt zu kurzen Imbalancen. Besonders deutlich kommt die stabilisierende Wirkung des Frank-Starling-Mechanismus bei extremen intrathorakalen Druckänderungen im Rahmen von inspiratorischen (Müller-Versuch) oder exspiratorischen (Valsalva-Versuch) Manövern zum Tragen. Ähnliches gilt für die Kreislaufanpassung bei körperlicher Belastung: Der Frank-Starling-Mechanismus sorgt für "Rechts-links-Ausgleich" der sich stark ändernden ventrikulären Pumpleistungen.
Ähnliches gilt für die Kreislaufanpassung bei körperlicher Belastung: Der Frank-Starling-Mechanismus sorgt für "Rechts-links-Ausgleich" der sich stark ändernden ventrikulären Pumpleistungen. Der Frank-Starling-Mechanismus kümmert sich auch um Angleich der reduzierten Auswurfleistungen bei Hypovolämie und Dehydration - oder umgekehrt der erhöhten Volumenförderungen bei Hypervolämie.
Der Frank-Starling-Mechanismus kümmert sich auch um Angleich der reduzierten Auswurfleistungen bei Hypovolämie und Dehydration - oder umgekehrt der erhöhten Volumenförderungen bei Hypervolämie. : Zusätzlich
zu, und nach dem (sofort wirkenden) Frank-Starling-Mechanismus kommt es
in isoliertem Myokard innerhalb weiterer 5-10 Minuten nach Erhöhung der Vorlast / diastolischen Dehnung zu weiterer direkter Erhöhung der Kontraktilität (slow force response). Der
vermutete Mechanismus hat mehrere Komponenten, die alle zu erhöhtem Calciumeinstrom in Kardiomyozyten führen:
: Zusätzlich
zu, und nach dem (sofort wirkenden) Frank-Starling-Mechanismus kommt es
in isoliertem Myokard innerhalb weiterer 5-10 Minuten nach Erhöhung der Vorlast / diastolischen Dehnung zu weiterer direkter Erhöhung der Kontraktilität (slow force response). Der
vermutete Mechanismus hat mehrere Komponenten, die alle zu erhöhtem Calciumeinstrom in Kardiomyozyten führen: Dehnung von Herzmuskelzellen aktiviert
membranständige Na/H-Austauscher, Natriumionen strömen in die Zelle
ein, hemmen intrazellulär Na/Ca-Austauscher und verlängern die Verweildauer von Ca++ im Sarkoplasma.
Dehnung von Herzmuskelzellen aktiviert
membranständige Na/H-Austauscher, Natriumionen strömen in die Zelle
ein, hemmen intrazellulär Na/Ca-Austauscher und verlängern die Verweildauer von Ca++ im Sarkoplasma.  Dehnung von Herzmuskelzellen aktiviert weiters Calciumkanäle, was ebenfalls vermehrt Ca++ im das Sarkoplasma bringt.
Dehnung von Herzmuskelzellen aktiviert weiters Calciumkanäle, was ebenfalls vermehrt Ca++ im das Sarkoplasma bringt.  Dehnung von Herzmuskelzellen regt deren Produktion inotroper Stoffe (Angiotensin II, Endothelin I) an. Auch diese erhöhen auto- / parakrin die intrazellulären Calciumspeicher.
Dehnung von Herzmuskelzellen regt deren Produktion inotroper Stoffe (Angiotensin II, Endothelin I) an. Auch diese erhöhen auto- / parakrin die intrazellulären Calciumspeicher. (Frequenzinotropie, "Treppenphänomen", staircase phenomenon)
bezeichnet man die Tatsache, dass Erhöhung der Schlagfrequenz eines
Herzmuskelpräparates zu einer Stärkung der einzelnen Systolen führt,
und dass nach Zurückschalten auf niedrigere Frequenz zunächst eine
besonders intensive Kontraktion erfolgt (
(Frequenzinotropie, "Treppenphänomen", staircase phenomenon)
bezeichnet man die Tatsache, dass Erhöhung der Schlagfrequenz eines
Herzmuskelpräparates zu einer Stärkung der einzelnen Systolen führt,
und dass nach Zurückschalten auf niedrigere Frequenz zunächst eine
besonders intensive Kontraktion erfolgt ( Abbildung).
Abbildung). 
 Abbildung: Treppenphänomen bei einem isolierten Herzmuskelpräparat (Bowditch-Effekt)
Abbildung: Treppenphänomen bei einem isolierten Herzmuskelpräparat (Bowditch-Effekt)
 Bei höherer Herzfrequenz ist die Summe der Plateauzeiten der
Aktionspotentiale pro Zeiteinheit und damit die Dauer des
Calciumeinstroms durch L-Typ-Calciumkanäle erhöht.
Bei höherer Herzfrequenz ist die Summe der Plateauzeiten der
Aktionspotentiale pro Zeiteinheit und damit die Dauer des
Calciumeinstroms durch L-Typ-Calciumkanäle erhöht. In den (in der Summe verlängerten) Plateauphasen arbeiten die Na/Ca-Austauscher (NCX) im "reverse mode" und lassen Ca++ in die Zelle eindringen, statt es zu exportieren.
In den (in der Summe verlängerten) Plateauphasen arbeiten die Na/Ca-Austauscher (NCX) im "reverse mode" und lassen Ca++ in die Zelle eindringen, statt es zu exportieren. Durch beide Mechanismen steigt der sarkoplasmatische Ca++-Spiegel. Das führt zu rascherer Einlagerung von Calcium in das sarkoplasmatische Retikulum, und das geht so:
Durch beide Mechanismen steigt der sarkoplasmatische Ca++-Spiegel. Das führt zu rascherer Einlagerung von Calcium in das sarkoplasmatische Retikulum, und das geht so: 
 Das Herz saugt
Blut aus Niederdruckgefäßen (vv. cavae, vv. pulmonales) und pumpt es in
arterielle Gefäße (Lungenschlagader bzw. Aorta). Jeder
Herzschlag fördert aus beiden Herzkammern (Ventrikeln ) je ~70 ml Blut
(Schlagvolumen) gegen einen Druck von 1-2 kPa im
Lungenkreislauf (rechtes Herz) und ~13 kPa im großen
Kreislauf (linkes Herz). Pro Herzschlag erbringt der Herzmuskel etwas
mehr als 1 J, die Leistung beträgt gut 1 W. Der Wirkungsgrad des
Herzschlags beträgt 20-25%, der gesamte Energieaufwand ~5 W
(Ruheumsatz des Organismus ~100 W). 3/4 des Energieverbrauchs
beansprucht die Kontraktion, 1/4 Membranpotentiale und
Strukturerhaltung. Der spezifische Sauerstoffverbrauch - in
körperlicher Ruhe ~10 ml O2/min/100g - kann bei Ausbelastung bis ~50 ml/min/100g steigen
Das Herz saugt
Blut aus Niederdruckgefäßen (vv. cavae, vv. pulmonales) und pumpt es in
arterielle Gefäße (Lungenschlagader bzw. Aorta). Jeder
Herzschlag fördert aus beiden Herzkammern (Ventrikeln ) je ~70 ml Blut
(Schlagvolumen) gegen einen Druck von 1-2 kPa im
Lungenkreislauf (rechtes Herz) und ~13 kPa im großen
Kreislauf (linkes Herz). Pro Herzschlag erbringt der Herzmuskel etwas
mehr als 1 J, die Leistung beträgt gut 1 W. Der Wirkungsgrad des
Herzschlags beträgt 20-25%, der gesamte Energieaufwand ~5 W
(Ruheumsatz des Organismus ~100 W). 3/4 des Energieverbrauchs
beansprucht die Kontraktion, 1/4 Membranpotentiale und
Strukturerhaltung. Der spezifische Sauerstoffverbrauch - in
körperlicher Ruhe ~10 ml O2/min/100g - kann bei Ausbelastung bis ~50 ml/min/100g steigen Systole (Kontraktion des Myokards) und Diastole (Erschlaffung
des Myokards) wechseln einander ab. In Ruhe (60/min) dauert die
Diastole doppelt so lange wie die Systole; bei maximaler Herzfrequenz
ist es umgekehrt, vor allem die Diastolendauer wird kürzer (zeitliche
Reserve). Die Systole beginnt mit der Anspannungszeit (isovolumetrische Kontraktion, alle Klappen geschlossen, der Ventrikel enthält das enddiastolische Volumen), in der Austreibungszeit wird das Schlagvolumen ausgeworfen (Aorten- und Pulmonalklappe offen), das Restvolumen verbleibt im Ventrikel. Das Verhältnis Schlagvolumen / enddiastolisches Volumen heißt
Auswurffraktion (Ejection fraction, EF) - ein Maß für die Effizienz des Herzschlags (mindestens 50-60% des enddiastolischen Füllungsvolumens)
Systole (Kontraktion des Myokards) und Diastole (Erschlaffung
des Myokards) wechseln einander ab. In Ruhe (60/min) dauert die
Diastole doppelt so lange wie die Systole; bei maximaler Herzfrequenz
ist es umgekehrt, vor allem die Diastolendauer wird kürzer (zeitliche
Reserve). Die Systole beginnt mit der Anspannungszeit (isovolumetrische Kontraktion, alle Klappen geschlossen, der Ventrikel enthält das enddiastolische Volumen), in der Austreibungszeit wird das Schlagvolumen ausgeworfen (Aorten- und Pulmonalklappe offen), das Restvolumen verbleibt im Ventrikel. Das Verhältnis Schlagvolumen / enddiastolisches Volumen heißt
Auswurffraktion (Ejection fraction, EF) - ein Maß für die Effizienz des Herzschlags (mindestens 50-60% des enddiastolischen Füllungsvolumens) Die diastolische Füllung (Vorlast) verhält sich
proportional zum diastolischen Druck (rechtes Herz: Zentralvenendruck -
im Liegen ~1 kPa, aufrecht ~0 kPa; linkes Herz: Druck im
Pulmonalkreislauf ~1 kPa). Während der Systole muss der Ventrikel die hydrodynamische Impedanz des
Arteriensystems überwinden (Nachlast) - proportional zum
Pulmonalarteriendruck (systolisch <25 mmHg, diastolisch <10 mmHg) bzw. arteriellen Blutdruck (systolisch <140 mmHg, diastolisch <90 mmHg). Die Kraft der Systole steigt mit der Vorlast (Frank-Starling-Mechanismus): Dieses Pronzip der "angebotsorientierten Pumpe"
gleicht unterschiedliche
Imbalancen aus, bedingt z.B. durch die Atmung oder orthostatische
Änderungen. Je besser dehnbar die Aorta ist (Windkesseleffekt: etwa die Hälfte des Schlagvolumens wird herznah
'zwischengespeichert'), desto geringer ist die Nachlast für das linke Herz
Die diastolische Füllung (Vorlast) verhält sich
proportional zum diastolischen Druck (rechtes Herz: Zentralvenendruck -
im Liegen ~1 kPa, aufrecht ~0 kPa; linkes Herz: Druck im
Pulmonalkreislauf ~1 kPa). Während der Systole muss der Ventrikel die hydrodynamische Impedanz des
Arteriensystems überwinden (Nachlast) - proportional zum
Pulmonalarteriendruck (systolisch <25 mmHg, diastolisch <10 mmHg) bzw. arteriellen Blutdruck (systolisch <140 mmHg, diastolisch <90 mmHg). Die Kraft der Systole steigt mit der Vorlast (Frank-Starling-Mechanismus): Dieses Pronzip der "angebotsorientierten Pumpe"
gleicht unterschiedliche
Imbalancen aus, bedingt z.B. durch die Atmung oder orthostatische
Änderungen. Je besser dehnbar die Aorta ist (Windkesseleffekt: etwa die Hälfte des Schlagvolumens wird herznah
'zwischengespeichert'), desto geringer ist die Nachlast für das linke Herz Diastole: Die Entspannungszeit beginnt mit dem Schließen der Taschenklappen und endet mit dem Öffnen der Segelklappen. Der Ventrikeldruck nimmt ab, im Ventrikel befindet sich das Restvolumen. Die Füllungszeit
beginnt mit dem Öffnen und endet mit dem Schluss der AV-Klappen, Blut
fließt aus dem Vorhof nach. Zuerst gleitet die offene AV-Klappe über
Vorhofblut (Ventilebenenmechanismus),vor der Vorhofkontraktion strömen
~80%
des nächsten Schlagvolumens in den Ventrikel ein, ~20% der
diastolischen Ventrikelfüllung erfolgt durch die Vorhofkontraktion
Diastole: Die Entspannungszeit beginnt mit dem Schließen der Taschenklappen und endet mit dem Öffnen der Segelklappen. Der Ventrikeldruck nimmt ab, im Ventrikel befindet sich das Restvolumen. Die Füllungszeit
beginnt mit dem Öffnen und endet mit dem Schluss der AV-Klappen, Blut
fließt aus dem Vorhof nach. Zuerst gleitet die offene AV-Klappe über
Vorhofblut (Ventilebenenmechanismus),vor der Vorhofkontraktion strömen
~80%
des nächsten Schlagvolumens in den Ventrikel ein, ~20% der
diastolischen Ventrikelfüllung erfolgt durch die Vorhofkontraktion  Erhöhung der Schlagfrequenz eines Herzmuskelpräparates stärkt die einzelnen Systolen (Bowditch-Effekt,
Frequenzinotropie, Treppenphänomen); nach Zurückschalten auf niedrigere
Frequenz erfolgt zunächst eine besonders intensive Kontraktion. Das
erklärt sich durch Erhöhung des Ca++-Speichers im sarkoplasmatischen Retikulum (kürzere Diastolendauer → weniger Zeit für das Zurückpumpen in das endoplasmatische Retikulum; Erhöhung des intrazellulären [Na+] → Na/Ca-Austausch reduziert). Der Effekt tritt unabhängig von der Vordehnung auf
Erhöhung der Schlagfrequenz eines Herzmuskelpräparates stärkt die einzelnen Systolen (Bowditch-Effekt,
Frequenzinotropie, Treppenphänomen); nach Zurückschalten auf niedrigere
Frequenz erfolgt zunächst eine besonders intensive Kontraktion. Das
erklärt sich durch Erhöhung des Ca++-Speichers im sarkoplasmatischen Retikulum (kürzere Diastolendauer → weniger Zeit für das Zurückpumpen in das endoplasmatische Retikulum; Erhöhung des intrazellulären [Na+] → Na/Ca-Austausch reduziert). Der Effekt tritt unabhängig von der Vordehnung auf