Primäre Aufgabe des Herzens ist die Förderung eines bestimmten Blutvolumens pro Zeit (cardiac output,
Herzminutenvolumen). Dessen Größe hängt von den Umständen ab: So nimmt
es durch Wechsel von liegender zu aufrechter Körperposition um ~30% ab (hydrostatischer Effekt) und steigt nach dem Essen um ~25% (erhöhte Durchblutung des Splanchnikusgebietes), am Ende der Schwangerschaft um ~50%
(erhöhtes Blutvolumen, Bedarf durch den Feten und zusätzliches Gewebe),
oder durch körperliche Belastung bis 4-5-fach an (Autoregulation der
Muskeldurchblutung). Die Anpassung der kardialen Förderleistung erfolgt
vor allem durch das autonome Nervensystem.
Das Herz ist ein Zielorgan des autonomen Nervensystems
 s. auch dort
s. auch dort
Die Förderleistung des Herzens ist auf die Kreislaufsituation
abgestimmt. Diese Harmonisierung erfolgt zum Teil durch das Herz
selbst (autonom), zum Teil über das Vegetativum und hormonelle
Steuerung.
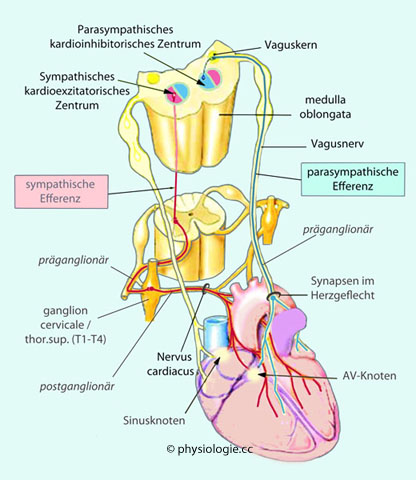

 Abbildung: Autonom-nervöse Beeinflussung der Herztätigkeit
Nach einer Vorlage in Martini FH. Fundamentals of Anatomy and Physiology. 8th ed. 2006
Abbildung: Autonom-nervöse Beeinflussung der Herztätigkeit
Nach einer Vorlage in Martini FH. Fundamentals of Anatomy and Physiology. 8th ed. 2006
Das lateral gelegene kardioakzeleratorische (→ Sympathikus) und mediale kardioinhibitorische Areal (→ Vagus) sind Teile des Kreislaufzentrums in der medulla oblongata.
Die beiden Teile des autonomen Nervensystems innervieren das Herz mittels Fasern, welche in Herznähe (Aortenbogen) den plexus cardiacus
bilden. Sympathische postganglionäre Neurone liegen in unteren
zervikalen und oberen thorakalen Ganglien - also nahe dem Rückenmark -,
parasympathische hingegen organnahe, d.h. im plexus cardiacus. Beide
Systeme innervieren den Sinus- und AV-Knoten sowie die Vorhöfe, die
Ventrikel sind fast ausschließlich sympathisch versorgt
 Eine unmittelbare Anpassung der Herzleistung an die aktuelle Kreislaufsituation erfolgt über die Volumenbelastung (preload): Auf eine Zunahme der diastolischen Füllung (Vorlast)
reagiert der Herzmuskel mit erhöhter Schlagkraft. Dieser Mechanismus
ist autonom, er funktioniert auch ohne nervöse oder humorale
Beeinflussung. Durch ihn steigt entweder das Schlagvolumen (bei
gleichbleibender Nachlast), oder es wird
gegen einen höheren Druck im Arteriensystem (Nachlast) ausgeworfen.
Eine unmittelbare Anpassung der Herzleistung an die aktuelle Kreislaufsituation erfolgt über die Volumenbelastung (preload): Auf eine Zunahme der diastolischen Füllung (Vorlast)
reagiert der Herzmuskel mit erhöhter Schlagkraft. Dieser Mechanismus
ist autonom, er funktioniert auch ohne nervöse oder humorale
Beeinflussung. Durch ihn steigt entweder das Schlagvolumen (bei
gleichbleibender Nachlast), oder es wird
gegen einen höheren Druck im Arteriensystem (Nachlast) ausgeworfen.
 Die Vorlast wurde früher als 'vis a tergo', also die Kraft von hinten - d.h. aus dem Niederdrucksystem (Venenraum) - bezeichnet. Die Nachlast nannte man 'vis a fronte', also die Kraft von vorne, d.h. aus dem Hochdrucksystem (Aorten- bzw. arteriellen Raum).
Die Vorlast wurde früher als 'vis a tergo', also die Kraft von hinten - d.h. aus dem Niederdrucksystem (Venenraum) - bezeichnet. Die Nachlast nannte man 'vis a fronte', also die Kraft von vorne, d.h. aus dem Hochdrucksystem (Aorten- bzw. arteriellen Raum).
 Das autonome Nervensystem steuert Kreislaufreflexe zur Anpassung der Herzleistung bei: Ändert sich der arterielle Druck, wird er durch den Barorezeptorreflex (kurzzeitig) stabilisiert:
Blutdruckerhöhung steigert den parasympathischen (Vagus → Herz) und
senkt den sympathischen Einfluss, Herzzeitvolumen und Gefäßtonus
nehmen ab (Vasodilatation), der Blutdruck sinkt. Bei Blutdruckabfall
funktioniert der Reflex umgekehrt (negative Rückkopplung zur
Stabilisierung der Regelgröße Blutdruck).
Das autonome Nervensystem steuert Kreislaufreflexe zur Anpassung der Herzleistung bei: Ändert sich der arterielle Druck, wird er durch den Barorezeptorreflex (kurzzeitig) stabilisiert:
Blutdruckerhöhung steigert den parasympathischen (Vagus → Herz) und
senkt den sympathischen Einfluss, Herzzeitvolumen und Gefäßtonus
nehmen ab (Vasodilatation), der Blutdruck sinkt. Bei Blutdruckabfall
funktioniert der Reflex umgekehrt (negative Rückkopplung zur
Stabilisierung der Regelgröße Blutdruck).
 Weiters wirken Hormone auf das Herz ein: So
bewirkt Adrenalin eine Umverteilung des Herzzeitvolumens zur Muskulatur, auf
Kosten von Eingeweiden und Haut. Das Herz wird angeregt, Herzfrequenz
und Herzzeitvolumen nehmen zu. Natriuretische Peptide bewirken eine Reduktion des effektiven Blutvolumens und damit eine
Entlastung der Druckprofile im Kreislauf; das Herz reguliert auf diese
Weise auf endokrinem Weg seine Vorlast, was vor allem bei Überdehnung
der Herzräume erfolgt.
Weiters wirken Hormone auf das Herz ein: So
bewirkt Adrenalin eine Umverteilung des Herzzeitvolumens zur Muskulatur, auf
Kosten von Eingeweiden und Haut. Das Herz wird angeregt, Herzfrequenz
und Herzzeitvolumen nehmen zu. Natriuretische Peptide bewirken eine Reduktion des effektiven Blutvolumens und damit eine
Entlastung der Druckprofile im Kreislauf; das Herz reguliert auf diese
Weise auf endokrinem Weg seine Vorlast, was vor allem bei Überdehnung
der Herzräume erfolgt.
Die Kontrolle
sympathischer und parasympathischer Aktivität unterliegt
Rückkopplungseffekten aus der Peripherie. Das Kreislaufzentrum liegt im
Hirnstamm: Der
nucl. tractus solitarii
erhält Afferenzen aus der Peripherie (Gefäße, Herz, Skelettmuskeln) und
der area postrema (chemorezeptorisches zirkumventrikuläres Organ hinter
dem nucl. tractus solitarii).
 Zum Kreislaufzentrum s. dort
Zum Kreislaufzentrum s. dort
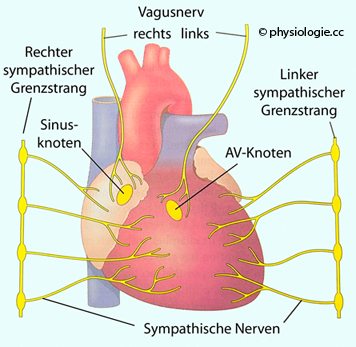
 Abbildung: Nervöse Versorgung des Herzens
Abbildung: Nervöse Versorgung des Herzens
Nach einer Vorlage bei Guyton and Hall, Textbook of Medical Physiology, 15th ed. Elsevier 2026
Gezeigt
sind parasympathische (über N. vagus) und sympathische Efferenzen (über Blutgefäße) zum
Herzen.
Der rechte Vagusnerv beeinflusst den Sinusknoten (und wirkt
damit negativ chronotrop, also frequenzsenkend), der linke den
Atroventrikular- (AV-) Knoten (und wirkt damit negativ dromotrop, bremst also die Überleitung der Erregung von Vorhof zu Kammer und
verlängert damit auch die PQ-Zeit).
Der Vagustonus senkt im Ruhezustand die Herzfrequenz von der
Eigenfrequemnz des Sinusknotens (ungefähr 100 bpm) auf ca. 60 bpm
("Normokardie"). Starke Reizung der Vagus-Efferenzen zum Herzen senkt
die Herzfrequenz noch stärker (Bradykardie, z.B. im Schlaf oder bei
stark trainierten Personen - "Sportlerherz"), im Extremfall (maximale
Vagusaktivität bei intensiven Reflexmustern) kann es zu einem
Herzstillstand kommen.
Nimmt der sympathische Einfluss auf das Herz zu (ergotrope Sutuation),
nehmen die Herzfrequenz (positiv chronotroper Effekt) und die
Schlagkraft des Moykards zu (positiv inotrope Wirkung), die
Aktionspotentialübermittlung via Reizleitungssytem wird beschleunigt
(positiv dromotrope Wirkung) - letzteres unterstützt die raschere
Abfolge der Phasen des Herzzyklus
 Reizung von Barorezeptoren regt den
dorsalen Vaguskern sowie
den nucleus ambiguus an (Blutdrucksenkung, Herzbremsung) und hemmt das
vasokonstriktorische Zentrum (Vasodilatation); Muskeltätigkeit regt
umgekehrt den Sympathikus an.
Reizung von Barorezeptoren regt den
dorsalen Vaguskern sowie
den nucleus ambiguus an (Blutdrucksenkung, Herzbremsung) und hemmt das
vasokonstriktorische Zentrum (Vasodilatation); Muskeltätigkeit regt
umgekehrt den Sympathikus an.
Die autonom-nervöse Kontrolle des Herzens zeigt eine Besonderheit:
Typischerweise übt im Organismus der Synpathikus (nicht der
Parasympathikus) tonische Aktivität aus (Blutgefäße). Beim Herzen ist
es umgekehrt: Der Parasympathikus ist es, der im Ruhezustand (über muskarinische M2-Rezeptoren)
tonisch auf das Reizleitungssystem wirkt und die Entladungsfrequenz des
Sinusknotens (der auf sich alleine gestellt - Spontanfrequenz - 100-120
Entladungen pro Minute produziert) auf 60-70 pro Minute drückt
("Normokardie").
Bei körperlicher Belastung nimmt der parasympathische Einfluss ab,
allein das erhöht schon die Schlagfrequenz des Herzens. Zusätzlich
steigt der Sympathikustonus, auch schüttet das Nebennierenmark Adrenalin aus, und über ß1-Rezeptoren wird das Herz gestärkt (positive Inotropie) und seine Schlagfrequenz erhöht (Tachykardie).
Der Sympathikus verstärkt und verkürzt die Systole - z.B. bei Stress, Aufrichten des Körpers (Orthostase), körperlicher Belastung oder Blutverlust. Mehrere Komponenten sind im Spiel:
 Erhöhte Schlagkraft (positive Inotropie) lässt den ventrikulären Druck stärker und rascher (dp/dtmax) ansteigen
Erhöhte Schlagkraft (positive Inotropie) lässt den ventrikulären Druck stärker und rascher (dp/dtmax) ansteigen
 Das Schlagvolumen nimmt (ceteris paribus) zu, die Auswurffraktion (ejection fraction) kann bis um ~65%
ansteigen, folglich nimmt das diastolische Volumen ab. Die Zunahme der
Kontraktilität reduziert das Ventrikelvolumen (diastolisch und
systolisch)
Das Schlagvolumen nimmt (ceteris paribus) zu, die Auswurffraktion (ejection fraction) kann bis um ~65%
ansteigen, folglich nimmt das diastolische Volumen ab. Die Zunahme der
Kontraktilität reduziert das Ventrikelvolumen (diastolisch und
systolisch)
 Die Pulsfrequenz steigt (positive Chronotropie), die Dauer der diastolischen Füllungszeit nimmt ab
Die Pulsfrequenz steigt (positive Chronotropie), die Dauer der diastolischen Füllungszeit nimmt ab
 Die Refraktärzeit nimmt ab (vermehrte Neigung zu ektopischen Herzschlägen)
Die Refraktärzeit nimmt ab (vermehrte Neigung zu ektopischen Herzschlägen)
 Der Quotient zwischen Sauerstoffbedarf und Herzarbeit wird geringer.
Der Quotient zwischen Sauerstoffbedarf und Herzarbeit wird geringer.
Erhöhter Sympathikuseinfluss stärkt also das Herz, hat aber auch problematische Wirkungen, wie die letzten beiden Punkte zeigen.
Präganglionäre sympathische
Fasern verlassen das Rückenmark in T1-T4 und schalten in
paravertebralen Ganglien um ( Abbildung oben). Die wesentlich längeren postsynaptischen
Fasern erreichen das Herz über große Gefäße. Sie innervieren alle Teile
des Herzens. Schrittmachergewebe wird vor allem von rechtsseitigen, die
Ventrikel vor allem durch linksseitige Fasern versorgt. Die für den Herzmuskel charakteristischen ß1-Rezeptoren kommen an Kardiomyozyten des Menschen 4-mal häufiger von als ß2-Rezeptoren.
Abbildung oben). Die wesentlich längeren postsynaptischen
Fasern erreichen das Herz über große Gefäße. Sie innervieren alle Teile
des Herzens. Schrittmachergewebe wird vor allem von rechtsseitigen, die
Ventrikel vor allem durch linksseitige Fasern versorgt. Die für den Herzmuskel charakteristischen ß1-Rezeptoren kommen an Kardiomyozyten des Menschen 4-mal häufiger von als ß2-Rezeptoren.
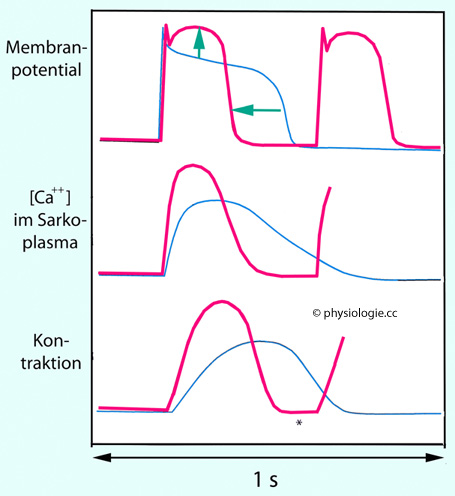
 Abbildung: Effekt sympathischer Reizung auf eine ventrikuläre Herzmuskelzelle
Abbildung: Effekt sympathischer Reizung auf eine ventrikuläre Herzmuskelzelle
Nach einer Vorlage in Herring / Paterson, Levick's Introduction to Cardiovascular Physiology, 6th ed. 2018
Blaue dünne Kurven: Kontrollsituation, rote
Kurven: während Stimulation efferenter (kardiotroper) sympathischer
Fasern. Die Stimulation hat die Herzfrequenz verdoppelt.
Oben: Der grüne Pfeil nach oben
deutet auf die "Aufwölbung" des Aktionspotentials infolge verstärkten
Calciumeinstroms in der Plateauphase, der grüne Pfeil nach links auf
die Verkürzung des Aktionspotentials (kürzere Plateauphase) infolge
verstärkten repolarisierenden Kaliumausstroms.
Mitte: Die Freisetzung von
Calciumionen in das Sarkoplasma erfolgt während sympathischer Stimulation intensiver (verstärkte
Kontraktion, positiv inotroper Effekt), aber für kürzere Zeit (raschere
Entfernung / Entspannung, positiv lusitroper Effekt).
Unten: Die Kontraktion ist
unter intensiver Sympathikuswirkung stärker und kürzer, die
diastolische Füllung wegen der kurzen Diastolenzeit unter Umständen
kompromittiert (Stern)
 Die
Die  Abbildung zeigt
positiv chronotrope, inotrope und lusitrope Effekte sympathischer
Reizung sowie die Verkürzung des Aktionspotentials der Kardiomyozyten.
Die starke Verkürzung der Diastolendauer kann bei hoher Herzfrequenz die diastolischen Füllung der Ventrikel reduzieren: Überschreitet die Herzfrequenz einen Betrag von ~160/min, kann die Auswurffraktion abnehmen, und ein nunmehr sinkendes
Herzminutenvolumen kann zu Hypotonie, zerebrale Unterdurchblutung und Kreislaufkollaps führen.
Abbildung zeigt
positiv chronotrope, inotrope und lusitrope Effekte sympathischer
Reizung sowie die Verkürzung des Aktionspotentials der Kardiomyozyten.
Die starke Verkürzung der Diastolendauer kann bei hoher Herzfrequenz die diastolischen Füllung der Ventrikel reduzieren: Überschreitet die Herzfrequenz einen Betrag von ~160/min, kann die Auswurffraktion abnehmen, und ein nunmehr sinkendes
Herzminutenvolumen kann zu Hypotonie, zerebrale Unterdurchblutung und Kreislaufkollaps führen.
Die Aktivität sympathischer Fasern zum Herzen steigt in Situationen wie Orthostase, Stress, Muskelarbeit, Blutverlust. Die sympathischen Transmitter (Noradrenalin, Adrenalin) wirken über ß1-Adrenozeptoren. Deren Gs-Protein aktiviert Adenylylcyclase, es entsteht cAMP (das die Na+-Leitfähigkeit von HCN-Kanälen erhöht und den Schrittmacherstrom If durch die Zellmembran verstärkt) und spannungsgesteuerte Ca++-Kanäle
aktiviert (Calcium strömt in die Herzmuskelzelle ein). Proteinkinase A
(PKA) wird aktiviert, das regulierende Protein Phospholamban
phosphoryliert. Das hebt die Hemmung der muskulär-intrazellulären
Calciumpumpe SERCA-2a auf (schnellere Erschlaffung - positive
Lusitropie). Zusätzlich führt die stärkere SERCA-Funktion zu einer
erhöhten Calciumfreisetzung bei der nächsten Systole (positiv inotroper
Fffekt).
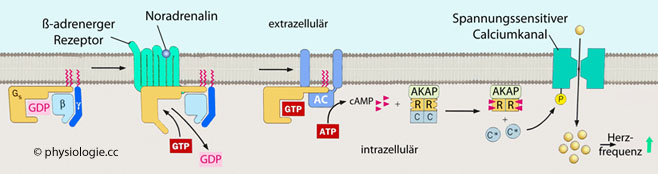
 Abbildung: Wie Noradrenalin die Herzfrequenz steigert
Abbildung: Wie Noradrenalin die Herzfrequenz steigert
Nach einer Vorlage in Liqun Luo, Principles of Neurobiology, 2nd ed. CRC Press 2021
Von
links: Noradrenalin bindet an ß1-Rezeptoren, das aktiviert Gs-Protein
(eine Variante des Gα-Proteins; "s" steht für stimulierend), welches
darauf hin Adenylatcyclase (AC) aktiviert. cAMP aktiviert wiederum Proteinkinase A:
Diese besteht aus zwei regulatorischen (R) und zwei katalytischen
Einheiten (C). Jede regulatorische Einheit hat zwei Bindungsstellen für
cAMP und ist mit A-Kinase-Verankerungsprotein (AKAP) assoziiert - so
bleibt der Komplex an der Innenseite der Zellmembran.
Sind alle vier Bindungsstellen mit cAMP besetzt, lösen sich die
katalytischen Einheiten von diesem Komplex, diffundieren durch das
Zytoplasma und werden aktiv (C*). Sie phosphorylieren ihre Substrate,
wie spannungssensitive Calciumkanäle. Das erhöht deren
Offen-Wahrscheinlichkeit und verstärkt den Calciumeinstrom in die Zelle
 Die Effekte erhöhten Sympathikuseinflusses auf das Herz erfolgen hauptsächlich durch Aktivierung von ß1-Rezeptoren
und damit über Erhöhung des [cAMP] in Kardiomyozyten - Proteinkinase A
phosphoryliert Calciumkanäle, und diese lassen mehr Ca++
in die Muskelzelle einströmen (
Die Effekte erhöhten Sympathikuseinflusses auf das Herz erfolgen hauptsächlich durch Aktivierung von ß1-Rezeptoren
und damit über Erhöhung des [cAMP] in Kardiomyozyten - Proteinkinase A
phosphoryliert Calciumkanäle, und diese lassen mehr Ca++
in die Muskelzelle einströmen ( Abbildung). Das wirkt sich auf die oben genannten
Eigenschaften aus, auch beschleunigt es die Zurückbeförderung von Ca++ in das sarkoplasmatische Retikulum über SERCA.
Abbildung). Das wirkt sich auf die oben genannten
Eigenschaften aus, auch beschleunigt es die Zurückbeförderung von Ca++ in das sarkoplasmatische Retikulum über SERCA.
Noradrenalin / Adrenalin binden an ß1-Rezeptoren. Das aktiviert Adenylylcyclase (cAMP → erhöhter Schrittmacherstrom) und SERCA-2a (raschere Ca++-Rückführung in das sarkoplasmatische Retikulum → raschere Erschlaffung, indirekt positiv inotrope Wirkung), L-Typ- Ca++-Kanäle werden (über PKA) geöffnet (Einstrom von Calciumionen aus dem Extrazellulärraum)
|
Der Effekt an den Herzmuskelzellen ist eine Steigerung der zytosolischen [Ca++] und damit eine Erhöhung des Prozentsatzes systolisch aktivierter Myosin-Querbrücken (erhöhte Kontraktilität und Auswurffraktion,
verringertes Restvolumen). Gleichzeitig steigt die Aktivität der
SERCA-Pumpe durch Inaktivierung von Phospholamban, sodass sich der
Muskel rascher entspannt (verkürzte Systolendauer). Auch der enddiastolische Druck nimmt ab.
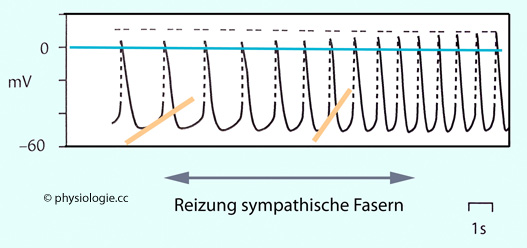
 Abbildung: Wirkung sympathischer Stimulation auf das Schrittmacherpotential
Nach Hutter OF, Trautwein W: Vagal and sympathetic effects on the pacemaker fibers in the sinus venosus of the heart. J Gen Physiol 1956; 39: 715-33
Abbildung: Wirkung sympathischer Stimulation auf das Schrittmacherpotential
Nach Hutter OF, Trautwein W: Vagal and sympathetic effects on the pacemaker fibers in the sinus venosus of the heart. J Gen Physiol 1956; 39: 715-33
Tachykardie
setzt nur verzögert (einige Sekunden) nach Einsetzen der erhöhten
Sympathikusaktivität ein (Zeitmarke: 1 Sekunde). Auch die Rückkehr zur
Ausgangsfrequenz nach Absetzen der Stimulation dauert mehrere Sekunden
(rechts).
Die orange gefärbten
Linien deuten die Zunahme der Anstiegssteilheit des
Schrittmacherpotentials an - diese verkürzt die Zeit bis zum Erreichen
des Schwellenpotentials und steigert die Herzfrequenz.
Die obere strichlierte Linie macht auf die Zunahme der Amplitude der Aktionspotentiale hin, erklärbar durch noradrenalinbedingte Steigerung des Calciumeinstroms
 Im Gegensatz zu einer Schlagvolumensteigerung durch den
Frank-Starling-Mechanismus - der vermehrte diastolische Füllung
voraussetzt - nimmt der Ventrikeldurchmesser bei sympathischer
Stimulierung ab (nicht zu), und zwar sowohl systolisch als auch
diastolisch.
Im Gegensatz zu einer Schlagvolumensteigerung durch den
Frank-Starling-Mechanismus - der vermehrte diastolische Füllung
voraussetzt - nimmt der Ventrikeldurchmesser bei sympathischer
Stimulierung ab (nicht zu), und zwar sowohl systolisch als auch
diastolisch.
Die Steigerung des Schlagvolumens - insbesondere bei körperlicher Belastung - hängt von mehreren Faktoren ab (Grad der Belastung, Alter der Person, Qualität der koronaren Durchblutung). Auch die Körperlage
spielt eine Rolle: Während sich das Schlagvolumen bei aufrechter
Körperposition deutlich steigern lässt, ist das im Liegen kaum möglich,
weil dann die ohnehin schon starke diastolische Füllung nicht
wesentlich erhöht werden kann.
Außer der Kontraktilität (positive Inotropie) steigen unter
Sympathikuseinfluss Herzfrequenz (positive Chronotropie) und
Überleitungsgeschwindigkeit (positive Dromotropie). Die Erregbarkeit
nimmt zu (positive Bathmotropie), der Ventrikel erschlafft rascher und
vollständiger (positive Lusitropie).
 Die Herztätigkeit kann über ß1-adrenerge
Einflüsse angeregt werden, z.B. durch Isoprenalin, Dopamin oder
Dobutamin (Beta-Agonisten). Ähnliche Effekte können auch unter Umgehung
der Rezeptoren erzielt werden, z.B. durch Breitband- (wie Theophyllin
oder Koffein) oder spezifische Phosphodiesterasehemmer (wie der PDE3-Hemmer Milrinon) - diese steigern [cAMP], das aktiviert Proteinkinasen und Ca++-Kanäle - dadurch steigt der Ca++-Einstrom in der Plateauphase und die Ca++-Freisetzung aus dem sarkoplasmatischen Retikulum (positiv inotroper Effekt).
Die Herztätigkeit kann über ß1-adrenerge
Einflüsse angeregt werden, z.B. durch Isoprenalin, Dopamin oder
Dobutamin (Beta-Agonisten). Ähnliche Effekte können auch unter Umgehung
der Rezeptoren erzielt werden, z.B. durch Breitband- (wie Theophyllin
oder Koffein) oder spezifische Phosphodiesterasehemmer (wie der PDE3-Hemmer Milrinon) - diese steigern [cAMP], das aktiviert Proteinkinasen und Ca++-Kanäle - dadurch steigt der Ca++-Einstrom in der Plateauphase und die Ca++-Freisetzung aus dem sarkoplasmatischen Retikulum (positiv inotroper Effekt).
Angiotensin II
erhöht über AT1-Rezeptoren sowohl an zentralen Neuronen als auch an
sympathischen Ganglien die sympathische Aktivität, sowie die
Freisetzung von Noradrenalin in der Peripherie an den Varikositäten (Neuromodulation).
Der Angiotensinspiegel steigt bei körperlicher Belastung; der positiv
inotrope Angiotensineffekt auf das Herz geht zu einem beträchtlichen
auf die neuromodulatorische Wirkung (Sympathikus) zurück, Angiotensin
wirkt aber auch direkt verstärkend auf den Ca++-Einstrom in die Herzmuskelzelle.
Herz und Parasympathikus

s. auch
dort
Der parasympathische dorsale Vaguskern und nucleus ambiguus senden mit dem Vagusnerven lange
präganglionäre Fasern bis zum Herzen und wirken hier vor allem bremsend
auf das Reizleitungssystem (rechter Vagus vorwiegend auf Sinusknoten,
linker auf AV-Knoten, Abbildung oben). Diese Wirkungen erfolgen via M2-Rezeptoren, d.h. sie hemmen die Adenylatzyklase, öffnen über βγ-Untereinheiten von Gi-Protein KG (KACh) -Kaliumkanäle
und hyperpolarisieren so die Herzmuskelzellen ( Abbildung). Das
Membranpotential
rückt näher an den Betrag des Kalium-Gleichgewichtspotentials von -94
mV, d.h. die Zelle wird hyperpolarisiert, die Spontanentlagungsfrequenz
des Sinusknotens (oder einer anderen Schrittmacherregion) nimmt ab.
Abbildung). Das
Membranpotential
rückt näher an den Betrag des Kalium-Gleichgewichtspotentials von -94
mV, d.h. die Zelle wird hyperpolarisiert, die Spontanentlagungsfrequenz
des Sinusknotens (oder einer anderen Schrittmacherregion) nimmt ab.
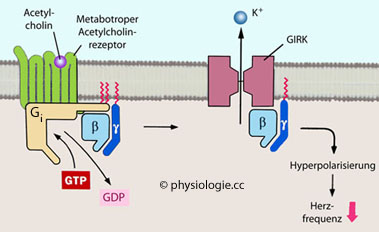
 Abbildung: Wie Acetylcholin die Herzfrequenz senkt
Abbildung: Wie Acetylcholin die Herzfrequenz senkt
Nach einer Vorlage in Liqun Luo, Principles of Neurobiology, 2nd ed. CRC Press 2021
Bindet Acetylcholin an einen metabotropen Acetylcholinrezeptor, dissoziiert der Gβγ- vom Gi-Anteil
("i" steht für inhibierend), lagert sich an Kaliumkanäle (GIRK) und
steigert deren Öffnungswahrscheinlichkeit. Der resultierende
Kaliumausstrom erhöht den Betrag des Membranpotentials und senkt
dadurch die Herzfrequenz (negativ chronotroper Effekt)

Diese
Umstellung erfolgt sehr rasch, was erklärt, wieso es zu
respiratorischer Sinusarrhythmie (exspiratorische Frequenzabnahme),
plötzlicher Bradykardie beim Tauchen oder bei vasovagaler Synkope, und
sogar zu Herzstillstand bei übermäßiger vegetativer Reizung (Bolustod)
kommen kann.
Muskarinerge Rezeptoren
finden sich in großer Zahl in den Vorhöfen (Sinusknoten, AV-Knoten),
aber kaum in den Ventrikeln.
Die Ruhefrequenz von ~60/min
(bei hohem körperlichem Trainingsgrad wegen des erhöhten parasympathischen Tonus niedriger, bis etwa 30/min: training bradycardia) ist Vagustonus-bedingt - die Spontanfrequenz eines isolierten
Sinusknotens bzw. eines denervierten Herzens liegt bei ~100/min
(Reduktion des Vaguseinflusses erhöht sofort die Herzfrequenz).
Hochtrainierte Sportler zeigen auch eine rasche Erholung (Reduktion)
der Pulsfrequenz nach körperlicher Belastung, ebenfalls durch erhöhten
Vagustonus erklärbar. Acetylcholin senkt vor allem das Tempo der
spontanen Depolarisation (ein langanhaltender Effekt, der auch bei
relativ geringer Acetylcholineinwirkung bestehen bleibt).

 Abbildung: Wirkung parasympathischer Stimulation auf das Schrittmacherpotential
Abbildung: Wirkung parasympathischer Stimulation auf das Schrittmacherpotential
Nach Bolter CP, Wallace DJ, Hirst GDS. Failure of Ba2+ and Cs+ to block the effects of vagal nerve stimulation in sinoatrial node cells of the guinea-pig heart. Autonom Neurosci 2001; 94: 93-101
Bradykardie
setzt sofort nach Einsetzen der erhöhten
Sympathikusaktivität ein (Zeitmarke: 1 Sekunde). Die orange gefärbten Linien deuten die Abnahme der Anstiegssteilheit des Schrittmacherpotentials an.
Zusammen mit
der Verflachung des Schrittmacherpotentials verlängert die
Hyperpolarisierung (Pfeil) die Zeit bis zum Erreichen des
Schwellenpotentials, was die Herzfrequenz reduziert.
Die Effekte
veränderten parasympatischen Einflusses auf die Herzfrequenz erfolgen
(im Gegensatz zu solchen der sympathischen Aktivität) ohne Verzögerung und ermöglichen damit rasche chronotrope Anpassung, z.B. im Rahmen respiratorischer Arrhythmie (Verlangsamung der Herzfrequenz während der Ausatmung).
Beendigung der Vagusreizung führt zu sofortigem Anstieg der Frequenz durch raschan Abbau des Acetylcholins im synaptischen Raum

Rascher Blutdruckanstieg bewirkt über den Barorezeptorreflex
eine Aktivierung parasympathischer Efferenzen zum Sinusknoten, was Herzfrequenz und
arteriellen Druck sofort senken kann.
Akute
Zunahme des (zentralen) Blutdrucks führt reflektorisch zu erhöhter
Freisetzung von Acetylcholin aus efferenten (parasympathischen) Fasern
des Vagusnerven, die zum Herzen ziehen
|
Der frequenzsenkende Effekt des Acetylcholins beruht auf einer Förderung des Kaliumausstroms aus der Herzmuskelzelle; dadurch wird die Wirkung der HCN-Kanäle (Begünstigung von Na+-Einstrom) reduziert und die Spontandepolarisation der Schrittmacherzellen verlangsamt.
Acetylcholin fördert den K+-Ausstrom
und senkt die Geschwindigkeit der spontanen Depolarisation von
Schrittmacherzellen (negativ chronotroper Effekt). Werden muskarische
Rezeptoren am Herzen blockiert (z.B. durch Atropin), steigt die
Herzfrequenz
|

 Abbildung: Nucleus tractus solitarii und zentrale Kreislaufsteuerung
Abbildung: Nucleus tractus solitarii und zentrale Kreislaufsteuerung
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 1st ed. Saunders 2003
Afferenzen
von Mechanorezeptoren in Carotissinus und Aortenbogen
(Hochdruckrezeptoren) sowie dem Herzen senden an den nucleus tractus
solitarii druckproportionale
Aktionspotentialfrequenzen (PD-Fühler). Von hier gelangen Steuerimpulse
an kardioinhibitorische und vasomotorische Neuronengruppen.
Die Efferenzen sind -
bei Druckabfall - sympathisch (Herzanregung, Vasokonstriktion,
Adrenalinausschüttung aus der Nebenniere) oder - bei Druckerhöhung -
parasympathisch (sinkende Pulsfrequenz)

Über das
Vasomotorenzentrum s.
dort
Barorezeptoren in der Wand des Karotissinus und des
Aortenbogens sind - wie die meisten Sinnesrezeptoren - PD-Fühler, d.h. sie antworten nicht nur entsprechend dem
Betrag des Reizes (proportional), sondern sprechen auch auf dessen Änderung an (differentiell). Sie
reagieren auf Dehnung der Gefäßwand (infolge arterieller
Drucksteigerung) mit erhöhter
Aktionspotenzialfrequenz.
Die Afferenz zum Kreislaufzentrum im
Hirnstamm ( Abbildung)
Abbildung)
 nucleus tractus solitarii: Afferenz von Barorezeptoren, Efferenz zu nucl. ambiguus und ventrolaterale medulla;
nucleus tractus solitarii: Afferenz von Barorezeptoren, Efferenz zu nucl. ambiguus und ventrolaterale medulla;
 nucleus ambiguus: Afferenz von nucl. tractus solitarii, Efferenz zu N. vagus;
nucleus ambiguus: Afferenz von nucl. tractus solitarii, Efferenz zu N. vagus;
 ventrolaterale medulla: Efferenz zu Sympathikus
ventrolaterale medulla: Efferenz zu Sympathikus
läuft über den
IX. (von Carotisrezeptoren) und X. Hirnnerven (von Aortenrezeptoren).
Da der arterielle
hydrostatische Indifferenzpunkt etwa auf Höhe des Aortenbogens liegt,
reagiert vor allem der Karotissinus auf Lageänderung des Körpers (liegend <=> aufrecht).
Vasodilatation führt zu stärkerer
Füllung der Kapazitätsgefäße und damit Druckentlastung in den Vorhöfen.
Die Kontraktilität
des Herzmuskels wird durch parasympathische Fasern nur schwach
beeinflusst, eine maximale Parasympathikusaktivität kann jedoch die Schlagkraft der Ventrikel um
bis zu 38% reduzieren. Parasympathische Fasern hemmen die Aktivität
sympathischer
Efferenzen; das gilt auch vice versa (cross-inhibition).
Herzqualitäten: Wie man die kardiale Funktion beurteilt
Man unterscheidet folgende Kriterien zur Beurteilung der Herzfunktion ("Herzqualitäten") -  vgl. dort:
vgl. dort:
 Inotropie
Inotropie  : Einfluss auf die Schlagkraft ("herzstärkende" inotrope Wirkung). Mit zunehmender systolischer Ca++-Freisetzung aus dem sarkoplasmatischen Retikulum (SR) steigt die Zahl engagierter Myosin-Querbrücken und damit die Kontraktionskraft der Kardiomyozyten.
: Einfluss auf die Schlagkraft ("herzstärkende" inotrope Wirkung). Mit zunehmender systolischer Ca++-Freisetzung aus dem sarkoplasmatischen Retikulum (SR) steigt die Zahl engagierter Myosin-Querbrücken und damit die Kontraktionskraft der Kardiomyozyten.
Zur Beurteilung der Inotropie wird die maximale Druckanstiegsgeschwindigkeit im Ventrikel (pd/dtmax) herangezogen. Diese kann mittels Herzkatheteruntersuchung festgestellt werden.
Ca++-Einstrom durch L-Kanäle (transversale Tubuli) regt den Ca++-Strom aus dem sarkoplasmatischen Retikulum in das Sarkoplasma via Ryanodinrezeptoren (calcium release channels) an (trigger Ca++). Anschließend wird Ca++ aus dem Sarkoplasma in das SR zurückbefördert (SERCA: Sarcoplasmic / endoplasmic reticulum calcium ATPase).
Steigender Calciumeinstrom in das SR über mehrere Herzschläge (vermehrter Affinität der SERCA-Calciumpumpe) erhöht den Calciumspeicher des sarkoplasmatischen Retikulums und wirkt so positiv inotrop.
Positiv inotrop wirken Katecholamine, negativ inotrop ("herzschwächend") u.a. Sauerstoffmangel und Azidose.

Zu inotropen Auswirkungen auf
ventrikuläre Druck-Volumen-Kurven s.
dort
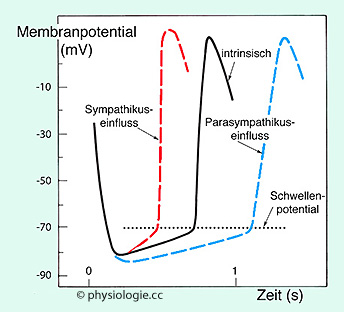

Abbildung: Autonom-nervöse Beeinflussung des Sinusknotenpotentialverlaufs
Nach einer Vorlage bei Mohrman DE / Heller LJ, Cardiovascular Physiology, 8th ed. McGraw Hill 2014
Das Vegetativum beeinflusst die Herzfrequenz (Chronotropie):
 Sympathische Wirkung
(rot) erhöht die Depolarisationsgeschwindigkeit des Schrittmacherpotentials, das Schwellenpotential wird früher erreicht, die Herzfrequenz steigt (z.B. bei körperlicher Belastung);
Sympathische Wirkung
(rot) erhöht die Depolarisationsgeschwindigkeit des Schrittmacherpotentials, das Schwellenpotential wird früher erreicht, die Herzfrequenz steigt (z.B. bei körperlicher Belastung);
 parasympathischer Einfluss (blau) verflacht hingegen das Schrittmacherpotential und erhöht zusätzlich das Ruhepotential (hyperpolarisierender Effekt), von dem
aus die Depolarisation beginnt; das Schwellenpotential wird später erreicht, die Herzfrequenz sinkt (Ruhepuls).
parasympathischer Einfluss (blau) verflacht hingegen das Schrittmacherpotential und erhöht zusätzlich das Ruhepotential (hyperpolarisierender Effekt), von dem
aus die Depolarisation beginnt; das Schwellenpotential wird später erreicht, die Herzfrequenz sinkt (Ruhepuls).
Dadurch erreicht das
Membranpotential das Schwellenpotential unter Einwirkung von
Noradrenalin früher, unter Einwirkung von Acetylcholin später als im
intrinsischen Zustand ohne autonom-nervösem Einfluss (schwarz, autonome Frequenz etwa 100/min)
 Positiv inotrop
Positiv inotrop wirkende Substanzen
steigern die sarkoplasmatische (intrazelluläre) Konzentration freier Calciumionen ([Ca
++]
i)
- durch Öffnung von Calciumkanälen, Hemmung des Na/Ca-Austausches
(NCX), oder der Calciumpumpen, alles in der Außenmembran der
Herzmuskelzelle (Sarkolemm). Dies erfolgt durch
 ß1-adrenerge
ß1-adrenerge Wirkung,
 Herzglykoside
Herzglykoside,
 Frequenzinotropie
Frequenzinotropie,

Absinken des extrazellulären Natriumspiegels (verringert den Na-Gradienten für den
Na/Ca-Austausch),

Erhöhung des Serum-Calciumspiegels ([Ca
++]
o) - verstärkt das Einströmen durch
L-Typ-Calciumkanäle und verringert den Ca-Gradienten für den Na/Ca-Austausch.
Negativ inotrop wirken Stoffe, die den [Ca
++]
i senken:

Calciumkanalblocker hemmen L-Typ-Calciumkanäle,

erniedrigter extrazellulärer Calciumspiegel reduziert den Gradienten für den Calciumeinstrom,

erhöhter Natriumspiegel verstärkt den Na-Gradienten für den Na/Ca-Austausch.
 Die Abhängigkeit der Schlagkraft von der Herzfrequenz wird als Frequenzinotropie bezeichnet ("Bowditch-sche Herztreppe";
Die Abhängigkeit der Schlagkraft von der Herzfrequenz wird als Frequenzinotropie bezeichnet ("Bowditch-sche Herztreppe";  Anreicherung von Ca++ in den Myozyten durch transiente Überforderung des Rücktransportes erhöht wahrscheinlich die Kontraktion).
Anreicherung von Ca++ in den Myozyten durch transiente Überforderung des Rücktransportes erhöht wahrscheinlich die Kontraktion).
 Chronotropie
Chronotropie  : Einfluss auf die Steilheit der spontanen Depolarisierung, also des Schrittmacherpotentials (
: Einfluss auf die Steilheit der spontanen Depolarisierung, also des Schrittmacherpotentials ( Abbildung) - Beurteilung über die Schlagfrequenz (chronotrope Wirkung).
Chronotrope Wirkung haben Einflüsse auf (
Abbildung) - Beurteilung über die Schlagfrequenz (chronotrope Wirkung).
Chronotrope Wirkung haben Einflüsse auf ( vgl. dort):
vgl. dort):
 Kaliumausstrom (iKv) - vermehrte Deaktivierung der Kaliumkanäle steigert Depolarisierungstempo und Herzfrequenz
Kaliumausstrom (iKv) - vermehrte Deaktivierung der Kaliumkanäle steigert Depolarisierungstempo und Herzfrequenz
 "Funny"-Natriumeinstrom (if) - wie die beiden folgenden senkt er das Membranpotential und steigert die Herzfrequenz
"Funny"-Natriumeinstrom (if) - wie die beiden folgenden senkt er das Membranpotential und steigert die Herzfrequenz
 Calciumeinstrom (iCa-L)
Calciumeinstrom (iCa-L)
 Natriumeinstrom über 3Na/Ca-Austauscher (iNa-Ca).
Natriumeinstrom über 3Na/Ca-Austauscher (iNa-Ca).
Steigende Schlagfrequenz senkt, abnehmende steigert den diastolischen Zeitanteil am Herzzyklus (Ruhe: Systolen-
/ Diastolendauer 1:2), um bei Tachykardien über ~160/min eine
ineffektive Ventrikelfüllung, sinkende Auswurffraktion, reduziertes
Herzminutenvolumen zu bedingen; im Extremfall kann Bewusstlosigkeit auftreten ( s. oben).
s. oben).
 Tachykardie
Tachykardie ist eine erhöhte,
Bradykardie
eine erniedrigte Herzfrequenz. Die Ruhefrequenz einer erwachsenen
Person beträgt zwischen 60 und 80 bpm, im Liegen ist sie niedriger als
im Stehen (
orthostatische Belastung, reflektorische Anregung des Sinusknotenrhythmus).
 Abbildung), bedingt durch ß-Rezeptor-bedingte Verstärkung des Ca++-Einstroms.
Dazu kommen weitere Effekte auf Ionenkanäle (verstärkter
Natriumeinstrom durch if-Kanäle, verstärkte Inaktivierung
spannungsgesteuerter Kaliumkanäle).
Die
Dauer der Plateauphase des Aktionspotentials hängt von der Herzfrequenz
ab: Je höher letztere ist, desto kürzer dauert das Plateau, im EKG nimmt die Dauer der QT-Zeit ab.
Abbildung), bedingt durch ß-Rezeptor-bedingte Verstärkung des Ca++-Einstroms.
Dazu kommen weitere Effekte auf Ionenkanäle (verstärkter
Natriumeinstrom durch if-Kanäle, verstärkte Inaktivierung
spannungsgesteuerter Kaliumkanäle).
Die
Dauer der Plateauphase des Aktionspotentials hängt von der Herzfrequenz
ab: Je höher letztere ist, desto kürzer dauert das Plateau, im EKG nimmt die Dauer der QT-Zeit ab.
 Dromotropie
Dromotropie  : Einfluss auf die Erregungsleitungsgeschwindigkeit
(vor allem im AV-Knoten) - Beurteilung über das EKG (Länge des PR-Intervalls). Reizung von ß1-Rezeptoren im AV-Knoten beschleuningt die atrio-ventrikuläre Überleitung (positiv dromotroper Effekt).
: Einfluss auf die Erregungsleitungsgeschwindigkeit
(vor allem im AV-Knoten) - Beurteilung über das EKG (Länge des PR-Intervalls). Reizung von ß1-Rezeptoren im AV-Knoten beschleuningt die atrio-ventrikuläre Überleitung (positiv dromotroper Effekt).
 Bathmotropie
Bathmotropie  : Einfluss auf die Erregbarkeit (bathmotrope
Wirkung) - eine Veränderung des Schwellenpotentials wirkt sich
bathmotrop aus: Je höher der Potentialbetrag (Hyperpolarisierung),
desto länger dauert es bis zum Erreichen des Schwellenpotentials.
: Einfluss auf die Erregbarkeit (bathmotrope
Wirkung) - eine Veränderung des Schwellenpotentials wirkt sich
bathmotrop aus: Je höher der Potentialbetrag (Hyperpolarisierung),
desto länger dauert es bis zum Erreichen des Schwellenpotentials.
 Lusitropie
Lusitropie  (Genaueres s. dort): Wirkungen auf die diastolische Relaxation nennt man lusitrop
(Zeit von Kontraktionsmaximum bis Erreichen der vollständigen
Erschlaffung). Der lusitrope Effekt beruht vor allem (85%) auf der Wirkung
von Phospholamban auf die Steuerung der Ca++-Aufnahme
in das sarkoplasmatische Retikulum durch SERCA (15% gehen auf das Konto
von Troponin I). Das heißt, er wird vor allem durch raschere Aufnahme
von Ca++-Ionen aus dem Sarkoplasma in das sarkoplasmatische Retikulum bewirkt - durch die SERCA des Netzwerk-SR. Der lusitrope Effekt erhöht die Zeit für die diastolische Füllung der Ventrikel.
(Genaueres s. dort): Wirkungen auf die diastolische Relaxation nennt man lusitrop
(Zeit von Kontraktionsmaximum bis Erreichen der vollständigen
Erschlaffung). Der lusitrope Effekt beruht vor allem (85%) auf der Wirkung
von Phospholamban auf die Steuerung der Ca++-Aufnahme
in das sarkoplasmatische Retikulum durch SERCA (15% gehen auf das Konto
von Troponin I). Das heißt, er wird vor allem durch raschere Aufnahme
von Ca++-Ionen aus dem Sarkoplasma in das sarkoplasmatische Retikulum bewirkt - durch die SERCA des Netzwerk-SR. Der lusitrope Effekt erhöht die Zeit für die diastolische Füllung der Ventrikel.
Das autonome Nervensystem beeinflusst die Herzqualitäten:
 Der
(noradrenerge) Sympathikus (ß1-Adrenozeptoren) fördernd ("positiv"), z.B. steigen
Schlagkraft und Herzfrequenz, die Förderleistung des Herzens nimmt zu
Der
(noradrenerge) Sympathikus (ß1-Adrenozeptoren) fördernd ("positiv"), z.B. steigen
Schlagkraft und Herzfrequenz, die Förderleistung des Herzens nimmt zu
 Der (cholinerge) Parasympathikus
(Vagus - muskarinische M2-Rezeptoren) dämpfend ("negativ") - er stellt das Herz auf "Schongang".
Der (cholinerge) Parasympathikus
(Vagus - muskarinische M2-Rezeptoren) dämpfend ("negativ") - er stellt das Herz auf "Schongang".
Blockade muskarinischer Rezeptoren führt zu Tachykardie
|

 Abbildung: Autonom-nervöse Einflüsse auf eine kardiale Schrittmacherzelle
Abbildung: Autonom-nervöse Einflüsse auf eine kardiale Schrittmacherzelle
Modifiziert nach einer Vorlage in Herring / Paterson, Levick's Introduction to Cardiovascular Physiology, 6th ed. 2018
Oben: ß1-Rezeptoren (noradrenerg) aktivieren Gs-Proteine
und Adenylylcyclase, [cAMP] nimmt zu. Erhöhter Schrittmacherstrom durch if-Kanäle
depolarisiert die Zelle unmittelbar, über Proteinkinase A werden Ca++-Einstrom (iCa-L) und Repolarisierung (iKv) angeregt. Der Ca++-Pumpenhemmer Phospholamban wird inaktiviert, Ca++ zügig in das sarkoplasmatische Retikulum evakuiert, der Herzmuskel entspannt rascher (lusitroper Effekt).
Propranolol ist ein ß1-Blocker, Caesiumionen (Cs+) hemmen den if-Natriumkanal, Verapamil den L-Typ Calciumkanal.
Unten: M2-Rezeptoren (cholinerg, kardialer Subtyp) aktivieren Gi-Proteine, deren abdissoziierte ßγ-Untereinheit aktiviert Kaliumkanäle (inward rectifier KACh channel), die Zelle wird in Richtung K-Gleichgewichtspotential hyperpolarisiert.
Gleichzeitig reduziert die α-Untereinheit die Aktivität der Adenylylcyclase (hier nicht gezeigt), damit sinkt die
Öffnungswahrscheinlichkeit der if- und iCa-L-Kanäle (Natrium- und Calciumeinstrom), was das Schrittmacherpotential abflacht (vgl.  Abbildung oben)
Abbildung oben)

 Der Sympathikus (T1-4) lässt den
Sauerstoffverbrauch stärker ansteigen als die Herzarbeit, d.h. er erhöht zwar die Auswurfleistung, reduziert jedoch dabei die Effizienz der Herztätigkeit.
Das limitiert
die Nützlichkeit von ß-Agonisten zur Schockbekämpfung: gesteigerter
Sympathikustonus - wie er bei Myokardinfarkt auftritt - hebt den
Sauerstoffbedarf des (verletzten!) Gewebes an.
Der Sympathikus (T1-4) lässt den
Sauerstoffverbrauch stärker ansteigen als die Herzarbeit, d.h. er erhöht zwar die Auswurfleistung, reduziert jedoch dabei die Effizienz der Herztätigkeit.
Das limitiert
die Nützlichkeit von ß-Agonisten zur Schockbekämpfung: gesteigerter
Sympathikustonus - wie er bei Myokardinfarkt auftritt - hebt den
Sauerstoffbedarf des (verletzten!) Gewebes an.
Katecholamine binden an ß1-Rezeptoren ( Abbildung), diese
Abbildung), diese
 aktivieren die Adenylylcyclase (cAMP) und Proteinkinase A. Das öffnet L-Typ-Ca++-Kanäle und dies verstärkt den Calciumeinstrom aus dem Interstitium.
aktivieren die Adenylylcyclase (cAMP) und Proteinkinase A. Das öffnet L-Typ-Ca++-Kanäle und dies verstärkt den Calciumeinstrom aus dem Interstitium.
 Weiters wird SERCA-2a (eine Ca++-ATPase)
in der Membran des sarkoplasmatischen Retikulums aktiviert; dadurch
wird Calcium schneller aus dem Sarkoplasma zurückgepumpt, die Faser
erschlafft schneller und die nächste Kontraktion wird durch erhöhte Calciumfreisetzung intensiviert.
Weiters wird SERCA-2a (eine Ca++-ATPase)
in der Membran des sarkoplasmatischen Retikulums aktiviert; dadurch
wird Calcium schneller aus dem Sarkoplasma zurückgepumpt, die Faser
erschlafft schneller und die nächste Kontraktion wird durch erhöhte Calciumfreisetzung intensiviert.
Beides steigert die Kontraktionskraft des Myokards (positiv inotroper Effekt).
Katecholamine
bewirken verbesserte Verfügbarkeit von Calciumionen und damit einen
positiv inotropen (kontraktionsstärkenden) Effekt
|
Die
ventrikuläre Funktionskurve (Schlagarbeit als Funktion des
enddiastolischen Drucks) wird unter Sympathikuseinfluss bzw.
Katecholaminwirkung
steiler. Alle sympathischen Wirkungen auf das Herz werden über
ß1-Rezeptoren (und damit über gesteigertes zelluläres
cAMP) vermittelt. Der Sympathikus hat "positive" Wirkung auf die Herzqualitäten (chrono-, dromo-, ino-, lusitrop).
Sympathische Effekte beginnen verzögert und halten länger an.
 Parasympathische Einflüsse (nucl. dorsalis der medulla oblongata > N. vagus) werden über muskarinische M2-Rezeptoren
vermittelt (
Parasympathische Einflüsse (nucl. dorsalis der medulla oblongata > N. vagus) werden über muskarinische M2-Rezeptoren
vermittelt ( Abbildung), die reichlich an den Vorhöfen und am Reizleitungssystem
vorkommen, kaum im Ventrikel. Die α-Untereinheiten reduzieren die Aktivität der Adenylylcyclase und senken die Konzentration an cAMP, damit sinkt die
Öffnungswahrscheinlichkeit der if- und iCa-L-Kanäle (Natrium- und Calciumeinstrom), was das Schrittmacherpotential abflacht. Die ßγ-Untereinheiten aktivieren Kaliumkanäle (inward rectifier KACh channel), die Zelle wird in Richtung K-Gleichgewichtspotential hyperpolarisiert.
Abbildung), die reichlich an den Vorhöfen und am Reizleitungssystem
vorkommen, kaum im Ventrikel. Die α-Untereinheiten reduzieren die Aktivität der Adenylylcyclase und senken die Konzentration an cAMP, damit sinkt die
Öffnungswahrscheinlichkeit der if- und iCa-L-Kanäle (Natrium- und Calciumeinstrom), was das Schrittmacherpotential abflacht. Die ßγ-Untereinheiten aktivieren Kaliumkanäle (inward rectifier KACh channel), die Zelle wird in Richtung K-Gleichgewichtspotential hyperpolarisiert.
Die Ruhefrequenz hochtrainierter Menschen ist wegen ihres erhöhten
Vagustonus herabgesetzt (Bradykardie: "Sportlerherz"). Hauptgrund ist
die Verflachung des Schrittmacherpotentials, die Hyperpolarisierung hat
einen geringeren Anteil am Bradykardieeffekt.
Parasympathische Effekte treten prompt auf und verschwinden mit dem raschen
Abbau von Acetylcholin auch sehr schnell. "Respiratorische Arrhythmie"
(Sinusarrhythmie - Abnahme der Herzfrequenz bei Ausatmung) ist durch
Oszillationen des Vagustonus (nicht des Sympathikustonus) erklärbar.
Vagal bewirkte Bradykardie ist auch Bestandteil des Tauchreflexes. Bei einer vasovagalen Synkope ist es der hohe Vagustonus, der den Herzschlag aussetzen lässt.
Intensive Parasympathikuswirkung kann Dysrhythmien, Überleitungsblock
oder Herzstillstand (Beispiel Bolustod: Herzstillstand durch
Übererregung im Rachenbereich und extreme Parasympathikusstimulation)
zur Folge haben.
Interagierende Einflüsse auf die Herztätigkeit
Sympathische
und parasympathische Faktoren beeinflussen einander wechselseitig -
teils auf präsynaptischer, teils auf postsynaptischer Ebene. Dazu kommt
die Wirkung von Cofaktoren, wie Angiotensin, VIP, NPY, oder
natriuretische Peptide.
 Sympathische
Varikositäten setzen neben Katecholaminen auch die (längerlebigen)
Faktoren Neuropeptid Y (NPY) und Galanin frei und hemmen die
Transmitterfreisetzung an parasympathischen Endigungen - insbesondere
bei hoher Belastung des Herzmuskels.
Sympathische
Varikositäten setzen neben Katecholaminen auch die (längerlebigen)
Faktoren Neuropeptid Y (NPY) und Galanin frei und hemmen die
Transmitterfreisetzung an parasympathischen Endigungen - insbesondere
bei hoher Belastung des Herzmuskels.
 Parasympathische
Nervenfasern setzen neben Acetylcholin auch VIP und endogene Opioide
frei, die physiologische Bedeutung dieses Mechanismus ist unklar.
Parasympathische
Nervenfasern setzen neben Acetylcholin auch VIP und endogene Opioide
frei, die physiologische Bedeutung dieses Mechanismus ist unklar.

 Abbildung: Duale Innervation des Herzens und wichtigste Mechanismen der Informationsübertragung
Nach Gourine AV, Ackland GL. Cardiac Vagus and Exercise. Physiology 2019; 34: 71-80
Abbildung: Duale Innervation des Herzens und wichtigste Mechanismen der Informationsübertragung
Nach Gourine AV, Ackland GL. Cardiac Vagus and Exercise. Physiology 2019; 34: 71-80
Autonom-nervöse
Faserverzweigungen wirken direkt auf die Herzmuskelzelle (beta-adrenerg
und M2-cholinerg). Noradrenalin fördert, Acetylcholin hemmt - über G-Proteine - die Wirkung der Adenylylcyclase und damit die Bildung des second messenger cAMP.
Darüber hinaus wirken die Transmitter präsynaptisch (alpha-adrenerg
und M2-cholinerg) wechselseitig hemmend aufeinander ein (reziproke Inhibition).
Die Wirkungsweise von Stickstoffmonoxid (NO) in Bezug auf Mechanismen zur Modulierung der Expression von G-Protein-gekoppelter Rezeptorkinase (GRK2) und Arrestin (ß-arr) wird gegenwärtig untersucht
AC, Adenylylcyclase; sGC, lösliche Guanylatzyklase
 Präsynaptische Interaktionen:
Wie an zahlreichen anderen Stellen im Körper, dämpfen einander auch am
Herzen entgegengesetzte Regelungseffekte wechselseitig. Das verhindert
überschießende Reaktionen und stabilisiert das Systemverhalten (“accentuated antagonism”).
Diese reziproke Inhibition
spielt sich zwischen sympathischen und parasympathischen Fasern auf
präsynaptischer Ebene ab (
Präsynaptische Interaktionen:
Wie an zahlreichen anderen Stellen im Körper, dämpfen einander auch am
Herzen entgegengesetzte Regelungseffekte wechselseitig. Das verhindert
überschießende Reaktionen und stabilisiert das Systemverhalten (“accentuated antagonism”).
Diese reziproke Inhibition
spielt sich zwischen sympathischen und parasympathischen Fasern auf
präsynaptischer Ebene ab ( Abbildung). Noradrenalin (aus
sympathischen Fasern) hemmt über α2-Adrenozeptoren parasympathische
Neuronen, und Acetylcholin (aus parasympathischen Fasern) über
muskarinerge Rezeptoren sympathische Nervenzellen - beides knapp vor
der Herzmuskelzelle.
Autorezeptorvermittelte Selbsthemmung:
Darüber hinaus inhibieren in den Extrazellulärraum freigesetzte
Transmitter ihre eigene weitere Freisetzung: Noradrenalin über
präsynaptische α2-, und Acetylcholin über präsynaptische M-Rezeptoren.
Auch dadurch wird einem überschießenden Systemverhalten vorgebeugt.
Abbildung). Noradrenalin (aus
sympathischen Fasern) hemmt über α2-Adrenozeptoren parasympathische
Neuronen, und Acetylcholin (aus parasympathischen Fasern) über
muskarinerge Rezeptoren sympathische Nervenzellen - beides knapp vor
der Herzmuskelzelle.
Autorezeptorvermittelte Selbsthemmung:
Darüber hinaus inhibieren in den Extrazellulärraum freigesetzte
Transmitter ihre eigene weitere Freisetzung: Noradrenalin über
präsynaptische α2-, und Acetylcholin über präsynaptische M-Rezeptoren.
Auch dadurch wird einem überschießenden Systemverhalten vorgebeugt.
Das Herzminutenvolumen steigt proportional mit dem zentralen Blutvolumen. Das effektive / zentrale Blutvolumen
(als funktionelle Füllungsreserve für das rechte bzw. linke Herz)
beeinflusst die Herzleistung über die Kombination mehrerer
physiologischer Mechanismen bzw. Reflexe (Abbildung):

 Abbildung: Einfluss des (effektiven bzw. zentralen) Blutvolumens auf das Herzzeitvolumen
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 1st ed. Saunders 2003
Abbildung: Einfluss des (effektiven bzw. zentralen) Blutvolumens auf das Herzzeitvolumen
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 1st ed. Saunders 2003
Ordinate:
% Abweichung vom Kontrollwert bei nominellem Blutvolumen (=Null).
Das Herzminutenvolumen nimmt mit dem (effektiven) Blutvolumen stetig zu
- bei niedrigen Füllungsvolumina durch Steigerung des Schlagvolumens
(Starling-Mechanismus), die sich stärker auswirkt als der Effekt des
Barorezeptorreflexes auf die Herzfrequenz; bei höheren durch Ansteigen
der Herzfrequenz (Bainbridge-Reflex)

Die  Abbildung zeigt den Effekt des effektiven (zentral
verfügbaren) Blutvolumens auf Herzfrequenz (f) und Schlagvolumen (SV) - und damit
auf das Herzminutenvolumen (f
Abbildung zeigt den Effekt des effektiven (zentral
verfügbaren) Blutvolumens auf Herzfrequenz (f) und Schlagvolumen (SV) - und damit
auf das Herzminutenvolumen (f x
SV). Dabei zeigt sich, dass die Mechanismen je
nach Größe des zentralen Blutvolumens unterschiedlich stark in den Vordergrund
treten:
 Niedriger
Volumenbereich (blaue Felder, links): Bei sinkendem zentralem
Blutvolumen nimmt die Herzfrequenz wegen des Baroreflexes zu, das
Schlagvolumen wegen des Starling-Mechanismus
ab.
Niedriger
Volumenbereich (blaue Felder, links): Bei sinkendem zentralem
Blutvolumen nimmt die Herzfrequenz wegen des Baroreflexes zu, das
Schlagvolumen wegen des Starling-Mechanismus
ab.
Der Baroreflex verstärkt den Effekt des Starling-Mechanismus noch,
indem er die Vorlast des Herzens durch Tachykardie weiter senkt. Der
Wirkungsbereich des Starling-Mechanismus konzentriert sich auf niedrige
Füllungswerte des Ventrikels.
 Hoher
Volumenbereich (gelbe Felder, rechts): Bei zunehmendem
Herzminutenvolumen supprimiert der Baroreflex eine weitere Stärkung
durch den Starling-Mechanismus und kompensiert
dessen Effekt - die Schlagvolumenskurve verflacht (blau). Das
Schlagvolumen nimmt mit zunehmender Hypovolämie ab, von Hypervolämie
bleibt es unbeeinflusst.
Hoher
Volumenbereich (gelbe Felder, rechts): Bei zunehmendem
Herzminutenvolumen supprimiert der Baroreflex eine weitere Stärkung
durch den Starling-Mechanismus und kompensiert
dessen Effekt - die Schlagvolumenskurve verflacht (blau). Das
Schlagvolumen nimmt mit zunehmender Hypovolämie ab, von Hypervolämie
bleibt es unbeeinflusst.
Andererseits steigert der Bainbridge-Reflex die Herzfrequenz mit zunehmender kardialer Blutfüllung. Das bedeutet:
 Die Herzfrequenz ist am niedrigsten bei einem normalen Betrag des effektiven Blutvolumens.
Die Herzfrequenz ist am niedrigsten bei einem normalen Betrag des effektiven Blutvolumens.
Sowohl Hypovolämie als auch Hypervolämie steigert die Herzfrequenz (bedingt durch den Barorezeptor- bzw. Bainbridge-Reflex).
Ergebnis dieser drei Mechanismen (Barorezeptorreflex,
Starling-Mechanismus, Bainbridgereflex): Das Herzminutenvolumen (rote
Kurve) nimmt mit dem zentralen Blutvolumen stetig zu. Man sieht, das
dies nicht auf einen Mechanismus alleine, sondern auf das Zusammenwirken mehrerer Mechanismen zurückzuführen ist.
Baroreflex, Bainbridge-Reflex und Starling-Mechanismus sind nur drei
von zahlreichen weiteren Einflüssen auf die autonome Herztätigkeit.
Dazu zählen Vorlast und Nachlast, die wiederum
abhängen von Faktoren wie Blutvolumen, Gefäßcompliances, und
Strömungswiderstandswerten ( s. dort).
s. dort).
Diese Faktoren sind ihrerseits beeinflussbar durch den Blutspiegel vasoaktiver Stoffe - wie Angiotensin, Vasopressin, Adrenalin, oder lokalen Mediatoren (z.B. NO, Endothelin).
Weiters wirken Aldosteron und natriuretische Peptide
auf den Elektrolythaushalt und damit einerseits auf
Flüssigkeitsvolumina (Kochsalz ... extrazelluläres Volumen),
andererseits auf Membranpotentiale und -erregbarkeit (Natrium: Einstrom erzeugt Aktionspotential;
Kalium: Ausstrom erzeugt Ruhepotential; Calcium: Einstrom depolarisiert die Zelle, wirkt als second messenger sowie unmittelbar anregend, z.B. auf Kontraktion, Sekretion).
 Der Starling-Mechanismus
hat physiologischerweise kaum Bedeutung für die Anpassung der
Herzleistung an die Bedürfnisse des Kreislaufs (insbesondere bei
Muskelarbeit, bei der das Herzzeitvolumen bis zu etwa 5-fach ansteigen
kann) - der Anstieg des Sympathikustonus erhöht die Pumpleistung bei
praktisch unverändertem diastolischem Füllungsdruck. Anders ist das bei
Menschen, die ein transplantiertes Herz
haben (das über keine Nervenversorgung mehr verfügt) - hier ist keine
sympathisch-noradrenerge positiv inotrope Wirkung mehr möglich, und der
Starling-Mechanismus erhält eine wichtige Rolle für die Anpassung der
Herzleistung (über gesteigerten diastolischen Füllungsdruck, der sich
aus dem erhöhten venösen Rückstrom ergibt).
Der Starling-Mechanismus
hat physiologischerweise kaum Bedeutung für die Anpassung der
Herzleistung an die Bedürfnisse des Kreislaufs (insbesondere bei
Muskelarbeit, bei der das Herzzeitvolumen bis zu etwa 5-fach ansteigen
kann) - der Anstieg des Sympathikustonus erhöht die Pumpleistung bei
praktisch unverändertem diastolischem Füllungsdruck. Anders ist das bei
Menschen, die ein transplantiertes Herz
haben (das über keine Nervenversorgung mehr verfügt) - hier ist keine
sympathisch-noradrenerge positiv inotrope Wirkung mehr möglich, und der
Starling-Mechanismus erhält eine wichtige Rolle für die Anpassung der
Herzleistung (über gesteigerten diastolischen Füllungsdruck, der sich
aus dem erhöhten venösen Rückstrom ergibt).

  Der nucleus tractus solitarii erhält Afferenzen von Barorezeptoren (Carotissinus, Aortenbogen, Herz) und projiziert auf den nucl. ambiguus (Efferenzen zu Vaguskernen) und die ventrolaterale medulla (Efferenzen zum Sympathikus). Sympathische
Fasern (T1-T4) innervieren alle Teile des Herzens, ihre Aktivität
steigt bei Orthostase, Stress, Muskelarbeit, Blutverlust. Sie erhöhen
intrazelluläre [Ca++] und damit den Prozentsatz aktivierter
Myosin-Querbrücken (erhöhte Kontraktilität, verringertes Restvolumen);
die Aktivität der SERCA-Pumpe nimmt durch Inaktivierung von
Phospholamban zu (verkürzte Systolendauer); der Ventrikeldurchmesser
nimmt sowohl systolisch als auch diastolisch ab. Sympathische Effekte beginnen verzögert und halten länger an. Sympathische
Varikositäten setzen Katecholamine, Neuropeptid Y und Galanin frei und hemmen die
Transmitterfreisetzung parasympathischer Endigungen Der nucleus tractus solitarii erhält Afferenzen von Barorezeptoren (Carotissinus, Aortenbogen, Herz) und projiziert auf den nucl. ambiguus (Efferenzen zu Vaguskernen) und die ventrolaterale medulla (Efferenzen zum Sympathikus). Sympathische
Fasern (T1-T4) innervieren alle Teile des Herzens, ihre Aktivität
steigt bei Orthostase, Stress, Muskelarbeit, Blutverlust. Sie erhöhen
intrazelluläre [Ca++] und damit den Prozentsatz aktivierter
Myosin-Querbrücken (erhöhte Kontraktilität, verringertes Restvolumen);
die Aktivität der SERCA-Pumpe nimmt durch Inaktivierung von
Phospholamban zu (verkürzte Systolendauer); der Ventrikeldurchmesser
nimmt sowohl systolisch als auch diastolisch ab. Sympathische Effekte beginnen verzögert und halten länger an. Sympathische
Varikositäten setzen Katecholamine, Neuropeptid Y und Galanin frei und hemmen die
Transmitterfreisetzung parasympathischer Endigungen
 Der
parasympathische dorsale Vaguskern wirkt bremsend auf das
Reizleitungssystem (rechter Vagus: Sinusknoten, linker: AV-Knoten) und
senkt die Herzfrequenz (Ruhefrequenz ~60/min: Spontanfrequenz des Sinusknotens ~100/min). Parasympathikusaktivität
senkt auch die Schlagkraft der Ventrikel. Vasodilatation
führt zu stärkerer Füllung der Kapazitätsgefäße und damit
Druckentlastung der Vorhöfe. Parasympathische
Effekte treten prompt auf und verschwinden auch rasch (Sinusarrhythmie durch Oszillationen des Vagustonus). Hochtrainierte Menschen haben in Ruhe einen erhöhten Vagustonus und sind bradykard ("Sportlerherz"). Parasympathische Nervenfasern setzen neben Acetylcholin auch VIP und endogene Opioide frei Der
parasympathische dorsale Vaguskern wirkt bremsend auf das
Reizleitungssystem (rechter Vagus: Sinusknoten, linker: AV-Knoten) und
senkt die Herzfrequenz (Ruhefrequenz ~60/min: Spontanfrequenz des Sinusknotens ~100/min). Parasympathikusaktivität
senkt auch die Schlagkraft der Ventrikel. Vasodilatation
führt zu stärkerer Füllung der Kapazitätsgefäße und damit
Druckentlastung der Vorhöfe. Parasympathische
Effekte treten prompt auf und verschwinden auch rasch (Sinusarrhythmie durch Oszillationen des Vagustonus). Hochtrainierte Menschen haben in Ruhe einen erhöhten Vagustonus und sind bradykard ("Sportlerherz"). Parasympathische Nervenfasern setzen neben Acetylcholin auch VIP und endogene Opioide frei
 Kriterien zur Beurteilung der Herzfunktion ("Herzqualitäten") sind die Inotropie (Schlagkraft: mit dem Ca++-Einstrom
steigt die Zahl aktivierter Myosin-Querbrücken) - Beurteilung über den
maximalen Druckanstieg im Ventrikel (pd/dtmax); Chronotropie (Herzfrequenz: Steilheit des Schrittmacherpotentials); Dromotropie (Geschwindigkeit der Erregungsleitung, vor allem im AV-Knoten) - Beurteilung über Länge des PR-Intervalls im EKG); Bathmotropie (Erregbarkeit - über Veränderung des Schwellenpotentials); Lusitropie (diastolische Relaxation - Steuerung der Ca++-Aufnahme in das sarkoplasmatische Retikulum über Phospholamban). Die Herzqualitäten werden sympathisch (via ß1-Adrenozeptoren) positiv, parasympathisch (via M2-Rezeptoren) negativ beeinflusst (vermindert). - Frequenzinotropie ist die Abhängigkeit der Schlagkraft von der Herzfrequenz ("Bowditch- Herztreppe": Anreicherung von Ca++) Kriterien zur Beurteilung der Herzfunktion ("Herzqualitäten") sind die Inotropie (Schlagkraft: mit dem Ca++-Einstrom
steigt die Zahl aktivierter Myosin-Querbrücken) - Beurteilung über den
maximalen Druckanstieg im Ventrikel (pd/dtmax); Chronotropie (Herzfrequenz: Steilheit des Schrittmacherpotentials); Dromotropie (Geschwindigkeit der Erregungsleitung, vor allem im AV-Knoten) - Beurteilung über Länge des PR-Intervalls im EKG); Bathmotropie (Erregbarkeit - über Veränderung des Schwellenpotentials); Lusitropie (diastolische Relaxation - Steuerung der Ca++-Aufnahme in das sarkoplasmatische Retikulum über Phospholamban). Die Herzqualitäten werden sympathisch (via ß1-Adrenozeptoren) positiv, parasympathisch (via M2-Rezeptoren) negativ beeinflusst (vermindert). - Frequenzinotropie ist die Abhängigkeit der Schlagkraft von der Herzfrequenz ("Bowditch- Herztreppe": Anreicherung von Ca++)
 Das zentrale
Blutvolumen beeinflusst die Herzleistung über die Kombination mehrerer
Mechanismen / Reflexe: Das Herzminutenvolumen nimmt mit dem effektiven
Blutvolumen zu (Starling-Mechanismus); bei höheren
Volumina durch Ansteigen der Herzfrequenz (Bainbridge-Reflex). Der Baroreflex
verstärkt den Effekt des Starling-Mechanismus, indem er die Vorlast des
Herzens durch Tachykardie weiter senkt. Im Ergebnis nimmt das Herzminutenvolumen mit dem
zentralen Blutvolumen stetig zu Das zentrale
Blutvolumen beeinflusst die Herzleistung über die Kombination mehrerer
Mechanismen / Reflexe: Das Herzminutenvolumen nimmt mit dem effektiven
Blutvolumen zu (Starling-Mechanismus); bei höheren
Volumina durch Ansteigen der Herzfrequenz (Bainbridge-Reflex). Der Baroreflex
verstärkt den Effekt des Starling-Mechanismus, indem er die Vorlast des
Herzens durch Tachykardie weiter senkt. Im Ergebnis nimmt das Herzminutenvolumen mit dem
zentralen Blutvolumen stetig zu
|

 Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.
Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein. 




 Einflüsse
auf die Herztätigkeit
Einflüsse
auf die Herztätigkeit
 bathmotrop: βαϑμός = Schwelle (der Erregbarkeit), τρόπος = Richtung, Wendung
bathmotrop: βαϑμός = Schwelle (der Erregbarkeit), τρόπος = Richtung, Wendung Sympathikus
Sympathikus  Parasympathikus
Parasympathikus  Herzqualitäten und Schrittmacherpotential
Herzqualitäten und Schrittmacherpotential  Reziproke Interaktion und Selbsthemmung
Reziproke Interaktion und Selbsthemmung  Interaktion Barorezeptorreflex,
Starling-Mechanismus, Bainbridge-Reflex
Interaktion Barorezeptorreflex,
Starling-Mechanismus, Bainbridge-Reflex



 Abbildung: Autonom-nervöse Beeinflussung der Herztätigkeit
Abbildung: Autonom-nervöse Beeinflussung der Herztätigkeit
 Die Vorlast wurde früher als 'vis a tergo', also die Kraft von hinten - d.h. aus dem Niederdrucksystem (Venenraum) - bezeichnet. Die Nachlast nannte man 'vis a fronte', also die Kraft von vorne, d.h. aus dem Hochdrucksystem (Aorten- bzw. arteriellen Raum).
Die Vorlast wurde früher als 'vis a tergo', also die Kraft von hinten - d.h. aus dem Niederdrucksystem (Venenraum) - bezeichnet. Die Nachlast nannte man 'vis a fronte', also die Kraft von vorne, d.h. aus dem Hochdrucksystem (Aorten- bzw. arteriellen Raum). Das autonome Nervensystem steuert Kreislaufreflexe zur Anpassung der Herzleistung bei: Ändert sich der arterielle Druck, wird er durch den Barorezeptorreflex (kurzzeitig) stabilisiert:
Blutdruckerhöhung steigert den parasympathischen (Vagus → Herz) und
senkt den sympathischen Einfluss, Herzzeitvolumen und Gefäßtonus
nehmen ab (Vasodilatation), der Blutdruck sinkt. Bei Blutdruckabfall
funktioniert der Reflex umgekehrt (negative Rückkopplung zur
Stabilisierung der Regelgröße Blutdruck).
Das autonome Nervensystem steuert Kreislaufreflexe zur Anpassung der Herzleistung bei: Ändert sich der arterielle Druck, wird er durch den Barorezeptorreflex (kurzzeitig) stabilisiert:
Blutdruckerhöhung steigert den parasympathischen (Vagus → Herz) und
senkt den sympathischen Einfluss, Herzzeitvolumen und Gefäßtonus
nehmen ab (Vasodilatation), der Blutdruck sinkt. Bei Blutdruckabfall
funktioniert der Reflex umgekehrt (negative Rückkopplung zur
Stabilisierung der Regelgröße Blutdruck).
 Weiters wirken Hormone auf das Herz ein: So
bewirkt Adrenalin eine Umverteilung des Herzzeitvolumens zur Muskulatur, auf
Kosten von Eingeweiden und Haut. Das Herz wird angeregt, Herzfrequenz
und Herzzeitvolumen nehmen zu. Natriuretische Peptide bewirken eine Reduktion des effektiven Blutvolumens und damit eine
Entlastung der Druckprofile im Kreislauf; das Herz reguliert auf diese
Weise auf endokrinem Weg seine Vorlast, was vor allem bei Überdehnung
der Herzräume erfolgt.
Weiters wirken Hormone auf das Herz ein: So
bewirkt Adrenalin eine Umverteilung des Herzzeitvolumens zur Muskulatur, auf
Kosten von Eingeweiden und Haut. Das Herz wird angeregt, Herzfrequenz
und Herzzeitvolumen nehmen zu. Natriuretische Peptide bewirken eine Reduktion des effektiven Blutvolumens und damit eine
Entlastung der Druckprofile im Kreislauf; das Herz reguliert auf diese
Weise auf endokrinem Weg seine Vorlast, was vor allem bei Überdehnung
der Herzräume erfolgt.
 Abbildung: Nervöse Versorgung des Herzens
Abbildung: Nervöse Versorgung des Herzens
 Erhöhte Schlagkraft (positive Inotropie) lässt den ventrikulären Druck stärker und rascher (dp/dtmax) ansteigen
Erhöhte Schlagkraft (positive Inotropie) lässt den ventrikulären Druck stärker und rascher (dp/dtmax) ansteigen Das Schlagvolumen nimmt (ceteris paribus) zu, die Auswurffraktion (ejection fraction) kann bis um ~65%
ansteigen, folglich nimmt das diastolische Volumen ab. Die Zunahme der
Kontraktilität reduziert das Ventrikelvolumen (diastolisch und
systolisch)
Das Schlagvolumen nimmt (ceteris paribus) zu, die Auswurffraktion (ejection fraction) kann bis um ~65%
ansteigen, folglich nimmt das diastolische Volumen ab. Die Zunahme der
Kontraktilität reduziert das Ventrikelvolumen (diastolisch und
systolisch) Die Pulsfrequenz steigt (positive Chronotropie), die Dauer der diastolischen Füllungszeit nimmt ab
Die Pulsfrequenz steigt (positive Chronotropie), die Dauer der diastolischen Füllungszeit nimmt ab Die Refraktärzeit nimmt ab (vermehrte Neigung zu ektopischen Herzschlägen)
Die Refraktärzeit nimmt ab (vermehrte Neigung zu ektopischen Herzschlägen) Der Quotient zwischen Sauerstoffbedarf und Herzarbeit wird geringer.
Der Quotient zwischen Sauerstoffbedarf und Herzarbeit wird geringer. Abbildung oben). Die wesentlich längeren postsynaptischen
Fasern erreichen das Herz über große Gefäße. Sie innervieren alle Teile
des Herzens. Schrittmachergewebe wird vor allem von rechtsseitigen, die
Ventrikel vor allem durch linksseitige Fasern versorgt. Die für den Herzmuskel charakteristischen ß1-Rezeptoren kommen an Kardiomyozyten des Menschen 4-mal häufiger von als ß2-Rezeptoren.
Abbildung oben). Die wesentlich längeren postsynaptischen
Fasern erreichen das Herz über große Gefäße. Sie innervieren alle Teile
des Herzens. Schrittmachergewebe wird vor allem von rechtsseitigen, die
Ventrikel vor allem durch linksseitige Fasern versorgt. Die für den Herzmuskel charakteristischen ß1-Rezeptoren kommen an Kardiomyozyten des Menschen 4-mal häufiger von als ß2-Rezeptoren.
 Abbildung: Effekt sympathischer Reizung auf eine ventrikuläre Herzmuskelzelle
Abbildung: Effekt sympathischer Reizung auf eine ventrikuläre Herzmuskelzelle
 Abbildung zeigt
positiv chronotrope, inotrope und lusitrope Effekte sympathischer
Reizung sowie die Verkürzung des Aktionspotentials der Kardiomyozyten.
Die starke Verkürzung der Diastolendauer kann bei hoher Herzfrequenz die diastolischen Füllung der Ventrikel reduzieren: Überschreitet die Herzfrequenz einen Betrag von ~160/min, kann die Auswurffraktion abnehmen, und ein nunmehr sinkendes
Herzminutenvolumen kann zu Hypotonie, zerebrale Unterdurchblutung und Kreislaufkollaps führen.
Abbildung zeigt
positiv chronotrope, inotrope und lusitrope Effekte sympathischer
Reizung sowie die Verkürzung des Aktionspotentials der Kardiomyozyten.
Die starke Verkürzung der Diastolendauer kann bei hoher Herzfrequenz die diastolischen Füllung der Ventrikel reduzieren: Überschreitet die Herzfrequenz einen Betrag von ~160/min, kann die Auswurffraktion abnehmen, und ein nunmehr sinkendes
Herzminutenvolumen kann zu Hypotonie, zerebrale Unterdurchblutung und Kreislaufkollaps führen.
 Abbildung: Wie Noradrenalin die Herzfrequenz steigert
Abbildung: Wie Noradrenalin die Herzfrequenz steigert
 Abbildung). Das wirkt sich auf die oben genannten
Eigenschaften aus, auch beschleunigt es die Zurückbeförderung von Ca++ in das sarkoplasmatische Retikulum über SERCA.
Abbildung). Das wirkt sich auf die oben genannten
Eigenschaften aus, auch beschleunigt es die Zurückbeförderung von Ca++ in das sarkoplasmatische Retikulum über SERCA.
 Abbildung: Wirkung sympathischer Stimulation auf das Schrittmacherpotential
Abbildung: Wirkung sympathischer Stimulation auf das Schrittmacherpotential
 Die Herztätigkeit kann über ß1-adrenerge
Einflüsse angeregt werden, z.B. durch Isoprenalin, Dopamin oder
Dobutamin (Beta-Agonisten). Ähnliche Effekte können auch unter Umgehung
der Rezeptoren erzielt werden, z.B. durch Breitband- (wie Theophyllin
oder Koffein) oder spezifische Phosphodiesterasehemmer (wie der PDE3-Hemmer Milrinon) - diese steigern [cAMP], das aktiviert Proteinkinasen und Ca++-Kanäle - dadurch steigt der Ca++-Einstrom in der Plateauphase und die Ca++-Freisetzung aus dem sarkoplasmatischen Retikulum (positiv inotroper Effekt).
Die Herztätigkeit kann über ß1-adrenerge
Einflüsse angeregt werden, z.B. durch Isoprenalin, Dopamin oder
Dobutamin (Beta-Agonisten). Ähnliche Effekte können auch unter Umgehung
der Rezeptoren erzielt werden, z.B. durch Breitband- (wie Theophyllin
oder Koffein) oder spezifische Phosphodiesterasehemmer (wie der PDE3-Hemmer Milrinon) - diese steigern [cAMP], das aktiviert Proteinkinasen und Ca++-Kanäle - dadurch steigt der Ca++-Einstrom in der Plateauphase und die Ca++-Freisetzung aus dem sarkoplasmatischen Retikulum (positiv inotroper Effekt). s. auch dort
s. auch dort Abbildung). Das
Membranpotential
rückt näher an den Betrag des Kalium-Gleichgewichtspotentials von -94
mV, d.h. die Zelle wird hyperpolarisiert, die Spontanentlagungsfrequenz
des Sinusknotens (oder einer anderen Schrittmacherregion) nimmt ab.
Abbildung). Das
Membranpotential
rückt näher an den Betrag des Kalium-Gleichgewichtspotentials von -94
mV, d.h. die Zelle wird hyperpolarisiert, die Spontanentlagungsfrequenz
des Sinusknotens (oder einer anderen Schrittmacherregion) nimmt ab.
 Abbildung: Wie Acetylcholin die Herzfrequenz senkt
Abbildung: Wie Acetylcholin die Herzfrequenz senkt

 Abbildung: Wirkung parasympathischer Stimulation auf das Schrittmacherpotential
Abbildung: Wirkung parasympathischer Stimulation auf das Schrittmacherpotential

 Abbildung: Nucleus tractus solitarii und zentrale Kreislaufsteuerung
Abbildung: Nucleus tractus solitarii und zentrale Kreislaufsteuerung Über das Vasomotorenzentrum s. dort
Über das Vasomotorenzentrum s. dort Abbildung)
Abbildung) nucleus tractus solitarii: Afferenz von Barorezeptoren, Efferenz zu nucl. ambiguus und ventrolaterale medulla;
nucleus tractus solitarii: Afferenz von Barorezeptoren, Efferenz zu nucl. ambiguus und ventrolaterale medulla;  nucleus ambiguus: Afferenz von nucl. tractus solitarii, Efferenz zu N. vagus;
nucleus ambiguus: Afferenz von nucl. tractus solitarii, Efferenz zu N. vagus;  ventrolaterale medulla: Efferenz zu Sympathikus
ventrolaterale medulla: Efferenz zu Sympathikus vgl. dort:
vgl. dort:  : Einfluss auf die Schlagkraft ("herzstärkende" inotrope Wirkung). Mit zunehmender systolischer Ca++-Freisetzung aus dem sarkoplasmatischen Retikulum (SR) steigt die Zahl engagierter Myosin-Querbrücken und damit die Kontraktionskraft der Kardiomyozyten.
: Einfluss auf die Schlagkraft ("herzstärkende" inotrope Wirkung). Mit zunehmender systolischer Ca++-Freisetzung aus dem sarkoplasmatischen Retikulum (SR) steigt die Zahl engagierter Myosin-Querbrücken und damit die Kontraktionskraft der Kardiomyozyten. 
 Abbildung: Autonom-nervöse Beeinflussung des Sinusknotenpotentialverlaufs
Abbildung: Autonom-nervöse Beeinflussung des Sinusknotenpotentialverlaufs Sympathische Wirkung
(rot) erhöht die Depolarisationsgeschwindigkeit des Schrittmacherpotentials, das Schwellenpotential wird früher erreicht, die Herzfrequenz steigt (z.B. bei körperlicher Belastung);
Sympathische Wirkung
(rot) erhöht die Depolarisationsgeschwindigkeit des Schrittmacherpotentials, das Schwellenpotential wird früher erreicht, die Herzfrequenz steigt (z.B. bei körperlicher Belastung); parasympathischer Einfluss (blau) verflacht hingegen das Schrittmacherpotential und erhöht zusätzlich das Ruhepotential (hyperpolarisierender Effekt), von dem
aus die Depolarisation beginnt; das Schwellenpotential wird später erreicht, die Herzfrequenz sinkt (Ruhepuls).
parasympathischer Einfluss (blau) verflacht hingegen das Schrittmacherpotential und erhöht zusätzlich das Ruhepotential (hyperpolarisierender Effekt), von dem
aus die Depolarisation beginnt; das Schwellenpotential wird später erreicht, die Herzfrequenz sinkt (Ruhepuls).
 ß1-adrenerge Wirkung,
ß1-adrenerge Wirkung,  Herzglykoside,
Herzglykoside, Frequenzinotropie,
Frequenzinotropie,  Absinken des extrazellulären Natriumspiegels (verringert den Na-Gradienten für den Na/Ca-Austausch),
Absinken des extrazellulären Natriumspiegels (verringert den Na-Gradienten für den Na/Ca-Austausch), Erhöhung des Serum-Calciumspiegels ([Ca++]o) - verstärkt das Einströmen durch L-Typ-Calciumkanäle und verringert den Ca-Gradienten für den Na/Ca-Austausch.
Erhöhung des Serum-Calciumspiegels ([Ca++]o) - verstärkt das Einströmen durch L-Typ-Calciumkanäle und verringert den Ca-Gradienten für den Na/Ca-Austausch. Calciumkanalblocker hemmen L-Typ-Calciumkanäle,
Calciumkanalblocker hemmen L-Typ-Calciumkanäle,  erniedrigter extrazellulärer Calciumspiegel reduziert den Gradienten für den Calciumeinstrom,
erniedrigter extrazellulärer Calciumspiegel reduziert den Gradienten für den Calciumeinstrom, erhöhter Natriumspiegel verstärkt den Na-Gradienten für den Na/Ca-Austausch.
erhöhter Natriumspiegel verstärkt den Na-Gradienten für den Na/Ca-Austausch.  Die Abhängigkeit der Schlagkraft von der Herzfrequenz wird als Frequenzinotropie bezeichnet ("Bowditch-sche Herztreppe";
Die Abhängigkeit der Schlagkraft von der Herzfrequenz wird als Frequenzinotropie bezeichnet ("Bowditch-sche Herztreppe";  Anreicherung von Ca++ in den Myozyten durch transiente Überforderung des Rücktransportes erhöht wahrscheinlich die Kontraktion).
Anreicherung von Ca++ in den Myozyten durch transiente Überforderung des Rücktransportes erhöht wahrscheinlich die Kontraktion). : Einfluss auf die Steilheit der spontanen Depolarisierung, also des Schrittmacherpotentials (
: Einfluss auf die Steilheit der spontanen Depolarisierung, also des Schrittmacherpotentials ( Abbildung) - Beurteilung über die Schlagfrequenz (chronotrope Wirkung).
Chronotrope Wirkung haben Einflüsse auf (
Abbildung) - Beurteilung über die Schlagfrequenz (chronotrope Wirkung).
Chronotrope Wirkung haben Einflüsse auf ( vgl. dort):
vgl. dort): Kaliumausstrom (iKv) - vermehrte Deaktivierung der Kaliumkanäle steigert Depolarisierungstempo und Herzfrequenz
Kaliumausstrom (iKv) - vermehrte Deaktivierung der Kaliumkanäle steigert Depolarisierungstempo und Herzfrequenz "Funny"-Natriumeinstrom (if) - wie die beiden folgenden senkt er das Membranpotential und steigert die Herzfrequenz
"Funny"-Natriumeinstrom (if) - wie die beiden folgenden senkt er das Membranpotential und steigert die Herzfrequenz Calciumeinstrom (iCa-L)
Calciumeinstrom (iCa-L) Natriumeinstrom über 3Na/Ca-Austauscher (iNa-Ca).
Natriumeinstrom über 3Na/Ca-Austauscher (iNa-Ca). s. oben).
s. oben). Tachykardie ist eine erhöhte, Bradykardie
eine erniedrigte Herzfrequenz. Die Ruhefrequenz einer erwachsenen
Person beträgt zwischen 60 und 80 bpm, im Liegen ist sie niedriger als
im Stehen (orthostatische Belastung, reflektorische Anregung des Sinusknotenrhythmus).
Tachykardie ist eine erhöhte, Bradykardie
eine erniedrigte Herzfrequenz. Die Ruhefrequenz einer erwachsenen
Person beträgt zwischen 60 und 80 bpm, im Liegen ist sie niedriger als
im Stehen (orthostatische Belastung, reflektorische Anregung des Sinusknotenrhythmus). Abbildung), bedingt durch ß-Rezeptor-bedingte Verstärkung des Ca++-Einstroms.
Dazu kommen weitere Effekte auf Ionenkanäle (verstärkter
Natriumeinstrom durch if-Kanäle, verstärkte Inaktivierung
spannungsgesteuerter Kaliumkanäle).
Abbildung), bedingt durch ß-Rezeptor-bedingte Verstärkung des Ca++-Einstroms.
Dazu kommen weitere Effekte auf Ionenkanäle (verstärkter
Natriumeinstrom durch if-Kanäle, verstärkte Inaktivierung
spannungsgesteuerter Kaliumkanäle). : Einfluss auf die Erregungsleitungsgeschwindigkeit
(vor allem im AV-Knoten) - Beurteilung über das EKG (Länge des PR-Intervalls). Reizung von ß1-Rezeptoren im AV-Knoten beschleuningt die atrio-ventrikuläre Überleitung (positiv dromotroper Effekt).
: Einfluss auf die Erregungsleitungsgeschwindigkeit
(vor allem im AV-Knoten) - Beurteilung über das EKG (Länge des PR-Intervalls). Reizung von ß1-Rezeptoren im AV-Knoten beschleuningt die atrio-ventrikuläre Überleitung (positiv dromotroper Effekt). : Einfluss auf die Erregbarkeit (bathmotrope
Wirkung) - eine Veränderung des Schwellenpotentials wirkt sich
bathmotrop aus: Je höher der Potentialbetrag (Hyperpolarisierung),
desto länger dauert es bis zum Erreichen des Schwellenpotentials.
: Einfluss auf die Erregbarkeit (bathmotrope
Wirkung) - eine Veränderung des Schwellenpotentials wirkt sich
bathmotrop aus: Je höher der Potentialbetrag (Hyperpolarisierung),
desto länger dauert es bis zum Erreichen des Schwellenpotentials. (Genaueres s. dort): Wirkungen auf die diastolische Relaxation nennt man lusitrop
(Zeit von Kontraktionsmaximum bis Erreichen der vollständigen
Erschlaffung). Der lusitrope Effekt beruht vor allem (85%) auf der Wirkung
von Phospholamban auf die Steuerung der Ca++-Aufnahme
in das sarkoplasmatische Retikulum durch SERCA (15% gehen auf das Konto
von Troponin I). Das heißt, er wird vor allem durch raschere Aufnahme
von Ca++-Ionen aus dem Sarkoplasma in das sarkoplasmatische Retikulum bewirkt - durch die SERCA des Netzwerk-SR. Der lusitrope Effekt erhöht die Zeit für die diastolische Füllung der Ventrikel.
(Genaueres s. dort): Wirkungen auf die diastolische Relaxation nennt man lusitrop
(Zeit von Kontraktionsmaximum bis Erreichen der vollständigen
Erschlaffung). Der lusitrope Effekt beruht vor allem (85%) auf der Wirkung
von Phospholamban auf die Steuerung der Ca++-Aufnahme
in das sarkoplasmatische Retikulum durch SERCA (15% gehen auf das Konto
von Troponin I). Das heißt, er wird vor allem durch raschere Aufnahme
von Ca++-Ionen aus dem Sarkoplasma in das sarkoplasmatische Retikulum bewirkt - durch die SERCA des Netzwerk-SR. Der lusitrope Effekt erhöht die Zeit für die diastolische Füllung der Ventrikel. Der
(noradrenerge) Sympathikus (ß1-Adrenozeptoren) fördernd ("positiv"), z.B. steigen
Schlagkraft und Herzfrequenz, die Förderleistung des Herzens nimmt zu
Der
(noradrenerge) Sympathikus (ß1-Adrenozeptoren) fördernd ("positiv"), z.B. steigen
Schlagkraft und Herzfrequenz, die Förderleistung des Herzens nimmt zu Der (cholinerge) Parasympathikus
(Vagus - muskarinische M2-Rezeptoren) dämpfend ("negativ") - er stellt das Herz auf "Schongang".
Der (cholinerge) Parasympathikus
(Vagus - muskarinische M2-Rezeptoren) dämpfend ("negativ") - er stellt das Herz auf "Schongang".
 Abbildung: Autonom-nervöse Einflüsse auf eine kardiale Schrittmacherzelle
Abbildung: Autonom-nervöse Einflüsse auf eine kardiale Schrittmacherzelle Abbildung oben)
Abbildung oben)
 Der Sympathikus (T1-4) lässt den
Sauerstoffverbrauch stärker ansteigen als die Herzarbeit, d.h. er erhöht zwar die Auswurfleistung, reduziert jedoch dabei die Effizienz der Herztätigkeit.
Das limitiert
die Nützlichkeit von ß-Agonisten zur Schockbekämpfung: gesteigerter
Sympathikustonus - wie er bei Myokardinfarkt auftritt - hebt den
Sauerstoffbedarf des (verletzten!) Gewebes an.
Der Sympathikus (T1-4) lässt den
Sauerstoffverbrauch stärker ansteigen als die Herzarbeit, d.h. er erhöht zwar die Auswurfleistung, reduziert jedoch dabei die Effizienz der Herztätigkeit.
Das limitiert
die Nützlichkeit von ß-Agonisten zur Schockbekämpfung: gesteigerter
Sympathikustonus - wie er bei Myokardinfarkt auftritt - hebt den
Sauerstoffbedarf des (verletzten!) Gewebes an. Abbildung), diese
Abbildung), diese  aktivieren die Adenylylcyclase (cAMP) und Proteinkinase A. Das öffnet L-Typ-Ca++-Kanäle und dies verstärkt den Calciumeinstrom aus dem Interstitium.
aktivieren die Adenylylcyclase (cAMP) und Proteinkinase A. Das öffnet L-Typ-Ca++-Kanäle und dies verstärkt den Calciumeinstrom aus dem Interstitium. Weiters wird SERCA-2a (eine Ca++-ATPase)
in der Membran des sarkoplasmatischen Retikulums aktiviert; dadurch
wird Calcium schneller aus dem Sarkoplasma zurückgepumpt, die Faser
erschlafft schneller und die nächste Kontraktion wird durch erhöhte Calciumfreisetzung intensiviert.
Weiters wird SERCA-2a (eine Ca++-ATPase)
in der Membran des sarkoplasmatischen Retikulums aktiviert; dadurch
wird Calcium schneller aus dem Sarkoplasma zurückgepumpt, die Faser
erschlafft schneller und die nächste Kontraktion wird durch erhöhte Calciumfreisetzung intensiviert.  Parasympathische Einflüsse (nucl. dorsalis der medulla oblongata > N. vagus) werden über muskarinische M2-Rezeptoren
vermittelt (
Parasympathische Einflüsse (nucl. dorsalis der medulla oblongata > N. vagus) werden über muskarinische M2-Rezeptoren
vermittelt ( Abbildung), die reichlich an den Vorhöfen und am Reizleitungssystem
vorkommen, kaum im Ventrikel. Die α-Untereinheiten reduzieren die Aktivität der Adenylylcyclase und senken die Konzentration an cAMP, damit sinkt die
Öffnungswahrscheinlichkeit der if- und iCa-L-Kanäle (Natrium- und Calciumeinstrom), was das Schrittmacherpotential abflacht. Die ßγ-Untereinheiten aktivieren Kaliumkanäle (inward rectifier KACh channel), die Zelle wird in Richtung K-Gleichgewichtspotential hyperpolarisiert.
Abbildung), die reichlich an den Vorhöfen und am Reizleitungssystem
vorkommen, kaum im Ventrikel. Die α-Untereinheiten reduzieren die Aktivität der Adenylylcyclase und senken die Konzentration an cAMP, damit sinkt die
Öffnungswahrscheinlichkeit der if- und iCa-L-Kanäle (Natrium- und Calciumeinstrom), was das Schrittmacherpotential abflacht. Die ßγ-Untereinheiten aktivieren Kaliumkanäle (inward rectifier KACh channel), die Zelle wird in Richtung K-Gleichgewichtspotential hyperpolarisiert. Sympathische
Varikositäten setzen neben Katecholaminen auch die (längerlebigen)
Faktoren Neuropeptid Y (NPY) und Galanin frei und hemmen die
Transmitterfreisetzung an parasympathischen Endigungen - insbesondere
bei hoher Belastung des Herzmuskels.
Sympathische
Varikositäten setzen neben Katecholaminen auch die (längerlebigen)
Faktoren Neuropeptid Y (NPY) und Galanin frei und hemmen die
Transmitterfreisetzung an parasympathischen Endigungen - insbesondere
bei hoher Belastung des Herzmuskels.  Parasympathische
Nervenfasern setzen neben Acetylcholin auch VIP und endogene Opioide
frei, die physiologische Bedeutung dieses Mechanismus ist unklar.
Parasympathische
Nervenfasern setzen neben Acetylcholin auch VIP und endogene Opioide
frei, die physiologische Bedeutung dieses Mechanismus ist unklar. 
 Abbildung: Duale Innervation des Herzens und wichtigste Mechanismen der Informationsübertragung
Abbildung: Duale Innervation des Herzens und wichtigste Mechanismen der Informationsübertragung
 Abbildung). Noradrenalin (aus
sympathischen Fasern) hemmt über α2-Adrenozeptoren parasympathische
Neuronen, und Acetylcholin (aus parasympathischen Fasern) über
muskarinerge Rezeptoren sympathische Nervenzellen - beides knapp vor
der Herzmuskelzelle.
Abbildung). Noradrenalin (aus
sympathischen Fasern) hemmt über α2-Adrenozeptoren parasympathische
Neuronen, und Acetylcholin (aus parasympathischen Fasern) über
muskarinerge Rezeptoren sympathische Nervenzellen - beides knapp vor
der Herzmuskelzelle.
 Abbildung: Einfluss des (effektiven bzw. zentralen) Blutvolumens auf das Herzzeitvolumen
Abbildung: Einfluss des (effektiven bzw. zentralen) Blutvolumens auf das Herzzeitvolumen
 Abbildung zeigt den Effekt des effektiven (zentral
verfügbaren) Blutvolumens auf Herzfrequenz (f) und Schlagvolumen (SV) - und damit
auf das Herzminutenvolumen (f x SV). Dabei zeigt sich, dass die Mechanismen je
nach Größe des zentralen Blutvolumens unterschiedlich stark in den Vordergrund
treten:
Abbildung zeigt den Effekt des effektiven (zentral
verfügbaren) Blutvolumens auf Herzfrequenz (f) und Schlagvolumen (SV) - und damit
auf das Herzminutenvolumen (f x SV). Dabei zeigt sich, dass die Mechanismen je
nach Größe des zentralen Blutvolumens unterschiedlich stark in den Vordergrund
treten: Niedriger
Volumenbereich (blaue Felder, links): Bei sinkendem zentralem
Blutvolumen nimmt die Herzfrequenz wegen des Baroreflexes zu, das
Schlagvolumen wegen des Starling-Mechanismus
ab.
Niedriger
Volumenbereich (blaue Felder, links): Bei sinkendem zentralem
Blutvolumen nimmt die Herzfrequenz wegen des Baroreflexes zu, das
Schlagvolumen wegen des Starling-Mechanismus
ab.  Hoher
Volumenbereich (gelbe Felder, rechts): Bei zunehmendem
Herzminutenvolumen supprimiert der Baroreflex eine weitere Stärkung
durch den Starling-Mechanismus und kompensiert
dessen Effekt - die Schlagvolumenskurve verflacht (blau). Das
Schlagvolumen nimmt mit zunehmender Hypovolämie ab, von Hypervolämie
bleibt es unbeeinflusst.
Hoher
Volumenbereich (gelbe Felder, rechts): Bei zunehmendem
Herzminutenvolumen supprimiert der Baroreflex eine weitere Stärkung
durch den Starling-Mechanismus und kompensiert
dessen Effekt - die Schlagvolumenskurve verflacht (blau). Das
Schlagvolumen nimmt mit zunehmender Hypovolämie ab, von Hypervolämie
bleibt es unbeeinflusst. Die Herzfrequenz ist am niedrigsten bei einem normalen Betrag des effektiven Blutvolumens.
Die Herzfrequenz ist am niedrigsten bei einem normalen Betrag des effektiven Blutvolumens.  s. dort).
s. dort).  Der Starling-Mechanismus
hat physiologischerweise kaum Bedeutung für die Anpassung der
Herzleistung an die Bedürfnisse des Kreislaufs (insbesondere bei
Muskelarbeit, bei der das Herzzeitvolumen bis zu etwa 5-fach ansteigen
kann) - der Anstieg des Sympathikustonus erhöht die Pumpleistung bei
praktisch unverändertem diastolischem Füllungsdruck. Anders ist das bei
Menschen, die ein transplantiertes Herz
haben (das über keine Nervenversorgung mehr verfügt) - hier ist keine
sympathisch-noradrenerge positiv inotrope Wirkung mehr möglich, und der
Starling-Mechanismus erhält eine wichtige Rolle für die Anpassung der
Herzleistung (über gesteigerten diastolischen Füllungsdruck, der sich
aus dem erhöhten venösen Rückstrom ergibt).
Der Starling-Mechanismus
hat physiologischerweise kaum Bedeutung für die Anpassung der
Herzleistung an die Bedürfnisse des Kreislaufs (insbesondere bei
Muskelarbeit, bei der das Herzzeitvolumen bis zu etwa 5-fach ansteigen
kann) - der Anstieg des Sympathikustonus erhöht die Pumpleistung bei
praktisch unverändertem diastolischem Füllungsdruck. Anders ist das bei
Menschen, die ein transplantiertes Herz
haben (das über keine Nervenversorgung mehr verfügt) - hier ist keine
sympathisch-noradrenerge positiv inotrope Wirkung mehr möglich, und der
Starling-Mechanismus erhält eine wichtige Rolle für die Anpassung der
Herzleistung (über gesteigerten diastolischen Füllungsdruck, der sich
aus dem erhöhten venösen Rückstrom ergibt).
 Der nucleus tractus solitarii erhält Afferenzen von Barorezeptoren (Carotissinus, Aortenbogen, Herz) und projiziert auf den nucl. ambiguus (Efferenzen zu Vaguskernen) und die ventrolaterale medulla (Efferenzen zum Sympathikus). Sympathische
Fasern (T1-T4) innervieren alle Teile des Herzens, ihre Aktivität
steigt bei Orthostase, Stress, Muskelarbeit, Blutverlust. Sie erhöhen
intrazelluläre [Ca++] und damit den Prozentsatz aktivierter
Myosin-Querbrücken (erhöhte Kontraktilität, verringertes Restvolumen);
die Aktivität der SERCA-Pumpe nimmt durch Inaktivierung von
Phospholamban zu (verkürzte Systolendauer); der Ventrikeldurchmesser
nimmt sowohl systolisch als auch diastolisch ab. Sympathische Effekte beginnen verzögert und halten länger an. Sympathische
Varikositäten setzen Katecholamine, Neuropeptid Y und Galanin frei und hemmen die
Transmitterfreisetzung parasympathischer Endigungen
Der nucleus tractus solitarii erhält Afferenzen von Barorezeptoren (Carotissinus, Aortenbogen, Herz) und projiziert auf den nucl. ambiguus (Efferenzen zu Vaguskernen) und die ventrolaterale medulla (Efferenzen zum Sympathikus). Sympathische
Fasern (T1-T4) innervieren alle Teile des Herzens, ihre Aktivität
steigt bei Orthostase, Stress, Muskelarbeit, Blutverlust. Sie erhöhen
intrazelluläre [Ca++] und damit den Prozentsatz aktivierter
Myosin-Querbrücken (erhöhte Kontraktilität, verringertes Restvolumen);
die Aktivität der SERCA-Pumpe nimmt durch Inaktivierung von
Phospholamban zu (verkürzte Systolendauer); der Ventrikeldurchmesser
nimmt sowohl systolisch als auch diastolisch ab. Sympathische Effekte beginnen verzögert und halten länger an. Sympathische
Varikositäten setzen Katecholamine, Neuropeptid Y und Galanin frei und hemmen die
Transmitterfreisetzung parasympathischer Endigungen Der
parasympathische dorsale Vaguskern wirkt bremsend auf das
Reizleitungssystem (rechter Vagus: Sinusknoten, linker: AV-Knoten) und
senkt die Herzfrequenz (Ruhefrequenz ~60/min: Spontanfrequenz des Sinusknotens ~100/min). Parasympathikusaktivität
senkt auch die Schlagkraft der Ventrikel. Vasodilatation
führt zu stärkerer Füllung der Kapazitätsgefäße und damit
Druckentlastung der Vorhöfe. Parasympathische
Effekte treten prompt auf und verschwinden auch rasch (Sinusarrhythmie durch Oszillationen des Vagustonus). Hochtrainierte Menschen haben in Ruhe einen erhöhten Vagustonus und sind bradykard ("Sportlerherz"). Parasympathische Nervenfasern setzen neben Acetylcholin auch VIP und endogene Opioide frei
Der
parasympathische dorsale Vaguskern wirkt bremsend auf das
Reizleitungssystem (rechter Vagus: Sinusknoten, linker: AV-Knoten) und
senkt die Herzfrequenz (Ruhefrequenz ~60/min: Spontanfrequenz des Sinusknotens ~100/min). Parasympathikusaktivität
senkt auch die Schlagkraft der Ventrikel. Vasodilatation
führt zu stärkerer Füllung der Kapazitätsgefäße und damit
Druckentlastung der Vorhöfe. Parasympathische
Effekte treten prompt auf und verschwinden auch rasch (Sinusarrhythmie durch Oszillationen des Vagustonus). Hochtrainierte Menschen haben in Ruhe einen erhöhten Vagustonus und sind bradykard ("Sportlerherz"). Parasympathische Nervenfasern setzen neben Acetylcholin auch VIP und endogene Opioide frei Kriterien zur Beurteilung der Herzfunktion ("Herzqualitäten") sind die Inotropie (Schlagkraft: mit dem Ca++-Einstrom
steigt die Zahl aktivierter Myosin-Querbrücken) - Beurteilung über den
maximalen Druckanstieg im Ventrikel (pd/dtmax); Chronotropie (Herzfrequenz: Steilheit des Schrittmacherpotentials); Dromotropie (Geschwindigkeit der Erregungsleitung, vor allem im AV-Knoten) - Beurteilung über Länge des PR-Intervalls im EKG); Bathmotropie (Erregbarkeit - über Veränderung des Schwellenpotentials); Lusitropie (diastolische Relaxation - Steuerung der Ca++-Aufnahme in das sarkoplasmatische Retikulum über Phospholamban). Die Herzqualitäten werden sympathisch (via ß1-Adrenozeptoren) positiv, parasympathisch (via M2-Rezeptoren) negativ beeinflusst (vermindert). - Frequenzinotropie ist die Abhängigkeit der Schlagkraft von der Herzfrequenz ("Bowditch- Herztreppe": Anreicherung von Ca++)
Kriterien zur Beurteilung der Herzfunktion ("Herzqualitäten") sind die Inotropie (Schlagkraft: mit dem Ca++-Einstrom
steigt die Zahl aktivierter Myosin-Querbrücken) - Beurteilung über den
maximalen Druckanstieg im Ventrikel (pd/dtmax); Chronotropie (Herzfrequenz: Steilheit des Schrittmacherpotentials); Dromotropie (Geschwindigkeit der Erregungsleitung, vor allem im AV-Knoten) - Beurteilung über Länge des PR-Intervalls im EKG); Bathmotropie (Erregbarkeit - über Veränderung des Schwellenpotentials); Lusitropie (diastolische Relaxation - Steuerung der Ca++-Aufnahme in das sarkoplasmatische Retikulum über Phospholamban). Die Herzqualitäten werden sympathisch (via ß1-Adrenozeptoren) positiv, parasympathisch (via M2-Rezeptoren) negativ beeinflusst (vermindert). - Frequenzinotropie ist die Abhängigkeit der Schlagkraft von der Herzfrequenz ("Bowditch- Herztreppe": Anreicherung von Ca++)  Das zentrale
Blutvolumen beeinflusst die Herzleistung über die Kombination mehrerer
Mechanismen / Reflexe: Das Herzminutenvolumen nimmt mit dem effektiven
Blutvolumen zu (Starling-Mechanismus); bei höheren
Volumina durch Ansteigen der Herzfrequenz (Bainbridge-Reflex). Der Baroreflex
verstärkt den Effekt des Starling-Mechanismus, indem er die Vorlast des
Herzens durch Tachykardie weiter senkt. Im Ergebnis nimmt das Herzminutenvolumen mit dem
zentralen Blutvolumen stetig zu
Das zentrale
Blutvolumen beeinflusst die Herzleistung über die Kombination mehrerer
Mechanismen / Reflexe: Das Herzminutenvolumen nimmt mit dem effektiven
Blutvolumen zu (Starling-Mechanismus); bei höheren
Volumina durch Ansteigen der Herzfrequenz (Bainbridge-Reflex). Der Baroreflex
verstärkt den Effekt des Starling-Mechanismus, indem er die Vorlast des
Herzens durch Tachykardie weiter senkt. Im Ergebnis nimmt das Herzminutenvolumen mit dem
zentralen Blutvolumen stetig zu