

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert


Erythropoetin: ἐρυθρός = rot, ποιεῖν = machen
Hämoglobin: αἷμα = Blut, globus = Kugel (kugelförmiges Globin)
Hüfner'sche Zahl: Gustav v. Hüfner
Hypoxämie: ὑπό = unter, ὀξύς = scharf, sauer, γεννάω = erzeugen (oxygen: Säurebildner), αἷμα = Blut
Krogh'scher Zylinder: S.A.S. Krogh
Sinkt der Sauerstoffanteil im Blut (Hypoxämie), nimmt auch die O2-Versorgung des Gewebes ab (Hypoxie).
Das kann bei Aufstieg in große Höhen geschehen, hier sinkt der
Sauerstoffpartialdruck proportional mit dem Luftdruck, und die
O2-Sättigung nimmt entsprechend der Bindungskurve des Hämoglobins ab.
Rascher
Druckabfall führt zu Akutsymptomen der Hypoxie
wie
-- Anstieg des Augeninnendrucks,
-- Beeinträchtigung des Sehvermögens,
-- Nachlassen der Hirnfunktionen
- es fehlt die Zeit für
Anpassungsvorgänge.
Längerdauernde Hypoxie steigert die Produktion von Erythropoetin,
der Blutspiegel kann bis auf das 100-fache des Normalwertes erhöht
sein. Diese Anpassung wird durch humorale Faktoren
hervorgerufen, steigert Hämatokrit und Blutviskosität. Diese Umstellung bleibt im adaptierten Zustand erhalten, solange die Hypoxie
fortdauert.
Die reflektorische Steigerung der Atmung durch Hypoxie führt zu
vermehrter Abatmung von Kohlendioxid und damit zu Hypokapnie und respiratorischer Alkalose
(die nicht-respiratorisch kompensiert werden kann). Hält die Hypoxie länger
an, treten metabolische Adaptationen auf, die
Mitochondriendichte nimmt zu und in der Muskulatur steigt der
Kapillarisierungsgrad.
|

 Abbildung: Sauerstoff-Bindungskurve des Hämoglobins
Abbildung: Sauerstoff-Bindungskurve des Hämoglobins
Modifiziert nach einer Vorlage bei epomedicine.com
Einflüsse von pH, pCO2, Temperatur und 2,3-DPG (Biphosphoglycerat) auf die Sauerstoffbindung von Hämoglobin.
Rechtsverschiebung (rote Kurve) bedeutet, dass Sauerstoff schon bei höherem pO2
an das Gewebe abgegeben wird und leichter zu den Zellen diffundiert;
Linksverschiebung (blaue Kurve), dass Sauerstoff stärker von Hämoglobin
retiniert wird (geringere Sauerstoffabgabe bei gegebenem pO2)

 Hypoxie bedeutet Mangelversorgung der Gewebe mit Sauerstoff (Kriterium: Entspricht das Angebot der Nachfrage?), Hypoxämie
Hypoxie bedeutet Mangelversorgung der Gewebe mit Sauerstoff (Kriterium: Entspricht das Angebot der Nachfrage?), Hypoxämie  einen reduzierten Sauerstoffpartialdruck bzw. abnorm
niedrigen Sauerstoffgehalt des arteriellen Blutes (bedingt durch
Lungenerkrankungen oder geringen Sauerstoffgehalt der
Inspirationsluft). Niedriger arterieller pO2
(Blutgasanalyse) definiert Hypoxämie, der Sauerstoffgehalt des Blutes
inkludiert hingegen den an das Hämoglobin gebundenen Sauerstoff.
Extreme Hypoxie kann als Anoxie, extreme Hypoxämie als Anoxämie bezeichnet werden.
einen reduzierten Sauerstoffpartialdruck bzw. abnorm
niedrigen Sauerstoffgehalt des arteriellen Blutes (bedingt durch
Lungenerkrankungen oder geringen Sauerstoffgehalt der
Inspirationsluft). Niedriger arterieller pO2
(Blutgasanalyse) definiert Hypoxämie, der Sauerstoffgehalt des Blutes
inkludiert hingegen den an das Hämoglobin gebundenen Sauerstoff.
Extreme Hypoxie kann als Anoxie, extreme Hypoxämie als Anoxämie bezeichnet werden.
Auf Meereshöhe beträgt der pO2 in der Einatemluft 21 kPa, in den Lungenalveolen und im arterialisierten Blut etwa 13 kPa (~100 mmHg), und ein Liter Blut enthält 0,2 Liter Sauerstoff (Hüfner'sche Zahl  ) - einen normalem Anteil (~150 g/l Blut) und Zustand des Hämoglobins vorausgesetzt.
) - einen normalem Anteil (~150 g/l Blut) und Zustand des Hämoglobins vorausgesetzt.
Steigerung des Sauerstofftransports im Blut durch Erhöhung des Sauerstoffanteils im Atemgas:
Nur 1,4% (1/70) des Sauerstoffs wird im arteriellen Blut physikalisch
gelöst transportiert - etwa 3 ml/1 Blut. Das Hämoglobin transportiert
98,6% des Sauerstoffs im Blut (~200 ml/l), ist in diesem Zustand (pO2 = 13 kPa) aber vollständig sauerstoffgesättigt. Weitere Erhöhung des
pO2 (z.B. bei Atmung von reinem Sauerstoff - 100 kPa pO2) kann nur den physikalisch gelösten Anteil im Blut steigern - in
diesem Fall auf maximal das Fünffache, also ~15 ml/l. Der Anstieg der
transportierten Sauerstoffmenge beträgt dann lediglich 6% (12/200).
Sinkt der pO2 unter 13 kPa, nimmt die
Sättigung allmählich ab ( Abbildung); bei 5 kPa pO2 ist das Hämoglobin etwa zu 3/4, bei 4 kPa pO2 etwa zur Hälfte und bei 3 kPa pO2 etwa zu 1/4 sauerstoffgesättigt.
Abbildung); bei 5 kPa pO2 ist das Hämoglobin etwa zu 3/4, bei 4 kPa pO2 etwa zur Hälfte und bei 3 kPa pO2 etwa zu 1/4 sauerstoffgesättigt.

 Abbildung: Visuelle Funktionen und Sauerstoffpartialdruck: Symptome bei raschem Druckabfall (präadaptiv)
Abbildung: Visuelle Funktionen und Sauerstoffpartialdruck: Symptome bei raschem Druckabfall (präadaptiv)
Nach Daten der NASA
Mit
rasch abnehmendem Sauerstoffpartialdruck treten stufenweise
hypoxiebedingte
Symptome auf. Zuerst sind die Anpassung an Dunkelheit sowie das
Farbensehen beeinträchtigt; ab einem pO2, wie er in ~4000 m Meersehöhe
herrscht, nimmt der Augeninnendruck
zu, und ab einem Äquivalent von ~6000 m kommt es (bei fehlender
Adaptation / ohne Sauerstoffbeimischung zur Atemluft) zu weiteren
Einbußen der Leistungsfähigkeit des visuellen Systems

Diese Werte sind für Transport am Hämoglobin einerseits (Bindung von Sauerstoff an das Hämoglobinmolekül, Transport zum Gewebe),
Versorgung des Gewebes andererseits (Abgabe vom Hämoglobin)
ausschlaggebend.
Niedrige Sauerstoffpartialdrucke können bei Aufenthalt in großer Höhe auftreten ( s. dort): Der pO2 halbiert
sich jeweils mit einem Aufstieg um ~5 km. So beträgt der
Sauerstoffpartialdruck am Gipfel des Mt. Everest (8848 Meter) etwa 50
mmHg (Außenluft), im Blut kaum 25 mmHg (<4 kPa).
s. dort): Der pO2 halbiert
sich jeweils mit einem Aufstieg um ~5 km. So beträgt der
Sauerstoffpartialdruck am Gipfel des Mt. Everest (8848 Meter) etwa 50
mmHg (Außenluft), im Blut kaum 25 mmHg (<4 kPa).
Wegen der hypoxiebedingten Hyperventilation besteht ferner eine starke Hypokapnie, der arterielle pCO2 liegt unter 15 mmHg (Normalwert auf Meereshöhe 40 mmHg), sodass die O2-Bindungskurve des Hämoglobins linksverschoben ist ( Abbildung oben).
Abbildung oben).
Unter diesen Umständen beträgt die Sauerstoffsättigung des arteriellen
Hämoglobins trotz des extremen Sauerstoffmangels ("Todeszone") immer
noch >50%. Dadurch ist es möglich, den O2-Transport auf einer Höhe zu halten, die mit dem Überleben - zumindest für einige Zeit - vereinbar ist.
Sauerstoffverfügbarkeit in Abhängigkeit von Partialdruck bzw. Meereshöhe

Gerundete Werte, nach Michael H. Hecht und John B. West
|
Höhe (m)
|
Luftdruck (kPa)
|
Sauerstoff-
partialdruck Luft (kPa)
|
Alveolarer Sauerstoff-
partialdruck (kPa)
|
Sauerstoff-
sättigung Hämoglobin (%)
|
0
|
101
|
20
|
13
|
97
|
2500
|
75
|
14
|
8
|
89
|
5500
|
50
|
9
|
5
|
71
|
8848
|
34
|
<6
|
3,7
|
<40
|
Hypoxie hat vielfache Auswirkungen. Beispielsweise erhöht sie die Zahl offener Kaliumkanäle in glatten Muskelzellen arterieller Blutgefäße. Das führt zu verstärktem Austritt von K+ aus der Zelle, das Membranpotential steigt an, folglich nimmt der Einstrom von Ca++ durch spannungsgesteuerte Calciumkanäle (VDCCs) in der Membran der Gefäßmuskelzellen ab, es kommt zu Vasodilatation, besserer Durchblutung und erhöhtem Sauerstoffangebot im betroffenen Gewebe.
Bei der Höhenanpassung
treten Hämatokritwerte
bis zu ~70% auf, was einer Erythrozytenzahl von ~8 Mio / µl Blut
entspricht. Auslösend ist eine stark gesteigerte
Erythropoetinproduktion:
Erythropoetin 
 s. auch dort
s. auch dort
Erythropoetin (EPO)
wird zu ~90% in der Niere von interstitiellen bzw. peritubulären
Fibroblasten, zu ~10% in der Leber (von perisinusoidalen Hepatozyten) -
u.U. auch anderen
Zellen (Gehirn, Milz etc) gebildet (in der Fetal- und Perinatalzeit
hauptsächlich von der Leber). Erythropoetin wirkt über Rezeptoren (EpoR), die zur Zytokinrezeptorfamilie gehören. Es fördert die Umwandlung von Vorläuferzellen zu reifen
Erythrozyten und ist auch
an Angiogenese (Wundheilung) beteiligt.
Erythropoetin wird vorwiegend in den Nieren produziert
|
 Erythropoetin
Erythropoetin (Serum)
~10 mU/ml (6-32 mU/ml)
kann bei Sauerstoffmangel um das ~1000-fache (auf 10,000 mU/ml) zunehmen
Biologische Halbwertszeit etwa 5 Stunden
Die Erythropoetinsynthese wird ferner durch zahlreiche weitere Faktoren beeinflusst:

EPO-
Steigerung erfolgt u.a. durch
Androgene

EPO-
Verringerung erfolgt durch
Östrogene (Ery-Zahl bei Frauen im Schnitt niedriger als bei Männern)
Sauerstoffmangel (Blutverlust, Höhenaufenthalt) steigert die Produktion von Erythropoetin
|
Der
Sauerstofftransport im Blut nimmt mit der Verfügbarkeit von Hämoglobin
zu. Andererseits steigt mit dem Hämatokrit die Fließzähigkeit
(Viskosität) und die Perfusion sinkt. Mit steigender Erythrozytenzahl
steigt also einerseits die theoretische O2-Transportkapazität,
andererseits nimmt das tatsächliche Transportvermögen durch Behinderung
der Mikrozirkulation ab einem Punkt ab, der als optimaler Hämatokrit
angesehen werden kann.
 Abbildung: Fließzähigkeit des Blutes (blaue Kurve) und
Sauerstofftransport an das Gewebe (schwarze Kurve) als Funktion der
Hämoglobinkonzentration im Blut
Nach einer Vorlage in Hematology in Clinical Practice (Hillman / Ault / Rinder, eds), 4th ed., 2005 McGraw-Hill
Abbildung: Fließzähigkeit des Blutes (blaue Kurve) und
Sauerstofftransport an das Gewebe (schwarze Kurve) als Funktion der
Hämoglobinkonzentration im Blut
Nach einer Vorlage in Hematology in Clinical Practice (Hillman / Ault / Rinder, eds), 4th ed., 2005 McGraw-Hill
Steigender
Hämatokrit erschwert das Fließen von Blut (und Hämoglobin) in der
Mikrozirkulation. Das Maximum der Sauerstoffverfügbarkeit ist in diesem
Beispiel bei ~12 g/dl gegeben

Dieser Wert ist erreicht, wenn das Blut etwa zur
Hälfte aus Erythrozyten und Plasma besteht ( Abbildung).
Weitere Erhöhung des Ery-Anteils ("Blutdoping") wirkt kontraproduktiv, da das Blut
zwar mehr Hämoglobin enthält, aber schwer fließt.
Abbildung).
Weitere Erhöhung des Ery-Anteils ("Blutdoping") wirkt kontraproduktiv, da das Blut
zwar mehr Hämoglobin enthält, aber schwer fließt.
Bei Werten, wie sie bei starker Hypoxie auftreten (Hkt ~70%, s. oben), kann die Viskosität des Blutes
etwa auf das Dreifache des Normalwerts zunehmen, das Blut quält sich durch
die Mikrozirkulation, die Anlieferung von Sauerstoff an das Gewebe nimmt ab, es kommt zu
zusätzlicher Kreislaufbelastung.
Therapie: Sauerstoffzufuhr. Eine Erhöhung des pO2 in der Inspirationsluft kann durch verschiedene Maßnahmen erreicht werden, wie
 Zufuhr reinen Sauerstoffs (Sauerstoff-Flaschen) bei gegebenem (geringem Umgebungs-) Druck - pro Stunde werden etwa 250 Liter O2 benötigt
Zufuhr reinen Sauerstoffs (Sauerstoff-Flaschen) bei gegebenem (geringem Umgebungs-) Druck - pro Stunde werden etwa 250 Liter O2 benötigt
 Erhöhung
des Luftdrucks (Hyperbare Kammer: Mittels Handpumpe aufblasbarer
Rettungssack, in den die betreffende Person gelegt wird)
Erhöhung
des Luftdrucks (Hyperbare Kammer: Mittels Handpumpe aufblasbarer
Rettungssack, in den die betreffende Person gelegt wird)
 Abtransport der Person zu geringerer Höhe (einige hundert Höhenmeter
weniger können schon merkliche Erleichterung bringen)
Abtransport der Person zu geringerer Höhe (einige hundert Höhenmeter
weniger können schon merkliche Erleichterung bringen)
 Zur Sauerstoffversorgung des Gehirns s. dort
Zur Sauerstoffversorgung des Gehirns s. dort
 Zur Sauerstoffversorgung der Leber s. dort
Zur Sauerstoffversorgung der Leber s. dort
Angiogenese
 vgl. dort
vgl. dort
Sauerstoffmangel (Hypoxie) kann die Angiogenese (Gefäßneubildung) in entsprechenden Geweben anregen:
 Hypoxie-induzierbare
Transkriptionsfaktoren (wie der Hypoxie-induzierte Faktor HIF, welcher die Synthese von VEGF
reguliert) werden hinauf-, und
Hypoxie-induzierbare
Transkriptionsfaktoren (wie der Hypoxie-induzierte Faktor HIF, welcher die Synthese von VEGF
reguliert) werden hinauf-, und
 Angiogenese-Inhibitoren
herunterreguliert.
Angiogenese-Inhibitoren
herunterreguliert.
Angiogenese findet in hohem Ausmaß im Rahmen der Embryogenese, der
Fetalperiode und postnatal statt (je intensiver die Wachstumsvorgänge,
desto höher die Ansprüche auf zunehmende Blutversorgung der
betreffenden Gewebe).
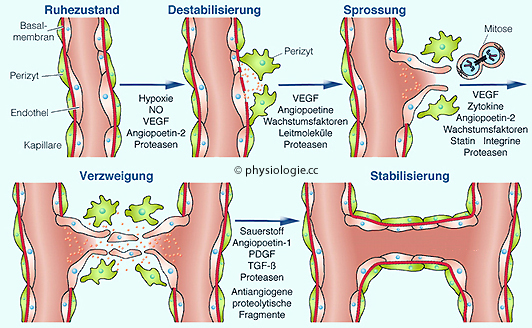

Abbildung: Gefäßneubildung und ihre Steuerung
Nach
Clapp C, Thebault S, Jeziorski MC, De La Escalera GM. Peptide Hormone
Regulation of Angiogenesis. Physiol Rev 2009; 89: 1177-215
Hypoxie induziert die Bildung von
Stickstoffmonoxid (NO), gefäß-endothelialem
Wachstumsfaktor (VEGF)
und Angiopoetinen 1 und 2, welche mit extrazellulären Matrixproteinen
interagieren und die Gefäßpermeabilität steigern.
Die folgende
"Destabilisierung" veranlasst Endothelzellen zum Verlassen des
Gefäßwandverbands (
Migration)
und zur Ausbildung neuer Gefäßröhren. Dabei werden sie unterstützt von
VEGF, Angiopoetinen, Leitsubstanzen, Wachstumsfaktoren,
Zytokinen
sowie dem Abbau extrazellulärer Matrixteile.
Neugebildete Gefäße reifen
unter der Einwirkung von antiangiogenen Faktoren, die z.T. durch den
Abbau der Matrix entstehen.
PDGF,
platelet-derived growth factor; TGF-β,
transforming growth factor-β

Angiogene Faktoren sind Wachstumsfaktoren, die an verschiedenen Orten wirksam werden können und insbesondere Gefäßwandzellen zum
Aussprossen neuer Seitenzweige und Gefäßneubildung (Angiogenese) motivieren, z.B.
 VEGFs (vascular
endothelial growth factors) - sie führen auch zu Lymphangiogenese,
VEGFs (vascular
endothelial growth factors) - sie führen auch zu Lymphangiogenese,
 Angiopoetine (Ang1 bis Ang4 - sie wirken über enditheliale Tyrosinkinase-Rezeptoren),
Angiopoetine (Ang1 bis Ang4 - sie wirken über enditheliale Tyrosinkinase-Rezeptoren),
 Hypoxie-induzierte Faktoren (HIF, hypoxia-inducible factors) - Transkriptionsfaktoren, die auf Sauerstoffmangel (und Pseudohypoxie wie bei Vit.B1-Mangel) mit einer Anregung der Gefäßneubildung reagieren,
Hypoxie-induzierte Faktoren (HIF, hypoxia-inducible factors) - Transkriptionsfaktoren, die auf Sauerstoffmangel (und Pseudohypoxie wie bei Vit.B1-Mangel) mit einer Anregung der Gefäßneubildung reagieren,
 TGFs (transforming growth factors),
TGFs (transforming growth factors),
 PDGFs u.a. (platelet derived growth factors) u.a.
PDGFs u.a. (platelet derived growth factors) u.a.
Solche Faktoren wirken an verschiedenen Orten, vor allem den Gefäßen. Der Gesamtvorgang schließt ein Zusammenspiel mit der
extrazellulären Matrix ein, diese wird z.T. ab- und umgebaut und gibt dabei ihrerseits regulierende Faktoren in den Extrazellulärraum ab.
Sauerstofftransport und pH-Regulation
Zwischen O2-Transport und Säure-Basen-Haushalt bestehen wichtige Querbeziehungen. Kohlendioxid (CO2) und Bicarbonat (HCO3-) verwandeln sich - über Kohlensäure, H2CO3 - ineinander:
CO
2 + H
2O

H
2CO
3 
H
+ + HCO
2-
Im Gewebe läuft die Reaktion nach rechts ab (Bildung von Bicarbonat), in der Lunge nach links (Bildung von CO2). Der Schritt zwischen CO2 und H2CO3 wird durch das Enzym Karboanhydrase (carboanhydrase, CAH) beschleunigt.

 Abbildung: Krogh'scher Zylinder
Abbildung: Krogh'scher Zylinder  . Verteilung des Sauerstoff-Partialdrucks (Ordinate, mmHg) um eine Kapillare
. Verteilung des Sauerstoff-Partialdrucks (Ordinate, mmHg) um eine Kapillare
Nach einer Vorlage in bioscience.org
Der Partialdruck nimmt sowohl entlang der Kapillare (arteriell >
venös) als auch quer dazu mit zunehmendem Abstand im Gewebe ab
(Verbrauch durch oxidativen Stoffwechsel der Zellen). Kritische Punkte
sind die mit minimalem Partialdruckwert (im Bild: ~30 µm neben venösem
Ende)

Die Lunge atmet CO2
ab und ist damit das wichtigste säureausscheidende Organ. Das
Hämoglobin nimmt vor allem durch seine Eigenschaft als Puffer am
Transport von CO2 teil, wodurch eine Wechselwirkung zwischen Sauerstofftransport und Säure-Basen-Gleichgewicht besteht:

 Hämoglobin bindet CO2 bzw. Wasserstoffionen (H+) leichter, wenn es wenig Sauerstoff bindet; bei der Beladung mit O2 hingegen gibt es CO2 bzw. Wasserstoffionen ab (Haldane-Effekt).
Hämoglobin bindet CO2 bzw. Wasserstoffionen (H+) leichter, wenn es wenig Sauerstoff bindet; bei der Beladung mit O2 hingegen gibt es CO2 bzw. Wasserstoffionen ab (Haldane-Effekt).
 Andererseits nimmt Hämoglobin Sauerstoff leichter auf, wenn es H+ abgibt, und schwerer, wenn es H+ gebunden hat (Bohr-Effekt).
Andererseits nimmt Hämoglobin Sauerstoff leichter auf, wenn es H+ abgibt, und schwerer, wenn es H+ gebunden hat (Bohr-Effekt).
 Hypoxie regt Typ-I-Zellen in peripheren Chemorezeptoren (glomera carotica & aortica) an.
Hypoxie regt Typ-I-Zellen in peripheren Chemorezeptoren (glomera carotica & aortica) an.
Verstärkte Atmung (Höhenanpassung) hat automatisch einen erhöhten Verlust an CO2 zur Folge (Hypokapnie). Dies senkt wiederum den Atemantrieb im Atemzentrum.
Es ergibt sich ein Zustand, bei dem hemmende (respiratorische Alkalose)
und stimulierende Faktoren auf die Atmung (Hypoxämie) gegensätzliche
Wirkung ausüben. Der niedrige Sauerstoffpartialdruck führt zu einer Vasokonstriktion der Pulmonalgefäße; dies erhöht den pulmonalarteriellen Druck.

 Abbildung: Mechanismus der Reaktion von Glomuszellen (Typ I) auf Hypoxie
Abbildung: Mechanismus der Reaktion von Glomuszellen (Typ I) auf Hypoxie
Nach Teppema LJ, Dahan A. The Ventilatory Response to
Hypoxia in Mammals: Mechanisms, Measurement, and Analysis. Physiol Rev
2010; 90: 675-754
Hypoxiebedingte verminderte Reizung von O2-Sensoren
senkt den Kaliumausstrom und depolarisiert damit die Glomuszelle. Dies
aktiviert spannungsabhängige Calciumkanäle (blau), der Calciumeinstrom
triggert Transmitterfreisetzung (ATP, Acetylcholin?).
Afferente
Nervenfasern werden daraufhin erregt und leiten Aktionspotentiale an
nucleus tractus solitarii und Atemzentrum - die Atmung wird angeregt
 Näheres zu Glomusrezeptoren und Atemsteuerung s. dort
Näheres zu Glomusrezeptoren und Atemsteuerung s. dort

Längerdauernde Hypoxie führt zu zahlreichen Anpassungsvorgängen (über Tage und Wochen), wie:
 Metabolische Kompensation der respiratorischen Alkalose (vermehrte Bicarbonatausscheidung)
Metabolische Kompensation der respiratorischen Alkalose (vermehrte Bicarbonatausscheidung)
 Verringerte Laktatproduktion durch reduzierten Glucoseabbau
Verringerte Laktatproduktion durch reduzierten Glucoseabbau
 Gesenktes Plasmavolumen, erhöhte Erythrozytenproduktion
Gesenktes Plasmavolumen, erhöhte Erythrozytenproduktion
 Steigerung der Kapillarisierung in der Muskulatur, Erhöhung der Mitochondrienzahl und der Myoglobinkonzentration im Muskelgewebe.
Steigerung der Kapillarisierung in der Muskulatur, Erhöhung der Mitochondrienzahl und der Myoglobinkonzentration im Muskelgewebe.



 Der Sauerstoffbedarf beträgt im Ruhezustand knapp 4 ml pro kg
Körpergewicht und Minute (~0,3 l/min) und steigt bei körperlicher
Belastung bis um das 15- bis 20-fache an
Der Sauerstoffbedarf beträgt im Ruhezustand knapp 4 ml pro kg
Körpergewicht und Minute (~0,3 l/min) und steigt bei körperlicher
Belastung bis um das 15- bis 20-fache an
 Hypoxie bedeutet Mangelversorgung des Gewebes mit Sauerstoff, ein
geringer Sauerstoffanteil im Blut bezeichnet man als Hypoxämie
Hypoxie bedeutet Mangelversorgung des Gewebes mit Sauerstoff, ein
geringer Sauerstoffanteil im Blut bezeichnet man als Hypoxämie
 Bei einem pO2 von ≥13 kPa ist das Hämoglobin vollständig sauerstoffgesättigt. Bei pO2 = 5 kPa beträgt die Sättigung ~75%, bei 4 kPa ~50%, bei 3 kPa ~25% Bei einem pO2 von ≥13 kPa ist das Hämoglobin vollständig sauerstoffgesättigt. Bei pO2 = 5 kPa beträgt die Sättigung ~75%, bei 4 kPa ~50%, bei 3 kPa ~25%
 Erythropoetin entsteht vorwiegend in den Nieren (interstitielle /
peritubuläre Fibroblasten), ~10% in anderen Zellen (Leber, Gehirn,
Milz). Es regt die Erythropoese und Angiogenese (Wundheilung!) an. Bei
Sauerstoffmangel kann der Epo-Spiegel bis zu 1000-fach zunehmen.
Zahlreiche Hormone regen die Epo-Bildung an, Östrogene verringern sie
Erythropoetin entsteht vorwiegend in den Nieren (interstitielle /
peritubuläre Fibroblasten), ~10% in anderen Zellen (Leber, Gehirn,
Milz). Es regt die Erythropoese und Angiogenese (Wundheilung!) an. Bei
Sauerstoffmangel kann der Epo-Spiegel bis zu 1000-fach zunehmen.
Zahlreiche Hormone regen die Epo-Bildung an, Östrogene verringern sie
 Hypoxie regt die Bildung von Stickstoffmonoxid (NO),
gefäß-endothelialem Wachstumsfaktor (VEGF) und Angiopoetinen an.
Endothelzellen bilden dann neue Gefäße, unterstützt von zahlreichen
extrazellulären (VEGF, Angiopoetine, Wachstumsfaktoren, Zytokine) und
intrazellulären Faktoren (der hypoxie-induzierte Faktor HIF ist ein
Transkriptionsfaktor)
Hypoxie regt die Bildung von Stickstoffmonoxid (NO),
gefäß-endothelialem Wachstumsfaktor (VEGF) und Angiopoetinen an.
Endothelzellen bilden dann neue Gefäße, unterstützt von zahlreichen
extrazellulären (VEGF, Angiopoetine, Wachstumsfaktoren, Zytokine) und
intrazellulären Faktoren (der hypoxie-induzierte Faktor HIF ist ein
Transkriptionsfaktor)
 Um Kapillaren bestehen Zonen mit quer und längs abnehmendem
Sauerstoffpartialdruck (Krogh-Zylinder), kritische Stellen haben
minimalen pO2-Wert
Um Kapillaren bestehen Zonen mit quer und längs abnehmendem
Sauerstoffpartialdruck (Krogh-Zylinder), kritische Stellen haben
minimalen pO2-Wert
 Typ-I-Glomuszellen senken bei Hypoxie den Kaliumausstrom und
depolarisieren dadurch. Dies aktiviert spannungsabhängige Calciumkanäle, Ca++ strömt in die Zelle und triggert
Transmitterfreisetzung, afferente Nervenfasern melden an den nucleus
tractus solitarii und das Atemzentrum, die Atmung nimmt zu
Typ-I-Glomuszellen senken bei Hypoxie den Kaliumausstrom und
depolarisieren dadurch. Dies aktiviert spannungsabhängige Calciumkanäle, Ca++ strömt in die Zelle und triggert
Transmitterfreisetzung, afferente Nervenfasern melden an den nucleus
tractus solitarii und das Atemzentrum, die Atmung nimmt zu
|

 Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.
Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.





 Erythropoetin und Sauerstofftransport
Erythropoetin und Sauerstofftransport  Angiogenese
Angiogenese  Säure-Basen-Komponente
Säure-Basen-Komponente

 Hypoxie / Hypoxämie
Hypoxie / Hypoxämie
 transportiert, abhängig vom
Sauerstoffpartialdruck (pO2).
transportiert, abhängig vom
Sauerstoffpartialdruck (pO2).
 Abbildung: Sauerstoff-Bindungskurve des Hämoglobins
Abbildung: Sauerstoff-Bindungskurve des Hämoglobins
 Hypoxie bedeutet Mangelversorgung der Gewebe mit Sauerstoff (Kriterium: Entspricht das Angebot der Nachfrage?), Hypoxämie
Hypoxie bedeutet Mangelversorgung der Gewebe mit Sauerstoff (Kriterium: Entspricht das Angebot der Nachfrage?), Hypoxämie  einen reduzierten Sauerstoffpartialdruck bzw. abnorm
niedrigen Sauerstoffgehalt des arteriellen Blutes (bedingt durch
Lungenerkrankungen oder geringen Sauerstoffgehalt der
Inspirationsluft). Niedriger arterieller pO2
(Blutgasanalyse) definiert Hypoxämie, der Sauerstoffgehalt des Blutes
inkludiert hingegen den an das Hämoglobin gebundenen Sauerstoff.
Extreme Hypoxie kann als Anoxie, extreme Hypoxämie als Anoxämie bezeichnet werden.
einen reduzierten Sauerstoffpartialdruck bzw. abnorm
niedrigen Sauerstoffgehalt des arteriellen Blutes (bedingt durch
Lungenerkrankungen oder geringen Sauerstoffgehalt der
Inspirationsluft). Niedriger arterieller pO2
(Blutgasanalyse) definiert Hypoxämie, der Sauerstoffgehalt des Blutes
inkludiert hingegen den an das Hämoglobin gebundenen Sauerstoff.
Extreme Hypoxie kann als Anoxie, extreme Hypoxämie als Anoxämie bezeichnet werden. ) - einen normalem Anteil (~150 g/l Blut) und Zustand des Hämoglobins vorausgesetzt.
) - einen normalem Anteil (~150 g/l Blut) und Zustand des Hämoglobins vorausgesetzt. Abbildung); bei 5 kPa pO2 ist das Hämoglobin etwa zu 3/4, bei 4 kPa pO2 etwa zur Hälfte und bei 3 kPa pO2 etwa zu 1/4 sauerstoffgesättigt.
Abbildung); bei 5 kPa pO2 ist das Hämoglobin etwa zu 3/4, bei 4 kPa pO2 etwa zur Hälfte und bei 3 kPa pO2 etwa zu 1/4 sauerstoffgesättigt.
 Abbildung: Visuelle Funktionen und Sauerstoffpartialdruck: Symptome bei raschem Druckabfall (präadaptiv)
Abbildung: Visuelle Funktionen und Sauerstoffpartialdruck: Symptome bei raschem Druckabfall (präadaptiv)
 s. dort): Der pO2 halbiert
sich jeweils mit einem Aufstieg um ~5 km. So beträgt der
Sauerstoffpartialdruck am Gipfel des Mt. Everest (8848 Meter) etwa 50
mmHg (Außenluft), im Blut kaum 25 mmHg (<4 kPa).
s. dort): Der pO2 halbiert
sich jeweils mit einem Aufstieg um ~5 km. So beträgt der
Sauerstoffpartialdruck am Gipfel des Mt. Everest (8848 Meter) etwa 50
mmHg (Außenluft), im Blut kaum 25 mmHg (<4 kPa).  Abbildung oben).
Abbildung oben). 
 EPO-Steigerung erfolgt u.a. durch Androgene
EPO-Steigerung erfolgt u.a. durch Androgene  EPO-Verringerung erfolgt durch Östrogene (Ery-Zahl bei Frauen im Schnitt niedriger als bei Männern)
EPO-Verringerung erfolgt durch Östrogene (Ery-Zahl bei Frauen im Schnitt niedriger als bei Männern)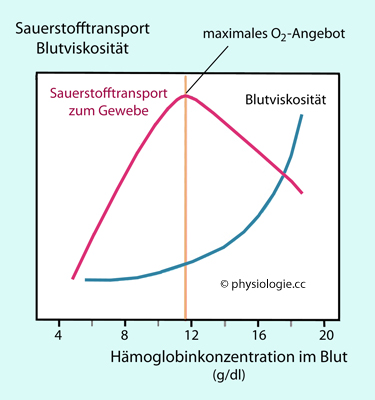
 Abbildung: Fließzähigkeit des Blutes (blaue Kurve) und
Sauerstofftransport an das Gewebe (schwarze Kurve) als Funktion der
Hämoglobinkonzentration im Blut
Abbildung: Fließzähigkeit des Blutes (blaue Kurve) und
Sauerstofftransport an das Gewebe (schwarze Kurve) als Funktion der
Hämoglobinkonzentration im Blut
 Abbildung).
Weitere Erhöhung des Ery-Anteils ("Blutdoping") wirkt kontraproduktiv, da das Blut
zwar mehr Hämoglobin enthält, aber schwer fließt.
Abbildung).
Weitere Erhöhung des Ery-Anteils ("Blutdoping") wirkt kontraproduktiv, da das Blut
zwar mehr Hämoglobin enthält, aber schwer fließt. Zufuhr reinen Sauerstoffs (Sauerstoff-Flaschen) bei gegebenem (geringem Umgebungs-) Druck - pro Stunde werden etwa 250 Liter O2 benötigt
Zufuhr reinen Sauerstoffs (Sauerstoff-Flaschen) bei gegebenem (geringem Umgebungs-) Druck - pro Stunde werden etwa 250 Liter O2 benötigt Erhöhung
des Luftdrucks (Hyperbare Kammer: Mittels Handpumpe aufblasbarer
Rettungssack, in den die betreffende Person gelegt wird)
Erhöhung
des Luftdrucks (Hyperbare Kammer: Mittels Handpumpe aufblasbarer
Rettungssack, in den die betreffende Person gelegt wird) Abtransport der Person zu geringerer Höhe (einige hundert Höhenmeter
weniger können schon merkliche Erleichterung bringen)
Abtransport der Person zu geringerer Höhe (einige hundert Höhenmeter
weniger können schon merkliche Erleichterung bringen) vgl. dort
vgl. dort Hypoxie-induzierbare
Transkriptionsfaktoren (wie der Hypoxie-induzierte Faktor HIF, welcher die Synthese von VEGF
reguliert) werden hinauf-, und
Hypoxie-induzierbare
Transkriptionsfaktoren (wie der Hypoxie-induzierte Faktor HIF, welcher die Synthese von VEGF
reguliert) werden hinauf-, und  Angiogenese-Inhibitoren
herunterreguliert.
Angiogenese-Inhibitoren
herunterreguliert.
 Abbildung: Gefäßneubildung und ihre Steuerung
Abbildung: Gefäßneubildung und ihre Steuerung
 VEGFs (vascular
endothelial growth factors) - sie führen auch zu Lymphangiogenese,
VEGFs (vascular
endothelial growth factors) - sie führen auch zu Lymphangiogenese, Angiopoetine (Ang1 bis Ang4 - sie wirken über enditheliale Tyrosinkinase-Rezeptoren),
Angiopoetine (Ang1 bis Ang4 - sie wirken über enditheliale Tyrosinkinase-Rezeptoren), Hypoxie-induzierte Faktoren (HIF, hypoxia-inducible factors) - Transkriptionsfaktoren, die auf Sauerstoffmangel (und Pseudohypoxie wie bei Vit.B1-Mangel) mit einer Anregung der Gefäßneubildung reagieren,
Hypoxie-induzierte Faktoren (HIF, hypoxia-inducible factors) - Transkriptionsfaktoren, die auf Sauerstoffmangel (und Pseudohypoxie wie bei Vit.B1-Mangel) mit einer Anregung der Gefäßneubildung reagieren, TGFs (transforming growth factors),
TGFs (transforming growth factors),  PDGFs u.a. (platelet derived growth factors) u.a.
PDGFs u.a. (platelet derived growth factors) u.a. H2CO3
H2CO3  H+ + HCO2-
H+ + HCO2-
 Abbildung: Krogh'scher Zylinder
Abbildung: Krogh'scher Zylinder  . Verteilung des Sauerstoff-Partialdrucks (Ordinate, mmHg) um eine Kapillare
. Verteilung des Sauerstoff-Partialdrucks (Ordinate, mmHg) um eine Kapillare

 Hämoglobin bindet CO2 bzw. Wasserstoffionen (H+) leichter, wenn es wenig Sauerstoff bindet; bei der Beladung mit O2 hingegen gibt es CO2 bzw. Wasserstoffionen ab (Haldane-Effekt).
Hämoglobin bindet CO2 bzw. Wasserstoffionen (H+) leichter, wenn es wenig Sauerstoff bindet; bei der Beladung mit O2 hingegen gibt es CO2 bzw. Wasserstoffionen ab (Haldane-Effekt). Andererseits nimmt Hämoglobin Sauerstoff leichter auf, wenn es H+ abgibt, und schwerer, wenn es H+ gebunden hat (Bohr-Effekt).
Andererseits nimmt Hämoglobin Sauerstoff leichter auf, wenn es H+ abgibt, und schwerer, wenn es H+ gebunden hat (Bohr-Effekt).  Hypoxie regt Typ-I-Zellen in peripheren Chemorezeptoren (glomera carotica & aortica) an.
Hypoxie regt Typ-I-Zellen in peripheren Chemorezeptoren (glomera carotica & aortica) an.
 Abbildung: Mechanismus der Reaktion von Glomuszellen (Typ I) auf Hypoxie
Abbildung: Mechanismus der Reaktion von Glomuszellen (Typ I) auf Hypoxie Näheres zu Glomusrezeptoren und Atemsteuerung s. dort
Näheres zu Glomusrezeptoren und Atemsteuerung s. dort
 Metabolische Kompensation der respiratorischen Alkalose (vermehrte Bicarbonatausscheidung)
Metabolische Kompensation der respiratorischen Alkalose (vermehrte Bicarbonatausscheidung) Verringerte Laktatproduktion durch reduzierten Glucoseabbau
Verringerte Laktatproduktion durch reduzierten Glucoseabbau Gesenktes Plasmavolumen, erhöhte Erythrozytenproduktion
Gesenktes Plasmavolumen, erhöhte Erythrozytenproduktion Steigerung der Kapillarisierung in der Muskulatur, Erhöhung der Mitochondrienzahl und der Myoglobinkonzentration im Muskelgewebe.
Steigerung der Kapillarisierung in der Muskulatur, Erhöhung der Mitochondrienzahl und der Myoglobinkonzentration im Muskelgewebe.
 Der Sauerstoffbedarf beträgt im Ruhezustand knapp 4 ml pro kg
Körpergewicht und Minute (~0,3 l/min) und steigt bei körperlicher
Belastung bis um das 15- bis 20-fache an
Der Sauerstoffbedarf beträgt im Ruhezustand knapp 4 ml pro kg
Körpergewicht und Minute (~0,3 l/min) und steigt bei körperlicher
Belastung bis um das 15- bis 20-fache an Hypoxie bedeutet Mangelversorgung des Gewebes mit Sauerstoff, ein
geringer Sauerstoffanteil im Blut bezeichnet man als Hypoxämie
Hypoxie bedeutet Mangelversorgung des Gewebes mit Sauerstoff, ein
geringer Sauerstoffanteil im Blut bezeichnet man als Hypoxämie Bei einem pO2 von ≥13 kPa ist das Hämoglobin vollständig sauerstoffgesättigt. Bei pO2 = 5 kPa beträgt die Sättigung ~75%, bei 4 kPa ~50%, bei 3 kPa ~25%
Bei einem pO2 von ≥13 kPa ist das Hämoglobin vollständig sauerstoffgesättigt. Bei pO2 = 5 kPa beträgt die Sättigung ~75%, bei 4 kPa ~50%, bei 3 kPa ~25% Erythropoetin entsteht vorwiegend in den Nieren (interstitielle /
peritubuläre Fibroblasten), ~10% in anderen Zellen (Leber, Gehirn,
Milz). Es regt die Erythropoese und Angiogenese (Wundheilung!) an. Bei
Sauerstoffmangel kann der Epo-Spiegel bis zu 1000-fach zunehmen.
Zahlreiche Hormone regen die Epo-Bildung an, Östrogene verringern sie
Erythropoetin entsteht vorwiegend in den Nieren (interstitielle /
peritubuläre Fibroblasten), ~10% in anderen Zellen (Leber, Gehirn,
Milz). Es regt die Erythropoese und Angiogenese (Wundheilung!) an. Bei
Sauerstoffmangel kann der Epo-Spiegel bis zu 1000-fach zunehmen.
Zahlreiche Hormone regen die Epo-Bildung an, Östrogene verringern sie Hypoxie regt die Bildung von Stickstoffmonoxid (NO),
gefäß-endothelialem Wachstumsfaktor (VEGF) und Angiopoetinen an.
Endothelzellen bilden dann neue Gefäße, unterstützt von zahlreichen
extrazellulären (VEGF, Angiopoetine, Wachstumsfaktoren, Zytokine) und
intrazellulären Faktoren (der hypoxie-induzierte Faktor HIF ist ein
Transkriptionsfaktor)
Hypoxie regt die Bildung von Stickstoffmonoxid (NO),
gefäß-endothelialem Wachstumsfaktor (VEGF) und Angiopoetinen an.
Endothelzellen bilden dann neue Gefäße, unterstützt von zahlreichen
extrazellulären (VEGF, Angiopoetine, Wachstumsfaktoren, Zytokine) und
intrazellulären Faktoren (der hypoxie-induzierte Faktor HIF ist ein
Transkriptionsfaktor) Um Kapillaren bestehen Zonen mit quer und längs abnehmendem
Sauerstoffpartialdruck (Krogh-Zylinder), kritische Stellen haben
minimalen pO2-Wert
Um Kapillaren bestehen Zonen mit quer und längs abnehmendem
Sauerstoffpartialdruck (Krogh-Zylinder), kritische Stellen haben
minimalen pO2-Wert Typ-I-Glomuszellen senken bei Hypoxie den Kaliumausstrom und
depolarisieren dadurch. Dies aktiviert spannungsabhängige Calciumkanäle, Ca++ strömt in die Zelle und triggert
Transmitterfreisetzung, afferente Nervenfasern melden an den nucleus
tractus solitarii und das Atemzentrum, die Atmung nimmt zu
Typ-I-Glomuszellen senken bei Hypoxie den Kaliumausstrom und
depolarisieren dadurch. Dies aktiviert spannungsabhängige Calciumkanäle, Ca++ strömt in die Zelle und triggert
Transmitterfreisetzung, afferente Nervenfasern melden an den nucleus
tractus solitarii und das Atemzentrum, die Atmung nimmt zu