

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert

T-Zellen
und Zytokine
© H. Hinghofer-Szalkay
 Apoptose: ἀποπίπτειν = abfallen
Apoptose: ἀποπίπτειν = abfallen
bursa Fabricii: Girolamo Fabrizio
Helminthiasis: ἔλμις = (Eingeweide-) Wurm
Interferon: interferre = "sich einmischen" - Interferone stören die Replikation von Viren
Interleukin: inter = zwischen, λευκός = weiß (Leukozyt)
Thymus: θυμός = Lebenskraft (Bries)
Pleiotropie: πλείων = mehr, τρόπος = Richtung
Zytokin: κύτος = Gefäß (Zelle), κίνἔω = antreiben, bewegen
Aus dem Knochenmark wandern Vorläufer der T-Lymphozyten in die Thymusdrüse, wo Thymosine
ihre Reifung, Proliferation und Differenzierung zu verschiedenen
Lymphozyten-Subsets (Helfer-, regulatorische, zytotoxische, γδ-,
natürliche Killer-T-Zellen) steuern.
Junge T-Lymphozyten haben noch keine CD4-, CD8-, oder
T-Zell-Rezeptoren, sie sind "doppelt negativ". Im Thymus beginnen sie,
diese Faktoren zu exprimieren (CD4+ und CD8+: "doppelt positiv"), und
werden für Apoptose-Signale zugänglich: Die meisten gehen zugrunde,
sofern sie den positiven und negativen Selektionstest nicht bestehen. T-Zellen, die peptidbeladene MHC-I und MHC-II-Moleküle an Thymuszellen
in begrenztem Ausmaß erkennen, überleben ("positive Selektion"). Solche, die zu stark auf den präsentierten Peptid-MHC-Komplex reagieren, unterliegen apoptotischer Zerstörung ("negative Selektion"), auch solche, die den Komplex nicht erkennen. Die Produktion eines der beiden Korezeptoren (CD4 oder CD8) wird eingestellt
("einfach positiv").
Reife
Lymphozyten verlassen den Thymus und wandern in sekundäre lymphatische
Organe ein (Lymphknoten, Milz, Peyer-Plaques, andere lymphatische Gewebe); im Kreislauf halten
sie sich jeweils nur für kurze Zeit auf.

-- Helferzellen sezernieren Zytokine,
hormonartige Substanzen, die über spezifische Rezeptoren das Immunsystem koordinieren (Interleukine, Interferone,
koloniestimulierende Faktoren);

-- Suppressorzellen hemmen die Funktion anderer Lymphozyten;

-- Zytotoxische Zellen zerstören infizierte oder Tumorzellen.
Zytokine dienen der Kommunikation und Koordination innerhalb des Immunsystems. Sie haben vielfältige Wirkung; so können Interferone Zellen vor Virusbefall schützen, Interleukine spezifisch Zellgruppen steuern, Tumornekrosefaktor
natürliche Killerzellen und Makrophagen aktivieren. Zytokine werden
nicht nur von Leukozyten, sondern auch anderen Zellen gebildet
(Fibroblasten, Endothel, Epithelzellen).
|
Übersicht  T-Zellen und spezifische Abwehr
T-Zellen und spezifische Abwehr  Thymus: Positive und negative Selektion
Thymus: Positive und negative Selektion  T-Zell-Aktivierung, klonale Expansion und Kontraktion
T-Zell-Aktivierung, klonale Expansion und Kontraktion  Gedächtniszellen
Gedächtniszellen  T-Zellen und ihre Rezeptoren
T-Zellen und ihre Rezeptoren  Aktivierung des TCR, erstes und zweites Signal
Aktivierung des TCR, erstes und zweites Signal  Arten von T-Zellen
Arten von T-Zellen  Lymphozyten mit limitierter Diversität
Lymphozyten mit limitierter Diversität  Zytokine
Zytokine  Zytokinrezeptorfamilie
Zytokinrezeptorfamilie

CD3  Thymosine
Thymosine  Positive Selektion
Positive Selektion  Negative Selektion
Negative Selektion  AIRE
AIRE  TNF-Superfamilie
TNF-Superfamilie  Klonale Expansion
Klonale Expansion  Immunologische Synapse
Immunologische Synapse  Perforin, Granzyme
Perforin, Granzyme  Zytokin
Zytokin  Interferone
Interferone  Chemokine
Chemokine  Koloniestimulierende Faktoren (CSF)
Koloniestimulierende Faktoren (CSF)  Treg-Zellen
Treg-Zellen
 Praktische Aspekte
Praktische Aspekte  Core messages
Core messages
T-Lymphozyten
spielen eine zentrale Rolle für die Steuerung der adaptiven Immunität.
Dementsprechend unterliegt die Art und Weise, wie sie Epitope
erkennen
und durch diese aktiviert werden, strikter Regulation.
T-Zell-Rezeptoren "sehen" nur Antigene, die ihnen über
MHC-Moleküle - als kurze Aminosäureketten ("lineare" Antigene) -
präsentiert werden. Die Aktivierung der T-Zellen erfordert über diese
MHC-Restriktion hinaus die Interaktion zusätzlicher
Oberflächenproteine, die zwischen Lymphozyt und antigenpräsentierender
Zelle spezifische molekulare Brücken aufbauen.
Insbesondere vermitteln T-Zellen zelluläre Immunität gegen Mikroben,
welche in Zellen eingedrungen sind und sich hier vermehren können.
CD8-positive Lymphozyten töten durch Viren, Rickettsien oder Protozoen infizierte kernhaltige Zellen ab, weiters auch
Phagozyten (z.B. neutrophile Granulozyten), die Bakterien oder Pilze
aufgenommen haben und diese nicht selbst eliminieren konnten.
CD4-positive Lymphozyten sezernieren Zytokine, welche die
Abwehrreaktionen verstärken.
Zu den wichtigsten Funktionen der T-Lymphozyten gehören das Abtöten
infizierter Zellen und Tumorzellen, die fallweise Aktivierung von
Phagozyten, sowie die Unterstützung der Funktion von B-Lymphozyten.
Nicht nur mit diesen müssen dazu die T-Zellen kooperieren, sondern auch
mit
speziellen - insbesondere dendritischen - Zellen, welche naiven
T-Zellen Antigene in sekundärem lymphatischem Gewebe (z.B. Lymphknoten)
präsentieren und sie dazu zur Zellteilung anregen (Klonselektion).
T-Zellen vermitteln zelluläre spezifische Abwehr
Um Antigene zu erkennen, benötigen T-Lymphozyten nicht nur entsprechende T-Zell-Rezeptoren (TCR), sondern auch die Hilfe von MHC-Molekülen. Über diese präsentieren ihnen andere Körperzellen aufbereitete Peptide. Ohne MHC werden Antigene von T-Zellen nicht erkannt (MHC-Restriktion).
Solche
Peptide stammen entweder aus proteasomalem Abbau ubiquitinierter,
intrazellulär produzierter Proteine - sie werden über MHC-I-Moleküle
präsentiert und von CD8-positiven Lymphozyten erkannt. Oder es geht um die Erkennung aus dem Extrazellulärraum durch professionelle
antigenpräsentierende - vor allem dendritische - Zellen aufgenommer (insbesondere mikrobieller) Antigene - diese werden über MHC-II-Moleküle präsentiert und von CD4-positiven T-Zellen erkannt.
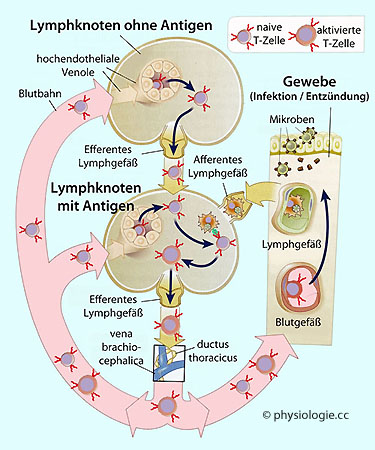

Abbildung: T-Lymphozyten-Zirkulation
Nach einer Vorlage in Abbas / Lichtman / Pillai: Cellular and Molecular Immunology, 9th ed. 2018
Naive
T-Zellen wechseln vorwiegend über hochendotheliale Venolen aus dem
Blutkreislauf in Lymphknoten (oben). Über efferente Lymphgefäße können
sie diese wieder verlassen, ohne notwendigerweise auf Antigene
getroffen zu sein.
Antigene gelangen z.B. mit dendritischen Zellen - über afferente
Lymphgefäße- in Lymphknoten (Mitte). Erkennt eine naive T-Zelle das
(mikrobielle) Antigen - d.h., passen ihre Rezeptoren auf den
präsentierten MHC-Peptid-Komplex -, wird sie aktiviert.
Aktivierte Zellen vermehren sich (Klonexpansion), gelangen in den Blutkreislauf und
treten von dort an Stellen einer Entzündung / Infektion in das Gewebe aus

MHC-I-gebundene Peptide entstehen aus zytoplasmatischen Proteinen, die
(entsprechend zelleigenen oder Virus-"Bauplänen") von der Zelle selbst
synthetisiert und über den Ubiquitinmechanismus für proteasomalen Abbau
freigegeben wurden. Ihre Präsentation kann CD8-positive (zytotoxische)
Lymphozyten aktivieren.
MHC-II-gebundene Peptide entstehen meist aus endozytierten
(extrazellulären) Antigenen. Sie stammen aus dem lysosomalen Abbau professioneller
antigenpräsentierender (z.B. dendritischer) Zellen. Ihre Präsentation
kann CD4-positive (Helfer-) Lymphozyten aktivieren.
Der Ursprung
der präsentierten Antigene ist also im Wesentlichen bei MHC-I
intrazellulär, bei MHC-II extrazellulär, und die Funktionsweise der
engagierten T-Zellen ist sehr unterschiedlich:
 CD8+-Lymphozyten (MHC-I-aktiviert) töten Zellen ab, die intrazelluläre
Antigene produzieren (z.B. wenn diese virusinfiziert sind oder
Tumorprotein erzeugen), und aktivieren Makrophagen, Antigenträger zu
phagozytieren. Da Lymphozyten, die intensiv auf körpereigene Peptide
reagieren, im Thymus eliminiert werden (negative Selektion), reagiert
das System normalerweise nicht auf normale "Selbst"-Moleküle (Selbsttoleranz, horror autotoxicus) und verursacht keine Autoimmunität. Nur MHC-I-gebundene Peptide, die dem System fremd sind (aus dem proteasomalen Abbau veränderter, viraler, oder aus Fremdgewebe stammender Proteine resultieren), führen zu Immunreaktionen und Zerstörung der Zelle (Abtötung virusinfizierter Zellen, Krebszellen, oder Transplantatabstoßung).
CD8+-Lymphozyten (MHC-I-aktiviert) töten Zellen ab, die intrazelluläre
Antigene produzieren (z.B. wenn diese virusinfiziert sind oder
Tumorprotein erzeugen), und aktivieren Makrophagen, Antigenträger zu
phagozytieren. Da Lymphozyten, die intensiv auf körpereigene Peptide
reagieren, im Thymus eliminiert werden (negative Selektion), reagiert
das System normalerweise nicht auf normale "Selbst"-Moleküle (Selbsttoleranz, horror autotoxicus) und verursacht keine Autoimmunität. Nur MHC-I-gebundene Peptide, die dem System fremd sind (aus dem proteasomalen Abbau veränderter, viraler, oder aus Fremdgewebe stammender Proteine resultieren), führen zu Immunreaktionen und Zerstörung der Zelle (Abtötung virusinfizierter Zellen, Krebszellen, oder Transplantatabstoßung).
 CD4+-Lymphozyten hingegen (MHC-II-aktiviert) tragen zur Eliminierung extrazellulärer
Antigene bei: Sie helfen Phagozyten dabei,
Mikroben (oder infizierte Zellen) zu zerstören; sie aktivieren
B-Lymphozyten (Plasmazellen) zur Produktion von Antikörpern, die
extrazelluläre Antigene stoppen können; und sie regen Entzündungsvorgänge (vermehrte Durchblutung und Gefäßdurchlässigkeit) an.
CD4+-Lymphozyten hingegen (MHC-II-aktiviert) tragen zur Eliminierung extrazellulärer
Antigene bei: Sie helfen Phagozyten dabei,
Mikroben (oder infizierte Zellen) zu zerstören; sie aktivieren
B-Lymphozyten (Plasmazellen) zur Produktion von Antikörpern, die
extrazelluläre Antigene stoppen können; und sie regen Entzündungsvorgänge (vermehrte Durchblutung und Gefäßdurchlässigkeit) an.
Neben CD8+ und CD4+ T-Lymphozyten existieren einige weitere Untergruppen, wie natürliche Killer-T- oder γδ-T-Zellen.
CD4 ist der Membranrezeptor, an den HI-Viren binden
|
Der jeweils betreffende MHC-Weg und die Funktionsweise der dabei
aktivierten Lymphozytenart hängen eng miteinander zusammen; der für den Abbau mikrobieller Antigene jeweils effizienteste Mechanismus wird vorzugsweise genützt.
Die Rolle des Thymus: Positive und negative Selektion
Zu den Organen, die Lymphozyten in großer Zahl beherbergen und
beeinflussen, gehören Milz und Thymusdrüse (Bries). Epithel-, dendritische Zellen und Makrophagen
im Thymus ("epitheliale retikuläre Zellen") exprimieren MHC-Moleküle und steuern die Reifung von
Lymphozyten durch die Sekretion verschiedener Signalstoffe.
Vorläufer der T-Zellen entstehen im Knochenmark
und wandern in die Thymusdrüse ein ( Abbildung unten). Im Gegensatz zur Milz ("freier Eintritt") ist der Eintritt von Blutkörperchen in den Thymus restringiert; T-Zell-Vorläufer aus dem Knochenmark werden aber von thymischen Stoffen - z.B. Lymphotactin - angelockt.
Abbildung unten). Im Gegensatz zur Milz ("freier Eintritt") ist der Eintritt von Blutkörperchen in den Thymus restringiert; T-Zell-Vorläufer aus dem Knochenmark werden aber von thymischen Stoffen - z.B. Lymphotactin - angelockt.
In den Thymus eingewandert, nennt man T-Zell-Vorläufer Prothymozyten. Sind sie über die subkapsuläre Region in die Rindenzone gelangt, heißen sie Thymozyten (=Immunzellen im Thymus). Noch exprimieren sie weder CD4 oder CD8 (sie sind "doppelt negativ") noch CD3 oder T-Zell-Rezeptoren (TCR).
 Als CD3 bezeichnet
man einen T-Zell-Corezeptor, der zur Aktivierung von Helfer- (CD4+)
und/oder zytotoxischen (CD8+) Lymphozyten notwendig ist. Seine γ-, δ-
und ε-Ketten assoziieren mit dem T-Zell-Rezeptor sowie der ζ-Kette, und
dieser Komplex triggern ein Aktivierungssignal im Lymphozyten:
Phosphorylierung von ITAM an CD3 ermöglicht an der ζ-Kette die Bindung einer Kinase (ZAP70, zeta-assoziiertes Protein), die sich an der Aktivierung der Zelle beteiligt.
Als CD3 bezeichnet
man einen T-Zell-Corezeptor, der zur Aktivierung von Helfer- (CD4+)
und/oder zytotoxischen (CD8+) Lymphozyten notwendig ist. Seine γ-, δ-
und ε-Ketten assoziieren mit dem T-Zell-Rezeptor sowie der ζ-Kette, und
dieser Komplex triggern ein Aktivierungssignal im Lymphozyten:
Phosphorylierung von ITAM an CD3 ermöglicht an der ζ-Kette die Bindung einer Kinase (ZAP70, zeta-assoziiertes Protein), die sich an der Aktivierung der Zelle beteiligt.
Vielfache Signale von Epithel-,
Stroma-, dendritischen Zellen und Makrophagen im Thymus - insbesondere Thymosine - wirken auf die Thymozyten ein und steuern ihre weitere Entwicklung.
 Thymosine
Thymosine  ("Thymushormone"
- sie wirken an vielen Stellen im Körper, nicht nur im Thymus) sind
eine Gruppe genetisch und strukturell unterschiedlicher kleiner (1 bis
15 kDa) Peptide,
die (nach ihrer elektrophoretischen Wanderungsgeschwindigkeit) als α-, β-
und γ-Thymosine bezeichnet werden. Insbesondere das Thymosin β4 (Tβ4) beeinflusst - zusammen mit der spezifischen Umgebung (microenvironment) - Reifung, Differenzierung und Proliferation von T-Zellen.
("Thymushormone"
- sie wirken an vielen Stellen im Körper, nicht nur im Thymus) sind
eine Gruppe genetisch und strukturell unterschiedlicher kleiner (1 bis
15 kDa) Peptide,
die (nach ihrer elektrophoretischen Wanderungsgeschwindigkeit) als α-, β-
und γ-Thymosine bezeichnet werden. Insbesondere das Thymosin β4 (Tβ4) beeinflusst - zusammen mit der spezifischen Umgebung (microenvironment) - Reifung, Differenzierung und Proliferation von T-Zellen.
Thymosine

regen die Bildung von T-Zell-Vorläufern im roten Knochenmark an,

steuern die Differenzierung in Helfer-, regulatorische und zytotoxische T-Zellen (s. weiter
unten),

aktivieren reife T-Zellen in Lymphknoten und Milz,

regulieren die Aktivität verschiedener Zellen, beispielsweise fördert
Thymulin die Sekretion von GH, Prolaktin, ACTH, TSH und LH (endokrine Wirkungen).
Die Produktion der Thymosine sinkt mit zunehmendem Alter
(beginnend mit der Adoleszenz) und verharrt ab dem 4. Lebensjahrzehnt
(ab dem auch das Volumen der Thymusdrüse
deutlich verringert ist) auf einem niedrigen Niveau.
Die Thymusdrüse
bildet nicht nur Thymosine und Zytokine, sondern ist sowohl neural (cholinerg) als auch hormonell gesteuert. Thymusepithelzellen produzieren IL-7, das die Entwicklung von Thymozyten beinflusst.
Vorstufen von T-Zellen (Pro-T-Zellen, doppelt negative T-Zellen) vermehren sich im Thymus unter IL-7-Einfluss und bilden αβ-T-Rezeptoren, CD3-, CD4- und CD8-Moleküle (sie sind jetzt doppelt positiv und befinden sich in der Rindenzone des Thymus), weiters zusätzliche Rezeptoren und Adhäsionsmoleküle, die für
interzelluläre Erkennung sowie die Migration durch das Thymusstroma
wichtig sind.
Ähnlich wie B-Zellen im Knochenmark, durchlaufen die T-Zellen im Thymus ein etwa zwei Wochen dauerndes Ausleseverfahren, das ausreichende, aber nicht zu starke Peptiderkennung zum Ziel hat. Dazu
wandern die T-Zellen von der Rinde zum Mark (sie sind nunmehr einfach positiv - single positive SP, d.h. entweder CD4+ oder CD8+).
Die Bindungseigenschaften der neu entstandenen T-Zell-Rezeptoren werden nunmehr im Kontakt mit diversen antigenpräsentierenden Zellen - Thymus-Epithelzellen, Makrophagen, dendritische Zellen und B-Lymphozyten - durchgespielt.
 Um immunologisch brauchbar zu sein, müssen die Rezeptoren der (zunächst noch doppelt positiven) T-Zellen Komplexe aus Peptid und MHC antigenpräsentierender Zellen schwach bis mäßig stark binden. Können sie das, überleben sie (positive Selektion): Erkennung von Peptid auf MHC-I (Cofaktor CD8) ergibt eine reife CD8+ Zelle, Erkennung von Peptid auf MHC-II (Cofaktor
CD4) eine reife CD4+ Zelle (
Um immunologisch brauchbar zu sein, müssen die Rezeptoren der (zunächst noch doppelt positiven) T-Zellen Komplexe aus Peptid und MHC antigenpräsentierender Zellen schwach bis mäßig stark binden. Können sie das, überleben sie (positive Selektion): Erkennung von Peptid auf MHC-I (Cofaktor CD8) ergibt eine reife CD8+ Zelle, Erkennung von Peptid auf MHC-II (Cofaktor
CD4) eine reife CD4+ Zelle ( Abbildung).
Abbildung).
 Zellen, die Peptid-MHC-Komplexe nicht erkennen, sind nutzlos, werden nicht positiv selektioniert und werden zur Apoptose gebracht (death by neglect). Ist die Bindung zu stark, gefährden sie die eigenen Zellen (Autoimmunität!) und sterben ebenfalls apoptotisch ab (negative Selektion).
Zellen, die Peptid-MHC-Komplexe nicht erkennen, sind nutzlos, werden nicht positiv selektioniert und werden zur Apoptose gebracht (death by neglect). Ist die Bindung zu stark, gefährden sie die eigenen Zellen (Autoimmunität!) und sterben ebenfalls apoptotisch ab (negative Selektion).
 Gereifte einfach-positive Lymphozyten gelangen über das Endothel von
Thymus-Venolen als naive (immunkompetente, aber noch nicht durch
Antigenkontakt selektionierte) T-Zellen in den Kreislauf.
Gereifte einfach-positive Lymphozyten gelangen über das Endothel von
Thymus-Venolen als naive (immunkompetente, aber noch nicht durch
Antigenkontakt selektionierte) T-Zellen in den Kreislauf.

 Abbildung: Reifung und Selektion MHC-restringierter T-Zellen im Thymus
Abbildung: Reifung und Selektion MHC-restringierter T-Zellen im Thymus
Nach einer Vorlage bei Abbas / Lichtman / Pillai, Basic Immunology, 7th ed. Elsevier 2024
Die
Stärke der Bindung von Peptid-MHC-Komplexen durch unreife T-Zellen
entscheidet über ihr Schicksal: Entweder Entwicklung zu reifen einfach
positiven (CD4+ oder CD8+) T-Zellen (positive Selektion) oder Absterben
durch Apoptose (Nichterkennen oder zu starke Bindung des Peptid-MHC-Komplexes).
APC = antigenpräsentierende Zelle, TCR = T-Zell-Rezeptor
 Positive Selektion bedeutet, dass ein Thymozyt, der Peptid-MHC-Komplexe auf antigenpräsentierenden kortikalen Epithelzellen schwach bis mäßig stark bindet, überlebt und sich teilt. Der Sinn dieses
Mechanismus liegt darin, dass nur über eigene MHC-Rezeptoren präsentierte Peptide
vom TCR erkannt wird.
Positive Selektion bedeutet, dass ein Thymozyt, der Peptid-MHC-Komplexe auf antigenpräsentierenden kortikalen Epithelzellen schwach bis mäßig stark bindet, überlebt und sich teilt. Der Sinn dieses
Mechanismus liegt darin, dass nur über eigene MHC-Rezeptoren präsentierte Peptide
vom TCR erkannt wird.
Wird der betreffende Peptid-MHC-Komplex vom TCR nicht erkannt, durchläuft der Thymozyt rezeptorvermittelte Apoptose  (Reaktion Fas-FasL) und stirbt ab.)
(Reaktion Fas-FasL) und stirbt ab.)
Umgekehrt können die nunmehr einfach (CD4+ oder CD8+) positiven T-Zellen bei ihrem Eintritt in die Markzone des Thymus auch apoptotisch absterben, wenn die Bindungsstärke ihrer TCR an Peptid-MHC-Kojmplexe zu intensiv ist (negative Selektion). Solche Zellen sind potenziell autoreaktiv (z.B. Anregung von B-Zellen, Antikörper
gegen körpereigenes Eiweiß zu bilden oder von zytotoxischen T-Zellen,
eigene Zellen anzugreifen).
 Negative Selektion ist
die Eliminierung junger Lymphozyten, die stark selbstreaktive
Antigenrezeptoren exprimieren. Negative Selektion unterstützt
Selbsttoleranz, d.h. Ausbleiben eines immunologischen Angriffs auf körpereigene Moleküle.
Negative Selektion ist
die Eliminierung junger Lymphozyten, die stark selbstreaktive
Antigenrezeptoren exprimieren. Negative Selektion unterstützt
Selbsttoleranz, d.h. Ausbleiben eines immunologischen Angriffs auf körpereigene Moleküle.
Die Effizienz der negativen Selektion wird durch das von Zellen des Thymusmarks exprimierte Gen AIRE
erhöht. Das Gen codiert einen Transkriptionsfaktor, der
Moleküle entstehen lässt, die von Zellen außerhalb des Thymus
exprimiert werden; das unterstützt negative Selektion bzw. Toleranz
gegenüber zahlreichen auch nicht-thymischen "Selbst"-Peptiden.
 AIRE (Autoimmun-Regulator, autoimmune regulator) ist ein Protein, das in der Übergangszone Rinde-Mark des Thymus die Expression mehrerer tausend Arten gewebespezifischer Autoantigene in Epithelzellen anregt. Deren durch Wirkung von Proteasomen entstandenen Bruchstücke
werden MHC-I gekoppelt T-Zellen
präsentiert. Binden diese das Antigen, sterben sie durch Apoptose
(negative Selektion).
AIRE (Autoimmun-Regulator, autoimmune regulator) ist ein Protein, das in der Übergangszone Rinde-Mark des Thymus die Expression mehrerer tausend Arten gewebespezifischer Autoantigene in Epithelzellen anregt. Deren durch Wirkung von Proteasomen entstandenen Bruchstücke
werden MHC-I gekoppelt T-Zellen
präsentiert. Binden diese das Antigen, sterben sie durch Apoptose
(negative Selektion).
Funktioniert das nicht (AIRE-Gendefekt), resultieren (polyendokrine) Autoimmunkrankheiten.
Überlebenschance 1:30: Jeden Tag werden im Thymus ~60 Millionen T-Zellen getestet, nur ~2 Millionen bestehen den Test und
überleben. Aus dem Ausleseprozess gehen nur 1-5% als
reife T-Lymphozyten hervor, die das Thymusmark über Venolen verlassen.
95 bis 99% bestehen den Selektionsprozess nicht und gehen apoptotisch zugrunde.
Einige andere Lymphozyten verlassen den Thymus vor der Selektion, z.B. als
γδ-T-Zellen:
Im Thymus entwickeln sich (neben T-Zellen mit αβ-Rezeptoren) auch T-Zellen mit γδ-TCR, die über CD3 verfügen und CD4 oder CD8 exprimieren
können, aber nicht müssen. Sie unterliegen nicht den für αβ-Zellen typischen Selektionsmechanismen und verlassen den Thymus kurz
nachdem sie ihre Rezeptoren exprimiert haben. Man hält sie für eine
Übergangsform - Zellen zwischen dem angeborenen und adaptiven
Immunsystem. Sie entwickeln sich ontogenetisch früh (vor αβ-Lymphozyten)
und wandern vorwiegend in Haut, Respirationstrakt und Peritonealraum.
Ihr Antigen-Erkennungsrepertoire ist wesentlich kleiner als das der αβ-Zellen, sie entwickeln kein immunologisches Gedächtnis, aber sie reagieren rascher auf Antigenkontakt als αβ-T-Zellen.
Auch NKT-Zellen entwickeln sich (zumindest
teilweise) im Thymus (im Gegensatz zu NK-Zellen), und sie exprimieren
TC-Rezeptoren, die durch DNA-Umgruppierung entstehen. Diese Rezeptoren
haben ein sehr begrenztes Repertoire und binden vorwiegend Lipide,
Glykolipide und einige Peptide.
Welche Reaktionen ruft die Bildung von TCR-Peptid-MHC-Komplexen aus? Diese können - je nach Umständen bzw. Umgebung (microenvironment) - sehr verschieden ausfallen:
 Positive Selektion (Thymusrinde)
Positive Selektion (Thymusrinde)
 Negative Selektion (Thymusmark)
Negative Selektion (Thymusmark)
 Aktivierung anderer Zellen (Peripherie).
Aktivierung anderer Zellen (Peripherie).
Der Unterschied liegt vielleicht in der Intensität der
Interaktion zwischen TCR und Peptid-MHC-Komplex sowie in der Tatsache,
dass die beteiligten Zellen über jeweils unterschiedliche Adhäsions- und costimulatorische Moleküle verfügen:
 Kortikale Epithelzellen
Kortikale Epithelzellen für die MHC-Restriktion (positive Selektion)
 Medulläre dendritische
Medulläre dendritische (aus dem Knochenmark stammende) und
medulläre Epithelzellen für die Toleranzprüfung (negative Selektion)
 antigenpräsentierende
antigenpräsentierende Zellen für die
Aktivierung im lymphatischen Gewebe.
Immunkompetente (aber noch naive) T-Zellen verlassen den Thymus. Es sind Helferzellen (Th), regulatorische (TReg) oder zytotoxische Zellen (TC):
 Helferzellen (CD4+, Th-Zellen) sezernieren Zytokine
Helferzellen (CD4+, Th-Zellen) sezernieren Zytokine  , welche andere Lymphozyten anregen;
, welche andere Lymphozyten anregen;
 Zytotoxische Zellen (CTL, CD8+, TC-Zellen) zerstören virusinfizierte, Tumor- und Fremdzellen;
Zytotoxische Zellen (CTL, CD8+, TC-Zellen) zerstören virusinfizierte, Tumor- und Fremdzellen;
 Regulatorische Zellen (TReg) - früher auch Suppressorzellen - hemmen Induktion und Proliferation von Effektorzellen (Th, TC).
Regulatorische Zellen (TReg) - früher auch Suppressorzellen - hemmen Induktion und Proliferation von Effektorzellen (Th, TC).
Diese "reifen" Zellen verlassen den Thymus und wandern in sekundäre
lymphatische Organe ein (Lymphknoten, Milz, Peyer-Plaques, etc).
Anschließend werden sie fallweise in den Kreislauf entlassen und nehmen
von dort aus ihre spezifischen Funktionen wahr.
T-Zell-Aktivierung, klonale Expansion und Kontraktion
Im Thymus entstehen Klone spezifischer Lymphozyten, deren Rezeptoren jeweils ein ganz bestimmtes Epitop
erkennen (s. oben). Dies sind zunächst naive T-Lymphozyten (mit fertig ausgebildeten Rezeptoren, die aber noch nie ihr
Antigen gesehen haben). Sie kreisen in einem Ruhezustand (resting state)
durch den Körper und gelagen dabei in T-Lymphozyten-Zonen sekundärer (peripherer)
lymphatischer Organe - angelockt durch Chemokine, die auch antigenpräsentierende Zellen hierher führen (die Zellen exprimieren CCR7-Rezeptoren).
Sekundäre lymphatische Organe sind
 Lymphknoten
Lymphknoten (detektieren Antigene aus dem Gewebe),
 Milz
Milz (detektieren Antigene im Blut),
 muköse lymphatische
muköse lymphatische Gewebe (detektieren Antigene auf Schleimhäuten).
Dabei werden die T-Zellen hauptsächlich durch ein retikuläres Netzwerk von
Fibroblasten geleitet. Hier ist die Wahrscheinlichkeit
relativ hoch, dass sie Antigene antreffen, die von reifen dendritischen
Zellen präsentiert werden; und hier werden sie hauptsächlich aktiviert. Die Aktivierung naiver T-Zellen erfordert die Präsentation des passenden Antigens durch dendritische Zellen (Abbildungen).
Treffen sie dabei auf "ihr" Antigen - den Erstkontakt eines naiven
Lymphozyten (T-Helfer-Zell-Vorfahren) mit "seinem" Antigen bezeichnet
man als priming -, bleiben sie an diesem Kontaktpunkt
hängen und starten einen Aktivierungsvorgang, bei dem sie ihre volle
Funktionsfähigkeit erlangen. Es kommt zu Zytokinsekretion, Proliferation (Klonerweiterung, clonal expansion) und Differenzierung der naiven Zellen zu Effektor- und Gedächtniszellen ( Abbildung).
Abbildung).


Abbildung: Aktivierung von T-Zellen
Nach einer Vorlage bei Abbas / Lichtman / Pillai, Basic Immunology, 7th ed. Elsevier 2024
Naive
T-Zellen erkennen Peptid-MHC-Komplexe auf antigenpräsentierenden
Zellen. T-Zellen bilden darauf hin Interleukin 2 (IL2) und
exprimieren IL2-Rezeptoren. Das führt zu Proliferation (Wachstum und
Vermehrung) der T-Zellen und Vergrößerung betreffender Lymphozytenklone
(Klonexpansion).
Ein Teil der Zellen der betreffenden Lymphozytenklone entwickeln sich zu Effektorzellen, andere zu Gedächtniszellen
Differenzierte Effektor-T-Zellen reagieren auch auf Antigene, die von anderen als dendritischen Zellen präsentiert werden:
 Präsentieren B-Lymphozyten Antigene, bilden Helfer-T-Zellen Zytokine und regen die B-Zellen an;
Präsentieren B-Lymphozyten Antigene, bilden Helfer-T-Zellen Zytokine und regen die B-Zellen an;
 Makrophagen präsentieren Antigene an CD4+-T-Zellen und lassen sich von diesen stimulieren;
Makrophagen präsentieren Antigene an CD4+-T-Zellen und lassen sich von diesen stimulieren;
 praktisch alle kernhaltigen Zellen präsentieren Antigene an CD8+-T-Zellen (und werden von diesen abgetötet, wenn sie z.B. virale Antigene präsentieren).
praktisch alle kernhaltigen Zellen präsentieren Antigene an CD8+-T-Zellen (und werden von diesen abgetötet, wenn sie z.B. virale Antigene präsentieren).
 Erkennt und bindet der
T-Zell-Rezeptor (TCR) ein Antigen in Kombination mit MHC, kommt es
damit noch nicht zur Weiterleitung eines Signals in die Zelle. Dazu
bedarf es weiterer Faktoren, sogenannter Costimulatoren:
Erkennt und bindet der
T-Zell-Rezeptor (TCR) ein Antigen in Kombination mit MHC, kommt es
damit noch nicht zur Weiterleitung eines Signals in die Zelle. Dazu
bedarf es weiterer Faktoren, sogenannter Costimulatoren:
 CD3- und ζ (Zeta)- Proteine, die zusammen mit dem Rezeptor einen TCR-Komplex bilden. Diese Faktoren sind für den Start einer Signalübermittlung unverzichtbar, wenn der Rezeptor ein Antigen gebunden hat.
CD3- und ζ (Zeta)- Proteine, die zusammen mit dem Rezeptor einen TCR-Komplex bilden. Diese Faktoren sind für den Start einer Signalübermittlung unverzichtbar, wenn der Rezeptor ein Antigen gebunden hat.
 Weitere Oberflächenproteine
- Adhäsionsmoleküle, Corezeptoren, Costimulatoren - sowie Zytokine komplettieren die Aktivierung / Proliferation zu Effektor- und
Gedächtnis- T-Zellen. Ein solcher Costimulator auf aktivierten
antigenpräsentierenden Zellen ist B7, er bindet an CD28 auf T-Zellen
(
Weitere Oberflächenproteine
- Adhäsionsmoleküle, Corezeptoren, Costimulatoren - sowie Zytokine komplettieren die Aktivierung / Proliferation zu Effektor- und
Gedächtnis- T-Zellen. Ein solcher Costimulator auf aktivierten
antigenpräsentierenden Zellen ist B7, er bindet an CD28 auf T-Zellen
( Abbildung). Die Kombination CD28 mit dem Antigensignal ist für
Überleben und Proliferation entsprechender T-Zellen erforderlich.
Abbildung). Die Kombination CD28 mit dem Antigensignal ist für
Überleben und Proliferation entsprechender T-Zellen erforderlich.
Diese komplizierten Vorgänge sollen
sicherstellen, dass T-Zellen nicht "versehentlich" aktiviert werden.


Abbildung: Rolle von Costimulatoren bei der Aktivierung von T-Lymphozyten
Nach einer Vorlage in in Strachan / Read, Human Molecular Genetics, 5th ed. 2020 (CRC Press)
Antigenpräsentierende Zellen exprimieren im "Ruhezustand" kaum Costimulatoren und lassen
naive T-Zellen ungereizt. Werden sie durch Mikroben oder Zytokine angeregt, dann
exprimieren sie Costimulatoren, wie B7-Moleküle und aktivieren (über CD28 des Lymphozyten) z.B. naive T-Zellen.
αβ-T-Zell-Rezeptoren erkennen MHC-1- präsentierte zelleigene
Peptidbruchstücke (Antigen). CD8 der (zytotoxischen) T-Zelle bindet an
MHC-I und nimmt so an der gegenseitigen Erkennung der Zellen teil.
Die Anhaftung der Zellen aneinander wird u.a. durch LFA1-ICAM-Brücken (s. unten) etabliert
 Die TNF-Superfamilie (TNFSF)
Die TNF-Superfamilie (TNFSF)
ist eine große Familie homologer Transmembran-Proteine. Diese
regulieren Wachstum, Differenzierung, Genexpression und Apoptose. Dazu
binden sie an Mitglieder der
TNF-Rezeptor-Superfamilie (TNFRSF), ebenfall eine große Gruppe transmembranaler Proteine.
CD40 aktiviert Makrophagen (zelluläre Abwehr) und B-Zellen (humorale Abwehr). Sind Helfer-(CD4+)
T-Zellen aktiviert, exprimieren sie CD40L, und dieses aktiviert über
CD40 antigenpräsentierende Zellen zur Expression von B7 und Sekretion
von Zytokinen. Dies regt die Differenzierung von T-Lymphozyten an
( Abbildung).
Abbildung).
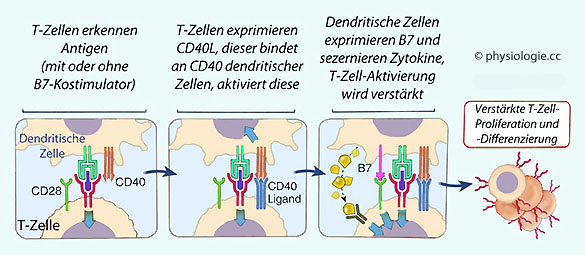

Abbildung: Costimulation - CD40 und T-Zell-Aktivierung
Nach einer Vorlage in Abbas / Lichtman / Pillai: Cellular and Molecular Immunology, 9th ed. 2018
Aktivierte T-Zellen exprimieren den Liganden für CD40 (CD40L), wenn sie Antigen erkennen und Costimulatoren vorhanden sind.
Das regt antigenpräsentierende (z.B. dendritische) Zellen über deren CD40-Rezeptoren an:
Sie exprimieren B7 und bilden Zytokine, die wiederum die T-Zelle anregen

 Effektor-Lymphozyten sind bereit für den Einsatz überall im
Gewebe. Hier treffen sie auf Antigene, die ihre Aktivierung ausgelöst
haben. Sie können Zellen direkt zerstören (CD8+) und/oder
andere Immunzellen stimulieren, z.B. Makrophagen, B-Zellen oder
Granulozyten.
Effektor-Lymphozyten sind bereit für den Einsatz überall im
Gewebe. Hier treffen sie auf Antigene, die ihre Aktivierung ausgelöst
haben. Sie können Zellen direkt zerstören (CD8+) und/oder
andere Immunzellen stimulieren, z.B. Makrophagen, B-Zellen oder
Granulozyten.
Um diese Funktionen vollführen zu können, müssen Effektorzellen eine ganze Reihe verschiedener
Oberflächenmoleküle exprimieren. Bei Helferzellen (CD4
+) sind das:
 CD29 - binnen Stunden exprimieren T-Zellen dieses Protein, das über
seinen Bindungspartner (Sphingosin-1-Phosphat Rezeptor) die
Verweildauer der T-Zelle im lymphatischen Organ verlängert, was Zeit
für Proliferation und Differenzierung bringt;
CD29 - binnen Stunden exprimieren T-Zellen dieses Protein, das über
seinen Bindungspartner (Sphingosin-1-Phosphat Rezeptor) die
Verweildauer der T-Zelle im lymphatischen Organ verlängert, was Zeit
für Proliferation und Differenzierung bringt;
 CD25 (IL-2-Rezeptor) - dadurch können T-Zellen auf Interleukin 2 reagieren;
CD25 (IL-2-Rezeptor) - dadurch können T-Zellen auf Interleukin 2 reagieren;
 CD40-Ligand - hier dauert die Expression 1-2 Tage (
CD40-Ligand - hier dauert die Expression 1-2 Tage ( Abbildung), ebenso für
Abbildung), ebenso für
 CD152;
CD152;
 Adhäsionsmoleküle und Chemokinrezeptoren.
Adhäsionsmoleküle und Chemokinrezeptoren.


Abbildung: Expression von Oberflächenmolekülen nach Aktivierung von T-Zellen
Nach einer Vorlage in Abbas / Lichtman / Pillai: Cellular and Molecular Immunology, 9th ed. 2018
Oben:
Beispielhafter Zeitverlauf des Erscheinens einiger Marker in
antigenstimulierten T-Zellen. c-Fos ist ein Transkriptionsfaktor, IL-2
ein Zytokin, CD-Faktoren Oberflächenproteine. Naive T-Zellen
exprimieren diese Moleküle nur geringgradig.
Unten: Hauptfunktion einiger Oberflächenproteine
 Abbildung unten).
So kann dann zum Höhepunkt der
Immunantwort etwa jede dritte CD8-positive T-Zelle spezifisch gegen den
betreffenden Antikörper wirken, also zum selektierten Klon gehören.
Abbildung unten).
So kann dann zum Höhepunkt der
Immunantwort etwa jede dritte CD8-positive T-Zelle spezifisch gegen den
betreffenden Antikörper wirken, also zum selektierten Klon gehören.
 Klonale Expansion ist die 103- bis 105-fache
Vermehrung der Zahl von Lymphozyten (B / T) im Körper, die ein
bestimmtes Antigen erkennen. Sie erfolgt in lymphatischem Gewebe.
Klonale Expansion ist die 103- bis 105-fache
Vermehrung der Zahl von Lymphozyten (B / T) im Körper, die ein
bestimmtes Antigen erkennen. Sie erfolgt in lymphatischem Gewebe.
Homöostase: Nachdem das Antigen eliminiert ist, nimmt die Zahl
entsprechend spezialisierter T-Zellen - hauptsächlich bedingt durch Apoptose antigenaktivierter T-Zellen - wieder ab (klonale Kontraktion, clonal contraction,  Abbildung).
Das liegt daran, dass durch die Beseitigung der Antigene auch der
anregende Reiz (durch Antigen, Costimulatoren und Zytokine) wieder
wegfällt. Dazu kommen inhibitorische Mechanismen (z.B. TReg-Lymphozyten), die im Rahmen der
Antigenerkennung aktiv werden.
Abbildung).
Das liegt daran, dass durch die Beseitigung der Antigene auch der
anregende Reiz (durch Antigen, Costimulatoren und Zytokine) wieder
wegfällt. Dazu kommen inhibitorische Mechanismen (z.B. TReg-Lymphozyten), die im Rahmen der
Antigenerkennung aktiv werden.

 Abbildung: Klonale Expression und Kontraktion von T-Lymphozyten
Abbildung: Klonale Expression und Kontraktion von T-Lymphozyten
Nach einer Vorlage in Abbas / Lichtman / Pillai: Cellular and Molecular Immunology, 9th ed. 2018
Der
spezifische Lymphozytenklon expandiert für eine Woche, anschließend
wird er allmählich auf eine Größe reduziert, die dem Pool der
Gedächtniszellen entspricht. Die Infektion ist nach einer Woche
abgeklungen.
Zeitachse nichtlinear
Hat ein spezifischer Abwehrprozess stattgefunden, verfügt der Organismus über einen spezifischen (adaptiven) Immunschutz
(s. weiter unten): Wesentlich mehr auf ein bestimmtes Antigen
spezialisierte Gedächtniszellen (in Haut, Schleimhäuten und lymphoiden
Organen) als ursprünglich - vor der Klonselektion - naive T-Zellen mit
dem entsprechenden T-Rezeptor-Besatz vorhanden waren.
Gedächtniszellen (memory cells)
eines speziellen Lymphozytenklons bleiben für Jahre oder sogar
lebenslang bestehen, nachdem der entsprechende Antigenstimulus
stattgefunden hat. Sie haben ein anderes Schicksal als Effektorzellen,
die bald nach Ablauf der Immunantwort wieder verschwinden.
Zu den besonderen Merkmalen von Gedächtniszellen zählt:
 Sie
Sie exprimieren
antiapoptotische Proteine, was zu ihrer hohen Überlebenszeit beiträgt. Bei älteren Menschen sind mehr als 50% der T-Zellen im Blut Gedächtniszellen.
 Sie reagieren rascher auf das Auftauchen "ihres" Antigens als entsprechende naive T-Zellen. Wahrscheinlich spielen dabei epigenetische Umstellungen eine Rolle.
Sie reagieren rascher auf das Auftauchen "ihres" Antigens als entsprechende naive T-Zellen. Wahrscheinlich spielen dabei epigenetische Umstellungen eine Rolle.
 Nach Ablauf der Immunantwort und Klonexpansion liegen etwa 10- bis 100-fach mehr spezifische Gedächtnis- als naive T-Zellen des Zellklons vor.
Nach Ablauf der Immunantwort und Klonexpansion liegen etwa 10- bis 100-fach mehr spezifische Gedächtnis- als naive T-Zellen des Zellklons vor.
 Gedächtniszellen begeben sich in das Gewebe und antworten bei weiterem
Antigenkontakt direkt am "Ort des Geschehens", und sind dort weniger
abhängig von Costimulierung als naive T-Zellen.
Gedächtniszellen begeben sich in das Gewebe und antworten bei weiterem
Antigenkontakt direkt am "Ort des Geschehens", und sind dort weniger
abhängig von Costimulierung als naive T-Zellen.
 Sie können replizieren, allerdings mit relativ niedriger Quote.
Sie können replizieren, allerdings mit relativ niedriger Quote.
 Ihre Erhaltung hängt von der Anwesenheit von Zytokinen (vor allem IL-7), nicht aber von der Anwesenheit des Antigens, ab.
Ihre Erhaltung hängt von der Anwesenheit von Zytokinen (vor allem IL-7), nicht aber von der Anwesenheit des Antigens, ab.
 Das Verhältnis der Zahlen von naiven zu Gedächtnis-T-Zellen im Kreislauf nimmt mit zunehmendem Alter kontinuierlich ab - von fast 100% naiven T-Lymphozyten bei Neugeborenen bis auf ~20% im höheren Alter.
Das Verhältnis der Zahlen von naiven zu Gedächtnis-T-Zellen im Kreislauf nimmt mit zunehmendem Alter kontinuierlich ab - von fast 100% naiven T-Lymphozyten bei Neugeborenen bis auf ~20% im höheren Alter.
T-Zell-Rezeptoren
 Zu Rezeptoren der adaptiven Abwehr s. dort, zur Rezeptordiversität s. auch dort
Zu Rezeptoren der adaptiven Abwehr s. dort, zur Rezeptordiversität s. auch dort
T-Lymphozyten
verfügen typischerweise über etwa 3.104 T-Zell-Rezeptoren (TCR, T cell receptors) an ihrer Oberfläche,
die typisch für aktivierende Rezeptoren auf Immunzellen sind (wie auch
Immunglobuline auf B-Zellen, Rezeptoren auf NK-Zellen, Fc-Rezeptoren
auf Eosinophilen und Mastzellen). TCR vermitteln bei ihrer Aktivierung ein Signal,
das an den Zellkern adressiert ist.
T-Zell-Rezeptoren ( Abbildung) bestehen aus zwei Proteinen (sie
sind heterodimer) - jeweils aus einer leichten (α oder γ) und einer schweren Kette (β oder δ):
Abbildung) bestehen aus zwei Proteinen (sie
sind heterodimer) - jeweils aus einer leichten (α oder γ) und einer schweren Kette (β oder δ):

 Abbildung: T-Zell-Rezeptor (TCR)
Nach einer Vorlage bei
Doan / Lievano / Swanson-Mungerson / Viselli, Immunology (3rd ed).
Lippincott Illustrated Reviews, Wolters Kluwer 2022
Abbildung: T-Zell-Rezeptor (TCR)
Nach einer Vorlage bei
Doan / Lievano / Swanson-Mungerson / Viselli, Immunology (3rd ed).
Lippincott Illustrated Reviews, Wolters Kluwer 2022
T-Lymphozyten
tragen TCR, kombiniert aus zwei Untereinheiten (im Bild α und β). Assoziiert ist ein CD3-Komplex (cluster of differentiation 3) für die intrazelluläre Signalübermitlung. Der CD3-Komplex enthält γ-, δ- und έ- (CD3) sowie ζ-Ketten (CD247).
TCR sind immer membrangebunden. Sie erkennen Antigenbruchstücke in Kombination
mit MHC-Molekülen (pMHC-Komplex), aber keine freien Antigene. CD4 oder CD8-Moleküle fungieren als Corezeptoren
 Der extrazelluläre Teil (N-Terminus) enthält je Kette zwei Domänen, eine (hyper-) variable (z.B. Vα und Vβ) und eine nichtvariable (constant, z.B. Cα und Cβ). An den (hyper)variablen Teil bindet das Antigen bzw. Epitop, im Gegensatz zu Antikörpern nicht mit zwei, sondern nur einer Bindungsstelle
Der extrazelluläre Teil (N-Terminus) enthält je Kette zwei Domänen, eine (hyper-) variable (z.B. Vα und Vβ) und eine nichtvariable (constant, z.B. Cα und Cβ). An den (hyper)variablen Teil bindet das Antigen bzw. Epitop, im Gegensatz zu Antikörpern nicht mit zwei, sondern nur einer Bindungsstelle
 Die
transmembranale Sequenz verankert den Rezeptor in der Zellmembran
Die
transmembranale Sequenz verankert den Rezeptor in der Zellmembran
 Die kurze intrazelluläre
Domäne (C-Terminus) ist mit einem signalübertragenden CD3-Komplex assoziiert.
Die kurze intrazelluläre
Domäne (C-Terminus) ist mit einem signalübertragenden CD3-Komplex assoziiert.
 Gelöste Antigene erkennen TCR
nicht (anders als B-Zell-Rezeptoren und Rezeptoren des angeborenen
Immunsystems).
Gelöste Antigene erkennen TCR
nicht (anders als B-Zell-Rezeptoren und Rezeptoren des angeborenen
Immunsystems).
"Traditionelle" TCR bestehen aus einer α- und einer β-Kette (αβ-TCRs),
wie die meisten T-Lymphozyten im Blut. Jede Kette enthält (wie
Immunglobuline) eine antigenbindende V- (mit jeweils drei
hypervariablen Anteilen) und eine C-Region.
Eine Subpopulation (<5% aller T-Zellen) exprimieren neben αβ-TCRs auch Oberflächenmoleküle, die für natürliche Killerzellen typisch sind, und werden daher natürliche Killer-T-Zellen (NKT-Zellen) genannt.
"Nicht-traditionelle" TCR bestehen aus einer γ- und einer δ-Kette (γ/δ-TCRs - 2-5% der T-Zellen im Blut, 5-10% im Körper).
Diese Zellen reagieren rasch, haben aber ein
relativ geringes Rezeptorrepertoire und
dienen u.a. der Erkennung konservierter mikrobieller Strukturen. γδ-T-Zellen
finden sich auf epithelialen Oberflächen (Haut, Darm) besonders häufig
und können hier die dominierende Lymphozytenpopulation sein.
 T-Zellen haben entweder α/β- oder γ/δ-TCR - niemals beide gleichzeitig.
T-Zellen haben entweder α/β- oder γ/δ-TCR - niemals beide gleichzeitig.
T-Zellen verfügen auch über Immun-Checkpoints,
das sind Rezeptoren, welche die Reaktion von T-Zellen an die
entsprechende Situation anpassen - anregen (proinflammatorische
Immuncheckpoints, z.B. CD27, 28, 40, 122, 137) oder dämpfen
(antiinflammatorische Immuncheckpoints, z.B. KIR - killer-cell immunoglobulin-like receptors, PD-1 - programmed cell death protein, TIM-3 - T-cell immunoglobulin and mucin-domain containing).
 Obwohl jede Ei- und jede Samenzelle nur jeweils 4 TCR-Gene enthält
(TRA, TRB, TRD, TRG), entstehen im Laufe der Ontogenese (individuellen Entwicklung)
unterschiedliche T-Zell-Klone mit unterschiedlichen
TCR. Die zugrunde liegenden DNA-Veränderungen erfolgen in zellspezifischer Weise.
Obwohl jede Ei- und jede Samenzelle nur jeweils 4 TCR-Gene enthält
(TRA, TRB, TRD, TRG), entstehen im Laufe der Ontogenese (individuellen Entwicklung)
unterschiedliche T-Zell-Klone mit unterschiedlichen
TCR. Die zugrunde liegenden DNA-Veränderungen erfolgen in zellspezifischer Weise.
TCR-Ketten bestehen aus jeweils einer variablen und einer konstanten (C) Region. Die variable Region wird von drei Arten wiederholter Gensequenzen codiert - angeordnet in einer variablen (variable, V für den Großteil der variablen Domäne), einer "Diversitäts"- (diversity, D) und einer "Verknüpfungs"- (joining, J) Region entsprechender Chromosomen ( Abbildung).
Abbildung).
 für α auf Chromosom 14 (45 V- und 55 J-Gene, Gesamtzahl der möglichen Kombinationen 2475)
für α auf Chromosom 14 (45 V- und 55 J-Gene, Gesamtzahl der möglichen Kombinationen 2475)
 für β auf Chromosom 7 (50 V-, 2 D-, 12 J-Gene, Gesamtzahl der möglichen Kombinationen 1200)
für β auf Chromosom 7 (50 V-, 2 D-, 12 J-Gene, Gesamtzahl der möglichen Kombinationen 1200)
 für γ auf Chromosom 7 (5 V-,5 J-Gene, Gesamtzahl der möglichen Kombinationen 25)
für γ auf Chromosom 7 (5 V-,5 J-Gene, Gesamtzahl der möglichen Kombinationen 25)
 für δ auf Chromosom 14 (2 V-, 3 D-, 4 J-Gene, Gesamtzahl der möglichen Kombinationen 24)
für δ auf Chromosom 14 (2 V-, 3 D-, 4 J-Gene, Gesamtzahl der möglichen Kombinationen 24)
Daraus ergeben sich fast 3 Millionen mögliche epitoperkennende α/β- und 600 γ/δ-TCR-Varianten.
Jede T-Zelle
(bzw. ihr Klon) hält an "ihrer" individuellen, nicht mehr abänderbaren Genkombination (und damit
der Epitopspezifität ihrer Rezeptoren) fest.
Die
V-Region jeder Kette hat jeweils drei hypervariable Regionen (CDR: complementarity-determining region), welche die Spezifität der Epitoperkennung ausmachen. Das individuelle Repertoire (also pro Person) beläuft sich auf etwa 6 Millionen Lymphozytenklone
mit jeweils spezifischem molekularem Muster - und damit Epitope, die
erkannt werden können. Insgesamt schätzt man die theoretisch mögliche Bandbreite in der Gesamtpopulation auf ~1018 T-Zell-Rezeptormuster.
 Zur somatischen Rekombination (Immunglobuline / T-Zell-Rezeptoren) s. auch dort
Zur somatischen Rekombination (Immunglobuline / T-Zell-Rezeptoren) s. auch dort
Aktivierung des TCR: Immunologische Synapse
T-Lymphozyten sind bei der Erkennung von Peptidantigenen auf die Mitwirkung antigenpräsentierender Zellen
angewiesen, denn diese "zeigen" der T-Zelle MHC-angelagerte Epitope aus
ihrem Proteinabbau (die Kombination eines präsentierten
Peptidbruchstücks und des MHC-Moleküls hat die Abkürzung pMHC - für peptide loaded on MHC). Durch spezifische Bindung entsteht ein TCR-Peptid-MHC-Komplex (TCR:pMHC). Dies ist aber nicht ausreichend, um einen entsprechenden T-Zell-Klon entstehen zu lassen. Um dies zu erreichen, müssen Komponenten des angeborenen (z.B. dendritische Zellen) mit solchen des adaptiven Immunsystems (Lymphozyten) eng kooperieren:
Moleküle
des angeborenen Systems liefern Impulse, die - zusätzlich zu Antigenen
- erforderlich sind, um naive B- und T-Zellen zu aktivieren. So kann
ein "Signal 1" ein mikrobielles Antigen sein, das an einen
lymphozytären Rezeptor bindet, und ein "Signal 2" Moleküle
(Costimulatoren), die als Antwort des angeborenen Systems auf die
Anwesenheit von Mikroben gebildet wurden und ebenfalls - über andere
Rezeptoren - an denselben Lymphozyten gekoppelt haben. Erst diese
komplexe Anregung führt zur Vermehrung und Differenzierung der
betreffenden Lymphozyten.
Wenn der T-Zell-Rezeptor einen passenden pMHC-Komplex gebunden
hat, versammeln sich an dieser interzellulären Kontaktstelle mehrere
membranständige sowie intrazelluläre Signalmoleküle (clustering). Diese als immunologische Synapse bezeichnete Struktur
 stabilisiert die Interaktion von antigenpräsentierender und T-Zelle,
stabilisiert die Interaktion von antigenpräsentierender und T-Zelle,
 ist Ausgangspunkt für die Signaltransduktion
in angeregten T-Zellen,
ist Ausgangspunkt für die Signaltransduktion
in angeregten T-Zellen,
 stellt die optimale Abfolge
und Kombination der spezifischen (z.B. Zytokinsekretion), zum Teil
aggressiven (z.B. Freisetzung von Perforin) Folgereaktionen sicher.
stellt die optimale Abfolge
und Kombination der spezifischen (z.B. Zytokinsekretion), zum Teil
aggressiven (z.B. Freisetzung von Perforin) Folgereaktionen sicher.
 Der Terminus immunologische Synapse
(SMAC: supramolecular activation cluster,
Der Terminus immunologische Synapse
(SMAC: supramolecular activation cluster,  Abbildung) bezieht sich auf die Summe der Membranproteine an Kontaktpunkten
zwischen einer antigenpräsentierenden und einer T-Zelle:
T-Zell-Rezeptor-Komplex, CD4 / CD8, Costimulatoren und costimulatorische Rezeptoren, Integrine der T-Zelle und
Integrinliganden der antigenpräsentierenden Zelle. Diese Faktoren sind
für die vollständige bidirektionale Kommunikation zwischen antigenpräsentierender Zelle und Lymphozyt notwendig und fördern die Sekretion z.B. des granulären Inhalts zytotoxischer T-Zellen.
Abbildung) bezieht sich auf die Summe der Membranproteine an Kontaktpunkten
zwischen einer antigenpräsentierenden und einer T-Zelle:
T-Zell-Rezeptor-Komplex, CD4 / CD8, Costimulatoren und costimulatorische Rezeptoren, Integrine der T-Zelle und
Integrinliganden der antigenpräsentierenden Zelle. Diese Faktoren sind
für die vollständige bidirektionale Kommunikation zwischen antigenpräsentierender Zelle und Lymphozyt notwendig und fördern die Sekretion z.B. des granulären Inhalts zytotoxischer T-Zellen.

 Abbildung: Immunologische Synapse
Abbildung: Immunologische Synapse
Nach einer Vorlage bei
Doan / Lievano / Swanson-Mungerson / Viselli, Immunology (3rd ed).
Lippincott Illustrated Reviews, Wolters Kluwer 2022
Eine
naive CD4-positive T-Zelle (unten) kontaktiert eine
antigenpräsentierende Zelle (APC, oben). Ihre Adhäsionsmoleküle - LFA-1
( CD11a:CD18) - binden ICAM-1 (leukocyte function antigen,immune cell adhesion molecule, CD54) der APC. Die so entstandenen LFA-ICAM- Komplexe entfernen sich vom pMHC:TCR:CD4-Komplex (blaue Pfeile).
Gleichzeitig
bewegen sich CD2:LFA-3-
Komplexe und costimulatorische Komplexe (wie CD28:CD80 oder 86) zum
pMHC:TCR:CD4-Komplex; auch CD28:CD80-Brücken sowie CD4 nähern sich ihm
(blaue Pfeile). Die entstandenen Molekülbrücken zwischen
antigenpräsentierender und T-Zelle verändern ihre Plätze relativ zum
TCR-pMHC-Komplex, was für die Aktivierung von ITAMs bedeutsam ist (s.
unten).
Diese Vorgänge spielen sich bei der Übermittlung des sogenannten ersten Signals ab, das für die Anregung naiver T-Zellen zu Proliferation und Differenzierung notwendig, aber nicht ausreichend ist.
Rotbraun: Präsentiertes Peptid (pMHC-II)
An T-Zell-Rezeptoren erfolgt - im Gegensatz zur Reifung von
Antikörpern - keine antigenselektionierte somatische Hypermutation, sodass die Bindungsstärke an den
MHC-Peptid-Komplex etwa so groß ist wie bei primären Immunglobulinen, also vor einer Affinitätsreifung (Affinitätskonstante 105-107
l/M). Die Affinität des TCR zum MHC-Peptid-Komplex reicht für eine
verlässliche Interaktion zwischen T-Zelle und Zielzelle meist nicht
aus. Es braucht eine zusätzliche Verstärkung der interzellulären
Kontaktnahme. Diese erfolgt durch Adhäsionsproteine, akzessorische Rezeptoren, die nicht variabel (nicht "spezifisch") sind.
Senden solche Adhäsionsproteine auch intrazelluläre Signale aus, spricht man von Corezeptoren. CD4
und CD8 sind solche Corezeptoren der Lymphozyten,
sie binden an nichtpolymorphe Regionen des MHC-Moleküls an der
dendritischen bzw. Zielzelle. Sie tragen zur Erkennung der "richtigen"
Zelle bei und erleichtern die Signalwirkung aktivierter
T-Zell-Rezeptorkomplexe während
der T-Zell-Aktivierung. T-Zellen exprimieren weiters CD28,
das bei der Bildung immunologischer Synapsen an CD80- oder
CD86-Moleküle antigenpräsentierender Zellen bindet ( Abbildung).
Abbildung).
Corezeptoren sind für die Klassenrestriktion (MHC-I / MHC-II) der T-Zellen verantwortlich. CD4
ist monomer und bindet an MHC-II und wird von Lymphozyten, Thymozyten
und (mit niedriger Dichte) mononukleären Phagozyten sowie einigen
dendritischen Zellen exprimiert. HIV nützen CD4 für den Eintritt in Zellen. CD8 liegt meist als Dimer vor, es bindet an MHC-I.
Zusätzlich sezerniert die aktive T-Zelle IL2, das auf zelleigene
IL2-Rezeptoren wirkt (Selbstverstärkung, Anregung der Proliferation).
 Bindet die T-Zelle lediglich den
MHC-Komplex (ohne Costimulatoren), wird sie anerg, also funktionslos.
Bindet die T-Zelle lediglich den
MHC-Komplex (ohne Costimulatoren), wird sie anerg, also funktionslos.
Die
Formierung immunologischer Synapsen löst auch Seitwärtsbewegung von
Adhäsionsmolekülen in der Membran der T-Zelle aus ( Abbildung oben). Einige dieser
Moleküle tragen an ihrem zytoplasmatischen Ende ITAMs (immunoreceptor tyrosin-based activation motifs,
Abbildung oben). Einige dieser
Moleküle tragen an ihrem zytoplasmatischen Ende ITAMs (immunoreceptor tyrosin-based activation motifs,  Abbildung). Wenn diese aneinanderrücken, lösen sie Signalvorgänge in der Zelle aus. Die zytoplasmatischen Enden des
CD3-Komplexes tragen ITAMs (nicht hingegen die zytoplasmatischen Enden
der TCR). Regulatorische Membranproteine wie
ITAMs und ITIMs (immunoreceptor tyrosin-based inhibition motifs)
werden innerhalb von Sekunden bis
Minuten nach Bindung des Antigens durch Kinasen der Src-Familie
(Nicht-Rezeptor-Kinasen) phosphoryliert und dadurch aktiviert
(Interaktion mit Zielproteinen wie z.B. die lymphozytenspezifische
Tyrosinkinase ZAP-70 (zeta-chain associated protein kinase 70) für ITAMs oder Phosphatasen für ITIMs).
Abbildung). Wenn diese aneinanderrücken, lösen sie Signalvorgänge in der Zelle aus. Die zytoplasmatischen Enden des
CD3-Komplexes tragen ITAMs (nicht hingegen die zytoplasmatischen Enden
der TCR). Regulatorische Membranproteine wie
ITAMs und ITIMs (immunoreceptor tyrosin-based inhibition motifs)
werden innerhalb von Sekunden bis
Minuten nach Bindung des Antigens durch Kinasen der Src-Familie
(Nicht-Rezeptor-Kinasen) phosphoryliert und dadurch aktiviert
(Interaktion mit Zielproteinen wie z.B. die lymphozytenspezifische
Tyrosinkinase ZAP-70 (zeta-chain associated protein kinase 70) für ITAMs oder Phosphatasen für ITIMs).

 Abbildung: Moleküle für die Aktivierung von CD4+-T-Zellen
Abbildung: Moleküle für die Aktivierung von CD4+-T-Zellen
Nach einer Vorlage in Abbas / Lichtman / Pillai: Cellular and Molecular Immunology, 9th ed. 2018
CD8+-Zellen
(sie erkennen MHC-I-assoziierte Peptide) nutzen die meisten der
gezeigten Moleküle ebenfalls.
Die T-Zelle wird nur dann vollständig aktiviert, wenn zusätzliche Faktoren (Costimulatoren) binden.
ITAMs regen die Signaltransduktion an,
ITIMshemmen sie
B7 = CD80/86, ζ = zeta
 Die Aktivierung einer T-Zelle ist ein kritischer Vorgang, denn sie kann
den Untergang von ihr angegriffener Zellen bedeuten. Es ist daher nicht
verwunderlich, dass dieser Vorgang mehrfach abgesichert ist.
Der gegenseitige Erkennungsmechanismus ist komplex und zusätzlich abgesichert. Man unterscheidet in der molekularen Abfolge ein "erstes Signal"
- das für die Stimulierung einer naiven T-Zelle notwendig, aber
noch nicht ausreichend ist - von einem darauf folgenden "zweiten Signal"
(das in Wirklichkeit aus mehreren Signalen besteht) durch einen oder
mehrere costimularorische(n) Faktor(en). Beide Signale initiieren
intrazelluläre Wirkkaskaden, die über einen oder mehrere
Transkriptionsfaktor(en) die Ablesung betreffender Gene auslösen. Erst
das Zusammentreffen beider Signale führt zu einer vollständigen
Aktivierung, Differenzierung und Klonbildung (Selektion) des
betreffenden T-Lymphozyten.
Die Aktivierung einer T-Zelle ist ein kritischer Vorgang, denn sie kann
den Untergang von ihr angegriffener Zellen bedeuten. Es ist daher nicht
verwunderlich, dass dieser Vorgang mehrfach abgesichert ist.
Der gegenseitige Erkennungsmechanismus ist komplex und zusätzlich abgesichert. Man unterscheidet in der molekularen Abfolge ein "erstes Signal"
- das für die Stimulierung einer naiven T-Zelle notwendig, aber
noch nicht ausreichend ist - von einem darauf folgenden "zweiten Signal"
(das in Wirklichkeit aus mehreren Signalen besteht) durch einen oder
mehrere costimularorische(n) Faktor(en). Beide Signale initiieren
intrazelluläre Wirkkaskaden, die über einen oder mehrere
Transkriptionsfaktor(en) die Ablesung betreffender Gene auslösen. Erst
das Zusammentreffen beider Signale führt zu einer vollständigen
Aktivierung, Differenzierung und Klonbildung (Selektion) des
betreffenden T-Lymphozyten.
Die resultierende Komplexbildung (pMHC:TCR:CD) bewirkt ein erstes Signal in die T-Zelle über CD3, das an diesen Komplex angelagertet ist. TCR benötigen an ihrer
intrazellulären Seite Hilfsfaktoren (γ, δ, ε, ζ), die das intrazelluläre Signal generieren und als CD3-Komplex
zusammengefasst werden. Die CD3- und ζ-Proteine sind nicht-kovalent mit dem αβ-Heterodimer des T-Zell-Rezeptors verbunden und bilden zusammen den TCR-Komplex ( Abbildung).
Abbildung).
 Abbildung: T-Zell-Rezeptor-Aktivierung, CD4 bindet an MHC II
Abbildung: T-Zell-Rezeptor-Aktivierung, CD4 bindet an MHC II
Nach einer Vorlage in Kumar / Abbas / Fausto / Aster,
Robbin and Cotran's Pathological Basis of Disease, 8th ed. Saunders /
Elsevier 2010
CD4-T-Zellen werden von antigenpräsentierenden Zellen über phagozytierte / verarbeitete Peptide vermittels MHC II-Moleküle informiert (MHC-Restriktion). Angelagerter
CD3-Komplex sowie ζ-Ketten triggern aktivierende Signale, sie sind in allen T-Zellen ident. CD4 (oder
stattdessen CD8 im Fall von MHC-I, s. unten) und CD28 sind an der
T-Zell-Aktivierung beteiligt.
Im Falle
der Anwesenheit eines passenden Antigenpeptids führt die Anlagerung des
MHC-II-Moleküls (antigenpräsentierende Zelle) an den
T-Zell-Rezeptor-Komplex
("Signal 1") - ergänzt durch die Kopplung von CD80 (=B7-1) oder CD86
(=B7-2) an ein CD28 ("Signal 2") - zur Aktivierung des Lymphozyten.
Sowohl das MHC-II-Molekül als auch die meisten der T-Zell-Rezeptoren (~95%) bestehen aus je einer α- und einer β-Kette
 Die Erkennung von peptidbeladenem MHC (pMHC) durch T-Zell-Rezeptoren (TCR) CD4- und CD8-positiver Lymphozyten aktiviert die immunologische Synapse und vermittelt das "erste Signal". Die TCR "sehen" ausschließlich auf MHC-Molekülen gebundene Peptide (Antigenbruchstücke - MHC-Restriktion).
CD4+-T-Zellen sind
MHC-II-restringiert, CD8+
Die Erkennung von peptidbeladenem MHC (pMHC) durch T-Zell-Rezeptoren (TCR) CD4- und CD8-positiver Lymphozyten aktiviert die immunologische Synapse und vermittelt das "erste Signal". Die TCR "sehen" ausschließlich auf MHC-Molekülen gebundene Peptide (Antigenbruchstücke - MHC-Restriktion).
CD4+-T-Zellen sind
MHC-II-restringiert, CD8+-T-Zellen (meist) MHC-I-restringiert.
Diese Interaktion ist relativ schwach und wird durch die Zusatzfaktoren CD4 / CD8
verstärkt, die an "konstante" (nicht peptidbindende) Sequenzen der MHC-Moleküle koppeln.
Aktivierungssignale treten in der T-Zelle nur auf, wenn sowohl das
MHC-Allel als auch das präsentierte Peptid mit dem TCR zusammenpassen. Ist das der Fall, verstärkt sich das Signal durch
Clustering mehrerer TCR.
Dieses Signal kann Aktivierung, bei fehlender Anregung durch
Costimulation aber auch
Anergie oder Apoptose der T-Zelle bedeuten.
Zum Vergleich: B-Zell-Rezeptoren (BCR)
binden extrazelluläre, "native" (nicht-prozessierte) Antigene - das können beliebige
organische Moleküle sein (auch Kohlenhydrate und Fette) - alleine, ohne
MHC. In der Tiefe eines Antigens verborgene Epitope können auf diese
Weise allerdings nicht erkannt werden. Und: BCR durchlaufen somatische Hypermutation - TCR tun dies nicht.

Über Rezeptoren der
Immunglobulin-Superfamilie s. auch
dort
Immunologische Toleranz wird durch regulatorische Lymphozyten (Treg) gefördert; Ziel ist die Inaktivierung autoreaktiver Lymphozyten.
Bei
der Aktivierung von T-Lymphozyten spielen neben TCR-Komplex einerseits
und peptidbeladenem MHC andererseits noch weitere Moleküle eine
wichtige Rolle. So beteiligen sich
 auf der Seite des CD4+-Lymphozyten CD4, CD3, ζ-Proteine, CTLA-4 (cytotoxic T lymphocyte antigen-4) und PD-1 (programmed death 1) an der Signaltransduktion,
auf der Seite des CD4+-Lymphozyten CD4, CD3, ζ-Proteine, CTLA-4 (cytotoxic T lymphocyte antigen-4) und PD-1 (programmed death 1) an der Signaltransduktion,
 auf der Seite der antigenpräsentierenden Zelle B7 (für CD28 und CTLA-4) und PD-L (programmed death ligand) für den Coinhibitor PD-1 (programmed cell death protein 1) an der Signalübertragung auf die T-Zelle.
auf der Seite der antigenpräsentierenden Zelle B7 (für CD28 und CTLA-4) und PD-L (programmed death ligand) für den Coinhibitor PD-1 (programmed cell death protein 1) an der Signalübertragung auf die T-Zelle.
Dabei tragen CD3 und ζ-Proteine mit ITAMs zur Aktivierung, PD-1 mit ITIMs zur Inhibierung der Signalwege bei (s. weiter unten).
LFA-1 (leukocyte function-associated antigen 1) auf lymphozytärer, ICAM-1 (intercellular adhesion molecule 1) auf der Seite der antigenpräsentierenden Zelle dienen der Anhaftung.
T-Zell-Molekül
|
Funktion
|
Ligand
|
Wer exprimiert?
|
CD3
|
Signaltransduktion
|
-
|
-
|
ζ (zeta)
|
Signaltransduktion durch TCR-Komplex
|
-
|
-
|
CD4
|
Signaltransduktion |
MHC-II
|
Dendritische (antigenpräsentierende) Zelle
|
CD8
|
Signaltransduktion |
MHC-I
|
Alle kernhaltigen Zellen
|
CD28
|
Signaltransduktion (Costimulation)
|
B7 =
CD80/86
|
Dendritische (antigenpräsentierende) Zelle |
CD40L
|
Proliferation / Differenzierung der T-Zelle
Aktivierung DC
|
CD40
|
Antigenpräsentierende Zelle |
CTLA-4
|
Inhibition
|
B7 =
CD80/86
|
Antigenpräsentierende Zelle |
PD-1
|
Inhibition |
PD-L
|
Antigenpräsentierende Zelle
Hämatopoetische Zellen
Gewebezellen (Tumorzellen)
|
LFA-1
|
Inhibition |
ICAM-1
|
Antigenpräsentierende Zelle
Endothelzellen
|
Wie die Folgereaktionen des "ersten Signals" strukturiert sind, zeigt die folgende  Abbildung:
Abbildung:

 Abbildung: Transduktion des "ersten Signals" in einem CD4+-Lymphozyten
Abbildung: Transduktion des "ersten Signals" in einem CD4+-Lymphozyten
Nach einer Vorlage bei
Doan / Lievano / Swanson-Mungerson / Viselli, Immunology (3rd ed).
Lippincott Illustrated Reviews, Wolters Kluwer 2022
1: Der T-Zell-Rezeptor (α/β TCR) eines CD4+-Lymphozyten
(unten) erkennt ein auf MHC II sitzendes Peptid (pMHCII, rotbraun)
einer antigenpräsentierenden Zelle (oben, nur pMHCII gezeigt)
2: CD4 stabilisiert diesen Komplex, indem es sich (nicht-kovalent) an eine nicht-peptidbindende Region des MHCII anlagert
3: Das aktiviert eine Tyrosinkinase (LCK, lymphocyte-specific protein tyrosine kinase), ITAMs (immunoreceptor tyrosin-based activation motifs) am zytoplasmatischen Ende von CD3-Molekülen zu phosphorylieren (P)
4: Die Tyrosinkinase ZAP-70 dockt an phosphorylierte ITAMs an und phosphoryliert ihrerseits u.a. Phospholipase (PLC-γ)
5: PLC-γ spaltet PIP2 zu DAG und IP3
6: IP3 (Insotitoltriphosphat) triggert die Freisetzung von Calciumionen aus dem endoplasmatischen Retikulum, und Ca++ zusammen mit DAG (Diacylglycerol) aktiviert
Proteinkinase C (PKC) und die Proteinphosphatase Calcineurin
7: PKC prosphoryliert IκB (inhibitor of NF-κB), woraufhin er vom Transkriptionsfaktor NF-κB dissoziiert und dessen Aktivität freigibt. NF-κB ist ein Proteinkomplex, der besonders in proliferierenden Zellen, z.B.
Immunzellen, aktiv ist. Er bindet an eine Sequenz von ~10 Basenpaaren
der DNA (κB-Motiv) und verstärkt meist die Transkription. Calcineurin
dephosphoryliert NFAT (nuclear factor of activated T cells). Beide Transkriptionsfaktoren (NF-κB und NFAT) wandern zum Zellkern und aktivieren dort Gene
8: ZAP-70 phosphoryliert auch LAT (linker of activation for T cells), welche die GEFs (guanin nucleotide exchange factors) ras und rac aktiviert
9: ras und rac schalten die Phosphorylierungskaskade ein, die den Transkriptionsfaktor AP-1 (activator protein 1) aktiviert
Erkennung des Antigens durch den T-Zell-Rezeptor führt zu Gruppierung (Clustering) von T-Zell-Rezeptorkomplexen mit Corezeptoren (hier: CD4). Eine mit diesem assoziierte Protein-Tyrosinkinase (Lck) phosphoryliert daraufhin Tyrosinreste in ITAMs von CD3 und ζ-Proteinen.
Der Spaltraum zwischen antigenpräsentierender und T-Zelle beträgt im
zentralen Bereich etwa 15 nm (Zellmembran: 4-10 nm).
ZAP-70 (ζ-associated protein of 70 kD) bindet an Phosphotyrosinreste an ζ-Ketten und wird selbst phosphoryliert und aktiviert. Dann phosphoryliert es Tyrosinreste an verschiedenen Proteinen, u.a. LAT (Linker for activation of T cells).
Phosphorylierte Adapterproteine binden Signalmoleküle und bilden
Zentren für die Anlagerung verschiedener Enzyme, wie die Phospholipase
GLCγ1 und Faktoren des MAP-Kinase-Weges. Die Enzyme aktivieren und koordinieren darauf folgende Reaktionen des T-Lymphozyten.
Ein zweites Signal
zur endgültigen Aktivierung der T-Zelle wird durch costimulatorische
Faktoren bewirkt, die dem naiven Lymphozyten sozusagen klarmachen, dass
tatsächlich Gefahr im Verzug ist ( Abbildung) und auch Information über die Art der erforderlichen adaptiven Immunantwort vermitteln - z.B. bei Mikroben in der Zelle: zellulär, bei extrazellulären Mikroben: humoral.
Abbildung) und auch Information über die Art der erforderlichen adaptiven Immunantwort vermitteln - z.B. bei Mikroben in der Zelle: zellulär, bei extrazellulären Mikroben: humoral.


Abbildung: Da "zweite Signal" zur definitiven Aktivierung eines CD4
+-Lymphozyten
Nach einer Vorlage bei
Doan / Lievano / Swanson-Mungerson / Viselli, Immunology (3rd ed).
Lippincott Illustrated Reviews, Wolters Kluwer 2022
Die
Costimulierung ist für das endgültige "Scharfmachen" des Lymphozyten
notwendig. Nachdem die immunologische Synapse gesichert hergestellt
wurde (s. oben), dephosphoryliert das Leukozytenantigen CD45 und
aktiviert Fyn, eine Tyrosin-Proteinkinase.
Das costimulatorische CD28 und Fyn aktivieren daraufhin zusammen mit IP3-Kinase (PI3K) die GTPase Ras, was eine (zweite) Kaskade von Phosphorylierungen / Aktivierung und Genablesung einleitet - AP-1 (activator protein 1) ist ein Transkriptionsfaktor
Solche CD4-positiven Th0-Zellen
können sich verschieden weiterentwickeln - je nach dem Zytokincocktail,
den antigenpräsentierende Zellen (nach Maßgabe der jeweiligen
mikrobiellen Herausforderung) produzieren und auf die Th0-Zellen
einwirken lassen:
 Bei Anwesenheit bakterieller Lipopolysaccharide sezernieren antigenpräsentierende Zellen vor allem IL-12. Durch den Einfluss von IL-12 und IFN-γ entwickeln sich Th0-Zellen zu Th1-Zellen (IL-12
und IFN-γ hemmen gleichzeitig die Bildung von Th2). Diese rekrutieren /
aktivieren daraufhin Phagozyten oder zytotoxische T-Zellen.
Bei Anwesenheit bakterieller Lipopolysaccharide sezernieren antigenpräsentierende Zellen vor allem IL-12. Durch den Einfluss von IL-12 und IFN-γ entwickeln sich Th0-Zellen zu Th1-Zellen (IL-12
und IFN-γ hemmen gleichzeitig die Bildung von Th2). Diese rekrutieren /
aktivieren daraufhin Phagozyten oder zytotoxische T-Zellen.
 Durch den Einfluss von IL-4 entwickeln sich Th0-Zellen zu Th2-Zellen
(IL-4 hemmt gleichzeitig die Bildung von Th1). Th2-Zellen reagieren auf
die Anwesenheit von Pathogenen, indem sie B-Lymphozyten dazu anregen,
zu Plasmazellen (Antikörperproduktion) oder Gedächtniszellen zu werden,
und sie rekrutieren eosinophile und basophile Granulozyten.
Durch den Einfluss von IL-4 entwickeln sich Th0-Zellen zu Th2-Zellen
(IL-4 hemmt gleichzeitig die Bildung von Th1). Th2-Zellen reagieren auf
die Anwesenheit von Pathogenen, indem sie B-Lymphozyten dazu anregen,
zu Plasmazellen (Antikörperproduktion) oder Gedächtniszellen zu werden,
und sie rekrutieren eosinophile und basophile Granulozyten.
 Sehen sich antigenpräsentierende Zellen mit bakteriellen oder Pilzpathogenen konfrontiert, produzieren sie IL-6, IL-21 und TGF-β. Durch deren Einfluss entwickeln sich Th0-Zellen zu Th17-Zellen, die neutrophile Granulozyten zum Abwehrort rekrutieren und antimikrobielle Reaktionen auslösen.
Sehen sich antigenpräsentierende Zellen mit bakteriellen oder Pilzpathogenen konfrontiert, produzieren sie IL-6, IL-21 und TGF-β. Durch deren Einfluss entwickeln sich Th0-Zellen zu Th17-Zellen, die neutrophile Granulozyten zum Abwehrort rekrutieren und antimikrobielle Reaktionen auslösen.
Metabolische Veränderungen in aktivierten Lymphozyten: Die Energiegewinnung ruhender T-Zellen erfolgt im Wesentlichen oxidativ, d.h. über den Zitratzyklus (aus 1 mol Glucose werden 36 mol ATP gewonnen, der Abbau erfolgt bis zum CO2). Bei Aktivierung und Proliferation
schaltet die Zelle auf anaerobe Glykolyse um: Aus 1 M Glucose werden
nur 4 mol ATP gewonnen (es entsteht Laktat), Glucose wird für die
Biosynthese von Aminosäuren und Proteinen, Nukleotiden und Lipiden
genutzt.
Limitierte Aktivitätsperiode von Lymphozyten. Sind T-Zellen aktiviert, wandert CD152 (=CTLA4, cytotoxic T lymphocyte antigen-4) in die äußere Zellmembran und bindet an CD80/85 mit einer hohen Avidität (102-mal
höher als CD28). Die Aktivierung von CD152 hemmt ihrerseits die Bildung
von Interleukin 2-Rezeptoren, sodass die Wirkung der T-Zelle selbstlimitiert
ist. Verschwindet der Antigenreiz, stellt auch die T-Zelle ihre
Aktivität ein. (Einige Zellen des Klons werden zu Gedächtniszellen.)
Außer CD152 wirkt PD-1 (programmed cell death protein 1) als Coinhibitor. PD-1 wird von aktivierten CD4+ / CD8+-Zellen hinaufreguliert, was ebenfalls die Immunantwort limitiert. PD-1 bindet PD-L1 oder PD-L2 (programmed death ligand) und blockiert weitere Signalübertragung über den TCR.

 Abbildung: CD4 bindet an MHC II in Kombination mit TCR
Nach einer Vorlage bei Parham P, The Immune System, 2nd ed, Garland Science 2005
Abbildung: CD4 bindet an MHC II in Kombination mit TCR
Nach einer Vorlage bei Parham P, The Immune System, 2nd ed, Garland Science 2005
CD4-positive Lymphozyten regulieren die Antwort anderer Immunzellen auf die Anwesenheit von Pathogenen (Antigen: rot)
Zytotoxische T-Lymphozyten exprimieren im Allgemeinen den Cofaktor CD8,
Helferzellen hingegen CD4. Dadurch wird adäquate Erkennung der
entsprechenden Peptide (intra- oder extrazellulär?) ermöglicht. Dabei
binden

CD4-Rezeptoren an CD3-TCR-(Helferzelle)-MHC-II-Peptid-Komplexe (

Abbildung)

CD8-Rezeptoren an CD3-TCR-(Killerzelle)-MHC-I-Peptid-Komplexe (

Abbildung).
CD-Corezeptoren haben intrazelluläre Signalwirkungen, welche
diejenigen der TCR verstärken. Immunologische Synapsen (s. oben) sind
das Interface zwischen antigenpräsentierender Zelle und
Lymphozyt (z.B. Effektor-T-Zelle oder NK-Zelle). Zu den Aufgaben
immunologischer Synapsen gehören
 Regulierung der Lymphozytenaktivierung
Regulierung der Lymphozytenaktivierung
 Übertragung von Peptid-MHC-Komplexen von antigenpräsentierenden Zellen auf Lymphozyten
Übertragung von Peptid-MHC-Komplexen von antigenpräsentierenden Zellen auf Lymphozyten
 Sekretion von Zytokinen / lytischen Granula
Sekretion von Zytokinen / lytischen Granula
 Abbildung: CD8 bindet an α3-Domäne eines MHC I
Nach einer Vorlage bei Parham P, The Immune System, 2nd ed, Garland Science 2005
Abbildung: CD8 bindet an α3-Domäne eines MHC I
Nach einer Vorlage bei Parham P, The Immune System, 2nd ed, Garland Science 2005
CD8-positive
T-Zellen töten mit Pathogenen infizierte oder Tumorzellen ab. Sie
werden mittels ihres Rezeptors (blau) über die Anwesenheit
intrazellulärer Antigene (rot) informiert, die von Zielzellen prozessiert wurden. Die Antigene sind an MHC I (gelb) angelagert
Helfer-T-Zellen
werden in mehreren Schritten aktiviert. Zuerst erfolgt die Anlagerung
von antigenpräsentierenden Zellen über deren MHC-II-Rezeptor an den
TCR. Dann erfolgt eine Bindung von Cofaktoren. Bei der Aktivierung von
B-Zellen sind dies CD40 - CD40L, bei der Aktivierung von T-Zellen CD28 - B7.
Aktivierte Helferzellen produzieren zahlreiche Zytokine. Auf diese
Weise kommunizieren sie mit dem gesamten Immunsystem. Dabei produziert
eine T-Zelle nicht alle Zytokine gleichzeitig, sondern jeweils eine
Gruppe davon für verschiedene Schwerpunkte der Funktion.
Dementsprechend unterscheidet man Th1-, Th2- und Th17- Lymphozyten ( s.
unten).
s.
unten).
Diese Einteilung ist bis zu einem gewissen Grad willkürlich,
denn die Flexibilität ist viel größer: Helferzellen verhalten sich
sozusagen situationslogisch.
 Dabei entscheiden dendritische Zellen
darüber, welches Zytokinprofil die Helferzelle in welcher
Situation genau produzieren soll.
Dabei entscheiden dendritische Zellen
darüber, welches Zytokinprofil die Helferzelle in welcher
Situation genau produzieren soll.
 Paul Ehrlich
gilt als Begründer der modernen Immunologie. 1897 publizierte er seine
"Seitenkettentheorie", derzufolge Antikörper auf der Oberfläche von
Immunzellen Antigene erkennen, und deren Anwesenheit die Zellen zur
verstärkten Bildung von Antikörpern anregt - ein damals hypothetisches
Konzept, solche Moleküle waren noch nicht nachweisbar. Ehrlich ging von einer chemischen Reaktion aus, indem zelluläre
"Seitenketten" (Makromoleküle) in der Lage sind, Gifte zu binden, und
von den Zellen auch sezerniert werden können (Antikörper). Auch nahm er
weitere Immunmoleküle zwischen Antigen und Antikörper an (Komplement).
Ehrlich erhielt 1908 zusammen mit Ilja Metschnikow den Nobelpreis für Physiologie oder Medizin.
Zelluläre
Hormonrezeptoren wurden Jahrzente später entdeckt, Antigenrezeptoren
auf Lymphozyten erst in den frühen 1980-er Jahren.
Paul Ehrlich
gilt als Begründer der modernen Immunologie. 1897 publizierte er seine
"Seitenkettentheorie", derzufolge Antikörper auf der Oberfläche von
Immunzellen Antigene erkennen, und deren Anwesenheit die Zellen zur
verstärkten Bildung von Antikörpern anregt - ein damals hypothetisches
Konzept, solche Moleküle waren noch nicht nachweisbar. Ehrlich ging von einer chemischen Reaktion aus, indem zelluläre
"Seitenketten" (Makromoleküle) in der Lage sind, Gifte zu binden, und
von den Zellen auch sezerniert werden können (Antikörper). Auch nahm er
weitere Immunmoleküle zwischen Antigen und Antikörper an (Komplement).
Ehrlich erhielt 1908 zusammen mit Ilja Metschnikow den Nobelpreis für Physiologie oder Medizin.
Zelluläre
Hormonrezeptoren wurden Jahrzente später entdeckt, Antigenrezeptoren
auf Lymphozyten erst in den frühen 1980-er Jahren.


Abbildung: T-Zell-Rezeptor und die Erkennung eines Peptid-MHC-Komplexes
Nach einer Vorlage bei Abbas / Lichtman / Pillai, Basic Immunology, 7th ed. Elsevier 2024
Links:
Schema eines T-Zell-Rezeptors (TCR). Der antigenbindende Teil des
Rezeptors besteht aus den variablen (V) Domänen der α- und β-Ketten.
Mitte: Röntgenkristallographisch ermittelte Struktur des extrazellulären Anteils eines TCR.
Rechts:
Variabler Anteil eines TCR (oben), ein präsentiertes antigenes Peptid
(Mitte, gelb dargestellt), präsentierendes MHC-Molekül (unten). Das
Peptid ist in die durch die α-Ketten des MHC-Moleküls gebildete Grube eingelagert und kontaktiert mit einem Seitenarm die V-Region des lymphozytären Rezeptors

Zytotoxische (CD8+) T-Zellen (CTLs)
 Zytotoxische T-Lymphozyten (CTLs, Tc cells) töten körpereigene Zellen, die von Viren oder anderen intrazellulären Pathogenen befallen sind.
Zytotoxische T-Lymphozyten (CTLs, Tc cells) töten körpereigene Zellen, die von Viren oder anderen intrazellulären Pathogenen befallen sind.
Etwa 35% aller reifen CD3-positiven T-Zellen im Blut sind CD8-positiv (zytotoxische T-Zellen). CD8-Moleküle
auf der Oberfläche dieser Zellen erkennen peptidbeladene MHC I-Moleküle (pMHC I-Komplexe), welche die Anwesenheit intrazellulärer Bakterien oder Viren signalisieren können.
 Abbildung: Aktivierung CD8-positiver T-Zellen
Nach einer Vorlage bei
Doan / Lievano / Swanson-Mungerson / Viselli, Immunology (3rd ed).
Lippincott Illustrated Reviews, Wolters Kluwer 2022
Abbildung: Aktivierung CD8-positiver T-Zellen
Nach einer Vorlage bei
Doan / Lievano / Swanson-Mungerson / Viselli, Immunology (3rd ed).
Lippincott Illustrated Reviews, Wolters Kluwer 2022
Haben
antigenpräsentierende Zellen (APC) Mikroben phagozytiert und abgebaut,
präsentieren sie über MHC-II entsprechende Fremdpeptide an Lymphozyten.
Solche mit passenden (epitopspezifischen) Rezeptoren (TCR) lagern sich
an, es entstehen pMHC-TCR-Komplexe. Das löst ein "erstes Signal" in den
Lymphozyten aus (vgl. oben).
Angedockte Helferzellen (CD4+, oben) produzieren (nach Aktivierung) Interleukin 2 (IL-2). Haben benachbarte CD8+-Zellen
IL-2-Rezeptoren (IL2-R) exprimiert, erfahren sie durch die Bindung von
IL-2 an IL2-R ein "zweites Signal", das sie endgültig einsatzfähig
macht. Sie replizieren und bilden einen (epitopspezifischen)
Killerzellklon (unten)
Signal 1: Die Reifung einer CD8+-Zelle
mit passenden Rezeptoren wird dadurch ausgelöst, dass eine (infizierte)
antigenpräsentierende Zelle (mikrobielle) Peptide über pMHC-I
präsentiert (erstes Signal) und die CD8+-Zelle daraufhin IL-2-Rezeptoren exprimiert ( Abbildung).
Abbildung).
Signal 2: Andererseits stimuliert die Präsentation von Antigenen (z.B. nach der Phagozytose virusbefallener Zellen) an entsprechende CD4+-Zellen diese dazu, IL-2 zu produzieren. Dessen Bindung an Rezeptoren der CD8+-Zelle ergibt ein zweites Signal für die CD8+-Zelle.
Nun intensiviert die Interaktion mit der antigenpräsentierenden Zelle deren Expression von CD80/86 ( Abbildung). Dieses bindet an CD28 von Lymphozyten und regt die Differenzierung von CD8+-Zellen an. Diese werden zu "vollwertigen" zytotoxischen Zellen (CTL, cytotoxic T lymphocytes) mit Granula, die Perforin (womit angegriffene Zielzellen "durchlöchert" werden können) sowie Granzyme (Proteasen) enthalten.
Abbildung). Dieses bindet an CD28 von Lymphozyten und regt die Differenzierung von CD8+-Zellen an. Diese werden zu "vollwertigen" zytotoxischen Zellen (CTL, cytotoxic T lymphocytes) mit Granula, die Perforin (womit angegriffene Zielzellen "durchlöchert" werden können) sowie Granzyme (Proteasen) enthalten.
Überblick
Wie kann sich eine Zelle gegen mikrobiellen Befall wehren? Die meisten Körperzellen verfügen nicht über lysosomale mikrobizide Mechanismen, wie sie
Phagozyten haben; und diese nützten nicht, wenn die Viren im
Zytoplasma und damit für die Lysosomen unerreichbar sind. Das gilt auch
für phagozytierte Bakterien, die es schaffen, aus Phagosomen in das
Zytoplasma - und dadurch der Lyse - zu entkommen.
 Abbildung: Abfolge der CTL-vermittelten Lyse einer Zielzelle
Nach einer Vorlage in Abbas / Lichtman / Pillai: Cellular and Molecular Immunology, 9th ed. 2018
Abbildung: Abfolge der CTL-vermittelten Lyse einer Zielzelle
Nach einer Vorlage in Abbas / Lichtman / Pillai: Cellular and Molecular Immunology, 9th ed. 2018
Nachdem die CTL (Cytotoxic T-Lymphocyte, CD8+
zytotoxische T-Zelle) eine antigenpräsentierende Zielzelle (mit MHC-I)
erkannt hat und aktiviert wurde, exozytiert sie den Inhalt ihrer
Granula im Bereich der Kontaktstelle (immunologische Synapse), in der
weitere Kontaktmoleküle interagieren.
Die CTL kann sich anschließend wieder ablösen und weitere Zielzellen abtöten. Die Zielzelle stirbt durch Apoptose.
LFA = Leukocyte function-associated antigen, ICAM = Intercellular Adhesion Molecule
Der einzige
Ausweg ist das Abtöten der befallenen Zelle, denn damit verlieren die
Viren ihre Replikationsgrundlage. Diese Aufgabe übernehmen CD8-positive Lymphozyten (zytotoxische oder "Killer"-T-Zellen, CTLs, Cytotoxic T Lymphocytes), die auch virusbefallene Phagozyten eliminieren können. (Im Rahmen der angeborenen Abwehr übernehmen diese Aufgabe NK-Zellen).
T-Zellen sind selbsttolerant, attackieren aber virusinfizierte,
Tumorzellen oder Zellen, deren Zytoplasma mit Bakterien infiziert ist.
Zur spezifischen Erkennung nützen sie antigenspezifische Rezeptoren - im
Gegensatz zu NK-Zellen, die eine breite Palette stressinduzierter zellulärer Moleküle erkennen.
 Naive CD8+-T-Lymphozyten haben keine zelltötende Wirkung - diese entwickeln sie erst, wenn sie zu Effektorzellen aktiviert wurden. Wie erfolgt diese kritische Veränderung?
Naive CD8+-T-Lymphozyten haben keine zelltötende Wirkung - diese entwickeln sie erst, wenn sie zu Effektorzellen aktiviert wurden. Wie erfolgt diese kritische Veränderung?
CD8+-T-Zellen werden zu funktionsfähigen zytotoxischen T-Zellen durch den Einfluss
 aktivierter dendritischer Zellen (über MHC-I-gekoppelte Antigene z.B. viraler Herkunft sowie Costimulatoren) und von
aktivierter dendritischer Zellen (über MHC-I-gekoppelte Antigene z.B. viraler Herkunft sowie Costimulatoren) und von
 CD4+-T-Helferzellen (diese regen die CD8+-Zelle bei passendem MHC-Kontakt mittels Zytokinen an).
CD4+-T-Helferzellen (diese regen die CD8+-Zelle bei passendem MHC-Kontakt mittels Zytokinen an).
Das bedeutet, dass CD8+-T-Zellen für eine zytotoxische Funktion meist die Hilfe von Helfer- (CD4+-) T-Zellen
benötigen, die in ihrer Nachbarschaft - auf ein und derselben
antigenpräsentierenden Zelle - das antigene Peptid erkennen, gebunden
an MHC-II. (Die antigenpräsentierende Zelle exprimiert sowohl MHC-I als auch MHC-II.)
Die Differenzierungsschritte laufen ähnlich ab wie bei CD4+-T-Zellen.
 Dendritische Zellen sind meist nicht von Viren infiziert; woher nehmen
sie das zu präsentierende Antigen? Spezialisierte dendritische Zellen
endozytieren virusinfizierte Zellen oder Tumorzellen (oder Proteine),
transportieren daraus gewonnene Antigene in ihr Zytosol und
präsentieren sie über MHC-I an CD8+-Lymphozyten (Cross-presentation).
Dendritische Zellen sind meist nicht von Viren infiziert; woher nehmen
sie das zu präsentierende Antigen? Spezialisierte dendritische Zellen
endozytieren virusinfizierte Zellen oder Tumorzellen (oder Proteine),
transportieren daraus gewonnene Antigene in ihr Zytosol und
präsentieren sie über MHC-I an CD8+-Lymphozyten (Cross-presentation).
Zytotoxische (CD8+)
T-Lymphozyten kontrollieren solchermaßen alle kernhaltigen Zellen des
Körpers, ob sie infiziert sind und Fremdpeptide präsentieren (sie alle sind mit MHC-I ausgestattet).
Zytokine (IL-2, IL-12, IL-15, IL-21 - gebildet
von verschiedenen Lymphozyten und antigenpräsentierenden Zellen)
unterstützen die Reifung der CD8+-T-Zellen. CD4+-T-Helferzellen
verstärken weiters die Fähigkeit dendritischer Zellen, die
Differenzierung zytotoxischer T-Zellen zu fördern. Das geschieht u.a.
dadurch, dass dendritische Zellen Costimulatormoleküle exprimieren, die
dann mit Rezeptoren an den CD8+-T-Zellen interagieren. Dabei wird CD40 (auf antigenpräsentierenden Zellen) durch CD40-Liganden (auf Helferzellen) aktiviert. Und auch dendritische Zellen bilden Zytokine (IL-12, IL-15), die CD8+-T-Lymphozyten aktivieren.
 Einmal aktiviert, proliferieren die Killerzellen, bilden einen Klon, wandern aus dem Lymphknoten in die Blutbahn und von dort an die Stelle, wo sich infizierte Zellen
befinden. Killerzellen töten Zielzellen ab, die dieselben MHC-I-assoziierten
Antigene exprimieren, welche die Proliferation des betreffenden CD8+-Lymphozytenklons ausgelöst hat.
Einmal aktiviert, proliferieren die Killerzellen, bilden einen Klon, wandern aus dem Lymphknoten in die Blutbahn und von dort an die Stelle, wo sich infizierte Zellen
befinden. Killerzellen töten Zielzellen ab, die dieselben MHC-I-assoziierten
Antigene exprimieren, welche die Proliferation des betreffenden CD8+-Lymphozytenklons ausgelöst hat.
Reife Effektor-CD8+-T-Zellen bilden Zytokine - vor allem γ-Interferon zur Anregung der Phagozytose.
Weiters bilden und speichern sie in modifizierten Lysosomen -
sogenannten Granula - Granzyme und Perforin. Mit diesen können sie
virusinfizierte oder Tumorzellen abtöten.
Auch bei der Abstoßung transplantierten Gewebes spielen diese Mechanismen eine Schlüsselrolle.
Bei der Erkennung und Abtötung der Zielzellen spielt der Aufbau immunologischer Synapsen
eine wichtige Rolle: Der komplette Erkennungsvorgang
involviert - außer der Bindung zwischen lymphozytärem Rezeptor
einerseits, MHC-I und präsentiertem Peptid andererseits - CD8 (Bindung
an MHC-I) sowie die stabilisierende Interaktion von Integrinen,
insbesondere zwischen LFA-1 (Leukocyte function-associated antigen 1) des Lymphozyten und ICAM (Intercellular Adhesion Molecule) der
Zielzelle. Die "immunologische Synapse" nimmt eine ringförmige Gestalt
an, die es ermöglicht, aggressive Stoffe in den so entstandenen
separierten Spaltraum abzusondern, ohne dass diese in den umgebenden
Extrazellulärraum entweichen; stattdessen entfalten sie ihre
konzentrierte Wirkung an der Kontaktstelle zur Zielzelle.
 Abbildung: Mechanismus der Abtötung von Zielzellen der CTL
Nach einer Vorlage in Abbas / Lichtman / Pillai: Cellular and Molecular Immunology, 9th ed. 2018
Abbildung: Mechanismus der Abtötung von Zielzellen der CTL
Nach einer Vorlage in Abbas / Lichtman / Pillai: Cellular and Molecular Immunology, 9th ed. 2018
Die Eliminierung der Zielzellen erfolgt über zwei Hauptmechanismen:
Oben: Die CD8+-T-Zelle setzt Perforin-Granzym-Komplexe frei.
Der Perforinmechanismus bewirkt die Aufnahme von Granzymen in das
Zytoplasma der Zielzelle, was ihre Apoptose auslöst.
Unten: Aktivierte CD8+-T-Zellen exprimieren FasL (Fas-Ligand), der an Fas (fast apoptosis signal) der Zielzellen bindet
Der Mechanismus der Abtötung
der Zielzellen besteht in erster Linie in der Freisetzung zytotoxischer
Proteine aus der aktivierten T-Zelle und ihre Deponierung an der
Membran der Zielzelle ( Abbildung).
Abbildung).
Bindung des Antigens an den T-Zell-Rezeptor führt dabei zu
Umstrukturierung des Zytoskeletts: Dessen Organisationszentrum rückt in
die Nähe der Kontaktstelle mit der Zielzelle, die zytoplasmatischen
Granula werden entlang von Mikrotubuli zur ringförmigen "immunologischen Synapse" transportiert, angereichert, und dort ihr Inhalt exozytotisch freigesetzt.
Es dauert wenige Minuten, bis dieser Mechanismus greift, und auch wenn
die T-Zelle sich anschließend von der Kontaktstelle wieder löst, stirbt
die Zielzelle innerhalb der nächsten 2-6 Stunden durch Apoptose.
 Perforin-Granzym-Mechanismus: Die führenden Wirkstoffe, welche die T-Zelle freisetzt, sind Granzyme und Perforin (das gilt auch für NK-Zellen). Die lymphozytären Granula enthalten auch Serglycin, ein sulfatiertes Proteoglykan, das Granzyme und Perforin in einem inaktiven Zustand
hält, solange sie in den Granula gespeichert sind (und wahrscheinlich
nach Öffnung der Vesikel zum Rezeptor-Spaltraum hin die CD8+-T-Zelle schützt).
Perforin-Granzym-Mechanismus: Die führenden Wirkstoffe, welche die T-Zelle freisetzt, sind Granzyme und Perforin (das gilt auch für NK-Zellen). Die lymphozytären Granula enthalten auch Serglycin, ein sulfatiertes Proteoglykan, das Granzyme und Perforin in einem inaktiven Zustand
hält, solange sie in den Granula gespeichert sind (und wahrscheinlich
nach Öffnung der Vesikel zum Rezeptor-Spaltraum hin die CD8+-T-Zelle schützt).
 Perforin ist ein zytolytisches
Protein aus Granula zytotoxischer (CD8+)
T-Zellen und NK-Zellen, das nach deren
Degranulation die Membran von Zielzellen perforiert und Poren bildet
(
Perforin ist ein zytolytisches
Protein aus Granula zytotoxischer (CD8+)
T-Zellen und NK-Zellen, das nach deren
Degranulation die Membran von Zielzellen perforiert und Poren bildet
( Abbildung).
Es ist zum C9-Komplementfaktor homolog. Wie der
Eintritt der Wirkstoffe in die Zielzelle genau erfolgt, ist noch
unklar. Vielleicht bewirkt die Einlagerung der Perforinporen einen
Reparaturvorgang, über den dann die Enzyme letztlich in das Zytosol der
Zielzelle gelangen. Die Granzyme A, B und C sind
apoptoseauslösende Serin-Proteasen, sie
dringen durch Perforinporen in die angegriffene Zelle ein. Granzym B aktiviert Caspasen und leitet damit Apoptose ein.
Abbildung).
Es ist zum C9-Komplementfaktor homolog. Wie der
Eintritt der Wirkstoffe in die Zielzelle genau erfolgt, ist noch
unklar. Vielleicht bewirkt die Einlagerung der Perforinporen einen
Reparaturvorgang, über den dann die Enzyme letztlich in das Zytosol der
Zielzelle gelangen. Die Granzyme A, B und C sind
apoptoseauslösende Serin-Proteasen, sie
dringen durch Perforinporen in die angegriffene Zelle ein. Granzym B aktiviert Caspasen und leitet damit Apoptose ein.


Abbildung: Perforinmechanismus
Kombiniert nach Vorlagen in 78stepshealth.us und meddic.jp
Oben: Zytotoxische T-Zellen setzen auf entsprechende Reize hin - Ca++-getriggert
- aus Granula (modifizierten Lysosomen) Perforinmonomere frei, nachdem sie die
Angriffsstelle vom übrigen Extrazellulärraum durch Membrananlagerung
abgedichtet haben (selektive Attacke, Schutz benachbarter Zellen).
Unten: Die Monomere aggregieren in der Membran der Zielzelle - ebenfalls Ca++-getriggert - zu röhrenförmigen "Angriffskomplexen" (ähnlich dem Komplement-MAC), durch die u.a. Granzyme - kooperierende Proteasen aus den Granula zytotoxischer T-Zellen - in die Zelle eindringen (violetter Pfeil)

Jedenfalls aktivieren die Granzyme verschiedene Substratmoleküle, darunter Caspasen. Damit ist die Apoptose "eingeschaltet".
Es gibt noch einen zweiten Weg, die Apoptose zu aktivieren: Aktivierte CD8+-T-Zellen exprimieren Fas-Ligand, der an den - von vielen Zellen exprimierten - "Todesrezeptor" Fas (fast apoptosis signal) der Zielzellen bindet, was ebenfalls Caspase aktiviert.
Hat die CD8-positive T-Zelle den Angriff auf die Zielzelle vollbracht,
kann sie sich wieder von ihr ablösen (sie bleibt bei diesem Vorgang
unbeschädigt) und kann sich weiteren virusbefallenen oder Krebszellen
zuwenden.
Nach erfolgter Apoptose der Zielzellen werden die Bruchstücke von Makrophagen abgeräumt. Dabei wird auch virale DNA / RNA zerstört.
T-Zell-Erschöpfung:
Bleibt ein Antigen trotz Immunabwehr für längere Zeit im Körper präsent
- wie bei chronischer viraler Infektion -, kann es zu Abnahme der
Effektorfunktion zytotoxischer T-Zellen kommen (T cell exhaustion).
Dabei nimmt die Proliferation der zytotoxischen Zellen ab, sie bilden
weniger Interferon und zeigen sinkende Zytotoxizität. Das verringert
die gewebeschädigenden Nebenwirkungen der zellulären Abwehrmechanismen,
worin wahrscheinlich der evolutionäre Vorteil der T-Zell-Erschöpfung besteht.
CD4+-T-Lymphozyten
s. auch Abbildung oben
Etwa 65% aller CD3-positiven T-Zellen sind CD4-positiv. CD4-Moleküle
auf der Oberfläche dieser Zellen erkennen Teile von MHC II-Molekülen.
Man unterscheidet Helfer-T-Zellen und regulatorische T-Zellen:
Th1-Helferzellen  Th2-Helferzellen
Th2-Helferzellen  Th17-Helferzellen
Th17-Helferzellen  TFH-Helferzellen
TFH-Helferzellen  Treg-Zellen
Treg-Zellen
Th1-Zellen koordinieren zelluläre Immunität, Th2-Zellen unterstützen humorale Immunität, Th17-Zellen fördern entzündliche Veränderungen und die Abwehr von extrazellulären Pathogenen (inklusive Pilzen) durch neutrophile Granulozyten. Sie tun das durch Sekretion entsprechender Zytokine:

Subpopulationen CD4-positiver Lymphozyten

Modifiziert nach Ritter / Flower / Henderson / Loke / MacEwan / Rang, Rang & Dale's Pharmacology, 9th ed. Elsevier 2020
|
Zelltyp
|
Zytokintrigger
|
wichtigste produzierte Zytokine
|
Funktionen
|
Th0
|
IL-2
|
-
|
Vorläuferzelle
|
Th1
|
IL-2
|
INFγ
IL-2
TNF-α
|
"Zelluläre Immunität" Aktivieren Makrophagen,
CD8+-T-Zellen (CTL), NK-Zellen
Hemmen Th2-Reifung
|
Th2
|
IL-4
|
IL-4
IL-5
TGFD-ß
IL-10
IL-13
|
"Humorale Immunität"
Stimulieren Bildung von Plasmazellen
Aktivieren eosinophile Granulozyten
Hemmen Th1-Reifung
|
Th17
|
TGF-ß. IL-6, IL-21
|
IL-17
|
Spezialisierung von Th1
|
| Treg
|
IL-10 und TGF-ß oder FOX P3
|
IL-10
TGF-ß
|
Bremsen Immunantwort, verhindern Autoimmunität
|
Proliferierende CD4+- (Helfer-) T-Zellen entwickeln sich - angeregt durch antigenpräsentierende Zellen (hauptsächlich dendritische Zellen und Makrophagen) sowie andere Zellen (NK-Zellen, Mastzellen) - zu Spezialisten, die für die jeweilige Situation optimierte "Zytokin-Cocktails" bilden (vgl. Tabelle).

 Abbildung: Abfolge CD4+-T-Zell-vermittelter Immunantworten
Nach einer Vorlage in Abbas / Lichtman / Pillai: Cellular and Molecular Immunology, 9th ed. 2018
Abbildung: Abfolge CD4+-T-Zell-vermittelter Immunantworten
Nach einer Vorlage in Abbas / Lichtman / Pillai: Cellular and Molecular Immunology, 9th ed. 2018
CD4+-T-Zellen
erkennen in einem Lymphknoten mikrobielle Peptide, die von
dendritischen Zellen präsentiert werden. Sie teilen sich und werden zu
Effektorzellen. Diese gelangen in den Blutkreislauf und wandern in
infiziertes Gewebe. Hier binden sie Antigen, sezernieren Zytokine und
diese locken mehr Leukozyten an den Ort des Geschehens
Helferzellen aktivieren B-Lymphozyten, Makrophagen und dendritische Zellen. Ein Teil von ihnen verbleibt in lymphatischem Gewebe und hilft B-Zellen bei der Produktion von Antikörpern.
Zellen in der Nachbarschaft antigenstimulierter CD4+-Zellen im lymphatischen Organ (wo die Immunantwort getriggert wird) beeinflussen deren schrittweise Reifung:
Dendritische, NK- und Mastzellen präsentieren nicht nur Antigen,
sondern sezernieren auch Zytokine und Costimulatoren - in Abhängigkeit
von den Mikroben, denen sie ausgesetzt sind. Mit
anderen Worten: Mikroben steuern das Muster verschiedener
Immunfaktoren, die von antigenerkennenden Zellen exprimiert werden.
CD4+- Effektor-T-Zellen entwickeln sich aus naiven CD4+-Lymphozyten und kommen als mehrere Subsets vor,
die - auf Grund ihrer Expression von Chemokinrezeptoren und
Adhäsionsmolekülen - jeweils unterschiedliche Muster der Migration in
das Gewebe (homing) aufweisen.
Entsprechend dem Zytokinmuster, das sie erzeugen, unterscheidet man Th1-, Th2-, Th17-,
follikuläre (Tfh) Helferzellen - all dies sind Effektorzellen - sowie
regulatorische T-Lymphozyten (Treg-Zellen). Dabei gibt es
Überlappungen, und die Zuordnung einer T-Helferzelle zu einem
bestimmten Subset muss nicht eindeutig sein.
Die Ausdifferenzierung verschiedener T-Helferzellen aus
undifferenzierten Vorläufern wird über Zytokine orchestriert, die von
antigenpräsentierenden (und anderen) Zellen "situationslogisch"
sezerniert werden (Zytokincocktail), mit denen aber auch Lymphozyten wechselseitig ihre Differenzierung bzw. Wirkung steuern:

 Abbildung: Differenzierung CD4-positiver (Helfer-) T-Zellen
Abbildung: Differenzierung CD4-positiver (Helfer-) T-Zellen
Nach einer Vorlage bei
Doan / Lievano / Swanson-Mungerson / Viselli, Immunology (3rd ed).
Lippincott Illustrated Reviews, Wolters Kluwer 2022
Entwicklung naiver (Thp: T helper precursor) zu undeterminierten (Th0) zu differenzierten Zellen. Der letzte Schritt wird durch Zytokine gesteuert:
Bakterielle Lipopolysaccharide bringen antigenpräsentierende Zellen (APC) zur Sekretion von IL-12 und IFN-γ, dadurch entwickeln sich Th0- zu Th1-Zellen (IL-12
und IFN-γ hemmen die Bildung von Th2).
IL-4 induziert die Bildung von Th2-Zellen und hemmt die Bildung von Th1-Zellen.
Bei Anwesenheit bakterieller oder Pilzpathogene produzieren APC IL-6, IL-21 und TGF-β, dadurch entwickeln sich Th0-Zellen zu Th17-Zellen.
IL-4 hemmt die Entwicklung zu Th1-, IL-12 und IFN-γ die Entwicklung zu Th2-Zellen. Th1-Zellen (über IFN-γ) und Th2-Zellen (über IL-4 und IL-13) hemmen Th17-Zellen
Zytokincocktail: Die Kombination der von einer differenzierten Zelle erzeugten Zytokine hängt von Transkriptionsfaktoren
sowie von epigenetischen Veränderungen (Modifikationen am Chromatin -
Methylierung, Acetylierung u.a.) ab, welche die Zugänglichkeit zu den
betreffenden Genorten beeinflussen. Die Transkriptionsfaktoren werden
ihrerseits von Antigenrezeptoren, Costimulatoren und Zytokinrezeptoren
an der Oberfläche der Zelle aktiviert. Einmal festgelegt, bleibt der
betreffende "Zytokin-Cocktail" für den Lymphozytenklon erhalten. Dieser
fördert die Proliferation des eigenen Subsets, und kann die Entwicklung
von Zellen eines anderen Subsets behindern.
 Mikroben induzieren die Aktivierung von Lymphozyten-Subsets, der zu ihrer Bekämpfung am besten geeignet sind.
Mikroben induzieren die Aktivierung von Lymphozyten-Subsets, der zu ihrer Bekämpfung am besten geeignet sind.
Außer Zytokinen beeinflussen auch andere Faktoren
die Lymphozytenentwicklung, wie genetische Ausstattung, Zugänglichkeit
der DNA-Sequenzen (epigenetische Veränderungen), Antigenmenge,
Rezeptoraffinität für das Antigen, Costimulatoren, Art der
antigenpräsentierenden Zelle.
Th1- (TH1-) Helferzellen
 Th1-Helferzellen interagieren mit mononukleären Phagozyten und helfen ihnen, ihre Pathogene abzutöten.
Th1-Helferzellen interagieren mit mononukleären Phagozyten und helfen ihnen, ihre Pathogene abzutöten.
Sie bekämpfen intrazelluläre Pathogene, indem sie Phagozyten anregen und CD8
+-T-Zellen assistieren (
zellulär vermittelte Immunität).
Sie werden aktiv, wenn Mikroben von dendritischen Zellen, Makrophagen oder NK-Zellen phagozytiert wurden, und regen Makrophagen zur Abtötung der Mikroben an.


Abbildung: Entwicklung von Th1-Lymphozyten
Nach einer Vorlage in Abbas / Lichtman / Pillai: Cellular and Molecular Immunology, 9th ed. 2018
Dendritische
Zellen und Makrophagen bilden bei Mikrobenkontakt Interleukin 12, und
NK-Zellen Interferon-γ. Beide Zytokine aktivieren
Transkriptionsfaktoren (T-bet, STAT1, STAT4), diese fördern die
Verwandlung naiver CD4-positiver T-Zellen zu Th1-Zellen.
Th1-Zellen bilden Interferon-γ, das wiederum die Entwicklung von Th2- und Th17-Zellen hemmt
 Abbildung).
Abbildung).
Th1-Zellen hemmen die Th2-Zellreifung und setzen
Zytokine frei, vor allem γ-Interferon - das außer Makrophagen auch die Entwicklung von Th1-Zellen stimuliert - und einige Interleukine. Diese unterstützen die Bekämpfung von Viren oder
Bakterien, welche körpereigene Zellen infiziert haben, mobilisieren die spezifische Abwehr (zellulär und humoral) und unterstützen
entzündliches Geschehen (proinflammatorische Wirkung).
| Th1-Lymphozyten produzieren IFNγ und einige Interleukine
|
Ziel der Th1-Wirkung ist
die Phagozytose und Abtötung von Mikroben durch Makrophagen. Dabei kommt es zur Abtötung intrazellulärer Mikroben durch lysosomale Enzyme und Radikale (NO, ROS).
γ-Interferon hat mehrere weitere Wirkungen:
 Es stimuliert Gewebsmakrophagen zur Phagozytose intrazellulärer Bakterien / Protozoen, aktiviert die NO-Bildung (iNOS) zur Abtötung von Bakterien / Protozoen.
Es stimuliert Gewebsmakrophagen zur Phagozytose intrazellulärer Bakterien / Protozoen, aktiviert die NO-Bildung (iNOS) zur Abtötung von Bakterien / Protozoen.
 Es regt die Differenzierung naiver CD4+-Zellen zu Th1-Zellen an (diese können auch CD8+-zytotoxische T-Zellen steuern!) und hemmt gleichzeitig diejenige von Th2- und Th17-Zellen.
Es regt die Differenzierung naiver CD4+-Zellen zu Th1-Zellen an (diese können auch CD8+-zytotoxische T-Zellen steuern!) und hemmt gleichzeitig diejenige von Th2- und Th17-Zellen.
 Es regt die Expression von Proteinen (u.a. MHC) an, welche Antigenpräsentation und T-Zell-Aktivierung stimulieren.
Es regt die Expression von Proteinen (u.a. MHC) an, welche Antigenpräsentation und T-Zell-Aktivierung stimulieren.
 Es beeinflusst den Immunglobulin-Switch von B-Lymphozyten.
Es beeinflusst den Immunglobulin-Switch von B-Lymphozyten.
Defekte an Interferon-γ- oder IL-12-Rezeptoren erhöhen die Infektanfälligkeit gegenüber intrazellulären Mikroben, z.B. Mykobakterien.
Überaktivierung von Th1-Zellen kann Typ-4-Hypersensitivität hervorrufen.
Th2- (TH2-) Helferzellen
 Th2-Helferzellen unterstützen B-Zellen bei der Zellteilung, Differenzierung und Antikörperproduktion.
Th2-Helferzellen unterstützen B-Zellen bei der Zellteilung, Differenzierung und Antikörperproduktion.
Sie vermitteln Abwehrvorgänge (humoral und allergisch) gegen nicht phagozytierbare Erreger - Ektoparasiten,
Würmer (
Helminthen
)
durch eosinophile Granulozyten (Produktion von IgE) und Mastzellen, was Makrophagen triggert ("alternative" Makrophagenaktivierung im Gegensatz zur durch Interferon angeregten,  Abbildung). Dieser Mechanismus dient auch der Bekämpfung von Mikroben auf Schleimhäuten - unter anderem durch Erhöhung muköser Schleimbildung. Auch
wird die Gewebeheilung angeregt.
Abbildung). Dieser Mechanismus dient auch der Bekämpfung von Mikroben auf Schleimhäuten - unter anderem durch Erhöhung muköser Schleimbildung. Auch
wird die Gewebeheilung angeregt.

Abbildung: Funktion von Th2- und Tfh-Lymphozyten
Nach einer Vorlage in Abbas / Lichtman / Pillai: Cellular and Molecular Immunology, 9th ed. 2018
Naive CD4+-T-Zellen
differenzieren - vermittelt über die Wirkung antigenpräsentierender
Zellen - zu Th2- und Tfh-Zellen. Interleukine stimulieren B-Zellen
((IgG-, IgE-Produktion), eosinophile Granulozyten (IgE), Makrophagen
(alternative Makrophagenaktivierung) und regen die Peristaltik und
Schleimproduktion im Darm an, was Würmern das Leben schwermacht
Th2-Zellen werden durch IL-4 aktiviert, regen B-Zellen zur Proliferation an
und hemmen die Th1 / Th17-Funktion (antiinflammatorische Wirksamkeit). Sie sind durch die Produktion von Interleukinen (u.a. IL-4, IL-5, IL-13) gekennzeichnet:
 IL-4 ist ein Schlüsselfaktor der adaptiven Abwehr. Es regt die
Entwicklung naiver Lymphozyten zu Th2-Effektorzellen und deren
Wachstum, alternative Makrophagenaktivierung, die Darmperistaltik,
sowie aktivierte B-Zellen und deren Differenzierung zu Plasmazellen und auch Bildung von IgE
(Isotypen-Switch) an. Auch kann es Eosinophile an den Ort des
Geschehens locken. Das alles unterstützt die Bekämpfung von Parasiten
IL-4 ist ein Schlüsselfaktor der adaptiven Abwehr. Es regt die
Entwicklung naiver Lymphozyten zu Th2-Effektorzellen und deren
Wachstum, alternative Makrophagenaktivierung, die Darmperistaltik,
sowie aktivierte B-Zellen und deren Differenzierung zu Plasmazellen und auch Bildung von IgE
(Isotypen-Switch) an. Auch kann es Eosinophile an den Ort des
Geschehens locken. Das alles unterstützt die Bekämpfung von Parasiten
 IL-5
stimuliert die Bildung von IgA und regt das B-Zell-Wachstum an, es
aktiviert eosinophile Granulozyten und fördert deren Wachstum
IL-5
stimuliert die Bildung von IgA und regt das B-Zell-Wachstum an, es
aktiviert eosinophile Granulozyten und fördert deren Wachstum
 IL-13 hat ähnliche Wirkungen wie IL-4, verstärkt dessen Wirkungen und fördert die Schleimsekretion.
IL-13 hat ähnliche Wirkungen wie IL-4, verstärkt dessen Wirkungen und fördert die Schleimsekretion.
Th2-Lymphozyten bilden u.a. IL-4 und IL-13
|
Würmer sind zu groß, um von Neutrophilen und Makrophagen aufgenommen zu
werden. Spezielle Wege sind zu ihrer Bekämpfung vonnöten. IL-4
und IL-13 regen die Darmmotorik und Schleimsekretion an; B-Zellen werden
durch IL-4 zur Bildung von IgE veranlasst, das Mastzellen zur
Degranulierung bringt; IL-5 aktiviert eosinophile Granulozyten, die
IgE-spezifische Fc-Rezeptoren exprimieren. Auch basophile Granulozyten sind in die Helminthenabwehr eingebunden.
Auf diese Weise kommt es zu
Degranulation und Freisetzung von sauren und basischen Proteinen,
welche die Außenwand von Würmern zerstören.
Die phagozytäre Antwort auf Th2-Zytokine nennt man "alternative" Makrophagenaktivierung. Dabei erzeugen (sogenannte M2-) Makrophagen Zytokine, die entzündungshemmend wirken und Wundheilung einleiten - sie regen die Bildung von Wachstumsfaktoren, Kollagen und Blutgefäßen an.
Die Entwicklung von
Th2-Lymphozyten wird durch Helminthiasis (Wurmerkrankung) und Allergene
angeregt, verstärkt durch Interleukin 4 (das auch die Entwicklung von
Th1- und Th17-Zellen hemmt) aus Mastzellen, Eosinophilen und T-Zellen
selbst. Dies läuft über die Wirkung von Transkriptionsfaktoren
(STAT6, GATA-3), dadurch wird die naive T-Zelle zum Th2-Lymphozyt.
GATA-3 stellt nicht nur die Weiche in Richtung Th2, sondern regt auch
die Expression von IL-4, IL-5 und IL-13 an.
Zwischen
Th-1 und Th-2-Zellen besteht eine reziproke Hemmung
(Th1/Th2-Balance). Da diese Hemmung durch Zytokine erfolgt
und Zytokine nur auf kurze Distanz wirksam sind, besteht diese
wechselseitige Beeinflussung jeweils für ein eng umschriebenes
Gewebeareal. Das verleiht dem Immunsystem hohe Flexibilität:
Gleichzeitig können verschiedene Erreger mit dem jeweils notwendigen
spezifischen Apparat angegangen werden.
Th17- (TH17-) Helferzellen
 Th17-Helferzellen produzieren IL-17 und beteiligen sich an der Abwehr von Mikroben, insbesondere an mukösen Oberflächen.
Th17-Helferzellen produzieren IL-17 und beteiligen sich an der Abwehr von Mikroben, insbesondere an mukösen Oberflächen.
Sie mobilisieren Leukozyten - hauptsächlich neutrophile Granulozyten,
weniger stark auch Monozyten - zu Orten von Entzündungen ("neutrophile Entzündung" durch IL-17), insbesondere
an Schleimhäuten, und veranlassen B-Zellen zur Bildung passender Antikörper. So
helfen sie, die
Unversehrtheit epithelialer Barrieren - z.B. im Darm - zu erhalten. Sie vermitteln auch antifungale Immunität (Schutz vor Pilzen).
 Abbildung:
Abbildung: Funktion der Th17-Lymphozyten
Nach einer Vorlage in Abbas / Lichtman / Pillai: Cellular and Molecular Immunology, 9th ed. 2018
Naive CD4+-T-Zellen werden von antigenpräsentierenden
Zellen (APC) nach Kontakt mit Bakterien oder Pilzen zur Ausbildung von
Th17-Klonen angeregt. Th17-Zellen produzieren Chemokine, die
Neutrophile und andere Leukozyten an Orte locken, wo Schleimhäute vor
Mikroben geschützt werden sollen
Besonders wirksam sind Th17-Zellen (benannt nach ihrem Leitzytokin, IL-17) gegen extrazelluläre Bakterien und Pilze. Viele Entzündungsvorgänge werden durch IL-17 mediiert.
Aktiviert werden Th17-Zellen durch IL-6, IL-21 und TGF-ß (aus
dendritischen Zellen). Gehemmt werden sie durch IFN-γ (von Th1-Zellen) und durch IL-4 / IL-13 (von Th2-Zellen).
Th17-Zellen sind durch die Produktion von IL-17, IL-21 und IL-22 gekennzeichnet ( Abbildung). Sie limitieren das Eindringen von Mikroben über epitheliale Barrieren (z.B. Darmmukosa), regen die Produktion antimikrobieller Peptide (z.B. Defensine) an und unterstützen die Regeneration der Schleimhäute (über IL-22). Ferner haben regulatorische Eigenschaften im T-Zell-System.
Abbildung). Sie limitieren das Eindringen von Mikroben über epitheliale Barrieren (z.B. Darmmukosa), regen die Produktion antimikrobieller Peptide (z.B. Defensine) an und unterstützen die Regeneration der Schleimhäute (über IL-22). Ferner haben regulatorische Eigenschaften im T-Zell-System.
 IL-17 stimuliert - über IL-17-Rezeptoren (A bis F), die von zahlreichen verschiedenen Zellen exprimiert werden
(Neutrophile, Makrophagen, Endothel- und Epithelzellen, Fibroblasten) - die Bildung
antimikrobieller Stoffe (z.B. Defensine) und zahlreicher anderer Zytokine, Chemokine und Prostaglandine.
IL-17 stimuliert - über IL-17-Rezeptoren (A bis F), die von zahlreichen verschiedenen Zellen exprimiert werden
(Neutrophile, Makrophagen, Endothel- und Epithelzellen, Fibroblasten) - die Bildung
antimikrobieller Stoffe (z.B. Defensine) und zahlreicher anderer Zytokine, Chemokine und Prostaglandine.
 IL-21 - aus aktivierten CD4+-Zellen - regt die Differenzierung von Th17-Zellen sowie B-Zellen zur Antikörperproduktion an.
IL-21 - aus aktivierten CD4+-Zellen - regt die Differenzierung von Th17-Zellen sowie B-Zellen zur Antikörperproduktion an.
 IL-22
- gebildet von aktivierten T-Zellen, einigen NK- und lymphoiden Zellen
IL-22
- gebildet von aktivierten T-Zellen, einigen NK- und lymphoiden Zellen der angeborenen Immunabwehr -
verstärkt die Barrierefunktion der Schleimhäute, produziert
antimikrobielle Peptide und stimuliert die Bildung von Chemokinen, die
zu entzündlichen Prozessen beitragen.
Überaktivierte Th
17-Zellen können an zahlreichen Autoimmunerkrankungen beteiligt
sein (multiple Sklerose, rheumatoide Arthritis, Psoriasis).
Die
Entwicklung von
Th17-Lymphozyten wird durch
proinflammatorische Zytokine(IL-1,
IL-6 und IL-23) angeregt, produziert von antigenpräsentierenden Zellen,
die durch Anwesenheit und Phagozytose von Bakterien und Pilzen dazu
angeregt werden. IL-6 (aus dendritischen Zellen) und
TGF-ß (aus verschiedenen anderen Zellen) wirken auf
Transkriptionsfaktoren (STAT3, RORγt), dadurch werden
naive CD4
+- zu Th17-Lymphozyten. TGF-ß supprimiert auch Th1- und Th2-Zellen.
Tfh-Helferzellen (follikuläre Helferzellen) sind vor allem für die Interaktion mit B-Lymphozyten vonnöten. Sie "überwachen" den sie umgebenden extrazellulären Raum und beteiligen sich an der Bildung und Funktion von Keimzentren in Lymphfollikeln. Mittels eines Chemokinrezeptors (CXCR5) finden sie zu B-Lymphozyten-Follikeln und aktivieren B-Lymphozyten zur Antikörperproduktion. Dabei steuern sie den Ig-Klassenwechsel - z.B. über IFN-γ zu IgG1, über TGFß zu IgA oder über IL4 zu IgE.
Tfh-Zellen sind durch die Produktion von Interleukin 21 gekennzeichnet, bilden auch IL-4 (dieses regt die Entwicklung zu Th2-Effektorzellen sowie deren Wachstum an) und γ-Interferon und bekämpfen extrazelluläre Pathogene.
Die folgende Abbildung vergleicht involvierte Zytokine und Eigenschaften unterschiedlicher CD4+-Helferzellen:
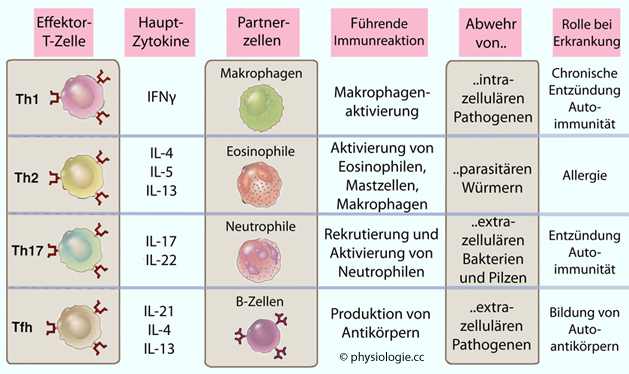

 Abbildung: Charakteristika von Untergruppen der CD4+-T-Lymphozyten
Abbildung: Charakteristika von Untergruppen der CD4+-T-Lymphozyten
Nach einer Vorlage bei Abbas / Lichtman / Pillai, Basic Immunology, 7th ed. Elsevier 2024
Naive CD4+-T-Helferzellen können sich zu Th1-, Th2-, Th17- oder Tfh-Zellen entwickeln. Diese produzieren diverse Sets von Zytokinen (IFN = Interferon, IL = Interleukin) und rekrutieren unterschiedliche Zelltypen (hier "Partnerzellen"), um ihre Wirkungen zu entfalten.
Als Effektorzellen bekämpfen sie unterschiedliche Infektionen und
können in verschiedene Arten entzündlicher Komplikationen verwickelt
sein

Treg-Zellen (regulatorische T-Zellen)
 Treg-Zellen (regulatorische Lymphozyten, früher Suppressor-T-Zellen)
sind eine Gruppe von T-Zellen, die in verschiedenen Geweben vorkommen und für die Erhaltung peripherer Toleranz gegenüber
Selbst-Antigenen beteiligt sind (Verhinderung von Autoimmunität durch Limitierung der Aktivität selbstreaktiver Lymphozyten). Sie enthalten FoxP3 (nach forkhead box P3, auch Scurfin
genannt), ein Protein, das spezifisch für Treg-Zellen ist (Marker) und
Transkriptionsvorgänge anregen oder hemmen kann. Treg-Zellen sind über
den Nachweis der Biomarker FoxP3, CD4, CD25 und CD152 identifizierbar. Sie machen
5-10% aller T-Zellen in der Peripherie aus.
Mutationen des (X-chromosomalen) FoxP3-Gens können zu einer Erkrankung (IPEX: Immunodysregulation, Polyendocrinopathy, Enteropathy - X-linked) führen, die durch multiple Autoimmunprobleme gekennzeichnet ist.
Treg-Zellen (regulatorische Lymphozyten, früher Suppressor-T-Zellen)
sind eine Gruppe von T-Zellen, die in verschiedenen Geweben vorkommen und für die Erhaltung peripherer Toleranz gegenüber
Selbst-Antigenen beteiligt sind (Verhinderung von Autoimmunität durch Limitierung der Aktivität selbstreaktiver Lymphozyten). Sie enthalten FoxP3 (nach forkhead box P3, auch Scurfin
genannt), ein Protein, das spezifisch für Treg-Zellen ist (Marker) und
Transkriptionsvorgänge anregen oder hemmen kann. Treg-Zellen sind über
den Nachweis der Biomarker FoxP3, CD4, CD25 und CD152 identifizierbar. Sie machen
5-10% aller T-Zellen in der Peripherie aus.
Mutationen des (X-chromosomalen) FoxP3-Gens können zu einer Erkrankung (IPEX: Immunodysregulation, Polyendocrinopathy, Enteropathy - X-linked) führen, die durch multiple Autoimmunprobleme gekennzeichnet ist.
Treg-Zellen sezernieren TGFß und IL10 und wirken entzündungshemmend: Sie unterdrücken Immunreaktionen - sie halten dadurch gewebeschädigende Effekte im Zaum - und erhalten die Autoimmuntoleranz. Es gibt mehrere Subtypen an Treg-Zellen; gebildet werden sie vorwiegend durch Erkennung von Selbst-Antigenen im Thymus (tTreg-Zellen); und durch Antigenerkennung (selbst und fremd) in peripherem lymphatischem Gewebe (pTreg-Zellen).


Abbildung: Regulatorisches Gleichgewicht im Immunsystem
Das
Immunsystem schützt den Organismus vor mikrobiellen Angriffen, muss
aber gleichzeitig die eigenen Gewebe schonen. Die Maßnahmen müssen
daher ausgewogen und gezielt erfolgen.
Regulatorische
Gleichgewichte bestehen z.B. zwischen T-Helferzellen und regulatorischen T-Zellen sowie zwischen pro-
vs.
anti-inflammatorischen Faktoren. Treg-Lymphozyten (Suppressorzellen) sollen fehlgeleitete
Antworten (Autoaggression, Hypersensitivität) verhindern bzw. begrenzen
Treg-Zellen bremsen Effektor-T-Zellen z.B. durch
 Produktion von IL-10 und TGF-ß
Produktion von IL-10 und TGF-ß
 Bildung
von Faktoren wie CD25 (α-Untereinheit des IL-2-Rezeptors; Treg-Zellen brauchen
zum Überleben IL-2) und CD152 (CTLA-4, cytotoxic T-lymphocyte associated antigen 4)
Bildung
von Faktoren wie CD25 (α-Untereinheit des IL-2-Rezeptors; Treg-Zellen brauchen
zum Überleben IL-2) und CD152 (CTLA-4, cytotoxic T-lymphocyte associated antigen 4)
 Limitierung klonaler Expansion
Limitierung klonaler Expansion
 Verbrauch von IL-2
Verbrauch von IL-2
Treg-Zellen können "natürlich" vorkommen (nTreg: natural regulatory T), oder sie sind "induzierbar" (iTreg: induced regulatory T). Letztere entwickeln sich aus reifen CD4+-Zellen außerhalb des Thymus. Ihre Funktion scheint analog zu sein.
Dendritische Zellen präsentieren den Treg-Rezeptoren Antigene (über MHC-II), und wenn dabei nicht auch IL-6
gebildet wird, hat die dendritische Zelle die Pathogenität als gering
eingestuft und bremst die Immunantwort ein (andernfalls würden
Th17-Zellen aktiviert).
Lymphozyten mit αβ-T-Zell-Rezeptoren, die MHC-Peptid-Antigene binden

Nach Strachan / Read, Human Molecular Genetics, 5th ed. 2020 (CRC Press)
|
Klasse
|
Eigenschaften
|
Funktionen
|
zytotoxische T-Zellen
(CD8+, CTL) |
Bindung meist an MHC-I-Peptide antigenpräsentierender Zellen
|
Töten virusinfizierte und Tumorzellen, induzieren Apoptose (wie NK-Zellen)
|
Helfer-T-Zellen (CD4+, TH)
|
Bindung meist an MHC-II-Peptide antigenpräsentierender Zellen
TH1, TH2, TH17
|
TH1 aktivieren Makrophagen und Killer-T-Zellen
TH2 aktivieren Eosinophile und Antikörperproduktion
TH17 bewirken Entzündung und Autoimmunität
|
Regulatorische T-Zellen (Treg)
|
Exprimieren CD4 und CD25, intrazellulär FOXP3
|
Unterdrücken Autoimmunantworten
|
Gedächtniszellen
(Memory-T-cells)
|
Klonale Expansion von αβ-T-Zellen mit Antigenkontakt |
Rasche Expandierung des Klons bei Sekundärkontakt
|
Lymphozyten mit limitierter Diversität
NKT-Zellen  MAIT-Zellen
MAIT-Zellen  "Nicht-traditionelle" γδ-T-Lymphozyten
"Nicht-traditionelle" γδ-T-Lymphozyten
Mehr als 95% der zirkulierenden T-Zellen tragen αβ-T-Rezeptoren und exprimieren CD4 für die Erkennung von Peptiden auf MHC-II, CD8 für die Erkennung von Peptiden auf MHC-I.
Neben diesen
"traditionellen" / "klassischen" T-Zellen gibt es eine kleinere Gruppe
von "nicht-traditionellen" T-Zellen mit geringer Diversität ihrer
Erkennungsstrukturen. Darunter sind einige mit αβ-T-Rezeptoren, andere sind γδ-T-Zellen. Sie bilden zwar ebenfalls somatisch umgestaltete Antigenrezeptoren wie
traditionelle T- bzw. B-Zellen, aber die Bandbreite der Spezifität dieser Rezeptoren ist
eingeschränkt. Solche Zellen zeigen Charakteristika sowohl der angeborenen als auch der
adaptiven Immunität.
Zu Lymphozyten mit limitierter Diversität zählt man NKT-, MAIT- und γδ-Zellen. Ihre physiologische Bedeutung ist nicht klar.
NKT-Zellen (natürliche Killer-T-Zellen)
NKT-Zellen
(natürliche Killer-T-Zellen)
- eine kleine Untergruppe der T-Zellen - exprimieren Marker, die auch
auf NK-Zellen zu finden sind (z.B. CD56). Sie erkennen mit ihren
T-Rezeptoren (die eng begrenzte Diversität aufweisen) fremde Lipide, Glycolipide und
hydrophobe Peptide (z. B. von intrazellulären Bakterien) auf
CD1d, einem MHC-ähnlichen
Molekül. Dieses nichtklassische MHC-Molekül präsentiert offenbar andere (oft Nichtpeptid-) Epitope als der αβ-Typ.
Einige "invariante" NKT-Zellen (iNKT) exprimieren zwar αβ-Antigenrezeptoren, diese sind aber von sehr geringer Diversität. Sie erkennen Lipidantigene über CD1-Moleküle.

 Abbildung: NK- (links) und NKT-Zelle (rechts) im Vergleich
Abbildung: NK- (links) und NKT-Zelle (rechts) im Vergleich
Nach einer Vorlage in Doan / Lievano /
Swanson-Mungerson / Viselli, Immunology (3rd ed). Lippincott
Illustrated Reviews, Wolters Kluwer 2022
Lichtmikroskopisch
sind NK- nicht von NKT-Zellen zu unterscheiden. Beide zeigen
zytoplasmatische Granula, aus denen sie Perforin (zytolytisches
Protein) und Granzyme (apoptosefördernde Serinproteasen) freisetzen
können.
Funktionell stellen beide eine Brücke zwischen adaptivem und
angeborenem System dar und teilen einige funktionelle Charakteristika

 Abbildung).
Abbildung).
Neu gebildetes CD1 bringt z.B. Lipide aus dem Zytoplasma an
die Zelloberfläche, tauscht sie gegen exogene Lipide aus, wird wieder
endozytiert und gelangt in den endo- / lysosomalen Apparat, um
schließlich die aufgenommenen Fremdlipide zu präsentieren (Abwehr
lipidreicher Bakterien, z.B. Mykobakterien).
 Haben NKT-Zellen Substanzen gebunden, die über das spezielle (nichtklassische) HMC
I-Molekül CD1d präsentiert werden, sezernieren sie große Mengen von Zytokinen, wie IL-4 und IFN-γ. Deren Auswirkungen können sowohl stimulierend als auch inhibierend sein.
Haben NKT-Zellen Substanzen gebunden, die über das spezielle (nichtklassische) HMC
I-Molekül CD1d präsentiert werden, sezernieren sie große Mengen von Zytokinen, wie IL-4 und IFN-γ. Deren Auswirkungen können sowohl stimulierend als auch inhibierend sein.
NKT-Zellen können auch virusinfizierte oder Tumorzellen vernichten (dazu werden Perforin und Granzyme ausgeschüttet).
 Zu NK-Zellen s. dort
Zu NK-Zellen s. dort
MAIT-Zellen (mukosa-assoziierte invariante T-Zellen)
Eine andere Untergruppe der T-Zellen (~5% aller T-Zellen im Blut) finden sich vor allem in der Leber (20-50% aller hepatischen T-Zellen). Man nennt sie mukosa-assoziierte invariante T-Tellen (MAIT: Mucosa-associated invariant T cells),
weil sie über invariante T-Zell-Rezeptoren verfügen (ähnlich wie
NKT-Zellen). Sie erkennen Metabolite des Riboflavin-Syntheseweges von
Pilzen und Bakterien, die über ein MHC-I-ähnliches Protein (MR1)
präsentiert werden.
MAIT-Zellen sind meist CD8-positiv und werden über MR1 oder Zytokine
(IL-12, IL-18) aktiviert. Sie selbst sezernieren entzündungsfördernde
Zytokine (TNF, Inferferon-γ) und wirken zytotoxisch auf infizierte
Zellen. Vermutlich wirkt diese Zellgruppe als zweite Abwehrlinie gegen
Mikroben, welche die Darmbarriere überwunden und über den
Pfortaderkreislauf bis zur Leber vorgedrungen sind.

Über
ILCs (lymphoide Zellen der angeborenen Immunität,
innate lymphoid cells) s.
dort
 Externer Link: CD-Antigenliste
Externer Link: CD-Antigenliste
"Nicht-traditionelle" γδ-T-Lymphozyten
Mehr als 95% der zirkulierenden T-Zellen tragen αβ-T-Rezeptoren und exprimieren Corezeptoren - CD4 für Peptide und MHC-II, CD8 für Peptide und MHC-I. αβ-T- sind "traditionelle" T-Zellen. Einige kleinere T-Zell-Populationen erkennen Lipide oder andere
Moleküle - entweder über MHC-I-ähnliche Moleküle oder auch ohne
Notwendigkeit zur Antigenpräsentation (nicht MHC-restringiert):
Seltener als "traditionelle" T-Zellen (<5% - im Darm ~10% - der jeweils vorhandenen T-Lymphozyten) sind γδ-T-Zellen; sie sind nicht MHC-restringiert und binden Peptide, Lipide und kleine Moleküle. Solche "nicht-traditionellen" T-Zellen (oft ohne CD-Corezeptoren) finden sich in Körpergegenden, die mit der
Außenwelt Berührung haben (Haut, Zunge, Schleimhaut in Darm und Urogenitaltrakt, Lunge, Peritoneum). Vermutlich sind
sie auf die Erkennung von Angreifern spezialisiert, die an diesen
Stellen am ehesten zu erwarten sind.
γδ-T-Zellen
gehören mit NKT-Zellen und mukosa-assoziierten invarianten T-Zellen
sowie B1-Zellen und Randzonen-B-Zellen zu Lymphozyten, die Zytokine
produzieren und somatisch rekombinierte Antigenrezeptoren exprimieren, aber diese weisen nur beschränkte Diversität der Antigenerkennung
auf. Sie reagieren rasch auf Infektionen (ein Kennzeichen der
angeborenen Immunität), ihre Fähigkeit zu adaptiver Immunität ist aber
limitiert.
Zytokine sind Hormone des Immunsystems
 Zytokine
Zytokine  (alte Bezeichnung: Lymphokine) sind Protein- / Peptid-Mediatoren, die bei entsprechender Reizung synthetisiert / sezerniert
werden und
auf das Immunsystem rückwirken. Diese Reizung erfolgt über die
Erkennung mikrobieller (z.B. Lipopolysaccharide, Peptidoglykane,
mikrobielle Nukleinsäuren) oder irregulärer MHC-präsentierter Merkmale
via Rezeptoren der angeborenen - z.B. Toll-like (TLRs) Rezeptoren -
oder der adaptiven Abwehr, insbesondere T-Zell-Rezeptoren auf Immunzellen. Zytokine wirken also in beiden Sektoren (angeboren und adaptiv) des Immunsystems (s. Tabelle).
(alte Bezeichnung: Lymphokine) sind Protein- / Peptid-Mediatoren, die bei entsprechender Reizung synthetisiert / sezerniert
werden und
auf das Immunsystem rückwirken. Diese Reizung erfolgt über die
Erkennung mikrobieller (z.B. Lipopolysaccharide, Peptidoglykane,
mikrobielle Nukleinsäuren) oder irregulärer MHC-präsentierter Merkmale
via Rezeptoren der angeborenen - z.B. Toll-like (TLRs) Rezeptoren -
oder der adaptiven Abwehr, insbesondere T-Zell-Rezeptoren auf Immunzellen. Zytokine wirken also in beiden Sektoren (angeboren und adaptiv) des Immunsystems (s. Tabelle).
Zytokine aktivieren Leukozyten, regen die Blutbildung an, töten Tumorzellen und inaktivieren Infektionserreger. Viele der zellulären Mechanismen der angeborenen Immunität werden über Zytokine gesteuert. Die Hauptquelle von Zytokinen der adaptiven Abwehr sind T-Helferzellen.
Die meisten Zytokine wirken über kinasegekoppelte Rezeptoren, Chemokine über GPCR. Sie übernehmen einen großen
Teil der Kommunikation und Koordination innerhalb des
Immunsystems sowie mit anderen an der Abwehr beteiligten Zellen. Zytokine wirken wirken autokrin / parakrin, oder auch endokrin (dendritische Zellen, Makrophagen); ihr Blutspiegel ist im gesunden Zustand sehr niedrig, kann aber
bei akuten Entzündungen bis zu tausendfach ansteigen. Alle Zytokine werden rasch wieder abgebaut, ihre Halbwertszeit liegt im
Minutenbereich.
Die Ausstattung der Zielzellen mit Zytokinrezeptoren unterliegt sich teils gegenseitig
beeinflussenden Steuerfaktoren.
Zytokine beeinflussen ihre Bildung gegenseitig und werden auch durch Signale aus dem vegetativen Nervensystem reguliert (z.B.
über muskarinische Rezeptoren). Einige Zytokine regen in der Leber die Produktion von Akutphasenproteinen an. Zytokine wirken auch auf das Gehirn und können so Fieber (Hypothalamus) und Krankheitsverhalten auslösen (Unwohlsein, Sich-Zurückziehen etc).
Zytokine wirken wie ein Orchester zusammen. Der Gesamteffekt kann
proinflammatorisch (entzündlich - TNF, IL-1) oder antiinflammatorisch
(entzündungshemmend - TGF-ß) sein.
 Über Wechselwirkungen zwischen Immunsystem und Glucocorticoiden
Über Wechselwirkungen zwischen Immunsystem und Glucocorticoiden  s. dort
s. dort
 über das unspezifische
über das unspezifische Immunsystem (z.B. Interferon-α, Interferon-β, TNF-α, IL-1, IL-6, IL-10, Chemokine) sowie auch

über das
spezifische Immunsystem (z.B. IL-2, IL-4, Interferon-γ, TGF-β, Lymphotoxin - früher TNF-β);


einige steuern auch die
Blutbildung (
CSF -

s. unten).
Komplexes System. Zytokine können auf die Senderzellen zurückwirken (autokrin), im benachbarten Gewebe (parakrin) oder - wenn ihre Produktion erhöht wird - über die Blutbahn an entfernten Teilen des Organismus (endokrin) aktiv werden. Sie wirken nicht singulär, sondern in Mustern - teils synergistisch, teils antagonistisch.
So können einige Zytokine proliferativ (z.B. IL-2), andere wachstumshemmend tätig
sein (z.B. TNF-α, TGF-ß). Außerdem können sie von verschiedenen Zellarten gebildet werden,
und bestimmte Effekte können von verschiedenen Zytokinen ausgeübt werden
(Redundanz).
Schließlich kann jedes Zytokin je nach Zielzelle (und
Rezeptorbesatz) unterschiedliche Wirkungen haben (Pleiotropie  ). Dazu kommt, dass die Untersuchung einzelner Zytokine in vitro
nicht schlüssig ihre Rolle und Wirkungsstärke im Gesamtsystem des
Organismus erhellt. All das macht das Verständnis der Zytokinwirkungen
nicht gerade einfach; die
Nomenklatur ist aufgrund der großen Dynamik der immunologischen
Forschung noch ziemlich uneinheitlich.
). Dazu kommt, dass die Untersuchung einzelner Zytokine in vitro
nicht schlüssig ihre Rolle und Wirkungsstärke im Gesamtsystem des
Organismus erhellt. All das macht das Verständnis der Zytokinwirkungen
nicht gerade einfach; die
Nomenklatur ist aufgrund der großen Dynamik der immunologischen
Forschung noch ziemlich uneinheitlich.
Interleukine 
Interleukine machen einen großen Anteil der Zytokine aus. Sie wurden so benannt, weil sie Signale zwischen (inter) Leukozyten vermitteln, obwohl sie auch andere Zellen betreffen und neben Makrophagen, Monozyten und Lymphozyten auch
von Endothelzellen gebildet werden. Mittlerweile sind über 30 Interleukine
bekannt. Sie wirken spezifisch fördernd oder hemmend auf Wachstum, Reifung und Teilung bestimmter
Immunzellen (s. Tabelle). Ihre biologische Halbwertszeit liegt im
Bereich von Minuten, sie sind also ziemlich kurzlebig.
 Initiierung der akuten Phase: Auf bakterielle Reize hin (LPS: Lipopolysaccharid) werden Zytokine der frühen Abwehr freigesetzt - hauptsächlich von Makrophagen und Monozyten, aber auch von Endothelzellen, Fibroblasten u.a.: IL-1 und IL-6 lösen zusammen mit TNF-α lokale Entzündung aus (Ausbildung von Adhäsionsmolekülen
an Endothelzellen) und rekrutieren Leukozyten. In moderatem Ausmaß
gebildet, bewirken diese Zytokine (Hypothalamus), die Produktion von FieberAkutphasen-Proteinen (Leber) und Mobilisierung von Leukozyten (Knochenmark). Diagnostisch
äußert sich dies in Temperaturanstieg, Entzündungsparametern
(Blutsenkung, CRP) und Leukozytenzahl. Wegen der fieberinduzierenden
Wirkung von IL-1, IL-6 und TNF-α spricht man von endogenen Pyrogenen.
Initiierung der akuten Phase: Auf bakterielle Reize hin (LPS: Lipopolysaccharid) werden Zytokine der frühen Abwehr freigesetzt - hauptsächlich von Makrophagen und Monozyten, aber auch von Endothelzellen, Fibroblasten u.a.: IL-1 und IL-6 lösen zusammen mit TNF-α lokale Entzündung aus (Ausbildung von Adhäsionsmolekülen
an Endothelzellen) und rekrutieren Leukozyten. In moderatem Ausmaß
gebildet, bewirken diese Zytokine (Hypothalamus), die Produktion von FieberAkutphasen-Proteinen (Leber) und Mobilisierung von Leukozyten (Knochenmark). Diagnostisch
äußert sich dies in Temperaturanstieg, Entzündungsparametern
(Blutsenkung, CRP) und Leukozytenzahl. Wegen der fieberinduzierenden
Wirkung von IL-1, IL-6 und TNF-α spricht man von endogenen Pyrogenen.
In höherer Konzentration üben sie systemische (Kreislauf-)Effekte aus (übermäßige Produktion von TNF-α kann zu septischem Schock führen: TNF-α kann die Kontraktilität des Herzmuskels und den Gefäßtonus reduzieren).
 Spezifische Abwehrphase: Nach
der Erkennung antigener Eigenschaften proliferieren und differenzieren
sich Lymphozyten - geregelt durch Zytokine, die vorwiegend aus CD4+-T-Zellen stammen.
Spezifische Abwehrphase: Nach
der Erkennung antigener Eigenschaften proliferieren und differenzieren
sich Lymphozyten - geregelt durch Zytokine, die vorwiegend aus CD4+-T-Zellen stammen.
Sobald T-Zellen "ihr" Antigen erkannt haben, bilden sie IL-2 und IL2-Rezeptoren. IL-2 beschleunigt die Proliferation (klonale Expansion) von T-Zellen (autokrin),
NK-Zellen (parakrin: zytolytische Aktivität) und B-Zellen
(Antikörperbildung). Darüber hinaus bilden IL-2-stimulierte Zellen
weitere Zytokine wie IL-4 und Interferon-γ. IL-4 beeinflusst den Antikörper-Klassenwechsel zu IgE und hat proliferierende Wirkung u.a. auf Mastzellen.

 Abbildung: Signalstoffe zur Interaktion zwischen endokrinem, Immun- und Nervensystem
Abbildung: Signalstoffe zur Interaktion zwischen endokrinem, Immun- und Nervensystem
Zwischen
Immun- und Zentralnervensystem wirken Interleukine 1, 2 und 6,
Interferone, TNF-α, β-Endorphine; Somatostatin, GH, ACTH, Prolaktin,
VIP, Substanz P wirken auf das Immunsystem.
Zwischen Immun- und endokrinem System wirken ACTH, β-Endorphine; auf das endokrine System wirken Interleukine 1 und 6, Interferone, TNF-α.
Zwischen endokrinem und Zentralnervensystem wirken CRH, ACTH, β-Endorphine.
 Vgl. dort
Vgl. dort
Zentralnervensystem: Interleukine haben - wie auch andere Zytokine - zahlreiche neuromodulatorische Effekte,
können zu zirkumventrikulären Organen vordringen und über spezifische
Transportmechanismen die Blut-Hirn-Schranke überwinden, und finden an
den Zellen des Nervengewebes entsprechende Rezeptoren vor.
Damit
beeinflussen sie z.B.
 Transmitterfreisetzung,
Transmitterfreisetzung,
 Körpertemperatur,
Körpertemperatur,
 Schlafmuster,
Schlafmuster,
 Verhaltensweisen.
Verhaltensweisen.
Sie können neuroprotektiv (Verhinderung
von Apoptose) und erregungsdämpfend wirken.
Auf das neuroendokrine System (Hypothalamus) haben sie
zahlreiche Effekte und beeinflussen die Sekretion mehrerer
hypophysärer Vorderlappenhormone. Einige Interleukine (IL-4, IL-10, IL-13) wirken entzündungshemmend, nicht (wie andere) proinflammatorisch.
Interleukine (IL)
Nach Abbas / Lichtman / Pillai, Basic Immunology, 7th ed. Elsevier 2024 |
Interleukin
|
Quelle (Zellen)
|
Rezeptoren / Subeinheiten
|
Ziele / Wirkungen
|
IL-2
|
T-Zellen
|
CD25 (IL-2Rα)
CD122 (IL-2Rβ)
CD132 (γc)
|
T-Zellen: Vermehrung und Differenzierung, Überleben
NK-Zellen: Proliferation, Aktivierung
|
IL-3
|
T-Zellen
|
CD123 (IL-3Rα)
CD131 (βc) |
Hämatopoetische Vorläuferzellen: Reifung
|
IL-4
|
CD4+-T-Zellen (Th2, Thf), Mastzellen
|
CD124 (IL-4Rα)
CD132 (γc)
|
B-Zellen: Isotypenswitch zu IgE, IgG4
T-Zellen: Th2-Differenzierung
Makrophagen: Alternative Aktivierung, Inhibition IFN-γ-mediierter Aktivierung
|
IL-5
|
CD4+-Zellen (Th2), ILCs
|
CD125 (IL-5Rα)
CD131 (βc)
|
Eosinophile: Aktivierung, vestärkte Bildung
|
IL-6
|
Makrophagen, Endothelzellen, T-Zellen, Fibroblasten
|
CD126 (IL-6Rα)
CD130 (gp130)
|
Leber: Bildung von Akutphasenproteinen
B-Zellen: Vermehrung antikörperbildender Zellen
T-Zellen: Differenzierung Th17
|
IL-7
|
Fibroblasten, Stromazellen im Knochenmark
|
CD127 (IL-7R)
CD132 (γc) |
Lymphoide Vorläuferzellen: Vermehrung früher T- und B-Formen
|
IL-9
|
CD4+-T-Zellen |
CD129 (IL-9R)
CD132 (γc) |
Mastzellen, B-Zellen, T-Zellen, Epithelien (Aktivierung, Überleben)
|
IL-11
|
Stromazellen im Knochenmark |
IL-11Rα
CD130 (pg130)
|
Produktion von Thrombozyten
|
IL-12
(A, B)
|
Makrophagen, dendritische Zellen
|
CD212 (IL-12Rβ1)
IL-12Rβ2
|
T-Zellen: Differenzierung Th1
NK- und T-Zellen: Bildung IFN-γ, erhöhte Zytotoxizität
|
IL-13
|
CD4+-T-Zellen (Th2), NKT-Zellen, ILCs, Mastzellen
|
CD213a1 (IL-13Rα1)
CD213a2 (IL-13Rα2)
CD132 (γc)
|
B-Zellen: Isotypenswitch zu IgE
Epithelzellen: Erhöhte Schleimproduktion
Makrophagen: Alternative Aktivierung
|
IL-15
|
Makrophagen u.a.
|
IL-15Rα
CD122 (IL-2Rβ)
CD132 (γc)
|
NK-Zellen: Vermehrung
T-Zellen: Überleben, Vermehrung, Differenzierung
|
IL-17
(A, F)
|
CD4+-T-Zellen (Th17), ILCs
|
CD217 (IL-17RA)
IL-17RC
|
Epithelzellen, Makrophagen u.a.: Erhöhte Bildung von Chemokinen, Zytokinen, Bildung von GM-CSF und G-CSF
|
IL-21
|
Tfh-Zellen
|
CD360 (IL-21R)
CD132 (γc)
|
B-Zellen: Aktivierung, Vermehrung, Differenzierung
|
IL-23
(A, B)
|
Makrophagen, dendritische Zellen
|
IL-23R
CD212 (IL-12Rβ1) |
T-Zellen: Differenzierung, Vermehrung
ILCs: Aktivierung
|
IL-25
|
T-Zellen, dendritische Zellen, Makrophagen, Epithelzellen, Mastzellen, Eosinophile
|
IL-17RB
|
T-Zellen: Differenzierung Th2
ILCs: Aktivierung
|
IL-27
|
Makrophagen, dendritische Zellen
|
IL-27Rα
CD130 (gp130)
|
T-Zellen: Förderung Th1-Differenzierung, Hemmung Th17-Differenzierung
|
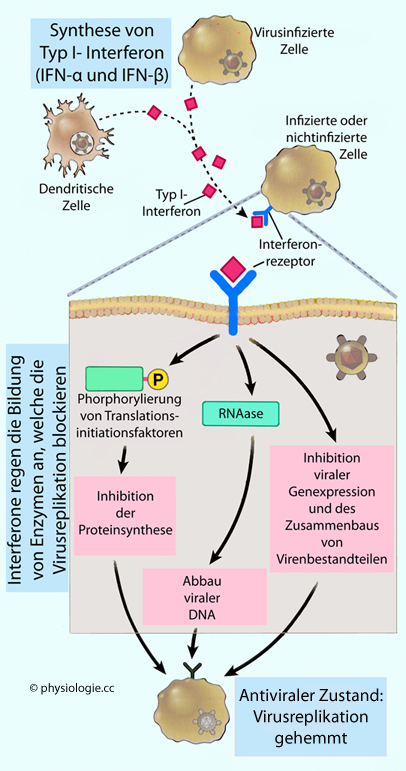
 Typ-I-Interferone umfassen mehrere IFN-α und eine Form von IFN-β. Sie gehören zum unspezifischen System und schützen Nachbarzellen vor Viren (antiviraler Zustand). Virusbefallene Zellen können ihre Produktion innerhalb weniger Minuten hochfahren, wenn virale PAMPs mit bestimmten PRRs reagieren.
Typ-I-Interferone umfassen mehrere IFN-α und eine Form von IFN-β. Sie gehören zum unspezifischen System und schützen Nachbarzellen vor Viren (antiviraler Zustand). Virusbefallene Zellen können ihre Produktion innerhalb weniger Minuten hochfahren, wenn virale PAMPs mit bestimmten PRRs reagieren.
Typ-I-Interferone wirken sowohl auf die infizierte "Senderzelle" zurück
(autokrin), als auch auf - nicht infizierte - Nachbarn (parakrin). Sie
aktivieren über den JAK-STAT-Signalweg
zahlreiche Gene, u.a. solche zur Bildung von verschiedenen Zytokinen.
Das hemmt die Reproduktion der Viren. Auch beinflussen sie die
Tätigkeit von dendritischen Zellen und Makrophagen.
 α-Interferone
α-Interferone
- etwa 20 an der Zahl - werden von
dendritischen Zellen nach Kontakt mit Nukleinsäure
(bakteriell, viral) freigesetzt und regen über spezifische Rezeptoren
an
benachbarten Zellen die Expression von Genen an, die einerseits
die
Synthese fremder Proteine hemmen (

Abbildung) und andererseits
den
Abbau fremder
RNA fördern. Auch aktivieren sie
NK-Zellen.
IFN-α haben nicht nur antivirale, sondern auch tumorbekämpfende Wirkung.
 β-Interferone
β-Interferone stammen hauptsächlich aus virusinfizierten Fibroblasten und haben ebenfalls antivirale Wirkung.
 Typ-II-Interferon (IFN-γ) ist weniger stark antiviral wirksam als Typ-I-Interferone - es unterstützt die zelluläre Abwehr auch durch Aktivierung zytotoxischer (CD8+) T- und NK-Zellen -, aber das stärkste bekannte Makrophagen aktivierende Zytokin. Interferon-γ stammt aus T-Helferzellen (CD4+), die bakterien-phagozytierende Makrophagen erkennen und deren Bakterienabbau unterstützen.
Typ-II-Interferon (IFN-γ) ist weniger stark antiviral wirksam als Typ-I-Interferone - es unterstützt die zelluläre Abwehr auch durch Aktivierung zytotoxischer (CD8+) T- und NK-Zellen -, aber das stärkste bekannte Makrophagen aktivierende Zytokin. Interferon-γ stammt aus T-Helferzellen (CD4+), die bakterien-phagozytierende Makrophagen erkennen und deren Bakterienabbau unterstützen.
Interferonrezeptoren werden
auch als Typ II-Zytokinrezeptoren bezeichnet. Es handelt sich um
heterodimere oder multimere Transmembranrezeptoren mit Immunglobulin-
und Tyrosinkinase-Anteilen.
 Zum Mechanismus der Transkriptionssteuerung durch Interferone s. auch dort
Zum Mechanismus der Transkriptionssteuerung durch Interferone s. auch dort
Chemokine
 Chemokine (chemoattractant cytokines, chemotactic cytokines) sind strukturell homologe, kleine (8-10-kD)
Zytokine, welche (neben anderen Funktionen) den Austritt von Leukozyten
aus der Blutbahn zu korrekten Stellen im Gewebe steuern. Mehr als 40
verschiedene Chemokine sind bekannt; sie wirken chemotaktisch (daher
der Name) d.h. sie locken
Chemokine (chemoattractant cytokines, chemotactic cytokines) sind strukturell homologe, kleine (8-10-kD)
Zytokine, welche (neben anderen Funktionen) den Austritt von Leukozyten
aus der Blutbahn zu korrekten Stellen im Gewebe steuern. Mehr als 40
verschiedene Chemokine sind bekannt; sie wirken chemotaktisch (daher
der Name) d.h. sie locken Lymphozyten
an, die über Chemokinrezeptoren (CCR - metabotrope Rezeptoren) verfügen. Dabei besteht beträchtliche Redundanz,
d.h. einige Chemokine regen mehrere verschiedene CCR an, und einige CCR
reagieren auf verschiedene Chemokine. Insgesamt steuern Chemokine den
"Verkehr" von Leukozyten, der im Rahmen von Immun- und
Entzündungsvorgängen in Kreislauf und Gewebe stattfindet. Das Chemokin-Rezeptor-System involviert insbesondere Leukozyten, Endothel-, Epithelzellen und Fibroblasten.
Chemotaxis spielt für Zellentwicklung und -bewegung, Erhaltung der Zytoarchitektur, sowie immunologische Vorgänge eine
Rolle. Chemokine kontrollieren die Entwicklung lymphatischer Organe,
und sie
steuern die Bewegung von Leukozyten durch deren spezialisierte Zonen.
Chemokine beteiligen sich weiters an der Steuerung von Immunzellen zu
Stellen, an denen sich Tumore angesiedelt haben ( Abbildung).
Abbildung).
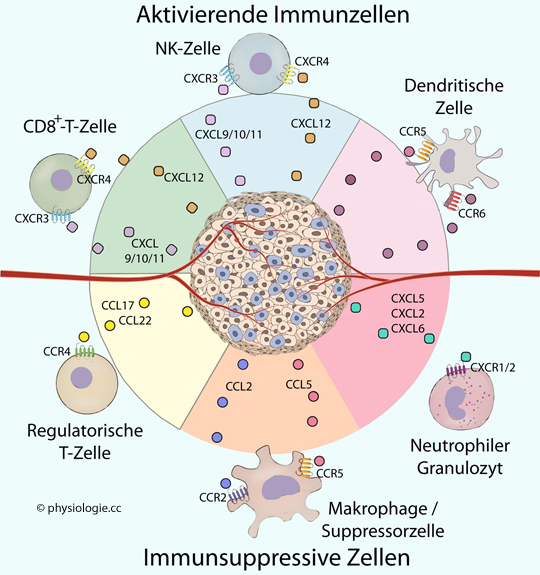
 Abbildung: Chemokine steuern Immunzellen
Abbildung: Chemokine steuern Immunzellen
Nach Kohli K, Pillarisetty VG, Lim TS. Key chemokines direct migration of immune cells in solid tumors. Cancer Gene Therapy 2022; 29: 10-21
Die
Abbildung zeigt Chemokine, welche verschiedene Arten von -
aktivierenden (oben) sowie suppressiven (unten) - Immunzellen zu
Stellen lotsen, an denen sich Tumorzellen angesiedelt haben.
Aktivierte Killerlymphozyten (CD8+) und NK-Zellen können Tumorzellen
auflösen (dazu werden sie über Chemokingradienten in den Tumor
geleitet, woran sich auch dendritische Zellen beteiligen, die ebenfalls
in das Tumorgewebe einwandern) und produzieren Interferon-γ, was
tumorverhindernde Immunität zur Folge hat.
Auch immunsuppressive Zellen folgen dem Chemokin- Konzentrationsgefälle
in das Tumorgewebe, wie regulatorische (CD4+) T-Lymphozyten (Treg).
Chemokine steuern auch die Migration von tumorassoziierten Makrophagen
und myeloiden Suppressorzellen (MDSC, myeloid-derived suppressor cells
- diese können T-Zell-abhängige Immunreaktionen supprimieren). Wieder
andere Chemokine beeinflussen die Aktivität neutrophiler Granulozyten,
die das Tumorwachstum u.U. begünstigen können.
CC = Chemokin, R = Rezeptor, L = Ligand
Die Bezeichnung der Chemokine ist verwirrend, viele haben mehrere
Namen. Chemokine mit einem Cystein bezeichnet man als C-Chemokine,
solche mit zwei als C-C-Chemokine, solche mit einer oder drei
Aminosäuren zwischen den Cysteinmolekülen als C-X-C- (=IL-8, auch
bezeichnet als CXCL8) bzw. C-XXX-C-Chemokine

Nach antigener Stimulation ändern Lymphozyten die Expression ihrer
Chemokinrezeptoren - je nach spezifischer Aufgabe. Die Ausstattung von
B- und T-Zellen mit CCR ist ein dynamischer, situationsabhängiger
Prozess.
Tumornekrosefaktor
( s. auch Tabelle)
s. auch Tabelle)
Die Tumornekrosefaktor (TNF)- und TNF-Rezeptor-Superfamilien
umfassen 19 verschiedene Liganden sowie 29 Rezeptoren. (der TNF-Rezeptor ist trimer, so wie TNF selber.) Sie modulieren
zelluläre Homöostase, Entwicklung sowie Reizantwort, und sichern teils
das Überleben der Zelle, teils sind sie apoptosefördernd. Vor allem
wirken sie im Immunsystem - sowohl im adaptiven als auch im angeborenen - costimulatorisch und koinhibierend.

 Abbildung: TNF und andere Zytokine bei entzündlichen Reaktionen
Abbildung: TNF und andere Zytokine bei entzündlichen Reaktionen
Nach einer Vorlage in Abbas / Lichtman / Pillai: Cellular and Molecular Immunology, 9th ed. 2018
TNF ruft mit
anderen Zytokinen (IL-1, IL-6) lokale (erhöhte Gefäßpermeabilität) und
systemische Entzündungserscheinungen hervor. Dazu gehören die
Entstehung von Fieber, die Bildung von Akutphasenproteinen und
gesteigerter Output von Leukozyten aus dem roten Knochenmark.
Zu pathologischen Reaktionen gehören geschwächte Herzfunktion, Thrombose und erniedrigte Insulinwirkung, sowie septischer Schock

TNF kann - wie andere Zytokine auch -
an unterschiedliche Rezeptoren binden und dabei auch unterschiedliche, teils sogar gegensätzliche Reaktionen auslösen. Beispiel TNF-
-α:
Bindet es an einen Rezeptor 1 (TNFR1), wird in der Zielzelle das
Caspasesystem aktiviert und deren Apoptose gestartet; bindet es an den
Rezeptor 2 (TNFR2), werden Kinasen aktiviert und damit die Zelle vor
Apoptose bewahrt. Die Expression von Rezeptoren ist klonal
unterschiedlich und damit auch das jeweilige Reaktionsmuster auf
extrazellulär auftauchende Zytokine.
Tumornekrosefaktor-α
ist
ein hauptsächlich von Makrophagen, aber auch von T-Lymphozyten,
dendritischen Zellen, Adipozyten und Fibroblasten gebildetes Protein. TNF wirkt auf
Immunzellen, Endothelien und andere Zellen regulierend ein; er beeinflusst Proliferation, Differenzierung und Apoptose von Zielzellen, Aktivierung
von Makrophagen und NK-Zellen, Bildung von Akutphasenproteinen in der
Leber, Osteoklastenaktivierung oder modifizierte synaptische
Transmission über Gliazellen.
TNF zerstört Infektionserreger und Tumorzellen (daher der Name), und es hemmt die
Nahrungsaufnahme (wirkt kachexiefördernd).
Fehlregulation involvierter Signalwege kann entzündliche und Autoimmunprozesse bewirken.
Koloniestimulierende Faktoren
( s. auch dort)
s. auch dort)
 Koloniestimulierende Faktoren (CSFs = colony stimulating factors) sind Zytokine,
welche Stammzellen im Knochenmark wachsen und reifen lassen. Für die
Entwicklung von Erythrozyten, Lymphozyten, Granulozyten und Monozyten
sind sie unabdingbar.
Koloniestimulierende Faktoren (CSFs = colony stimulating factors) sind Zytokine,
welche Stammzellen im Knochenmark wachsen und reifen lassen. Für die
Entwicklung von Erythrozyten, Lymphozyten, Granulozyten und Monozyten
sind sie unabdingbar.
 Abbildung: Hämatopoese
Nach einer Vorlage in Rassow / Deutzmann / Hauser, Duale Reihe: Biochemie, Thieme 2008
Abbildung: Hämatopoese
Nach einer Vorlage in Rassow / Deutzmann / Hauser, Duale Reihe: Biochemie, Thieme 2008

 Makrophagen / Monozyten: Fibroblasten, Endothelzellen, glatte Muskulatur, Stromazellen und Makrophagen produzieren konstitutiv M-CSF (macrophage colony-stimulating factor). M-CSF (CSF1) läßt aus Blutstammzellen Makrophagen, Monozyten und andere mononukleäre Phagozyten reifen und ermöglicht deren Wachstum und Überleben. CSF1-Rezeptoren haben alle Zellen
mononukleärer Herkunft, inlusive Monozyten, Makrophagen, Osteoklasten und Mikroglia.
Makrophagen / Monozyten: Fibroblasten, Endothelzellen, glatte Muskulatur, Stromazellen und Makrophagen produzieren konstitutiv M-CSF (macrophage colony-stimulating factor). M-CSF (CSF1) läßt aus Blutstammzellen Makrophagen, Monozyten und andere mononukleäre Phagozyten reifen und ermöglicht deren Wachstum und Überleben. CSF1-Rezeptoren haben alle Zellen
mononukleärer Herkunft, inlusive Monozyten, Makrophagen, Osteoklasten und Mikroglia.
 Granulozyten und Monozyten: Das Glycoprotein GM-CSF (CSF2) wird von Makrophagen,
T-Zellen, Fibroblasten, Endothelzellen, Mastzellen und NK-Zellen
produziert. CSF2 regt Stammzellen zur Produktion von Granulozyten und
Monozyten an. Letztere verlassen den Blutkreislauf und reifen im Gewebe
zu Makrophagen und dendritischen Zellen heran. CSF2 reguliert vorwiegend die Produktion von Zellen im Knochenmark.
Granulozyten und Monozyten: Das Glycoprotein GM-CSF (CSF2) wird von Makrophagen,
T-Zellen, Fibroblasten, Endothelzellen, Mastzellen und NK-Zellen
produziert. CSF2 regt Stammzellen zur Produktion von Granulozyten und
Monozyten an. Letztere verlassen den Blutkreislauf und reifen im Gewebe
zu Makrophagen und dendritischen Zellen heran. CSF2 reguliert vorwiegend die Produktion von Zellen im Knochenmark.
 Granulozyten: G-CSF (CSF3) entsteht in Endothelzellen, Makrophagen und anderen Immunzellen. Es steuert Entwicklung und Reifung neutrophiler Granulozyten,
deren Freisetzung aus dem Knochenmark und Funktion es fördert. Der entsprechende Rezeptor (G-CSF-R) wird von Vorläuferzellen im Knochenmark exprimiert und fördert die Differenzierung zu reifen Granulozyten.
Granulozyten: G-CSF (CSF3) entsteht in Endothelzellen, Makrophagen und anderen Immunzellen. Es steuert Entwicklung und Reifung neutrophiler Granulozyten,
deren Freisetzung aus dem Knochenmark und Funktion es fördert. Der entsprechende Rezeptor (G-CSF-R) wird von Vorläuferzellen im Knochenmark exprimiert und fördert die Differenzierung zu reifen Granulozyten.
 Megakaryozyten: Ihre Entwicklung regt das von Leber und Nieren sezernierte Thrombopoetin an.
Megakaryozyten: Ihre Entwicklung regt das von Leber und Nieren sezernierte Thrombopoetin an.
 Stammzellen: S-CSF tritt in einer freien und einer membrangebundenen Variante auf; Bindung an den Rezeptor führt zu Tyrosinkinaseaktivität.
Stammzellen: S-CSF tritt in einer freien und einer membrangebundenen Variante auf; Bindung an den Rezeptor führt zu Tyrosinkinaseaktivität.
 Auch Erythropoetin und einige Interleukine (wie IL-3) werden zu dieser Gruppe gezählt.
Auch Erythropoetin und einige Interleukine (wie IL-3) werden zu dieser Gruppe gezählt.
 Über zytokinartige Botenstoffe aus Muskel- oder Fettgewebe (z.B. Irisin, Leptin) s. dort
Über zytokinartige Botenstoffe aus Muskel- oder Fettgewebe (z.B. Irisin, Leptin) s. dort
Transformierende Wachstumsfaktoren
Zu den Transformierenden Wachstumsfaktoren (Transforming growth factors TGFs)
werden zwei Peptidklassen gezählt: TGF-α und TGF-β; diese sind
unterschiedlich aufgebaut und wirken über verschiedene Rezeptoren.
 TGF-α
TGF-α wird von Makrophagen, Gehirn- und Hautzellen gebildet und fördert das Epithelwachstum;
 TGF-β
TGF-β (3 Subtypen: 1-3) regulieren den Zellzyklus und induzieren Apoptose,
beeinflussen
Zelldifferenzierung, Entwicklung, Wachstum und Regeneration, sowie das
Immunsystem. Zur TGF-ß-Familie gehören weiters - von verschiedensten
Geweben gebildet - als
Aktivine (A, B) bezeichnete Glykoproteine, die neben
wachstumsfördernden und morphogenetischen auch
endokrine Wirkungen ausüben, u.a. die Aktivierung von
FSH.
TGFs wirken über
TGF-Rezeptoren,
die als dissoziierte Heterodimere (RI und RII) vorliegen. Bindet RII
das Hormon, dimerisieren die beiden, RII aktiviert RI, und dieses
aktiviert
SMADs*:
Zelluläre Proteine, die als Dimere Signale von TGF-Rezeptoren in den
Zellkern leiten und die Expression spezifischer Gene aktivieren.
* Nach "Small body size" (Fadenwurm) und "Mothers against decapentaplegic" (Taufliege)


Abbildung: Zytokinrezeptoren
Nach einer Vorlage in Abbas / Lichtman / Pillai, Cellular and Molecular Immunology, 9th ed. Elsevier 2018
Oben: Zytokinrezeptoren werden
entsprechend ihrer extrazellulären Domänen und intrazellulären
Signalwege klassifiziert. Die Liganden sind jeweils unter den
intrazellulären Anteilen angeführt (z.B. Chemokine für
GPCRs).
Typ-I-Rezeptoren haben keine eigene enzymatische Aktivität, bei Bindung ihres Signalstoffs (extrazellulär) dimerisieren sie und aktivieren Janus-Kinase (Jak; intrazellulär). JAK phosphoryliert STAT; STAT-Moleküle verfügen über eine DNA-bindende Domäne und wandern
nach ihrer Aktivierung in den Zellkern, wo sie ihre Zielgene
"einschalten". Näheres im nachstehenden Text.
Unten: Einige Rezeptorgruppen haben identische / homologe Untereinheiten (repräsentative Auswahl)
 Zytokine wirken - wie Hormone - über eigene Rezeptoren (
Zytokine wirken - wie Hormone - über eigene Rezeptoren ( Abbildung), die unterschiedliche intrazelluläre Mechanismen benützen. Sie steuern und koordinieren Funktionen des Immunsystems; so regen z.B. aktivierte T-Zellen B-Lymphozyten, die über passende Rezeptoren
für das erkannte Antigen verfügen, zu Teilung und Wachstum an.
Abbildung), die unterschiedliche intrazelluläre Mechanismen benützen. Sie steuern und koordinieren Funktionen des Immunsystems; so regen z.B. aktivierte T-Zellen B-Lymphozyten, die über passende Rezeptoren
für das erkannte Antigen verfügen, zu Teilung und Wachstum an.
Beispiel: Bei
entzündlichen Prozessen hat Interleukin 6 eine strategische Position
beim Übertragen angeborener
(Konzentration von Granulozyten) zu adaptiver Immunität (Attraktion von
T-Zellen). Es ist dabei dem (vor allem aus Makrophagen stammenden)
Tumornekrosefaktor untergeordnet, der mit entsprechenden Rezeptoren
ausgestattete Zellen aktivieren oder zerstören kann.
Alle
Zytokinrezeptoren bestehen aus einer oder mehreren
Transmembranproteinen; ihre extrazelluläre Domäne bindet ein Zytokin,
die zytoplasmatische startet draufhin intrazelluläre Signalkaskaden.
Meist werden dabei aktivierte Rezeptoren in der Membran zu Gruppen
versammelt (Clustering) - das schaltet entsprechende zelluläre Reaktionen ein.
Je nach der Struktur der extrazellulären Rezeptordomäne unterscheidet man verschiedene Zytokin-Rezeptorfamilien:
 Typ-I-Zytokinrezeptoren
Typ-I-Zytokinrezeptoren
(Hämatopoetin-Rezeptorfamilie) - z.B. für Interleukine 2, 4, 6, 7, 9,
11, 15, 21, 27; GM-CSF, G-CSF - nützen den JAK-STAT-Signalweg und
bestehen aus zwei oder drei Einheiten (dimer / trimer), die zusammen
eine ligandenbildende extrazelluläre Struktur (4 α-Helices, die
Aminosäuremuster bestimmen die Bindungsspezifität an das Zytokin) sowie
eine oder mehrere signalübermittelnde intrazelluläre Aminosäurekette(n)
bilden.

 Typ-II-Zytokinrezeptoren
Typ-II-Zytokinrezeptoren
(Interferon-Rezeptorfamilie) - z.B. für Interleukine 10, 20, 22;
Interferone vom Typ I und II. Auch diese Rezeptoren nützen den
JAK-STAT-Signalweg.

 TNF-Rezeptorfamilie
TNF-Rezeptorfamilie - z.B. TNF-Rezeptoren, CD40-Protein, Fas u.a. Diese Rezeptoren können Genexpression und auch (über Caspasen)
Apoptose anregen. Sie können Adapterproteine (
TRADD:
TNF receptor-associated death domain) nutzen, die ihrerseits weitere Proteine (
TRAFs:
TNF receptor associated factors) "einschalten".

 Interleukin 1-Rezeptorfamilie
Interleukin 1-Rezeptorfamilie: Diese Rezeptoren haben eine Toll/IL-1 Rezeptor (
TIR)
Domäne gemeinsam und nutzen ähnliche Wege zur Signalübermittlung zwecks
Gentranskription. Bei Bindung des Liganden dimerisieren die Rezeptoren
und aktivieren Adapterproteine, die den Rezeptor an Kinasen (
IRAK:
IL-1 receptor-associated kinase) koppeln und dadurch weitere Downstream-Mechanismen anregen.

 Interleukin 17-Rezeptorfamilie
Interleukin 17-Rezeptorfamilie:
Diese Rezeptoren liegen von Haus aus als Oligomere vor (Kombination des
Rezeptors mit A, B, C, D oder E-Ketten). Dabei werden TRAFs aktiviert
(s. TNF-Rezeptorfamilie) und (wie auch bei anderen Zytokinrezeptoren)
NF-κB aktiviert.

 TGF-beta Rezeptorfamilie
TGF-beta Rezeptorfamilie: Funktionsweise s.
dort

Einige Zytokinrezeptoren zählen zur
Immunglobulin-Superfamilie.

Bei zahlreichen Erkrankungen ist es wünschnswert, die Funktionsketten im Immunsystem zu modulieren. Dies kann mit einer Zytokintherapie
erfolgen. So stärkt man z.B. bei Infektionskrankheiten oder Tumoren die
Abwehr, oder man bremst sie bei Autoimmun- oder allergischen
Erkrankungen. Oder man verabreicht koloniestimulierende Faktoren (CSF)
nach Knochenmarkstransplantationen und regt so die Blutbildung an.
Ist die immunologische Selbsttoleranz (s. oben: Auslese im Thymus) gestört, kann es zu Autoimmunkrankheiten
kommen. Solche Erkrankungen sind oft mit spezifischen HLA-Mustern
assoziiert.
Helferzellen
sind das bevorzugte Ziel der AIDS-Erreger, HIV = human immunodeficiency
virus. Hier nimmt die Abwehrkraft auch gegenüber
sonst harmlosen Erregern - Bakterien, Pilzen - in
lebensbedrohlicher Weise ab. Man erkennt daran die Abwehrbedeutung der
T-Zellen: Ohne sie ist das Immunsystem nicht in der Lage, den Körper
ausreichend vor Infektionen zu schützen.
Zur T-Zell-Proliferation ist Interleukin 2 (IL-2) notwendig. Blockade des IL-2-Signalweges wird genützt, um die Abstoßung transplantierter Organe zu verhindern. Zu den Medikamenten, die auf diesem Weg wirksam sind, gehören Cyclosporin und Rapamycin.


 CD8-positive (zytotoxische) Lymphozyten können Zellen abtötetn, die über MHC-I
intrazelluläre Antigene aus proteasomalem Abbau präsentieren
CD8-positive (zytotoxische) Lymphozyten können Zellen abtötetn, die über MHC-I
intrazelluläre Antigene aus proteasomalem Abbau präsentieren
 CD4-positive (Helfer-) Lymphozyten werden durch MHC-II-gebundene Peptide aktiviert, die aus dem
lysosomalen Abbau endozytierter extrazellulärer Antigene stammen. Sie
helfen Phagozyten, aktivieren B-Lymphozyten und
regen Entzündungsvorgänge an CD4-positive (Helfer-) Lymphozyten werden durch MHC-II-gebundene Peptide aktiviert, die aus dem
lysosomalen Abbau endozytierter extrazellulärer Antigene stammen. Sie
helfen Phagozyten, aktivieren B-Lymphozyten und
regen Entzündungsvorgänge an
 Im Thymus reifen Stammzellen zu naiven Helfer-, zytotoxischen und
regulatorischen T-Zellen heran. Sie durchlaufen positive (mäßige Affinität zu MHC → Zelle überlebt) und negative Selektion (zu starke Affinität zu MHC → Apoptose),
bei ausbleibender Bindung an MHC kommt es ebenfalls zu Apoptose. Nur
ein geringer Anteil der unreifen
T-Zellen übersteht die Selektion und verlässt die Thymusdrüse als reife
T-Lymphozyten. Thymushormone (Thymosine) beeinflussen Differenzierung
und
Proliferation
Im Thymus reifen Stammzellen zu naiven Helfer-, zytotoxischen und
regulatorischen T-Zellen heran. Sie durchlaufen positive (mäßige Affinität zu MHC → Zelle überlebt) und negative Selektion (zu starke Affinität zu MHC → Apoptose),
bei ausbleibender Bindung an MHC kommt es ebenfalls zu Apoptose. Nur
ein geringer Anteil der unreifen
T-Zellen übersteht die Selektion und verlässt die Thymusdrüse als reife
T-Lymphozyten. Thymushormone (Thymosine) beeinflussen Differenzierung
und
Proliferation
 Die Aktivierung naiver T-Zellen erfordert die Präsentation des
passenden Antigens durch dendritische Zellen. Auf positive Erkennung
folgt Zytokinsekretion, Proliferation (Klonerweiterung) und
Differenzierung der naiven zu reifen Lymphozyten (Effektor- und
Gedächtniszellen). Diese gelangen in sekundäre lymphatische Organe
(Lymphknoten, Milz, Peyer-Plaques) und können von dort über den
Kreislauf überall im Körper ihre Funktionen ausüben
Die Aktivierung naiver T-Zellen erfordert die Präsentation des
passenden Antigens durch dendritische Zellen. Auf positive Erkennung
folgt Zytokinsekretion, Proliferation (Klonerweiterung) und
Differenzierung der naiven zu reifen Lymphozyten (Effektor- und
Gedächtniszellen). Diese gelangen in sekundäre lymphatische Organe
(Lymphknoten, Milz, Peyer-Plaques) und können von dort über den
Kreislauf überall im Körper ihre Funktionen ausüben
 T-Zell-Rezeptoren (TCR) erkennen Peptidantigene und liegen in
Nachbarschaft regulierender Membranproteine wie ITAMS und ITIMS, die
nach Bindung des Antigens phosphoryliert werden. Einmal aktiviert,
senden TCR - unterstützt durch Hilfsfaktoren (CD3-Komplex) - ein Signal
an den Zellkern, um die Immunreaktion des Lymphozyten zu starten
T-Zell-Rezeptoren (TCR) erkennen Peptidantigene und liegen in
Nachbarschaft regulierender Membranproteine wie ITAMS und ITIMS, die
nach Bindung des Antigens phosphoryliert werden. Einmal aktiviert,
senden TCR - unterstützt durch Hilfsfaktoren (CD3-Komplex) - ein Signal
an den Zellkern, um die Immunreaktion des Lymphozyten zu starten
 Zytotoxische (CD8+) T-Zellen attackieren virusinfizierte, bakterienbefallene oder Tumorzellen. Aktiviert werden CD8+-T-Zellen durch dendritische Zellen und CD4+-T-Helferzellen, die das entsprechende antigene Peptid erkennen Zytotoxische (CD8+) T-Zellen attackieren virusinfizierte, bakterienbefallene oder Tumorzellen. Aktiviert werden CD8+-T-Zellen durch dendritische Zellen und CD4+-T-Helferzellen, die das entsprechende antigene Peptid erkennen
 Dendritische Zellen sind meist nicht selbst von Viren infiziert; sie
endozytieren virusinfizierte oder Tumorzellen und präsentieren daraus
gewonnene Antigene über MHC-I an CD8+-Lymphozyten. Diese
kontrollieren solchermaßen alle kernhaltigem Zellen des Körpers auf
Fremdpeptide und töten diese bei Erkennung durch Freisetzung
zytotoxischer Proteine (Perforin-Granzym-Mechanismus). Auch wird die
Apoptose aktiviert (Caspase). Nach erfolgreichem Angriff löst sich die
CD8+-T-Zelle wieder von der Zielzelle ab und kann weitere virusbefallene oder Krebszellen attackieren
Dendritische Zellen sind meist nicht selbst von Viren infiziert; sie
endozytieren virusinfizierte oder Tumorzellen und präsentieren daraus
gewonnene Antigene über MHC-I an CD8+-Lymphozyten. Diese
kontrollieren solchermaßen alle kernhaltigem Zellen des Körpers auf
Fremdpeptide und töten diese bei Erkennung durch Freisetzung
zytotoxischer Proteine (Perforin-Granzym-Mechanismus). Auch wird die
Apoptose aktiviert (Caspase). Nach erfolgreichem Angriff löst sich die
CD8+-T-Zelle wieder von der Zielzelle ab und kann weitere virusbefallene oder Krebszellen attackieren
 CD4+-T-Lymphozyten
kommen in mehreren Varianten vor und bilden für die jeweilige Situation
optimierte "Zytokin-Cocktails": Th1-Helferzellen bekämpfen
intrazelluläre Pathogene, Th2-Helferzellen Mikroben auf Schleimhäuten
und Würmer, Th17-Helferzellen extrazelluläre Bakterien und Pilze,
Tfh-Helferzellen extrazelluläre Pathogene, Treg-Zellen bremsen
Effektor-T-Zellen und unterdrücken Immunreaktionen CD4+-T-Lymphozyten
kommen in mehreren Varianten vor und bilden für die jeweilige Situation
optimierte "Zytokin-Cocktails": Th1-Helferzellen bekämpfen
intrazelluläre Pathogene, Th2-Helferzellen Mikroben auf Schleimhäuten
und Würmer, Th17-Helferzellen extrazelluläre Bakterien und Pilze,
Tfh-Helferzellen extrazelluläre Pathogene, Treg-Zellen bremsen
Effektor-T-Zellen und unterdrücken Immunreaktionen
|

 Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.
Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.




 Apoptose: ἀποπίπτειν = abfallen
Apoptose: ἀποπίπτειν = abfallen


 T-Zellen und spezifische Abwehr
T-Zellen und spezifische Abwehr  Thymus: Positive und negative Selektion
Thymus: Positive und negative Selektion  T-Zell-Aktivierung, klonale Expansion und Kontraktion
T-Zell-Aktivierung, klonale Expansion und Kontraktion  Gedächtniszellen
Gedächtniszellen  T-Zellen und ihre Rezeptoren
T-Zellen und ihre Rezeptoren  Aktivierung des TCR, erstes und zweites Signal
Aktivierung des TCR, erstes und zweites Signal  Arten von T-Zellen
Arten von T-Zellen  Lymphozyten mit limitierter Diversität
Lymphozyten mit limitierter Diversität  Zytokine
Zytokine  Zytokinrezeptorfamilie
Zytokinrezeptorfamilie 
 Thymosine
Thymosine  Positive Selektion
Positive Selektion  Negative Selektion
Negative Selektion  AIRE
AIRE  TNF-Superfamilie
TNF-Superfamilie  Klonale Expansion
Klonale Expansion  Immunologische Synapse
Immunologische Synapse  Perforin, Granzyme
Perforin, Granzyme  Zytokin
Zytokin  Interferone
Interferone  Chemokine
Chemokine  Koloniestimulierende Faktoren (CSF)
Koloniestimulierende Faktoren (CSF)  Treg-Zellen
Treg-Zellen 
 Core messages
Core messages
 Abbildung: T-Lymphozyten-Zirkulation
Abbildung: T-Lymphozyten-Zirkulation
 CD8+-Lymphozyten (MHC-I-aktiviert) töten Zellen ab, die intrazelluläre
Antigene produzieren (z.B. wenn diese virusinfiziert sind oder
Tumorprotein erzeugen), und aktivieren Makrophagen, Antigenträger zu
phagozytieren. Da Lymphozyten, die intensiv auf körpereigene Peptide
reagieren, im Thymus eliminiert werden (negative Selektion), reagiert
das System normalerweise nicht auf normale "Selbst"-Moleküle (Selbsttoleranz, horror autotoxicus) und verursacht keine Autoimmunität. Nur MHC-I-gebundene Peptide, die dem System fremd sind (aus dem proteasomalen Abbau veränderter, viraler, oder aus Fremdgewebe stammender Proteine resultieren), führen zu Immunreaktionen und Zerstörung der Zelle (Abtötung virusinfizierter Zellen, Krebszellen, oder Transplantatabstoßung).
CD8+-Lymphozyten (MHC-I-aktiviert) töten Zellen ab, die intrazelluläre
Antigene produzieren (z.B. wenn diese virusinfiziert sind oder
Tumorprotein erzeugen), und aktivieren Makrophagen, Antigenträger zu
phagozytieren. Da Lymphozyten, die intensiv auf körpereigene Peptide
reagieren, im Thymus eliminiert werden (negative Selektion), reagiert
das System normalerweise nicht auf normale "Selbst"-Moleküle (Selbsttoleranz, horror autotoxicus) und verursacht keine Autoimmunität. Nur MHC-I-gebundene Peptide, die dem System fremd sind (aus dem proteasomalen Abbau veränderter, viraler, oder aus Fremdgewebe stammender Proteine resultieren), führen zu Immunreaktionen und Zerstörung der Zelle (Abtötung virusinfizierter Zellen, Krebszellen, oder Transplantatabstoßung). CD4+-Lymphozyten hingegen (MHC-II-aktiviert) tragen zur Eliminierung extrazellulärer
Antigene bei: Sie helfen Phagozyten dabei,
Mikroben (oder infizierte Zellen) zu zerstören; sie aktivieren
B-Lymphozyten (Plasmazellen) zur Produktion von Antikörpern, die
extrazelluläre Antigene stoppen können; und sie regen Entzündungsvorgänge (vermehrte Durchblutung und Gefäßdurchlässigkeit) an.
CD4+-Lymphozyten hingegen (MHC-II-aktiviert) tragen zur Eliminierung extrazellulärer
Antigene bei: Sie helfen Phagozyten dabei,
Mikroben (oder infizierte Zellen) zu zerstören; sie aktivieren
B-Lymphozyten (Plasmazellen) zur Produktion von Antikörpern, die
extrazelluläre Antigene stoppen können; und sie regen Entzündungsvorgänge (vermehrte Durchblutung und Gefäßdurchlässigkeit) an. Abbildung unten). Im Gegensatz zur Milz ("freier Eintritt") ist der Eintritt von Blutkörperchen in den Thymus restringiert; T-Zell-Vorläufer aus dem Knochenmark werden aber von thymischen Stoffen - z.B. Lymphotactin - angelockt.
Abbildung unten). Im Gegensatz zur Milz ("freier Eintritt") ist der Eintritt von Blutkörperchen in den Thymus restringiert; T-Zell-Vorläufer aus dem Knochenmark werden aber von thymischen Stoffen - z.B. Lymphotactin - angelockt.  Als CD3 bezeichnet
man einen T-Zell-Corezeptor, der zur Aktivierung von Helfer- (CD4+)
und/oder zytotoxischen (CD8+) Lymphozyten notwendig ist. Seine γ-, δ-
und ε-Ketten assoziieren mit dem T-Zell-Rezeptor sowie der ζ-Kette, und
dieser Komplex triggern ein Aktivierungssignal im Lymphozyten:
Phosphorylierung von ITAM an CD3 ermöglicht an der ζ-Kette die Bindung einer Kinase (ZAP70, zeta-assoziiertes Protein), die sich an der Aktivierung der Zelle beteiligt.
Als CD3 bezeichnet
man einen T-Zell-Corezeptor, der zur Aktivierung von Helfer- (CD4+)
und/oder zytotoxischen (CD8+) Lymphozyten notwendig ist. Seine γ-, δ-
und ε-Ketten assoziieren mit dem T-Zell-Rezeptor sowie der ζ-Kette, und
dieser Komplex triggern ein Aktivierungssignal im Lymphozyten:
Phosphorylierung von ITAM an CD3 ermöglicht an der ζ-Kette die Bindung einer Kinase (ZAP70, zeta-assoziiertes Protein), die sich an der Aktivierung der Zelle beteiligt. Thymosine
Thymosine  ("Thymushormone"
- sie wirken an vielen Stellen im Körper, nicht nur im Thymus) sind
eine Gruppe genetisch und strukturell unterschiedlicher kleiner (1 bis
15 kDa) Peptide,
die (nach ihrer elektrophoretischen Wanderungsgeschwindigkeit) als α-, β-
und γ-Thymosine bezeichnet werden. Insbesondere das Thymosin β4 (Tβ4) beeinflusst - zusammen mit der spezifischen Umgebung (microenvironment) - Reifung, Differenzierung und Proliferation von T-Zellen.
("Thymushormone"
- sie wirken an vielen Stellen im Körper, nicht nur im Thymus) sind
eine Gruppe genetisch und strukturell unterschiedlicher kleiner (1 bis
15 kDa) Peptide,
die (nach ihrer elektrophoretischen Wanderungsgeschwindigkeit) als α-, β-
und γ-Thymosine bezeichnet werden. Insbesondere das Thymosin β4 (Tβ4) beeinflusst - zusammen mit der spezifischen Umgebung (microenvironment) - Reifung, Differenzierung und Proliferation von T-Zellen.  regen die Bildung von T-Zell-Vorläufern im roten Knochenmark an,
regen die Bildung von T-Zell-Vorläufern im roten Knochenmark an, steuern die Differenzierung in Helfer-, regulatorische und zytotoxische T-Zellen (s. weiter unten),
steuern die Differenzierung in Helfer-, regulatorische und zytotoxische T-Zellen (s. weiter unten), aktivieren reife T-Zellen in Lymphknoten und Milz,
aktivieren reife T-Zellen in Lymphknoten und Milz, regulieren die Aktivität verschiedener Zellen, beispielsweise fördert Thymulin die Sekretion von GH, Prolaktin, ACTH, TSH und LH (endokrine Wirkungen).
regulieren die Aktivität verschiedener Zellen, beispielsweise fördert Thymulin die Sekretion von GH, Prolaktin, ACTH, TSH und LH (endokrine Wirkungen). Um immunologisch brauchbar zu sein, müssen die Rezeptoren der (zunächst noch doppelt positiven) T-Zellen Komplexe aus Peptid und MHC antigenpräsentierender Zellen schwach bis mäßig stark binden. Können sie das, überleben sie (positive Selektion): Erkennung von Peptid auf MHC-I (Cofaktor CD8) ergibt eine reife CD8+ Zelle, Erkennung von Peptid auf MHC-II (Cofaktor
CD4) eine reife CD4+ Zelle (
Um immunologisch brauchbar zu sein, müssen die Rezeptoren der (zunächst noch doppelt positiven) T-Zellen Komplexe aus Peptid und MHC antigenpräsentierender Zellen schwach bis mäßig stark binden. Können sie das, überleben sie (positive Selektion): Erkennung von Peptid auf MHC-I (Cofaktor CD8) ergibt eine reife CD8+ Zelle, Erkennung von Peptid auf MHC-II (Cofaktor
CD4) eine reife CD4+ Zelle ( Abbildung).
Abbildung).  Zellen, die Peptid-MHC-Komplexe nicht erkennen, sind nutzlos, werden nicht positiv selektioniert und werden zur Apoptose gebracht (death by neglect). Ist die Bindung zu stark, gefährden sie die eigenen Zellen (Autoimmunität!) und sterben ebenfalls apoptotisch ab (negative Selektion).
Zellen, die Peptid-MHC-Komplexe nicht erkennen, sind nutzlos, werden nicht positiv selektioniert und werden zur Apoptose gebracht (death by neglect). Ist die Bindung zu stark, gefährden sie die eigenen Zellen (Autoimmunität!) und sterben ebenfalls apoptotisch ab (negative Selektion).  Gereifte einfach-positive Lymphozyten gelangen über das Endothel von
Thymus-Venolen als naive (immunkompetente, aber noch nicht durch
Antigenkontakt selektionierte) T-Zellen in den Kreislauf.
Gereifte einfach-positive Lymphozyten gelangen über das Endothel von
Thymus-Venolen als naive (immunkompetente, aber noch nicht durch
Antigenkontakt selektionierte) T-Zellen in den Kreislauf.
 Abbildung: Reifung und Selektion MHC-restringierter T-Zellen im Thymus
Abbildung: Reifung und Selektion MHC-restringierter T-Zellen im Thymus Positive Selektion bedeutet, dass ein Thymozyt, der Peptid-MHC-Komplexe auf antigenpräsentierenden kortikalen Epithelzellen schwach bis mäßig stark bindet, überlebt und sich teilt. Der Sinn dieses
Mechanismus liegt darin, dass nur über eigene MHC-Rezeptoren präsentierte Peptide
vom TCR erkannt wird.
Positive Selektion bedeutet, dass ein Thymozyt, der Peptid-MHC-Komplexe auf antigenpräsentierenden kortikalen Epithelzellen schwach bis mäßig stark bindet, überlebt und sich teilt. Der Sinn dieses
Mechanismus liegt darin, dass nur über eigene MHC-Rezeptoren präsentierte Peptide
vom TCR erkannt wird.  (Reaktion Fas-FasL) und stirbt ab.)
(Reaktion Fas-FasL) und stirbt ab.)  Negative Selektion ist
die Eliminierung junger Lymphozyten, die stark selbstreaktive
Antigenrezeptoren exprimieren. Negative Selektion unterstützt
Selbsttoleranz, d.h. Ausbleiben eines immunologischen Angriffs auf körpereigene Moleküle.
Negative Selektion ist
die Eliminierung junger Lymphozyten, die stark selbstreaktive
Antigenrezeptoren exprimieren. Negative Selektion unterstützt
Selbsttoleranz, d.h. Ausbleiben eines immunologischen Angriffs auf körpereigene Moleküle.  AIRE (Autoimmun-Regulator, autoimmune regulator) ist ein Protein, das in der Übergangszone Rinde-Mark des Thymus die Expression mehrerer tausend Arten gewebespezifischer Autoantigene in Epithelzellen anregt. Deren durch Wirkung von Proteasomen entstandenen Bruchstücke
werden MHC-I gekoppelt T-Zellen
präsentiert. Binden diese das Antigen, sterben sie durch Apoptose
(negative Selektion).
AIRE (Autoimmun-Regulator, autoimmune regulator) ist ein Protein, das in der Übergangszone Rinde-Mark des Thymus die Expression mehrerer tausend Arten gewebespezifischer Autoantigene in Epithelzellen anregt. Deren durch Wirkung von Proteasomen entstandenen Bruchstücke
werden MHC-I gekoppelt T-Zellen
präsentiert. Binden diese das Antigen, sterben sie durch Apoptose
(negative Selektion).  Positive Selektion (Thymusrinde)
Positive Selektion (Thymusrinde) Negative Selektion (Thymusmark)
Negative Selektion (Thymusmark) Aktivierung anderer Zellen (Peripherie).
Aktivierung anderer Zellen (Peripherie).  Kortikale Epithelzellen für die MHC-Restriktion (positive Selektion)
Kortikale Epithelzellen für die MHC-Restriktion (positive Selektion) Medulläre dendritische (aus dem Knochenmark stammende) und medulläre Epithelzellen für die Toleranzprüfung (negative Selektion)
Medulläre dendritische (aus dem Knochenmark stammende) und medulläre Epithelzellen für die Toleranzprüfung (negative Selektion) antigenpräsentierende Zellen für die Aktivierung im lymphatischen Gewebe.
antigenpräsentierende Zellen für die Aktivierung im lymphatischen Gewebe. Helferzellen (CD4+, Th-Zellen) sezernieren Zytokine
Helferzellen (CD4+, Th-Zellen) sezernieren Zytokine  , welche andere Lymphozyten anregen;
, welche andere Lymphozyten anregen;  Zytotoxische Zellen (CTL, CD8+, TC-Zellen) zerstören virusinfizierte, Tumor- und Fremdzellen;
Zytotoxische Zellen (CTL, CD8+, TC-Zellen) zerstören virusinfizierte, Tumor- und Fremdzellen; Regulatorische Zellen (TReg) - früher auch Suppressorzellen - hemmen Induktion und Proliferation von Effektorzellen (Th, TC).
Regulatorische Zellen (TReg) - früher auch Suppressorzellen - hemmen Induktion und Proliferation von Effektorzellen (Th, TC).

 Entwicklung von Effektor CD4+ T-Zellen
Entwicklung von Effektor CD4+ T-Zellen
 Lymphknoten (detektieren Antigene aus dem Gewebe),
Lymphknoten (detektieren Antigene aus dem Gewebe),  Milz (detektieren Antigene im Blut),
Milz (detektieren Antigene im Blut),  muköse lymphatische Gewebe (detektieren Antigene auf Schleimhäuten).
muköse lymphatische Gewebe (detektieren Antigene auf Schleimhäuten). Abbildung).
Abbildung). 
 Abbildung: Aktivierung von T-Zellen
Abbildung: Aktivierung von T-Zellen
 Präsentieren B-Lymphozyten Antigene, bilden Helfer-T-Zellen Zytokine und regen die B-Zellen an;
Präsentieren B-Lymphozyten Antigene, bilden Helfer-T-Zellen Zytokine und regen die B-Zellen an; Makrophagen präsentieren Antigene an CD4+-T-Zellen und lassen sich von diesen stimulieren;
Makrophagen präsentieren Antigene an CD4+-T-Zellen und lassen sich von diesen stimulieren; praktisch alle kernhaltigen Zellen präsentieren Antigene an CD8+-T-Zellen (und werden von diesen abgetötet, wenn sie z.B. virale Antigene präsentieren).
praktisch alle kernhaltigen Zellen präsentieren Antigene an CD8+-T-Zellen (und werden von diesen abgetötet, wenn sie z.B. virale Antigene präsentieren). Erkennt und bindet der
T-Zell-Rezeptor (TCR) ein Antigen in Kombination mit MHC, kommt es
damit noch nicht zur Weiterleitung eines Signals in die Zelle. Dazu
bedarf es weiterer Faktoren, sogenannter Costimulatoren:
Erkennt und bindet der
T-Zell-Rezeptor (TCR) ein Antigen in Kombination mit MHC, kommt es
damit noch nicht zur Weiterleitung eines Signals in die Zelle. Dazu
bedarf es weiterer Faktoren, sogenannter Costimulatoren:  CD3- und ζ (Zeta)- Proteine, die zusammen mit dem Rezeptor einen TCR-Komplex bilden. Diese Faktoren sind für den Start einer Signalübermittlung unverzichtbar, wenn der Rezeptor ein Antigen gebunden hat.
CD3- und ζ (Zeta)- Proteine, die zusammen mit dem Rezeptor einen TCR-Komplex bilden. Diese Faktoren sind für den Start einer Signalübermittlung unverzichtbar, wenn der Rezeptor ein Antigen gebunden hat. Weitere Oberflächenproteine
- Adhäsionsmoleküle, Corezeptoren, Costimulatoren - sowie Zytokine komplettieren die Aktivierung / Proliferation zu Effektor- und
Gedächtnis- T-Zellen. Ein solcher Costimulator auf aktivierten
antigenpräsentierenden Zellen ist B7, er bindet an CD28 auf T-Zellen
(
Weitere Oberflächenproteine
- Adhäsionsmoleküle, Corezeptoren, Costimulatoren - sowie Zytokine komplettieren die Aktivierung / Proliferation zu Effektor- und
Gedächtnis- T-Zellen. Ein solcher Costimulator auf aktivierten
antigenpräsentierenden Zellen ist B7, er bindet an CD28 auf T-Zellen
( Abbildung). Die Kombination CD28 mit dem Antigensignal ist für
Überleben und Proliferation entsprechender T-Zellen erforderlich.
Abbildung). Die Kombination CD28 mit dem Antigensignal ist für
Überleben und Proliferation entsprechender T-Zellen erforderlich.
 Abbildung: Rolle von Costimulatoren bei der Aktivierung von T-Lymphozyten
Abbildung: Rolle von Costimulatoren bei der Aktivierung von T-Lymphozyten
 Die TNF-Superfamilie (TNFSF)
ist eine große Familie homologer Transmembran-Proteine. Diese
regulieren Wachstum, Differenzierung, Genexpression und Apoptose. Dazu
binden sie an Mitglieder der TNF-Rezeptor-Superfamilie (TNFRSF), ebenfall eine große Gruppe transmembranaler Proteine.
Die TNF-Superfamilie (TNFSF)
ist eine große Familie homologer Transmembran-Proteine. Diese
regulieren Wachstum, Differenzierung, Genexpression und Apoptose. Dazu
binden sie an Mitglieder der TNF-Rezeptor-Superfamilie (TNFRSF), ebenfall eine große Gruppe transmembranaler Proteine. Abbildung).
Abbildung).
 Abbildung: Costimulation - CD40 und T-Zell-Aktivierung
Abbildung: Costimulation - CD40 und T-Zell-Aktivierung
 Effektor-Lymphozyten sind bereit für den Einsatz überall im
Gewebe. Hier treffen sie auf Antigene, die ihre Aktivierung ausgelöst
haben. Sie können Zellen direkt zerstören (CD8+) und/oder
andere Immunzellen stimulieren, z.B. Makrophagen, B-Zellen oder
Granulozyten.
Effektor-Lymphozyten sind bereit für den Einsatz überall im
Gewebe. Hier treffen sie auf Antigene, die ihre Aktivierung ausgelöst
haben. Sie können Zellen direkt zerstören (CD8+) und/oder
andere Immunzellen stimulieren, z.B. Makrophagen, B-Zellen oder
Granulozyten.  CD29 - binnen Stunden exprimieren T-Zellen dieses Protein, das über
seinen Bindungspartner (Sphingosin-1-Phosphat Rezeptor) die
Verweildauer der T-Zelle im lymphatischen Organ verlängert, was Zeit
für Proliferation und Differenzierung bringt;
CD29 - binnen Stunden exprimieren T-Zellen dieses Protein, das über
seinen Bindungspartner (Sphingosin-1-Phosphat Rezeptor) die
Verweildauer der T-Zelle im lymphatischen Organ verlängert, was Zeit
für Proliferation und Differenzierung bringt; CD25 (IL-2-Rezeptor) - dadurch können T-Zellen auf Interleukin 2 reagieren;
CD25 (IL-2-Rezeptor) - dadurch können T-Zellen auf Interleukin 2 reagieren; CD40-Ligand - hier dauert die Expression 1-2 Tage (
CD40-Ligand - hier dauert die Expression 1-2 Tage ( Abbildung), ebenso für
Abbildung), ebenso für  CD152;
CD152; Adhäsionsmoleküle und Chemokinrezeptoren.
Adhäsionsmoleküle und Chemokinrezeptoren.
 Abbildung: Expression von Oberflächenmolekülen nach Aktivierung von T-Zellen
Abbildung: Expression von Oberflächenmolekülen nach Aktivierung von T-Zellen
 Abbildung unten).
Abbildung unten).  Klonale Expansion ist die 103- bis 105-fache
Vermehrung der Zahl von Lymphozyten (B / T) im Körper, die ein
bestimmtes Antigen erkennen. Sie erfolgt in lymphatischem Gewebe.
Klonale Expansion ist die 103- bis 105-fache
Vermehrung der Zahl von Lymphozyten (B / T) im Körper, die ein
bestimmtes Antigen erkennen. Sie erfolgt in lymphatischem Gewebe. Abbildung).
Das liegt daran, dass durch die Beseitigung der Antigene auch der
anregende Reiz (durch Antigen, Costimulatoren und Zytokine) wieder
wegfällt. Dazu kommen inhibitorische Mechanismen (z.B. TReg-Lymphozyten), die im Rahmen der
Antigenerkennung aktiv werden.
Abbildung).
Das liegt daran, dass durch die Beseitigung der Antigene auch der
anregende Reiz (durch Antigen, Costimulatoren und Zytokine) wieder
wegfällt. Dazu kommen inhibitorische Mechanismen (z.B. TReg-Lymphozyten), die im Rahmen der
Antigenerkennung aktiv werden.
 Abbildung: Klonale Expression und Kontraktion von T-Lymphozyten
Abbildung: Klonale Expression und Kontraktion von T-Lymphozyten
 Sie exprimieren antiapoptotische Proteine, was zu ihrer hohen Überlebenszeit beiträgt. Bei älteren Menschen sind mehr als 50% der T-Zellen im Blut Gedächtniszellen.
Sie exprimieren antiapoptotische Proteine, was zu ihrer hohen Überlebenszeit beiträgt. Bei älteren Menschen sind mehr als 50% der T-Zellen im Blut Gedächtniszellen. Sie reagieren rascher auf das Auftauchen "ihres" Antigens als entsprechende naive T-Zellen. Wahrscheinlich spielen dabei epigenetische Umstellungen eine Rolle.
Sie reagieren rascher auf das Auftauchen "ihres" Antigens als entsprechende naive T-Zellen. Wahrscheinlich spielen dabei epigenetische Umstellungen eine Rolle. Nach Ablauf der Immunantwort und Klonexpansion liegen etwa 10- bis 100-fach mehr spezifische Gedächtnis- als naive T-Zellen des Zellklons vor.
Nach Ablauf der Immunantwort und Klonexpansion liegen etwa 10- bis 100-fach mehr spezifische Gedächtnis- als naive T-Zellen des Zellklons vor.  Gedächtniszellen begeben sich in das Gewebe und antworten bei weiterem
Antigenkontakt direkt am "Ort des Geschehens", und sind dort weniger
abhängig von Costimulierung als naive T-Zellen.
Gedächtniszellen begeben sich in das Gewebe und antworten bei weiterem
Antigenkontakt direkt am "Ort des Geschehens", und sind dort weniger
abhängig von Costimulierung als naive T-Zellen. Sie können replizieren, allerdings mit relativ niedriger Quote.
Sie können replizieren, allerdings mit relativ niedriger Quote. Ihre Erhaltung hängt von der Anwesenheit von Zytokinen (vor allem IL-7), nicht aber von der Anwesenheit des Antigens, ab.
Ihre Erhaltung hängt von der Anwesenheit von Zytokinen (vor allem IL-7), nicht aber von der Anwesenheit des Antigens, ab. Das Verhältnis der Zahlen von naiven zu Gedächtnis-T-Zellen im Kreislauf nimmt mit zunehmendem Alter kontinuierlich ab - von fast 100% naiven T-Lymphozyten bei Neugeborenen bis auf ~20% im höheren Alter.
Das Verhältnis der Zahlen von naiven zu Gedächtnis-T-Zellen im Kreislauf nimmt mit zunehmendem Alter kontinuierlich ab - von fast 100% naiven T-Lymphozyten bei Neugeborenen bis auf ~20% im höheren Alter.  Abbildung) bestehen aus zwei Proteinen (sie
sind heterodimer) - jeweils aus einer leichten (α oder γ) und einer schweren Kette (β oder δ):
Abbildung) bestehen aus zwei Proteinen (sie
sind heterodimer) - jeweils aus einer leichten (α oder γ) und einer schweren Kette (β oder δ):
 Abbildung: T-Zell-Rezeptor (TCR)
Abbildung: T-Zell-Rezeptor (TCR)
 Der extrazelluläre Teil (N-Terminus) enthält je Kette zwei Domänen, eine (hyper-) variable (z.B. Vα und Vβ) und eine nichtvariable (constant, z.B. Cα und Cβ). An den (hyper)variablen Teil bindet das Antigen bzw. Epitop, im Gegensatz zu Antikörpern nicht mit zwei, sondern nur einer Bindungsstelle
Der extrazelluläre Teil (N-Terminus) enthält je Kette zwei Domänen, eine (hyper-) variable (z.B. Vα und Vβ) und eine nichtvariable (constant, z.B. Cα und Cβ). An den (hyper)variablen Teil bindet das Antigen bzw. Epitop, im Gegensatz zu Antikörpern nicht mit zwei, sondern nur einer Bindungsstelle Die
transmembranale Sequenz verankert den Rezeptor in der Zellmembran
Die
transmembranale Sequenz verankert den Rezeptor in der Zellmembran Die kurze intrazelluläre
Domäne (C-Terminus) ist mit einem signalübertragenden CD3-Komplex assoziiert.
Die kurze intrazelluläre
Domäne (C-Terminus) ist mit einem signalübertragenden CD3-Komplex assoziiert. Gelöste Antigene erkennen TCR
nicht (anders als B-Zell-Rezeptoren und Rezeptoren des angeborenen
Immunsystems).
Gelöste Antigene erkennen TCR
nicht (anders als B-Zell-Rezeptoren und Rezeptoren des angeborenen
Immunsystems).  T-Zellen haben entweder α/β- oder γ/δ-TCR - niemals beide gleichzeitig.
T-Zellen haben entweder α/β- oder γ/δ-TCR - niemals beide gleichzeitig. Obwohl jede Ei- und jede Samenzelle nur jeweils 4 TCR-Gene enthält
(TRA, TRB, TRD, TRG), entstehen im Laufe der Ontogenese (individuellen Entwicklung)
unterschiedliche T-Zell-Klone mit unterschiedlichen
TCR. Die zugrunde liegenden DNA-Veränderungen erfolgen in zellspezifischer Weise.
Obwohl jede Ei- und jede Samenzelle nur jeweils 4 TCR-Gene enthält
(TRA, TRB, TRD, TRG), entstehen im Laufe der Ontogenese (individuellen Entwicklung)
unterschiedliche T-Zell-Klone mit unterschiedlichen
TCR. Die zugrunde liegenden DNA-Veränderungen erfolgen in zellspezifischer Weise. Abbildung).
Abbildung). 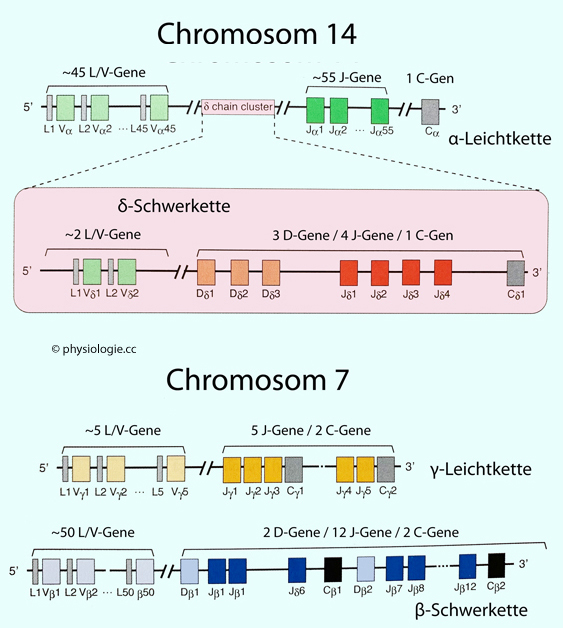
 Abbildung: TCR-Ketten codierende Gencluster
Abbildung: TCR-Ketten codierende Gencluster
 Die DNA zwischen einem Vα- und einem Jα-Gen wird entfernt
Die DNA zwischen einem Vα- und einem Jα-Gen wird entfernt Das Vα- und Jα-Gen werden verknüpft
Das Vα- und Jα-Gen werden verknüpft mRNA wird transkribiert (enthält umgruppierte VJ-Gene sowie Cα-Gen)
mRNA wird transkribiert (enthält umgruppierte VJ-Gene sowie Cα-Gen) Zwischenstücke (mRNA zwischen Vα- und Jα- sowie Jα- und Cα-Gentranskript) werden entfernt
Zwischenstücke (mRNA zwischen Vα- und Jα- sowie Jα- und Cα-Gentranskript) werden entfernt Die "gestutzte" mRNA dient als Vorlage für Synthese (Translation) der α-TCR-Kette.
Die "gestutzte" mRNA dient als Vorlage für Synthese (Translation) der α-TCR-Kette. für α auf Chromosom 14 (45 V- und 55 J-Gene, Gesamtzahl der möglichen Kombinationen 2475)
für α auf Chromosom 14 (45 V- und 55 J-Gene, Gesamtzahl der möglichen Kombinationen 2475) für β auf Chromosom 7 (50 V-, 2 D-, 12 J-Gene, Gesamtzahl der möglichen Kombinationen 1200)
für β auf Chromosom 7 (50 V-, 2 D-, 12 J-Gene, Gesamtzahl der möglichen Kombinationen 1200) für γ auf Chromosom 7 (5 V-,5 J-Gene, Gesamtzahl der möglichen Kombinationen 25)
für γ auf Chromosom 7 (5 V-,5 J-Gene, Gesamtzahl der möglichen Kombinationen 25) für δ auf Chromosom 14 (2 V-, 3 D-, 4 J-Gene, Gesamtzahl der möglichen Kombinationen 24)
für δ auf Chromosom 14 (2 V-, 3 D-, 4 J-Gene, Gesamtzahl der möglichen Kombinationen 24) Zur somatischen Rekombination (Immunglobuline / T-Zell-Rezeptoren) s. auch dort
Zur somatischen Rekombination (Immunglobuline / T-Zell-Rezeptoren) s. auch dort
 stabilisiert die Interaktion von antigenpräsentierender und T-Zelle,
stabilisiert die Interaktion von antigenpräsentierender und T-Zelle,  ist Ausgangspunkt für die Signaltransduktion
in angeregten T-Zellen,
ist Ausgangspunkt für die Signaltransduktion
in angeregten T-Zellen,  stellt die optimale Abfolge
und Kombination der spezifischen (z.B. Zytokinsekretion), zum Teil
aggressiven (z.B. Freisetzung von Perforin) Folgereaktionen sicher.
stellt die optimale Abfolge
und Kombination der spezifischen (z.B. Zytokinsekretion), zum Teil
aggressiven (z.B. Freisetzung von Perforin) Folgereaktionen sicher. Der Terminus immunologische Synapse
(SMAC: supramolecular activation cluster,
Der Terminus immunologische Synapse
(SMAC: supramolecular activation cluster,  Abbildung) bezieht sich auf die Summe der Membranproteine an Kontaktpunkten
zwischen einer antigenpräsentierenden und einer T-Zelle:
T-Zell-Rezeptor-Komplex, CD4 / CD8, Costimulatoren und costimulatorische Rezeptoren, Integrine der T-Zelle und
Integrinliganden der antigenpräsentierenden Zelle. Diese Faktoren sind
für die vollständige bidirektionale Kommunikation zwischen antigenpräsentierender Zelle und Lymphozyt notwendig und fördern die Sekretion z.B. des granulären Inhalts zytotoxischer T-Zellen.
Abbildung) bezieht sich auf die Summe der Membranproteine an Kontaktpunkten
zwischen einer antigenpräsentierenden und einer T-Zelle:
T-Zell-Rezeptor-Komplex, CD4 / CD8, Costimulatoren und costimulatorische Rezeptoren, Integrine der T-Zelle und
Integrinliganden der antigenpräsentierenden Zelle. Diese Faktoren sind
für die vollständige bidirektionale Kommunikation zwischen antigenpräsentierender Zelle und Lymphozyt notwendig und fördern die Sekretion z.B. des granulären Inhalts zytotoxischer T-Zellen.
 Abbildung: Immunologische Synapse
Abbildung: Immunologische Synapse
 Abbildung).
Abbildung). Bindet die T-Zelle lediglich den
MHC-Komplex (ohne Costimulatoren), wird sie anerg, also funktionslos.
Bindet die T-Zelle lediglich den
MHC-Komplex (ohne Costimulatoren), wird sie anerg, also funktionslos. Abbildung oben). Einige dieser
Moleküle tragen an ihrem zytoplasmatischen Ende ITAMs (immunoreceptor tyrosin-based activation motifs,
Abbildung oben). Einige dieser
Moleküle tragen an ihrem zytoplasmatischen Ende ITAMs (immunoreceptor tyrosin-based activation motifs,  Abbildung). Wenn diese aneinanderrücken, lösen sie Signalvorgänge in der Zelle aus. Die zytoplasmatischen Enden des
CD3-Komplexes tragen ITAMs (nicht hingegen die zytoplasmatischen Enden
der TCR). Regulatorische Membranproteine wie
ITAMs und ITIMs (immunoreceptor tyrosin-based inhibition motifs)
werden innerhalb von Sekunden bis
Minuten nach Bindung des Antigens durch Kinasen der Src-Familie
(Nicht-Rezeptor-Kinasen) phosphoryliert und dadurch aktiviert
(Interaktion mit Zielproteinen wie z.B. die lymphozytenspezifische
Tyrosinkinase ZAP-70 (zeta-chain associated protein kinase 70) für ITAMs oder Phosphatasen für ITIMs).
Abbildung). Wenn diese aneinanderrücken, lösen sie Signalvorgänge in der Zelle aus. Die zytoplasmatischen Enden des
CD3-Komplexes tragen ITAMs (nicht hingegen die zytoplasmatischen Enden
der TCR). Regulatorische Membranproteine wie
ITAMs und ITIMs (immunoreceptor tyrosin-based inhibition motifs)
werden innerhalb von Sekunden bis
Minuten nach Bindung des Antigens durch Kinasen der Src-Familie
(Nicht-Rezeptor-Kinasen) phosphoryliert und dadurch aktiviert
(Interaktion mit Zielproteinen wie z.B. die lymphozytenspezifische
Tyrosinkinase ZAP-70 (zeta-chain associated protein kinase 70) für ITAMs oder Phosphatasen für ITIMs).
 Abbildung: Moleküle für die Aktivierung von CD4+-T-Zellen
Abbildung: Moleküle für die Aktivierung von CD4+-T-Zellen Die Aktivierung einer T-Zelle ist ein kritischer Vorgang, denn sie kann
den Untergang von ihr angegriffener Zellen bedeuten. Es ist daher nicht
verwunderlich, dass dieser Vorgang mehrfach abgesichert ist.
Der gegenseitige Erkennungsmechanismus ist komplex und zusätzlich abgesichert. Man unterscheidet in der molekularen Abfolge ein "erstes Signal"
- das für die Stimulierung einer naiven T-Zelle notwendig, aber
noch nicht ausreichend ist - von einem darauf folgenden "zweiten Signal"
(das in Wirklichkeit aus mehreren Signalen besteht) durch einen oder
mehrere costimularorische(n) Faktor(en). Beide Signale initiieren
intrazelluläre Wirkkaskaden, die über einen oder mehrere
Transkriptionsfaktor(en) die Ablesung betreffender Gene auslösen. Erst
das Zusammentreffen beider Signale führt zu einer vollständigen
Aktivierung, Differenzierung und Klonbildung (Selektion) des
betreffenden T-Lymphozyten.
Die Aktivierung einer T-Zelle ist ein kritischer Vorgang, denn sie kann
den Untergang von ihr angegriffener Zellen bedeuten. Es ist daher nicht
verwunderlich, dass dieser Vorgang mehrfach abgesichert ist.
Der gegenseitige Erkennungsmechanismus ist komplex und zusätzlich abgesichert. Man unterscheidet in der molekularen Abfolge ein "erstes Signal"
- das für die Stimulierung einer naiven T-Zelle notwendig, aber
noch nicht ausreichend ist - von einem darauf folgenden "zweiten Signal"
(das in Wirklichkeit aus mehreren Signalen besteht) durch einen oder
mehrere costimularorische(n) Faktor(en). Beide Signale initiieren
intrazelluläre Wirkkaskaden, die über einen oder mehrere
Transkriptionsfaktor(en) die Ablesung betreffender Gene auslösen. Erst
das Zusammentreffen beider Signale führt zu einer vollständigen
Aktivierung, Differenzierung und Klonbildung (Selektion) des
betreffenden T-Lymphozyten. Abbildung).
Abbildung).
 Abbildung: T-Zell-Rezeptor-Aktivierung, CD4 bindet an MHC II
Abbildung: T-Zell-Rezeptor-Aktivierung, CD4 bindet an MHC II
 Über Rezeptoren der Immunglobulin-Superfamilie s. auch dort
Über Rezeptoren der Immunglobulin-Superfamilie s. auch dort auf der Seite des CD4+-Lymphozyten CD4, CD3, ζ-Proteine, CTLA-4 (cytotoxic T lymphocyte antigen-4) und PD-1 (programmed death 1) an der Signaltransduktion,
auf der Seite des CD4+-Lymphozyten CD4, CD3, ζ-Proteine, CTLA-4 (cytotoxic T lymphocyte antigen-4) und PD-1 (programmed death 1) an der Signaltransduktion,  auf der Seite der antigenpräsentierenden Zelle B7 (für CD28 und CTLA-4) und PD-L (programmed death ligand) für den Coinhibitor PD-1 (programmed cell death protein 1) an der Signalübertragung auf die T-Zelle.
auf der Seite der antigenpräsentierenden Zelle B7 (für CD28 und CTLA-4) und PD-L (programmed death ligand) für den Coinhibitor PD-1 (programmed cell death protein 1) an der Signalübertragung auf die T-Zelle. Abbildung:
Abbildung: 
 Abbildung: Transduktion des "ersten Signals" in einem CD4+-Lymphozyten
Abbildung: Transduktion des "ersten Signals" in einem CD4+-Lymphozyten
 Abbildung) und auch Information über die Art der erforderlichen adaptiven Immunantwort vermitteln - z.B. bei Mikroben in der Zelle: zellulär, bei extrazellulären Mikroben: humoral.
Abbildung) und auch Information über die Art der erforderlichen adaptiven Immunantwort vermitteln - z.B. bei Mikroben in der Zelle: zellulär, bei extrazellulären Mikroben: humoral. 
 Abbildung: Da "zweite Signal" zur definitiven Aktivierung eines CD4+-Lymphozyten
Abbildung: Da "zweite Signal" zur definitiven Aktivierung eines CD4+-Lymphozyten
 Bei Anwesenheit bakterieller Lipopolysaccharide sezernieren antigenpräsentierende Zellen vor allem IL-12. Durch den Einfluss von IL-12 und IFN-γ entwickeln sich Th0-Zellen zu Th1-Zellen (IL-12
und IFN-γ hemmen gleichzeitig die Bildung von Th2). Diese rekrutieren /
aktivieren daraufhin Phagozyten oder zytotoxische T-Zellen.
Bei Anwesenheit bakterieller Lipopolysaccharide sezernieren antigenpräsentierende Zellen vor allem IL-12. Durch den Einfluss von IL-12 und IFN-γ entwickeln sich Th0-Zellen zu Th1-Zellen (IL-12
und IFN-γ hemmen gleichzeitig die Bildung von Th2). Diese rekrutieren /
aktivieren daraufhin Phagozyten oder zytotoxische T-Zellen. Durch den Einfluss von IL-4 entwickeln sich Th0-Zellen zu Th2-Zellen
(IL-4 hemmt gleichzeitig die Bildung von Th1). Th2-Zellen reagieren auf
die Anwesenheit von Pathogenen, indem sie B-Lymphozyten dazu anregen,
zu Plasmazellen (Antikörperproduktion) oder Gedächtniszellen zu werden,
und sie rekrutieren eosinophile und basophile Granulozyten.
Durch den Einfluss von IL-4 entwickeln sich Th0-Zellen zu Th2-Zellen
(IL-4 hemmt gleichzeitig die Bildung von Th1). Th2-Zellen reagieren auf
die Anwesenheit von Pathogenen, indem sie B-Lymphozyten dazu anregen,
zu Plasmazellen (Antikörperproduktion) oder Gedächtniszellen zu werden,
und sie rekrutieren eosinophile und basophile Granulozyten. Sehen sich antigenpräsentierende Zellen mit bakteriellen oder Pilzpathogenen konfrontiert, produzieren sie IL-6, IL-21 und TGF-β. Durch deren Einfluss entwickeln sich Th0-Zellen zu Th17-Zellen, die neutrophile Granulozyten zum Abwehrort rekrutieren und antimikrobielle Reaktionen auslösen.
Sehen sich antigenpräsentierende Zellen mit bakteriellen oder Pilzpathogenen konfrontiert, produzieren sie IL-6, IL-21 und TGF-β. Durch deren Einfluss entwickeln sich Th0-Zellen zu Th17-Zellen, die neutrophile Granulozyten zum Abwehrort rekrutieren und antimikrobielle Reaktionen auslösen. 
 Abbildung: CD4 bindet an MHC II in Kombination mit TCR
Abbildung: CD4 bindet an MHC II in Kombination mit TCR
 CD4-Rezeptoren an CD3-TCR-(Helferzelle)-MHC-II-Peptid-Komplexe (
CD4-Rezeptoren an CD3-TCR-(Helferzelle)-MHC-II-Peptid-Komplexe ( Abbildung)
Abbildung) CD8-Rezeptoren an CD3-TCR-(Killerzelle)-MHC-I-Peptid-Komplexe (
CD8-Rezeptoren an CD3-TCR-(Killerzelle)-MHC-I-Peptid-Komplexe ( Abbildung).
Abbildung).  Regulierung der Lymphozytenaktivierung
Regulierung der Lymphozytenaktivierung  Übertragung von Peptid-MHC-Komplexen von antigenpräsentierenden Zellen auf Lymphozyten
Übertragung von Peptid-MHC-Komplexen von antigenpräsentierenden Zellen auf Lymphozyten  Sekretion von Zytokinen / lytischen Granula
Sekretion von Zytokinen / lytischen Granula
 Abbildung: CD8 bindet an α3-Domäne eines MHC I
Abbildung: CD8 bindet an α3-Domäne eines MHC I
 s.
unten).
s.
unten).  Dabei entscheiden dendritische Zellen
darüber, welches Zytokinprofil die Helferzelle in welcher
Situation genau produzieren soll.
Dabei entscheiden dendritische Zellen
darüber, welches Zytokinprofil die Helferzelle in welcher
Situation genau produzieren soll. Paul Ehrlich
gilt als Begründer der modernen Immunologie. 1897 publizierte er seine
"Seitenkettentheorie", derzufolge Antikörper auf der Oberfläche von
Immunzellen Antigene erkennen, und deren Anwesenheit die Zellen zur
verstärkten Bildung von Antikörpern anregt - ein damals hypothetisches
Konzept, solche Moleküle waren noch nicht nachweisbar. Ehrlich ging von einer chemischen Reaktion aus, indem zelluläre
"Seitenketten" (Makromoleküle) in der Lage sind, Gifte zu binden, und
von den Zellen auch sezerniert werden können (Antikörper). Auch nahm er
weitere Immunmoleküle zwischen Antigen und Antikörper an (Komplement).
Ehrlich erhielt 1908 zusammen mit Ilja Metschnikow den Nobelpreis für Physiologie oder Medizin.
Paul Ehrlich
gilt als Begründer der modernen Immunologie. 1897 publizierte er seine
"Seitenkettentheorie", derzufolge Antikörper auf der Oberfläche von
Immunzellen Antigene erkennen, und deren Anwesenheit die Zellen zur
verstärkten Bildung von Antikörpern anregt - ein damals hypothetisches
Konzept, solche Moleküle waren noch nicht nachweisbar. Ehrlich ging von einer chemischen Reaktion aus, indem zelluläre
"Seitenketten" (Makromoleküle) in der Lage sind, Gifte zu binden, und
von den Zellen auch sezerniert werden können (Antikörper). Auch nahm er
weitere Immunmoleküle zwischen Antigen und Antikörper an (Komplement).
Ehrlich erhielt 1908 zusammen mit Ilja Metschnikow den Nobelpreis für Physiologie oder Medizin.
 Abbildung: T-Zell-Rezeptor und die Erkennung eines Peptid-MHC-Komplexes
Abbildung: T-Zell-Rezeptor und die Erkennung eines Peptid-MHC-Komplexes

 Helfer (CD4+)-Zellen
Helfer (CD4+)-Zellen  NKT-Zellen
NKT-Zellen  MAIT-Zellen
MAIT-Zellen
 Zytotoxische T-Lymphozyten (CTLs, Tc cells) töten körpereigene Zellen, die von Viren oder anderen intrazellulären Pathogenen befallen sind.
Zytotoxische T-Lymphozyten (CTLs, Tc cells) töten körpereigene Zellen, die von Viren oder anderen intrazellulären Pathogenen befallen sind.
 Abbildung: Aktivierung CD8-positiver T-Zellen
Abbildung: Aktivierung CD8-positiver T-Zellen
 Abbildung).
Abbildung).  Abbildung). Dieses bindet an CD28 von Lymphozyten und regt die Differenzierung von CD8+-Zellen an. Diese werden zu "vollwertigen" zytotoxischen Zellen (CTL, cytotoxic T lymphocytes) mit Granula, die Perforin (womit angegriffene Zielzellen "durchlöchert" werden können) sowie Granzyme (Proteasen) enthalten.
Abbildung). Dieses bindet an CD28 von Lymphozyten und regt die Differenzierung von CD8+-Zellen an. Diese werden zu "vollwertigen" zytotoxischen Zellen (CTL, cytotoxic T lymphocytes) mit Granula, die Perforin (womit angegriffene Zielzellen "durchlöchert" werden können) sowie Granzyme (Proteasen) enthalten.
 Abbildung: Abfolge der CTL-vermittelten Lyse einer Zielzelle
Abbildung: Abfolge der CTL-vermittelten Lyse einer Zielzelle
 Naive CD8+-T-Lymphozyten haben keine zelltötende Wirkung - diese entwickeln sie erst, wenn sie zu Effektorzellen aktiviert wurden. Wie erfolgt diese kritische Veränderung?
Naive CD8+-T-Lymphozyten haben keine zelltötende Wirkung - diese entwickeln sie erst, wenn sie zu Effektorzellen aktiviert wurden. Wie erfolgt diese kritische Veränderung? aktivierter dendritischer Zellen (über MHC-I-gekoppelte Antigene z.B. viraler Herkunft sowie Costimulatoren) und von
aktivierter dendritischer Zellen (über MHC-I-gekoppelte Antigene z.B. viraler Herkunft sowie Costimulatoren) und von CD4+-T-Helferzellen (diese regen die CD8+-Zelle bei passendem MHC-Kontakt mittels Zytokinen an).
CD4+-T-Helferzellen (diese regen die CD8+-Zelle bei passendem MHC-Kontakt mittels Zytokinen an).  Dendritische Zellen sind meist nicht von Viren infiziert; woher nehmen
sie das zu präsentierende Antigen? Spezialisierte dendritische Zellen
endozytieren virusinfizierte Zellen oder Tumorzellen (oder Proteine),
transportieren daraus gewonnene Antigene in ihr Zytosol und
präsentieren sie über MHC-I an CD8+-Lymphozyten (Cross-presentation).
Dendritische Zellen sind meist nicht von Viren infiziert; woher nehmen
sie das zu präsentierende Antigen? Spezialisierte dendritische Zellen
endozytieren virusinfizierte Zellen oder Tumorzellen (oder Proteine),
transportieren daraus gewonnene Antigene in ihr Zytosol und
präsentieren sie über MHC-I an CD8+-Lymphozyten (Cross-presentation). Einmal aktiviert, proliferieren die Killerzellen, bilden einen Klon, wandern aus dem Lymphknoten in die Blutbahn und von dort an die Stelle, wo sich infizierte Zellen
befinden. Killerzellen töten Zielzellen ab, die dieselben MHC-I-assoziierten
Antigene exprimieren, welche die Proliferation des betreffenden CD8+-Lymphozytenklons ausgelöst hat.
Einmal aktiviert, proliferieren die Killerzellen, bilden einen Klon, wandern aus dem Lymphknoten in die Blutbahn und von dort an die Stelle, wo sich infizierte Zellen
befinden. Killerzellen töten Zielzellen ab, die dieselben MHC-I-assoziierten
Antigene exprimieren, welche die Proliferation des betreffenden CD8+-Lymphozytenklons ausgelöst hat.
 Abbildung: Mechanismus der Abtötung von Zielzellen der CTL
Abbildung: Mechanismus der Abtötung von Zielzellen der CTL
 Abbildung).
Abbildung).  Perforin-Granzym-Mechanismus: Die führenden Wirkstoffe, welche die T-Zelle freisetzt, sind Granzyme und Perforin (das gilt auch für NK-Zellen). Die lymphozytären Granula enthalten auch Serglycin, ein sulfatiertes Proteoglykan, das Granzyme und Perforin in einem inaktiven Zustand
hält, solange sie in den Granula gespeichert sind (und wahrscheinlich
nach Öffnung der Vesikel zum Rezeptor-Spaltraum hin die CD8+-T-Zelle schützt).
Perforin-Granzym-Mechanismus: Die führenden Wirkstoffe, welche die T-Zelle freisetzt, sind Granzyme und Perforin (das gilt auch für NK-Zellen). Die lymphozytären Granula enthalten auch Serglycin, ein sulfatiertes Proteoglykan, das Granzyme und Perforin in einem inaktiven Zustand
hält, solange sie in den Granula gespeichert sind (und wahrscheinlich
nach Öffnung der Vesikel zum Rezeptor-Spaltraum hin die CD8+-T-Zelle schützt). Perforin ist ein zytolytisches
Protein aus Granula zytotoxischer (CD8+)
T-Zellen und NK-Zellen, das nach deren
Degranulation die Membran von Zielzellen perforiert und Poren bildet
(
Perforin ist ein zytolytisches
Protein aus Granula zytotoxischer (CD8+)
T-Zellen und NK-Zellen, das nach deren
Degranulation die Membran von Zielzellen perforiert und Poren bildet
( Abbildung).
Es ist zum C9-Komplementfaktor homolog. Wie der
Eintritt der Wirkstoffe in die Zielzelle genau erfolgt, ist noch
unklar. Vielleicht bewirkt die Einlagerung der Perforinporen einen
Reparaturvorgang, über den dann die Enzyme letztlich in das Zytosol der
Zielzelle gelangen. Die Granzyme A, B und C sind
apoptoseauslösende Serin-Proteasen, sie
dringen durch Perforinporen in die angegriffene Zelle ein. Granzym B aktiviert Caspasen und leitet damit Apoptose ein.
Abbildung).
Es ist zum C9-Komplementfaktor homolog. Wie der
Eintritt der Wirkstoffe in die Zielzelle genau erfolgt, ist noch
unklar. Vielleicht bewirkt die Einlagerung der Perforinporen einen
Reparaturvorgang, über den dann die Enzyme letztlich in das Zytosol der
Zielzelle gelangen. Die Granzyme A, B und C sind
apoptoseauslösende Serin-Proteasen, sie
dringen durch Perforinporen in die angegriffene Zelle ein. Granzym B aktiviert Caspasen und leitet damit Apoptose ein.
 Abbildung: Perforinmechanismus
Abbildung: Perforinmechanismus
 Th2-Helferzellen
Th2-Helferzellen  Th17-Helferzellen
Th17-Helferzellen  TFH-Helferzellen
TFH-Helferzellen  Treg-Zellen
Treg-Zellen


 Abbildung: Abfolge CD4+-T-Zell-vermittelter Immunantworten
Abbildung: Abfolge CD4+-T-Zell-vermittelter Immunantworten

 Abbildung: Differenzierung CD4-positiver (Helfer-) T-Zellen
Abbildung: Differenzierung CD4-positiver (Helfer-) T-Zellen
 Mikroben induzieren die Aktivierung von Lymphozyten-Subsets, der zu ihrer Bekämpfung am besten geeignet sind.
Mikroben induzieren die Aktivierung von Lymphozyten-Subsets, der zu ihrer Bekämpfung am besten geeignet sind. Th1-Helferzellen interagieren mit mononukleären Phagozyten und helfen ihnen, ihre Pathogene abzutöten.
Th1-Helferzellen interagieren mit mononukleären Phagozyten und helfen ihnen, ihre Pathogene abzutöten.
 Abbildung: Entwicklung von Th1-Lymphozyten
Abbildung: Entwicklung von Th1-Lymphozyten
 Abbildung).
Abbildung). Es stimuliert Gewebsmakrophagen zur Phagozytose intrazellulärer Bakterien / Protozoen, aktiviert die NO-Bildung (iNOS) zur Abtötung von Bakterien / Protozoen.
Es stimuliert Gewebsmakrophagen zur Phagozytose intrazellulärer Bakterien / Protozoen, aktiviert die NO-Bildung (iNOS) zur Abtötung von Bakterien / Protozoen. Es regt die Differenzierung naiver CD4+-Zellen zu Th1-Zellen an (diese können auch CD8+-zytotoxische T-Zellen steuern!) und hemmt gleichzeitig diejenige von Th2- und Th17-Zellen.
Es regt die Differenzierung naiver CD4+-Zellen zu Th1-Zellen an (diese können auch CD8+-zytotoxische T-Zellen steuern!) und hemmt gleichzeitig diejenige von Th2- und Th17-Zellen. Es regt die Expression von Proteinen (u.a. MHC) an, welche Antigenpräsentation und T-Zell-Aktivierung stimulieren.
Es regt die Expression von Proteinen (u.a. MHC) an, welche Antigenpräsentation und T-Zell-Aktivierung stimulieren. Es beeinflusst den Immunglobulin-Switch von B-Lymphozyten.
Es beeinflusst den Immunglobulin-Switch von B-Lymphozyten. Th2-Helferzellen unterstützen B-Zellen bei der Zellteilung, Differenzierung und Antikörperproduktion.
Th2-Helferzellen unterstützen B-Zellen bei der Zellteilung, Differenzierung und Antikörperproduktion. ) durch eosinophile Granulozyten (Produktion von IgE) und Mastzellen, was Makrophagen triggert ("alternative" Makrophagenaktivierung im Gegensatz zur durch Interferon angeregten,
) durch eosinophile Granulozyten (Produktion von IgE) und Mastzellen, was Makrophagen triggert ("alternative" Makrophagenaktivierung im Gegensatz zur durch Interferon angeregten,  Abbildung). Dieser Mechanismus dient auch der Bekämpfung von Mikroben auf Schleimhäuten - unter anderem durch Erhöhung muköser Schleimbildung. Auch
wird die Gewebeheilung angeregt.
Abbildung). Dieser Mechanismus dient auch der Bekämpfung von Mikroben auf Schleimhäuten - unter anderem durch Erhöhung muköser Schleimbildung. Auch
wird die Gewebeheilung angeregt. 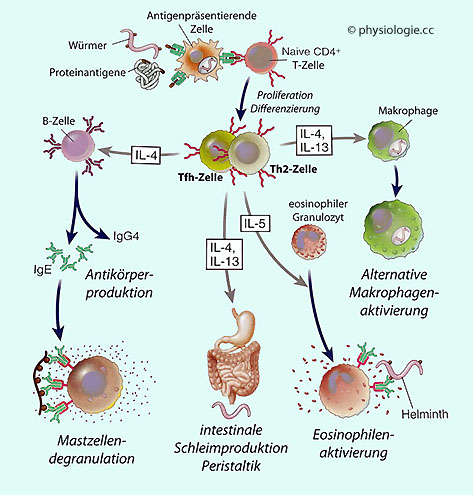
 Abbildung: Funktion von Th2- und Tfh-Lymphozyten
Abbildung: Funktion von Th2- und Tfh-Lymphozyten
 IL-4 ist ein Schlüsselfaktor der adaptiven Abwehr. Es regt die
Entwicklung naiver Lymphozyten zu Th2-Effektorzellen und deren
Wachstum, alternative Makrophagenaktivierung, die Darmperistaltik,
sowie aktivierte B-Zellen und deren Differenzierung zu Plasmazellen und auch Bildung von IgE
(Isotypen-Switch) an. Auch kann es Eosinophile an den Ort des
Geschehens locken. Das alles unterstützt die Bekämpfung von Parasiten
IL-4 ist ein Schlüsselfaktor der adaptiven Abwehr. Es regt die
Entwicklung naiver Lymphozyten zu Th2-Effektorzellen und deren
Wachstum, alternative Makrophagenaktivierung, die Darmperistaltik,
sowie aktivierte B-Zellen und deren Differenzierung zu Plasmazellen und auch Bildung von IgE
(Isotypen-Switch) an. Auch kann es Eosinophile an den Ort des
Geschehens locken. Das alles unterstützt die Bekämpfung von Parasiten IL-5
stimuliert die Bildung von IgA und regt das B-Zell-Wachstum an, es
aktiviert eosinophile Granulozyten und fördert deren Wachstum
IL-5
stimuliert die Bildung von IgA und regt das B-Zell-Wachstum an, es
aktiviert eosinophile Granulozyten und fördert deren Wachstum IL-13 hat ähnliche Wirkungen wie IL-4, verstärkt dessen Wirkungen und fördert die Schleimsekretion.
IL-13 hat ähnliche Wirkungen wie IL-4, verstärkt dessen Wirkungen und fördert die Schleimsekretion.

 Th17-Helferzellen produzieren IL-17 und beteiligen sich an der Abwehr von Mikroben, insbesondere an mukösen Oberflächen.
Th17-Helferzellen produzieren IL-17 und beteiligen sich an der Abwehr von Mikroben, insbesondere an mukösen Oberflächen.
 Abbildung: Funktion der Th17-Lymphozyten
Abbildung: Funktion der Th17-Lymphozyten
 Abbildung). Sie limitieren das Eindringen von Mikroben über epitheliale Barrieren (z.B. Darmmukosa), regen die Produktion antimikrobieller Peptide (z.B. Defensine) an und unterstützen die Regeneration der Schleimhäute (über IL-22). Ferner haben regulatorische Eigenschaften im T-Zell-System.
Abbildung). Sie limitieren das Eindringen von Mikroben über epitheliale Barrieren (z.B. Darmmukosa), regen die Produktion antimikrobieller Peptide (z.B. Defensine) an und unterstützen die Regeneration der Schleimhäute (über IL-22). Ferner haben regulatorische Eigenschaften im T-Zell-System.  IL-17 stimuliert - über IL-17-Rezeptoren (A bis F), die von zahlreichen verschiedenen Zellen exprimiert werden
(Neutrophile, Makrophagen, Endothel- und Epithelzellen, Fibroblasten) - die Bildung
antimikrobieller Stoffe (z.B. Defensine) und zahlreicher anderer Zytokine, Chemokine und Prostaglandine.
IL-17 stimuliert - über IL-17-Rezeptoren (A bis F), die von zahlreichen verschiedenen Zellen exprimiert werden
(Neutrophile, Makrophagen, Endothel- und Epithelzellen, Fibroblasten) - die Bildung
antimikrobieller Stoffe (z.B. Defensine) und zahlreicher anderer Zytokine, Chemokine und Prostaglandine.  IL-21 - aus aktivierten CD4+-Zellen - regt die Differenzierung von Th17-Zellen sowie B-Zellen zur Antikörperproduktion an.
IL-21 - aus aktivierten CD4+-Zellen - regt die Differenzierung von Th17-Zellen sowie B-Zellen zur Antikörperproduktion an.  IL-22
- gebildet von aktivierten T-Zellen, einigen NK- und lymphoiden Zellen der angeborenen Immunabwehr - verstärkt die Barrierefunktion der Schleimhäute, produziert
antimikrobielle Peptide und stimuliert die Bildung von Chemokinen, die
zu entzündlichen Prozessen beitragen.
IL-22
- gebildet von aktivierten T-Zellen, einigen NK- und lymphoiden Zellen der angeborenen Immunabwehr - verstärkt die Barrierefunktion der Schleimhäute, produziert
antimikrobielle Peptide und stimuliert die Bildung von Chemokinen, die
zu entzündlichen Prozessen beitragen.

 Abbildung: Charakteristika von Untergruppen der CD4+-T-Lymphozyten
Abbildung: Charakteristika von Untergruppen der CD4+-T-Lymphozyten
 Treg-Zellen (regulatorische Lymphozyten, früher Suppressor-T-Zellen)
sind eine Gruppe von T-Zellen, die in verschiedenen Geweben vorkommen und für die Erhaltung peripherer Toleranz gegenüber
Selbst-Antigenen beteiligt sind (Verhinderung von Autoimmunität durch Limitierung der Aktivität selbstreaktiver Lymphozyten). Sie enthalten FoxP3 (nach forkhead box P3, auch Scurfin
genannt), ein Protein, das spezifisch für Treg-Zellen ist (Marker) und
Transkriptionsvorgänge anregen oder hemmen kann. Treg-Zellen sind über
den Nachweis der Biomarker FoxP3, CD4, CD25 und CD152 identifizierbar. Sie machen
5-10% aller T-Zellen in der Peripherie aus.
Treg-Zellen (regulatorische Lymphozyten, früher Suppressor-T-Zellen)
sind eine Gruppe von T-Zellen, die in verschiedenen Geweben vorkommen und für die Erhaltung peripherer Toleranz gegenüber
Selbst-Antigenen beteiligt sind (Verhinderung von Autoimmunität durch Limitierung der Aktivität selbstreaktiver Lymphozyten). Sie enthalten FoxP3 (nach forkhead box P3, auch Scurfin
genannt), ein Protein, das spezifisch für Treg-Zellen ist (Marker) und
Transkriptionsvorgänge anregen oder hemmen kann. Treg-Zellen sind über
den Nachweis der Biomarker FoxP3, CD4, CD25 und CD152 identifizierbar. Sie machen
5-10% aller T-Zellen in der Peripherie aus.
 Abbildung: Regulatorisches Gleichgewicht im Immunsystem
Abbildung: Regulatorisches Gleichgewicht im Immunsystem

 Produktion von IL-10 und TGF-ß
Produktion von IL-10 und TGF-ß Bildung
von Faktoren wie CD25 (α-Untereinheit des IL-2-Rezeptors; Treg-Zellen brauchen
zum Überleben IL-2) und CD152 (CTLA-4, cytotoxic T-lymphocyte associated antigen 4)
Bildung
von Faktoren wie CD25 (α-Untereinheit des IL-2-Rezeptors; Treg-Zellen brauchen
zum Überleben IL-2) und CD152 (CTLA-4, cytotoxic T-lymphocyte associated antigen 4)  Limitierung klonaler Expansion
Limitierung klonaler Expansion Verbrauch von IL-2
Verbrauch von IL-2
 MAIT-Zellen
MAIT-Zellen  "Nicht-traditionelle" γδ-T-Lymphozyten
"Nicht-traditionelle" γδ-T-Lymphozyten
 Abbildung: NK- (links) und NKT-Zelle (rechts) im Vergleich
Abbildung: NK- (links) und NKT-Zelle (rechts) im Vergleich
 Abbildung).
Abbildung). Haben NKT-Zellen Substanzen gebunden, die über das spezielle (nichtklassische) HMC
I-Molekül CD1d präsentiert werden, sezernieren sie große Mengen von Zytokinen, wie IL-4 und IFN-γ. Deren Auswirkungen können sowohl stimulierend als auch inhibierend sein.
Haben NKT-Zellen Substanzen gebunden, die über das spezielle (nichtklassische) HMC
I-Molekül CD1d präsentiert werden, sezernieren sie große Mengen von Zytokinen, wie IL-4 und IFN-γ. Deren Auswirkungen können sowohl stimulierend als auch inhibierend sein. Externer Link: CD-Antigenliste
Externer Link: CD-Antigenliste Interferone (IFN)
Interferone (IFN)  Chemokine
Chemokine  Tumornekrosefaktor (TNF)
Tumornekrosefaktor (TNF)  Koloniestimulierende Faktoren (CSF)
Koloniestimulierende Faktoren (CSF)  TGF
TGF  Zytokinrezeptoren
Zytokinrezeptoren
 Zytokine
Zytokine  (alte Bezeichnung: Lymphokine) sind Protein- / Peptid-Mediatoren, die bei entsprechender Reizung synthetisiert / sezerniert
werden und
auf das Immunsystem rückwirken. Diese Reizung erfolgt über die
Erkennung mikrobieller (z.B. Lipopolysaccharide, Peptidoglykane,
mikrobielle Nukleinsäuren) oder irregulärer MHC-präsentierter Merkmale
via Rezeptoren der angeborenen - z.B. Toll-like (TLRs) Rezeptoren -
oder der adaptiven Abwehr, insbesondere T-Zell-Rezeptoren auf Immunzellen. Zytokine wirken also in beiden Sektoren (angeboren und adaptiv) des Immunsystems (s. Tabelle).
(alte Bezeichnung: Lymphokine) sind Protein- / Peptid-Mediatoren, die bei entsprechender Reizung synthetisiert / sezerniert
werden und
auf das Immunsystem rückwirken. Diese Reizung erfolgt über die
Erkennung mikrobieller (z.B. Lipopolysaccharide, Peptidoglykane,
mikrobielle Nukleinsäuren) oder irregulärer MHC-präsentierter Merkmale
via Rezeptoren der angeborenen - z.B. Toll-like (TLRs) Rezeptoren -
oder der adaptiven Abwehr, insbesondere T-Zell-Rezeptoren auf Immunzellen. Zytokine wirken also in beiden Sektoren (angeboren und adaptiv) des Immunsystems (s. Tabelle). über das unspezifische Immunsystem (z.B. Interferon-α, Interferon-β, TNF-α, IL-1, IL-6, IL-10, Chemokine) sowie auch
über das unspezifische Immunsystem (z.B. Interferon-α, Interferon-β, TNF-α, IL-1, IL-6, IL-10, Chemokine) sowie auch  über das spezifische Immunsystem (z.B. IL-2, IL-4, Interferon-γ, TGF-β, Lymphotoxin - früher TNF-β);
über das spezifische Immunsystem (z.B. IL-2, IL-4, Interferon-γ, TGF-β, Lymphotoxin - früher TNF-β);
 einige steuern auch die Blutbildung (CSF -
einige steuern auch die Blutbildung (CSF -  s. unten).
s. unten). ). Dazu kommt, dass die Untersuchung einzelner Zytokine in vitro
nicht schlüssig ihre Rolle und Wirkungsstärke im Gesamtsystem des
Organismus erhellt. All das macht das Verständnis der Zytokinwirkungen
nicht gerade einfach; die
Nomenklatur ist aufgrund der großen Dynamik der immunologischen
Forschung noch ziemlich uneinheitlich.
). Dazu kommt, dass die Untersuchung einzelner Zytokine in vitro
nicht schlüssig ihre Rolle und Wirkungsstärke im Gesamtsystem des
Organismus erhellt. All das macht das Verständnis der Zytokinwirkungen
nicht gerade einfach; die
Nomenklatur ist aufgrund der großen Dynamik der immunologischen
Forschung noch ziemlich uneinheitlich.  Initiierung der akuten Phase: Auf bakterielle Reize hin (LPS: Lipopolysaccharid) werden Zytokine der frühen Abwehr freigesetzt - hauptsächlich von Makrophagen und Monozyten, aber auch von Endothelzellen, Fibroblasten u.a.: IL-1 und IL-6 lösen zusammen mit TNF-α lokale Entzündung aus (Ausbildung von Adhäsionsmolekülen
an Endothelzellen) und rekrutieren Leukozyten. In moderatem Ausmaß
gebildet, bewirken diese Zytokine (Hypothalamus), die Produktion von FieberAkutphasen-Proteinen (Leber) und Mobilisierung von Leukozyten (Knochenmark). Diagnostisch
äußert sich dies in Temperaturanstieg, Entzündungsparametern
(Blutsenkung, CRP) und Leukozytenzahl. Wegen der fieberinduzierenden
Wirkung von IL-1, IL-6 und TNF-α spricht man von endogenen Pyrogenen.
Initiierung der akuten Phase: Auf bakterielle Reize hin (LPS: Lipopolysaccharid) werden Zytokine der frühen Abwehr freigesetzt - hauptsächlich von Makrophagen und Monozyten, aber auch von Endothelzellen, Fibroblasten u.a.: IL-1 und IL-6 lösen zusammen mit TNF-α lokale Entzündung aus (Ausbildung von Adhäsionsmolekülen
an Endothelzellen) und rekrutieren Leukozyten. In moderatem Ausmaß
gebildet, bewirken diese Zytokine (Hypothalamus), die Produktion von FieberAkutphasen-Proteinen (Leber) und Mobilisierung von Leukozyten (Knochenmark). Diagnostisch
äußert sich dies in Temperaturanstieg, Entzündungsparametern
(Blutsenkung, CRP) und Leukozytenzahl. Wegen der fieberinduzierenden
Wirkung von IL-1, IL-6 und TNF-α spricht man von endogenen Pyrogenen. Spezifische Abwehrphase: Nach
der Erkennung antigener Eigenschaften proliferieren und differenzieren
sich Lymphozyten - geregelt durch Zytokine, die vorwiegend aus CD4+-T-Zellen stammen.
Spezifische Abwehrphase: Nach
der Erkennung antigener Eigenschaften proliferieren und differenzieren
sich Lymphozyten - geregelt durch Zytokine, die vorwiegend aus CD4+-T-Zellen stammen.
 Abbildung: Signalstoffe zur Interaktion zwischen endokrinem, Immun- und Nervensystem
Abbildung: Signalstoffe zur Interaktion zwischen endokrinem, Immun- und Nervensystem Vgl. dort
Vgl. dort 
 Transmitterfreisetzung,
Transmitterfreisetzung,  Körpertemperatur,
Körpertemperatur,  Schlafmuster,
Schlafmuster,
 Verhaltensweisen.
Verhaltensweisen. 
 Abbildung: Typ-I-Interferon schützt Zellen vor Virenbefall
Abbildung: Typ-I-Interferon schützt Zellen vor Virenbefall
 Interferone
Interferone  (IFN) sind (Glyko-)Proteine, die anregend auf das Immunsystem wirken, vor allem antiviral (
(IFN) sind (Glyko-)Proteine, die anregend auf das Immunsystem wirken, vor allem antiviral ( Abbildung) und tumorbremsend (
Abbildung) und tumorbremsend ( s. auch Tabelle). Man teilt sie in drei Haupttypen ein: IFN-α, IFN-β und IFN-γ.
s. auch Tabelle). Man teilt sie in drei Haupttypen ein: IFN-α, IFN-β und IFN-γ. Typ-I-Interferone umfassen mehrere IFN-α und eine Form von IFN-β. Sie gehören zum unspezifischen System und schützen Nachbarzellen vor Viren (antiviraler Zustand). Virusbefallene Zellen können ihre Produktion innerhalb weniger Minuten hochfahren, wenn virale PAMPs mit bestimmten PRRs reagieren.
Typ-I-Interferone umfassen mehrere IFN-α und eine Form von IFN-β. Sie gehören zum unspezifischen System und schützen Nachbarzellen vor Viren (antiviraler Zustand). Virusbefallene Zellen können ihre Produktion innerhalb weniger Minuten hochfahren, wenn virale PAMPs mit bestimmten PRRs reagieren. α-Interferone
- etwa 20 an der Zahl - werden von dendritischen Zellen nach Kontakt mit Nukleinsäure
(bakteriell, viral) freigesetzt und regen über spezifische Rezeptoren
an
benachbarten Zellen die Expression von Genen an, die einerseits
die Synthese fremder Proteine hemmen (
α-Interferone
- etwa 20 an der Zahl - werden von dendritischen Zellen nach Kontakt mit Nukleinsäure
(bakteriell, viral) freigesetzt und regen über spezifische Rezeptoren
an
benachbarten Zellen die Expression von Genen an, die einerseits
die Synthese fremder Proteine hemmen ( Abbildung) und andererseits
den Abbau fremder
RNA fördern. Auch aktivieren sie NK-Zellen. IFN-α haben nicht nur antivirale, sondern auch tumorbekämpfende Wirkung.
Abbildung) und andererseits
den Abbau fremder
RNA fördern. Auch aktivieren sie NK-Zellen. IFN-α haben nicht nur antivirale, sondern auch tumorbekämpfende Wirkung. β-Interferone stammen hauptsächlich aus virusinfizierten Fibroblasten und haben ebenfalls antivirale Wirkung.
β-Interferone stammen hauptsächlich aus virusinfizierten Fibroblasten und haben ebenfalls antivirale Wirkung. Typ-II-Interferon (IFN-γ) ist weniger stark antiviral wirksam als Typ-I-Interferone - es unterstützt die zelluläre Abwehr auch durch Aktivierung zytotoxischer (CD8+) T- und NK-Zellen -, aber das stärkste bekannte Makrophagen aktivierende Zytokin. Interferon-γ stammt aus T-Helferzellen (CD4+), die bakterien-phagozytierende Makrophagen erkennen und deren Bakterienabbau unterstützen.
Typ-II-Interferon (IFN-γ) ist weniger stark antiviral wirksam als Typ-I-Interferone - es unterstützt die zelluläre Abwehr auch durch Aktivierung zytotoxischer (CD8+) T- und NK-Zellen -, aber das stärkste bekannte Makrophagen aktivierende Zytokin. Interferon-γ stammt aus T-Helferzellen (CD4+), die bakterien-phagozytierende Makrophagen erkennen und deren Bakterienabbau unterstützen.  Chemokine (chemoattractant cytokines, chemotactic cytokines) sind strukturell homologe, kleine (8-10-kD)
Zytokine, welche (neben anderen Funktionen) den Austritt von Leukozyten
aus der Blutbahn zu korrekten Stellen im Gewebe steuern. Mehr als 40
verschiedene Chemokine sind bekannt; sie wirken chemotaktisch (daher
der Name) d.h. sie locken Lymphozyten an, die über Chemokinrezeptoren (CCR - metabotrope Rezeptoren) verfügen. Dabei besteht beträchtliche Redundanz,
d.h. einige Chemokine regen mehrere verschiedene CCR an, und einige CCR
reagieren auf verschiedene Chemokine. Insgesamt steuern Chemokine den
"Verkehr" von Leukozyten, der im Rahmen von Immun- und
Entzündungsvorgängen in Kreislauf und Gewebe stattfindet. Das Chemokin-Rezeptor-System involviert insbesondere Leukozyten, Endothel-, Epithelzellen und Fibroblasten.
Chemokine (chemoattractant cytokines, chemotactic cytokines) sind strukturell homologe, kleine (8-10-kD)
Zytokine, welche (neben anderen Funktionen) den Austritt von Leukozyten
aus der Blutbahn zu korrekten Stellen im Gewebe steuern. Mehr als 40
verschiedene Chemokine sind bekannt; sie wirken chemotaktisch (daher
der Name) d.h. sie locken Lymphozyten an, die über Chemokinrezeptoren (CCR - metabotrope Rezeptoren) verfügen. Dabei besteht beträchtliche Redundanz,
d.h. einige Chemokine regen mehrere verschiedene CCR an, und einige CCR
reagieren auf verschiedene Chemokine. Insgesamt steuern Chemokine den
"Verkehr" von Leukozyten, der im Rahmen von Immun- und
Entzündungsvorgängen in Kreislauf und Gewebe stattfindet. Das Chemokin-Rezeptor-System involviert insbesondere Leukozyten, Endothel-, Epithelzellen und Fibroblasten.  Abbildung).
Abbildung).
 Abbildung: Chemokine steuern Immunzellen
Abbildung: Chemokine steuern Immunzellen
 s. auch Tabelle)
s. auch Tabelle)
 Abbildung: TNF und andere Zytokine bei entzündlichen Reaktionen
Abbildung: TNF und andere Zytokine bei entzündlichen Reaktionen
 s. auch dort)
s. auch dort) Koloniestimulierende Faktoren (CSFs = colony stimulating factors) sind Zytokine,
welche Stammzellen im Knochenmark wachsen und reifen lassen. Für die
Entwicklung von Erythrozyten, Lymphozyten, Granulozyten und Monozyten
sind sie unabdingbar.
Koloniestimulierende Faktoren (CSFs = colony stimulating factors) sind Zytokine,
welche Stammzellen im Knochenmark wachsen und reifen lassen. Für die
Entwicklung von Erythrozyten, Lymphozyten, Granulozyten und Monozyten
sind sie unabdingbar. 
 Abbildung: Hämatopoese
Abbildung: Hämatopoese CFU, kolonienbildende Einheiten (colony forming units) hämatopoetischer Zellinien
CFU, kolonienbildende Einheiten (colony forming units) hämatopoetischer Zellinien  G, Granulozyt
G, Granulozyt  IL, Interleukin
IL, Interleukin  M, Monozyt
M, Monozyt
 Makrophagen / Monozyten: Fibroblasten, Endothelzellen, glatte Muskulatur, Stromazellen und Makrophagen produzieren konstitutiv M-CSF (macrophage colony-stimulating factor). M-CSF (CSF1) läßt aus Blutstammzellen Makrophagen, Monozyten und andere mononukleäre Phagozyten reifen und ermöglicht deren Wachstum und Überleben. CSF1-Rezeptoren haben alle Zellen
mononukleärer Herkunft, inlusive Monozyten, Makrophagen, Osteoklasten und Mikroglia.
Makrophagen / Monozyten: Fibroblasten, Endothelzellen, glatte Muskulatur, Stromazellen und Makrophagen produzieren konstitutiv M-CSF (macrophage colony-stimulating factor). M-CSF (CSF1) läßt aus Blutstammzellen Makrophagen, Monozyten und andere mononukleäre Phagozyten reifen und ermöglicht deren Wachstum und Überleben. CSF1-Rezeptoren haben alle Zellen
mononukleärer Herkunft, inlusive Monozyten, Makrophagen, Osteoklasten und Mikroglia.  Granulozyten und Monozyten: Das Glycoprotein GM-CSF (CSF2) wird von Makrophagen,
T-Zellen, Fibroblasten, Endothelzellen, Mastzellen und NK-Zellen
produziert. CSF2 regt Stammzellen zur Produktion von Granulozyten und
Monozyten an. Letztere verlassen den Blutkreislauf und reifen im Gewebe
zu Makrophagen und dendritischen Zellen heran. CSF2 reguliert vorwiegend die Produktion von Zellen im Knochenmark.
Granulozyten und Monozyten: Das Glycoprotein GM-CSF (CSF2) wird von Makrophagen,
T-Zellen, Fibroblasten, Endothelzellen, Mastzellen und NK-Zellen
produziert. CSF2 regt Stammzellen zur Produktion von Granulozyten und
Monozyten an. Letztere verlassen den Blutkreislauf und reifen im Gewebe
zu Makrophagen und dendritischen Zellen heran. CSF2 reguliert vorwiegend die Produktion von Zellen im Knochenmark. Granulozyten: G-CSF (CSF3) entsteht in Endothelzellen, Makrophagen und anderen Immunzellen. Es steuert Entwicklung und Reifung neutrophiler Granulozyten,
deren Freisetzung aus dem Knochenmark und Funktion es fördert. Der entsprechende Rezeptor (G-CSF-R) wird von Vorläuferzellen im Knochenmark exprimiert und fördert die Differenzierung zu reifen Granulozyten.
Granulozyten: G-CSF (CSF3) entsteht in Endothelzellen, Makrophagen und anderen Immunzellen. Es steuert Entwicklung und Reifung neutrophiler Granulozyten,
deren Freisetzung aus dem Knochenmark und Funktion es fördert. Der entsprechende Rezeptor (G-CSF-R) wird von Vorläuferzellen im Knochenmark exprimiert und fördert die Differenzierung zu reifen Granulozyten. Megakaryozyten: Ihre Entwicklung regt das von Leber und Nieren sezernierte Thrombopoetin an.
Megakaryozyten: Ihre Entwicklung regt das von Leber und Nieren sezernierte Thrombopoetin an.  Stammzellen: S-CSF tritt in einer freien und einer membrangebundenen Variante auf; Bindung an den Rezeptor führt zu Tyrosinkinaseaktivität.
Stammzellen: S-CSF tritt in einer freien und einer membrangebundenen Variante auf; Bindung an den Rezeptor führt zu Tyrosinkinaseaktivität. Auch Erythropoetin und einige Interleukine (wie IL-3) werden zu dieser Gruppe gezählt.
Auch Erythropoetin und einige Interleukine (wie IL-3) werden zu dieser Gruppe gezählt. Über zytokinartige Botenstoffe aus Muskel- oder Fettgewebe (z.B. Irisin, Leptin) s. dort
Über zytokinartige Botenstoffe aus Muskel- oder Fettgewebe (z.B. Irisin, Leptin) s. dort TGF-α wird von Makrophagen, Gehirn- und Hautzellen gebildet und fördert das Epithelwachstum;
TGF-α wird von Makrophagen, Gehirn- und Hautzellen gebildet und fördert das Epithelwachstum; TGF-β (3 Subtypen: 1-3) regulieren den Zellzyklus und induzieren Apoptose, beeinflussen
Zelldifferenzierung, Entwicklung, Wachstum und Regeneration, sowie das
Immunsystem. Zur TGF-ß-Familie gehören weiters - von verschiedensten
Geweben gebildet - als Aktivine (A, B) bezeichnete Glykoproteine, die neben wachstumsfördernden und morphogenetischen auch endokrine Wirkungen ausüben, u.a. die Aktivierung von FSH.
TGF-β (3 Subtypen: 1-3) regulieren den Zellzyklus und induzieren Apoptose, beeinflussen
Zelldifferenzierung, Entwicklung, Wachstum und Regeneration, sowie das
Immunsystem. Zur TGF-ß-Familie gehören weiters - von verschiedensten
Geweben gebildet - als Aktivine (A, B) bezeichnete Glykoproteine, die neben wachstumsfördernden und morphogenetischen auch endokrine Wirkungen ausüben, u.a. die Aktivierung von FSH.
 Abbildung: Zytokinrezeptoren
Abbildung: Zytokinrezeptoren
 Abbildung), die unterschiedliche intrazelluläre Mechanismen benützen. Sie steuern und koordinieren Funktionen des Immunsystems; so regen z.B. aktivierte T-Zellen B-Lymphozyten, die über passende Rezeptoren
für das erkannte Antigen verfügen, zu Teilung und Wachstum an.
Abbildung), die unterschiedliche intrazelluläre Mechanismen benützen. Sie steuern und koordinieren Funktionen des Immunsystems; so regen z.B. aktivierte T-Zellen B-Lymphozyten, die über passende Rezeptoren
für das erkannte Antigen verfügen, zu Teilung und Wachstum an.  Typ-I-Zytokinrezeptoren
(Hämatopoetin-Rezeptorfamilie) - z.B. für Interleukine 2, 4, 6, 7, 9,
11, 15, 21, 27; GM-CSF, G-CSF - nützen den JAK-STAT-Signalweg und
bestehen aus zwei oder drei Einheiten (dimer / trimer), die zusammen
eine ligandenbildende extrazelluläre Struktur (4 α-Helices, die
Aminosäuremuster bestimmen die Bindungsspezifität an das Zytokin) sowie
eine oder mehrere signalübermittelnde intrazelluläre Aminosäurekette(n)
bilden.
Typ-I-Zytokinrezeptoren
(Hämatopoetin-Rezeptorfamilie) - z.B. für Interleukine 2, 4, 6, 7, 9,
11, 15, 21, 27; GM-CSF, G-CSF - nützen den JAK-STAT-Signalweg und
bestehen aus zwei oder drei Einheiten (dimer / trimer), die zusammen
eine ligandenbildende extrazelluläre Struktur (4 α-Helices, die
Aminosäuremuster bestimmen die Bindungsspezifität an das Zytokin) sowie
eine oder mehrere signalübermittelnde intrazelluläre Aminosäurekette(n)
bilden. 
 Typ-II-Zytokinrezeptoren
(Interferon-Rezeptorfamilie) - z.B. für Interleukine 10, 20, 22;
Interferone vom Typ I und II. Auch diese Rezeptoren nützen den
JAK-STAT-Signalweg.
Typ-II-Zytokinrezeptoren
(Interferon-Rezeptorfamilie) - z.B. für Interleukine 10, 20, 22;
Interferone vom Typ I und II. Auch diese Rezeptoren nützen den
JAK-STAT-Signalweg.
 TNF-Rezeptorfamilie - z.B. TNF-Rezeptoren, CD40-Protein, Fas u.a. Diese Rezeptoren können Genexpression und auch (über Caspasen) Apoptose anregen. Sie können Adapterproteine (TRADD: TNF receptor-associated death domain) nutzen, die ihrerseits weitere Proteine (TRAFs: TNF receptor associated factors) "einschalten".
TNF-Rezeptorfamilie - z.B. TNF-Rezeptoren, CD40-Protein, Fas u.a. Diese Rezeptoren können Genexpression und auch (über Caspasen) Apoptose anregen. Sie können Adapterproteine (TRADD: TNF receptor-associated death domain) nutzen, die ihrerseits weitere Proteine (TRAFs: TNF receptor associated factors) "einschalten".
 Interleukin 1-Rezeptorfamilie: Diese Rezeptoren haben eine Toll/IL-1 Rezeptor (TIR)
Domäne gemeinsam und nutzen ähnliche Wege zur Signalübermittlung zwecks
Gentranskription. Bei Bindung des Liganden dimerisieren die Rezeptoren
und aktivieren Adapterproteine, die den Rezeptor an Kinasen (IRAK: IL-1 receptor-associated kinase) koppeln und dadurch weitere Downstream-Mechanismen anregen.
Interleukin 1-Rezeptorfamilie: Diese Rezeptoren haben eine Toll/IL-1 Rezeptor (TIR)
Domäne gemeinsam und nutzen ähnliche Wege zur Signalübermittlung zwecks
Gentranskription. Bei Bindung des Liganden dimerisieren die Rezeptoren
und aktivieren Adapterproteine, die den Rezeptor an Kinasen (IRAK: IL-1 receptor-associated kinase) koppeln und dadurch weitere Downstream-Mechanismen anregen.
 Interleukin 17-Rezeptorfamilie:
Diese Rezeptoren liegen von Haus aus als Oligomere vor (Kombination des
Rezeptors mit A, B, C, D oder E-Ketten). Dabei werden TRAFs aktiviert
(s. TNF-Rezeptorfamilie) und (wie auch bei anderen Zytokinrezeptoren) NF-κB aktiviert.
Interleukin 17-Rezeptorfamilie:
Diese Rezeptoren liegen von Haus aus als Oligomere vor (Kombination des
Rezeptors mit A, B, C, D oder E-Ketten). Dabei werden TRAFs aktiviert
(s. TNF-Rezeptorfamilie) und (wie auch bei anderen Zytokinrezeptoren) NF-κB aktiviert.
 TGF-beta Rezeptorfamilie: Funktionsweise s. dort
TGF-beta Rezeptorfamilie: Funktionsweise s. dort


 CD8-positive (zytotoxische) Lymphozyten können Zellen abtötetn, die über MHC-I
intrazelluläre Antigene aus proteasomalem Abbau präsentieren
CD8-positive (zytotoxische) Lymphozyten können Zellen abtötetn, die über MHC-I
intrazelluläre Antigene aus proteasomalem Abbau präsentieren CD4-positive (Helfer-) Lymphozyten werden durch MHC-II-gebundene Peptide aktiviert, die aus dem
lysosomalen Abbau endozytierter extrazellulärer Antigene stammen. Sie
helfen Phagozyten, aktivieren B-Lymphozyten und
regen Entzündungsvorgänge an
CD4-positive (Helfer-) Lymphozyten werden durch MHC-II-gebundene Peptide aktiviert, die aus dem
lysosomalen Abbau endozytierter extrazellulärer Antigene stammen. Sie
helfen Phagozyten, aktivieren B-Lymphozyten und
regen Entzündungsvorgänge an Im Thymus reifen Stammzellen zu naiven Helfer-, zytotoxischen und
regulatorischen T-Zellen heran. Sie durchlaufen positive (mäßige Affinität zu MHC → Zelle überlebt) und negative Selektion (zu starke Affinität zu MHC → Apoptose),
bei ausbleibender Bindung an MHC kommt es ebenfalls zu Apoptose. Nur
ein geringer Anteil der unreifen
T-Zellen übersteht die Selektion und verlässt die Thymusdrüse als reife
T-Lymphozyten. Thymushormone (Thymosine) beeinflussen Differenzierung
und
Proliferation
Im Thymus reifen Stammzellen zu naiven Helfer-, zytotoxischen und
regulatorischen T-Zellen heran. Sie durchlaufen positive (mäßige Affinität zu MHC → Zelle überlebt) und negative Selektion (zu starke Affinität zu MHC → Apoptose),
bei ausbleibender Bindung an MHC kommt es ebenfalls zu Apoptose. Nur
ein geringer Anteil der unreifen
T-Zellen übersteht die Selektion und verlässt die Thymusdrüse als reife
T-Lymphozyten. Thymushormone (Thymosine) beeinflussen Differenzierung
und
Proliferation Die Aktivierung naiver T-Zellen erfordert die Präsentation des
passenden Antigens durch dendritische Zellen. Auf positive Erkennung
folgt Zytokinsekretion, Proliferation (Klonerweiterung) und
Differenzierung der naiven zu reifen Lymphozyten (Effektor- und
Gedächtniszellen). Diese gelangen in sekundäre lymphatische Organe
(Lymphknoten, Milz, Peyer-Plaques) und können von dort über den
Kreislauf überall im Körper ihre Funktionen ausüben
Die Aktivierung naiver T-Zellen erfordert die Präsentation des
passenden Antigens durch dendritische Zellen. Auf positive Erkennung
folgt Zytokinsekretion, Proliferation (Klonerweiterung) und
Differenzierung der naiven zu reifen Lymphozyten (Effektor- und
Gedächtniszellen). Diese gelangen in sekundäre lymphatische Organe
(Lymphknoten, Milz, Peyer-Plaques) und können von dort über den
Kreislauf überall im Körper ihre Funktionen ausüben T-Zell-Rezeptoren (TCR) erkennen Peptidantigene und liegen in
Nachbarschaft regulierender Membranproteine wie ITAMS und ITIMS, die
nach Bindung des Antigens phosphoryliert werden. Einmal aktiviert,
senden TCR - unterstützt durch Hilfsfaktoren (CD3-Komplex) - ein Signal
an den Zellkern, um die Immunreaktion des Lymphozyten zu starten
T-Zell-Rezeptoren (TCR) erkennen Peptidantigene und liegen in
Nachbarschaft regulierender Membranproteine wie ITAMS und ITIMS, die
nach Bindung des Antigens phosphoryliert werden. Einmal aktiviert,
senden TCR - unterstützt durch Hilfsfaktoren (CD3-Komplex) - ein Signal
an den Zellkern, um die Immunreaktion des Lymphozyten zu starten Zytotoxische (CD8+) T-Zellen attackieren virusinfizierte, bakterienbefallene oder Tumorzellen. Aktiviert werden CD8+-T-Zellen durch dendritische Zellen und CD4+-T-Helferzellen, die das entsprechende antigene Peptid erkennen
Zytotoxische (CD8+) T-Zellen attackieren virusinfizierte, bakterienbefallene oder Tumorzellen. Aktiviert werden CD8+-T-Zellen durch dendritische Zellen und CD4+-T-Helferzellen, die das entsprechende antigene Peptid erkennen Dendritische Zellen sind meist nicht selbst von Viren infiziert; sie
endozytieren virusinfizierte oder Tumorzellen und präsentieren daraus
gewonnene Antigene über MHC-I an CD8+-Lymphozyten. Diese
kontrollieren solchermaßen alle kernhaltigem Zellen des Körpers auf
Fremdpeptide und töten diese bei Erkennung durch Freisetzung
zytotoxischer Proteine (Perforin-Granzym-Mechanismus). Auch wird die
Apoptose aktiviert (Caspase). Nach erfolgreichem Angriff löst sich die
CD8+-T-Zelle wieder von der Zielzelle ab und kann weitere virusbefallene oder Krebszellen attackieren
Dendritische Zellen sind meist nicht selbst von Viren infiziert; sie
endozytieren virusinfizierte oder Tumorzellen und präsentieren daraus
gewonnene Antigene über MHC-I an CD8+-Lymphozyten. Diese
kontrollieren solchermaßen alle kernhaltigem Zellen des Körpers auf
Fremdpeptide und töten diese bei Erkennung durch Freisetzung
zytotoxischer Proteine (Perforin-Granzym-Mechanismus). Auch wird die
Apoptose aktiviert (Caspase). Nach erfolgreichem Angriff löst sich die
CD8+-T-Zelle wieder von der Zielzelle ab und kann weitere virusbefallene oder Krebszellen attackieren CD4+-T-Lymphozyten
kommen in mehreren Varianten vor und bilden für die jeweilige Situation
optimierte "Zytokin-Cocktails": Th1-Helferzellen bekämpfen
intrazelluläre Pathogene, Th2-Helferzellen Mikroben auf Schleimhäuten
und Würmer, Th17-Helferzellen extrazelluläre Bakterien und Pilze,
Tfh-Helferzellen extrazelluläre Pathogene, Treg-Zellen bremsen
Effektor-T-Zellen und unterdrücken Immunreaktionen
CD4+-T-Lymphozyten
kommen in mehreren Varianten vor und bilden für die jeweilige Situation
optimierte "Zytokin-Cocktails": Th1-Helferzellen bekämpfen
intrazelluläre Pathogene, Th2-Helferzellen Mikroben auf Schleimhäuten
und Würmer, Th17-Helferzellen extrazelluläre Bakterien und Pilze,
Tfh-Helferzellen extrazelluläre Pathogene, Treg-Zellen bremsen
Effektor-T-Zellen und unterdrücken Immunreaktionen