



 Galaktorrhoe: γάλα, γάλακτος, = Milch, ῥέω = fließen
Galaktorrhoe: γάλα, γάλακτος, = Milch, ῥέω = fließen| Der Hypophysenvorderlappen hat azido- und basophile sowie
chromophobe Zellen und bildet Somatotropin (Wachstumshormon, hGH = human growth hormone),
Prolaktin, und mehrere glandotrope Hormone (TSH - Schilddrüse, ACTH -
Nebennierenrinde, FSH / LH - Geschlechtsorgane). Das Wachstumshormon wird in mehreren Pulsen pro Tag freigesetzt (am stärksten gegen Mitternacht) sowie bei Stresseinfluss. Es wirkt über Rezeptoren, die den Zytokinrezeptoren ähneln, anabol auf die meisten Zellen des Körpers. Es regt die Bildung von Somatomedinen an, vor allem IGF-I (insulin-like growth factor); dieses fördert das Wachstum über Wirkung an Rezeptoren, die den Insulinrezeptoren ähnlich sind. Prolaktin bereitet während der Gravidität die Brust auf die Milchproduktion vor und hat zahlreiche weitere Wirkungen. Auch seine Freisetzung erfolgt pulsatil (90-Minuten-Rhythmus), am intensivsten in den Morgenstunden. Beim Stillreflex löst der Saugreiz an der Brustwarze intensive Prolaktinproduktion aus. Fördernd auf die Prolaktinfreisetzung wirken weiters TRH, GHRH, Östrogene; hemmend Dopamin (daher die alte Bezeichnung prolaktin-inhibiting factor). Thyreotropin regt akut die Schilddrüse zur Ausschüttung ihrer Hormone und Aufnahme von Jodid an. Über längere Zeit bewirkt es Schilddrüsenwachstum. Corticotropin (ACTH) wird vor allem in der Nacht und frühmorgens gebildet - in etwa zweistündigen Pulsen. Es stimuliert die Nebenniere zur Produktion von Cortisol und anderen Steroidhormonen, und wirkt lipolytisch. Gonadotropine (FSH, LH) regen die Bildung von Gameten und Geschlechtshormonen an. Mit entsprechenden GnRH-Pulsen steigt ihr Blutspiegel alle ~3 Stunden. Zellen des Hypophysenzwischenlappenssezernieren Melanotropine (Melanozyten-stimulierende Hormone, MSH); diese steuern die Melanin- (Pigment-) synthese in Pigmentzellen (Melanozyten). |
 Rückkopplung und zirkumventrikuläre Organe
Rückkopplung und zirkumventrikuläre Organe  Somatotropin (hGH)
Somatotropin (hGH)  Insulinähnliche Wachstumsfaktoren (IGF1, IGF2)
Insulinähnliche Wachstumsfaktoren (IGF1, IGF2)  Prolactin
Prolactin  Thyreotropin (TSH)
Thyreotropin (TSH)  Corticotropin (ACTH)
Corticotropin (ACTH)  Gonadotropine (LH / ICSH, FSH)
Gonadotropine (LH / ICSH, FSH)
 MSH, Lipotropine, ß-Endorphin, Metenkephalin
MSH, Lipotropine, ß-Endorphin, Metenkephalin Melanocortine
Melanocortine
 Core messages
Core messages (ACTH, TSH, FSH, LH, Prolaktin), sie steuern die Hormonfreisetzung peripherer Drüsen (Glucocorticoide,
Schilddrüsenhormone, Geschlechtshormone), Ovulation und Spermatogenese,
Wachstum und Brustdrüsenentwicklung. Man spricht von endokrinen Achsen:
(ACTH, TSH, FSH, LH, Prolaktin), sie steuern die Hormonfreisetzung peripherer Drüsen (Glucocorticoide,
Schilddrüsenhormone, Geschlechtshormone), Ovulation und Spermatogenese,
Wachstum und Brustdrüsenentwicklung. Man spricht von endokrinen Achsen:  hypothalamisch-hypophysär-adrenal (CRH - ACTH - Corticoide)
hypothalamisch-hypophysär-adrenal (CRH - ACTH - Corticoide) hypothalamisch-hypophysär-thyreoid (TRH - TSH - Schilddrüsenhormone)
hypothalamisch-hypophysär-thyreoid (TRH - TSH - Schilddrüsenhormone) hypothalamisch-hypophysär-ovariell (GnRH - LH / FSH / Östrogene, Progesteron..)
hypothalamisch-hypophysär-ovariell (GnRH - LH / FSH / Östrogene, Progesteron..) hypothalamisch-hypophysär-testikulär (GnRH - LH / FSH / Testosteron..)
hypothalamisch-hypophysär-testikulär (GnRH - LH / FSH / Testosteron..) hypothalamisch-hypophysär-hepatisch (GHRH / Somatostatin - GH - Leber)
hypothalamisch-hypophysär-hepatisch (GHRH / Somatostatin - GH - Leber)  Anmerkung: "-TROP" kommt von τρεπω
= auf etwas gerichtet sein, nämlich auf ein bestimmtes Zielorgen. "-TROPH" hingegen steht für τροφή =
Ernährung (z.B. in atroph, hypertroph).
In vielen (vor allem
amerikanischen) Büchern ist fälschlich von "trophen" (statt "tropen")
Hormonen ("somatotroph" etc) die Rede. Allmählich scheint eine
Korrektur dieser Usancen stattzufinden.
Anmerkung: "-TROP" kommt von τρεπω
= auf etwas gerichtet sein, nämlich auf ein bestimmtes Zielorgen. "-TROPH" hingegen steht für τροφή =
Ernährung (z.B. in atroph, hypertroph).
In vielen (vor allem
amerikanischen) Büchern ist fälschlich von "trophen" (statt "tropen")
Hormonen ("somatotroph" etc) die Rede. Allmählich scheint eine
Korrektur dieser Usancen stattzufinden.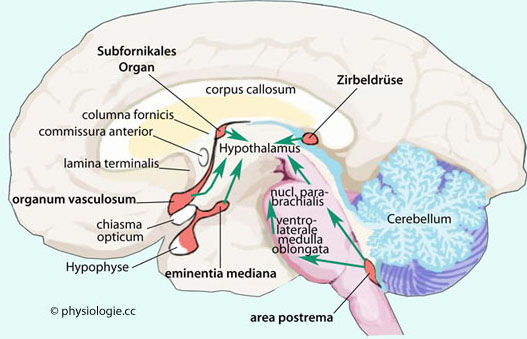
 Abbildung: Zirkumventrikuläre Organe
Abbildung: Zirkumventrikuläre Organe
 An den zirkumventrikulären Organen (
An den zirkumventrikulären Organen ( Abbildung: Eminentia mediana des Hypophysenstiels, organum vasculosum laminae terminalis, area postrema am kaudalen Ende der Rautengrube, Subfornikalorgan,
Subkommissuralorgan, Zirbeldrüse, plexus chorioideus) ist die Blut-Hirn-Schranke nicht wirksam, im Gegensatz zu anderen Hirnteilen. Hier
können (auch wasserlösliche) Signalstoffe durch die Kapillarwände ins Gehirngewebe treten.
Abbildung: Eminentia mediana des Hypophysenstiels, organum vasculosum laminae terminalis, area postrema am kaudalen Ende der Rautengrube, Subfornikalorgan,
Subkommissuralorgan, Zirbeldrüse, plexus chorioideus) ist die Blut-Hirn-Schranke nicht wirksam, im Gegensatz zu anderen Hirnteilen. Hier
können (auch wasserlösliche) Signalstoffe durch die Kapillarwände ins Gehirngewebe treten. Entsprechung hypothalamisch - hypophysär  Nach Kandel / Koester / Mack / Siegelbaum (eds), Principles of Neural Sciences, 6th ed. 2021 |
|||
| fördernd (releasing) |
hemmend (inhibiting) |
||
| TRH |
TSH Prolaktin |
PIH Dopamin |
Prolaktin |
| CRH |
ACTH ß-Lipotropin |
GHRIH Somatostatin |
GH TSH |
| GnRH |
LH FSH |
||
| GHRH |
GH |
||
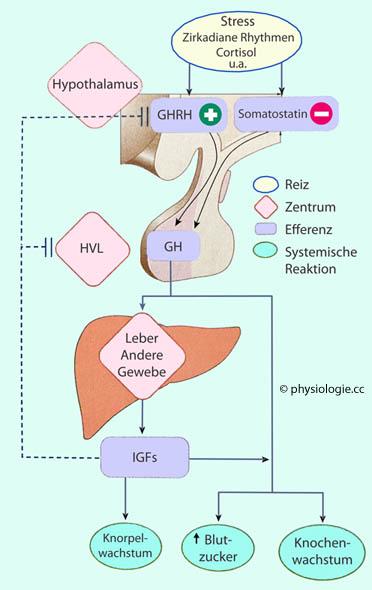
 Abbildung: Steuerung des Wachstumshormons
Abbildung: Steuerung des Wachstumshormons GH wird von den
somatotropen Zellen der Adenohypophyse zunächst als (größeres)
Prohormon gebildet. Anschließend wird es in endoplasmatischem Retikulum
und Golgi-Apparat modifiziert, einige kleine Peptide entfernt. Durch
alternatives Splicing entstehen mindestens drei molekulare Formen;
diese werden in sekretorischen Granula gespeichert, bis sie auf
"Kommando" (GHRH) freigesetzt werden.
GH wird von den
somatotropen Zellen der Adenohypophyse zunächst als (größeres)
Prohormon gebildet. Anschließend wird es in endoplasmatischem Retikulum
und Golgi-Apparat modifiziert, einige kleine Peptide entfernt. Durch
alternatives Splicing entstehen mindestens drei molekulare Formen;
diese werden in sekretorischen Granula gespeichert, bis sie auf
"Kommando" (GHRH) freigesetzt werden. PGH (placental growth hormone) - die plazentare Variante, auch PGH (placental growth hormone), pvGH oder HG2 (growth hormone 2)
genannt, die in der Schwangerschaft vorübergehend zur dominierenden
Form des Wachstumshormons wird und sich an der Glucoseversorgung des
Feten (und der mit anderen Nährstoffen) beteiligt,
PGH (placental growth hormone) - die plazentare Variante, auch PGH (placental growth hormone), pvGH oder HG2 (growth hormone 2)
genannt, die in der Schwangerschaft vorübergehend zur dominierenden
Form des Wachstumshormons wird und sich an der Glucoseversorgung des
Feten (und der mit anderen Nährstoffen) beteiligt,  das Plazentalaktogen HPL (human placental lactogen),
auch als Chorion- Somatomammotropin hCS1 und hCS2 bezeichnet, das u.a.
die Insulinempfindlichkeit senkt und den Blutzuckerspiegel steigert -,
sowie
das Plazentalaktogen HPL (human placental lactogen),
auch als Chorion- Somatomammotropin hCS1 und hCS2 bezeichnet, das u.a.
die Insulinempfindlichkeit senkt und den Blutzuckerspiegel steigert -,
sowie Prolactin (PRL).
Prolactin (PRL). )
- und damit das Körperwachstum an (IGF: insulinähnliche Wachstumsfaktoren, insulinlike growth factors).
)
- und damit das Körperwachstum an (IGF: insulinähnliche Wachstumsfaktoren, insulinlike growth factors). 
 GH steigert die Proteinsynthese (anaboler Effekt), bedingt u.a. durch verbesserte Aminosäureaufnahme in
die Zelle (diesbezüglich ist GH insulin-synergistisch).
GH steigert die Proteinsynthese (anaboler Effekt), bedingt u.a. durch verbesserte Aminosäureaufnahme in
die Zelle (diesbezüglich ist GH insulin-synergistisch). GH hemmt die Glucoseutilisation (was den Blutzuckerspiegel steigert: "anti-insulinärer" Effekt) und schont so körpereigene
Kohlenhydratreserven ("Sparhormon") - in Hepatozyten regt GH die Gluconeogenese an. Der Blutzuckerspiegel sinkt zuerst unter IGF-Wirkung ab, nach etwa einer Stunde nimmt er durch
insulin-antagonistische Wirkung zu. Hypoglykämie stimuliert die Ausschüttung von GH (das als Komponente des "kontrainsulinären" Systems gesehen werden kann).
Der
Blutzuckerspiegel wird durch GH-Freisetzung zweiphasig beeinflusst:
Zunächst fällt er kurzfristig durch IGF-Wirkung, nach etwa einer Stunde
nimmt er durch die insulinantagonistische Wirkung des GH zu (diabetogener Effekt). Bei Stress und Hunger ist der GH-Spiegel erhöht, IGF-Effekte werden überspielt, Energieträger mobilisiert - der Blutzuckerspiegel
steigt an.
GH hemmt die Glucoseutilisation (was den Blutzuckerspiegel steigert: "anti-insulinärer" Effekt) und schont so körpereigene
Kohlenhydratreserven ("Sparhormon") - in Hepatozyten regt GH die Gluconeogenese an. Der Blutzuckerspiegel sinkt zuerst unter IGF-Wirkung ab, nach etwa einer Stunde nimmt er durch
insulin-antagonistische Wirkung zu. Hypoglykämie stimuliert die Ausschüttung von GH (das als Komponente des "kontrainsulinären" Systems gesehen werden kann).
Der
Blutzuckerspiegel wird durch GH-Freisetzung zweiphasig beeinflusst:
Zunächst fällt er kurzfristig durch IGF-Wirkung, nach etwa einer Stunde
nimmt er durch die insulinantagonistische Wirkung des GH zu (diabetogener Effekt). Bei Stress und Hunger ist der GH-Spiegel erhöht, IGF-Effekte werden überspielt, Energieträger mobilisiert - der Blutzuckerspiegel
steigt an.  GH baut Fettspeicher ab, vor allem
im Hungerzustand. Mit 2-3stündiger Verzögerung wird die Oxidation von Fettsäuren
angeregt, was u.a. den Abbau viszeralen Fettgewebes begünstigt. GH ist ein lipolytisches Hormon, es aktiviert die hormonsensitive Lipase;
Neutralfette werden mobilisiert, der Fettsäurespiegel im Blut steigt
an, Muskel und Leber können mehr Energie umsetzen. Die Glucoseaufnahme
(insbesondere in Muskulatur und Fettgewebe) nimmt ab, der Glucosespiegel steigt an (diabetogene, "anti-insulinäre" Wirkung des GH).
GH baut Fettspeicher ab, vor allem
im Hungerzustand. Mit 2-3stündiger Verzögerung wird die Oxidation von Fettsäuren
angeregt, was u.a. den Abbau viszeralen Fettgewebes begünstigt. GH ist ein lipolytisches Hormon, es aktiviert die hormonsensitive Lipase;
Neutralfette werden mobilisiert, der Fettsäurespiegel im Blut steigt
an, Muskel und Leber können mehr Energie umsetzen. Die Glucoseaufnahme
(insbesondere in Muskulatur und Fettgewebe) nimmt ab, der Glucosespiegel steigt an (diabetogene, "anti-insulinäre" Wirkung des GH).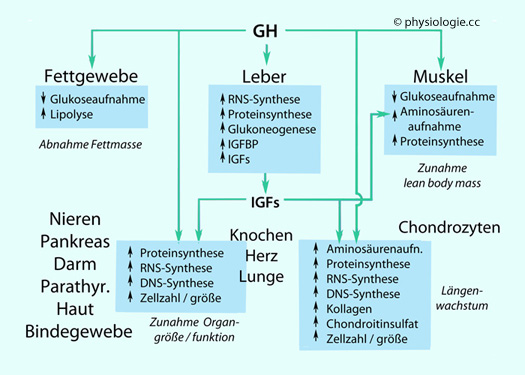
 Abbildung: Wirkungen der Wachstumshormone (GH / IGFs)
Abbildung: Wirkungen der Wachstumshormone (GH / IGFs)
 Abbildung):
Abbildung): Förderung des Längenwachstums und der Mineralisierung im Knochen - insbesondere über insulinähnliche Wachstumsfaktoren (IGFs, s. unten). GH wirkt anabol:
Der Einbau von Aminosäuren in Zellen nimmt zu, Proteolyse und
Stickstoffausscheidung (und Harnstoffproduktion) sinken. Vielleicht ist
der Verlust an Muskelmasse mit zunehmendem Alter zum Teil mit einer
Abnahme der GH-Produktion erklärbar.
Förderung des Längenwachstums und der Mineralisierung im Knochen - insbesondere über insulinähnliche Wachstumsfaktoren (IGFs, s. unten). GH wirkt anabol:
Der Einbau von Aminosäuren in Zellen nimmt zu, Proteolyse und
Stickstoffausscheidung (und Harnstoffproduktion) sinken. Vielleicht ist
der Verlust an Muskelmasse mit zunehmendem Alter zum Teil mit einer
Abnahme der GH-Produktion erklärbar. Insulin- und GH-Spiegel verändern sich normalerweise gegenphasig.
Kurzfristiges Fasten (niedriger Insulinspiegel) erhöht den GH-Spiegel
im Blut (Fettsäureverwertung). Vermutlich verhindert hohes GH im
Hungerzustand eine Unterbrechung des Wachstumsprozesses: STH fördert
die Proteinsynthese über IGF1 / IGF2 und wirkt muskelaufbauend
(anabol). Längerfristiges Fasten senkt allerdings den GH-Spiegel
(Schonung der Fettdepots).
Insulin- und GH-Spiegel verändern sich normalerweise gegenphasig.
Kurzfristiges Fasten (niedriger Insulinspiegel) erhöht den GH-Spiegel
im Blut (Fettsäureverwertung). Vermutlich verhindert hohes GH im
Hungerzustand eine Unterbrechung des Wachstumsprozesses: STH fördert
die Proteinsynthese über IGF1 / IGF2 und wirkt muskelaufbauend
(anabol). Längerfristiges Fasten senkt allerdings den GH-Spiegel
(Schonung der Fettdepots). Erhöhung der Muskelmasse, Wachstum innerer Organe
(Leber, Nieren, Milz, Immungewebe), Intensivierung der glomerulären
Filtration in der Niere, Differenzierung von Präadipozyten zu
Adipozyten, Anregung hepatischer
Glukoneogenese (via IGF-1), Förderung der Erythropoese.
Erhöhung der Muskelmasse, Wachstum innerer Organe
(Leber, Nieren, Milz, Immungewebe), Intensivierung der glomerulären
Filtration in der Niere, Differenzierung von Präadipozyten zu
Adipozyten, Anregung hepatischer
Glukoneogenese (via IGF-1), Förderung der Erythropoese. GH regt das Immunsystem an.
GH regt das Immunsystem an.
 Abbildung: Einflüsse auf die hypothalamische Koordination des GH-Systems
Abbildung: Einflüsse auf die hypothalamische Koordination des GH-Systems GHRH = GH-Releasinghormon
GHRH = GH-Releasinghormon
 Abbildung):
Abbildung):  Im Hypothalamus wirken Somatostatin- (-), Galanin- (+),
Prolactin- (+) und katecholaminerge (+) Neuronen auf GHRH-produzierende Neuronen des
Hypothalamus, Ghrelin regt NPY-Neurone an
Im Hypothalamus wirken Somatostatin- (-), Galanin- (+),
Prolactin- (+) und katecholaminerge (+) Neuronen auf GHRH-produzierende Neuronen des
Hypothalamus, Ghrelin regt NPY-Neurone an Somatostatinneurone im Hypothalamus werden von GH angeregt und von NPY-
(+), cholinergen (-), serotononergen (-) und CRH-Neuronen (+)
beeinflusst
Somatostatinneurone im Hypothalamus werden von GH angeregt und von NPY-
(+), cholinergen (-), serotononergen (-) und CRH-Neuronen (+)
beeinflusst GH koppelt auf NPY- (+) und Somatostatin- (+)
Neuronen zurück und regt das Fettgewebe an, dieses produziert Leptin,
das NPY-Neuronen bremst
GH koppelt auf NPY- (+) und Somatostatin- (+)
Neuronen zurück und regt das Fettgewebe an, dieses produziert Leptin,
das NPY-Neuronen bremst Glutamat, GABA (durch Hemmung von Somatostatinneuronen), GHRH, TRH, Noradrenalin (α2-Rezeptoren), Acetylcholin (muskarinerg), Serotonin, Dopamin, Östrogene und Testosteron (insbesondere in der Pubertät: Wachstumsschub), Schilddrüsenhormone, Leptin
Glutamat, GABA (durch Hemmung von Somatostatinneuronen), GHRH, TRH, Noradrenalin (α2-Rezeptoren), Acetylcholin (muskarinerg), Serotonin, Dopamin, Östrogene und Testosteron (insbesondere in der Pubertät: Wachstumsschub), Schilddrüsenhormone, Leptin Das "Magenhormon" Ghrelin,
das seinerseits auch die GHRH-Ausschüttung stimuliert (GHRH und Ghrelin sind die stärksten Stimuli für die GH-Ausschüttung) und neben diesem die Somatotropinausschüttung fördert. Es wirkt über metabotrope Rezeptoren an Zellen der Hypophyse, des Hypothalamus und anderen Gehirnarealen, und ist ein appetitförderndes Hormon
Das "Magenhormon" Ghrelin,
das seinerseits auch die GHRH-Ausschüttung stimuliert (GHRH und Ghrelin sind die stärksten Stimuli für die GH-Ausschüttung) und neben diesem die Somatotropinausschüttung fördert. Es wirkt über metabotrope Rezeptoren an Zellen der Hypophyse, des Hypothalamus und anderen Gehirnarealen, und ist ein appetitförderndes Hormon Hungerbedingte Hypoglykämie
(<60 mg/dl) - hypothalamischer Glucostat - sowie Aminosäuren (vor allem Arginin - eiweißreiche
Kost) führen zu deutlicher Steigerung des
Wachstumshormonspiegels
Hungerbedingte Hypoglykämie
(<60 mg/dl) - hypothalamischer Glucostat - sowie Aminosäuren (vor allem Arginin - eiweißreiche
Kost) führen zu deutlicher Steigerung des
Wachstumshormonspiegels Erregung (emotional), körperliche Aktivität, akuter Stress (Mobilisierung von Energiereserven),
Erregung (emotional), körperliche Aktivität, akuter Stress (Mobilisierung von Energiereserven),  Tiefer Schlaf (stimuliert die
GH-Freisetzung intensiv)
Tiefer Schlaf (stimuliert die
GH-Freisetzung intensiv)| Zu den Faktoren, welche die Sekretion von Somatotropin steigern, gehören Ghrelin und Hypoglykämie |
 GH selbst (autokrin), GABA
GH selbst (autokrin), GABA IGFs (insulin-like growth factors, insulinähnliche Wachstumsfaktoren); IGF-1 hat negative Rückkopplung auf den Hypothalamus
IGFs (insulin-like growth factors, insulinähnliche Wachstumsfaktoren); IGF-1 hat negative Rückkopplung auf den Hypothalamus Somatostatin (GHIH, growth hormone inhibiting factor) aus dem Hypothalamus (nucl. ventromedialis)
Somatostatin (GHIH, growth hormone inhibiting factor) aus dem Hypothalamus (nucl. ventromedialis) Hohen Blutzuckerspiegel (klinische Testmöglichkeit: Glucosebelastung sollte bei intaktem Regelkreis die GH-Ausschüttung senken)
Hohen Blutzuckerspiegel (klinische Testmöglichkeit: Glucosebelastung sollte bei intaktem Regelkreis die GH-Ausschüttung senken) Erhöhung der Konzentration von freien Fettsäuren im Kreislauf (Mechanismus unklar)
Erhöhung der Konzentration von freien Fettsäuren im Kreislauf (Mechanismus unklar) Senkung der Konzentration an Aminosäuren im Kreislauf (insbesondere Arginin)
Senkung der Konzentration an Aminosäuren im Kreislauf (insbesondere Arginin)  längerfristige Erhöhung der Glucocorticoide
längerfristige Erhöhung der Glucocorticoide Gestagene
Gestagene Adrenalin (ß-Rezeptoren)
Adrenalin (ß-Rezeptoren) Adipositas
Adipositas Kälteeinwirkung
Kälteeinwirkung Wachstumshormon (hGH, Somatotropes Hormon, Somatotropin)
Wachstumshormon (hGH, Somatotropes Hormon, Somatotropin)



 Substitution: hGH ist artspezifisch: Bei Somatotropinmangel kann nur humanes GH wirksam werden, GH anderer Spezies ist weitgehend unwirksam. Zur Therapie eines Wachstumshormonmangels wird gentechnologisch erzeugtes hGH verwendet.
Substitution: hGH ist artspezifisch: Bei Somatotropinmangel kann nur humanes GH wirksam werden, GH anderer Spezies ist weitgehend unwirksam. Zur Therapie eines Wachstumshormonmangels wird gentechnologisch erzeugtes hGH verwendet. Abbildung).
Abbildung).
 Abbildung: Rückkopplungsschleifen für GH und IGF-1
Abbildung: Rückkopplungsschleifen für GH und IGF-1
 Abbildung oben). IGF-1 ist bei erwachsenen Personen die prädominante IGF-Form, während IGF-2 beim Fetus überwiegt.
Abbildung oben). IGF-1 ist bei erwachsenen Personen die prädominante IGF-Form, während IGF-2 beim Fetus überwiegt. Nimmt man Nahrung zu sich, die Kohlenhydrate
(und Fette), aber kaum Aminosäuren enthält (proteinarm), dann sinkt die
Sekretion von GH und IGFs, da diese Situation nicht förderlich für die
Proteinsynthese ist - Insulin wird gleichzeitig ausgeschüttet, um die
Energieträger zu verwerten.
Nimmt man Nahrung zu sich, die Kohlenhydrate
(und Fette), aber kaum Aminosäuren enthält (proteinarm), dann sinkt die
Sekretion von GH und IGFs, da diese Situation nicht förderlich für die
Proteinsynthese ist - Insulin wird gleichzeitig ausgeschüttet, um die
Energieträger zu verwerten.  In der postdigestiven Phase bzw. im Hungerzustand (der für das Wachstum
nicht förderlich ist) steigt zwar der GH-, nicht aber IGF-Spiegel (es entfällt die negative Rückkopplung der IGFs auf die GH-Ausschüttung, GH wirkt fettmobilisierend und blutzuckersteigernd).
In der postdigestiven Phase bzw. im Hungerzustand (der für das Wachstum
nicht förderlich ist) steigt zwar der GH-, nicht aber IGF-Spiegel (es entfällt die negative Rückkopplung der IGFs auf die GH-Ausschüttung, GH wirkt fettmobilisierend und blutzuckersteigernd). 
 Abbildung: Rezeptoren für Insulin, IGF-1 und IGF-2 im Vergleich
Abbildung: Rezeptoren für Insulin, IGF-1 und IGF-2 im Vergleich
 IGF-1
(42% Strukturhomologie mit Insulin) wirkt über IGF-1-Rezeptoren. Es
wird hauptsächlich von der Leber - aber auch von Zellen in Zielorganen
- gebildet (am stärksten während des pubertären Wachstumsschubs) und zu
98% an IGF-Bindungsproteine gebunden im Blut transportiert. Leber- und Fettzellen haben relativ wenig IGF-1-Rezeptoren.
IGF-1
(42% Strukturhomologie mit Insulin) wirkt über IGF-1-Rezeptoren. Es
wird hauptsächlich von der Leber - aber auch von Zellen in Zielorganen
- gebildet (am stärksten während des pubertären Wachstumsschubs) und zu
98% an IGF-Bindungsproteine gebunden im Blut transportiert. Leber- und Fettzellen haben relativ wenig IGF-1-Rezeptoren. 
 IGF-2
wirkt über IGF-1und bindet auch an IGF-2- (Mannose
6-Phosphat-) Rezeptoren (diese sind nicht insulinrezeptor-ähnlich und
haben keine Tyrosinkinase-Aktivität). Es wird ebenfalls vor allem von
der Leber synthetisiert (angeregt durch Somatotropin), regt in der
Schwangerschaft das intrauterine
Wachstum des Feten an und hat im Zyklus der Frau eine gonadotropine Wirkung (Cofaktor zu LH und FSH).
IGF-2
wirkt über IGF-1und bindet auch an IGF-2- (Mannose
6-Phosphat-) Rezeptoren (diese sind nicht insulinrezeptor-ähnlich und
haben keine Tyrosinkinase-Aktivität). Es wird ebenfalls vor allem von
der Leber synthetisiert (angeregt durch Somatotropin), regt in der
Schwangerschaft das intrauterine
Wachstum des Feten an und hat im Zyklus der Frau eine gonadotropine Wirkung (Cofaktor zu LH und FSH).  Mehr über Prolactin und Lactation s. dort
Mehr über Prolactin und Lactation s. dort ist ein Peptidhormon (199 Aminosäuren) aus
laktotropen azidophilen Zellen des Hypophysenvorderlappens. Es wirkt
vor allem bei Frauen, während der Gravidität und zur Vorbereitung der
Brustdrüsen auf die
Laktation, die postpartal angeregt wird.
ist ein Peptidhormon (199 Aminosäuren) aus
laktotropen azidophilen Zellen des Hypophysenvorderlappens. Es wirkt
vor allem bei Frauen, während der Gravidität und zur Vorbereitung der
Brustdrüsen auf die
Laktation, die postpartal angeregt wird. 
 Abbildung: Steuerung der Prolactin-Sekretion
Abbildung: Steuerung der Prolactin-Sekretion ACh, Acetylcholin
ACh, Acetylcholin  DA, Dopamin
DA, Dopamin  GABA, gamma-Aminobuttersäure
GABA, gamma-Aminobuttersäure  NA, A = Noradrenalin, Adrenalin
NA, A = Noradrenalin, Adrenalin  VIP = vasoaktives intestinales Peptid
VIP = vasoaktives intestinales Peptid
| Dopamin ist der bedeutendste Inhibitor der Prolactinausschüttung |

 Abbildung: Prolactinrezeptor
Abbildung: Prolactinrezeptor MAPK = MAP-Kinase
MAPK = MAP-Kinase  PI3K = Phosphoinositid-3-Kinase, ist an der Signaltransduktion verschiedenster Zellen beteiligt
PI3K = Phosphoinositid-3-Kinase, ist an der Signaltransduktion verschiedenster Zellen beteiligt  PTEN = Phosphatase and tensin homolog, multifunktionales Enzym, hydrolysiert Phosphate insbesondere an Signalmolekülen, z.B. Phospholipides
PTEN = Phosphatase and tensin homolog, multifunktionales Enzym, hydrolysiert Phosphate insbesondere an Signalmolekülen, z.B. Phospholipides  SOCS = Suppressor of cytokine signaling, hemmt JAK-STAT-Signaltransduktion
SOCS = Suppressor of cytokine signaling, hemmt JAK-STAT-Signaltransduktion

 Abbildung). Nicht nur
Zellen in der Brustdrüse exprimieren Prolactinrezeptoren, sonden auch
in Ovarien, Gehirn, Herz, Lungen, auch Zellen des Immunsystems.
Abbildung). Nicht nur
Zellen in der Brustdrüse exprimieren Prolactinrezeptoren, sonden auch
in Ovarien, Gehirn, Herz, Lungen, auch Zellen des Immunsystems. Prolactin stimuliert die Freisetzung von Vasopressin und Oxytozin
aus
dem Hinterlappen, was die Laktation unterstützt
Prolactin stimuliert die Freisetzung von Vasopressin und Oxytozin
aus
dem Hinterlappen, was die Laktation unterstützt Prolactin stellt das
Verhaltensmuster in Richtung Fürsorglichkeit um (Eltern!) und hemmt
beim Mann den Sexualantrieb (fördert Dopaminausschüttung) sowie die
Gonadotropinproduktion
Prolactin stellt das
Verhaltensmuster in Richtung Fürsorglichkeit um (Eltern!) und hemmt
beim Mann den Sexualantrieb (fördert Dopaminausschüttung) sowie die
Gonadotropinproduktion Prolactin wird auch
beim Orgasmus freigesetzt und hat u.a. einen beruhigenden (auch
schlafinduzierenden) Effekt
Prolactin wird auch
beim Orgasmus freigesetzt und hat u.a. einen beruhigenden (auch
schlafinduzierenden) Effekt Prolactin wirkt insulinantagonistisch.
Prolactin wirkt insulinantagonistisch. Es gibt Hinweise auf die Existenz eines Prolactin releasing factor,
dessen Natur unklar ist. Die Prolactinsekretion wird (zumindest
experimentell) durch mehrere hypothalamische Faktoren angeregt, wie TRH und Somatoliberin (GH-RH). Jedenfalls ist das Stillen der stärkste Reiz zur Prolactinausschüttung.
Es gibt Hinweise auf die Existenz eines Prolactin releasing factor,
dessen Natur unklar ist. Die Prolactinsekretion wird (zumindest
experimentell) durch mehrere hypothalamische Faktoren angeregt, wie TRH und Somatoliberin (GH-RH). Jedenfalls ist das Stillen der stärkste Reiz zur Prolactinausschüttung.| Hyperprolactinämie (erhöhter Prolactinspiegel)
vermindert die pulsatile GnRH- und damit LH-Freisetzung (negative
Rückkopplung) |
 Dopamin aus tubero-infundibulären TIDA-Neuronen (tuberoinfundibular dopamine) hemmt via D2-Rezeptoren die Prolactinfreisetzung laktotroper Zellen im Hypophysenvorderlappen (früher: Prolactin inhibiting factor PIF). GABA hemmt die Dopaminfreisetzung und fördert so die Prolactinfreisetzung. TRH (Prolactin bremst die TRH-Freisetzung - Selbstbeschränkung).
Dopamin aus tubero-infundibulären TIDA-Neuronen (tuberoinfundibular dopamine) hemmt via D2-Rezeptoren die Prolactinfreisetzung laktotroper Zellen im Hypophysenvorderlappen (früher: Prolactin inhibiting factor PIF). GABA hemmt die Dopaminfreisetzung und fördert so die Prolactinfreisetzung. TRH (Prolactin bremst die TRH-Freisetzung - Selbstbeschränkung). ).
). Dopamin-D2-Agonisten
(z.B. Cabergolin) werden zur Hemmung der Prolactinsekretion eingesetzt
(Abstillen, Reduktion Prolactinsezernierender Hypophysenadenome).
Dopamin-D2-Agonisten
(z.B. Cabergolin) werden zur Hemmung der Prolactinsekretion eingesetzt
(Abstillen, Reduktion Prolactinsezernierender Hypophysenadenome). Abbildung oben):
Abbildung oben): Östrogene
regen das Wachstum Prolactinproduzierender Zellen an, stimulieren
direkt die Prolactinsekretion und hemmen die Dopaminfreisetzung
(
Östrogene
regen das Wachstum Prolactinproduzierender Zellen an, stimulieren
direkt die Prolactinsekretion und hemmen die Dopaminfreisetzung
( Abbildung). In der Schwangerschaft nehmen die
Östrogenspiegel stetig zu, damit auch die Prolactinfreisetzung
Abbildung). In der Schwangerschaft nehmen die
Östrogenspiegel stetig zu, damit auch die Prolactinfreisetzung
 Ghrelin, Angiotensin II, Substanz P, Glucagon, GIP, VIP regen die Prolactinfreisetzung an
Ghrelin, Angiotensin II, Substanz P, Glucagon, GIP, VIP regen die Prolactinfreisetzung an | Prolactinüberschuss kann Galaktorrhoe und Amenorrhoe bewirken |
 Prolactin, Blutserum
Prolactin, Blutserum ) des Organs.
) des Organs.
 Abbildung: TSH-Rezeptor und zelluläre Wirkmechanismen
Abbildung: TSH-Rezeptor und zelluläre Wirkmechanismen
 Abbildung) bindet das Hormonmolekül mittels
einer besonders großen (N-terminalen) extrazellulären Domäne (vgl.
Gonadotropine) und ist G-Protein-gekoppelt. Er mobilisiert über Adenylylcyclase (cAMP) und Phospholipase C (IP3-Mechanismus) Proteinkinasen und steuert auf diese Weise die Transkription von Zielgenen in den Follikelepithelzellen der Schilddrüse.
Abbildung) bindet das Hormonmolekül mittels
einer besonders großen (N-terminalen) extrazellulären Domäne (vgl.
Gonadotropine) und ist G-Protein-gekoppelt. Er mobilisiert über Adenylylcyclase (cAMP) und Phospholipase C (IP3-Mechanismus) Proteinkinasen und steuert auf diese Weise die Transkription von Zielgenen in den Follikelepithelzellen der Schilddrüse. Thyreotropin (Serum)
Thyreotropin (Serum) wird durch TRH
gefördert,
wird durch TRH
gefördert, 
 durch T3 und T4 (negative Rückkopplung) sowie durch Somatostatin gehemmt.
durch T3 und T4 (negative Rückkopplung) sowie durch Somatostatin gehemmt. | TRH stimuliert TSH, TSH stimuliert T3 / T4 |
 Akute Effekte stellen sich innerhalb von Minuten ein. Cholesterin wird rasch aus Lipidtröpfchen mobilisiert (posttranslationale Aktivierung hormonsensitiver Lipase
- einer intrazellulären Lipase, die ein breites Spektrum von Estern
hydrolysiert, durch Katecholamine und ACTH aktivierbar ist und zur
äußeren Mitochondrienmembran transportiert wird), die Expression des StAR-Proteins nimmt zu, der Pregnenolonspiegel in den Zielzellen steigt an (Ausgangssubstanz für Steroidhormone).
Akute Effekte stellen sich innerhalb von Minuten ein. Cholesterin wird rasch aus Lipidtröpfchen mobilisiert (posttranslationale Aktivierung hormonsensitiver Lipase
- einer intrazellulären Lipase, die ein breites Spektrum von Estern
hydrolysiert, durch Katecholamine und ACTH aktivierbar ist und zur
äußeren Mitochondrienmembran transportiert wird), die Expression des StAR-Proteins nimmt zu, der Pregnenolonspiegel in den Zielzellen steigt an (Ausgangssubstanz für Steroidhormone). Langsame Effekte treten im Rahmen mehrerer Stunden
auf. Sie sind durch die Expression von Enzymen und Koenzymen für die
Steroidhormonbildung gekennzeichnet. ACTH steigert auch die Expression
von LDL-Rezeptoren.
Langsame Effekte treten im Rahmen mehrerer Stunden
auf. Sie sind durch die Expression von Enzymen und Koenzymen für die
Steroidhormonbildung gekennzeichnet. ACTH steigert auch die Expression
von LDL-Rezeptoren. Trophische Effekte auf die zona fasciculata und reticularis machen sich über Wochen bis Monate bemerkbar. Diese
inneren Zonen der Nebennierenrinde atrophieren bei chronischem ACTH-Mangel (wie er bei Behandlung
mit unphysiologisch hohen Dosen von Glucocorticoid-Analoga auftritt -
Suppression der CRH- und ACTH-Ausschüttung infolge negativer
Rückkopplung).
Trophische Effekte auf die zona fasciculata und reticularis machen sich über Wochen bis Monate bemerkbar. Diese
inneren Zonen der Nebennierenrinde atrophieren bei chronischem ACTH-Mangel (wie er bei Behandlung
mit unphysiologisch hohen Dosen von Glucocorticoid-Analoga auftritt -
Suppression der CRH- und ACTH-Ausschüttung infolge negativer
Rückkopplung).
 Abbildung: Pulsatil-zirkadiane Sekretion von ACTH und Cortisol beim Menschen
Abbildung: Pulsatil-zirkadiane Sekretion von ACTH und Cortisol beim Menschen
 Abbildung).
Abbildung). Corticotropin / ACTH (Blutserum)
Corticotropin / ACTH (Blutserum)
 Abbildung: Regulationsachse Gehirn → Nebenniere
Abbildung: Regulationsachse Gehirn → Nebenniere
 Abbildung). Stress stimuliert auch die Freisetzung des Wachstumshormons und hemmt
die Sekretion von TRH.
Abbildung). Stress stimuliert auch die Freisetzung des Wachstumshormons und hemmt
die Sekretion von TRH.  Abbildung), indem sie über cAMP und Proteinkinasen Proteine aktivieren. Melanocortinrezeptoren kommen als 5 Subtypen
vor (MC1R bis MC5R); ACTH wirkt in der Nebenniere über MC2R (Melanocortin-2-Rezeptoren). Direkte antiinflammatorische Wirkung auf Makrophagen übt ACTH über MC3R aus.
Abbildung), indem sie über cAMP und Proteinkinasen Proteine aktivieren. Melanocortinrezeptoren kommen als 5 Subtypen
vor (MC1R bis MC5R); ACTH wirkt in der Nebenniere über MC2R (Melanocortin-2-Rezeptoren). Direkte antiinflammatorische Wirkung auf Makrophagen übt ACTH über MC3R aus. Bildung (de novo-Synthese) und Freisetzung
von Cortisol (aus der zona fasciculata der Nebennierenrinde, aber auch aus anderen Zellen, z.B. Lymphozyten), weniger stark von Sexualhormonen (zona reticularis) und Aldosteron (zona glomerulosa). Cholesterinesterase zur Bereitstellung von freiem Cholesterin, Enzyme des Pentosephosphatweges und der Steroidsynthese werden angeregt.
Bildung (de novo-Synthese) und Freisetzung
von Cortisol (aus der zona fasciculata der Nebennierenrinde, aber auch aus anderen Zellen, z.B. Lymphozyten), weniger stark von Sexualhormonen (zona reticularis) und Aldosteron (zona glomerulosa). Cholesterinesterase zur Bereitstellung von freiem Cholesterin, Enzyme des Pentosephosphatweges und der Steroidsynthese werden angeregt. Im Fettgewebe regt ACTH die Lipolyse an, was Acetyl-CoA mobilisiert, das von der Leber für die Neusynthese von Cholesterin gebraucht wird.
Im Fettgewebe regt ACTH die Lipolyse an, was Acetyl-CoA mobilisiert, das von der Leber für die Neusynthese von Cholesterin gebraucht wird. ACTH hat eine (nicht sehr bedeutsame) anregende Wirkung auf die Bildung von Aldosteron
in der Nebennierenrinde. Wesentlich stärker ist hier der anregende
Effekt von Angiotensin II, Volumen- und Salzmangel sowie
Kaliumüberschuss im Extrazellulärraum.
ACTH hat eine (nicht sehr bedeutsame) anregende Wirkung auf die Bildung von Aldosteron
in der Nebennierenrinde. Wesentlich stärker ist hier der anregende
Effekt von Angiotensin II, Volumen- und Salzmangel sowie
Kaliumüberschuss im Extrazellulärraum. Dauerstress
kann zu Sollwertverstellungen im Hypothalamus führen: CRH wird trotz hohen Cortisolspiegels im Blut freigesetzt (tertiärer Hypercortisolismus). Stress aktiviert verschiedene Transmitter, wie Serotonin; diese regen die Freisetzung von CRH
an, der ACTH-Spiegel steigt stärker an, als für eine maximale Anregung der
Nebenniere nötig wäre.
Dauerstress
kann zu Sollwertverstellungen im Hypothalamus führen: CRH wird trotz hohen Cortisolspiegels im Blut freigesetzt (tertiärer Hypercortisolismus). Stress aktiviert verschiedene Transmitter, wie Serotonin; diese regen die Freisetzung von CRH
an, der ACTH-Spiegel steigt stärker an, als für eine maximale Anregung der
Nebenniere nötig wäre.  Langzeitbehandlung mit Corticosteroiden führt infolge der dauerhaften Unterdrückung der
ACTH-Freisetzung (negative Rückkopplung in Hypothalamus und Hypophyse)
zu Atrophie der Nebennierenrinde.
Langzeitbehandlung mit Corticosteroiden führt infolge der dauerhaften Unterdrückung der
ACTH-Freisetzung (negative Rückkopplung in Hypothalamus und Hypophyse)
zu Atrophie der Nebennierenrinde. LH
LH
 Abbildung: Hypothalamisch-hypophysär-gonadale Achse
Abbildung: Hypothalamisch-hypophysär-gonadale Achse GABA, γ-AminoButtersäure
GABA, γ-AminoButtersäure  EOP, endogene opioide Peptide
EOP, endogene opioide Peptide  NA, Noradrenalin
NA, Noradrenalin  NKB, Neurokinin-B
NKB, Neurokinin-B  Dyn, Dynorphin
Dyn, Dynorphin  RFRP, RF-related peptides (RF steht für Arg-Phe)
RFRP, RF-related peptides (RF steht für Arg-Phe)
 Abbildung).
Abbildung).  GnRH-Peaks alle 60-90 Minuten (hohe Frequenz) codieren die Freisetzung von
LH, GnRH-Peaks alle 2-3 Stunden (niedrige Frequenz) die von FSH.
GnRH-Peaks alle 60-90 Minuten (hohe Frequenz) codieren die Freisetzung von
LH, GnRH-Peaks alle 2-3 Stunden (niedrige Frequenz) die von FSH. Progesteron hemmt auch beim Mann die Gonadotropinfunktion (mögliches Antikonzeptivum).
Progesteron hemmt auch beim Mann die Gonadotropinfunktion (mögliches Antikonzeptivum). LH (Lutropin) - Serum
LH (Lutropin) - Serum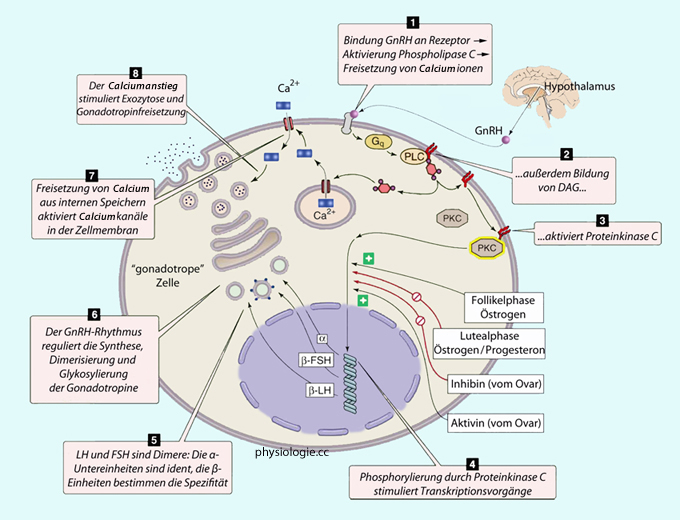
 Abbildung: Gonadotropinsekretion einer Vorderlappenzelle
Abbildung: Gonadotropinsekretion einer Vorderlappenzelle
 Gonadotrope Wirkung hat auch das aus der Plazenta stammende Choriongonadotropin (hCG; h für human).
Dieses Hormon sichert die Frühschwangerschaft (verhindert die Ablösung
der Uterusschleimhaut, indem es den Gelbkörper zu weiterer
Hormonproduktion anregt), solange die eigene Steroidproduktion der
Plazenta noch nicht intensiv genug ist, um eine Abbruchblutung zu
verhindern.
Gonadotrope Wirkung hat auch das aus der Plazenta stammende Choriongonadotropin (hCG; h für human).
Dieses Hormon sichert die Frühschwangerschaft (verhindert die Ablösung
der Uterusschleimhaut, indem es den Gelbkörper zu weiterer
Hormonproduktion anregt), solange die eigene Steroidproduktion der
Plazenta noch nicht intensiv genug ist, um eine Abbruchblutung zu
verhindern. Die Proteine Activin und Follistatin aus den sternförmigen folliculostellate cells regulieren die Aktivität von FSH-Zellen.
Die Proteine Activin und Follistatin aus den sternförmigen folliculostellate cells regulieren die Aktivität von FSH-Zellen. Gonadotropinrezeptoren-
für LH / hCG und für FSH - sind metabotrop
(G-Protein-gekoppelt,
Gonadotropinrezeptoren-
für LH / hCG und für FSH - sind metabotrop
(G-Protein-gekoppelt,  Abbildung) und fördern über Adenylylcyclase
die Bildung von cAMP, bei höheren Konzentrationen auch PKC und den Ca++-Signalweg.
Abbildung) und fördern über Adenylylcyclase
die Bildung von cAMP, bei höheren Konzentrationen auch PKC und den Ca++-Signalweg. Endokrine Zellen der Adenohypophyse  Nach White / Harrison / Mehlmann, Endocrine and reproductive physiology, 5th ed. 2019 (Elsevier) |
|||||
| |
Corticotrop |
Thyreotrop |
Gonadotrop |
Somatotrop |
Laktotrop |
| primäre hypo- thalamische Regulation durch |
CRH |
TRH |
GnRH |
GHRH (+) / Somatostatin (-) |
Dopamin (-) / PRF (+) |
| sezerniertes tropes Hormon |
ACTH |
TSH |
FSH, LH |
GH |
Prolactin |
| Rezeptor |
MC2R |
TSH-R |
FSH- und LH-R |
GH-R |
PRL-R |
| endokrine Zieldrüse |
Neben- niere |
Schild- drüse |
Theka- und Granulosa- zellen, Leydig- und Sertolizellen |
Leber metabolische Effekte |
- |
| Negativ rückkoppelndes peripheres Hormon |
Cortisol |
T3 |
Östrogene (auch positives feedback) Progesteron Testosteron Inhibin |
IGF-1 |
- |
 Abbildung): Corticotropin, Lipotropine, Melanotropine (MSH) und Endorphine. Im ersten
Schritt entstehen ACTH und Lipotropin, im zweiten (gegebenenfalls)
weitere Spaltprodukte (posttranslationale Modifikationen).
Abbildung): Corticotropin, Lipotropine, Melanotropine (MSH) und Endorphine. Im ersten
Schritt entstehen ACTH und Lipotropin, im zweiten (gegebenenfalls)
weitere Spaltprodukte (posttranslationale Modifikationen).
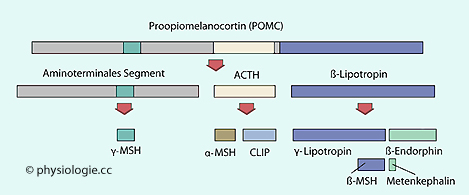
 Abbildung: Spaltung des Vorläufermoleküls POMC im Melanocortinsystem
Abbildung: Spaltung des Vorläufermoleküls POMC im Melanocortinsystem
 α-MSH (im Gehirn gebildet, hemmt es die Nahrungsaufnahme; in der Haut
gebildet, regt es Melanozyten zur Produktion und Freisetzung von
Melanin an),
α-MSH (im Gehirn gebildet, hemmt es die Nahrungsaufnahme; in der Haut
gebildet, regt es Melanozyten zur Produktion und Freisetzung von
Melanin an), ß-MSH, γ-MSH.
ß-MSH, γ-MSH.  Die MSH-Hormone (Melanotropine) und ACTH werden gemeinsam als Melanocortine bezeichnet (weil ihre ursprünglich bekannte Funktion die Bildung von Melanin war) und wirken über G-Protein-gekoppelte Rezeptoren (Melanocortinrezeptoren), von denen man fünf Subtypen kennt: MC1R bis MC5R.
Die MSH-Hormone (Melanotropine) und ACTH werden gemeinsam als Melanocortine bezeichnet (weil ihre ursprünglich bekannte Funktion die Bildung von Melanin war) und wirken über G-Protein-gekoppelte Rezeptoren (Melanocortinrezeptoren), von denen man fünf Subtypen kennt: MC1R bis MC5R. MC1R findet sich in Melanozyten; es ist der "Pigmentierungsrezeptor".
Die jeweilige Kombination aus einem Pool von über 30 verschiedene
Allelen des Rezeptorgens beeinflussen den Hauttyp (Hautbräunung,
Sonnenbrandneigung bei UV-Bestrahlung).
MC1R findet sich in Melanozyten; es ist der "Pigmentierungsrezeptor".
Die jeweilige Kombination aus einem Pool von über 30 verschiedene
Allelen des Rezeptorgens beeinflussen den Hauttyp (Hautbräunung,
Sonnenbrandneigung bei UV-Bestrahlung).  MC2R wird in der Nebenniere exprimiert, er ist der klassische ACTH-Rezeptor
MC2R wird in der Nebenniere exprimiert, er ist der klassische ACTH-Rezeptor MC3R findet sich weder in Melanozyten noch in der Nebenniere; er wird von Zellen im Hypothalamus (nahe dem organum vasculosum) exprimiert, auch in der Plazenta und im Darm. Aktiviert wird der MC3R durch ACTH, α-MSH, ß-MSH und γ-MSH
MC3R findet sich weder in Melanozyten noch in der Nebenniere; er wird von Zellen im Hypothalamus (nahe dem organum vasculosum) exprimiert, auch in der Plazenta und im Darm. Aktiviert wird der MC3R durch ACTH, α-MSH, ß-MSH und γ-MSH MC4R wird ebenfalls im Gehirn und im Darm (nicht von Plazenta,
Melanozyten oder Nebenniere) exprimiert; auch er spricht auf ACTH, α-MSH, ß-MSH und γ-MSH an. Er erhöht (wie MC3R) die normale Körpertemperatur, blockiert aber die Fieberreaktion; er supprimiert das Hungerempfinden und hat vermutlich noch weitere Wirkungen.
MC4R wird ebenfalls im Gehirn und im Darm (nicht von Plazenta,
Melanozyten oder Nebenniere) exprimiert; auch er spricht auf ACTH, α-MSH, ß-MSH und γ-MSH an. Er erhöht (wie MC3R) die normale Körpertemperatur, blockiert aber die Fieberreaktion; er supprimiert das Hungerempfinden und hat vermutlich noch weitere Wirkungen. steuert Melanozyten (Pigmentsynthese, Melanogenese) in Haut und Haaren,
steuert Melanozyten (Pigmentsynthese, Melanogenese) in Haut und Haaren, wirkt - über MC1R und MC3R - auf das Immunsystem (es hemmt die Freisetzung von IL-1 und TNFα und Neutrophileninfiltration des Gewebes und wirkt entzündungshemmend).
wirkt - über MC1R und MC3R - auf das Immunsystem (es hemmt die Freisetzung von IL-1 und TNFα und Neutrophileninfiltration des Gewebes und wirkt entzündungshemmend).  Über Enkephaline s. dort, über ACTH s. oben
Über Enkephaline s. dort, über ACTH s. oben

 Trope Hormone der Adenohypophyse steuern Wachstum und Stoffwechsel
(GH), Nebennierenrinde (ACTH), Schilddrüse (TSH), Geschlechtsdrüsen
(FSH / LH). Periphere Hormone wirken auf Hypothalamus und Hypophyse
(Rückkopplung). Das ist möglich, weil die Blut-Hirn-Schranke an
zirkumventrikulären Organen (z.B. eminentia mediana) nicht wirksam ist
Trope Hormone der Adenohypophyse steuern Wachstum und Stoffwechsel
(GH), Nebennierenrinde (ACTH), Schilddrüse (TSH), Geschlechtsdrüsen
(FSH / LH). Periphere Hormone wirken auf Hypothalamus und Hypophyse
(Rückkopplung). Das ist möglich, weil die Blut-Hirn-Schranke an
zirkumventrikulären Organen (z.B. eminentia mediana) nicht wirksam ist  Somatotropin (GH) wird aus azidophilen Zellen pulsatil freigesetzt (3-4
pro Tag; höchste Werte vor dem Aufwachen) und ist im Blut bis zu 50% an
Transportprotein gebunden. Stress, Hypoglykämie, Tiefschlaf, Ghrelin
sowie zahlreiche Transmitter stimulieren seine Sekretion. Gehemmt
wird die GH-Freisetzung durch GH, IGF und Somatostatin, Hyperglykämie
sowie mehrere Hormone und Transmitter. GH wirkt über
tyrosinkinase-assoziierte Rezeptoren (JAK-STAT- Mechanismus) anabol
(Proteinsynthese), längerfristig blutzuckersteigernd und lipolytisch,
und regt die Bildung von IGF-1 in der Leber an. Es fördert das Wachstum
von Muskulatur, Knochen, Knorpel und viszeralen Organen, und regt das
Immunsystem an. GH-Überschuss führt zu Riesenwuchs, nach Schluss der
Epiphysenfugen zu Akromegalie Somatotropin (GH) wird aus azidophilen Zellen pulsatil freigesetzt (3-4
pro Tag; höchste Werte vor dem Aufwachen) und ist im Blut bis zu 50% an
Transportprotein gebunden. Stress, Hypoglykämie, Tiefschlaf, Ghrelin
sowie zahlreiche Transmitter stimulieren seine Sekretion. Gehemmt
wird die GH-Freisetzung durch GH, IGF und Somatostatin, Hyperglykämie
sowie mehrere Hormone und Transmitter. GH wirkt über
tyrosinkinase-assoziierte Rezeptoren (JAK-STAT- Mechanismus) anabol
(Proteinsynthese), längerfristig blutzuckersteigernd und lipolytisch,
und regt die Bildung von IGF-1 in der Leber an. Es fördert das Wachstum
von Muskulatur, Knochen, Knorpel und viszeralen Organen, und regt das
Immunsystem an. GH-Überschuss führt zu Riesenwuchs, nach Schluss der
Epiphysenfugen zu Akromegalie IGFs sind an IGF-Bindungsprotein (IGFBP)
gebunden, ihre biologische Halbwertszeit beträgt bis zu 12 Stunden. Ihr
Blutspiegel steigt nach Einnahme proteinreicher Kost. IGF1 ist im Blut
bis zu 98% an Bindungsproteine gebunden; es steigert
Nukleinsäure- und Proteinsynthese und die Mitoserate in
Knochenwachstumszonen. IGF-2 regt das intrauterine Wachstum des Feten
an und hat gonadotropine Wirkung im Zyklus. Beide wirken über den
IGF-1-Rezeptor (der IGF-2-Rezeptor ist ein Clearance-Rezeptor). IGFs
hemmen die Freisetzung von GH
IGFs sind an IGF-Bindungsprotein (IGFBP)
gebunden, ihre biologische Halbwertszeit beträgt bis zu 12 Stunden. Ihr
Blutspiegel steigt nach Einnahme proteinreicher Kost. IGF1 ist im Blut
bis zu 98% an Bindungsproteine gebunden; es steigert
Nukleinsäure- und Proteinsynthese und die Mitoserate in
Knochenwachstumszonen. IGF-2 regt das intrauterine Wachstum des Feten
an und hat gonadotropine Wirkung im Zyklus. Beide wirken über den
IGF-1-Rezeptor (der IGF-2-Rezeptor ist ein Clearance-Rezeptor). IGFs
hemmen die Freisetzung von GH Prolactin wird aus azidophilen Zellen pulsatil (alle ~90 Minuten)
freigesetzt, am stärksten vor dem Aufwachen. Saugreiz an der Brust,
Östrogene, Ghrelin, Angiotensin II, Substanz P, Glucagon, GIP, VIP und
Hypoglykämie fördern, Stress hemmt seine Sekretion. Prolactin regt
Wachstum und Differenzierung der
Brustdrüse an, stimuliert die Freisetzung von Vasopressin und Oxytozin
und wirkt beruhigend. Der Prolactinrezeptor dimerisiert bei Bindung des
Hormons und funktioniert über den JAK/STAT-Mechanismus. Dopamin ist der
bedeutendste Inhibitor der Prolactinausschüttung, bei
hypothalamisch- hypophysärer Unterbrechung nimmt die Prolactinsekretion
zu (Galaktorrhoe). Der Prolactinspiegel steigt bei Schwangeren stark an
und bleibt während der Stillperiode erhöht - die
Gonadotropinfreisetzung ist reduziert (Laktationsamenorrhoe) Prolactin wird aus azidophilen Zellen pulsatil (alle ~90 Minuten)
freigesetzt, am stärksten vor dem Aufwachen. Saugreiz an der Brust,
Östrogene, Ghrelin, Angiotensin II, Substanz P, Glucagon, GIP, VIP und
Hypoglykämie fördern, Stress hemmt seine Sekretion. Prolactin regt
Wachstum und Differenzierung der
Brustdrüse an, stimuliert die Freisetzung von Vasopressin und Oxytozin
und wirkt beruhigend. Der Prolactinrezeptor dimerisiert bei Bindung des
Hormons und funktioniert über den JAK/STAT-Mechanismus. Dopamin ist der
bedeutendste Inhibitor der Prolactinausschüttung, bei
hypothalamisch- hypophysärer Unterbrechung nimmt die Prolactinsekretion
zu (Galaktorrhoe). Der Prolactinspiegel steigt bei Schwangeren stark an
und bleibt während der Stillperiode erhöht - die
Gonadotropinfreisetzung ist reduziert (Laktationsamenorrhoe) Die Sekretion von Thyreotropin (TSH) aus basophilen Zellen ist am
frühen Morgen am höchsten; sie wird angeregt durch TRH, gehemmt durch
Somatostatin und Schilddrüsenhormone. TSH besteht aus zwei
Untereinheiten, dem α-Glykoprotein (gemeinsam mit FSH und LH) und
der hormonspezifischen β-Untereinheit, welche negative Rückkopplung
bewirkt. TSH steigert in der Schilddrüse Jodid- und Glucoseaufnahme, Kolloid-Endozytose
und T3/T4-Sekretion sowie die Synthese zahlreicher
Proteine (Na/J-Transporter, Thyreoglobulin, Peroxidase), in höherer
Konzentration Vaskularisierung und Wachstum. Der TSH-Rezeptor ist
metabotrop (cAMP, Phospholipase C, IP3, Proteinkinasen, Transkription
von Zielgenen) Die Sekretion von Thyreotropin (TSH) aus basophilen Zellen ist am
frühen Morgen am höchsten; sie wird angeregt durch TRH, gehemmt durch
Somatostatin und Schilddrüsenhormone. TSH besteht aus zwei
Untereinheiten, dem α-Glykoprotein (gemeinsam mit FSH und LH) und
der hormonspezifischen β-Untereinheit, welche negative Rückkopplung
bewirkt. TSH steigert in der Schilddrüse Jodid- und Glucoseaufnahme, Kolloid-Endozytose
und T3/T4-Sekretion sowie die Synthese zahlreicher
Proteine (Na/J-Transporter, Thyreoglobulin, Peroxidase), in höherer
Konzentration Vaskularisierung und Wachstum. Der TSH-Rezeptor ist
metabotrop (cAMP, Phospholipase C, IP3, Proteinkinasen, Transkription
von Zielgenen) ACTH wird von basophilen Zellen aus Proopiomelanocortin (POMC) gebildet
und pulsatil, mit zirkadianer Rhythmik (höchste Werte frühmorgens)
sezerniert. Starker Stresseinfluss führt zu prompter Steigerung des
ACTH-Spiegels. ACTH bewirkt über metabotrope Melanocortinrezeptoren (5
Subtypen: MC1R bis MC5R) unmittelbar pregnenolonsteigernd, verzögert
auf die Steroidhormonsynthese, über längere Zeiträume trophisch auf die
Nebennierenrinde (die bei chronischem ACTH-Mangel atrophiert). Im
Fettgewebe regt ACTH die Lipolyse an ACTH wird von basophilen Zellen aus Proopiomelanocortin (POMC) gebildet
und pulsatil, mit zirkadianer Rhythmik (höchste Werte frühmorgens)
sezerniert. Starker Stresseinfluss führt zu prompter Steigerung des
ACTH-Spiegels. ACTH bewirkt über metabotrope Melanocortinrezeptoren (5
Subtypen: MC1R bis MC5R) unmittelbar pregnenolonsteigernd, verzögert
auf die Steroidhormonsynthese, über längere Zeiträume trophisch auf die
Nebennierenrinde (die bei chronischem ACTH-Mangel atrophiert). Im
Fettgewebe regt ACTH die Lipolyse an  Die Gonadotropine FSH und LH bestehen aus zwei Untereinheiten
(α-Glykoprotein, spezifische β-Untereinheit β-FSH, β-LH) und werden von
basophilen Zellen unter Anregung durch GnRH gebildet, gespeichert und
freigesetzt - am stärksten morgens. Testosteron, Östradiol und
Progesteron hemmen die Freisetzung (negative Rückkopplung).
Gonadotropinrezeptoren haben eine besonders große extrazelluläre Domäne
und sind metabotrop (cAMP, Ca++-Signalweg). LH regt beim
Mann die Testosteronbildung der Leydig'schen Zwischenzellen, bei der
Frau Östrogensynthese, Ovulation und Progesteronbildung an; FSH beim
Mann Spermatogenese und Wachstum der Hodenkanälchen, bei der Frau
Follikelwachstum und Eisprung, bei beiden Geschlechtern die Bildung von
Inhibin (dieses hemmt die FSH-Freisetzung). Gonadotrope Wirkung hat
auch das aus der Plazenta stammende hCG Die Gonadotropine FSH und LH bestehen aus zwei Untereinheiten
(α-Glykoprotein, spezifische β-Untereinheit β-FSH, β-LH) und werden von
basophilen Zellen unter Anregung durch GnRH gebildet, gespeichert und
freigesetzt - am stärksten morgens. Testosteron, Östradiol und
Progesteron hemmen die Freisetzung (negative Rückkopplung).
Gonadotropinrezeptoren haben eine besonders große extrazelluläre Domäne
und sind metabotrop (cAMP, Ca++-Signalweg). LH regt beim
Mann die Testosteronbildung der Leydig'schen Zwischenzellen, bei der
Frau Östrogensynthese, Ovulation und Progesteronbildung an; FSH beim
Mann Spermatogenese und Wachstum der Hodenkanälchen, bei der Frau
Follikelwachstum und Eisprung, bei beiden Geschlechtern die Bildung von
Inhibin (dieses hemmt die FSH-Freisetzung). Gonadotrope Wirkung hat
auch das aus der Plazenta stammende hCG Aus POMC (Pro-Opio-Melano-Cortin) bilden Zellen des Vorder- und
Zwischenlappens außer ACTH auch Lipotropine, Melanotropine und
Endorphine - abhängig von der jeweiligen Enzymausstattung (Vorderlappen
ACTH, ß-Endorphin und γ-Lipotropin; Zwischenlappen α-MSH). Das
Neuropeptid ß-Endorphin beteiligt sich an Lernen, Gedächtnis,
Blutdruck- und Thermoregulation, Schmerzdämpfung. α-MSH steuert die
Pigmentsynthese der Melanozyten und ist in die Steuerung von
Immunfunktionen und Nahrungsaufnahme involviert Aus POMC (Pro-Opio-Melano-Cortin) bilden Zellen des Vorder- und
Zwischenlappens außer ACTH auch Lipotropine, Melanotropine und
Endorphine - abhängig von der jeweiligen Enzymausstattung (Vorderlappen
ACTH, ß-Endorphin und γ-Lipotropin; Zwischenlappen α-MSH). Das
Neuropeptid ß-Endorphin beteiligt sich an Lernen, Gedächtnis,
Blutdruck- und Thermoregulation, Schmerzdämpfung. α-MSH steuert die
Pigmentsynthese der Melanozyten und ist in die Steuerung von
Immunfunktionen und Nahrungsaufnahme involviert |
