



 Adrenalin: ad = bei, ren = Niere
Adrenalin: ad = bei, ren = Niere| Das Nervensystem ist - neben
Erythrozyten und Nierenmark - auf Glucose als
Energiequelle angewiesen. Eine ausreichende Glucosekonzentration im
Blut (≥3,7 mM/l) ist für seine Versorgung wesentlich. Daher bewirkt
ein Absinken des Blutzuckerspiegels zahlreiche neurologische Symptome,
wie Heißhunger, Orientierungsstörungen, Erweiterung der Pupillen, Doppelbilder, Muskelzittern, Anstieg von Blutdruck und Herzfrequenz, schließlich Bewusstlosigkeit. Mehrere Hormone sichern den Blutzuckerspiegel ab: Mit zunehmender Hypoglykämie zeigt sich ein Anstieg zunächst von Glucagon und Adrenalin, dann zusätzlich Wachstumshormon, schließlich auch Cortisol. Das hebt den Glucosespiegel wieder an (daher die Bezeichnung "kontra-insulinäre" Hormone). Das Verhältnis Glucagon- zu Insulinspiegel im Blut (Glucagon-Insulin-Quotient) spiegelt die aktuelle Stoffwechselsituation wider. Nach einer Mahlzeit (postprandial) überwiegt das Insulin, im Nüchternzustand hingegen (postresorptiv) das Glucagon. Aus Proglucagon entstehen in Pankreas, Darm und Gehirn Glucagon und glucagonähnliche Peptide (GLP1, GLP2) - mit breitem Aktionsradius: So fördert GLP1 Insulinempfindlichkeit und Glucoseaufnahme im Muskel, Knochenbildung und Herzfunktion, und schützt das Nervengewebe. Glucagon aktiviert Schlüsselenzyme für die Zuckerbereitstellung und inaktiviert ihre Gegenspieler; es regt die Gluconeogenese aus Glyzerin (Fettabbau), ß-Oxidation, Ketogenese in der Leber und die Lipolyse im Fettgewebe an. Adrenalin und Cortisol mobilisieren Glykogen- und Proteinspeicher sowie die Lipolyse, regen die Utilisation von Muskeleiweiß sowie die Gluconeogenese in der Leber an. Das gemeinsame Ergebnis der Wirkung kontrainsulinärer Hormone ist die bessere Verfügbarkeit an Substratmolekülen und eine Stabilisierung des Blutzuckerspiegels. |
 Insulin-Glucagon-Quotient
Insulin-Glucagon-Quotient  Blutzuckerspiegel
Blutzuckerspiegel  "Kontrainsulinäre" Hormone
"Kontrainsulinäre" Hormone  Glucagon
Glucagon
 Glucagonähnliche Peptide (GLP)
Glucagonähnliche Peptide (GLP)  Adrenalin, Cortisol
Adrenalin, Cortisol  Synergismus
Synergismus Hypo- / Hyperglykämie
Hypo- / Hyperglykämie
 Core messages
Core messages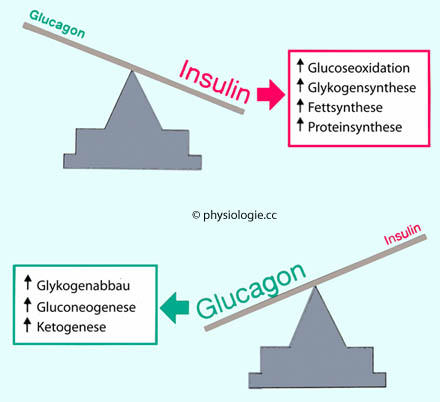
 Abbildung: Funktionsgleichgewicht Insulin / Glucagon
Abbildung: Funktionsgleichgewicht Insulin / Glucagon
 Hormonelle Wirkungen auf den Blutzuckerspiegel  Nach Ritter / Flower / Henderson / Loke / MacEwan / Rang, Rang & Dale's Pharmacology, 9th ed. Elsevier 2020 |
|||
| Hormon |
Wichtigste Wirkungen |
Wichtigste Reize zur Sekretion |
Wichtigster Effekt |
| blutzuckersenkend |
|||
| Insulin |
↑Glucoseaufnahme ↑Glykogensynthese ↓Glykogenolyse ↓Gluconeogenese |
Rascher Anstieg Blutzuckerspiegel Inkretine (GIP, GLP-1) |
↓[Glucose] |
| blutzuckersteigernd |
|||
| Glucagon |
↑Glykogenolyse ↑Gluconeogenese |
Hypoglycämie ([Glucose] <3 mM) Muskelarbeit Stress etc |
↑[Glucose] |
| Adrenalin |
↑Glykogenolyse |
||
| Glucocorticoide |
↓Glucoseaufnahme ↑Gluconeogenese ↓Glucoseaufnahme und -verbrauch |
||
| Somatotropin (hGH) |
↓Glucoseaufnahme | ||
 Abbildung)
machen 1-2% der Masse der Bauchspeicheldrüse aus und stellen dessen
endokrin aktiven Teil dar. Sie sind stark vaskularisiert (die spezifische Durchblutung
ist 5-mal höher als die des Herzmuskels!), sind autonom innerviert
(sympathisch und parasympathisch) und enthalten mehrere Zelltypen, die
humoral (Blutstrom zwischen den Zellen vom Zentrum zur Peripherie jeder
Insel) und direkt (gap junctions) kommunizieren:
Abbildung)
machen 1-2% der Masse der Bauchspeicheldrüse aus und stellen dessen
endokrin aktiven Teil dar. Sie sind stark vaskularisiert (die spezifische Durchblutung
ist 5-mal höher als die des Herzmuskels!), sind autonom innerviert
(sympathisch und parasympathisch) und enthalten mehrere Zelltypen, die
humoral (Blutstrom zwischen den Zellen vom Zentrum zur Peripherie jeder
Insel) und direkt (gap junctions) kommunizieren: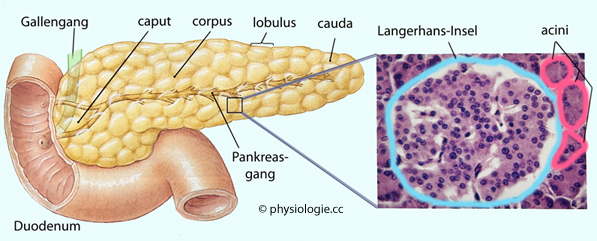
 Abbildung: Endokrines Pankreas
Abbildung: Endokrines Pankreas
 α-Zellen (20-30%), sie produzieren Glucagon, das im postabsorptiven Zustand blutzuckersteigernd wirkt - seine Sekretion steigt bei Hypoglykämie bis 4-fach - und Proglucagon; weiters glucagonähnliche Peptide (GLP-1, das insulinsteigernd und glucagonsenkend wirkt, und GLP-2)
α-Zellen (20-30%), sie produzieren Glucagon, das im postabsorptiven Zustand blutzuckersteigernd wirkt - seine Sekretion steigt bei Hypoglykämie bis 4-fach - und Proglucagon; weiters glucagonähnliche Peptide (GLP-1, das insulinsteigernd und glucagonsenkend wirkt, und GLP-2) β-Zellen (50-75%), sie produzieren Insulin, das den Blutzuckerspiegel senkt, indem es Einbau und Verwertung von Substraten fördert. Sie bilden darüber hinaus Amylin (das die Verdauungsvorgänge bremst und so den Glucoseanstieg nach Nahrunsaufnahme verringert) und GABA (dieses diffundiert zu α-Zellen und reduziert dort die Freisetzung von Glucagon)
β-Zellen (50-75%), sie produzieren Insulin, das den Blutzuckerspiegel senkt, indem es Einbau und Verwertung von Substraten fördert. Sie bilden darüber hinaus Amylin (das die Verdauungsvorgänge bremst und so den Glucoseanstieg nach Nahrunsaufnahme verringert) und GABA (dieses diffundiert zu α-Zellen und reduziert dort die Freisetzung von Glucagon) δ-Zellen (~10%), sie produzieren Somatostatin, das an Magen und Pankreas sekretionsmindernd wirkt (die Freisetzung von Insulin und Glucagon hemmt) und therapeutisch
zur Behandlung von Blutungen, Geschwüren und Entzündungen eingesetzt
wird
δ-Zellen (~10%), sie produzieren Somatostatin, das an Magen und Pankreas sekretionsmindernd wirkt (die Freisetzung von Insulin und Glucagon hemmt) und therapeutisch
zur Behandlung von Blutungen, Geschwüren und Entzündungen eingesetzt
wird  PP- (γ-, F-) Zellen (<5%), sie produzieren pankreatisches Polypeptid, das die Aktivität der Bauchspeicheldrüse dämpft, sekretionshemmend (Galle) und motilitätssenkend (Darm) sowie appetitbremsend wirkt
PP- (γ-, F-) Zellen (<5%), sie produzieren pankreatisches Polypeptid, das die Aktivität der Bauchspeicheldrüse dämpft, sekretionshemmend (Galle) und motilitätssenkend (Darm) sowie appetitbremsend wirkt ε-Zellen (<1%), sie produzieren Ghrelin, das die Somatostatinfreisetzung fördert (δ-Zellen haben Ghrelinrezeptoren) und indirekt die glucoseinduzierte Insulinsekretion hemmt.
ε-Zellen (<1%), sie produzieren Ghrelin, das die Somatostatinfreisetzung fördert (δ-Zellen haben Ghrelinrezeptoren) und indirekt die glucoseinduzierte Insulinsekretion hemmt.
 Abbildung: Glucoseabhängige Balance der Insulin- bzw. Glucagonfreisetzung aus dem Pankreas
Abbildung: Glucoseabhängige Balance der Insulin- bzw. Glucagonfreisetzung aus dem Pankreas

 Das
Konzentrationsverhältnis Insulin / Glucagon kennzeichnet den Status des Energiestoffwechsels:
Das
Konzentrationsverhältnis Insulin / Glucagon kennzeichnet den Status des Energiestoffwechsels: Es ist hoch nach Nahrungsaufnahme
(Resorptionsphase; viel Insulin), die im Überschuss vorhandene Glucose
wird
gespeichert
Es ist hoch nach Nahrungsaufnahme
(Resorptionsphase; viel Insulin), die im Überschuss vorhandene Glucose
wird
gespeichert In der Postresorptionsphase ist es niedrig (wenig Insulin),
die körpereigenen Energiespeicher werden angezapft.
In der Postresorptionsphase ist es niedrig (wenig Insulin),
die körpereigenen Energiespeicher werden angezapft.  Insulin-Glucagon-Quotient (molar, Serum)
Insulin-Glucagon-Quotient (molar, Serum) Beispiel: Insulin (gemittelt - pulsatile Freisetzung!) 70 pM, Glucagon 180 pM → Quotient 0,39
Beispiel: Insulin (gemittelt - pulsatile Freisetzung!) 70 pM, Glucagon 180 pM → Quotient 0,39 s. dort).
s. dort).
 Als Hyperglykämie werden - gemessen im Nüchternzustand (≥12 h) in Kapillarblut oder venösem Plasma - Blutzuckerwerte (Glucosespiegel) von mehr als 100 mg/dl (über 5,5 mM) eingestuft, als Hypoglykämie solche unter 60 mg/dl (3,3 mM).
Als Hyperglykämie werden - gemessen im Nüchternzustand (≥12 h) in Kapillarblut oder venösem Plasma - Blutzuckerwerte (Glucosespiegel) von mehr als 100 mg/dl (über 5,5 mM) eingestuft, als Hypoglykämie solche unter 60 mg/dl (3,3 mM).  steigen
die Glucosewerte im Blut an - je nach
aufgenommener Mahlzeit physiologischerweise um bis >50%, nach einer
kohlenhydratreichen Mahlzeit bis fast +100% (auf bis zu ~160 mg/dl oder
~9 mM). Die (hauptsächlich insulinbedingte) Rückkehr zu Nüchternwerten
dauert dann mehrere Stunden.
steigen
die Glucosewerte im Blut an - je nach
aufgenommener Mahlzeit physiologischerweise um bis >50%, nach einer
kohlenhydratreichen Mahlzeit bis fast +100% (auf bis zu ~160 mg/dl oder
~9 mM). Die (hauptsächlich insulinbedingte) Rückkehr zu Nüchternwerten
dauert dann mehrere Stunden. Die Glucoseaufnahme des Gehirns ist ab einem Blutzuckerspiegel von 3,7 mM reduziert.
Symptome wie Unruhe, Zittern, Heißhunger, Schweißausbruch finden sich ab 3,0
mM, Bewusstlosigkeit kann ab 2,7 mM auftreten.
Die Glucoseaufnahme des Gehirns ist ab einem Blutzuckerspiegel von 3,7 mM reduziert.
Symptome wie Unruhe, Zittern, Heißhunger, Schweißausbruch finden sich ab 3,0
mM, Bewusstlosigkeit kann ab 2,7 mM auftreten.  Glucose
liefert den Zellen Energie, Nervengewebe ist weitgehend
glucoseabhängig. Wird mehr Glucose resorbiert als der
Stoffwechsel benötigt, wird sie in der Leber gespeichert und zu Fett umgebaut. Andernfalls wird sie durch Abbau von Glykogen (Glykogenolyse) und
Aufbau von Zucker (Gluconeogenese
Glucose
liefert den Zellen Energie, Nervengewebe ist weitgehend
glucoseabhängig. Wird mehr Glucose resorbiert als der
Stoffwechsel benötigt, wird sie in der Leber gespeichert und zu Fett umgebaut. Andernfalls wird sie durch Abbau von Glykogen (Glykogenolyse) und
Aufbau von Zucker (Gluconeogenese  ) nachgeliefert.
) nachgeliefert.  Glucose ist ein reaktionsfreudiges Molekül - sie kann Biomoleküle chemisch verändern (z.B. Advanced glycation end-products - AGEs).
Dies erfordert entsprechende Regenerierungsvorgänge und beschleunigt
sich mit zunehmendem Glucosespiegel. Daraus können funktionelle
Beeinträchtigungen resultieren,
wie sie auch bei unzureichend behandeltem Diabetes mellitus als
Spätfolgen auftreten (Durchblutungsstörungen, mangelhafte
Blutdruckregulation, Nervenschädigungen etc.).
Glucose ist ein reaktionsfreudiges Molekül - sie kann Biomoleküle chemisch verändern (z.B. Advanced glycation end-products - AGEs).
Dies erfordert entsprechende Regenerierungsvorgänge und beschleunigt
sich mit zunehmendem Glucosespiegel. Daraus können funktionelle
Beeinträchtigungen resultieren,
wie sie auch bei unzureichend behandeltem Diabetes mellitus als
Spätfolgen auftreten (Durchblutungsstörungen, mangelhafte
Blutdruckregulation, Nervenschädigungen etc.).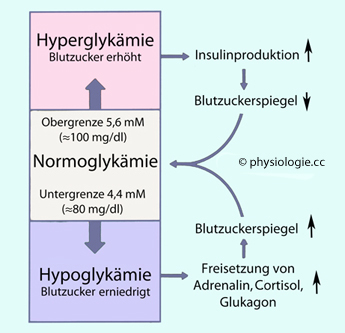
 Abbildung: Blutzuckerregulation
Abbildung: Blutzuckerregulation
| Körperliche Aktivität (z.B. Ausdauertraining) senkt den Ruhe-Blutzuckerspiegel |
 Blutglucose unter ~4,6 mM reduziert die Insulinsekretion
Blutglucose unter ~4,6 mM reduziert die Insulinsekretion  Blutglucose unter ~3,8 mM setzt Glucagon und Adrenalin frei
Blutglucose unter ~3,8 mM setzt Glucagon und Adrenalin frei Blutglucose unter ~3,7 mM regt die Sekretion von Wachstumshormon
an (GH wirkt zeitlich unterschiedlich: Es dauert etwa eine Stunde, bis
seine insulin-antagonistische Wirkung den Blutzuckerspiegel steigert.
Zunächst fällt dieser durch Somatomedinwirkung ab)
Blutglucose unter ~3,7 mM regt die Sekretion von Wachstumshormon
an (GH wirkt zeitlich unterschiedlich: Es dauert etwa eine Stunde, bis
seine insulin-antagonistische Wirkung den Blutzuckerspiegel steigert.
Zunächst fällt dieser durch Somatomedinwirkung ab) Blutglucose unter ~3,2 mM stimuliert die Freisetzung von Cortisol (deutliche Hypoglykämie-Symptome treten ab ~3,0 mM auf)
Blutglucose unter ~3,2 mM stimuliert die Freisetzung von Cortisol (deutliche Hypoglykämie-Symptome treten ab ~3,0 mM auf)
 Hypoglycämie und Adrenalin regen im Pankreas die Sekretion von Glucagon an
Hypoglycämie und Adrenalin regen im Pankreas die Sekretion von Glucagon an Glucagon fördert die Spaltung (und hemmt den Aufbau) von Glykogen in der Leber
Glucagon fördert die Spaltung (und hemmt den Aufbau) von Glykogen in der Leber Ist der hepatische Glykogenvorrat erschöpft, regt Cortisol die Gluconeogenese an
Ist der hepatische Glykogenvorrat erschöpft, regt Cortisol die Gluconeogenese anGlucagon: Eigenschaften Nach Silverthorn, Human Physiology - an integrated approach, 4th ed. Pearson International 2007 |
|
| Synthetisiert von |
Pankreas (Alpha-Inselzellen) |
| Transport im Kreislauf |
In Plasma gelöst (Peptid aus 29 Aminosäuren) |
| Biologische Halbwertszeit im Kreislauf |
4-6 Minuten |
| Sekretion angeregt durch |
Glucosespiegel unter 200 mg/dl maximal bei <50 mg/dl Anstieg [Aminosäuren] |
| Zielgewebe |
Primär Leber |
| Rezeptor / 2nd messenger |
GPCR / cAMP |
| Wirkung auf Körper |
Steigerung Glucosespiegel Steigerung Lipolyse, Ketogenese |
| Wirkung molekular |
Änderung Enzymaktivitäten Synthese neuer Enzyme |
| Feedback-Regulierung |
Erhöhter Glucosespiegel drosselt Glucagonsekretion |
 s. dort).
s. dort).
 Abbildung: Umsetzung des Glucagonsignals
Abbildung: Umsetzung des Glucagonsignals
 Glucagon
Glucagon  entsteht - wie auch die Glucagon-like peptides GLP-1 und GLP-2 - aus deren gemeinsamen Vorstufe Proglucagon. Proglucagon wird vom GCG-Gen codiert, und dieses wird im Pankreas, im Darm, aber auch im Gehirn
exprimiert und prozessiert. Dabei entstehen - mit unterschiedlicher Beteiligung - Glucagon,
GLP1, GLP2 und andere Peptide. Glucagon wird auf metabolische und neurale Reize hin (s. unten) von pankreatischen α-Zellen gebildet, in sekretorischen Granula gespeichert und bei Aufnahme eiweißreicher Nahrung sowie
Hypoglykämie (z.B. infolge Muskelarbeit) ins Blut freigesetzt.
entsteht - wie auch die Glucagon-like peptides GLP-1 und GLP-2 - aus deren gemeinsamen Vorstufe Proglucagon. Proglucagon wird vom GCG-Gen codiert, und dieses wird im Pankreas, im Darm, aber auch im Gehirn
exprimiert und prozessiert. Dabei entstehen - mit unterschiedlicher Beteiligung - Glucagon,
GLP1, GLP2 und andere Peptide. Glucagon wird auf metabolische und neurale Reize hin (s. unten) von pankreatischen α-Zellen gebildet, in sekretorischen Granula gespeichert und bei Aufnahme eiweißreicher Nahrung sowie
Hypoglykämie (z.B. infolge Muskelarbeit) ins Blut freigesetzt. Nach Sekretion im Pankreas erfolgt der proteolytische Glucagonabbau schon bei der ersten Leberpassage (weniger stark als Insulin), die biologische Halbwertszeit beträgt 5-6 Minuten. Die wichtigsten Glucagonwirkungen erfolgen an der Leber; im Fettgewebe fördert Glucagon den Fettabbau und hemmt die Lipogenese.
Nach Sekretion im Pankreas erfolgt der proteolytische Glucagonabbau schon bei der ersten Leberpassage (weniger stark als Insulin), die biologische Halbwertszeit beträgt 5-6 Minuten. Die wichtigsten Glucagonwirkungen erfolgen an der Leber; im Fettgewebe fördert Glucagon den Fettabbau und hemmt die Lipogenese.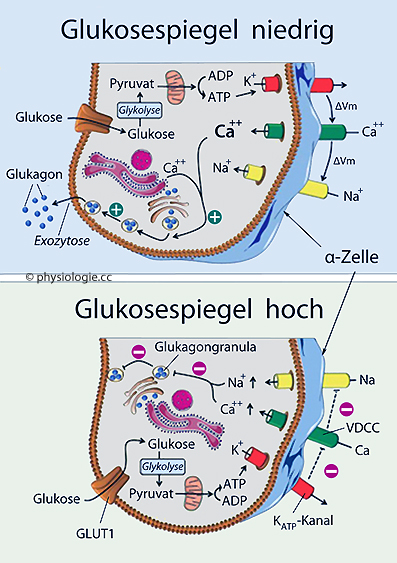
 Abbildung: Alpha-Zelle und ihre Funktion in Abhängigkeit vom Blutzuckerspiegel
Abbildung: Alpha-Zelle und ihre Funktion in Abhängigkeit vom Blutzuckerspiegel

 Abbildung oben) vor
allem auf die Leber, wo es sehr rasch (Sekunden) für ausreichende Glucoseversorgung des Körpers sorgt. Glucagonrezeptoren sind metabotrop - G-Protein, Adenylylcyclase), steigern den cAMP-Spiegel, aktivieren
dadurch Proteinkinase A und aktivieren so Schlüsselenzyme für die
Zuckerbereitstellung (Glykogen-Phosphorylase,
Fruktose-1,6-Biphosphatase), während sie Gegenspieler
(Glykogensynthase, Phosphofruktokinase) inaktivieren.
Abbildung oben) vor
allem auf die Leber, wo es sehr rasch (Sekunden) für ausreichende Glucoseversorgung des Körpers sorgt. Glucagonrezeptoren sind metabotrop - G-Protein, Adenylylcyclase), steigern den cAMP-Spiegel, aktivieren
dadurch Proteinkinase A und aktivieren so Schlüsselenzyme für die
Zuckerbereitstellung (Glykogen-Phosphorylase,
Fruktose-1,6-Biphosphatase), während sie Gegenspieler
(Glykogensynthase, Phosphofruktokinase) inaktivieren. in der Leber Gluconeogenese (cAMP → PKA → Enzyme), Glykogenolyse (Glykogenphosphorylase) und Ketogenese
in der Leber Gluconeogenese (cAMP → PKA → Enzyme), Glykogenolyse (Glykogenphosphorylase) und Ketogenese  (spart Blutzucker)
(spart Blutzucker) im Fettgewebe Lipolyse
im Fettgewebe Lipolyse im Muskel Proteolyse
im Muskel Proteolyse| Glucagon fördert Glykogenolyse und Gluconeogenese, der Glucosespiegel steigt an |
 die Glykolyseaktivität
die Glykolyseaktivität die Glykogensynthese
die Glykogensynthese die Synthese freier Fettsäuren in der Leber (de novo-Lipogenese)
die Synthese freier Fettsäuren in der Leber (de novo-Lipogenese) Abbildung).
Abbildung). 
 Abbildung: Wechselwirkungen zwischen Insulin- und Glucagonsystem, Wirkung auf den Blutzuckerspiegel
Abbildung: Wechselwirkungen zwischen Insulin- und Glucagonsystem, Wirkung auf den Blutzuckerspiegel
 Anregung: Die Glucagonfreisetzung wird stimuliert
Anregung: Die Glucagonfreisetzung wird stimuliert  durch Aufnahme von Proteinen, wobei Arginin (dieses regt auch die Sekretion von Insulin an) eine besondere Rolle spielt
durch Aufnahme von Proteinen, wobei Arginin (dieses regt auch die Sekretion von Insulin an) eine besondere Rolle spielt| Arginin stimuliert die Freisetzung sowohl von Insulin als auch von Glucagon |
 durch ein Absinken des Blutzuckerspiegels (
durch ein Absinken des Blutzuckerspiegels ( Abbildung)
Abbildung) Das Vegetativum fördert die Glucagonbildung - sowohl sympathisch (ß-Rezeptoren) als auch parasympathisch.
Das Vegetativum fördert die Glucagonbildung - sowohl sympathisch (ß-Rezeptoren) als auch parasympathisch. Inhibition: Die Glucagonsekretion wird gehemmt
Inhibition: Die Glucagonsekretion wird gehemmt  durch Anstieg der Konzentration von Glucose sowie freier Fettsäuren im Blut
durch Anstieg der Konzentration von Glucose sowie freier Fettsäuren im Blut Hormonell durch benachbarte Inselzellen (Insulin und GABA aus ß-Zellen, Somatostatin aus δ-Zellen) und aus dem Darm (Sekretin, GLP-1, GIP).
Hormonell durch benachbarte Inselzellen (Insulin und GABA aus ß-Zellen, Somatostatin aus δ-Zellen) und aus dem Darm (Sekretin, GLP-1, GIP).  Leber: Glucagon steigert die hepatische Glykogenolyse, die Glykogensynthese wird gehemmt, Gluconeogenese gefördert (Aminosäuren werden genutzt, Stickstoff wird frei, eine negative N-Bilanz ist die Folge.) Da auch die Glykolyse gehemmt wird, wird Glucose an das Blut abgegeben
Leber: Glucagon steigert die hepatische Glykogenolyse, die Glykogensynthese wird gehemmt, Gluconeogenese gefördert (Aminosäuren werden genutzt, Stickstoff wird frei, eine negative N-Bilanz ist die Folge.) Da auch die Glykolyse gehemmt wird, wird Glucose an das Blut abgegeben Fettgewebe: Glucagon wirkt auch lipolytisch (nicht so stark wie Adrenalin)
Fettgewebe: Glucagon wirkt auch lipolytisch (nicht so stark wie Adrenalin) Kreislauf: Glucagon erhöht die Frequenz und Schlagkraft des Herzens (positiv chronotrope und inotrope Wirkung).
Kreislauf: Glucagon erhöht die Frequenz und Schlagkraft des Herzens (positiv chronotrope und inotrope Wirkung). Abbildung).
Abbildung).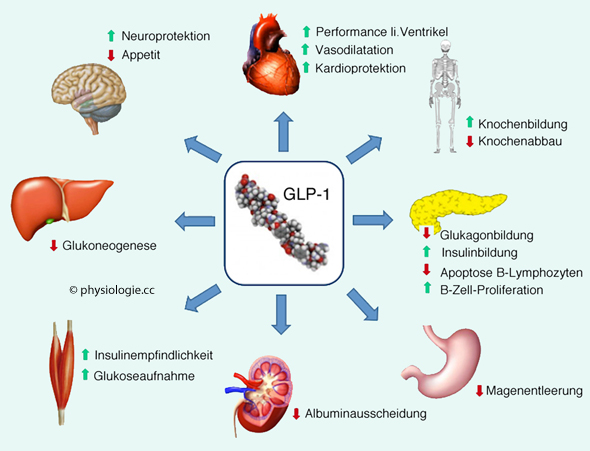
 Abbildung: Zielorgane und Wirkungen von GLP-1
Abbildung: Zielorgane und Wirkungen von GLP-1
 zügelt den Appetit (Gehirn),
zügelt den Appetit (Gehirn),  verzögert den gastrischen Weitertransport des Chymus (Magen),
verzögert den gastrischen Weitertransport des Chymus (Magen), reduziert die Gluconeogenese (Leber),
reduziert die Gluconeogenese (Leber),  steigert Glucoseaufnahme und
Insulinempfindlichkeit (Muskulatur),
steigert Glucoseaufnahme und
Insulinempfindlichkeit (Muskulatur),  fördert die Insulinfreisetzung ,
fördert die Insulinfreisetzung , senkt die Glucagonsekretion (Pankreas),
senkt die Glucagonsekretion (Pankreas),  stärkt Herztätigkeit und
Knochenaufbau.
stärkt Herztätigkeit und
Knochenaufbau. GLP-1-Rezeptor-Agonisten
aktivieren den GLP-1-Rezeptor. Sie fördern die Insulinsekretion und
hemmen die Glucagonausschüttung, senken den Blutzuckerspiegel
(Behandlung eines Typ-2-Diabetes) und werden zur Behandlung von
Übergewicht und Fettleibigkeit genutzt (vgl.
GLP-1-Rezeptor-Agonisten
aktivieren den GLP-1-Rezeptor. Sie fördern die Insulinsekretion und
hemmen die Glucagonausschüttung, senken den Blutzuckerspiegel
(Behandlung eines Typ-2-Diabetes) und werden zur Behandlung von
Übergewicht und Fettleibigkeit genutzt (vgl.  Abbildung). Das antidiabetisch wirkende Peptid Semaglutid
ist ein solcher GLP-1-Rezeptorantagonist; es fördert nicht nur die
pankreatische Insulinsekretion, sondern verzögert auch die
Magenentleerung (was den Zeitverlauf der duodenal-jejunalen
Glucoseresorption abflacht) und schwächt die Aktivität des "Hungerzentrums" im Hypothalamus.
Abbildung). Das antidiabetisch wirkende Peptid Semaglutid
ist ein solcher GLP-1-Rezeptorantagonist; es fördert nicht nur die
pankreatische Insulinsekretion, sondern verzögert auch die
Magenentleerung (was den Zeitverlauf der duodenal-jejunalen
Glucoseresorption abflacht) und schwächt die Aktivität des "Hungerzentrums" im Hypothalamus.
 Abbildung: Stimulierung der Nebenniere aktiviert bei Belastung
Abbildung: Stimulierung der Nebenniere aktiviert bei Belastung
 Adrenalin
Adrenalin  wirkt an Leber-, Fett- und Muskelzellen und erhöht (über β2-Rezeptoren) den Energieumsatz. Glucose und freie Fettsäuren werden durch Glykogenabbau, Abbau von Fett
(Lipolyse, über ß3-Rezeptoren) und hepatische Gluconeogenese (über ß2-Rezeptoren) bereitgestellt; der Blutzuckerspiegel
steigt.
wirkt an Leber-, Fett- und Muskelzellen und erhöht (über β2-Rezeptoren) den Energieumsatz. Glucose und freie Fettsäuren werden durch Glykogenabbau, Abbau von Fett
(Lipolyse, über ß3-Rezeptoren) und hepatische Gluconeogenese (über ß2-Rezeptoren) bereitgestellt; der Blutzuckerspiegel
steigt.  Die Freisetzung von Cortisol - dem wichtigsten Glucocorticoid - wird durch ACTH (Corticotropin) aus
dem
Hypophysen-Vorderlappen angeregt. Es wirkt blutzuckersteigernd und
leitet bei Belastung den Blutstrom zur Arbeitsmuskulatur um (
Die Freisetzung von Cortisol - dem wichtigsten Glucocorticoid - wird durch ACTH (Corticotropin) aus
dem
Hypophysen-Vorderlappen angeregt. Es wirkt blutzuckersteigernd und
leitet bei Belastung den Blutstrom zur Arbeitsmuskulatur um ( Genaueres s. dort).
Genaueres s. dort).
 Glucagon
ist das führende blutzuckersteigernde Hormon. Es aktiviert die
Adenylylcyclase und damit die Proteinkinase A, die gluconeogenetisch
und glykogenolytisch wirkt; auch aktiviert es die Phospholipase C und
steigert damit den Calciumspiegel im Zytosol.
Glucagon
ist das führende blutzuckersteigernde Hormon. Es aktiviert die
Adenylylcyclase und damit die Proteinkinase A, die gluconeogenetisch
und glykogenolytisch wirkt; auch aktiviert es die Phospholipase C und
steigert damit den Calciumspiegel im Zytosol. Cortisol
beeinflusst die Transkription mehrerer Gene, was über entsprechende
Enzyme u.a. zu hepatischer Gluconeogenese und zu Mobilisierung von
Aminosäuren in der Muskulatur führt.
Cortisol
beeinflusst die Transkription mehrerer Gene, was über entsprechende
Enzyme u.a. zu hepatischer Gluconeogenese und zu Mobilisierung von
Aminosäuren in der Muskulatur führt. Adrenalin wirkt glykogenolytisch (Leber, Muskel) und glycolytisch (Muskel).
Adrenalin wirkt glykogenolytisch (Leber, Muskel) und glycolytisch (Muskel).
 Muskulatur: Kraftlosigkeit
Muskulatur: Kraftlosigkeit
 Gehirn:
Konzentrationsstörungen, Verlangsamung, Verwirrtheit,
Stimmungsschwankungen, beeinträchtigte Koordination, Schlafstörungen
Gehirn:
Konzentrationsstörungen, Verlangsamung, Verwirrtheit,
Stimmungsschwankungen, beeinträchtigte Koordination, Schlafstörungen
 bei starker Hypoglykämie (<40 mg/dl) Krämpfe, Bewusstlosigkeit
bei starker Hypoglykämie (<40 mg/dl) Krämpfe, Bewusstlosigkeit
 ~106 Langerhans-Inseln (1-2% der Pankreasmasse) sind stark vaskularisiert, autonom
innerviert und enthalten mehrere Zelltypen: α-Zellen (20-30%)
produzieren Glucagon (dessen Sekretion steigt bei Hypoglykämie bis
4-fach), Proglucagon, glucagonähnliche Peptide (GLP-1, GLP-2); β-Zellen (50-75%) produzieren
Insulin, Amylin
(bremst die Verdauungsvorgänge), GABA (senkt die Glucagonfreisetzung); δ-Zellen (~10%) produzieren
Somatostatin; PP- (γ-, F-) Zellen (<5%)
produzieren pankreatisches Polypeptid; ε-Zellen (<1%) produzieren
Ghrelin (fördert die Somatostatinfreisetzung, hemmt die glucoseinduzierte Insulinsekretion) ~106 Langerhans-Inseln (1-2% der Pankreasmasse) sind stark vaskularisiert, autonom
innerviert und enthalten mehrere Zelltypen: α-Zellen (20-30%)
produzieren Glucagon (dessen Sekretion steigt bei Hypoglykämie bis
4-fach), Proglucagon, glucagonähnliche Peptide (GLP-1, GLP-2); β-Zellen (50-75%) produzieren
Insulin, Amylin
(bremst die Verdauungsvorgänge), GABA (senkt die Glucagonfreisetzung); δ-Zellen (~10%) produzieren
Somatostatin; PP- (γ-, F-) Zellen (<5%)
produzieren pankreatisches Polypeptid; ε-Zellen (<1%) produzieren
Ghrelin (fördert die Somatostatinfreisetzung, hemmt die glucoseinduzierte Insulinsekretion) Der Blutzuckerspiegel beträgt nüchtern um 4-5 mM (Referenzbereich 3,3-6,0 mM) oder 70-90 mg/dl. Nahrungsaufnahme
steigert, körperliche Aktivität senkt den Blutzuckerspiegel.
Postprandial steigt der Glucosespiegel um bis >50% (nach sehr kohlenhydratreichen
Mahlzeiten bis +100%) an, die Rückkehr zu Nüchternwerten kann mehrere
Stunden dauern. Der Quotient Insulin / Glucagon kennzeichnet
den Status des Energiestoffwechsels: Er ist hoch nach Nahrungsaufnahme
(Resorptionsphase; viel Insulin), die im Überschuss vorhandene Glucose
wird gespeichert; in der Postresorptionsphase ist er niedrig (wenig
Insulin), der Stoffwechsel greift auf körpereigene Energiespeicher
zurück. Die Glucoseaufnahme des Gehirns ist ab 3,7 mM
reduziert; Unruhe, Zittern, Heißhunger, Schweißausbruch treten ab 3,0 mM, Bewusstlosigkeit ab 2,7 mM Blutzucker auf Der Blutzuckerspiegel beträgt nüchtern um 4-5 mM (Referenzbereich 3,3-6,0 mM) oder 70-90 mg/dl. Nahrungsaufnahme
steigert, körperliche Aktivität senkt den Blutzuckerspiegel.
Postprandial steigt der Glucosespiegel um bis >50% (nach sehr kohlenhydratreichen
Mahlzeiten bis +100%) an, die Rückkehr zu Nüchternwerten kann mehrere
Stunden dauern. Der Quotient Insulin / Glucagon kennzeichnet
den Status des Energiestoffwechsels: Er ist hoch nach Nahrungsaufnahme
(Resorptionsphase; viel Insulin), die im Überschuss vorhandene Glucose
wird gespeichert; in der Postresorptionsphase ist er niedrig (wenig
Insulin), der Stoffwechsel greift auf körpereigene Energiespeicher
zurück. Die Glucoseaufnahme des Gehirns ist ab 3,7 mM
reduziert; Unruhe, Zittern, Heißhunger, Schweißausbruch treten ab 3,0 mM, Bewusstlosigkeit ab 2,7 mM Blutzucker auf Blutglucose
unter ~4,6 mM reduziert die Insulinsekretion, Werte unter ~3,8 mM
mobilisieren Glucagon und Adrenalin, unter ~3,7 mM GH (etwa eine
Stunde bis zur
insulin-antagonistischen Wirkung), unter ~3,2 mM Cortisol. α-Zellen setzen aus sekretorischen Granula Glucagon auf metabolische (Hypoglykämie, Aufnahme eiweißreicher Nahrung) und neurale Reize hin frei. Glucagon wirkt an Leber- und Fettzellen (heptahelikale Rezeptoren → cAMP↑ → PKA↑→
Phospholipase C → IP3↑ → intrazelluläres [Ca++]↑). Der Glucagonabbau beginnt schon bei der ersten Leberpassage (~80%), die
biologische Halbwertszeit beträgt 5-6 Minuten, nur ein geringer Anteil
gelangt in den systemischen Kreislauf (Fettgewebe) Blutglucose
unter ~4,6 mM reduziert die Insulinsekretion, Werte unter ~3,8 mM
mobilisieren Glucagon und Adrenalin, unter ~3,7 mM GH (etwa eine
Stunde bis zur
insulin-antagonistischen Wirkung), unter ~3,2 mM Cortisol. α-Zellen setzen aus sekretorischen Granula Glucagon auf metabolische (Hypoglykämie, Aufnahme eiweißreicher Nahrung) und neurale Reize hin frei. Glucagon wirkt an Leber- und Fettzellen (heptahelikale Rezeptoren → cAMP↑ → PKA↑→
Phospholipase C → IP3↑ → intrazelluläres [Ca++]↑). Der Glucagonabbau beginnt schon bei der ersten Leberpassage (~80%), die
biologische Halbwertszeit beträgt 5-6 Minuten, nur ein geringer Anteil
gelangt in den systemischen Kreislauf (Fettgewebe)  Im Gegensatz zur ß-Zelle sind die KATP-Kanäle der α-Zelle
bei niedriger ATP-Konzentration (wenig Glucose) gehemmt. Niedriger
Blutzucker reduziert den Kaliumausstrom, die Zelle depolarisiert, Glucagon wird freigesetzt - und umgekehrt. Glucagon kann die
Glucoseversorgung durch die Leber in Sekundenschnelle anregen. Glucagon
fördert die Gluconeogenese (Lipolyse in Fettgewebe, Aminosäuren
werden genutzt, Stickstoff wird frei), weiters die Glykogenolyse,
ß-Oxidation, Ketogenese. Glucagon senkt die Glykolyse, Glykogensynthese
und Synthese freier Fettsäuren in der Leber (de novo-Lipogenese). Es wirkt
energiemobilisierend und (wie GLP) herzstärkend (Frequenz,
Schlagkraft) Im Gegensatz zur ß-Zelle sind die KATP-Kanäle der α-Zelle
bei niedriger ATP-Konzentration (wenig Glucose) gehemmt. Niedriger
Blutzucker reduziert den Kaliumausstrom, die Zelle depolarisiert, Glucagon wird freigesetzt - und umgekehrt. Glucagon kann die
Glucoseversorgung durch die Leber in Sekundenschnelle anregen. Glucagon
fördert die Gluconeogenese (Lipolyse in Fettgewebe, Aminosäuren
werden genutzt, Stickstoff wird frei), weiters die Glykogenolyse,
ß-Oxidation, Ketogenese. Glucagon senkt die Glykolyse, Glykogensynthese
und Synthese freier Fettsäuren in der Leber (de novo-Lipogenese). Es wirkt
energiemobilisierend und (wie GLP) herzstärkend (Frequenz,
Schlagkraft) Die Glucagonsekretion wird angeregt durch Hypoglykämie, Aminosäuren
(Arginin regt auch die Sekretion von Insulin an), sympathische
(ß-adrenerg) und parasympathische Impulse; sie wird gehemmt durch
Anstieg der Konzentration von Glucose und freien Fettsäuren im Blut,
durch benachbarte Inselzellen (Insulin und GABA aus ß-Zellen,
Somatostatin aus δ-Zellen) und Hormone aus dem Darm (Sekretin, GLP-1,
GIP) Die Glucagonsekretion wird angeregt durch Hypoglykämie, Aminosäuren
(Arginin regt auch die Sekretion von Insulin an), sympathische
(ß-adrenerg) und parasympathische Impulse; sie wird gehemmt durch
Anstieg der Konzentration von Glucose und freien Fettsäuren im Blut,
durch benachbarte Inselzellen (Insulin und GABA aus ß-Zellen,
Somatostatin aus δ-Zellen) und Hormone aus dem Darm (Sekretin, GLP-1,
GIP)  L-Zellen
sezernieren GLP-1 bei Anwesenheit von Nährstoffen (Zucker, Lipide, auch
Proteine) im Darm, sowie auf neurale und hormonelle Stimuli hin. GLP-1 steigert Glucoseaufnahme und Insulinempfindlichkeit (Muskulatur), fördert
Insulinfreisetzung (Pankreas), stärkt
Herztätigkeit und Knochenaufbau; es senkt Glucagonsekretion, Appetit und Magenmotorik sowie hepatische Gluconeogenese L-Zellen
sezernieren GLP-1 bei Anwesenheit von Nährstoffen (Zucker, Lipide, auch
Proteine) im Darm, sowie auf neurale und hormonelle Stimuli hin. GLP-1 steigert Glucoseaufnahme und Insulinempfindlichkeit (Muskulatur), fördert
Insulinfreisetzung (Pankreas), stärkt
Herztätigkeit und Knochenaufbau; es senkt Glucagonsekretion, Appetit und Magenmotorik sowie hepatische Gluconeogenese Adrenalin (Stress) erhöht den Energieumsatz (β2-adrenerg), stellt Glucose und freie Fettsäuren durch Abbau von Leberglykogen, Lipolyse
(ß3) und hepatische Gluconeogenese (ß2) bereit; der Blutzuckerspiegel
steigt, unterstützt durch reduzierte Insulinproduktion (α2) und Freisetzung von Glucagon. Im Muskel erhöht Adrenalin die Glucose-Aufnahme Adrenalin (Stress) erhöht den Energieumsatz (β2-adrenerg), stellt Glucose und freie Fettsäuren durch Abbau von Leberglykogen, Lipolyse
(ß3) und hepatische Gluconeogenese (ß2) bereit; der Blutzuckerspiegel
steigt, unterstützt durch reduzierte Insulinproduktion (α2) und Freisetzung von Glucagon. Im Muskel erhöht Adrenalin die Glucose-Aufnahme  Cortisol erhöht
den Blutzuckerspiegel und leitet bei Belastung den Blutstrom zur
Arbeitsmuskulatur um, führt zu Eiweißabbau im Muskel und regt die
Gluconeogenese in der Leber an, senkt den zellulären Glucoseverbrauch und
erhöht die Spaltung von Triglyzeriden im Fettgewebe (→ steigender
Fettsäurespiegel im Blut) Cortisol erhöht
den Blutzuckerspiegel und leitet bei Belastung den Blutstrom zur
Arbeitsmuskulatur um, führt zu Eiweißabbau im Muskel und regt die
Gluconeogenese in der Leber an, senkt den zellulären Glucoseverbrauch und
erhöht die Spaltung von Triglyzeriden im Fettgewebe (→ steigender
Fettsäurespiegel im Blut) |
