

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert


 Energiehaushalt und Substrat-Interkonversion
Energiehaushalt und Substrat-Interkonversion
 Cori-Zyklus: Gerty Cori, Carl F. Cori
Cori-Zyklus: Gerty Cori, Carl F. Cori| Wenn
Aminosäuren für den Energiestoffwechsel genutzt werden sollen, müssen
sie desaminiert werden - d.h. Stickstoff wird aus dem Molekül entfernt.
Über den Glucose-Alanin-Zyklus wird aus Muskelprotein Glucose gewonnen: die Leber wandelt Alanin
(und Ketoglutarat) zu Stickstoff (für den Harnstoffzyklus) und Pyruvat
(für die Gluconeogenese) um. Diese Reaktion wird durch ein Enzym
beschleunigt, das vor allem von Leberzellen gebildet wird: Die Alanin-Aminotransferase AL(A)T (früher GPT). Wenn Lactat zu Glucose verwandelt werden soll, bedarf es ebenfalls der hepatischen Enzymausstattung. Im Cori-Zyklus wandert Glucose von Leber zu Muskulatur (Glykolyse), Lactat von Muskulatur zu Leber (Gluconeogenese). Es gibt mehrere energierelevante Umwandlungsprozesse in der Leber: Gluconeogenese (Hirnstoffwechsel!), Glykogenolyse (angeregt durch Glucagon, Adrenalin u.a.), Glykogensynthese (osmotische Pufferung), Glykolyse (aerob oder anaerob), Lipogenese, Cholesterinsynthese, Aminosäurestoffwechsel, Harnstoffsynthese. In Hungerperioden produziert die Leber - über die basale Ketogenese hinaus - vermehrt Ketonkörper (Ketose) für fast alle Gewebe, vor allem das Gehirn. Weitere Interkonversionen betreffen u.a. Cholesterinbildung, Nukleinsäuremetabolismus, Vitaminspeicherung und Säure-Basen-Haushalt (Glutamat, Ammonium, Harnstoff). |
 Leber und Energiestoffwechsel
Leber und Energiestoffwechsel  Hunger und Ketonkörper
Hunger und Ketonkörper  Leber und pH-Regulation
Leber und pH-Regulation  Leber und Cholesterin
Leber und Cholesterin  Nukleinsäuren, Vitamine, Spurenelemente
Nukleinsäuren, Vitamine, Spurenelemente Gluconeogenese
Gluconeogenese
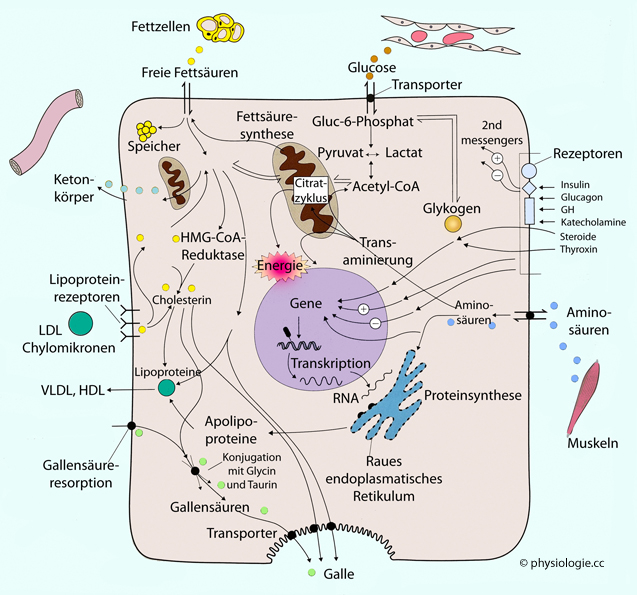
 Abbildung: Metabolische Aufgaben eines Hepatozyten
Abbildung: Metabolische Aufgaben eines Hepatozyten Als Gluconeogenese bezeichnet
man die Fähigkeit einer Zelle, aus Nichtzucker-Bausteinen des
Metabolismus (Lactat, Aminosäuren, Glycerin) Glucose zu synthetisieren.
Dieser Vorgang ist im Wesentlichen eine Umkehrung der Glycolyse und
findet vorwiegend im Zytoplasma statt; die Glucose-6-Phosphatase wirkt im endoplasmatischen Retikulum, die Pyruvatcarboxylase
in den Mitochondrien. Für einen vollständigen Ablauf der Gluconeogenese
sind daher diese drei Zellkompartimente notwendig. Leber, Nieren und
Darm sind zur Gluconeogenese fähig; die Leber tut dies u.a., um den
Blutzuckerspiegel zu stabilisieren. Sie verfügt über genügend Glucose-6-Phosphatase,
um das Phosphat aus Glucose-6-Phosphat zu entfernen und Glucose zu mobilisieren (vgl. dort) und versorgt andere glucoseabhängige Zellen, insbesondere im Nervensystem sowie im Blut (Erythrozyten).
Als Gluconeogenese bezeichnet
man die Fähigkeit einer Zelle, aus Nichtzucker-Bausteinen des
Metabolismus (Lactat, Aminosäuren, Glycerin) Glucose zu synthetisieren.
Dieser Vorgang ist im Wesentlichen eine Umkehrung der Glycolyse und
findet vorwiegend im Zytoplasma statt; die Glucose-6-Phosphatase wirkt im endoplasmatischen Retikulum, die Pyruvatcarboxylase
in den Mitochondrien. Für einen vollständigen Ablauf der Gluconeogenese
sind daher diese drei Zellkompartimente notwendig. Leber, Nieren und
Darm sind zur Gluconeogenese fähig; die Leber tut dies u.a., um den
Blutzuckerspiegel zu stabilisieren. Sie verfügt über genügend Glucose-6-Phosphatase,
um das Phosphat aus Glucose-6-Phosphat zu entfernen und Glucose zu mobilisieren (vgl. dort) und versorgt andere glucoseabhängige Zellen, insbesondere im Nervensystem sowie im Blut (Erythrozyten). Die Leber verfügt über hohe oxidative Kapazität, vor allem im peripheren Azinusbereich (Zone 1).
Daher ist sie u.a. in der Lage, Lactat zu metabolisieren (
Die Leber verfügt über hohe oxidative Kapazität, vor allem im peripheren Azinusbereich (Zone 1).
Daher ist sie u.a. in der Lage, Lactat zu metabolisieren ( Abbildung; Cori-Zyklus,
Abbildung; Cori-Zyklus,  Abbildung unten). Lactat fällt
insbesondere bei starker körperlicher Belastung in der
Skelettmuskulatur an.
Abbildung unten). Lactat fällt
insbesondere bei starker körperlicher Belastung in der
Skelettmuskulatur an.  Muskelzellen sind enzymatisch nicht dazu ausgestattet, Lactat in Glucose rückzuverwandeln; dazu wird die Enzymausstattung der
Leber benötigt.
Muskelzellen sind enzymatisch nicht dazu ausgestattet, Lactat in Glucose rückzuverwandeln; dazu wird die Enzymausstattung der
Leber benötigt. Abbildung). Dieses wird in
den Muskeln aus überschüssigem Stickstoff (in NH4+)
und Pyruvat
gebildet und mit dem Kreislauf zur Leber transportiert. Leberzellen
können Alanin desaminieren (sie verfügen über Alanin-Aminotransferase),
es entsteht Pyruvat, und es fällt Stickstoff (für den
Harnstoffzyklus) an. Pyruvat kann anschließend zu Glucose aufgebaut werden (Gluconeogenese).
Abbildung). Dieses wird in
den Muskeln aus überschüssigem Stickstoff (in NH4+)
und Pyruvat
gebildet und mit dem Kreislauf zur Leber transportiert. Leberzellen
können Alanin desaminieren (sie verfügen über Alanin-Aminotransferase),
es entsteht Pyruvat, und es fällt Stickstoff (für den
Harnstoffzyklus) an. Pyruvat kann anschließend zu Glucose aufgebaut werden (Gluconeogenese). Desaminierung von
Aminosäuren ist die Voraussetzung für deren Verwendung als
Energieträger.
Desaminierung von
Aminosäuren ist die Voraussetzung für deren Verwendung als
Energieträger.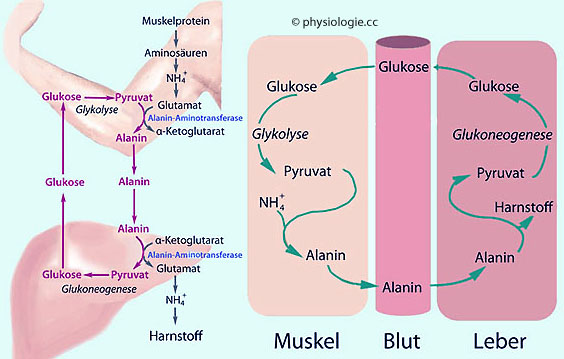
 Abbildung: Glucose-Alanin-Zyklus
Abbildung: Glucose-Alanin-Zyklus
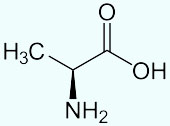 Alanin
Alanin
 Der Glucose-Alanin-Zyklus stellt dem Muskel Glucose zur Verfügung und entfernt Stickstoff (
Der Glucose-Alanin-Zyklus stellt dem Muskel Glucose zur Verfügung und entfernt Stickstoff ( Abbildung).
Abbildung). Abbildung):
Abbildung):
 Abbildung: Cori-Zyklus
Abbildung: Cori-Zyklus
 Der Cori-Zyklus
Der Cori-Zyklus
 nimmt Lactat aus der Peripherie (z.B. akut belasteter Muskulatur) auf, bildet daraus Glucose (energetisch angetrieben durch Fettsäureabbau) und retourniert diese zu glucoseabhängigen Zellen (z.B. aktive Myozyten,
nimmt Lactat aus der Peripherie (z.B. akut belasteter Muskulatur) auf, bildet daraus Glucose (energetisch angetrieben durch Fettsäureabbau) und retourniert diese zu glucoseabhängigen Zellen (z.B. aktive Myozyten,  Abbildung). Der Cori-Zyklus verknüpft die Glykolyse in arbeitender Muskulatur (und anderer Zellen, insbesondere roten Blutkörperchen) mit der Glukoneogenese in der Leber - was wiederum glucoseabhängigen Geweben zugute kommt.
Abbildung). Der Cori-Zyklus verknüpft die Glykolyse in arbeitender Muskulatur (und anderer Zellen, insbesondere roten Blutkörperchen) mit der Glukoneogenese in der Leber - was wiederum glucoseabhängigen Geweben zugute kommt.
 Kein "Rückstau" von Lactat in stark belasteter Muskulatur oder in Erythrozyten
Kein "Rückstau" von Lactat in stark belasteter Muskulatur oder in Erythrozyten  Regenerierung von Glucose, Glykolyse kann fortgesetzt werden
Regenerierung von Glucose, Glykolyse kann fortgesetzt werden Regenerierung von NADH (via Lactat-Dehydrogenase), das für die Glukoneogenese benötigt wird
Regenerierung von NADH (via Lactat-Dehydrogenase), das für die Glukoneogenese benötigt wird aerob vollständig abgebaut (Resorptionsphase), oder
aerob vollständig abgebaut (Resorptionsphase), oder als freie Glucose in den Extrazellulärraum abgegeben bzw. in Glykogen eingebaut werden (Postresorptionsphase).
als freie Glucose in den Extrazellulärraum abgegeben bzw. in Glykogen eingebaut werden (Postresorptionsphase). Über Leber und Kohlenhydrat- bzw. Fettstoffwechsel s. dort
Über Leber und Kohlenhydrat- bzw. Fettstoffwechsel s. dort Gluconeogenese,
d.h. die Neubildung von D-Glucose aus Vorstufen wie Pyruvat oder
Oxalacetat. Sie
findet sowohl im Zytoplasma als auch in Mitochondrien statt (Glykolyse
nur im Zytoplasma). Dabei werden 6 hochenergetische Phosphatbindungen
(4 von ATP, 2 von GTP) hydrolysiert, um aus zwei Molekülen Pyruvat ein
Molekül Glucose zu synthetisieren.
Gluconeogenese,
d.h. die Neubildung von D-Glucose aus Vorstufen wie Pyruvat oder
Oxalacetat. Sie
findet sowohl im Zytoplasma als auch in Mitochondrien statt (Glykolyse
nur im Zytoplasma). Dabei werden 6 hochenergetische Phosphatbindungen
(4 von ATP, 2 von GTP) hydrolysiert, um aus zwei Molekülen Pyruvat ein
Molekül Glucose zu synthetisieren. Gluconeogenese
ist von entscheidender Bedeutung, wenn der Körper seine
Kohlenhydratreserven verbraucht hat - wie beim Fasten, im
Hungerzustand, nach intensiver Muskelbelastung oder infolge anhaltend
kohlenhydratarmer Kost. Dann muss Glucose aus Pyruvat oder anderen
C-Trägern de novo gebildet werden. Die Leber
bestreitet 90%
der Gluconeogenese für den Organismus; beteiligt sind weiters Nieren
und Dünndarm. Abnehmer der neu synthetisierten Glucose sind vor allem
Erythrozyten (ihr Energiestoffwechsel ist vollständig auf anaerobe
Glykolyse angewiesen), Nervengewebe (weitgehend auf Glucose
angewiesen), aktive Muskulatur, Nierengewebe.
Gluconeogenese
ist von entscheidender Bedeutung, wenn der Körper seine
Kohlenhydratreserven verbraucht hat - wie beim Fasten, im
Hungerzustand, nach intensiver Muskelbelastung oder infolge anhaltend
kohlenhydratarmer Kost. Dann muss Glucose aus Pyruvat oder anderen
C-Trägern de novo gebildet werden. Die Leber
bestreitet 90%
der Gluconeogenese für den Organismus; beteiligt sind weiters Nieren
und Dünndarm. Abnehmer der neu synthetisierten Glucose sind vor allem
Erythrozyten (ihr Energiestoffwechsel ist vollständig auf anaerobe
Glykolyse angewiesen), Nervengewebe (weitgehend auf Glucose
angewiesen), aktive Muskulatur, Nierengewebe.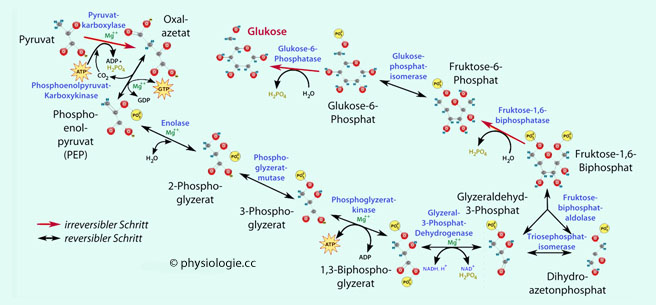
 Abbildung: Gluconeogenese
Abbildung: Gluconeogenese
 Abbildung) in mehreren Kompartimenten (Mitochondrien, Zytoplasma, endoplasmatisches Retikulum) beteiligt.
Abbildung) in mehreren Kompartimenten (Mitochondrien, Zytoplasma, endoplasmatisches Retikulum) beteiligt. Glykogenolyse
- der Abbau von Glykogen zu Glucose-1-phosphat und Glucose.
Glykogenolyse
- der Abbau von Glykogen zu Glucose-1-phosphat und Glucose.  Glykogensynthese - Glykogen ist osmotisch kaum aktiv, die speichernde Zelle hält ihr Volumen so gut wie unverändert,
Glykogensynthese - Glykogen ist osmotisch kaum aktiv, die speichernde Zelle hält ihr Volumen so gut wie unverändert,  s. dort
s. dort Glykolyse (Embden-Meyerhof-Parnas-Weg, EMP-Weg
Glykolyse (Embden-Meyerhof-Parnas-Weg, EMP-Weg  ): Abbau von Glucosemolekül zu Pyruvat, wobei Energie auf ATP übertragen und NAD+ zu NADH reduziert wird.
): Abbau von Glucosemolekül zu Pyruvat, wobei Energie auf ATP übertragen und NAD+ zu NADH reduziert wird. 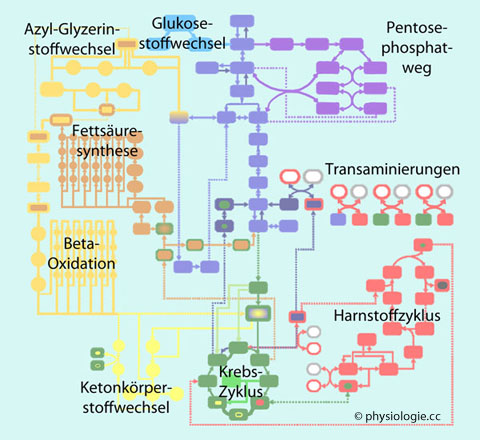
 Abbildung: Zentrale Stoffwechselwege: Eine Übersicht
Abbildung: Zentrale Stoffwechselwege: Eine Übersicht
 Fettsäuresynthese (Lipogenese): Sie erfolgt im Zytoplasma unter Einfluss eines multifunktionalen Enzyms, der Fettsäure-Synthase
Fettsäuresynthese (Lipogenese): Sie erfolgt im Zytoplasma unter Einfluss eines multifunktionalen Enzyms, der Fettsäure-Synthase Die komplexe Cholesterinsynthese
(Mevalonatweg) erfolgt in erster Linie in Leber und Darmschleimhaut.
Soferne möglich, verwendet der Körper Nahrungscholesterin für seinen
Bedarf. Da Cholesterin nicht die Blut-Hirn-Schranke passiert, synthetisiert das Gehirn sein eigenes Cholesterin
Die komplexe Cholesterinsynthese
(Mevalonatweg) erfolgt in erster Linie in Leber und Darmschleimhaut.
Soferne möglich, verwendet der Körper Nahrungscholesterin für seinen
Bedarf. Da Cholesterin nicht die Blut-Hirn-Schranke passiert, synthetisiert das Gehirn sein eigenes Cholesterin Cholesterin- und Triglyzeridaufnahme: Die Leber hat eine zentrale Stellung im Fettstoffwechsel - inklusive Speicherung s. dort
Cholesterin- und Triglyzeridaufnahme: Die Leber hat eine zentrale Stellung im Fettstoffwechsel - inklusive Speicherung s. dort Auf- und Abbau von Aminosäuren: Ähnliches gilt für Aminosäuren und Proteine s. dort
Auf- und Abbau von Aminosäuren: Ähnliches gilt für Aminosäuren und Proteine s. dort Zur Harnstoffsynthese s. dort
Zur Harnstoffsynthese s. dort Über den Abbau von Hormonen, Medikamenten und anderen Stoffen (Phase I- und Phase-II-Reaktionen) s. dort
Über den Abbau von Hormonen, Medikamenten und anderen Stoffen (Phase I- und Phase-II-Reaktionen) s. dort zu produzieren. Dazu werden im Fettgewebe Fettsäuren aus Triglyzeriden mobilisiert / oxidiert. Acetyl-CoA-Moleküle werden dabei in
den Mitochondrien kondensiert, es entsteht HMG-CoA (
zu produzieren. Dazu werden im Fettgewebe Fettsäuren aus Triglyzeriden mobilisiert / oxidiert. Acetyl-CoA-Moleküle werden dabei in
den Mitochondrien kondensiert, es entsteht HMG-CoA ( Abbildung) und daraus die wasserlöslichen sauren
Produkte Acetessigsäure (acetoacetate), ß-Hydroxybuttersäure (ß-hydroxybutyrate) und Aceton (acetone).
Nach wenigen Tagen ttritt eine deutliche Erhöhung der
Ketonkörperkonzentration im Blut (Ketose) mit Senkung des Blut-pH
(Ketoazidose) auf.
Abbildung) und daraus die wasserlöslichen sauren
Produkte Acetessigsäure (acetoacetate), ß-Hydroxybuttersäure (ß-hydroxybutyrate) und Aceton (acetone).
Nach wenigen Tagen ttritt eine deutliche Erhöhung der
Ketonkörperkonzentration im Blut (Ketose) mit Senkung des Blut-pH
(Ketoazidose) auf. 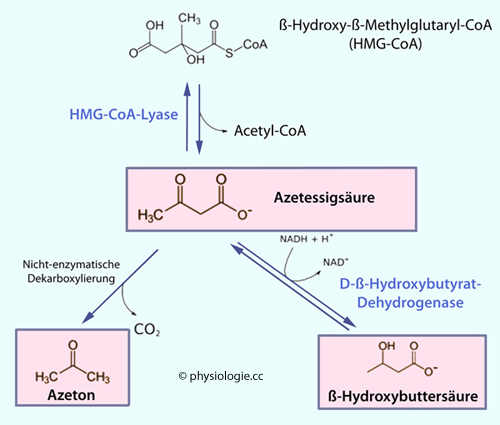
 Abbildung: Synthese der Ketonkörper
Abbildung: Synthese der Ketonkörper
 Abbildung).
Abbildung). 
 ß-Hydroxybutyrat wird zu Acetoacetat rückverwandelt (dabei wird NAD+ zu NADH und dieses überträgt sein Elektron auf den Komplex I der Atmungskette, es entstehen 3 ATP)
ß-Hydroxybutyrat wird zu Acetoacetat rückverwandelt (dabei wird NAD+ zu NADH und dieses überträgt sein Elektron auf den Komplex I der Atmungskette, es entstehen 3 ATP) CoA wird von Succinyl-CoA enzymatisch auf Acetoacetat übertragen; diese
Bildung von Acetoacetyl-CoA kostet 1 GTP. (Leberzellen verfügen nicht
über das verantwortliche Enzym Thiophorase und können diesen Schritt
nicht nutzen.) Ein weiteres Enzym (Thiolase) bricht anschließend Acetoacetyl-CoA zu 2 Acetyl-CoA auf, dieses gelangt in den Citratzyklus und liefert schließlich 2 mal 12 ATP.
CoA wird von Succinyl-CoA enzymatisch auf Acetoacetat übertragen; diese
Bildung von Acetoacetyl-CoA kostet 1 GTP. (Leberzellen verfügen nicht
über das verantwortliche Enzym Thiophorase und können diesen Schritt
nicht nutzen.) Ein weiteres Enzym (Thiolase) bricht anschließend Acetoacetyl-CoA zu 2 Acetyl-CoA auf, dieses gelangt in den Citratzyklus und liefert schließlich 2 mal 12 ATP. Zum Stoffwechsel in der postresorptiven Phase s. dort
Zum Stoffwechsel in der postresorptiven Phase s. dort Bei Azidose wird vermehrt Glutamat verwendet,
um Stickstoff
zu binden, die Ausscheidung von Ammonium nimmt zu. Mit Ammoniumchlorid gelangen
saure Valenzen zur
Ausscheidung; Ketoglutarat wird abgebaut, es entsteht Bicarbonat.
Bei Azidose wird vermehrt Glutamat verwendet,
um Stickstoff
zu binden, die Ausscheidung von Ammonium nimmt zu. Mit Ammoniumchlorid gelangen
saure Valenzen zur
Ausscheidung; Ketoglutarat wird abgebaut, es entsteht Bicarbonat.  Bei Alkalose nimmt die Stickstoffelimination über Harnstoff zu, die N-Ausscheidung über Ammonium ab.
Bei Alkalose nimmt die Stickstoffelimination über Harnstoff zu, die N-Ausscheidung über Ammonium ab.  Cholesterin wird hauptsächlich über die Galle ausgeschieden. Die Hepatozyten bilden daraus primäre Gallensalze
(Cholat, Chenodesoxycholat). Diese werden zwecks besserer
Wasserlöslichkeit konjugiert (mit Glyzin, Sulfat, Glukuronat oder
Taurin
Cholesterin wird hauptsächlich über die Galle ausgeschieden. Die Hepatozyten bilden daraus primäre Gallensalze
(Cholat, Chenodesoxycholat). Diese werden zwecks besserer
Wasserlöslichkeit konjugiert (mit Glyzin, Sulfat, Glukuronat oder
Taurin  ) und in die Primärgalle der Gallenkanälchen ausgeschieden.
) und in die Primärgalle der Gallenkanälchen ausgeschieden.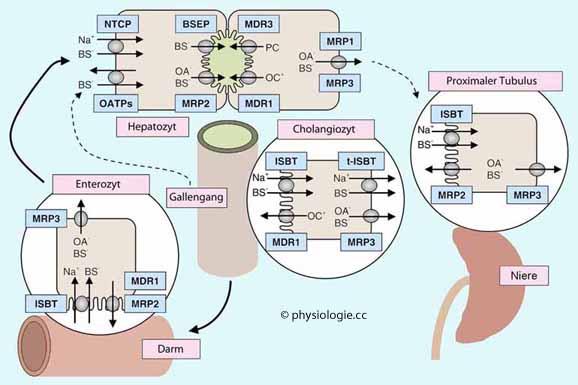
 Abbildung: Hepatobiliäre, enterale und renale Transportsysteme
Abbildung: Hepatobiliäre, enterale und renale Transportsysteme  Abbildung). Die Leberzellen konjugieren Gallensalze zurück, die vorher
dekonjugiert wurden.
Abbildung). Die Leberzellen konjugieren Gallensalze zurück, die vorher
dekonjugiert wurden.  Solchermaßen geht nur ein geringer Teil des Gallensäurepools
(3-4 Gramm, Rezirkulation 4-12mal pro Tag) mit dem Stuhl verloren; Gallensalzmoleküle werden als Emulgator wiederverwendet.
Solchermaßen geht nur ein geringer Teil des Gallensäurepools
(3-4 Gramm, Rezirkulation 4-12mal pro Tag) mit dem Stuhl verloren; Gallensalzmoleküle werden als Emulgator wiederverwendet. Der Nukleinsäurestoffwechsel
synthetisiert Kreatinphosphat, Harnsäure, Pyrimidin, Purine. Bildung und Ausscheidung von Harnstoff bedeutet Ausscheidung von Ammonium aus dem Körper (hepatisches Koma bei Leberversagen).
Der Nukleinsäurestoffwechsel
synthetisiert Kreatinphosphat, Harnsäure, Pyrimidin, Purine. Bildung und Ausscheidung von Harnstoff bedeutet Ausscheidung von Ammonium aus dem Körper (hepatisches Koma bei Leberversagen).  Die Leber speichert Vitamine - vor allem A (gut für ~10 Monate), D (3-4 Monate; auch Aktivierung des Provitamins zu Calcidiol, genügend UV-Bestrahlung vorausgesetzt), B12
(gut für bis zu mehrere Jahre). Seit langem ist bekannt, dass der
Verzehr von Leber eine ausgezeichnete Vitaminquelle bedeutet.
Die Leber speichert Vitamine - vor allem A (gut für ~10 Monate), D (3-4 Monate; auch Aktivierung des Provitamins zu Calcidiol, genügend UV-Bestrahlung vorausgesetzt), B12
(gut für bis zu mehrere Jahre). Seit langem ist bekannt, dass der
Verzehr von Leber eine ausgezeichnete Vitaminquelle bedeutet. Die Leber speichert zahlreiche Spurenelemente. Dazu gehört Eisen,
das als Ferritin gespeichert wird und neben Hämoglobin der bedeutendste
Eisenspeicher im Körper ist. Dazu bildet die Leber Apoferritin, das
Eisen reversibel bindet und so einen dynamischen Pool aufbaut.
Die Leber speichert zahlreiche Spurenelemente. Dazu gehört Eisen,
das als Ferritin gespeichert wird und neben Hämoglobin der bedeutendste
Eisenspeicher im Körper ist. Dazu bildet die Leber Apoferritin, das
Eisen reversibel bindet und so einen dynamischen Pool aufbaut. Zur Interaktion von Darm (Resorption), Leber (Speicherung), Knochenmark (Erythropoese), Milz (Ery-Abbau) und Nieren (Erythropoetin) s. auch dort
Zur Interaktion von Darm (Resorption), Leber (Speicherung), Knochenmark (Erythropoese), Milz (Ery-Abbau) und Nieren (Erythropoetin) s. auch dort
 Die Leber hat hohe oxidative Kapazität, vor allem in der peripheren
(sauerstoffreichen) Zone I ihrer Azini. So kann sie aus Lactat, das (insbesondere bei körperlicher Belastung) aus
Muskelzellen anflutet, Glucose aufbauen und diese der Muskulatur wieder
zur Verfügung
stellen (Cori-Zyklus). Weiters bildet die Leber aus Alanin und
Ketoglutarat
Glutamat (kann zu Harnstoff umgebaut werden) und Pyruvat (kann zur
Glucosesynthese herangezogen werden); im Muskel läuft die Reaktion in
die andere Richtung, so gelangt überschüssiger Stickstoff aus dem
Muskel (Glutamat / Alanin) über die Leber schließlich in den Harn (als
Harnstoff). Das benötigte Enzym ist in beiden Fällen Alanin-Aminotransferase (ALT), die als leberspezifisch gilt Die Leber hat hohe oxidative Kapazität, vor allem in der peripheren
(sauerstoffreichen) Zone I ihrer Azini. So kann sie aus Lactat, das (insbesondere bei körperlicher Belastung) aus
Muskelzellen anflutet, Glucose aufbauen und diese der Muskulatur wieder
zur Verfügung
stellen (Cori-Zyklus). Weiters bildet die Leber aus Alanin und
Ketoglutarat
Glutamat (kann zu Harnstoff umgebaut werden) und Pyruvat (kann zur
Glucosesynthese herangezogen werden); im Muskel läuft die Reaktion in
die andere Richtung, so gelangt überschüssiger Stickstoff aus dem
Muskel (Glutamat / Alanin) über die Leber schließlich in den Harn (als
Harnstoff). Das benötigte Enzym ist in beiden Fällen Alanin-Aminotransferase (ALT), die als leberspezifisch gilt Gluconeogenese dient dem Glucoseangebot (~200 g/d) vor allem für das Gehirn; Glykogenolyse wird durch Adrenalin und Glucagon angeregt (erhöhter Energiebedarf), durch Insulin gehemmt (postprandial); die Glykolyse (EMP-Weg) baut Glucose zu Pyruvat ab und bildet ATP / NADH. Aminosäuren,
Kohlenhydrate, Elektrolyte gelangen aus dem Extrazellulärraum mittels
Transportern in die Zelle, deren Synthese ist regulierbar. Der
Pentosephosphatweg betreibt Nukleotidsynthese und bildet
Reduktionsäquivalente (NADPH/H+). ß-Oxidation bedeutet Fettsäureabbau.
Der Harnstoffzyklus (Krebs-Henseleit) bildet Harnstoff aus
stickstoffhaltigen Abbauprodukten (Ammonium u.a.). Transaminierungen
transponieren α-Aminogruppen von Aminosäuren auf α-Ketosäuren.
Ketonkörper sind eine transportable Form des Acetyl-CoA
(Hungerstoffwechsel). Fettsäure-Synthase ermöglicht Lipogenese, der Mevalonatweg Cholesterinsynthese Gluconeogenese dient dem Glucoseangebot (~200 g/d) vor allem für das Gehirn; Glykogenolyse wird durch Adrenalin und Glucagon angeregt (erhöhter Energiebedarf), durch Insulin gehemmt (postprandial); die Glykolyse (EMP-Weg) baut Glucose zu Pyruvat ab und bildet ATP / NADH. Aminosäuren,
Kohlenhydrate, Elektrolyte gelangen aus dem Extrazellulärraum mittels
Transportern in die Zelle, deren Synthese ist regulierbar. Der
Pentosephosphatweg betreibt Nukleotidsynthese und bildet
Reduktionsäquivalente (NADPH/H+). ß-Oxidation bedeutet Fettsäureabbau.
Der Harnstoffzyklus (Krebs-Henseleit) bildet Harnstoff aus
stickstoffhaltigen Abbauprodukten (Ammonium u.a.). Transaminierungen
transponieren α-Aminogruppen von Aminosäuren auf α-Ketosäuren.
Ketonkörper sind eine transportable Form des Acetyl-CoA
(Hungerstoffwechsel). Fettsäure-Synthase ermöglicht Lipogenese, der Mevalonatweg Cholesterinsynthese Im Hungerzustand und unbehandeltem Diabetes mellitus produziert die Leber vermehrt (bis 20-fach) Ketonkörper (Ketose). ß-Oxy-Buttersäure und Acetessigsäure dienen vor allem dem Gehirn als alternative Energiequelle; Aceton hat diagnostische Bedeutung. Aus dem Fettgewebe kommen vermehrt Fettsäuren, aus der Muskulatur glucoplastische Aminosäuren Im Hungerzustand und unbehandeltem Diabetes mellitus produziert die Leber vermehrt (bis 20-fach) Ketonkörper (Ketose). ß-Oxy-Buttersäure und Acetessigsäure dienen vor allem dem Gehirn als alternative Energiequelle; Aceton hat diagnostische Bedeutung. Aus dem Fettgewebe kommen vermehrt Fettsäuren, aus der Muskulatur glucoplastische Aminosäuren Stickstoff wird zu >90%
über Harnstoff aus dem Körper entfernt (~900 mM N/d). Bei Azidose nimmt
über Glutamin / Glutamat / Ammonium die Ausscheidung von
Ammoniumchlorid (saure Valenzen) zu, gleichzeitig entsteht
Bicarbonat. Bei Alkalose wird die Ausscheidung von Harnstoff forciert,
die Ammoniumexkretion reduziert Stickstoff wird zu >90%
über Harnstoff aus dem Körper entfernt (~900 mM N/d). Bei Azidose nimmt
über Glutamin / Glutamat / Ammonium die Ausscheidung von
Ammoniumchlorid (saure Valenzen) zu, gleichzeitig entsteht
Bicarbonat. Bei Alkalose wird die Ausscheidung von Harnstoff forciert,
die Ammoniumexkretion reduziert Cholesterin
wird hauptsächlich über die Galle ausgeschieden. Hepatozyten bilden
daraus primäre Gallensalze (Cholat, Chenodesoxycholat), die mit Glyzin,
Sulfat, Glukuronat oder Taurin konjugiert
und in die Gallenkanälchen ausgeschieden werden. Monovalente
Gallensalze werden über den kanalikulären Gallensalz-Exporter (BSEP)
ausgeschieden, bivalente über die kanalikuläre Pumpe MRP2, zusammen mit
anderen Anionen. Phosphatidylcholin wird über den Phospholipid-Exporter
befördert, organische Kationen über den Multidrug-Exporter MDR1.
Gallensäuren werden im Ileum wieder resorbiert (ileal sodium / bile
transporter ISBT) Cholesterin
wird hauptsächlich über die Galle ausgeschieden. Hepatozyten bilden
daraus primäre Gallensalze (Cholat, Chenodesoxycholat), die mit Glyzin,
Sulfat, Glukuronat oder Taurin konjugiert
und in die Gallenkanälchen ausgeschieden werden. Monovalente
Gallensalze werden über den kanalikulären Gallensalz-Exporter (BSEP)
ausgeschieden, bivalente über die kanalikuläre Pumpe MRP2, zusammen mit
anderen Anionen. Phosphatidylcholin wird über den Phospholipid-Exporter
befördert, organische Kationen über den Multidrug-Exporter MDR1.
Gallensäuren werden im Ileum wieder resorbiert (ileal sodium / bile
transporter ISBT) |
