

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert


 Speicher-,
Transport-, Löslichkeitsfunktionen
Speicher-,
Transport-, Löslichkeitsfunktionen
 amphiphil: ἀμφί = beidseitig, φίλος = liebend
amphiphil: ἀμφί = beidseitig, φίλος = liebend| Etwa
15% des gesamten Blutvolumens (~750 ml, etwa gleich viel wie im gesamten Arteriensystem) befinden sich typischerweise
in den Gefäßen der Leber, bis zur Hälfte davon ist - z.B. bei
Lagewechsel des Körpers (Aufrichten) oder nach Blutverlust - mobilisierbar:
Die Gefäße - sonst weitgehend druckpassiv - kontrahieren stressbedingt
(Katecholaminausschüttung) und geben dadurch Blut an das Venensystem ab
(Entspeicherung, Kreislaufstabilisierung). Die Leber produziert Hepcidin, das die Resorption von Eisen im Darm hemmt, indem es Ferroportin an der Dünndarm-Mukosazelle blockiert. Diese physiologische "Eisenbremse" verhindert eine Überlastung des Organismus mit Eisen (Siderose), das praktisch nur durch Blutverlust aus dem Körper entfernt werden kann. Die Leber hält Kohlenhydrate (als Glykogen) und Aminosäuren (als Proteine) für Stunden bis Tage in Vorrat, und legt Langzeitspeicher von Vitaminen (Kobalamin bis zu mehreren Jahren) und Spurenelementen an. Im Fettstoffwechsel spielt die Leber eine mehrfache Rolle: Einerseits synthetisiert sie Apoproteine, die für den Transport von Lipiden im Extrazellulärraum benötigt werden; andererseits kann sie aus Fettsäuren Ketonkörper (zur "Notversorgung" im Hungerzustand) herstellen (Hepatozyten speichern normalerweise kein Fett, Ito-Zellen schon). Partikel im Blut für den Lipidtransport sind vor allem die kurzlebigen Chylomikronen (vorwiegend für Triglyzeride), VLDL, LDL und HDL (in dieser Reihenfolge nimmt die Verweildauer im Plasma zu, der Lipidanteil und Durchmesser der Partikel ab). |
 Vorwärts-Lipidtransport
Vorwärts-Lipidtransport  Reverser Lipidtransport
Reverser Lipidtransport  Speicherfunktionen
Speicherfunktionen
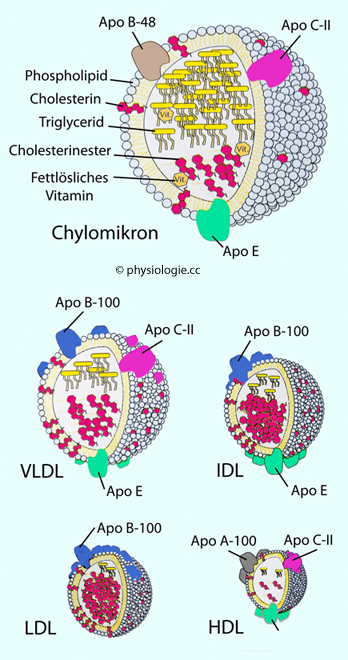
 Abbildung: Lipoproteine
Abbildung: Lipoproteine

 ) in Lipoprotein-Partikeln (
) in Lipoprotein-Partikeln (  Abbildung) transportiert
(die wegen des hohen Lipidanteils eigentlich Proteolipide heißen
müssten).
Abbildung) transportiert
(die wegen des hohen Lipidanteils eigentlich Proteolipide heißen
müssten).  (sowohl lipophile als auch hydrophile) Sequenzen und erfüllen mehrere
Aufgaben:
(sowohl lipophile als auch hydrophile) Sequenzen und erfüllen mehrere
Aufgaben: Apoproteine
Apoproteine stabilisieren die Struktur der Lipoproteinpartikel
stabilisieren die Struktur der Lipoproteinpartikel erhöhen die Lipidlöslichkeit und dienen so dem Lipidtransport im Blut
erhöhen die Lipidlöslichkeit und dienen so dem Lipidtransport im Blut wirken als Cofaktoren für lipidwirksame Enzyme
wirken als Cofaktoren für lipidwirksame Enzyme beteiligen sich an der Rezeptorbindung
beteiligen sich an der Rezeptorbindung 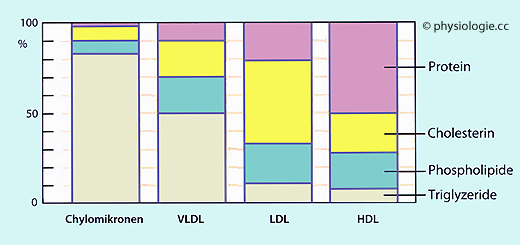
 Abbildung: Zusammensetzung von Lipidpartikeln
Abbildung: Zusammensetzung von Lipidpartikeln
| Werte nach verschiedenen Quellen kompiliert |
Chylo- mikronen |
VLDL |
LDL |
HDL |
| Durchmesser |
75-1200 nm |
30-80 nm |
18-25 nm |
50-120 nm |
| Dichte (g/l) |
<950 |
950 - 1006 |
1019 - 1063 |
1063 - 1210 |
| Masse (kDa) |
400.000 |
10.000 - 80.000 |
2300 |
175-360 |
| Führende(s) Lipid(e) |
Triglyzeride (Nahrung) |
endogene Triglyzeride (Leber) |
Cholesterin / Cholesterin- ester |
Cholesterin- ester und Phospho- lipide |
| Transportierte Lipide (Rest auf 100%: Proteine) |
85-92% TAG 4% PL 5% C/CE |
65% TAG 13% PL 10-20% C/CE |
45% C/CE 20% PL 10% TAG |
20-25% PL 15-20% CE 2% TAG |
| Apoproteine |
B48, AI/IV, C, E |
B100, C, E |
B100 | AI, AII, C, E |
| Proteinanteil (Oberfläche) |
1,5-2,5% |
5-10% |
20-25% |
40-55% |
| Verweildauer |
Minuten |
Stunden |
Tage |
|
| Bildungsort | Darm |
Leber |
||
| Funktion |
Transport im Darm resorbierter Lipide zu Muskel- und Fettzellen |
Interner Lipidtransport (Triglyzeride, Phospholipide, Cholesterin) |
Interner Lipidtransport nach Entfernung von Triglyzeriden aus VLDL durch Lipoprotein- lipase |
Abtransport von Cholesterin aus Peripherie in Richtung Leber (zwecks Ausscheidung) |
 Enzyme
(Lipoproteinlipase, hepatische Lipase, LCAT oder ACAT) für die Veränderung der
Lipide.
LCAT (Lecithin-Cholesterin Acyltransferase) verestert Cholesterin (Cholesterol) im Blut und macht es so besser löslich, ACAT
(Acyl-CoA-Cholesterin Acyltransferase)
verestert Fettsäuren und
Cholesterin (Cholesterol) im endoplasmatischen Retikulum. Bei dieser
Umesterung wird aus einem Triglycerid ein Acylrest abgespalten und mit
der OH-Gruppe von Cholesterin (Cholesterol) verestert;
Enzyme
(Lipoproteinlipase, hepatische Lipase, LCAT oder ACAT) für die Veränderung der
Lipide.
LCAT (Lecithin-Cholesterin Acyltransferase) verestert Cholesterin (Cholesterol) im Blut und macht es so besser löslich, ACAT
(Acyl-CoA-Cholesterin Acyltransferase)
verestert Fettsäuren und
Cholesterin (Cholesterol) im endoplasmatischen Retikulum. Bei dieser
Umesterung wird aus einem Triglycerid ein Acylrest abgespalten und mit
der OH-Gruppe von Cholesterin (Cholesterol) verestert;  Rezeptoren
wie z.B. der LDL-Rezeptor für die Aufnahme von Lipoproteinpartikeln. Der LDL-Rezeptor wird von den meisten
kernhaltigen Zellen exprimiert, ist aber in der Leber besonders aktiv.
Nach Bindung des LDL-Partikels wird der Komplex endozytiert,
Cholesterinester dann in Lysosomen hydrolysiert, das freie Cholesterin
dem zellulären Pool zugeschlagen und für die Harnsäuresynthese, den
Aufbau von LDL-Partikeln, den Aufbau von Membranmaterial (und in
hormonproduzierenden Zellen auch für die Steroidsynthese) verwendet.
Die Syntheserate neuer LDL-Rezeptoren sinkt mit der zellulären
Cholesterinkonzentration, und umgekehrt (Selbstlimitierung).
Rezeptoren
wie z.B. der LDL-Rezeptor für die Aufnahme von Lipoproteinpartikeln. Der LDL-Rezeptor wird von den meisten
kernhaltigen Zellen exprimiert, ist aber in der Leber besonders aktiv.
Nach Bindung des LDL-Partikels wird der Komplex endozytiert,
Cholesterinester dann in Lysosomen hydrolysiert, das freie Cholesterin
dem zellulären Pool zugeschlagen und für die Harnsäuresynthese, den
Aufbau von LDL-Partikeln, den Aufbau von Membranmaterial (und in
hormonproduzierenden Zellen auch für die Steroidsynthese) verwendet.
Die Syntheserate neuer LDL-Rezeptoren sinkt mit der zellulären
Cholesterinkonzentration, und umgekehrt (Selbstlimitierung).
 Abbildung: Lipidtransport - von der Leber, zur Leber
Abbildung: Lipidtransport - von der Leber, zur Leber ABCG1: ATP-Binding Cassette Transporter, befördern u.a. Cholesterin und Phospholipide durch die Zellmembran
ABCG1: ATP-Binding Cassette Transporter, befördern u.a. Cholesterin und Phospholipide durch die Zellmembran
 Apo, Apoprotein, das Lipid anlagern und extrazellulär transportieren kann
Apo, Apoprotein, das Lipid anlagern und extrazellulär transportieren kann
 CE, Cholesterinester (amphiphil)
CE, Cholesterinester (amphiphil)
 CETP,
Cholesterinester- Transferprotein, ein aus der Leber stammendes und ins
Blut abgegebenes (hier hauptsächlich an HDL gebundenes) Protein, das
Poren in Zellmembranen bildet und den Cholesterintransport unterstützt
CETP,
Cholesterinester- Transferprotein, ein aus der Leber stammendes und ins
Blut abgegebenes (hier hauptsächlich an HDL gebundenes) Protein, das
Poren in Zellmembranen bildet und den Cholesterintransport unterstützt
 FC, freies Cholesterin (nicht wasserlöslich
FC, freies Cholesterin (nicht wasserlöslich
 FFA, freie Fettsäuren (A = acid)
FFA, freie Fettsäuren (A = acid)
 HDL, High density lipoprotein
HDL, High density lipoprotein
 LCAT (Lezithin-Cholesterin- Acyltransferase) verestert Cholesterin (Cholesterol) im Blut und macht es so besser lipidlöslich
LCAT (Lezithin-Cholesterin- Acyltransferase) verestert Cholesterin (Cholesterol) im Blut und macht es so besser lipidlöslich
 LDL, Low density lipoprotein
LDL, Low density lipoprotein
 LPL, Lipoproteinlipase, spaltet Neutralfette von Lipoproteinen ab und macht sie für die Zellen verfügbar
LPL, Lipoproteinlipase, spaltet Neutralfette von Lipoproteinen ab und macht sie für die Zellen verfügbar
 SRB1, Scavenger receptor - nimmt im Zielgewebe Cholesterinester aus HDL auf
SRB1, Scavenger receptor - nimmt im Zielgewebe Cholesterinester aus HDL auf
 TG, Triglyzeride
TG, Triglyzeride
 VLDL, Very low density lipoprotein
VLDL, Very low density lipoprotein

 als Speicherfett (Adipozyten) oder
als Speicherfett (Adipozyten) oder 
 für Membran- und
Signalmoleküle verwendet (praktisch alle Zellen).
für Membran- und
Signalmoleküle verwendet (praktisch alle Zellen). verpackt,
wodurch ihre Löslichkeit bis um 6 Zehnerpotenzen ansteigt (Mizellen
sind einige Nanometer groß und sind Aggregate aneinandergelagerter
amphiphiler Moleküle, z.B. Phospholipide, in wässriger Lösung).
verpackt,
wodurch ihre Löslichkeit bis um 6 Zehnerpotenzen ansteigt (Mizellen
sind einige Nanometer groß und sind Aggregate aneinandergelagerter
amphiphiler Moleküle, z.B. Phospholipide, in wässriger Lösung).
 Abbildung: Verarbeitung von Chylomikronen, VLDL, IDL und LDL
Abbildung: Verarbeitung von Chylomikronen, VLDL, IDL und LDL
 ApoC zur Aktivierung der Lipoproteinlipase, die Neutralfette abspaltet und für die Zellen verfügbar macht
ApoC zur Aktivierung der Lipoproteinlipase, die Neutralfette abspaltet und für die Zellen verfügbar macht  ApoE - dieses vermittelt die Endozytose der Partikel in die Leber.
ApoE - dieses vermittelt die Endozytose der Partikel in die Leber. Hepatozyten packen Fette, die in die Leber gelangt sind und von ihr
nicht unmittelbar verwertet wurden, zusammen mit entsprechenden
Apoproteinen (
Hepatozyten packen Fette, die in die Leber gelangt sind und von ihr
nicht unmittelbar verwertet wurden, zusammen mit entsprechenden
Apoproteinen ( s. Tabelle) in VLDL-Partikel. VLDL bringen Triglyzeride, Phospholipide und Cholesterin von der Leber
zu peripherem Gewebe.
s. Tabelle) in VLDL-Partikel. VLDL bringen Triglyzeride, Phospholipide und Cholesterin von der Leber
zu peripherem Gewebe.  und Triglyzeriden zwischen Lipoproteinpartikeln).
und Triglyzeriden zwischen Lipoproteinpartikeln). 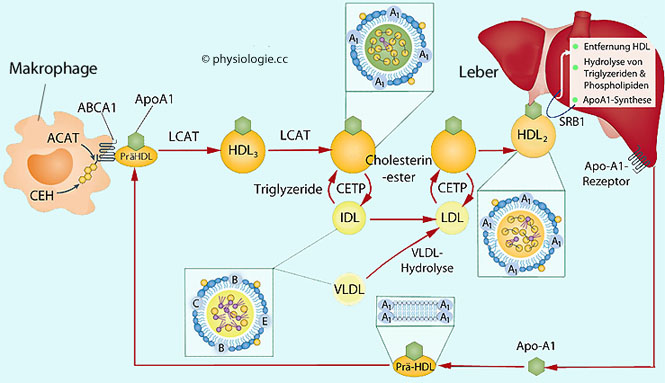
 Abbildung: ACAT und LCAT
Abbildung: ACAT und LCAT CEH = Cholesterinester- Hydrolase
CEH = Cholesterinester- Hydrolase
 CETP = Cholesterinester- Transferprotein
CETP = Cholesterinester- Transferprotein
 SRB1 = HDL-Docking-Rezeptor (Scavenger receptor class B-1)
SRB1 = HDL-Docking-Rezeptor (Scavenger receptor class B-1)
 Abbildung)
Abbildung) in der Zelle durch ACAT (Acetyl-CoA-Acetyltransferase) oder
in der Zelle durch ACAT (Acetyl-CoA-Acetyltransferase) oder
 im Blut durch LCAT (Lezithin-Cholesterin-, bildet aus Cholesterin und Lezithin
im Blut durch LCAT (Lezithin-Cholesterin-, bildet aus Cholesterin und Lezithin  Cholesterinester).
Cholesterinester).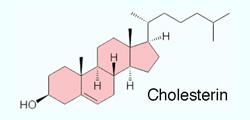 Cholesterin wird zum Teil mit der Nahrung zugeführt (maximale Resorptionskapazität ~0,5 g/d), zum Teil im Körper neu gebildet
(1-2 g/d - insgesamt ~20 enzymatische Stufen) - hauptsächlich von Leber- und Darmmukosazellen, aber auch
von anderen Zellen, so vom Gehirn für den Eigenbedarf (Cholesterin kann
die Blut-Hirn-Schranke schwer passieren).
Cholesterin wird zum Teil mit der Nahrung zugeführt (maximale Resorptionskapazität ~0,5 g/d), zum Teil im Körper neu gebildet
(1-2 g/d - insgesamt ~20 enzymatische Stufen) - hauptsächlich von Leber- und Darmmukosazellen, aber auch
von anderen Zellen, so vom Gehirn für den Eigenbedarf (Cholesterin kann
die Blut-Hirn-Schranke schwer passieren).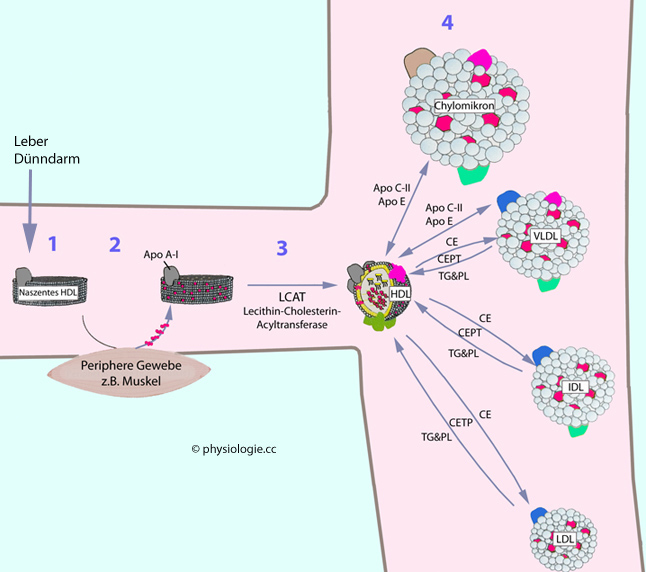

 Abbildung: Verarbeitung von HDL
Abbildung: Verarbeitung von HDL
 Cholesterin wird mittels HDL-Partikeln zur Leber
transportiert. Dieser
Lipidtransport wird als "Rückwärts- (reverser)
Transport" bezeichnet (Abbildungen):
HDL sammelt überschüssiges Cholesterin in der Peripherie ein und
transportiert es
Cholesterin wird mittels HDL-Partikeln zur Leber
transportiert. Dieser
Lipidtransport wird als "Rückwärts- (reverser)
Transport" bezeichnet (Abbildungen):
HDL sammelt überschüssiges Cholesterin in der Peripherie ein und
transportiert es
 zur Leber (Gallensäuren, Ausscheidung)
zur Leber (Gallensäuren, Ausscheidung) 
 oder zu Zellen, die Cholesterin benötigen (Steroidhormonsynthese).
oder zu Zellen, die Cholesterin benötigen (Steroidhormonsynthese). Lezithin-Cholesterin- (LCAT) - von der Leber gebildet, findet es sich im Blut auf der Oberfläche von HDL-Partikeln. Als "Cholesterinfänger"
nimmt es auch Phosphatidylcholin aus Chylomikronen, VLDL-Partikeln und
Membranresten auf und beteiligt sich an der Aufnahme von Cholesterin
aus extrahepatischen Geweben
Lezithin-Cholesterin- (LCAT) - von der Leber gebildet, findet es sich im Blut auf der Oberfläche von HDL-Partikeln. Als "Cholesterinfänger"
nimmt es auch Phosphatidylcholin aus Chylomikronen, VLDL-Partikeln und
Membranresten auf und beteiligt sich an der Aufnahme von Cholesterin
aus extrahepatischen Geweben  Phospholipid-Transferprotein (PLTP) wird von zahlreichen Geweben in das Blut abgegeben und beschleunigt die Diffusion von Lipiden in HDL-Partikel
Phospholipid-Transferprotein (PLTP) wird von zahlreichen Geweben in das Blut abgegeben und beschleunigt die Diffusion von Lipiden in HDL-Partikel  Cholesterinester-Transferprotein (CETP) stammt aus Leberzellen und vermittelt die Übertragung von Cholesterinestern von HDL- auf LDL- und VLDL-Partikel.
Cholesterinester-Transferprotein (CETP) stammt aus Leberzellen und vermittelt die Übertragung von Cholesterinestern von HDL- auf LDL- und VLDL-Partikel.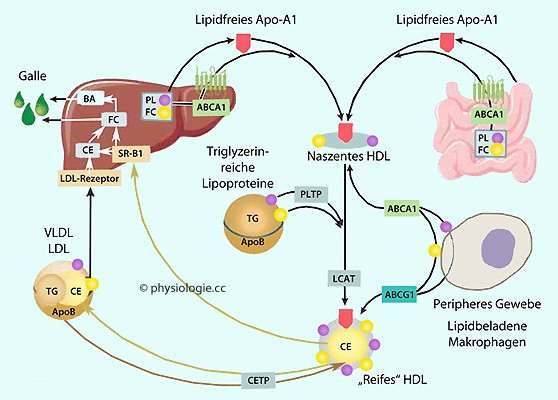
 Abbildung: HDL-Synthese und Cholesterintransport
Abbildung: HDL-Synthese und Cholesterintransport ABCG1, ATP binding cassette transporter G‐1
ABCG1, ATP binding cassette transporter G‐1
 BA, Gallensäuren
BA, Gallensäuren
 CE, Cholesterinester
CE, Cholesterinester
 CETP, Cholesterinester-Transferprotein
CETP, Cholesterinester-Transferprotein
 FC, freies Cholesterin
FC, freies Cholesterin
 LCAT, Lezithin- Cholesterin- Acyltransferase
LCAT, Lezithin- Cholesterin- Acyltransferase
 PL, Phospholipid
PL, Phospholipid
 PLTP, Phospholipid-Transferprotein
PLTP, Phospholipid-Transferprotein
 SR-B1, Scavenger-Rezeptor Klasse B1
SR-B1, Scavenger-Rezeptor Klasse B1
 TG, Triglyzerid
TG, Triglyzerid

 Synposis des Lipoprotein-processing s. dort
Synposis des Lipoprotein-processing s. dort können über verschiedene Zeiträume gespeichert und wieder verfügbar gemacht werden:
können über verschiedene Zeiträume gespeichert und wieder verfügbar gemacht werden:  Kurzzeitspeicherung von Blut in den Lebergefäßen (Sekunden bis Minuten).
Die Gefäße im Pfortadersystem verhalten sich druckpassiv, sie zeigen keine Autoregulation: Bei verringerter
Perfusion (sinkende Füllung von arterieller Seite) nimmt ihre Dehnung ab, sie werden enger und
reduzieren die in ihnen gespeicherte Blutmenge (→ DeJager-Krogh-Mechanismus).
Kurzzeitspeicherung von Blut in den Lebergefäßen (Sekunden bis Minuten).
Die Gefäße im Pfortadersystem verhalten sich druckpassiv, sie zeigen keine Autoregulation: Bei verringerter
Perfusion (sinkende Füllung von arterieller Seite) nimmt ihre Dehnung ab, sie werden enger und
reduzieren die in ihnen gespeicherte Blutmenge (→ DeJager-Krogh-Mechanismus). Die Leber enthält ~15% des gesamten Blutvolumens des Kreislaufs. Das hat wichtige Konsequenzen für eine allfällige Mobilisierbarkeit für kardiovaskuläre Notfälle: Etwa die Hälfte davon (350-400 ml bei 5 Liter Blutvolumen!) kann mobilisiert werden, z.B. bei
starkem Blutverlust.
Die Leber enthält ~15% des gesamten Blutvolumens des Kreislaufs. Das hat wichtige Konsequenzen für eine allfällige Mobilisierbarkeit für kardiovaskuläre Notfälle: Etwa die Hälfte davon (350-400 ml bei 5 Liter Blutvolumen!) kann mobilisiert werden, z.B. bei
starkem Blutverlust.  Speicherung
von Kohlenhydraten (als Glykogen) und Aminosäuren (als Proteine) in den
Leberzellen (Stunden bis Tage). Die Speicherung in der Form von
Makromolekülen hat den Vorteil, dass es zu keiner merklichen Auswirkung
auf den osmotischen Druck in den Leberzellen kommt (wenige Makromoleküle statt vieler Glucosemoleküle).
Speicherung
von Kohlenhydraten (als Glykogen) und Aminosäuren (als Proteine) in den
Leberzellen (Stunden bis Tage). Die Speicherung in der Form von
Makromolekülen hat den Vorteil, dass es zu keiner merklichen Auswirkung
auf den osmotischen Druck in den Leberzellen kommt (wenige Makromoleküle statt vieler Glucosemoleküle). s. auch dort
s. auch dort Langzeitspeicherung
von Vitaminen (A, D, K, B12
- letzteres bis zu 3-5 Jahre) und Spurenelementen.
Fettlösliche Vitamine werden im Darm in Chylomikronen oder VLDLs
verpackt und so der Leber zugeführt (z.B. VitA in der Form von
Retinylestern, ansonsten bleibt das Vitamin im Kreislauf, gebunden an
RBP - retinolbindendes Protein).
Langzeitspeicherung
von Vitaminen (A, D, K, B12
- letzteres bis zu 3-5 Jahre) und Spurenelementen.
Fettlösliche Vitamine werden im Darm in Chylomikronen oder VLDLs
verpackt und so der Leber zugeführt (z.B. VitA in der Form von
Retinylestern, ansonsten bleibt das Vitamin im Kreislauf, gebunden an
RBP - retinolbindendes Protein).
 Abbildung: Beteiligung der Leber an der Regulierung des Eisenmetabolismus
Abbildung: Beteiligung der Leber an der Regulierung des Eisenmetabolismus Die Leber produziert u.a. Hepcidin, welches die Resorption von Eisen im Darm hemmt. Es tut dies, indem es an Ferroportin
bindet und dessen Hilfsfunktion bei der "Umlagerung" des Eisens von der
Dünndarm-Mukosazelle auf Transferrin blockiert.
Die Leber produziert u.a. Hepcidin, welches die Resorption von Eisen im Darm hemmt. Es tut dies, indem es an Ferroportin
bindet und dessen Hilfsfunktion bei der "Umlagerung" des Eisens von der
Dünndarm-Mukosazelle auf Transferrin blockiert. 
 Lipide werden
in Lipoprotein-Partikeln transportiert. Der Triglyzeridanteil nimmt mit
deren zunehmender Dichte (Chylomikronen 80-90% → HDL <10%) ab, der
Proteinanteil zu; LDL ist die cholesterinreichste Fraktion. Apoproteine
werden zum Großteil in der Leber gebildet, einige in der
Darmschleimhaut, wo auch die Verpackung von Lipiden in Chylomikronen (bis 1 µm Durchmesser, Dichte <1 g/l) stattfindet.
Diese bringen vorwiegend Neutralfette in die Peripherie Lipide werden
in Lipoprotein-Partikeln transportiert. Der Triglyzeridanteil nimmt mit
deren zunehmender Dichte (Chylomikronen 80-90% → HDL <10%) ab, der
Proteinanteil zu; LDL ist die cholesterinreichste Fraktion. Apoproteine
werden zum Großteil in der Leber gebildet, einige in der
Darmschleimhaut, wo auch die Verpackung von Lipiden in Chylomikronen (bis 1 µm Durchmesser, Dichte <1 g/l) stattfindet.
Diese bringen vorwiegend Neutralfette in die Peripherie Der Lipidtransfer von Darm und Leber in Richtung Peripherie wird als Vorwärts-Transport bezeichnet, der von Cholesterin zur Leber als Rückwärts-Transport. Der Vorwärts-Transport
versorgt periphere Zellen vor allem mit Triglyzeriden, Fettsäuren und
Cholesterin. Chylomikronen werden von
Lymphgefäßen aufgenommen, größere
von der Leber zunächst nicht verwertet, da sie zu groß sind, um in den
Disse-Raum zu gelangen (Porengröße der Lebersinusoide ~0,4 µm). Kleinere Bruchstücke (remnants) werden über ApoE-Rezeptoren von Hepatozyten aufgenommen und abgebaut.Chylomikronen
nehmen im Kreislauf Apolipoproteine von HDL-Partikeln
auf: ApoC zur Aktivierung der Lipoproteinlipase, ApoE vermittelt die
hepatische Endozytose. Leberzellen packen nicht unmittelbar verwertbare
Fette mittels Apoproteinen in VLDL-Partikel und exportieren diese in
den Kreislauf Der Lipidtransfer von Darm und Leber in Richtung Peripherie wird als Vorwärts-Transport bezeichnet, der von Cholesterin zur Leber als Rückwärts-Transport. Der Vorwärts-Transport
versorgt periphere Zellen vor allem mit Triglyzeriden, Fettsäuren und
Cholesterin. Chylomikronen werden von
Lymphgefäßen aufgenommen, größere
von der Leber zunächst nicht verwertet, da sie zu groß sind, um in den
Disse-Raum zu gelangen (Porengröße der Lebersinusoide ~0,4 µm). Kleinere Bruchstücke (remnants) werden über ApoE-Rezeptoren von Hepatozyten aufgenommen und abgebaut.Chylomikronen
nehmen im Kreislauf Apolipoproteine von HDL-Partikeln
auf: ApoC zur Aktivierung der Lipoproteinlipase, ApoE vermittelt die
hepatische Endozytose. Leberzellen packen nicht unmittelbar verwertbare
Fette mittels Apoproteinen in VLDL-Partikel und exportieren diese in
den Kreislauf Cholesterin
wird zum Teil mit der Nahrung zugeführt (maximal ~0,5 g/d), zum Teil im
Körper (Leber, Darm, Gehirn..) neu gebildet (1-2 g/d). HDL sammelt Cholesterin in der Peripherie ein und transportiert es zur Leber (Rückwärts-Transport) oder zu Zellen, die es benötigen (Steroidhormonsynthese). LDL-Partikel
sind ein rasch verfügbarer
Cholesterinpool und verweilen einige Tage im Blut. Cholesterin ist in veresterter Form mobiler, die Veresterung erfolgt intrazellulär durch ACAT, im Blut durch LCAT - dieses erzeugt einen hydrophoben HDL-Kern. Cholesterin wandert über ABC-Transportproteine der Zellmembran in das Blut und dann über HDL zur Leber, die es via HDL-Rezeptoren aufnimmt. Cholesterin muss nicht abgebaut werden, es wird in Form von Gallensäuren und in abgeschilfertem Darmepithel ausgeschieden Cholesterin
wird zum Teil mit der Nahrung zugeführt (maximal ~0,5 g/d), zum Teil im
Körper (Leber, Darm, Gehirn..) neu gebildet (1-2 g/d). HDL sammelt Cholesterin in der Peripherie ein und transportiert es zur Leber (Rückwärts-Transport) oder zu Zellen, die es benötigen (Steroidhormonsynthese). LDL-Partikel
sind ein rasch verfügbarer
Cholesterinpool und verweilen einige Tage im Blut. Cholesterin ist in veresterter Form mobiler, die Veresterung erfolgt intrazellulär durch ACAT, im Blut durch LCAT - dieses erzeugt einen hydrophoben HDL-Kern. Cholesterin wandert über ABC-Transportproteine der Zellmembran in das Blut und dann über HDL zur Leber, die es via HDL-Rezeptoren aufnimmt. Cholesterin muss nicht abgebaut werden, es wird in Form von Gallensäuren und in abgeschilfertem Darmepithel ausgeschieden  Die Leber
speichert Kohlenhydrate als Glykogen und Aminosäuren als Proteine. Das
hat den Vorteil geringer Molekülzahl, sodass die Leberzellen keinem
osmotischen Stress unterliegen. Vorräte in der Leber helfen, Zufuhrlücken zu
überbrücken (saisonale Schwankungen verfügbarer
Nahrungsmittel, Vitamine, Spurenelemente). Die
Leber produziert Hepcidin, das die intestinale Eisenresorption hemmt,
indem es an Ferroportin bindet und damit die Eisenbeladung von
Transferrin blockiert. Sauerstoffmangel hemmt die Hepcidinbildung,
fördert die Eisenresorption und erhöht die Sauerstofftransportkapazität des Blutes Die Leber
speichert Kohlenhydrate als Glykogen und Aminosäuren als Proteine. Das
hat den Vorteil geringer Molekülzahl, sodass die Leberzellen keinem
osmotischen Stress unterliegen. Vorräte in der Leber helfen, Zufuhrlücken zu
überbrücken (saisonale Schwankungen verfügbarer
Nahrungsmittel, Vitamine, Spurenelemente). Die
Leber produziert Hepcidin, das die intestinale Eisenresorption hemmt,
indem es an Ferroportin bindet und damit die Eisenbeladung von
Transferrin blockiert. Sauerstoffmangel hemmt die Hepcidinbildung,
fördert die Eisenresorption und erhöht die Sauerstofftransportkapazität des Blutes |
