

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert

Ernährung und Verdauungssystem

 Resorption
Resorption
© H. Hinghofer-Szalkay
 Amylopektin: ἄμυλον = Stärke, πηκτός = geronnen
Amylopektin: ἄμυλον = Stärke, πηκτός = geronnen
funikuläre Myelose: funiculus = dünnes Seil (Strang), μυελός = Mark
Lieberkühn'sche Krypten: Johann Nathanael Lieberkühn
Mizelle: mica = Klümpchen, kleiner Bissen
perniziöse Anämie: pernicies = das Verderben, αν-αἷμα = ohne Blut
Resorption: sorbere (lat) = zu sich nehmen, schlucken, verzehren
Zöliakie: κοιλία = Bauch, Unterleib
Der
obere Dünndarm (Jejunum) resorbiert die
meisten Nährstoffe. Eisen und Calcium werden bereits im Duodenum, Gallensäuren und Vitamin B12
erst im terminalen Ileum (dieses dient ansonsten als
Resorptionsreserve) aufgenommen. Die Resorptionsoberfläche des Dünndarms (als glattes Darmrohr
ca. 0,3 m2) wird durch Falten und Zotten, vor allem aber durch Mikrovilli auf insgesamt ~200 Quadratmeter vergrößert.
Lipophile Substanzen werden von Zellmembranen direkt resorbiert,
wasserlösliche über Transportmechanismen.
Kohlenhydrate zum Beispiel werden von Darmepithelzellen mittels Cotransport mit Natrium (SGLT, sodium glucose transporter;
GLUT, Glucosetransporter) aufgenommen. Proteine werden zunächst im
Darmlumen enzymatisch aufgespalten und Oligopeptide / Aminosäuren
anschließend über spezielle Transportsysteme resorbiert.
Langkettige Fettsäuren, Cholesterin, Lezithin etc
binden nach ihrer Aufnahme in die Darmepithelzelle an Trägerproteine,
werden zu Triglyceriden, Phospholipiden und Cholesterinestern
zurückverwandelt und an Apoproteine gekoppelt. Die so entstandenen
Chylomikronen und VLDL-Partikel gelangen schließlich in
Extrazellulärraum, Lymphgefäße und venöses Blut. Kurz- bis mittelkettige Fettsäuren und Glycerin kommen hingegen in den Pfortaderkreislauf und direkt zur Leber.
Auch für die Aufnahme von Mineralen, Spurenelementen und Vitaminen gibt es mehr oder weniger spezifische Transportmechanismen.
|
Resorption, Kapazität, Bioverfügbarkeit  Lipide
Lipide  Kohlenhydrate
Kohlenhydrate  Aminosäuren und Peptide
Aminosäuren und Peptide  Wasser & Elektrolyte
Wasser & Elektrolyte
 Kochsalz
Kochsalz  Kalium
Kalium  Calcium und Phosphat
Calcium und Phosphat  Eisen
Eisen  Kobalamin, Folat
Kobalamin, Folat  Steuerung der Ionenresorption
Steuerung der Ionenresorption  Klinik
Klinik
 Resorption
Resorption
 Praktische Aspekte
Praktische Aspekte  Core messages
Core messages
Dünn-
und Dickdarm sind sich strukturell und funktionell teils sehr ähnlich,
zeigen aber auch Spezialisierungen. Diese finden sich auch im Vergleich
zwischen Zotten (villi intestinales, resorbierend und sekretorisch) und
Lieberhühn'schen Krypten  (glandulae intestinales, hauptsächlich sekretorisch aktiv) im Dünndarm.
Flüssigkeit und Elektrolyte werden von der gesamten Länge des Darmes
effizient resorbiert, Nährstoffe hingegen praktisch nur im Dünndarm.
(glandulae intestinales, hauptsächlich sekretorisch aktiv) im Dünndarm.
Flüssigkeit und Elektrolyte werden von der gesamten Länge des Darmes
effizient resorbiert, Nährstoffe hingegen praktisch nur im Dünndarm.
Resorptionskapazität und Bioverfügbarkeit
 Unter Resorption
Unter Resorption  (absorption)
versteht man die biologische Aufnahme von Stoffen, insbesondere im
Darmtrakt (z.B. Aufnahme von Aminosäuren aus dem Chymus über das
Dünndarmepithel), auch gegen ein Konzentrationsgefälle. Als Rückresorption bezeichnet
man die Wiederaufnahme von Stoffen, die bereits ein oder mehrere
Kompartiment(e) des Körpers durchlaufen haben (z.B. die Rückresorption
filtrierter Glucose in der Niere).
(absorption)
versteht man die biologische Aufnahme von Stoffen, insbesondere im
Darmtrakt (z.B. Aufnahme von Aminosäuren aus dem Chymus über das
Dünndarmepithel), auch gegen ein Konzentrationsgefälle. Als Rückresorption bezeichnet
man die Wiederaufnahme von Stoffen, die bereits ein oder mehrere
Kompartiment(e) des Körpers durchlaufen haben (z.B. die Rückresorption
filtrierter Glucose in der Niere).
Über
den Darm werden Wasser, Energieträger (vor allem Kohlenhydrate, Fette
und Proteine) und weitere essentielle (Mineralien, Spurenelemente,
Vitamine) sowie nicht-essentielle Stoffe aufgenommen - fallweise auch Medikamente (Pharmaka) und Giftstoffe (Toxine).
Die Resorptionskapazität des
Darms (für Kohlenhydrate, Fette, Proteine u.a.) ist so hoch, dass sie
praktisch nie überschritten wird. Das zeigt, dass unser
gastrointestinales System auf Situationen ausgelegt ist, wo zwischen
langen Hungerperioden ab und zu plötzliches Überangebot (Schlagen einer
Beute) liegt und zum Anlegen von Reserven maximal genutzt werden muss.
Das macht auch verständlich, warum kontinuierliche Verfügbarkeit von
Nahrung bei vielen Menschen zur Entwicklung von Übergewicht führt.

 Abbildung: Flüssigkeitsbilanz im Gastrointestinaltrakt
Nach: Boron / Boulpaep, Medical Physiology, 1st ed. Saunders 2003
Abbildung: Flüssigkeitsbilanz im Gastrointestinaltrakt
Nach: Boron / Boulpaep, Medical Physiology, 1st ed. Saunders 2003
Von
ca. 8-9 Litern Flüssigkeit, die dem Dünndarm täglich angeboten werden
(6-7 Liter davon sind körpereigene Sekrete: Speichel, Magensaft etc),
resorbiert er 6-7 l/d. Die restlichen ~2 l/d resorbiert der Dickdarm
fast vollständig, mit dem Stuhl gehen nur etwa 0,1 l Wasser pro Tag
verloren.
Mengenmäßig
führende Elektrolyte sind Natrium, Chlorid (Kochsalz wird resorbiert),
Kalium (Resorption im Dünndarm, Sekretion im Dickdarm) und Bicarbonat,
das (netto) in den Dünndarm sezerniert wird.
Links: Sekretion in das, rechts: Resorption aus dem Darmlumen
 Über Volumen- und Elektrolytbilanzen im Darm s. auch dort
Über Volumen- und Elektrolytbilanzen im Darm s. auch dort

Die Resorption all dieser Stoffe erfolgt über meist sehr genau
definierte Mechanismen und Wege. Die für die Aufnahme verfügbaren
Zellen sind die Mucosazellen,
welche die innere Oberfläche des Darmes (Darmschleimhaut, Mucosa)
auskleiden. Dabei können Stoffe über die an das Darmlumen angrenzende apikale (luminale) Membran in die Mucosazelle aufgenommen und über deren basolaterale Membran
an das darunterliegende Interstitium und dann in die Blut-oder
Lymphbahn weitergereicht werden.

Zur
apikalen /
basolateralen Membran s.
dort
Einige Stoffe (Salze, Wasser) schaffen
es auch zwischen den Mucosazellen, durch das dort vorhandene
Abdichtungssystem (tight junctions). Diese Vorgänge ähneln übrigens stark denen in den Tubuli der Niere, wo ja auch - zunächst glomerulär filtrierte - Stoffe resorbiert werden.
Aufnahmelimit: Die Transportkapazität
dieser Resorptionsprozesse hat jeweils eine Obergrenze, bedingt durch
die vorhandene Größe der Schleimhaut und deren molekulare
Beförderungslimits. Bei körperlicher Ruhe
(und Indifferenztemperatur) beträgt der durchschnittliche Energieumsatz
pro Stunde ungefähr 0,4 MJ; bei schwerer körperlicher Arbeit kann sich
dieser Wert bis zu verdreifachen. Die maximale Resorptionskapazität des
Darms korrespondiert mit den Bedarfswerten.
Dschungeltraining benötigt rund 20 MJ/d
(der Aufwand kann durch Resorption von Nährstoffen gerade gedeckt
werden), Teilnehmer der Tour de France verbrauchen ~30 MJ/d und begeben
sich damit in ein Energiedefizit - die enterische Resorption kommt mit
dem Bedarf nicht mit, die Energiereserven des Körpers werden angegriffen.
Das Mindestmaß an Energieverbrauch einer durchschnittlichen erwachsenen
Person (liegende Position, Körperruhe, Indifferenztemperatur) beträgt
etwa 7,5 MJ/d. Dieser Aufwand ist für das Leben unmittelbar
erforderlich und nicht für zusätzliche Leistungen - beispielsweise
Muskelarbeit - verfügbar. Die Differenz (12,5 MJ/d) zum Aufnahmelimit
(20 MJ/d) ist hingegen "disponierbar" und wird als Controllable Amount of Energy (CAEN) bezeichnet.
 Die wichtigsten Energieverbraucher sind die aktive Muskulatur, das Gehirn und das Immunsystem.
Die wichtigsten Energieverbraucher sind die aktive Muskulatur, das Gehirn und das Immunsystem.
Die Aufnahme von Stoffen
(Absorption, Resorption) aus dem Darmlumen erfolgt in Abhängigkeit von
Größe und Art der Moleküle oder Ionen, aus denen der Stoff besteht.
 So
können sich apolare (fettlösliche = lipophile) Stoffe in der Membran der Darmschleimhautzellen leicht lösen und diese durchdringen;
So
können sich apolare (fettlösliche = lipophile) Stoffe in der Membran der Darmschleimhautzellen leicht lösen und diese durchdringen;
 kleine (bis ~4 nm Durchmesser, entsprechend ≤200 D Molekulargewicht) polare (wasserlösliche = hydrophile) passieren "Poren" der Zellmembran;
kleine (bis ~4 nm Durchmesser, entsprechend ≤200 D Molekulargewicht) polare (wasserlösliche = hydrophile) passieren "Poren" der Zellmembran;
 größere
polare Moleküle (>4 nm) sind für die transmembranale Passage auf Proteine angewiesen, welche für den
Stoff komplexe "Kanäle" ausbilden.
größere
polare Moleküle (>4 nm) sind für die transmembranale Passage auf Proteine angewiesen, welche für den
Stoff komplexe "Kanäle" ausbilden.
Das geschieht
 entweder transmembranalentsprechend der
Konzentrationsdifferenz des Stoffes (Diffusion); oder
entweder transmembranalentsprechend der
Konzentrationsdifferenz des Stoffes (Diffusion); oder
 im Cotransport mit einer
anderen Substanz, für die ein solches Konzentrationsgefälle besteht
(Symport); oder
im Cotransport mit einer
anderen Substanz, für die ein solches Konzentrationsgefälle besteht
(Symport); oder
 im Austausch mit einem solchen Stoff in der
Gegenrichtung (Antiport); oder
im Austausch mit einem solchen Stoff in der
Gegenrichtung (Antiport); oder
 direkt energieverbrauchend mittles einer
Membran-"Pumpe" (wie die Na-K-induzierte ATPase).
direkt energieverbrauchend mittles einer
Membran-"Pumpe" (wie die Na-K-induzierte ATPase).
 Substanzen können auch
zwischen den Epithelzellen (parazellulär) durch die Schleimhaut
gelangen - eine eingeschränkte Option, weil die verfügbare
Oberfläche sehr klein ist (höchstens 1% im Vergleich zur verfügbaren Zellmembranfläche) - oder auch
Substanzen können auch
zwischen den Epithelzellen (parazellulär) durch die Schleimhaut
gelangen - eine eingeschränkte Option, weil die verfügbare
Oberfläche sehr klein ist (höchstens 1% im Vergleich zur verfügbaren Zellmembranfläche) - oder auch
 mit Hilfe spezieller
Transportmechanismen der M-Zellen, von wo aus der Weg über die Darmlymphe offensteht.
mit Hilfe spezieller
Transportmechanismen der M-Zellen, von wo aus der Weg über die Darmlymphe offensteht.

 Abbildung: Übersicht der Verdauungs- und Resorptionsmechanismen
Abbildung: Übersicht der Verdauungs- und Resorptionsmechanismen
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Der Abbau von Nährstoffen kann im Lumen, am Bürstensaum (Microvilli) und in den Mucosaepithelzellen erfolgen.
Die apikale Membran der resorbierenden Mucosazellen (insbesondere im
Dünndarm) trägt an ihrer Außenseite (luminal) eine etwa 0,3 µm dicke
Glykokalyx-Schichte, an der u.a. Enzyme zum endgültigen Aufschließen
von Kohlendydraten und Peptiden befestigt sind.
 Die maximale Kapazität für die Stoffaufnahme über das gastrointestinale System
liegt meist deutlich über den durchschnittlich auftretenden Werten (funktionelle Reserve), zum Beispiel:
Die maximale Kapazität für die Stoffaufnahme über das gastrointestinale System
liegt meist deutlich über den durchschnittlich auftretenden Werten (funktionelle Reserve), zum Beispiel:

Die Resorptionskapazität für
Wasser im Darm einer erwachsenen Person liegt bei etwa 1 Liter pro Stunde
- der tägliche Bedarf (Getränke + Wasser in "fester" Nahrung) liegt bei
1-2 l/d, bei erhöhtem Verlust (Schwitzen!) kann sich diese Zahl
vervielfachen.

Der Darm kann ein Mehrfaches des täglichen
Glucosebedarfs
(~300 g/d) resorbieren, auch hohe Mengen von Süßigkeiten können so vom
Dünndarm verarbeitet werden (Anlegen von Fettdepots).

Für
Aminosäuren liegt der Wert bei ~600 g (Bedarf ~60 g/d).

Bis zu 4000 mg
Cholesterin
können pro Tag aufgenommen werden (eine an Fleisch, Eiern und Innereien
reiche Kost liefert bis zu ~1000 mg/d, der Bedarf liegt bei ~200 mg/d
oder weniger).

Die Resorptionskapazität für
Eisen liegt bei etwa 12 mg/d (Bedarf 1-2 mg/d), die Aufnahme ist mehrfach
reguliert.
Zu berücksichtigen ist dabei, dass diese Werte unter Laborbedingungen
ermittelt wurden und nur unter entsprechenden Begleitbedingungen
gelten. In der angewandten Situation kann die gastrointestinale
Aufnahmekapazität - bedingt durch Wechselwirkungen, zeitliche
Anpassungen etc - auf längere Zeit durchaus überfordert sein, auch wenn
die individuellen Labordaten im Einzelfall höhere Resorptionsquoten
suggerieren.
Die meisten Nährstoffe werden im Jejunum resorbiert; Eisen und Calcium bereits im Zwölffingerdarm (Duodenum); Vitamin B12
und Gallensäuren erst ganz am Ende des Dünndarms (terminales Ileum).
Das Ileum stellt für die Resorption der meisten Nährstoffe eine
Reserveoberfläche dar.


Abbildung: Dünn- und Dickdarm
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Der Dünndarm (links)
verfügt über Zotten und Krypten; er resorbiert die meisten
Nahrungskomponenten, spätdistal vor allem gallensaure Salze, Magnesium,
Vitamin B12 und
intrinsic factor. Der Dickdarm (rechts) hat eine durchgehende Epitheloberfläche mit eingestreuten Krypten; er resorbiert vorwiegend Wasser und Elektrolyte.
Stamm- bzw. Vorläuferzellen dienen dem Ersatz an der Zottenspitze bzw.
im Colonepithel abgeschilferter Zellen (Durchlaufzeit 48-92 Stunden).
Andere Zellen sind spezialisiert (Epithelzellen zur Resorption,
Becherzellen zur Schleimbildung; endokrine Zellen bilden
Verdauungshormone, Paneth-Zellen in der Tiefe der Krypten des Dünndarms wirken antibiotisch)

Für die Resorption von oral verabreichten Wirkstoffen ist das Konzept der Bioverfügbarkeit
besonders wichtig: Dies ist der Anteil eines Stoffes (Medikaments), der nach seiner
Resorption unverändert im Kreislauf ankommt ('first pass'
ist die Passage durch die Leber nach enterischer Resorption - dabei
werden zahlreiche Stoffe metabolisiert und in ihrer Wirksamkeit
verändert). Die Bioverfügbarkeit wird durch Faktoren wir
Darmdurchblutung,
Darmmotilität, pH im Magen, und enzymatischen Ab- bzw. Umbau in Darm
und Leber beeinflusst.
Diese Faktoren sind individuell verschieden
ausgeprägt, daher unterscheidet sich auch die Bioverfügbarkeit einer
bestimmten Substanz von Mensch zu Mensch (individualisierte, "personalisierte" Medizin) und von Situation zu Situation
(z.B. erkrankungsabhängig).
Zur
Resorbierbarkeit müssen Substanzen entweder lipophil sein (sie können
dann Zellmembranen leicht durchdringen) oder es müssen eigene
Transportmechanismen vorhanden sein. Bei einem Dissoziationssystem
bestimmt der pK-Wert die Verteilung dissoziierter und undissoziierter
Moleküle (wenn pK = pH, liegt Gleichverteilung vor). Schwache Säuren
oder Basen werden partiell resorbiert, starke Säuren -
pK<3 - und starke Basen - pK>10 - kaum (deshalb kann
z.B. mit Curare erlegte Beute ohne weitere Folgen verzehrt werden - Giftpfeile südamerikanischer Ureinwohner!).
 Die Resorption von Nährstoffen erfolgt zum Großteil im Dünndarm (Duodenum, Jejunum, Ileum). Magen (Alkohol, einige Medikamente) und Dickdarm
(Flüssigkeit, Elektrolyte, sowie einige Fettsäuren aus bakteriellem
Abbau von Kohlenhydraten und Proteinen, die nicht im Dünndarm
resorbiert wurden) haben einen geringeren Anteil daran.
Die Resorption von Nährstoffen erfolgt zum Großteil im Dünndarm (Duodenum, Jejunum, Ileum). Magen (Alkohol, einige Medikamente) und Dickdarm
(Flüssigkeit, Elektrolyte, sowie einige Fettsäuren aus bakteriellem
Abbau von Kohlenhydraten und Proteinen, die nicht im Dünndarm
resorbiert wurden) haben einen geringeren Anteil daran.
Die funktionell wirksamen resorbierenden Oberflächen sind sehr unterschiedlich (Werte für Erwachsene):
| Mundhöhle |
0,02 m2 |
| Magen |
0,1 - 0,3 m2 |
| Dünndarm |
~200 m2
(100-300) |
| Dickdarm |
0,5 - 1,0 m2 |
| Rectum |
0,04 - 0,07 m2 |
Die Resorptionsfläche ist im Dünndarm bei weitem die größte. Je
schneller Chymus aus dem Magen in Duodenum und Jejunum weitergelangt,
desto rascher können Stoffe zügig resorbiert werden (das gilt auch für
Pharmaka - diese werden vor allem im Dünndarm aufgenommen).
Nahrungsaufnahme kann die Magenentleerung
verzögern und so auch die Resorption gleichzeitig aufgenommener
Arzneimittel verzögern.
Die Wirkung der zahlreichen Einflussfaktoren
auf das Tempo des Weitertransports (Magen → Duodenum) sind oft
schwer abschätzbar. Erfolgt die Einnahme auf nüchternen Magen,
verringert sich diese Unsicherheit, und das Pharmakon gelangt zügig in
den Kreislauf (allerdings kann es sein, dass darunter die
Verträglichkeit leidet).
Die Passagezeit im Dünndarm hängt von zahlreichen Faktoren ab, als Durchschnittswert können 7 Stunden angenommen werden.
 Zum "First-pass-Effekt" s. dort
Zum "First-pass-Effekt" s. dort
Über die gesamte Strecke des Dünndarms werden Zucker, Aminosäuren, Peptide, Fettsäuren, Salze, Spurenelemente und Vitamine resorbiert. Besonders intensiv ist
 "Spezialisiert" ist das Jejunum für die Aufnahme von kurzen (Di-, Tri-)Peptiden, Vitamin C und Phosphat;
"Spezialisiert" ist das Jejunum für die Aufnahme von kurzen (Di-, Tri-)Peptiden, Vitamin C und Phosphat;
 das Ileum für die Aufnahme von Vitamin B12 und (aber nicht ausschließlich) Gallensalzen.
das Ileum für die Aufnahme von Vitamin B12 und (aber nicht ausschließlich) Gallensalzen.
 Zu Fetten s. auch dort
Zu Fetten s. auch dort
Gallensäuren werden zunächst von der Leber aus Cholesterin gebildet (etwa 600 mg pro Tag: "primäre Gallensäuren": Cholsäure, Chenodesoxycholsäure) und mit Glycin oder Taurin konjugiert, was konjugierte Gallensäuren - auch als gallensaure Salze
bezeichnet - ergibt, die vom Hepatozyten sezerniert werden.
Unkonjugierte Gallensäuren haben einen pK-Wert zwischen 5 und 6,5; die
konjugierten Formen haben niedrigere pK-Werte (zwischen 1 und 4).

 Abbildung: Rezirkulation gallensaurer Salze
Abbildung: Rezirkulation gallensaurer Salze
Nach einer Vorlage bei Barrett KE: Gastrointestinal Physiology. McGraw-Hill 2006
Der
Großteil der Gallensäuren / gallensauren Salze kreist zwischen Dünndarm
und Leber (enterohepatischer Kreislauf). Ein kleiner Teil des
Gallensäurepools befindet sich im Blutkreislauf (unvollständige
Aufnahme aus dem Pfortaderkreislauf in die Leber) oder läuft in das
Colon über und geht mit dem Stuhl verloren.
Im Gleichgewichtszustand
entspricht die Neusynthese in der Leber dem fäkalen Verlust.
Der
Verlust von Gallensäuren mit dem Stuhl (ca. 600 mg werden pro Tag neu
synthetisiert) ist ein wichtiger Ausscheidungsweg von Cholesterin aus
dem Körper

Im Darmlumen werden Gallensäuren zum Teil dehydroxyliert, es entstehen "sekundäre
Gallensäuren": Cholsäure und Chenodesoxycholsäure. Alle diese
Gallensäuren werden über den enterohepatischen Kreislauf an die Leber
retourniert (ihr "Anfluten" aus dem Darm steuert im Wesentlichen die
hepatische Gallensäurensekretion).
Die Cholsäure
weist mit ihren drei Hydroxylgruppen die größte Wasserlöslichkeit aller
Gallensäuren auf, die Lithocholsäure (eine OH-Gruppe) die niedrigste.
Die pK-Werte der Gallensäuren liegen in der Nähe duodenaler pH-Werte
(saurer Mageninhalt), sodass hier die Gallensäuren (insbesondere
konjugierte Formen, die hauptsächlich in Form von Natriumsalzen
auftreten: bile salts) gut löslich sind. Bei höherer Konzentration interagieren die Moleküle so, dass sie Mizellen bilden.
Gallensäuren machen etwa 80% der organischen Bestandteile der Galle aus
(die restlichen 20% entfallen vor allem auf Cholesterin und
Phospholipide). Das Mengenverhältnis von Cholsäure :
Chenodesoxycholsäure : Desoxycholsäure im Gallensekret beträgt etwa
4:2:1; die Menge an Litocholsäure ist sehr gering.

Mehrfach ungesättigte Fettsäuren können z.T. nicht selbst vom Organismus synthetisiert werden, d.h. sie sind essentiell. Das gilt vor allem für Linolsäure (empfohlene Zufuhr 10 g/d) und α-Linolensäure (2 g/d). Aus ihnen werden Eikosanoide gebildet.
Die zu resorbierenden Stoffe
müssen die Schleimschicht sowie einen zwischen dieser und dem
Bürstensaum mit seiner apikalen Membran liegenden wässrigen Film (unstirred layer: ~40 µm) überwinden. Das gelingt kurz- und mittelkettigen Fettsäuren leicht, größeren hydrophoben Molekülen weniger gut; die
"Verpackung" in Mizellen
erhöht die Löslichkeit / Verfügbarkeit um 2-3 Zehnerpotenzen.
Gallensäuren spielen für die Bildung von Mizellen eine Schlüsselrolle.
Resorption: In die Enterozyten gelangen
Fettsäuren, Monoglyzeride, Lysophospholipide und Cholesterin
wahrscheinlich nicht (nur) durch
einfache Diffusion, sondern (auch) durch Vermittlung von Transportern; dies scheint aber von untergeordneter
Bedeutung zu sein.
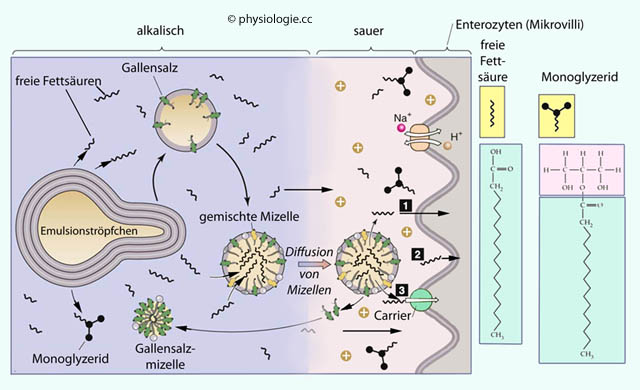
 Abbildung: Mizellärer Transport von Spaltprodukten der Fettverdauung zur Oberfläche von Enterozyten
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Abbildung: Mizellärer Transport von Spaltprodukten der Fettverdauung zur Oberfläche von Enterozyten
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021

 Abbildung: "Routing" der Lipide
Abbildung: "Routing" der Lipide
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 3rd ed., Elsevier 2016
Enterozyten nehmen Lipide aus Mizellen auf, verestern sie (re-esterification) und bilden Chylomikronen.
Langkettige Fettsäuren und 2-Monoglyceride werden im glatten endoplasmatischen Retikulum (SER) zu Triglyceriden resynthetisiert.
Cholesterin wird verestert, Lysolezithin zu Lezithin verwandelt.
Längerkettige
Fettsäuren, Cholesterin und Lezithin werden als Chylomikronen unter
Umgehung der Pfortader zu Lymphgefäßen gesteuert.
Glycerin, kurz- und mittelkettige Fettsäuren gelangen unverändert durch die Zelle und via portalen Kreislauf direkt zur Leber

 Kurz- und mittelkettige Fettsäuren und Glycerin werden nicht esterifiziert; sie gelangen (via
Epithelzelle) direkt in den Pfortaderkreislauf und zur Leber.
Kurz- und mittelkettige Fettsäuren und Glycerin werden nicht esterifiziert; sie gelangen (via
Epithelzelle) direkt in den Pfortaderkreislauf und zur Leber.
Fettlösliche
Vitamine (A, D, E, K) werden zusammen mit anderen Lipiden in analoger
Weise resorbiert.
 Gallensalze werden erst im Ileum resorbiert;
kurzkettige Fettsäuren auch im Colon.
Gallensalze werden erst im Ileum resorbiert;
kurzkettige Fettsäuren auch im Colon.
Kohlenhydratresorption
 Zu Kohlenhydraten s. auch dort
Zu Kohlenhydraten s. auch dort
Im Mund spaltet Speichelamylase
komplexe Kohlenhydrate zu kleineren Bruchstücken (inklusive
Monosaccharide). Ihre Wirkung ist limitiert, allerdings kann sie im
Magen noch beträchtliche Zeit nachwirken, solange die verschluckte
Nahrung die Salzsäure des Magens puffert und dadurch die Wirkungsdauer
der Speichelamylase verlängert.
Der Großteil der kohlenhydratspaltenden Aktivität entfaltet sich im Duodenum. Pankreatische Amylase spaltet Stärke und Glykogen an der 1,4-Bindung ( s. dort). Der Bürstensaum der Enterozyten hydrolysiert kleine Polymere (Maltase, Lactase, Sucrase -
s. dort). Der Bürstensaum der Enterozyten hydrolysiert kleine Polymere (Maltase, Lactase, Sucrase -  s. dort).
s. dort).
Resorbiert werden Mono- und Disaccharide schon im Duodenum,
weiters Jejunum und - falls Reste noch im Chymus verblieben sind - auch
im Ileum. Glucose und Galactose können nur über einen Natrium-Cotransporter aufgenommen werden (SGLT1: Sodium-glucose linked transporter), Fructose über erleichterte Diffusion (SGLT5), Pentose-Zucker über einfache Diffusion.
 Zur Resorption von Monosacchariden s. auch dort
Zur Resorption von Monosacchariden s. auch dort
 Die apikale
Zellmembran der Darmepithelzellen nehmen D-Glucose und Galactose
sekundär-aktiv - gegen deren Konzentrationsgradienten - mittels Cotransport mit Natrium (SGLT1)
auf. SGLT1 kann Fructose nicht befördern, diese gelangt über SGLT5 (via
erleichterte Diffusion) in die Epithelzelle. Sowohl Glucose als auch
Fructose gelangen basolateral über GLUT2 in das Interstitium weiter
(
Die apikale
Zellmembran der Darmepithelzellen nehmen D-Glucose und Galactose
sekundär-aktiv - gegen deren Konzentrationsgradienten - mittels Cotransport mit Natrium (SGLT1)
auf. SGLT1 kann Fructose nicht befördern, diese gelangt über SGLT5 (via
erleichterte Diffusion) in die Epithelzelle. Sowohl Glucose als auch
Fructose gelangen basolateral über GLUT2 in das Interstitium weiter
( Abbildung).
Abbildung).

 Abbildung: Abbau und Resorption von Kohlenhydraten zu Monosacchariden
Abbildung: Abbau und Resorption von Kohlenhydraten zu Monosacchariden
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Links oben: Amylase baut Stärke zu Maltose, Maltotriose und Dextrinen ab.
Rechts: Lactose, Maltose,
Maltotriose, Sucrose, Dextrine werden extrazellulär durch die
membranständigen Enzyme (luminal) Lactase, Glucoamylase und Sucrase /
Isomaltase aufgespalten, die Monosaccharide werden durch Transporter
(SGLT1, GLUT5) aufgenmommen.
Links unten: Die Aufnahme der Monosaccharide Glucose und
Galactose
über Co-Transport mit Natrium wird sekundär durch den Na-Gradienten
angetrieben (basolaterale Na-K-Pumpe). Fructose wird über den
GLUT5-Mechanismus resorbiert. GLUT2 transportiert Monosaccharide über
die basolaterale Membran
GLUT, Glucosetransporter; SGLT-1, sodium-glucose cotransporter-1

Mit einem Molekül Glucose wandern zwei Natriumionen;
aus dem Membranpotential und dem Na-Gradienten ergibt sich dabei die
Möglichkeit, einen fast 2000-fachen Konzentrationsgradienten für Glucose zu überwinden, d.h. die Glucose aus dem Darm so gut wie
vollständig aufzunehmen.
 L-Fructose gelangt konzentrationsabhängig durch erleichterte Diffusion mittels des Fructosetransporters GLUT5
in die Epithelzelle. GLUT5 findet sich vor allem in der Dünndarmmukosa,
in geringerem Ausmaß auch in anderen Geweben (Muskel-, Fett- und renale
Tubuluszellen).
L-Fructose gelangt konzentrationsabhängig durch erleichterte Diffusion mittels des Fructosetransporters GLUT5
in die Epithelzelle. GLUT5 findet sich vor allem in der Dünndarmmukosa,
in geringerem Ausmaß auch in anderen Geweben (Muskel-, Fett- und renale
Tubuluszellen).
GLUT5 ermöglicht Fructoseaufnahme über erleichterte Diffusion
|
 Die basolaterale Membran transportiert Monosaccharide - unabhängig von Natrium - mittels GLUT2
weiter Richtung Blutkreislauf. Es ist also für die Aufnahme von Glucose, Fructose und Galactose aus der Darmmukosa in das Interstitium verantwirtlich. GLUT2 wird außer von
Darmepithelien auch in Leber und Pankreas (ß-Zellen) exprimiert.
Die basolaterale Membran transportiert Monosaccharide - unabhängig von Natrium - mittels GLUT2
weiter Richtung Blutkreislauf. Es ist also für die Aufnahme von Glucose, Fructose und Galactose aus der Darmmukosa in das Interstitium verantwirtlich. GLUT2 wird außer von
Darmepithelien auch in Leber und Pankreas (ß-Zellen) exprimiert.
Enzymatische Aktivität und Glucosetransport sind im Jejunum am stärksten ausgeprägt, weniger im
Duodenum, noch schwächer im Ileum.
Periphere Verwertung: Die
Aufnahme der Monosaccharide aus dem Blut bzw. Interstitium in die
Zellen der Peripherie erfolgt über GLUT1 (weit verbreitet), GLUT3 (vor
allem im Gehirn) und das insulinabhängige GLUT4 (Fettzellen,
Skelettmuskelfasern).
 Inkretineffekt: Gelangt Glucose in den oberen Dünndarm, wird aus dessen K-Zellen GIP und aus L-Zellen GLP-1
freigesetzt. Beide regen die Synthese und Sekretion von Insulin an.
Deshalb ist orale Glucosegabe stärker insulinwirksam als dieselbe Menge Glucose i.v.
Inkretineffekt: Gelangt Glucose in den oberen Dünndarm, wird aus dessen K-Zellen GIP und aus L-Zellen GLP-1
freigesetzt. Beide regen die Synthese und Sekretion von Insulin an.
Deshalb ist orale Glucosegabe stärker insulinwirksam als dieselbe Menge Glucose i.v.
 Über Glucose- und Fructosetransporter s. dort
Über Glucose- und Fructosetransporter s. dort
 Über Ballaststoffe s. dort
Über Ballaststoffe s. dort
Aminosäuren und Peptide
 Zu Aminosäuren s. auch dort
Zu Aminosäuren s. auch dort
 Zur Verdauung von Proteinen s. dort
Zur Verdauung von Proteinen s. dort
Proteine werden im Darmlumen durch Pepsin und Pankreasproteasen gespalten (~70%
zu Oligopeptiden, ~30% zu Aminosäuren). Der Bürstensaum der Darmmukosa
baut die verbliebenen Oligopeptide mittels Exo-, Endo- und Dipeptidasen
zu Aminosäuren, Di- und Tripeptiden ab. Für diese existieren verschiedene transzelluläre Transportsysteme (die aus mehreren Untergruppen bestehen):

Ein
"neutrales" oder "methioninpräferierendes", das alle neutralen Aminosäuren über Enterozytenmembranen transportiert;

ein
"basisches", das
kationische Aminosäuren zusammen mit Zystein befördert;

ein
"saures" für Glutamat und Aspartat;

ein
"Iminoglyzinsystem", zuständig für
Prolin, Hydroxyprolin und Glyzin, sowie

ein
"β-aminosaures" System (ß-Alanin, Taurin),
die teilweise natriumabhängig, teitlweise natriumunabhängig funktionieren. Auch parazellulär kann es zur Aufnahme von Aminosäuren kommen.
Die Resorptionsleistung für exogenes plus endogenes Protein (bzw. Peptide und
Aminosäuren) beträgt bei einem gesunden erwachsenen Menschen
etwa 300 Gramm pro Tag.
 Aufnahme von Aminosäuren am apikalen Bürstensaum. Von der Darmschleimhautzelle apikal aufgenommen werden
nicht nur Aminosäuren - über die zahlreichen Aminosäuretransporter, die z.T. Na+- (oder H+-, Cl--) abhängig sind (s. weiter unten), sondern auch Di- und Tripeptide - über PepT1, einen H+-Oligopeptid-Cotransporter (den auch proximale Tubuli in der Niere exprimieren): Der Mechanismus wird durch einen Protonengradienten angetrieben. (In die Zelle aufgenommenes H+ wird über einen H+/Na+-Austauscher wieder in das Darmlumen retourniert.)
Aufnahme von Aminosäuren am apikalen Bürstensaum. Von der Darmschleimhautzelle apikal aufgenommen werden
nicht nur Aminosäuren - über die zahlreichen Aminosäuretransporter, die z.T. Na+- (oder H+-, Cl--) abhängig sind (s. weiter unten), sondern auch Di- und Tripeptide - über PepT1, einen H+-Oligopeptid-Cotransporter (den auch proximale Tubuli in der Niere exprimieren): Der Mechanismus wird durch einen Protonengradienten angetrieben. (In die Zelle aufgenommenes H+ wird über einen H+/Na+-Austauscher wieder in das Darmlumen retourniert.)
Dieses Oligopeptid-Transportsystem ist sehr effizient; Oligopeptide
werden im Darm besonders rasch aufgenommen, was man als "kinetischen
Vorteil" gegenüber Aminosäuren bezeichnet (vielleicht sind Oligopeptide
Aminosäuren für Substitutionszwecke vorzuziehen).
 Auch einige Antibiotika
(z.B. Cephalosporine) werden über dieses System aufgenommen.
Auch einige Antibiotika
(z.B. Cephalosporine) werden über dieses System aufgenommen.

 Abbildung: Resorption von Oligopeptiden und Aminosäuren im Dünndarm
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 3rd ed., Elsevier 2016
Abbildung: Resorption von Oligopeptiden und Aminosäuren im Dünndarm
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 3rd ed., Elsevier 2016
Im
Darmlumen erfolgt der Abbau durch pankreatische Enzyme wie Trypsin,
Chymotrypsin, Carboxypeptidasen und Elastase zu Oligopeptiden
sowie Prolin und Alanin. Oligopeptide können von membranständigen und zytoplasmatischen Enzymen
des Darmepithels weiter zu Aminosäuren abgebaut werden.
Die apikale Membran der Mucosaepithelzellen verfügt über verschiedene Peptidasen sowie über Transporter für Aminosäuren (AA) und Oligopeptide - (AA)2 Dipeptide, (AA)3 Tripeptide etc. Diese werden über H+- (PepT1, H+/Oligopeptid-Symporter) bzw. Na+-abhängige Symporter (für Aminosäuren) in die Zelle aufgenommen.
In der basolateralen Membran befinden sich Aminosäurepermeasen zum Weitertransport in Richtung Blut. Diese sind aminosäurespezifisch und natriumunabhängig

Carboxy- und Aminopeptidasen (sowie Di- und Tripeptidasen) bezeichnet man als Exopeptidasen,
sie knabbern vom Eiweißmolekül (C- oder N-terminale) Aminosäuren (bzw.
Di- oder Tripeptide) an dessen Ende ("außen") ab; andere Peptidasen
sind Endopeptidasen, d.h. sie spalten die Proteinmoleküle von "innen", spezifisch an bestimmen Peptidbindungen.
Die gemeinsame Aktivität pankreatischer Proteasen baut Nahrungseiweiß zu ~70% zu Oligopeptiden und zu 30% zu Aminosäuren ab.
Aufnahme von Aminosäuren / Oligopeptiden:
Oligopeptide werden z.T. von der Epithelzelle aufgenommen (Natrium-abhängige Aminosäuretransporter), z.T. von membranständigen Peptidasen
extrazellulär weiter zu kleineren
Peptiden und Aminosäuren abgebaut ( Abbildung). Diese Peptidasen haben hohe
Affinität für Peptide, die aus drei bis acht Aminosäuren bestehen
(intrazelluläre Peptidasen bevorzugen Di- und Tripeptide).
Abbildung). Diese Peptidasen haben hohe
Affinität für Peptide, die aus drei bis acht Aminosäuren bestehen
(intrazelluläre Peptidasen bevorzugen Di- und Tripeptide).
In die Mucosazelle aufgenommene Oligopeptide werden
dann im Zytoplasma von Di- und Tripeptidasen von intrazellulären Peptidasen zu Aminosäuren hydrolysiert. Nur wenige Dipeptide tauchen schließlich im Pfortaderblut auf - vor allem prolinhältige, weil diese der Hydrolyse am ehesten trotzen und damit die häufigsten Dipeptide im Blutkreislauf sind.
 Weitertransport der Aminosäuren über die basolaterale Membran.
Sind die Aminosäuren, Di- und Tripeptide einmal in die Bürstensaumzelle
aufgenommen, müssen sie basolateral an Interstitium und Blut
weitergegeben werden. Dies erfolgt mittels Aminosäuretransporter,
von denen es mindestens fünf verschiedene gibt - drei natriumunabhängige für
den "Export" und zwei natriumabhängige für den "Import" von
Aminosäuren, die also bidirektional durch die Membran gelangen können
(Enterozyten benötigen etwa 10% der aufgenommenen Aminosäuren für ihre eigene Proteinsynthese).
Weitertransport der Aminosäuren über die basolaterale Membran.
Sind die Aminosäuren, Di- und Tripeptide einmal in die Bürstensaumzelle
aufgenommen, müssen sie basolateral an Interstitium und Blut
weitergegeben werden. Dies erfolgt mittels Aminosäuretransporter,
von denen es mindestens fünf verschiedene gibt - drei natriumunabhängige für
den "Export" und zwei natriumabhängige für den "Import" von
Aminosäuren, die also bidirektional durch die Membran gelangen können
(Enterozyten benötigen etwa 10% der aufgenommenen Aminosäuren für ihre eigene Proteinsynthese).
Die Resorption der Aminosäuren im Darm ist sehr effizient; lediglich
weniger als 4% des mit der Nahrung angebotenen Stickstoffs wird mit dem
Stuhl direkt wieder ausgeschieden. Zu den mit der Nahrung zugeführten
Proteinen (~1 g/kg/d) kommen auch endogene (abgeschilfertes Epithel,
Immunglobuline, Enzyme, Hormone).
Die folgende Tabelle gibt eine Übersicht der Aminosäuretransporter in
der apikalen und basolateralen Membran der Enterozyten.
Diese sind zum Teil gekoppelt, zum Teil unabhängig vom
Natriumgradienten:

Transportsysteme für Aminosäuren
Nach Johnson: Gastrointestinal Physiology, 9th ed., Mosby 2019
|
System
|
Substrat
|
Abhängig
von Natrium-
Gradienten?
|
Bürstensaum (apikale Membran)
|
Bo
|
neutrale L-Aminosäuren
|
ja
|
Bo,t
|
neutrale L- und kationische L-Aminosäuren |
ja
|
| bo,t |
neutrale L- und kationische Aminosäuren, Zystin
|
nein
|
IMINO
|
Iminosäuren
|
ja
|
B
|
Taurin, ß-Alanin
|
ja
|
X-AG
|
anionische Aminosäuren
|
ja
|
ASC
|
neutrale L-Aminosäuren
|
ja
|
N
|
Glutamin, Asparagin, Histidin
|
ja
|
PAT
|
kleine neutrale Aminosäuren
|
nein
|
Basolaterale Membran
|
A
|
neutrale L-Aminosäuren |
ja
|
GLY
|
Glyzin
|
ja
|
| Y+ |
kationische Aminosäuren |
nein
|
L
|
neutrale L-Aminosäuren |
nein
|
Y+L
|
neutrale L-Aminosäuren, kationische Aminosäuren |
ja / nein
|
ASC
|
kleine L- und D-Aminosäuren
|
nein
|
Zusätzlich hat man in der apikalen Membran des Bürstensaums
protonenabhängige Transporter gefunden, die kurzkettige Aminosäuren
(Glyzin, Alanin, Serin, Prolin) zusammen mit H+ in die
Zelle transportieren und damit elektrogen sind (das Membranpotential
wird reduziert). Diese neue Transporterklasse werden als PAT-Proteine (proton-dependent amino acid transporters) bezeichnet.
Direkte Aufnahme von Protein
( Abbildung): Insbesondere in der postnatalen Periode können Darmepithelzellen -
Enterozyten sowie M-Zellen - aus der Nahrung (z.B. Muttermilch) direkt
Eiweißmoleküle resorbieren, ohne dass diese dabei abgebaut werden. Auf
diese Weise kann passive Immunität direkt von der Mutter auf das Baby
übertragen werden. Etwa mit 6 Monaten schließt sich dieses Fenster zur
Resorption ganzer Eiweißmoleküle ("closure").
Diese Änderung ist hormonell gesteuert; werden Corticosteroide
verabreicht, geht die Fähigkeit zur Phagozytose ganzer Proteine früher
verloren.
Abbildung): Insbesondere in der postnatalen Periode können Darmepithelzellen -
Enterozyten sowie M-Zellen - aus der Nahrung (z.B. Muttermilch) direkt
Eiweißmoleküle resorbieren, ohne dass diese dabei abgebaut werden. Auf
diese Weise kann passive Immunität direkt von der Mutter auf das Baby
übertragen werden. Etwa mit 6 Monaten schließt sich dieses Fenster zur
Resorption ganzer Eiweißmoleküle ("closure").
Diese Änderung ist hormonell gesteuert; werden Corticosteroide
verabreicht, geht die Fähigkeit zur Phagozytose ganzer Proteine früher
verloren.
Auch bei erwachsenen Personen behält der Darm eine begrenzte Kapazität zur Aufnahme von Eiweiß und Polypeptiden.
Proteinmoleküle können endozytiert, durch die Zelle gebracht und auf
der basolateralen Seite in das Interstitium abgegeben werden
(Transzytose,  Abbildung). Enterozyten bauen allerdings den Großteil
der Proteine ab (über 90%).
Abbildung). Enterozyten bauen allerdings den Großteil
der Proteine ab (über 90%).
Anders ist das bei den auf Eiweißaufnahme
spezialisierten M-Zellen, welche etwa die Hälfte des aufgenommenen Proteins in clathrinbedeckte Vesikel
aufnehmen und diese auf der Blutseite an Immunzellen in der lamina
propria weiterreichen. Antigene werden auf diese Weise aufbereitet, und
Lymphozyten leiten entsprechende Immunantworten ein.
H+-Oligopeptid-Symporter resorbieren Di- und Tripeptide - sekundär-aktiv und effizient
|
 Neugeborene resorbieren eine beträchtliche Menge Protein direkt aus dem Kolostrum - mittels Endozytose,
also ohne vorherigen Abbau zu Aminosäuren, Di- und Tripeptiden. Dieser
Mechanismus erlaubt die Aufnahme von (teils) unveränderten
Immunglobulinen aus der Muttermilch direkt in das Blut des
Neugeborenen. Enterozyten bringen auf diese Weise etwa jedes zehnte, die auf Proteinaufnahme spezialisierten M-Zellen etwa jedes zweite Eiweißmolekül unbeschadet aus dem Darmlumen in das Interstitium des Babys (jeweils 0,2 µg/h/cm2 Mucosaoberfläche - "direkter Pfad").
Neugeborene resorbieren eine beträchtliche Menge Protein direkt aus dem Kolostrum - mittels Endozytose,
also ohne vorherigen Abbau zu Aminosäuren, Di- und Tripeptiden. Dieser
Mechanismus erlaubt die Aufnahme von (teils) unveränderten
Immunglobulinen aus der Muttermilch direkt in das Blut des
Neugeborenen. Enterozyten bringen auf diese Weise etwa jedes zehnte, die auf Proteinaufnahme spezialisierten M-Zellen etwa jedes zweite Eiweißmolekül unbeschadet aus dem Darmlumen in das Interstitium des Babys (jeweils 0,2 µg/h/cm2 Mucosaoberfläche - "direkter Pfad").
Der Mechanismus der Protein-Endozytose bleibt etwa während der ersten 6
Monate postpartal bestehen, nachher wird er hormonell weitgehend
"abgestellt". Im späteren Lebensalter ist die direkte Proteinaufnahme nur noch minimal, kann aber bei manchen Erwachsenen dennoch Immunantworten auslösen (Proteinunverträglichkeit, z.B. gegenüber Milcheiweiß). M-Zellen präsentieren immunkompetenten Zellen aufgenommene Proteine, was Abwehrvorgänge triggern kann.
Wasser- und Elektrolytresorption
Der Dünndarm des Erwachsenen resorbiert im Schnitt täglich 6-8
(maximal 15-20) Liter Wasser pro Tag, der Dickdarm 0,5-2 (maximal 4-5)
Liter. Die Funktionsreserve beträgt daher mehr als das Doppelte der
normalerweise anfallenden Wasserresorption; mangelnde
Aufnahme im Dünndarm kann der Dickdarm zumindest zum Teil kompensieren.
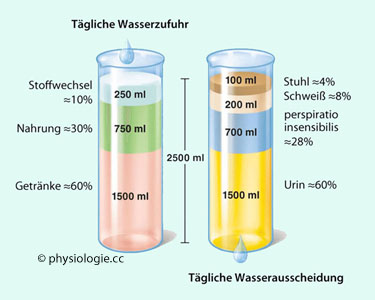
 Abbildung: Wasserbilanz (Durchschnittswerte für eine erwachsene Person)
Abbildung: Wasserbilanz (Durchschnittswerte für eine erwachsene Person)
Links: Wasser in Getränken ~1,5 l/d; im Essen ~0,75 l/d; Oxidationswasser ~0,25 l/d
Rechts: Harn ~1,5 l/d; Verlust über Atmung und Haut (ohne Schwitzen)
~0,7 l/d; Schweiß ~0,2 l/d (kühle Umgebung); Stuhl ~0,1 l/d (bei
maximaler Flüssigkeitsresorption aus dem Dickdarm)

Die Wasserbilanz mit der Umwelt resultiert bei einer erwachsenen Person
in etwa 2-3 Liter pro Tag ( Abbildung).
Abbildung).
 Ständiges Nuckeln an der Wasserflasche ist in
der Regel unnötig, es sei denn, es
liegen besondere Belastungen vor wie Hitze oder starke Muskelbelastung,
die zu erhöhtem Schweißverlust (perspiratio sensibilis) führen.
Ständiges Nuckeln an der Wasserflasche ist in
der Regel unnötig, es sei denn, es
liegen besondere Belastungen vor wie Hitze oder starke Muskelbelastung,
die zu erhöhtem Schweißverlust (perspiratio sensibilis) führen.
 Über die Flüssigkeitsbilanz des Körpers s. dort
Über die Flüssigkeitsbilanz des Körpers s. dort
Während
Nährstoffe praktisch nur im Dünndarm resorbiert werden (außer bei
Neugeborenen), kann auch der Dickdarm Elektrolyte und Wasser aufnehmen
(und sezernieren). Die Resorptionskapazität für Salze / Elektrolyte
hängt vom jeweiligen
Transportsystem ab; so kommt es bei salzreicher Kost zu einer täglichen
Aufnahme von z.B. 0,6 mol Natrium, entsprechend 30-40 Gramm Kochsalz.
Der Großteil der Kochsalzresorption erfolgt in den Zotten des
Dünndrms sowie über das Oberflächenepithel des Dickdarms. Die  Abbildung gibt einen Überblick über die Mechanismen der
Kochsalzresorption im Dünndarm:
Abbildung gibt einen Überblick über die Mechanismen der
Kochsalzresorption im Dünndarm:
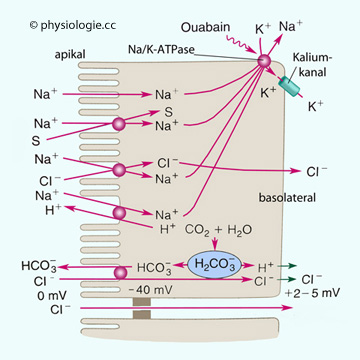
 Abbildung: Kochsalzresorption im Dünndarm
Abbildung: Kochsalzresorption im Dünndarm
Nach Nach einer Vorlage in Johnson: Gastrointestinal Physiology, 9th ed., Mosby 2019
Apikale Membran: Natrium
folgt seinem elektrochemischen Gradienten bei der Passage des
Bürstansaums. Es gelangt über vier Wege in den Enterozyten:
 Über
Natriumkanäle,
Über
Natriumkanäle,
 zusammen mit organischen Substraten (S)
wie Glucose oder Aminosäuren,
zusammen mit organischen Substraten (S)
wie Glucose oder Aminosäuren,
 im elektroneutralen Cotransport mit
Chlorid,
im elektroneutralen Cotransport mit
Chlorid,
 im elektroneutralen Austausch gegen Wasserstoffionen.
Chlorid wird gegen Bicarbonat ausgetauscht oder gelangt parazellulär in das Interstitium (elektrischer Gradient 2-5 mV).
Basolaterale Membran: Die Na/K-ATPase (hemmbar durch Ouabain, einem
Herzglykosid) befördert Natrium in das Interstitium; Chlorid folgt
passiv nach. Das elektrische Potenztial über die gesamte Zelle beträgt
zwischen +2 und +5 mV (basolaterale bezogen auf luminale Seite), was die parazelluläre Aufnahme von Chlorid unterstützt. Das
Membranpotential beträgt etwa -40 mV
im elektroneutralen Austausch gegen Wasserstoffionen.
Chlorid wird gegen Bicarbonat ausgetauscht oder gelangt parazellulär in das Interstitium (elektrischer Gradient 2-5 mV).
Basolaterale Membran: Die Na/K-ATPase (hemmbar durch Ouabain, einem
Herzglykosid) befördert Natrium in das Interstitium; Chlorid folgt
passiv nach. Das elektrische Potenztial über die gesamte Zelle beträgt
zwischen +2 und +5 mV (basolaterale bezogen auf luminale Seite), was die parazelluläre Aufnahme von Chlorid unterstützt. Das
Membranpotential beträgt etwa -40 mV

Natrium wird transzellulär, Chlorid auch
parazellulär aufgenommen und gelangt über das Interstitium zum
Blutkreislauf. Kalium wird vorwiegend parazellulär aufgenommen (falls ein entsprechender Konzentrationsgradient vorhanden ist).
Dabei verändern sich die Schwerpunkte des Mechanismus
entlang des Darms (vgl. weiter unten): Im Duodenum und Jejunum dominiert die
Natriumresorption über Cotransport mit Glucose und Aminosäuren sowie im
Austausch gegen H+; im Jejunum überwiegt die Kopplung an die
Chloridaufnahme, die wiederum einem elektrischen Gradienten folgt.
Im
distalen Ileum und besonders im Dickdarm ist der Austausch von Chlorid
gegen Bicarbonat (das aus CO2 entsteht, wozu Carboanhydrase gebraucht wird) bedeutsam (Bicarbonat macht den Stuhl alkalisch).
Flüssigkeit wird im Darm sowohl resorbiert als auch sezerniert. Die Resorption von Wasser
und Elektrolyten aus dem Darm - an die 9 Liter Flüssigkeit in 24 Stunden - erfolgt sowohl parazellulär als auch transzellulär und folgt hydrostatischen und osmotischen Kräften. Mehrere
Kompartimente interagieren dabei: Ein luminales (Darminhalt), ein
zelluläres (Enterozyten), ein interstitielles, sowie Blut- und
Lymphgefäße (Lymphdrainage aus dem Interstitium) - jeweils mit den dort herrschenden aktuellen Druckwerten.
Vor allem im Jejunum ist die parazelluläre Durchlässigkeit hoch, hier
tritt Flüssigkeit - bestehend aus Wasser, Elektrolyten sowie kleinen
Molekülen von Verdauungsprodukten - leicht vom Darmlumen in
Interstitium und Blutbahn über.
Andererseits werden im gesamten Darm Wasser und Elektrolyte sezerniert,
vor allem in den Krypten; das erhält die Fließfähigkeit des Chymus.
Chlorid tritt - gegen seinen elektrochemischen Gradienten - im Symport
mit Kationen (Na/K/2Cl-Cotransporter)
über die basolaterale Membran in Enterozyten ein und verlässt die Zelle
apikal über Chloridkanäle. Natriumionen wandern indessen parazellulär
in das Darmlumen, unterstützt durch das lumen-negative elektrische
Potenzial (bis 20 mV). So gelangt Kochsalz in den Darm, und Wasser
folgt osmotisch nach.
Gelangt hypertoner Chymus in den Dünndarm, wandert Wasser zunächst aus dem Kreislauf in
den Darm (osmotische Wirkung); anschließend kehrt sich die Richtung um,
und Wasser wird resorbiert (Kombination aus hydrostatischen,
osmotischen und lymphatischen Effekten). Hypertonizität kann osmotisch bedingte Diarrhoe
auslösen, z.B. bei Laktasemangel);
ist der Chymus hypoton (nach Trinken von hypoosmotischen
Flüssigkeiten), wird Wasser resorbiert.
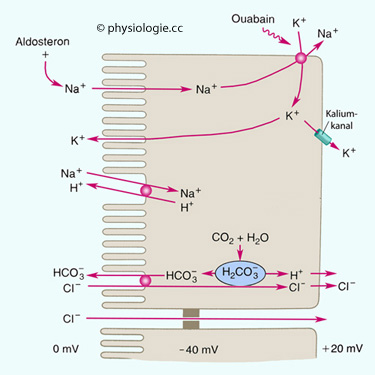
 Abbildung: Resorptionswege im Dickdarm
Abbildung: Resorptionswege im Dickdarm
Nach Nach einer Vorlage in Johnson: Gastrointestinal Physiology, 9th ed., Mosby 2019
Natrium folgt beim Eintritt über die luminale Membran seinem elektrochemischen Gradienten, auch wird es gegen H+
ausgetauscht. An der basolateralen Membran befördert es die Na/K-ATPase
in das Interstitium. Chlorid gelangt im Austausch gegen Bicarbonat in
die Zelle und folgt parazellulär dem elektrischen Gradienten (+20 mV)

Im Ileum nimmt die Permeabilität ab, im
Colon schließlich werden Wasser und gelöste Stoffe fast nur noch
transzelluär (nicht parazellulär) resorbiert.
Dazu gibt es die in der  Abbildung gezeigten Transportmechanismen:
Abbildung gezeigten Transportmechanismen:
 Apikal Natrium- und Kaliumkanäle, sowie ein Natrium / Protonen- und ein Bicarbonat / Chlorid- Austauscher;
Apikal Natrium- und Kaliumkanäle, sowie ein Natrium / Protonen- und ein Bicarbonat / Chlorid- Austauscher;
 basolateral
die allgengenwärtige Na/K-ATPase, die 3 Natrium- gegen 2 Kaliumionen
austauscht und die positive Ladung der Zellbasis verstärkt; sowie
Permeasen für Kalium,. Protonen und Chlorid.
basolateral
die allgengenwärtige Na/K-ATPase, die 3 Natrium- gegen 2 Kaliumionen
austauscht und die positive Ladung der Zellbasis verstärkt; sowie
Permeasen für Kalium,. Protonen und Chlorid.
Das ist wichtig, weil
Darmbakterien osmotisch wirksame Substanzen produzieren, die im
Wesentlichen hier verbleiben und der Stuhl hyperosmolar ist; die
apikale Membran der Colon-Epithelzellen hält diesen osmotischen
Gradienten aufrecht.
Alle Teile des Colons resorbieren Kochsalz - ohne Cotransport mit
organischen Substraten. Kalium kann - im Gegensatz zum Dünndarm -
transzellulär wandern und vor allem unter Aldosteronwirkung vom
Dickdarm sezerniert werden. Aldosteron aktiviert am Bürstensaum neue
Natriumkanäle sowie basolateral die Aktivität der Na/K-ATPase.
 Die Natriumkonzentration im Stuhlwasser kann unter dem Einfluss von Aldosteron von ~30 auf ~2 mM/l abnehmen, während die Kaliumkonzentration von ~75 auf ~150 mM ansteigt.
Die Natriumkonzentration im Stuhlwasser kann unter dem Einfluss von Aldosteron von ~30 auf ~2 mM/l abnehmen, während die Kaliumkonzentration von ~75 auf ~150 mM ansteigt.
Die Rückgewinnung des Natriums erfolgt elektrogen, von oral zu aboral
zunehmend; die Ionenkanäle stehen unter dem Einfluss von Aldosteron,
das ihre Zahl erhöht und die Natriumresorption verstärkt. Die Sekretion
von Bicarbonat erhöht den pH-Wert im Stuhl.
Die parazelluläre Aufnahme von Wasser und gelösten Salzen hängt von der Durchlässigkeit der interzellulären Kontakte (tight junctions)
ab. Der Dünndarm hat eine hohe parazelluläre Permeabilität; daher kann
er keine osmotischen Gradienten aufbauen (die aufgenommene Flüssigkeit
ist isoton), Wasser wandert nach seinem
Konzentrationsgradienten (Osmose). Der elektrische Widerstand der Darmschleimhaut
nimmt colonwärts deutlich zu, er verhält sich umgekehrt proportional
zur Permeabilität:
|
Jejunum
|
Ileum
|
Colon
|
Durchmesser tight junctions (nm)
|
0,8
|
0,3
|
0,2
|
Elektrischer Widerstand
relativ zu Jejunum (~25 Ω/cm2)
|
1
|
2
|
8
|
| Relative Durchlässigkeit |
hoch
|
mittel
|
niedrig
|
Der Elektrolyttransport im Darm wird durch das autonome System,
Mediatoren, Hormone und Immunfaktoren gesteuert. Dabei spielen in den
meisten Fällen intrazelluläres cAMP / cGMP, Proteinkinasen und Calciumionen eine vermittelnde Rolle (second messenger) - allesamt
reduzieren diese die NaCl-Resorption und regen die Sekretion von Anionen (Chlorid) an. Beispiele:
 Abführende Stoffe (Laxantien) und bakterielle Endotoxine fördern die Sekretion von Salz und Wasser
Abführende Stoffe (Laxantien) und bakterielle Endotoxine fördern die Sekretion von Salz und Wasser
 Parasympathische Aktivität (Acetylcholin), Histamin und VIP regen die Sekretion von K+ und Cl- an
Parasympathische Aktivität (Acetylcholin), Histamin und VIP regen die Sekretion von K+ und Cl- an

Immunfaktoren: Unter anderem bilden Makrophagen und Granulozyten
Eikosanoide, Mastzellen und Fibroblasten Histamin und
Bradykinin.
Das Muster von Bildung und Wirkung dieser Stoffe ist komplex; so kann
Histamin (z.B. nach Bindung von Antigenen an Rezeptoren an Mastzellen)
die Chloridsekretion in den Darm teils über eigene Rezeptoren, teils
über Anregung cholinerger Darmnervenzellen steigern
Die Resorption von Kochsalz wird hingegen gefördert durch Mineralcorticoide, Glucocorticoide und einige lokale Hormone / Neurotransmitter:
 Angiotensin fördert die Natriumaufnahme - elektroneutral - im Dünndarm, Aldosteron - elektrogen - im Colon (s. weiter unten). Dehydrierung regt die Bildung beider Hormone an
Angiotensin fördert die Natriumaufnahme - elektroneutral - im Dünndarm, Aldosteron - elektrogen - im Colon (s. weiter unten). Dehydrierung regt die Bildung beider Hormone an
 Glucocorticoide regen die elektroneutrale Kochsalzresorption sowohl im Dünn- als auch im Dickdarm, ohne Auswirkung auf die Kaliumresorption
Glucocorticoide regen die elektroneutrale Kochsalzresorption sowohl im Dünn- als auch im Dickdarm, ohne Auswirkung auf die Kaliumresorption
 Neurotransmitter endokriner Darmschleimhautzellen, wie Somatostatin,
Enkephaline und Noradrenalin, stimulieren die Flüssigkeits- und
Elektrolytresorption wahrscheinlich über eine Senkung der
intrazellulären Calciumkonzentration
Neurotransmitter endokriner Darmschleimhautzellen, wie Somatostatin,
Enkephaline und Noradrenalin, stimulieren die Flüssigkeits- und
Elektrolytresorption wahrscheinlich über eine Senkung der
intrazellulären Calciumkonzentration
Osmose und solvent drag: Der Transport von Wasser ist osmotisch an
den aktiven Transport von Elektrolyten gekoppelt; das erfordert den
Betrieb von Ionenpumpen. Umgekehrt können gelöste Stoffe - z.B.
Kochsalz, Harnstoff - durch "solvent drag" an die Bewegung von Wasser
gekoppelt sein (sie werden mit dem Lösungsmittel "mitgerissen") - sowohl para- als auch transzellulär.
Der transepitheliale Widerstand gegenüber Flüssigkeitsbewegung durch
die Schleimhaut nimmt vom proximalen Jejunum (hohe Leitfähigkeit) zum
distalen Colon (niedrige Leitfähigkeit) kontinuierlich zu.
Heterogenität: Die verschiedenen Darmabschnitte unterscheiden sich funktionell - sowohl
 entlang der Darmachse (segmentale Heterogenität, z.B. Duodenum, proximales Ileum, distales Ileum) als auch
entlang der Darmachse (segmentale Heterogenität, z.B. Duodenum, proximales Ileum, distales Ileum) als auch
 "vertikal" (Villus-Krypten-Heterogenität), schließlich auch
"vertikal" (Villus-Krypten-Heterogenität), schließlich auch
 von Zelle zu Zelle (zelluläre Heterogenität, z.B. resorptive, endokrine, schleimproduzierende, Stammzelle..).
von Zelle zu Zelle (zelluläre Heterogenität, z.B. resorptive, endokrine, schleimproduzierende, Stammzelle..).
So resorbiert der gesunde Dünndarm Kalium, der Dickdarm hingegen sezerniert es. (Beide Abschnitte resorbieren Natrium und Chlorid, und sezernieren Bicarbonat - s. unten.)
Natriumresorption
Die Natriumaufnahme
ist (zusammen mit der Chloridresorption) besonders relevant für die Erhaltung des extrazellulären Volumens
(Osmolalität durch NaCl) und der Kreislauffunktion (Blutvolumen!) und dementspechend lebensnotwendig.
Der Großteil des in den Gastrointestinaltrakt gelangten Natriums stammt
normalerweise aus körpereigenen Sekreten (Speichel, Magensaft,
Bauchspeicheldrüse, Galle, Dünndarmsekret: insgesamt 6-7 l/d, s. oben).
Die vom Darm resorbierte Flüssigkeit ist mehr oder weniger isoton: Oral
aufgenommene Flüssigkeiten können zwar stark hypo- (Wasser!) oder
hyperton sein, werden aber im Darm von körpereigenen Sekreten etwa im
Verhältnis 4:1 bis 5:1 verdünnt. Dazu kommt, dass eine auch nur geringe
Abweichung der Osmolalität der Körperflüssigkeiten vom Sollwert (wie
sie durch eine Tonizitätsabweichung im Verdauungssystem auftreten kann)
sofort durch Änderung des Durstempfindens einerseits, der
Vasopressinsekretion andererseits beantwortet wird und damit das Trinkverhalten bzw. die Konzentration des Harns beeinflusst (Osmoregulation).
Natrium wird vom Bürstensaum apikal auf verschiedenen Wegen aufgenommen, und die basolateral gelegene Na/K-ATPase liefert den Antrieb für
sekundär-aktive Transportprozesse. Vier
Mechanismen garantieren die Natriumaufnahme der Darmschleimhaut: Im Dünndarm die Kopplung von Glucose- und
Aminosäureresorption (vor allem postprandial), in
Duodenum und Jejunum elektroneutraler Na/H-Austausch, im Ileum und proximalen Colon paralleler Na/H- und Cl/HCO3-Austausch sowie im distalen Colon Na-Resorption über epitheliale Natriumkanäle ( Abbildung).
Abbildung).


Abbildung: Mechanismen der aktiven enterischen Natriumresorption
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 3rd ed., Elsevier 2016
Links oben: Na-Resorption in den Dünndarmzotten gekoppelt mit der Resorption eines Nährstoffes; dies ist der wichtigste postprandiale Mechanismus der Natriumaufnahme.
Links unten: Elektroneutraler
Na/H-Austausch an der apikalen Membran von Dünndarmepithelzellen wird
durch hohen pH des Darminhalts stimuliert und ist amiloridhemmbar.
Rechts oben: Paralleler Austausch von Na+/H+ (NHE3) und Cl-/HCO3--Antiport (chloride anion exchanger, genannt auch DRA: down-regulated in adenoma) bewirkt "elektroneutrale NaCl-Resorption" und ist der wichtigste interdigestive Mechanismus der Natriumaufnahme.
Rechts unten: "Elektrogene Natriumresorption" erfolgt durch epitheliale Natriumkanäle (ENaC) in der apikalen Membran
Dicke der Pfeile (blau) deutet die Intensität der Resorption an.
CA = Carboanhydrase

 Der führende Mechanismus zur Natriumaufnahme im Dünndarm ist die Kopplung an die Glucose- und Aminosäureresorption (Na/Glucose-Cotransport, Na/Galactose-Cotransport, Na/Aminosäuren-Coptransport über SLC-Transporter - solute carrier),
dem Natrium-Konzentrationsgradienten folgend über die apikale Membran
der Schleimhautzellen der Zotten (nicht der Krypten) aus der Nahrung,
also in der digestiven Phase.
Der führende Mechanismus zur Natriumaufnahme im Dünndarm ist die Kopplung an die Glucose- und Aminosäureresorption (Na/Glucose-Cotransport, Na/Galactose-Cotransport, Na/Aminosäuren-Coptransport über SLC-Transporter - solute carrier),
dem Natrium-Konzentrationsgradienten folgend über die apikale Membran
der Schleimhautzellen der Zotten (nicht der Krypten) aus der Nahrung,
also in der digestiven Phase.
Die Energie für den Transport kommt vom Na-Konzentrationsgradienten
(durch den Bürstensaum in die Zelle), der von der Na-K-Pumpe
(basolateral) aktiv aufrecht erhalten wird. Der Vorgang ladet nebenbei
das Lumen negativ auf, was die Resorption von Chlorid unterstützt.
Dieser Mechanismus findet sich im Jejunum, ein wenig auch im Ileum - und beim Neugeborenen auch im Colon, das diese Fähigkeit nach der Geburt aber rasch verliert.
 Das funktioniert auch als orale Rehydrationstherapie mit Kochsalz-Glucose-Lösung - da unabhängig von cAMP oder Ca++ - bei Darminfektionen (z.B. mit Coli- oder Cholerabakterien)
Das funktioniert auch als orale Rehydrationstherapie mit Kochsalz-Glucose-Lösung - da unabhängig von cAMP oder Ca++ - bei Darminfektionen (z.B. mit Coli- oder Cholerabakterien)
 Natrium-Wasserstoffionen-Exchanger (NHE): Durch elektroneutralen Na+/H+-Austausch im Duodenum und Jejunum (es existieren mehrere Isoformen dieses Austauschers. Auch die basolaterale Membran verfügt über Na+/H+-Antiporter, das Natrium wird gewissenmaßen durch die Zelle hindurchgereicht).
Natrium-Wasserstoffionen-Exchanger (NHE): Durch elektroneutralen Na+/H+-Austausch im Duodenum und Jejunum (es existieren mehrere Isoformen dieses Austauschers. Auch die basolaterale Membran verfügt über Na+/H+-Antiporter, das Natrium wird gewissenmaßen durch die Zelle hindurchgereicht).
Dieser Mechanismus wird
durch höheren pH-Wert im Darmlumen stimuliert (niedrige
Protonenkonzentration treibt H-Ionen lumenwärts) und ist durch das kaliumsparende Diuretikum Amilorid
(in mM-Konzentrationen) hemmbar.
 In der interdigestiven Phase ist ein Parallelmechanismus in Ileum und proximalen Colon für die Natriumresorption der bedeutendste: Na+/H+- gekoppelt mit Cl-/HCO3--Austausch. Der Mechanismus ist insgesamt elektroneutral.
In der interdigestiven Phase ist ein Parallelmechanismus in Ileum und proximalen Colon für die Natriumresorption der bedeutendste: Na+/H+- gekoppelt mit Cl-/HCO3--Austausch. Der Mechanismus ist insgesamt elektroneutral.
1. Bicarbonat wird unter Mitwirkung der Carboanhydrase von diversen Drüsenzellen gebildet. Durch den Cl-/HCO3--Austauscher wandert es apikal ins Lumen, im Austausch gegen Cl-, das in die Zelle - und basolateral durch Chloridkanäle Richtung Blut weiterfließt.
2. Bicarbonat (aus Pankreas-, Gallen- und Duodenalsekret) steigert den pH-Wert im Darmlumen (senkt die H+-Konzentration), was die Natriumresorption durch den Na+/H+-Austauscher (H+ ins Lumen, Na+ in die Zelle) antreibt (Na+ wird anschließend basolateral durch die Na-K-Pumpe weiter Richtung Blut befördert).
Diese Art der elektroneutralen Kochsalzresorption wird gesenkt durch cAMP, cGMP und Ca++ (und umgekehrt: Ihre Abnahme steigert die Aufnahme von Na+).
Toxine, die z.B. bei "Reisedurchfall" üblicherweise involviert sind,
aktivieren die Adenylylcyclase, cAMP nimmt zu und die Salzresorption ab
(Salz- und Wasserverlust: Diarrhoe).
 Elektrogen über epitheliale Natriumkanäle (ENaC - diese steigern die Salzaufnahme der Zelle) im distalen Colon
("Titration" des Salzhaushalts). Dieser Weg ist sehr spezifisch und
effizient; er ist unabhängig von Glucose, Bicarbonat oder
intrazellulären second messengers, ist von mikromolaren Konzentrationen des
Diuretikums Amilorid blockierbar und reagiert auf Aldosteron.
Elektrogen über epitheliale Natriumkanäle (ENaC - diese steigern die Salzaufnahme der Zelle) im distalen Colon
("Titration" des Salzhaushalts). Dieser Weg ist sehr spezifisch und
effizient; er ist unabhängig von Glucose, Bicarbonat oder
intrazellulären second messengers, ist von mikromolaren Konzentrationen des
Diuretikums Amilorid blockierbar und reagiert auf Aldosteron.
Aldosteron
regt die Salzaufnahe an, indem es
 die Öffnungswahrscheinlichkeit der Natriumkanäle erhöht - der Effekt tritt innerhalb von Sekunden auf
die Öffnungswahrscheinlichkeit der Natriumkanäle erhöht - der Effekt tritt innerhalb von Sekunden auf

 aus dem Vesikelpool mehr Natriumkanäle in die apikale Membran verlagert - dieser Effekt braucht mehrere Minuten
aus dem Vesikelpool mehr Natriumkanäle in die apikale Membran verlagert - dieser Effekt braucht mehrere Minuten

 die Synthese neuer Natriumkanäle und Na+-K+-ATPase anregt - das dauert Stunden.
die Synthese neuer Natriumkanäle und Na+-K+-ATPase anregt - das dauert Stunden.
Das Lumen wird durch die Resorption von Na+ negativ geladen,
was die Chloridaufnahme erleichtert.
Basolateral sorgt die Na-K-ATPase für den Weitertransport von Natrium, d.h. Na+ wird im Austausch gegen K+ aus der Zelle gepumpt.
Chlorid: Resorption und Sekretion
Die
Aufnahme von Chlorid erfolgt ebenfalls im gesamten Darm - parazellulär
oder transzellulär. Sie ist meist an die Resorption von Natrium
gekoppelt (Kochsalzaufnahme; Bedeutung für den Kreislauf s. oben)
- durch das an der epithelialen Zellmembran vorliegende Potential oder
den intrazellulären pH-Wert, kann aber auch unabhängig von Natrium
vonstatten gehen.
Folgende Mechanismen für eine Resorption von Chloridionen stehen zur Verfügung ( Abbildung):
Abbildung):

 Abbildung: Chloridaustausch über die Darmwand
Abbildung: Chloridaustausch über die Darmwand
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 3rd ed., Elsevier 2016
Resorption

Links oben: Chloridresorption spannungsabhängig parazellulär (durch tight junctions) sowie dem Konzentrationsgradienten folgend über apikale und basolaterale Cl-Kanäle
Links unten: Elektroneutraler Chloridaustausch gegen Bicarbonat, CA = Carboanhydrase
Rechts oben: Elektroneutrale Kochsalzresorption durch parallelen Austausch Na/H und Cl/HCO3. Der intrazelluläre pH-Wert koppelt die Mechanismen
Sekretion

Rechts unten: Elektrogene Sekretion von Chlorid. Der basolaterale Na/K/Cl-Symporter (NKCC1) schleust Chlorid in die Zelle, dieses wird apikal sezerniert (CFTR = Cystic Fibrosis Transmembrane Conductance Regulator). Natrium wandert parazellulär lumenwärts


Passive
spannungsabhängige Aufnahme,
getrieben über das (lumen-negative) transepitheliale
Potential:
Entweder durch Chloridkanäle in der apikalen und basolateralen Membran
der Epithelzellen, oder parazellulär über
tight junctions
 Elektroneutral über Austausch mit Bicarbonat über den apikalen Cl-/HCO3--Antiporter.
Durch diesen gelangt Bicarbonat in das Darmlumen; dieser Mechanismus
findet sich in den Zotten des Ileum sowie am Oberflächenepithel des
Colon
Elektroneutral über Austausch mit Bicarbonat über den apikalen Cl-/HCO3--Antiporter.
Durch diesen gelangt Bicarbonat in das Darmlumen; dieser Mechanismus
findet sich in den Zotten des Ileum sowie am Oberflächenepithel des
Colon
 In der interdigestiven Periode ("Nüchternzustand") kommt es im Ileum und proximalen Colon zu parallelem Austausch mittels Na+/H+-Austausch (NHE3) und Cl-/HCO3--Antiport (chloride anion exchanger,, auch DRA: down-regulated in adenoma) - Chlorid gelangt apikal in die Zelle und basolateral weiter Richtung Blut.
In der interdigestiven Periode ("Nüchternzustand") kommt es im Ileum und proximalen Colon zu parallelem Austausch mittels Na+/H+-Austausch (NHE3) und Cl-/HCO3--Antiport (chloride anion exchanger,, auch DRA: down-regulated in adenoma) - Chlorid gelangt apikal in die Zelle und basolateral weiter Richtung Blut.
 Stuhl ist bicarbonatreich; Durchfälle bedeuten Bicarbonatverlust und können metabolische Azidose bewirken.
Stuhl ist bicarbonatreich; Durchfälle bedeuten Bicarbonatverlust und können metabolische Azidose bewirken.
Sekretion: Chlorid wird auch im gesamten Darm sezerniert
(transzellulär, im Bereich der Krypten). Das findet im Ruhezustand nur
in geringem Ausmaß statt, kann aber durch Aztylcholin und andere
Neurotransmitter angeregt werden (Sekretagoga: sekretionsfördernde Stoffe). Die Chloridsekretion ist elektrogen (negatives Potential im Lumen) und involviert mehrere Ionenkanäle ( Abbildung):
Abbildung):
 Apikal sorgen Chloridkanäle für den Austritt von Cl-
über den Bürstensaum ins Darmlumen - Chlorid wird sezerniert. Die
intrazelluläre Chloridkonzentration ist dafür ausreichend hoch, dank
des Na/K/2Cl-Cotransporters in der basolateralen Membran. Sekretagoga steigern den intrazellulären [cAMP]- oder [Ca++]-Wert,
was subapikale Vesikel veranlasst, mit der Bürstensaummembran zu
fusionieren und so die Zahl verfügbarer Chloridkanäle zu steigern.
Apikal sorgen Chloridkanäle für den Austritt von Cl-
über den Bürstensaum ins Darmlumen - Chlorid wird sezerniert. Die
intrazelluläre Chloridkonzentration ist dafür ausreichend hoch, dank
des Na/K/2Cl-Cotransporters in der basolateralen Membran. Sekretagoga steigern den intrazellulären [cAMP]- oder [Ca++]-Wert,
was subapikale Vesikel veranlasst, mit der Bürstensaummembran zu
fusionieren und so die Zahl verfügbarer Chloridkanäle zu steigern.
 Basolateral
Basolateral sind drei Transporter beteiligt:
 Na+-K+-2Cl--Cotransporter
Na+-K+-2Cl--Cotransporter bringen Chlorid in die Zelle, außerdem Natrium- und Kaliumionen

Kalium verlässt die Zelle über
Kaliumkanäle,

Natrium über die
Na+-K+-ATPase - jeweils in Richtung Blut
Natrium folgt dem Chlorid parazellulär, getrieben durch das negative Lumenpotential.
CFTR-Chloridkanäle (Cystic Fibrosis Transmembrane Conductance Regulator)
erleichern den Kationendurchtritt durch Zellmembranen nicht nur im
Darm, sondern auch Leber, Pankreas, Lunge, Haut, Urogenitalsystem,
Schweißdrüsen. CFTR ist ein System, durch das
Chlorid sezerniert werden kann.
CFTR-Kanäle spielen bei zystischer Fibrose eine entscheidende Rolle, daher ihr Name.
Kalium: Resorption und Sekretion
Kaliumionen werden im Darm sowohl sezerniert als auch resorbiert; der Darm trägt damit zur Kalium-Homöostase
bei. Die Nahrung liefert etwa 70-120 mM/d Kalium (empfohlener Richtwert 120 mM/d, entsprechend 4,7g), dazu kommt Kalium in Sekreten (Speichel, Magen, Pankreas, Galle). Mit
dem Stuhl gehen nur etwa 10 mM/d verloren (die Kaliumkonzentration im
Stuhl beträgt häufig über 100 mM/l, vergleichbar der intrazellulären
Kaliumkonzentration). Der resultierende Überschuss (Zufuhr über Nahrung und sezernierte Flüssigkeiten minus Kalium im Stuhl) wird von den Nieren ausgeschieden.

 Abbildung: Mechanismen der Resorption und Sekretion von Kalium im Darm
Abbildung: Mechanismen der Resorption und Sekretion von Kalium im Darm
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 3rd ed., Elsevier 2016
Resorption: Links oben passiv im Dünndarm (wahrscheinlich über solvent drag), rechts unten aktiv im distalen Colon (mittels apikaler H/K-Pumpe)
Sekretion: Links unten passiv aus dem Colon (primär über tight junctions, angetrieben durch lumen-negatives Potential), rechts oben aktiv im colon ascendens (Zusammenspiel von Na/K-Pumpe und Na/K/Cl-Symporter, Kalium diffundiert durch apikale K-Kanäle)

 Abbildung).
Abbildung).
 Kaliumresorption:
Kaliumresorption:
 Im Dünndarm erfolgt K+-Resorption passiv-parazellulär höchstwahrscheinlich durch solvent drag - mit Wasser,
Im Dünndarm erfolgt K+-Resorption passiv-parazellulär höchstwahrscheinlich durch solvent drag - mit Wasser,
 im distalen Colon gekoppelt mit
Natriumtransport: Ein luminaler ATP-verbrauchender Transporter tauscht H+ (lumenwärts) gegen K+ (in die Zelle), das dann die Epithelzelle über die Basolateralmembran verlässt.
im distalen Colon gekoppelt mit
Natriumtransport: Ein luminaler ATP-verbrauchender Transporter tauscht H+ (lumenwärts) gegen K+ (in die Zelle), das dann die Epithelzelle über die Basolateralmembran verlässt.
 Der Dickdarm sezerniert Kalium (vor allem bei Kalium-Überangebot)
Der Dickdarm sezerniert Kalium (vor allem bei Kalium-Überangebot)
 hauptsächlich passiv-parazellulär über
lumen-negatives transepitheliales Potential (um die 25 mV), das die Kaliumionen anzieht - aber auch
hauptsächlich passiv-parazellulär über
lumen-negatives transepitheliales Potential (um die 25 mV), das die Kaliumionen anzieht - aber auch
 aktiv: Basolateral arbeiten Na/K-ATPase und Na/K/2Cl-Cotransporter zusammen, Kalium verlässt die Zelle über Kaliumkanäle sowohl in der apikalen als auch der basolateralen Membran.
aktiv: Basolateral arbeiten Na/K-ATPase und Na/K/2Cl-Cotransporter zusammen, Kalium verlässt die Zelle über Kaliumkanäle sowohl in der apikalen als auch der basolateralen Membran.
Kalium verlässt die Zelle über apikale Kaliumkanäle (Sekretion) und wird basolateral ausgetauscht, wobei die NA/K-ATPase niedriges intrazelluläres [Na+] garantiert und der Na/K/2Cl-Cotransporter Natrium, Kalium und Chlorid gleichzeitig und elektroneutral durch die Membran treten lässt (K+-Recycling, "pump-leak model"). Das
Verhältnis der Zahl von apikalen zu basolateralen Kaliumkanälen
bestimmt das Ausmaß der Kaliumsekretion im Dickdarm. Im Ruhezustand
überwiegen die basolateralen Kaliumkanäle (niedrige Sekretionsrate). Aldosteron erhöht die Aktivität der K+-Permeasen in der apikalen Membran und regt so die Kaliumsekretion an, gleichzeitig fördert es die Aktivität der Na/K-Pumpe.
Resorption von Calcium und Phosphat
 Etwa 200 mg Calcium (Ca++) werden pro Tag vom proximalen Dünndarm resorbiert. Das ist etwa die gleiche Menge, die mit dem Harn ausgeschieden wird. Die Resorption erfolgt teils passiv-parazellulär, teils unter Vitamin D-Wirkung aktiv-transzellulär (nur im Duodenum - angetrieben durch Konzentrations- und elektrische Gradienten
Etwa 200 mg Calcium (Ca++) werden pro Tag vom proximalen Dünndarm resorbiert. Das ist etwa die gleiche Menge, die mit dem Harn ausgeschieden wird. Die Resorption erfolgt teils passiv-parazellulär, teils unter Vitamin D-Wirkung aktiv-transzellulär (nur im Duodenum - angetrieben durch Konzentrations- und elektrische Gradienten):

 Abbildung:
Abbildung: Calc
iumaufnahme im Duodenum
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 3rd ed., Elsevier 2016
Der Dünndarm resorbiert Ca++ über zwei Mechanismen:

 Passiv-parazellulär (im gesamten Dünndarm), dieser Weg ist nicht vitaminkontrolliert; und
Passiv-parazellulär (im gesamten Dünndarm), dieser Weg ist nicht vitaminkontrolliert; und
 aktiv-transzellulär (nur im Zwölffingerdarm).
aktiv-transzellulär (nur im Zwölffingerdarm). Calc
iumionen gelangen apikal über den Calc
iumtransporter TRPV6 in die Schleimhautzelle. Die Synthese des TRPV6 und des Calbindin ist Vitamin-D-abhängig.
In der Zelle wird Ca++ über Calbindin
gepuffert (die Konzentration an freien Calc
iumionen in Zytoplasma
bleibt niedrig) und kann auch von Organellen wie dem endoplasmatischen
Retikulum gespeichert werden.
Der Enterozyt exportiert dann Ca++ basolateral über einen Na+/Ca++-Austauscher (NCX1) sowie eine H+/Ca++-Pumpe (ATPase) - die Synthese beider wird gefördert durch Vitamin D3 (Calc
itriol)

 Zuerst durch Ca++-Kanäle - Typ TRPV6
- der apikalen Bürstensaum-Membran, getrieben von einem
elektrochemischen Gradienten (Vitamin-D-Hormon fördert ihre
Expression);
Zuerst durch Ca++-Kanäle - Typ TRPV6
- der apikalen Bürstensaum-Membran, getrieben von einem
elektrochemischen Gradienten (Vitamin-D-Hormon fördert ihre
Expression);
 dann gebunden an Calbindin
(ein tetravalentes Transportprotein für Calcium, das sich außer in
Darm- auch in Gehirn-, Nieren- und Inselzellen findet), was die
Konzentration freier Ca++-Ionen in der Zelle niedrig und dadurch den Konzentrationsgradienten aufrecht erhält (Vitamin-D-Hormon fördert seine Expression);
dann gebunden an Calbindin
(ein tetravalentes Transportprotein für Calcium, das sich außer in
Darm- auch in Gehirn-, Nieren- und Inselzellen findet), was die
Konzentration freier Ca++-Ionen in der Zelle niedrig und dadurch den Konzentrationsgradienten aufrecht erhält (Vitamin-D-Hormon fördert seine Expression);
 und dann via basolaterale Membran aktiv über einen Na+-Ca++-Austauscher (NCX; Antrieb durch den Natriumgradienten) und vor allem - unter Energieverbrauch - eine H+-Ca++-Pumpe (Antrieb durch ATP: Plasma membrane Ca++ ATPase, PMCA - Vitamin-D-Hormon fördert seine Expression).
und dann via basolaterale Membran aktiv über einen Na+-Ca++-Austauscher (NCX; Antrieb durch den Natriumgradienten) und vor allem - unter Energieverbrauch - eine H+-Ca++-Pumpe (Antrieb durch ATP: Plasma membrane Ca++ ATPase, PMCA - Vitamin-D-Hormon fördert seine Expression).
Vermehrte Resorption von Calcium steigert den Plasma-[Ca++]; das hemmt die Sekretion von Parathormon aus den Epithelkörperchen (Nebenschilddrüse), was wiederum die Aktivierung des Vitamin D3 aus seiner Vorstufe einbremst. Daraus ergibt sich eine negative Rückkopplung:
Vermehrte Resorption von Calcium senkt die Vit-D3-Synthese, was
wiederum im Darmepithel die Bildung von Faktoren senkt, die für die
Resorption von Calcium benötigt werden.
Duodenale Mucosazellen transportieren Ca++ aktiv aus dem Darmlumen in das Interstitium
|
Vitamin D fördert alle
transzellulären Mechanismen des Calciumtransports, insbesondere die
Calbindinsynthese, in der Duodenal- und Jejunalschleimhautzelle. Nimmt
die Ca++-Zufuhr mit der Nahrung ab, steigt - über Vit-D3 - die Effizienz der Ca++-Resorption. Parathormon wirkt indirekt fördernd auf die Calciumresorption, indem es die renale 1α-Hydroxylase und somit die Vitamin D-Synthese anregt.
Vitamin D (Calcitriol) regt die Resorption von Calcium und Phosphat im Dünndarm an
|

 Abbildung: Phosphataufnahme im Jejunum
Abbildung: Phosphataufnahme im Jejunum
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 3rd ed., Elsevier 2016
Die apikale
Membran der Mucosazellen im Dünndarm nimmt anorganisches Phosphat (Pi)
über einen Cotransporter mit Natrium auf (NaPi) - dies ist vermutlich
der geschwindigkeitsbestimmende Schritt der Phosphatresorption. Die
basolaterale Membran exportiert Phosphat Richtung Kreislauf.
Vitamin D3 stimuliert die Proteinsynthese und damit auch die Bildung des Na/Phosphat-Cotransporters

 Phosphat wird in erster Linie proportional zur angebotenen Menge in der Nahrung resorbiert. Der Niere
kommt daher eine bedeutende Rolle für die Kontrolle des
Phosphathaushalts zu. Proximale Tubuluszellen resorbieren dort Phosphat
über einen Na/Pi-Cotransporter ihrer apikalen Membran. Dieser arbeitet hormonabhängig: Parathormon verringert seine Expression und damit die Phosphataufnahme, bei Phosphatüberschuss steigt die Ausscheidung mit dem Harn.
Phosphat wird in erster Linie proportional zur angebotenen Menge in der Nahrung resorbiert. Der Niere
kommt daher eine bedeutende Rolle für die Kontrolle des
Phosphathaushalts zu. Proximale Tubuluszellen resorbieren dort Phosphat
über einen Na/Pi-Cotransporter ihrer apikalen Membran. Dieser arbeitet hormonabhängig: Parathormon verringert seine Expression und damit die Phosphataufnahme, bei Phosphatüberschuss steigt die Ausscheidung mit dem Harn.
Hauptsächlich das Jejunum resorbiert Phosphat ( Abbildung) mit Hilfe eines Na+/PO4---Symporters (ungefähr 1 g/d, 70-80% der mit der Nahrung zugeführten Menge,
Abbildung) mit Hilfe eines Na+/PO4---Symporters (ungefähr 1 g/d, 70-80% der mit der Nahrung zugeführten Menge,  s. dort).
In "organischer" Form angebotenes Phosphat (z.B. in Phospholipidem)
wird zu "anorganischem" Phosphat (Phosphatsalz) hydrolysiert, um
resorbiert werden zu können. Die Resorption ist durch die Kapazität von NPT2 begrenzt, einer Isoform des Na-Pi-Cotransporters in der apikalen Membran der Mucosazellen.
s. dort).
In "organischer" Form angebotenes Phosphat (z.B. in Phospholipidem)
wird zu "anorganischem" Phosphat (Phosphatsalz) hydrolysiert, um
resorbiert werden zu können. Die Resorption ist durch die Kapazität von NPT2 begrenzt, einer Isoform des Na-Pi-Cotransporters in der apikalen Membran der Mucosazellen.
Calcitriol (Vit. D3-Hormon) fördert die Phosphataufnahme ein wenig, es hat nur geringen Einfluss auf die Resorptionsrate.
Eisenresorption

s. auch
dort
Die
Resorption von Eisen erfolgt im Duodenum und oberen Ileum (bei schweren Mangelzuständen
auch im Jejunum). Hier ist Eisen bei einem pH zwischen 5 und 7 (saurer
Magensaft!) sowohl als Fe2+ als auch in Hämin löslich. Eisen wechselt zwischen zweiwertiger (Transport durch die Zellmembran)
und dreiwertiger Form (an Ferritin, Transferrin u.a. gebunden). Dazu
bedarf es der Tätigkeit von Oxidasen (Ferroxidasen: Fe2+ → Fe3+) und Reduktasen (Ferrireduktase: Fe3+ → Fe2+).

 Abbildung: Resorption von freiem und Hämeisen an einer duodenalen Mucosazelle
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 3rd ed., Elsevier 2016
Abbildung: Resorption von freiem und Hämeisen an einer duodenalen Mucosazelle
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 3rd ed., Elsevier 2016
Nahrungseisen liegt im Wesentlichen in zwei Formen vor: Frei (Nichthämeisen) oder an eine Hämgruppe gebunden (Hämeisen). Die Mechanismen der Aufnahme sind unterschiedlich:
 Nichthämeisen ist die mengenmäßig führende Form von Eisen in der Nahrung, Es wird von DcytB (duodenales Cytochrom B) reduziert und dann von DMT (divalent metal transporter) als Fe2+,
Nichthämeisen ist die mengenmäßig führende Form von Eisen in der Nahrung, Es wird von DcytB (duodenales Cytochrom B) reduziert und dann von DMT (divalent metal transporter) als Fe2+,
 Häm mit dem darin enthaltenen als Fe2+ wahrscheinlich über ein Carrier-Protein (HCP: haem carrier protein) aufgenommen. Häm wird in Lysosomen abgebaut und Fe++
freigesetzt. Es wird dann basolateral exportiert (niedrige
Eisenspeicher im Körper) oder in Form von Ferritin in der Zelle
gespeichert (Eisenspeicher gefüllt).
Aufgenommene Wasserstoffionen werden an der apikalen Membran über einen
Na/H-Austauscher gegen Natrium wieder exportiert, und Natrium
basolateral über die Na/K-ATPase entfernt (nicht gezeigt).
Über Mobilferrin gelangt zweiwertiges Eisen an die basolaterale Membran, wo es zuerst durch Ferroportin nach extrazellulär verfrachtet und direkt daneben von Hephaestin zu Fe3+ oxidiert wird.
In dieser Form gelangt es ins Blut und wird von Transferrin
Häm mit dem darin enthaltenen als Fe2+ wahrscheinlich über ein Carrier-Protein (HCP: haem carrier protein) aufgenommen. Häm wird in Lysosomen abgebaut und Fe++
freigesetzt. Es wird dann basolateral exportiert (niedrige
Eisenspeicher im Körper) oder in Form von Ferritin in der Zelle
gespeichert (Eisenspeicher gefüllt).
Aufgenommene Wasserstoffionen werden an der apikalen Membran über einen
Na/H-Austauscher gegen Natrium wieder exportiert, und Natrium
basolateral über die Na/K-ATPase entfernt (nicht gezeigt).
Über Mobilferrin gelangt zweiwertiges Eisen an die basolaterale Membran, wo es zuerst durch Ferroportin nach extrazellulär verfrachtet und direkt daneben von Hephaestin zu Fe3+ oxidiert wird.
In dieser Form gelangt es ins Blut und wird von Transferrin weiterbefördert

Eisen liegt in der Nahrung in folgenden Formen vor:
 Gut
resorbierbar (zu 10-20%; bei Schwangeren bis zu 40%) ist Eisen in
organischer Bindung (Hämeisen in
Fleisch, Blutprodukten, Ferritin),
Gut
resorbierbar (zu 10-20%; bei Schwangeren bis zu 40%) ist Eisen in
organischer Bindung (Hämeisen in
Fleisch, Blutprodukten, Ferritin),
 weniger gut (zu 1-7%) aus pflanzlichen
Quellen (Nicht-Häm-Eisen). Besonders Phosphate behindern die Resorption von Nicht-Häm-Eisen; Fleisch und Ascorbinsäure begünstigen sie.
weniger gut (zu 1-7%) aus pflanzlichen
Quellen (Nicht-Häm-Eisen). Besonders Phosphate behindern die Resorption von Nicht-Häm-Eisen; Fleisch und Ascorbinsäure begünstigen sie.
Die enterische Eisenresorption beträgt im Schnitt 1-2 mg/d, sie
kann (bei Eisenmangel) auf maximal 2-5 mg/d gesteigert werden (was eine
nur langsame Kompensation von Eisenmangel zulässt, z.B. während und nach
Schwangerschaften).
Die Eisenresorption verbessert sich bei gleichzeitiger Anwesenheit von Vitamin
C, Zitronensäure, Eiweiß. Zahlreiche pflanzliche Stoffe hemmen hingegen die Eisenresorption, z.B.
Oxalsäure (reichlich vorhanden in Spinat, Rhabarber, Schokolade) und
Gerbstoffe (Rotwein, schwarzer Tee!).
 In der Nahrung vorhandenes freies Eisen liegt vorwiegend in dreiwertiger (unresorbierbarer) Form vor. Es wird teils im Magen (mit seinem niedrigen pH), teils in Duodenum und oberem Ileum von Ferrireduktase (DcytB - Duodenal cytochrome B) des enterozytären Bürstensaums - noch extrazellulär - in zweiwertige Form gebracht und dann mittels des divalenten Metalltransporters (DMT-1) in die Zelle aufgenommen. Die Expression von DcytB scheint durch mehrere Faktoren beeinflusst zu werden, welche so die Eisenaufnahme regulieren.
In der Nahrung vorhandenes freies Eisen liegt vorwiegend in dreiwertiger (unresorbierbarer) Form vor. Es wird teils im Magen (mit seinem niedrigen pH), teils in Duodenum und oberem Ileum von Ferrireduktase (DcytB - Duodenal cytochrome B) des enterozytären Bürstensaums - noch extrazellulär - in zweiwertige Form gebracht und dann mittels des divalenten Metalltransporters (DMT-1) in die Zelle aufgenommen. Die Expression von DcytB scheint durch mehrere Faktoren beeinflusst zu werden, welche so die Eisenaufnahme regulieren.
 Parallel dazu gibt es einen anderen Aufnahmemechanismus: In Fleisch liegt Eisen an Häm gebunden vor und wird in dieser Form aufgenommen - mittels eines Häm-Rezeptors (HCP: haem carrier protein) im Bürstensaum - und erst im Enterozyten aus dieser Bindung herausgelöst.
Parallel dazu gibt es einen anderen Aufnahmemechanismus: In Fleisch liegt Eisen an Häm gebunden vor und wird in dieser Form aufgenommen - mittels eines Häm-Rezeptors (HCP: haem carrier protein) im Bürstensaum - und erst im Enterozyten aus dieser Bindung herausgelöst.
Wenn die Eisenspeicher im Körper gefüllt sind und kein weiteres Eisen benötigt wird, verbleibt das aufgenommene Eisen in der Darmschleimhautzelle, als Fe3+ an Apoferritin gebunden - woraus sich die wichtigste intrazelluläre Speicherform Ferritin ergibt. (Aus Ferritin kann in der Zelle Hämosiderin entstehen - ein Speicherkomplex, der aus teilweise verdautem Ferritin und Lysosomen besteht und zu Hämosiderose
führen kann. Das kann - im Rahmen einer Systemüberlastung mit Eisen,
z.B. infolge zahlreicher Bluttransfusionen - in Zellen des
Phagozytensystems passieren, auch in Epithelzellen der Leber und
Nieren.)
Ansonsten wird das Eisen über die basolaterale Membran an das Blut weitergegeben. Dazu bedarf es eines Eisentransporters - Ferroportin -, der Fe2+ durch die basolaterale Membran lässt; und einer Ferroxidase, welche das Eisen wieder in dreiwertige Form bringt: Hephästin. So kann Fe3+ an Transferrin im Blut abgegeben und weitertransportiert werden.
 Näheres zur Physiologie des Eisens s. dort
Näheres zur Physiologie des Eisens s. dort
Eisen kann am effizientesten als Hämeisen (Fleisch, Blut) resorbiert werden
|
 Da es keinen Mechanismus zur Regulation der Eisenexkretion gibt, ist
die Steuerung der Aufnahme der einzige Angriffspunkt für die Regulation
des Eisenstatus im Körper.
Da es keinen Mechanismus zur Regulation der Eisenexkretion gibt, ist
die Steuerung der Aufnahme der einzige Angriffspunkt für die Regulation
des Eisenstatus im Körper.

Zur
Interaktiom von Darm (Resorption), Leber (Speicherung), Knochenmark (Erythropoese), Milz (Ery-Abbau) und Nieren (Erythropoetin) s. auch
dort
Resorption von Vitamin B12
Vitamin B12 (Cobalamine) bindet zunächst an Haptocorrin
- auch Transcobalamin-1 (TC-1) oder Cobalophilin -, ein Glykoprotein,
das die Speicheldrüsen bei Nahrungsaufnahme sezernieren. Haptocorrin
ist resistent gegenüber Säure- und Pepsineinfluss und schützt so das
Vitamin bei seiner Passage durch den Magen. Im Duodenum wird Haptocorrin durch pankreatische Peptidasen abgebaut.

 Abbildung: Kobalamin-"Handling" im Magen und proximalen Dünndarm
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 3rd ed., Elsevier 2016
Abbildung: Kobalamin-"Handling" im Magen und proximalen Dünndarm
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 3rd ed., Elsevier 2016
Vitamin
B12 bindet an Nahrungsprotein, dann an das von Speicheldrüsen (und im Magen?) produzierte Glykoprotein Haptocorrin,
anschließend im Dünndarm an (im Magen gebildeten) Intrinsic factor. Die
Resorption des B12-IF-Komplexes erfolgt im Ileum
CBL = Kobalamin (Vit. B12), IF = Intrinsic Factor, TCII = Transkobalamin II

Vitamin
B12 wird im Mund an Haptocorrin gebunden, ein Glykoprotein, das Speicheldrüsen bei Nahrungsaufnahme sezernieren.
Haptocorrin ist resistent gegen die Einwirkung von Pepsin und
Salzsäure, und ermöglicht dem gebundenen Vitamin eine unbeschadete
Passage durch den Magen.
Im Duodenum wird Haptocorrin durch pankreatische Enzyme abgebaut; an seine Stelle tritt Intrinsic factor (IF), ein Glykoprotein, das im Magen von Belegzellen freigesetzt wird.
Die Bindung von Cobalamin an IF erfolgt erst im Duodenum - nach Abbau des Haptocorrins. Anwesenheit von Ca++- oder Mg++-Ionen
sowie ein alkalischer pH-Wert fördern diesen Vorgang. Der entstandene
Komplex ist resistent gegenüber den Verdauungsprozessen im Duodenum. An IF komplexiert, wird das Vitamin im unteren Ileum
(wo auch Folat zur Aufnahme gelangt) - vermutlich mittels rezeptorvermittelter Endozytose - resorbiert ( Abbildung).
Abbildung).
Der Intrinsic
factor-Cobalamin-Komplex wird dann lysosomal abgebaut, Cobalamin an Transcobalamin gebunden und dieser Komplex durch Exozytose sekretorischer Vesikel an das Interstitium weitergegeben ( Abbildung).
Abbildung).
Auch für die Aufnahme von Folsäure gibt es einen speziellen Mechanismus (Folat-Polyglutamat-Carrier). Die Resorption erfolgt im Duodenum und Jejunum.
Beide
Vitamine werden
zur Purin- und Pyrimidinsynthese (hauptsächlich Thymidylat) und damit
zum Aufbau von DNA benötigt.
Steuerung der Ionenresorption
Neuronen
des Darmnervensystems, endokrine und Immunzellen der lamina propria
sezernieren Mediatoren, welche die Resorptions- oder
Sekretionstätigkeit anregen. So produzieren

Makrophagen Prostaglandine und
Sauerstoffradikale;

Mastzellen
Histamin;

neutrophile Granulozyten
Eikosanoide und
PAF;

Fibroblasten Eikosanoide und
Bradykinin.
Zu den Mediatoren, die aus dem
Darmnervensystem stammen, zählen Histamin,
Serotonin,
VIP. Acetylcholin aktiviert u.a. die aktive
Chloridresorption.
Das endokrine System wirkt z.B. über die
Angiotensin-Aldosteron-Achse auf den Elektrolythaushalt: Diese regt die Natriumresorption an (Angiotensin im Dünndarm, Aldosteron im Colon).
Stoffe, welche die Sekretion anregen, nennt man sekretagog (αγω =
antreiben, in Bewegung setzen). Man kann sie nach Typus (Hormone,
Neurotransmitter, Zytokine etc.) oder involvierte
Second-messenger-Mechanismen klassiizieren (cAMP, cGMP, Calciumionen).

 Erkrankungen,
bei denen der Bürstensaum defekt ist (z.B. Zöliakie
Erkrankungen,
bei denen der Bürstensaum defekt ist (z.B. Zöliakie  ),
sind durch schwere
Resorptionsstörungen gekennzeichnet (charakteristischer Stuhl:
voluminös, vergoren, faul riechend). Ursache der Zöliakie ist eine
immunologische Reaktion auf Klebereiweiß (Weizenproteine wie Gliadin),
die in die Schleimhaut eingedrungen sind.
),
sind durch schwere
Resorptionsstörungen gekennzeichnet (charakteristischer Stuhl:
voluminös, vergoren, faul riechend). Ursache der Zöliakie ist eine
immunologische Reaktion auf Klebereiweiß (Weizenproteine wie Gliadin),
die in die Schleimhaut eingedrungen sind.
 Bei Mukoviszidose ist die Cl--Sekretion gestört, weil der CFTR-Chloridkanal defekt ist. Der Darminhalt wird eingedickt, es kann Mekoniumileus (mekoniumbedingter Darmverschluss) auftreten.
Bei Mukoviszidose ist die Cl--Sekretion gestört, weil der CFTR-Chloridkanal defekt ist. Der Darminhalt wird eingedickt, es kann Mekoniumileus (mekoniumbedingter Darmverschluss) auftreten.
 Ist
die Zuckerresorption über SGLT1 gestört (Glucose-Galactose-Malabsorption),
kann der Kohlenhydratbedarf auch über Fruktose gedeckt werden
(ausreichender Gradient: Nüchtern-Fruktosespiegel im Blut <0,3 mM).
Ist
die Zuckerresorption über SGLT1 gestört (Glucose-Galactose-Malabsorption),
kann der Kohlenhydratbedarf auch über Fruktose gedeckt werden
(ausreichender Gradient: Nüchtern-Fruktosespiegel im Blut <0,3 mM).
 Vitamin B12- bzw. Folat- Mangel führt zu megaloblastärer ("perniziöser"
Vitamin B12- bzw. Folat- Mangel führt zu megaloblastärer ("perniziöser"  ) Anämie
(das Vitamin ist für die Blutbildung notwendig) bzw. funikulärer
Myelose
) Anämie
(das Vitamin ist für die Blutbildung notwendig) bzw. funikulärer
Myelose  (Entmarkungserkrankung, die zu motorischen und
sensorischen Defiziten führt).
(Entmarkungserkrankung, die zu motorischen und
sensorischen Defiziten führt).
 Kleinkinder können Lactose in der Milch meist
problemlos verwerten. Viele Erwachsene hingegen weisen geringe
Laktaseaktivität im Dünndarm auf und vertragen daher Milchzucker in der Ernährung nur schlecht (Lactoseintoleranz).
Die Inzidenz liegt zwischen <40% (indo-europäischer Raum, Nordamerika) bis >70% (Asien,
Afrika, Südamerika -
Kleinkinder können Lactose in der Milch meist
problemlos verwerten. Viele Erwachsene hingegen weisen geringe
Laktaseaktivität im Dünndarm auf und vertragen daher Milchzucker in der Ernährung nur schlecht (Lactoseintoleranz).
Die Inzidenz liegt zwischen <40% (indo-europäischer Raum, Nordamerika) bis >70% (Asien,
Afrika, Südamerika -  Abbildung).
Abbildung).

 Abbildung: Globale Häufigkeitsverteilung der Lactoseintoleranz
Abbildung: Globale Häufigkeitsverteilung der Lactoseintoleranz
Nach einer Vorlage bei Wikipedia / Verein für Laktoseintoleranz / Die Zeit
Die Mehrzahl erwachsener Personen nördlich der Äquatorialzone (außer Grönland: Inuit) sowie in Australien / Neuseeland (Einwanderer) verträgt Lactose. In Asien,
Afrika, Mittel- und Südamerika beheimatete Menschen tolerieren Lactose
(Milch, Milchprodukte) hingegen nur zu einem geringen Prozentsatz

 Orale Rehydratation. Die Resorption von Natrium ist sehr stabil (z.B. SGLT1-vermittelte
nährstoffgekoppelte Aufnahme) und erfolgt weitgehend unabhängig von der
Einwirkung von second messenger (wie cAMP, Ca++-Ionen), auch im Falle von
Infektionen mit enterotoxinbildenden Bakterien. Solche Toxine
verursachen Durchfallerkrankungen. Trinken einer
Kochsalz-Glucose-Lösung führt zu Ersatz verlorengegangenen
Flüssigkeitsvolumens und stabilisiert Salz-Wasser-Bilanz und Kreislauffunktion.
Orale Rehydratation. Die Resorption von Natrium ist sehr stabil (z.B. SGLT1-vermittelte
nährstoffgekoppelte Aufnahme) und erfolgt weitgehend unabhängig von der
Einwirkung von second messenger (wie cAMP, Ca++-Ionen), auch im Falle von
Infektionen mit enterotoxinbildenden Bakterien. Solche Toxine
verursachen Durchfallerkrankungen. Trinken einer
Kochsalz-Glucose-Lösung führt zu Ersatz verlorengegangenen
Flüssigkeitsvolumens und stabilisiert Salz-Wasser-Bilanz und Kreislauffunktion.
 Kurzdarmsyndrom: Nach weitgehender Entfernung des Dünndarms (z.B. nach Mesenterialinfarkt) ist u.a. die Resorption der Gallensalze
gestört; diese werden von Darmbakterien dekonjugiert und regen dann die
Sekretion von Salz und Wasser an (die dann nicht ausreichend resorbiert
werden). Das regt die Colonpassage an und führt zu chologener Diarrhoe: Durchfälle durch mangelnde Resorption von Gallensäuren
(Gallensäurenverlustsyndrom). Übersteigt der Verlust an gallensauren
Salzen die Neubildung, resultiert daraus mangelhafte Fettresorption und
es treten Fettstühle auf (Steatorrhoe).
Kurzdarmsyndrom: Nach weitgehender Entfernung des Dünndarms (z.B. nach Mesenterialinfarkt) ist u.a. die Resorption der Gallensalze
gestört; diese werden von Darmbakterien dekonjugiert und regen dann die
Sekretion von Salz und Wasser an (die dann nicht ausreichend resorbiert
werden). Das regt die Colonpassage an und führt zu chologener Diarrhoe: Durchfälle durch mangelnde Resorption von Gallensäuren
(Gallensäurenverlustsyndrom). Übersteigt der Verlust an gallensauren
Salzen die Neubildung, resultiert daraus mangelhafte Fettresorption und
es treten Fettstühle auf (Steatorrhoe).


 Die Resorptionskapazität des Darms wird selten überschritten: Der minimale Energiebedarf beträgt
~7,5 MJ/d (Gehirn, Immunsystem, aktive Muskulatur) ~20 MJ/d bei intensivem Training. Die maximale Kapazität liegt meist eine
Zehnerpotenz über den Durchschnittswerten: Glucose 3000 g/d
(Bedarf ~300 g/d), Aminosäuren ~600 g (Bedarf ~60 g/d), Cholesterin
4000 mg/d (Bedarf ~200 mg/d oder
weniger), Eisen 12 mg/d (Bedarf 1-2 mg/d) (funktionelle Reserve) Die Resorptionskapazität des Darms wird selten überschritten: Der minimale Energiebedarf beträgt
~7,5 MJ/d (Gehirn, Immunsystem, aktive Muskulatur) ~20 MJ/d bei intensivem Training. Die maximale Kapazität liegt meist eine
Zehnerpotenz über den Durchschnittswerten: Glucose 3000 g/d
(Bedarf ~300 g/d), Aminosäuren ~600 g (Bedarf ~60 g/d), Cholesterin
4000 mg/d (Bedarf ~200 mg/d oder
weniger), Eisen 12 mg/d (Bedarf 1-2 mg/d) (funktionelle Reserve)
 Hauptort der Resorption ist der Dünndarm (~200 m2): Eisen und Calcium werden bereits im Duodenum, die meisten Nährstoffe im Jejunum vollständig resorbiert; Magnesium,
intrinsic factor, Vitamin B12 und
Gallensäuren im Ileum (Reserve für die Resorption anderer Nährstoffe). Der Dickdarm (0,5-1 m2) resorbiert Flüssigkeit, Elektrolyte, einige
Fettsäuren. Bioverfügbarkeit ist der Anteil eines
resorbierten Stoffes, der unverändert in den
Kreislauf geallgengenwärtigelangt; sie hängt von Durchblutung, Darmmotilität, pH im Magen,
enzymatischem Ab- bzw. Umbau in Darm und Leber ab Hauptort der Resorption ist der Dünndarm (~200 m2): Eisen und Calcium werden bereits im Duodenum, die meisten Nährstoffe im Jejunum vollständig resorbiert; Magnesium,
intrinsic factor, Vitamin B12 und
Gallensäuren im Ileum (Reserve für die Resorption anderer Nährstoffe). Der Dickdarm (0,5-1 m2) resorbiert Flüssigkeit, Elektrolyte, einige
Fettsäuren. Bioverfügbarkeit ist der Anteil eines
resorbierten Stoffes, der unverändert in den
Kreislauf geallgengenwärtigelangt; sie hängt von Durchblutung, Darmmotilität, pH im Magen,
enzymatischem Ab- bzw. Umbau in Darm und Leber ab
 Lipide
werden aus Mizellen besser resorbiert, Emulsion
durch Gallensäurern ist essentiell. Aus dem Mundspeichel zugesetzte
Lipasen und deren Aktivierung im sauren Milieu des Magens verseifen die
Fette des Nahrungsbreies bereits teilweise. Im oberen Duodenum treten
durch die Papilla Vateri Gallensäuren aus der Galle und weitere Lipasen
aus dem Pankreas hinzu, womit der Nahrungsbrei fortschreitend emulgiert
wird bis zu fein verteilten Micellen und in dieser Größe von der
Mucosa resorbiert werden kann. Lipide
werden aus Mizellen besser resorbiert, Emulsion
durch Gallensäurern ist essentiell. Aus dem Mundspeichel zugesetzte
Lipasen und deren Aktivierung im sauren Milieu des Magens verseifen die
Fette des Nahrungsbreies bereits teilweise. Im oberen Duodenum treten
durch die Papilla Vateri Gallensäuren aus der Galle und weitere Lipasen
aus dem Pankreas hinzu, womit der Nahrungsbrei fortschreitend emulgiert
wird bis zu fein verteilten Micellen und in dieser Größe von der
Mucosa resorbiert werden kann.
 Im
glatten endoplasmatischen Retikulum der Mucosa entstehen Triglyceride, Phospholipide und Cholesterinester (Fetttröpfchen), im
rauhen endoplasmatischen Retikulum Apoproteine; die Komponenten werden
zusammengebracht, Chylomikronen und VLDL-Partikel im Golgi-Apparat
glykosyliert, anschließend freigesetzt, und gelangen über die Darmlymphe unmittelbar zur
fettkonsumierenden Peripherie. Die Leber nimmt nicht
verbrauchte Fette auf und verwandelt sie z.T. in Phosphoglyzeride. Fettlösliche Vitamine (A, D, E, K) werden in analoger Weise resorbiert. Aus Linolsäure und α-Linolensäure (essentiell) entstehen Eikosanoide. Mit
steigendem Cholesterinangebot mit der Nahrung nimmt der Prozentsatz
resorbierten Cholesterins ab Im
glatten endoplasmatischen Retikulum der Mucosa entstehen Triglyceride, Phospholipide und Cholesterinester (Fetttröpfchen), im
rauhen endoplasmatischen Retikulum Apoproteine; die Komponenten werden
zusammengebracht, Chylomikronen und VLDL-Partikel im Golgi-Apparat
glykosyliert, anschließend freigesetzt, und gelangen über die Darmlymphe unmittelbar zur
fettkonsumierenden Peripherie. Die Leber nimmt nicht
verbrauchte Fette auf und verwandelt sie z.T. in Phosphoglyzeride. Fettlösliche Vitamine (A, D, E, K) werden in analoger Weise resorbiert. Aus Linolsäure und α-Linolensäure (essentiell) entstehen Eikosanoide. Mit
steigendem Cholesterinangebot mit der Nahrung nimmt der Prozentsatz
resorbierten Cholesterins ab
 Durch Cotransport mit Natriumionen kann ein mehr als 103-facher
Konzentrationsgradient überwunden und Glucose vollständig resorbiert
werden. Fruktose gelangt über den Transporter GLUT5 in die Epithelzelle
(erleichterte Diffusion).
Die basolaterale Membran transportiert Monosaccharide mittels GLUT2
weiter Richtung Blutkreislauf. Gelangt Glucose in den oberen Dünndarm,
produziert dieser GIP und GLP-1, beide regen die Insulinsekretion an (Inkretineffekt: orale Glucose ist stärker insulinwirksam als i.v. verabreichte) Durch Cotransport mit Natriumionen kann ein mehr als 103-facher
Konzentrationsgradient überwunden und Glucose vollständig resorbiert
werden. Fruktose gelangt über den Transporter GLUT5 in die Epithelzelle
(erleichterte Diffusion).
Die basolaterale Membran transportiert Monosaccharide mittels GLUT2
weiter Richtung Blutkreislauf. Gelangt Glucose in den oberen Dünndarm,
produziert dieser GIP und GLP-1, beide regen die Insulinsekretion an (Inkretineffekt: orale Glucose ist stärker insulinwirksam als i.v. verabreichte)
 Pepsin und Pankreasproteasen spalten Proteine zu ~70% zu Oligopeptiden, ~30% zu Aminosäuren (luminal); Exo-, Endo- und Dipeptidasen des Mucosa-Bürstensaums Oligopeptide zu Aminosäuren, Di- und Tripeptiden. Oligopeptide werden besonders rasch aufgenommen (kinetischer Vorteil gegenüber Aminosäuren). Für
den transzellulären Transport der Aminosäuren stehen ein "neutrales"
(neutrale Aminosäuren), "basisches" (kationische Aminosäuren, Zystein),
"saures" (Glutamat und Aspartat), "β-aminosaures" (ß-Alanin, Taurin) und ein "Iminoglyzinsystem" (Glyzin, Prolin, Hydroxyprolin) zur Verfügung, die teilweise natriumabhängig funktionieren. Weiters gibt es elektrogene PAT-Proteine im Bürstensaum, die Glyzin, Alanin, Serin und Prolin zusammen mit H+ in die Zelle transportieren. Etwa 10% der aufgenommenen Aminosäuren verwenden Enterozyten für ihre eigene Proteinsynthese. In der basolateralen Membran befinden sich mindestens fünf verschiedene Aminosäurepermeasen. Aminosäuren
können auch parazellulär resorbiert werden. Eiweißmoleküle können z.T.
unverändert aufgenommen werden, insbesondere von M-Zellen (Clathrin-Caveola-Mechanismus, Transzytose),
welche sie an Immunzellen weitergeben. Dieser Mechanismus erlaubt bei
Säuglingen die Aufnahme von Immunglobulinen aus der Muttermilch direkt
in die Blutbahn Pepsin und Pankreasproteasen spalten Proteine zu ~70% zu Oligopeptiden, ~30% zu Aminosäuren (luminal); Exo-, Endo- und Dipeptidasen des Mucosa-Bürstensaums Oligopeptide zu Aminosäuren, Di- und Tripeptiden. Oligopeptide werden besonders rasch aufgenommen (kinetischer Vorteil gegenüber Aminosäuren). Für
den transzellulären Transport der Aminosäuren stehen ein "neutrales"
(neutrale Aminosäuren), "basisches" (kationische Aminosäuren, Zystein),
"saures" (Glutamat und Aspartat), "β-aminosaures" (ß-Alanin, Taurin) und ein "Iminoglyzinsystem" (Glyzin, Prolin, Hydroxyprolin) zur Verfügung, die teilweise natriumabhängig funktionieren. Weiters gibt es elektrogene PAT-Proteine im Bürstensaum, die Glyzin, Alanin, Serin und Prolin zusammen mit H+ in die Zelle transportieren. Etwa 10% der aufgenommenen Aminosäuren verwenden Enterozyten für ihre eigene Proteinsynthese. In der basolateralen Membran befinden sich mindestens fünf verschiedene Aminosäurepermeasen. Aminosäuren
können auch parazellulär resorbiert werden. Eiweißmoleküle können z.T.
unverändert aufgenommen werden, insbesondere von M-Zellen (Clathrin-Caveola-Mechanismus, Transzytose),
welche sie an Immunzellen weitergeben. Dieser Mechanismus erlaubt bei
Säuglingen die Aufnahme von Immunglobulinen aus der Muttermilch direkt
in die Blutbahn
 Die Wasserbilanz mit der Umwelt beträgt ~2-3 l/d (Erwachsene). Von ca. 8-9 Litern Flüssigkeit, die täglich in den Dünndarm gelangen, resorbiert dieser 6-7 l; ~2 l resorbiert der
Dickdarm, mit dem Stuhl werden ~0,1 l Wasser ausgeschieden. Natrium (Erhaltung des extrazellulären Volumens) gelangt über Natriumkanäle, mit organischen
Substraten, im Cotransport mit Chlorid, oder im Austausch gegen
Wasserstoffionen in Enterozyten. Na/K-ATPasen exportieren es über die basolaterale Membran in das Interstitium. Wasser folgt nach, der Dünndarm arbeitet isoosmotisch. Chlorid wird auch - und Kalium vorwiegend - parazellulär aufgenommen (solvent drag). Kalium wird im Darm sowohl sezerniert als auch resorbiert. Angiotensin
fördert die Natriumaufnahme elektroneutral im Dünndarm, Aldosteron
elektrogen im Colon (Vermehrung der Natriumkanäle); Dehydrierung regt die Bildung beider Hormone an. Distales Ileum und besonders der Dickdarm tauschen Chlorid gegen Bicarbonat aus: Der Stuhl ist bicarbonatreich; Durchfälle bedeuten Bicarbonatverlust (metabolische Azidose). Auch das Colon resorbiert Kochsalz, Kalium kann vor allem unter
Aldosteronwirkung sezerniert werden.
Die Natriumkonzentration im Stuhlwasser kann unter dem Einfluss von
Aldosteron von ~30 auf ~2 mM/l abnehmen, die Kaliumkonzentration von
~75 auf ~150 mM ansteigen Die Wasserbilanz mit der Umwelt beträgt ~2-3 l/d (Erwachsene). Von ca. 8-9 Litern Flüssigkeit, die täglich in den Dünndarm gelangen, resorbiert dieser 6-7 l; ~2 l resorbiert der
Dickdarm, mit dem Stuhl werden ~0,1 l Wasser ausgeschieden. Natrium (Erhaltung des extrazellulären Volumens) gelangt über Natriumkanäle, mit organischen
Substraten, im Cotransport mit Chlorid, oder im Austausch gegen
Wasserstoffionen in Enterozyten. Na/K-ATPasen exportieren es über die basolaterale Membran in das Interstitium. Wasser folgt nach, der Dünndarm arbeitet isoosmotisch. Chlorid wird auch - und Kalium vorwiegend - parazellulär aufgenommen (solvent drag). Kalium wird im Darm sowohl sezerniert als auch resorbiert. Angiotensin
fördert die Natriumaufnahme elektroneutral im Dünndarm, Aldosteron
elektrogen im Colon (Vermehrung der Natriumkanäle); Dehydrierung regt die Bildung beider Hormone an. Distales Ileum und besonders der Dickdarm tauschen Chlorid gegen Bicarbonat aus: Der Stuhl ist bicarbonatreich; Durchfälle bedeuten Bicarbonatverlust (metabolische Azidose). Auch das Colon resorbiert Kochsalz, Kalium kann vor allem unter
Aldosteronwirkung sezerniert werden.
Die Natriumkonzentration im Stuhlwasser kann unter dem Einfluss von
Aldosteron von ~30 auf ~2 mM/l abnehmen, die Kaliumkonzentration von
~75 auf ~150 mM ansteigen
 Der proximale Dünndarm resorbiert ~200 mg Ca++ pro Tag - teils passiv-parazellulär (gesamter Dünndarm), teils unter Vitamin D-Wirkung aktiv-transzellulär (Duodenum): Vit.D (Calcitriol) fördert die Expression von Ca++-Kanälen vom Typ TRPV6. Calbindin (Vit-D-abhängig) bindet Ca++, hält [Ca++] im Enterozyten niedrig, den
Konzentrationsgradienten zum Extrazellulärraum aufrecht. Na/Ca-Austauscher in der
basolateralen Membran sowie Vit-D-abhängige H/Ca-Pumpen bringen Ca++
in das Interstitium. Erhöhtes Serum-[Ca++] hemmt die Sekretion von Parathormon (negative Rückkopplung: Parathormon regt die renale
1α-Hydroxylase an). Vit-D regt auch die Resorption von Phosphat im Dünndarm (Jejunum) an; diese erfolgt über Na/PO4-Symporter Der proximale Dünndarm resorbiert ~200 mg Ca++ pro Tag - teils passiv-parazellulär (gesamter Dünndarm), teils unter Vitamin D-Wirkung aktiv-transzellulär (Duodenum): Vit.D (Calcitriol) fördert die Expression von Ca++-Kanälen vom Typ TRPV6. Calbindin (Vit-D-abhängig) bindet Ca++, hält [Ca++] im Enterozyten niedrig, den
Konzentrationsgradienten zum Extrazellulärraum aufrecht. Na/Ca-Austauscher in der
basolateralen Membran sowie Vit-D-abhängige H/Ca-Pumpen bringen Ca++
in das Interstitium. Erhöhtes Serum-[Ca++] hemmt die Sekretion von Parathormon (negative Rückkopplung: Parathormon regt die renale
1α-Hydroxylase an). Vit-D regt auch die Resorption von Phosphat im Dünndarm (Jejunum) an; diese erfolgt über Na/PO4-Symporter
 Eisen wird im
Duodenum und oberen Ileum resorbiert. Es wechselt zwischen zweiwertiger
(Transport durch die Zellmembran) und dreiwertiger Form (an Proteine
gebunden): Ferroxidasen: Fe2+ → Fe3+, Ferrireduktasen: Fe3+ → Fe2+. Nahrungseisen liegt vorwiegend frei (Nichthämeisen, meist Fe3+)
oder an eine Hämgruppe gebunden vor (Hämeisen). Nichthämeisen wird von
duodenalem Cytochrom B reduziert und vom Metalltransporter DMT als Fe2+, Häm als Ganzes aufgenommen (HCP) und lysosomal abgebaut. Im Bedarfsfall gibt die Mucosa Eisen an das Blut ab: Über Mobilferrin gelangt Fe2+ an die basolaterale Membran, wird durch Ferroportin nach extrazellulär verfrachtet und dabei von Hephaestin zu Fe3+ oxidiert (anschließend Transport durch Transferrin). Wird Eisen nicht benötigt, bleibt es ferritingebunden in der Darmschleimhautzelle. Die Eisenexkretion (Blutverlust) ist nicht reguliert, nur die Aufnahme aus der Darmschleimhaut. Die Eisenresorption beträgt ~1-2 mg/d und kann (Eisenmangel) auf maximal 2-5 mg/d gesteigert werden. Die
Eisenresorption verbessert sich bei gleichzeitiger Anwesenheit von
Vitamin C, Zitronensäure, Eiweiß. Zahlreiche pflanzliche Stoffe hemmen
die Eisenresorption Eisen wird im
Duodenum und oberen Ileum resorbiert. Es wechselt zwischen zweiwertiger
(Transport durch die Zellmembran) und dreiwertiger Form (an Proteine
gebunden): Ferroxidasen: Fe2+ → Fe3+, Ferrireduktasen: Fe3+ → Fe2+. Nahrungseisen liegt vorwiegend frei (Nichthämeisen, meist Fe3+)
oder an eine Hämgruppe gebunden vor (Hämeisen). Nichthämeisen wird von
duodenalem Cytochrom B reduziert und vom Metalltransporter DMT als Fe2+, Häm als Ganzes aufgenommen (HCP) und lysosomal abgebaut. Im Bedarfsfall gibt die Mucosa Eisen an das Blut ab: Über Mobilferrin gelangt Fe2+ an die basolaterale Membran, wird durch Ferroportin nach extrazellulär verfrachtet und dabei von Hephaestin zu Fe3+ oxidiert (anschließend Transport durch Transferrin). Wird Eisen nicht benötigt, bleibt es ferritingebunden in der Darmschleimhautzelle. Die Eisenexkretion (Blutverlust) ist nicht reguliert, nur die Aufnahme aus der Darmschleimhaut. Die Eisenresorption beträgt ~1-2 mg/d und kann (Eisenmangel) auf maximal 2-5 mg/d gesteigert werden. Die
Eisenresorption verbessert sich bei gleichzeitiger Anwesenheit von
Vitamin C, Zitronensäure, Eiweiß. Zahlreiche pflanzliche Stoffe hemmen
die Eisenresorption
 Vitamin B12
(Kobalamin) bindet zunächst an Haptocorrin (Transcobalamin) aus dem
Speichel. Haptocorrin ist resistent gegenüber Säure- und Pepsineinfluss
und schützt so das Vitamin bei seiner Passage durch den Magen, nach Abbau des Haptocorrins im Dünndarm an (von Belegzellen gebildeten, verdauungsresistenten) Intrinsic factor; dieser Komplex wird im Ileum resorbiert (rezeptorvermittelte Endozytose?), der Intrinsic factor-Kobalamin-Komplex lysosomal gespalten, Kobalamin an Transkobalamin gebunden (Transportform) Vitamin B12
(Kobalamin) bindet zunächst an Haptocorrin (Transcobalamin) aus dem
Speichel. Haptocorrin ist resistent gegenüber Säure- und Pepsineinfluss
und schützt so das Vitamin bei seiner Passage durch den Magen, nach Abbau des Haptocorrins im Dünndarm an (von Belegzellen gebildeten, verdauungsresistenten) Intrinsic factor; dieser Komplex wird im Ileum resorbiert (rezeptorvermittelte Endozytose?), der Intrinsic factor-Kobalamin-Komplex lysosomal gespalten, Kobalamin an Transkobalamin gebunden (Transportform)
|

 Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.
Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.





 Resorption
Resorption
 Amylopektin: ἄμυλον = Stärke, πηκτός = geronnen
Amylopektin: ἄμυλον = Stärke, πηκτός = geronnen Lipide
Lipide  Kohlenhydrate
Kohlenhydrate  Aminosäuren und Peptide
Aminosäuren und Peptide  Wasser & Elektrolyte
Wasser & Elektrolyte
 Kochsalz
Kochsalz  Kalium
Kalium  Calcium und Phosphat
Calcium und Phosphat  Eisen
Eisen  Kobalamin, Folat
Kobalamin, Folat  Steuerung der Ionenresorption
Steuerung der Ionenresorption  Klinik
Klinik Resorption
Resorption
 Core messages
Core messages (glandulae intestinales, hauptsächlich sekretorisch aktiv) im Dünndarm.
Flüssigkeit und Elektrolyte werden von der gesamten Länge des Darmes
effizient resorbiert, Nährstoffe hingegen praktisch nur im Dünndarm.
(glandulae intestinales, hauptsächlich sekretorisch aktiv) im Dünndarm.
Flüssigkeit und Elektrolyte werden von der gesamten Länge des Darmes
effizient resorbiert, Nährstoffe hingegen praktisch nur im Dünndarm. Unter Resorption
Unter Resorption  (absorption)
versteht man die biologische Aufnahme von Stoffen, insbesondere im
Darmtrakt (z.B. Aufnahme von Aminosäuren aus dem Chymus über das
Dünndarmepithel), auch gegen ein Konzentrationsgefälle. Als Rückresorption bezeichnet
man die Wiederaufnahme von Stoffen, die bereits ein oder mehrere
Kompartiment(e) des Körpers durchlaufen haben (z.B. die Rückresorption
filtrierter Glucose in der Niere).
(absorption)
versteht man die biologische Aufnahme von Stoffen, insbesondere im
Darmtrakt (z.B. Aufnahme von Aminosäuren aus dem Chymus über das
Dünndarmepithel), auch gegen ein Konzentrationsgefälle. Als Rückresorption bezeichnet
man die Wiederaufnahme von Stoffen, die bereits ein oder mehrere
Kompartiment(e) des Körpers durchlaufen haben (z.B. die Rückresorption
filtrierter Glucose in der Niere).
 Abbildung: Flüssigkeitsbilanz im Gastrointestinaltrakt
Abbildung: Flüssigkeitsbilanz im Gastrointestinaltrakt
 Die wichtigsten Energieverbraucher sind die aktive Muskulatur, das Gehirn und das Immunsystem.
Die wichtigsten Energieverbraucher sind die aktive Muskulatur, das Gehirn und das Immunsystem. So
können sich apolare (fettlösliche = lipophile) Stoffe in der Membran der Darmschleimhautzellen leicht lösen und diese durchdringen;
So
können sich apolare (fettlösliche = lipophile) Stoffe in der Membran der Darmschleimhautzellen leicht lösen und diese durchdringen;  kleine (bis ~4 nm Durchmesser, entsprechend ≤200 D Molekulargewicht) polare (wasserlösliche = hydrophile) passieren "Poren" der Zellmembran;
kleine (bis ~4 nm Durchmesser, entsprechend ≤200 D Molekulargewicht) polare (wasserlösliche = hydrophile) passieren "Poren" der Zellmembran;  größere
polare Moleküle (>4 nm) sind für die transmembranale Passage auf Proteine angewiesen, welche für den
Stoff komplexe "Kanäle" ausbilden.
größere
polare Moleküle (>4 nm) sind für die transmembranale Passage auf Proteine angewiesen, welche für den
Stoff komplexe "Kanäle" ausbilden.  entweder transmembranalentsprechend der
Konzentrationsdifferenz des Stoffes (Diffusion); oder
entweder transmembranalentsprechend der
Konzentrationsdifferenz des Stoffes (Diffusion); oder  im Cotransport mit einer
anderen Substanz, für die ein solches Konzentrationsgefälle besteht
(Symport); oder
im Cotransport mit einer
anderen Substanz, für die ein solches Konzentrationsgefälle besteht
(Symport); oder  im Austausch mit einem solchen Stoff in der
Gegenrichtung (Antiport); oder
im Austausch mit einem solchen Stoff in der
Gegenrichtung (Antiport); oder  direkt energieverbrauchend mittles einer
Membran-"Pumpe" (wie die Na-K-induzierte ATPase).
direkt energieverbrauchend mittles einer
Membran-"Pumpe" (wie die Na-K-induzierte ATPase).  Substanzen können auch
zwischen den Epithelzellen (parazellulär) durch die Schleimhaut
gelangen - eine eingeschränkte Option, weil die verfügbare
Oberfläche sehr klein ist (höchstens 1% im Vergleich zur verfügbaren Zellmembranfläche) - oder auch
Substanzen können auch
zwischen den Epithelzellen (parazellulär) durch die Schleimhaut
gelangen - eine eingeschränkte Option, weil die verfügbare
Oberfläche sehr klein ist (höchstens 1% im Vergleich zur verfügbaren Zellmembranfläche) - oder auch  mit Hilfe spezieller
Transportmechanismen der M-Zellen, von wo aus der Weg über die Darmlymphe offensteht.
mit Hilfe spezieller
Transportmechanismen der M-Zellen, von wo aus der Weg über die Darmlymphe offensteht.
 Abbildung: Übersicht der Verdauungs- und Resorptionsmechanismen
Abbildung: Übersicht der Verdauungs- und Resorptionsmechanismen
 Die Resorptionskapazität für Wasser im Darm einer erwachsenen Person liegt bei etwa 1 Liter pro Stunde
- der tägliche Bedarf (Getränke + Wasser in "fester" Nahrung) liegt bei
1-2 l/d, bei erhöhtem Verlust (Schwitzen!) kann sich diese Zahl
vervielfachen.
Die Resorptionskapazität für Wasser im Darm einer erwachsenen Person liegt bei etwa 1 Liter pro Stunde
- der tägliche Bedarf (Getränke + Wasser in "fester" Nahrung) liegt bei
1-2 l/d, bei erhöhtem Verlust (Schwitzen!) kann sich diese Zahl
vervielfachen. Der Darm kann ein Mehrfaches des täglichen Glucosebedarfs
(~300 g/d) resorbieren, auch hohe Mengen von Süßigkeiten können so vom
Dünndarm verarbeitet werden (Anlegen von Fettdepots).
Der Darm kann ein Mehrfaches des täglichen Glucosebedarfs
(~300 g/d) resorbieren, auch hohe Mengen von Süßigkeiten können so vom
Dünndarm verarbeitet werden (Anlegen von Fettdepots). Für Aminosäuren liegt der Wert bei ~600 g (Bedarf ~60 g/d).
Für Aminosäuren liegt der Wert bei ~600 g (Bedarf ~60 g/d). Bis zu 4000 mg Cholesterin
können pro Tag aufgenommen werden (eine an Fleisch, Eiern und Innereien
reiche Kost liefert bis zu ~1000 mg/d, der Bedarf liegt bei ~200 mg/d
oder weniger).
Bis zu 4000 mg Cholesterin
können pro Tag aufgenommen werden (eine an Fleisch, Eiern und Innereien
reiche Kost liefert bis zu ~1000 mg/d, der Bedarf liegt bei ~200 mg/d
oder weniger). Die Resorptionskapazität für Eisen liegt bei etwa 12 mg/d (Bedarf 1-2 mg/d), die Aufnahme ist mehrfach reguliert.
Die Resorptionskapazität für Eisen liegt bei etwa 12 mg/d (Bedarf 1-2 mg/d), die Aufnahme ist mehrfach reguliert. 
 Abbildung: Dünn- und Dickdarm
Abbildung: Dünn- und Dickdarm
 Die Resorption von Nährstoffen erfolgt zum Großteil im Dünndarm (Duodenum, Jejunum, Ileum). Magen (Alkohol, einige Medikamente) und Dickdarm
(Flüssigkeit, Elektrolyte, sowie einige Fettsäuren aus bakteriellem
Abbau von Kohlenhydraten und Proteinen, die nicht im Dünndarm
resorbiert wurden) haben einen geringeren Anteil daran.
Die Resorption von Nährstoffen erfolgt zum Großteil im Dünndarm (Duodenum, Jejunum, Ileum). Magen (Alkohol, einige Medikamente) und Dickdarm
(Flüssigkeit, Elektrolyte, sowie einige Fettsäuren aus bakteriellem
Abbau von Kohlenhydraten und Proteinen, die nicht im Dünndarm
resorbiert wurden) haben einen geringeren Anteil daran.  im Duodenum die Aufnahme von Elektrolyten, u.a Calcium und Eisen,
im Duodenum die Aufnahme von Elektrolyten, u.a Calcium und Eisen, im Jejunum die Aufnahme von Monosacchariden und Aminosäuren,
im Jejunum die Aufnahme von Monosacchariden und Aminosäuren, im Ileum die Aufnahme von Gallensalzen, Magnesium und Vitamin B12.
im Ileum die Aufnahme von Gallensalzen, Magnesium und Vitamin B12. "Spezialisiert" ist das Jejunum für die Aufnahme von kurzen (Di-, Tri-)Peptiden, Vitamin C und Phosphat;
"Spezialisiert" ist das Jejunum für die Aufnahme von kurzen (Di-, Tri-)Peptiden, Vitamin C und Phosphat; das Ileum für die Aufnahme von Vitamin B12 und (aber nicht ausschließlich) Gallensalzen.
das Ileum für die Aufnahme von Vitamin B12 und (aber nicht ausschließlich) Gallensalzen. Zu Fetten s. auch dort
Zu Fetten s. auch dort
 Abbildung: Rezirkulation gallensaurer Salze
Abbildung: Rezirkulation gallensaurer Salze


 Abbildung: Mizellärer Transport von Spaltprodukten der Fettverdauung zur Oberfläche von Enterozyten
Abbildung: Mizellärer Transport von Spaltprodukten der Fettverdauung zur Oberfläche von Enterozyten
 Monoglycerid-Acylierung: Coenzym A-aktivierte Fettsäuren werden mit
2-Monoglyceriden zusammengeführt; Acyltransferasen koppeln die freien
Fettsäuren an das Glycerin und bilden Di- und Triglyceride - vor allem
im glatten endoplasmatischen Retikulum. Fettsäurebindende Moleküle (fatty acid-binding proteins FABPs) spielen dabei eine Rolle; sie halten einen Konzentrationsgradienten für langkettige Fettsäuren aufrecht.
Monoglycerid-Acylierung: Coenzym A-aktivierte Fettsäuren werden mit
2-Monoglyceriden zusammengeführt; Acyltransferasen koppeln die freien
Fettsäuren an das Glycerin und bilden Di- und Triglyceride - vor allem
im glatten endoplasmatischen Retikulum. Fettsäurebindende Moleküle (fatty acid-binding proteins FABPs) spielen dabei eine Rolle; sie halten einen Konzentrationsgradienten für langkettige Fettsäuren aufrecht. Phosphatidsäure-Weg: Triglyceride können auch aus Coenzym
A-aktivierten Fettsäuren und α-Glycerophosphat aufgebaut werden. Es
entsteht Phosphatidsäure, die zu Diglycerid dephosphoryliert und dann
durch Acylierung zu Triglycerid umgewandelt wird. Dieser Pfad ist
weniger ergiebig.
Phosphatidsäure-Weg: Triglyceride können auch aus Coenzym
A-aktivierten Fettsäuren und α-Glycerophosphat aufgebaut werden. Es
entsteht Phosphatidsäure, die zu Diglycerid dephosphoryliert und dann
durch Acylierung zu Triglycerid umgewandelt wird. Dieser Pfad ist
weniger ergiebig.
 Abbildung: "Routing" der Lipide
Abbildung: "Routing" der Lipide

 Langkettige Fettsäuren
binden nach ihrer Aufnahme in die Darmepithelzelle (vor allem im
proximalen Jejunum) an ein fettsäurebindendes Protein, was ihren
Transport ins endoplasmatische Retikulum erleichtert
Langkettige Fettsäuren
binden nach ihrer Aufnahme in die Darmepithelzelle (vor allem im
proximalen Jejunum) an ein fettsäurebindendes Protein, was ihren
Transport ins endoplasmatische Retikulum erleichtert Langkettige Fettsäuren und andere Produkte der Lipidverdauung
(Cholesterin, Lysolezithin) werden im glatten endoplasmatischen
Retikulum zu Triglyceriden, Phospholipiden und Cholesterinestern
zurückverwandelt, es entstehen intrazelluläre Fetttröpfchen
Langkettige Fettsäuren und andere Produkte der Lipidverdauung
(Cholesterin, Lysolezithin) werden im glatten endoplasmatischen
Retikulum zu Triglyceriden, Phospholipiden und Cholesterinestern
zurückverwandelt, es entstehen intrazelluläre Fetttröpfchen Das rauhe endoplasmatische Retikulum bildet Apoproteine
Das rauhe endoplasmatische Retikulum bildet Apoproteine Apoproteine werden an das glatte endoplasmatische Retikulum verbracht und mit den Fetttröpfchen integriert
Apoproteine werden an das glatte endoplasmatische Retikulum verbracht und mit den Fetttröpfchen integriert Die so entstandenen Chylomikronen und VLDL-Partikel gelangen zum Golgi-Apparat (cis-Seite); Apoproteine werden durch Enzyme des Golgi-Apparats glykosyliert
Die so entstandenen Chylomikronen und VLDL-Partikel gelangen zum Golgi-Apparat (cis-Seite); Apoproteine werden durch Enzyme des Golgi-Apparats glykosyliert Vesikel mit Chylomikronen / VLDL sequestrieren sich vom Golgi-Apparat
ab (Trans-Seite) und wandern zur basolateralen Membran
Vesikel mit Chylomikronen / VLDL sequestrieren sich vom Golgi-Apparat
ab (Trans-Seite) und wandern zur basolateralen Membran Die Vesikel fusionieren mit der Membran und setzen Chylomikronen und VLDL-Partikel in den Extrazellulärraum frei
Die Vesikel fusionieren mit der Membran und setzen Chylomikronen und VLDL-Partikel in den Extrazellulärraum frei Die Lipide werden durch
Wiederveresterung und "Verpackung" in Chylomikronen (postprandial) und
VLDL-Tröpfchen (im Nüchternzustand) transportfähig gemacht. Sie gelangen in die Lymphgefäße des Darms (Chylusgefäße) und über den Venenwinkel zu den Organen.
Die Lipide werden durch
Wiederveresterung und "Verpackung" in Chylomikronen (postprandial) und
VLDL-Tröpfchen (im Nüchternzustand) transportfähig gemacht. Sie gelangen in die Lymphgefäße des Darms (Chylusgefäße) und über den Venenwinkel zu den Organen. Die verdauten Fette umgehen zunächst die Leber - sie werden über den
ductus thoracicus in den systemischen Kreislauf abgegeben und gelangen
so direkt zur fettkonsumierenden Peripherie. Die Leber
nimmt anschließend die nicht verbrauchten Fette auf und bietet sie
wiederum der Peripherie an - zum Teil in anderer Form, z.B. als
Phosphoglyzeride für den Aufbau von Zellmembranen
Die verdauten Fette umgehen zunächst die Leber - sie werden über den
ductus thoracicus in den systemischen Kreislauf abgegeben und gelangen
so direkt zur fettkonsumierenden Peripherie. Die Leber
nimmt anschließend die nicht verbrauchten Fette auf und bietet sie
wiederum der Peripherie an - zum Teil in anderer Form, z.B. als
Phosphoglyzeride für den Aufbau von Zellmembranen Kurz- und mittelkettige Fettsäuren und Glycerin werden nicht esterifiziert; sie gelangen (via
Epithelzelle) direkt in den Pfortaderkreislauf und zur Leber.
Kurz- und mittelkettige Fettsäuren und Glycerin werden nicht esterifiziert; sie gelangen (via
Epithelzelle) direkt in den Pfortaderkreislauf und zur Leber.  Gallensalze werden erst im Ileum resorbiert;
kurzkettige Fettsäuren auch im Colon.
Gallensalze werden erst im Ileum resorbiert;
kurzkettige Fettsäuren auch im Colon. Zu Kohlenhydraten s. auch dort
Zu Kohlenhydraten s. auch dort s. dort). Der Bürstensaum der Enterozyten hydrolysiert kleine Polymere (Maltase, Lactase, Sucrase -
s. dort). Der Bürstensaum der Enterozyten hydrolysiert kleine Polymere (Maltase, Lactase, Sucrase -  s. dort).
s. dort).  Die apikale
Zellmembran der Darmepithelzellen nehmen D-Glucose und Galactose
sekundär-aktiv - gegen deren Konzentrationsgradienten - mittels Cotransport mit Natrium (SGLT1)
auf. SGLT1 kann Fructose nicht befördern, diese gelangt über SGLT5 (via
erleichterte Diffusion) in die Epithelzelle. Sowohl Glucose als auch
Fructose gelangen basolateral über GLUT2 in das Interstitium weiter
(
Die apikale
Zellmembran der Darmepithelzellen nehmen D-Glucose und Galactose
sekundär-aktiv - gegen deren Konzentrationsgradienten - mittels Cotransport mit Natrium (SGLT1)
auf. SGLT1 kann Fructose nicht befördern, diese gelangt über SGLT5 (via
erleichterte Diffusion) in die Epithelzelle. Sowohl Glucose als auch
Fructose gelangen basolateral über GLUT2 in das Interstitium weiter
( Abbildung).
Abbildung).
 Abbildung: Abbau und Resorption von Kohlenhydraten zu Monosacchariden
Abbildung: Abbau und Resorption von Kohlenhydraten zu Monosacchariden
 L-Fructose gelangt konzentrationsabhängig durch erleichterte Diffusion mittels des Fructosetransporters GLUT5
in die Epithelzelle. GLUT5 findet sich vor allem in der Dünndarmmukosa,
in geringerem Ausmaß auch in anderen Geweben (Muskel-, Fett- und renale
Tubuluszellen).
L-Fructose gelangt konzentrationsabhängig durch erleichterte Diffusion mittels des Fructosetransporters GLUT5
in die Epithelzelle. GLUT5 findet sich vor allem in der Dünndarmmukosa,
in geringerem Ausmaß auch in anderen Geweben (Muskel-, Fett- und renale
Tubuluszellen).  Die basolaterale Membran transportiert Monosaccharide - unabhängig von Natrium - mittels GLUT2
weiter Richtung Blutkreislauf. Es ist also für die Aufnahme von Glucose, Fructose und Galactose aus der Darmmukosa in das Interstitium verantwirtlich. GLUT2 wird außer von
Darmepithelien auch in Leber und Pankreas (ß-Zellen) exprimiert.
Die basolaterale Membran transportiert Monosaccharide - unabhängig von Natrium - mittels GLUT2
weiter Richtung Blutkreislauf. Es ist also für die Aufnahme von Glucose, Fructose und Galactose aus der Darmmukosa in das Interstitium verantwirtlich. GLUT2 wird außer von
Darmepithelien auch in Leber und Pankreas (ß-Zellen) exprimiert.  Inkretineffekt: Gelangt Glucose in den oberen Dünndarm, wird aus dessen K-Zellen GIP und aus L-Zellen GLP-1
freigesetzt. Beide regen die Synthese und Sekretion von Insulin an.
Deshalb ist orale Glucosegabe stärker insulinwirksam als dieselbe Menge Glucose i.v.
Inkretineffekt: Gelangt Glucose in den oberen Dünndarm, wird aus dessen K-Zellen GIP und aus L-Zellen GLP-1
freigesetzt. Beide regen die Synthese und Sekretion von Insulin an.
Deshalb ist orale Glucosegabe stärker insulinwirksam als dieselbe Menge Glucose i.v. Ein "neutrales" oder "methioninpräferierendes", das alle neutralen Aminosäuren über Enterozytenmembranen transportiert;
Ein "neutrales" oder "methioninpräferierendes", das alle neutralen Aminosäuren über Enterozytenmembranen transportiert; ein "basisches", das kationische Aminosäuren zusammen mit Zystein befördert;
ein "basisches", das kationische Aminosäuren zusammen mit Zystein befördert; ein "saures" für Glutamat und Aspartat;
ein "saures" für Glutamat und Aspartat; ein "Iminoglyzinsystem", zuständig für Prolin, Hydroxyprolin und Glyzin, sowie
ein "Iminoglyzinsystem", zuständig für Prolin, Hydroxyprolin und Glyzin, sowie ein "β-aminosaures" System (ß-Alanin, Taurin),
ein "β-aminosaures" System (ß-Alanin, Taurin), Aufnahme von Aminosäuren am apikalen Bürstensaum. Von der Darmschleimhautzelle apikal aufgenommen werden
nicht nur Aminosäuren - über die zahlreichen Aminosäuretransporter, die z.T. Na+- (oder H+-, Cl--) abhängig sind (s. weiter unten), sondern auch Di- und Tripeptide - über PepT1, einen H+-Oligopeptid-Cotransporter (den auch proximale Tubuli in der Niere exprimieren): Der Mechanismus wird durch einen Protonengradienten angetrieben. (In die Zelle aufgenommenes H+ wird über einen H+/Na+-Austauscher wieder in das Darmlumen retourniert.)
Aufnahme von Aminosäuren am apikalen Bürstensaum. Von der Darmschleimhautzelle apikal aufgenommen werden
nicht nur Aminosäuren - über die zahlreichen Aminosäuretransporter, die z.T. Na+- (oder H+-, Cl--) abhängig sind (s. weiter unten), sondern auch Di- und Tripeptide - über PepT1, einen H+-Oligopeptid-Cotransporter (den auch proximale Tubuli in der Niere exprimieren): Der Mechanismus wird durch einen Protonengradienten angetrieben. (In die Zelle aufgenommenes H+ wird über einen H+/Na+-Austauscher wieder in das Darmlumen retourniert.)  Auch einige Antibiotika
(z.B. Cephalosporine) werden über dieses System aufgenommen.
Auch einige Antibiotika
(z.B. Cephalosporine) werden über dieses System aufgenommen.
 Abbildung: Resorption von Oligopeptiden und Aminosäuren im Dünndarm
Abbildung: Resorption von Oligopeptiden und Aminosäuren im Dünndarm
 Abbildung). Diese Peptidasen haben hohe
Affinität für Peptide, die aus drei bis acht Aminosäuren bestehen
(intrazelluläre Peptidasen bevorzugen Di- und Tripeptide).
Abbildung). Diese Peptidasen haben hohe
Affinität für Peptide, die aus drei bis acht Aminosäuren bestehen
(intrazelluläre Peptidasen bevorzugen Di- und Tripeptide). Weitertransport der Aminosäuren über die basolaterale Membran.
Sind die Aminosäuren, Di- und Tripeptide einmal in die Bürstensaumzelle
aufgenommen, müssen sie basolateral an Interstitium und Blut
weitergegeben werden. Dies erfolgt mittels Aminosäuretransporter,
von denen es mindestens fünf verschiedene gibt - drei natriumunabhängige für
den "Export" und zwei natriumabhängige für den "Import" von
Aminosäuren, die also bidirektional durch die Membran gelangen können
(Enterozyten benötigen etwa 10% der aufgenommenen Aminosäuren für ihre eigene Proteinsynthese).
Weitertransport der Aminosäuren über die basolaterale Membran.
Sind die Aminosäuren, Di- und Tripeptide einmal in die Bürstensaumzelle
aufgenommen, müssen sie basolateral an Interstitium und Blut
weitergegeben werden. Dies erfolgt mittels Aminosäuretransporter,
von denen es mindestens fünf verschiedene gibt - drei natriumunabhängige für
den "Export" und zwei natriumabhängige für den "Import" von
Aminosäuren, die also bidirektional durch die Membran gelangen können
(Enterozyten benötigen etwa 10% der aufgenommenen Aminosäuren für ihre eigene Proteinsynthese).
 Abbildung): Insbesondere in der postnatalen Periode können Darmepithelzellen -
Enterozyten sowie M-Zellen - aus der Nahrung (z.B. Muttermilch) direkt
Eiweißmoleküle resorbieren, ohne dass diese dabei abgebaut werden. Auf
diese Weise kann passive Immunität direkt von der Mutter auf das Baby
übertragen werden. Etwa mit 6 Monaten schließt sich dieses Fenster zur
Resorption ganzer Eiweißmoleküle ("closure").
Diese Änderung ist hormonell gesteuert; werden Corticosteroide
verabreicht, geht die Fähigkeit zur Phagozytose ganzer Proteine früher
verloren.
Abbildung): Insbesondere in der postnatalen Periode können Darmepithelzellen -
Enterozyten sowie M-Zellen - aus der Nahrung (z.B. Muttermilch) direkt
Eiweißmoleküle resorbieren, ohne dass diese dabei abgebaut werden. Auf
diese Weise kann passive Immunität direkt von der Mutter auf das Baby
übertragen werden. Etwa mit 6 Monaten schließt sich dieses Fenster zur
Resorption ganzer Eiweißmoleküle ("closure").
Diese Änderung ist hormonell gesteuert; werden Corticosteroide
verabreicht, geht die Fähigkeit zur Phagozytose ganzer Proteine früher
verloren. 
 Abbildung: Enterische Aufnahme ganzer Proteinmoleküle
Abbildung: Enterische Aufnahme ganzer Proteinmoleküle
 Abbildung). Enterozyten bauen allerdings den Großteil
der Proteine ab (über 90%).
Abbildung). Enterozyten bauen allerdings den Großteil
der Proteine ab (über 90%). Neugeborene resorbieren eine beträchtliche Menge Protein direkt aus dem Kolostrum - mittels Endozytose,
also ohne vorherigen Abbau zu Aminosäuren, Di- und Tripeptiden. Dieser
Mechanismus erlaubt die Aufnahme von (teils) unveränderten
Immunglobulinen aus der Muttermilch direkt in das Blut des
Neugeborenen. Enterozyten bringen auf diese Weise etwa jedes zehnte, die auf Proteinaufnahme spezialisierten M-Zellen etwa jedes zweite Eiweißmolekül unbeschadet aus dem Darmlumen in das Interstitium des Babys (jeweils 0,2 µg/h/cm2 Mucosaoberfläche - "direkter Pfad").
Neugeborene resorbieren eine beträchtliche Menge Protein direkt aus dem Kolostrum - mittels Endozytose,
also ohne vorherigen Abbau zu Aminosäuren, Di- und Tripeptiden. Dieser
Mechanismus erlaubt die Aufnahme von (teils) unveränderten
Immunglobulinen aus der Muttermilch direkt in das Blut des
Neugeborenen. Enterozyten bringen auf diese Weise etwa jedes zehnte, die auf Proteinaufnahme spezialisierten M-Zellen etwa jedes zweite Eiweißmolekül unbeschadet aus dem Darmlumen in das Interstitium des Babys (jeweils 0,2 µg/h/cm2 Mucosaoberfläche - "direkter Pfad").
 Abbildung: Wasserbilanz (Durchschnittswerte für eine erwachsene Person)
Abbildung: Wasserbilanz (Durchschnittswerte für eine erwachsene Person)
 Abbildung).
Abbildung).  Ständiges Nuckeln an der Wasserflasche ist in
der Regel unnötig, es sei denn, es
liegen besondere Belastungen vor wie Hitze oder starke Muskelbelastung,
die zu erhöhtem Schweißverlust (perspiratio sensibilis) führen.
Ständiges Nuckeln an der Wasserflasche ist in
der Regel unnötig, es sei denn, es
liegen besondere Belastungen vor wie Hitze oder starke Muskelbelastung,
die zu erhöhtem Schweißverlust (perspiratio sensibilis) führen. Abbildung gibt einen Überblick über die Mechanismen der
Kochsalzresorption im Dünndarm:
Abbildung gibt einen Überblick über die Mechanismen der
Kochsalzresorption im Dünndarm: 
 Abbildung: Kochsalzresorption im Dünndarm
Abbildung: Kochsalzresorption im Dünndarm Über
Natriumkanäle,
Über
Natriumkanäle, zusammen mit organischen Substraten (S)
wie Glucose oder Aminosäuren,
zusammen mit organischen Substraten (S)
wie Glucose oder Aminosäuren, im elektroneutralen Cotransport mit
Chlorid,
im elektroneutralen Cotransport mit
Chlorid, im elektroneutralen Austausch gegen Wasserstoffionen.
im elektroneutralen Austausch gegen Wasserstoffionen.

 Abbildung: Resorptionswege im Dickdarm
Abbildung: Resorptionswege im Dickdarm
 Abbildung gezeigten Transportmechanismen:
Abbildung gezeigten Transportmechanismen:  Apikal Natrium- und Kaliumkanäle, sowie ein Natrium / Protonen- und ein Bicarbonat / Chlorid- Austauscher;
Apikal Natrium- und Kaliumkanäle, sowie ein Natrium / Protonen- und ein Bicarbonat / Chlorid- Austauscher; basolateral
die allgengenwärtige Na/K-ATPase, die 3 Natrium- gegen 2 Kaliumionen
austauscht und die positive Ladung der Zellbasis verstärkt; sowie
Permeasen für Kalium,. Protonen und Chlorid.
basolateral
die allgengenwärtige Na/K-ATPase, die 3 Natrium- gegen 2 Kaliumionen
austauscht und die positive Ladung der Zellbasis verstärkt; sowie
Permeasen für Kalium,. Protonen und Chlorid. Die Natriumkonzentration im Stuhlwasser kann unter dem Einfluss von Aldosteron von ~30 auf ~2 mM/l abnehmen, während die Kaliumkonzentration von ~75 auf ~150 mM ansteigt.
Die Natriumkonzentration im Stuhlwasser kann unter dem Einfluss von Aldosteron von ~30 auf ~2 mM/l abnehmen, während die Kaliumkonzentration von ~75 auf ~150 mM ansteigt. Abführende Stoffe (Laxantien) und bakterielle Endotoxine fördern die Sekretion von Salz und Wasser
Abführende Stoffe (Laxantien) und bakterielle Endotoxine fördern die Sekretion von Salz und Wasser Parasympathische Aktivität (Acetylcholin), Histamin und VIP regen die Sekretion von K+ und Cl- an
Parasympathische Aktivität (Acetylcholin), Histamin und VIP regen die Sekretion von K+ und Cl- an Immunfaktoren: Unter anderem bilden Makrophagen und Granulozyten Eikosanoide, Mastzellen und Fibroblasten Histamin und Bradykinin.
Das Muster von Bildung und Wirkung dieser Stoffe ist komplex; so kann
Histamin (z.B. nach Bindung von Antigenen an Rezeptoren an Mastzellen)
die Chloridsekretion in den Darm teils über eigene Rezeptoren, teils
über Anregung cholinerger Darmnervenzellen steigern
Immunfaktoren: Unter anderem bilden Makrophagen und Granulozyten Eikosanoide, Mastzellen und Fibroblasten Histamin und Bradykinin.
Das Muster von Bildung und Wirkung dieser Stoffe ist komplex; so kann
Histamin (z.B. nach Bindung von Antigenen an Rezeptoren an Mastzellen)
die Chloridsekretion in den Darm teils über eigene Rezeptoren, teils
über Anregung cholinerger Darmnervenzellen steigern Angiotensin fördert die Natriumaufnahme - elektroneutral - im Dünndarm, Aldosteron - elektrogen - im Colon (s. weiter unten). Dehydrierung regt die Bildung beider Hormone an
Angiotensin fördert die Natriumaufnahme - elektroneutral - im Dünndarm, Aldosteron - elektrogen - im Colon (s. weiter unten). Dehydrierung regt die Bildung beider Hormone an Glucocorticoide regen die elektroneutrale Kochsalzresorption sowohl im Dünn- als auch im Dickdarm, ohne Auswirkung auf die Kaliumresorption
Glucocorticoide regen die elektroneutrale Kochsalzresorption sowohl im Dünn- als auch im Dickdarm, ohne Auswirkung auf die Kaliumresorption Neurotransmitter endokriner Darmschleimhautzellen, wie Somatostatin,
Enkephaline und Noradrenalin, stimulieren die Flüssigkeits- und
Elektrolytresorption wahrscheinlich über eine Senkung der
intrazellulären Calciumkonzentration
Neurotransmitter endokriner Darmschleimhautzellen, wie Somatostatin,
Enkephaline und Noradrenalin, stimulieren die Flüssigkeits- und
Elektrolytresorption wahrscheinlich über eine Senkung der
intrazellulären Calciumkonzentration entlang der Darmachse (segmentale Heterogenität, z.B. Duodenum, proximales Ileum, distales Ileum) als auch
entlang der Darmachse (segmentale Heterogenität, z.B. Duodenum, proximales Ileum, distales Ileum) als auch  "vertikal" (Villus-Krypten-Heterogenität), schließlich auch
"vertikal" (Villus-Krypten-Heterogenität), schließlich auch  von Zelle zu Zelle (zelluläre Heterogenität, z.B. resorptive, endokrine, schleimproduzierende, Stammzelle..).
von Zelle zu Zelle (zelluläre Heterogenität, z.B. resorptive, endokrine, schleimproduzierende, Stammzelle..). Abbildung).
Abbildung).
 Abbildung: Mechanismen der aktiven enterischen Natriumresorption
Abbildung: Mechanismen der aktiven enterischen Natriumresorption
 Der führende Mechanismus zur Natriumaufnahme im Dünndarm ist die Kopplung an die Glucose- und Aminosäureresorption (Na/Glucose-Cotransport, Na/Galactose-Cotransport, Na/Aminosäuren-Coptransport über SLC-Transporter - solute carrier),
dem Natrium-Konzentrationsgradienten folgend über die apikale Membran
der Schleimhautzellen der Zotten (nicht der Krypten) aus der Nahrung,
also in der digestiven Phase.
Der führende Mechanismus zur Natriumaufnahme im Dünndarm ist die Kopplung an die Glucose- und Aminosäureresorption (Na/Glucose-Cotransport, Na/Galactose-Cotransport, Na/Aminosäuren-Coptransport über SLC-Transporter - solute carrier),
dem Natrium-Konzentrationsgradienten folgend über die apikale Membran
der Schleimhautzellen der Zotten (nicht der Krypten) aus der Nahrung,
also in der digestiven Phase. Das funktioniert auch als orale Rehydrationstherapie mit Kochsalz-Glucose-Lösung - da unabhängig von cAMP oder Ca++ - bei Darminfektionen (z.B. mit Coli- oder Cholerabakterien)
Das funktioniert auch als orale Rehydrationstherapie mit Kochsalz-Glucose-Lösung - da unabhängig von cAMP oder Ca++ - bei Darminfektionen (z.B. mit Coli- oder Cholerabakterien) Natrium-Wasserstoffionen-Exchanger (NHE): Durch elektroneutralen Na+/H+-Austausch im Duodenum und Jejunum (es existieren mehrere Isoformen dieses Austauschers. Auch die basolaterale Membran verfügt über Na+/H+-Antiporter, das Natrium wird gewissenmaßen durch die Zelle hindurchgereicht).
Natrium-Wasserstoffionen-Exchanger (NHE): Durch elektroneutralen Na+/H+-Austausch im Duodenum und Jejunum (es existieren mehrere Isoformen dieses Austauschers. Auch die basolaterale Membran verfügt über Na+/H+-Antiporter, das Natrium wird gewissenmaßen durch die Zelle hindurchgereicht).  In der interdigestiven Phase ist ein Parallelmechanismus in Ileum und proximalen Colon für die Natriumresorption der bedeutendste: Na+/H+- gekoppelt mit Cl-/HCO3--Austausch. Der Mechanismus ist insgesamt elektroneutral.
In der interdigestiven Phase ist ein Parallelmechanismus in Ileum und proximalen Colon für die Natriumresorption der bedeutendste: Na+/H+- gekoppelt mit Cl-/HCO3--Austausch. Der Mechanismus ist insgesamt elektroneutral.
 Elektrogen über epitheliale Natriumkanäle (ENaC - diese steigern die Salzaufnahme der Zelle) im distalen Colon
("Titration" des Salzhaushalts). Dieser Weg ist sehr spezifisch und
effizient; er ist unabhängig von Glucose, Bicarbonat oder
intrazellulären second messengers, ist von mikromolaren Konzentrationen des
Diuretikums Amilorid blockierbar und reagiert auf Aldosteron.
Elektrogen über epitheliale Natriumkanäle (ENaC - diese steigern die Salzaufnahme der Zelle) im distalen Colon
("Titration" des Salzhaushalts). Dieser Weg ist sehr spezifisch und
effizient; er ist unabhängig von Glucose, Bicarbonat oder
intrazellulären second messengers, ist von mikromolaren Konzentrationen des
Diuretikums Amilorid blockierbar und reagiert auf Aldosteron.
 die Öffnungswahrscheinlichkeit der Natriumkanäle erhöht - der Effekt tritt innerhalb von Sekunden auf
die Öffnungswahrscheinlichkeit der Natriumkanäle erhöht - der Effekt tritt innerhalb von Sekunden auf
 aus dem Vesikelpool mehr Natriumkanäle in die apikale Membran verlagert - dieser Effekt braucht mehrere Minuten
aus dem Vesikelpool mehr Natriumkanäle in die apikale Membran verlagert - dieser Effekt braucht mehrere Minuten
 die Synthese neuer Natriumkanäle und Na+-K+-ATPase anregt - das dauert Stunden.
die Synthese neuer Natriumkanäle und Na+-K+-ATPase anregt - das dauert Stunden. Abbildung):
Abbildung):
 Abbildung: Chloridaustausch über die Darmwand
Abbildung: Chloridaustausch über die Darmwand


 Passive spannungsabhängige Aufnahme, getrieben über das (lumen-negative) transepitheliale
Potential:
Entweder durch Chloridkanäle in der apikalen und basolateralen Membran
der Epithelzellen, oder parazellulär über tight junctions
Passive spannungsabhängige Aufnahme, getrieben über das (lumen-negative) transepitheliale
Potential:
Entweder durch Chloridkanäle in der apikalen und basolateralen Membran
der Epithelzellen, oder parazellulär über tight junctions Elektroneutral über Austausch mit Bicarbonat über den apikalen Cl-/HCO3--Antiporter.
Durch diesen gelangt Bicarbonat in das Darmlumen; dieser Mechanismus
findet sich in den Zotten des Ileum sowie am Oberflächenepithel des
Colon
Elektroneutral über Austausch mit Bicarbonat über den apikalen Cl-/HCO3--Antiporter.
Durch diesen gelangt Bicarbonat in das Darmlumen; dieser Mechanismus
findet sich in den Zotten des Ileum sowie am Oberflächenepithel des
Colon In der interdigestiven Periode ("Nüchternzustand") kommt es im Ileum und proximalen Colon zu parallelem Austausch mittels Na+/H+-Austausch (NHE3) und Cl-/HCO3--Antiport (chloride anion exchanger,, auch DRA: down-regulated in adenoma) - Chlorid gelangt apikal in die Zelle und basolateral weiter Richtung Blut.
In der interdigestiven Periode ("Nüchternzustand") kommt es im Ileum und proximalen Colon zu parallelem Austausch mittels Na+/H+-Austausch (NHE3) und Cl-/HCO3--Antiport (chloride anion exchanger,, auch DRA: down-regulated in adenoma) - Chlorid gelangt apikal in die Zelle und basolateral weiter Richtung Blut. Stuhl ist bicarbonatreich; Durchfälle bedeuten Bicarbonatverlust und können metabolische Azidose bewirken.
Stuhl ist bicarbonatreich; Durchfälle bedeuten Bicarbonatverlust und können metabolische Azidose bewirken.  Abbildung):
Abbildung): Apikal sorgen Chloridkanäle für den Austritt von Cl-
über den Bürstensaum ins Darmlumen - Chlorid wird sezerniert. Die
intrazelluläre Chloridkonzentration ist dafür ausreichend hoch, dank
des Na/K/2Cl-Cotransporters in der basolateralen Membran. Sekretagoga steigern den intrazellulären [cAMP]- oder [Ca++]-Wert,
was subapikale Vesikel veranlasst, mit der Bürstensaummembran zu
fusionieren und so die Zahl verfügbarer Chloridkanäle zu steigern.
Apikal sorgen Chloridkanäle für den Austritt von Cl-
über den Bürstensaum ins Darmlumen - Chlorid wird sezerniert. Die
intrazelluläre Chloridkonzentration ist dafür ausreichend hoch, dank
des Na/K/2Cl-Cotransporters in der basolateralen Membran. Sekretagoga steigern den intrazellulären [cAMP]- oder [Ca++]-Wert,
was subapikale Vesikel veranlasst, mit der Bürstensaummembran zu
fusionieren und so die Zahl verfügbarer Chloridkanäle zu steigern.  Basolateral sind drei Transporter beteiligt:
Basolateral sind drei Transporter beteiligt: 



 Abbildung: Mechanismen der Resorption und Sekretion von Kalium im Darm
Abbildung: Mechanismen der Resorption und Sekretion von Kalium im Darm
 Abbildung).
Abbildung). Kaliumresorption:
Kaliumresorption:  Im Dünndarm erfolgt K+-Resorption passiv-parazellulär höchstwahrscheinlich durch solvent drag - mit Wasser,
Im Dünndarm erfolgt K+-Resorption passiv-parazellulär höchstwahrscheinlich durch solvent drag - mit Wasser, im distalen Colon gekoppelt mit
Natriumtransport: Ein luminaler ATP-verbrauchender Transporter tauscht H+ (lumenwärts) gegen K+ (in die Zelle), das dann die Epithelzelle über die Basolateralmembran verlässt.
im distalen Colon gekoppelt mit
Natriumtransport: Ein luminaler ATP-verbrauchender Transporter tauscht H+ (lumenwärts) gegen K+ (in die Zelle), das dann die Epithelzelle über die Basolateralmembran verlässt.  Der Dickdarm sezerniert Kalium (vor allem bei Kalium-Überangebot)
Der Dickdarm sezerniert Kalium (vor allem bei Kalium-Überangebot) hauptsächlich passiv-parazellulär über
lumen-negatives transepitheliales Potential (um die 25 mV), das die Kaliumionen anzieht - aber auch
hauptsächlich passiv-parazellulär über
lumen-negatives transepitheliales Potential (um die 25 mV), das die Kaliumionen anzieht - aber auch  aktiv: Basolateral arbeiten Na/K-ATPase und Na/K/2Cl-Cotransporter zusammen, Kalium verlässt die Zelle über Kaliumkanäle sowohl in der apikalen als auch der basolateralen Membran.
aktiv: Basolateral arbeiten Na/K-ATPase und Na/K/2Cl-Cotransporter zusammen, Kalium verlässt die Zelle über Kaliumkanäle sowohl in der apikalen als auch der basolateralen Membran.
 Etwa 200 mg Calcium (Ca++) werden pro Tag vom proximalen Dünndarm resorbiert. Das ist etwa die gleiche Menge, die mit dem Harn ausgeschieden wird. Die Resorption erfolgt teils passiv-parazellulär, teils unter Vitamin D-Wirkung aktiv-transzellulär (nur im Duodenum - angetrieben durch Konzentrations- und elektrische Gradienten):
Etwa 200 mg Calcium (Ca++) werden pro Tag vom proximalen Dünndarm resorbiert. Das ist etwa die gleiche Menge, die mit dem Harn ausgeschieden wird. Die Resorption erfolgt teils passiv-parazellulär, teils unter Vitamin D-Wirkung aktiv-transzellulär (nur im Duodenum - angetrieben durch Konzentrations- und elektrische Gradienten): 
 Abbildung: Calciumaufnahme im Duodenum
Abbildung: Calciumaufnahme im Duodenum
 Passiv-parazellulär (im gesamten Dünndarm), dieser Weg ist nicht vitaminkontrolliert; und
Passiv-parazellulär (im gesamten Dünndarm), dieser Weg ist nicht vitaminkontrolliert; und  aktiv-transzellulär (nur im Zwölffingerdarm). Calciumionen gelangen apikal über den Calciumtransporter TRPV6 in die Schleimhautzelle. Die Synthese des TRPV6 und des Calbindin ist Vitamin-D-abhängig.
aktiv-transzellulär (nur im Zwölffingerdarm). Calciumionen gelangen apikal über den Calciumtransporter TRPV6 in die Schleimhautzelle. Die Synthese des TRPV6 und des Calbindin ist Vitamin-D-abhängig.

 Zuerst durch Ca++-Kanäle - Typ TRPV6
- der apikalen Bürstensaum-Membran, getrieben von einem
elektrochemischen Gradienten (Vitamin-D-Hormon fördert ihre
Expression);
Zuerst durch Ca++-Kanäle - Typ TRPV6
- der apikalen Bürstensaum-Membran, getrieben von einem
elektrochemischen Gradienten (Vitamin-D-Hormon fördert ihre
Expression);  dann gebunden an Calbindin
(ein tetravalentes Transportprotein für Calcium, das sich außer in
Darm- auch in Gehirn-, Nieren- und Inselzellen findet), was die
Konzentration freier Ca++-Ionen in der Zelle niedrig und dadurch den Konzentrationsgradienten aufrecht erhält (Vitamin-D-Hormon fördert seine Expression);
dann gebunden an Calbindin
(ein tetravalentes Transportprotein für Calcium, das sich außer in
Darm- auch in Gehirn-, Nieren- und Inselzellen findet), was die
Konzentration freier Ca++-Ionen in der Zelle niedrig und dadurch den Konzentrationsgradienten aufrecht erhält (Vitamin-D-Hormon fördert seine Expression);  und dann via basolaterale Membran aktiv über einen Na+-Ca++-Austauscher (NCX; Antrieb durch den Natriumgradienten) und vor allem - unter Energieverbrauch - eine H+-Ca++-Pumpe (Antrieb durch ATP: Plasma membrane Ca++ ATPase, PMCA - Vitamin-D-Hormon fördert seine Expression).
und dann via basolaterale Membran aktiv über einen Na+-Ca++-Austauscher (NCX; Antrieb durch den Natriumgradienten) und vor allem - unter Energieverbrauch - eine H+-Ca++-Pumpe (Antrieb durch ATP: Plasma membrane Ca++ ATPase, PMCA - Vitamin-D-Hormon fördert seine Expression).
 Abbildung: Phosphataufnahme im Jejunum
Abbildung: Phosphataufnahme im Jejunum
 Phosphat wird in erster Linie proportional zur angebotenen Menge in der Nahrung resorbiert. Der Niere
kommt daher eine bedeutende Rolle für die Kontrolle des
Phosphathaushalts zu. Proximale Tubuluszellen resorbieren dort Phosphat
über einen Na/Pi-Cotransporter ihrer apikalen Membran. Dieser arbeitet hormonabhängig: Parathormon verringert seine Expression und damit die Phosphataufnahme, bei Phosphatüberschuss steigt die Ausscheidung mit dem Harn.
Phosphat wird in erster Linie proportional zur angebotenen Menge in der Nahrung resorbiert. Der Niere
kommt daher eine bedeutende Rolle für die Kontrolle des
Phosphathaushalts zu. Proximale Tubuluszellen resorbieren dort Phosphat
über einen Na/Pi-Cotransporter ihrer apikalen Membran. Dieser arbeitet hormonabhängig: Parathormon verringert seine Expression und damit die Phosphataufnahme, bei Phosphatüberschuss steigt die Ausscheidung mit dem Harn. Abbildung) mit Hilfe eines Na+/PO4---Symporters (ungefähr 1 g/d, 70-80% der mit der Nahrung zugeführten Menge,
Abbildung) mit Hilfe eines Na+/PO4---Symporters (ungefähr 1 g/d, 70-80% der mit der Nahrung zugeführten Menge,  s. dort).
In "organischer" Form angebotenes Phosphat (z.B. in Phospholipidem)
wird zu "anorganischem" Phosphat (Phosphatsalz) hydrolysiert, um
resorbiert werden zu können. Die Resorption ist durch die Kapazität von NPT2 begrenzt, einer Isoform des Na-Pi-Cotransporters in der apikalen Membran der Mucosazellen.
s. dort).
In "organischer" Form angebotenes Phosphat (z.B. in Phospholipidem)
wird zu "anorganischem" Phosphat (Phosphatsalz) hydrolysiert, um
resorbiert werden zu können. Die Resorption ist durch die Kapazität von NPT2 begrenzt, einer Isoform des Na-Pi-Cotransporters in der apikalen Membran der Mucosazellen.
 Abbildung: Resorption von freiem und Hämeisen an einer duodenalen Mucosazelle
Abbildung: Resorption von freiem und Hämeisen an einer duodenalen Mucosazelle Nichthämeisen ist die mengenmäßig führende Form von Eisen in der Nahrung, Es wird von DcytB (duodenales Cytochrom B) reduziert und dann von DMT (divalent metal transporter) als Fe2+,
Nichthämeisen ist die mengenmäßig führende Form von Eisen in der Nahrung, Es wird von DcytB (duodenales Cytochrom B) reduziert und dann von DMT (divalent metal transporter) als Fe2+, Häm mit dem darin enthaltenen als Fe2+ wahrscheinlich über ein Carrier-Protein (HCP: haem carrier protein) aufgenommen. Häm wird in Lysosomen abgebaut und Fe++
freigesetzt. Es wird dann basolateral exportiert (niedrige
Eisenspeicher im Körper) oder in Form von Ferritin in der Zelle
gespeichert (Eisenspeicher gefüllt).
Häm mit dem darin enthaltenen als Fe2+ wahrscheinlich über ein Carrier-Protein (HCP: haem carrier protein) aufgenommen. Häm wird in Lysosomen abgebaut und Fe++
freigesetzt. Es wird dann basolateral exportiert (niedrige
Eisenspeicher im Körper) oder in Form von Ferritin in der Zelle
gespeichert (Eisenspeicher gefüllt).
 Gut
resorbierbar (zu 10-20%; bei Schwangeren bis zu 40%) ist Eisen in
organischer Bindung (Hämeisen in
Fleisch, Blutprodukten, Ferritin),
Gut
resorbierbar (zu 10-20%; bei Schwangeren bis zu 40%) ist Eisen in
organischer Bindung (Hämeisen in
Fleisch, Blutprodukten, Ferritin),  weniger gut (zu 1-7%) aus pflanzlichen
Quellen (Nicht-Häm-Eisen). Besonders Phosphate behindern die Resorption von Nicht-Häm-Eisen; Fleisch und Ascorbinsäure begünstigen sie.
weniger gut (zu 1-7%) aus pflanzlichen
Quellen (Nicht-Häm-Eisen). Besonders Phosphate behindern die Resorption von Nicht-Häm-Eisen; Fleisch und Ascorbinsäure begünstigen sie. In der Nahrung vorhandenes freies Eisen liegt vorwiegend in dreiwertiger (unresorbierbarer) Form vor. Es wird teils im Magen (mit seinem niedrigen pH), teils in Duodenum und oberem Ileum von Ferrireduktase (DcytB - Duodenal cytochrome B) des enterozytären Bürstensaums - noch extrazellulär - in zweiwertige Form gebracht und dann mittels des divalenten Metalltransporters (DMT-1) in die Zelle aufgenommen. Die Expression von DcytB scheint durch mehrere Faktoren beeinflusst zu werden, welche so die Eisenaufnahme regulieren.
In der Nahrung vorhandenes freies Eisen liegt vorwiegend in dreiwertiger (unresorbierbarer) Form vor. Es wird teils im Magen (mit seinem niedrigen pH), teils in Duodenum und oberem Ileum von Ferrireduktase (DcytB - Duodenal cytochrome B) des enterozytären Bürstensaums - noch extrazellulär - in zweiwertige Form gebracht und dann mittels des divalenten Metalltransporters (DMT-1) in die Zelle aufgenommen. Die Expression von DcytB scheint durch mehrere Faktoren beeinflusst zu werden, welche so die Eisenaufnahme regulieren. Parallel dazu gibt es einen anderen Aufnahmemechanismus: In Fleisch liegt Eisen an Häm gebunden vor und wird in dieser Form aufgenommen - mittels eines Häm-Rezeptors (HCP: haem carrier protein) im Bürstensaum - und erst im Enterozyten aus dieser Bindung herausgelöst.
Parallel dazu gibt es einen anderen Aufnahmemechanismus: In Fleisch liegt Eisen an Häm gebunden vor und wird in dieser Form aufgenommen - mittels eines Häm-Rezeptors (HCP: haem carrier protein) im Bürstensaum - und erst im Enterozyten aus dieser Bindung herausgelöst.  Da es keinen Mechanismus zur Regulation der Eisenexkretion gibt, ist
die Steuerung der Aufnahme der einzige Angriffspunkt für die Regulation
des Eisenstatus im Körper.
Da es keinen Mechanismus zur Regulation der Eisenexkretion gibt, ist
die Steuerung der Aufnahme der einzige Angriffspunkt für die Regulation
des Eisenstatus im Körper. Zur Interaktiom von Darm (Resorption), Leber (Speicherung), Knochenmark (Erythropoese), Milz (Ery-Abbau) und Nieren (Erythropoetin) s. auch dort
Zur Interaktiom von Darm (Resorption), Leber (Speicherung), Knochenmark (Erythropoese), Milz (Ery-Abbau) und Nieren (Erythropoetin) s. auch dort
 Abbildung: Kobalamin-"Handling" im Magen und proximalen Dünndarm
Abbildung: Kobalamin-"Handling" im Magen und proximalen Dünndarm
 Abbildung).
Abbildung).  Abbildung).
Abbildung).
 Abbildung: Übersicht über Resorptionsorte und -intensitäten
Abbildung: Übersicht über Resorptionsorte und -intensitäten
 Makrophagen Prostaglandine und Sauerstoffradikale;
Makrophagen Prostaglandine und Sauerstoffradikale;  Mastzellen Histamin;
Mastzellen Histamin;  neutrophile Granulozyten Eikosanoide und PAF;
neutrophile Granulozyten Eikosanoide und PAF;  Fibroblasten Eikosanoide und Bradykinin.
Fibroblasten Eikosanoide und Bradykinin.
 Erkrankungen,
bei denen der Bürstensaum defekt ist (z.B. Zöliakie
Erkrankungen,
bei denen der Bürstensaum defekt ist (z.B. Zöliakie  ),
sind durch schwere
Resorptionsstörungen gekennzeichnet (charakteristischer Stuhl:
voluminös, vergoren, faul riechend). Ursache der Zöliakie ist eine
immunologische Reaktion auf Klebereiweiß (Weizenproteine wie Gliadin),
die in die Schleimhaut eingedrungen sind.
),
sind durch schwere
Resorptionsstörungen gekennzeichnet (charakteristischer Stuhl:
voluminös, vergoren, faul riechend). Ursache der Zöliakie ist eine
immunologische Reaktion auf Klebereiweiß (Weizenproteine wie Gliadin),
die in die Schleimhaut eingedrungen sind.  Bei Mukoviszidose ist die Cl--Sekretion gestört, weil der CFTR-Chloridkanal defekt ist. Der Darminhalt wird eingedickt, es kann Mekoniumileus (mekoniumbedingter Darmverschluss) auftreten.
Bei Mukoviszidose ist die Cl--Sekretion gestört, weil der CFTR-Chloridkanal defekt ist. Der Darminhalt wird eingedickt, es kann Mekoniumileus (mekoniumbedingter Darmverschluss) auftreten.  Ist
die Zuckerresorption über SGLT1 gestört (Glucose-Galactose-Malabsorption),
kann der Kohlenhydratbedarf auch über Fruktose gedeckt werden
(ausreichender Gradient: Nüchtern-Fruktosespiegel im Blut <0,3 mM).
Ist
die Zuckerresorption über SGLT1 gestört (Glucose-Galactose-Malabsorption),
kann der Kohlenhydratbedarf auch über Fruktose gedeckt werden
(ausreichender Gradient: Nüchtern-Fruktosespiegel im Blut <0,3 mM). Vitamin B12- bzw. Folat- Mangel führt zu megaloblastärer ("perniziöser"
Vitamin B12- bzw. Folat- Mangel führt zu megaloblastärer ("perniziöser"  ) Anämie
(das Vitamin ist für die Blutbildung notwendig) bzw. funikulärer
Myelose
) Anämie
(das Vitamin ist für die Blutbildung notwendig) bzw. funikulärer
Myelose  (Entmarkungserkrankung, die zu motorischen und
sensorischen Defiziten führt).
(Entmarkungserkrankung, die zu motorischen und
sensorischen Defiziten führt). Kleinkinder können Lactose in der Milch meist
problemlos verwerten. Viele Erwachsene hingegen weisen geringe
Laktaseaktivität im Dünndarm auf und vertragen daher Milchzucker in der Ernährung nur schlecht (Lactoseintoleranz).
Die Inzidenz liegt zwischen <40% (indo-europäischer Raum, Nordamerika) bis >70% (Asien,
Afrika, Südamerika -
Kleinkinder können Lactose in der Milch meist
problemlos verwerten. Viele Erwachsene hingegen weisen geringe
Laktaseaktivität im Dünndarm auf und vertragen daher Milchzucker in der Ernährung nur schlecht (Lactoseintoleranz).
Die Inzidenz liegt zwischen <40% (indo-europäischer Raum, Nordamerika) bis >70% (Asien,
Afrika, Südamerika -  Abbildung).
Abbildung).
 Abbildung: Globale Häufigkeitsverteilung der Lactoseintoleranz
Abbildung: Globale Häufigkeitsverteilung der Lactoseintoleranz
 Orale Rehydratation. Die Resorption von Natrium ist sehr stabil (z.B. SGLT1-vermittelte
nährstoffgekoppelte Aufnahme) und erfolgt weitgehend unabhängig von der
Einwirkung von second messenger (wie cAMP, Ca++-Ionen), auch im Falle von
Infektionen mit enterotoxinbildenden Bakterien. Solche Toxine
verursachen Durchfallerkrankungen. Trinken einer
Kochsalz-Glucose-Lösung führt zu Ersatz verlorengegangenen
Flüssigkeitsvolumens und stabilisiert Salz-Wasser-Bilanz und Kreislauffunktion.
Orale Rehydratation. Die Resorption von Natrium ist sehr stabil (z.B. SGLT1-vermittelte
nährstoffgekoppelte Aufnahme) und erfolgt weitgehend unabhängig von der
Einwirkung von second messenger (wie cAMP, Ca++-Ionen), auch im Falle von
Infektionen mit enterotoxinbildenden Bakterien. Solche Toxine
verursachen Durchfallerkrankungen. Trinken einer
Kochsalz-Glucose-Lösung führt zu Ersatz verlorengegangenen
Flüssigkeitsvolumens und stabilisiert Salz-Wasser-Bilanz und Kreislauffunktion.  Kurzdarmsyndrom: Nach weitgehender Entfernung des Dünndarms (z.B. nach Mesenterialinfarkt) ist u.a. die Resorption der Gallensalze
gestört; diese werden von Darmbakterien dekonjugiert und regen dann die
Sekretion von Salz und Wasser an (die dann nicht ausreichend resorbiert
werden). Das regt die Colonpassage an und führt zu chologener Diarrhoe: Durchfälle durch mangelnde Resorption von Gallensäuren
(Gallensäurenverlustsyndrom). Übersteigt der Verlust an gallensauren
Salzen die Neubildung, resultiert daraus mangelhafte Fettresorption und
es treten Fettstühle auf (Steatorrhoe).
Kurzdarmsyndrom: Nach weitgehender Entfernung des Dünndarms (z.B. nach Mesenterialinfarkt) ist u.a. die Resorption der Gallensalze
gestört; diese werden von Darmbakterien dekonjugiert und regen dann die
Sekretion von Salz und Wasser an (die dann nicht ausreichend resorbiert
werden). Das regt die Colonpassage an und führt zu chologener Diarrhoe: Durchfälle durch mangelnde Resorption von Gallensäuren
(Gallensäurenverlustsyndrom). Übersteigt der Verlust an gallensauren
Salzen die Neubildung, resultiert daraus mangelhafte Fettresorption und
es treten Fettstühle auf (Steatorrhoe).

 Die Resorptionskapazität des Darms wird selten überschritten: Der minimale Energiebedarf beträgt
~7,5 MJ/d (Gehirn, Immunsystem, aktive Muskulatur) ~20 MJ/d bei intensivem Training. Die maximale Kapazität liegt meist eine
Zehnerpotenz über den Durchschnittswerten: Glucose 3000 g/d
(Bedarf ~300 g/d), Aminosäuren ~600 g (Bedarf ~60 g/d), Cholesterin
4000 mg/d (Bedarf ~200 mg/d oder
weniger), Eisen 12 mg/d (Bedarf 1-2 mg/d) (funktionelle Reserve)
Die Resorptionskapazität des Darms wird selten überschritten: Der minimale Energiebedarf beträgt
~7,5 MJ/d (Gehirn, Immunsystem, aktive Muskulatur) ~20 MJ/d bei intensivem Training. Die maximale Kapazität liegt meist eine
Zehnerpotenz über den Durchschnittswerten: Glucose 3000 g/d
(Bedarf ~300 g/d), Aminosäuren ~600 g (Bedarf ~60 g/d), Cholesterin
4000 mg/d (Bedarf ~200 mg/d oder
weniger), Eisen 12 mg/d (Bedarf 1-2 mg/d) (funktionelle Reserve)  Hauptort der Resorption ist der Dünndarm (~200 m2): Eisen und Calcium werden bereits im Duodenum, die meisten Nährstoffe im Jejunum vollständig resorbiert; Magnesium,
intrinsic factor, Vitamin B12 und
Gallensäuren im Ileum (Reserve für die Resorption anderer Nährstoffe). Der Dickdarm (0,5-1 m2) resorbiert Flüssigkeit, Elektrolyte, einige
Fettsäuren. Bioverfügbarkeit ist der Anteil eines
resorbierten Stoffes, der unverändert in den
Kreislauf geallgengenwärtigelangt; sie hängt von Durchblutung, Darmmotilität, pH im Magen,
enzymatischem Ab- bzw. Umbau in Darm und Leber ab
Hauptort der Resorption ist der Dünndarm (~200 m2): Eisen und Calcium werden bereits im Duodenum, die meisten Nährstoffe im Jejunum vollständig resorbiert; Magnesium,
intrinsic factor, Vitamin B12 und
Gallensäuren im Ileum (Reserve für die Resorption anderer Nährstoffe). Der Dickdarm (0,5-1 m2) resorbiert Flüssigkeit, Elektrolyte, einige
Fettsäuren. Bioverfügbarkeit ist der Anteil eines
resorbierten Stoffes, der unverändert in den
Kreislauf geallgengenwärtigelangt; sie hängt von Durchblutung, Darmmotilität, pH im Magen,
enzymatischem Ab- bzw. Umbau in Darm und Leber ab Lipide
werden aus Mizellen besser resorbiert, Emulsion
durch Gallensäurern ist essentiell. Aus dem Mundspeichel zugesetzte
Lipasen und deren Aktivierung im sauren Milieu des Magens verseifen die
Fette des Nahrungsbreies bereits teilweise. Im oberen Duodenum treten
durch die Papilla Vateri Gallensäuren aus der Galle und weitere Lipasen
aus dem Pankreas hinzu, womit der Nahrungsbrei fortschreitend emulgiert
wird bis zu fein verteilten Micellen und in dieser Größe von der
Mucosa resorbiert werden kann.
Lipide
werden aus Mizellen besser resorbiert, Emulsion
durch Gallensäurern ist essentiell. Aus dem Mundspeichel zugesetzte
Lipasen und deren Aktivierung im sauren Milieu des Magens verseifen die
Fette des Nahrungsbreies bereits teilweise. Im oberen Duodenum treten
durch die Papilla Vateri Gallensäuren aus der Galle und weitere Lipasen
aus dem Pankreas hinzu, womit der Nahrungsbrei fortschreitend emulgiert
wird bis zu fein verteilten Micellen und in dieser Größe von der
Mucosa resorbiert werden kann. Im
glatten endoplasmatischen Retikulum der Mucosa entstehen Triglyceride, Phospholipide und Cholesterinester (Fetttröpfchen), im
rauhen endoplasmatischen Retikulum Apoproteine; die Komponenten werden
zusammengebracht, Chylomikronen und VLDL-Partikel im Golgi-Apparat
glykosyliert, anschließend freigesetzt, und gelangen über die Darmlymphe unmittelbar zur
fettkonsumierenden Peripherie. Die Leber nimmt nicht
verbrauchte Fette auf und verwandelt sie z.T. in Phosphoglyzeride. Fettlösliche Vitamine (A, D, E, K) werden in analoger Weise resorbiert. Aus Linolsäure und α-Linolensäure (essentiell) entstehen Eikosanoide. Mit
steigendem Cholesterinangebot mit der Nahrung nimmt der Prozentsatz
resorbierten Cholesterins ab
Im
glatten endoplasmatischen Retikulum der Mucosa entstehen Triglyceride, Phospholipide und Cholesterinester (Fetttröpfchen), im
rauhen endoplasmatischen Retikulum Apoproteine; die Komponenten werden
zusammengebracht, Chylomikronen und VLDL-Partikel im Golgi-Apparat
glykosyliert, anschließend freigesetzt, und gelangen über die Darmlymphe unmittelbar zur
fettkonsumierenden Peripherie. Die Leber nimmt nicht
verbrauchte Fette auf und verwandelt sie z.T. in Phosphoglyzeride. Fettlösliche Vitamine (A, D, E, K) werden in analoger Weise resorbiert. Aus Linolsäure und α-Linolensäure (essentiell) entstehen Eikosanoide. Mit
steigendem Cholesterinangebot mit der Nahrung nimmt der Prozentsatz
resorbierten Cholesterins ab Durch Cotransport mit Natriumionen kann ein mehr als 103-facher
Konzentrationsgradient überwunden und Glucose vollständig resorbiert
werden. Fruktose gelangt über den Transporter GLUT5 in die Epithelzelle
(erleichterte Diffusion).
Die basolaterale Membran transportiert Monosaccharide mittels GLUT2
weiter Richtung Blutkreislauf. Gelangt Glucose in den oberen Dünndarm,
produziert dieser GIP und GLP-1, beide regen die Insulinsekretion an (Inkretineffekt: orale Glucose ist stärker insulinwirksam als i.v. verabreichte)
Durch Cotransport mit Natriumionen kann ein mehr als 103-facher
Konzentrationsgradient überwunden und Glucose vollständig resorbiert
werden. Fruktose gelangt über den Transporter GLUT5 in die Epithelzelle
(erleichterte Diffusion).
Die basolaterale Membran transportiert Monosaccharide mittels GLUT2
weiter Richtung Blutkreislauf. Gelangt Glucose in den oberen Dünndarm,
produziert dieser GIP und GLP-1, beide regen die Insulinsekretion an (Inkretineffekt: orale Glucose ist stärker insulinwirksam als i.v. verabreichte)  Pepsin und Pankreasproteasen spalten Proteine zu ~70% zu Oligopeptiden, ~30% zu Aminosäuren (luminal); Exo-, Endo- und Dipeptidasen des Mucosa-Bürstensaums Oligopeptide zu Aminosäuren, Di- und Tripeptiden. Oligopeptide werden besonders rasch aufgenommen (kinetischer Vorteil gegenüber Aminosäuren). Für
den transzellulären Transport der Aminosäuren stehen ein "neutrales"
(neutrale Aminosäuren), "basisches" (kationische Aminosäuren, Zystein),
"saures" (Glutamat und Aspartat), "β-aminosaures" (ß-Alanin, Taurin) und ein "Iminoglyzinsystem" (Glyzin, Prolin, Hydroxyprolin) zur Verfügung, die teilweise natriumabhängig funktionieren. Weiters gibt es elektrogene PAT-Proteine im Bürstensaum, die Glyzin, Alanin, Serin und Prolin zusammen mit H+ in die Zelle transportieren. Etwa 10% der aufgenommenen Aminosäuren verwenden Enterozyten für ihre eigene Proteinsynthese. In der basolateralen Membran befinden sich mindestens fünf verschiedene Aminosäurepermeasen. Aminosäuren
können auch parazellulär resorbiert werden. Eiweißmoleküle können z.T.
unverändert aufgenommen werden, insbesondere von M-Zellen (Clathrin-Caveola-Mechanismus, Transzytose),
welche sie an Immunzellen weitergeben. Dieser Mechanismus erlaubt bei
Säuglingen die Aufnahme von Immunglobulinen aus der Muttermilch direkt
in die Blutbahn
Pepsin und Pankreasproteasen spalten Proteine zu ~70% zu Oligopeptiden, ~30% zu Aminosäuren (luminal); Exo-, Endo- und Dipeptidasen des Mucosa-Bürstensaums Oligopeptide zu Aminosäuren, Di- und Tripeptiden. Oligopeptide werden besonders rasch aufgenommen (kinetischer Vorteil gegenüber Aminosäuren). Für
den transzellulären Transport der Aminosäuren stehen ein "neutrales"
(neutrale Aminosäuren), "basisches" (kationische Aminosäuren, Zystein),
"saures" (Glutamat und Aspartat), "β-aminosaures" (ß-Alanin, Taurin) und ein "Iminoglyzinsystem" (Glyzin, Prolin, Hydroxyprolin) zur Verfügung, die teilweise natriumabhängig funktionieren. Weiters gibt es elektrogene PAT-Proteine im Bürstensaum, die Glyzin, Alanin, Serin und Prolin zusammen mit H+ in die Zelle transportieren. Etwa 10% der aufgenommenen Aminosäuren verwenden Enterozyten für ihre eigene Proteinsynthese. In der basolateralen Membran befinden sich mindestens fünf verschiedene Aminosäurepermeasen. Aminosäuren
können auch parazellulär resorbiert werden. Eiweißmoleküle können z.T.
unverändert aufgenommen werden, insbesondere von M-Zellen (Clathrin-Caveola-Mechanismus, Transzytose),
welche sie an Immunzellen weitergeben. Dieser Mechanismus erlaubt bei
Säuglingen die Aufnahme von Immunglobulinen aus der Muttermilch direkt
in die Blutbahn Die Wasserbilanz mit der Umwelt beträgt ~2-3 l/d (Erwachsene). Von ca. 8-9 Litern Flüssigkeit, die täglich in den Dünndarm gelangen, resorbiert dieser 6-7 l; ~2 l resorbiert der
Dickdarm, mit dem Stuhl werden ~0,1 l Wasser ausgeschieden. Natrium (Erhaltung des extrazellulären Volumens) gelangt über Natriumkanäle, mit organischen
Substraten, im Cotransport mit Chlorid, oder im Austausch gegen
Wasserstoffionen in Enterozyten. Na/K-ATPasen exportieren es über die basolaterale Membran in das Interstitium. Wasser folgt nach, der Dünndarm arbeitet isoosmotisch. Chlorid wird auch - und Kalium vorwiegend - parazellulär aufgenommen (solvent drag). Kalium wird im Darm sowohl sezerniert als auch resorbiert. Angiotensin
fördert die Natriumaufnahme elektroneutral im Dünndarm, Aldosteron
elektrogen im Colon (Vermehrung der Natriumkanäle); Dehydrierung regt die Bildung beider Hormone an. Distales Ileum und besonders der Dickdarm tauschen Chlorid gegen Bicarbonat aus: Der Stuhl ist bicarbonatreich; Durchfälle bedeuten Bicarbonatverlust (metabolische Azidose). Auch das Colon resorbiert Kochsalz, Kalium kann vor allem unter
Aldosteronwirkung sezerniert werden.
Die Natriumkonzentration im Stuhlwasser kann unter dem Einfluss von
Aldosteron von ~30 auf ~2 mM/l abnehmen, die Kaliumkonzentration von
~75 auf ~150 mM ansteigen
Die Wasserbilanz mit der Umwelt beträgt ~2-3 l/d (Erwachsene). Von ca. 8-9 Litern Flüssigkeit, die täglich in den Dünndarm gelangen, resorbiert dieser 6-7 l; ~2 l resorbiert der
Dickdarm, mit dem Stuhl werden ~0,1 l Wasser ausgeschieden. Natrium (Erhaltung des extrazellulären Volumens) gelangt über Natriumkanäle, mit organischen
Substraten, im Cotransport mit Chlorid, oder im Austausch gegen
Wasserstoffionen in Enterozyten. Na/K-ATPasen exportieren es über die basolaterale Membran in das Interstitium. Wasser folgt nach, der Dünndarm arbeitet isoosmotisch. Chlorid wird auch - und Kalium vorwiegend - parazellulär aufgenommen (solvent drag). Kalium wird im Darm sowohl sezerniert als auch resorbiert. Angiotensin
fördert die Natriumaufnahme elektroneutral im Dünndarm, Aldosteron
elektrogen im Colon (Vermehrung der Natriumkanäle); Dehydrierung regt die Bildung beider Hormone an. Distales Ileum und besonders der Dickdarm tauschen Chlorid gegen Bicarbonat aus: Der Stuhl ist bicarbonatreich; Durchfälle bedeuten Bicarbonatverlust (metabolische Azidose). Auch das Colon resorbiert Kochsalz, Kalium kann vor allem unter
Aldosteronwirkung sezerniert werden.
Die Natriumkonzentration im Stuhlwasser kann unter dem Einfluss von
Aldosteron von ~30 auf ~2 mM/l abnehmen, die Kaliumkonzentration von
~75 auf ~150 mM ansteigen Der proximale Dünndarm resorbiert ~200 mg Ca++ pro Tag - teils passiv-parazellulär (gesamter Dünndarm), teils unter Vitamin D-Wirkung aktiv-transzellulär (Duodenum): Vit.D (Calcitriol) fördert die Expression von Ca++-Kanälen vom Typ TRPV6. Calbindin (Vit-D-abhängig) bindet Ca++, hält [Ca++] im Enterozyten niedrig, den
Konzentrationsgradienten zum Extrazellulärraum aufrecht. Na/Ca-Austauscher in der
basolateralen Membran sowie Vit-D-abhängige H/Ca-Pumpen bringen Ca++
in das Interstitium. Erhöhtes Serum-[Ca++] hemmt die Sekretion von Parathormon (negative Rückkopplung: Parathormon regt die renale
1α-Hydroxylase an). Vit-D regt auch die Resorption von Phosphat im Dünndarm (Jejunum) an; diese erfolgt über Na/PO4-Symporter
Der proximale Dünndarm resorbiert ~200 mg Ca++ pro Tag - teils passiv-parazellulär (gesamter Dünndarm), teils unter Vitamin D-Wirkung aktiv-transzellulär (Duodenum): Vit.D (Calcitriol) fördert die Expression von Ca++-Kanälen vom Typ TRPV6. Calbindin (Vit-D-abhängig) bindet Ca++, hält [Ca++] im Enterozyten niedrig, den
Konzentrationsgradienten zum Extrazellulärraum aufrecht. Na/Ca-Austauscher in der
basolateralen Membran sowie Vit-D-abhängige H/Ca-Pumpen bringen Ca++
in das Interstitium. Erhöhtes Serum-[Ca++] hemmt die Sekretion von Parathormon (negative Rückkopplung: Parathormon regt die renale
1α-Hydroxylase an). Vit-D regt auch die Resorption von Phosphat im Dünndarm (Jejunum) an; diese erfolgt über Na/PO4-Symporter Eisen wird im
Duodenum und oberen Ileum resorbiert. Es wechselt zwischen zweiwertiger
(Transport durch die Zellmembran) und dreiwertiger Form (an Proteine
gebunden): Ferroxidasen: Fe2+ → Fe3+, Ferrireduktasen: Fe3+ → Fe2+. Nahrungseisen liegt vorwiegend frei (Nichthämeisen, meist Fe3+)
oder an eine Hämgruppe gebunden vor (Hämeisen). Nichthämeisen wird von
duodenalem Cytochrom B reduziert und vom Metalltransporter DMT als Fe2+, Häm als Ganzes aufgenommen (HCP) und lysosomal abgebaut. Im Bedarfsfall gibt die Mucosa Eisen an das Blut ab: Über Mobilferrin gelangt Fe2+ an die basolaterale Membran, wird durch Ferroportin nach extrazellulär verfrachtet und dabei von Hephaestin zu Fe3+ oxidiert (anschließend Transport durch Transferrin). Wird Eisen nicht benötigt, bleibt es ferritingebunden in der Darmschleimhautzelle. Die Eisenexkretion (Blutverlust) ist nicht reguliert, nur die Aufnahme aus der Darmschleimhaut. Die Eisenresorption beträgt ~1-2 mg/d und kann (Eisenmangel) auf maximal 2-5 mg/d gesteigert werden. Die
Eisenresorption verbessert sich bei gleichzeitiger Anwesenheit von
Vitamin C, Zitronensäure, Eiweiß. Zahlreiche pflanzliche Stoffe hemmen
die Eisenresorption
Eisen wird im
Duodenum und oberen Ileum resorbiert. Es wechselt zwischen zweiwertiger
(Transport durch die Zellmembran) und dreiwertiger Form (an Proteine
gebunden): Ferroxidasen: Fe2+ → Fe3+, Ferrireduktasen: Fe3+ → Fe2+. Nahrungseisen liegt vorwiegend frei (Nichthämeisen, meist Fe3+)
oder an eine Hämgruppe gebunden vor (Hämeisen). Nichthämeisen wird von
duodenalem Cytochrom B reduziert und vom Metalltransporter DMT als Fe2+, Häm als Ganzes aufgenommen (HCP) und lysosomal abgebaut. Im Bedarfsfall gibt die Mucosa Eisen an das Blut ab: Über Mobilferrin gelangt Fe2+ an die basolaterale Membran, wird durch Ferroportin nach extrazellulär verfrachtet und dabei von Hephaestin zu Fe3+ oxidiert (anschließend Transport durch Transferrin). Wird Eisen nicht benötigt, bleibt es ferritingebunden in der Darmschleimhautzelle. Die Eisenexkretion (Blutverlust) ist nicht reguliert, nur die Aufnahme aus der Darmschleimhaut. Die Eisenresorption beträgt ~1-2 mg/d und kann (Eisenmangel) auf maximal 2-5 mg/d gesteigert werden. Die
Eisenresorption verbessert sich bei gleichzeitiger Anwesenheit von
Vitamin C, Zitronensäure, Eiweiß. Zahlreiche pflanzliche Stoffe hemmen
die Eisenresorption Vitamin B12
(Kobalamin) bindet zunächst an Haptocorrin (Transcobalamin) aus dem
Speichel. Haptocorrin ist resistent gegenüber Säure- und Pepsineinfluss
und schützt so das Vitamin bei seiner Passage durch den Magen, nach Abbau des Haptocorrins im Dünndarm an (von Belegzellen gebildeten, verdauungsresistenten) Intrinsic factor; dieser Komplex wird im Ileum resorbiert (rezeptorvermittelte Endozytose?), der Intrinsic factor-Kobalamin-Komplex lysosomal gespalten, Kobalamin an Transkobalamin gebunden (Transportform)
Vitamin B12
(Kobalamin) bindet zunächst an Haptocorrin (Transcobalamin) aus dem
Speichel. Haptocorrin ist resistent gegenüber Säure- und Pepsineinfluss
und schützt so das Vitamin bei seiner Passage durch den Magen, nach Abbau des Haptocorrins im Dünndarm an (von Belegzellen gebildeten, verdauungsresistenten) Intrinsic factor; dieser Komplex wird im Ileum resorbiert (rezeptorvermittelte Endozytose?), der Intrinsic factor-Kobalamin-Komplex lysosomal gespalten, Kobalamin an Transkobalamin gebunden (Transportform)