

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert

Physiologie der Nierenfunktion
und der ableitenden Harnwege

 Nierenmark und Gegenstrommechanismus
Nierenmark und Gegenstrommechanismus
© H. Hinghofer-Szalkay
 Bartter-Syndrom: Frederic Bartter
Bartter-Syndrom: Frederic Bartter
Henle-Schleife: Jakob Henle
hyperton: ὑπέρ = über (hinaus), τόνος = (An)spannung
juxtamedullär: iuxta = benachbart, medulla = Mark
Osmose: ὠσμός = Antrieb, Eindringen, Schub
Tamm-Horsfall-Protein: Zuerst von Igor Tamm und Frank Horsfall dargestellt
Vasopressin: vas = Gefäß, premere = drücken, pressen
Etwa jedes neunte Nephron liegt so nahe am Nierenmark (juxtamedullär),
dass die Mittelzone seines Tubulus schleifenförmig (Henle'sche Schleife) in diese "osmotische
Sonderzone" eintaucht. Die Osmolalität im tiefen Nierenmark ist um ein Mehrfaches höher (bis 1,5 osmol/l) als im Körper sonst üblich (~0,3 osmol/l).
Der absteigende Schenkel dieser Schleife
verhält sich eher passiv; er ist wasser-, nicht aber
harnstoffdurchlässig (Wasser tritt osmotisch bedingt aus). Beim (dünnwandigen) Anfangsteil des aufsteigenden Schenkels ist
es umgekehrt (harnstoffdurchlässig, wasserundurchlässig; Harnstoff tritt ein). Der
dickwandige Endteil des aufsteigenden Schenkels schließlich ist sowohl
wasser- als auch harnstoffdicht, und er pumpt - unter ATP-Verbrauch - Kochsalz aus dem Tubulus
in das Interstitium des Nierenmarks. Dadurch entsteht dessen hohe
osmotische Konzentration, während der Tubulusinhalt schließlich hypoton
(bis ~0,1 osmol/l) wird.
Der Zweck dieses Gegenstromaustausch-Mechanismus besteht darin, die Flüssigkeit im
absteigenden Schleifenschenkel "vorzukonzentrieren" (Wasser wandert wegen
der hohen Osmolarität des Interstitiums aus dem Tubulus). Dann kann der
dickwandige Teil des aufsteigenden Schenkels aus einem bereits
hypertonen Reservoir schöpfen und die Kochsalzkonzentration im
Interstitium weiter steigern, ohne ein hohes
Konzentrationsgefälle überwinden zu müssen. Dieser
Multiplikationseffekt spart Stoffwechselenergie.
Harnstoff beteiligt sich an diesem osmotischen Konzept, indem seine Konzentration in der inneren
Markzone bis auf 0,6 osmol/l ansteigt - bedingt durch seine
Rezirkulation im Nierenmark (Transportsysteme in den Sammelrohren, harnstoffundurchlässige absteigende Schenkel) und - energetisch abhängig von der Kochsalzpumpe - im aufsteigenden Schenkel.
Vasopressin fördert einerseits die Rückresorption von Wasser (Aquaporine), andererseits die von Harnstoff (Harnstofftransporter).
Dadurch minimiert es den Wasserverlust in der Niere
(Vasopressin wirkt als "Wassersparhormon") und fördert den osmotischen
Konzentrierungsmechanismus.
|
Die
Nieren müssen in der Lage sein, die osmotische Konzentration des Harns
an die jeweilige Situation anzupassen: Vermehrt Wasser aus dem Körper
zu entfernen, wenn dieser zu viel davon abbekommen hat (übertriebenes
Trinken, Infusionen) einerseits, Wasser zu sparen, wenn zu wenig davon
vorhanden ist, andererseits. Die Osmolalität kann im ersten Fall bis
auf 40 mosmol/l sinken, im zweiten bis auf 1200 mosmol/l steigen (Blut und interstitielle Flüssigkeit - und "isotone" Flüssigkeiten - haben ungefähr 290 mosmol/l (0,29 osmol/l).
Das Nierenmark baut einen hohen osmotischen Gradienten auf
Die
Nieren sind in der Lage, die Konzentration gelöster Stoffe
(=
Osmolarität 
)
in Teilen ihres Gewebes und in Harn - verglichen zu anderen
Körperflüssigkeiten - bis auf ein Siebentel zu
senken (→ Wasserausscheidung) oder bis zum Vierfachen zu steigern (→ Ausscheidung
konzentrierten Harns). Die Fähigkeit zu diesem Grad an Verdünnung oder
Konzentrierung ermöglicht die rasche Anpassung an wechselnde
Salz-Wasser-Bilanzen (Trinken vs. Durst, unterschiedliche Salzzufuhr)
und basiert im Wesentlichen auf der Struktur des Nierenmarks, in dem
der Inhalt der Tubuli teils aktiv (Ionenpumpen), teils passiv
(osmotisch) aufbereitet wird.
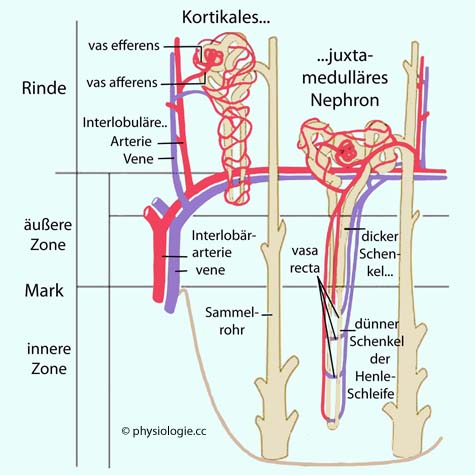

Abbildung: Kortikales vs. juxtamedulläres Nephron
Nach einer Vorlage bei Guyton, Textbook of medical physiology, 8th ed. 1991 (WB Saunders, Philadelphia)
Die zahlreicheren kortikalen Nephrone liegen unter der Nierenoberfläche, ihre kurzen Henle-Schleifen liegen im Wesentlichen in der Rindenzone; ihre Kapazität für die Rückresorptionvon Wasser und Elektrolyten ist relativ gering.
Juxtamedulläre
Nephrone liegen in der Tiefe der Nierenrinde, grenzen an das Mark,
in das sie tiefreichende Henle'sche Schleifen entsenden. Diese
resorbieren intensiv Wasser und Salze, generieren ausgeprägte
osmotische Gradienten und können hochkonzentrierten Urin produzieren

Die meisten Nephrone (~88%) sind (samt ihrem Tubulus)
in der (plasmaisotonen) Rinde der Niere untergebracht und nehmen an der
Osmoregulation nicht direkt teil (kortikale Nephrone). Sie tragen aber die Hauptlast exkretorischer und regulatorischer Funktionen. Ihre Henle-Schleifen  sind kurz (
sind kurz ( Abbildung).
Abbildung).
Nur ~12% sind juxtamedulläre Nephrone  , ihre Glomeruli liegen nahe dem Mark,
in das ihre vergleichsweise langen Tubuli tief eintauchen. Sie ziehen
durch die stark hypertonen
, ihre Glomeruli liegen nahe dem Mark,
in das ihre vergleichsweise langen Tubuli tief eintauchen. Sie ziehen
durch die stark hypertonen  Zonen
des tieferen Nierenmarks, was für
Wasserhaushalt und Osmoregulation bedeutsam ist: Die Henle-Schleifen
der juxtamedullären Nephrone ermöglichen einen Gegenstrom-
Austauschmechanismus (countercurrent exchange).
Dieser baut in
energiesparender Weise Zonen hoher Osmolarität im Nierenmark auf.
Zonen
des tieferen Nierenmarks, was für
Wasserhaushalt und Osmoregulation bedeutsam ist: Die Henle-Schleifen
der juxtamedullären Nephrone ermöglichen einen Gegenstrom-
Austauschmechanismus (countercurrent exchange).
Dieser baut in
energiesparender Weise Zonen hoher Osmolarität im Nierenmark auf.
 Die tiefen Regionen des Marks - die Zonen um die Papillenspitzen
- empfangen nur ~1% der renalen Durchblutung (das hilft bei der
Erhaltung der hohen Osmolalität), haben dadurch allerdings einen sehr niedrigen
Sauerstoffpartialdruck (um 10 mmHg) und sind im Wesentlichen auf anaeroben Stoffwechsel eingestellt. Energieintensive Transportprozesse sind hier nicht mehr möglich, was auch in dem Umstand zum Ausdruck kommt, dass die
dünnwandigen Tubulusschleifen aus flachen (nicht zylinderförmigen)
Zellen aufgebaut sind.
Die tiefen Regionen des Marks - die Zonen um die Papillenspitzen
- empfangen nur ~1% der renalen Durchblutung (das hilft bei der
Erhaltung der hohen Osmolalität), haben dadurch allerdings einen sehr niedrigen
Sauerstoffpartialdruck (um 10 mmHg) und sind im Wesentlichen auf anaeroben Stoffwechsel eingestellt. Energieintensive Transportprozesse sind hier nicht mehr möglich, was auch in dem Umstand zum Ausdruck kommt, dass die
dünnwandigen Tubulusschleifen aus flachen (nicht zylinderförmigen)
Zellen aufgebaut sind.
 Der
"horizontale" Osmolaritätsunterschied, den die tubulären Salzpumpen
der dickwandigen Schleifenzellen überwinden müssen, ist gering, gleichzeitig werden aber
"stockwerkartig" vertikale Osmolaritätszonen im Nierenmark aufgebaut:
Der
"horizontale" Osmolaritätsunterschied, den die tubulären Salzpumpen
der dickwandigen Schleifenzellen überwinden müssen, ist gering, gleichzeitig werden aber
"stockwerkartig" vertikale Osmolaritätszonen im Nierenmark aufgebaut:
 Der absteigende
Teil der Henle-Schleife ist für Wasser durchgängig, nicht aber für Harnstoff; die Tubulusflüssigkeit wird durch die zunehmende
Osmolarität im Mark hyperton. Die Wasserdurchlässigkeit erklärt sich durch das Fehlen von tight junctions ("loose junctions"), so kann Wasser parazellulär in das Interstitium eindringen.
Der absteigende
Teil der Henle-Schleife ist für Wasser durchgängig, nicht aber für Harnstoff; die Tubulusflüssigkeit wird durch die zunehmende
Osmolarität im Mark hyperton. Die Wasserdurchlässigkeit erklärt sich durch das Fehlen von tight junctions ("loose junctions"), so kann Wasser parazellulär in das Interstitium eindringen.
Der absteigende Schenkel der Henle-Schleife ist für Wasser sehr gut permeabel
|
Die Tubuluszellen enthalten
 Der dünnwandige aufsteigende Teil der Henle-Schleife lässt Harnstoff passieren, nicht aber Wasser (Abbildungen). Diese Partien der Schleife liegen in Zonen niedrigen pO2
(s. oben). Die fehlende Durchlässigkeit für Wasser erklärt sich
einerseits durch die Abwesenheit von Aquaporinen in der Membran der
Epithelzellen, andererseits stark ausgebildete tight junctions - sowohl
der transzelluläre als auch der parazelluläre Weg ist für Wasser
versperrt.
Der dünnwandige aufsteigende Teil der Henle-Schleife lässt Harnstoff passieren, nicht aber Wasser (Abbildungen). Diese Partien der Schleife liegen in Zonen niedrigen pO2
(s. oben). Die fehlende Durchlässigkeit für Wasser erklärt sich
einerseits durch die Abwesenheit von Aquaporinen in der Membran der
Epithelzellen, andererseits stark ausgebildete tight junctions - sowohl
der transzelluläre als auch der parazelluläre Weg ist für Wasser
versperrt.
Der
(wasserundurchlässige) dünne Teil der aufsteigenden Henle-Schleife nimmt aus dem Interstitium große Mengen Harnstoff auf
|
 Abbildung: Resorption im dicken aufsteigenden Schenkel der Henle-Schleife
Abbildung: Resorption im dicken aufsteigenden Schenkel der Henle-Schleife
Nach einer Vorlage in Danzinger / Zeidel / Parker:
Renal Physiology - A Clinical Approach. Wolters Kluwer / Lippincott
Williams & Wilkins 2012
Basolaterale Membran links, apikale rechts.
1: Das glomeruläre Filtrat ist reich an Kochsalz (und enthält relativ wenig Kalium)
2: Die Na/K-ATPase erzeugt einen einwärtsgerichteten Natriumgradienten und ist elektrogen
3: Der basale Kationentransport wird apikal über den Na+/K+/2Cl--Cotransporter
angetrieben; dieser arbeitet elektroneutral. Dazu kommt ein
Na/H-Austauscher, der Wasserstoffionen in das Lumen transportiert
4: Kalium gelangt durch Kaliumkanäle (ROMK: Renal Outer Medullary Potassium (K) channel)
in das Lumen
5: Der Kalium-Rückfluss in das Lumen baut ein lumen-positives Potential auf, dieses treibt die Resorption von Calcium und Magnesium (parazellulär, gelber Pfeil) sowie Kalium an
6: Chlorid verlässt die Zelle basolateral via Chloridkanäle. Zusätzlich existiert ein K/Cl-Kotransport aus der Zelle in das Interstitium (nicht gezeigt)

Der Stoffaustausch erfolgt über apikale (luminale), basolaterale (blutseitige) Membran sowie parazellulär:
 Über die apikale Membran
Über die apikale Membran
 werden 20-30% der filtrierten Kochsalzmenge elektroneutral mittels Na+/K+/2Cl--Cotransport in der luminalen Membran resorbiert (
werden 20-30% der filtrierten Kochsalzmenge elektroneutral mittels Na+/K+/2Cl--Cotransport in der luminalen Membran resorbiert ( Abbildung).
Dieser Carrier funktioniert über den in die Zelle gerichteten
Natrium-Konzentrationsgradienten (angetrieben durch die Na/K-ATPase in der basolateralen Membran); Kalium und Chlorid werden
sekundär-aktiv "mitgeschleppt". Vasopressin
Abbildung).
Dieser Carrier funktioniert über den in die Zelle gerichteten
Natrium-Konzentrationsgradienten (angetrieben durch die Na/K-ATPase in der basolateralen Membran); Kalium und Chlorid werden
sekundär-aktiv "mitgeschleppt". Vasopressin  regt
die Expression dieses Transporters an - dadurch wird der Aufbau des
osmotischen Gradienten gefördert, der für die Rückresorption von Wasser
essentiell ist (Vasopressin: "Wassersparhormon").
regt
die Expression dieses Transporters an - dadurch wird der Aufbau des
osmotischen Gradienten gefördert, der für die Rückresorption von Wasser
essentiell ist (Vasopressin: "Wassersparhormon").
Limitierend für die Aktivität des Na/K/2Cl-Cotransporters ist die
luminale Verfügbarkeit von Chloridionen; der Cotransport funktioniert
hingegen auch noch bei sehr niedrigen Natrium- und
Kaliumkonzentrationen im Tubuluslumen.
Der Na/K/2Cl-Symporter im aufsteigenden Schenkel der Henle-Schleife (apikale Membran) nutzt den Na+-Gradienten zur Resorption von K+ und Cl-, die intrazelluläre Osmolarität steigt an
In der basolateralen Membran wird Na+ aus der Zelle gepumpt (Na/K-ATPase), K+ verlässt die Zelle über Kaliumkanäle. Cl- wird im Austausch gegen HCO3- aufgenommen
|
Die basolaterale Membran enthält einen Calciumsensor, dessen Aktivierung durch hohes extrazelluläres [Ca++] den Na/K/2Cl-Cotransporter hemmt. Das lumen-positive Potential und der parazelluläre Ca++-Transport Richtung Interstitium - also die Ca++-Resorption - nimmt dadurch ab.
Magnesium
wird zu 40-70% parazellulär aufgenommen, angetrieben durch das
lumen-positive Potential (das infolge Kaliumrückstroms in das Lumen
auftritt). Die basolaterale Na-K-ATPase erzeugt einen Natriumgradienten
zur Blutseite. Der Calciumsensor kann auch den Magnesiumtransport reduzieren.
 Schleifendiuretika. Der Na+/K+/2Cl--Cotransport ist der Motor der renalen Konzentrierungsleistung und des osmotischen Gradienten im Nierenmark. Blockade dieses Systems - durch "Schleifendiuretika" wie Furosemid - verhindert die Wiederaufnahme von Natrium, Kalium und Chlorid und damit die Harnkonzentration im Mark - die Konzentrierungsfähigkeit der Niere sinkt. Dadurch werden diese Elektrolyte vermehrt ausgeschieden und das extrazelluläre Flüssigkeitsvolumen nimmt ab (was z.B. für das Ausschwemmen von Ödemen der gewünschte therapeutische Effekt sein kann).
Schleifendiuretika. Der Na+/K+/2Cl--Cotransport ist der Motor der renalen Konzentrierungsleistung und des osmotischen Gradienten im Nierenmark. Blockade dieses Systems - durch "Schleifendiuretika" wie Furosemid - verhindert die Wiederaufnahme von Natrium, Kalium und Chlorid und damit die Harnkonzentration im Mark - die Konzentrierungsfähigkeit der Niere sinkt. Dadurch werden diese Elektrolyte vermehrt ausgeschieden und das extrazelluläre Flüssigkeitsvolumen nimmt ab (was z.B. für das Ausschwemmen von Ödemen der gewünschte therapeutische Effekt sein kann).
Gleichzeitig nimmt die Ca++-Resorption ab ( Abbildung oben), deshalb können Schleifendiuretika zur Behalndlung von Hypercalcämie eingesetzt werden.
Abbildung oben), deshalb können Schleifendiuretika zur Behalndlung von Hypercalcämie eingesetzt werden.
Der konzentrierungshemmende Effekt der Schleifendiuretika senkt die Osmolarität im Nierenmark.
Damit sinkt nicht nur die Rückresorption von Wasser in das Interstitium
(und steigt die Menge in den Sammelrohren), sondern auch die von Kalium
(mit der Folge einer Hypokaliämie). Schleifendiuretika gelten als "Kaliumräuber"; sie sollten mit zusätzlichem Kalium appliziert werden.
Wegen des reduzierten luminalen Plus-Potentials (das Kationen Richtung
Interstitium treibt) nimmt auch die parazelluläre Rückresorption von Calcium und Magnesium ab ( Abbildung) - deren fraktionelle Ausscheidung steigt an.
Abbildung) - deren fraktionelle Ausscheidung steigt an.
Blockade des Na+/K+/2Cl--Cotransporters steigert die Magnesiumausscheidung
|
 In die Zelle gelangtes Kalium wird über eine (funktionell gekoppelte) K-Permease (ROMK: Renal Outer Medullary Potassium (K) channel)
in den Tubulus zurückbefördert und steht für weiteren Cotransport zur
Verfügung ("Kalium-Recycling"). Durch diesen Mechanismus wird das Lumen im aufsteigenden Schenkel positiv geladen
(5-10 mV gegen das Interstitium). Da sich nur wenig Kalium im
glomerulären Filtrat befindet, ist das Kalium-Recycling für die
Aufrechterhaltung des Na/K/2Cl-Cotransports notwendig.
In die Zelle gelangtes Kalium wird über eine (funktionell gekoppelte) K-Permease (ROMK: Renal Outer Medullary Potassium (K) channel)
in den Tubulus zurückbefördert und steht für weiteren Cotransport zur
Verfügung ("Kalium-Recycling"). Durch diesen Mechanismus wird das Lumen im aufsteigenden Schenkel positiv geladen
(5-10 mV gegen das Interstitium). Da sich nur wenig Kalium im
glomerulären Filtrat befindet, ist das Kalium-Recycling für die
Aufrechterhaltung des Na/K/2Cl-Cotransports notwendig.
 Außerdem können Protonen mittels Na+/H+-Austauscher (NHE3, E für exchanger) gegen Natriumionen ausgewechselt werden.
Außerdem können Protonen mittels Na+/H+-Austauscher (NHE3, E für exchanger) gegen Natriumionen ausgewechselt werden.

 ÜberÜber die basolaterale Membran
ÜberÜber die basolaterale Membran
 wird (mittels Na/K-ATPase) Natrium in Richtung Blut und Kalium in die Zelle gebracht, sowie
wird (mittels Na/K-ATPase) Natrium in Richtung Blut und Kalium in die Zelle gebracht, sowie

 Cl- über eine Chlorid-Permease Richtung Blut transportiert.
Cl- über eine Chlorid-Permease Richtung Blut transportiert.

 Zusätzlich stehen eine Kaliumpermease (K+-Ausstrom aus der Zelle) sowie ein Cl-/HCO3--Austauscher zur Verfügung (Bicarbonat in das Interstitium, Chlorid in die Zelle).
Zusätzlich stehen eine Kaliumpermease (K+-Ausstrom aus der Zelle) sowie ein Cl-/HCO3--Austauscher zur Verfügung (Bicarbonat in das Interstitium, Chlorid in die Zelle).

Aktiver
Elektrolyttransport im dicken aufsteigenden Teil der Henle-Schleife
baut eine hohe interstitielle Osmolarität im Nierenmark auf
|
 Parazellulär: Das Lumen ist positiv aufgeladen (+3 bis maximal +15 mV). Das unterstützt die parazelluläre Auswärtsbewegung von Natrium- (~25%, konzentrationsabhängig), Calcium- (25% des insgesamt resorbierten Ca++) und Magnesiumionen (~70% des insgesamt resorbierten Mg++ -
Parazellulär: Das Lumen ist positiv aufgeladen (+3 bis maximal +15 mV). Das unterstützt die parazelluläre Auswärtsbewegung von Natrium- (~25%, konzentrationsabhängig), Calcium- (25% des insgesamt resorbierten Ca++) und Magnesiumionen (~70% des insgesamt resorbierten Mg++ -  Abbildung oben,
Abbildung oben,  vgl. dort). Dabei wird die Durchlässigkeit der Schlussleisten (tight junctions) für Magnesium durch Paracellin-1 (ein Claudin) gewährleistet (Mutationen dieses Proteins führen zu Hypomagnesiämie, weil weniger Magnesium aus dem Tubulus rückresorbiert wird).
vgl. dort). Dabei wird die Durchlässigkeit der Schlussleisten (tight junctions) für Magnesium durch Paracellin-1 (ein Claudin) gewährleistet (Mutationen dieses Proteins führen zu Hypomagnesiämie, weil weniger Magnesium aus dem Tubulus rückresorbiert wird).
Das lumenpositive Potential - an dessen Entstehung der Na/K/2Cl-Cotransporter, der basolaterale Chloridkanal, das Kalium-Recycling und die Na/K-ATPase beteiligt sind - ist für die parazelluläre Ca++- und Mg++- Resorption notwendig.

Der Hauptanteil des glomerulär filtrierten Magnesiums wird im dicken aufsteigenden Schenkel der Henle-Schleife parazellulär resorbiert
|
 Die Henle-Schleifen der juxtamedullären (tief ins Mark eintauchenden) Nephrone bilden ein spezielles Protein (Uromodulin, Tamm-Horsfall-Protein
Die Henle-Schleifen der juxtamedullären (tief ins Mark eintauchenden) Nephrone bilden ein spezielles Protein (Uromodulin, Tamm-Horsfall-Protein  ),
das für diese Nephrone spezifisch und im Harn nachweisbar ist (mit ~50
mg/d das am stärksten renal ausgeschiedene Eiweiß). Vermutlich hat es
eine protektive Wirkung gegenüber Ca++-Harnsteinbildung (zusammen mit den Kristallisationsinhibitoren Uropontin und Nephrocalcin) und
bakteriellen Infektionsvorgängen.
),
das für diese Nephrone spezifisch und im Harn nachweisbar ist (mit ~50
mg/d das am stärksten renal ausgeschiedene Eiweiß). Vermutlich hat es
eine protektive Wirkung gegenüber Ca++-Harnsteinbildung (zusammen mit den Kristallisationsinhibitoren Uropontin und Nephrocalcin) und
bakteriellen Infektionsvorgängen.
 Zu den Kalium-Austauschmengen in den Nierenabschnitten s. dort
Zu den Kalium-Austauschmengen in den Nierenabschnitten s. dort
Osmotischer Multiplikator
Die Aufnahme von Kochsalz aus der
Tubulusflüssigkeit wird vor allem durch die Na-K-Pumpe in den basolateralen Membranen angetrieben. Dabei entsteht
ein (transversaler) osmotischer Gradient; zahlreiche Mitochondrien und basolaterale Membrantaschen spiegeln die aktive Transportfunktion der Tubuluszellen wider.

 Abbildung: Gegenstrom- Multiplikationsprinzip
Abbildung: Gegenstrom- Multiplikationsprinzip
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Oben: Antidiurese, unten: Wasserdiurese. Bedingt durch die Rückresorption von Flüssigkeit aus dem Sammelrohrsystem (H2O) fließt über die vasa recta mehr Blut ab als in die Markzone einfließt.
Werte für die Osmolarität (grüne Felder rechts, Werte in mosmol/l) beispielhaft. Rote Pfeile: Aktiver Transport (Na/Cl-Symporter
im aufsteigenden Schenkel der Henle-Schleife). Blaue und grüne Pfeile: Passsiver Transport von Wasser bzw. gelösten Stoffen.
 Der absteigende Schenkel der Henle-Schleife ist für Wasser durchlässig,
Der absteigende Schenkel der Henle-Schleife ist für Wasser durchlässig,
 die
Schleife selbst sowohl für Wasser als auch für Harnstoff,
die
Schleife selbst sowohl für Wasser als auch für Harnstoff,
 der dickwandige
aufsteigende Schenkel weder für Wasser noch für Harnstoff (hier erfolgt
die Verdünnung des Tubulusinhalts auf ~120 mM).
der dickwandige
aufsteigende Schenkel weder für Wasser noch für Harnstoff (hier erfolgt
die Verdünnung des Tubulusinhalts auf ~120 mM).
Muss Wasser gespart werden (Antidiurese), kann der Harn bis 4-fach hyperton werden
(hier 1200 mosmol/l); leistet die Niere Verdünnungsarbeit (Wasserdiurese), ist der Endharn
hypoton (hier 60 mosmol/l, etwa 1/5 der Plasma-Osmolarität)
AQP, Aquaporin  NKCC2, Na/K/Cl-Cotransporter
NKCC2, Na/K/Cl-Cotransporter  UT, Harnstofftransporter
UT, Harnstofftransporter

 Die
Kochsalzkonzentration sinkt schließlich unter
diejenige im Blutplasma (bis auf ~50-100 mosmol/l) - die
tubuläre Flüssigkeit, die in den distalen Tubulus der Rinde gelangt,
ist
also hypoton.
Die
Kochsalzkonzentration sinkt schließlich unter
diejenige im Blutplasma (bis auf ~50-100 mosmol/l) - die
tubuläre Flüssigkeit, die in den distalen Tubulus der Rinde gelangt,
ist
also hypoton.
Der dicke aufsteigende
Teil der Henle'schen Schleife und der frühdistale Tubulus werden als Verdünnungssegment bezeichnet (beide sind wasserundurchlässig; der frühdistale Tubulus verfügt über einen Na+-Cl--Symporter).
 Durch
die Strömung der Tubulusflüssigkeit ergibt sich im Mark ein vertikaler
Osmolaritätsgradient, der Inhalt langer Henle-Schleifen
kann so 5-fach hyperton werden (d.h. bis zu maximal ~1500 mosmol/l).
Durch
die Strömung der Tubulusflüssigkeit ergibt sich im Mark ein vertikaler
Osmolaritätsgradient, der Inhalt langer Henle-Schleifen
kann so 5-fach hyperton werden (d.h. bis zu maximal ~1500 mosmol/l).
 Kochsalz- und Harnstoffkonzentration und damit Osmolarität nehmen
mit dem Abstand zur Rinden-Mark-Grenze zu. (Wüstentiere mit besonders
"schlanken" Markpyramiden können im Mark Hypertonie bis zu 5000
mosmol/l - etwa das 17-fache der Osmolarität des Blutes - und einen entsprechend konzentrierten Harn aufbauen, und
dadurch extrem wassersparend bilanzieren.)
Kochsalz- und Harnstoffkonzentration und damit Osmolarität nehmen
mit dem Abstand zur Rinden-Mark-Grenze zu. (Wüstentiere mit besonders
"schlanken" Markpyramiden können im Mark Hypertonie bis zu 5000
mosmol/l - etwa das 17-fache der Osmolarität des Blutes - und einen entsprechend konzentrierten Harn aufbauen, und
dadurch extrem wassersparend bilanzieren.)
Der Harn kann bei maximaler Konzentrierung 4-5fach hyperton werden (1200-1500 mosmol/l)
|
Die Sammelrohre
der Niere passieren auf ihrem Weg zum Nierenbecken das hypertone Mark.
Aus der Rinde (≤ 290 mosmol/l) kommend, strömt Harn durch diese
hypertone Zone, und Wasser kann je
nach Durchlässigkeit der Sammelrohrwand (Vasopressin, Aquaporine!)
osmotisch (=ohne zusätzlichen
Stoffwechselaufwand) zurückgewonnen werden.
Gesteigerte Wasserdurchlässigkeit der Sammelrohre konzentriert den Harn
|
Das
Sammelrohr ist durchlässig für NaCl (~3% des filtrierten Natriums wird
aus dem medullären Sammelrohrsystem resorbiert) und bei Vasopressinwirkung für Wasser und Harnstoff.
Blutgefäße im Nierenmark:
Während vasa recta, die nahe der Nierenoberfläche liegen, im
Rindenbereich verbleiben (~90% der renalen Durchblutung), ziehen vasa
recta juxtamedullärer Tubuli - deren Glomeruli in der Nähe des
Nierenmarks liegen - parallel zum Tubulus Richtung Nierenbecken und
tauchen in die
Markzone ein ( Abbildung oben); nur etwa 2% der Perfusion erreichen
die tiefsten Markgebiete (die auch die höchste Osmolarität aufweisen).
Abbildung oben); nur etwa 2% der Perfusion erreichen
die tiefsten Markgebiete (die auch die höchste Osmolarität aufweisen).
Dieser relativ niedrige Perfusionswert hilft, ein "osmotisches
Auswaschen" des Nierenmarks zu minimieren, beträgt aber immer noch ~30
ml/min (oder 40-50 l/d) - ohne einen zusätzlichen "Verdünnungsschutz"
könnte die hohe osmotische Konzentration des inneren Marks (1200 mosmol/l
und mehr) nicht aufrechterhalten werden. Wie wird dieses Problem gelöst?
Auch in den Blutgefäßen des Nierenmarks wirkt ein Gegenstrom-Austauschmechanismus:
Die Endothelien sind frei für Wasser und Natrium permeabel, und der
Gefäßinhalt stellt sich automatisch auf die im Interstitium
herrschenden Konzentrationswerte ein. Das abwärts strömende Blut wird
osmotisch eingedickt (Wasser wandert durch die Gefäßwand in das
Interstitium), während das rindenwärts zurückfließende Blut umgekehrt wieder
die "normale" Osmolarität zurückerhält (Wasser wandert in das Blut
zurück). So bleibt ein osmotischer Auswascheffekt aus, der die
Konzentrationsfähigkeit der Niere beeinträchtigen würde.
Filtratvolumen und Osmolarität entlang eines Nephrons

Nach Silverthorn, Human Physiology - an integrated approach, 4th ed. Pearson International 2007 |
Lage im Nephron
|
Volumen
|
Osmolarität
|
Bowman-Kapsel
|
180 l/d
|
300 mosmol/l
|
Ende des proximalen Tubulus
|
54 l/d
|
300 mosmol/l |
Ende der Henle-Schleife
|
18 l/d
|
100 mosmol/l |
Ende des Sammelrohrs
|
1,5 l/d
|
50-1200 mosmol/l |
Die Rolle des Harnstoffs
Die
Tubulusflüssigkeit unterliegt einem "osmotischen Slalom": Im proximalen
Tubulus isoton, wird sie in der Henle-Schleife zuerst konzentriert
(Wasserverlust), anschließend verdünnt (Entfernung von Kochsalz) und im
weiteren distalen Nephronverlauf weiter verdünnt, wieder isoton, oder
weiter konzentriert ( Abbildung). Harnstoff spielt dabei eine wichtige unterstützende Rolle
Abbildung). Harnstoff spielt dabei eine wichtige unterstützende Rolle.

 Abbildung: Relative Osmolalität (Plasma: ~290 mosmol/l) der Tubulusflüssigkeit entlang eines Nephrons
Abbildung: Relative Osmolalität (Plasma: ~290 mosmol/l) der Tubulusflüssigkeit entlang eines Nephrons
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Auf der
y-Achse ist die relative Osmolalität (Tubulusflüssigkeit / Blutplasma)
entlang eines Nephrons angegeben - für zwei Beispiele: Antidiurese und
Wasserdiurese. In beiden Fällen wird die Tubulusflüssigkeit am Ende der
Henle-Schleife (diluting segment, Beginn des distalen Tubulus) - nach unterschiedlich starker Konzentrierung entlang der Schleife - hypoton.
Im ersten Beispiel (Antidiurese - rote Kurve) wird die
Tubulusflüssigkeit anschließend im distalen Tubulus wieder isoton,
bleibt es im kortikalen Sammelrohr und wird im medullären Sammelrohr -
durch Vasopressinwirkung - 3-fach hyperton (etwa wie Morgenharn: 800-900 mosmol/l).
Im zweiten
Beispiel (hohe Wasseraufnahme, positive Wasserclearance - blaue Kurve)
nimmt die Osmolalität entlang des peripheren Nephrons immer weiter ab;
der Harn ist schließlich stark hypoton.

Unter Bedingungen ungenügender Wasserzufuhr (
Hydropenie)
erhöht Vasopressin die Wasserdurchlässigkeit der Sammelrohre. Damit
kann viel Wasser aus dem medullären Sammelrohr rückresorbiert werden -
das Interstitium ist in dieser Situation stark hyperton (bis 1200
m
osmol/l). Daran beteiligt sich neben Kochsalz auch Harnstoff:
Harnstoff-Recycling:
Im inneren Mark liegt eine hohe Harnstoffkonzentration
vor (bis ~600 m
osmol/l), dies trägt etwa zur Hälfte zum osmotischen
Konzentrierungsmechanismus der Niere bei (Konzentration im unteren Markbereich ~1200 m
osmol/l).
Bedingt durch die hohe Konzentration im inneren
Mark, diffundiert Harnstoff zu ≥50% der glomerulär filtrierten Menge in den
dünnen Schenkel des aufsteigenden Teils der Henle-Schleife
(juxtamedullärer Nephrone).
Die folgende Abbildung verdeutlicht den Mechanismus der
Harnstoffrückgewinnung im Nierenmark, welche die vasa recta mit
einbezieht:

 Abbildung: Recycling des Harnstoffs im Nierenmark
Nach einer Vorlage in Danzinger / Zeidel / Parker:
Renal Physiology - A Clinical Approach. Wolters Kluwer / Lippincott
Williams & Wilkins 2012
Abbildung: Recycling des Harnstoffs im Nierenmark
Nach einer Vorlage in Danzinger / Zeidel / Parker:
Renal Physiology - A Clinical Approach. Wolters Kluwer / Lippincott
Williams & Wilkins 2012
1:
Durch den osmotisch bedingten Ausstrom von Wasser (via Aquaporine)
steigt die Konzentration von Harnstoff, der das obere Sammelrohr nicht
verlassen kann
2: Das untere Sammelrohr enthält Harnstofftransporter. Durch diese
diffundiert Harnstoff - seinem Konzentrationsgradienten folgend - in
das Interstitium und hilft dessen hohe Osmolarität (~1200 mosmol/l)
aufzubauen
3: Harnstoff diffundiert in die absteigenden Schenkel der vasa recta und strömt zum aufsteigenden Schenkel weiter
4: Der größte Teil dieser Menge rezirkuliert in absteigende vasa recta zurück (Rezirkulation)
5: Aus weiter
oben liegenden Teilen der vasa recta diffundiert Harnstoff in
absteigende Schenkel der Henle-Schleife (diese verfügen über
Harnstofftransporter). Von dort gelangt er via distalen Tubulus zum
Sammelrohrsystem zurück

Da
Harnstoff ein Produkt des Eiweißabbaus ist, nimmt das Angebot an die
Niere mit der Proteinaufnahme zu - eiweißreiche Kost erhöht damit auch
das Konzentriervermögen der Niere.
Die Permeabilitätsverteilung entlang der Tubuli ( s. dort)
- kombiniert mit dem Harnstoffrecycling - ergibt einen steilen Anstieg
der interstitiellen Harnstoffkonzentration in Richtung Papillenspitze,
bei etwa gleichbleibender Kochsalzkonzentration (
s. dort)
- kombiniert mit dem Harnstoffrecycling - ergibt einen steilen Anstieg
der interstitiellen Harnstoffkonzentration in Richtung Papillenspitze,
bei etwa gleichbleibender Kochsalzkonzentration ( Abbildung);
demgemäß hängt die Beteiligung des Harnstoffs an der interstitiellen
Osmolalität von der Position im Nierenmark ab, sie steigt mit der Nähe
zu Papillenspitze bzw. Nierenbecken.
Abbildung);
demgemäß hängt die Beteiligung des Harnstoffs an der interstitiellen
Osmolalität von der Position im Nierenmark ab, sie steigt mit der Nähe
zu Papillenspitze bzw. Nierenbecken.
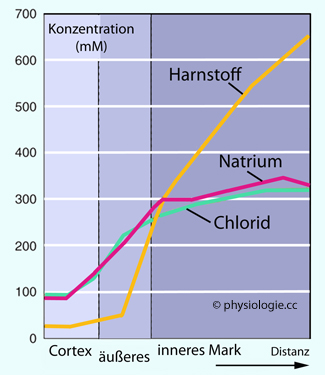
 Abbildung: Konzentrationsprofile von Kochsalz und Harnstoff
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Abbildung: Konzentrationsprofile von Kochsalz und Harnstoff
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Die Konzentrationswerte sind im äußeren Kortex (links) am niedrigsten (zum Vergleich: Im Blutplasma Na+ ~140 mM, Cl- ~100 mM, urea ~5 mM) und nehmen im Nierenmark (rechts) zu.
Die Kochsalzkonzentration steigt in diesem Beispiel (Hydropenie, also
Antidiurese) etwa auf das Dreifache und ändert sich mit weiterer
Entfernung von der Rinde (Abszisse: Distanz) nur geringfügig, während
die Harnstoffkonzentration papillenwärts immer mehr ansteigt (hier bis
über 600 mM)

Im dickwandigen
Teil des aufsteigenden Schenkels der Henle-Schleife ist die
Harnstoffkonzentration um ein Mehrfaches höher als im Plasma (Harnstoff
ist im Tubulus verblieben, während Wasser resorbiert wurde), und dies
gilt auch für die inneren Marksegmente der Sammelrohre. Hier erhöht
Aquaporin nicht nur die Durchlässigkeit für Wasser, sondern auch für
Harnstoff. Dazu kommen Harnstofftransporter (apikal UT-1, basolateral
UT-3).
So reichert sich der Harnstoff im Interstitium des inneren Nierenmarks
an und trägt in den innersten (papillennahen) Zonen etwa zur Hälfte zur
hier herrschenden Osmolalität bei. Dazu kommt noch ein apikaler
Cotransport mit Natrium.
Der Harnstoffgradient innerhalb des Nierenmarks erklärt auch, dass die
interstitielle Konzentration höher ist als im Lumen der Henle-Schleife
juxtamedullärer Nephrone (die ja tief in die Markzone eintauchen). Der
Gradient erlaubt die Wanderung von Harnstoff in die Tubuli dieser
Nephrone - im absteigenden Schenkel via UT-A2, im dünnen aufsteigenden über einen noch unbekannten Mechanismus.

 Abbildung: Harnstoff-Recycling in der Niere unter Antidiuresebedingungen
Abbildung: Harnstoff-Recycling in der Niere unter Antidiuresebedingungen
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
In diesem Beispiel scheidet die Niere
~15% der filtrierten Harnstoffmenge aus, ~5% werden über die vasa recta entfernt (und gelangen zurück zu oberflächlichen Neuronen oder in den Kreislauf).
Die Hälfte der Harnstoffmenge, die glomerulär filtriert wird, gelangt
in diesem Beispiel zur Sekretion (rosa Box). Ergebnis ist eine hohe
Harnstoffkonzentration im Nierenmark bei geringer Rückgewinnung in den
Kreislauf

Die  Abbildung zeigt die Situation im Status einer Antidiurese, d.h. wenn der Harn auf hohe Osmolalität konzentriert wird (negative Wasserclearance).
Abbildung zeigt die Situation im Status einer Antidiurese, d.h. wenn der Harn auf hohe Osmolalität konzentriert wird (negative Wasserclearance).
Unter Bedingungen der Wasserdiurese
kehrt sich das Vorzeichen um, die Sammelrohre werden für Wasser
weitgehend undurchlässig (fehlender Vasopressineffekt), Wasser wird
kaum resorbiert und gelangt - bei niedriger Osmolalität - in den Harn
(positive Wasserclearance). Auch wird bei Wasserdiurese vermehrt Harnstoff ausgeschieden, die interstitielle Harnstoffkonzentration ist niedriger als bei Antidiurese.
 Bei den medullären Teilen der Sammelrohre wirken also folgende Eigenschaften zusammen:
Bei den medullären Teilen der Sammelrohre wirken also folgende Eigenschaften zusammen:
 Ohne Vasopressinwirkung sind sie ziemlich undurchlässig für Wasser, Kochsalz und Harnstoff
Ohne Vasopressinwirkung sind sie ziemlich undurchlässig für Wasser, Kochsalz und Harnstoff
 Vasopressin steigert die Permeabilität für Wasser entlang der gesamten Strecke
Vasopressin steigert die Permeabilität für Wasser entlang der gesamten Strecke
 Vasopressin
steigert auch die Permeabilität für Harnstoff, aber nur im inneren
Mark, also im terminalen Abschnitt der Sammelrohre, bevor diese in
einen Nierenkelch bzw. das Nierenbecken münden.
Vasopressin
steigert auch die Permeabilität für Harnstoff, aber nur im inneren
Mark, also im terminalen Abschnitt der Sammelrohre, bevor diese in
einen Nierenkelch bzw. das Nierenbecken münden.
Die hohe interstitielle Kochsalzkonzentration begünstigt die Resorption
von Wasser aus dem Sammelrohr; beim Harnstoff ist es genau umgekehrt:
Eine hohe Konzentration im Lumen begünstigt (ebenfalls aus osmotischen
Gründen) die Bewegung von Wasser in das
(nicht aus dem) Sammelrohr. Der hohe Kochsalzgradient hat aber in einer
Situation, in der Wasser gespart werden muss, den stärkeren Effekt, und
Wasser wird Richtung Blut resorbiert (<Abbildung).

 Abbildung: Osmotische Wirkungen von Kochsalz und Harnstoff während Antidiurese
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Abbildung: Osmotische Wirkungen von Kochsalz und Harnstoff während Antidiurese
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Im Falle von Wasserdiurese wandert das Wasser durch das
Sammelrohr und wird in hypotonem Harn ausgeschieden (positive
Wasserclearance)

Kochsalz wirkt voll osmotisch
(Reflexionskoeffizient 1,0), der Reflexionskoeffizient für Harnmstoff
ist geringer (0,74), was die Tendenz zur harnstoffbedingten Aufnahme
von Wasser in das Sammelrohr (und damit Wasserverlust mit dem Harn)
verringert (

Abbildung). Außerdem erhöht Vasopressin (hoher
Blutspiegel bei Antidiurese) die Harnstoffpermeabilität der
Sammelrohre, dadurch wird der osmotische Hemmeffekt des Harnstoffs auf
die Rückgewinnung von Wasser weiter reduziert.
 Harnstoff
Harnstoff (Plasma / Serum
)3-8 mM (20-50 mg/dl)
Kinder: Von 2-4 mM in den ersten Lebensjahren ansteigend bis zum 10. LJ (Erwachsenenwerte)
Frauen über 50 a: 3,5-7,2 mM
Männer über 50 a: 3,0-9,2 mM
Biologische Halbwertszeit im Blutkreislauf 2-3 Minuten
 Ausscheidung mit dem Harn: 18-33 g/24 h
Ausscheidung mit dem Harn: 18-33 g/24 h
 zur Harnstoffausscheidung s. auch dort
zur Harnstoffausscheidung s. auch dort
 zur Ausscheidung saurer Valenzen und Ammonium s. dort
zur Ausscheidung saurer Valenzen und Ammonium s. dort
Insgesamt: Während
Kochsalz zum Großteil aus dem Interstitium zurückgewonnen werden muss
(dicker aufsteigender Schenkel der Henle-Schleife), ist Harnstoff ein
Ausscheidungsprodukt, das im Nierenmark als osmotischer
Verstärkungsfaktor genutzt wird und zwischen Tubulussystem und
Intertstitium zirkuliert.
Woher bezieht dieser "Harnstoff-Motor" seine Energie? Er wird letztlich
durch die Kochsalz-Pumpe des dicken Teils des aufsteigenden
Henle-Schleifen-Schenkels angetrieben - dieser führt zu osmotischen
Effekten (abhängig von Vasopressin,
das die Rückresorption von Wasser steuert), von denen die
Harnstoffanreicherung abhängt (Resorption von Wasser aus Tubulus /
Sammelrohr erhöht hier die Konzentration gelöster Stoffe).
Im
medullären Sammelrohr erhöht Vasopressin auch die Permeabilität für Harnstoff,
sodass dieser ins Mark übertreten kann. Letztlich erfolgt das 'Pooling'
von Harnstoff im Nierenmark mit vergleichsweise geringer
Stoffwechselenergie.
Das Nierenmark ist gering durchblutet (90% der renalen Perfusion gehen
an die Rinde); nur 1-2% erreichen papillennahe Gebiete des Marks (hoher
Widerstand der langen vasa recta).
Atemgase und Energiestoffwechsel: Auch der Sauerstoff- und CO2-Partialdruck
im Nierengewebe zeigt starke regionale Unterschiede, was durch
Gegenstromaustausch der Atemgase erklärbar ist. In der (stark durchbluteten) Rinde findet
sich ein beinahe arterieller pO2-Wert (um 80 mmHg), im (gering durchbluteten) Mark nimmt er bis auf ~10 mmHg pO2 ab (Papillenregion). Umgekehrt verhält es sich mit dem pCO2,
der in tiefen Markzonen besonders hoch ist. Dementsprechend läuft der
Energiestoffwechsel in der Rinde aerob, im Mark weitgehend anaerob ab (das Nierenmark ist für seinen Energiestoffwechsel - wie Gehirn, Eryrthrozyten und Fibroblasten - auf Glucose angewiesen).
Dadurch, und durch die U-förmige
Anordnung der Kapillaren (Gegenstromaustausch wie im Tubulussystem),
wird der "Auswascheffekt"
der Perfusion des hypertonen Nierenmarks gering gehalten. Andererseits
transportieren die vasa recta Harnstoff und Salze in der notwendigen
Menge ab (Vermeidung eines Überschreitens des Löslichkeitsprodukts).
 Die maximale Harnstoffkonzentration im Harn entspricht ~600 mosmol/l. Bei
Antidiurese kann eine Harn-Osmolarität von 1200 mosmol/l (oder etwas
mehr) erreicht werden. Das bedeutet, dass alle anderen im Harn gelösten
Stoffe (vor allem Salze) einen Anteil von nicht viel mehr als ~600
mosmol/l bestreiten können, dann ist das Konzentrationsvermögen der Niere
ausgeschöpft. (Meerwasser hat eine Salzkonzentration von ~1200 mosmol/l,
nimmt man es zu sich, kommt es unweigerlich zu Salzanreicherung und
hypertoner Dehydrierung).
Die maximale Harnstoffkonzentration im Harn entspricht ~600 mosmol/l. Bei
Antidiurese kann eine Harn-Osmolarität von 1200 mosmol/l (oder etwas
mehr) erreicht werden. Das bedeutet, dass alle anderen im Harn gelösten
Stoffe (vor allem Salze) einen Anteil von nicht viel mehr als ~600
mosmol/l bestreiten können, dann ist das Konzentrationsvermögen der Niere
ausgeschöpft. (Meerwasser hat eine Salzkonzentration von ~1200 mosmol/l,
nimmt man es zu sich, kommt es unweigerlich zu Salzanreicherung und
hypertoner Dehydrierung).
 Man
könnte z.B. fragen, wieviel Harn für die Ausscheidung von 600 mosmol im
Harn gelöster (osmotisch wirksamer) Bestandteile mindestens notwendig
ist. Da die maximale Konzentrierfähigkeit der gesunden menschlichen
Niere einen Harn mit 1200 mosmol/l produzieren kann, wären das 600 / 1200
(0,5) Liter.
Man
könnte z.B. fragen, wieviel Harn für die Ausscheidung von 600 mosmol im
Harn gelöster (osmotisch wirksamer) Bestandteile mindestens notwendig
ist. Da die maximale Konzentrierfähigkeit der gesunden menschlichen
Niere einen Harn mit 1200 mosmol/l produzieren kann, wären das 600 / 1200
(0,5) Liter.
Erhöhter Blutdruck fördert die Harnausscheidung (Druckdiurese)
Druckdiurese / Drucknatriurese bedeutet
eine erhöhte Ausscheidung von Salz und Wasser als Folge erhöhten Drucks
in der Nierenarterie. Die glomeruläre Filtration ist sehr gut
autoreguliert und daher weitgehend unabhängig von Druckänderungen. Auch
die Durchblutung des Nierenmarks unterliegt einer Autoregulation,
allerdings einer weniger präzisen:
Vermutlich nimmt der Druck in den Kapillaren des Nierenmarks mit
arterieller Drucksteigerung zu, Flüssigkeit wird filtriert, der
interstitielle Druck nimmt zu, die Rückresorption wird erschwert, und
es wird mehr Salz und Wasser ausgeschieden.
Blutdruckanstieg reduziert außerdem die osmotischen Gradienten ("Auswaschen" des Marks), der osmotische Rückresorptionsmechanismus ist dadurch geschwächt, es
wird weniger Wasser zurückgewonnen, die Diurese nimmt zu.
Zusätzlich
zu diesen physikalischen Mechanismen kommen hormonelle Regelungen:
Kreislaufreflexe steuern die Sekretion nierenwirksamer Hormonsysteme,
und diese fördern ebenfalls die Ausscheidung von Kochsalz, wenn die
Systemdruckwerte ansteigen (weniger Angiotensin und Aldosteron, evt.
vermehrt natriuretische Peptide).

 Schleifendiuretika (loop diuretics) - Furosemid, Bumetanid, Torasemid - fördern die Wasserausscheidung, indem sie die Wirkung des Na+/K+/2Cl-- Cotransportsystems hemmen. Sie können die Natriumausscheidung bis auf
25% der
filtrierten Kochsalzmenge steigern (d.h. um etwa eine
Zehnerpotenz). Gleichzeitig verringern sie die Aufladung des
Tubuluslumens (ROMK, s.
oben) und damit auch die Resorption von Kationen (Calcium, Magnesium -
Schleifendiuretika können gegen Hypercalcämie angewendet werden).
Schleifendiuretika (loop diuretics) - Furosemid, Bumetanid, Torasemid - fördern die Wasserausscheidung, indem sie die Wirkung des Na+/K+/2Cl-- Cotransportsystems hemmen. Sie können die Natriumausscheidung bis auf
25% der
filtrierten Kochsalzmenge steigern (d.h. um etwa eine
Zehnerpotenz). Gleichzeitig verringern sie die Aufladung des
Tubuluslumens (ROMK, s.
oben) und damit auch die Resorption von Kationen (Calcium, Magnesium -
Schleifendiuretika können gegen Hypercalcämie angewendet werden).
Der Verlust von Kalium, der bei der Anwendung von Schleifendiuretika unvermeidlich ist, kann durch Nutzung kaliumsparender Diuretika (wie Amilorid) vermieden werden. Diese erniedrigen die Öffnungswahrscheinlichkeit der ENaC-Natriumpermeasen an der luminalen
Membran spätdistaler Tubulusepithelzellen - es tritt weniger Natrium in
die Zelle ein (geringerer elektrogener Natrium-Influx, das
Membranpotential der apikalen Membran nimmt zu), und es wird mehr
Natrium ausgeschieden. Gleichzeitig nimmt die positive Ladung der
peritubulären (interstitiellen) Seite des Tubulus ab, und es wandert
weniger Kalium aus der Zelle in das Interstitium (kaliumsparender
Effekt).
ENaC-Natriumkanäle in spätdistalen Tubuli werden durch kaliumsparende Diuretika gehemmt
|
Das Bartter-Syndrom ist eine seltene genetische Erkrankung aufgrund eines Defekts im dicken
aufsteigenden Schenkel der Henle-Schleife. Diese Krankheit bedingt Verlust an Natrium-, Kalium- und Chloridionen und führt zu
Hypokaliämie, Alkalose und eventuell erniedrigtem Blutdruck.
ist eine seltene genetische Erkrankung aufgrund eines Defekts im dicken
aufsteigenden Schenkel der Henle-Schleife. Diese Krankheit bedingt Verlust an Natrium-, Kalium- und Chloridionen und führt zu
Hypokaliämie, Alkalose und eventuell erniedrigtem Blutdruck.
Je nach
den betroffenen Ionenkanälen treten entsprechende Typen der Erkrankung auf:
Typ 1:
Der Na/K/2Cl-Symporter ist betroffen.
Typ 2: Der mit NKCC2 gekoppelte Kaliumkanal (ROMK)
der apikalen Membran der Tubulusepithelzellen ist defekt, das
Kalium-"Recycling" in den Tubulus funktioniert nicht mehr,
Kalium geht verloren, und es ist auch die Natrium-Rückresorption
behindert.
Bartter-Syndrom Typ 2 beruht auf einem Defekt der apikalen K+-Kanäle im dicken aufsteigenden Schenkel der Henle-Schleife und führt zu verringerter Na+-Rückresorption
|
Typ 3: Chloridkanäle sind betroffen.
Typ 4: Der tubuläre Salzverlust ist kombiniert mit
Mutationen einer Untereinheit ("Barttin") von Chloridkanälen in der
basolateralen Membran marginaler Zellen der stria vascularis im Corti-Organ, was mangelnde Chlorid-Leitfähigkeit und Innenohrtaubheit zur Folge hat.
Gelingt die Wasserrückresorption wegen zu hoher Konzentration osmotisch
aktiver Stoffe im Sammelrohrsystem nicht ausreichend, geht ein Teil des
Wassers verloren (
osmotische Diurese). Beispiel: Glucose kann bei starker Hyperglykämie (unbehandelter diabetes mellitus) nicht vollständig rückresorbiert werden (
tubuläres Transportmaximum überschritten) und "nimmt Wasser in den Harn mit".


 Die Nieren des
Menschen können die Osmolalität des Harns 4-5fach senken
(Wasserausscheidung) oder steigern (Konzentrierung). ~12% der Nephrone
liegen juxtamedullär, ihre Henle-Schleifen bauen über einen Gegenstrom-
Austauschmechanismus Zonen hoher Osmolarität im Nierenmark auf, dessen
tiefe Regionen (~1-2% der renalen Durchblutung) anaerob (pO2 ~10 mmHg) und energiesparend hohe Osmolalität aufbauen. Der absteigende Teil der Henle-Schleife ist parazellulär für Wasser durchgängig (Fehlen von tight junctions),
Wasser tritt aus, die Tubulusflüssigkeit wird hyperton. Der dünnwandige
aufsteigende Teil der Henle-Schleife ist für Harnstoff (dieser
diffundiert in den Tubulus), nicht für Wasser durchgängig (tight
junctions, keine Aquaporine) Die Nieren des
Menschen können die Osmolalität des Harns 4-5fach senken
(Wasserausscheidung) oder steigern (Konzentrierung). ~12% der Nephrone
liegen juxtamedullär, ihre Henle-Schleifen bauen über einen Gegenstrom-
Austauschmechanismus Zonen hoher Osmolarität im Nierenmark auf, dessen
tiefe Regionen (~1-2% der renalen Durchblutung) anaerob (pO2 ~10 mmHg) und energiesparend hohe Osmolalität aufbauen. Der absteigende Teil der Henle-Schleife ist parazellulär für Wasser durchgängig (Fehlen von tight junctions),
Wasser tritt aus, die Tubulusflüssigkeit wird hyperton. Der dünnwandige
aufsteigende Teil der Henle-Schleife ist für Harnstoff (dieser
diffundiert in den Tubulus), nicht für Wasser durchgängig (tight
junctions, keine Aquaporine)
 Der dickwandige aufsteigende Teil der Schleife ist für Wasser und Harnstoff unpassierbar, resorbiert aber 20-30% der filtrierten Kochsalzmenge (apikaler elektroneutraler Na/K/2Cl-Cotransporter; Schleifendiuretika hemmen diesen und senken Rückresorption, interstitielle Osmolalität und Konzentrierungsleistung). Kalium gelangt über ROMK in das Tubuluslumen zurück, das es dabei positiv auflädt. Das glomeruläre Filtrat enthält nur wenig Kalium, daher ist das Kalium-Recycling
für die Aufrechterhaltung des Na/K/2Cl-Cotransports notwendig. Das lumen-positive Potential treibt die Ca++- und Mg++-Resorption in das Blut an. Ein Calciumsensor in der basolateralen Membran hemmt bei Erhöhung des extrazellulären [Ca++] den Na/K/2Cl-Cotransporter und damit die Ca++- und Mg++-Aufnahme (und erhöht deren Ausscheidung). Der Na+-Gradient (basolaterale Na/K-ATPase) ermöglicht die Resorption von K+ und Cl- (Chlorid im Austausch gegen Bicarbonat) Der dickwandige aufsteigende Teil der Schleife ist für Wasser und Harnstoff unpassierbar, resorbiert aber 20-30% der filtrierten Kochsalzmenge (apikaler elektroneutraler Na/K/2Cl-Cotransporter; Schleifendiuretika hemmen diesen und senken Rückresorption, interstitielle Osmolalität und Konzentrierungsleistung). Kalium gelangt über ROMK in das Tubuluslumen zurück, das es dabei positiv auflädt. Das glomeruläre Filtrat enthält nur wenig Kalium, daher ist das Kalium-Recycling
für die Aufrechterhaltung des Na/K/2Cl-Cotransports notwendig. Das lumen-positive Potential treibt die Ca++- und Mg++-Resorption in das Blut an. Ein Calciumsensor in der basolateralen Membran hemmt bei Erhöhung des extrazellulären [Ca++] den Na/K/2Cl-Cotransporter und damit die Ca++- und Mg++-Aufnahme (und erhöht deren Ausscheidung). Der Na+-Gradient (basolaterale Na/K-ATPase) ermöglicht die Resorption von K+ und Cl- (Chlorid im Austausch gegen Bicarbonat)
 Kochsalz- und Harnstoffkonzentration sowie Osmolarität nehmen mit der Tiefe des Nierenmarks zu. Durch die
Strömung der Tubulusflüssigkeit baut sich ein vertikaler
Osmolaritätsgradient auf, der Inhalt langer Henle-Schleifen wird
hyperton (bis maximal ~1500 mosmol/l). Aus der Rinde (≤ 290 mosmol/l) kommend, strömt Harn durch diese hypertone Zone und kann bei starker Vasopressinwirkung 4-5fach hyperton werden (1200-1500 mosmol/l). Auch in den
Blutgefäßen des Nierenmarks wirkt ein Gegenstrom-Austauschmechanismus:
Endothelien sind für Wasser und Natrium permeabel, ein osmotischer
Auswascheffekt durch die Perfusion (der die Konzentrationsfähigkeit der Niere
beeinträchtigen würde) bleibt aus. Der dicke
aufsteigende Teil der Henle'schen Schleife und der frühdistale Tubulus
werden zusammen als Verdünnungssegment bezeichnet: Sie entfernen Kochsalz und sind wasserundurchlässig, die
Osmolalität ihres Inhalts sinkt auf 50-100 mosmol/l Kochsalz- und Harnstoffkonzentration sowie Osmolarität nehmen mit der Tiefe des Nierenmarks zu. Durch die
Strömung der Tubulusflüssigkeit baut sich ein vertikaler
Osmolaritätsgradient auf, der Inhalt langer Henle-Schleifen wird
hyperton (bis maximal ~1500 mosmol/l). Aus der Rinde (≤ 290 mosmol/l) kommend, strömt Harn durch diese hypertone Zone und kann bei starker Vasopressinwirkung 4-5fach hyperton werden (1200-1500 mosmol/l). Auch in den
Blutgefäßen des Nierenmarks wirkt ein Gegenstrom-Austauschmechanismus:
Endothelien sind für Wasser und Natrium permeabel, ein osmotischer
Auswascheffekt durch die Perfusion (der die Konzentrationsfähigkeit der Niere
beeinträchtigen würde) bleibt aus. Der dicke
aufsteigende Teil der Henle'schen Schleife und der frühdistale Tubulus
werden zusammen als Verdünnungssegment bezeichnet: Sie entfernen Kochsalz und sind wasserundurchlässig, die
Osmolalität ihres Inhalts sinkt auf 50-100 mosmol/l
|

 Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.
Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.





 Nierenmark und Gegenstrommechanismus
Nierenmark und Gegenstrommechanismus
 Bartter-Syndrom: Frederic Bartter
Bartter-Syndrom: Frederic Bartter Osmotischer Gradient; Schleifendiuretika
Osmotischer Gradient; Schleifendiuretika  Osmotischer Multiplikator
Osmotischer Multiplikator  Harnstoffmechanismus
Harnstoffmechanismus  Energiemetabolismus
Energiemetabolismus  Druckdiurese
Druckdiurese
 Core messages
Core messages )
in Teilen ihres Gewebes und in Harn - verglichen zu anderen
Körperflüssigkeiten - bis auf ein Siebentel zu
senken (→ Wasserausscheidung) oder bis zum Vierfachen zu steigern (→ Ausscheidung
konzentrierten Harns). Die Fähigkeit zu diesem Grad an Verdünnung oder
Konzentrierung ermöglicht die rasche Anpassung an wechselnde
Salz-Wasser-Bilanzen (Trinken vs. Durst, unterschiedliche Salzzufuhr)
und basiert im Wesentlichen auf der Struktur des Nierenmarks, in dem
der Inhalt der Tubuli teils aktiv (Ionenpumpen), teils passiv
(osmotisch) aufbereitet wird.
)
in Teilen ihres Gewebes und in Harn - verglichen zu anderen
Körperflüssigkeiten - bis auf ein Siebentel zu
senken (→ Wasserausscheidung) oder bis zum Vierfachen zu steigern (→ Ausscheidung
konzentrierten Harns). Die Fähigkeit zu diesem Grad an Verdünnung oder
Konzentrierung ermöglicht die rasche Anpassung an wechselnde
Salz-Wasser-Bilanzen (Trinken vs. Durst, unterschiedliche Salzzufuhr)
und basiert im Wesentlichen auf der Struktur des Nierenmarks, in dem
der Inhalt der Tubuli teils aktiv (Ionenpumpen), teils passiv
(osmotisch) aufbereitet wird.
 Abbildung: Kortikales vs. juxtamedulläres Nephron
Abbildung: Kortikales vs. juxtamedulläres Nephron
 sind kurz (
sind kurz ( Abbildung).
Abbildung). , ihre Glomeruli liegen nahe dem Mark,
in das ihre vergleichsweise langen Tubuli tief eintauchen. Sie ziehen
durch die stark hypertonen
, ihre Glomeruli liegen nahe dem Mark,
in das ihre vergleichsweise langen Tubuli tief eintauchen. Sie ziehen
durch die stark hypertonen  Zonen
des tieferen Nierenmarks, was für
Wasserhaushalt und Osmoregulation bedeutsam ist: Die Henle-Schleifen
der juxtamedullären Nephrone ermöglichen einen Gegenstrom-
Austauschmechanismus (countercurrent exchange).
Dieser baut in
energiesparender Weise Zonen hoher Osmolarität im Nierenmark auf.
Zonen
des tieferen Nierenmarks, was für
Wasserhaushalt und Osmoregulation bedeutsam ist: Die Henle-Schleifen
der juxtamedullären Nephrone ermöglichen einen Gegenstrom-
Austauschmechanismus (countercurrent exchange).
Dieser baut in
energiesparender Weise Zonen hoher Osmolarität im Nierenmark auf.  Die tiefen Regionen des Marks - die Zonen um die Papillenspitzen
- empfangen nur ~1% der renalen Durchblutung (das hilft bei der
Erhaltung der hohen Osmolalität), haben dadurch allerdings einen sehr niedrigen
Sauerstoffpartialdruck (um 10 mmHg) und sind im Wesentlichen auf anaeroben Stoffwechsel eingestellt. Energieintensive Transportprozesse sind hier nicht mehr möglich, was auch in dem Umstand zum Ausdruck kommt, dass die
dünnwandigen Tubulusschleifen aus flachen (nicht zylinderförmigen)
Zellen aufgebaut sind.
Die tiefen Regionen des Marks - die Zonen um die Papillenspitzen
- empfangen nur ~1% der renalen Durchblutung (das hilft bei der
Erhaltung der hohen Osmolalität), haben dadurch allerdings einen sehr niedrigen
Sauerstoffpartialdruck (um 10 mmHg) und sind im Wesentlichen auf anaeroben Stoffwechsel eingestellt. Energieintensive Transportprozesse sind hier nicht mehr möglich, was auch in dem Umstand zum Ausdruck kommt, dass die
dünnwandigen Tubulusschleifen aus flachen (nicht zylinderförmigen)
Zellen aufgebaut sind. Der
"horizontale" Osmolaritätsunterschied, den die tubulären Salzpumpen
der dickwandigen Schleifenzellen überwinden müssen, ist gering, gleichzeitig werden aber
"stockwerkartig" vertikale Osmolaritätszonen im Nierenmark aufgebaut:
Der
"horizontale" Osmolaritätsunterschied, den die tubulären Salzpumpen
der dickwandigen Schleifenzellen überwinden müssen, ist gering, gleichzeitig werden aber
"stockwerkartig" vertikale Osmolaritätszonen im Nierenmark aufgebaut: Der absteigende
Teil der Henle-Schleife ist für Wasser durchgängig, nicht aber für Harnstoff; die Tubulusflüssigkeit wird durch die zunehmende
Osmolarität im Mark hyperton. Die Wasserdurchlässigkeit erklärt sich durch das Fehlen von tight junctions ("loose junctions"), so kann Wasser parazellulär in das Interstitium eindringen.
Der absteigende
Teil der Henle-Schleife ist für Wasser durchgängig, nicht aber für Harnstoff; die Tubulusflüssigkeit wird durch die zunehmende
Osmolarität im Mark hyperton. Die Wasserdurchlässigkeit erklärt sich durch das Fehlen von tight junctions ("loose junctions"), so kann Wasser parazellulär in das Interstitium eindringen. in der luminalen (apikalen) Membran einen Na+-H+-Austauscher
in der luminalen (apikalen) Membran einen Na+-H+-Austauscher  in der basolateralen Membran Na+-K+-ATPase, K+/Cl--Cotransporter und eine Chlorid-Permease ("Chloridkanal").
in der basolateralen Membran Na+-K+-ATPase, K+/Cl--Cotransporter und eine Chlorid-Permease ("Chloridkanal").  Der dünnwandige aufsteigende Teil der Henle-Schleife lässt Harnstoff passieren, nicht aber Wasser (Abbildungen). Diese Partien der Schleife liegen in Zonen niedrigen pO2
(s. oben). Die fehlende Durchlässigkeit für Wasser erklärt sich
einerseits durch die Abwesenheit von Aquaporinen in der Membran der
Epithelzellen, andererseits stark ausgebildete tight junctions - sowohl
der transzelluläre als auch der parazelluläre Weg ist für Wasser
versperrt.
Der dünnwandige aufsteigende Teil der Henle-Schleife lässt Harnstoff passieren, nicht aber Wasser (Abbildungen). Diese Partien der Schleife liegen in Zonen niedrigen pO2
(s. oben). Die fehlende Durchlässigkeit für Wasser erklärt sich
einerseits durch die Abwesenheit von Aquaporinen in der Membran der
Epithelzellen, andererseits stark ausgebildete tight junctions - sowohl
der transzelluläre als auch der parazelluläre Weg ist für Wasser
versperrt. Im dickwandigen aufsteigenden Teil der Schleife können weder
Wasser noch Harnstoff durchtreten, aber er transportiert aktiv Salze (bei immer noch relativ niedrigem pO2).
Im dickwandigen aufsteigenden Teil der Schleife können weder
Wasser noch Harnstoff durchtreten, aber er transportiert aktiv Salze (bei immer noch relativ niedrigem pO2).  s. auch dort
s. auch dort
 Abbildung: Resorption im dicken aufsteigenden Schenkel der Henle-Schleife
Abbildung: Resorption im dicken aufsteigenden Schenkel der Henle-Schleife 
 Über die apikale Membran
Über die apikale Membran werden 20-30% der filtrierten Kochsalzmenge elektroneutral mittels Na+/K+/2Cl--Cotransport in der luminalen Membran resorbiert (
werden 20-30% der filtrierten Kochsalzmenge elektroneutral mittels Na+/K+/2Cl--Cotransport in der luminalen Membran resorbiert ( Abbildung).
Dieser Carrier funktioniert über den in die Zelle gerichteten
Natrium-Konzentrationsgradienten (angetrieben durch die Na/K-ATPase in der basolateralen Membran); Kalium und Chlorid werden
sekundär-aktiv "mitgeschleppt". Vasopressin
Abbildung).
Dieser Carrier funktioniert über den in die Zelle gerichteten
Natrium-Konzentrationsgradienten (angetrieben durch die Na/K-ATPase in der basolateralen Membran); Kalium und Chlorid werden
sekundär-aktiv "mitgeschleppt". Vasopressin  regt
die Expression dieses Transporters an - dadurch wird der Aufbau des
osmotischen Gradienten gefördert, der für die Rückresorption von Wasser
essentiell ist (Vasopressin: "Wassersparhormon").
regt
die Expression dieses Transporters an - dadurch wird der Aufbau des
osmotischen Gradienten gefördert, der für die Rückresorption von Wasser
essentiell ist (Vasopressin: "Wassersparhormon").  Schleifendiuretika. Der Na+/K+/2Cl--Cotransport ist der Motor der renalen Konzentrierungsleistung und des osmotischen Gradienten im Nierenmark. Blockade dieses Systems - durch "Schleifendiuretika" wie Furosemid - verhindert die Wiederaufnahme von Natrium, Kalium und Chlorid und damit die Harnkonzentration im Mark - die Konzentrierungsfähigkeit der Niere sinkt. Dadurch werden diese Elektrolyte vermehrt ausgeschieden und das extrazelluläre Flüssigkeitsvolumen nimmt ab (was z.B. für das Ausschwemmen von Ödemen der gewünschte therapeutische Effekt sein kann).
Schleifendiuretika. Der Na+/K+/2Cl--Cotransport ist der Motor der renalen Konzentrierungsleistung und des osmotischen Gradienten im Nierenmark. Blockade dieses Systems - durch "Schleifendiuretika" wie Furosemid - verhindert die Wiederaufnahme von Natrium, Kalium und Chlorid und damit die Harnkonzentration im Mark - die Konzentrierungsfähigkeit der Niere sinkt. Dadurch werden diese Elektrolyte vermehrt ausgeschieden und das extrazelluläre Flüssigkeitsvolumen nimmt ab (was z.B. für das Ausschwemmen von Ödemen der gewünschte therapeutische Effekt sein kann). Abbildung oben), deshalb können Schleifendiuretika zur Behalndlung von Hypercalcämie eingesetzt werden.
Abbildung oben), deshalb können Schleifendiuretika zur Behalndlung von Hypercalcämie eingesetzt werden. Abbildung) - deren fraktionelle Ausscheidung steigt an.
Abbildung) - deren fraktionelle Ausscheidung steigt an. In die Zelle gelangtes Kalium wird über eine (funktionell gekoppelte) K-Permease (ROMK: Renal Outer Medullary Potassium (K) channel)
in den Tubulus zurückbefördert und steht für weiteren Cotransport zur
Verfügung ("Kalium-Recycling"). Durch diesen Mechanismus wird das Lumen im aufsteigenden Schenkel positiv geladen
(5-10 mV gegen das Interstitium). Da sich nur wenig Kalium im
glomerulären Filtrat befindet, ist das Kalium-Recycling für die
Aufrechterhaltung des Na/K/2Cl-Cotransports notwendig.
In die Zelle gelangtes Kalium wird über eine (funktionell gekoppelte) K-Permease (ROMK: Renal Outer Medullary Potassium (K) channel)
in den Tubulus zurückbefördert und steht für weiteren Cotransport zur
Verfügung ("Kalium-Recycling"). Durch diesen Mechanismus wird das Lumen im aufsteigenden Schenkel positiv geladen
(5-10 mV gegen das Interstitium). Da sich nur wenig Kalium im
glomerulären Filtrat befindet, ist das Kalium-Recycling für die
Aufrechterhaltung des Na/K/2Cl-Cotransports notwendig.  Außerdem können Protonen mittels Na+/H+-Austauscher (NHE3, E für exchanger) gegen Natriumionen ausgewechselt werden.
Außerdem können Protonen mittels Na+/H+-Austauscher (NHE3, E für exchanger) gegen Natriumionen ausgewechselt werden.
 ÜberÜber die basolaterale Membran
ÜberÜber die basolaterale Membran  wird (mittels Na/K-ATPase) Natrium in Richtung Blut und Kalium in die Zelle gebracht, sowie
wird (mittels Na/K-ATPase) Natrium in Richtung Blut und Kalium in die Zelle gebracht, sowie 
 Cl- über eine Chlorid-Permease Richtung Blut transportiert.
Cl- über eine Chlorid-Permease Richtung Blut transportiert. 
 Zusätzlich stehen eine Kaliumpermease (K+-Ausstrom aus der Zelle) sowie ein Cl-/HCO3--Austauscher zur Verfügung (Bicarbonat in das Interstitium, Chlorid in die Zelle).
Zusätzlich stehen eine Kaliumpermease (K+-Ausstrom aus der Zelle) sowie ein Cl-/HCO3--Austauscher zur Verfügung (Bicarbonat in das Interstitium, Chlorid in die Zelle). 

 Parazellulär: Das Lumen ist positiv aufgeladen (+3 bis maximal +15 mV). Das unterstützt die parazelluläre Auswärtsbewegung von Natrium- (~25%, konzentrationsabhängig), Calcium- (25% des insgesamt resorbierten Ca++) und Magnesiumionen (~70% des insgesamt resorbierten Mg++ -
Parazellulär: Das Lumen ist positiv aufgeladen (+3 bis maximal +15 mV). Das unterstützt die parazelluläre Auswärtsbewegung von Natrium- (~25%, konzentrationsabhängig), Calcium- (25% des insgesamt resorbierten Ca++) und Magnesiumionen (~70% des insgesamt resorbierten Mg++ -  Abbildung oben,
Abbildung oben,  vgl. dort). Dabei wird die Durchlässigkeit der Schlussleisten (tight junctions) für Magnesium durch Paracellin-1 (ein Claudin) gewährleistet (Mutationen dieses Proteins führen zu Hypomagnesiämie, weil weniger Magnesium aus dem Tubulus rückresorbiert wird).
vgl. dort). Dabei wird die Durchlässigkeit der Schlussleisten (tight junctions) für Magnesium durch Paracellin-1 (ein Claudin) gewährleistet (Mutationen dieses Proteins führen zu Hypomagnesiämie, weil weniger Magnesium aus dem Tubulus rückresorbiert wird). 
 Die Henle-Schleifen der juxtamedullären (tief ins Mark eintauchenden) Nephrone bilden ein spezielles Protein (Uromodulin, Tamm-Horsfall-Protein
Die Henle-Schleifen der juxtamedullären (tief ins Mark eintauchenden) Nephrone bilden ein spezielles Protein (Uromodulin, Tamm-Horsfall-Protein  ),
das für diese Nephrone spezifisch und im Harn nachweisbar ist (mit ~50
mg/d das am stärksten renal ausgeschiedene Eiweiß). Vermutlich hat es
eine protektive Wirkung gegenüber Ca++-Harnsteinbildung (zusammen mit den Kristallisationsinhibitoren Uropontin und Nephrocalcin) und
bakteriellen Infektionsvorgängen.
),
das für diese Nephrone spezifisch und im Harn nachweisbar ist (mit ~50
mg/d das am stärksten renal ausgeschiedene Eiweiß). Vermutlich hat es
eine protektive Wirkung gegenüber Ca++-Harnsteinbildung (zusammen mit den Kristallisationsinhibitoren Uropontin und Nephrocalcin) und
bakteriellen Infektionsvorgängen.
 Abbildung: Gegenstrom- Multiplikationsprinzip
Abbildung: Gegenstrom- Multiplikationsprinzip Der absteigende Schenkel der Henle-Schleife ist für Wasser durchlässig,
Der absteigende Schenkel der Henle-Schleife ist für Wasser durchlässig, die
Schleife selbst sowohl für Wasser als auch für Harnstoff,
die
Schleife selbst sowohl für Wasser als auch für Harnstoff, der dickwandige
aufsteigende Schenkel weder für Wasser noch für Harnstoff (hier erfolgt
die Verdünnung des Tubulusinhalts auf ~120 mM).
der dickwandige
aufsteigende Schenkel weder für Wasser noch für Harnstoff (hier erfolgt
die Verdünnung des Tubulusinhalts auf ~120 mM). NKCC2, Na/K/Cl-Cotransporter
NKCC2, Na/K/Cl-Cotransporter  UT, Harnstofftransporter
UT, Harnstofftransporter
 Die
Kochsalzkonzentration sinkt schließlich unter
diejenige im Blutplasma (bis auf ~50-100 mosmol/l) - die
tubuläre Flüssigkeit, die in den distalen Tubulus der Rinde gelangt,
ist
also hypoton.
Die
Kochsalzkonzentration sinkt schließlich unter
diejenige im Blutplasma (bis auf ~50-100 mosmol/l) - die
tubuläre Flüssigkeit, die in den distalen Tubulus der Rinde gelangt,
ist
also hypoton. Durch
die Strömung der Tubulusflüssigkeit ergibt sich im Mark ein vertikaler
Osmolaritätsgradient, der Inhalt langer Henle-Schleifen
kann so 5-fach hyperton werden (d.h. bis zu maximal ~1500 mosmol/l).
Durch
die Strömung der Tubulusflüssigkeit ergibt sich im Mark ein vertikaler
Osmolaritätsgradient, der Inhalt langer Henle-Schleifen
kann so 5-fach hyperton werden (d.h. bis zu maximal ~1500 mosmol/l).
 Kochsalz- und Harnstoffkonzentration und damit Osmolarität nehmen
mit dem Abstand zur Rinden-Mark-Grenze zu. (Wüstentiere mit besonders
"schlanken" Markpyramiden können im Mark Hypertonie bis zu 5000
mosmol/l - etwa das 17-fache der Osmolarität des Blutes - und einen entsprechend konzentrierten Harn aufbauen, und
dadurch extrem wassersparend bilanzieren.)
Kochsalz- und Harnstoffkonzentration und damit Osmolarität nehmen
mit dem Abstand zur Rinden-Mark-Grenze zu. (Wüstentiere mit besonders
"schlanken" Markpyramiden können im Mark Hypertonie bis zu 5000
mosmol/l - etwa das 17-fache der Osmolarität des Blutes - und einen entsprechend konzentrierten Harn aufbauen, und
dadurch extrem wassersparend bilanzieren.)  Abbildung oben); nur etwa 2% der Perfusion erreichen
die tiefsten Markgebiete (die auch die höchste Osmolarität aufweisen).
Abbildung oben); nur etwa 2% der Perfusion erreichen
die tiefsten Markgebiete (die auch die höchste Osmolarität aufweisen). 
 Abbildung). Harnstoff spielt dabei eine wichtige unterstützende Rolle.
Abbildung). Harnstoff spielt dabei eine wichtige unterstützende Rolle.
 Abbildung: Relative Osmolalität (Plasma: ~290 mosmol/l) der Tubulusflüssigkeit entlang eines Nephrons
Abbildung: Relative Osmolalität (Plasma: ~290 mosmol/l) der Tubulusflüssigkeit entlang eines Nephrons

 Abbildung: Recycling des Harnstoffs im Nierenmark
Abbildung: Recycling des Harnstoffs im Nierenmark
 s. dort)
- kombiniert mit dem Harnstoffrecycling - ergibt einen steilen Anstieg
der interstitiellen Harnstoffkonzentration in Richtung Papillenspitze,
bei etwa gleichbleibender Kochsalzkonzentration (
s. dort)
- kombiniert mit dem Harnstoffrecycling - ergibt einen steilen Anstieg
der interstitiellen Harnstoffkonzentration in Richtung Papillenspitze,
bei etwa gleichbleibender Kochsalzkonzentration ( Abbildung);
demgemäß hängt die Beteiligung des Harnstoffs an der interstitiellen
Osmolalität von der Position im Nierenmark ab, sie steigt mit der Nähe
zu Papillenspitze bzw. Nierenbecken.
Abbildung);
demgemäß hängt die Beteiligung des Harnstoffs an der interstitiellen
Osmolalität von der Position im Nierenmark ab, sie steigt mit der Nähe
zu Papillenspitze bzw. Nierenbecken.
 Abbildung: Konzentrationsprofile von Kochsalz und Harnstoff
Abbildung: Konzentrationsprofile von Kochsalz und Harnstoff 

 Abbildung: Harnstoff-Recycling in der Niere unter Antidiuresebedingungen
Abbildung: Harnstoff-Recycling in der Niere unter Antidiuresebedingungen
 Abbildung zeigt die Situation im Status einer Antidiurese, d.h. wenn der Harn auf hohe Osmolalität konzentriert wird (negative Wasserclearance).
Abbildung zeigt die Situation im Status einer Antidiurese, d.h. wenn der Harn auf hohe Osmolalität konzentriert wird (negative Wasserclearance).  Bei den medullären Teilen der Sammelrohre wirken also folgende Eigenschaften zusammen:
Bei den medullären Teilen der Sammelrohre wirken also folgende Eigenschaften zusammen: Ohne Vasopressinwirkung sind sie ziemlich undurchlässig für Wasser, Kochsalz und Harnstoff
Ohne Vasopressinwirkung sind sie ziemlich undurchlässig für Wasser, Kochsalz und Harnstoff Vasopressin steigert die Permeabilität für Wasser entlang der gesamten Strecke
Vasopressin steigert die Permeabilität für Wasser entlang der gesamten Strecke Vasopressin
steigert auch die Permeabilität für Harnstoff, aber nur im inneren
Mark, also im terminalen Abschnitt der Sammelrohre, bevor diese in
einen Nierenkelch bzw. das Nierenbecken münden.
Vasopressin
steigert auch die Permeabilität für Harnstoff, aber nur im inneren
Mark, also im terminalen Abschnitt der Sammelrohre, bevor diese in
einen Nierenkelch bzw. das Nierenbecken münden.
 Abbildung: Osmotische Wirkungen von Kochsalz und Harnstoff während Antidiurese
Abbildung: Osmotische Wirkungen von Kochsalz und Harnstoff während Antidiurese
 Abbildung). Außerdem erhöht Vasopressin (hoher
Blutspiegel bei Antidiurese) die Harnstoffpermeabilität der
Sammelrohre, dadurch wird der osmotische Hemmeffekt des Harnstoffs auf
die Rückgewinnung von Wasser weiter reduziert.
Abbildung). Außerdem erhöht Vasopressin (hoher
Blutspiegel bei Antidiurese) die Harnstoffpermeabilität der
Sammelrohre, dadurch wird der osmotische Hemmeffekt des Harnstoffs auf
die Rückgewinnung von Wasser weiter reduziert.  Harnstoff (Plasma / Serum)
Harnstoff (Plasma / Serum)
 Die maximale Harnstoffkonzentration im Harn entspricht ~600 mosmol/l. Bei
Antidiurese kann eine Harn-Osmolarität von 1200 mosmol/l (oder etwas
mehr) erreicht werden. Das bedeutet, dass alle anderen im Harn gelösten
Stoffe (vor allem Salze) einen Anteil von nicht viel mehr als ~600
mosmol/l bestreiten können, dann ist das Konzentrationsvermögen der Niere
ausgeschöpft. (Meerwasser hat eine Salzkonzentration von ~1200 mosmol/l,
nimmt man es zu sich, kommt es unweigerlich zu Salzanreicherung und
hypertoner Dehydrierung).
Die maximale Harnstoffkonzentration im Harn entspricht ~600 mosmol/l. Bei
Antidiurese kann eine Harn-Osmolarität von 1200 mosmol/l (oder etwas
mehr) erreicht werden. Das bedeutet, dass alle anderen im Harn gelösten
Stoffe (vor allem Salze) einen Anteil von nicht viel mehr als ~600
mosmol/l bestreiten können, dann ist das Konzentrationsvermögen der Niere
ausgeschöpft. (Meerwasser hat eine Salzkonzentration von ~1200 mosmol/l,
nimmt man es zu sich, kommt es unweigerlich zu Salzanreicherung und
hypertoner Dehydrierung).
 Man
könnte z.B. fragen, wieviel Harn für die Ausscheidung von 600 mosmol im
Harn gelöster (osmotisch wirksamer) Bestandteile mindestens notwendig
ist. Da die maximale Konzentrierfähigkeit der gesunden menschlichen
Niere einen Harn mit 1200 mosmol/l produzieren kann, wären das 600 / 1200
(0,5) Liter.
Man
könnte z.B. fragen, wieviel Harn für die Ausscheidung von 600 mosmol im
Harn gelöster (osmotisch wirksamer) Bestandteile mindestens notwendig
ist. Da die maximale Konzentrierfähigkeit der gesunden menschlichen
Niere einen Harn mit 1200 mosmol/l produzieren kann, wären das 600 / 1200
(0,5) Liter.
 Schleifendiuretika (loop diuretics) - Furosemid, Bumetanid, Torasemid - fördern die Wasserausscheidung, indem sie die Wirkung des Na+/K+/2Cl-- Cotransportsystems hemmen. Sie können die Natriumausscheidung bis auf
25% der
filtrierten Kochsalzmenge steigern (d.h. um etwa eine
Zehnerpotenz). Gleichzeitig verringern sie die Aufladung des
Tubuluslumens (ROMK, s.
oben) und damit auch die Resorption von Kationen (Calcium, Magnesium -
Schleifendiuretika können gegen Hypercalcämie angewendet werden).
Schleifendiuretika (loop diuretics) - Furosemid, Bumetanid, Torasemid - fördern die Wasserausscheidung, indem sie die Wirkung des Na+/K+/2Cl-- Cotransportsystems hemmen. Sie können die Natriumausscheidung bis auf
25% der
filtrierten Kochsalzmenge steigern (d.h. um etwa eine
Zehnerpotenz). Gleichzeitig verringern sie die Aufladung des
Tubuluslumens (ROMK, s.
oben) und damit auch die Resorption von Kationen (Calcium, Magnesium -
Schleifendiuretika können gegen Hypercalcämie angewendet werden).  ist eine seltene genetische Erkrankung aufgrund eines Defekts im dicken
aufsteigenden Schenkel der Henle-Schleife. Diese Krankheit bedingt Verlust an Natrium-, Kalium- und Chloridionen und führt zu
Hypokaliämie, Alkalose und eventuell erniedrigtem Blutdruck.
ist eine seltene genetische Erkrankung aufgrund eines Defekts im dicken
aufsteigenden Schenkel der Henle-Schleife. Diese Krankheit bedingt Verlust an Natrium-, Kalium- und Chloridionen und führt zu
Hypokaliämie, Alkalose und eventuell erniedrigtem Blutdruck. 
 Die Nieren des
Menschen können die Osmolalität des Harns 4-5fach senken
(Wasserausscheidung) oder steigern (Konzentrierung). ~12% der Nephrone
liegen juxtamedullär, ihre Henle-Schleifen bauen über einen Gegenstrom-
Austauschmechanismus Zonen hoher Osmolarität im Nierenmark auf, dessen
tiefe Regionen (~1-2% der renalen Durchblutung) anaerob (pO2 ~10 mmHg) und energiesparend hohe Osmolalität aufbauen. Der absteigende Teil der Henle-Schleife ist parazellulär für Wasser durchgängig (Fehlen von tight junctions),
Wasser tritt aus, die Tubulusflüssigkeit wird hyperton. Der dünnwandige
aufsteigende Teil der Henle-Schleife ist für Harnstoff (dieser
diffundiert in den Tubulus), nicht für Wasser durchgängig (tight
junctions, keine Aquaporine)
Die Nieren des
Menschen können die Osmolalität des Harns 4-5fach senken
(Wasserausscheidung) oder steigern (Konzentrierung). ~12% der Nephrone
liegen juxtamedullär, ihre Henle-Schleifen bauen über einen Gegenstrom-
Austauschmechanismus Zonen hoher Osmolarität im Nierenmark auf, dessen
tiefe Regionen (~1-2% der renalen Durchblutung) anaerob (pO2 ~10 mmHg) und energiesparend hohe Osmolalität aufbauen. Der absteigende Teil der Henle-Schleife ist parazellulär für Wasser durchgängig (Fehlen von tight junctions),
Wasser tritt aus, die Tubulusflüssigkeit wird hyperton. Der dünnwandige
aufsteigende Teil der Henle-Schleife ist für Harnstoff (dieser
diffundiert in den Tubulus), nicht für Wasser durchgängig (tight
junctions, keine Aquaporine)  Der dickwandige aufsteigende Teil der Schleife ist für Wasser und Harnstoff unpassierbar, resorbiert aber 20-30% der filtrierten Kochsalzmenge (apikaler elektroneutraler Na/K/2Cl-Cotransporter; Schleifendiuretika hemmen diesen und senken Rückresorption, interstitielle Osmolalität und Konzentrierungsleistung). Kalium gelangt über ROMK in das Tubuluslumen zurück, das es dabei positiv auflädt. Das glomeruläre Filtrat enthält nur wenig Kalium, daher ist das Kalium-Recycling
für die Aufrechterhaltung des Na/K/2Cl-Cotransports notwendig. Das lumen-positive Potential treibt die Ca++- und Mg++-Resorption in das Blut an. Ein Calciumsensor in der basolateralen Membran hemmt bei Erhöhung des extrazellulären [Ca++] den Na/K/2Cl-Cotransporter und damit die Ca++- und Mg++-Aufnahme (und erhöht deren Ausscheidung). Der Na+-Gradient (basolaterale Na/K-ATPase) ermöglicht die Resorption von K+ und Cl- (Chlorid im Austausch gegen Bicarbonat)
Der dickwandige aufsteigende Teil der Schleife ist für Wasser und Harnstoff unpassierbar, resorbiert aber 20-30% der filtrierten Kochsalzmenge (apikaler elektroneutraler Na/K/2Cl-Cotransporter; Schleifendiuretika hemmen diesen und senken Rückresorption, interstitielle Osmolalität und Konzentrierungsleistung). Kalium gelangt über ROMK in das Tubuluslumen zurück, das es dabei positiv auflädt. Das glomeruläre Filtrat enthält nur wenig Kalium, daher ist das Kalium-Recycling
für die Aufrechterhaltung des Na/K/2Cl-Cotransports notwendig. Das lumen-positive Potential treibt die Ca++- und Mg++-Resorption in das Blut an. Ein Calciumsensor in der basolateralen Membran hemmt bei Erhöhung des extrazellulären [Ca++] den Na/K/2Cl-Cotransporter und damit die Ca++- und Mg++-Aufnahme (und erhöht deren Ausscheidung). Der Na+-Gradient (basolaterale Na/K-ATPase) ermöglicht die Resorption von K+ und Cl- (Chlorid im Austausch gegen Bicarbonat) Kochsalz- und Harnstoffkonzentration sowie Osmolarität nehmen mit der Tiefe des Nierenmarks zu. Durch die
Strömung der Tubulusflüssigkeit baut sich ein vertikaler
Osmolaritätsgradient auf, der Inhalt langer Henle-Schleifen wird
hyperton (bis maximal ~1500 mosmol/l). Aus der Rinde (≤ 290 mosmol/l) kommend, strömt Harn durch diese hypertone Zone und kann bei starker Vasopressinwirkung 4-5fach hyperton werden (1200-1500 mosmol/l). Auch in den
Blutgefäßen des Nierenmarks wirkt ein Gegenstrom-Austauschmechanismus:
Endothelien sind für Wasser und Natrium permeabel, ein osmotischer
Auswascheffekt durch die Perfusion (der die Konzentrationsfähigkeit der Niere
beeinträchtigen würde) bleibt aus. Der dicke
aufsteigende Teil der Henle'schen Schleife und der frühdistale Tubulus
werden zusammen als Verdünnungssegment bezeichnet: Sie entfernen Kochsalz und sind wasserundurchlässig, die
Osmolalität ihres Inhalts sinkt auf 50-100 mosmol/l
Kochsalz- und Harnstoffkonzentration sowie Osmolarität nehmen mit der Tiefe des Nierenmarks zu. Durch die
Strömung der Tubulusflüssigkeit baut sich ein vertikaler
Osmolaritätsgradient auf, der Inhalt langer Henle-Schleifen wird
hyperton (bis maximal ~1500 mosmol/l). Aus der Rinde (≤ 290 mosmol/l) kommend, strömt Harn durch diese hypertone Zone und kann bei starker Vasopressinwirkung 4-5fach hyperton werden (1200-1500 mosmol/l). Auch in den
Blutgefäßen des Nierenmarks wirkt ein Gegenstrom-Austauschmechanismus:
Endothelien sind für Wasser und Natrium permeabel, ein osmotischer
Auswascheffekt durch die Perfusion (der die Konzentrationsfähigkeit der Niere
beeinträchtigen würde) bleibt aus. Der dicke
aufsteigende Teil der Henle'schen Schleife und der frühdistale Tubulus
werden zusammen als Verdünnungssegment bezeichnet: Sie entfernen Kochsalz und sind wasserundurchlässig, die
Osmolalität ihres Inhalts sinkt auf 50-100 mosmol/l