




 Rezeptoren, second messenger, Kommunikation zwischen Zellen
Rezeptoren, second messenger, Kommunikation zwischen Zellen
 Acetylcholin: acetum = Essig, χολή = Galle (Cholin 1849 in Schweinegalle entdeckt)
Acetylcholin: acetum = Essig, χολή = Galle (Cholin 1849 in Schweinegalle entdeckt)| Die
Kommunikation zwischen Zellen kann über
Signalstoff-Rezeptor-Interaktion (Sender-Empfänger-Prinzip) oder
direkte Schaltstellen (z.B. gap junctions)
erfolgen. Letztere erlauben Stromflüsse zwischen Zellen (Übertragung
von Aktionspotentialen, z.B. im Herzmuskel) und interzellulären Austausch von
Molekülen. Rezeptoren in der Zellmembran oder im Zellinneren sind Moleküle, die Information aus dem extrazellulären Raum aufnehmen, indem sie Signalstoffe binden und zelluläre Sekundärprozesse auslösen. Je nach Funktionstyp unterscheidet man u.a. -- Direkt enzymatisch aktive Rezeptoren, sie dimerisieren nach Bindung ihres Bindungspartners (Insulin, ANF..) und haben an der Zellinnenseite Enzymfunktion (Tyrosinkinase, Guanylatzyklase). Das kann Transkriptionsvorgänge, eventuell auch Zellteilung bewirken -- Ionotrope Rezeptoren, z.B. für Neurotransmitter - 4 oder 5 Proteine bilden zusammen einen Ionenkanal, dessen Permeabilität ligandenabhängig ist -- Metabotrope Rezeptoren sind sehr häufig (~80% aller transmembranalen Signalmeldungen): Es sind G-Protein-gekoppelte (GTP-bindende) Rezeptoren, die auf verschiedenste Reize reagieren (Geruchsstoffe, Licht, Transmitter, Aminosäuren, Proteohormone..) -- Nukleäre Rezeptoren sind intrazellulär, binden nach Anlagerung ihrer Hormone (Steroide, Schilddrüsenhormone) an hormone response elements der Zielgene oder andere Transkriptionsfaktoren, und können viele Gene gleichzeitig beeinflussen. |
 Rezeptortypen
Rezeptortypen  Proteolytische Signalerweiterung
Proteolytische Signalerweiterung  Folgereaktionen
Folgereaktionen  Calciumionen als Signal
Calciumionen als Signal  Interzellulärer und Zell-Matrix- Kontakt
Interzellulärer und Zell-Matrix- Kontakt
 Phospholipase C / Proteinkinase C
Phospholipase C / Proteinkinase C  Calmodulin
Calmodulin  Phosphodiesterasen (PDE)
Phosphodiesterasen (PDE)  Januskinasen
Januskinasen  STATs
STATs  Chaperone
Chaperone  Divergenz, Konvergenz
Divergenz, Konvergenz  G-Proteine
G-Proteine
 Core messages
Core messages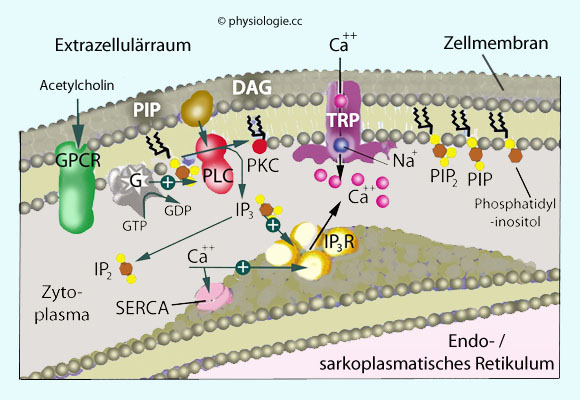
 Abbildung: Signale an der Zellmembran können die Aktivierung von Calciumionen auslösen
Abbildung: Signale an der Zellmembran können die Aktivierung von Calciumionen auslösen GPCR, G-protein coupled receptor, ein Rezeptor der Zellmembran, der extrazelluläre Signale über GTP-bindende Proteine weiterleitet
GPCR, G-protein coupled receptor, ein Rezeptor der Zellmembran, der extrazelluläre Signale über GTP-bindende Proteine weiterleitet  IP2, Inositolbiphosphat
IP2, Inositolbiphosphat  IP3R, Inositoltriphosphat-Rezeptor
IP3R, Inositoltriphosphat-Rezeptor  PLC, Phospholipase C, hydrolysiert die Phosphatidylinositol-4,5-bisphosphat (PIP2) zu Inositoltrisphosphat (IP3) und Diacylglycerol (DAG)
PLC, Phospholipase C, hydrolysiert die Phosphatidylinositol-4,5-bisphosphat (PIP2) zu Inositoltrisphosphat (IP3) und Diacylglycerol (DAG)  PKC, Proteinkinase C
PKC, Proteinkinase C  SERCA, Calciumpumpe des endo/sarkoplasmatischen Retikulums
SERCA, Calciumpumpe des endo/sarkoplasmatischen Retikulums  TRP, TRP-Kanal
TRP, TRP-Kanal
 Phospholipase C (PLC) ist der Sammelbegriff für membrangebundene Enzyme, die - angeregt durch die Bindung extrazellulärer Signalstoffe an GPCR, Tyrosinkinasen, Calciumionen u.a. - Phospholipide der Zellmembran spalten (mehrere Isotypen). Aus PIP2 entstehen dabei die Botenstoffe (second messenger) DAG und IP3.
Phospholipase C (PLC) ist der Sammelbegriff für membrangebundene Enzyme, die - angeregt durch die Bindung extrazellulärer Signalstoffe an GPCR, Tyrosinkinasen, Calciumionen u.a. - Phospholipide der Zellmembran spalten (mehrere Isotypen). Aus PIP2 entstehen dabei die Botenstoffe (second messenger) DAG und IP3. 
 Abbildung: Signalkaskaden extra- zu intrazellulär
Abbildung: Signalkaskaden extra- zu intrazellulär
 Abbildung): Ihre Produkte erreichen eine wesentlich
höhere Konzentration als die des Liganden ("first messenger") an der
Zellmembran - es kommt über mehrere Zwischenschritte zu einer
lawinenartigen Intensivierung, der gewünschte Effekt in der Zelle wird
dadurch gesichert.
Abbildung): Ihre Produkte erreichen eine wesentlich
höhere Konzentration als die des Liganden ("first messenger") an der
Zellmembran - es kommt über mehrere Zwischenschritte zu einer
lawinenartigen Intensivierung, der gewünschte Effekt in der Zelle wird
dadurch gesichert.Rezeptortypen Nach Rang & Dale's Pharmacology, 9th ed. 2020 (Elsevier) |
||||
| Ligandengesteuerter Ionenkanal (ionotroper Rezeptor) |
G-Protein-gekoppelt (metabotroper Rezeptor) |
Enzym (Rezeptorkinase) |
Nukleärer Rezeptor |
|
| Wo? |
Membran |
Membran |
Membran |
Intrazellulär |
| Effektor |
Ionenkanal |
Kanal oder Enzym |
Proteinkinase |
Gentranskription |
| Kopplung |
direkt |
G-Protein oder Arrestin |
direkt |
über DNA |
| Beispiele: Rezeptoren für |
Acetylcholin (nikotinisch) GABAA |
Acetylcholin (muskarinisch) Acetylcholinrezeptor  Katecholamine |
Insulin Wachstumsfaktoren  Zytokine |
Steroide |
| Struktur |
Untereinheiten um zentrale Pore (oligomer) Rezeptordomäne extrazellulär |
Heptahelikal, mono- oder oligomer, G-Protein-Kopplung intrazellulär Rezeptordomäne extrazellulär |
Einfach transmembranal, Kinasedomäne intrazellulär Rezeptordomäne extrazellulär |
Monomer, mit Rezeptor- und DNA-bindender Domäne |
 Schritte der Signaltransduktion:
Schritte der Signaltransduktion: Bindung externer Signalmoleküle an Rezeptormoleküle
Bindung externer Signalmoleküle an Rezeptormoleküle Aktivierung rezeptorabhängiger Proteine
Aktivierung rezeptorabhängiger Proteine Synthese "zweiter Botenstoff"-Moleküle
Synthese "zweiter Botenstoff"-Moleküle Verstärkter zellulärer Effekt
Verstärkter zellulärer Effekt| Verstärkerenzym |
Wo? |
Aktiviert durch |
Zielmolekül |
Produkt |
| Adenylylcyclase |
Zellmembran |
G-Protein-gekoppelter Rezeptor |
ATP |
cAMP |
| Guanylylcyclase |
Zellmembran Zytosol |
Rezeptorenzym Stickstoffmonoxid |
GTP |
cGMP |
| Phospholipase C |
Zellmembran |
G-Protein-gekoppelter Rezeptor | Phospholipide (Zellmembran) |
IP3 DAG |
 Veränderung des Ansprechverhaltens von Ionenkanälen → Veränderung des Membranpotentials → elektrisches Signal
Veränderung des Ansprechverhaltens von Ionenkanälen → Veränderung des Membranpotentials → elektrisches Signal Erhöhung der intrazellulären Calciumkonzentration → Bindung an Proteine → veränderte Funktion
Erhöhung der intrazellulären Calciumkonzentration → Bindung an Proteine → veränderte Funktion Veränderung von Enzymaktivitäten, insbesondere von Kinasen / Phosphatasen → (De-) Phosphorylierung von Zieloproteinen → allosterische Effekte → veränderte Proteinfunktion (z.B. Ionenkanal, Enzym)
Veränderung von Enzymaktivitäten, insbesondere von Kinasen / Phosphatasen → (De-) Phosphorylierung von Zieloproteinen → allosterische Effekte → veränderte Proteinfunktion (z.B. Ionenkanal, Enzym)
 Membrangebundene Rezeptoren verfügen über drei Anteile: Eine extrazelluläre Domäne, welche den Liganden (Signalstoff: Hormon, Transmitter..) spezifisch binden kann; eine oder mehrere lipophile transmembranale Domäne(n); und eine intrazelluläre
Domäne, welche Sekundärreaktionen in der Zelle auslöst. Bindet der
spezifische Ligand (extrazellulär) an den Rezeptor, erfahren alle drei
Anteile eine Konformationsänderung,
und das Signal wird (intrazellulär) "gezündet". Der gesamte Vorgang
kann einen oder mehrere der folgenden Schritte enthalten: Aktivierung
eines Guaninaustauschs (G-Protein); Homo- und/oder Hetero-Dimerisierung
von Rezeptormolekülen (u.U. Corezeptoren); Aktivierung von
Signalproteinen im Zytoplasma.
Membrangebundene Rezeptoren verfügen über drei Anteile: Eine extrazelluläre Domäne, welche den Liganden (Signalstoff: Hormon, Transmitter..) spezifisch binden kann; eine oder mehrere lipophile transmembranale Domäne(n); und eine intrazelluläre
Domäne, welche Sekundärreaktionen in der Zelle auslöst. Bindet der
spezifische Ligand (extrazellulär) an den Rezeptor, erfahren alle drei
Anteile eine Konformationsänderung,
und das Signal wird (intrazellulär) "gezündet". Der gesamte Vorgang
kann einen oder mehrere der folgenden Schritte enthalten: Aktivierung
eines Guaninaustauschs (G-Protein); Homo- und/oder Hetero-Dimerisierung
von Rezeptormolekülen (u.U. Corezeptoren); Aktivierung von
Signalproteinen im Zytoplasma. Rezeptoren (ligandengesteuerten Ionenkanälen, LICs, ligand-gated ion channels, ionotropic receptors) greifen rasch wirkende Neurotransmitter an. Sie dienen vor allem rascher synaptischer
Signalübertragung, absolvieren Ligandenbindung und Kanalöffnung in
Bruchteilen einer Millisekunde. Ionotrope Rezeptoren finden sich in der Zellmembran, aber auch in der Zelle (IP3-Rezeptor, Ryanodinrezeptor - beide lassen Ca++ aus intrazellulären Speichern in das Zytoplasma strömen).
Rezeptoren (ligandengesteuerten Ionenkanälen, LICs, ligand-gated ion channels, ionotropic receptors) greifen rasch wirkende Neurotransmitter an. Sie dienen vor allem rascher synaptischer
Signalübertragung, absolvieren Ligandenbindung und Kanalöffnung in
Bruchteilen einer Millisekunde. Ionotrope Rezeptoren finden sich in der Zellmembran, aber auch in der Zelle (IP3-Rezeptor, Ryanodinrezeptor - beide lassen Ca++ aus intrazellulären Speichern in das Zytoplasma strömen).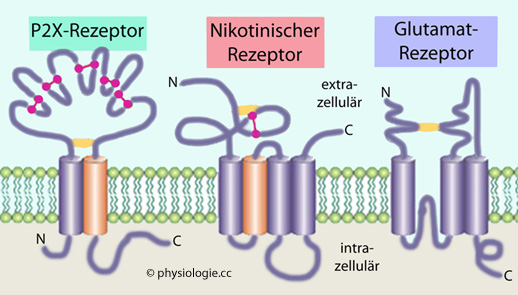
 Abbildung: Beispiele ligandengesteuerter Ionenkanäle (Ionotrope Rezeptoren)
Abbildung: Beispiele ligandengesteuerter Ionenkanäle (Ionotrope Rezeptoren)
 Abbildung):
Abbildung):  Purinerge P2X-Rezeptoren
Purinerge P2X-Rezeptoren Nikotinische Acetylcholinrezeptoren
Nikotinische Acetylcholinrezeptoren 
 Glutamatrezeptoren
Glutamatrezeptoren  vom NMDA-, AMPA- und Kainat-Typ
vom NMDA-, AMPA- und Kainat-Typ GABAA-Rezeptoren
GABAA-Rezeptoren Serotoninrezeptoren
Serotoninrezeptoren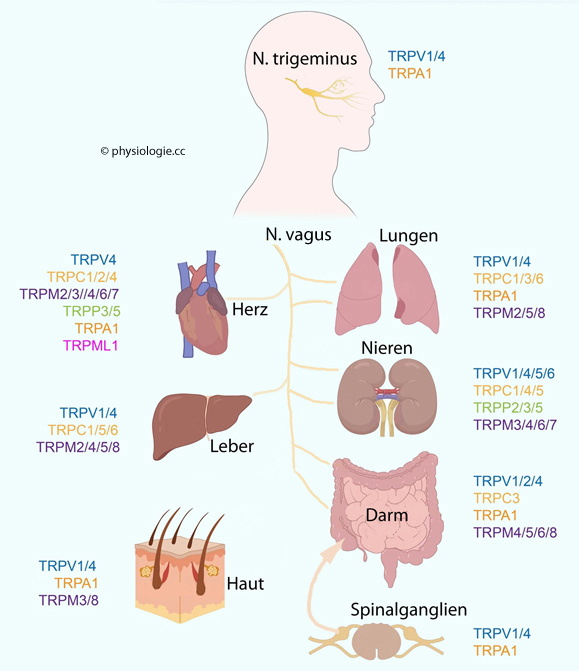
 Abbildung: Verteilung verschiedener TRP-Kanäle im Körper des Menschen
Abbildung: Verteilung verschiedener TRP-Kanäle im Körper des Menschen
 Abbildung),
wobei die Empfindlichkeit gegenüber bestimmten Substanzen (z.B. TRPV
für Vanilloid etc) namensgebend war. Die Bezeichnung der verschiedenen
TRP-Ionenkanäle
richtet sich nach der genetischen Subfamilie und der "Mitgliedsnummer".
So steht z.B. TRPA1 für Ankyrin-1, TRPM8 für Melastatin-8, TRPV1 für
Vanilloid-1 usw.
Abbildung),
wobei die Empfindlichkeit gegenüber bestimmten Substanzen (z.B. TRPV
für Vanilloid etc) namensgebend war. Die Bezeichnung der verschiedenen
TRP-Ionenkanäle
richtet sich nach der genetischen Subfamilie und der "Mitgliedsnummer".
So steht z.B. TRPA1 für Ankyrin-1, TRPM8 für Melastatin-8, TRPV1 für
Vanilloid-1 usw.  Zur Gruppe 1 zählt man TRPC (Canonical), TRPV (Vanilloid), TRPM (Melastatin), TRPN (No mechanoreceptor potential), TRPA (Ankyrin repeats).
Zur Gruppe 1 zählt man TRPC (Canonical), TRPV (Vanilloid), TRPM (Melastatin), TRPN (No mechanoreceptor potential), TRPA (Ankyrin repeats). Zur Gruppe 2 zählt man TRPP (Polycystic), TRPML (Mucolipin).
Zur Gruppe 2 zählt man TRPP (Polycystic), TRPML (Mucolipin). Mehr zu TRP-Kanälen und Schmerz s. dort, zu TRP-Kanälen und Temperatur s. dort
Mehr zu TRP-Kanälen und Schmerz s. dort, zu TRP-Kanälen und Temperatur s. dort Pharmaka können Ionenkanäle auf mehrere Arten beeinflussen: Durch Bindung an das Kanalprotein (orthosterisch
oder allosterisch), durch Beeinflussung von
second-messenger-Mechanismen, oder durch Veränderung der Expression von
Ionenkanälen an der Zelloberfläche.
Pharmaka können Ionenkanäle auf mehrere Arten beeinflussen: Durch Bindung an das Kanalprotein (orthosterisch
oder allosterisch), durch Beeinflussung von
second-messenger-Mechanismen, oder durch Veränderung der Expression von
Ionenkanälen an der Zelloberfläche.  vgl. dort
vgl. dort oder G-Protein-gekoppelte (GTP-bindende: G-Proteine binden Guanosinphosphat), heptahelikale (7-TM, 7-transmembrane, heptahelical, serpentine) Rezeptoren (
oder G-Protein-gekoppelte (GTP-bindende: G-Proteine binden Guanosinphosphat), heptahelikale (7-TM, 7-transmembrane, heptahelical, serpentine) Rezeptoren ( s. auch dort) bestehen meist aus 350-400 Aminosäuren, können aber auch wesentlich größer sein (NAS>1000). Ihre sieben transmembranalen α-Helices sind mittels intra- bzw. extrazellulären Verbindungsstücken miteinander verbunden (zwischen den Helices 5 und 6 liegt eine lange
intrazelluläre Schleife), das gesamte Molekül windet sich schlangenförmig ("serpentinisch") durch die Zellmembran.
Der glykolsylierte N-Terminus liegt extrazellulär, der hydrophile
C-Terminus intrazellulär. Binden GPCRs ihren Liganden (z.B. ein Hormon), aktivieren
sie ein assoziiertes G-Protein, indem sie gebundenes GDP gegen GTP
tauschen (
s. auch dort) bestehen meist aus 350-400 Aminosäuren, können aber auch wesentlich größer sein (NAS>1000). Ihre sieben transmembranalen α-Helices sind mittels intra- bzw. extrazellulären Verbindungsstücken miteinander verbunden (zwischen den Helices 5 und 6 liegt eine lange
intrazelluläre Schleife), das gesamte Molekül windet sich schlangenförmig ("serpentinisch") durch die Zellmembran.
Der glykolsylierte N-Terminus liegt extrazellulär, der hydrophile
C-Terminus intrazellulär. Binden GPCRs ihren Liganden (z.B. ein Hormon), aktivieren
sie ein assoziiertes G-Protein, indem sie gebundenes GDP gegen GTP
tauschen ( s. dort).
s. dort). G-Proteine sind
membranständige Eiweißmoleküle, die mit Guaninnukleotiden (GTP, GDP)
interagieren (daher ihr Name); ihre Aufgabe ist es, auf die Aktivierung
von GPCRs zu reagieren und ein
rezeptorabhängiges Signal in die Zelle weiterzuleiten, wo
Effektorsysteme (Kinasen, Ionenkanäle etc) eine entsprechende Antwort
der Zelle bewirken.
G-Proteine sind
membranständige Eiweißmoleküle, die mit Guaninnukleotiden (GTP, GDP)
interagieren (daher ihr Name); ihre Aufgabe ist es, auf die Aktivierung
von GPCRs zu reagieren und ein
rezeptorabhängiges Signal in die Zelle weiterzuleiten, wo
Effektorsysteme (Kinasen, Ionenkanäle etc) eine entsprechende Antwort
der Zelle bewirken.Wichtigste G-Protein-Subtypen und ihre Funktion Nach Rang & Dale's Pharmacology, 9th ed. 2020 |
|
| Subtyp |
Effekte |
| Gαs | Anregung der Adenylylcyclase (Bildung von cAMP) |
| Gαi | Hemmung der Adenylylcyclase |
| Gαo | vermutlich über βγ |
| Gαq | Aktivierung von Phospholipace C (mehr IP3 / DAG), Freisetzung Ca++, Aktivierung Proteinkinase C |
| Gα12/13 | Aktivierung von Rho-Kinase (ROCK1, Protein mit vielfachen Funktionen) |
| Gβγ | Aktivierung von Kaliumkanälen Hemmung spannungsgesteuerter Calciumkanäle Aktivierung von GPCR-Kinasen Interaktion mit Adenylylcyclase / PLC |
 Die G-Protein-Hauptklassen vom Typ Gαs, Gαi, Gα0 und Gαq
haben die größte pharmakologische Bedeutung. Beim Menschen sind 21
Gα-Subtypen bekannt, 6 Gβ- und 12 Gγ-Subtypen (theoretische Gesamtzahl
der möglichen Kombinationen 1,5.103).
Die G-Protein-Hauptklassen vom Typ Gαs, Gαi, Gα0 und Gαq
haben die größte pharmakologische Bedeutung. Beim Menschen sind 21
Gα-Subtypen bekannt, 6 Gβ- und 12 Gγ-Subtypen (theoretische Gesamtzahl
der möglichen Kombinationen 1,5.103). Drei Hauptklassen metabotroper Rezeptoren Nach Rang & Dale's Pharmacology, 9th ed. 2020 |
||
| Klasse |
Rezeptoren |
Strukturelle Merkmale |
| A: Rhodopsin- Familie |
Größte Gruppe, Rezeptoren für die meisten Amin-Neurotransmitter, viele Neuropeptide, Purine, Prostanoide, Glucagon, Calcitonin |
Kurzer N-terminaler extrazellulärer Anteil, Ligand bindet an Transmembranhelices (Amine) oder extrazelluläre Schleifen (Peptide) |
| B: Sekretin- / Glukagonrezeptor- Familie |
Peptidhormonrezeptoren (Sekretin, Glucagon, Calcitonin etc) |
Ligandenbindende Domäne auf extrazellulärer Zwischensequenz |
| C: Metabotrope Glutamatrezeptor- / Calciumsensor- Familie |
Kleine Gruppe; Metabotrope Glutamatrezeptoren, GABAB-Rezeptoren, Ca++-sensing receptors |
Langer extrazellulärer Anteil mit ligandenbindender Domäne |
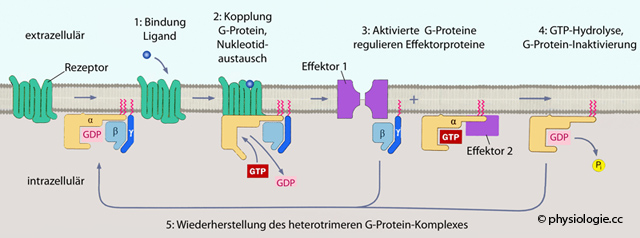
 Abbildung: Struktur und Signalauslösung an GPCRs
Abbildung: Struktur und Signalauslösung an GPCRs
 kleiner G-Proteine wie Rab, Ras und Rho).
kleiner G-Proteine wie Rab, Ras und Rho). Abbildung).
Abbildung). 
 Abbildung: Aktivierung der Adenylylcyclase und Proteinkinase A durch G-Protein-gekoppelte Rezeptoren
Abbildung: Aktivierung der Adenylylcyclase und Proteinkinase A durch G-Protein-gekoppelte Rezeptoren
 Jeder ligandenaktivierte Rezeptor aktiviert ~100 oder auch deutlich mehr G-Proteine (erste Stufe der Signalverstärkung). Die Adenylylcyclase produziert cAMP, so lange die α-Untereinheit
gebunden bleibt und sie aktiviert. Dadurch entsteht viel mehr cAMP als G-Proteine aktiviert wurden (zweite Stufe der Signalverstärkung).
Jeder ligandenaktivierte Rezeptor aktiviert ~100 oder auch deutlich mehr G-Proteine (erste Stufe der Signalverstärkung). Die Adenylylcyclase produziert cAMP, so lange die α-Untereinheit
gebunden bleibt und sie aktiviert. Dadurch entsteht viel mehr cAMP als G-Proteine aktiviert wurden (zweite Stufe der Signalverstärkung).  Abbildung).
Abbildung). 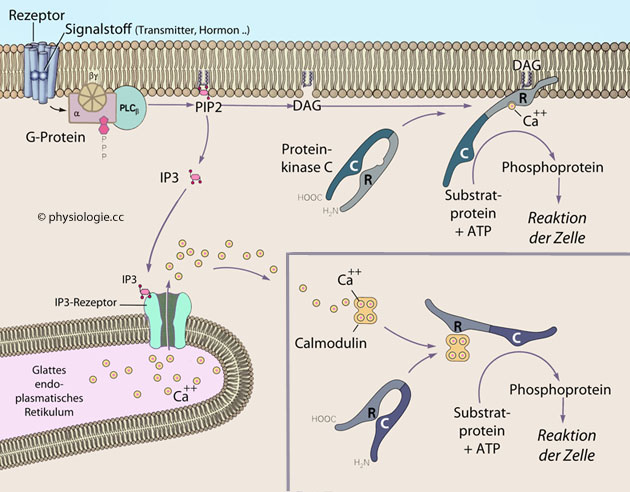
 Abbildung: Aktivierung des DAG / IP3-Systems durch G-Protein- gekoppelte Rezeptoren
Abbildung: Aktivierung des DAG / IP3-Systems durch G-Protein- gekoppelte Rezeptoren
 IP3 erreicht innerhalb von Sekunden nach Rezeptoraktivierung einen Gipfelwert (der rasch wieder abklingt),
IP3 erreicht innerhalb von Sekunden nach Rezeptoraktivierung einen Gipfelwert (der rasch wieder abklingt),  DAG
einen kleinen frühen Gipfelwert ebenfalls innerhalb von Sekunden (durch
PIP2 verursacht) und einen späteren, intensiveren und über Minuten und
Stunden anhaltenden Maximalwert (Mitwirkung von Phospholipase D).
DAG
einen kleinen frühen Gipfelwert ebenfalls innerhalb von Sekunden (durch
PIP2 verursacht) und einen späteren, intensiveren und über Minuten und
Stunden anhaltenden Maximalwert (Mitwirkung von Phospholipase D). Phospholipase C spaltet Phosphatidylinositol-Biphosphat (PIP2)
Phospholipase C spaltet Phosphatidylinositol-Biphosphat (PIP2)  zu Diazylglyzerin (DAG) und Inositol-Triphosphat (IP3).
DAG ist fettlöslich und wirkt in der Zellmembran, IP3 diffundiert durch
die Zelle und erreicht das endoplasmatische Retikulum, wo es über
IP3-Rezeptoren die Freisetzung von Ca++ und damit intrazelluläre Signalkaskaden aktiviert.
zu Diazylglyzerin (DAG) und Inositol-Triphosphat (IP3).
DAG ist fettlöslich und wirkt in der Zellmembran, IP3 diffundiert durch
die Zelle und erreicht das endoplasmatische Retikulum, wo es über
IP3-Rezeptoren die Freisetzung von Ca++ und damit intrazelluläre Signalkaskaden aktiviert.  direkte Anlagerung an das Zielprotein, oder über
direkte Anlagerung an das Zielprotein, oder über  Bindung an Vermittlerproteine, wie das ubiquitäre und multifunktionale Steuerprotein Calmodulin.
Bindung an Vermittlerproteine, wie das ubiquitäre und multifunktionale Steuerprotein Calmodulin. Proteinkinase C (PKC) wird von beiden second messengers
- DAG in der Zellmembran, Ca/Calmodulin im Zytoplasma - aktiviert,
worauf Proteine phosphoryliert werden und entsprechende Reaktionen der
Zelle erfolgen. PKC
unterliegt ihrerseits verschiedenen regulatorischen Einflüssen, z.B.
Ubiquitinierung ihrer regulatorischen und/oder katalytischen Einheit.
Proteinkinase C (PKC) wird von beiden second messengers
- DAG in der Zellmembran, Ca/Calmodulin im Zytoplasma - aktiviert,
worauf Proteine phosphoryliert werden und entsprechende Reaktionen der
Zelle erfolgen. PKC
unterliegt ihrerseits verschiedenen regulatorischen Einflüssen, z.B.
Ubiquitinierung ihrer regulatorischen und/oder katalytischen Einheit. Abbildung).
Abbildung). 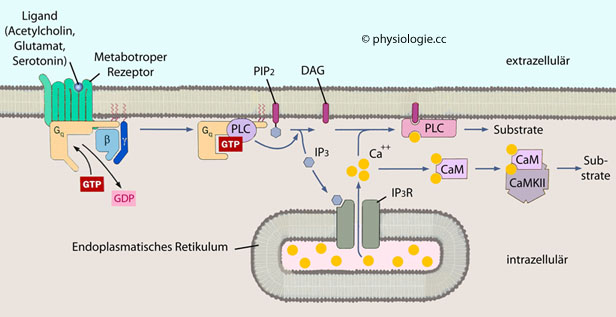
 Abbildung: Signalwere von GPCR durch Phospholipase C und Calciumionen
Abbildung: Signalwere von GPCR durch Phospholipase C und Calciumionen
 Abbildung).
Abbildung). Calmodulin (CaM, von calcium-modulated protein)
ist ein calciumbindendes Signalprotein (148 Aminosäuren, ähnlich dem
Muskeleiweiß Troponin aufgebaut), das alle eukaryoten Zellen
exprimieren. Durch intrazelluläre Bindung von Ca++-Ionen aktiviert (Konformationsänderung des Moleküls: allosterischer Effekt), interagiert es mit Zielproteinen (mehr als 300 verschiedene Phosphatasen,
Kinasen u.a.). So spielt es eine Rolle z.B. für die Kontraktion glatter
Muskelzellen, im Glucose- und Fettstoffwechsel, aber auch für
synaptische Plastizität (Kurz- und Langzeitgedächtnis).
Calmodulin (CaM, von calcium-modulated protein)
ist ein calciumbindendes Signalprotein (148 Aminosäuren, ähnlich dem
Muskeleiweiß Troponin aufgebaut), das alle eukaryoten Zellen
exprimieren. Durch intrazelluläre Bindung von Ca++-Ionen aktiviert (Konformationsänderung des Moleküls: allosterischer Effekt), interagiert es mit Zielproteinen (mehr als 300 verschiedene Phosphatasen,
Kinasen u.a.). So spielt es eine Rolle z.B. für die Kontraktion glatter
Muskelzellen, im Glucose- und Fettstoffwechsel, aber auch für
synaptische Plastizität (Kurz- und Langzeitgedächtnis). Phosphodiesterasen
(PDE) sind zelleigene Enzyme, die Phosphodiestergruppen aufbrechen - insbesondere in zyklischen Nukleotiden (cAMP, cGMP werden zu AMP / GMP - 3',5'-zyklische Nukleotide-PDE
Phosphodiesterasen
(PDE) sind zelleigene Enzyme, die Phosphodiestergruppen aufbrechen - insbesondere in zyklischen Nukleotiden (cAMP, cGMP werden zu AMP / GMP - 3',5'-zyklische Nukleotide-PDE  : PDE4, PDE7, PDE8 bauen spezifisch nur cAMP ab, PDE1, 2, 3, 10 und 11
auch cGMP), DNA / RNA, aber auch anderen Verbindungen, z.B. Phospholipiden. Es gibt mehrere
PDE-Isoenzyme mit unterschiedlicher Gewebeverteilung und
unterschiedlichem Wirkungsprofil. Beispielsweise wirken
Phosphodiesterase-Isoenzyme vom Typ 5 (PDE5) cGMP-spezifisch auf Gefäße und Bronchialmuskulatur in der Lunge und Gefäße im Penis (corpora cavernosa / spongiosa), solche vom Typ 3 (PDE3A) in Oozyten. Insgesamt 21 Phosphodiesterasen sind bekannt.
: PDE4, PDE7, PDE8 bauen spezifisch nur cAMP ab, PDE1, 2, 3, 10 und 11
auch cGMP), DNA / RNA, aber auch anderen Verbindungen, z.B. Phospholipiden. Es gibt mehrere
PDE-Isoenzyme mit unterschiedlicher Gewebeverteilung und
unterschiedlichem Wirkungsprofil. Beispielsweise wirken
Phosphodiesterase-Isoenzyme vom Typ 5 (PDE5) cGMP-spezifisch auf Gefäße und Bronchialmuskulatur in der Lunge und Gefäße im Penis (corpora cavernosa / spongiosa), solche vom Typ 3 (PDE3A) in Oozyten. Insgesamt 21 Phosphodiesterasen sind bekannt. Unterschiedliche Phosphodiesterase-Isoenzyme können durch Pharmaka z.T. spezifisch beeinflusst werden. So bewirken PDE5-Hemmer (Beispiel Sildenafil: Viagra) Vasodilatation in Lungenkreislauf und Genitalien (
Unterschiedliche Phosphodiesterase-Isoenzyme können durch Pharmaka z.T. spezifisch beeinflusst werden. So bewirken PDE5-Hemmer (Beispiel Sildenafil: Viagra) Vasodilatation in Lungenkreislauf und Genitalien ( vgl. dort). Phosphodiesterasehemmer wie Theophyllin erhöhen den
cAMP-Spiegel in Muskelzellen der Bronchien, wirken also bronchodilatierend (
vgl. dort). Phosphodiesterasehemmer wie Theophyllin erhöhen den
cAMP-Spiegel in Muskelzellen der Bronchien, wirken also bronchodilatierend ( s. dort).
s. dort). Die G-Proteinrezeptor-Superfamilie - definiert über den Wechsel zwischen GDP-gebundener und GTP-gebundener Form - weist insgesamt mehr als tausend Mitglieder auf.
Sie reagieren auf verschiedenste Reize, wie Licht, Duftstoffe,
Aminosäuren, biogene Amine, Neurotransmitter, Peptide.
Die G-Proteinrezeptor-Superfamilie - definiert über den Wechsel zwischen GDP-gebundener und GTP-gebundener Form - weist insgesamt mehr als tausend Mitglieder auf.
Sie reagieren auf verschiedenste Reize, wie Licht, Duftstoffe,
Aminosäuren, biogene Amine, Neurotransmitter, Peptide.  Etwa 80% aller
transmembranalen Signalmeldungen erfolgen über diesen Rezeptortyp.
Etwa 80% aller
transmembranalen Signalmeldungen erfolgen über diesen Rezeptortyp.
 Abbildung: G-Protein und Zellmembran
Abbildung: G-Protein und Zellmembran
 Acetylcholin (muskarinisch)
Acetylcholin (muskarinisch) Adrenalin / Noradrenalin (α, β)
Adrenalin / Noradrenalin (α, β)  Glutamat (mGlu)
Glutamat (mGlu)  Opiate
Opiate Leukotriene, Prostaglandine
Leukotriene, Prostaglandine Chemokine
Chemokine Komplementfaktoren (C3a, C5a)
Komplementfaktoren (C3a, C5a) Vasopressin
Vasopressin Histamin
Histamin Serotonin
Serotonin Calcitonin
Calcitonin Parathormon
Parathormon Calcium (CaSR: Ca++-sensing receptor)
Calcium (CaSR: Ca++-sensing receptor) Glucagon
Glucagon Corticotropin
Corticotropin Gonadotropine
Gonadotropine G-Protein-gekoppelte Rezeptoren sind der häufigste Angriffspunkt
therapeutischer Pharmaka (Rezeptoren für Acetylcholin, Amine, Peptide,
Purine u.a.).
G-Protein-gekoppelte Rezeptoren sind der häufigste Angriffspunkt
therapeutischer Pharmaka (Rezeptoren für Acetylcholin, Amine, Peptide,
Purine u.a.).  vgl. dort
vgl. dort Kinasen nennt man Enzyme, die Phosphatreste
auf Tyrosin-, Serin- oder Threonin-Seitenketten von Zielproteinen übertragen (sie phosphorylieren), entweder direkt
oder über Adapterproteine. Dadurch kann die Signaltransduktion in der Zelle angeregt werden. Phosphatasen (Proteinphosphatasen) sind Hydrolasen, welche Phosphatgruppen von Proteinen (die Teile von intrazellulären Signalkaskaden sein können) entfernen (sie dephosphorylieren) - und damit die Wirkung von Kinasen wieder aufheben können. Sie haben meist hemmende Wirkung auf die Signaltransduktion - und damit auf die Transkription von Genen.
Kinasen nennt man Enzyme, die Phosphatreste
auf Tyrosin-, Serin- oder Threonin-Seitenketten von Zielproteinen übertragen (sie phosphorylieren), entweder direkt
oder über Adapterproteine. Dadurch kann die Signaltransduktion in der Zelle angeregt werden. Phosphatasen (Proteinphosphatasen) sind Hydrolasen, welche Phosphatgruppen von Proteinen (die Teile von intrazellulären Signalkaskaden sein können) entfernen (sie dephosphorylieren) - und damit die Wirkung von Kinasen wieder aufheben können. Sie haben meist hemmende Wirkung auf die Signaltransduktion - und damit auf die Transkription von Genen.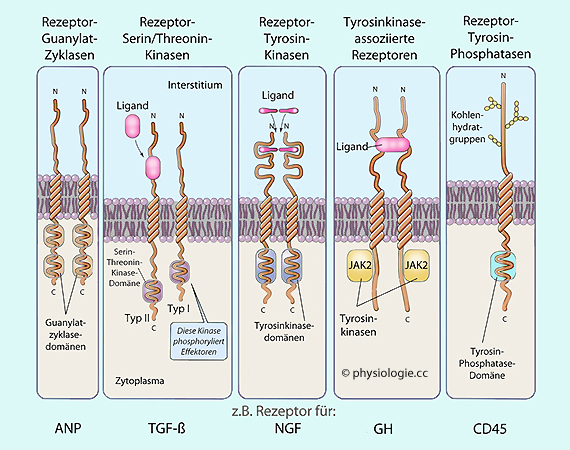
 Abbildung: Enzymatisch aktive Rezeptoren
Abbildung: Enzymatisch aktive Rezeptoren
 Abbildung)
Abbildung)  Rezeptor-Guanylatzyklasen, über die z.B. natriuretische Peptide wirken
Rezeptor-Guanylatzyklasen, über die z.B. natriuretische Peptide wirken Rezeptor-Serin / Threoninkinasen,
z.B. für TGF-ß
Rezeptor-Serin / Threoninkinasen,
z.B. für TGF-ß Rezeptor-Tyrosinkinasen (RTK) haben intrinsische Tyrosinkinase-Aktivität (auf diesem Weg wirken viele Wachstumsfaktoren, Zytokine, Insulin, IGF, Adipokine, Ephrine)
Rezeptor-Tyrosinkinasen (RTK) haben intrinsische Tyrosinkinase-Aktivität (auf diesem Weg wirken viele Wachstumsfaktoren, Zytokine, Insulin, IGF, Adipokine, Ephrine) Tyrosinkinase-assoziierte Rezeptoren haben selbst keine Kinase-Aktivität, sondern aktivieren zytoplasmatische Nichtrezeptor-Tyrosinkinasen (so wirken zahlreiche Interleukine, Interferone, Erythropoetin, Somatotropin, Prolactin, Leptin)
Tyrosinkinase-assoziierte Rezeptoren haben selbst keine Kinase-Aktivität, sondern aktivieren zytoplasmatische Nichtrezeptor-Tyrosinkinasen (so wirken zahlreiche Interleukine, Interferone, Erythropoetin, Somatotropin, Prolactin, Leptin) Rezeptor- Tyrosinphosphatasen, die man zur Aktivierung von Lymphozyten benötigt. Bei Anregung erlangen Rezeptor Tyrosinphosphatasen hohe Aktivität. In unstimulierten Zellen ist ihre Zahl gering, und ihre Halbwertszeit ist kurz, was ihre Wirkung begrenzt.
Rezeptor- Tyrosinphosphatasen, die man zur Aktivierung von Lymphozyten benötigt. Bei Anregung erlangen Rezeptor Tyrosinphosphatasen hohe Aktivität. In unstimulierten Zellen ist ihre Zahl gering, und ihre Halbwertszeit ist kurz, was ihre Wirkung begrenzt.
 Ein Signalmolekül / Ligand bindet an die extrazelluläre Domäne der RTK → Gestaltsänderung des Rezeptors → Dimerisierung des Rezeptors ("aus 2 mach' 1")
Ein Signalmolekül / Ligand bindet an die extrazelluläre Domäne der RTK → Gestaltsänderung des Rezeptors → Dimerisierung des Rezeptors ("aus 2 mach' 1") Der dimerisierte Rezeptor phosphoryliert spezifische Tyrosingruppen (Autophosphorylierung)
Der dimerisierte Rezeptor phosphoryliert spezifische Tyrosingruppen (Autophosphorylierung) Die Phosphotyrosingruppen binden an Adapter- / Dockingproteine, diese aktivieren Signalkaskaden
Die Phosphotyrosingruppen binden an Adapter- / Dockingproteine, diese aktivieren Signalkaskaden Die Signalwege triggern die Phosphorylierung von Zielproteinen in Zellkern, Zytoplasma und Zellmembran
Die Signalwege triggern die Phosphorylierung von Zielproteinen in Zellkern, Zytoplasma und Zellmembran Der Mechanismus wird beendet durch Abbau von Signalmolekülen durch
extrazelluläre Proteasen, ligandenaktivierte Endozytose und lysosomalen
Abbau der Rezeptoren u.a.
Der Mechanismus wird beendet durch Abbau von Signalmolekülen durch
extrazelluläre Proteasen, ligandenaktivierte Endozytose und lysosomalen
Abbau der Rezeptoren u.a. JAKs (Januskinasen)
sind Tyrosinkinasen (sie phosphorylieren Proteine am Tyrosin), die sich
an den intrazellulären Teil von Rezeptoren anlagern und diese
phosphorylieren (aktivieren) können. Unterschiedliche Rezeptoren binden
unterschiedliche JAKs.
JAKs (Januskinasen)
sind Tyrosinkinasen (sie phosphorylieren Proteine am Tyrosin), die sich
an den intrazellulären Teil von Rezeptoren anlagern und diese
phosphorylieren (aktivieren) können. Unterschiedliche Rezeptoren binden
unterschiedliche JAKs.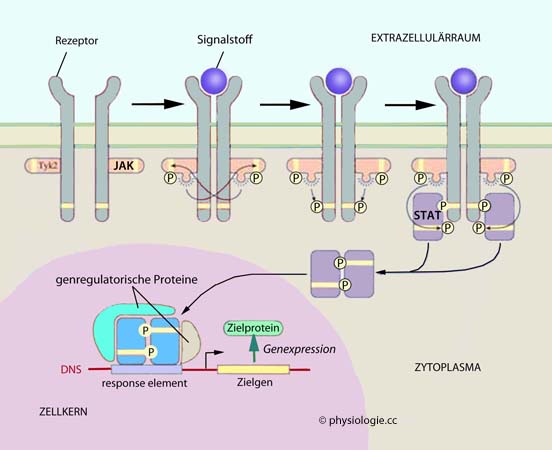
 Abbildung: JAK-STAT-Mechanismus
Abbildung: JAK-STAT-Mechanismus
 STATs (Signal transducer and activator of transcription) sind Transkriptionsfaktoren, die monomer im Zytoplasma vorliegen und bei Aktivierung (z.B. durch Zytokine) an intrazelluläre Domänen von Zytokinrezeptoren binden, von JAKs phosphoryliert werden, vom Rezeptorkomplex dissoziieren, dimerisieren, in den Zellkern wandern und Transkriptionsvorgänge regulieren (
STATs (Signal transducer and activator of transcription) sind Transkriptionsfaktoren, die monomer im Zytoplasma vorliegen und bei Aktivierung (z.B. durch Zytokine) an intrazelluläre Domänen von Zytokinrezeptoren binden, von JAKs phosphoryliert werden, vom Rezeptorkomplex dissoziieren, dimerisieren, in den Zellkern wandern und Transkriptionsvorgänge regulieren ( Abbildung).
Abbildung). Abbildung). Sie warten auf die Ankunft "ihrer" Hormone - Steroide, Vitamin D-Hormon, Schilddrüsenhormone - im Zytoplasma oder im Zellkern. Binden sie an entsprechende DNA-Sequenzen (HRE, Hormone response elements), geben sie den Kopiervorgang entsprechender Gene und damit die Synthese bestimmter Proteine (insbesondere Enzyme) frei.
Abbildung). Sie warten auf die Ankunft "ihrer" Hormone - Steroide, Vitamin D-Hormon, Schilddrüsenhormone - im Zytoplasma oder im Zellkern. Binden sie an entsprechende DNA-Sequenzen (HRE, Hormone response elements), geben sie den Kopiervorgang entsprechender Gene und damit die Synthese bestimmter Proteine (insbesondere Enzyme) frei.
 Abbildung: Wie Hormone über intrazelluläre Rezeptoren die Proteinsynthese einschalten
Abbildung: Wie Hormone über intrazelluläre Rezeptoren die Proteinsynthese einschalten Einer Domäne am N-Ende (ATD: Amino terminus domain), die hormonunabhängig transkriptionsaktivierend wirkt;
Einer Domäne am N-Ende (ATD: Amino terminus domain), die hormonunabhängig transkriptionsaktivierend wirkt; einer DNA-bindenden Domäne (DBD: DNA binding domain), die mit Zinkfingermotiven, die HREs der DNA binden können;
einer DNA-bindenden Domäne (DBD: DNA binding domain), die mit Zinkfingermotiven, die HREs der DNA binden können; dem C-Ende (LBD: Ligand binding domain),
das den Liganden (das Hormon) bindet, koregulatorische Proteine (HSP)
anlagert, dimerisiert, mit Chaperonen assoziiert und allenfalls die
Verlagerung in den Zellkern orchestriert.
dem C-Ende (LBD: Ligand binding domain),
das den Liganden (das Hormon) bindet, koregulatorische Proteine (HSP)
anlagert, dimerisiert, mit Chaperonen assoziiert und allenfalls die
Verlagerung in den Zellkern orchestriert. Chaperone
Chaperone  sind
Proteine, welche die Faltung oder Entfaltung von großen
Proteinmolekülen oder Proteinkomplexen bei deren Synthese oder
Denaturierung unterstützen. Sie beteiligen sich auch an Transfer und
Abbau von Eiweißen, im endoplasmatischen Retikulum kommen sie besonders
häufig vor. Hier kümmern sie sich u.a. um die korrekte Faltung von
Eiweißmolekülen (folding chaperones),
um Lektinwirkung etc. Chaperonproteine machen etwa 10% des menschlichen
Proteoms aus und werden stark exprimiert.
sind
Proteine, welche die Faltung oder Entfaltung von großen
Proteinmolekülen oder Proteinkomplexen bei deren Synthese oder
Denaturierung unterstützen. Sie beteiligen sich auch an Transfer und
Abbau von Eiweißen, im endoplasmatischen Retikulum kommen sie besonders
häufig vor. Hier kümmern sie sich u.a. um die korrekte Faltung von
Eiweißmolekülen (folding chaperones),
um Lektinwirkung etc. Chaperonproteine machen etwa 10% des menschlichen
Proteoms aus und werden stark exprimiert.  Ein besonders flexibler Mittelteil des Rezeptormoleküls (hinge region)
wirkt auf die Bewegung des Rezeptors durch die Zelle, erleichtert seine
Dimerisierung und kann die Anlagerung an verschiedene DNA-Abschnitte
beeinflussen.
Ein besonders flexibler Mittelteil des Rezeptormoleküls (hinge region)
wirkt auf die Bewegung des Rezeptors durch die Zelle, erleichtert seine
Dimerisierung und kann die Anlagerung an verschiedene DNA-Abschnitte
beeinflussen. Androgene (ARE: androgen-response element),
Androgene (ARE: androgen-response element), Östrogene (ERE: estrogen-response element),
Östrogene (ERE: estrogen-response element),  Progesteron (PRE: progesterone-response element),
Progesteron (PRE: progesterone-response element), Cortisol (GRE: glucocorticoid-response element),
Cortisol (GRE: glucocorticoid-response element), Mineralcorticoide (MRE: mineralcorticoid-response element).
Mineralcorticoide (MRE: mineralcorticoid-response element).
 Abbildung:
Abbildung:
 Abbildung: Signalverstärkung
Abbildung: Signalverstärkung
 Divergenz bedeutet,
dass ein bestimmter Transmitter verschiedene Neurone (oder auch
verschiedene Teile ein und desselben Neurons) ungleich beeinflusst -
mittels unterschiedlicher Rezeptoren (z.B. adrenerge α- vs.
β-Rezeptoren); Divergenz kann auf jeder Stufe der Signalverarbeitung
auftreten. Konvergenz bedeutet,
dass unterschiedliche Transmitter - über unterschiedliche Rezeptoren -
auf ein un denselben Ionenkanal wirken. Die Konvergenz kann sich auf
der Ebene der second messenger oder der Ionenkanäle ergeben.
Divergenz bedeutet,
dass ein bestimmter Transmitter verschiedene Neurone (oder auch
verschiedene Teile ein und desselben Neurons) ungleich beeinflusst -
mittels unterschiedlicher Rezeptoren (z.B. adrenerge α- vs.
β-Rezeptoren); Divergenz kann auf jeder Stufe der Signalverarbeitung
auftreten. Konvergenz bedeutet,
dass unterschiedliche Transmitter - über unterschiedliche Rezeptoren -
auf ein un denselben Ionenkanal wirken. Die Konvergenz kann sich auf
der Ebene der second messenger oder der Ionenkanäle ergeben. Über mechanische Reize (mechanically gated),
Über mechanische Reize (mechanically gated),  elektrische Reize (voltage-gated),
elektrische Reize (voltage-gated),  Bindungspartner von Rezeptoren (ligand-gated).
Bindungspartner von Rezeptoren (ligand-gated).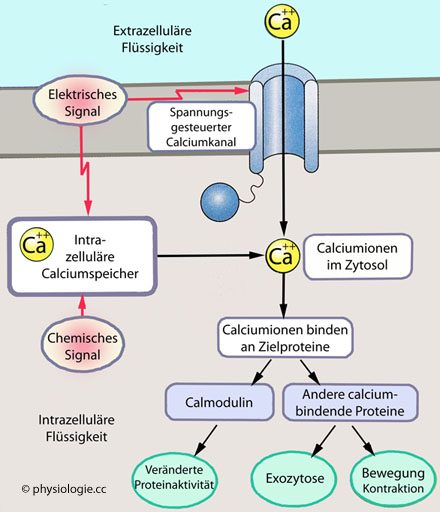
 Abbildung: Calciumionen als intrazellulärer Botenstoff
Abbildung: Calciumionen als intrazellulärer Botenstoff
 vgl. dort
vgl. dort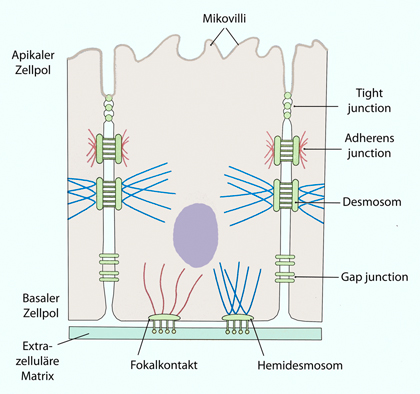
 Abbildung: Interzelluläre Verbindungen
Abbildung: Interzelluläre Verbindungen
 Adhäsionsverbindungen (adherens junctions)
über Cadherine (diese sind intrazellulär über Ankerproteine wie
Catenine, Vinculin und α-Actinin an Aktinfilamente in der Zelle
fixiert),
Adhäsionsverbindungen (adherens junctions)
über Cadherine (diese sind intrazellulär über Ankerproteine wie
Catenine, Vinculin und α-Actinin an Aktinfilamente in der Zelle
fixiert), Desmosomen in Form von Punktdesmosomen (puncta adhaerentes), Gürteldesmosomen
(zonulae adhaerentes) oder Streifendesmosomen (fasciae adhaerentes).
Dabei binden Desmocolline und Desmogleine einer Zelle an Moleküle
desselben Typs einer Nachbarzelle. Desmoplakine und Plakoglobin knüpfen
sie an intermediäre Filamente in der Zelle (vgl. dort)
Desmosomen in Form von Punktdesmosomen (puncta adhaerentes), Gürteldesmosomen
(zonulae adhaerentes) oder Streifendesmosomen (fasciae adhaerentes).
Dabei binden Desmocolline und Desmogleine einer Zelle an Moleküle
desselben Typs einer Nachbarzelle. Desmoplakine und Plakoglobin knüpfen
sie an intermediäre Filamente in der Zelle (vgl. dort) Aktinverknüpfte fokale Adhäsionen (Fokalkontakte. actin-linked focal adhesions)
verknüpfen punktförmig das Aktingerüst des Zytoskeletts über Integrine
mit der extrazellulären Matrix. Die Integrine sind intrazellulär via
Ankerproteine wie Talin, Vinculin, Filamin und α-Actinin an Aktinfilamenten befestigt
Aktinverknüpfte fokale Adhäsionen (Fokalkontakte. actin-linked focal adhesions)
verknüpfen punktförmig das Aktingerüst des Zytoskeletts über Integrine
mit der extrazellulären Matrix. Die Integrine sind intrazellulär via
Ankerproteine wie Talin, Vinculin, Filamin und α-Actinin an Aktinfilamenten befestigt Hemidesmosomen
verknüpfen epitheliale Zellen mit Basalmembranen. Integrine binden
intrazellulär an intermediäre Filamente via Ankerproteine wie Plectin,
extrazellulär an Laminin der Basalmembran
Hemidesmosomen
verknüpfen epitheliale Zellen mit Basalmembranen. Integrine binden
intrazellulär an intermediäre Filamente via Ankerproteine wie Plectin,
extrazellulär an Laminin der Basalmembran Interdigitierende Zellfortsätze (die einem Klettverschluss ähneln) können Zellen miteinander mechanisch verknüpfen, wie in der Linse des Auges.
Interdigitierende Zellfortsätze (die einem Klettverschluss ähneln) können Zellen miteinander mechanisch verknüpfen, wie in der Linse des Auges. Adhärenten Verbindungen (adherens junctions) für Aktinfilamente, und
Adhärenten Verbindungen (adherens junctions) für Aktinfilamente, und Desmosomen (maculae adherentes) für Intermediärfilamente.
Desmosomen (maculae adherentes) für Intermediärfilamente. Aktinverknüpfte und
Aktinverknüpfte und über Intermediärfilamente verknüpfte (s. Tabelle).
über Intermediärfilamente verknüpfte (s. Tabelle). Ankerverbindungen  Nach Alberts et al, Molekularbiologie der Zelle, 6. Aufl. 2017 |
||||
| Art |
Transmembranes Adhäsionsprotein |
Extrazellulärer Ligand |
Intrazelluläre Verbindung |
Intrazelluläre Adapterproteine |
| Adhärente Verbindung |
Klassische Cadherine |
Cadherin auf Nachbarzelle |
Aktin- filamente |
Catenine (α, β), Vinculin u.a. |
| Desmosomen |
Nichtklassische Cadherine |
Nichtklassische Cadherine auf Nachbarzelle |
Intermediär- filamente |
γ-Catenin, Vinculin u.a. |
| Aktinverknüpfte Zell-Matrix- Verbindungen |
Integrin |
Extrazelluläre Matrixproteine |
Aktin- filamente |
Talin, Vinculin u.a. |
| Hemi- desmosomen |
Integrin, Kollagen (Typ XVII) |
Extrazelluläre Matrixproteine | Intermediär- filamente |
Plektin u.a. |
 Eine intrazelluläre Domäne, welche sich an Elemente des Zytoskeletts (Aktin- und intermediäre Filamente) knüpft,
Eine intrazelluläre Domäne, welche sich an Elemente des Zytoskeletts (Aktin- und intermediäre Filamente) knüpft, eine transmembranale (lipophile) Domäne zur Verankerung in der Zellmembran,
eine transmembranale (lipophile) Domäne zur Verankerung in der Zellmembran,  eine extrazelluläre Domäne, die Kontakt mit einerm identen (homophile Bindung) oder einem unterschiedlichen CAM einer Nachbarzelle (heterophile Bindung) oder mit Komponenten der extrazellulären Matrix aufbaut.
eine extrazelluläre Domäne, die Kontakt mit einerm identen (homophile Bindung) oder einem unterschiedlichen CAM einer Nachbarzelle (heterophile Bindung) oder mit Komponenten der extrazellulären Matrix aufbaut. Cadherine sind Ca++-abhängige
(daher die Bezeichnung) transmembranale Proteine, die für
Zell-Zell-Adhäsion, Zellpolarität, Signaltransduktion und Morphogenese
wichtig sind. Cadherine können homophile interzelluläre Bindungen herstellen.
Cadherine sind Ca++-abhängige
(daher die Bezeichnung) transmembranale Proteine, die für
Zell-Zell-Adhäsion, Zellpolarität, Signaltransduktion und Morphogenese
wichtig sind. Cadherine können homophile interzelluläre Bindungen herstellen. Integrine sind Adhäsione-Heterodimere (sie bestehen aus zwei Komponenten) mit einer Anlagerungsstelle für
RGD (Arg-Gly-Asp) - einer Bindungssequenz, die besonders häufig in
Matrixproteinen vorkommt, z.B. in Fibronektin. Sie verbinden Zellen - z.B. Leukozyten - mit der umgebenden Matrix (Bindung
an spezifische Aminosäuresequenzen in Kollagen, Fibronektin, Laminin)
und kommen außer an
Erythrozyten überall vor. Sie beteiligen sich an der Regulation von
Zellproliferation und Differenzierung (sie "integrieren"
durch extrazelluläre Liganden getriggerte Signale mit Gestaltsänderung,
Bewegung und phagozytotischer Aktivität der Zelle).
Intrazelluläre Signale können die Affinität der Integrine zu ihren
Liganden durch Konformationsänderung erhöhen (inside-out signaling).
Integrine sind Adhäsione-Heterodimere (sie bestehen aus zwei Komponenten) mit einer Anlagerungsstelle für
RGD (Arg-Gly-Asp) - einer Bindungssequenz, die besonders häufig in
Matrixproteinen vorkommt, z.B. in Fibronektin. Sie verbinden Zellen - z.B. Leukozyten - mit der umgebenden Matrix (Bindung
an spezifische Aminosäuresequenzen in Kollagen, Fibronektin, Laminin)
und kommen außer an
Erythrozyten überall vor. Sie beteiligen sich an der Regulation von
Zellproliferation und Differenzierung (sie "integrieren"
durch extrazelluläre Liganden getriggerte Signale mit Gestaltsänderung,
Bewegung und phagozytotischer Aktivität der Zelle).
Intrazelluläre Signale können die Affinität der Integrine zu ihren
Liganden durch Konformationsänderung erhöhen (inside-out signaling). Selektine stellen vorübergehende Verbindungen zwischen bestimmten Zellarten im Blutkreislauf her.
Beispielsweise finden frisch differenziertte Lymphozyten den richtigen
Entwicklungsweg, indem ihr L-Selektin mit Adhäsionsmolekülen an
Endothelzellen in Lymphknoten interagieren. E-Selektin findet sich in der Membranen von Endothelzellen, P-Selektin auf Blutplättchen (platelets), L-Selektin auf Leukozyten. Auf diese Weise kann der Austritt von Leukozyten in das Gewebe (Extravasation) reguliert werden.
Selektine stellen vorübergehende Verbindungen zwischen bestimmten Zellarten im Blutkreislauf her.
Beispielsweise finden frisch differenziertte Lymphozyten den richtigen
Entwicklungsweg, indem ihr L-Selektin mit Adhäsionsmolekülen an
Endothelzellen in Lymphknoten interagieren. E-Selektin findet sich in der Membranen von Endothelzellen, P-Selektin auf Blutplättchen (platelets), L-Selektin auf Leukozyten. Auf diese Weise kann der Austritt von Leukozyten in das Gewebe (Extravasation) reguliert werden. Ig-CAMs (immunoglobulin superfamily cell adhesion molecules) besitzen Ig-ähnliche
Domänen und bilden eine große funktionelle Proteinfamilie, die sowohl
homo- als auch heterophile Bindungen etablieren. Zu ihnen gehören
zahlreiche Proteingruppen, wie ICAMs (interzellulär), NCAMs (neuronal),
VCAMs (vaskulär), PECAMs (Plättchen und Endothelien) usw.
Ig-CAMs (immunoglobulin superfamily cell adhesion molecules) besitzen Ig-ähnliche
Domänen und bilden eine große funktionelle Proteinfamilie, die sowohl
homo- als auch heterophile Bindungen etablieren. Zu ihnen gehören
zahlreiche Proteingruppen, wie ICAMs (interzellulär), NCAMs (neuronal),
VCAMs (vaskulär), PECAMs (Plättchen und Endothelien) usw. der
mechanischen Festigkeit - scheibenförmige Desmosomen (maculae adhaerentes) und gürtelförmige Zonulae adhaerentes (adhering junctions)
z.B. zwischen Epithelzellen (Keratine u.a.), Muskelzellen (Desmin
u.a.). Besonders zahlreich sind Desmosomen in Geweben ausgebildet, die
starker Krafteinwirkung unterworfen sind. Intermediärfilamente
übertragen die Kraft auf das Zytoskelett;
der
mechanischen Festigkeit - scheibenförmige Desmosomen (maculae adhaerentes) und gürtelförmige Zonulae adhaerentes (adhering junctions)
z.B. zwischen Epithelzellen (Keratine u.a.), Muskelzellen (Desmin
u.a.). Besonders zahlreich sind Desmosomen in Geweben ausgebildet, die
starker Krafteinwirkung unterworfen sind. Intermediärfilamente
übertragen die Kraft auf das Zytoskelett;  der Abdichtung des Extrazellulärraums kombiniert mit einem Siebeffekt (Schlussleisten, tight
junctions, s.
der Abdichtung des Extrazellulärraums kombiniert mit einem Siebeffekt (Schlussleisten, tight
junctions, s.  Abbildung unten), oder
Abbildung unten), oder  der Verbindung der Zellinnenräume (Nexus, gap junctions) - das macht den direkten Austausch von Stoffen und elektrischen Ladungen zwischen benachbarten Zellen möglich.
der Verbindung der Zellinnenräume (Nexus, gap junctions) - das macht den direkten Austausch von Stoffen und elektrischen Ladungen zwischen benachbarten Zellen möglich. 
 Abbildung: Verbindungen zwischen Zellen
Abbildung: Verbindungen zwischen Zellen
 Interzellulärer Austausch: Gap junctions
(Nexus, Porengröße ~1,4 nm, Spaltbreite 2-4 nm) liegen in der Nähe der Zellbasis und erlauben den
interzellulären Austausch kleiner Moleküle und Ionen und
wirken auch als "elektrische Brücken", z.B. bei der
Erregungsausbreitung im Herzmuskel. Sie bilden direkte Verbindungen
zwischen dem Zytoplasma zweier benachbarter Zellen (
Interzellulärer Austausch: Gap junctions
(Nexus, Porengröße ~1,4 nm, Spaltbreite 2-4 nm) liegen in der Nähe der Zellbasis und erlauben den
interzellulären Austausch kleiner Moleküle und Ionen und
wirken auch als "elektrische Brücken", z.B. bei der
Erregungsausbreitung im Herzmuskel. Sie bilden direkte Verbindungen
zwischen dem Zytoplasma zweier benachbarter Zellen ( Abbildung).
Abbildung).  Abdichtung und Siebung: Tight junctions
(Schlussleisten, zonulae occludentes) grenzen apikale und basolaterale Membran voneinander ab. Dabei beschränken sie die Seitwärtsbewegung von Membranmolekülen auf ein
apikales und ein basolaterales Kompartiment. Diese "Zaunfunktion"
erhält die Polarität von Zellen, deren Membranbestandteile sich
zwischen apikalem und balolateralem Abschnitt (
Abdichtung und Siebung: Tight junctions
(Schlussleisten, zonulae occludentes) grenzen apikale und basolaterale Membran voneinander ab. Dabei beschränken sie die Seitwärtsbewegung von Membranmolekülen auf ein
apikales und ein basolaterales Kompartiment. Diese "Zaunfunktion"
erhält die Polarität von Zellen, deren Membranbestandteile sich
zwischen apikalem und balolateralem Abschnitt ( Abbildung) stark unterscheiden und
verschiedene Funktionen (gerichteter Stofftransport!) erfüllen.
Abbildung) stark unterscheiden und
verschiedene Funktionen (gerichteter Stofftransport!) erfüllen.
 Abbildung: Tight junctions und Claudin
Abbildung: Tight junctions und Claudin
 (Menschen haben 26 verschiedene Claudin-Gene), Occludin, Cadherin,
Cingulin, Catenin.
(Menschen haben 26 verschiedene Claudin-Gene), Occludin, Cadherin,
Cingulin, Catenin. 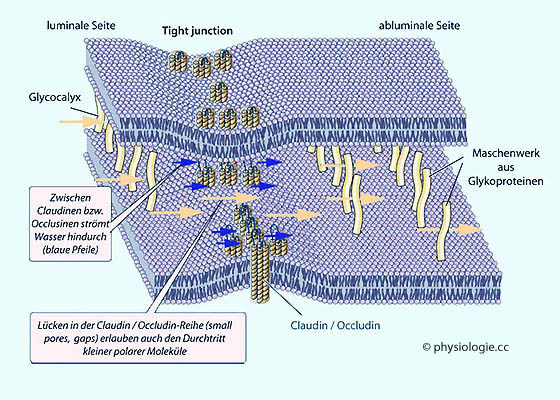
 Abbildung: Tight junction
Abbildung: Tight junction
 Junctional adhesion molecules und Tricellulin.
Diese Moleküle haben intra-, trans- und extrazelluläre Domänen und
übernehmen spezifische Rollen bei der Abdichtung von
Schlussleistensystemen, indem sie mit Hilfe von Gerüstproteinen (scaffold proteins) untereinander und mit Proteinen des Zytoskeletts (z.B. Aktinfilamenten) zusammenwirken.
Junctional adhesion molecules und Tricellulin.
Diese Moleküle haben intra-, trans- und extrazelluläre Domänen und
übernehmen spezifische Rollen bei der Abdichtung von
Schlussleistensystemen, indem sie mit Hilfe von Gerüstproteinen (scaffold proteins) untereinander und mit Proteinen des Zytoskeletts (z.B. Aktinfilamenten) zusammenwirken. Anheftung, Kontakt, Festigung: Gürteldesmosomen (zonulae adhaerentes), Streifendesmosomen (fasciae adhaerentes) und Punktdesmosomen (puncta adhaerentia) gehören zur Gruppe der Adhäsionsverbindungen (adhering junctions). Solche
mechanischen Verstärkungen finden sich zum Beispiel zwischen
Epithelzellen. Sie stabilisieren interzelluläre Kontakte und spielen auch eine Rolle für
die die Übertragung von Signalen von einer Zelle auf die andere, für die Erhaltung der Polarität von Zellen (apikal - basolateral), sowie in der Embryogenese.
Anheftung, Kontakt, Festigung: Gürteldesmosomen (zonulae adhaerentes), Streifendesmosomen (fasciae adhaerentes) und Punktdesmosomen (puncta adhaerentia) gehören zur Gruppe der Adhäsionsverbindungen (adhering junctions). Solche
mechanischen Verstärkungen finden sich zum Beispiel zwischen
Epithelzellen. Sie stabilisieren interzelluläre Kontakte und spielen auch eine Rolle für
die die Übertragung von Signalen von einer Zelle auf die andere, für die Erhaltung der Polarität von Zellen (apikal - basolateral), sowie in der Embryogenese.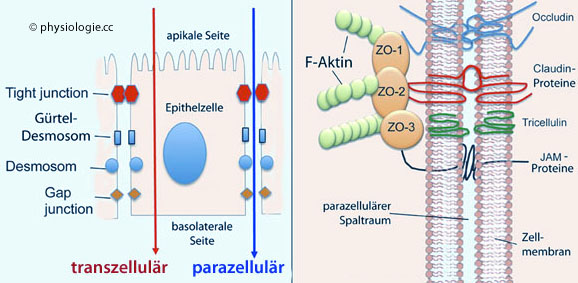
 Abbildung: Kontakt zwischen Epithelzellen
Abbildung: Kontakt zwischen Epithelzellen
 Die Mehrzahl der klinisch bedeutsamen Medikamente greift an Rezeptoren an: Agonisten fördern, Antagonisten hemmen den jeweiligen physiologischen Vorgang der Signaltransduktion.
Die Mehrzahl der klinisch bedeutsamen Medikamente greift an Rezeptoren an: Agonisten fördern, Antagonisten hemmen den jeweiligen physiologischen Vorgang der Signaltransduktion.  So werden ß-Agonisten zur Entspannung der Gebärmutter (Tokolyse) oder bei asthma bronchiale eingesetzt,
So werden ß-Agonisten zur Entspannung der Gebärmutter (Tokolyse) oder bei asthma bronchiale eingesetzt, 
 ß-Blocker (Antagonisten) bei Bluthochdruck, Herzinsuffizienz, Rhythmusstörungen und Migräne.
ß-Blocker (Antagonisten) bei Bluthochdruck, Herzinsuffizienz, Rhythmusstörungen und Migräne. 
 Rezeptormoleküle in der Zellmembran reagieren auf Schlüsselreize und lösen zelluläre Reaktionen aus. Zellen beeinflussen einander
über Veränderungen des Membranpotentials oder der Konzentration
intrazellulärer Signalstoffe. Es gibt in der Zellmembran verankerte (extrazelluläre, transmembranale, intrazelluläre Domäne; Angrifspunkt für Proteo- / Peptidhormone, Neurotransmitter, Katecholamine; bewirken
Signalverstärkung und wirken rasch) und intrazelluläre Rezeptoren (für fettlösliche Hormone; wirken über Transkription und Translation) Rezeptormoleküle in der Zellmembran reagieren auf Schlüsselreize und lösen zelluläre Reaktionen aus. Zellen beeinflussen einander
über Veränderungen des Membranpotentials oder der Konzentration
intrazellulärer Signalstoffe. Es gibt in der Zellmembran verankerte (extrazelluläre, transmembranale, intrazelluläre Domäne; Angrifspunkt für Proteo- / Peptidhormone, Neurotransmitter, Katecholamine; bewirken
Signalverstärkung und wirken rasch) und intrazelluläre Rezeptoren (für fettlösliche Hormone; wirken über Transkription und Translation) Rezeptoren
werden nach verschiedenen Kriterien eingeteilt (Struktur, Position,
Wirkungsmechanismus, Signalweg): Enzymatisch aktive Rezeptoren
(z.B. Insulinrezeptor), Ionenkanäle (z.B. Glutamatrezeptor),
G-Protein-gekoppelte (z.B. muskarinischer Rezeptor), nukleäre (z.B. Östrogenrezeptor). Die Bindung einen "agonistischen"
Signalstoffs an einen Rezeptor führt zu Konformationsänderungen, die
Ionen durch die Membran treten lassen, second messenger freisetzen, Enzyme aktivieren und/oder die Ablesung von Genen (in)aktivieren. Bindung eines Antagonisten blockiert den Rezeptorweg Rezeptoren
werden nach verschiedenen Kriterien eingeteilt (Struktur, Position,
Wirkungsmechanismus, Signalweg): Enzymatisch aktive Rezeptoren
(z.B. Insulinrezeptor), Ionenkanäle (z.B. Glutamatrezeptor),
G-Protein-gekoppelte (z.B. muskarinischer Rezeptor), nukleäre (z.B. Östrogenrezeptor). Die Bindung einen "agonistischen"
Signalstoffs an einen Rezeptor führt zu Konformationsänderungen, die
Ionen durch die Membran treten lassen, second messenger freisetzen, Enzyme aktivieren und/oder die Ablesung von Genen (in)aktivieren. Bindung eines Antagonisten blockiert den Rezeptorweg Interzelluläre Kontakte dienen der mechanischen Festigkeit und Anheftung (Desmosomen) sowie Verbindungen zwischen Zellen und extrazellulärer Matrix (Integrine etc); der Abdichtung (tight junctions: Permeabilität, Siebeffekt, selektive Diffusion, Erhaltung der Zellpolarität - apikal / basolateral: "Zaunfunktion"); oder der Verbindung der Zellinnenräume (gap junctions mit Connexonen: Elektrische Brücke, Stoff- und Informationsaustausch). Signalstoffe, Membranpotential, pH-Wert und Ca++-Konzentration beeinflussen die Durchlässigkeit von gap junctions Interzelluläre Kontakte dienen der mechanischen Festigkeit und Anheftung (Desmosomen) sowie Verbindungen zwischen Zellen und extrazellulärer Matrix (Integrine etc); der Abdichtung (tight junctions: Permeabilität, Siebeffekt, selektive Diffusion, Erhaltung der Zellpolarität - apikal / basolateral: "Zaunfunktion"); oder der Verbindung der Zellinnenräume (gap junctions mit Connexonen: Elektrische Brücke, Stoff- und Informationsaustausch). Signalstoffe, Membranpotential, pH-Wert und Ca++-Konzentration beeinflussen die Durchlässigkeit von gap junctions |
