

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert


 Galle: Sekretion,
Transport, Funktion
Galle: Sekretion,
Transport, Funktion
 Bilirubin: bilis = Galle, ruber = rot
Bilirubin: bilis = Galle, ruber = rot| Die
von der Leber sezernierte Gallenflüssigkeit ("Lebergalle") liefert
gallensaure Salze für die Fettverdauung (emulgierende Wirkung) und
entfernt durch Konjugation wasserlöslich gemachte Stoffe, z.B.
Gallenfarbstoffe (Bilirubin aus dem Abbau des Hämoglobins). Die Gallenblase kann bis zu ~50 ml Volumen fassen. Durchschnittlich 80% des Gallensekrets stammt aus Hepatozyten (kanalikulär). Dieser Gallenfluss hat einen basalen Anteil, kann sich durch (parasympathische) Anregung erhöhen. 20% des Gallensekrets stammt aus Zellen der Gallengänge (duktulär). Durch Rückresorption von Flüssigkeit aus der Gallenblase kann die Konzentration der Gallensäuren bis 10-fach konzentriert werden ("Blasengalle"). Der hydrostatische Druck im Gallengangsystem beträgt etwa 10 mmHg. Die Füllung der Gallenblase (Speicherung) wird durch pankreatisches Polypeptid (PP), vasoaktives intestinales Peptid (VIP) und Somatostatin begünstigt (Relaxation der Gallenblasenwand), die Kontraktion (Entleerung) durch Cholezystokinin und parasympathische Anregung. |
Allgemeines
 Gallenflüssigkeit: Bildung und Zusammensetzung
Gallenflüssigkeit: Bildung und Zusammensetzung  Gallenblase
Gallenblase  Steuerung
Steuerung  Enterohepatischer Kreislauf
Enterohepatischer Kreislauf  Bilirubin
Bilirubin
 Core messages
Core messages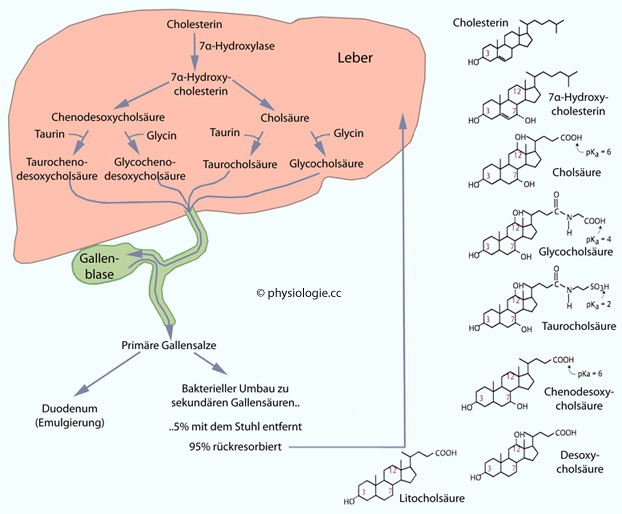
 Abbildung: Gallensäuren
Abbildung: Gallensäuren
| Zusammensetzung von Leber- und Blasengalle Gerundete Werte Nach Guyton and Hall, Textbook of Medical Physiology, 15th ed. Elsevier 2026 |
||
| Substanz |
Lebergalle |
Blasengalle |
| Wasser |
97,5 g/dl |
92 g/dl |
| Gallensalze |
1,1 g/dl |
6 g/dl |
| Bilirubin |
0,04 g/dl |
0,3 g/dl |
| Cholesterin |
0,1 g/dl |
0,3-0,9 g/dl |
| Fettsäuren |
0,12 g/dl | 0,3-1,2 g/dl |
| Lezithin |
0,04 g/dl | 0,3 g/dl |
| Natriumionen |
145 meq/l |
130 meq/l |
| Kaliumionen |
5 meq/l | 12 meq/l |
| Calciumionen |
5 meq/l | 23 meq/l |
| Chloridionen |
100 meq/l | 25 meq/l |
| Bicarbonationen |
28 meq/l | 10 meq/l |
 Abbildung).
Abbildung). 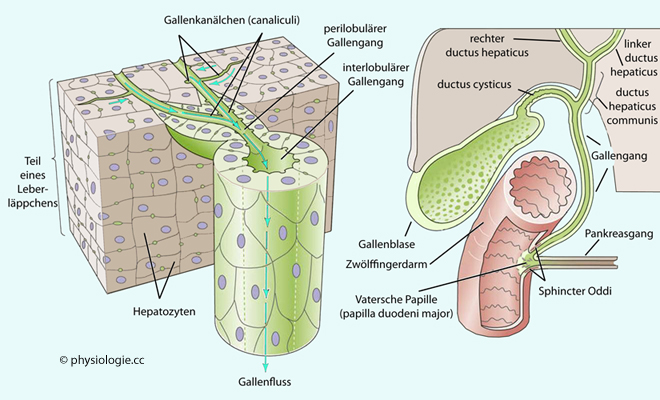
 Abbildung: Gallengangsystem
Abbildung: Gallengangsystem in den Zwölffingerdarm, wo ein
glattmuskulärer Ringmuskel (sphincter Oddi
in den Zwölffingerdarm, wo ein
glattmuskulärer Ringmuskel (sphincter Oddi ) den Zufluss von
Galle und Pankreassekret in das Duodenum kontrolliert. CCK kontrahiert die Gallenblase und relaxiert den Sphincter, dieses Muster erlaubt den Zufluss von Galle in den Darm
) den Zufluss von
Galle und Pankreassekret in das Duodenum kontrolliert. CCK kontrahiert die Gallenblase und relaxiert den Sphincter, dieses Muster erlaubt den Zufluss von Galle in den Darm
 Abbildung), resorbiert und zur Leber retourniert.
Abbildung), resorbiert und zur Leber retourniert.

 Abbildung: Synthese der Gallensäuren
Abbildung: Synthese der Gallensäuren
 Mechanisch
über die Kontraktionen der Gallenblase (Transport bis zum sphincter
Oddi) sowie die Peristaltik des Dünndarms (Transport bis zum terminalen
Ileum)
Mechanisch
über die Kontraktionen der Gallenblase (Transport bis zum sphincter
Oddi) sowie die Peristaltik des Dünndarms (Transport bis zum terminalen
Ileum) Chemisch
über energieverbrauchenden Transport im terminalen Ileum (Resorption
aus dem Darm) sowie in den Hepatozyten (Aufnahme aus den Sinusoiden).
Chemisch
über energieverbrauchenden Transport im terminalen Ileum (Resorption
aus dem Darm) sowie in den Hepatozyten (Aufnahme aus den Sinusoiden). Gallengänge (duktuläre Komponente)
Gallengänge (duktuläre Komponente) Im Durchschnitt kommt Lebergalle zu 4/5 (mindestens zu 60%) aus Hepatozyten (kanalikulär), 1/5 (bis zu 40%) stammt sie aus Gallengangsepithelien (duktulär).
Im Durchschnitt kommt Lebergalle zu 4/5 (mindestens zu 60%) aus Hepatozyten (kanalikulär), 1/5 (bis zu 40%) stammt sie aus Gallengangsepithelien (duktulär). Lebergalle (A-Galle, Farbe: gelb) Werte nach verschiedenen Quellen kompiliert |
|||
| Na+ |
~150 mM |
Gallensalze (Cholat) |
25 mM |
| K+ | ~4,5 mM |
Phospholipide (z.B. Lezithin) |
bis ~8 g/l |
| Ca++ | ~4 mM |
Cholesterin |
~4 mM (110 mg/dl) |
| Cl- |
80-100 mM |
Bilirubin |
~1 mM (100 mg/dl) |
| pH |
7,4±0,6 |
Enzyme, Hormone, Medikamente... | Spuren |
 Abbildung).
Abbildung).
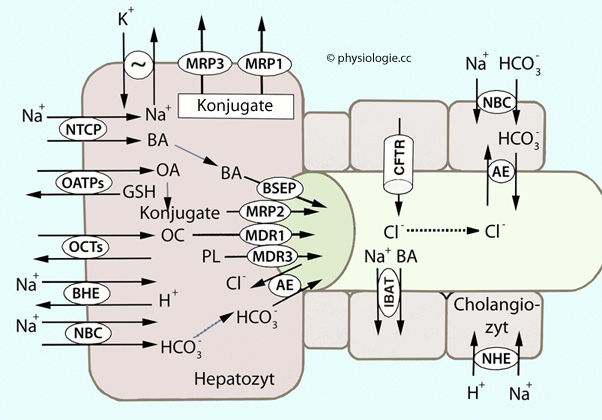
 Abbildung: An der Bildung der Galle beteiligte Transporter
Abbildung: An der Bildung der Galle beteiligte Transporter
 Abbildung):
Abbildung):
 Abbildung: Komponenten der Cholerese
Abbildung: Komponenten der Cholerese
 Der konstante (gallensäureunabhängige, basale) Anteil (gelb in der
Der konstante (gallensäureunabhängige, basale) Anteil (gelb in der  Abbildung oben) wird durch die Sekretion kleiner organischer Moleküle angetrieben
Abbildung oben) wird durch die Sekretion kleiner organischer Moleküle angetrieben Die variable Komponente des Sekretflusses steigt mit der Sekretion von Gallensäuren linear an (gallensäureabhängig,
blau in der
Die variable Komponente des Sekretflusses steigt mit der Sekretion von Gallensäuren linear an (gallensäureabhängig,
blau in der  Abbildung). Leberzellen bilden aus Cholesterin
"primäre" Gallensäuren (Cholsäure, Desoxycholsäure); sekundäre
Gallenäuren entstehen im Darm (distales Ileum, Colon) durch bakterielle
Dehydroxylierung, werden rückresorbiert und können konjugiert werden
(
Abbildung). Leberzellen bilden aus Cholesterin
"primäre" Gallensäuren (Cholsäure, Desoxycholsäure); sekundäre
Gallenäuren entstehen im Darm (distales Ileum, Colon) durch bakterielle
Dehydroxylierung, werden rückresorbiert und können konjugiert werden
( Abbildung oben: "Synthese der Gallensäuren").
Abbildung oben: "Synthese der Gallensäuren"). frisch synthetisierte primäre (Cholsäure, Chenodesoxycholsäure) bzw. deren Salze, sowie
frisch synthetisierte primäre (Cholsäure, Chenodesoxycholsäure) bzw. deren Salze, sowie über
den enterohepatischen Kreislauf rezirkulierte, durch bakterielle
Dehydroxylierung eines Teils der primären Gallensäuren entstandene sekundäre Gallensäuren (Desoxycholsäure, Lithocholsäure) bzw. deren Salze
auf, konjugieren diese mit den Aminosäuren Taurin oder Glyzin, machen
sie so wasserlöslich (Taurocholat, Glykocholat) und sezernieren sie
primär-aktiv
(ATP-Verbrauch).
über
den enterohepatischen Kreislauf rezirkulierte, durch bakterielle
Dehydroxylierung eines Teils der primären Gallensäuren entstandene sekundäre Gallensäuren (Desoxycholsäure, Lithocholsäure) bzw. deren Salze
auf, konjugieren diese mit den Aminosäuren Taurin oder Glyzin, machen
sie so wasserlöslich (Taurocholat, Glykocholat) und sezernieren sie
primär-aktiv
(ATP-Verbrauch). 
 Abbildung: Modell eines Gallengangsbaums
Abbildung: Modell eines Gallengangsbaums
 Abbildung
zeigt ein Modell der Aufzweigung von intrahepatischen Gallengängen.
Während die Cholangiozyten großer Gallengänge über Sekretinrezeptoren
verfügen und apikale CFTR-Chloridkanäle exprimieren, die auf endokrine Signale mit
Sekretion reagieren (und bis zu 40% des Gallensekretvolumens produzieren
können), exprimieren die kleinen Gallengänge (unter 15 µm Durchmesser)
diese Komponenten nicht, können hingegen bei Verletzung oder Vergiftung
größerer Gänge proliferieren und beschädugte oder vergiftete größere
Gallengänge ersetzen.
Abbildung
zeigt ein Modell der Aufzweigung von intrahepatischen Gallengängen.
Während die Cholangiozyten großer Gallengänge über Sekretinrezeptoren
verfügen und apikale CFTR-Chloridkanäle exprimieren, die auf endokrine Signale mit
Sekretion reagieren (und bis zu 40% des Gallensekretvolumens produzieren
können), exprimieren die kleinen Gallengänge (unter 15 µm Durchmesser)
diese Komponenten nicht, können hingegen bei Verletzung oder Vergiftung
größerer Gänge proliferieren und beschädugte oder vergiftete größere
Gallengänge ersetzen. Abbildung) liefert eine konstante Flussrate (duktuläre Produktion)
- bei physiologischem Verdauungsablauf ~30% der Gesamtproduktion an
Lebergalle. Die Gallenblase speichert und konzentriert
Gallenflüssigkeit und pumpt sie während des Verdauungsvorgangs in den
Dünndarm.
Abbildung) liefert eine konstante Flussrate (duktuläre Produktion)
- bei physiologischem Verdauungsablauf ~30% der Gesamtproduktion an
Lebergalle. Die Gallenblase speichert und konzentriert
Gallenflüssigkeit und pumpt sie während des Verdauungsvorgangs in den
Dünndarm.
 Abbildung: Funktion und Steuerung eines Cholangiozyten (=Gallengangs-Epithelzelle)
Abbildung: Funktion und Steuerung eines Cholangiozyten (=Gallengangs-Epithelzelle)
| Die Chloridkonzentration ist in der Blasengalle niedriger als in der Lebergalle |
 Blasengalle (B-Galle, Farbe: grün-braun)  Werte nach verschiedenen Quellen kompiliert |
|||
| Na+ | 200-300 mM | Gallensalze | ~300 mM |
| K+ | 10-15 mM | Phospholipide (z.B. Lezithin) | >30 g/l |
| Ca++ | 10-20 mM | Cholesterin | ~20 mM (600 mg/dl) |
| Cl- |
~5 mM | Bilirubin | ~10 mM (1000 mg/dl) |
| pH |
6,5±0,9 |
Enzyme, Hormone, Medikamente... | Spuren |

 Abbildung: Isotone Flüssigkeitsresorption durch das Gallenblasenepithel
Abbildung: Isotone Flüssigkeitsresorption durch das Gallenblasenepithel
 Abbildung): Auch die Epithelzellen
in der Wand der Gallenblase sind gegeneinander mit tight junctions
abgedichtet, gelöste Stoffe können parazellulär nur schwer passieren.
Abbildung): Auch die Epithelzellen
in der Wand der Gallenblase sind gegeneinander mit tight junctions
abgedichtet, gelöste Stoffe können parazellulär nur schwer passieren.  An der apikalen (gallenseitigen) Membran werden Natriumionen mittels
eines Natrium-Wasserstoffionen-Exchanger (NHE) elektroneutral gegen H+, und Chlorid gegen Bicarbonat mittels Cl-/HCO3--Exchanger
getauscht (der luminale pH-Wert sinkt, weil ersterer Mechanismus etwas
rascher arbeitet). Die apikale Membran enthält Aquaporin-8.
An der apikalen (gallenseitigen) Membran werden Natriumionen mittels
eines Natrium-Wasserstoffionen-Exchanger (NHE) elektroneutral gegen H+, und Chlorid gegen Bicarbonat mittels Cl-/HCO3--Exchanger
getauscht (der luminale pH-Wert sinkt, weil ersterer Mechanismus etwas
rascher arbeitet). Die apikale Membran enthält Aquaporin-8. Die basolaterale (blutseitige, sinusoidale) Membran verfügt über besonders zahlreiche Na-K-ATPasen (transportieren 3 Na+ gegen 2 K+), Kalium- und Chloridkanäle sowie Aquaporin-1, das auch in der apikalen Membran vorkommt (
Die basolaterale (blutseitige, sinusoidale) Membran verfügt über besonders zahlreiche Na-K-ATPasen (transportieren 3 Na+ gegen 2 K+), Kalium- und Chloridkanäle sowie Aquaporin-1, das auch in der apikalen Membran vorkommt ( Abbildung).
Abbildung).  ,
welche den Zustrom in die, und Abstrom aus der Gallenblase vom / in den
ductus cysticus reguliert. Durch diesen Verschlussmechanismus wird z.B.
ein Austreten von Gallenflüssigkeit bei Druckerhöhung im Bauchraum
verhindert.
,
welche den Zustrom in die, und Abstrom aus der Gallenblase vom / in den
ductus cysticus reguliert. Durch diesen Verschlussmechanismus wird z.B.
ein Austreten von Gallenflüssigkeit bei Druckerhöhung im Bauchraum
verhindert. s. dort).
s. dort).| Sekretin regt die Bildung bicarbonatreichen Gallesekrets an |
 (Anwendung
zum Weitertransport von Gallengrieß).
(Anwendung
zum Weitertransport von Gallengrieß).  Cholekinetika
Cholekinetika  sind Stoffe, welche die Entleerung der Gallenblase fördern; Spasmolytika
können den Effekt unterstützen (Senkung des Abflusswiderstandes). Der
wichtigste physiologische Anreger der Gallenblasenmotorik ist Cholezystokinin (CCK),
das seinen Namen dieser Wirkung verdankt (chole = Galle, cysto = Blase,
kinein = bewegen).
sind Stoffe, welche die Entleerung der Gallenblase fördern; Spasmolytika
können den Effekt unterstützen (Senkung des Abflusswiderstandes). Der
wichtigste physiologische Anreger der Gallenblasenmotorik ist Cholezystokinin (CCK),
das seinen Namen dieser Wirkung verdankt (chole = Galle, cysto = Blase,
kinein = bewegen). 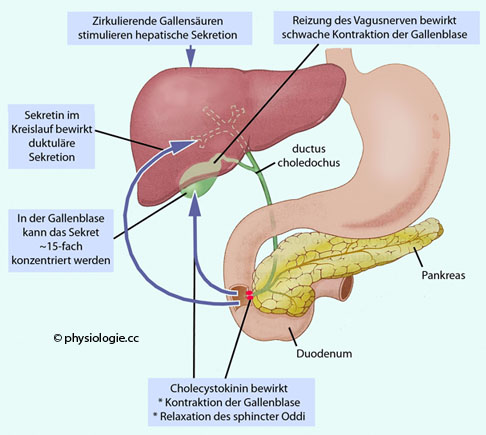
 Abbildung: Dynamik des Gallensystems
Abbildung: Dynamik des Gallensystems
 Füllung (Relaxation): Pankreatisches Polypeptid (PP), vasoaktives intestinales Peptid (VIP) und Somatostatin
stabilisieren das Membranpotential der Muskelzellen in der Wand der
Gallenblase; dadurch kann sie sich passiv füllen. Die Sekretion dieser
Hormone wird im Zug der Verdauungstätigkeit angeregt: PP bei
Anwesenheit von Peptiden im Darm, VIP durch fettreiche Nahrung, und
Somatostatin durch Gastrin und hohe Proteinkonzentration im Magen. FGF19 entspannt die Wand der Gallenblase (vgl. oben).
Füllung (Relaxation): Pankreatisches Polypeptid (PP), vasoaktives intestinales Peptid (VIP) und Somatostatin
stabilisieren das Membranpotential der Muskelzellen in der Wand der
Gallenblase; dadurch kann sie sich passiv füllen. Die Sekretion dieser
Hormone wird im Zug der Verdauungstätigkeit angeregt: PP bei
Anwesenheit von Peptiden im Darm, VIP durch fettreiche Nahrung, und
Somatostatin durch Gastrin und hohe Proteinkonzentration im Magen. FGF19 entspannt die Wand der Gallenblase (vgl. oben). Kontraktion (Cholerese): Fettreiche Nahrung im Duodenum löst aber dann - innerhalb von ~2 Minuten - Gallenblasenkontraktion aus, vermittelt durch Cholezystokinin
Kontraktion (Cholerese): Fettreiche Nahrung im Duodenum löst aber dann - innerhalb von ~2 Minuten - Gallenblasenkontraktion aus, vermittelt durch Cholezystokinin  . Auch der Parasympathikus regt die Kontraktion (muskarinerg) an. 2-6 Kontraktionen werden pro Minute in der glatten Muskulatur der Blasenwand ausgelöst; der maximale Druck in der Gallenblase beträgt 25-30 mmHg (~4 kPa). Der Druck überwindet den Strömungswiderstand des ductus cysticus und des 3-10 cm langen ductus choledochus
. Auch der Parasympathikus regt die Kontraktion (muskarinerg) an. 2-6 Kontraktionen werden pro Minute in der glatten Muskulatur der Blasenwand ausgelöst; der maximale Druck in der Gallenblase beträgt 25-30 mmHg (~4 kPa). Der Druck überwindet den Strömungswiderstand des ductus cysticus und des 3-10 cm langen ductus choledochus  , mit ihrem Außendurchmesser von nur ~2 mm.
, mit ihrem Außendurchmesser von nur ~2 mm. Abbildung).
Abbildung).| Der
Gallensäurepool rezirkuliert mehrmals täglich. Neusynthese reicht nicht
aus, um eine blockierte Rückresorption der Gallensäuren zu kompensieren |

 Abbildung: Gallensäuren - Pool und enterohepatisches Recycling
Abbildung: Gallensäuren - Pool und enterohepatisches Recycling
| Enterohepatisches
Recycling von Gallensäuren: Leberzelle → Gallengänge → Dünndarm →
Enterozyt → Pfortader → Lebersinusoide → Leberzelle |
 Die basolaterale (sinusoidale) Membran verfügt dazu über ein natriumgekoppeltes Transporterprotein (NTCP: Natrium-taurocholate cotransporting peptide) und natriumunabhängige organische-Anionen-Transporter (OATP: Organic anion transport protein)
Die basolaterale (sinusoidale) Membran verfügt dazu über ein natriumgekoppeltes Transporterprotein (NTCP: Natrium-taurocholate cotransporting peptide) und natriumunabhängige organische-Anionen-Transporter (OATP: Organic anion transport protein)  Auf der apikalen (kanalikulären) Seite bewirken mindestens zwei
ATP-abhängige Systeme den Export in die Gallenflüssigkeit, genannt BSEP
(Bile salt export pump) und MRP2 (Multidrug resistance-associated protein 2) (
Auf der apikalen (kanalikulären) Seite bewirken mindestens zwei
ATP-abhängige Systeme den Export in die Gallenflüssigkeit, genannt BSEP
(Bile salt export pump) und MRP2 (Multidrug resistance-associated protein 2) ( s. dort).
s. dort).  s. auch dort
s. auch dort ist
der primäre Gallenfarbstoff. Er entsteht aus dem Abbau von Hämoglobin
durch Zellen des retikulo-endothelialen Systems - insbesondere in der Milz - aus gealterten Erythrozyten (~80%) sowie (20%) aus anderen Quellen, wie hepatischen Enzymsystemen (P450 etc). Bilirubin
ist wasserunlöslich; durch Bindung an Plasmaprotein (vorwiegend
Albumin) wird es löslich und transportfähig. Normalerweise liegt
Bilirubin im Blut zum Großteil in unkonjugierter ("indirekter") Form
vor, also proteingebunden.
ist
der primäre Gallenfarbstoff. Er entsteht aus dem Abbau von Hämoglobin
durch Zellen des retikulo-endothelialen Systems - insbesondere in der Milz - aus gealterten Erythrozyten (~80%) sowie (20%) aus anderen Quellen, wie hepatischen Enzymsystemen (P450 etc). Bilirubin
ist wasserunlöslich; durch Bindung an Plasmaprotein (vorwiegend
Albumin) wird es löslich und transportfähig. Normalerweise liegt
Bilirubin im Blut zum Großteil in unkonjugierter ("indirekter") Form
vor, also proteingebunden. 
 Abbildung: Bilirubinausscheidung
Abbildung: Bilirubinausscheidung
 Eisen (das von Transferrin aufgenommen wird),
Eisen (das von Transferrin aufgenommen wird),  Globin (dessen Aminosäuren wiederverwertet werden) und
Globin (dessen Aminosäuren wiederverwertet werden) und  Häm. Dieses wird - nach Öffnen der Ringverbindung des Hämoglobins zu vier Pyrrolkernen - zu Biliverdin und rasch weiter zu Bilirubin umgewandelt.
Häm. Dieses wird - nach Öffnen der Ringverbindung des Hämoglobins zu vier Pyrrolkernen - zu Biliverdin und rasch weiter zu Bilirubin umgewandelt.  Bilirubin (Serum, Plasma)
Bilirubin (Serum, Plasma)
 Zum Bilirubinspiegel bei Neugeborenen / Kindern s. dort
Zum Bilirubinspiegel bei Neugeborenen / Kindern s. dort
 Abbildung: Bilirubinstoffwechsel
Abbildung: Bilirubinstoffwechsel
 elektrogene Bilirubintranslokase
elektrogene Bilirubintranslokase
 mittels Austausch gegen Chloiridionen (ohne Natrium; organischer Anionentransporter OATP-1)
mittels Austausch gegen Chloiridionen (ohne Natrium; organischer Anionentransporter OATP-1)
 elektroneutraler Transport
elektroneutraler Transport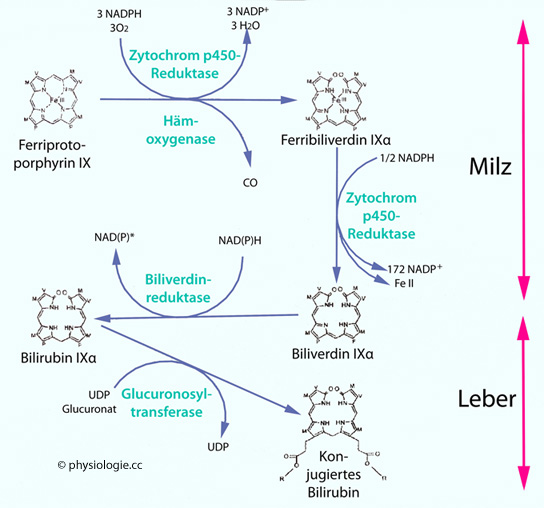
 Abbildung: Konversion von Häm (Ferriprotoporphyrin IX) zu Bilirubin IXα
Abbildung: Konversion von Häm (Ferriprotoporphyrin IX) zu Bilirubin IXα vgl. dort
vgl. dort
 80% mit Glukuronat
80% mit Glukuronat
 10% mit Sulfat
10% mit Sulfat
 10% mit anderen Begleitstoffen
10% mit anderen Begleitstoffen mittels aktiven Transports in die Galle: Der organische
Aniontransporter MRP2 (Multidrug resistance-associated protein 2 - ein
Mitglied der ATP-binding cassette-Familie) tut dies unter ATP-Verbrauch
mittels aktiven Transports in die Galle: Der organische
Aniontransporter MRP2 (Multidrug resistance-associated protein 2 - ein
Mitglied der ATP-binding cassette-Familie) tut dies unter ATP-Verbrauch übergeführt und mit dem Stuhl ausgeschieden (40-280 mg/d). Am Bilirubinabbau im Darm ist die Darmflora beteiligt.
übergeführt und mit dem Stuhl ausgeschieden (40-280 mg/d). Am Bilirubinabbau im Darm ist die Darmflora beteiligt. Mukoviszidose
(=zystische Fibrose) führt wegen der gestörten Leber- und
Gallenwegsfunktion (s. oben) zu Leberzirrhose und Gallensteinen bei
erwachsenen Patienten.
Mukoviszidose
(=zystische Fibrose) führt wegen der gestörten Leber- und
Gallenwegsfunktion (s. oben) zu Leberzirrhose und Gallensteinen bei
erwachsenen Patienten.  Die hohe
Cholesterinkonzentration (10-16 mM) der Blasengalle kann zu
Gallensteinbildung führen. Der Anteil der Bevölkerung
mit Gallensteinen beträgt bei uns mehr als 10%; meistens (80-90%) handelt
es sich um Cholesterinsteine, beim Rest vor allem um Pigmentsteine.
Die hohe
Cholesterinkonzentration (10-16 mM) der Blasengalle kann zu
Gallensteinbildung führen. Der Anteil der Bevölkerung
mit Gallensteinen beträgt bei uns mehr als 10%; meistens (80-90%) handelt
es sich um Cholesterinsteine, beim Rest vor allem um Pigmentsteine. Steigt der Bilirubinspiegel
im Blut (Normalwert: ≤1 mg/dl Plasma), kann Gelbsucht (Ikterus
Steigt der Bilirubinspiegel
im Blut (Normalwert: ≤1 mg/dl Plasma), kann Gelbsucht (Ikterus  , jaundice)
auftreten.
, jaundice)
auftreten. Übermäßiger Hämoglobinabbau (z.B. Hämolyse) führt zu prähepatischer,
Übermäßiger Hämoglobinabbau (z.B. Hämolyse) führt zu prähepatischer,  ein Defekt in den
Leberzellen (Störung von Transport, Konjugation oder Sekretion von Bilirubin) zu intrahepatischer,
ein Defekt in den
Leberzellen (Störung von Transport, Konjugation oder Sekretion von Bilirubin) zu intrahepatischer,  Abflusshindernis in den Gallenwegen (Gallengangsverschluss) zu
posthepatischer Form.
Abflusshindernis in den Gallenwegen (Gallengangsverschluss) zu
posthepatischer Form.  Sind die ableitenden Gallenwege verlegt (z.B. durch einen
Gallenstein), kann Bilirubin nicht mehr in den Darm übertreten, es tritt ein posthepatischer Ikterus auf.
Sind die ableitenden Gallenwege verlegt (z.B. durch einen
Gallenstein), kann Bilirubin nicht mehr in den Darm übertreten, es tritt ein posthepatischer Ikterus auf.  Gallenpflichtige Stoffe (Bilirubin, Gallensäuren, Cholesterin) stauen
sich zurück, ihre Plasmakonzentration steigt an.
Gallenpflichtige Stoffe (Bilirubin, Gallensäuren, Cholesterin) stauen
sich zurück, ihre Plasmakonzentration steigt an.  Die Konzentration von Urobilinogen
sinkt hingegen im Blutplasma, weil Bilirubin nicht mehr in den Darm
gelangt und dem bakteriellen Abbau zu Urobilinogen nicht mehr zugeführt
wird. So gelangt auch kein Urobilinogen mehr (via enterohepatischen Kreislauf) in das Blut.
Die Konzentration von Urobilinogen
sinkt hingegen im Blutplasma, weil Bilirubin nicht mehr in den Darm
gelangt und dem bakteriellen Abbau zu Urobilinogen nicht mehr zugeführt
wird. So gelangt auch kein Urobilinogen mehr (via enterohepatischen Kreislauf) in das Blut.

 Die Leber sezerniert im Schnitt 0,7 l isotone Gallenflüssigkeit pro Tag; Leberzellen produzieren 4/5 (anregbar durch Choleretika: kanalikuläre Sekretion, bestehend aus einem konstanten und einem gallensäureabhängigen Anteil), Gallengangsepithelien 1/5 (duktuläre Sekretion). Natrium und Wasser wandern parazellulär in das Lumen, Chlorid wird apikal sezerniert. Sekretin, Glucagon,
VIP, GRP fördern die Sekretion, Somatostatin hemmt sie. Sekretin erhöht
die Bicarbonatkonzentration bis auf ~75 mM Die Leber sezerniert im Schnitt 0,7 l isotone Gallenflüssigkeit pro Tag; Leberzellen produzieren 4/5 (anregbar durch Choleretika: kanalikuläre Sekretion, bestehend aus einem konstanten und einem gallensäureabhängigen Anteil), Gallengangsepithelien 1/5 (duktuläre Sekretion). Natrium und Wasser wandern parazellulär in das Lumen, Chlorid wird apikal sezerniert. Sekretin, Glucagon,
VIP, GRP fördern die Sekretion, Somatostatin hemmt sie. Sekretin erhöht
die Bicarbonatkonzentration bis auf ~75 mM  Organische Bestandteile der Galle sind durch Konjugation wasserlöslich gemachte Stoffe sowie gallensaure Salze (Cholsäure, Chenodesoxycholsäure), die ~50% aller gelösten Bestandteile ausmachen. Rückresorbierte Gallensäuren (auch Desoxycholsäure, ) hemmen die hepatische 7α-Hydroxylase und damit die de-novo-Synthese aus Cholesterin. Cholsäure ist am stärksten, am geringsten wasserlöslich. Je
mehr Gallensäuren sezerniert werden, desto höher ist auch die
Ausscheidung von Cholesterin und Phospholipiden. Phospholipide
(vor allem Lezithin) lagern sich nur in Anwesenheit gallensaurer Salze
in Mizellen ein. Cholesterin (~4% der gelösten Bestandteile) reichert
sich im Zentrum der Mizellen an; 2% sind
Gallenfarbstoffe, vor allem Bilirubin. Der pH der Blasengalle (bis 7,3) und hohe Konzentration gallensaurer Salze (50-200 mM) und Phospholipide (20-30 mM) erhöhen die Ca++-Löslichkeit und verhindern Kristallisation Organische Bestandteile der Galle sind durch Konjugation wasserlöslich gemachte Stoffe sowie gallensaure Salze (Cholsäure, Chenodesoxycholsäure), die ~50% aller gelösten Bestandteile ausmachen. Rückresorbierte Gallensäuren (auch Desoxycholsäure, ) hemmen die hepatische 7α-Hydroxylase und damit die de-novo-Synthese aus Cholesterin. Cholsäure ist am stärksten, am geringsten wasserlöslich. Je
mehr Gallensäuren sezerniert werden, desto höher ist auch die
Ausscheidung von Cholesterin und Phospholipiden. Phospholipide
(vor allem Lezithin) lagern sich nur in Anwesenheit gallensaurer Salze
in Mizellen ein. Cholesterin (~4% der gelösten Bestandteile) reichert
sich im Zentrum der Mizellen an; 2% sind
Gallenfarbstoffe, vor allem Bilirubin. Der pH der Blasengalle (bis 7,3) und hohe Konzentration gallensaurer Salze (50-200 mM) und Phospholipide (20-30 mM) erhöhen die Ca++-Löslichkeit und verhindern Kristallisation Etwa die Hälfte
der Lebergalle gelangt in die Gallenblase und wird modifiziert (Na/H- und Cl/Bicarbonat- Austauscher in der luminalen,
Na/K-ATPase und K/Cl-Kanäle in der basolateralen Membran, sowie Aquaporine).
Die Chloridkonzentration sinkt so sehr ab, dass sie (trotz Eindickung
des Sekrets) niedriger liegt als in der Lebergalle (dafür ist
Bicarbonat angereichert). Die
basolaterale (sinusoidale) Membran verfügt über NTCP und OATP, die
apikale (kanalikuläre) über BSEP und MRP2; die Kapazität dieser Systeme wird
nur selten überschritten. Besonders konzentriert sind Phospholipide
(10-fach), Gallenfarbstoffe (5-fach), Calciumionen und Gallensäuren (~4-fach), Cholesterin (2,5fach). Kalium ist dreimal konzentrierter als im Serum. Gallensäuren werden bis zu 10-mal täglich rückresorbiert (15-30 g/d) und
erneut ausgeschieden Etwa die Hälfte
der Lebergalle gelangt in die Gallenblase und wird modifiziert (Na/H- und Cl/Bicarbonat- Austauscher in der luminalen,
Na/K-ATPase und K/Cl-Kanäle in der basolateralen Membran, sowie Aquaporine).
Die Chloridkonzentration sinkt so sehr ab, dass sie (trotz Eindickung
des Sekrets) niedriger liegt als in der Lebergalle (dafür ist
Bicarbonat angereichert). Die
basolaterale (sinusoidale) Membran verfügt über NTCP und OATP, die
apikale (kanalikuläre) über BSEP und MRP2; die Kapazität dieser Systeme wird
nur selten überschritten. Besonders konzentriert sind Phospholipide
(10-fach), Gallenfarbstoffe (5-fach), Calciumionen und Gallensäuren (~4-fach), Cholesterin (2,5fach). Kalium ist dreimal konzentrierter als im Serum. Gallensäuren werden bis zu 10-mal täglich rückresorbiert (15-30 g/d) und
erneut ausgeschieden  Die Kapazität der Gallenblase beträgt bis zu 50 ml. Es gibt Faktoren, welche die Füllung begünstigen (Relaxation): Pankreatisches
Polypeptid, vasoaktives intestinales Peptid und Somatostatin
stabilisieren das Membranpotential der Muskelzellen in der Wand der
Gallenblase:
Pankreatisches Polypeptid (Peptide im Darm), vasoaktives intestinales
Peptid (Fette im Darm) und Somatostatin (Proteine im Magen)
stabilisieren das Membranpotential der Muskelzellen in der Wand der
Gallenblase; dadurch kann sie sich passiv füllen. Andere Faktoren regen Kontraktion und damit Entleerung der Gallenblase an (Cholerese, 2-6 Kontraktionen pro Minute, Maximaldruck ~4 kPa): CCK (Fette im Duodenum), parasympathischer Einfluss (muskarinerg). CCK wirkt choleretisch und widerstandssenkend (relaxiert den m. sphincter Oddi) Die Kapazität der Gallenblase beträgt bis zu 50 ml. Es gibt Faktoren, welche die Füllung begünstigen (Relaxation): Pankreatisches
Polypeptid, vasoaktives intestinales Peptid und Somatostatin
stabilisieren das Membranpotential der Muskelzellen in der Wand der
Gallenblase:
Pankreatisches Polypeptid (Peptide im Darm), vasoaktives intestinales
Peptid (Fette im Darm) und Somatostatin (Proteine im Magen)
stabilisieren das Membranpotential der Muskelzellen in der Wand der
Gallenblase; dadurch kann sie sich passiv füllen. Andere Faktoren regen Kontraktion und damit Entleerung der Gallenblase an (Cholerese, 2-6 Kontraktionen pro Minute, Maximaldruck ~4 kPa): CCK (Fette im Duodenum), parasympathischer Einfluss (muskarinerg). CCK wirkt choleretisch und widerstandssenkend (relaxiert den m. sphincter Oddi) Der primäre Gallenfarbstoff Bilirubin entsteht aus dem Abbau von Hämoglobin (Häm → Biliverdin → Bilirubin) aus Erythrozyten (~80%) und anderen Quellen, wie hepatischen Enzymsystemen (200-300 mg/d). Bilirubin wird im Blut großteils (>80%) unkonjugiert, proteingebunden transportiert ("indirektes" Bilirubin). Leberzellen konjugieren das Bilirubin (UDP-Glukuronyltransferase) und
geben es wieder ab ("direktes", konjugiertes, nicht-albumingebundenes
Bilirubin: <20%). Normalerweise beträgt dieser Anteil weniger als
20% des Gesamt-Bilirubins im Blutserum. Zum Großteil wird es mit der
Galle ausgeschieden (Fäzes: Urobilinogen, Bilirubinglukuronid, Sterkobilinogen, Sterkobilin), zu einem geringen Teil mit dem Harn (→ Urobilinogen → Urobilin) Der primäre Gallenfarbstoff Bilirubin entsteht aus dem Abbau von Hämoglobin (Häm → Biliverdin → Bilirubin) aus Erythrozyten (~80%) und anderen Quellen, wie hepatischen Enzymsystemen (200-300 mg/d). Bilirubin wird im Blut großteils (>80%) unkonjugiert, proteingebunden transportiert ("indirektes" Bilirubin). Leberzellen konjugieren das Bilirubin (UDP-Glukuronyltransferase) und
geben es wieder ab ("direktes", konjugiertes, nicht-albumingebundenes
Bilirubin: <20%). Normalerweise beträgt dieser Anteil weniger als
20% des Gesamt-Bilirubins im Blutserum. Zum Großteil wird es mit der
Galle ausgeschieden (Fäzes: Urobilinogen, Bilirubinglukuronid, Sterkobilinogen, Sterkobilin), zu einem geringen Teil mit dem Harn (→ Urobilinogen → Urobilin) |
