

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert

Ernährung und Verdauungssystem

 Magen
Magen
© H. Hinghofer-Szalkay
 Antrum: antrum = Höhle, Grotte
Antrum: antrum = Höhle, Grotte
Cardia: καρδία = muskuläres Hohlorgan
Fundus: fundus = Boden, Grund (fundare = (be)gründen)
Gastrin: γαστήρ = Bauch
Pepsin: πέψις = "Kochung", Verdauung
Pylorus: πυλωρός = Pförtner
Der Magen erfüllt zahlreiche - lokal, hormonell und neural koordinierte - Funktionen: Zwischenspeicherung (Fundus), Transport, Durchmischung, Homogenisierung; Ansäuerung, Eiweißabbau (Pepsin); Resorption (Flüssigkeit, kleine Moleküle); Schutz der Schleimhaut (Mucine, Bicarbonat); Mechano- und Chemosensibilität; Hormonproduktion (Gastrin); Bildung von intrincic factor (Vitamin B12).
Im oberen Corpusteil befindet sich eine Schrittmacherzone
für die Peristaltik des Magens (etwa 3 Wellen pro Minute), die hier der Durchmischung, im distalen Magen der Zerkleinerung dient
("Antrummühle"). Erst bei ausreichender Zerkleinerung des
Mageninhalts zeigt der Pylorus Relaxationsphasen, die duodenalwärts
gerichteten Transport (Tonus plus Peristaltik) zulassen.
Gastrin fördert die
Säureproduktion, Kontraktion der Cardia, Peristaltik am Magenausgang,
Gallen- und Pankreassekretion, und regt ECL-Zellen (Histamin) sowie
D-Zellen (Somatostatin) an; seine Freisetzung wird durch Dehnung der
Magenwand, "Saftlocker" und GRP-bildende parasympathische Fasern
stimuliert.
Die Anregung der Magentätigkeit wird in eine zephale (Gehirn), gastrische (≥50%) und intestinale Phase eingeteilt.
Belegzellen (Produktion
von Salzsäure) werden durch Acetylcholin, Gastrin und Histamin
angeregt; Somatostatin, Prostaglandine, Sekretin und VIP hemmen die
Säureproduktion.
|
Funktionen  Phasen der Digestion
Phasen der Digestion  Magenmotorik
Magenmotorik  Produktion des Magensekrets
Produktion des Magensekrets  Regulation der Magentätigkeit
Regulation der Magentätigkeit  Wirkungsprofil: Gastrin
Wirkungsprofil: Gastrin  Somatostatin
Somatostatin  Enterogastrone
Enterogastrone

Mucine  ECL-Zellen
ECL-Zellen  GRP
GRP
 Praktische Aspekte
Praktische Aspekte  Core messages
Core messages
Zwischen
Oesophagus (rascher Weitertransport geschluckter Speisen und Getränke)
und Dünndarm (Verdauung und Resorption) gelegen, hat der Magen mehrere
Funktionen: Sinnesorgan (Dehnungs- und Chemorezeptoren),
Zwischenspeicher (Fundus), Zerkleinerungs- (antrale"Mühle") und Mischmaschine
(Peristaltik), Säureproduzent (Belegzellen), Vitaminschutz (intrinsic
factor), Eiweißabbau (Pepsinproduktion), endokrines Organ (Bildung von
Gastrin). Diese Einzelfunktionen sind untereinander und mit der
Gesamtfunktion des gastrointestinalen Systems abgestimmt - neural
(autonomes Nervensystem) und endokrin (Verdauungshormone).
Der Magen speichert, zerkleinert, verdaut
Der Magen ist ein Organ, das motorisch, sekretorisch,
enzymatisch, protektiv, resorptiv, sensorisch und endokrin tätig ist.
Er steht unter der Kontrolle des autonomen und des Darmnervensystems sowie hormoneller Steuerungen. Strategisch gesehen nimmt
er eine Position zwischen dem Trink- und Nahrungsaufnahmeverhalten
einerseits, und dem Dünndarm als Hauptort der Verdauung und Resorption
andererseits ein.
Jede Minute stößt die Magenschleimhaut etwa eine halbe Million Zellen
ab, die laufend ersetzt werden.
Der Magen ist ein heterogenes Organ mit spezialisierten Abschnitten:
 Der Fundus hat ausgeprägte Speicherfunktion
Der Fundus hat ausgeprägte Speicherfunktion
 Der Corpusteil des Magens enthält Hauptzellen (Pepsinogenproduktion), Belegzellen (Sekretion von HCl und Intrinsic factor), Becherzellen (Mucinbildun, Bicarbonatsekretion), endokrine Zellen (darunter ECL-Zellen) und transportiert den Chymus weiter
Der Corpusteil des Magens enthält Hauptzellen (Pepsinogenproduktion), Belegzellen (Sekretion von HCl und Intrinsic factor), Becherzellen (Mucinbildun, Bicarbonatsekretion), endokrine Zellen (darunter ECL-Zellen) und transportiert den Chymus weiter
 Das Antrum ist auf Zerkleinerung spezialisiert ("Antrummühle") und bildet Hormone (Gastrin: G-Zellen, Somatostatin: D-Zellen).
Das Antrum ist auf Zerkleinerung spezialisiert ("Antrummühle") und bildet Hormone (Gastrin: G-Zellen, Somatostatin: D-Zellen).
Die einzige unersetzliche Komponente des Magensaftes ist der Intrinsic factor für die Vit. B12-Aufnahme.
Die Proteinverdauung kann mittels pankreatischer Enzyme vollständig
erfolgen; Magensäure tötet die meisten Mikroben ab, bei stark
eingeschränkter oder fehlender Säureproduktion steigt die Inzidenz für
Infektionen im Darmbereich.
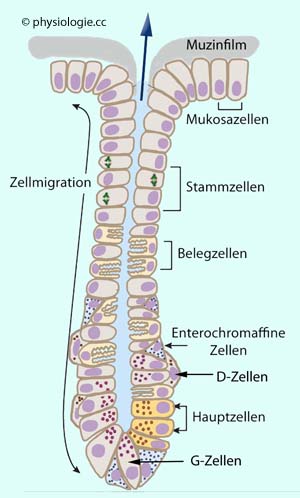
 Abbildung: Drüsenschlauch in säureproduzierender Magenschleimhaut (
Abbildung: Drüsenschlauch in säureproduzierender Magenschleimhaut (Fundus / Corpus)
Modifiziert nach einer Vorlage bei Barrett KE: Gastrointestinal Physiology, McGraw-Hill 2006
Mucosazellen werden von dem ihnen aufliegenden Schleimfilm vor Verdauung geschützt. Sie produzieren fortlaufend Mucin (tonische Sekretion durch Nebenzellen), bei Irritation der Schleimhaut nimmt die Produktion zu. Oberflächlich liegende Mucosazellen produzieren auch Bicarbonatpuffer.
Das Lager der Stammzellen
produziert junge Zellen: Nach
Teilung einer Stammzelle verbleibt eine Tochterzelle als Stammzelle am
Ort fixiert, die andere teilt sich mehrfach weiter und bildet
spezialisierte Zellen. Vom Stammzellager wandern die Zellen sowohl
Richtung Oberfläche als auch in die Tiefe des Drüsenschlauchs (Pfeile).
Angeregte Belegzellen
(Parietalzellen) produzieren
Salzsäure und Intrinsic factor. Angeregt werden sie über Acetylcholin,
Gastrin und Histamin. Die Salzsäure aktiviert Pepsin und tötet
Bakterien ab; intrinsic factor komplexiert mit Vitamin B12 und ermöglicht dessen Resorption.
ECL-Zellen (Enterochromaffinähnliche, enterochromaffin-like cells) sezernieren Histamin; angeregt werden sie durch Acetylcholin und Gastrin. Sie stimulieren Belegzellen zur Säureproduktion.
D-Zellen bilden Somatostatin; angeregt werden sie durch Magensäure, deren Produktion sie hemmen.
Hauptzellen
bilden Pepsinogen (Eiweißverdauung) und gastrische Lipase (Fettverdauung). Sie können sich selbständig teilen, aber auch aus Stammzellen
entstehen. Acetylcholin und Sekretin regen sie an.
G-Zellen
sezernieren Gastrin, wenn sie durch Acetylcholin, Peptide oder
Aminosäuren stimuliert werden. Gastrin regt die Säureproduktion des
Magens an
Funktionen des Magens
 Zwischenspeicherung von Bissen / Schlucken, die den Ösophagus passiert haben: Die verschluckten Portionen sind meist größer als die Menge, die der
Dünndarm unmittelbar verarbeiten könnte. Der Magen erfüllt die Aufgabe der "Volumendämpfung" auf zwei Wegen:
Zwischenspeicherung von Bissen / Schlucken, die den Ösophagus passiert haben: Die verschluckten Portionen sind meist größer als die Menge, die der
Dünndarm unmittelbar verarbeiten könnte. Der Magen erfüllt die Aufgabe der "Volumendämpfung" auf zwei Wegen:
Rezeptive Relaxation wird über einen vago-vagalen Reflex vermittelt: Afferente Meldungen im Rahmen des Schluckvorganges laufen zum Hirnstamm, relaxierende Efferenzen zum unteren Ösophagussphinkter und zeitgleich des Fundus und der oberen Corpusregion,
was die Passage des Bissens und seine Speicherung im Fundus
unterstützt. Der Mechanismus ist weder cholinerg noch adrenerg; bei
Unterbrechung der vagalen Innervation des Magens nimmt der
intragastrische Druck bei Nahrungsaufnahme rascher zu als normalerweise.
und der oberen Corpusregion,
was die Passage des Bissens und seine Speicherung im Fundus
unterstützt. Der Mechanismus ist weder cholinerg noch adrenerg; bei
Unterbrechung der vagalen Innervation des Magens nimmt der
intragastrische Druck bei Nahrungsaufnahme rascher zu als normalerweise.
Dazu kommt gastrische Akkommodation: Die Füllung des Magens an sich führt zu Erschlaffung der Wand des proximalen Magens -
vermutlich vor allem über lokale Reflexe im Darmnervensystem,
aber auch moduliert über den Vagusnerv (Vagotomie schwächt die
gastrische Akkommodation ab). Dadurch kann das Volumen zunehmen (bis
etwa 700 ml), ohne dass es zu einer merklichen intragastrischen
Druckerhöhung kommt.
Der Zeitverlauf der Entleerung eines Bolus, der in den Magen gelangt
ist, erfolgt in nichtlinearer Weise (mit abnehmendem Tempo). Wasser
oder isotone Kochsalzlösung passiert den Magen am raschesten und
gelangt schnell (in etwa 4 Minuten zur Hälfte) in das Duodenum. Saure
oder kalorienreiche Flüssigkeiten verbleiben länger im Magen (etwa 10
Minuten für die Hälfte), und fette bzw. ölige Speisen am langsamsten
(ca. 20 Minuten für die Hälfte).
 Sekretion von Magensaft (Corpusteil):
Sekretion von Magensaft (Corpusteil):
 Belegzellen (parietal cells, oxyntic cells) produzieren das Glykoprotein Intrinsic factor (Vitamin B12-Resorption) und Salzsäure (hydrochloric acid - hydrolysiert Makromoleküle, aktiviert Proenzyme und wirkt sterilisierend);
Belegzellen (parietal cells, oxyntic cells) produzieren das Glykoprotein Intrinsic factor (Vitamin B12-Resorption) und Salzsäure (hydrochloric acid - hydrolysiert Makromoleküle, aktiviert Proenzyme und wirkt sterilisierend);
 Hauptzellen (chief cells) sezernieren Pepsinogen, das durch HCl-Wirkung zum eiweißabbauenden Enzym Pepsin wird, sowie Lipase;
Hauptzellen (chief cells) sezernieren Pepsinogen, das durch HCl-Wirkung zum eiweißabbauenden Enzym Pepsin wird, sowie Lipase;
 Becherzellen (Nebenzellen) (goblet cells, mucous cells) produzieren Schleim (Mucin), der die Mucosa vor HCl und Pepsin schützt.
Becherzellen (Nebenzellen) (goblet cells, mucous cells) produzieren Schleim (Mucin), der die Mucosa vor HCl und Pepsin schützt.
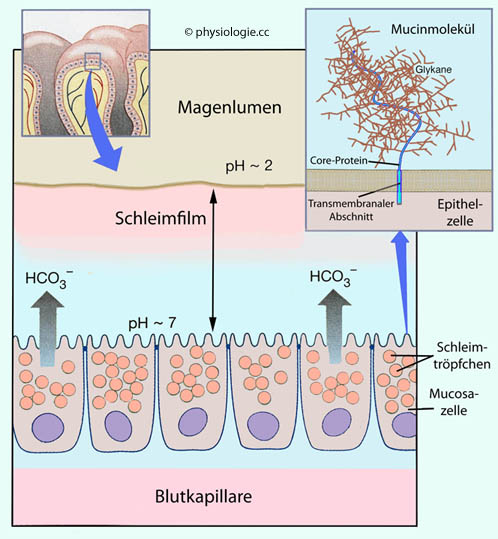

Abbildung: Schleimbarriere im Magen, Mucinmolekül
Modifiziert nach einer Vorlage bei Silverthorn, Human Physiology - an integrated approach, 4th ed. Pearson International 2007
Die
Magenschleimhaut ist durch eine Mucin-Bicarbonat-Barriere vor der
Einwirkung des sauren Magensaftes geschützt. Becherzellen produzieren
sowohl Mucin als auch Bicarbonat. Die Mucinschichte bildet eine
physikalisch-chemische Barriere gegen das offene Magenlumen (pH~2), die darunter liegende, dem Epithel direkt anliegende Flüssigkeit ist durch Bicarbonat gepuffert (pH~7).
Mucine können membrangebunden sein (wie in der Abbildung gezeigt) oder frei im Sekret gelöst vorliegen (z.B. im Sekret von Speicheldrüsen, Magen, Dünn- und Dickdarm, Respirationstrakt, Urogenitaltrakt, Gallenblase, Tränendrüsen).
Bei Reizung
dess Magens (z.B. durch Alkohol, Aspirin) nimmt die Mucinproduktion zu.
Dadurch kann einer Beschädigung der Schleimhaut vorgebeugt werden. Bei
überschießender Säureproduktion (z.B. Zollinger-Ellicon-Syndrom infolge
eines gastrinproduzierenden Tumors) kann die Schleimhautbarriere
zusammenbrechen, Magengeschwüre können auftreten
 Mucine
sind große, stark glykosylierte Proteine, die viel Wasser halten
können (gelartige
Eigenschaften), resistent gegenüber Proteolyse sind, Gele bilden können
und sowohl physikalisch (als "Schmiermittel") als auch chemisch (als
Barrieren) bedeutsame Funktionen erfüllen, inklusive Bindung von
Pathogenen (Immunsystem). Sie werden von Epithelzellen meist als
große Aggregate sezerniert (bis 104 kDa), liegen aber auch
an Zellmembranen gebunden
vor (Bild), wo sie als rezeptorartige Liganden für Kohlenhydrate wirken
können.
Mucine
sind große, stark glykosylierte Proteine, die viel Wasser halten
können (gelartige
Eigenschaften), resistent gegenüber Proteolyse sind, Gele bilden können
und sowohl physikalisch (als "Schmiermittel") als auch chemisch (als
Barrieren) bedeutsame Funktionen erfüllen, inklusive Bindung von
Pathogenen (Immunsystem). Sie werden von Epithelzellen meist als
große Aggregate sezerniert (bis 104 kDa), liegen aber auch
an Zellmembranen gebunden
vor (Bild), wo sie als rezeptorartige Liganden für Kohlenhydrate wirken
können.
 Transport, Durchmischung, Homogenisierung
des Inhalts
Transport, Durchmischung, Homogenisierung
des Inhalts
 Schutz der Schleimhaut durch Mucine (
Schutz der Schleimhaut durch Mucine ( Abbildung), s. unten
Abbildung), s. unten
 Abbau von Nahrungsbestandteilen, hauptsächlich von Eiweiß (Pepsin
Abbau von Nahrungsbestandteilen, hauptsächlich von Eiweiß (Pepsin  )
)
 Bereitstellung des Glykoproteins Intrincic
factor zur Vitamin-B12-Aufnahme (rezeptorvermittelte Resorption des Faktor-Vitamin-Komplexes im Ileum)
Bereitstellung des Glykoproteins Intrincic
factor zur Vitamin-B12-Aufnahme (rezeptorvermittelte Resorption des Faktor-Vitamin-Komplexes im Ileum)
 Resorption von Flüssigkeit und kleinen Molekülen (kurzkettige Fettsäuren, Alkohol, Medikamente)
Resorption von Flüssigkeit und kleinen Molekülen (kurzkettige Fettsäuren, Alkohol, Medikamente)
 Registrierung des Dehnungszustandes der Magenwand (Mechanosensibilität)
Registrierung des Dehnungszustandes der Magenwand (Mechanosensibilität)
 Registrierung des Chemismus des Inhalts (Peptide: G-Zellen, pH-Wert: D-Zellen)
Registrierung des Chemismus des Inhalts (Peptide: G-Zellen, pH-Wert: D-Zellen)
 Hormonproduktion durch neuroendokrine Zellen (Gastrin-17 im Antrum
Hormonproduktion durch neuroendokrine Zellen (Gastrin-17 im Antrum  ).
).
 Enterochromaffin-ähnliche Zellen (ECL, enterochromaffin-like cells) sind die in der Magenschleimhaut am häufigsten vorkommenden neuroendokrinen Zellen. Sie bilden, speichern und sezernieren Histamin, das Belegzellen und dadurch die Produktion von Salzsäure im Magen anregt. Daneben produzieren sie auch Peptidhormone / Wachstumsfaktoren.
(ECL sind nicht zu verwechseln mit enterochromaffinen Zellen, diese befinden sich hauptsächlich in Dünndarm, Colon und appendix vermicularis und produzieren Serotonin.)
Enterochromaffin-ähnliche Zellen (ECL, enterochromaffin-like cells) sind die in der Magenschleimhaut am häufigsten vorkommenden neuroendokrinen Zellen. Sie bilden, speichern und sezernieren Histamin, das Belegzellen und dadurch die Produktion von Salzsäure im Magen anregt. Daneben produzieren sie auch Peptidhormone / Wachstumsfaktoren.
(ECL sind nicht zu verwechseln mit enterochromaffinen Zellen, diese befinden sich hauptsächlich in Dünndarm, Colon und appendix vermicularis und produzieren Serotonin.)
Histaminfreisetzung der ECL erfolgt auch unter Basisbedingungen kontinuierlich und wird
 gesteigert durch Acetylcholin (parasympathische muskarinerge Innervation), Gastrin (G-Zellen) sowie ein VIP-ähnliches Peptid, das sowohl parakrin, auch als Neurotransmitter / Neuromodulator wirkt (PACAP: pituitary adenylate cyclase-activating polypeptide).
gesteigert durch Acetylcholin (parasympathische muskarinerge Innervation), Gastrin (G-Zellen) sowie ein VIP-ähnliches Peptid, das sowohl parakrin, auch als Neurotransmitter / Neuromodulator wirkt (PACAP: pituitary adenylate cyclase-activating polypeptide).
 Gehemmt wird die ECL-Aktivität durch Somatostatin (D-Zellen) sowie durch Prostaglandine.
Gehemmt wird die ECL-Aktivität durch Somatostatin (D-Zellen) sowie durch Prostaglandine.
Von den entsprechenden Kompartimenten (Ösophagus,
Duodenum) grenzt sich der Magen durch Sphinkteren ab, die eine Passage nur unter bestimmten Bedingungen erlauben.
 Geschlucktes wird durch die Cardia
Geschlucktes wird durch die Cardia bzw. den unteren Ösophagussphincter (LES: Lower esophageal sphincter) kontrolliert in den Magen befördert und hier so lange gespeichert und modifiziert, bis es
(entsprechend "bearbeitet") für den Weitertransport in den
Zwölffingerdarm präpariert ist - eine "Einbahnstraße" für
den Chymus. Nur unter Ausnahmebedingungen kommt es zu Passage in die
Gegenrichtung (Regurgitation, Reflux, Erbrechen).
bzw. den unteren Ösophagussphincter (LES: Lower esophageal sphincter) kontrolliert in den Magen befördert und hier so lange gespeichert und modifiziert, bis es
(entsprechend "bearbeitet") für den Weitertransport in den
Zwölffingerdarm präpariert ist - eine "Einbahnstraße" für
den Chymus. Nur unter Ausnahmebedingungen kommt es zu Passage in die
Gegenrichtung (Regurgitation, Reflux, Erbrechen).
 Der Pylorus
Der Pylorus  funktioniert in Kooperation mit der äußeren Muskelschicht (muscularis
externa), um nur kleine Partikel in den Zwölffingerdarm (Duodenum)
gelangen zu lassen, abhängig von dessen Verarbeitungskapazität (s.
weiter unten).
funktioniert in Kooperation mit der äußeren Muskelschicht (muscularis
externa), um nur kleine Partikel in den Zwölffingerdarm (Duodenum)
gelangen zu lassen, abhängig von dessen Verarbeitungskapazität (s.
weiter unten).
Phasen der Digestion
In der Ruhephase zwischen Mahlzeiten (interdigestive Phase) ist die Säureproduktion des Magens minimal, folgt aber einem zirkadianen Rhythmus:
Morgens (vor dem Aufwachen) ist die Sekretionsrate am geringsten,
abends ist die interdigestive HCl-Produktion am höchsten. Ihr Betrag
ist direkt proportional der Zahl der Belegzellen, bei Männern ist sie
im Schnitt höher als bei Frauen. Es bestehen starke individuelle
Unterschiede. Der pH-Wert im interdigestiven Magen kann zwischen 3 und
7 betragen (ein Unterschied des [H+] von 10.000 zu 1).
Die digestive Aktivität beginnt schon vor (Anblick, Geruch) einer Nahrungsaufnahme und setzt sich während und nach ihr fort. Nach
der Reihenfolge unterscheidet man drei
Phasen der digestiven Tätigkeit: Eine zephale, eine gastrische ( Abbildung) und eine intestinale.
Abbildung) und eine intestinale.


Abbildung: Phasen der Magenaktivität
Nach einer in jpp.krakow.pl verwendeten Quelle (S.J. Konturek)
Die zephale Phase wird vom Gehirn aus getriggert; olfaktorische, gustatotrische, reflektorische und metabolische Afferenzen werden dabei berücksichtigt.
Die gastrische Phase wird durch den Kontakt von Chymus mit der Magenwand ausgelöst und von dessen Zusammensetzung beeinflusst.
Gastrin regt die Säureproduktion von Belegzellen an
ACh, Acetylcholin; GRP, gastrin releasing peptide
 GRP (gastrin releasing peptide) ist ein neurokriners Peptid (27 As) aus gastrischen Nervenzellen, wird durch cholinerge Impulse (Vagus) freigesetzt und regt die Gastrinsekretion in G-Zellen an.
Der GRP-Rezeptor BB2
(benannt nach Bombesin, einem strukturell ähnlichen Peptid in der Haut der Rotbauchunke bombina bombina) ist G-Protein-gekoppelt und wird in Pankreas, Magen,
Gehirn und Nebennierenrinde exprimiert. Auch Pituizyten im
Hypophysenhinterlappen produzieren GRP, das in die Regulation zirkadianer Rhythmen
involviert ist und Lichtinformation an den hypothalamischen
Oszillator im nucl. suprachiasmaticus signalisiert. Auch scheint GRP Aspekte von
Stress zu mediieren.
GRP (gastrin releasing peptide) ist ein neurokriners Peptid (27 As) aus gastrischen Nervenzellen, wird durch cholinerge Impulse (Vagus) freigesetzt und regt die Gastrinsekretion in G-Zellen an.
Der GRP-Rezeptor BB2
(benannt nach Bombesin, einem strukturell ähnlichen Peptid in der Haut der Rotbauchunke bombina bombina) ist G-Protein-gekoppelt und wird in Pankreas, Magen,
Gehirn und Nebennierenrinde exprimiert. Auch Pituizyten im
Hypophysenhinterlappen produzieren GRP, das in die Regulation zirkadianer Rhythmen
involviert ist und Lichtinformation an den hypothalamischen
Oszillator im nucl. suprachiasmaticus signalisiert. Auch scheint GRP Aspekte von
Stress zu mediieren.
1. Zephale Phase
Geruch nach, oder Vorstellung von,
appetitanregenden Stoffen sowie Anwesenheit von Nahrung im Mund
(Geschmack) führt
zu Anregung der Magensaftproduktion bei herabgesetzter Motilität. Diese
- vor bzw. ohne Kontakt mit der Magenwand wirksamen - Faktoren
aktivieren den dorsalen Vaguskern.
Präganglionäre Axone ziehen von hier zu Ganglien in der Magenwand und
schalten auf postganglionäre Fasern, die wiederum Belegzellen
(cholinerg) sowie G-Zellen (über GRP) anregen ( Abbildung).
Abbildung).
Die Wirkung der vagalen Aktivität während der gastrischen Phase beruht auf folgenden Komponenten:
 Postganglionär freigesetztes Acetylcholin im Corpusteil des Magens regt Belegzellen direkt an (M3-Rezeptoren)
Postganglionär freigesetztes Acetylcholin im Corpusteil des Magens regt Belegzellen direkt an (M3-Rezeptoren)
 Acetylcholin regt weiters ECL-Zellen in der Corpuswand zur Histaminfreisetzung an (M3-Rezeptoren)
Acetylcholin regt weiters ECL-Zellen in der Corpuswand zur Histaminfreisetzung an (M3-Rezeptoren)
 Im Antrum setzen peptiderge parasympathisch- postganglionäre Fasern und
auch Neurone des Darmnervensystems GRP frei, das G-Zellen zur
Gastrinfreisetzung stimuliert (GRP-Rezeptor BB2)
Im Antrum setzen peptiderge parasympathisch- postganglionäre Fasern und
auch Neurone des Darmnervensystems GRP frei, das G-Zellen zur
Gastrinfreisetzung stimuliert (GRP-Rezeptor BB2)
 Vagale Efferenzen hemmen D-Zellen in Corpus und Antrum (M3-Rezeptoren), dadurch sinkt der hemmende Einfluss von Somatostatin auf Belegzellen.
Die zephale Phase trägt mit 20-30% zur Verdauungsanregung bei.
Vagale Efferenzen hemmen D-Zellen in Corpus und Antrum (M3-Rezeptoren), dadurch sinkt der hemmende Einfluss von Somatostatin auf Belegzellen.
Die zephale Phase trägt mit 20-30% zur Verdauungsanregung bei.
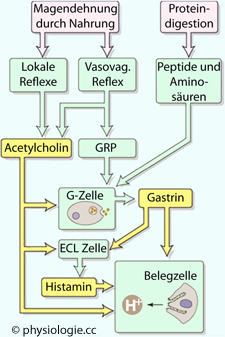

Abbildung: Gastrische Phase der Magensäuresekretion
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Dehnung
der Magenwand einerseits, die Entstehung von Peptiden im Rahmen der
Proteinverdauung andererseits regen die Belegzellen indirekt zur
Sekretion von HCl an: Über Freisetzung von Acetylcholin (wirkt direkt
oder über G-Zellen / ECL-Zellen), GRP (über G-Zellen) oder Gastrin (das
auch ECL-Zellen anregt)
ECL = enterochromaffin-like, GRP = Gastrin releasing peptide
2. Gastrische Phase
Kontakt des
Verschluckten mit der Magenwand (gastrische Phase).
Zunächst steigt der pH-Wert im Magen durch die verschluckte Nahrung,
insbesondere wirken Proteine puffernd (der Speisebrei kann einen
pH-Wert von über 6 haben). Dadurch wird die Sekretion von Gastrin nicht
inhibiert (wie bei pH<3, s. weiter unten).
Die zwei primären Reize zur Säurepropduktion in der gastrischen Phasen sind
 Dehnung der Magenwand aktiviert einen vago-vagalen Reflex (über den dorsalen Vaguskern) sowie lokale Reflexe im Darmnervensystem. Dies ist der stärkste Stimulus für die Säureproduktion
Dehnung der Magenwand aktiviert einen vago-vagalen Reflex (über den dorsalen Vaguskern) sowie lokale Reflexe im Darmnervensystem. Dies ist der stärkste Stimulus für die Säureproduktion
 Anwesenheit anregender Stoffe, wie Aminosäuren (Aromatische Aminosäuren regen G-Zellen besonders stark an - auch nach
Vagotomie), Peptide
(Bouillon!), Amine, Kaffee (auch koffeinfrei).
Anwesenheit anregender Stoffe, wie Aminosäuren (Aromatische Aminosäuren regen G-Zellen besonders stark an - auch nach
Vagotomie), Peptide
(Bouillon!), Amine, Kaffee (auch koffeinfrei).
Das bewirkt Magensaftsekretion, Peristaltik und Magenentleerung.
(Über Gastrinfreisetzung s. unten.)
Während der gastrischen Phase kann ein niedriger pH-Wert im Magen
D-Zellen der Antrumschleimhaut anregen, das hemmt die
Gastrinfreisetzung der G-Zellen, und die HCl-Produktion sinkt ab
(negative Rückkopplung).
Der Magen wird vor allem in der gastrischen Phase angeregt; die HCl-Sekretion während dieser Phase trägt zu 50-60% zur Antwort auf eine Nahrungsaufnahme bei.


Abbildung: Intestinale Phase der Magensäuresekretion
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Entero-Oxyntin
ist ein endokrines Signal - wahrscheinlich ein Peptid(mix) - aus
endokrinen Zellen des Dünndarms, seine Bedeutung für die Anregung der
Belegzellen des Menschen ist noch hypothetisch
 3. Intestinale Phase
3. Intestinale Phase
 Duodenale G-Zellen setzen Gastrin frei (vorwiegend Gastrin-34)
Duodenale G-Zellen setzen Gastrin frei (vorwiegend Gastrin-34)
 Peptone regen endokrine Zellen an (Entero-Oxyntin,
Peptone regen endokrine Zellen an (Entero-Oxyntin,  Abbildung)
Abbildung)
 Im proximalen Dünndarm resorbierte Aminosäuren regen Belegzellen ebenfalls an (Mechanismus unbekannt)
Im proximalen Dünndarm resorbierte Aminosäuren regen Belegzellen ebenfalls an (Mechanismus unbekannt)
Die Säuresekretion im Magen
wird durch die intestinale Phase zu 5-10% der Gesamtwirkung weiter angeregt.
Auch hemmende Einflüsse auf
den Magen sind aus dem Dünndarm wirksam, vor allem bei Anwesenheit von
Fett (das die Verweildauer im Magen wesentlich verländert). Die beteiligten Faktoren werden insgesamt als Enterogastrone bezeichnet.
Magenmotorik
Interstitielle (Cajal-) Zellen lösen in der Magenwand regelmäßig organspezifische Entladungswellen der glatten Muskulatur aus, unabhängig von nervalen oder humoralen Einflüssen. Sie haben verschiedene Bezeichnungen (slow waves, basic electrical rhythm, control activity, pacesetter potentials) und sind immer vorhanden, unabhängig davon, ob sie Kontraktionen zur Folge haben oder nicht; ihre Frequenz beträgt ~3 pro Minute (cpm: cycles per minute).
Sie entstehen am Übergang der Fundus- zur Corpusregion (Ursprungsstelle,
Schrittmacherzone) und wandern von hier zur Pylorusregion ( Abbildung). Werden sie von mehreren Stellen synchron registriert, zeigt sich
überall die gleiche Frequenz, aber eine konsekutive Verzögerung als
Zeichen der Fortleitung über die Magenwand.
Abbildung). Werden sie von mehreren Stellen synchron registriert, zeigt sich
überall die gleiche Frequenz, aber eine konsekutive Verzögerung als
Zeichen der Fortleitung über die Magenwand.
Der Verlauf des Membranpotentials der slow waves zeigt eine rasche Entladungs- (spike-) und eine längere Plateauphase; letztere muss ausreichend intensiv sein, um eine Kontraktion auszulösen. Die Depolarisationen können also - müssen aber nicht -
Kontraktionswellen auslösen.
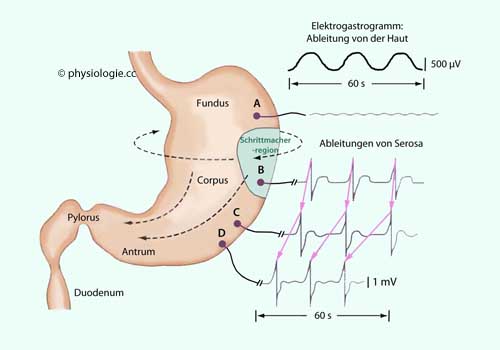
 Abbildung: Elektrische Aktivität des Magens
Abbildung: Elektrische Aktivität des Magens
Nach Koch
KL. Electrogastrography. In: Schuster M, Crowel M, Koch, KL, editors.
Atlas of Gastrointestinal Motility. BC Decker; 2002.
pp 185-201
Registrierungen von der Haut (Elektrogastrogramm, EGG, rechts oben) und von der Oberfläche des Magens. A: Fundus - keine Aktivität; B: Schrittmacherzone (grün); C: Corpus; D:
Antrum.
Eine Schrittmacherzone am Übergang von Fundus zu Corpus (grün angedeutet) generiert elektrische Entladungswellen (3/min), die zirkumferentiell und funduswärts die
Muskulatur der Magenwand entlanglaufen (Pfeile) und Kontraktionswellen
generieren können

Ursprung der Magenperistaltik ist die rhythmische Entladung von Cajal-Schrittmacherzellen im oberen Corpusbereich
|
Neuronale und humorale Faktoren sind zwar
nicht für die Entstehung, wohl aber die Eigenschaften der slow waves bedeutsam:
 Parasympathische Aktivität erhöht Stärke und Frequenz, Vagotomie reduziert Stärke und Organisationsgrad
Parasympathische Aktivität erhöht Stärke und Frequenz, Vagotomie reduziert Stärke und Organisationsgrad
 Sympathische Aktivität dämpft sie
Sympathische Aktivität dämpft sie
 Gastrin und Cholezystokinin erhöhen die Kontraktionsfrequenz, , ändern
aber nichts an der Propagation der Erregungswellen
Gastrin und Cholezystokinin erhöhen die Kontraktionsfrequenz, , ändern
aber nichts an der Propagation der Erregungswellen
 Sekretin und GIP senken sie.
Sekretin und GIP senken sie.
An den beiden Enden des Magens lassen
Schließmuskel die
Passage (eines Bolus aus der Speiseröhre, oder von Chymus in das
Duodenum) nur in kontrollierter Weise zu: Sammelt sich im
untersten Speiseröhrenabschnitt Geschlucktes an und dehnt die Cardia,
öffnet sich diese reflektorisch. (Bei
der Einnahme von Medikamenten soll Flüssigkeit
nachgetrunken werden, um die Öffnung der Cardia zu gewährleisten.)
Als
gastroösophagealen Reflux
bezeichnet man die Bewegung von Mageninhalt in die Speiseröhre. Diese
verfügt über eine (begrenzte) Pufferkapazität, sodass kleinere Mengen
sauren Mageninhalts keine Schädigung der Schleimhaut der Speiseröhre
bewirken (säurebindende Wirkung verschluckten Speichels). Geringgradiger
Reflux, insbesondere nach den Mahlzeiten, ist physiologisch.
 Der Pylorus
("Pförtner") stellt sicher, dass der im Magen bearbeitete
(kleinkörnige, saure, angedaute) Speisebrei nur in kleinen Portionen
zum Duodenum weiterbewegt wird, je nach dessen jeweiliger Fähigkeit,
weitere saure Valenzen zu puffern und Nährstoffe zu verdauen.
Der Pylorus
("Pförtner") stellt sicher, dass der im Magen bearbeitete
(kleinkörnige, saure, angedaute) Speisebrei nur in kleinen Portionen
zum Duodenum weiterbewegt wird, je nach dessen jeweiliger Fähigkeit,
weitere saure Valenzen zu puffern und Nährstoffe zu verdauen.
Magentätigkeit
und funktionelle Kapazität des Dünndarms werden so bei der Regulierung der
Magenentleerung berücksichtigt. Die Transportperistaltik des Pylorus ist auf die
Aufnahmekapazität des Duodenums abgestimmt. Der Chymus am Magenausgang hat einen pH-Wert zwischen 4,0 und 7,2.
 Akkommodationsreflex: In der Speiseröhre Richtung Magen wandernder Chymus
entspannt die oberen Magenpartien (Fundus, oberer Corpusteil) schon
bevor er den Magen erreicht hat. Die anschließende Dehnung der
Magenwand verstärkt diese gastrische Akkommodation, die durch einen vago-vagalen Reflex erfolgt:
Sowohl Afferenzen zum Gehirn als auch Efferenzen zum Magen laufen über
parasympathische Fasern des N. vagus.
Akkommodationsreflex: In der Speiseröhre Richtung Magen wandernder Chymus
entspannt die oberen Magenpartien (Fundus, oberer Corpusteil) schon
bevor er den Magen erreicht hat. Die anschließende Dehnung der
Magenwand verstärkt diese gastrische Akkommodation, die durch einen vago-vagalen Reflex erfolgt:
Sowohl Afferenzen zum Gehirn als auch Efferenzen zum Magen laufen über
parasympathische Fasern des N. vagus.
Der Effekt ist eine Weitung des Magens ohne wesentliche Steigerung des Mageninnendrucks. Der Magen kann ~1,5 Liter Inhalt mit einem Druckanstieg von nur ~10 mmHg aufnehmen.
Durch diese reflektorische Relaxation kann der Chymus länger im Magen
verbleiben und ausführlich durchmischt, zerkleinert und angedaut werden.
Abhängig von Menge und
Beschaffenheit der Nahrung bleibt der Magen bis zu mehrere Stunden
nach der Mahlzeit teilweise gefüllt. Die Verweildauer im Magen beträgt z.B. bei Flüssigkeiten einige Minuten, bei einer Reismahlzeit 1-2 Stunden, bei gekochtem Fleisch 3-4 Stunden, und bei sehr fettreicher Nahrung (z.B. Ölsardinen) 6-9 Stunden. Der Mageninhalt
wird dabei angesäuert und angedaut (der Magen bildet ~10 ml Salzsäure
pro Tag). Da die Speisen meist selbst
puffernd wirken, kommt es nur zu langsamer Ansäuerung des Mageninhalts.
Das Ptyalin des verschluckten Speichels (α-Amylase; pH-Optimum nahe dem
Neutralpunkt) bleibt im Magen so lange aktiv, bis es vom sauren
Magensaft inaktiviert wird.
Im Bereich des Antrum (distaler Magen) dient die Motorik der
Zerkleinerung der Nahrung. Hier können Drucke bis über 100 mmHg
auftreten, vor dem geschlossenen Pylorus wird der Speisebrei "massiert", bis die Bruchstücke weniger als 2 mm
Durchmesser (durchschnittlich ~0,25 mm) haben und den Pylorus passieren können ("Antrummühle",  Abbildung). Die Magenmotorik erzeugt - noch vor der Emulgierung zu Mizellen
durch Gallensäuren - Fetttröpfchen mit einem Durchmesser von lediglich ~1 µm.
Abbildung). Die Magenmotorik erzeugt - noch vor der Emulgierung zu Mizellen
durch Gallensäuren - Fetttröpfchen mit einem Durchmesser von lediglich ~1 µm.
Die Geschwindigkeit der peristaltischen Kontraktionswelle (und der sie auslösenden elektrischen Aktivität,
die von der Oberfläche des Magens abgeleitet werden kann) nimmt umso
mehr zu, je näher sie dem Pylorus kommt. Dadurch "überholt" die
Peristaltik den Inhalt, sodass dieser Richtung Corpus zurückgedrängt
wird (Retropulsion) und hier verbleibt, bis die nächste Kontraktionswelle ankommt.
Im Rahmen des Brechreflexes kommt es - gesteuert durch das Brechzentrum im Hirnstamm - zu reverser Peristaltik.
Ausgehend vom distalen Dünndarm, befördert eine oralwärts laufende
Transportwelle Chymus in Duodenum und Magen. Reflektorisch kommt es zu
tiefer Einatmung, die Glottis schließt sich, die Exspirationsmuskulatur
spannt sich an und der Überdruck (bis über 100 mmHg) befördert den
Mageninhalt durch die Cardia in die Speiseröhre. Bei diesem Vorgang -
der sich mehrmals wiederholen kann - gleitet ein Teil des Magens
vorübergehend durch die Öffnung im Zwerchfell, in der sonst die Cardia
zu liegen kommt. Schließlich rückt der Kehlkopf nach vorne, und der zu
erbrechende Inhalt wird durch den oberen Oesophagussphincter nach außen
gepresst. Nicht Erbrochenes gelangt in den Magen zurück. Auch dieser
Vorgang kann sich mehrfach wiederholen. Massive Speichelsekretion dient
der Pufferung des sauren Mageninhalts.
Magenentleerung: Erst bei
diesem Verkleinerungsgrad der Partikel des Mageninhalts kann dieser in das
Duodenum passieren. Solche Relaxationsphasen, in denen der Pylorus eine
duodenalwärts gerichtete Peristaltik zulässt, erfolgen allerdings nur, wenn das
Duodenum das - neurohumoral geregelt - "freigibt".

Abbildung: Zeitverlauf der Magenentleerung
Nach
Steinert RE, Feinle-Bisset C, Asarian L, Horowitz M, Beglinger C, Geary
N. Ghrelin, CCK, GLP-1, and PYY(3–36): Secretory Controls and
Physiological Roles in Eating and Glycemia in Health, Obesity, and
After RYGB. Physiol Rev 2017; 97: 411-63
Der Magen (vor allem der Fundusteil) dient u.a. als Zwischenspeicher. Flüssige
Nahrung wird ohne Verzögerung an das Duodenum weitergegeben
(exponentielle Entleerung, rot - geringe Mengen Flüssigkeit werden
innerhalb weniger Minuten resorbiert). Feste Nahrung (grün) gelangt erst nach einer Latenzphase weiter.
Der Zeitverlauf hängt u.a. vom aufgenommenen Volumen, der Osmolarität, Energiedichte und Verdaubarkeit, auch vom Geschlecht ab (bei Frauen erfolgt die Magenentleerung langsamer als bei Männern). Fett- und ölreiche Nahrung verbleibt länger im Magen als saure, und diese länger als salzige.
Die
Entleerungszeiten sind kaum altersabhängig, aber individuell
unterschiedlich, bei ein und demselben Menschen (ceteris paribus)
ziemlich gleich, also individualtypisch

Ist der Duodenalinhalt noch sauer (was die Schleimhaut herausfordert und pankreatische Enzyme hemmt), wird der Pylorus nicht relaxiert. Ist das Duodenum hingegen aufnahmebereit, greifen endokrine Komponenten wie Motilin, das den myoelektrischen Komplex beschleunigt und die Magenentleerung anregt.
Das vom Dünndarm freigesetzte Peptidhormon Motilin regt die Magenentleerung an
|
Treibende
Kraft für die Magenentleerung ist der Tonus im proximalen Magen.
Flüssigkeiten verlassen den Magen umso rascher, je höher die im Magen
gespeicherte Menge ist (die Entleerung nimmt mit dem Volumen
exponentiell zu und verhindert so eine Überdehnung des Magens). Die Entleerung "fester" Nahrungsbestandteile zeigt
eine etwa lineare Kinetik (nimmt proportional mit dem Volumen zu).
 Die
Verdauungsvorgänge im Magen wurden erst zu Beginn des 19. Jahrhunderts
allmählich verstanden. Der amerikanische Arzt William Beaumont
machte an einem Patienten (Alexis St. Martin), der nach einem
Gewehrdurchschuss eine permanente Magenfistel hatte, Beobachtungen und
Experimente und stellte fest, dass der Magen auf Emotionen des
Patienten reagiert (1835). In Magensaftproben konnte er den wechselnden
Salzsäuregehalt nachweisen. (Die Amerikanische Physiologische
Gesellschaft besitzt heute das "Beaumont House" in Bethesda, Maryland)
Die
Verdauungsvorgänge im Magen wurden erst zu Beginn des 19. Jahrhunderts
allmählich verstanden. Der amerikanische Arzt William Beaumont
machte an einem Patienten (Alexis St. Martin), der nach einem
Gewehrdurchschuss eine permanente Magenfistel hatte, Beobachtungen und
Experimente und stellte fest, dass der Magen auf Emotionen des
Patienten reagiert (1835). In Magensaftproben konnte er den wechselnden
Salzsäuregehalt nachweisen. (Die Amerikanische Physiologische
Gesellschaft besitzt heute das "Beaumont House" in Bethesda, Maryland)
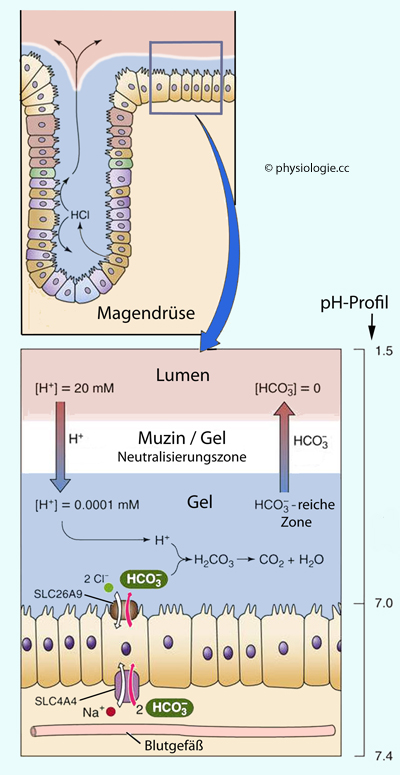
 Abbildung: Diffusions- und Schutzbarriere auf der Magenschleimhaut
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Abbildung: Diffusions- und Schutzbarriere auf der Magenschleimhaut
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Eine Mucin- und eine Flüssigkeitsschicht schützen die Magenschleimhaut. Unter einem gewissen Druck sezernierte Salzsäure gelangt aus den Belegzellen in der Tiefe der Drüse zur
Mittelzone der (blau dargestellten) Mucinsäule und entweicht durch
einen "Tunnel" in das Lumen (Pfeil nach oben), ohne den
bicarbonatreichen Schutzfilm zu kompromittieren und die Schleimhaut
anzugreifen ("viscous fingering").
Dringen
Wasserstoffionen in die unstirred layer direkt auf der Schleimhaut (blau), werden sie durch Bicarbonat
gepuffert. Potentiell schädliches Pepsin wird von der Mucinschicht am retrograden Durchtritt blockiert.
Eine wichtige Schutzfunktion hat auch die Durchblutung der Magenschleimhaut - diese hilft bei der Pufferung (Nachschub von Bicarbonat) und verhindert eine Selbstverdauung (Autodigestion) der Schleimhaut

Die als Mucin aus Nebenzellen (mucus secreting cells) bezeichnete Mischung aus Glykoprotein wird aus apikalen Granula freigesetzt. Mucin überzieht die Magenschleimhaut
mit einem vor Selbstandauung und Geschwürbildung schützenden Film ( Abbildung), insbesondere auch in der interdigestiven Phase (niedriger Oberflächen-pH).
Abbildung), insbesondere auch in der interdigestiven Phase (niedriger Oberflächen-pH).
Acetylcholin steigert die Mucinproduktion der Nebenzellen, wie auch physikalische (rauhe Speisen) und chemische (Alkohol) Reize; Cortisol hingegen hemmt sie und regt die Salzsäurebildung an (ulzerogene Wirkung).
Bei maximaler Anregung der Säureproduktion kann der intraluminale pH-Wert unter 1 sinken (d.h. die H+-Konzentration
auf über 100 mM ansteigen). Dass dabei die Epithelzellen der
Magenschleimhaut nicht zerstört werden, liegt an der durch Mucin
aufgebauten Diffusionsbarriere, die dem Epithel aufliegt
( Abbildung).
Abbildung).
Die Schutzschichte besteht hauptsächlich aus Mucin, Phospholipiden,
Elektrolyten und Wasser. Sie schützt nicht nur vor Säure, sondern auch
anderen Substanzen (z.B. Alkohol) sowie mechanischer Belastung durch
den vorbeigleitenden Speisebrei bzw. dessen Bestandteile.
 Bicarbonat aus Oberflächenepithelzellen (superficial epithelial cells)
des Corpus- und Antrumteils stellt in der dünnen "unstirred layer"-Schichte zwischen Zelloberfläche
und Mucinschicht einen pH-Wert von 6-7 ein, was das Epithel schützt,
indem es puffert und Pepsin inaktiviert (dieses dringt kaum durch die Mucinschicht).
Bicarbonat aus Oberflächenepithelzellen (superficial epithelial cells)
des Corpus- und Antrumteils stellt in der dünnen "unstirred layer"-Schichte zwischen Zelloberfläche
und Mucinschicht einen pH-Wert von 6-7 ein, was das Epithel schützt,
indem es puffert und Pepsin inaktiviert (dieses dringt kaum durch die Mucinschicht).
 Pepsin s. unten
Pepsin s. unten
 Intrinsic factor s. unten
Intrinsic factor s. unten
Belegzellen (Abbildung s. dort) produzieren Salzsäure. Die Steuerung ihrer Funktion ist komplex geregelt, sie erfolgt vor allem durch Gastrin und ECL-Zellen (gastrin-ECL-parietal cell axis). Nach dem gängigen Modell tun G-Zellen den ersten Schritt: Gastrin bewirkt über Gastrinrezeptoren (=CCK2-Rezeptoren) an ECL-Zellen die Freisetzung von Histamin, und dieses erhöht via H2-Rezeptoren
[cAMP] in Belegzellen - was diese zur Sekretion von Salzsäure
veranlasst. Parasympathische Aktivität kann dies direkt über M3-Rezeptoren bewirken.
Salzsäure: ~1 Milliarde Belegzellen (parietal (oxyntic) cells) produzieren ~10 ml HCl/Tag. Die proximalen 80% des Magens - Fundus, Corpus - produzieren Salzsäure (oxyntic gland area).
Die Bewegung von Chloridionen durch die apikale Membran erzeuget ein lumen-negatives Potential (-60 bis -70 mV).
Salzsäure
 aktiviert Pepsinogen,
aktiviert Pepsinogen,

 regt die
Ausschüttung von Gastrin an,
regt die
Ausschüttung von Gastrin an,
 wirkt keimtötend.
wirkt keimtötend.
Im Ruhezustand ist die Sekretionsleitung der Belegzellen
niedrig, röhrenförmige "Tubulovesikel" (apikale Membran!) enthalten
ruhende H/K-ATPase (Protonen-Kalium-Pumpe, die zur Familie der P-Typ ATPasen gehört). Sie besteht aus einer α- und einer β-Untereinheit, mit
unterschiedlicher Aufgabe: Die katalytische
Funktion hat die α-Untereinheit, die β-Untereinheit weiß, wo es
hingeht: Sie "steuert" das Enzym in die apikale Membran. Zur vollen
Aktivität bedarf die Protonen-Kalium-Pumpe beider Einheiten. Ihre Blockade kann die Säureproduktion vollständig stoppen.
Nach Beendigung der anregenden Reize bildet sich die Belegzelle wieder in die inaktive Form zurück.
Apikale Membran: Der Transport von Wasserstoffionen in das Lumen erfolgt über ATP-betriebenen H+/K+-Austausch.
Kalium- und Chloridionen gelangen - ihrem Gradienten folgend - über
eigene Kanäle in das Lumen. Kalium wird für die
Protonenpumpe benötigt, Chlorid "ergänzt" H+ zur Salzsäure.
| Die apikale Membran der Belegzelle tauscht H+ aktiv (ATP) gegen K+ aus und verfügt über Kaliumkanäle, über die K+ rezirkulieren kann
|
Basolaterale Membran: Das für
die HCl-Produktion benötigte Chlorid wird im Austausch gegen Bicarbonat
(dieses wird in der Belegzellen durch Wirkung von Carboanhydrase aus CO2 nachfabriziert) durch einen Cl/HCO3-Antiporter aus dem Interstitium herbeigeschafft ( Abbildung). Die obligate Na+/K+-ATPase ist ebenfalls vorhanden.
Abbildung). Die obligate Na+/K+-ATPase ist ebenfalls vorhanden.
| Die basolaterale Membran der Belegzelle bringt Chloridionen über einen Cl-/HCO3--Austauscher aus dem Interstitium in die Zelle
|
 Apikale
Apikale /
basolaterale Membran s.
dort
Bei der Produktion von HCl wird Carboanhydrase benötigt, um die Verwandlung von CO2 in Kohlensäure zu beschleunigen ( vgl. dort).
vgl. dort).

 Abbildung: Mechanismus der Säureproduktion der Belegzellen
Abbildung: Mechanismus der Säureproduktion der Belegzellen
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Der Schlüsselprozess der Bildung von Salzsäure ist die apikale Sekretion von H+ im Austausch gegen K+ (links), angetrieben durch eine H/K-Pumpe (die von der Zelle aufgenommenen Kaliumionen werden über
spannungsgesteuerte KvLQT1-Kaliumkanäle in das Lumen recycelt).
Der
abschließende Schritt ist die Diffusion von Cl- durch Chloridkanäle (CFTR: Cystic Fibrosis Transmembrane Conductance Regulator) - HCl ist sezerniert worden.
In der basolateralen Membran befindet sich Na/K-ATPase und ein Chlorid-Bicarbonat-Austauscher.
Durch die Sekretion von Wasserstoffionen steigt der intrazelluläre pH-Wert, was die Aufnahme von CO2,
die Bildung von Bicarbonat und den Nachschub von Protonen antreibt (CA
= Carboanhydrase). Bicarbonat wird basolateral im Austausch gegen
Chlorid ausgeschieden (Pufferbasennachschub). Chlorid betritt die Zelle
basolateral auch über Na/K/2Cl-Symporter und den SLC26A7-solute carrier
(oben). AE = anion exchanger
Wasser diffundiert transzellulär in das Magenlumen
 Die Bewegung von Chloridionen durch die apikale Membran ist der Hauptgrund für das lumen-negative Potential
(-60 bis -70 mV), das für säureproduzierende Magenschleimhaut
charakteristisch ist (Ösophagus: -15 mV; Duodenum: -5 mV) und mit
Elektroden (Katheterpositionierung) gemessen werden kann. Dieses
Potential unterstützt die Sekretion von Protonen, die auf diese Weise einem elektrischen Gradienten folgen können.
Die Bewegung von Chloridionen durch die apikale Membran ist der Hauptgrund für das lumen-negative Potential
(-60 bis -70 mV), das für säureproduzierende Magenschleimhaut
charakteristisch ist (Ösophagus: -15 mV; Duodenum: -5 mV) und mit
Elektroden (Katheterpositionierung) gemessen werden kann. Dieses
Potential unterstützt die Sekretion von Protonen, die auf diese Weise einem elektrischen Gradienten folgen können.
Die folgende Tabelle zeigt, dass die Konzentration an Natriumionen im Lumen der Canaliculi von Belegzellen rund 50-mal niedriger ist als in
der interstitiellen (extrazellulären) Flüssigkeit, die an
Wasserstoffionen hingegen um 7-8 Zehnerpotenzen höher liegt. (Die
Konzentration an Kaliumionen liegt gut beim 3-fachen, diejenige an Chloridionen um ca. 50% höher als im Interstitium - sie diffundieren durch Kalium- bzw. Chloridkanäle in der apikalen Membran in das Lumen). Die "bergauf" laufenden Transporte werden luminal (apikal) durch H+/K+-, basolateral durch Na+/K+-Pumpen hergestellt (beide verbrauchen ATP).
Konzentrationsvergleiche
|
Ion
|
Interstitielle Flüssigkeit
|
Lumen eines Canaliculus
|
Na+
|
144 mM
|
3 mM
|
| K+ |
4,5 mM
|
15 mM
|
Cl-
|
116 mM
|
173 mM
|
| H+ |
4.10-5 mM
|
155 mM
|
Der Magensaft kann bis zu einem pH-Wert von 1 erreichen - entsprechend
einer ~106-fachen Konzentrierung von Wasserstoffionen (der pH-Wert
ist ein negativer dekadischer Logarithmus, d.h. eine Hochzahl auf der
Basis zehn. 10-1 ist das Millionenfache von 10-7);
meist liegt er zwischen pH 2 und pH 3. Das denaturiert Proteine, d.h.
lädt Aminosäuren positiv auf und "entknäuelt" Eiweißmoleküle (was den
Angriff von Proteasen erleichtert), aktiviert Pepsin und macht Bakterien das Überleben
schwer.
Hemmung der Magensäureproduktion. Der zytoprotektive Effekt von Prostaglandinen beruht u.a.
auf der Bildung von Bicarbonat und Mucin sowie Hemmung der
Säuresekretion. Schleimhaut- und glatte Muskelzellen des Magens bilden PGE2 - dieses entsteht aus Arachidonsäure (in der Zellmembran - Wirkung der Cyclooxygenase).
 Prostaglandin-Synthesehemmer - nichtsteroidale Antirheumatika (NSAR) wie Acetylsalizylsäure oder Diclofenac - werden
u.a. wegen ihrer schmerzhemmenden Wirkung verwendet. Sie reduzieren die
Aktivität der Zyklooxygenase und damit auch die Schleimproduktion der
Nebenzellen; zusätzlich schränken sie die Durchblutungsregulation der Mucosa ein und regen die Säureproduktion an.
Der Säureschutz der Magenschleimhaut wird also durch Gabe von NSAR
dreifach herausgefordert; Magengeschwüre können die Folge sein.
Prostaglandin-Synthesehemmer - nichtsteroidale Antirheumatika (NSAR) wie Acetylsalizylsäure oder Diclofenac - werden
u.a. wegen ihrer schmerzhemmenden Wirkung verwendet. Sie reduzieren die
Aktivität der Zyklooxygenase und damit auch die Schleimproduktion der
Nebenzellen; zusätzlich schränken sie die Durchblutungsregulation der Mucosa ein und regen die Säureproduktion an.
Der Säureschutz der Magenschleimhaut wird also durch Gabe von NSAR
dreifach herausgefordert; Magengeschwüre können die Folge sein.
| PGE2 hemmt die Produktion von HCl und fördert die Mucin- und Bicarbonatsekretion
|
Der Schutz der Magenschleimhaut basiert auf folgenden Mechanismen:
 Reduktion der Magensäureproduktion der Belegzellen
Reduktion der Magensäureproduktion der Belegzellen

 Erhöhte Durchblutung der Magenschleimhaut
Erhöhte Durchblutung der Magenschleimhaut
 Bildung von Schleim und Bicarbonat (Pufferung) - der alkalische Schleim
neutralisiert direkt die Wasserstoffionen (der pH-Wert liegt im Cardia-
und Antrumbereich bei ~7!)
Bildung von Schleim und Bicarbonat (Pufferung) - der alkalische Schleim
neutralisiert direkt die Wasserstoffionen (der pH-Wert liegt im Cardia-
und Antrumbereich bei ~7!)
Dabei spielt Somatostatin
eine wichtige Rolle:
 Es senkt in den Belegzellen die
cAMP-Konzentration (direkter Effekt) und
Es senkt in den Belegzellen die
cAMP-Konzentration (direkter Effekt) und
 hemmt die Aktivität der
G-Zellen (parakrin) sowie der ECL-Zellen (endokrin), senkt also die
Gastrin- und Histaminfreisetzung (indirekter Effekt).
hemmt die Aktivität der
G-Zellen (parakrin) sowie der ECL-Zellen (endokrin), senkt also die
Gastrin- und Histaminfreisetzung (indirekter Effekt).
D-Zellen werden
durch einen niedrigen pH-Wert im Magen (<3) angeregt sowie neuronal
und humoral gesteuert. Somatostatin gilt als genereller Hemmstoff und
wird fast überall im Körper gebildet; es inhibiert auch Cholezystokinin
(CCK) und VIP.
Auch Sekretin, VIP
und GIP dämpfen die Gastrinfreisetzung, fördern die Aktivität der
D-Zellen und hemmen die Säurebildung. Weiters werden Belegzellen durch Cholecystokinin gehemmt. Aus dem Ileum
und Colon kommen weitere Signale: Bei lipidreichem Darminhalt bewirken
von hier aus weitere Faktoren wie Peptid YY eine Bremsung der Belegzellaktivität.


 Ist
dieses Gleichgewicht nicht gegeben, besteht die Gefahr von
Schleimhautschädigung, Entzündung und Geschwürbildung (gastroduodenales
Ulcus, s. unten).
Ist
dieses Gleichgewicht nicht gegeben, besteht die Gefahr von
Schleimhautschädigung, Entzündung und Geschwürbildung (gastroduodenales
Ulcus, s. unten).
Eine weitere Funktion der Belegzellen ist die Produktion von Intrinsic factor:
Intrinsic factor
Intrinsic
factor (MG 55 kDa) reagiert mit Vitamin B12 (=Kobalamin) aus
der Nahrung und befördert es in gebundener Form in den Dünndarm weiter.
Dort wird das Vitamin resorbiert. Atrophie der Magenschleimhaut führt
u.a. zu Vitamin B12-Mangel. Da die Leber einen Vitamin
B12-Vorrat
für viele Monate (bis mehrere Jahre) speichern kann, treten Symptome
nach mangelnder Vitaminzufuhr ("perniziöse" Anämie, funikuläre Myelose)
sehr
verzögert auf.
Der Intrinsic factor (IF) der Belegzellen bindet Vitamin B12 im Magen
Der untere Dünndarm (Ileum) endozytiert den IF-B12-Komplex
|
Pepsinogene sind das Produkt der Hauptzellen (chief cells, peptic cells). Diese haben
ein hochentwickeltes endoplasmatisches Retikulum, mit dem sie
Pepsinogen produzieren. Dieses wird vom Golgi-Apparat in Zymogenvesikel verpackt, die zum
apikalen Zellpol wandern und bei Reizung in das Magenlumen freigesetzt
werden.
In der interdigestiven Phase beträgt die Pepsinogensekretion etwa 20% der digestiv maximal erreichbaren.
Bei einem pH<3 entstehen aus Pepsinogenen
(einer aus mehreren Gruppen bestehenden Proteinfamilie: Pepsinogen A,
B, C, F, Prochymosin - allesamt Zymogene, d.h. Vorstufen eines aktiven
Enzyms) durch Abspaltung eines N-terminalen Peptids Pepsine (spontane Aktivierung). Diese Endopeptidasen (~36 kDa) wirken eiweißspaltend,
so lange genügend Salzsäure für ihre Aktivierung vorhanden ist. Pepsine aktivieren auch ihre eigene Vorstufe.
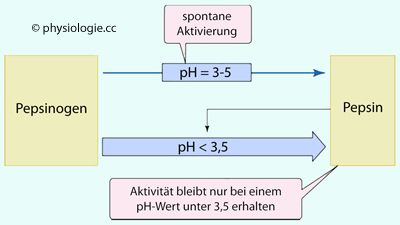
 Abbildung: Aktivierung von Pepsinogenen zu Pepsin
Abbildung: Aktivierung von Pepsinogenen zu Pepsin
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Ist
die Konzentration von Wasserstoffionen hoch genug (pH unter 5),
entsteht Pepsin spontan aus seiner Vorstufe, den Pepsinogenen. Es
bleibt nur stabil, wenn der pH-Wert <3,5 ist, andernfalls wird es
wieder inaktiv. Dadurch ist seine Aktivität im weniger sauren Bereich
limitiert

Hauptzellen
werden durch eine Reihe von Stimuli zur Freisetzung von Pepsinogenen
angeregt. Sie verfügen über eine Vielzahl an Rezeptoren, u.a. für
 Acetylcholin (der wichtigste Stimulus für die Pepsinogensekretion)
Acetylcholin (der wichtigste Stimulus für die Pepsinogensekretion)
 Sekretin (Acetylcholin regt auch die Säureproduktion an und diese sie Sekretinbildung)
Sekretin (Acetylcholin regt auch die Säureproduktion an und diese sie Sekretinbildung)
 VIP (wirkt sekretionsfördernd)
VIP (wirkt sekretionsfördernd)
 Gastrin (regt Belegzellen an)
Gastrin (regt Belegzellen an)
Pepsine wirken am besten in einem pH-Bereich zwischen 1,8 und 3,5.
Setzen sie aus dem Chymus kleine Peptide und Aminosäuren frei, wirken
diese wiederum anregend auf die Gastrinfreisetzung aus G-Zellen des
Antrum. Damit wird wiederum die Ansäuerung des Mageninhalts verstärkt.
Regulation der Magentätigkeit
Ohne Anregung produziert der Magen
10-15% der Menge an Salzsäure, die er bei maximaler Stimulierung
sezerniert; das reicht aus, um dem Flüssigkeitsfilm auf der Mucosa
einen pH<2 zu verleihen. Diese basale Sekretion unterliegt einem
zirkadianen Rhythmus (geringe Menge morgens, höhere abends). Wie dieser
Rhythmus zustande kommt, ist unkar, denn die basale (interdigestive)
Gastrinfreisertzung ist ziemlich konstant.


Abbildung: Autonome und humorale Einflüsse auf die Magentätigkeit
Nach einer Vorlage in New Human Physiology
Der
Sympathikus sowie Enterogastrone (duodenale Hormone, z.B. Sekretin,
Cholecystokinin) hemmen die Magentätigkeit, der Parasympathikus (Vagus) und Gastrin
fördern
sie. Belegzellen produzieren Salzsäure.
Die Schrittmacherzone (rot) für die Magenperistaltik befindet sich im Übergangsbereich von Fundus- zu Corpus-Region
 Nahrungsaufnahme erhöht die Sekretion (Digestionsphasen s. oben);
etwa eine Stunde nach Beginn der Mahlzeit erreicht die Säureproduktion
einen Höhepunkt. Mit sinkendem pH-Wert (Ansäuerung des Chymus mit
sinkender Pufferwirkung sowie Entleerung des Magens) wird die
Gastrinfreisetzung gehemmt; für die Steuerung der Säurebildung ist
diese negative Rückkopplung extrem bedeutsam.
Nahrungsaufnahme erhöht die Sekretion (Digestionsphasen s. oben);
etwa eine Stunde nach Beginn der Mahlzeit erreicht die Säureproduktion
einen Höhepunkt. Mit sinkendem pH-Wert (Ansäuerung des Chymus mit
sinkender Pufferwirkung sowie Entleerung des Magens) wird die
Gastrinfreisetzung gehemmt; für die Steuerung der Säurebildung ist
diese negative Rückkopplung extrem bedeutsam.
 Angeregt
Angeregt werden ECL-Zellen durch Gastin, Acetylcholin (über muskarinische M
1-Rezeptoren - diese Achse ist
durch Atropin blockierbar) und auch Noradrenalin.
Stimulation
der ECL-Zellen erhöht die Säureproduktion via Histamin - dies erfolgt
über Steigerung des cAMP-Spiegels in den Belegzellen. Vermutlich sind ECL-Zellen auch endokrin tätig (
Wachstumsfaktoren u.a.).

Der wichtigste
Inhibitor der ECL-Zellen ist Somatostatin.
Aktive ECL-Zellen stimulieren die Säurebildung, der pH im Magen sinkt
Somatostatin hemmt ECL-Zellen und Säurebildung
|
 Freisetzung von Gastrin aus G-Zellen - diese Wirkung wird durch GRP vermittelt (s. oben).
Anlagerung des Gastrins an den CCK-2-Rezeptor (Gastrinrezeptor) steigert den intrazellulären Ca++-Spiegel in der Belegzelle.
G-Zellen begrenzen ihre eigene Aktivität, indem ihr Gastrin (sowie auch
die gebildete Salzsäure) D-Zellen stimuliert, was wiederum über das
entstehende Somatostatin G-Zellen inhibiert
Freisetzung von Gastrin aus G-Zellen - diese Wirkung wird durch GRP vermittelt (s. oben).
Anlagerung des Gastrins an den CCK-2-Rezeptor (Gastrinrezeptor) steigert den intrazellulären Ca++-Spiegel in der Belegzelle.
G-Zellen begrenzen ihre eigene Aktivität, indem ihr Gastrin (sowie auch
die gebildete Salzsäure) D-Zellen stimuliert, was wiederum über das
entstehende Somatostatin G-Zellen inhibiert
 M3-Rezeptor-vermittelte Hemmung der Freisetzung von Somatostatin. Da Somatostatin die Belegzellen hemmt sowie auch die Freisetzung von Histamin, bewirkt die Reduktion der Somatostatinbildung eine
Disinhibition, regt also die HCl-Produktion an (dies bewirkt der Vagus
auch direkt).
M3-Rezeptor-vermittelte Hemmung der Freisetzung von Somatostatin. Da Somatostatin die Belegzellen hemmt sowie auch die Freisetzung von Histamin, bewirkt die Reduktion der Somatostatinbildung eine
Disinhibition, regt also die HCl-Produktion an (dies bewirkt der Vagus
auch direkt).
 Aktivierung von Oberflächenzellen zur Bildung von Bicarbonat - diese Wirkung haben auch Prostaglandine (PGE2)
Aktivierung von Oberflächenzellen zur Bildung von Bicarbonat - diese Wirkung haben auch Prostaglandine (PGE2)
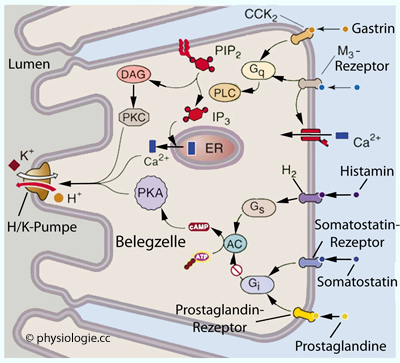
 Abbildung: Rezeptoren und Signaltransduktionswege einer Belegzelle
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Abbildung: Rezeptoren und Signaltransduktionswege einer Belegzelle
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Acetylcholin (über M3-Rezeptor), Gastrin (über CCK2-Rezeptor) und Histamin (über H2-Rezeptor) wirken über die gezeigten Signalkaskaden anregend auf die H/K-Pumpe in der apikalen Membran.
Histamin, Gastrin und Acetylcholin fördern, Somatostatin hemmt die Insertion von H/K-ATPase
in die apikale Membran der Belegzelle. Dies wird vermittelt durch cAMP
(Histamin, Somatostatin) oder Calciumionen (Gastrin, Acetylcholin).
Prostaglandine
hemmen via Rezeptoren in der basolateralen Membran Adenylylcyclase und
senken auch die Histaminfreisetzung aus ECL-Zellen.
AC = Adenylylcyclase, DAG = Diacylglycerol, ER = endoplasmatisches
Retikulum, PIP2 = Phosphatidylinositol- Biphosphat, PKA = Proteinkinase
A, PKC = Proteinkinase C, PLC = Phospholipase C

 Abbildung)
Abbildung)
 Acetylcholin aus postganglionär-parasympathischen Fasern über M3-Rezeptoren - das
steigert intrazelluläres Calcium
Acetylcholin aus postganglionär-parasympathischen Fasern über M3-Rezeptoren - das
steigert intrazelluläres Calcium
 Gastrin aus G-Zellen - wirkt auf CCK-2-Rezeptoren (Gastrinrezeptoren), auch das
steigert intrazelluläres Calcium
Gastrin aus G-Zellen - wirkt auf CCK-2-Rezeptoren (Gastrinrezeptoren), auch das
steigert intrazelluläres Calcium

Histamin aus ECL-Zellen - wirkt auf
H2-Rezeptoren
und wirkt über cAMP-Anstieg anregend auf die Belegzelle. Somatostatin
senkt cAMP und wirkt dadurch hemmend auf die Säureproduktion.
Acetylcholin, Gastrin und Histamin regen die Salzsäureproduktion der Belegzellen an
|
 Maximale Anregung der Salzsäureproduktion erfolgt durch die kombinierte Wirkung von Acetylcholin, Histamin und Gastrin. Die gemeinsame Wirkung dieser Komponenten zur Erreichung eines maximalen Effekts ist ein Beispiel für Potenzierung.
Maximale Anregung der Salzsäureproduktion erfolgt durch die kombinierte Wirkung von Acetylcholin, Histamin und Gastrin. Die gemeinsame Wirkung dieser Komponenten zur Erreichung eines maximalen Effekts ist ein Beispiel für Potenzierung.
 Wirkt
nur eine oder zwei dieser Anregungen, ist die Säurebildung deutlich
reduziert. Das bedeutet, dass die Blockade nur eines dieser Faktoren
bereits einen starken Drosselungseffekt auf die Säureproduktion hat -
z.B. wirkt die Gabe eines Histamin-Rezeptorblockers deutlich säurehemmend, auch bei hoher Konzentration von Acetylcholin und Gastrin an der Belegzelle.
Wirkt
nur eine oder zwei dieser Anregungen, ist die Säurebildung deutlich
reduziert. Das bedeutet, dass die Blockade nur eines dieser Faktoren
bereits einen starken Drosselungseffekt auf die Säureproduktion hat -
z.B. wirkt die Gabe eines Histamin-Rezeptorblockers deutlich säurehemmend, auch bei hoher Konzentration von Acetylcholin und Gastrin an der Belegzelle.
Protonenpumpenhemmer können die H+/K+-ATPase und damit die Säureproduktion des Magens vollständig blockieren. Sie werden zur
Behandlung von Magengeschwüren eingesetzt, die durch Überproduktion von
Salzsäure entstehen (Gastrinome bedingen das Zollinger-Ellison-Syndrom,
bei dem die Zahl und Aktivität von G-Zellen erhöht ist).
Bei Anregung bilden G-Zellen der Schleimhaut des Antrum (distale 20% des Magens, pyloric gland mucosa) Gastrin. Antrum-G-Zellen haben Mikrovilli an ihrer apikalen Membran und sind vom "offenen" Typ, d.h. ihr apikalenr Pol hat Kontakt mit dem Lumeninhalt ( s. dort).
s. dort).
G-Zellen werden angeregt durch
 Dehnung der Magenwand
Dehnung der Magenwand, insgesondere im Antrum - dies ist der stärkste Reiz für die Gastrinausschüttung und wirkt
Acetylcholinunabhängig über postganglionär-
parasympathische Fasern (N. vagus), die
GRP freisetzen (

Abbildung unten). Vermittelt wird dieser Effekt durch
lokale Nervenbahnen sowie einen
vagovagalen Reflex;
 Die Wirkungskette
postganglionäre Zelle → GRP → Gastrin → Belegzelle →
Salzsäureproduktion ist an keiner Stelle cholinerg vermittelt und daher durch Atropin nicht blockierbar.
Die Wirkungskette
postganglionäre Zelle → GRP → Gastrin → Belegzelle →
Salzsäureproduktion ist an keiner Stelle cholinerg vermittelt und daher durch Atropin nicht blockierbar.
 GRP wird durch cholinerge Anregung freigesetzt (
GRP wird durch cholinerge Anregung freigesetzt ( Abbildung) und regt die Gastrinsekretion in G-Zellen an.
Der metabotrope GRP-Rezeptor BB2
(benannt nach Bombesin, einem strukturell ähnlichen Peptid in der Haut der Rotbauchunke bombina bombina) entsteht außer im Magen auch in Pankreas, Nebennierenrinde und
Gehirn.
Abbildung) und regt die Gastrinsekretion in G-Zellen an.
Der metabotrope GRP-Rezeptor BB2
(benannt nach Bombesin, einem strukturell ähnlichen Peptid in der Haut der Rotbauchunke bombina bombina) entsteht außer im Magen auch in Pankreas, Nebennierenrinde und
Gehirn.
 In der gastrischen Phase werden G-Zellen durch die Anwesenheit appetitanregender Substanzen in Magen und Duodenum -
"Saftlocker" wie Oligopeptide (z.B. in Suppen), Aminosäuren, weiters Nikotin, Koffein, Alkohol angeregt.
In der gastrischen Phase werden G-Zellen durch die Anwesenheit appetitanregender Substanzen in Magen und Duodenum -
"Saftlocker" wie Oligopeptide (z.B. in Suppen), Aminosäuren, weiters Nikotin, Koffein, Alkohol angeregt.
Zeitverlauf: Der Anstieg des Gastrinspiegels im Blut - auf ein Mehrfaches des Basiswertes - erfolgt innerhalb von 30-60 Minuten nach Einnahme des Mahles.
Gehemmt wird die Gastrinfreisetzung durch folgende Faktoren:
 pH-Wert ≤3 im Magenlumen (Selbstbegrenzung der Säurebildung) - durch
Somatostatin aus D-Zellen im Antrum- und Corpusteil des Megans, die auf niedrigen pH-Wert (<3) im
Lumen reagieren. Gastrin regt die Sekretion von Somatostatin an (negative Rückkopplung).
pH-Wert ≤3 im Magenlumen (Selbstbegrenzung der Säurebildung) - durch
Somatostatin aus D-Zellen im Antrum- und Corpusteil des Megans, die auf niedrigen pH-Wert (<3) im
Lumen reagieren. Gastrin regt die Sekretion von Somatostatin an (negative Rückkopplung).
Somatostatin hemmt die Gastrinfreisetzung direkt und indirekt ( Abbildung oben): Im direkten
Weg (para- oder endokrin) bindet es an Somatostatinrezeptoren der
basolateralen Membran von Belegzellen und hemmt deren Säureproduktion;
in zwei indirekten entweder durch Hemmung von ECL-Zellen im Corpusteil des Magens, oder durch Hemmung von G-Zellen im Antrum.
Abbildung oben): Im direkten
Weg (para- oder endokrin) bindet es an Somatostatinrezeptoren der
basolateralen Membran von Belegzellen und hemmt deren Säureproduktion;
in zwei indirekten entweder durch Hemmung von ECL-Zellen im Corpusteil des Magens, oder durch Hemmung von G-Zellen im Antrum.
Saurer Chymus (pH<3) blockiert die Säureproduktion des Magens
|
 Enterogastrone, die von Dünn- und Dickdarm in der intestinalen Phase bei Dehnung, Hypertonizität, Übersäuerung oder hoher Fettsäurekonzentration abgegeben werden
Enterogastrone, die von Dünn- und Dickdarm in der intestinalen Phase bei Dehnung, Hypertonizität, Übersäuerung oder hoher Fettsäurekonzentration abgegeben werden
 Prostaglandine (PGE2, PGI2) hemmen die Salzsäureproduktion der Belegzellen vermutlich indem sie mit der Histaminwirkung auf Belegzellen interferieren. Siehemmen
via Prostaglandinrezeptoren in der basolateralen Membran die
Adenylylcyclase und reduzieren darüber hinaus die Histaminfreisetzung
aus ECL-Zellen.
Prostaglandine (PGE2, PGI2) hemmen die Salzsäureproduktion der Belegzellen vermutlich indem sie mit der Histaminwirkung auf Belegzellen interferieren. Siehemmen
via Prostaglandinrezeptoren in der basolateralen Membran die
Adenylylcyclase und reduzieren darüber hinaus die Histaminfreisetzung
aus ECL-Zellen.


Abbildung: Steuerung der Magensaftsekretion
Modifiziert nach Boron / Boulpaep, Medical Physiology, 1st ed. Saunders 2003
Magencorpus: Belegzellen (Parietalzellen, parietal cells) produzieren Salzsäure und verfügen über Rezeptoren für Acetylcholin, Histamin, Cholezystokinin (alle anregend) und Somatostatin (hemmend). ECL-Zellen (Enterochromaffin- like cells) produzieren Histamin und haben Rezeptoren für Acetylcholin (M1) und Gastrin (anregend) sowie Somatostatin (hemmend). D-Zellen produzieren Somatostatin und werden durch Acetylcholin gehemmt.
Magenausgang:
 G-Zellen
produzieren Gastrin; sie werden apikal angeregt durch Oligopeptide im
Darmlumen ("Saftlocker") und basolateral durch GRP (Rezeptoren),
gehemmt durch Somatostatin. D-Zellen produzieren Somatostatin; sie werden apikal durch H-Ionen, basolateral durch Gastrin angeregt und durch Acetylcholin gehemmt.
ACh, Acetylcholin
G-Zellen
produzieren Gastrin; sie werden apikal angeregt durch Oligopeptide im
Darmlumen ("Saftlocker") und basolateral durch GRP (Rezeptoren),
gehemmt durch Somatostatin. D-Zellen produzieren Somatostatin; sie werden apikal durch H-Ionen, basolateral durch Gastrin angeregt und durch Acetylcholin gehemmt.
ACh, Acetylcholin  CCK, Cholezystokinin
CCK, Cholezystokinin  CCKB = CCK2-Rezeptor = Gastrinrezeptor
CCKB = CCK2-Rezeptor = Gastrinrezeptor

Gastrin wird in der Form von Vorstufen gebildet und von der G-Zelle durch posttranslationale Verarbeitung (posttranslational processing) aufbereitet: Präprogastrin ist das primäre Transkript. Durch Sulfatierung und Enteroproteolyse entstehen Progastrine, die weiterer Endoproteolyse, sowie Ringbildung zu einem Pyroglutamylrest unterliegen.
So werden Gastrin-Zwischenformen (Intermediate) gebildet, aus denen durch weitere Modifikationen schließlich das aus 17 Aminosäuren bestehende (G-17), biologisch aktive Gastrin entsteht, das
vor dem Angriff durch Amino- und Carboxypeptidasen geschützt ist.
Gastrin wird in Granula an der Zellbasis (basolateral) gespeichert und bei Bedarf an das Interstitium freigegeben, von wo es in die Blutbahn gelangt.
Gastrin fördert
bei Füllung des Magens die Sekretion von Salzsäure und Pepsinogen sowie
die Kontraktionstätigkeit des Magens. Es wirkt über
CCK-2-Rezeptoren (Gastrinrezeptoren) in der Membran der betreffenden Zellen (DAG → Phospholipase C → L-Typ-Calciumkanäle → Einströmen extrazellulären Calciums → Exozytose histaminhältiger sekretorischer Vesikel → Histaminfreisetzung).
Gastrin fördert auch (über verstärkte Expression der
Histamin-Decarboxylase) die Histaminsynthese und -speicherung in
ECL-Zellen (Enterochromaffin-ähnliche, ECL, enterochromaffin-like cells -  Abbildung).
Abbildung).
 Die biologische Aktivität erfolgt über die letzten vier Aminosäuren des Gastrins; das synthetische Pentagastrin
enthält diese Aminosäuren (plus N-terminales Alanin, was die Stabilität
erhöht) und wirkt dementsprechend anregend auf Motorik und Sekretion
des Magens etc. (s. unten).
Die biologische Aktivität erfolgt über die letzten vier Aminosäuren des Gastrins; das synthetische Pentagastrin
enthält diese Aminosäuren (plus N-terminales Alanin, was die Stabilität
erhöht) und wirkt dementsprechend anregend auf Motorik und Sekretion
des Magens etc. (s. unten).
Gastrin bewirkt also
 Anregung der Säureproduktion der Belegzellen
Anregung der Säureproduktion der Belegzellen

 Wachstum der Mucosa (Bereich der Belegzellen im Magen, Schleimhaut des Dünn- und Dickdarms; Antrektomie führt zu Atrophie der restlichen Magenschleimhaut)
Wachstum der Mucosa (Bereich der Belegzellen im Magen, Schleimhaut des Dünn- und Dickdarms; Antrektomie führt zu Atrophie der restlichen Magenschleimhaut)

 Anregung von Funktion und Wachstum histaminproduzierender ECL-Zellen im Corpusteil (unterstützt die Säureproduktion)
Anregung von Funktion und Wachstum histaminproduzierender ECL-Zellen im Corpusteil (unterstützt die Säureproduktion)
Zahlreiche weitere Wirkungen wurden beschrieben, sind aber physiologisch wohl nicht bedautsam:
 Tonuserhöhung (Verschluss) des Kardiasphinkters
Tonuserhöhung (Verschluss) des Kardiasphinkters

 Anregung der Peristaltik am Magenausgang
Anregung der Peristaltik am Magenausgang

 Sekretion von Galle
und Pankreassaft
Sekretion von Galle
und Pankreassaft

 Stimulation von D-Zellen im Antrum (Selbsthemmung der G-Zellen)
Stimulation von D-Zellen im Antrum (Selbsthemmung der G-Zellen)
Rezeptor: Gastrin wirkt über CCK2-Rezeptoren.
Die trophische Wirkung des Gastrins auf die Schleimhaut von Magen und
Darm erklärt sich über eine Anregung der Synthese von Nukleinsäuren und
Proteinen.
Überproduktion von
Gastrin (Gastrinom) bedingt Mucosa-Hyperplasie / Hypertrophie und
vermehrtes Wachstum von ECL-Zellen, Reduktion der Gastrinproduktion
(Antrektomie) führt zu gastrointestinaler Schleimhautatrophie (behebbar
durch exogenes Gastrin).
Dünn- und Dickdarm geben in der intestinalen Phase - bei Dehnung, Hypertonizität,
Übersäuerung oder hoher Fettsäurekonzentration - kollektiv als Enterogastrone bezeichnete Hormone ab: Dazu zählen
 Sekretin und GIP aus Duodenum und Jejunum,
Sekretin und GIP aus Duodenum und Jejunum,
 Peptid YY und GLP-1 aus Ileum und Colon.
Peptid YY und GLP-1 aus Ileum und Colon.
Durch die
Wirkung der Enterogastrone wird eine Übersäuerung der Schleimhaut
verhindert, das pH-Optimum intestinaler Enzyme bewahrt und der Fettverdauung mehr Zeit gegeben.
Die intestinale Phase trägt bis zu 70% zur gesamten anregenden Wirkung auf die digestiven Vorgänge bei.

Verdauungshormone, welche die H+-Sekretion im Magen hemmen

Nach Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
|
Hormon
|
Bildungsort
|
CCK
|
I-Zellen in Duodenum und Jejunum, Neurone in Ileum und Colon
|
Sekretin
|
S-Zellen im Dünndarm
|
VIP
|
Neurone des Darmnervensystems
|
GIP
|
K-Zellen in Duodenum und Jejunum
|
Neurotensin
|
Endokrine Zellen im Ileum
|
Peptid YY
|
Endokrine Zellen in Ileum und Colon
|
Somatostatin
|
D-Zellen in Magen und Duodenum, ∂-Zellen in Langerhans-Inseln
|

Übermäßiger Kaffeegenuss kann Magenschmerzen verursachen, da Koffein die Gastrinbildung und damit die Sekretion von Salzsäure anregt.


 Funktionelle Einschränkungen des gastrischen Nervensystems (wie bei diabetischer Neuropathie) beeinträchtigen die Magenmotorik (MMC), was zur Bildung von Magensteinen führen kann. Die gastrische Akkommodation des Fundusbereichs (
Funktionelle Einschränkungen des gastrischen Nervensystems (wie bei diabetischer Neuropathie) beeinträchtigen die Magenmotorik (MMC), was zur Bildung von Magensteinen führen kann. Die gastrische Akkommodation des Fundusbereichs ( s. oben) läßt nach, dies führt zu ungenügender Zwischenspeicherung und Auftreten von Völlegefühl.
s. oben) läßt nach, dies führt zu ungenügender Zwischenspeicherung und Auftreten von Völlegefühl.
 Überdehnung des Magens, Sekretin und zu niedriger
pH-Wert des Mageninhalts hemmen die Gastrinfreisetzung.
Überdehnung des Magens, Sekretin und zu niedriger
pH-Wert des Mageninhalts hemmen die Gastrinfreisetzung.
 Übermäßige
Freisetzung von Salzsäure leistet der Bildung von Geschwüren
(gastroduodenale Ulzera) Vorschub. Die HCl-Produktion kann verringert (und die Ausheilung von Ulzera gefördert) werden durch
Übermäßige
Freisetzung von Salzsäure leistet der Bildung von Geschwüren
(gastroduodenale Ulzera) Vorschub. Die HCl-Produktion kann verringert (und die Ausheilung von Ulzera gefördert) werden durch
 Hemmung von Histaminrezeptoren
(durch H2- Rezeptorblocker)
Hemmung von Histaminrezeptoren
(durch H2- Rezeptorblocker)
 Gabe von Somatostatin-Analoga und Prostaglandin E2 (
Gabe von Somatostatin-Analoga und Prostaglandin E2 ( Mechanismen s. oben)
Mechanismen s. oben)
 Hemmung der H+/K+-ATPase
der Belegzellen (durch H+-Pumpen-Hemmer wie Omeprazol)
Hemmung der H+/K+-ATPase
der Belegzellen (durch H+-Pumpen-Hemmer wie Omeprazol)
 Patienten, denen Teile des Magens
entfernt wurde, müssen in kleineren Zeitabständen beschränkte
Nahrungsmengen zu sich nehmen, um ein "Dumping-Syndrom"
mit allzu starken
Schwankungen des Blutzuckerspiegels zu vermeiden. Dabei kommt es zu
überstürzter Entleerung von Mageninhalt in den Dünndarm,
Flüssigkeitsverschiebung in den Darm (osmotische Wirkung) und Störungen
der Glukostase (heftige Blutzucker- und Insulinschwankungen). Symptome
sind Krämpfe und Übelkeit nach Mahlzeiten, begleitet mit
Schweißausbrüchen und Tachykardie.
Patienten, denen Teile des Magens
entfernt wurde, müssen in kleineren Zeitabständen beschränkte
Nahrungsmengen zu sich nehmen, um ein "Dumping-Syndrom"
mit allzu starken
Schwankungen des Blutzuckerspiegels zu vermeiden. Dabei kommt es zu
überstürzter Entleerung von Mageninhalt in den Dünndarm,
Flüssigkeitsverschiebung in den Darm (osmotische Wirkung) und Störungen
der Glukostase (heftige Blutzucker- und Insulinschwankungen). Symptome
sind Krämpfe und Übelkeit nach Mahlzeiten, begleitet mit
Schweißausbrüchen und Tachykardie.
 Gastrinproduzierende
Tumoren treiben die Belegzellen zu maximaler Bildung von Salzsäure an
(Zollinger-Ellison-Syndrom). Dies führt zu so starker Ulcusbildung, dass
es unbehandelt zu Blutungen und sogar Perforationen der Magenwand kommt.
Gastrinproduzierende
Tumoren treiben die Belegzellen zu maximaler Bildung von Salzsäure an
(Zollinger-Ellison-Syndrom). Dies führt zu so starker Ulcusbildung, dass
es unbehandelt zu Blutungen und sogar Perforationen der Magenwand kommt.
 Prostaglandin E2
(PGE2) hemmt die Säuresekretion, fördert die Mucin- und
Bicarbonatbildung sowie die Magendurchblutung und schützt so die
Magenschleimhaut vor der Einwirkung von HCl (
Prostaglandin E2
(PGE2) hemmt die Säuresekretion, fördert die Mucin- und
Bicarbonatbildung sowie die Magendurchblutung und schützt so die
Magenschleimhaut vor der Einwirkung von HCl ( s. oben). Zur Bildung von
PGE2 (aus Arachidonsäure) ist die Zyklooxygenase 1 (COX 1) notwendig. Medikamente, welche
deren Aktivität hemmen ("COX-Hemmer", z.B. die Schmerzmittel Acetylsalizylsäure,
Ibuprofen), können bei häufiger Einnahme Magengeschwüre bedingen.
s. oben). Zur Bildung von
PGE2 (aus Arachidonsäure) ist die Zyklooxygenase 1 (COX 1) notwendig. Medikamente, welche
deren Aktivität hemmen ("COX-Hemmer", z.B. die Schmerzmittel Acetylsalizylsäure,
Ibuprofen), können bei häufiger Einnahme Magengeschwüre bedingen.
 Medikamentös nicht therapierbare Magen- oder Zwölffingerdarmgeschwüre
(Ulcus ventriculi, Ulcus duodeni) können durch eine Magenresektion
(Entfernung der unteren 2/3 des Magens) behandelt werden, weil der
Verlust des Großteils der Belegzellen die Magensäureproduktion stark
reduziert.
Medikamentös nicht therapierbare Magen- oder Zwölffingerdarmgeschwüre
(Ulcus ventriculi, Ulcus duodeni) können durch eine Magenresektion
(Entfernung der unteren 2/3 des Magens) behandelt werden, weil der
Verlust des Großteils der Belegzellen die Magensäureproduktion stark
reduziert.


 Der Magen dient als Zwischenspeicher (Fundus: Vago-vagaler Akkommodationsreflex - Kapazität ~1,5 Liter mit ~10 mmHg Druckanstieg), bildet Salzsäure, Pepsinogen, intrinsic factor
(Corpus), zerkleinert feste Teile des Chymus (Antrum). Er ist mechano-
und chemosensitiv und bildet Hormone. Die Magenfunktionen wird hauptsächlich gastrisch angeregt (zephale Phase 20-30%, intestinale ~5%). Der Dünndarm hemmt die Pyloruspassage vor allem bei Anwesenheit
von Fett (Enterogastrone). Der Zeitverlauf der Magenentleerung hängt vom aufgenommenen Volumen sowie Osmolarität,
Energiedichte und Verdaubarkeit des Chymus ab. Sphinkteren grenzen gegen
Ösophagus (Cardia) und Duodenum (Pylorus) ab, diese sind neuronal und
humoral gesteuert und lassen nur ausnahmsweise oralwärts
gerichtete Passage zu (Regurgitation, Reflux, Erbrechen) Der Magen dient als Zwischenspeicher (Fundus: Vago-vagaler Akkommodationsreflex - Kapazität ~1,5 Liter mit ~10 mmHg Druckanstieg), bildet Salzsäure, Pepsinogen, intrinsic factor
(Corpus), zerkleinert feste Teile des Chymus (Antrum). Er ist mechano-
und chemosensitiv und bildet Hormone. Die Magenfunktionen wird hauptsächlich gastrisch angeregt (zephale Phase 20-30%, intestinale ~5%). Der Dünndarm hemmt die Pyloruspassage vor allem bei Anwesenheit
von Fett (Enterogastrone). Der Zeitverlauf der Magenentleerung hängt vom aufgenommenen Volumen sowie Osmolarität,
Energiedichte und Verdaubarkeit des Chymus ab. Sphinkteren grenzen gegen
Ösophagus (Cardia) und Duodenum (Pylorus) ab, diese sind neuronal und
humoral gesteuert und lassen nur ausnahmsweise oralwärts
gerichtete Passage zu (Regurgitation, Reflux, Erbrechen)
 Eine Schrittmacherzone im oberen Corpusteil reagiert auf Dehnung mit peristaltischen Wellen (~3 pro Minute), diese wandern bis zum Pylorus und durchmischen den Chymus. Interstitielle (Cajal-) Zellen zeigen oszillierende Entladungen, die Kontraktionswellen auslösen, wenn die Aktionspotentiale Plateauphasen ausbilden. Dies tritt autonom auf und kann durch nervöse oder endokrine
Signale beeinflusst werden: Parasympathische Impulse, Gastrin und CCK erhöhen
Stärke und Frequenz der Kontraktionen; sympathische Impulse, Sekretin und GIP senken sie. Motilin aus dem Dünndarm beschleunigt den myoelektrischen Komplex und regt die Magenentleerung an. Kontraktionswellen
zermahlen den Inhalt des Magenausgangs zu ~1 mm großen Stücken (Antrummühle: Drucke bis über 100 mmHg), bevor
der Pylorus den Chymus portionsweise (2-4 ml) in das Duodenum lässt. Die Verweildauer des Mageninhalts beträgt bei Flüssigkeiten einige Minuten, bei fettreicher Nahrung bis zu 9 Stunden. Die Magenentleerung nimmt mit dem Volumen exponentiell zu, das verhindert Überdehnung Eine Schrittmacherzone im oberen Corpusteil reagiert auf Dehnung mit peristaltischen Wellen (~3 pro Minute), diese wandern bis zum Pylorus und durchmischen den Chymus. Interstitielle (Cajal-) Zellen zeigen oszillierende Entladungen, die Kontraktionswellen auslösen, wenn die Aktionspotentiale Plateauphasen ausbilden. Dies tritt autonom auf und kann durch nervöse oder endokrine
Signale beeinflusst werden: Parasympathische Impulse, Gastrin und CCK erhöhen
Stärke und Frequenz der Kontraktionen; sympathische Impulse, Sekretin und GIP senken sie. Motilin aus dem Dünndarm beschleunigt den myoelektrischen Komplex und regt die Magenentleerung an. Kontraktionswellen
zermahlen den Inhalt des Magenausgangs zu ~1 mm großen Stücken (Antrummühle: Drucke bis über 100 mmHg), bevor
der Pylorus den Chymus portionsweise (2-4 ml) in das Duodenum lässt. Die Verweildauer des Mageninhalts beträgt bei Flüssigkeiten einige Minuten, bei fettreicher Nahrung bis zu 9 Stunden. Die Magenentleerung nimmt mit dem Volumen exponentiell zu, das verhindert Überdehnung
 Der Magensaft enthält Mucin aus Nebenzellen (Schutz); Bicarbonat aus Oberflächenepithelzellen (Pufferung); Salzsäure aus Belegzellen (aktiviert Pepsinogen, regt die Gastrinsekretion an, wirkt keimtötend); Pepsinogen aus Hauptzellen (→ Pepsin, Endopeptidase); Intrinsic factor aus Belegzellen (Bindung an Kobalamin). Gastrin (aus G-Zellen), Histamin (aus ECL-Zellen), parasympathische Impulse regen die HCl-produktion an. Der Magen
bildet ~10 ml Salzsäure pro Tag; Speisen wirken puffernd, α-Amylase des
Speichels kann im Magen einige Zeit weiterwirken. Der Magensaft ist isoton, die Konzentration der einzelnen Elektrolyte hängt
von der Funktion ab: In Ruhephasen sezernieren Nicht-Belegzellen
Kochsalz und Natriumbicarbonat, mit steigender Sekretionsrate
produzieren Belegzellen Wasserstoffionen (~10 → ~160 mM) Der Magensaft enthält Mucin aus Nebenzellen (Schutz); Bicarbonat aus Oberflächenepithelzellen (Pufferung); Salzsäure aus Belegzellen (aktiviert Pepsinogen, regt die Gastrinsekretion an, wirkt keimtötend); Pepsinogen aus Hauptzellen (→ Pepsin, Endopeptidase); Intrinsic factor aus Belegzellen (Bindung an Kobalamin). Gastrin (aus G-Zellen), Histamin (aus ECL-Zellen), parasympathische Impulse regen die HCl-produktion an. Der Magen
bildet ~10 ml Salzsäure pro Tag; Speisen wirken puffernd, α-Amylase des
Speichels kann im Magen einige Zeit weiterwirken. Der Magensaft ist isoton, die Konzentration der einzelnen Elektrolyte hängt
von der Funktion ab: In Ruhephasen sezernieren Nicht-Belegzellen
Kochsalz und Natriumbicarbonat, mit steigender Sekretionsrate
produzieren Belegzellen Wasserstoffionen (~10 → ~160 mM)
 Belegzellen (HCl) haben Rezeptoren für Acetylcholin, Histamin, CCK (anregend) und Somatostatin (hemmend). ECL-Zellen (Histamin) haben Rezeptoren für Gastrin, Acetylcholin, Noradrenalin (anregend) und Somatostatin (hemmend). Parasympathische Impulse aktivieren Belegzellen, G-Zellen und hemmen D-Zellen. D-Zellen
produzieren Somatostatin, werden apikal durch H+ (offener
Zelltyp), basolateral durch Gastrin angeregt, durch Acetylcholin
gehemmt. G-Zellen (Gastrin) werden angeregt durch appetitanregende Substanzen, Dehnung
des Antrum (lokale Nervenbahnen plus vagovagaler Reflex), GRP aus
Nervenzellen im Magen; gehemmt wird sie bei pH ≤3 im Magenlumen
(Selbstbegrenzung) und Somatostatin. Gastrin
fördert die Trophik der Schleimhaut, regt die Sekretion von Salzsäure
und Pepsinogen sowie die Histaminsynthese in ECL-Zellen an. PGE2 hemmt die Produktion von HCl und fördert die Mucin- und Bicarbonatsekretion Belegzellen (HCl) haben Rezeptoren für Acetylcholin, Histamin, CCK (anregend) und Somatostatin (hemmend). ECL-Zellen (Histamin) haben Rezeptoren für Gastrin, Acetylcholin, Noradrenalin (anregend) und Somatostatin (hemmend). Parasympathische Impulse aktivieren Belegzellen, G-Zellen und hemmen D-Zellen. D-Zellen
produzieren Somatostatin, werden apikal durch H+ (offener
Zelltyp), basolateral durch Gastrin angeregt, durch Acetylcholin
gehemmt. G-Zellen (Gastrin) werden angeregt durch appetitanregende Substanzen, Dehnung
des Antrum (lokale Nervenbahnen plus vagovagaler Reflex), GRP aus
Nervenzellen im Magen; gehemmt wird sie bei pH ≤3 im Magenlumen
(Selbstbegrenzung) und Somatostatin. Gastrin
fördert die Trophik der Schleimhaut, regt die Sekretion von Salzsäure
und Pepsinogen sowie die Histaminsynthese in ECL-Zellen an. PGE2 hemmt die Produktion von HCl und fördert die Mucin- und Bicarbonatsekretion
|

 Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.
Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.





 Magen
Magen
 Antrum: antrum = Höhle, Grotte
Antrum: antrum = Höhle, Grotte Phasen der Digestion
Phasen der Digestion  Magenmotorik
Magenmotorik  Produktion des Magensekrets
Produktion des Magensekrets  Regulation der Magentätigkeit
Regulation der Magentätigkeit  Wirkungsprofil: Gastrin
Wirkungsprofil: Gastrin  Somatostatin
Somatostatin  Enterogastrone
Enterogastrone
 ECL-Zellen
ECL-Zellen  GRP
GRP
 Core messages
Core messages
 Abbildung: Struktur des Magens
Abbildung: Struktur des Magens
 Der Fundus hat ausgeprägte Speicherfunktion
Der Fundus hat ausgeprägte Speicherfunktion Der Corpusteil des Magens enthält Hauptzellen (Pepsinogenproduktion), Belegzellen (Sekretion von HCl und Intrinsic factor), Becherzellen (Mucinbildun, Bicarbonatsekretion), endokrine Zellen (darunter ECL-Zellen) und transportiert den Chymus weiter
Der Corpusteil des Magens enthält Hauptzellen (Pepsinogenproduktion), Belegzellen (Sekretion von HCl und Intrinsic factor), Becherzellen (Mucinbildun, Bicarbonatsekretion), endokrine Zellen (darunter ECL-Zellen) und transportiert den Chymus weiter Das Antrum ist auf Zerkleinerung spezialisiert ("Antrummühle") und bildet Hormone (Gastrin: G-Zellen, Somatostatin: D-Zellen).
Das Antrum ist auf Zerkleinerung spezialisiert ("Antrummühle") und bildet Hormone (Gastrin: G-Zellen, Somatostatin: D-Zellen).
 Abbildung: Drüsenschlauch in säureproduzierender Magenschleimhaut (Fundus / Corpus)
Abbildung: Drüsenschlauch in säureproduzierender Magenschleimhaut (Fundus / Corpus) Zwischenspeicherung von Bissen / Schlucken, die den Ösophagus passiert haben: Die verschluckten Portionen sind meist größer als die Menge, die der
Dünndarm unmittelbar verarbeiten könnte. Der Magen erfüllt die Aufgabe der "Volumendämpfung" auf zwei Wegen:
Zwischenspeicherung von Bissen / Schlucken, die den Ösophagus passiert haben: Die verschluckten Portionen sind meist größer als die Menge, die der
Dünndarm unmittelbar verarbeiten könnte. Der Magen erfüllt die Aufgabe der "Volumendämpfung" auf zwei Wegen: und der oberen Corpusregion,
was die Passage des Bissens und seine Speicherung im Fundus
unterstützt. Der Mechanismus ist weder cholinerg noch adrenerg; bei
Unterbrechung der vagalen Innervation des Magens nimmt der
intragastrische Druck bei Nahrungsaufnahme rascher zu als normalerweise.
und der oberen Corpusregion,
was die Passage des Bissens und seine Speicherung im Fundus
unterstützt. Der Mechanismus ist weder cholinerg noch adrenerg; bei
Unterbrechung der vagalen Innervation des Magens nimmt der
intragastrische Druck bei Nahrungsaufnahme rascher zu als normalerweise. Sekretion von Magensaft (Corpusteil):
Sekretion von Magensaft (Corpusteil):  Belegzellen (parietal cells, oxyntic cells) produzieren das Glykoprotein Intrinsic factor (Vitamin B12-Resorption) und Salzsäure (hydrochloric acid - hydrolysiert Makromoleküle, aktiviert Proenzyme und wirkt sterilisierend);
Belegzellen (parietal cells, oxyntic cells) produzieren das Glykoprotein Intrinsic factor (Vitamin B12-Resorption) und Salzsäure (hydrochloric acid - hydrolysiert Makromoleküle, aktiviert Proenzyme und wirkt sterilisierend);  Hauptzellen (chief cells) sezernieren Pepsinogen, das durch HCl-Wirkung zum eiweißabbauenden Enzym Pepsin wird, sowie Lipase;
Hauptzellen (chief cells) sezernieren Pepsinogen, das durch HCl-Wirkung zum eiweißabbauenden Enzym Pepsin wird, sowie Lipase; Becherzellen (Nebenzellen) (goblet cells, mucous cells) produzieren Schleim (Mucin), der die Mucosa vor HCl und Pepsin schützt.
Becherzellen (Nebenzellen) (goblet cells, mucous cells) produzieren Schleim (Mucin), der die Mucosa vor HCl und Pepsin schützt.
 Abbildung: Schleimbarriere im Magen, Mucinmolekül
Abbildung: Schleimbarriere im Magen, Mucinmolekül Mucine
sind große, stark glykosylierte Proteine, die viel Wasser halten
können (gelartige
Eigenschaften), resistent gegenüber Proteolyse sind, Gele bilden können
und sowohl physikalisch (als "Schmiermittel") als auch chemisch (als
Barrieren) bedeutsame Funktionen erfüllen, inklusive Bindung von
Pathogenen (Immunsystem). Sie werden von Epithelzellen meist als
große Aggregate sezerniert (bis 104 kDa), liegen aber auch
an Zellmembranen gebunden
vor (Bild), wo sie als rezeptorartige Liganden für Kohlenhydrate wirken
können.
Mucine
sind große, stark glykosylierte Proteine, die viel Wasser halten
können (gelartige
Eigenschaften), resistent gegenüber Proteolyse sind, Gele bilden können
und sowohl physikalisch (als "Schmiermittel") als auch chemisch (als
Barrieren) bedeutsame Funktionen erfüllen, inklusive Bindung von
Pathogenen (Immunsystem). Sie werden von Epithelzellen meist als
große Aggregate sezerniert (bis 104 kDa), liegen aber auch
an Zellmembranen gebunden
vor (Bild), wo sie als rezeptorartige Liganden für Kohlenhydrate wirken
können.  Transport, Durchmischung, Homogenisierung
des Inhalts
Transport, Durchmischung, Homogenisierung
des Inhalts Schutz der Schleimhaut durch Mucine (
Schutz der Schleimhaut durch Mucine ( Abbildung), s. unten
Abbildung), s. unten Abbau von Nahrungsbestandteilen, hauptsächlich von Eiweiß (Pepsin
Abbau von Nahrungsbestandteilen, hauptsächlich von Eiweiß (Pepsin  )
) Bereitstellung des Glykoproteins Intrincic
factor zur Vitamin-B12-Aufnahme (rezeptorvermittelte Resorption des Faktor-Vitamin-Komplexes im Ileum)
Bereitstellung des Glykoproteins Intrincic
factor zur Vitamin-B12-Aufnahme (rezeptorvermittelte Resorption des Faktor-Vitamin-Komplexes im Ileum) Resorption von Flüssigkeit und kleinen Molekülen (kurzkettige Fettsäuren, Alkohol, Medikamente)
Resorption von Flüssigkeit und kleinen Molekülen (kurzkettige Fettsäuren, Alkohol, Medikamente) Registrierung des Dehnungszustandes der Magenwand (Mechanosensibilität)
Registrierung des Dehnungszustandes der Magenwand (Mechanosensibilität) Registrierung des Chemismus des Inhalts (Peptide: G-Zellen, pH-Wert: D-Zellen)
Registrierung des Chemismus des Inhalts (Peptide: G-Zellen, pH-Wert: D-Zellen) Hormonproduktion durch neuroendokrine Zellen (Gastrin-17 im Antrum
Hormonproduktion durch neuroendokrine Zellen (Gastrin-17 im Antrum  ).
). Enterochromaffin-ähnliche Zellen (ECL, enterochromaffin-like cells) sind die in der Magenschleimhaut am häufigsten vorkommenden neuroendokrinen Zellen. Sie bilden, speichern und sezernieren Histamin, das Belegzellen und dadurch die Produktion von Salzsäure im Magen anregt. Daneben produzieren sie auch Peptidhormone / Wachstumsfaktoren.
Enterochromaffin-ähnliche Zellen (ECL, enterochromaffin-like cells) sind die in der Magenschleimhaut am häufigsten vorkommenden neuroendokrinen Zellen. Sie bilden, speichern und sezernieren Histamin, das Belegzellen und dadurch die Produktion von Salzsäure im Magen anregt. Daneben produzieren sie auch Peptidhormone / Wachstumsfaktoren. gesteigert durch Acetylcholin (parasympathische muskarinerge Innervation), Gastrin (G-Zellen) sowie ein VIP-ähnliches Peptid, das sowohl parakrin, auch als Neurotransmitter / Neuromodulator wirkt (PACAP: pituitary adenylate cyclase-activating polypeptide).
gesteigert durch Acetylcholin (parasympathische muskarinerge Innervation), Gastrin (G-Zellen) sowie ein VIP-ähnliches Peptid, das sowohl parakrin, auch als Neurotransmitter / Neuromodulator wirkt (PACAP: pituitary adenylate cyclase-activating polypeptide).  Gehemmt wird die ECL-Aktivität durch Somatostatin (D-Zellen) sowie durch Prostaglandine.
Gehemmt wird die ECL-Aktivität durch Somatostatin (D-Zellen) sowie durch Prostaglandine. Geschlucktes wird durch die Cardia
Geschlucktes wird durch die Cardia bzw. den unteren Ösophagussphincter (LES: Lower esophageal sphincter) kontrolliert in den Magen befördert und hier so lange gespeichert und modifiziert, bis es
(entsprechend "bearbeitet") für den Weitertransport in den
Zwölffingerdarm präpariert ist - eine "Einbahnstraße" für
den Chymus. Nur unter Ausnahmebedingungen kommt es zu Passage in die
Gegenrichtung (Regurgitation, Reflux, Erbrechen).
bzw. den unteren Ösophagussphincter (LES: Lower esophageal sphincter) kontrolliert in den Magen befördert und hier so lange gespeichert und modifiziert, bis es
(entsprechend "bearbeitet") für den Weitertransport in den
Zwölffingerdarm präpariert ist - eine "Einbahnstraße" für
den Chymus. Nur unter Ausnahmebedingungen kommt es zu Passage in die
Gegenrichtung (Regurgitation, Reflux, Erbrechen).  Der Pylorus
Der Pylorus  funktioniert in Kooperation mit der äußeren Muskelschicht (muscularis
externa), um nur kleine Partikel in den Zwölffingerdarm (Duodenum)
gelangen zu lassen, abhängig von dessen Verarbeitungskapazität (s.
weiter unten).
funktioniert in Kooperation mit der äußeren Muskelschicht (muscularis
externa), um nur kleine Partikel in den Zwölffingerdarm (Duodenum)
gelangen zu lassen, abhängig von dessen Verarbeitungskapazität (s.
weiter unten). Abbildung) und eine intestinale.
Abbildung) und eine intestinale.
 Abbildung: Phasen der Magenaktivität
Abbildung: Phasen der Magenaktivität GRP (gastrin releasing peptide) ist ein neurokriners Peptid (27 As) aus gastrischen Nervenzellen, wird durch cholinerge Impulse (Vagus) freigesetzt und regt die Gastrinsekretion in G-Zellen an.
Der GRP-Rezeptor BB2
(benannt nach Bombesin, einem strukturell ähnlichen Peptid in der Haut der Rotbauchunke bombina bombina) ist G-Protein-gekoppelt und wird in Pankreas, Magen,
Gehirn und Nebennierenrinde exprimiert. Auch Pituizyten im
Hypophysenhinterlappen produzieren GRP, das in die Regulation zirkadianer Rhythmen
involviert ist und Lichtinformation an den hypothalamischen
Oszillator im nucl. suprachiasmaticus signalisiert. Auch scheint GRP Aspekte von
Stress zu mediieren.
GRP (gastrin releasing peptide) ist ein neurokriners Peptid (27 As) aus gastrischen Nervenzellen, wird durch cholinerge Impulse (Vagus) freigesetzt und regt die Gastrinsekretion in G-Zellen an.
Der GRP-Rezeptor BB2
(benannt nach Bombesin, einem strukturell ähnlichen Peptid in der Haut der Rotbauchunke bombina bombina) ist G-Protein-gekoppelt und wird in Pankreas, Magen,
Gehirn und Nebennierenrinde exprimiert. Auch Pituizyten im
Hypophysenhinterlappen produzieren GRP, das in die Regulation zirkadianer Rhythmen
involviert ist und Lichtinformation an den hypothalamischen
Oszillator im nucl. suprachiasmaticus signalisiert. Auch scheint GRP Aspekte von
Stress zu mediieren. Zu Gastrin s. dort
Zu Gastrin s. dort Abbildung).
Abbildung). 
 Postganglionär freigesetztes Acetylcholin im Corpusteil des Magens regt Belegzellen direkt an (M3-Rezeptoren)
Postganglionär freigesetztes Acetylcholin im Corpusteil des Magens regt Belegzellen direkt an (M3-Rezeptoren) Acetylcholin regt weiters ECL-Zellen in der Corpuswand zur Histaminfreisetzung an (M3-Rezeptoren)
Acetylcholin regt weiters ECL-Zellen in der Corpuswand zur Histaminfreisetzung an (M3-Rezeptoren) Im Antrum setzen peptiderge parasympathisch- postganglionäre Fasern und
auch Neurone des Darmnervensystems GRP frei, das G-Zellen zur
Gastrinfreisetzung stimuliert (GRP-Rezeptor BB2)
Im Antrum setzen peptiderge parasympathisch- postganglionäre Fasern und
auch Neurone des Darmnervensystems GRP frei, das G-Zellen zur
Gastrinfreisetzung stimuliert (GRP-Rezeptor BB2) Vagale Efferenzen hemmen D-Zellen in Corpus und Antrum (M3-Rezeptoren), dadurch sinkt der hemmende Einfluss von Somatostatin auf Belegzellen.
Vagale Efferenzen hemmen D-Zellen in Corpus und Antrum (M3-Rezeptoren), dadurch sinkt der hemmende Einfluss von Somatostatin auf Belegzellen.
 Abbildung: Gastrische Phase der Magensäuresekretion
Abbildung: Gastrische Phase der Magensäuresekretion
 Dehnung der Magenwand aktiviert einen vago-vagalen Reflex (über den dorsalen Vaguskern) sowie lokale Reflexe im Darmnervensystem. Dies ist der stärkste Stimulus für die Säureproduktion
Dehnung der Magenwand aktiviert einen vago-vagalen Reflex (über den dorsalen Vaguskern) sowie lokale Reflexe im Darmnervensystem. Dies ist der stärkste Stimulus für die Säureproduktion Anwesenheit anregender Stoffe, wie Aminosäuren (Aromatische Aminosäuren regen G-Zellen besonders stark an - auch nach
Vagotomie), Peptide
(Bouillon!), Amine, Kaffee (auch koffeinfrei).
Anwesenheit anregender Stoffe, wie Aminosäuren (Aromatische Aminosäuren regen G-Zellen besonders stark an - auch nach
Vagotomie), Peptide
(Bouillon!), Amine, Kaffee (auch koffeinfrei).

 Abbildung: Intestinale Phase der Magensäuresekretion
Abbildung: Intestinale Phase der Magensäuresekretion
 Duodenale G-Zellen setzen Gastrin frei (vorwiegend Gastrin-34)
Duodenale G-Zellen setzen Gastrin frei (vorwiegend Gastrin-34) Peptone regen endokrine Zellen an (Entero-Oxyntin,
Peptone regen endokrine Zellen an (Entero-Oxyntin,  Abbildung)
Abbildung) Im proximalen Dünndarm resorbierte Aminosäuren regen Belegzellen ebenfalls an (Mechanismus unbekannt)
Im proximalen Dünndarm resorbierte Aminosäuren regen Belegzellen ebenfalls an (Mechanismus unbekannt) Abbildung). Werden sie von mehreren Stellen synchron registriert, zeigt sich
überall die gleiche Frequenz, aber eine konsekutive Verzögerung als
Zeichen der Fortleitung über die Magenwand.
Abbildung). Werden sie von mehreren Stellen synchron registriert, zeigt sich
überall die gleiche Frequenz, aber eine konsekutive Verzögerung als
Zeichen der Fortleitung über die Magenwand. 
 Abbildung: Elektrische Aktivität des Magens
Abbildung: Elektrische Aktivität des Magens
 Parasympathische Aktivität erhöht Stärke und Frequenz, Vagotomie reduziert Stärke und Organisationsgrad
Parasympathische Aktivität erhöht Stärke und Frequenz, Vagotomie reduziert Stärke und Organisationsgrad Sympathische Aktivität dämpft sie
Sympathische Aktivität dämpft sie Gastrin und Cholezystokinin erhöhen die Kontraktionsfrequenz, , ändern
aber nichts an der Propagation der Erregungswellen
Gastrin und Cholezystokinin erhöhen die Kontraktionsfrequenz, , ändern
aber nichts an der Propagation der Erregungswellen Sekretin und GIP senken sie.
Sekretin und GIP senken sie. Der Pylorus
("Pförtner") stellt sicher, dass der im Magen bearbeitete
(kleinkörnige, saure, angedaute) Speisebrei nur in kleinen Portionen
zum Duodenum weiterbewegt wird, je nach dessen jeweiliger Fähigkeit,
weitere saure Valenzen zu puffern und Nährstoffe zu verdauen.
Der Pylorus
("Pförtner") stellt sicher, dass der im Magen bearbeitete
(kleinkörnige, saure, angedaute) Speisebrei nur in kleinen Portionen
zum Duodenum weiterbewegt wird, je nach dessen jeweiliger Fähigkeit,
weitere saure Valenzen zu puffern und Nährstoffe zu verdauen. Akkommodationsreflex: In der Speiseröhre Richtung Magen wandernder Chymus
entspannt die oberen Magenpartien (Fundus, oberer Corpusteil) schon
bevor er den Magen erreicht hat. Die anschließende Dehnung der
Magenwand verstärkt diese gastrische Akkommodation, die durch einen vago-vagalen Reflex erfolgt:
Sowohl Afferenzen zum Gehirn als auch Efferenzen zum Magen laufen über
parasympathische Fasern des N. vagus.
Akkommodationsreflex: In der Speiseröhre Richtung Magen wandernder Chymus
entspannt die oberen Magenpartien (Fundus, oberer Corpusteil) schon
bevor er den Magen erreicht hat. Die anschließende Dehnung der
Magenwand verstärkt diese gastrische Akkommodation, die durch einen vago-vagalen Reflex erfolgt:
Sowohl Afferenzen zum Gehirn als auch Efferenzen zum Magen laufen über
parasympathische Fasern des N. vagus. 
 Abbildung: Neuromuskuläre Magenaktivität nach Einnahme einer Mahlzeit
Abbildung: Neuromuskuläre Magenaktivität nach Einnahme einer Mahlzeit
 Abbildung). Die Magenmotorik erzeugt - noch vor der Emulgierung zu Mizellen
durch Gallensäuren - Fetttröpfchen mit einem Durchmesser von lediglich ~1 µm.
Abbildung). Die Magenmotorik erzeugt - noch vor der Emulgierung zu Mizellen
durch Gallensäuren - Fetttröpfchen mit einem Durchmesser von lediglich ~1 µm.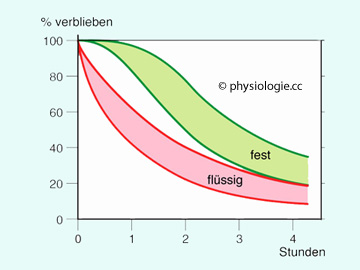
 Abbildung: Zeitverlauf der Magenentleerung
Abbildung: Zeitverlauf der Magenentleerung
 Die
Verdauungsvorgänge im Magen wurden erst zu Beginn des 19. Jahrhunderts
allmählich verstanden. Der amerikanische Arzt William Beaumont
machte an einem Patienten (Alexis St. Martin), der nach einem
Gewehrdurchschuss eine permanente Magenfistel hatte, Beobachtungen und
Experimente und stellte fest, dass der Magen auf Emotionen des
Patienten reagiert (1835). In Magensaftproben konnte er den wechselnden
Salzsäuregehalt nachweisen. (Die Amerikanische Physiologische
Gesellschaft besitzt heute das "Beaumont House" in Bethesda, Maryland)
Die
Verdauungsvorgänge im Magen wurden erst zu Beginn des 19. Jahrhunderts
allmählich verstanden. Der amerikanische Arzt William Beaumont
machte an einem Patienten (Alexis St. Martin), der nach einem
Gewehrdurchschuss eine permanente Magenfistel hatte, Beobachtungen und
Experimente und stellte fest, dass der Magen auf Emotionen des
Patienten reagiert (1835). In Magensaftproben konnte er den wechselnden
Salzsäuregehalt nachweisen. (Die Amerikanische Physiologische
Gesellschaft besitzt heute das "Beaumont House" in Bethesda, Maryland) Belegzellen
Belegzellen  Hauptzellen
Hauptzellen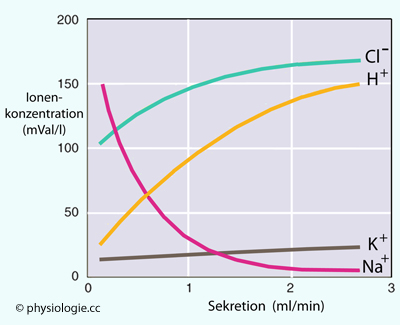
 Abbildung: Ionenmuster des Magensekrets als Funktion der Produktion
Abbildung: Ionenmuster des Magensekrets als Funktion der Produktion
 Natrium: Bei niedriger Saftmenge liegt die Natriumkonzentration bei
~100 mM, mit steigender Produktionsrate nimmt sie auf fast Null ab.
Natrium: Bei niedriger Saftmenge liegt die Natriumkonzentration bei
~100 mM, mit steigender Produktionsrate nimmt sie auf fast Null ab. Chlorid: Das Anion im Magensekret. Die Chloridkonzentration beträgt bei
geringer Saftproduktion ~100 mM und steigt mit letzterer bis auf ~160
mM an.
Chlorid: Das Anion im Magensekret. Die Chloridkonzentration beträgt bei
geringer Saftproduktion ~100 mM und steigt mit letzterer bis auf ~160
mM an. Protonen: Die Konzentration an Wasserstoffionen steigt mit der Produktionsrate von ~10 auf bis ~160 mM (Magensäure: [H+] 150-160 mM).
Protonen: Die Konzentration an Wasserstoffionen steigt mit der Produktionsrate von ~10 auf bis ~160 mM (Magensäure: [H+] 150-160 mM). Kalium: Bei niedriger Produktion etwa entsprechend den Werten im Blut
(~5 mM), mit der Sekretionsrate steigend (bis auf 20 mM).
Kalium: Bei niedriger Produktion etwa entsprechend den Werten im Blut
(~5 mM), mit der Sekretionsrate steigend (bis auf 20 mM).
 Abbildung: Diffusions- und Schutzbarriere auf der Magenschleimhaut
Abbildung: Diffusions- und Schutzbarriere auf der Magenschleimhaut
 Abbildung), insbesondere auch in der interdigestiven Phase (niedriger Oberflächen-pH).
Abbildung), insbesondere auch in der interdigestiven Phase (niedriger Oberflächen-pH).  Abbildung).
Abbildung). Bicarbonat aus Oberflächenepithelzellen (superficial epithelial cells)
des Corpus- und Antrumteils stellt in der dünnen "unstirred layer"-Schichte zwischen Zelloberfläche
und Mucinschicht einen pH-Wert von 6-7 ein, was das Epithel schützt,
indem es puffert und Pepsin inaktiviert (dieses dringt kaum durch die Mucinschicht).
Bicarbonat aus Oberflächenepithelzellen (superficial epithelial cells)
des Corpus- und Antrumteils stellt in der dünnen "unstirred layer"-Schichte zwischen Zelloberfläche
und Mucinschicht einen pH-Wert von 6-7 ein, was das Epithel schützt,
indem es puffert und Pepsin inaktiviert (dieses dringt kaum durch die Mucinschicht). Pepsin s. unten
Pepsin s. unten Intrinsic factor s. unten
Intrinsic factor s. unten aktiviert Pepsinogen,
aktiviert Pepsinogen,
 regt die
Ausschüttung von Gastrin an,
regt die
Ausschüttung von Gastrin an, wirkt keimtötend.
wirkt keimtötend. 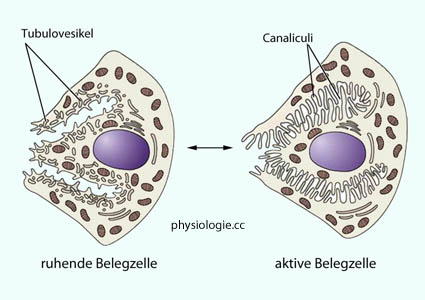
 Abbildung: Ruhende und angeregte Belegzelle
Abbildung: Ruhende und angeregte Belegzelle
 Werden Belegzellen
angeregt (Acetylcholin, Histamin, Gastrin), verschmelzen ihre Tubulovesikel (mit den darin befindlichen
Protonenpumpen) innerhalb von Sekunden zu Ausführungsgängen
(Canaliculi), was die apikale
Oberfläche bis zu 100-fach vergrößert und
damit die Sekretionskapazität enorm erhöht; es entsteht der Eindruck
entstehender Mikrovilli (
Werden Belegzellen
angeregt (Acetylcholin, Histamin, Gastrin), verschmelzen ihre Tubulovesikel (mit den darin befindlichen
Protonenpumpen) innerhalb von Sekunden zu Ausführungsgängen
(Canaliculi), was die apikale
Oberfläche bis zu 100-fach vergrößert und
damit die Sekretionskapazität enorm erhöht; es entsteht der Eindruck
entstehender Mikrovilli ( Abbildung).
Abbildung). 
 Abbildung: Nahrungsaufnahme und Säurebildung
Abbildung: Nahrungsaufnahme und Säurebildung
 Abbildung). Die obligate Na+/K+-ATPase ist ebenfalls vorhanden.
Abbildung). Die obligate Na+/K+-ATPase ist ebenfalls vorhanden. vgl. dort).
vgl. dort). 
 Abbildung: Mechanismus der Säureproduktion der Belegzellen
Abbildung: Mechanismus der Säureproduktion der Belegzellen
 Prostaglandin-Synthesehemmer - nichtsteroidale Antirheumatika (NSAR) wie Acetylsalizylsäure oder Diclofenac - werden
u.a. wegen ihrer schmerzhemmenden Wirkung verwendet. Sie reduzieren die
Aktivität der Zyklooxygenase und damit auch die Schleimproduktion der
Nebenzellen; zusätzlich schränken sie die Durchblutungsregulation der Mucosa ein und regen die Säureproduktion an.
Der Säureschutz der Magenschleimhaut wird also durch Gabe von NSAR
dreifach herausgefordert; Magengeschwüre können die Folge sein.
Prostaglandin-Synthesehemmer - nichtsteroidale Antirheumatika (NSAR) wie Acetylsalizylsäure oder Diclofenac - werden
u.a. wegen ihrer schmerzhemmenden Wirkung verwendet. Sie reduzieren die
Aktivität der Zyklooxygenase und damit auch die Schleimproduktion der
Nebenzellen; zusätzlich schränken sie die Durchblutungsregulation der Mucosa ein und regen die Säureproduktion an.
Der Säureschutz der Magenschleimhaut wird also durch Gabe von NSAR
dreifach herausgefordert; Magengeschwüre können die Folge sein.  Reduktion der Magensäureproduktion der Belegzellen
Reduktion der Magensäureproduktion der Belegzellen

 Erhöhte Durchblutung der Magenschleimhaut
Erhöhte Durchblutung der Magenschleimhaut
 Bildung von Schleim und Bicarbonat (Pufferung) - der alkalische Schleim
neutralisiert direkt die Wasserstoffionen (der pH-Wert liegt im Cardia-
und Antrumbereich bei ~7!)
Bildung von Schleim und Bicarbonat (Pufferung) - der alkalische Schleim
neutralisiert direkt die Wasserstoffionen (der pH-Wert liegt im Cardia-
und Antrumbereich bei ~7!) Es senkt in den Belegzellen die
cAMP-Konzentration (direkter Effekt) und
Es senkt in den Belegzellen die
cAMP-Konzentration (direkter Effekt) und  hemmt die Aktivität der
G-Zellen (parakrin) sowie der ECL-Zellen (endokrin), senkt also die
Gastrin- und Histaminfreisetzung (indirekter Effekt).
hemmt die Aktivität der
G-Zellen (parakrin) sowie der ECL-Zellen (endokrin), senkt also die
Gastrin- und Histaminfreisetzung (indirekter Effekt). 
 Ist
dieses Gleichgewicht nicht gegeben, besteht die Gefahr von
Schleimhautschädigung, Entzündung und Geschwürbildung (gastroduodenales
Ulcus, s. unten).
Ist
dieses Gleichgewicht nicht gegeben, besteht die Gefahr von
Schleimhautschädigung, Entzündung und Geschwürbildung (gastroduodenales
Ulcus, s. unten).
 Abbildung: Aktivierung von Pepsinogenen zu Pepsin
Abbildung: Aktivierung von Pepsinogenen zu Pepsin
 Acetylcholin (der wichtigste Stimulus für die Pepsinogensekretion)
Acetylcholin (der wichtigste Stimulus für die Pepsinogensekretion) Sekretin (Acetylcholin regt auch die Säureproduktion an und diese sie Sekretinbildung)
Sekretin (Acetylcholin regt auch die Säureproduktion an und diese sie Sekretinbildung) VIP (wirkt sekretionsfördernd)
VIP (wirkt sekretionsfördernd) Gastrin (regt Belegzellen an)
Gastrin (regt Belegzellen an)
 Abbildung: Autonome und humorale Einflüsse auf die Magentätigkeit
Abbildung: Autonome und humorale Einflüsse auf die Magentätigkeit
 Direkte Reizung von Belegzellen (HCl-Produktion) - cholinerg über Aktivierung von M3-Rezeptoren und Steigerung des intrazellulären Ca++-Spiegels
Direkte Reizung von Belegzellen (HCl-Produktion) - cholinerg über Aktivierung von M3-Rezeptoren und Steigerung des intrazellulären Ca++-Spiegels Freisetzung von Histamin aus enterochromaffinähnlichen Zellen (ECL-Zellen)
- dies sind neuroendokrine Zellen im Drüsenfeld des Magens (
Freisetzung von Histamin aus enterochromaffinähnlichen Zellen (ECL-Zellen)
- dies sind neuroendokrine Zellen im Drüsenfeld des Magens ( Abbildung).
Abbildung). 
 Abbildung: Anregung der Säureproduktion
Abbildung: Anregung der Säureproduktion
 Angeregt werden ECL-Zellen durch Gastin, Acetylcholin (über muskarinische M1-Rezeptoren - diese Achse ist
durch Atropin blockierbar) und auch Noradrenalin. Stimulation
der ECL-Zellen erhöht die Säureproduktion via Histamin - dies erfolgt
über Steigerung des cAMP-Spiegels in den Belegzellen. Vermutlich sind ECL-Zellen auch endokrin tätig (Wachstumsfaktoren u.a.).
Angeregt werden ECL-Zellen durch Gastin, Acetylcholin (über muskarinische M1-Rezeptoren - diese Achse ist
durch Atropin blockierbar) und auch Noradrenalin. Stimulation
der ECL-Zellen erhöht die Säureproduktion via Histamin - dies erfolgt
über Steigerung des cAMP-Spiegels in den Belegzellen. Vermutlich sind ECL-Zellen auch endokrin tätig (Wachstumsfaktoren u.a.).  Der wichtigste Inhibitor der ECL-Zellen ist Somatostatin.
Der wichtigste Inhibitor der ECL-Zellen ist Somatostatin. Freisetzung von Gastrin aus G-Zellen - diese Wirkung wird durch GRP vermittelt (s. oben).
Anlagerung des Gastrins an den CCK-2-Rezeptor (Gastrinrezeptor) steigert den intrazellulären Ca++-Spiegel in der Belegzelle.
Freisetzung von Gastrin aus G-Zellen - diese Wirkung wird durch GRP vermittelt (s. oben).
Anlagerung des Gastrins an den CCK-2-Rezeptor (Gastrinrezeptor) steigert den intrazellulären Ca++-Spiegel in der Belegzelle. M3-Rezeptor-vermittelte Hemmung der Freisetzung von Somatostatin. Da Somatostatin die Belegzellen hemmt sowie auch die Freisetzung von Histamin, bewirkt die Reduktion der Somatostatinbildung eine
Disinhibition, regt also die HCl-Produktion an (dies bewirkt der Vagus
auch direkt).
M3-Rezeptor-vermittelte Hemmung der Freisetzung von Somatostatin. Da Somatostatin die Belegzellen hemmt sowie auch die Freisetzung von Histamin, bewirkt die Reduktion der Somatostatinbildung eine
Disinhibition, regt also die HCl-Produktion an (dies bewirkt der Vagus
auch direkt). Aktivierung von Oberflächenzellen zur Bildung von Bicarbonat - diese Wirkung haben auch Prostaglandine (PGE2)
Aktivierung von Oberflächenzellen zur Bildung von Bicarbonat - diese Wirkung haben auch Prostaglandine (PGE2)
 Abbildung: Rezeptoren und Signaltransduktionswege einer Belegzelle
Abbildung: Rezeptoren und Signaltransduktionswege einer Belegzelle
 Abbildung)
Abbildung) Acetylcholin aus postganglionär-parasympathischen Fasern über M3-Rezeptoren - das
steigert intrazelluläres Calcium
Acetylcholin aus postganglionär-parasympathischen Fasern über M3-Rezeptoren - das
steigert intrazelluläres Calcium Gastrin aus G-Zellen - wirkt auf CCK-2-Rezeptoren (Gastrinrezeptoren), auch das
steigert intrazelluläres Calcium
Gastrin aus G-Zellen - wirkt auf CCK-2-Rezeptoren (Gastrinrezeptoren), auch das
steigert intrazelluläres Calcium Histamin aus ECL-Zellen - wirkt auf H2-Rezeptoren
und wirkt über cAMP-Anstieg anregend auf die Belegzelle. Somatostatin
senkt cAMP und wirkt dadurch hemmend auf die Säureproduktion.
Histamin aus ECL-Zellen - wirkt auf H2-Rezeptoren
und wirkt über cAMP-Anstieg anregend auf die Belegzelle. Somatostatin
senkt cAMP und wirkt dadurch hemmend auf die Säureproduktion. Maximale Anregung der Salzsäureproduktion erfolgt durch die kombinierte Wirkung von Acetylcholin, Histamin und Gastrin. Die gemeinsame Wirkung dieser Komponenten zur Erreichung eines maximalen Effekts ist ein Beispiel für Potenzierung.
Maximale Anregung der Salzsäureproduktion erfolgt durch die kombinierte Wirkung von Acetylcholin, Histamin und Gastrin. Die gemeinsame Wirkung dieser Komponenten zur Erreichung eines maximalen Effekts ist ein Beispiel für Potenzierung. Wirkt
nur eine oder zwei dieser Anregungen, ist die Säurebildung deutlich
reduziert. Das bedeutet, dass die Blockade nur eines dieser Faktoren
bereits einen starken Drosselungseffekt auf die Säureproduktion hat -
z.B. wirkt die Gabe eines Histamin-Rezeptorblockers deutlich säurehemmend, auch bei hoher Konzentration von Acetylcholin und Gastrin an der Belegzelle.
Wirkt
nur eine oder zwei dieser Anregungen, ist die Säurebildung deutlich
reduziert. Das bedeutet, dass die Blockade nur eines dieser Faktoren
bereits einen starken Drosselungseffekt auf die Säureproduktion hat -
z.B. wirkt die Gabe eines Histamin-Rezeptorblockers deutlich säurehemmend, auch bei hoher Konzentration von Acetylcholin und Gastrin an der Belegzelle.  s. dort).
s. dort).  Dehnung der Magenwand, insgesondere im Antrum - dies ist der stärkste Reiz für die Gastrinausschüttung und wirkt Acetylcholinunabhängig über postganglionär- parasympathische Fasern (N. vagus), die GRP freisetzen (
Dehnung der Magenwand, insgesondere im Antrum - dies ist der stärkste Reiz für die Gastrinausschüttung und wirkt Acetylcholinunabhängig über postganglionär- parasympathische Fasern (N. vagus), die GRP freisetzen ( Abbildung unten). Vermittelt wird dieser Effekt durch lokale Nervenbahnen sowie einen vagovagalen Reflex;
Abbildung unten). Vermittelt wird dieser Effekt durch lokale Nervenbahnen sowie einen vagovagalen Reflex; Die Wirkungskette
postganglionäre Zelle → GRP → Gastrin → Belegzelle →
Salzsäureproduktion ist an keiner Stelle cholinerg vermittelt und daher durch Atropin nicht blockierbar.
Die Wirkungskette
postganglionäre Zelle → GRP → Gastrin → Belegzelle →
Salzsäureproduktion ist an keiner Stelle cholinerg vermittelt und daher durch Atropin nicht blockierbar. GRP wird durch cholinerge Anregung freigesetzt (
GRP wird durch cholinerge Anregung freigesetzt ( Abbildung) und regt die Gastrinsekretion in G-Zellen an.
Der metabotrope GRP-Rezeptor BB2
(benannt nach Bombesin, einem strukturell ähnlichen Peptid in der Haut der Rotbauchunke bombina bombina) entsteht außer im Magen auch in Pankreas, Nebennierenrinde und
Gehirn.
Abbildung) und regt die Gastrinsekretion in G-Zellen an.
Der metabotrope GRP-Rezeptor BB2
(benannt nach Bombesin, einem strukturell ähnlichen Peptid in der Haut der Rotbauchunke bombina bombina) entsteht außer im Magen auch in Pankreas, Nebennierenrinde und
Gehirn.
 In der gastrischen Phase werden G-Zellen durch die Anwesenheit appetitanregender Substanzen in Magen und Duodenum -
"Saftlocker" wie Oligopeptide (z.B. in Suppen), Aminosäuren, weiters Nikotin, Koffein, Alkohol angeregt.
In der gastrischen Phase werden G-Zellen durch die Anwesenheit appetitanregender Substanzen in Magen und Duodenum -
"Saftlocker" wie Oligopeptide (z.B. in Suppen), Aminosäuren, weiters Nikotin, Koffein, Alkohol angeregt. pH-Wert ≤3 im Magenlumen (Selbstbegrenzung der Säurebildung) - durch
Somatostatin aus D-Zellen im Antrum- und Corpusteil des Megans, die auf niedrigen pH-Wert (<3) im
Lumen reagieren. Gastrin regt die Sekretion von Somatostatin an (negative Rückkopplung).
pH-Wert ≤3 im Magenlumen (Selbstbegrenzung der Säurebildung) - durch
Somatostatin aus D-Zellen im Antrum- und Corpusteil des Megans, die auf niedrigen pH-Wert (<3) im
Lumen reagieren. Gastrin regt die Sekretion von Somatostatin an (negative Rückkopplung).
 Abbildung oben): Im direkten
Weg (para- oder endokrin) bindet es an Somatostatinrezeptoren der
basolateralen Membran von Belegzellen und hemmt deren Säureproduktion;
in zwei indirekten entweder durch Hemmung von ECL-Zellen im Corpusteil des Magens, oder durch Hemmung von G-Zellen im Antrum.
Abbildung oben): Im direkten
Weg (para- oder endokrin) bindet es an Somatostatinrezeptoren der
basolateralen Membran von Belegzellen und hemmt deren Säureproduktion;
in zwei indirekten entweder durch Hemmung von ECL-Zellen im Corpusteil des Magens, oder durch Hemmung von G-Zellen im Antrum. Enterogastrone, die von Dünn- und Dickdarm in der intestinalen Phase bei Dehnung, Hypertonizität, Übersäuerung oder hoher Fettsäurekonzentration abgegeben werden
Enterogastrone, die von Dünn- und Dickdarm in der intestinalen Phase bei Dehnung, Hypertonizität, Übersäuerung oder hoher Fettsäurekonzentration abgegeben werden Prostaglandine (PGE2, PGI2) hemmen die Salzsäureproduktion der Belegzellen vermutlich indem sie mit der Histaminwirkung auf Belegzellen interferieren. Siehemmen
via Prostaglandinrezeptoren in der basolateralen Membran die
Adenylylcyclase und reduzieren darüber hinaus die Histaminfreisetzung
aus ECL-Zellen.
Prostaglandine (PGE2, PGI2) hemmen die Salzsäureproduktion der Belegzellen vermutlich indem sie mit der Histaminwirkung auf Belegzellen interferieren. Siehemmen
via Prostaglandinrezeptoren in der basolateralen Membran die
Adenylylcyclase und reduzieren darüber hinaus die Histaminfreisetzung
aus ECL-Zellen.
 Abbildung: Steuerung der Magensaftsekretion
Abbildung: Steuerung der Magensaftsekretion
 CCK, Cholezystokinin
CCK, Cholezystokinin  CCKB = CCK2-Rezeptor = Gastrinrezeptor
CCKB = CCK2-Rezeptor = Gastrinrezeptor
 Abbildung).
Abbildung). Die biologische Aktivität erfolgt über die letzten vier Aminosäuren des Gastrins; das synthetische Pentagastrin
enthält diese Aminosäuren (plus N-terminales Alanin, was die Stabilität
erhöht) und wirkt dementsprechend anregend auf Motorik und Sekretion
des Magens etc. (s. unten).
Die biologische Aktivität erfolgt über die letzten vier Aminosäuren des Gastrins; das synthetische Pentagastrin
enthält diese Aminosäuren (plus N-terminales Alanin, was die Stabilität
erhöht) und wirkt dementsprechend anregend auf Motorik und Sekretion
des Magens etc. (s. unten). Anregung der Säureproduktion der Belegzellen
Anregung der Säureproduktion der Belegzellen 
 Wachstum der Mucosa (Bereich der Belegzellen im Magen, Schleimhaut des Dünn- und Dickdarms; Antrektomie führt zu Atrophie der restlichen Magenschleimhaut)
Wachstum der Mucosa (Bereich der Belegzellen im Magen, Schleimhaut des Dünn- und Dickdarms; Antrektomie führt zu Atrophie der restlichen Magenschleimhaut)
 Anregung von Funktion und Wachstum histaminproduzierender ECL-Zellen im Corpusteil (unterstützt die Säureproduktion)
Anregung von Funktion und Wachstum histaminproduzierender ECL-Zellen im Corpusteil (unterstützt die Säureproduktion) Tonuserhöhung (Verschluss) des Kardiasphinkters
Tonuserhöhung (Verschluss) des Kardiasphinkters
 Anregung der Peristaltik am Magenausgang
Anregung der Peristaltik am Magenausgang
 Sekretion von Galle
und Pankreassaft
Sekretion von Galle
und Pankreassaft
 Stimulation von D-Zellen im Antrum (Selbsthemmung der G-Zellen)
Stimulation von D-Zellen im Antrum (Selbsthemmung der G-Zellen) s. dort). Im Fundus- und Corpusbereich des Magens hemmt Somatostatin die Histaminfreisetzung aus ECL-Zellen sowie
die Aktivität der Belegzellen.
Das ist zweckmäßig, um den pH-Wert im Lumen des Magens nicht zu stark
(pH~3) sinken zu lassen und das Duodenum nicht zu übersäuern.
s. dort). Im Fundus- und Corpusbereich des Magens hemmt Somatostatin die Histaminfreisetzung aus ECL-Zellen sowie
die Aktivität der Belegzellen.
Das ist zweckmäßig, um den pH-Wert im Lumen des Magens nicht zu stark
(pH~3) sinken zu lassen und das Duodenum nicht zu übersäuern. durch Wasserstoffionen im Mageninhalt, was die H-Ionensekretion begrenzt;
durch Wasserstoffionen im Mageninhalt, was die H-Ionensekretion begrenzt;

 durch Gastrin (Selbsthemmung von
G-Zellen);
durch Gastrin (Selbsthemmung von
G-Zellen); 
 durch VIP.
durch VIP.  Sekretin und GIP aus Duodenum und Jejunum,
Sekretin und GIP aus Duodenum und Jejunum,  Peptid YY und GLP-1 aus Ileum und Colon.
Peptid YY und GLP-1 aus Ileum und Colon. 




 Funktionelle Einschränkungen des gastrischen Nervensystems (wie bei diabetischer Neuropathie) beeinträchtigen die Magenmotorik (MMC), was zur Bildung von Magensteinen führen kann. Die gastrische Akkommodation des Fundusbereichs (
Funktionelle Einschränkungen des gastrischen Nervensystems (wie bei diabetischer Neuropathie) beeinträchtigen die Magenmotorik (MMC), was zur Bildung von Magensteinen führen kann. Die gastrische Akkommodation des Fundusbereichs ( s. oben) läßt nach, dies führt zu ungenügender Zwischenspeicherung und Auftreten von Völlegefühl.
s. oben) läßt nach, dies führt zu ungenügender Zwischenspeicherung und Auftreten von Völlegefühl. Überdehnung des Magens, Sekretin und zu niedriger
pH-Wert des Mageninhalts hemmen die Gastrinfreisetzung.
Überdehnung des Magens, Sekretin und zu niedriger
pH-Wert des Mageninhalts hemmen die Gastrinfreisetzung. Übermäßige
Freisetzung von Salzsäure leistet der Bildung von Geschwüren
(gastroduodenale Ulzera) Vorschub. Die HCl-Produktion kann verringert (und die Ausheilung von Ulzera gefördert) werden durch
Übermäßige
Freisetzung von Salzsäure leistet der Bildung von Geschwüren
(gastroduodenale Ulzera) Vorschub. Die HCl-Produktion kann verringert (und die Ausheilung von Ulzera gefördert) werden durch Hemmung von Histaminrezeptoren
(durch H2- Rezeptorblocker)
Hemmung von Histaminrezeptoren
(durch H2- Rezeptorblocker) Gabe von Somatostatin-Analoga und Prostaglandin E2 (
Gabe von Somatostatin-Analoga und Prostaglandin E2 ( Mechanismen s. oben)
Mechanismen s. oben) Hemmung der H+/K+-ATPase
der Belegzellen (durch H+-Pumpen-Hemmer wie Omeprazol)
Hemmung der H+/K+-ATPase
der Belegzellen (durch H+-Pumpen-Hemmer wie Omeprazol) Patienten, denen Teile des Magens
entfernt wurde, müssen in kleineren Zeitabständen beschränkte
Nahrungsmengen zu sich nehmen, um ein "Dumping-Syndrom"
mit allzu starken
Schwankungen des Blutzuckerspiegels zu vermeiden. Dabei kommt es zu
überstürzter Entleerung von Mageninhalt in den Dünndarm,
Flüssigkeitsverschiebung in den Darm (osmotische Wirkung) und Störungen
der Glukostase (heftige Blutzucker- und Insulinschwankungen). Symptome
sind Krämpfe und Übelkeit nach Mahlzeiten, begleitet mit
Schweißausbrüchen und Tachykardie.
Patienten, denen Teile des Magens
entfernt wurde, müssen in kleineren Zeitabständen beschränkte
Nahrungsmengen zu sich nehmen, um ein "Dumping-Syndrom"
mit allzu starken
Schwankungen des Blutzuckerspiegels zu vermeiden. Dabei kommt es zu
überstürzter Entleerung von Mageninhalt in den Dünndarm,
Flüssigkeitsverschiebung in den Darm (osmotische Wirkung) und Störungen
der Glukostase (heftige Blutzucker- und Insulinschwankungen). Symptome
sind Krämpfe und Übelkeit nach Mahlzeiten, begleitet mit
Schweißausbrüchen und Tachykardie. Gastrinproduzierende
Tumoren treiben die Belegzellen zu maximaler Bildung von Salzsäure an
(Zollinger-Ellison-Syndrom). Dies führt zu so starker Ulcusbildung, dass
es unbehandelt zu Blutungen und sogar Perforationen der Magenwand kommt.
Gastrinproduzierende
Tumoren treiben die Belegzellen zu maximaler Bildung von Salzsäure an
(Zollinger-Ellison-Syndrom). Dies führt zu so starker Ulcusbildung, dass
es unbehandelt zu Blutungen und sogar Perforationen der Magenwand kommt. Prostaglandin E2
(PGE2) hemmt die Säuresekretion, fördert die Mucin- und
Bicarbonatbildung sowie die Magendurchblutung und schützt so die
Magenschleimhaut vor der Einwirkung von HCl (
Prostaglandin E2
(PGE2) hemmt die Säuresekretion, fördert die Mucin- und
Bicarbonatbildung sowie die Magendurchblutung und schützt so die
Magenschleimhaut vor der Einwirkung von HCl ( s. oben). Zur Bildung von
PGE2 (aus Arachidonsäure) ist die Zyklooxygenase 1 (COX 1) notwendig. Medikamente, welche
deren Aktivität hemmen ("COX-Hemmer", z.B. die Schmerzmittel Acetylsalizylsäure,
Ibuprofen), können bei häufiger Einnahme Magengeschwüre bedingen.
s. oben). Zur Bildung von
PGE2 (aus Arachidonsäure) ist die Zyklooxygenase 1 (COX 1) notwendig. Medikamente, welche
deren Aktivität hemmen ("COX-Hemmer", z.B. die Schmerzmittel Acetylsalizylsäure,
Ibuprofen), können bei häufiger Einnahme Magengeschwüre bedingen. Medikamentös nicht therapierbare Magen- oder Zwölffingerdarmgeschwüre
(Ulcus ventriculi, Ulcus duodeni) können durch eine Magenresektion
(Entfernung der unteren 2/3 des Magens) behandelt werden, weil der
Verlust des Großteils der Belegzellen die Magensäureproduktion stark
reduziert.
Medikamentös nicht therapierbare Magen- oder Zwölffingerdarmgeschwüre
(Ulcus ventriculi, Ulcus duodeni) können durch eine Magenresektion
(Entfernung der unteren 2/3 des Magens) behandelt werden, weil der
Verlust des Großteils der Belegzellen die Magensäureproduktion stark
reduziert.

 Der Magen dient als Zwischenspeicher (Fundus: Vago-vagaler Akkommodationsreflex - Kapazität ~1,5 Liter mit ~10 mmHg Druckanstieg), bildet Salzsäure, Pepsinogen, intrinsic factor
(Corpus), zerkleinert feste Teile des Chymus (Antrum). Er ist mechano-
und chemosensitiv und bildet Hormone. Die Magenfunktionen wird hauptsächlich gastrisch angeregt (zephale Phase 20-30%, intestinale ~5%). Der Dünndarm hemmt die Pyloruspassage vor allem bei Anwesenheit
von Fett (Enterogastrone). Der Zeitverlauf der Magenentleerung hängt vom aufgenommenen Volumen sowie Osmolarität,
Energiedichte und Verdaubarkeit des Chymus ab. Sphinkteren grenzen gegen
Ösophagus (Cardia) und Duodenum (Pylorus) ab, diese sind neuronal und
humoral gesteuert und lassen nur ausnahmsweise oralwärts
gerichtete Passage zu (Regurgitation, Reflux, Erbrechen)
Der Magen dient als Zwischenspeicher (Fundus: Vago-vagaler Akkommodationsreflex - Kapazität ~1,5 Liter mit ~10 mmHg Druckanstieg), bildet Salzsäure, Pepsinogen, intrinsic factor
(Corpus), zerkleinert feste Teile des Chymus (Antrum). Er ist mechano-
und chemosensitiv und bildet Hormone. Die Magenfunktionen wird hauptsächlich gastrisch angeregt (zephale Phase 20-30%, intestinale ~5%). Der Dünndarm hemmt die Pyloruspassage vor allem bei Anwesenheit
von Fett (Enterogastrone). Der Zeitverlauf der Magenentleerung hängt vom aufgenommenen Volumen sowie Osmolarität,
Energiedichte und Verdaubarkeit des Chymus ab. Sphinkteren grenzen gegen
Ösophagus (Cardia) und Duodenum (Pylorus) ab, diese sind neuronal und
humoral gesteuert und lassen nur ausnahmsweise oralwärts
gerichtete Passage zu (Regurgitation, Reflux, Erbrechen)  Eine Schrittmacherzone im oberen Corpusteil reagiert auf Dehnung mit peristaltischen Wellen (~3 pro Minute), diese wandern bis zum Pylorus und durchmischen den Chymus. Interstitielle (Cajal-) Zellen zeigen oszillierende Entladungen, die Kontraktionswellen auslösen, wenn die Aktionspotentiale Plateauphasen ausbilden. Dies tritt autonom auf und kann durch nervöse oder endokrine
Signale beeinflusst werden: Parasympathische Impulse, Gastrin und CCK erhöhen
Stärke und Frequenz der Kontraktionen; sympathische Impulse, Sekretin und GIP senken sie. Motilin aus dem Dünndarm beschleunigt den myoelektrischen Komplex und regt die Magenentleerung an. Kontraktionswellen
zermahlen den Inhalt des Magenausgangs zu ~1 mm großen Stücken (Antrummühle: Drucke bis über 100 mmHg), bevor
der Pylorus den Chymus portionsweise (2-4 ml) in das Duodenum lässt. Die Verweildauer des Mageninhalts beträgt bei Flüssigkeiten einige Minuten, bei fettreicher Nahrung bis zu 9 Stunden. Die Magenentleerung nimmt mit dem Volumen exponentiell zu, das verhindert Überdehnung
Eine Schrittmacherzone im oberen Corpusteil reagiert auf Dehnung mit peristaltischen Wellen (~3 pro Minute), diese wandern bis zum Pylorus und durchmischen den Chymus. Interstitielle (Cajal-) Zellen zeigen oszillierende Entladungen, die Kontraktionswellen auslösen, wenn die Aktionspotentiale Plateauphasen ausbilden. Dies tritt autonom auf und kann durch nervöse oder endokrine
Signale beeinflusst werden: Parasympathische Impulse, Gastrin und CCK erhöhen
Stärke und Frequenz der Kontraktionen; sympathische Impulse, Sekretin und GIP senken sie. Motilin aus dem Dünndarm beschleunigt den myoelektrischen Komplex und regt die Magenentleerung an. Kontraktionswellen
zermahlen den Inhalt des Magenausgangs zu ~1 mm großen Stücken (Antrummühle: Drucke bis über 100 mmHg), bevor
der Pylorus den Chymus portionsweise (2-4 ml) in das Duodenum lässt. Die Verweildauer des Mageninhalts beträgt bei Flüssigkeiten einige Minuten, bei fettreicher Nahrung bis zu 9 Stunden. Die Magenentleerung nimmt mit dem Volumen exponentiell zu, das verhindert Überdehnung  Der Magensaft enthält Mucin aus Nebenzellen (Schutz); Bicarbonat aus Oberflächenepithelzellen (Pufferung); Salzsäure aus Belegzellen (aktiviert Pepsinogen, regt die Gastrinsekretion an, wirkt keimtötend); Pepsinogen aus Hauptzellen (→ Pepsin, Endopeptidase); Intrinsic factor aus Belegzellen (Bindung an Kobalamin). Gastrin (aus G-Zellen), Histamin (aus ECL-Zellen), parasympathische Impulse regen die HCl-produktion an. Der Magen
bildet ~10 ml Salzsäure pro Tag; Speisen wirken puffernd, α-Amylase des
Speichels kann im Magen einige Zeit weiterwirken. Der Magensaft ist isoton, die Konzentration der einzelnen Elektrolyte hängt
von der Funktion ab: In Ruhephasen sezernieren Nicht-Belegzellen
Kochsalz und Natriumbicarbonat, mit steigender Sekretionsrate
produzieren Belegzellen Wasserstoffionen (~10 → ~160 mM)
Der Magensaft enthält Mucin aus Nebenzellen (Schutz); Bicarbonat aus Oberflächenepithelzellen (Pufferung); Salzsäure aus Belegzellen (aktiviert Pepsinogen, regt die Gastrinsekretion an, wirkt keimtötend); Pepsinogen aus Hauptzellen (→ Pepsin, Endopeptidase); Intrinsic factor aus Belegzellen (Bindung an Kobalamin). Gastrin (aus G-Zellen), Histamin (aus ECL-Zellen), parasympathische Impulse regen die HCl-produktion an. Der Magen
bildet ~10 ml Salzsäure pro Tag; Speisen wirken puffernd, α-Amylase des
Speichels kann im Magen einige Zeit weiterwirken. Der Magensaft ist isoton, die Konzentration der einzelnen Elektrolyte hängt
von der Funktion ab: In Ruhephasen sezernieren Nicht-Belegzellen
Kochsalz und Natriumbicarbonat, mit steigender Sekretionsrate
produzieren Belegzellen Wasserstoffionen (~10 → ~160 mM) Belegzellen (HCl) haben Rezeptoren für Acetylcholin, Histamin, CCK (anregend) und Somatostatin (hemmend). ECL-Zellen (Histamin) haben Rezeptoren für Gastrin, Acetylcholin, Noradrenalin (anregend) und Somatostatin (hemmend). Parasympathische Impulse aktivieren Belegzellen, G-Zellen und hemmen D-Zellen. D-Zellen
produzieren Somatostatin, werden apikal durch H+ (offener
Zelltyp), basolateral durch Gastrin angeregt, durch Acetylcholin
gehemmt. G-Zellen (Gastrin) werden angeregt durch appetitanregende Substanzen, Dehnung
des Antrum (lokale Nervenbahnen plus vagovagaler Reflex), GRP aus
Nervenzellen im Magen; gehemmt wird sie bei pH ≤3 im Magenlumen
(Selbstbegrenzung) und Somatostatin. Gastrin
fördert die Trophik der Schleimhaut, regt die Sekretion von Salzsäure
und Pepsinogen sowie die Histaminsynthese in ECL-Zellen an. PGE2 hemmt die Produktion von HCl und fördert die Mucin- und Bicarbonatsekretion
Belegzellen (HCl) haben Rezeptoren für Acetylcholin, Histamin, CCK (anregend) und Somatostatin (hemmend). ECL-Zellen (Histamin) haben Rezeptoren für Gastrin, Acetylcholin, Noradrenalin (anregend) und Somatostatin (hemmend). Parasympathische Impulse aktivieren Belegzellen, G-Zellen und hemmen D-Zellen. D-Zellen
produzieren Somatostatin, werden apikal durch H+ (offener
Zelltyp), basolateral durch Gastrin angeregt, durch Acetylcholin
gehemmt. G-Zellen (Gastrin) werden angeregt durch appetitanregende Substanzen, Dehnung
des Antrum (lokale Nervenbahnen plus vagovagaler Reflex), GRP aus
Nervenzellen im Magen; gehemmt wird sie bei pH ≤3 im Magenlumen
(Selbstbegrenzung) und Somatostatin. Gastrin
fördert die Trophik der Schleimhaut, regt die Sekretion von Salzsäure
und Pepsinogen sowie die Histaminsynthese in ECL-Zellen an. PGE2 hemmt die Produktion von HCl und fördert die Mucin- und Bicarbonatsekretion