




 Duodenum, Jejunum, Ileum
Duodenum, Jejunum, Ileum
 Chymus: χυμός = Saft
Chymus: χυμός = Saft| Der
Dünndarm steht im Zentrum der Resorptionsvorgänge. Dazu erhält er aus
dem hepatobiliären System (Leber, Gallenblase) Gallensekret und aus der
Bauchspeicheldrüse Pankreassekret. Das Gallensekret enthält Salze und
gallensaure Salze, letztere dienen der Fettverdauung; das
Pankreassekret enthält Salze (vor allem Bicarbonat, das den sauren
Mageninhalt puffert) und Enzyme für das Aufschließen von Proteinen /
Peptiden, Kohlenhydraten, Fetten und anderen Nahrungsbestandteilen. Die Sekretionsvorgänge sind hormonell und neural gesteuert. Auslösend sind vor allem die Bestandteile im Chymus. Spezielle Schleimhautzellen in Duodenum und Jejunum "messen" deren Muster und Konzentration und reagieren mit der Freisetzung von "Verdauungshormonen" wie Sekretin (regt die Bildung basischen Sekrets an) oder Cholezystokinin (fördert die Bildung enzymreichen Sekrets). CCK bringt darüber hinaus die Gallenblase zur Kontraktion und entspannt den Sphincter Oddi, der über die Passage von Gallen- und Pankreassekret in das Duodenum wacht. Die Schleimhaut des Dünndarms verfügt über die Mechanismen zur Resoption verschiedenster Nahrungsbestandteile und wacht einerseits über immunologische Intaktheit, bildet andererseits einen Passageweg für den Weitertransport resorbierter Komponenten in Blut (Pfortader) und Lymphe (Chylusgefäße). Die Muskulatur des Dünndarms vermittelt die motorischen Elemente zur Durchmischung des Darminhalts einerseits (Erleichterung der Verdauungs- und Aufnahmeprozesse) und zu dessen Weitertransport andererseits (Peristaltik). Die Koordination der dazu notwendigen Bewegungselemente obliegt spezifischen Schrittmacherzellen und deren Interaktion mit autonomen Nervenzellen und deren Plexus, sowie den glatten Muskelzellen, welche Tonus und Motorik generieren. |
 Verdauung und Resorption
Verdauung und Resorption  Motilität des Dünndarms
Motilität des Dünndarms  Resorptionsmechanismen
Resorptionsmechanismen  Dünndarm und Pankreas
Dünndarm und Pankreas  Dünndarm und Galle
Dünndarm und Galle
 (Kontraktionsfrequenz ~3/min) und die Muskulatur des Duodenum
(Kontraktionsfrequenz ~3/min) und die Muskulatur des Duodenum  (~12/min) können unabhängig voneinander aktiv sein.
(~12/min) können unabhängig voneinander aktiv sein. 
 Näheres zu den Verdauungsmechanismen im Dünndarm s. dort
Näheres zu den Verdauungsmechanismen im Dünndarm s. dort Näheres zu den Resorptionsmechanismen im Dünndarm s. dort
Näheres zu den Resorptionsmechanismen im Dünndarm s. dort mit Sekret und Enzymen
mit Sekret und Enzymen  , Wechsel der Kontaktorte
mit der Schleimhaut) sowie Weitertransport. Die Passagezeit des ~7 m langen Dünndarms beträgt 2-4 Stunden.
, Wechsel der Kontaktorte
mit der Schleimhaut) sowie Weitertransport. Die Passagezeit des ~7 m langen Dünndarms beträgt 2-4 Stunden. Abbildung):
Abbildung):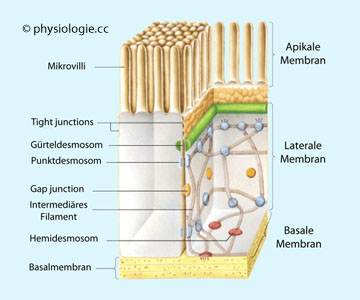
 Abbildung: Enterozyt
Abbildung: Enterozyt vgl. dort). Sie sind durch ein Schlussleistensystem voneinander separiert.
vgl. dort). Sie sind durch ein Schlussleistensystem voneinander separiert.
 Eine Seite blickt zum Lumen und ermöglicht die Resorption von Stoffen aus dem Chymus - die entsprechende Membran nennt man apikal
(Apex = Spitze - der Zelle) bzw. luminal. Diese Membran ist in den
meisten Fällen zwecks Oberflächenvergrößerung zu zahlreichen winzigen
Ausstülpungen (Mikrovilli) gefaltet.
Eine Seite blickt zum Lumen und ermöglicht die Resorption von Stoffen aus dem Chymus - die entsprechende Membran nennt man apikal
(Apex = Spitze - der Zelle) bzw. luminal. Diese Membran ist in den
meisten Fällen zwecks Oberflächenvergrößerung zu zahlreichen winzigen
Ausstülpungen (Mikrovilli) gefaltet. Die andere Seite - seitlich und zum Interstitium (Blutseite) hin gerichtet - ist von
Membran überzogen. Über diese werden u.a. apikal resorbierte Stoffe
weitertransportiert, sie enthält in jedem Fall Na/K-ATPase, welche die
meisten Transportprozesse (sekundär) antreibt und basolateralertranszellulären Austausch verschiedener Stoffe erlaubt (A, C und D in der folgenden
Die andere Seite - seitlich und zum Interstitium (Blutseite) hin gerichtet - ist von
Membran überzogen. Über diese werden u.a. apikal resorbierte Stoffe
weitertransportiert, sie enthält in jedem Fall Na/K-ATPase, welche die
meisten Transportprozesse (sekundär) antreibt und basolateralertranszellulären Austausch verschiedener Stoffe erlaubt (A, C und D in der folgenden  Abbildung).
Abbildung).  Das
Muster der Ausstattung der apikalen und basolateralen Membran mit Transportmolekülen (Permeasen, Pumpen,
Symportern, Antiportern) ist jeweils unterschiedlich und entscheidet
darüber, welche Ionen und Moleküle wie stark und in welche Richtung
durch die Zelle transportiert werden können.
Das
Muster der Ausstattung der apikalen und basolateralen Membran mit Transportmolekülen (Permeasen, Pumpen,
Symportern, Antiportern) ist jeweils unterschiedlich und entscheidet
darüber, welche Ionen und Moleküle wie stark und in welche Richtung
durch die Zelle transportiert werden können. Abbildung).
Abbildung).
 Abbildung: Resorptionswege in der Darmschleimhaut
Abbildung: Resorptionswege in der Darmschleimhaut Zur Vergrößerung der Resorptionsoberfläche s. dort
Zur Vergrößerung der Resorptionsoberfläche s. dort Sekretin
aus S-Zellen in der Mucosa (angeregt durch einem pH ab 4,5, ansteigend
bis pH 3,0 - Werte, die nur im proximalen Duodenum auftreten - sowie
hohe Konzentrationen langkettiger Fettsäuren) und
Sekretin
aus S-Zellen in der Mucosa (angeregt durch einem pH ab 4,5, ansteigend
bis pH 3,0 - Werte, die nur im proximalen Duodenum auftreten - sowie
hohe Konzentrationen langkettiger Fettsäuren) und  Cholezystokinin (CCK) aus I-Zellen in der Mucosa (angeregt durch
Aminosäuren, Peptide, Fette im Chymus). Acinuszellen im Pankreas exprimieren (beim Menschen) keine CCK-Rezeptoren; CCK wirkt offenbar auf vagale Afferenzen, die dann in der Bauchspeicheldrüse vagovagale Reflexe auslösen (die atropinblockierbar sind).
Cholezystokinin (CCK) aus I-Zellen in der Mucosa (angeregt durch
Aminosäuren, Peptide, Fette im Chymus). Acinuszellen im Pankreas exprimieren (beim Menschen) keine CCK-Rezeptoren; CCK wirkt offenbar auf vagale Afferenzen, die dann in der Bauchspeicheldrüse vagovagale Reflexe auslösen (die atropinblockierbar sind).  Die
Sekretions- bzw. Bicarbonatantwort auf eine Mahlzeit beruht auf der
Freisetzung geringer Mengen Sekretin, ausgelöst durch Ansäuerung des
Duodenum und via CCK cholinerg potenziert im Rahmen vagovagaler Reflexe.
Die
Sekretions- bzw. Bicarbonatantwort auf eine Mahlzeit beruht auf der
Freisetzung geringer Mengen Sekretin, ausgelöst durch Ansäuerung des
Duodenum und via CCK cholinerg potenziert im Rahmen vagovagaler Reflexe.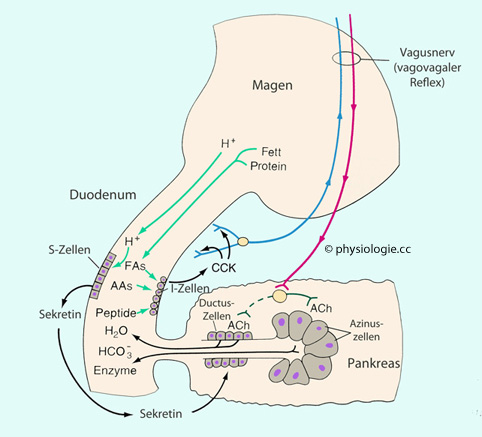
 Abbildung: Duodenum und Anregung des Pankreas
Abbildung: Duodenum und Anregung des Pankreas
 Abbildung) - dieser Mechanismus ist durch Atropin blockierbar (die Endstrecke ist cholinerg).
Abbildung) - dieser Mechanismus ist durch Atropin blockierbar (die Endstrecke ist cholinerg).
 Abbildung: Gallensystem und enterohepatischer Kreislauf - Überblick
Abbildung: Gallensystem und enterohepatischer Kreislauf - Überblick
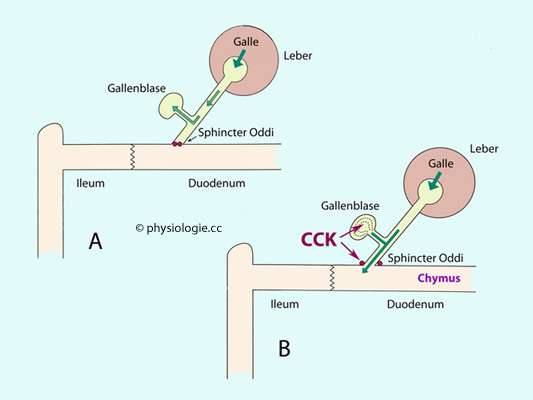
 Abbildung: Steuerung von Gallenblase und Sphincter Oddi
Abbildung: Steuerung von Gallenblase und Sphincter Oddi
 (m. sphincter ampullae hepatopancreaticae) - eine Verstärkung des
Ringmuskels des Endstücks des Gallengangs - umschließt die gemeinsame
Einmündung des Gallen- (ductus choledochus) und
Pankreasausführungsganges (ductus pancreaticus); er liegt in der
Vater'schen Papille
(m. sphincter ampullae hepatopancreaticae) - eine Verstärkung des
Ringmuskels des Endstücks des Gallengangs - umschließt die gemeinsame
Einmündung des Gallen- (ductus choledochus) und
Pankreasausführungsganges (ductus pancreaticus); er liegt in der
Vater'schen Papille  (papilla duodeni major).
(papilla duodeni major).  Abbildung).
Abbildung). Abbildung).
Abbildung).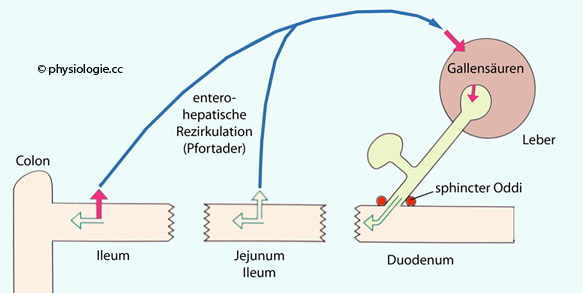
 Abbildung: Enterohepatischer Kreislauf von Gallensäuren
Abbildung: Enterohepatischer Kreislauf von Gallensäuren
 Über die Resorption von Protein s. dort und dort
Über die Resorption von Protein s. dort und dort Über die Resorption von Kohlenhydraten s. dort
Über die Resorption von Kohlenhydraten s. dort Über die Resorption von Fetten s. dort und dort
Über die Resorption von Fetten s. dort und dort Über die Darmmotorik s. dort
Über die Darmmotorik s. dort Über das Immunsystem des Darmes s. dort
Über das Immunsystem des Darmes s. dort
 Das Duodenum zeigt in der digestiven Phase vor allem Segmentationsmotorik (~12/min),
die durch Ruhephasen unterbrochen ist; gelegentlich tritt Peristaltik
auf. Wenn der Mageninhalt entsprechend homogenisiert und das Duodenum
aufnahmebereit ist, lässt der Pylorus die Passage von Chymus zu. Zur Wirkung der kohlenhydrat-, fett-,
eiweiß- und nukleinsäurespaltenden pankreatischen Enzyme kommt die von
membranständigen Enzymen des Bürstensaums im Dünndarm Das Duodenum zeigt in der digestiven Phase vor allem Segmentationsmotorik (~12/min),
die durch Ruhephasen unterbrochen ist; gelegentlich tritt Peristaltik
auf. Wenn der Mageninhalt entsprechend homogenisiert und das Duodenum
aufnahmebereit ist, lässt der Pylorus die Passage von Chymus zu. Zur Wirkung der kohlenhydrat-, fett-,
eiweiß- und nukleinsäurespaltenden pankreatischen Enzyme kommt die von
membranständigen Enzymen des Bürstensaums im Dünndarm Die Dünndarmmotorik unterstützt die Verdauungs- und Resorptionsprozesse durch Transport (Peristaltik), Wechsel des Schleimhautkontakts und Vermischung des Chymus mit Sekret (Segmentationen). Sie wird getriggert durch interstitielle (Cajal-) Schrittmacherzellen, die einerseits den basalen Rhythmus vorgeben, andererseits neuronale Inputs vermitteln. Elektrische Entladungswellen (MMC) triggern im Nüchternzustand etwa alle 90 Minuten Kontraktionswellen (~5 cm/min),
die sich vom Magen bis zum Colon fortsetzen (Entleerung,
Eindämmung des Bakterienwachstums). Die digestive Phase zeigt Segmentationen (5 Sekunden-Periodik) und
Peristaltik. Schwankungen des Membranpotentials glatter Muskelzellen in
der Darmwand (Frequenz vom Duodenum zum Ileum abnehmend) lösen nur dann
Kontraktionen aus, wenn sie Aktionspotentiale triggern - das hängt von nervösen und humoralen Begleitfaktoren ab. Starke Dehnung eines Darmabschnitts hemmt generell die motorische Aktivität (intestino-intestinaler Reflex) Die Dünndarmmotorik unterstützt die Verdauungs- und Resorptionsprozesse durch Transport (Peristaltik), Wechsel des Schleimhautkontakts und Vermischung des Chymus mit Sekret (Segmentationen). Sie wird getriggert durch interstitielle (Cajal-) Schrittmacherzellen, die einerseits den basalen Rhythmus vorgeben, andererseits neuronale Inputs vermitteln. Elektrische Entladungswellen (MMC) triggern im Nüchternzustand etwa alle 90 Minuten Kontraktionswellen (~5 cm/min),
die sich vom Magen bis zum Colon fortsetzen (Entleerung,
Eindämmung des Bakterienwachstums). Die digestive Phase zeigt Segmentationen (5 Sekunden-Periodik) und
Peristaltik. Schwankungen des Membranpotentials glatter Muskelzellen in
der Darmwand (Frequenz vom Duodenum zum Ileum abnehmend) lösen nur dann
Kontraktionen aus, wenn sie Aktionspotentiale triggern - das hängt von nervösen und humoralen Begleitfaktoren ab. Starke Dehnung eines Darmabschnitts hemmt generell die motorische Aktivität (intestino-intestinaler Reflex) Schlussleistensysteme trennen die apikale (Bürstensaum, Resorptionsoberfläche
~200 m2) von der basolateralen Membran der Mucosaepithelzellen (Enterozyten), diese sind mit jeweils unterschiedlichen Transportsystemen (Permeasen, Pumpen, Symportern, Antiportern) ausgestattet. Deren Zahl
(Expression) und Zustand (Öffnungswahrscheinlichkeit) hängt von Lokalisierung, Situation und Anforderung ab und
entscheidet darüber, welche Ionen und Moleküle wie stark und in welche
Richtung durch die Zelle transportiert werden. Resorption kann
transzellulär oder parazellulär erfolgen. Die Zottenmotorik variiert
Kontaktzonen zum Chymus und unterstützt den Abtransport der Lymphe (zentrales Chylusgefäß). Die Epithelschicht wird in 2-6 Tagen komplett ausgetauscht Schlussleistensysteme trennen die apikale (Bürstensaum, Resorptionsoberfläche
~200 m2) von der basolateralen Membran der Mucosaepithelzellen (Enterozyten), diese sind mit jeweils unterschiedlichen Transportsystemen (Permeasen, Pumpen, Symportern, Antiportern) ausgestattet. Deren Zahl
(Expression) und Zustand (Öffnungswahrscheinlichkeit) hängt von Lokalisierung, Situation und Anforderung ab und
entscheidet darüber, welche Ionen und Moleküle wie stark und in welche
Richtung durch die Zelle transportiert werden. Resorption kann
transzellulär oder parazellulär erfolgen. Die Zottenmotorik variiert
Kontaktzonen zum Chymus und unterstützt den Abtransport der Lymphe (zentrales Chylusgefäß). Die Epithelschicht wird in 2-6 Tagen komplett ausgetauscht  Wenige Minuten nach Ankunft sauren Mageninhalts im Duodenum steigt die Pankreassekretion (physiologische Selbsthemmung: Der nach ~30 min erreichte Gipfelwert entspricht ~3/4 der maximal möglichen Menge), zum Großteil angeregt durch die Anwesenheit von Aminosäuren, Peptiden, Fetten (CCK wirkt auf afferente Fasern und über einen vagalen Reflex cholinerg auf Azinuszellen) und Wasserstoffionen (Sekretin steigert die Bicarbonatsekretion ab pH=5: "natürliches Antazidum") im Dünndarm. Insulin potenziert die sekretionsfördernden Effekte von Sekretin und CCK. CCK wird in den ersten 90 cm Dünndarmstrecke gebildet Wenige Minuten nach Ankunft sauren Mageninhalts im Duodenum steigt die Pankreassekretion (physiologische Selbsthemmung: Der nach ~30 min erreichte Gipfelwert entspricht ~3/4 der maximal möglichen Menge), zum Großteil angeregt durch die Anwesenheit von Aminosäuren, Peptiden, Fetten (CCK wirkt auf afferente Fasern und über einen vagalen Reflex cholinerg auf Azinuszellen) und Wasserstoffionen (Sekretin steigert die Bicarbonatsekretion ab pH=5: "natürliches Antazidum") im Dünndarm. Insulin potenziert die sekretionsfördernden Effekte von Sekretin und CCK. CCK wird in den ersten 90 cm Dünndarmstrecke gebildet Mit der Galle
werden Gallensäuren (in Form ihrer Salze), Cholesterin,
Gallenfarbstoffe, auch Medikamente und Schwermetalle ausgeschieden. Gallensäuren - die führende organische Komponente des Gallensekrets (~50% aller gelösten Bestandteile) - emulgieren Fette, machen sie für Lipase zugänglich und beteiligen sich an der Mizellenbildung. Gallensäuren werden passiv resorbiert (hydrophobe
und dekonjugierte Gallensäuren) oder aktiv im Ileum (hydrophilere
Gallensäuren wie Cholsäure). Dazu hat die apikale
Membran natriumabhängige Transporter, Transportproteine binden die Gallensäuren, an der
basolateralen Membran gelangen sie via Anionenaustauscher in
Interstitium und Pfortaderblut (enterohepatischer Kreislauf: tägliche Sekretion 20-30 g, Gallensäurepool 2-3 g). Die Leber produziert Gallensäuren abhängig vom Bedarf nach (bis zu 5 g/d) . Die Sekretion von Gallensäuren zieht aufgrund des osmotischen Effekts Wasser und Elektrolyte in die Gallenflüssigkeit (gallensäurenabhängige Gallenproduktion; der
in den Gallengängen unter dem Einfluss von Sekretin gebildete
bicarbonatreiche Gallensaft wird gallensäuren-unabhängig gebildet). Der
Sekretionsdruck (Gallengangdruck) beträgt bis zu 20 mmHg Mit der Galle
werden Gallensäuren (in Form ihrer Salze), Cholesterin,
Gallenfarbstoffe, auch Medikamente und Schwermetalle ausgeschieden. Gallensäuren - die führende organische Komponente des Gallensekrets (~50% aller gelösten Bestandteile) - emulgieren Fette, machen sie für Lipase zugänglich und beteiligen sich an der Mizellenbildung. Gallensäuren werden passiv resorbiert (hydrophobe
und dekonjugierte Gallensäuren) oder aktiv im Ileum (hydrophilere
Gallensäuren wie Cholsäure). Dazu hat die apikale
Membran natriumabhängige Transporter, Transportproteine binden die Gallensäuren, an der
basolateralen Membran gelangen sie via Anionenaustauscher in
Interstitium und Pfortaderblut (enterohepatischer Kreislauf: tägliche Sekretion 20-30 g, Gallensäurepool 2-3 g). Die Leber produziert Gallensäuren abhängig vom Bedarf nach (bis zu 5 g/d) . Die Sekretion von Gallensäuren zieht aufgrund des osmotischen Effekts Wasser und Elektrolyte in die Gallenflüssigkeit (gallensäurenabhängige Gallenproduktion; der
in den Gallengängen unter dem Einfluss von Sekretin gebildete
bicarbonatreiche Gallensaft wird gallensäuren-unabhängig gebildet). Der
Sekretionsdruck (Gallengangdruck) beträgt bis zu 20 mmHg Die Aufnahmekapazität der Gallenblase
beträgt 20-50 ml. Die Gallenblasenwand entzieht der Galle in der interdigestiven Phase
mittels aktivem Transport Natrium, Chlorid und Bicarbonat (Wasser folgt
osmotisch nach), es entsteht Blasengalle. Die Konzentration an Gallensäuren, Cholesterin, Bilirubin kann bis zum 20-fachen des Ausgangswertes (Lebergalle) zunehmen, die Gallenflüssigkeit bleibt durch Bildung von Mizellen dennoch isoton. Wieviel Galle
in das Duodenum gelangt, hängt ab vom Druckunterschied zwischen
Gallengang und Duodenum einerseits, vom Strömungswiderstand des
Sphincter Oddi andererseits. In
der interdigestiven Phase ist der Tonus des sphincter Oddi hoch,
derjenige der Gallenblasenwand niedrig, Lebergalle fließt in die
Gallenblase. Die Gallenblase kontrahiert in der digestiven Phase (CCK-Rezeptoren in der
Gallenblasenwand und auf cholinergen
Nervenfasern; CCK relaxiert den sphincter Oddi), aber auch im Rahmen von MMCs (interdigestiver Gallenfluss) Die Aufnahmekapazität der Gallenblase
beträgt 20-50 ml. Die Gallenblasenwand entzieht der Galle in der interdigestiven Phase
mittels aktivem Transport Natrium, Chlorid und Bicarbonat (Wasser folgt
osmotisch nach), es entsteht Blasengalle. Die Konzentration an Gallensäuren, Cholesterin, Bilirubin kann bis zum 20-fachen des Ausgangswertes (Lebergalle) zunehmen, die Gallenflüssigkeit bleibt durch Bildung von Mizellen dennoch isoton. Wieviel Galle
in das Duodenum gelangt, hängt ab vom Druckunterschied zwischen
Gallengang und Duodenum einerseits, vom Strömungswiderstand des
Sphincter Oddi andererseits. In
der interdigestiven Phase ist der Tonus des sphincter Oddi hoch,
derjenige der Gallenblasenwand niedrig, Lebergalle fließt in die
Gallenblase. Die Gallenblase kontrahiert in der digestiven Phase (CCK-Rezeptoren in der
Gallenblasenwand und auf cholinergen
Nervenfasern; CCK relaxiert den sphincter Oddi), aber auch im Rahmen von MMCs (interdigestiver Gallenfluss) |
