

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert


 Motorik,
Transport, Sensorik
Motorik,
Transport, Sensorik
 Auerbach-scher Plexus: Leopold Auerbach
Auerbach-scher Plexus: Leopold Auerbach| Die Motorik des gastrointestinalen Systems ist vielfältig: Verschluss (Sphincter), Transport (Peristaltik), Speicherung
(Akkommodation), Durchmischung (Segmentier-, Pendelbewegung,
nichtpropulsive Peristaltik). Interstitielle (Cajal-) Zellen sind die Quelle für Spontanaktivität und basalen Organrhythmus (BER: basal electrical rhythm) verschiedener Darmabschnitte. Das Darmnervensystem funktioniert weitgehend autonom und enthält mehrere Zelltypen (cholinerge, adrenerge, serotoninerge, purinerge, GABAerge). Das vegetative (autonome) System ist ihm "aufgeschaltet" und stellt funktionelle Beziehungen her - einerseits zwischen verschiedenen Darmabschnitten (z.B. gastro-kolischer Reflex), andererseits mit dem Zentralnervensystem. Im Nüchternzustand (interdigestive Phase) dienen alle 5-10 Minuten auftretende peristaltische Wellen - vom Magen bis zum Colon (MMC: migratory myoelectric complex) - der Reinigung des Darmes und dem Transport unverdaulicher Reste Richtung Enddarm. Im Rahmen der Peristaltik aktiviert die Dehnung eines Darmabschnittes Kontraktion vor diesem Abschnitt (aszendierender exzitatorischer Reflex) und Erschlaffung hinter ihm (deszendierender inhibitorischer Reflex) - vermittelt durch Neurone im plexus myentericus: Die einen fördern, die anderen hemmen Muskelzellen. Gleitet der Darminhalt weiter, verlagert sich mit ihm die Dehnungszone und damit das Reflexmuster. |
 Phasen der Verdauung
Phasen der Verdauung  Elektromechanische Koppelung
Elektromechanische Koppelung  Darmnervensystem
Darmnervensystem  Sekretion im Darm
Sekretion im Darm  Sensorik
Sensorik  Motorik
Motorik  SIP-Synzytium und Schrittmacherfunktion
SIP-Synzytium und Schrittmacherfunktion  Interdigestive Phase und migrierender Motorkomplex (MMC)
Interdigestive Phase und migrierender Motorkomplex (MMC) Enterochromaffine Zellen
Enterochromaffine Zellen
 Core messages
Core messages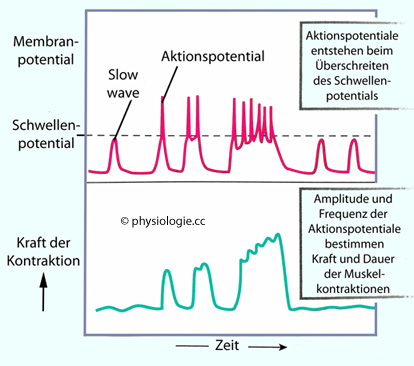
 Abbildung: Auslösung von Aktionspotentialen in der Darmmuskulatur
Abbildung: Auslösung von Aktionspotentialen in der Darmmuskulatur vgl. dort
vgl. dort
 Abbildung), die einerseits tonische
(dauerhafte), andererseits alternierende Aktivität (rhythmischen
Wechsel zwischen kontrahiert und relaxiert) ausüben muss. Diese Muster
werden durch - exzitatorische sowie inhibitorische - neuronale und
endokrine Einflüsse modifiziert. Motorische Anregung erfolgt im Darm
vorwiegend über Acetylcholin, Hemmung durch VIP und NO.
Dazu kommen Einflüsse des Darminhalts, dessen Eigenschaften über
Rezeptoren und Afferenzen auf das enterische Nervensystem und die
Freisetzung gastrointestinaler Hormone wirken. Dehnung der Darmwand
kann komplexe Kontraktionsmuster auslösen, etwa im Sinne eines
Vorwärtstransports (Peristaltik).
Abbildung), die einerseits tonische
(dauerhafte), andererseits alternierende Aktivität (rhythmischen
Wechsel zwischen kontrahiert und relaxiert) ausüben muss. Diese Muster
werden durch - exzitatorische sowie inhibitorische - neuronale und
endokrine Einflüsse modifiziert. Motorische Anregung erfolgt im Darm
vorwiegend über Acetylcholin, Hemmung durch VIP und NO.
Dazu kommen Einflüsse des Darminhalts, dessen Eigenschaften über
Rezeptoren und Afferenzen auf das enterische Nervensystem und die
Freisetzung gastrointestinaler Hormone wirken. Dehnung der Darmwand
kann komplexe Kontraktionsmuster auslösen, etwa im Sinne eines
Vorwärtstransports (Peristaltik). Abbildung):
Abbildung):
 Abbildung: Komponenten des Verdauungsapparates
Abbildung: Komponenten des Verdauungsapparates
 Die Speiseröhre verfügt über Transportperistaltik (an der sich quergestreifte und glatte
Muskelzellen gemeinsam beteiligen) mit einer Geschwindigkeit von über
200 cm/min. Der obere ösophageale Sphincter sowie das obere Drittel der Speiseröhre besteht aus quergestreiftem
Muskelgewebe, alle folgenden Abschnitte des Darmrohres - bis zum
äußeren Schließmuskel des Anus, der wieder quergestreift ist - aus glatter Muskulatur.
Die Speiseröhre verfügt über Transportperistaltik (an der sich quergestreifte und glatte
Muskelzellen gemeinsam beteiligen) mit einer Geschwindigkeit von über
200 cm/min. Der obere ösophageale Sphincter sowie das obere Drittel der Speiseröhre besteht aus quergestreiftem
Muskelgewebe, alle folgenden Abschnitte des Darmrohres - bis zum
äußeren Schließmuskel des Anus, der wieder quergestreift ist - aus glatter Muskulatur. Der Magenfundus ist auf die Speicherung aufgenommenen
Chymus spezialisiert, der Corpusanteil auf Mischperistaltik, der
Antrumanteil auf mechanische Zerkleinerung
Der Magenfundus ist auf die Speicherung aufgenommenen
Chymus spezialisiert, der Corpusanteil auf Mischperistaltik, der
Antrumanteil auf mechanische Zerkleinerung Im Dünndarm beträgt die
durchschnittliche Transportgeschwindigkeit 1-4 cm/min, die Transportperistaltik bewegt sich mit 30-120 cm/min voran); und
Im Dünndarm beträgt die
durchschnittliche Transportgeschwindigkeit 1-4 cm/min, die Transportperistaltik bewegt sich mit 30-120 cm/min voran); und  Im Dickdarm ~0,05-0,5 cm/min, wobei vorgeschaltete Darmabschnitte Einfluss nehmen (gastro-kolischer
Im Dickdarm ~0,05-0,5 cm/min, wobei vorgeschaltete Darmabschnitte Einfluss nehmen (gastro-kolischer  Reflex:
Dehnung der Magenwand führt zu Kontraktionen des Colons - nervös und
wahrscheinlich auch hormonell bedingt -, was den Darminhalt Richtung
Sigmoid schiebt und Stuhldrang auslöst) und auch gegenläufiger
Transport vorkommt.
Reflex:
Dehnung der Magenwand führt zu Kontraktionen des Colons - nervös und
wahrscheinlich auch hormonell bedingt -, was den Darminhalt Richtung
Sigmoid schiebt und Stuhldrang auslöst) und auch gegenläufiger
Transport vorkommt. Zu Pharmaka, welche Bewegungsabläufe im Gastrointestinaltrakt beeinflussen, gehören die folgenden:
Zu Pharmaka, welche Bewegungsabläufe im Gastrointestinaltrakt beeinflussen, gehören die folgenden: ) erhöhen
das Volumen (Faserstoffe, hyperosmotische Laxantien), erniedrigen die
Viskosität bzw. lubrizieren den Darminhalt, und beschleunigen seine
Passage zum Rectum
) erhöhen
das Volumen (Faserstoffe, hyperosmotische Laxantien), erniedrigen die
Viskosität bzw. lubrizieren den Darminhalt, und beschleunigen seine
Passage zum Rectum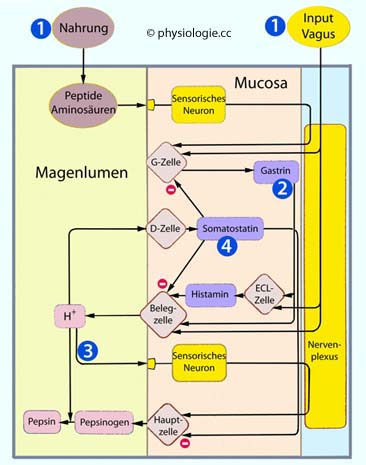
 Abbildung: Auswirkungen der zephalen und gastrischen Phase der Verdauung auf den Magen
Abbildung: Auswirkungen der zephalen und gastrischen Phase der Verdauung auf den Magen
 Die zephale Phase ("Gehirnphase")geht vom Gehirn aus: Verschiedene Sinnesreize, die mit der Nahrung zusammenhängen (auch die bloße Vorstellung davon), können über Zwischenhirn / limbisches System und Vagusnerv zu Sekretion - Salivation, Bildung von Magen- und Pankreassaft - sowie Hormonfreisetzung (vor allem Gastrin) führen. Im Magen zählen verschiedene Zellen
zu Adressaten der cholinergen Impulse: Angeregt werden Parietalzellen
(Salzsäureproduktion steigt auf ~40% des Maximums), Hauptzellen
(Pepsinogen), ECL-Zellen (Histamin), G-Zellen (Gastrin); gehemmt werden
D-Zellen (Somatostatin).
Die zephale Phase ("Gehirnphase")geht vom Gehirn aus: Verschiedene Sinnesreize, die mit der Nahrung zusammenhängen (auch die bloße Vorstellung davon), können über Zwischenhirn / limbisches System und Vagusnerv zu Sekretion - Salivation, Bildung von Magen- und Pankreassaft - sowie Hormonfreisetzung (vor allem Gastrin) führen. Im Magen zählen verschiedene Zellen
zu Adressaten der cholinergen Impulse: Angeregt werden Parietalzellen
(Salzsäureproduktion steigt auf ~40% des Maximums), Hauptzellen
(Pepsinogen), ECL-Zellen (Histamin), G-Zellen (Gastrin); gehemmt werden
D-Zellen (Somatostatin). Die gastrische Phase ("Magenphase") dauert während der Füllung des Magens an: Dehnungsrezeptoren aktivieren vago-vagale Reflexe
(sowohl die Afferenz als auch die Efferenz läuft über Fasern des N.
vagus) und diese aktivieren die Verdauungstätigkeit wie in der zephalen
Phase. Dazu kommen lokale Reflexe des enterischen Nervensystems. Zusammen ergibt das u.a. die volle Magensaftproduktion. G-Zellen werden chemosensitiv
zur Gastrinbildung angeregt ("Saftlocker" in den Speisen, z.B. Peptide
in Bouillon, Alkohol, Kaffee); benachbarte D-Zellen hemmen sie, wenn
der pH-Wert im Magen unter 3 absinkt (Selbstschutz). Ghrelin stimuliert das Hungerzentrum.
Die gastrische Phase ("Magenphase") dauert während der Füllung des Magens an: Dehnungsrezeptoren aktivieren vago-vagale Reflexe
(sowohl die Afferenz als auch die Efferenz läuft über Fasern des N.
vagus) und diese aktivieren die Verdauungstätigkeit wie in der zephalen
Phase. Dazu kommen lokale Reflexe des enterischen Nervensystems. Zusammen ergibt das u.a. die volle Magensaftproduktion. G-Zellen werden chemosensitiv
zur Gastrinbildung angeregt ("Saftlocker" in den Speisen, z.B. Peptide
in Bouillon, Alkohol, Kaffee); benachbarte D-Zellen hemmen sie, wenn
der pH-Wert im Magen unter 3 absinkt (Selbstschutz). Ghrelin stimuliert das Hungerzentrum.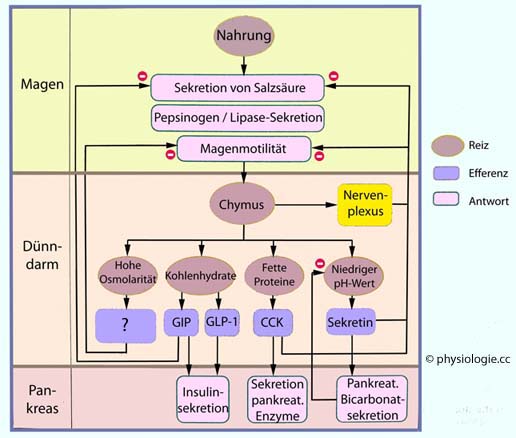
 Abbildung: Effekte der intestinalen Verdauungsphase auf die Magenfunktion
Abbildung: Effekte der intestinalen Verdauungsphase auf die Magenfunktion
 Die intestinale Phase ("Dünndarmphase",
Die intestinale Phase ("Dünndarmphase",  Abbildung) wird vom oberen Dünndarm beigesteuert: Sie beginnt, sobald der Chymus in diese Zone eintritt. Zellen in den Darmkrypten, dem Pankreas und den Gallengängen werden von dieser Phase beeinflusst:
Abbildung) wird vom oberen Dünndarm beigesteuert: Sie beginnt, sobald der Chymus in diese Zone eintritt. Zellen in den Darmkrypten, dem Pankreas und den Gallengängen werden von dieser Phase beeinflusst:  pH-empfindliche S-Zellen produzieren Sekretin, das die Gastrinbildung hemmt und die Sekretion bicarbonatreichen Sekrets fördert;
pH-empfindliche S-Zellen produzieren Sekretin, das die Gastrinbildung hemmt und die Sekretion bicarbonatreichen Sekrets fördert; monomere Verdauungsprodukte (emulgiertes Fett, Glucose, Aminosäuren) regen K-Zellen an, welche GIP sowie GLP-1 freisetzen und so die Magentätigkeit einbremsen;
monomere Verdauungsprodukte (emulgiertes Fett, Glucose, Aminosäuren) regen K-Zellen an, welche GIP sowie GLP-1 freisetzen und so die Magentätigkeit einbremsen; dieselben Monomere veranlassen I-Zellen zur Bildung von CCK, was die Magenaktivität dämpft und zu pankreatischer Enzymbildung (Verdauung), Kontraktion der Gallenblase und Relaxation des spincter Oddi führt (Gallenfluss). Außerdem werden orexigene Impulse im Hypothalamus supprimiert (z.B. durch PYY).
dieselben Monomere veranlassen I-Zellen zur Bildung von CCK, was die Magenaktivität dämpft und zu pankreatischer Enzymbildung (Verdauung), Kontraktion der Gallenblase und Relaxation des spincter Oddi führt (Gallenfluss). Außerdem werden orexigene Impulse im Hypothalamus supprimiert (z.B. durch PYY).
 Abbildung: Elektromechanische Kopplung in glatter Muskulatur
Abbildung: Elektromechanische Kopplung in glatter Muskulatur SERCA: Ca-ATPase des sarko- / endoplasmatischen Retikulums
SERCA: Ca-ATPase des sarko- / endoplasmatischen Retikulums  STIC: spontaneous transient inward currents
STIC: spontaneous transient inward currents  STIM1: stromal interaction molecule, Calciumsensor in der Membran des endoplasmatischen Retikulums
STIM1: stromal interaction molecule, Calciumsensor in der Membran des endoplasmatischen Retikulums  STOC: spontaneous transient outward currents
STOC: spontaneous transient outward currents
 Abbildung). Dadurch werden die Calciumspeicher wieder aufgefüllt.
Abbildung). Dadurch werden die Calciumspeicher wieder aufgefüllt. Propulsive Peristaltik - von Speiseröhre bis Dickdarm beobachtbar -
transportiert den Inhalt in Richtung oral → aboral.
Propulsive Peristaltik - von Speiseröhre bis Dickdarm beobachtbar -
transportiert den Inhalt in Richtung oral → aboral.  Nicht-propulsive Peristaltik im Dünndarm dient der Durchmischung des Darminhalts
Nicht-propulsive Peristaltik im Dünndarm dient der Durchmischung des Darminhalts Akkommodation
- Erweiterung ohne Druckanstieg (Erschlaffung, Compliancesteigerung)
zur intermediären Speicherung - findet sich im Fundusteil des Magens
sowie im Colon ascendens und im Rektum
Akkommodation
- Erweiterung ohne Druckanstieg (Erschlaffung, Compliancesteigerung)
zur intermediären Speicherung - findet sich im Fundusteil des Magens
sowie im Colon ascendens und im Rektum Pendelbewegungen und Segmentationsbewegungen des Dünn- und Dickdarms
"reiben" den Chymus an der Darmschleimhaut entlang und dienen der
Durchmischung
Pendelbewegungen und Segmentationsbewegungen des Dünn- und Dickdarms
"reiben" den Chymus an der Darmschleimhaut entlang und dienen der
Durchmischung Tonische Dauerkontraktion der Schließmuskel (Cardia, Pylurus,
Iliocoecalsphincter) stellen funktionelle Darmabschnitte mit
spezialisierten Funktionen her
Tonische Dauerkontraktion der Schließmuskel (Cardia, Pylurus,
Iliocoecalsphincter) stellen funktionelle Darmabschnitte mit
spezialisierten Funktionen her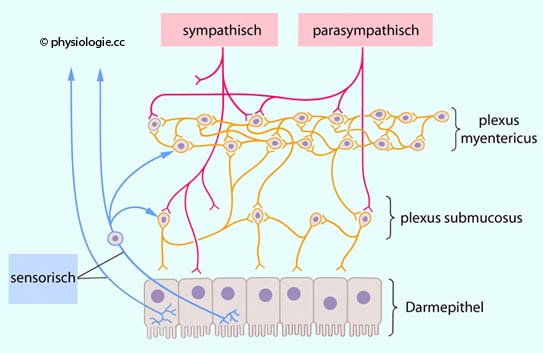
 Abbildung: Nervenverschaltungen in der Darmwand
Abbildung: Nervenverschaltungen in der Darmwand Die
Darmwand enthält mehr als 100 Millionen Neuronen, was ungefähr der Zahl
an Nervenzellen im Rückenmark entspricht. Angesichts dieser Zahl sowie
der Komplexität und weitgehenden Autonomie der involvierten Funktionen
ist es gerechtfertigt, von einem eigenen enterischen Nervensystem zu
sprechen. Die meisten dieser Neuronen sind in einem der beiden
Nervengeflechte des Darms (Darmnervensystem, enterisches Nervensystem (ENS), intramurales bzw. Eingeweidenervensystem) untergebracht: Im plexus myentericus (Auerbach-Plexus) und im plexus submucosus (Meissner-Plexus).
Die
Darmwand enthält mehr als 100 Millionen Neuronen, was ungefähr der Zahl
an Nervenzellen im Rückenmark entspricht. Angesichts dieser Zahl sowie
der Komplexität und weitgehenden Autonomie der involvierten Funktionen
ist es gerechtfertigt, von einem eigenen enterischen Nervensystem zu
sprechen. Die meisten dieser Neuronen sind in einem der beiden
Nervengeflechte des Darms (Darmnervensystem, enterisches Nervensystem (ENS), intramurales bzw. Eingeweidenervensystem) untergebracht: Im plexus myentericus (Auerbach-Plexus) und im plexus submucosus (Meissner-Plexus).  Abbildung unten). Afferenzen
leiten Information über Aktivität und Dehnungsgrad von Darmabschnitten
sowie die Zusammensetzung des Inhalts (pH-Wert, Osmolalität,
Nährstoffgehalt); Interneurone aktivieren Motorik und Sekretion; Effektorzellen
können glatte Muskelzellen - sowohl der Darmwand als auch von
Blutgefäßen -, endokrine (Hormonproduktion) oder Epithelzellen sein
(Resorption, Sekretion).
Abbildung unten). Afferenzen
leiten Information über Aktivität und Dehnungsgrad von Darmabschnitten
sowie die Zusammensetzung des Inhalts (pH-Wert, Osmolalität,
Nährstoffgehalt); Interneurone aktivieren Motorik und Sekretion; Effektorzellen
können glatte Muskelzellen - sowohl der Darmwand als auch von
Blutgefäßen -, endokrine (Hormonproduktion) oder Epithelzellen sein
(Resorption, Sekretion).
 Abbildung: Hierarchische Gliederung der vegetativ-nervösen Steuerung des gastrointestinalen Systems
Abbildung: Hierarchische Gliederung der vegetativ-nervösen Steuerung des gastrointestinalen Systems
 Darmnervensystem (1 in der
Darmnervensystem (1 in der  Abbildung)
Abbildung)  Autonome Ganglien
(2; eine analoge Steuerungsebene ist schon bei Würmern ausgebildet. Das
ggl. cervicale superius enthält ~106 Nervenzellen)
Autonome Ganglien
(2; eine analoge Steuerungsebene ist schon bei Würmern ausgebildet. Das
ggl. cervicale superius enthält ~106 Nervenzellen) Rückenmark (3) - diese Stufe findet sich allgemein bei
Chordaten (Rückensaitentieren)
Rückenmark (3) - diese Stufe findet sich allgemein bei
Chordaten (Rückensaitentieren) Hirnstamm (4 - "Reptiliengehirn")
Hirnstamm (4 - "Reptiliengehirn") Höhere
Zentren im Gehirn, insbesondere Hypothalamus (5).
Höhere
Zentren im Gehirn, insbesondere Hypothalamus (5).  Motorik der glatten Muskulatur,
Motorik der glatten Muskulatur, sekretorische und resorptive Aktivitäten der Mucosa,
sekretorische und resorptive Aktivitäten der Mucosa,
 Durchblutung und
Durchblutung und  Neuroimmunfunktionen.
Neuroimmunfunktionen.
 Abbildung: Darmwand und Darmnerven
Abbildung: Darmwand und Darmnerven Abbildung).
Abbildung). 
 Cholinerg wirken
Cholinerg wirken präganglionäre Neurone sowie
präganglionäre Neurone sowie intrinsisch primär afferente Neurone (IPAN), diese bilden u.a. den
afferenten Schenkel lokaler Reflexe für die Transportmotorik und können durch
Serotonin oder den Darminhalt stimuliert werden
intrinsisch primär afferente Neurone (IPAN), diese bilden u.a. den
afferenten Schenkel lokaler Reflexe für die Transportmotorik und können durch
Serotonin oder den Darminhalt stimuliert werden Adrenerg (postganglionär sympathisch) - α- und ß-Rezeptoren haben unterschiedliche Wirkungen.
Adrenerg (postganglionär sympathisch) - α- und ß-Rezeptoren haben unterschiedliche Wirkungen. Dopaminerg.
Ein beträchtlicher Anteil des im Blut zirkulierenden Dopamins (dessen
Funktion nicht ganz klar ist) stammt aus den Mesenterien des Darms.
Möglicherweise besteht ein Zusammenhang mit einer Detoxifizierung mit
der Nahrung aufgenommenen Dopamins (der Dopaminspiegel steigt nach
einer Mahlzeit stark an, es wird im Darm sulfatiert und in dieser Form
mit dem Harn ausgeschieden).
Dopaminerg.
Ein beträchtlicher Anteil des im Blut zirkulierenden Dopamins (dessen
Funktion nicht ganz klar ist) stammt aus den Mesenterien des Darms.
Möglicherweise besteht ein Zusammenhang mit einer Detoxifizierung mit
der Nahrung aufgenommenen Dopamins (der Dopaminspiegel steigt nach
einer Mahlzeit stark an, es wird im Darm sulfatiert und in dieser Form
mit dem Harn ausgeschieden). GABAerg (inhibitoprisch)
GABAerg (inhibitoprisch) Serotoninerg (5-HT)
- der Großteil (~90%) des im Körper erzeugten Serotonins befindet sich
im Darm, vorwiegend in enterochromaffinen Zellen, zu einem kleinen Teil
in Neuronen des Darmnervensystems.
Serotoninerg (5-HT)
- der Großteil (~90%) des im Körper erzeugten Serotonins befindet sich
im Darm, vorwiegend in enterochromaffinen Zellen, zu einem kleinen Teil
in Neuronen des Darmnervensystems.  Im Darmepithel eingelagerte, als enterochromaffine Zellen
Im Darmepithel eingelagerte, als enterochromaffine Zellen  bezeichnete neuroendokrine Zellen (
bezeichnete neuroendokrine Zellen ( Abbildung unten) sezernieren Hormone und Neurotransmitter und sind hier die Hauptproduzenten von Serotonin, das sie vesikulär speichern und auf Dehnungsreize sowie die Anwesenheit
bestimmter (insbesondere irritierender) Darminhaltsstoffe freisetzen (sowohl luminal als auch
basolateral). Sie erzeugen das im Kreislauf zirkulierende (im Blut nachweisbare) Serotonin.
Abbildung unten) sezernieren Hormone und Neurotransmitter und sind hier die Hauptproduzenten von Serotonin, das sie vesikulär speichern und auf Dehnungsreize sowie die Anwesenheit
bestimmter (insbesondere irritierender) Darminhaltsstoffe freisetzen (sowohl luminal als auch
basolateral). Sie erzeugen das im Kreislauf zirkulierende (im Blut nachweisbare) Serotonin.  Purinerg (ATP)
Purinerg (ATP) Nitriderg (NO)
Nitriderg (NO) Peptiderg - z.B. nutzt das Darmnervensystem
Peptiderg - z.B. nutzt das Darmnervensystem Enkephaline (ENK) / Dynorphine finden sich sowohl
in in der Mucosa als auch in der glatten Muskulatur des
gastrointestinalen Trakts. Sie verlangsamen die Darmpassage wahrscheinlich durch Beteiligung an peristaltischen Abläufen und verringern auch die Sekretion.
Enkephaline (ENK) / Dynorphine finden sich sowohl
in in der Mucosa als auch in der glatten Muskulatur des
gastrointestinalen Trakts. Sie verlangsamen die Darmpassage wahrscheinlich durch Beteiligung an peristaltischen Abläufen und verringern auch die Sekretion.  Das erklärt die Wirksamkeit von Opiaten zur Durchfallsbehandlung.
Das erklärt die Wirksamkeit von Opiaten zur Durchfallsbehandlung. Motilin und Somatostatin (SOM) sind weitere Regulatoren der Motilität sowie der Resorption von Flüssigkeit.
Motilin und Somatostatin (SOM) sind weitere Regulatoren der Motilität sowie der Resorption von Flüssigkeit.
 Abbildung: Darmnervensystem und Transmitter
Abbildung: Darmnervensystem und Transmitter
 Abbildung), die u.a. durch mechanische Dehnung der Darmwand (durch einen umfassten Chymus-Bolus) angeregt werden. Die zahlreichen afferenten Fasern können durch
Serotonin oder den Darminhalt stimuliert werden. Sensorische Afferenzen
projizieren zum ZNS (EPAN: Extrinsich-primär afferente Neuronen; im N. vagus sind 80% der Fasern afferent).
Abbildung), die u.a. durch mechanische Dehnung der Darmwand (durch einen umfassten Chymus-Bolus) angeregt werden. Die zahlreichen afferenten Fasern können durch
Serotonin oder den Darminhalt stimuliert werden. Sensorische Afferenzen
projizieren zum ZNS (EPAN: Extrinsich-primär afferente Neuronen; im N. vagus sind 80% der Fasern afferent). Neuropeptid Y,
Neuropeptid Y,
 Dynorphin,
Dynorphin, Galanin oder
Galanin oder VIP
VIP 
 Abbildung: Steuerung der Sekretion im Dünndarm
Abbildung: Steuerung der Sekretion im Dünndarm
 ) liegt zwischen Mucosa (Darmschleimhaut) und
Muskelschicht, er wird von parasympathischen Fasern kontaktiert und
steuert die Funktion der Mucosa (Sekretion, Absorption; Epithelmotorik;
Immunvorgänge).
) liegt zwischen Mucosa (Darmschleimhaut) und
Muskelschicht, er wird von parasympathischen Fasern kontaktiert und
steuert die Funktion der Mucosa (Sekretion, Absorption; Epithelmotorik;
Immunvorgänge).  Parasympathisch-präganglionäre Fasern (cholinerg: ACh) innervieren sowohl erregende als auch hemmende Interneurone des Darmnervensystems.
Parasympathisch-präganglionäre Fasern (cholinerg: ACh) innervieren sowohl erregende als auch hemmende Interneurone des Darmnervensystems.  Sympathisch-postganglionäre (adrenerg: NA/NPY) wirken gefäßverengend, andere (NA/SOM)
hemmen DYN/GAL/VIP-Neurone und hemmen so indirekt die Sekretion; wieder
andere hemmen erregende Interneurone im plexus myentericus und dämpfen
so die motorische Aktivität. Auch gibt es Neurone, die vom plexus
myentericus auf sympathische Ganglien projizieren.
Sympathisch-postganglionäre (adrenerg: NA/NPY) wirken gefäßverengend, andere (NA/SOM)
hemmen DYN/GAL/VIP-Neurone und hemmen so indirekt die Sekretion; wieder
andere hemmen erregende Interneurone im plexus myentericus und dämpfen
so die motorische Aktivität. Auch gibt es Neurone, die vom plexus
myentericus auf sympathische Ganglien projizieren. reduziert eine erhöhte Kreislaufanforderung (körperliche
Arbeit, orthostatischer Stress, Wärmebelastung) Durchblutung und
Aktivität im Darm (hoher Sympathikustonus);
reduziert eine erhöhte Kreislaufanforderung (körperliche
Arbeit, orthostatischer Stress, Wärmebelastung) Durchblutung und
Aktivität im Darm (hoher Sympathikustonus); umgekehrt wird die
Verdauungstätigkeit in einer "trophotropen" Situation gefördert (hoher
Vagustonus).
umgekehrt wird die
Verdauungstätigkeit in einer "trophotropen" Situation gefördert (hoher
Vagustonus). auf sympathische Ganglien zurückprojizieren.
auf sympathische Ganglien zurückprojizieren. )
in der muscularis-Schichte des Oesophagus, Magens und Darms (zwischen
Longitudinal- und Zirkulärschichte gelegen) wird sowohl von
sympathischen als auch parasympathischen Fasern angesteuert und dient
der Steuerung der Motorik. Seine Neuronen
werden durch präganglionär parasympathische Fasern angeregt, durch
postganglionär sympathische (teils indirekt,
d.h. durch Interaktion mit parasympathischen Fasern) über
α2-Rezeptoren gehemmt. Kontraktion von Gefäßen und Sphincteren ist α1-Rezeptor-vermittelt.
)
in der muscularis-Schichte des Oesophagus, Magens und Darms (zwischen
Longitudinal- und Zirkulärschichte gelegen) wird sowohl von
sympathischen als auch parasympathischen Fasern angesteuert und dient
der Steuerung der Motorik. Seine Neuronen
werden durch präganglionär parasympathische Fasern angeregt, durch
postganglionär sympathische (teils indirekt,
d.h. durch Interaktion mit parasympathischen Fasern) über
α2-Rezeptoren gehemmt. Kontraktion von Gefäßen und Sphincteren ist α1-Rezeptor-vermittelt. Segmentationsbewegungen (segmental contractions) (
Segmentationsbewegungen (segmental contractions) ( Abbildung): Dünn-
und Dickdarm vollführen vor allem in der digestiven Phase unkoordinierte, lokal begrenzte, gürtelartige Kontraktionen,
die den Darm vorübergehend in "Segmente" gliedern (daher der Name).
Sie dauern jeweils lediglich 5 bis 30 Sekunden und treten an wechselnden Stellen des Darmrohres auf.
Abbildung): Dünn-
und Dickdarm vollführen vor allem in der digestiven Phase unkoordinierte, lokal begrenzte, gürtelartige Kontraktionen,
die den Darm vorübergehend in "Segmente" gliedern (daher der Name).
Sie dauern jeweils lediglich 5 bis 30 Sekunden und treten an wechselnden Stellen des Darmrohres auf.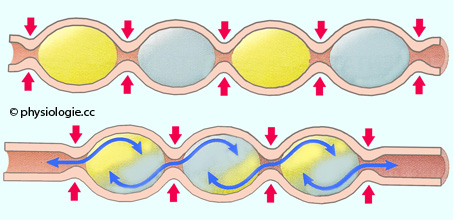
 Abbildung: Segmentationsmotorik
Abbildung: Segmentationsmotorik
 Peristaltik
Peristaltik  (peristalsis) (
(peristalsis) ( Abbildung)
tritt in Ösophagus, Magen und Dünndarm auf. Sie kommt durch ein
Kontraktionsmuster der Ring- und Längsmuskulatur der tunica muscularis
zustande, das sich durch die resultierende Bewegung des Darminhalts
automatisch mit diesem weiterbewegt. So wird der Chymus schrittweise
durch den Gastrointestinaltrakt
befördert - die Peristaltik dient der Fortbewegung des Darminhalts. Sie
entsteht durch lokal synchronisierte Aktivität der
glatten Muskulatur, jeweils ausgehend von einer durch lokale Dehnung (Darminhalt) angeregte Schrittmacherzone. Im betreffenden Segment kommt es im jeweils oralen Abschnitt (upstream)
- der seinen Inhalt weiterbefördert - zu einer Kontraktion der Ring-
und einer Erschlaffung der Längsmuskulatur, die Compliance nimmt ab; im
aboralen (empfangenden) Abschnitt (downstream) ist es umgekehrt (Kontraktion der Längs- und Erschlaffung der Ringsmuskulatur, die Compliance steigt).
Abbildung)
tritt in Ösophagus, Magen und Dünndarm auf. Sie kommt durch ein
Kontraktionsmuster der Ring- und Längsmuskulatur der tunica muscularis
zustande, das sich durch die resultierende Bewegung des Darminhalts
automatisch mit diesem weiterbewegt. So wird der Chymus schrittweise
durch den Gastrointestinaltrakt
befördert - die Peristaltik dient der Fortbewegung des Darminhalts. Sie
entsteht durch lokal synchronisierte Aktivität der
glatten Muskulatur, jeweils ausgehend von einer durch lokale Dehnung (Darminhalt) angeregte Schrittmacherzone. Im betreffenden Segment kommt es im jeweils oralen Abschnitt (upstream)
- der seinen Inhalt weiterbefördert - zu einer Kontraktion der Ring-
und einer Erschlaffung der Längsmuskulatur, die Compliance nimmt ab; im
aboralen (empfangenden) Abschnitt (downstream) ist es umgekehrt (Kontraktion der Längs- und Erschlaffung der Ringsmuskulatur, die Compliance steigt). 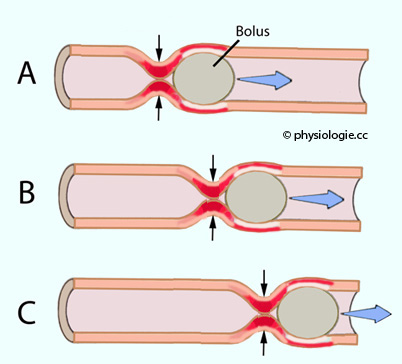
 Abbildung: Propulsive Peristaltik
Abbildung: Propulsive Peristaltik

 Ausgehend von
der Dehnungszone erregen von hier aus oralwärts
projizierende plexus-myentericus-Neurone (die als Kotransmitter
Enkephaline oder Substanz P verwenden)
die Ringmuskulatur in einer einige Millimeter weit reichenden
Kontraktionszone (aszendierender exzitatorischer Reflex).
Ausgehend von
der Dehnungszone erregen von hier aus oralwärts
projizierende plexus-myentericus-Neurone (die als Kotransmitter
Enkephaline oder Substanz P verwenden)
die Ringmuskulatur in einer einige Millimeter weit reichenden
Kontraktionszone (aszendierender exzitatorischer Reflex).  Gleichzeitig
hemmen Neurone mit Stickstoffmonoxid (NO) und vasoaktivem
intestinalen Peptid (VIP) als Transmitter aboralwärts gelegene Zellen
der Ringmuskulatur (deszendierender inhibitorischer Reflex:
Dilatationszone). Eine Erschlaffungswelle geht also einer Kontraktionswelle voraus. Zusammen ergibt sich ein Muster, das als
Peristaltik bezeichnet wird und den Darminhalt von oral nach aboral
weiterbefördert. Das Reflexmuster wandert analwärts, angeregt im jeweils gedehnten Darmsegment.
Gleichzeitig
hemmen Neurone mit Stickstoffmonoxid (NO) und vasoaktivem
intestinalen Peptid (VIP) als Transmitter aboralwärts gelegene Zellen
der Ringmuskulatur (deszendierender inhibitorischer Reflex:
Dilatationszone). Eine Erschlaffungswelle geht also einer Kontraktionswelle voraus. Zusammen ergibt sich ein Muster, das als
Peristaltik bezeichnet wird und den Darminhalt von oral nach aboral
weiterbefördert. Das Reflexmuster wandert analwärts, angeregt im jeweils gedehnten Darmsegment. Massenbewegungen
(mass movements) sind kraftvolle Kontraktionen des Colon, kombiniert mit einer
Relaxation der analwärts von der Kontraktionszone gelegenen Muskulatur
und damit einem Verschwinden der Haustrierung (
Massenbewegungen
(mass movements) sind kraftvolle Kontraktionen des Colon, kombiniert mit einer
Relaxation der analwärts von der Kontraktionszone gelegenen Muskulatur
und damit einem Verschwinden der Haustrierung ( Abbildung).
Abbildung).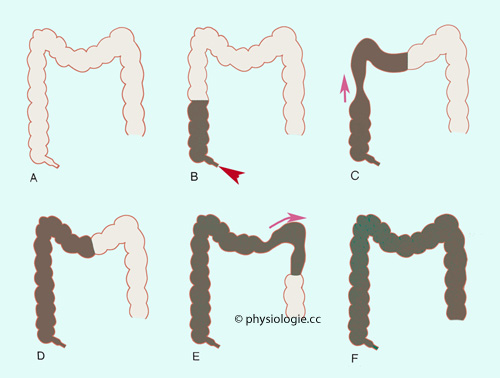
 Abbildung: Zwei Massenbewegungen im Dickdarm (Röntgenbefund)
Abbildung: Zwei Massenbewegungen im Dickdarm (Röntgenbefund)
 Zellen (ICC: Interstitial Cajal cell)
und Darmnervenzellen. Isolierte ICCs zeigen Membraneigenschaften, die
sie als Schrittmacherzellen qualifizieren; in Abwesenheit von ICCs in
der Darmwand bleiben langsame Kontraktionswellen aus. Die Frequenz der
Kontraktionswellen steigt mit metabolischer Aktivität und Temperatur,
durch neurale oder humorale Faktoren sind sie hingegen kaum
beeinflussbar (im Gegensatz zu Spike-Entladungen, die Ca++-abhängig sind und stark auf Hormone und neuronale Impulse ansprechen).
Zellen (ICC: Interstitial Cajal cell)
und Darmnervenzellen. Isolierte ICCs zeigen Membraneigenschaften, die
sie als Schrittmacherzellen qualifizieren; in Abwesenheit von ICCs in
der Darmwand bleiben langsame Kontraktionswellen aus. Die Frequenz der
Kontraktionswellen steigt mit metabolischer Aktivität und Temperatur,
durch neurale oder humorale Faktoren sind sie hingegen kaum
beeinflussbar (im Gegensatz zu Spike-Entladungen, die Ca++-abhängig sind und stark auf Hormone und neuronale Impulse ansprechen).
 Abbildung: System Cajal-, Nerven-, glatte Muskelzellen im Darm
Abbildung: System Cajal-, Nerven-, glatte Muskelzellen im Darm β-NAD, β-Nikotinamid-Adenin-Dinucleotid
β-NAD, β-Nikotinamid-Adenin-Dinucleotid  ER, endoplasmatisches (sarkoplasmatisches) Retikulum
ER, endoplasmatisches (sarkoplasmatisches) Retikulum  P2YR, Purinrezeptoren
P2YR, Purinrezeptoren  SK3, calciumaktivierte Kaliumkanäle (small conductance calcium-activated potassium channel 3)
SK3, calciumaktivierte Kaliumkanäle (small conductance calcium-activated potassium channel 3)
 Abbildung) in Magen, Dünn- und Dickdarm. Von ihnen geht ein basaler Organrhythmus (basal electrical rhythm, BER)
aus: Rhythmisch oszillierende Potentialschwankungen der glatten
Muskelzellen entstehen durch das Zusammenspiel von Cajal- und
enterischen Nervenzellen, und die resultierenden Depolarisationsphasen
triggern unter -45 mV Membranpotential Entladungen ("spikes"), was Kontraktionen
auslöst.
Abbildung) in Magen, Dünn- und Dickdarm. Von ihnen geht ein basaler Organrhythmus (basal electrical rhythm, BER)
aus: Rhythmisch oszillierende Potentialschwankungen der glatten
Muskelzellen entstehen durch das Zusammenspiel von Cajal- und
enterischen Nervenzellen, und die resultierenden Depolarisationsphasen
triggern unter -45 mV Membranpotential Entladungen ("spikes"), was Kontraktionen
auslöst.  Abbildung), bestehend aus glatten Muskelzellen (smooth muscle), interstitiellen (Cajal-) Zellen und intramuskulären PDGFRα+ (platelet-derived growth factor-receptor α-positive) Zellen.
Abbildung), bestehend aus glatten Muskelzellen (smooth muscle), interstitiellen (Cajal-) Zellen und intramuskulären PDGFRα+ (platelet-derived growth factor-receptor α-positive) Zellen. | Gap
junctions verbinden die glatten Muskelzellen der Darmwand zu einem
funktionellen Synzytium, das Änderungen des Membranpotentials
transzellulär überträgt |
 Transport,
Transport, 
 Aufbereitung und Resorption von Flüssigkeit,
Nahrung, Elektrolyten, Vitaminen, Spurenelementen und anderen
Wirkstoffen,
Aufbereitung und Resorption von Flüssigkeit,
Nahrung, Elektrolyten, Vitaminen, Spurenelementen und anderen
Wirkstoffen, 
 Ausscheidung.
Ausscheidung. 
 Abbildung: Migrierende Motorkomplexe (MMC's)
Abbildung: Migrierende Motorkomplexe (MMC's)
 Abbildung).
Abbildung). Phase 1: Ruhephase ohne motorische oder sekretorische Tätigkeit
Phase 1: Ruhephase ohne motorische oder sekretorische Tätigkeit Phase 2: Unkoordinierte Motorik niedriger Intensität
Phase 2: Unkoordinierte Motorik niedriger Intensität Phase 3: Starke Kontraktionen, Luft im Magen wird zusammengepresst (erzeugt "Magenknurren")
Phase 3: Starke Kontraktionen, Luft im Magen wird zusammengepresst (erzeugt "Magenknurren") ),
können die Magenentleerung und damit Resorptionsvorgänge verzögern.
Umgekehrt können Medikamente die Darmmotorik beeinflussen und damit die
Aufnahme anderer Pharmaka beschleunigen oder bremsen.
),
können die Magenentleerung und damit Resorptionsvorgänge verzögern.
Umgekehrt können Medikamente die Darmmotorik beeinflussen und damit die
Aufnahme anderer Pharmaka beschleunigen oder bremsen.  ),
der einen Transportstop im Darm bedingt. Dieser kann mechanisch (etwa
durch Einklemmung) oder funktionell durch Darmlähmung (Paralyse)
bedingt sein.
),
der einen Transportstop im Darm bedingt. Dieser kann mechanisch (etwa
durch Einklemmung) oder funktionell durch Darmlähmung (Paralyse)
bedingt sein. massiven
Sympathikuseinfluss ("reflektorischer"
Ileus, z.B. bei operativen Eingriffen im Bauchraum)
massiven
Sympathikuseinfluss ("reflektorischer"
Ileus, z.B. bei operativen Eingriffen im Bauchraum) metabolische
Entgleisungen - Sepsis, diabetisches Koma, Urämie, Hypokaliämie,
Elektrolytstoffwechselstörungen ("metabolischer" Ileus)
metabolische
Entgleisungen - Sepsis, diabetisches Koma, Urämie, Hypokaliämie,
Elektrolytstoffwechselstörungen ("metabolischer" Ileus)  Gifte ("toxischer" Ileus, etwa nach diffuser Peritonitis)
Gifte ("toxischer" Ileus, etwa nach diffuser Peritonitis) Über Therapieoptionen bei Ileuserkrankung, die von antiinflammatorischen Reflexmechanismen Gebrauch machen s. dort
Über Therapieoptionen bei Ileuserkrankung, die von antiinflammatorischen Reflexmechanismen Gebrauch machen s. dort

 Die zephale
Phase der Verdauung wird durch Sinnesreize (auch die Vorstellung davon) ausgelöst und
führt über limbisches System, Hirnstamm und Vagusnerv zu Sekretion und
Hormonfreisetzung (Magensäureproduktion auf ~40% des Maximums,
Pepsinogen, Gastrin). Die gastrische
Phase über vago-vagale Reflexe ergibt die volle Aktivierung des Magens,
G-Zellen reagieren auf Peptide und andere Saftlocker im Mageninhalt.
Sinkt der pH-Wert unter 3, wird die Aktivität gehemmt (Selbstschutz).
Die intestinale Phase wird vom oberen Dünndarm getriggert: pH-empfindliche S-Zellen produzieren Sekretin, bicarbonatreiches Sekret entsteht. Emulgiertes Fett, Glucose, Aminosäuren regen K-Zellen (GIP hemmt die Magentätigkeit) und
I-Zellen an (CCK stimuliert die Sekretion enzymreichen Speichels und die
Gallenblasenmotorik, entspannt den sphincter Oddi und hemmt die
Magenaktivität) Die zephale
Phase der Verdauung wird durch Sinnesreize (auch die Vorstellung davon) ausgelöst und
führt über limbisches System, Hirnstamm und Vagusnerv zu Sekretion und
Hormonfreisetzung (Magensäureproduktion auf ~40% des Maximums,
Pepsinogen, Gastrin). Die gastrische
Phase über vago-vagale Reflexe ergibt die volle Aktivierung des Magens,
G-Zellen reagieren auf Peptide und andere Saftlocker im Mageninhalt.
Sinkt der pH-Wert unter 3, wird die Aktivität gehemmt (Selbstschutz).
Die intestinale Phase wird vom oberen Dünndarm getriggert: pH-empfindliche S-Zellen produzieren Sekretin, bicarbonatreiches Sekret entsteht. Emulgiertes Fett, Glucose, Aminosäuren regen K-Zellen (GIP hemmt die Magentätigkeit) und
I-Zellen an (CCK stimuliert die Sekretion enzymreichen Speichels und die
Gallenblasenmotorik, entspannt den sphincter Oddi und hemmt die
Magenaktivität) Aktionspotentiale an glatten Muskelzellen erhöhen [Ca++]
im Zytoplasma (Calcium-spark), das aktiviert elektromechanische
Kopplung und Tonuserhöhung. Der Ca-Speicher im sarkoplasmatischen
Retikulum füllt sich sowohl aus dem Extrazellulär- (CRAC) als auch
dem Intrazellulärraum (SERCA) Aktionspotentiale an glatten Muskelzellen erhöhen [Ca++]
im Zytoplasma (Calcium-spark), das aktiviert elektromechanische
Kopplung und Tonuserhöhung. Der Ca-Speicher im sarkoplasmatischen
Retikulum füllt sich sowohl aus dem Extrazellulär- (CRAC) als auch
dem Intrazellulärraum (SERCA) Das Darmnervensystem generiert propulsive Peristaltik (oral → aboral), Pendel- und Segmentationsbewegungen in Dünn- und Dickdarm (Durchmischung: Magen 3/min, Duodenum ~12/min, Jejunum ~10/min, Ileum ~8/min, Colon ~3/min), Akkommodation (vorübergehende Erschlaffung: Magenfundus, Colon ascendens, Rectum), tonische Dauerkontraktion der Schließmuskel (Cardia, Pylurus, Iliocoecalsphincter). Lokale Reflexe
können über prävertebrale Ganglien ziehen und bewirken z.B. bei Dehnung
eines proximalen Darmabschnitts Relaxation eines weiter distal
gelegenen (intestino-intestinale Reflexe). Einige
Projektionen erfolgen auf Thalamus und Insel (viszerosensorisch). Sie leiten
viszerale Reflexe ein und führen zu bewussten Empfindungen
(Übelkeit, Stuhldrang, Schmerz) Das Darmnervensystem generiert propulsive Peristaltik (oral → aboral), Pendel- und Segmentationsbewegungen in Dünn- und Dickdarm (Durchmischung: Magen 3/min, Duodenum ~12/min, Jejunum ~10/min, Ileum ~8/min, Colon ~3/min), Akkommodation (vorübergehende Erschlaffung: Magenfundus, Colon ascendens, Rectum), tonische Dauerkontraktion der Schließmuskel (Cardia, Pylurus, Iliocoecalsphincter). Lokale Reflexe
können über prävertebrale Ganglien ziehen und bewirken z.B. bei Dehnung
eines proximalen Darmabschnitts Relaxation eines weiter distal
gelegenen (intestino-intestinale Reflexe). Einige
Projektionen erfolgen auf Thalamus und Insel (viszerosensorisch). Sie leiten
viszerale Reflexe ein und führen zu bewussten Empfindungen
(Übelkeit, Stuhldrang, Schmerz) Je nach Transmitter und Rezeptorbestückung fördern oder hemmen Neuronen des enterischen Nervensystems (mehrere 106, vor allem im plexus
myentericus und submucosus) Motorik, Sekretion, Perfusion und Neuroimmunfunktionen - auch in Abwesenheit sympathischer / parasympathischer Steuerung. Die Neuronen sind cholinerg (Kotransmitter: Substanz P, Enkephalin), adrenerg (NPY), dopaminerg, GABAerg, serotoninerg (enterochromaffine Zellen), purinerg, peptiderg, nitriderg. Extrinsisch-primär
afferente Neuronen (EPAN) senden sensorische Impulse zum ZNS,
intrinsich-primär afferente Neuronen (IPAN) verteilen Information
innerhalb des Darmnervensystems. Aufgeschaltet sind Ganglien, Rückenmark, Hirnstamm,
hypothalamisch-hypophysäres System (Hunger / Sättigung, Osmoregulation
/ Durst etc). Der Parasympathikus (Vagus, Pelvicusnerven) wirkt
überwiegend anregend, der Sympathikus hemmend auf den Darm. Afferente
Fasern (N. vagus ~75%) melden den Zustand der Peripherie und lösen
regulative Antworten (z.B. vago-vagale Reflexe) aus Je nach Transmitter und Rezeptorbestückung fördern oder hemmen Neuronen des enterischen Nervensystems (mehrere 106, vor allem im plexus
myentericus und submucosus) Motorik, Sekretion, Perfusion und Neuroimmunfunktionen - auch in Abwesenheit sympathischer / parasympathischer Steuerung. Die Neuronen sind cholinerg (Kotransmitter: Substanz P, Enkephalin), adrenerg (NPY), dopaminerg, GABAerg, serotoninerg (enterochromaffine Zellen), purinerg, peptiderg, nitriderg. Extrinsisch-primär
afferente Neuronen (EPAN) senden sensorische Impulse zum ZNS,
intrinsich-primär afferente Neuronen (IPAN) verteilen Information
innerhalb des Darmnervensystems. Aufgeschaltet sind Ganglien, Rückenmark, Hirnstamm,
hypothalamisch-hypophysäres System (Hunger / Sättigung, Osmoregulation
/ Durst etc). Der Parasympathikus (Vagus, Pelvicusnerven) wirkt
überwiegend anregend, der Sympathikus hemmend auf den Darm. Afferente
Fasern (N. vagus ~75%) melden den Zustand der Peripherie und lösen
regulative Antworten (z.B. vago-vagale Reflexe) aus  In den Plexus
submucosus ziehende cholinerge Fasern (Kotransmitter: Neuropeptid Y,
Dynorphin, Galanin, VIP) regen die Sekretion an (Mucine, Bicarbonat,
Enteropeptidase); somatostatinerge und noradrenerge Neuronen hemmen die
Sekretion. Kollateralen zu Blutgefäßen bewirken verstärkte Perfusion und unterstützen die Sekretion. Histamin wirkt sekretionsfördernd In den Plexus
submucosus ziehende cholinerge Fasern (Kotransmitter: Neuropeptid Y,
Dynorphin, Galanin, VIP) regen die Sekretion an (Mucine, Bicarbonat,
Enteropeptidase); somatostatinerge und noradrenerge Neuronen hemmen die
Sekretion. Kollateralen zu Blutgefäßen bewirken verstärkte Perfusion und unterstützen die Sekretion. Histamin wirkt sekretionsfördernd Peristaltik
beginnt mit der Dehnung eines Dünndarmabschnittes, von dem aus oralwärts
projizierende Neurone die Ringmuskulatur anregen
(aszendierender exzitatorischer Reflex: Kontraktionsring), andere (NO,
VIP) aboralwärts erschlaffen (deszendierender inhibitorischer Reflex:
Dilatationszone). Dieses Muster
bewegt sich mit der Verschiebung des Dehnungsreizes über das Darmrohr, der peristaltische Komplex gleitet nach distal. In der interdigestiven Phase hat die Peristaltik eine "Ausputzerfunktion", die auch das Bakterienwachstum kontrolliert. Bei leerem Magen-Darm-Trakt wandern migrierende Motorkomplexe (MMC, Dauer: 1 min) mit ~5 cm/min vom Magen colonwärts, das bringt unverdauliche Reste zum Enddarm. In dieser Reinigungsphase gebildetes Magen-, Gallen- und
Bauchspeicheldrüsensekret spült den
Darm und erschwert retrograden
Aufstieg von Mikroorganismen. MMCs können Magenknurren verursachen, Nahrungsaufnahme unterdrückt MMCs vollständig Peristaltik
beginnt mit der Dehnung eines Dünndarmabschnittes, von dem aus oralwärts
projizierende Neurone die Ringmuskulatur anregen
(aszendierender exzitatorischer Reflex: Kontraktionsring), andere (NO,
VIP) aboralwärts erschlaffen (deszendierender inhibitorischer Reflex:
Dilatationszone). Dieses Muster
bewegt sich mit der Verschiebung des Dehnungsreizes über das Darmrohr, der peristaltische Komplex gleitet nach distal. In der interdigestiven Phase hat die Peristaltik eine "Ausputzerfunktion", die auch das Bakterienwachstum kontrolliert. Bei leerem Magen-Darm-Trakt wandern migrierende Motorkomplexe (MMC, Dauer: 1 min) mit ~5 cm/min vom Magen colonwärts, das bringt unverdauliche Reste zum Enddarm. In dieser Reinigungsphase gebildetes Magen-, Gallen- und
Bauchspeicheldrüsensekret spült den
Darm und erschwert retrograden
Aufstieg von Mikroorganismen. MMCs können Magenknurren verursachen, Nahrungsaufnahme unterdrückt MMCs vollständig  Langsame Kontraktionswellen in Magen, Dünn- und Dickdarm entstehen durch ein komplexes Zusammenspiel: Das SIP-Synzytium aus glatten Muskelzellen (smooth muscle),
interstitiellen (Cajal-) Zellen und intramuskulären PDGFRα+
Zellen ist über gap junctions verbunden (Erregungsübertragung). Vom Zusammenspiel dieser Zellen
geht ein - nach Darmabschnitt spezifischer - basaler Organrhythmus aus:
Oszillierende Potentialschwankungen der glatten Muskelzellen triggern
Entladungen, diese lösen Kontraktionen aus. - Massenbewegungen
kombiniert mit distaler Relaxation (Verschwinden der
Haustrierung) transportieren den Dickdarminhalt. Stuhldrang tritt
auf, wenn das Rectum gefüllt und seine mit Dehnungsrezeptoren bestückte Wand unter Spannung gesetzt wird Langsame Kontraktionswellen in Magen, Dünn- und Dickdarm entstehen durch ein komplexes Zusammenspiel: Das SIP-Synzytium aus glatten Muskelzellen (smooth muscle),
interstitiellen (Cajal-) Zellen und intramuskulären PDGFRα+
Zellen ist über gap junctions verbunden (Erregungsübertragung). Vom Zusammenspiel dieser Zellen
geht ein - nach Darmabschnitt spezifischer - basaler Organrhythmus aus:
Oszillierende Potentialschwankungen der glatten Muskelzellen triggern
Entladungen, diese lösen Kontraktionen aus. - Massenbewegungen
kombiniert mit distaler Relaxation (Verschwinden der
Haustrierung) transportieren den Dickdarminhalt. Stuhldrang tritt
auf, wenn das Rectum gefüllt und seine mit Dehnungsrezeptoren bestückte Wand unter Spannung gesetzt wird |
