



 Hormon: ὁρμᾶν = antreiben
Hormon: ὁρμᾶν = antreiben| Zwischen
dem Nerven- und Immunsystem bestehen enge
wechselseitige Beziehungen: Autonome Nervenfasern
geben Neurotransmitter ab, für die Immunzellen in Knochenmark, Thymusdrüse, Milz und Lymphknoten Rezeptoren
haben; andererseits können Zytokine den afferenten Impulsfluss zum
Stammhirn (nucleus tractus solitarii) beeinflussen. -- Noradrenalin senkt die Sekretion von IL-2, -- NK-Zellen senken ihre zytotoxische Funktion, -- Makrophagen stoppen die Sekretion von Zytokinen, -- im Thymus nimmt die Lymphozytenzahl ab. Auch Cofaktoren sympathischer Fasern (VIP, CCK, NPY, Somatostatin) beeinflussen die Tätigkeit von Immunzellen. Parasympathische Fasern hemmen u.a. die Freisetzung von IL-1 unf TNF (cholinerge Wirkung). Immunzellen produzieren Hormone, z.B. CRH, ACTH, TSH, GH und Prolaktin. Dadurch erlangen sie steuernde Wirkung auf Nebenniere, Schilddrüse, Stoffwechsel; umgekehrt beeinflussen endokrine Zellen das Immunsystem. Solche Verknüpfungen erklären auch zum Teil psychosomatische Interaktionen (Placebo-, Nocebowirkung). |
 Bidirektionale Kommunikation
Bidirektionale Kommunikation  Chronischer Stress
Chronischer Stress  Neuronale und humorale Wege
Neuronale und humorale Wege Distress / Eustress
Distress / Eustress
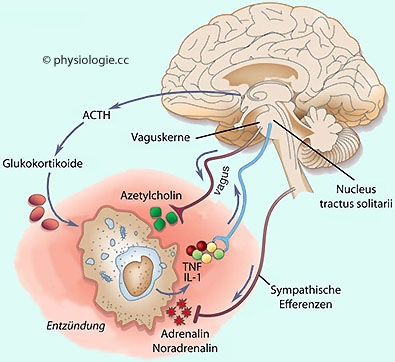
 Abbildung: Autonom-nervöse und humorale Einflüsse auf Entzündungsvorgänge
Abbildung: Autonom-nervöse und humorale Einflüsse auf Entzündungsvorgänge IL-1, Interleukin 1
IL-1, Interleukin 1  TNF, Tumornekrosefaktor
TNF, Tumornekrosefaktor
 So werden Zytokine
So werden Zytokine  auch
von anderen als Immunzellen sezerniert
auch
von anderen als Immunzellen sezerniert
 umgekehrt bilden Immunzellen
Hormone
umgekehrt bilden Immunzellen
Hormone  (z.B. können Lymphozyten CRH, ACTH, TSH, GH und Prolaktin bilden). Die
Regulation über diese HPA-Achse (Hypothalamus - Hypophyse - Nebenniere)
erfolgt verzögert, hält aber länger an als eine autonom-nervöse. Glucocorticoide wirken immunsuppressiv
(z.B. können Lymphozyten CRH, ACTH, TSH, GH und Prolaktin bilden). Die
Regulation über diese HPA-Achse (Hypothalamus - Hypophyse - Nebenniere)
erfolgt verzögert, hält aber länger an als eine autonom-nervöse. Glucocorticoide wirken immunsuppressiv Hirnzellen und Fasern des N. vagus verfügen über Zytokinrezeptoren
Hirnzellen und Fasern des N. vagus verfügen über Zytokinrezeptoren natürliche Killerzellen haben ß-adrenerge und Opioidrezeptoren.
natürliche Killerzellen haben ß-adrenerge und Opioidrezeptoren.  -
-  Abbildung) neuroendokrine Funktionen modifizieren (das äußert
sich z.B. in Schlafstörungen, herabgesetztem Antrieb, Gewichtsverlust -
"Krankheitsverhalten"; Patienten mit Depression zeigen erhöhte
Konzentration proinflammatorischer, und erniedrigte Konzentration
antiinflammatorischer Zytokine im Blut) und im Gehirn Stressmechanismen
aktivieren; ACTH kann die Freisetzung von Cortisol aus Lymphozyten
bewirken.
Abbildung) neuroendokrine Funktionen modifizieren (das äußert
sich z.B. in Schlafstörungen, herabgesetztem Antrieb, Gewichtsverlust -
"Krankheitsverhalten"; Patienten mit Depression zeigen erhöhte
Konzentration proinflammatorischer, und erniedrigte Konzentration
antiinflammatorischer Zytokine im Blut) und im Gehirn Stressmechanismen
aktivieren; ACTH kann die Freisetzung von Cortisol aus Lymphozyten
bewirken. 
 Es ergibt sich ein "Beziehungsdreieck" mit bidirektionaler
Kommunikation:
Es ergibt sich ein "Beziehungsdreieck" mit bidirektionaler
Kommunikation:  Immunzellen wirken über Zytokine auf Gehirn und endokrine Zellen
Immunzellen wirken über Zytokine auf Gehirn und endokrine Zellen Endokrine Zellen beeinflussen über Hormone Gehirn und Immunsystem
Endokrine Zellen beeinflussen über Hormone Gehirn und Immunsystem Nervenzellen bilden Katecholamine und Neuropeptide, auf die Immun- und endokrine Zellen reagieren
Nervenzellen bilden Katecholamine und Neuropeptide, auf die Immun- und endokrine Zellen reagieren
 Abbildung: Ein vagal vermittelter entzündungshemmender Reflexweg
Abbildung: Ein vagal vermittelter entzündungshemmender Reflexweg
 Abbildung).
Abbildung). Patient(inn)en leiden unter Angst und Verunsicherung: Stress und Angst schwächen das Immunsystem. Es
ist problematisch, den Patienten "die Wahrheit zu sagen". Zuversicht
zu schaffen und Vertrauen zu fördern ist eine primäre Pflicht des
medizinischen Personals, das ethische Dilemma (schaden durch
informieren?) ist offensichtlich.
Patient(inn)en leiden unter Angst und Verunsicherung: Stress und Angst schwächen das Immunsystem. Es
ist problematisch, den Patienten "die Wahrheit zu sagen". Zuversicht
zu schaffen und Vertrauen zu fördern ist eine primäre Pflicht des
medizinischen Personals, das ethische Dilemma (schaden durch
informieren?) ist offensichtlich. Als Distress (Dystress)
bezeichnet man eine "negative" Stressform, an die sich die Person nur
unvollständig bzw. schlecht anpassen kann (vor allem psychologische
Faktoren: soziale Umgebung, Familie, Todesfall u.a.) und welche die
Lebensqualität reduziert (das Gegenteil von Eustress,
bei dem eine weitgehende Adaptation an den Stressor gelingt). Distress
erhöht die Inzidenz zu verschiedenen Erkrankungen und führt zu
Depressionen, passivem oder aggressivem Verhalten.
Als Distress (Dystress)
bezeichnet man eine "negative" Stressform, an die sich die Person nur
unvollständig bzw. schlecht anpassen kann (vor allem psychologische
Faktoren: soziale Umgebung, Familie, Todesfall u.a.) und welche die
Lebensqualität reduziert (das Gegenteil von Eustress,
bei dem eine weitgehende Adaptation an den Stressor gelingt). Distress
erhöht die Inzidenz zu verschiedenen Erkrankungen und führt zu
Depressionen, passivem oder aggressivem Verhalten. 
 Abbildung: Interaktion zwischen hypothalamisch- hypophysärem und Immunsystem
Abbildung: Interaktion zwischen hypothalamisch- hypophysärem und Immunsystem
 Chronische Depression steigert die Apoptoserate in, und senkt das Volumen von Hippocampus, Mandelkernen und Frontallappen. Die Mikroglia
wird aktiviert und setzt entzündungsfördernde Zytokine frei, Astrozyten
und Nervenzellen gehen zugrunde. Die Bildung neurotropher Faktoren - wie BDNF - nimmt ab, Reparaturmechanismen sind weniger wirksam.
Chronische Depression steigert die Apoptoserate in, und senkt das Volumen von Hippocampus, Mandelkernen und Frontallappen. Die Mikroglia
wird aktiviert und setzt entzündungsfördernde Zytokine frei, Astrozyten
und Nervenzellen gehen zugrunde. Die Bildung neurotropher Faktoren - wie BDNF - nimmt ab, Reparaturmechanismen sind weniger wirksam. Lebenslange Neigung zu schwerer Depression erhöht das Risiko, an Morbus Alzheimer zu erkranken.
Lebenslange Neigung zu schwerer Depression erhöht das Risiko, an Morbus Alzheimer zu erkranken.  Im Gehirn von Patienten, die an schwerer Depression und/oder
Alzheimer-Krankheit leiden, finden sich Neurotoxine (Chinolinsäure,
3-OH-Kynurenin) aus dem Tryptophanstoffwechsel, welche wahrscheinlich
die Entwicklung der neurodegenerativen Erscheinungen verursachen.
Im Gehirn von Patienten, die an schwerer Depression und/oder
Alzheimer-Krankheit leiden, finden sich Neurotoxine (Chinolinsäure,
3-OH-Kynurenin) aus dem Tryptophanstoffwechsel, welche wahrscheinlich
die Entwicklung der neurodegenerativen Erscheinungen verursachen. Abbildung):
Abbildung):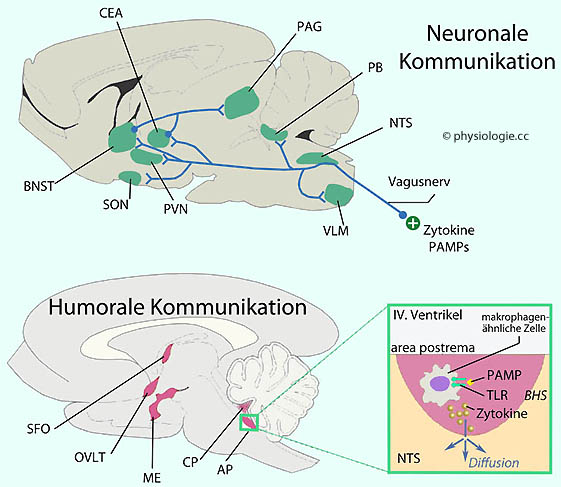
 Abbildung: Neuronale und humorale Querbeziehungen zwischen Nerven- und Immunsystem im Gehirn der Ratte
Abbildung: Neuronale und humorale Querbeziehungen zwischen Nerven- und Immunsystem im Gehirn der Ratte BHS, Blut-Hirn-Schranke
BHS, Blut-Hirn-Schranke  CEA, zentraler Amygdalakern
CEA, zentraler Amygdalakern  CP, plexus chorioideus
CP, plexus chorioideus  ME, eminentia mediana
ME, eminentia mediana  NTS, nucleus tractus solitarii
NTS, nucleus tractus solitarii  OVLT, organum vasculosum laminae terminalis,
in die Regelung von Körpertemperatur, Hunger und Durst involviert,
reagiert auf endogene Pyrogene und beteiligt sich an der Fieberantwort
OVLT, organum vasculosum laminae terminalis,
in die Regelung von Körpertemperatur, Hunger und Durst involviert,
reagiert auf endogene Pyrogene und beteiligt sich an der Fieberantwort  PAG, periaquäduktales Höhlengrau, beteiligt sich u.a. an Schmerzunterdrückung und reflektorischen Antworten auf Bedrohungsszenarien
PAG, periaquäduktales Höhlengrau, beteiligt sich u.a. an Schmerzunterdrückung und reflektorischen Antworten auf Bedrohungsszenarien  PAMPs, pathogen-associated molecular patterns, für Mikroben unverzichtbare molekulare Muster, die vom Immunsystem erkannt werden
PAMPs, pathogen-associated molecular patterns, für Mikroben unverzichtbare molekulare Muster, die vom Immunsystem erkannt werden  PB, nucleus parabrachialis, vermittelt Information zum Hypothalamus
PB, nucleus parabrachialis, vermittelt Information zum Hypothalamus  PVN, nucleus paraventricularis, u.a. in Stressreaktionen involviert
PVN, nucleus paraventricularis, u.a. in Stressreaktionen involviert  SFO, subfornikales Organ, ein zirkumventrikuläres Gewebe am Dach des III. Ventrikels
SFO, subfornikales Organ, ein zirkumventrikuläres Gewebe am Dach des III. Ventrikels  SON, nucleus supraopticus, bildet Vasopressin
SON, nucleus supraopticus, bildet Vasopressin  TLR, toll-like receptor, bindet Liganden wie PAMPs und wird z.B. von Leukozyten exprimiert
TLR, toll-like receptor, bindet Liganden wie PAMPs und wird z.B. von Leukozyten exprimiert  VLM, ventrolaterale medulla oblongata
VLM, ventrolaterale medulla oblongata

 Abbildung: Wirkungen des Sympathikus auf das Immunsystem
Abbildung: Wirkungen des Sympathikus auf das Immunsystem
 Abbildung) - Immunzellen verfügen über Rezeptoren
für Katecholamine,
Serotonin, Substanz P, VIP, Histamin.
Abbildung) - Immunzellen verfügen über Rezeptoren
für Katecholamine,
Serotonin, Substanz P, VIP, Histamin.  Der Sympathikus innerviert
alle Gewebe des
Immunsystems: Knochenmark, Thymusdrüse, Milz, Lymphknoten.
Der Sympathikus innerviert
alle Gewebe des
Immunsystems: Knochenmark, Thymusdrüse, Milz, Lymphknoten.  So senkt Noradrenalin an
T-Zellen deren Sekretion von Interleukin-2,
So senkt Noradrenalin an
T-Zellen deren Sekretion von Interleukin-2,
 NK-Zellen stellen ihre
zytotoxische Funktion ein,
NK-Zellen stellen ihre
zytotoxische Funktion ein,
 Makrophagen stoppen ihre Sekretion von IL-1
und TNF-α,
Makrophagen stoppen ihre Sekretion von IL-1
und TNF-α,
 Lymphozytennachbildung und -zahl sinken im Thymus.
Lymphozytennachbildung und -zahl sinken im Thymus.
 Humorale
Humorale
 Wege umfassen z.B. PAMPs, welche das Gehirn auf der Ebene des
plexus
chorioideus und des zirkumventrikulären Organs (
Wege umfassen z.B. PAMPs, welche das Gehirn auf der Ebene des
plexus
chorioideus und des zirkumventrikulären Organs ( Abbildung oben: ME eminantia mediana,
OVLT organum vasculosum laminae terminalis, AP area postrema, SFO
subfornikales Organ). Im subfornikalen Organ
induzieren PAMPs die Freisetzung entzündungsauslösender Zytokine über
Phagozyten, die toll-like receptors (TLRs) exprimieren. Die zirkumventrikulären Organe liegen
außerhalb der Blut-Hirn-Schranke.
Abbildung oben: ME eminantia mediana,
OVLT organum vasculosum laminae terminalis, AP area postrema, SFO
subfornikales Organ). Im subfornikalen Organ
induzieren PAMPs die Freisetzung entzündungsauslösender Zytokine über
Phagozyten, die toll-like receptors (TLRs) exprimieren. Die zirkumventrikulären Organe liegen
außerhalb der Blut-Hirn-Schranke.Immuneffekte von Neurotransmittern / Neuropeptiden Nach Wilkinson / Brown: An Introduction to Neuroendocrinology, 2nd ed. 2015. Cambridge University Press |
|
| Hormon / Signalstoff |
Zytokin / Immunfunktion |
| α-Endorphin | Hemmt Immunglobulinproduktion |
| α-MSH | Hemmt IL 1- und IL 2-Produktion |
| Acetylcholin |
Regt T-Zellen, NK-Zellen und Interferon-γ-Synthese an |
| ACTH |
Hemmt Interferon-γ-Synthese, Immunglobulinbildung und Makrophagenaktivierung über Interferon-γ |
| Adrenalin |
Hemmt IL 1- und IL 2-Produktion |
| Angiotensin II |
Erhöht Interferon-γ-Synthese |
| ß-Endorphin |
Regt Interferon-γ-Synthese und NK-Zell-mediierte Zytotoxizität an, hemmt T-Zell-Proliferation |
| cAMP |
Fördert die Produktion von IL-4 und IL-5, hemmt die von IL-2 |
| CGRP |
Regt T-Zellen-Adhäsion sowie die Bildung von IL-2, IL-4 und Interferon-γ an |
| Katecholamine |
Fördern Synthese von Immunglobulinen, senken T- und NK-Zellzahl im Blut, hemmen NK-Zellen |
| Cortisol |
Komplexe Wirkung auf Zytokine - teils Anregung, teils Hemmung |
| CRH |
Aktiviert Makrophagen, senkt Synthese von IL-1 und IL-6 |
| GH |
Aktiviert Makrophagen, regt Lymphozytenentwicklung im Thymus an, stimuliert Entwicklung von B-Lymphozyten und Zytokinbildung |
| GnRH |
Steigert Expression von IL-2-Rezeptoren und Proliferation von T- und B-Lymphozyten |
| Histamin |
Hemmt IL-12, TNF und Interferon-γ, erhöht Produktion von IL-10 |
| Inhibin |
Hemmt Bildung von Interferon-γ |
| LH |
Stärkt T-Zell-Proliferation |
| MIF (macrophage inhibitory factor) |
Blockiert glukokortikoidbedingte Hemmung der T-Zell-Proliferation und Zytokinbildung |
| Melatonin |
Erhöht Produktion von IL-2, IL-6, IL-11 und Interferon-γ |
| Metenkephalin |
Verstärkt antikörperabhängige Proliferation |
| NGF |
Verstärkt B-Zell-Proliferation, Produktion von IL-6 und IL-2-Rezeptoren |
| Neuropeptid Y |
Erhöht T-Zell-Adhäsion, stimuliert IL-2, IL-4 und Interferon-γ |
| Östradiol |
Verstärkt T-Zell-Proliferation |
| Oxytozin |
Regt Interferon-γ-Synthese an |
| Prostaglandin E2 |
Hemmt IL-2-Produktion |
| Progesteron |
Erhöht IL-4-Produktion |
| Prolaktin |
Stärkt T-Zell-Proliferation, erhöht Interferon-γ-Spiegel und Expression von IL-2-Rezeptoren |
| Serotonin |
Hemmt T-Zell-Proliferation und Interferon-γ-induzierte MHC-II-Expression, erhöht NK-Zytotoxizität |
| Somatostatin |
Hemmt T-Zell-Proliferation, Interferon-γ-Produktion, Makrophagen |
| Substanz P |
Regt T-Zell-Proliferation, IL-1, IL-6, TNF an |
| Testosteron |
Erhöht IL-10-Produktion |
| TSH |
Fördert Sekretion von IL-2, GM-CSF, Immunglobulin |
| Thyroxin |
Aktiviert T-Lymphozyten |
| Vitamin D-Hormon |
Hemmt IL-2 und Interferon-γ, fördert IL-4-Bildung |
| Vasopressin |
Regt Interferon-γ-Synthese an |
| VIP |
Hemmt T-Zell-Proliferation und IL-12, regt Produktion von IL-5 und cAMP an |

 Immunzellen bilden nicht nur Zytokine, sondern auch Hormone, wie CRH,
ACTH, TSH, GH und Prolaktin. Umgekehrt verfügen einige über adrenerge
sowie Opiatrezeptoren. Nervenzellen (Gehirn, N. vagus) verfügen über
Zytokinrezeptoren
Immunzellen bilden nicht nur Zytokine, sondern auch Hormone, wie CRH,
ACTH, TSH, GH und Prolaktin. Umgekehrt verfügen einige über adrenerge
sowie Opiatrezeptoren. Nervenzellen (Gehirn, N. vagus) verfügen über
Zytokinrezeptoren Gehirn und Immunsystem kommunizieren bidirektional. Immunzellen wirken
über Zytokine auf Nerven- und endokrine Zellen, Hormone wirken auf
Gehirn und Immunsystem, Nervenzellen wirken über Katecholamine und
Neuropeptide auf Immunozyten
Gehirn und Immunsystem kommunizieren bidirektional. Immunzellen wirken
über Zytokine auf Nerven- und endokrine Zellen, Hormone wirken auf
Gehirn und Immunsystem, Nervenzellen wirken über Katecholamine und
Neuropeptide auf Immunozyten Die Entwicklung von Immunzellen in Thymusdrüse und Knochenmark steht
unter dem Einfluss des sympathischen und parasympathischen Nervensystems
Die Entwicklung von Immunzellen in Thymusdrüse und Knochenmark steht
unter dem Einfluss des sympathischen und parasympathischen Nervensystems Psychosoziale Umgebungsfaktoren beeinflussen neurobiologische,
endokrine und immunologische Funktionen. Stress setzt Cortisol,
Katecholamine, Somatotropine, Schilddrüsenhormone frei, die
kontrainsulinär wirken und die Energiespeicherung von Zellen reduzieren
Psychosoziale Umgebungsfaktoren beeinflussen neurobiologische,
endokrine und immunologische Funktionen. Stress setzt Cortisol,
Katecholamine, Somatotropine, Schilddrüsenhormone frei, die
kontrainsulinär wirken und die Energiespeicherung von Zellen reduzieren Der Sympathikus innerviert alle Gewebe des Immunsystems: Knochenmark,
Thymusdrüse, Milz, Lymphknoten. Noradrenalin reduziert die Sekretion
von IL-2 an T-Zellen, stoppt die Zytotoxizität von NK-Zellen und die
Bildung von Zytokinen bei Makrophagen
Der Sympathikus innerviert alle Gewebe des Immunsystems: Knochenmark,
Thymusdrüse, Milz, Lymphknoten. Noradrenalin reduziert die Sekretion
von IL-2 an T-Zellen, stoppt die Zytotoxizität von NK-Zellen und die
Bildung von Zytokinen bei Makrophagen Hypothalamisch-hypophysäre Hormone beeinflussen Immunsystem,
Nebenniere, Schilddrüse, Gonaden. Für alle diese Hormone finden sich
Rezeptoren an Immunzellen
Hypothalamisch-hypophysäre Hormone beeinflussen Immunsystem,
Nebenniere, Schilddrüse, Gonaden. Für alle diese Hormone finden sich
Rezeptoren an Immunzellen |
