



 Corticoliberin: cortex = Rinde, liberare = freilassen
Corticoliberin: cortex = Rinde, liberare = freilassen| Der Hypothalamus bildet Signalstoffe (Tropine), die Zellen im Hypophysen-Vorderlappen anregen (Liberine, releasing hormones)
oder hemmen (Inhibine, inhibiting hormones). Die Wirkung erfolgt über Rezeptoren. Einige
Vorderlappenzellen stehen gleichzeitig unter dem Einfluss von mehr als nur einem Tropin. Die Bezeichnung der Tropine richtet sich nach deren Adressaten: -- CRH (Corticoliberin) wird alle 1-3 Stunden sezerniert, vorwiegend morgens; es koppelt an CRH-Rezeptoren ACTH-produzierender basophiler Vorderlappenzellen -- GHRH (Somatoliberin) wird ebenfall pulsatil freigesetzt, vor allem in der Nacht; es stimuliert die Freisetzung von Wachstumshormon (Somatotropin) aus azidophilen Zellen -- GHIH (Somatostatin) hemmt die Freisetzung von Somatotropin und bewirkt zusammen mit GHRH dessen pulsatile Sekretion -- GnRH (Gonadoliberin) wird pulsatil freigesetzt - bei der Frau alle 90, beim Mann alle 120 Minuten. Es bewirkt an basophilen Vorderlappenzellen die Sekretion der Gonadotropine FSH und LH -- TRH (Thyreoliberin) regt die Ausschüttung von Thyreotropin und Prolaktin an. |
 gibt es eine hypophysiotrope Region mit endokrin aktiven Zellen:
gibt es eine hypophysiotrope Region mit endokrin aktiven Zellen: Kleine
(parvozelluläre) Neurone steuern den Hypophysenvorderlappen, indem sie
ihre neuroendokrinen Steuersubstanzen an der eminentia mediana (am
Hypophysenstiel) an Kapillaren des hypothalamisch-hypophysären
Pfortadersystems abgeben. Diese Kapillaren sind vom fenestrierten Typ und lassen Peptide zwischen Blut und Interstitium hindurchtreten (sie sind nicht Teil der Blut-Hirn-Schranke).
Kleine
(parvozelluläre) Neurone steuern den Hypophysenvorderlappen, indem sie
ihre neuroendokrinen Steuersubstanzen an der eminentia mediana (am
Hypophysenstiel) an Kapillaren des hypothalamisch-hypophysären
Pfortadersystems abgeben. Diese Kapillaren sind vom fenestrierten Typ und lassen Peptide zwischen Blut und Interstitium hindurchtreten (sie sind nicht Teil der Blut-Hirn-Schranke). Große (magnozelluläre) Neurone synthetisieren Hormone, die sie über den Hypophysenstiel in den Hinterlappen transportieren, dort speichern und bei Bedarf an den systemischen Blutkreislauf abgeben (Vasopressin, Oxytozin, Neurophysine).
Große (magnozelluläre) Neurone synthetisieren Hormone, die sie über den Hypophysenstiel in den Hinterlappen transportieren, dort speichern und bei Bedarf an den systemischen Blutkreislauf abgeben (Vasopressin, Oxytozin, Neurophysine).
 Abbildung: Steuerung hormoneller Achsen Hypothalamus - Hypophyse - Zielorgan
Abbildung: Steuerung hormoneller Achsen Hypothalamus - Hypophyse - Zielorgan
 , Corticorelin. Dieses Proteohormon (41 Aminosäuren) wird von parvozellulären hypothalamischen Neuronen - vor allem des nucl. paraventricularis - als Vorstufe synthetisiert (Procorticotropin-Releasingfaktor, pro-CRH), bearbeitet und als CRH freigesetzt -
pulsatil (alle 1-3 Stunden), mit der größten Amplitude in
den frühen Morgenstunden.
, Corticorelin. Dieses Proteohormon (41 Aminosäuren) wird von parvozellulären hypothalamischen Neuronen - vor allem des nucl. paraventricularis - als Vorstufe synthetisiert (Procorticotropin-Releasingfaktor, pro-CRH), bearbeitet und als CRH freigesetzt -
pulsatil (alle 1-3 Stunden), mit der größten Amplitude in
den frühen Morgenstunden. 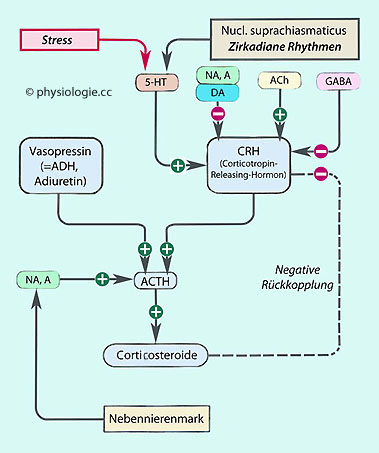
 Abbildung: Steuerung der CRH-Sekretion
Abbildung: Steuerung der CRH-Sekretion ACh, Acetylcholin
ACh, Acetylcholin  DA, Dopamin
DA, Dopamin  GABA, Gamma-Aminobuttersäure
GABA, Gamma-Aminobuttersäure  NA, A = Noradrenalin, Adrenalin
NA, A = Noradrenalin, Adrenalin
 Abbildung); zu ihnen gehört Belastung (Stress).
Abbildung); zu ihnen gehört Belastung (Stress).  s. dort).
s. dort). fördernden Einflüssen auf CRH-Neurone Serotonin (5-HT) und Peptide wie NPY und Vasopressin (Wirkung über V3-Rezeptoren), und zu den
fördernden Einflüssen auf CRH-Neurone Serotonin (5-HT) und Peptide wie NPY und Vasopressin (Wirkung über V3-Rezeptoren), und zu den
 hemmenden GABA und Opioide
hemmenden GABA und Opioide  (und Cortisol - negative Rückkopplung).
(und Cortisol - negative Rückkopplung).  CRH-Stimulationstest: Diagnostische CRH-Gabe führt bei zentralem Cushing-Syndrom
zu überschießendem Anstieg von ACTH (hypersensible Vorderlappenzellen)
und Cortisol. Bei HyperCortisolismus (hormonproduzierender Nebennierenrinden-Tumor) bleibt der ACTH-Anstieg nach CRH-Gabe aus (herunterregulierte Empfindlichkeit des hypothalamisch-hypophysären Systems).
CRH-Stimulationstest: Diagnostische CRH-Gabe führt bei zentralem Cushing-Syndrom
zu überschießendem Anstieg von ACTH (hypersensible Vorderlappenzellen)
und Cortisol. Bei HyperCortisolismus (hormonproduzierender Nebennierenrinden-Tumor) bleibt der ACTH-Anstieg nach CRH-Gabe aus (herunterregulierte Empfindlichkeit des hypothalamisch-hypophysären Systems).  Abbildung). Es stammt aus kleinen Neuronen im nucleus
arcuatus und gelangt über den hypothalamisch-hypophysären
Pfortaderkreislauf zu Zellen des Vorderlappens.
Abbildung). Es stammt aus kleinen Neuronen im nucleus
arcuatus und gelangt über den hypothalamisch-hypophysären
Pfortaderkreislauf zu Zellen des Vorderlappens. 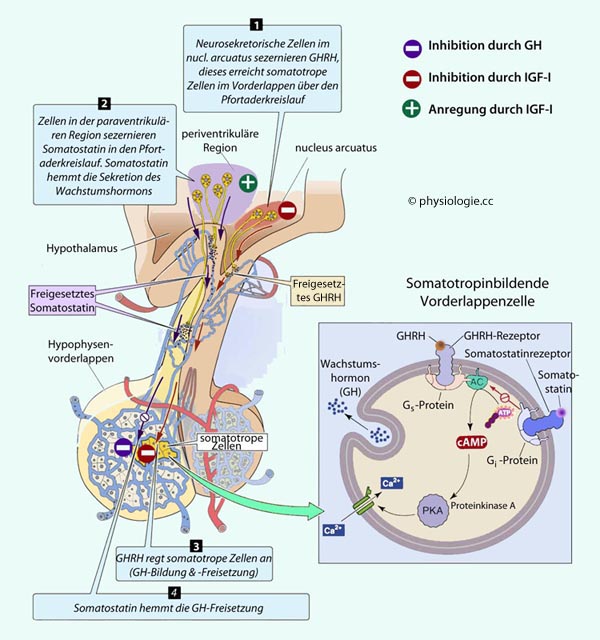
 Abbildung: Das GHRH- Somatostatin- GH-IGF- System
Abbildung: Das GHRH- Somatostatin- GH-IGF- System
 Die Abgabe von GHRH erfolgt pulsatil, am stärksten (und höherfrequent) in der Nacht, überlagert auf eine geringere basale Sekretion.
Die Abgabe von GHRH erfolgt pulsatil, am stärksten (und höherfrequent) in der Nacht, überlagert auf eine geringere basale Sekretion.  Die Freisetzung von GHRH wird angeregt durch
Die Freisetzung von GHRH wird angeregt durch Psychische
und physische Belastung (Stress)
Psychische
und physische Belastung (Stress) Ghrelin
Ghrelin erhöhte Aminosäurenkonzentration im Blut
erhöhte Aminosäurenkonzentration im Blut (insulininduzierte) Hypoglykämie
(insulininduzierte) Hypoglykämie Hunger
Hunger Dopamin
Dopamin Östradiol und Testosteron
Östradiol und Testosteron Tiefschlaf
Tiefschlaf  Die Freisetzung von GHRH wird gehemmt durch
Die Freisetzung von GHRH wird gehemmt durch Glucose
Glucose Glucocorticoide
Glucocorticoide freie Fettsäuren
freie Fettsäuren größere Dosen GH (short-loop feedback - die GHRH-Sekretion ist selbstbegrenzt (auto- / parakrine Regulation).
größere Dosen GH (short-loop feedback - die GHRH-Sekretion ist selbstbegrenzt (auto- / parakrine Regulation).
 Abbildung: GH-IGF I-Achse und ihre Regulierung
Abbildung: GH-IGF I-Achse und ihre Regulierung
 GHRH-Test:
Diagnostische Gabe von GHRH unterscheidet zwischen hypophysären und
hypothalamischen Störungen des Wachstumshormonsystems
("Etagendiagnostik"), da es direkt am Vorderlappen wirkt. Spricht
dieser auf GHRH an, kommt es in ~30 Minuten zu einem GH-peak.
GHRH-Test:
Diagnostische Gabe von GHRH unterscheidet zwischen hypophysären und
hypothalamischen Störungen des Wachstumshormonsystems
("Etagendiagnostik"), da es direkt am Vorderlappen wirkt. Spricht
dieser auf GHRH an, kommt es in ~30 Minuten zu einem GH-peak. Somatostatin ist besonders kurzlebig, seine biologische Halbwertszeit im Blut beträgt 2-4 Minuten.
Somatostatin ist besonders kurzlebig, seine biologische Halbwertszeit im Blut beträgt 2-4 Minuten. 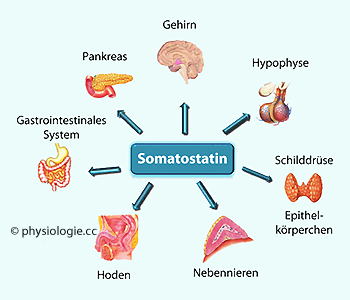
 Abbildung: Einige Wirkorte von Somatostatin
Abbildung: Einige Wirkorte von Somatostatin
 Abbildung), zum Beispiel:
Abbildung), zum Beispiel:  Im Magen hemmt Somatostatin die Pepsinfreisetzung und Gastrinsekretion sowie im Darm die Freisetzung fast jeden Verdauungshormons,
Im Magen hemmt Somatostatin die Pepsinfreisetzung und Gastrinsekretion sowie im Darm die Freisetzung fast jeden Verdauungshormons, im Pankreas Insulin- und Glucagonfreisetzung,
im Pankreas Insulin- und Glucagonfreisetzung, in der Gallenblase Kontraktion,
in der Gallenblase Kontraktion, im Darm
CCK-Sekretion und Motilität (es fördert die Flüssigkeits- / Elektrolytresorption),
im Darm
CCK-Sekretion und Motilität (es fördert die Flüssigkeits- / Elektrolytresorption), in der Niere die Reninsekretion bei hypovolämischer Reizung und die wassersparende Wirkung von Vasopressin,
in der Niere die Reninsekretion bei hypovolämischer Reizung und die wassersparende Wirkung von Vasopressin, in der Nebennierenrinde die angiotensininduzierte Freisetzung von Aldosteron,
in der Nebennierenrinde die angiotensininduzierte Freisetzung von Aldosteron, im Nebennierenmark die acetylcholinstimulierte Sekretion von Katecholaminen,
im Nebennierenmark die acetylcholinstimulierte Sekretion von Katecholaminen,  im Hypothalamus die Freisetzung von hGH sowie TSH (und damit indirekt der Schilddrüsenhormone)
im Hypothalamus die Freisetzung von hGH sowie TSH (und damit indirekt der Schilddrüsenhormone) 
 Abbildung: Wachstumshormon- System
Abbildung: Wachstumshormon- System Sermorelin ist ein GHRF-Analog und kann zur Testung der Somatotropin- Sekretionskapazität verwendet werden.
Sermorelin ist ein GHRF-Analog und kann zur Testung der Somatotropin- Sekretionskapazität verwendet werden.
 ,
Gonadoliberin, Gonadorelin) wird aus parvozellulären Neuronen des nucl. arcuatus und der präoptischen Region in Pulsen
(etwa 8 bis 14 in 24 Stunden) freigesetzt und wirkt über GPCR-Rezeptoren
(über Gq, Phospholipase C, IP3, Ca++ - vielleich auch andere Pfade) anregend auf gonadotrope Zellen der Adenohypophyse.
,
Gonadoliberin, Gonadorelin) wird aus parvozellulären Neuronen des nucl. arcuatus und der präoptischen Region in Pulsen
(etwa 8 bis 14 in 24 Stunden) freigesetzt und wirkt über GPCR-Rezeptoren
(über Gq, Phospholipase C, IP3, Ca++ - vielleich auch andere Pfade) anregend auf gonadotrope Zellen der Adenohypophyse.
 Abbildung: Multiple Einflüsse auf hypothalamische Neurone - Beispiel GnRH
Abbildung: Multiple Einflüsse auf hypothalamische Neurone - Beispiel GnRH GABA, γ-Aminobutyrat
GABA, γ-Aminobutyrat  GALP, Galanin-like peptide: Hypothalamischer Transmitter mit vielfacher Funktion
GALP, Galanin-like peptide: Hypothalamischer Transmitter mit vielfacher Funktion  Kisspeptin ist ein Neuropeptid, es regt u.a. die Ausschüttung von GnRH zu Beginn der Pubertät an
Kisspeptin ist ein Neuropeptid, es regt u.a. die Ausschüttung von GnRH zu Beginn der Pubertät an  NPY, Neuropeptid Y: Neurotransmitter im Gehirn und sympathischer Kotransmitter
NPY, Neuropeptid Y: Neurotransmitter im Gehirn und sympathischer Kotransmitter
 Ein GnRH-Puls pro Stunde fördert vor allem die Freisetzung von LH, ein Puls alle drei Stunden vorwiegend die von FSH.
Ein GnRH-Puls pro Stunde fördert vor allem die Freisetzung von LH, ein Puls alle drei Stunden vorwiegend die von FSH.  GnRH-Sekretion bei der Frau: Östradiol
in hoher Konzentration hat einen positiven Feedback-Effekt auf GnRH-Neuronen: Dieser selbstverstärkende Effekt bewirkt den
präovulatorischen Gonadotropin-Peak und die Ovulation. In der zweiten
Zyklushälfte bewirkt die inhibitorische Wirkung des Progesterons auf den hypothalamischen GnRH-Pulsgeber eine niedrigere Frequenz (bei höherer Amplitude) der LH-Pulse.
GnRH-Sekretion bei der Frau: Östradiol
in hoher Konzentration hat einen positiven Feedback-Effekt auf GnRH-Neuronen: Dieser selbstverstärkende Effekt bewirkt den
präovulatorischen Gonadotropin-Peak und die Ovulation. In der zweiten
Zyklushälfte bewirkt die inhibitorische Wirkung des Progesterons auf den hypothalamischen GnRH-Pulsgeber eine niedrigere Frequenz (bei höherer Amplitude) der LH-Pulse. 
 GnRH-Sekretion beim
Mann: Alle 2-4 Stunden erfolgt ein GnRH-Puls. Hier haben sowohl Testosteron als auch Östradiol
einen ausschließlich hemmenden Effekt auf GnRH-Neurone (negative
Rückkopplung).
GnRH-Sekretion beim
Mann: Alle 2-4 Stunden erfolgt ein GnRH-Puls. Hier haben sowohl Testosteron als auch Östradiol
einen ausschließlich hemmenden Effekt auf GnRH-Neurone (negative
Rückkopplung).
 Die GnRH-Pulse werden durch intensiven physischen (Muskelarbeit) und psychischen Stress reduziert und können im Hungerzustand
komplett ausbleiben, was die Neigung anorektischer Personen zu Amenorrhoe und Infertilität erklärt
(ausbleibende LH/FSH-Ausschüttung aus der Hypophyse, fehlende Anregung
von Ovarien / Hoden, ausbleibender Zyklus bei Frauen).
Die GnRH-Pulse werden durch intensiven physischen (Muskelarbeit) und psychischen Stress reduziert und können im Hungerzustand
komplett ausbleiben, was die Neigung anorektischer Personen zu Amenorrhoe und Infertilität erklärt
(ausbleibende LH/FSH-Ausschüttung aus der Hypophyse, fehlende Anregung
von Ovarien / Hoden, ausbleibender Zyklus bei Frauen). | GnRH stimuliert die Freisetzung der Gonadotropine FSH und LH |
 Der GHRH-Test
prüft die Stimulierbarkeit der hypophysären LH-Sekretion. Therapeutisch
kann das Hormon bei GnRH-Mangel eingesetzt werden, wobei die
Applikation pulsatil erfolgen muss, um wirksam zu sein (receptor downregulation
bei kontinuierlicher Gabe) - bei Männern in Abständen von 120, bei
Frauen von 90 Minuten (computergesteuerte Infusion). GnRH ist auch bei
nasaler Applikation wirksam.
Der GHRH-Test
prüft die Stimulierbarkeit der hypophysären LH-Sekretion. Therapeutisch
kann das Hormon bei GnRH-Mangel eingesetzt werden, wobei die
Applikation pulsatil erfolgen muss, um wirksam zu sein (receptor downregulation
bei kontinuierlicher Gabe) - bei Männern in Abständen von 120, bei
Frauen von 90 Minuten (computergesteuerte Infusion). GnRH ist auch bei
nasaler Applikation wirksam. Ähnliches gilt für GnRH-Analoga: Auch diese wirken nur bei stoßweiser
Applikation dauerhaft anregend auf die Gonadotropinbildung. Depotpräparate erhöhen zwar kurzzeitig den FSH/LH-Spiegel, der dann
aber immer mehr absinkt (Refrakterität der hypophysären Zielzellen) -
das Resultat ist ein Östrogenmangel. Das kann therapeutisch genutzt
werden, wenn ein niedriger Östrogenspiegel das Behandlungsziel ist -
wie zur Verhinderung einer vorzeitigen Ovulation bei IVF, oder zum Eindämmen östrogen-positiver Karzinome (Prostata, Brustdrüse).
Ähnliches gilt für GnRH-Analoga: Auch diese wirken nur bei stoßweiser
Applikation dauerhaft anregend auf die Gonadotropinbildung. Depotpräparate erhöhen zwar kurzzeitig den FSH/LH-Spiegel, der dann
aber immer mehr absinkt (Refrakterität der hypophysären Zielzellen) -
das Resultat ist ein Östrogenmangel. Das kann therapeutisch genutzt
werden, wenn ein niedriger Östrogenspiegel das Behandlungsziel ist -
wie zur Verhinderung einer vorzeitigen Ovulation bei IVF, oder zum Eindämmen östrogen-positiver Karzinome (Prostata, Brustdrüse).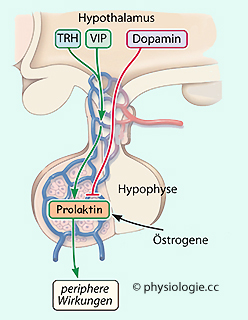
 Abbildung: Regulierung der Prolaktinfreisetzung
Abbildung: Regulierung der Prolaktinfreisetzung

 nigro-striatal - für die Bewegungssteuerung im Bereich der Basalganglien;
nigro-striatal - für die Bewegungssteuerung im Bereich der Basalganglien; 
 mesolimbisch, gilt als das „Belohnungssystem“;
mesolimbisch, gilt als das „Belohnungssystem“; 
 mesocortikal, mit Einfluss auf zielgerichtetes Handeln und Motivation.
mesocortikal, mit Einfluss auf zielgerichtetes Handeln und Motivation. Abbildung).
Abbildung).
 Abbildung: Achse Hypothalamus - Hypophyse - Schilddrüse (und retour)
Abbildung: Achse Hypothalamus - Hypophyse - Schilddrüse (und retour) DAG = Diacylglycerin
DAG = Diacylglycerin  IP3 = Inositoltriphosphat
IP3 = Inositoltriphosphat  PLC = Phospholipase C
PLC = Phospholipase C  PKC = Proteinkinase C
PKC = Proteinkinase C
 Für seine Synthese sind mehrere
Enzyme erforderlich. Die Expression der TRH-Gene wird durch erhöhte Schilddrüsenhormonspiegel im Blut unterdrückt, die TSH-Bildung und folglich die Schilddrüsenfunktion wird dadurch supprimiert.
Für seine Synthese sind mehrere
Enzyme erforderlich. Die Expression der TRH-Gene wird durch erhöhte Schilddrüsenhormonspiegel im Blut unterdrückt, die TSH-Bildung und folglich die Schilddrüsenfunktion wird dadurch supprimiert.  TRH hat eine geringe Halbwertszeit (2-5 Minuten); es wird spezifisch durch eine Metallopeptidase (TRH-Degrading Ectoenzyme, Thyreoliberinase) abgebaut.
TRH hat eine geringe Halbwertszeit (2-5 Minuten); es wird spezifisch durch eine Metallopeptidase (TRH-Degrading Ectoenzyme, Thyreoliberinase) abgebaut.  TRH
ist i.v., aber auch bei nasaler Applikation wirksam (das Molekül ist an
beiden Enden abbaugeschützt). Angewendet wird es sowohl
TRH
ist i.v., aber auch bei nasaler Applikation wirksam (das Molekül ist an
beiden Enden abbaugeschützt). Angewendet wird es sowohl  therapeutisch (gedächtnisfördernd, antidepressiv, angsthemmend,
antikonvulsiv, durchblutungsfördernd etc.) als auch
therapeutisch (gedächtnisfördernd, antidepressiv, angsthemmend,
antikonvulsiv, durchblutungsfördernd etc.) als auch  diagnostisch (TRH-Test): Liegt eine Hypophyseninsuffizienz vor, führt TRH-Gabe nicht wie zu erwarten zu TSH-Anstieg; besteht eine primäre Hypothyreose, führt TRH-Gabe zu überschießender TSH-Antwort.
diagnostisch (TRH-Test): Liegt eine Hypophyseninsuffizienz vor, führt TRH-Gabe nicht wie zu erwarten zu TSH-Anstieg; besteht eine primäre Hypothyreose, führt TRH-Gabe zu überschießender TSH-Antwort. 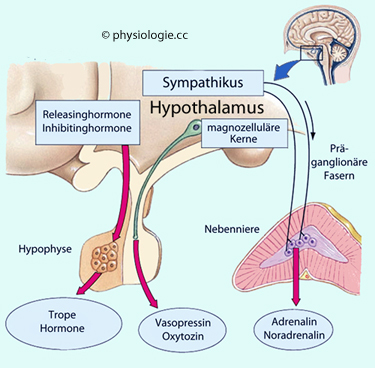
 Abbildung: Hormonelle und neuronale Ausgänge des Hypothalamus
Abbildung: Hormonelle und neuronale Ausgänge des Hypothalamus
 Vasopressin (ADH) entsteht aus Proneurophysin II. Der wichtigste
physiologische Reiz zur Vasopressinfreisetzung ist eine Zunahme der
Osmolarität des Blutes (ab >280 mOsm/l). Zentrale Osmorezeptoren
befinden sich im nucleus supraopticus, dem Subfornikalorgan am Dach des III. Ventrikels und im zirkumventrikulären organum vasculosum laminae terminalis (OVLT), das ein Teil der lamina terminalis ist.
Vasopressin (ADH) entsteht aus Proneurophysin II. Der wichtigste
physiologische Reiz zur Vasopressinfreisetzung ist eine Zunahme der
Osmolarität des Blutes (ab >280 mOsm/l). Zentrale Osmorezeptoren
befinden sich im nucleus supraopticus, dem Subfornikalorgan am Dach des III. Ventrikels und im zirkumventrikulären organum vasculosum laminae terminalis (OVLT), das ein Teil der lamina terminalis ist.
 Die hypophysiotrope Region des Hypothalamus enthält parvizelluläre (Steuerung des Hypophysenvorderlappens über das hypothalamisch-hypophysäre Pfortadersystem: Liberine, Statine) und magnozelluläre
Neurone (zum Hinterlappen: Vasopressin, Oxytozin, Neurophysine). Sie
werden über zentrale (Vorwärtskopplung) und periphere Einflüsse (Rückkopplung) gesteuert.
Die Freisetzung der Hormone erfolgt pulsatil. Hypophysäre Hormone
wirken zum Teil direkt auf Erfolgsorgane (nicht-glandotrope Hormone:
GH, Prolaktin), zum Teil indirekt über dazwischengeschaltete Drüsen,
deren Hormonproduktion kontrolliert wird (glandotrope Hormone) Die hypophysiotrope Region des Hypothalamus enthält parvizelluläre (Steuerung des Hypophysenvorderlappens über das hypothalamisch-hypophysäre Pfortadersystem: Liberine, Statine) und magnozelluläre
Neurone (zum Hinterlappen: Vasopressin, Oxytozin, Neurophysine). Sie
werden über zentrale (Vorwärtskopplung) und periphere Einflüsse (Rückkopplung) gesteuert.
Die Freisetzung der Hormone erfolgt pulsatil. Hypophysäre Hormone
wirken zum Teil direkt auf Erfolgsorgane (nicht-glandotrope Hormone:
GH, Prolaktin), zum Teil indirekt über dazwischengeschaltete Drüsen,
deren Hormonproduktion kontrolliert wird (glandotrope Hormone) CRH (Corticoliberin) aus parvozellulären Neuronen vor allem des nucl.
paraventricularis wird alle 1-3 Stunden freigesetzt, insbesondere in den frühen Morgenstunden. Gefördert wird die CRH-Sekretion
durch Serotonin und Acetylcholin, gehemmt durch Katecholamine, Dopamin
GABA, Cortisol. CRH stimuliert die Ausschüttung von ACTH im
Hypophysenvorderlappen und wirkt auch hungerbremsend,
aufmerksamkeitsfördernd sowie angstverstärkend CRH (Corticoliberin) aus parvozellulären Neuronen vor allem des nucl.
paraventricularis wird alle 1-3 Stunden freigesetzt, insbesondere in den frühen Morgenstunden. Gefördert wird die CRH-Sekretion
durch Serotonin und Acetylcholin, gehemmt durch Katecholamine, Dopamin
GABA, Cortisol. CRH stimuliert die Ausschüttung von ACTH im
Hypophysenvorderlappen und wirkt auch hungerbremsend,
aufmerksamkeitsfördernd sowie angstverstärkend  GHRH (Somatoliberin) wird - über eine geringere basale Sekretion -
pulsatil (stärker in der Nacht) aus dem nucl. arcuatus freigesetzt,
angeregt durch Stress, erhöhte Aminosäurespiegel im Blut,
Hypoglykämie, Hunger, Ghrelin, Dopamin, Östradiol und Testosteron.
Gehemmt wird seine Freisetzung durch Glucose, freie Fettsäuren,
Glucocorticoide. Es wirkt auf GHRH-Rezeptoren und fördert die
GH-Bildung im Hypophysenvorderlappen
GHRH (Somatoliberin) wird - über eine geringere basale Sekretion -
pulsatil (stärker in der Nacht) aus dem nucl. arcuatus freigesetzt,
angeregt durch Stress, erhöhte Aminosäurespiegel im Blut,
Hypoglykämie, Hunger, Ghrelin, Dopamin, Östradiol und Testosteron.
Gehemmt wird seine Freisetzung durch Glucose, freie Fettsäuren,
Glucocorticoide. Es wirkt auf GHRH-Rezeptoren und fördert die
GH-Bildung im Hypophysenvorderlappen Somatostatin aus dem periventrikulären anterioren Hypothalamus hemmt
die Freisetzung von GH, TSH und ACTH. Im Magen-Darm-Trakt hemmt es die
Sekretion fast aller Hormone sowie die Motilität, in der Niere
Reninsekretion und Vasopressineffekt, in der Nebennierenrinde die
angiotensininduzierte Freisetzung von Aldosteron, im Nebennierenmark
die acetylcholinstimulierte Sekretion von Katecholaminen. Über
Somatostatinrezeptoren in
Großhirnrinde, Mandelkernen, Hippokampus, Basalganglien, Mittelhirn und
medulla oblongata hat es neuromodulatorische Effekte auf Kognition,
Schlaf, Motorik und sensorische Verarbeitung Somatostatin aus dem periventrikulären anterioren Hypothalamus hemmt
die Freisetzung von GH, TSH und ACTH. Im Magen-Darm-Trakt hemmt es die
Sekretion fast aller Hormone sowie die Motilität, in der Niere
Reninsekretion und Vasopressineffekt, in der Nebennierenrinde die
angiotensininduzierte Freisetzung von Aldosteron, im Nebennierenmark
die acetylcholinstimulierte Sekretion von Katecholaminen. Über
Somatostatinrezeptoren in
Großhirnrinde, Mandelkernen, Hippokampus, Basalganglien, Mittelhirn und
medulla oblongata hat es neuromodulatorische Effekte auf Kognition,
Schlaf, Motorik und sensorische Verarbeitung GnRH (Gonadoliberin) aus parvizellulären Neuronen des nucl. arcuatus
wird pulsatil freigesetzt und regt über GPCR-Rezeptoren gonadotrope
Zellen der Adenohypophyse zur Sekretion von LH und FSH an. Ein Puls pro Stunde fördert vor allem die Freisetzung von LH,
ein Puls alle drei Stunden vorwiegend die von FSH. Östradiol in hoher Konzentration hat einen
positiven Feedback-Effekt auf GnRH-Neuronen (präovulatorischer
Gonadotropin-Peak, Ovulation). In der zweiten Zyklushälfte bewirkt
Progesteron eine niedrigere Frequenz (bei höherer Amplitude) der
LH-Pulse. Stress reduziert die GnRH-Pulse, sie können im Hungerzustand
ausbleiben (Neigung zu Amenorrhoe bei anorektischen Personen). Der
hypothalamische GnRH-Pulsgenerator wird in der späten Fetalperiode
aktiv; postpartal wird er bis kurz vor Eintreten der Pubertät inhibiert;
Intensität und Frequenz der GnRH-Pulse nehmen dann zu, insbesondere im
Schlaf GnRH (Gonadoliberin) aus parvizellulären Neuronen des nucl. arcuatus
wird pulsatil freigesetzt und regt über GPCR-Rezeptoren gonadotrope
Zellen der Adenohypophyse zur Sekretion von LH und FSH an. Ein Puls pro Stunde fördert vor allem die Freisetzung von LH,
ein Puls alle drei Stunden vorwiegend die von FSH. Östradiol in hoher Konzentration hat einen
positiven Feedback-Effekt auf GnRH-Neuronen (präovulatorischer
Gonadotropin-Peak, Ovulation). In der zweiten Zyklushälfte bewirkt
Progesteron eine niedrigere Frequenz (bei höherer Amplitude) der
LH-Pulse. Stress reduziert die GnRH-Pulse, sie können im Hungerzustand
ausbleiben (Neigung zu Amenorrhoe bei anorektischen Personen). Der
hypothalamische GnRH-Pulsgenerator wird in der späten Fetalperiode
aktiv; postpartal wird er bis kurz vor Eintreten der Pubertät inhibiert;
Intensität und Frequenz der GnRH-Pulse nehmen dann zu, insbesondere im
Schlaf  Dopamin aus dem nucl. arcuatus hemmt die Prolaktinausschüttung (daher PIH = Prolactin inhibiting hormone) Dopamin aus dem nucl. arcuatus hemmt die Prolaktinausschüttung (daher PIH = Prolactin inhibiting hormone)  TRH (Thyreoliberin) aus kleinzelligen Neuronen in eminentia mediana und
nucleus arcuatus wird pulsatil freigesetzt; die
Sekretion beginnt am Abend zu steigen und ist in den frühen
Morgenstunden am höchsten. Über eigene Rezeptoren regt
es die Freisetzung von TSH an. Seine Freisetzung wird noradrenerg
gefördert und durch Stress, Glucocorticoide, Somatostatin und T3 gehemmt. Im Gehirn wirkt TRH gedächtnisfördernd, antidepressiv,
angsthemmend, antikonvulsiv, durchblutungsfördernd TRH (Thyreoliberin) aus kleinzelligen Neuronen in eminentia mediana und
nucleus arcuatus wird pulsatil freigesetzt; die
Sekretion beginnt am Abend zu steigen und ist in den frühen
Morgenstunden am höchsten. Über eigene Rezeptoren regt
es die Freisetzung von TSH an. Seine Freisetzung wird noradrenerg
gefördert und durch Stress, Glucocorticoide, Somatostatin und T3 gehemmt. Im Gehirn wirkt TRH gedächtnisfördernd, antidepressiv,
angsthemmend, antikonvulsiv, durchblutungsfördernd |
