

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert

 Dendrit: δενδρίτης = verzweigt, von Bäumen abstammend (δένδρον = Baum)
Dendrit: δενδρίτης = verzweigt, von Bäumen abstammend (δένδρον = Baum)| Für die Kommunikation zwischen Nervenzellen verfügt ein erwachsener Mensch über etwa
hundert Billionen (~1014) Synapsen. Ihre
primäre Wirkung ist eine Veränderung des Zustands der nachgeschalteten (postsynaptischen, "empfangenden") Zelle im Sinne einer Verstärkung (inhibitorisches postsynaptisches Potential, IPSP) oder Abschwächung (exzitatorisches postsynaptisches Potential, EPSP) des Membranpotentials: IPSPs erschweren, EPSPs erleichtern die Entstehung eines Aktionspotentials am postsynaptischen Neuron. Das präsynaptische ("sendende") Neuron synthetisiert Neurotransmitter in der Nähe des Zellkerns, transportiert den Transmitter durch den Neurit, speichert ihn in Vesikeln und sezerniert ihn schließlich über Exozytose. Die Exozytose erfolgt mittels vesikulärer Proteinkomplexe des SNARE-Mechanismus (soluble N-ethylmaleimide- sensitive- factor attachment receptor). Transmitter diffundieren über den synaptischen Spaltraum (~20 nm) und binden an postsynaptische Rezeptoren. Dies löst rezeptortypische Folgereaktionen (z.B. Natriumeinstrom und Depolarisation) aus, welche postsynaptische Auswirkungen haben. Je nach Transmitter erfolgt rasche (Millisekundenbereich: Glutamat, GABA, Glycin, Acetylcholin nikotinerg..) oder langsame Übertragung (Sekundenbereich: Katecholamine, Acetylcholin muskarinerg). Kotransmitter bewirken zusätzlich Fazilitation oder Depression (Sekunden- bis Minutenbereich oder länger) sowie Modulation des synaptischen Effekts (Sekunden bis Tage: Neuropeptide). |
 Neurotransmitter
Neurotransmitter  Speicherung, Freisetzung und Recycling, SNARE-Proteine
Speicherung, Freisetzung und Recycling, SNARE-Proteine  Synaptischer Spaltraum
Synaptischer Spaltraum  Postsynaptischer Apparat
Postsynaptischer Apparat  präsynaptische vs. postsynaptische Rezeptoren
präsynaptische vs. postsynaptische Rezeptoren  Neuromodulation
Neuromodulation  Postsynaptisaches Potential und Summation, EPSP und IPSP, Genexpression
Postsynaptisaches Potential und Summation, EPSP und IPSP, Genexpression  Entfernung des Transmitters aus dem synaptischen Spaltraum
Entfernung des Transmitters aus dem synaptischen Spaltraum  Glutamat
Glutamat  GABA
GABA  Glycin
Glycin  Bahnung und Hemmung
Bahnung und Hemmung  Colokalisation und Cotransmission
Colokalisation und Cotransmission  Konvergenz & Divergenz
Konvergenz & Divergenz
 Neurotransmitter
Neurotransmitter  Fazilitation, Depression, Habituation, Augmentation
Fazilitation, Depression, Habituation, Augmentation  Neuromodulation
Neuromodulation  Disinhibition
Disinhibition  Cotransmission
Cotransmission
 Core messages
Core messages Über die Arbeitsweise der Gehirns s. dort
Über die Arbeitsweise der Gehirns s. dort  miteinander verschaltet (Gesamtzahl im Körper ~1014),
wobei eine Nervenzelle auf bis zu ~5.104 andere synaptisch wirken
(Divergenz) und umgekehrt von bis zu ~5.104 anderen synaptisch erreicht werden
kann (Konvergenz).
Je komplexer die Verschaltungsmuster - sowohl zwischen einzelnen Zellen
als auch insgesamt im Verbund, also im Gehirn -, desto größer die
Wahrscheinlichkeit, dass die Aktivität solcher komplexen Systeme
(welche auch Sinnesmeldungen - aus der Umwelt und aus dem Körperinneren
- einbezieht) etwas ergibt, was man als Bewusstsein bezeichnet.
miteinander verschaltet (Gesamtzahl im Körper ~1014),
wobei eine Nervenzelle auf bis zu ~5.104 andere synaptisch wirken
(Divergenz) und umgekehrt von bis zu ~5.104 anderen synaptisch erreicht werden
kann (Konvergenz).
Je komplexer die Verschaltungsmuster - sowohl zwischen einzelnen Zellen
als auch insgesamt im Verbund, also im Gehirn -, desto größer die
Wahrscheinlichkeit, dass die Aktivität solcher komplexen Systeme
(welche auch Sinnesmeldungen - aus der Umwelt und aus dem Körperinneren
- einbezieht) etwas ergibt, was man als Bewusstsein bezeichnet.| Vergleich elektrische - chemische Synapsen Nach Kandel / Koester / Mack / Siegelbaum (eds), Principles of Neural Sciences, 6th ed. 2021 (McGraw Hill) |
||||||
| Typ Synapse |
Abstand prä- post- synaptisch |
Zytoplas- matische Kontinuität? |
Ultra- struktur |
Trans- mission durch |
Synaptische Verzögerung |
Richtung der Übertragung |
| Elektrisch |
4 nm |
ja |
Gap junction- Kanäle |
Ionenstrom |
nein |
meist bidirektional |
| Chemisch |
20-40 nm |
nein |
Vesikel (präsyn.) Rezeptoren (postsyn.) |
chemische Transmitter |
≥0,3 ms (meist 1-5 ms) |
unidirektional ("Einbahn") |
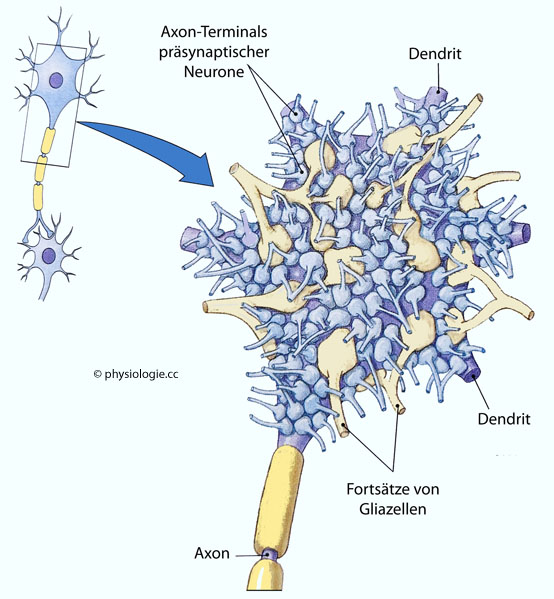
 Abbildung: Soma eines postsynaptischen Neurons
Abbildung: Soma eines postsynaptischen Neurons
 Verpacken des Neurotransmitters in Speichervesikel, die dann an das präsynaptische Terminal docken
Verpacken des Neurotransmitters in Speichervesikel, die dann an das präsynaptische Terminal docken Depolarisierung der präsynaptischen Membran (eintreffendes Aktionspotential)
Depolarisierung der präsynaptischen Membran (eintreffendes Aktionspotential) Öffnung spannungsabhängiger Calciumkanäle, Einströmen von Ca++ in das präsynaptische Terminal
Öffnung spannungsabhängiger Calciumkanäle, Einströmen von Ca++ in das präsynaptische Terminal Fusion einiger Vesikel mit der präsynaptischen Membran (Synaptotagmine), Steigerung der Transmitterfreisetzung um einen Faktor ~105
Fusion einiger Vesikel mit der präsynaptischen Membran (Synaptotagmine), Steigerung der Transmitterfreisetzung um einen Faktor ~105 Diffusion des Transmitters zur postsynaptischen Membran
Diffusion des Transmitters zur postsynaptischen Membran Anlagerung einiger Transmittermoleküle an Rezeptoren, postsynaptische Reaktion (Öffnung von Ionenkanälen, Aktivierung von G-Proteinen,..)
Anlagerung einiger Transmittermoleküle an Rezeptoren, postsynaptische Reaktion (Öffnung von Ionenkanälen, Aktivierung von G-Proteinen,..) Transmitter wird enzymatisch abgebaut, wieder aufgenommen, oder abtransportiert
Transmitter wird enzymatisch abgebaut, wieder aufgenommen, oder abtransportiert
 Abbildung: Synaptische Verschaltungen
Abbildung: Synaptische Verschaltungen
 Indem er als junger Forscher ein Kapitel für ein Physiologie-Lehrbuch verfasste, führte der britische Neurophysiologe Charles S. Sherrington den
Begriff "Synapse" in die Neurowissenschaften ein. Sherrington, der
später als "Philosoph des Nervensystems" galt, erhielt zusammen mit dem britischen Elektrophysiologen
Edgar D. Adrian
1932 den Nobelpreis für Physiologie oder Medizin "für ihre Entdeckungen
auf dem Gebiet der Funktion der Neuronen". Adrian erforschte vor allem
die Elektrophysiologie von Sinnesorganen.
Indem er als junger Forscher ein Kapitel für ein Physiologie-Lehrbuch verfasste, führte der britische Neurophysiologe Charles S. Sherrington den
Begriff "Synapse" in die Neurowissenschaften ein. Sherrington, der
später als "Philosoph des Nervensystems" galt, erhielt zusammen mit dem britischen Elektrophysiologen
Edgar D. Adrian
1932 den Nobelpreis für Physiologie oder Medizin "für ihre Entdeckungen
auf dem Gebiet der Funktion der Neuronen". Adrian erforschte vor allem
die Elektrophysiologie von Sinnesorganen. wirken typischerweise mehr
als 100 Synapsen.
wirken typischerweise mehr
als 100 Synapsen. Über Dendriten s. dort
Über Dendriten s. dort  Abbildung). Dort diffundiert der Transmitterstoff ca. 20 nm zur postsynaptischen Membran.
Abbildung). Dort diffundiert der Transmitterstoff ca. 20 nm zur postsynaptischen Membran.
 Abbildung: Sequenz der Signalübermittlung an einer chemischen Synapse
Abbildung: Sequenz der Signalübermittlung an einer chemischen Synapse
 Die Aktivierung chemischer Synapsen verändert die Leitfähigkeit ihrer postsynaptischen Membran für monovalente Ionen (Na+, K+, Cl-) und verändert das Membranpotential dementsprechend (Depolarisierung / Hyperpolarisierung).
Die Aktivierung chemischer Synapsen verändert die Leitfähigkeit ihrer postsynaptischen Membran für monovalente Ionen (Na+, K+, Cl-) und verändert das Membranpotential dementsprechend (Depolarisierung / Hyperpolarisierung).  Abbildung).
Abbildung). 
 Abbildung: Neurotransmitter öffnen postsynaptische Ionenkanäle direkt oder indirekt
Abbildung: Neurotransmitter öffnen postsynaptische Ionenkanäle direkt oder indirekt
 Abbildung zeigt die unterschiedliche Struktur und Wirkungsweise der Rezeptoren: Während das direkte Gating über solche läuft, die auch ein Ionenkanal sind (ionotrop)
und sehr rasche Effekte bewirken (Millisekunden - geeignet für
blitzartige Aktion, z.B. im Rahmen von Muskelspindelreflexen),
funktioniert das indirekte Gating über metabotrope
Rezeptoren - die Ionenkanäle werden indirekt, oft über Proteinkinase A
aktiviert. Letztere haben verzögerte, langsamere und länger wirkende
Effekte zur Folge, z.B. bei Verstärkungsfunktionen im Rahmen von Lernvorgängen.
Abbildung zeigt die unterschiedliche Struktur und Wirkungsweise der Rezeptoren: Während das direkte Gating über solche läuft, die auch ein Ionenkanal sind (ionotrop)
und sehr rasche Effekte bewirken (Millisekunden - geeignet für
blitzartige Aktion, z.B. im Rahmen von Muskelspindelreflexen),
funktioniert das indirekte Gating über metabotrope
Rezeptoren - die Ionenkanäle werden indirekt, oft über Proteinkinase A
aktiviert. Letztere haben verzögerte, langsamere und länger wirkende
Effekte zur Folge, z.B. bei Verstärkungsfunktionen im Rahmen von Lernvorgängen.
 Abbildung: Synapsen im ZNS
Abbildung: Synapsen im ZNS
 Neurotransmitter
sind von Nervenzellen - üblicherweise aus Speichervesikeln -
freigesetzte Signalstoffe. Ein Neurotransmitter muss folgende Kriterien
erfüllen, um als solcher qualifiziert zu gelten: (1) Er muss präsynaptisch synthetisiert werden, (2) entsprechende Stimulation des Nerven muss ihn freisetzen, (3) seine synaptische Mikroapplikation muss den Effekt einer Nervenreizung zumindest teilweise nachahmen, und (4) seine Wirkung muss pharmakologisch blockierbar sein.
Neurotransmitter
sind von Nervenzellen - üblicherweise aus Speichervesikeln -
freigesetzte Signalstoffe. Ein Neurotransmitter muss folgende Kriterien
erfüllen, um als solcher qualifiziert zu gelten: (1) Er muss präsynaptisch synthetisiert werden, (2) entsprechende Stimulation des Nerven muss ihn freisetzen, (3) seine synaptische Mikroapplikation muss den Effekt einer Nervenreizung zumindest teilweise nachahmen, und (4) seine Wirkung muss pharmakologisch blockierbar sein.  Neurotransmitter sind mehreren
Stoffklassen zuzuordnen: Aminosäuren, Amine und Neuropeptide. Dazu kommen Cotransmitter wie Purine, NO,
Eikosanoide.
Neurotransmitter sind mehreren
Stoffklassen zuzuordnen: Aminosäuren, Amine und Neuropeptide. Dazu kommen Cotransmitter wie Purine, NO,
Eikosanoide. Häufig vorkommende Neurotransmitter Nach Liqun Luo, Principles of Neurobiology, 2nd ed. CRC Press 2021 (erweitert) |
||
| Neurotransmitter |
Vorkommen |
Cotransmission |
| Acetylcholin |
Motorische Neurone zu Muskeln; Neurone im autonomen Nervensystem; exzitatorische / modulatorische Neurone im ZNS |
VIP Substanz P |
| Glutamat |
Mehrzahl der exzitatorischen Neurone im ZNS; meiste sensorische Neurone |
|
| GABA |
Meiste inhibitorische Neurone im ZNS | Somatostatin Cholecystokinin Neuropeptid Y |
| Glycin |
Einige inhibitorische Neurone (hauptsächlich in Hirnstamm und Rückenmark) |
|
| Serotonin (5-HT) |
Modulatorische Neurone im ZNS; Neurone im Gastrointestinaltrakt |
Substanz P TRH Enkephaline |
| Dopamin |
Modulatorische Neurone im ZNS | Cholecystokinin Neurotensin GLP-1 |
| Noradrenalin |
Modulatorische Neurone im ZNS; autonom-nervöse Neurone |
Galanin Enkephaline Neuropeptid Y |
| Histamin |
Modulatorische Neurone im ZNS | |
| ATP, Adenosin |
Einige sensorische und ZNS-Neurone |
|
| Neuropeptide |
Exzitatorische, inhibitorische, modulatorische Neurone (Cotransmission); neurosekretorische Zellen |
Mit Katecholaminen, Acetylcholin, GABA, Serotonin, Oxytocin, Vasopressin |
 Anreicherung bis zum 105-fachen der Konzentration im
Zytoplasma,
Anreicherung bis zum 105-fachen der Konzentration im
Zytoplasma, Schutz vor Abbau,
Schutz vor Abbau, Reserve für die synaptische
Aktivität.
Reserve für die synaptische
Aktivität. Wie
gelangen die im Soma der Nervenzelle gebildeten Vesikel (auch
Mitochondrien) in die Peripherie (das Axon-Terminal kann bis zu ca.
einen Meter entfernt sein)? Diese Aufgabe übernehmen Mikrotubuli im
Axonfortsatz (schneller axonaler Transport bewältigt 0,4 m in 24 Stunden).
Wie
gelangen die im Soma der Nervenzelle gebildeten Vesikel (auch
Mitochondrien) in die Peripherie (das Axon-Terminal kann bis zu ca.
einen Meter entfernt sein)? Diese Aufgabe übernehmen Mikrotubuli im
Axonfortsatz (schneller axonaler Transport bewältigt 0,4 m in 24 Stunden). Die Mehrzahl der präsynaptischen Vesikel hat einen Durchmesser von ~40 nm,
sie speichern kleine Nichtpeptide wie Glutamat, GABA, Acetylcholin. Diese Vesikel finden sich in der Nähe von aktiven Zonen und erscheinen
elektronenmikroskopisch "leer" (clear / small vesicles). Ihre Wirkung beschränkt sich auf klar begrenzte synaptische Strukturen.
Die Mehrzahl der präsynaptischen Vesikel hat einen Durchmesser von ~40 nm,
sie speichern kleine Nichtpeptide wie Glutamat, GABA, Acetylcholin. Diese Vesikel finden sich in der Nähe von aktiven Zonen und erscheinen
elektronenmikroskopisch "leer" (clear / small vesicles). Ihre Wirkung beschränkt sich auf klar begrenzte synaptische Strukturen. Einige Vesikel sind größer (70-250 nm Durchmesser: large dense-core vesicles,
homolog sekretorischen Granula von Nicht-Nervenzellen), gleichen sekretorischen Granula in endokrinen Zellen (dense-core secretory granules) und enthalten Neuropeptide, die aus Vorstufen synthetisiert und zusammen mit anderen Proteinen in das
Trans-Golgi-Netzwerk gebracht werden. Aus diesem separieren sich Vesikel, und diese werden vom Soma zu
präsynaptischen Zielen transportiert. Kleinmolekulare Transmitter und andere neuroaktive Moleküle (Cotransmitter) können zusammen mit dem Neuropeptid in dense-core-Vesikeln gespeichert und zusammen mit diesem freigesetzt werden.
Einige Vesikel sind größer (70-250 nm Durchmesser: large dense-core vesicles,
homolog sekretorischen Granula von Nicht-Nervenzellen), gleichen sekretorischen Granula in endokrinen Zellen (dense-core secretory granules) und enthalten Neuropeptide, die aus Vorstufen synthetisiert und zusammen mit anderen Proteinen in das
Trans-Golgi-Netzwerk gebracht werden. Aus diesem separieren sich Vesikel, und diese werden vom Soma zu
präsynaptischen Zielen transportiert. Kleinmolekulare Transmitter und andere neuroaktive Moleküle (Cotransmitter) können zusammen mit dem Neuropeptid in dense-core-Vesikeln gespeichert und zusammen mit diesem freigesetzt werden.  Abbildung).
Abbildung).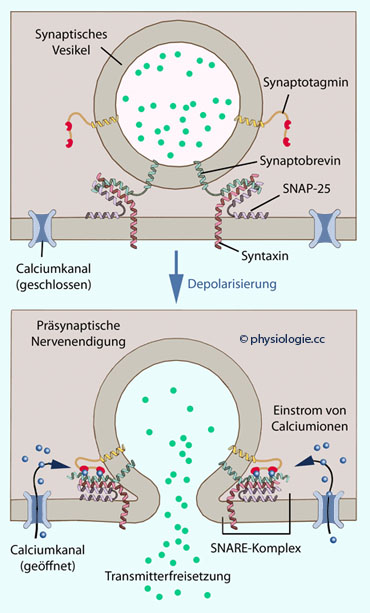
 Abbildung: Mechanismus der Neurotransmitterfreigabe aus präsynaptischen Vesikeln
Abbildung: Mechanismus der Neurotransmitterfreigabe aus präsynaptischen Vesikeln
| An der Fusion transmitterspeichernder Vesikel mit der präsynaptischen Membran sind SNARE-Komplexe beteiligt |
 Synaptotagmine (SYTs), vesikelgebundene Proteine, die Ca++ binden können und als Calciumsensoren wirken. Sie wirken als intrazellulärer Ca++-Sensor für die Exozytose.
Diese Poteine verhindern im Ruhezustand (niedrige zytoplasmatische
Calciumkonzentration) die Verschmelzung von Vesikeln mit der
präsynaptischen Membran und werden durch Calciumionen
aktiviert, was dann die Freisetzung des Transmitters triggert
Synaptotagmine (SYTs), vesikelgebundene Proteine, die Ca++ binden können und als Calciumsensoren wirken. Sie wirken als intrazellulärer Ca++-Sensor für die Exozytose.
Diese Poteine verhindern im Ruhezustand (niedrige zytoplasmatische
Calciumkonzentration) die Verschmelzung von Vesikeln mit der
präsynaptischen Membran und werden durch Calciumionen
aktiviert, was dann die Freisetzung des Transmitters triggert Synaptobrevine (=VAMP: vesicle-associated membrane proteins),
Schlüsselproteine für die Membranfusion im Rahmen der Exozytose. Sie
erleichtern die Fusion der Vesikel mit der präsynaptischen Membran
Synaptobrevine (=VAMP: vesicle-associated membrane proteins),
Schlüsselproteine für die Membranfusion im Rahmen der Exozytose. Sie
erleichtern die Fusion der Vesikel mit der präsynaptischen Membran Syntaxine
in der inneren Zellmembran, die Synaptotagmine und Synaptobrevine
binden können und wahrscheinlich einen Teil der exozytotischen
Fusionsporen bilden
Syntaxine
in der inneren Zellmembran, die Synaptotagmine und Synaptobrevine
binden können und wahrscheinlich einen Teil der exozytotischen
Fusionsporen bilden SNAP-25 (SNAp REceptors - SNAP = synaptosomal-associated protein),
das bei Aktivierung (durch allosterische Veränderung des
Synaptotagmins) zusammen mit Synaptobrevin und Syntaxin den
SNARE-Komplex bildet, der bei der Membranfusion / Exozytose eine essentielle Rolle spielt
SNAP-25 (SNAp REceptors - SNAP = synaptosomal-associated protein),
das bei Aktivierung (durch allosterische Veränderung des
Synaptotagmins) zusammen mit Synaptobrevin und Syntaxin den
SNARE-Komplex bildet, der bei der Membranfusion / Exozytose eine essentielle Rolle spielt Synapsin (stellt die
Nähe des Vesikels zur aktiven Zone sicher)
Synapsin (stellt die
Nähe des Vesikels zur aktiven Zone sicher) Rab3 (eine GTPase).
Rab3 (eine GTPase).
 Abbildung: Organisation einer präsynaptischen Endigung (presynaptic terminal)
Abbildung: Organisation einer präsynaptischen Endigung (presynaptic terminal) Aktive Zonen (
Aktive Zonen ( Abbildung) sind
Teile der präsynaptischen Membran, mit denen Vesikel fusionieren und
hier ihren Inhalt (Transmitter) in den synaptischen Spaltraum
freisetzen. Sie liegen rezeptorbeladenen postsynaptischen
Membranflächen direkt gegenüber. Die meisten Synapsen im ZNS weisen nur
wenige aktive Zonen auf (oft nur eine, manchmal bis zu 20).
Abbildung) sind
Teile der präsynaptischen Membran, mit denen Vesikel fusionieren und
hier ihren Inhalt (Transmitter) in den synaptischen Spaltraum
freisetzen. Sie liegen rezeptorbeladenen postsynaptischen
Membranflächen direkt gegenüber. Die meisten Synapsen im ZNS weisen nur
wenige aktive Zonen auf (oft nur eine, manchmal bis zu 20).  Abbildung)
spielt eine zentrale Rolle bei dem Mechanismus, der die Exozytose
organisiert: Es bindet und aktiviert t-SNAREs (Membranproteine)
und fixiert gleichzeitig das v-SNARE Synaptobrevin (Vesikel) an die
Stelle, wo der Transmitter in den synaptischen Spalt abgegeben werden
soll. Zwei weitere Komponenten der aktiven Zone sind RIM (Rab3-interacting molecule) und RIM-BP (RIM-bindung protein).
RIM bindet die GTPase Rab3 und befördert synaptische Vesikel in die
Nähe spannungssensitiver Calciumkanäle der präsynaptischen
Membran.
Abbildung)
spielt eine zentrale Rolle bei dem Mechanismus, der die Exozytose
organisiert: Es bindet und aktiviert t-SNAREs (Membranproteine)
und fixiert gleichzeitig das v-SNARE Synaptobrevin (Vesikel) an die
Stelle, wo der Transmitter in den synaptischen Spalt abgegeben werden
soll. Zwei weitere Komponenten der aktiven Zone sind RIM (Rab3-interacting molecule) und RIM-BP (RIM-bindung protein).
RIM bindet die GTPase Rab3 und befördert synaptische Vesikel in die
Nähe spannungssensitiver Calciumkanäle der präsynaptischen
Membran.  Neurotoxine hemmen die Exozytose (vor allem an der motorischen Endplatte) durch Spaltung von SNARE-Proteinen (Botulinumtoxine A und E → SNAP-25, Botulinumtoxin B → Synaptobrevin). Das Clostridiengift Botulinumtoxin (Botox) kann therapeutisch verwendet werden, z.B. um Muskelkrämpfen gegenzuwirken (i.m. Injektion bei Spasmen).
Neurotoxine hemmen die Exozytose (vor allem an der motorischen Endplatte) durch Spaltung von SNARE-Proteinen (Botulinumtoxine A und E → SNAP-25, Botulinumtoxin B → Synaptobrevin). Das Clostridiengift Botulinumtoxin (Botox) kann therapeutisch verwendet werden, z.B. um Muskelkrämpfen gegenzuwirken (i.m. Injektion bei Spasmen). | Die präsynaptische Freisetzung von Acetylcholin wird durch Botulinumtoxin spezifisch gehemmt |
| Tetanustoxin spaltet Synaptobrevin und verhindert die Glycin-Freisetzung an Renshaw-Zellen |
 Jedes
Aktionspotential führt zur Entleerung von einigen hundert Vesikeln, was
die Freisetzung von einigen zehntausend Transmittermolekülen bedeutet.
Der freigesetzte Transmitter wird anschließend z.T. wiederaufgenommen,
z.T. wird neu synthetisierter Transmitter aus dem Soma nachgeliefert (axonaler Transport).
Jedes
Aktionspotential führt zur Entleerung von einigen hundert Vesikeln, was
die Freisetzung von einigen zehntausend Transmittermolekülen bedeutet.
Der freigesetzte Transmitter wird anschließend z.T. wiederaufgenommen,
z.T. wird neu synthetisierter Transmitter aus dem Soma nachgeliefert (axonaler Transport).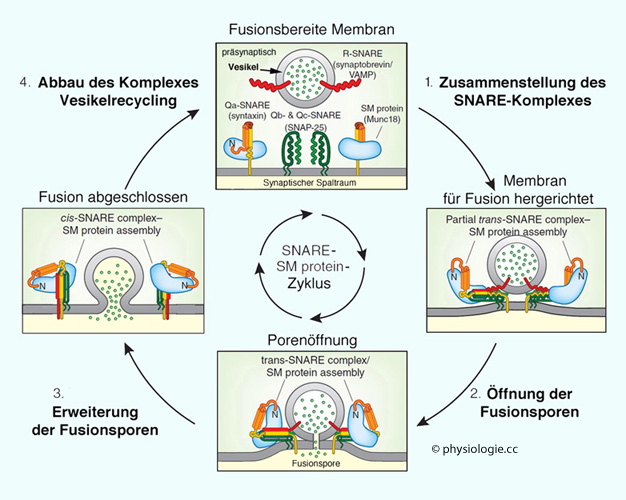
 Abbildung: Modell des SNARE-Mechanismus bei synaptischer Vesikelfusion
Abbildung: Modell des SNARE-Mechanismus bei synaptischer Vesikelfusion
 Abbildung). Ca++-Ionen aktivieren über Calmodulin und eine Proteinkinase
Synapsine - mit dem Zytoskelett
verbundene Membranproteine, welche die Stabilität der Vesikel steuern
-, was weitere Vesikel für die Transmitterfreigabe vorbereitet.
Abbildung). Ca++-Ionen aktivieren über Calmodulin und eine Proteinkinase
Synapsine - mit dem Zytoskelett
verbundene Membranproteine, welche die Stabilität der Vesikel steuern
-, was weitere Vesikel für die Transmitterfreigabe vorbereitet. 
 Abbildung: Zyklus der synaptischen Vesikel
Abbildung: Zyklus der synaptischen Vesikel
 Abbildung).
Dabei
wird nur ein Teil der im Vesikel gespeicherten Transmittermenge an den
Extrazellulärraum freigegeben. Dies
spart aber Stoffwechselenergie, weil das Vesikel mehrfach
hintereinander zum Einsatz kommt, ohne remodifiziert zu werden. Vor
allem geht nur ein kleiner Anteil der Bestandteile der
Vesikelmembran an die präsynaptische Zellmembran verloren.
Abbildung).
Dabei
wird nur ein Teil der im Vesikel gespeicherten Transmittermenge an den
Extrazellulärraum freigegeben. Dies
spart aber Stoffwechselenergie, weil das Vesikel mehrfach
hintereinander zum Einsatz kommt, ohne remodifiziert zu werden. Vor
allem geht nur ein kleiner Anteil der Bestandteile der
Vesikelmembran an die präsynaptische Zellmembran verloren. Abbildung).
Cadherine binden an Cadherin (homophile Bindung).
Abbildung).
Cadherine binden an Cadherin (homophile Bindung).
 Abbildung: Synaptische Molekülnetze
Abbildung: Synaptische Molekülnetze
 BAR, hochkonservierte Proteindomäne
BAR, hochkonservierte Proteindomäne
 CaCh, Ca++-Kanal
CaCh, Ca++-Kanal
 CaMKII, calcium/calmodulin-dependent protein kinase II; an Lern- und Gedächtnisprozessen beteiligte serin / threoninspezifische Kinase
CaMKII, calcium/calmodulin-dependent protein kinase II; an Lern- und Gedächtnisprozessen beteiligte serin / threoninspezifische Kinase
 CASK, ein Membranprotein (calcium / calmodulin dependent serin protein kinase)
CASK, ein Membranprotein (calcium / calmodulin dependent serin protein kinase)  CRIPT, cysteine-rich PDZ-binding protein; interagiert mit Synapsenproteinen
CRIPT, cysteine-rich PDZ-binding protein; interagiert mit Synapsenproteinen  EphR, Adrenalinrezeptor
EphR, Adrenalinrezeptor
 GKAP, guanylate kinase-associated protein; an der Errichtung postsynaptischer Verbindungen beteiligt
GKAP, guanylate kinase-associated protein; an der Errichtung postsynaptischer Verbindungen beteiligt
 GRASP, GRIP-associated protein
GRASP, GRIP-associated protein
 GRIP, glutamate receptor interacting protein, Adaptermolekül für zellulären Transport
GRIP, glutamate receptor interacting protein, Adaptermolekül für zellulären Transport  IP3R, Inositol-1,4,5-trisphosphat-Rezeptor
IP3R, Inositol-1,4,5-trisphosphat-Rezeptor
 KCh, K+-Kanal
KCh, K+-Kanal
 MAP1A, microtubule-associated protein 1A, wichtig für Neurogenese
MAP1A, microtubule-associated protein 1A, wichtig für Neurogenese
 L27, Protein-Bindedomäne
L27, Protein-Bindedomäne
 mGluR, metabotroper Glutamatrezeptor
mGluR, metabotroper Glutamatrezeptor
 nNOS, neuronale NO-Synthase
nNOS, neuronale NO-Synthase
 NMDAR, N-Methyl-D-Aspartat-Rezeptor (Glutamatrezeptor)
NMDAR, N-Methyl-D-Aspartat-Rezeptor (Glutamatrezeptor)
 PDZ, PDZ-Bindemotiv, mit anderen Proteinen interagierender Proteinteil (Proteininteraktionsdomäne)
PDZ, PDZ-Bindemotiv, mit anderen Proteinen interagierender Proteinteil (Proteininteraktionsdomäne)
 PICK1, protein interacting with PRKCA1, Adapterprotein
PICK1, protein interacting with PRKCA1, Adapterprotein
 SER, glattes endoplasmastisches Retikulum
SER, glattes endoplasmastisches Retikulum
 SH3, Interaktionen vermittelnde Proteindomäne
SH3, Interaktionen vermittelnde Proteindomäne
 SPAR, spine-associated RAPGA
SPAR, spine-associated RAPGA
 SV, synaptisches Vesikel
SV, synaptisches Vesikel
 SYNGAP, synaptic Ras GTPase-activating protein, an synaptischer Plastizität beteiligt
SYNGAP, synaptic Ras GTPase-activating protein, an synaptischer Plastizität beteiligt
 TIAM1, T-cell lymphoma invasion and metastasis -inducing protein 1, verknüpft extrazelluläre Signale mit Aktivitäten im Zytoskelett
TIAM1, T-cell lymphoma invasion and metastasis -inducing protein 1, verknüpft extrazelluläre Signale mit Aktivitäten im Zytoskelett
 TRAP, C-terminal receptor-binding region
TRAP, C-terminal receptor-binding region
 Abbildung zeigt die postsynaptischen Wirkungsmechanismen, welche Neurotransmitter am postsynaptischen Neuron auslösen können:
Abbildung zeigt die postsynaptischen Wirkungsmechanismen, welche Neurotransmitter am postsynaptischen Neuron auslösen können: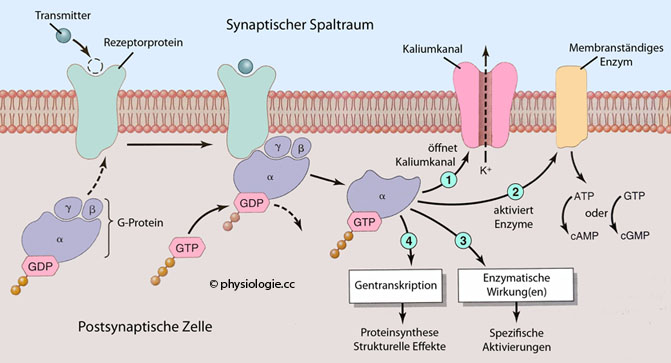
 Abbildung: Postsynaptische Reaktionen auf die Bindung eines Neurotransmitters
Abbildung: Postsynaptische Reaktionen auf die Bindung eines Neurotransmitters
 Für Glutamat (ionotrop) NMDA, AMPA, Kainat, (metabotrop) mGluR1 bis mGluR6
Für Glutamat (ionotrop) NMDA, AMPA, Kainat, (metabotrop) mGluR1 bis mGluR6
 Für GABA GABAA und GABAB
Für GABA GABAA und GABAB
 Für Acetylcholin muskarinerge (M1 bis M5) und nikotinerge (Muskel, neuronal: α-Bungarotoxin-insensitiv)
Für Acetylcholin muskarinerge (M1 bis M5) und nikotinerge (Muskel, neuronal: α-Bungarotoxin-insensitiv)
 Für Dopamin D1 bis D5
Für Dopamin D1 bis D5
 Für Adrenalin / Noradrenalin α1A bis α1C, α2A bis α2D, ß1 bis ß3
Für Adrenalin / Noradrenalin α1A bis α1C, α2A bis α2D, ß1 bis ß3
 Für Serotonin 5-HT1A bis 5-HT1F, 5-HT2A bis 5-HT2C, 5-HT3 bis 5-HT7
Für Serotonin 5-HT1A bis 5-HT1F, 5-HT2A bis 5-HT2C, 5-HT3 bis 5-HT7
 Für Histamin H1 bis H4
Für Histamin H1 bis H4
 Für Opioide µ1 bis µ3, δ1, δ2, κ1 bis κ3
Für Opioide µ1 bis µ3, δ1, δ2, κ1 bis κ3
 Für Endocannabinoide CB1 (Gehirn) und CB2 (Körperperipherie)
Für Endocannabinoide CB1 (Gehirn) und CB2 (Körperperipherie) Genaue Kenntnis der Rezeptorverteilungen hat
große pharmakologische Bedeutung, da spezifisches Ansprechen bestimmter
Rezeptor-Subtypen wesentlich verfeinerte therapeutische Effekte
ermöglicht.
Genaue Kenntnis der Rezeptorverteilungen hat
große pharmakologische Bedeutung, da spezifisches Ansprechen bestimmter
Rezeptor-Subtypen wesentlich verfeinerte therapeutische Effekte
ermöglicht.  Diffusion und damit das Absinken der Transmitterkonzentration
Diffusion und damit das Absinken der Transmitterkonzentration Enzymatischer Abbau im Bereich des synaptischen Spalts
Enzymatischer Abbau im Bereich des synaptischen Spalts
 Na+-Gradient-abhängige Aufnahme in den präsynaptischen Neuritenfortsatz (reuptake, recycling) bzw. in benachbarte Gliazellen
Na+-Gradient-abhängige Aufnahme in den präsynaptischen Neuritenfortsatz (reuptake, recycling) bzw. in benachbarte Gliazellen  (
( Abbildung unten).
Abbildung unten).  Praktisch alle Stufen des synaptischen Wirkmechanismus können chemisch beeinflusst werden (Neuropharmaka, Neurotoxine):
Praktisch alle Stufen des synaptischen Wirkmechanismus können chemisch beeinflusst werden (Neuropharmaka, Neurotoxine):  Aufnahmesysteme der Zellmembran (Aufnahme von Transmittervorstufen, Wiederaufnahme fertigen Transmitters)
Aufnahmesysteme der Zellmembran (Aufnahme von Transmittervorstufen, Wiederaufnahme fertigen Transmitters) Natriumkanäle (die Erregbarkeit der Nervenzelle kann durch Lokalanästhetika - oder, spezifischer auf Na+-Kanäle, durch Tetrodotoxin - unterbrochen werden)
Natriumkanäle (die Erregbarkeit der Nervenzelle kann durch Lokalanästhetika - oder, spezifischer auf Na+-Kanäle, durch Tetrodotoxin - unterbrochen werden) Calciumkanäle (Angriffspunkt z.B. von Tetanusroxin, Botulinustoxin)
Calciumkanäle (Angriffspunkt z.B. von Tetanusroxin, Botulinustoxin) Synthese- und Abbauenzyme
Synthese- und Abbauenzyme posttranslationale Reifung, axonaler Transport
posttranslationale Reifung, axonaler Transport vesikuläre Speicherung
vesikuläre Speicherung Rezeptoren (präsynaptisch, postsynaptisch, unterschiedliche Rezeptortypen)
Rezeptoren (präsynaptisch, postsynaptisch, unterschiedliche Rezeptortypen) Fazilitation bedeutet eine kurzfristige (10-100 Millisekunden) Erhöhung, Depression
eine Erniedrigung der synaptischen Wirkung nach hochfrequenter Reizung
des betreffenden Synapsensystems. Habituation ist eine allmähliche Abschwächung im Rahmen andauernder relativ schwacher (niedrigfrequenter) Reizung.
Fazilitation bedeutet eine kurzfristige (10-100 Millisekunden) Erhöhung, Depression
eine Erniedrigung der synaptischen Wirkung nach hochfrequenter Reizung
des betreffenden Synapsensystems. Habituation ist eine allmähliche Abschwächung im Rahmen andauernder relativ schwacher (niedrigfrequenter) Reizung. Zu posttetanischer Potenzierung und synaptischer Plastizität s. auch dort
Zu posttetanischer Potenzierung und synaptischer Plastizität s. auch dort Zu Neuromodulation s. unten
Zu Neuromodulation s. unten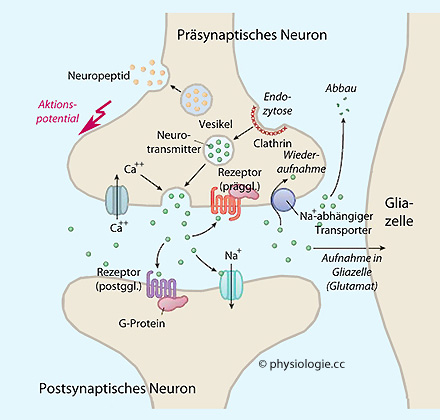
 Abbildung: Freisetzung, Wirkung und Inaktivierung von Neurotransmittern
Abbildung: Freisetzung, Wirkung und Inaktivierung von Neurotransmittern
 Abbildung).
Abbildung).
 Abbildung: Wirkung eines Neurotransmitters an präsynaptischen Rezeptoren
Abbildung: Wirkung eines Neurotransmitters an präsynaptischen Rezeptoren
 Ionotrope Rezeptoren - z.B. nikotinartige cholinerge Rezeptoren - beeinflussen über die Permeabilität von Ionen direkt das Membranpotential und finden sich üblicherweise in der postsynaptischen Membran. Sie wirken
rasch (Millisekunden) - begrenzt auf ihr unmittelbares Umfeld - entweder de- (EPSP: exzitatorisch) oder hyperpolarisierend (IPSP: inhibitorisch).
Ionotrope Rezeptoren - z.B. nikotinartige cholinerge Rezeptoren - beeinflussen über die Permeabilität von Ionen direkt das Membranpotential und finden sich üblicherweise in der postsynaptischen Membran. Sie wirken
rasch (Millisekunden) - begrenzt auf ihr unmittelbares Umfeld - entweder de- (EPSP: exzitatorisch) oder hyperpolarisierend (IPSP: inhibitorisch).  Metabotrope Rezeptoren - etwa 80% aller Neurotransmitter und Neurohormone - wirken über G-Proteine auf intrazelluläre second-messenger-Mechanismen und funktionieren etwas
langsamer (Sekunden). Sie bilden Botenstoffe, die durch
Diffusion auch in einiger Entfernung vom aktivierten Rezeptor und
unterschiedliche Ionenkanäle beeinflussen können. Oft wirken sie auf die präsynaptische Neuronenendigung und modulieren dort die Freisetzung des Neurotransmitters. So kann z.B. der präsynaptische Einstrom von Ca++
direkt oder indirekt beeinflusst und damit die synaptische Intensität
gesteuert werden.
Metabotrope Rezeptoren - etwa 80% aller Neurotransmitter und Neurohormone - wirken über G-Proteine auf intrazelluläre second-messenger-Mechanismen und funktionieren etwas
langsamer (Sekunden). Sie bilden Botenstoffe, die durch
Diffusion auch in einiger Entfernung vom aktivierten Rezeptor und
unterschiedliche Ionenkanäle beeinflussen können. Oft wirken sie auf die präsynaptische Neuronenendigung und modulieren dort die Freisetzung des Neurotransmitters. So kann z.B. der präsynaptische Einstrom von Ca++
direkt oder indirekt beeinflusst und damit die synaptische Intensität
gesteuert werden. 
 Abbildung: Wirkung von Noradrenalin auf präsynaptische Calciumkanäle
Abbildung: Wirkung von Noradrenalin auf präsynaptische Calciumkanäle
 Abbildung
zeigt das Beispiel der Selbsthemmung adrenerger Synapsen durch Senkung
des Calciumeinstroms durch freigesetztes Noradrenalin. So können
präsynaptische Nervenendigungen bei anhaltender Aktivität (hoher
Aktionspotentialfrequenz) durch negatives Feedback die eigene Freisetzung ihres Neurotransmitters reduzieren - eine synaptische Kurzzeit-Plastizität.
Abbildung
zeigt das Beispiel der Selbsthemmung adrenerger Synapsen durch Senkung
des Calciumeinstroms durch freigesetztes Noradrenalin. So können
präsynaptische Nervenendigungen bei anhaltender Aktivität (hoher
Aktionspotentialfrequenz) durch negatives Feedback die eigene Freisetzung ihres Neurotransmitters reduzieren - eine synaptische Kurzzeit-Plastizität. Abbildung). So sind sowohl Bahnungs- als auch Hemmeffekte möglich, welche die Synapsenaktivität beeinflussen - je nach Art des Neurotransmitters, der involvierten Rezeptoren, Signalwege und Effektoren (z.B. Enzyme) in der Zielzelle.
Abbildung). So sind sowohl Bahnungs- als auch Hemmeffekte möglich, welche die Synapsenaktivität beeinflussen - je nach Art des Neurotransmitters, der involvierten Rezeptoren, Signalwege und Effektoren (z.B. Enzyme) in der Zielzelle. 
 Abbildung: Präsynaptische Bahnung und Hemmung
Abbildung: Präsynaptische Bahnung und Hemmung
 Abbildung). Dadurch steuern sie - an Dendriten,
Soma, oder Axon - mehrere Größen (Membranwiderstand, Längskonstante, Ruhepotential, Schwellenpotential, Aktionspotentialdauer).
Abbildung). Dadurch steuern sie - an Dendriten,
Soma, oder Axon - mehrere Größen (Membranwiderstand, Längskonstante, Ruhepotential, Schwellenpotential, Aktionspotentialdauer).  Transmitter, die in der Peripherie des - den Neuromodulator
produzierenden - Axons synthetisiert oder wiederverwendet und in
Vesikeln gespeichert werden, wie Monoamine (Noradrenalin, Dopamin, Serotonin, Histamin) und Acetylcholin; oder
Transmitter, die in der Peripherie des - den Neuromodulator
produzierenden - Axons synthetisiert oder wiederverwendet und in
Vesikeln gespeichert werden, wie Monoamine (Noradrenalin, Dopamin, Serotonin, Histamin) und Acetylcholin; oder  Neuropeptide (mehr als einhundert sind bekannt) mit 2 bis 50 Aminosäuren, z.B. CCK, α-MSH, NPY, AgRP). Diese werden im Soma der Nervenzelle synthetisiert (nahe an Zellkern und endoplasmatischem Retikulum) und anschließend zum synaptischen Terminal transportiert.
Neuropeptide (mehr als einhundert sind bekannt) mit 2 bis 50 Aminosäuren, z.B. CCK, α-MSH, NPY, AgRP). Diese werden im Soma der Nervenzelle synthetisiert (nahe an Zellkern und endoplasmatischem Retikulum) und anschließend zum synaptischen Terminal transportiert.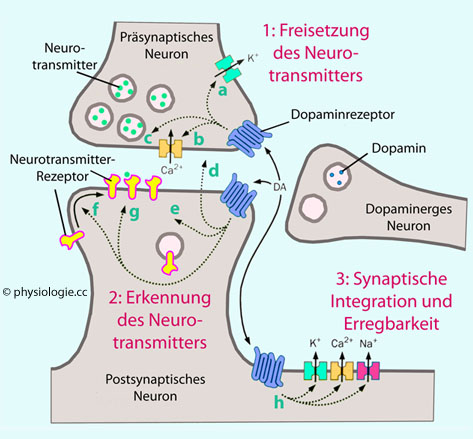
 Abbildung: Wirkung von Neuromodulatoren auf Zielneurone
Abbildung: Wirkung von Neuromodulatoren auf Zielneurone (Neuro-) Modulation ist die Abänderung neuronaler Aktivität durch Wirkung eines Neuromodulators, meist über metabotrope - G-Protein-gekoppelte und daher langsamer wirkende - Rezeptoren (GPCRs) an ihren Zielzellen. Diese können sowohl auf der Membran präsynaptischer als auch postsynaptischer Neuronen liegen. So können
metabotrope Rezeptoren durch
Modulation ionotroper Rezeptoren in der postsynaptischen Membran die Öffnungswahrscheinlichkeit ionotroper Rezeptoren und damit die Amplitude postsynaptischer Potentiale verändern. Allgemein kann man Produkte von Nervenzellen, welche die Aktivität anderer Nervenzellen beeinflussen, als natürliche neuroaktive Substanzen (NAS, natural neuroactive substances) bezeichnen. Neuromodulatoren können auch gemeinsam mit "klassischen" Transmittern freigesetzt werden (Cotransmission).
(Neuro-) Modulation ist die Abänderung neuronaler Aktivität durch Wirkung eines Neuromodulators, meist über metabotrope - G-Protein-gekoppelte und daher langsamer wirkende - Rezeptoren (GPCRs) an ihren Zielzellen. Diese können sowohl auf der Membran präsynaptischer als auch postsynaptischer Neuronen liegen. So können
metabotrope Rezeptoren durch
Modulation ionotroper Rezeptoren in der postsynaptischen Membran die Öffnungswahrscheinlichkeit ionotroper Rezeptoren und damit die Amplitude postsynaptischer Potentiale verändern. Allgemein kann man Produkte von Nervenzellen, welche die Aktivität anderer Nervenzellen beeinflussen, als natürliche neuroaktive Substanzen (NAS, natural neuroactive substances) bezeichnen. Neuromodulatoren können auch gemeinsam mit "klassischen" Transmittern freigesetzt werden (Cotransmission).  Abbildung). Neuromodulation wirkt längerfristig und ist auch bei Gedächtnisprozessen involviert.
Abbildung). Neuromodulation wirkt längerfristig und ist auch bei Gedächtnisprozessen involviert.

 Abbildung: Neuromodulation sympathischer / parasympathischer Signalübertragung
Abbildung: Neuromodulation sympathischer / parasympathischer Signalübertragung
 Abbildung). Dabei können die Neuromodulatoren auf die Freisetzung oder Aufnahme von
Transmittern wirken, autokrin oder parakrin, anregend oder
(auto-)inhibitorisch.
Abbildung). Dabei können die Neuromodulatoren auf die Freisetzung oder Aufnahme von
Transmittern wirken, autokrin oder parakrin, anregend oder
(auto-)inhibitorisch. , also erregende und hemmende sein.
, also erregende und hemmende sein. Abbildung).
Abbildung). 
 Abbildung: Erregende und hemmende Neurotransmission
Abbildung: Erregende und hemmende Neurotransmission
 Wenn z.B. an einem Neuron die Aktivierung einer exzitatorische Synapse
das Membranpotential um 1 mV reduziert und das Schwellenpotential 15 mV
vom Ruhepotential entfernt liegt, bedarf es an dieser Nervenzelle der
Wirkung von mindestens 15 EPSPs, um ein Aktionspotential auszulösen.
Wenn z.B. an einem Neuron die Aktivierung einer exzitatorische Synapse
das Membranpotential um 1 mV reduziert und das Schwellenpotential 15 mV
vom Ruhepotential entfernt liegt, bedarf es an dieser Nervenzelle der
Wirkung von mindestens 15 EPSPs, um ein Aktionspotential auszulösen. 
 Abbildung: Räumliche und zeitliche Bahnung
Abbildung: Räumliche und zeitliche Bahnung
| Ein zweites kurz nach einem vorangehenden EPSP ist größer als das erste, weil die präsynaptisch- zytoplasmatische Ca++-Konzentration noch erhöht ist |

 Abbildung: Abschwächung postsynaptischer Potentiale in Dendriten
Abbildung: Abschwächung postsynaptischer Potentiale in Dendriten
 Abbildung). Beispielsweise weist ein Dendrit mit 0,2 µm
Durchmesser einen λ-Wert von 0,35 mm, ein Dendrit mit 10 µm Durchmesser
(ceteris paribus) einen λ-Wert von 2,5 mm
auf - etwa der 7-fache Wert. Damit werden EPSPs dicker Dendriten auch
stärker zur Depolarisierung des Axonhügels beitragen als solche an
dünnen.
Abbildung). Beispielsweise weist ein Dendrit mit 0,2 µm
Durchmesser einen λ-Wert von 0,35 mm, ein Dendrit mit 10 µm Durchmesser
(ceteris paribus) einen λ-Wert von 2,5 mm
auf - etwa der 7-fache Wert. Damit werden EPSPs dicker Dendriten auch
stärker zur Depolarisierung des Axonhügels beitragen als solche an
dünnen. Abbildung). Diese Wirkung hält wesentlich länger an (vgl. auch dort).
Abbildung). Diese Wirkung hält wesentlich länger an (vgl. auch dort).
 Abbildung: Signalwege von der Synapse zum Zellkern
Abbildung: Signalwege von der Synapse zum Zellkern
 Abbildung
gezeigten Signalwege von der Synapse bis zur Freigabe der Transkription
diverser Gene im Zellkern des Zielneurons involvieren gemeinsam erhöhte
Calciumspiegel, haben aber unterschiedliche funktionelle Eigenschaften.
So funktioniert der Calmodulin-Kinase-Weg rasch (innerhalb von Minuten
nach der Depolarisierung kommt es zur Phosphorylierung von CREB),
während sich die Wirkung des MAP-Kinase-Weges über Stunden hinzieht.
Außer CREB können weiters andere calciumsemsitive
Transkriptionsfaktoren an unerschiedliche Promotorregionen binden.
Abbildung
gezeigten Signalwege von der Synapse bis zur Freigabe der Transkription
diverser Gene im Zellkern des Zielneurons involvieren gemeinsam erhöhte
Calciumspiegel, haben aber unterschiedliche funktionelle Eigenschaften.
So funktioniert der Calmodulin-Kinase-Weg rasch (innerhalb von Minuten
nach der Depolarisierung kommt es zur Phosphorylierung von CREB),
während sich die Wirkung des MAP-Kinase-Weges über Stunden hinzieht.
Außer CREB können weiters andere calciumsemsitive
Transkriptionsfaktoren an unerschiedliche Promotorregionen binden.  teils an Rezeptoren gebunden,
teils an Rezeptoren gebunden, 
 dann endozytiert und abgebaut;
dann endozytiert und abgebaut;

 teils werden sie präsynaptisch gebunden (können dort auch negativ
rückkoppelnd wirken) und
teils werden sie präsynaptisch gebunden (können dort auch negativ
rückkoppelnd wirken) und 
 wieder aufgenommen (recycling);
wieder aufgenommen (recycling); 
 teils
diffundieren sie in den Extrazellulärraum weiter und werden z.T. dort
enzymatisch inaktiviert,
teils
diffundieren sie in den Extrazellulärraum weiter und werden z.T. dort
enzymatisch inaktiviert, 
 oder mit dem Kreislauf weitertransportiert und
können so - auf größere Distanz - auch neuroendokrin aktiv werden.
oder mit dem Kreislauf weitertransportiert und
können so - auf größere Distanz - auch neuroendokrin aktiv werden.  Kokain
blockiert die präsynaptische Wiederaufnahme von Serotonin, Noradrenalin
und Dopamin und verlängert ihre Wirkung; das Antidepressivum Fluoxetin inhibiert selektiv die Aufnahme von Serotonin.
Kokain
blockiert die präsynaptische Wiederaufnahme von Serotonin, Noradrenalin
und Dopamin und verlängert ihre Wirkung; das Antidepressivum Fluoxetin inhibiert selektiv die Aufnahme von Serotonin. < Glutamat ist der führende (exzitatorische) Transmitter des Gehirns - man schätzt, dass jede zweite Synapse im Gehirn glutamaterg ist. Glutamat ist nicht nur Transmitter, sondern (zusammen mit Asparagin) auch wichtiger Baustein zerebraler Proteine. Es ist über α-Ketoglutarat mit dem Citratzyklus verknüpft und kann zu Glutamin amidiert werden (auf diese Weise wird aus dem Gehirn Ammoniak entfernt).
< Glutamat ist der führende (exzitatorische) Transmitter des Gehirns - man schätzt, dass jede zweite Synapse im Gehirn glutamaterg ist. Glutamat ist nicht nur Transmitter, sondern (zusammen mit Asparagin) auch wichtiger Baustein zerebraler Proteine. Es ist über α-Ketoglutarat mit dem Citratzyklus verknüpft und kann zu Glutamin amidiert werden (auf diese Weise wird aus dem Gehirn Ammoniak entfernt). < AMPA - Aminohydroxy-Methyl-Isoxazol-Propionsäure (Chemikalie)
< AMPA - Aminohydroxy-Methyl-Isoxazol-Propionsäure (Chemikalie)
 Abbildung: Ionotrope Glutamatrezeptoren (mit direktem Gating)
Abbildung: Ionotrope Glutamatrezeptoren (mit direktem Gating)

 Abbildung: NMDA-Glutamatrezeptor
Abbildung: NMDA-Glutamatrezeptor
 Abbildung). Diese unterscheiden sich in Ionenbeteiligung, Abhängigkeit
von der Membranspannung, Kinetik und pharmakologischem Profil. Auch
dienen sie im Gehirn unterschiedlichen Funktionen. Ionotrope
Glutamatrezeptoren sind aus einem "Bausatz" von 14 verschiedenen
Untereinheiten zusammengefügte Heterotetramere: Je vier davon sind
jeweils um einen zentralen Ionenkanal angeordnet.
Abbildung). Diese unterscheiden sich in Ionenbeteiligung, Abhängigkeit
von der Membranspannung, Kinetik und pharmakologischem Profil. Auch
dienen sie im Gehirn unterschiedlichen Funktionen. Ionotrope
Glutamatrezeptoren sind aus einem "Bausatz" von 14 verschiedenen
Untereinheiten zusammengefügte Heterotetramere: Je vier davon sind
jeweils um einen zentralen Ionenkanal angeordnet.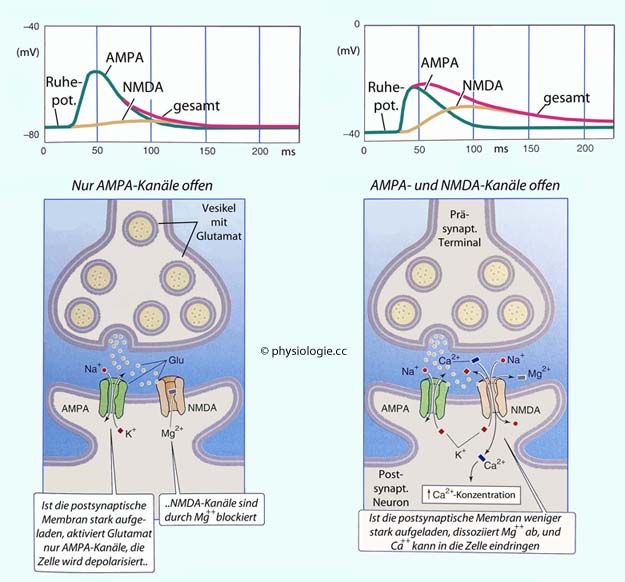
 Abbildung: Glutamat-getriggerte Ionenkanäle
Abbildung: Glutamat-getriggerte Ionenkanäle AMPA (α-amino-3-hydroxy-5-methylisoxazole-4-propionic acid) -Rezeptoren finden sich in den meisten exzitatorischen Synapsen des Gehirns, wo sie die Mehrzahl der L-Glutamat-Rezeptoren darstellen. AMPA-Rezeptoren steuern die rasche Komponente des Glutamateffekts (Millisekunden) bei. Da sie sowohl für Na+ als auch K+ (annähernd gleich gut) durchgängig sind, liegt ihr Gleichgewichtspotential nahe beim Spannungs-Nullpunkt, d.h. es kommt vom Ruhepotential aus zu Depolarisation: Exzitatorische postsynaptische Potentiale (EPSPs).
AMPA (α-amino-3-hydroxy-5-methylisoxazole-4-propionic acid) -Rezeptoren finden sich in den meisten exzitatorischen Synapsen des Gehirns, wo sie die Mehrzahl der L-Glutamat-Rezeptoren darstellen. AMPA-Rezeptoren steuern die rasche Komponente des Glutamateffekts (Millisekunden) bei. Da sie sowohl für Na+ als auch K+ (annähernd gleich gut) durchgängig sind, liegt ihr Gleichgewichtspotential nahe beim Spannungs-Nullpunkt, d.h. es kommt vom Ruhepotential aus zu Depolarisation: Exzitatorische postsynaptische Potentiale (EPSPs). Kainat-Rezeptoren (für Kainat - Salz der Kainsäure - zuerst in einer Meeresalge entdeckt, ein Strukturanalog der Glutaminsäure) beteiligen sich an glutamatbedingten EPSPs. Sie finden sich an
spezifischen Neuronentypen und auch an präsynaptischen glutamatergen
und GABAergen Axonterminals (wo sie die Transmitterfreisetzung
fördern).
Kainat-Rezeptoren (für Kainat - Salz der Kainsäure - zuerst in einer Meeresalge entdeckt, ein Strukturanalog der Glutaminsäure) beteiligen sich an glutamatbedingten EPSPs. Sie finden sich an
spezifischen Neuronentypen und auch an präsynaptischen glutamatergen
und GABAergen Axonterminals (wo sie die Transmitterfreisetzung
fördern).  NMDA (N-methyl-D-aspartic acid) -Rezeptoren sind für Kationen (Ca++ - das unterscheidet sie von AMPA-Rezeptoren -, Na+, K+)
permeabel. Sie haben eine langsamere Kinetik als AMPA-Kanäle, und ihr Öffnungsverhalten hängt nicht nur von der Bindung
des Agonisten ab, sondern auch von der Membranspannung; damit stellen sie eine Sonderform ionotroper Rezeptoren dar.
NMDA (N-methyl-D-aspartic acid) -Rezeptoren sind für Kationen (Ca++ - das unterscheidet sie von AMPA-Rezeptoren -, Na+, K+)
permeabel. Sie haben eine langsamere Kinetik als AMPA-Kanäle, und ihr Öffnungsverhalten hängt nicht nur von der Bindung
des Agonisten ab, sondern auch von der Membranspannung; damit stellen sie eine Sonderform ionotroper Rezeptoren dar.  Der NMDA-Kanal ist also sowohl transmitter- als auch spannungsgesteuert. Die
Ionenströmung duch den NMDA-Rezeptorkanal ist am stärksten, wenn zwei
Faktoren zusammenkommen: Bindung des Transmitters (Glutamat) und
Depolarisierung der Membran. Insoferne kann der NMDA-Rezeptor als
"Koinzidenzdetektor" fungieren - wenn sowohl die präsynaptische als
auch die postsynaptische Zelle erregt ist.
Der NMDA-Kanal ist also sowohl transmitter- als auch spannungsgesteuert. Die
Ionenströmung duch den NMDA-Rezeptorkanal ist am stärksten, wenn zwei
Faktoren zusammenkommen: Bindung des Transmitters (Glutamat) und
Depolarisierung der Membran. Insoferne kann der NMDA-Rezeptor als
"Koinzidenzdetektor" fungieren - wenn sowohl die präsynaptische als
auch die postsynaptische Zelle erregt ist. | NMDA-Kanäle sind ionotrope Glutamatrezeptoren |
 Abbildung oben). Serin ist eine Aminosäure, die von Nervenzellen als Neuromodulator verwendet wird:
Abbildung oben). Serin ist eine Aminosäure, die von Nervenzellen als Neuromodulator verwendet wird:  Zwei der vier Untereinheiten des Glutamatrezeptors haben Bindungsstellen für Glutamat, zwei für Glycin und D-Serin
(
Zwei der vier Untereinheiten des Glutamatrezeptors haben Bindungsstellen für Glutamat, zwei für Glycin und D-Serin
( Abbildung oben). Dabei existieren unterschiedliche Isoformen
der Glutamat- und der Serin-Bindungsstellen, die ontogenetisch
unterschiedlich kombiniert werden, sodass der Rezeptor abhängig von der
Entwicklungsphase und von der Lage im Gehirn entsprechend spezifische
funktionelle Eigenschaften aufweisen kann.
Abbildung oben). Dabei existieren unterschiedliche Isoformen
der Glutamat- und der Serin-Bindungsstellen, die ontogenetisch
unterschiedlich kombiniert werden, sodass der Rezeptor abhängig von der
Entwicklungsphase und von der Lage im Gehirn entsprechend spezifische
funktionelle Eigenschaften aufweisen kann.  Zinkionen werden zusammen mit Glutamat in
präsynaptischen Vesikeln gespeichert und von dort freigesetzt; Serin
stammt aus Astrozyten, seine verstärkende Wirkung auf die
NMDA-Rezeptoren (über die Bindungsstellen für Glycin) könnte zur
Festigung von Engrammen beitragen.
Zinkionen werden zusammen mit Glutamat in
präsynaptischen Vesikeln gespeichert und von dort freigesetzt; Serin
stammt aus Astrozyten, seine verstärkende Wirkung auf die
NMDA-Rezeptoren (über die Bindungsstellen für Glycin) könnte zur
Festigung von Engrammen beitragen. Zur langsamen Komponente des Glutamateffekts siehe synaptische Plastizität und Langzeitpotenzierung
Zur langsamen Komponente des Glutamateffekts siehe synaptische Plastizität und Langzeitpotenzierung
 Gruppe I: Diese aktivieren die Kette Phospholipase C → IP3 → Ca++-Freisetzung, DAG → Proteinkinase C
Gruppe I: Diese aktivieren die Kette Phospholipase C → IP3 → Ca++-Freisetzung, DAG → Proteinkinase C Gruppe II und
III: Sie hemmen die Adenylylcyclase → cAMP sinkt.
Gruppe II und
III: Sie hemmen die Adenylylcyclase → cAMP sinkt.
 Abbildung: Aktivierung eines metabotropen Glutamatrezeptors
Abbildung: Aktivierung eines metabotropen Glutamatrezeptors
 Metabotrope Glutamatrezeptoren können sowohl depolarisierend
(exzitatortisch) als auch hyperpolarisierend (inhibitorisch) wirken, je
nach Umkehrpotential des jeweils regulierten Ions bzw. ob sie Kanäle
öffnen oder schließen.
Metabotrope Glutamatrezeptoren können sowohl depolarisierend
(exzitatortisch) als auch hyperpolarisierend (inhibitorisch) wirken, je
nach Umkehrpotential des jeweils regulierten Ions bzw. ob sie Kanäle
öffnen oder schließen.  Abbildung). Glutamattransporter
nützen vor allem den Natriumgradienten (extrazellulär 140 mM,
intrazellulär 12 mM) zum Import von Glutamat (gegen dessen
Konzentrationsgefälle); so befördern sie 3 Na+-Ionen und ein Proton (H+) in die Zelle und ein K+-Ion
aus der Zelle. Ein Glutamatmolekül wird in diesem Fall also zusammen
mit insgesamt fünf anderen Ionen durch den Transporter bewegt (sodium and potassium coupled glutamate transporters).
Abbildung). Glutamattransporter
nützen vor allem den Natriumgradienten (extrazellulär 140 mM,
intrazellulär 12 mM) zum Import von Glutamat (gegen dessen
Konzentrationsgefälle); so befördern sie 3 Na+-Ionen und ein Proton (H+) in die Zelle und ein K+-Ion
aus der Zelle. Ein Glutamatmolekül wird in diesem Fall also zusammen
mit insgesamt fünf anderen Ionen durch den Transporter bewegt (sodium and potassium coupled glutamate transporters).
 Abbildung: Lokales Glutamin-Glutamat-System und "tripartite" Synapse
Abbildung: Lokales Glutamin-Glutamat-System und "tripartite" Synapse
 Die Entfernung von Glutamat aus dem synaptischen Spaltraum reguliert den Erregungspegel des Nervengewebes.
Die Entfernung von Glutamat aus dem synaptischen Spaltraum reguliert den Erregungspegel des Nervengewebes. Abbildung).
Abbildung).  VGLUTs: vesicular glutamate transporters
VGLUTs: vesicular glutamate transporters
 EAATs: excitatory amino acid transporters
EAATs: excitatory amino acid transporters
 Glutamat-Cystein-Austauscher
Glutamat-Cystein-Austauscher Über Acetylcholin, Katecholamine, Serotonin, Histamin, ATP, Opioide und Prostaglandine s. dort
Über Acetylcholin, Katecholamine, Serotonin, Histamin, ATP, Opioide und Prostaglandine s. dort Über zentralnervöse noradrenerge, serotoninerge, dopaminerge und cholinerge Systeme s. dort
Über zentralnervöse noradrenerge, serotoninerge, dopaminerge und cholinerge Systeme s. dort Unter Disinhibition versteht man die Abschwächung oder Unterdrückung einer hemmenden Aktivität, z.B. im Bereich der Basalganglien. Hier können dadurch "nachgeschaltete" anregende neuronale Muster freigegeben werden, z.B. von Bewegungsabfolgen im Thalamus.
Unter Disinhibition versteht man die Abschwächung oder Unterdrückung einer hemmenden Aktivität, z.B. im Bereich der Basalganglien. Hier können dadurch "nachgeschaltete" anregende neuronale Muster freigegeben werden, z.B. von Bewegungsabfolgen im Thalamus. GABA wird durch Glutamat-Decarboxylase aus Glutamat gebildet und (wie
auch andere Transmitter) nach seiner Freisetzung teils abtransportiert
und abgebaut, teils wieder in die präsynaptische Zelle aufgenommen (reuptake) und wiederverwendet ("GABA-shunt",
GABA wird durch Glutamat-Decarboxylase aus Glutamat gebildet und (wie
auch andere Transmitter) nach seiner Freisetzung teils abtransportiert
und abgebaut, teils wieder in die präsynaptische Zelle aufgenommen (reuptake) und wiederverwendet ("GABA-shunt",  Abbildung).
Abbildung).

 Abbildung: Bildung und Wiederverwertung (uptake & release) von GABA
Abbildung: Bildung und Wiederverwertung (uptake & release) von GABA
 Sechs Typen von α-Untereinheiten (GABRA1 bis GABRA6)
Sechs Typen von α-Untereinheiten (GABRA1 bis GABRA6) Drei Typen von β-Untereinheiten (GABRB1 bis GABRB3)
Drei Typen von β-Untereinheiten (GABRB1 bis GABRB3) Drei Typen von γ-Untereinheiten (GABRG1 bis GABRG3)
Drei Typen von γ-Untereinheiten (GABRG1 bis GABRG3) Eine δ-Untereinheit (GABRD)
Eine δ-Untereinheit (GABRD) Eine ε-Untereinheit (GABRE)
Eine ε-Untereinheit (GABRE) Eine π-Untereinheit (GABRP)
Eine π-Untereinheit (GABRP) Eine θ-Untereinheit (BABRQ)
Eine θ-Untereinheit (BABRQ)
 Abbildung: GABAA-Rezeptor (schematisch)
Abbildung: GABAA-Rezeptor (schematisch) Über GABAA-Rezeptoren
wirken Pharmaka, die sich nicht an die GABA-Bindungsstelle, sondern an
andere Rezeptorareale anlagern (
Über GABAA-Rezeptoren
wirken Pharmaka, die sich nicht an die GABA-Bindungsstelle, sondern an
andere Rezeptorareale anlagern ( Abbildung) und die Eigenschaften des Ionenkanals allosterisch verändern. Die Rezeptoren können ganz unterschiedliche
Empfindlichkeit für diese Modulatoren haben (die Untereinheiten des
Rezeptors können verschieden kombiniert sein). Benzodiazepine (z.B. Diazepam [Valium]) und Barbiturate (z.B. Phenobarbital) regen GABAA-Rezeptoren
an (Bildung von IPSPs), daher ihr
suppressiver Effekt auf das Gehirn. Diese Substanzen wirken
für sich alleine kaum, aber zusammen mit GABA auf den Rezeptor. Beispielsweise erhöhen
Benzodiazepine die Frequenz der Kanalöffnungen, Barbiturate und einige Steroide deren Dauer usw.
Abbildung) und die Eigenschaften des Ionenkanals allosterisch verändern. Die Rezeptoren können ganz unterschiedliche
Empfindlichkeit für diese Modulatoren haben (die Untereinheiten des
Rezeptors können verschieden kombiniert sein). Benzodiazepine (z.B. Diazepam [Valium]) und Barbiturate (z.B. Phenobarbital) regen GABAA-Rezeptoren
an (Bildung von IPSPs), daher ihr
suppressiver Effekt auf das Gehirn. Diese Substanzen wirken
für sich alleine kaum, aber zusammen mit GABA auf den Rezeptor. Beispielsweise erhöhen
Benzodiazepine die Frequenz der Kanalöffnungen, Barbiturate und einige Steroide deren Dauer usw.| GABAA-Rezeptoren öffnen Chloridkanäle und reduzieren die postsynaptische Erregbarkeit |
 Spontanaktive Zellen senken ihre Aktionspotentialfrequenz, wenn an ihnen Chloridkanäle geöffnet werden.
Spontanaktive Zellen senken ihre Aktionspotentialfrequenz, wenn an ihnen Chloridkanäle geöffnet werden. erhöhen über Gi die Offen-Wahrscheinlichkeit von K+-Kanälen (GIRKs) - das nähert das Membranpotential des Neurons an das Kalium-Gleichgewichtspotential an
erhöhen über Gi die Offen-Wahrscheinlichkeit von K+-Kanälen (GIRKs) - das nähert das Membranpotential des Neurons an das Kalium-Gleichgewichtspotential an  senken die Offen-Wahrscheinlichkeit von Ca++-Kanälen via Reduktion der Aktivität der Adenylylcyclase.
senken die Offen-Wahrscheinlichkeit von Ca++-Kanälen via Reduktion der Aktivität der Adenylylcyclase. Auf GABAB-Rezeptoren wirkt eine Vielzahl von Agonisten (z.B. das muskelrelaxierende GABA-Analog Baclofen), Antagonisten und allosterisch wirksame Modulatoren.
Auf GABAB-Rezeptoren wirkt eine Vielzahl von Agonisten (z.B. das muskelrelaxierende GABA-Analog Baclofen), Antagonisten und allosterisch wirksame Modulatoren. Glycin
Glycin
 ist eine Aminosäure, die - vor allem in Rückenmark, Hirnstamm und in der Netzhaut - über Glycinrezeptoren wirkt, z.B. an motorischen Vorderhornzellen
(Renshaw-Selbsthemmung). Glycin wirkt meist inhibitorisch, indem es (wie GABAA-Rezeptoren) Chloridkanäle öffnet (
ist eine Aminosäure, die - vor allem in Rückenmark, Hirnstamm und in der Netzhaut - über Glycinrezeptoren wirkt, z.B. an motorischen Vorderhornzellen
(Renshaw-Selbsthemmung). Glycin wirkt meist inhibitorisch, indem es (wie GABAA-Rezeptoren) Chloridkanäle öffnet ( Abbildung). Die Rezeptoren sind aus α- und β-Untereinheiten aufgebaut.
Abbildung). Die Rezeptoren sind aus α- und β-Untereinheiten aufgebaut.

 Abbildung: Glycinrezeptor
Abbildung: Glycinrezeptor vermittelt Clustering, Stabilisierung (für Interaktion mit dem
Zytoskelett) und Verfügbarkeit (Plastizität) von Glycin- und GABA-
Rezeptoren an der postsynaptischen Membran. Die Interaktion des Gephyrin mit anderen Proteinen ist komplex. An manchen GABAA-Rezeptoren ist Gephyrin nicht nachweisbar.
vermittelt Clustering, Stabilisierung (für Interaktion mit dem
Zytoskelett) und Verfügbarkeit (Plastizität) von Glycin- und GABA-
Rezeptoren an der postsynaptischen Membran. Die Interaktion des Gephyrin mit anderen Proteinen ist komplex. An manchen GABAA-Rezeptoren ist Gephyrin nicht nachweisbar.| Glycinrezeptoren öffnen Chloridkanäle und reduzieren die postsynaptische Erregbarkeit |
 Weitere inhibitorische Neurotransmitter sind ß-Alanin und Taurin.
Weitere inhibitorische Neurotransmitter sind ß-Alanin und Taurin.
 Abbildung: Präsynaptische Hemmung (presynaptic inhibition)
Abbildung: Präsynaptische Hemmung (presynaptic inhibition)
 So
kann das Interneuron "A" einen Transmitter freisetzen, der das
Membranpotential der axonalen Endigung von "B" senkt.
So
kann das Interneuron "A" einen Transmitter freisetzen, der das
Membranpotential der axonalen Endigung von "B" senkt.  Oder der vom Interneuron "A" sezernierte Transmitter inaktiviert auf
"B" Calciumkanäle und sorgt auf diesem Wege für geringere
Transmitterfreisetzung an der zu beeinflussenden Synapse zwischen "B"
und "C" (
Oder der vom Interneuron "A" sezernierte Transmitter inaktiviert auf
"B" Calciumkanäle und sorgt auf diesem Wege für geringere
Transmitterfreisetzung an der zu beeinflussenden Synapse zwischen "B"
und "C" ( Abbildung).
Abbildung). vgl. dort).
vgl. dort).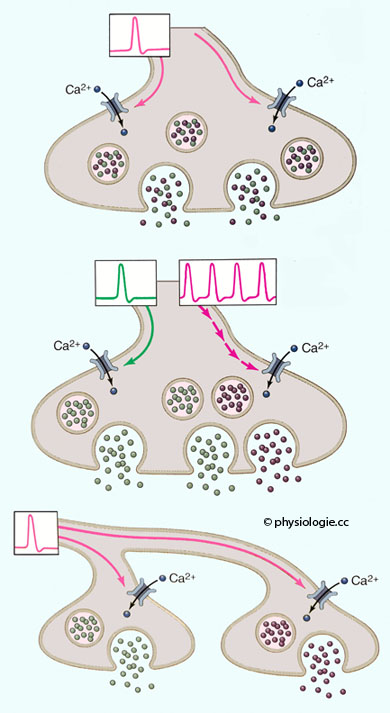
 Abbildung: Gleichzeitige Freisetzung mehrerer Transmitterstoffe
Abbildung: Gleichzeitige Freisetzung mehrerer Transmitterstoffe
 Abbildung).
Abbildung). Als Cotransmission bezeichnet
man die gemeinsame Freisetzung verschiedener Neurotransmitter von ein
und demselben axonalen Nerventerminal. Beispiele sind
Als Cotransmission bezeichnet
man die gemeinsame Freisetzung verschiedener Neurotransmitter von ein
und demselben axonalen Nerventerminal. Beispiele sind Glutamat mit Dopamin
Glutamat mit Dopamin Glutamat mit Acetylcholin
Glutamat mit Acetylcholin Glutamat und Dynorphin (Hippocampus)
Glutamat und Dynorphin (Hippocampus) GABA mit Glycin
GABA mit Glycin Acetylcholin mit Calcitonin
Acetylcholin mit Calcitonin Acetylcholin mit Vasopressin
Acetylcholin mit Vasopressin Abbildung:
Abbildung:
 Abbildung: Selektive Freisetzung colokalisierter Transmitter
Abbildung: Selektive Freisetzung colokalisierter Transmitter
 Abbildung). Abhängig von der Intensität des Calciumanstiegs im
Axonterminal können ein oder mehrere Vesikel ihren Inhalt (Transmitter)
in den Extrazellulärraum entleeren. Aber nicht jedes Aktionspotential
steigert den intrazellulären Calciumspiegel ausreichend stark, um den
Exozytosemechanismus zu triggern. Einzelne präsynaptische Entladungen
können also auch wirkungslos auf das Membranopotential des
postsynaptischen Neurons bleiben.
Abbildung). Abhängig von der Intensität des Calciumanstiegs im
Axonterminal können ein oder mehrere Vesikel ihren Inhalt (Transmitter)
in den Extrazellulärraum entleeren. Aber nicht jedes Aktionspotential
steigert den intrazellulären Calciumspiegel ausreichend stark, um den
Exozytosemechanismus zu triggern. Einzelne präsynaptische Entladungen
können also auch wirkungslos auf das Membranopotential des
postsynaptischen Neurons bleiben.  Abbildung).
Abbildung). 
 Abbildung: Nervenzelle, Kon- und Divergenz
Abbildung: Nervenzelle, Kon- und Divergenz

 Abbildung: Konvergenz- und Divergenzprinzip neuronaler Verschaltung
Abbildung: Konvergenz- und Divergenzprinzip neuronaler Verschaltung
 Divergenz: Noradrenalin wirkt auf α1-Rezeptoren (über G-Protein, PLC, PKC), α2-Rezeptoren
(über G-Proteine und z.T. PLC, PKC), und ß-Rezeptoren (über G-Protein,
Adenylylcyclase, cAMP) ganz unterschiedlich auf diverse Ionenkanäle und
damit auf das Membranpotential
Divergenz: Noradrenalin wirkt auf α1-Rezeptoren (über G-Protein, PLC, PKC), α2-Rezeptoren
(über G-Proteine und z.T. PLC, PKC), und ß-Rezeptoren (über G-Protein,
Adenylylcyclase, cAMP) ganz unterschiedlich auf diverse Ionenkanäle und
damit auf das Membranpotential Konvergenz: Kaliumkanäle werden über Gα-Protein
von Rezeptoren für Adenosin, Acetylcholin, Dopamin, Enkephalin, GABA,
Noradrenalin, Serotonin und Somatostatin beeinflusst
Konvergenz: Kaliumkanäle werden über Gα-Protein
von Rezeptoren für Adenosin, Acetylcholin, Dopamin, Enkephalin, GABA,
Noradrenalin, Serotonin und Somatostatin beeinflusst
 Wundstarrkrampf (Tetanus
im pathologischen Sinn: Hemmung inhibierender Synapsen - GABA, Glycin - an Renshaw-Zellen) oder
Wundstarrkrampf (Tetanus
im pathologischen Sinn: Hemmung inhibierender Synapsen - GABA, Glycin - an Renshaw-Zellen) oder  Lähmungen (Acetylcholin an exzitatorischen Synapsen bzw. der motorischen Endplatte
wird nicht freigesetzt) auf (Botulismus).
Lähmungen (Acetylcholin an exzitatorischen Synapsen bzw. der motorischen Endplatte
wird nicht freigesetzt) auf (Botulismus). 
 Neuronen sind über Synapsen miteinander
verknüpft. Der präsynaptische Teil setzt bei Erregung Transmitter
frei, der postsynaptische trägt Rezeptormoleküle. Der
Transmitter wird nach seiner Freisetzung wiederaufgenommen und/oder
abgebaut, er kann auch präsynaptisch negativ rückkoppelnd oder
über den Kreislauf neuroendokrin wirken (längere Halbwertszeit). Neurotransmitter sind z.B. Glutamat / Aspartat,
GABA, Glycin, Acetylcholin, Katecholamine, Serotonin; Kotransmitter Peptide, Purine, NO,
Eikosanoide Neuronen sind über Synapsen miteinander
verknüpft. Der präsynaptische Teil setzt bei Erregung Transmitter
frei, der postsynaptische trägt Rezeptormoleküle. Der
Transmitter wird nach seiner Freisetzung wiederaufgenommen und/oder
abgebaut, er kann auch präsynaptisch negativ rückkoppelnd oder
über den Kreislauf neuroendokrin wirken (längere Halbwertszeit). Neurotransmitter sind z.B. Glutamat / Aspartat,
GABA, Glycin, Acetylcholin, Katecholamine, Serotonin; Kotransmitter Peptide, Purine, NO,
Eikosanoide Symmetrische
Synapsen haben gleich große prä- und postsynaptische Zonen (meist
inhibitorisch), bei asymmetrischen ist der postsynaptische Apparat
ausgeprägter (meist exzitatorisch). Man unterscheidet axodendritische,
axosomale, axoaxonale, auch dendrodendritische Synapsen. Die
Signalübertragung kann Millisekunden (Glutamat, GABA, Glycin, Acetylcholin nikotinerg), Sekunden (Katecholamine, Acetylcholin
muskarinerg), oder bis Tage wirken (Neuromodulation).
Fazilitation bedeutet Erhöhung, Depression Erniedrigung der
synaptischen Wirkung nach hochfrequenter Reizung des betreffenden
Synapsensystems (synaptische Plastizität),
erklärbar durch Verstärkung oder Abschwächung der
Transmitterfreisetzung und der Rezeptoransprechbarkeit Symmetrische
Synapsen haben gleich große prä- und postsynaptische Zonen (meist
inhibitorisch), bei asymmetrischen ist der postsynaptische Apparat
ausgeprägter (meist exzitatorisch). Man unterscheidet axodendritische,
axosomale, axoaxonale, auch dendrodendritische Synapsen. Die
Signalübertragung kann Millisekunden (Glutamat, GABA, Glycin, Acetylcholin nikotinerg), Sekunden (Katecholamine, Acetylcholin
muskarinerg), oder bis Tage wirken (Neuromodulation).
Fazilitation bedeutet Erhöhung, Depression Erniedrigung der
synaptischen Wirkung nach hochfrequenter Reizung des betreffenden
Synapsensystems (synaptische Plastizität),
erklärbar durch Verstärkung oder Abschwächung der
Transmitterfreisetzung und der Rezeptoransprechbarkeit Einzelne synaptische Depolarisationen (EPSPs) depolarisieren um 0,01-1 mV, sie bleiben alleine unterschwellig. Mehrere EPSPs können das Membranpotential über das Schwellenpotential hinaus reduzieren (Summation) und so ein Aktionspotential auslösen. Die
Summation kann zeitlich (d.h. nacheinander) oder räumlich (d.h.
gleichzeitig durch mehrere Synapsen) erfolgen. Bei zeitlicher Summation
ist die [Ca++] im präsynaptischen Zytoplasma durch initiale
Erregung erhöht, das verstärkt die Transmitterfreisetzung sowie knapp
nachfolgende EPSPs. Inhibierende Synapsen
hyperpolarisieren meist durch erhöhte Durchlässigkeit für Chloridionen
oder Anstieg der Kaliumdurchlässigkeit. IPSPs stabilisieren das
Membranpotential Einzelne synaptische Depolarisationen (EPSPs) depolarisieren um 0,01-1 mV, sie bleiben alleine unterschwellig. Mehrere EPSPs können das Membranpotential über das Schwellenpotential hinaus reduzieren (Summation) und so ein Aktionspotential auslösen. Die
Summation kann zeitlich (d.h. nacheinander) oder räumlich (d.h.
gleichzeitig durch mehrere Synapsen) erfolgen. Bei zeitlicher Summation
ist die [Ca++] im präsynaptischen Zytoplasma durch initiale
Erregung erhöht, das verstärkt die Transmitterfreisetzung sowie knapp
nachfolgende EPSPs. Inhibierende Synapsen
hyperpolarisieren meist durch erhöhte Durchlässigkeit für Chloridionen
oder Anstieg der Kaliumdurchlässigkeit. IPSPs stabilisieren das
Membranpotential Neurotransmitter
und Neuropeptide werden vesikulär gespeichert: Protonenpumpen stellen einen
pH-Wert von ~5,4 ein, Transporter konzentrieren den Transmitter im
Vesikel. Die Transmitterfreisetzung erfolgt nach folgender Sequenz: Depolarisierung öffnet spannungsgesteuerte Ca++-Kanäle → Exozytose (elektro-sekretorische Kopplung), über Calmodulin und Proteinkinasen Aktivierung weiterer Vesikel → Transmitterfreisetzung.
Zahlreiche spezielle Proteine sind involviert (Synaptotagmin,
Synaptobrevin, Syntaxin, SNARE-Proteine). Jedes
Aktionspotential führt zur Entleerung hunderter Vesikel (Freisetzung von einigen 104 Transmittermolekülen) Neurotransmitter
und Neuropeptide werden vesikulär gespeichert: Protonenpumpen stellen einen
pH-Wert von ~5,4 ein, Transporter konzentrieren den Transmitter im
Vesikel. Die Transmitterfreisetzung erfolgt nach folgender Sequenz: Depolarisierung öffnet spannungsgesteuerte Ca++-Kanäle → Exozytose (elektro-sekretorische Kopplung), über Calmodulin und Proteinkinasen Aktivierung weiterer Vesikel → Transmitterfreisetzung.
Zahlreiche spezielle Proteine sind involviert (Synaptotagmin,
Synaptobrevin, Syntaxin, SNARE-Proteine). Jedes
Aktionspotential führt zur Entleerung hunderter Vesikel (Freisetzung von einigen 104 Transmittermolekülen) Transmitter binden an unterschiedliche Rezeptor-Subtypen (verschiedene Effekte möglich). Rezeptoren
verändern ihre Ansprechbarkeit gegenüber dem Neurotransmitter: Phosphorylierung / Dephosphorylierung, Wechsel
rezeptorbeladener Membranabschnitte zwischen Zellmembran und
Zellinnerem. Drei
Mechanismen beenden die Transmitterwirkung: Sinkende Konzentration
durch Diffusion in das umliegende Interstitium, enzymatischer Abbau im
synaptischen Spalt, Aufnahme in präsynaptische Neurone und Gliazellen. Praktisch alle
Stufen des synaptischen Wirkmechanismus können pharmakologisch /
toxikologisch beeinflusst werden Transmitter binden an unterschiedliche Rezeptor-Subtypen (verschiedene Effekte möglich). Rezeptoren
verändern ihre Ansprechbarkeit gegenüber dem Neurotransmitter: Phosphorylierung / Dephosphorylierung, Wechsel
rezeptorbeladener Membranabschnitte zwischen Zellmembran und
Zellinnerem. Drei
Mechanismen beenden die Transmitterwirkung: Sinkende Konzentration
durch Diffusion in das umliegende Interstitium, enzymatischer Abbau im
synaptischen Spalt, Aufnahme in präsynaptische Neurone und Gliazellen. Praktisch alle
Stufen des synaptischen Wirkmechanismus können pharmakologisch /
toxikologisch beeinflusst werden Glutamat ist
der wichtigste exzitatorische Transmitter (~50% aller zerebralen Synapsen), es ist mit dem Zitratzyklus verknüpft und kann zu Glutamin
amidiert werden. Glutamat wirkt
über vier Rezeptorklassen - eine metabotrope: mGluR, drei ionotrope: AMPA-, NMDA-,
Kainat-R. mGluR
werden eingeteilt in Gruppe I: Aktivierung Phospholipase C → IP3 →
Ca++-Freisetzung, DAG → Proteinkinase C; und Gruppe II und III: Hemmung
der Adenylylcyclase → cAMP sinkt. AMPA sind durchgängig für Na+ und K+, sie finden sich an den meisten exzitatorischen Synapsen und bewirken rasche EPSPs. Der NMDA-Glutamatrezeptor ist ein Na+-, K+- und Ca++-Kanal, für seine Öffnung reicht die Bindung von Glutamat nicht aus: Mg++
blockiert den Ionenkanal, Depolarisierung entfernt es, z.B. durch
Aktivierung von AMPA- oder Kainat-Rezeptoren; als Cofaktoren wirken
Glycin oder Serin sowie Zinkionen, die zusammen mit Glutamat aus
präsynaptischen Vesikeln freigesetzt werden. Kainat-Rezeptoren lassen Na+ und K+ passieren Glutamat ist
der wichtigste exzitatorische Transmitter (~50% aller zerebralen Synapsen), es ist mit dem Zitratzyklus verknüpft und kann zu Glutamin
amidiert werden. Glutamat wirkt
über vier Rezeptorklassen - eine metabotrope: mGluR, drei ionotrope: AMPA-, NMDA-,
Kainat-R. mGluR
werden eingeteilt in Gruppe I: Aktivierung Phospholipase C → IP3 →
Ca++-Freisetzung, DAG → Proteinkinase C; und Gruppe II und III: Hemmung
der Adenylylcyclase → cAMP sinkt. AMPA sind durchgängig für Na+ und K+, sie finden sich an den meisten exzitatorischen Synapsen und bewirken rasche EPSPs. Der NMDA-Glutamatrezeptor ist ein Na+-, K+- und Ca++-Kanal, für seine Öffnung reicht die Bindung von Glutamat nicht aus: Mg++
blockiert den Ionenkanal, Depolarisierung entfernt es, z.B. durch
Aktivierung von AMPA- oder Kainat-Rezeptoren; als Cofaktoren wirken
Glycin oder Serin sowie Zinkionen, die zusammen mit Glutamat aus
präsynaptischen Vesikeln freigesetzt werden. Kainat-Rezeptoren lassen Na+ und K+ passieren Nerven- und Gliazellen nehmen Glutamat über Transporter auf - dabei gelangen 3 Na+ und ein H+ in die, ein K+ aus der Zelle. So wird Glutamat aus dem synaptischen Spaltraum entfernt und der Erregungspegel des Nervengewebes reguliert (Schutz vor Exzitotoxizität: diese kann bei Ischämie durch verringerte Glutamatclearance auftreten). Gliazellen wandeln freigesetztes Glutamat zu Glutamin um (Glutamat-Ammonium-Ligase), Nervenzellen nehmen dieses auf und wandeln es in Glutamat um (Glutaminase), dabei entsteht Ammoniak (das aus dem Gehirn
entfernt wird) Nerven- und Gliazellen nehmen Glutamat über Transporter auf - dabei gelangen 3 Na+ und ein H+ in die, ein K+ aus der Zelle. So wird Glutamat aus dem synaptischen Spaltraum entfernt und der Erregungspegel des Nervengewebes reguliert (Schutz vor Exzitotoxizität: diese kann bei Ischämie durch verringerte Glutamatclearance auftreten). Gliazellen wandeln freigesetztes Glutamat zu Glutamin um (Glutamat-Ammonium-Ligase), Nervenzellen nehmen dieses auf und wandeln es in Glutamat um (Glutaminase), dabei entsteht Ammoniak (das aus dem Gehirn
entfernt wird) GABA und Glycin sind inhibitorische Neurotransmitter; beide werden präsynaptisch vesikulär gespeichert. Glutamatdecarboxylase bildet GABA (γ-Aminobuttersäure) aus Glutamat; GABA ist der führende inhibitorische Transmitter im Zentralnervensystem (~30% aller zerebralen Synapsen). Astrozyten
nehmen GABA und Glutamat auf und stellen dem präsynaptischen Neuron
Glutamin für die Transmittersynthese zur Verfügung (Glutaminzyklus). GABA wirkt über drei Rezeptor-Haupttypen: Ionotrope sind die häufigsten (GABAA), sie öffnen Chloridkanäle und reduzieren die postsynaptische Erregbarkeit (IPSP); metabotrope (GABAB) hemmen die Adenylylcyclase, öffnen K+- und schließen Ca++-Kanäle, beides stabilisiert das Membranpotential; und Chloridkanäle (GABAC: Retina, Rückenmark, colliculi superiores, Hypophyse). GABA wird nach seiner Freisetzung teils abgebaut, teils in präsynaptische Neuronen aufgenommen. - Glyzin öffnet an seinen Rezeptoren Chloridkanäle; der Effekt ist abhängig vom Ausgangswert des Membranpotentials (Cl-- Gleichgewichtspotential ~-70 mV, bei geringerem Wert des Membranpotentials → IPSP, bei höherem → EPSP) und der Öffnung der Chloridkanäle GABA und Glycin sind inhibitorische Neurotransmitter; beide werden präsynaptisch vesikulär gespeichert. Glutamatdecarboxylase bildet GABA (γ-Aminobuttersäure) aus Glutamat; GABA ist der führende inhibitorische Transmitter im Zentralnervensystem (~30% aller zerebralen Synapsen). Astrozyten
nehmen GABA und Glutamat auf und stellen dem präsynaptischen Neuron
Glutamin für die Transmittersynthese zur Verfügung (Glutaminzyklus). GABA wirkt über drei Rezeptor-Haupttypen: Ionotrope sind die häufigsten (GABAA), sie öffnen Chloridkanäle und reduzieren die postsynaptische Erregbarkeit (IPSP); metabotrope (GABAB) hemmen die Adenylylcyclase, öffnen K+- und schließen Ca++-Kanäle, beides stabilisiert das Membranpotential; und Chloridkanäle (GABAC: Retina, Rückenmark, colliculi superiores, Hypophyse). GABA wird nach seiner Freisetzung teils abgebaut, teils in präsynaptische Neuronen aufgenommen. - Glyzin öffnet an seinen Rezeptoren Chloridkanäle; der Effekt ist abhängig vom Ausgangswert des Membranpotentials (Cl-- Gleichgewichtspotential ~-70 mV, bei geringerem Wert des Membranpotentials → IPSP, bei höherem → EPSP) und der Öffnung der Chloridkanäle Wird das
Membranpotential eines Axons durch aufgeschaltete Neurite verändert,
beeinflusst das die Menge des von ihm (aktionspotentialbedingt)
freigesetzten Transmitters. Dieses Prinzip der präsynaptischen Hemmung ist insbesondere im Rückenmark wirksam.
Neuromodulation ist die prä- oder postsynaptische, indirekte
Beeinflussung der Freisetzung oder Wirkung von Transmittern - meist
über veränderte Permeabilität von K+- und Ca++-Kanälen. Neuromodulation erfolgt über Kotransmitter, wirkt längerfristig und ist an Gedächtnisprozessen beteiligt Wird das
Membranpotential eines Axons durch aufgeschaltete Neurite verändert,
beeinflusst das die Menge des von ihm (aktionspotentialbedingt)
freigesetzten Transmitters. Dieses Prinzip der präsynaptischen Hemmung ist insbesondere im Rückenmark wirksam.
Neuromodulation ist die prä- oder postsynaptische, indirekte
Beeinflussung der Freisetzung oder Wirkung von Transmittern - meist
über veränderte Permeabilität von K+- und Ca++-Kanälen. Neuromodulation erfolgt über Kotransmitter, wirkt längerfristig und ist an Gedächtnisprozessen beteiligt  Mehrere tausend synaptische Endigungen von verschiedenen anderen Neuronen können auf
eine einzelne Nervenzelle einwirken (Konvergenz), andererseits wirkt
ein Neuron auf mehrere andere ein (Divergenz). Konvergenz und Divergenz ermöglichen die Analyse und Beeinflussung von Erregungsmustern: Sinnesmeldungen werden abstrahiert,
Kontraste verstärkt, Muster erkannt, Merkmale zugeordnet. Schwache
Impulse können summiert und überschwellig, Assoziationen
verfestigt werden (Koinzidenzdetektion). Das Gebiet in einem Sinnesorgan, das zu
einer zentralen Nervenzelle konvergiert, nennt man dessen rezeptives
Feld. Rezeptive Felder überschneiden sich (Divergenz) Mehrere tausend synaptische Endigungen von verschiedenen anderen Neuronen können auf
eine einzelne Nervenzelle einwirken (Konvergenz), andererseits wirkt
ein Neuron auf mehrere andere ein (Divergenz). Konvergenz und Divergenz ermöglichen die Analyse und Beeinflussung von Erregungsmustern: Sinnesmeldungen werden abstrahiert,
Kontraste verstärkt, Muster erkannt, Merkmale zugeordnet. Schwache
Impulse können summiert und überschwellig, Assoziationen
verfestigt werden (Koinzidenzdetektion). Das Gebiet in einem Sinnesorgan, das zu
einer zentralen Nervenzelle konvergiert, nennt man dessen rezeptives
Feld. Rezeptive Felder überschneiden sich (Divergenz) |
