



 Allocortex: ἄλλος = anders, cortex (lat) = Rinde
Allocortex: ἄλλος = anders, cortex (lat) = Rinde| Das Gehirn gilt als eines der komplexesten existierenden Systeme. Seine Moleküle, Synapsen,
Zellen und Module werden intensiv erforscht; seine
Funktionsweise als Ganzes ist noch lange nicht erfasst. Der Zeitrahmen der zerebralen Vorgänge kann sehr unterschiedlich sein: Millisekunden (Aktionspotential, rasche Transmitter, Ionenkanäle), Sekunden bis Minuten (langsame Transmitter, second messenger), Stunden (Rezeptorzahl) oder noch länger (veränderte Genexpression, modifizierte Verbindungsstrategien). Synapsen sind interzelluläre Schaltstellen; einige wenige arbeiten elektrisch, die meisten chemisch: Dutzende Transmitterstoffe sind bekannt. Der wichtigste anregende (depolarisierende) Transmitter ist Glutamat, hemmend (hyperoplarisierend) wirken GABA und Glycin. Dazu kommen zahlreiche Kotransmitter. Synapsen können depolarisierend wirken, ihr Effekt heißt exzitatorisches postsynaptisches Potential (EPSP) - das "Vorspiel" zur Erregung (Aktionspotential). Wird das Membranpotential verstärkt (hyperpolarisierende Synapsenwirtkung), wirkt dies hemmend (inhibitorisches postsynaptisches Potential, IPSP). Auch können Synapsen auf andere "aufgeschaltet "sein und dadurch deren Wirkung verändern (z.B. präsynaptische Inhibition). Im Neocortex sind Neuronengruppen zu kortikalen Säulen organisiert - mit jeweils ~1 mm3 Volumen, ~104 Neuronen und ~108 Synapsen; diese Recheneinheiten sind modular miteinander verschaltet. Assoziationsfasern stellen Kontakte mit Nachbarsäulen und entfernteren Teilen der Hemisphäre (ipsilateralen Arealen) her, Kommissurenfasern mit kontralateralen Rindengebieten (Seitenkreuzung im Balken), Projektionsfasern mit Neuronen außerhalb des Cortex. Die Gesamtheit der Verbindungen im Nervensystem wird als Konnektom bezeichnet. |
 Großhirnrinde
Großhirnrinde  Neuronale Verbindungen
Neuronale Verbindungen  Transmitter
Transmitter  Hirnrinde, Bewusstsein und Hirnstamm
Hirnrinde, Bewusstsein und Hirnstamm  Lateralisation
Lateralisation  kortikale Säulen
kortikale Säulen  Assoziationscortex
Assoziationscortex  Entstehung kortikaler Potentiale, EEG
Entstehung kortikaler Potentiale, EEG 
 Reelin
Reelin  Aufmerksamkeit
Aufmerksamkeit  Bewusstsein
Bewusstsein  Konnektom
Konnektom  Assoziationscortex
Assoziationscortex
 Core messages
Core messages Registrieren (Beobachten
von Aktivität). Dieser Weg bezieht sich in erster Linie auf das Studium
der neuronalen Antworten auf etwas, was erlebt wird
(Sinneseindrücke,..) oder bei Bewegungen auftritt. Die Beziehung
zwischen dem auslösenden Ereignis und der abgeleiteten Nervenaktivität
wird umso weniger voraussagbar, je weiter entfernt von dem Auslöser
registriert wird (z.B. optischer Reiz → Sinneszelle → Sehnerv → Okzipitalrinde...).
Registrieren (Beobachten
von Aktivität). Dieser Weg bezieht sich in erster Linie auf das Studium
der neuronalen Antworten auf etwas, was erlebt wird
(Sinneseindrücke,..) oder bei Bewegungen auftritt. Die Beziehung
zwischen dem auslösenden Ereignis und der abgeleiteten Nervenaktivität
wird umso weniger voraussagbar, je weiter entfernt von dem Auslöser
registriert wird (z.B. optischer Reiz → Sinneszelle → Sehnerv → Okzipitalrinde...). Stimulieren
(Reizung von Nervenzellen). Wie sieht ein
"physiologischer" Stimulus aus, der eine definierbare Antwort zur
Folge hat? Beispiel: Reizung einer Zelle der "motorischen" area 4 der Großhirnrinde
führt nicht unbedingt zu einem motorischen Effekt; die Interaktion
zwischen Neuronen ist komplex, die Aktivierung einzelner Zellen
kann unterschiedliche - oder keine beobachtbaren - Auswirkungen haben.
Stimulieren
(Reizung von Nervenzellen). Wie sieht ein
"physiologischer" Stimulus aus, der eine definierbare Antwort zur
Folge hat? Beispiel: Reizung einer Zelle der "motorischen" area 4 der Großhirnrinde
führt nicht unbedingt zu einem motorischen Effekt; die Interaktion
zwischen Neuronen ist komplex, die Aktivierung einzelner Zellen
kann unterschiedliche - oder keine beobachtbaren - Auswirkungen haben.  Ausschalten. Was kann man aus der Läsion einer Gehirnregion lernen? Das kommt auf die normale Funktion des entsprechenden Zellverbandes an (hat dieser
beispielsweise inhibitorische Funktion, führt seine Ausschaltung nicht zu einem Ausfall, sondern zu Überaktivität zerebraler Aktivität).
Ausschalten. Was kann man aus der Läsion einer Gehirnregion lernen? Das kommt auf die normale Funktion des entsprechenden Zellverbandes an (hat dieser
beispielsweise inhibitorische Funktion, führt seine Ausschaltung nicht zu einem Ausfall, sondern zu Überaktivität zerebraler Aktivität).
 (Ge-) Hirn: idg. *ker (cerebrum!) = oberster Körperteil
(Ge-) Hirn: idg. *ker (cerebrum!) = oberster Körperteil Abbildung),
den es mit anderen Wirbeltieren teilt - was den Lauf der Phylogenese
widerspiegelt. Viele funktionelle Eigenheiten der Arbeitsweise unseres
Nervensystems werden durch die Kenntnis dieses Grundplans
verständlicher.
Abbildung),
den es mit anderen Wirbeltieren teilt - was den Lauf der Phylogenese
widerspiegelt. Viele funktionelle Eigenheiten der Arbeitsweise unseres
Nervensystems werden durch die Kenntnis dieses Grundplans
verständlicher. 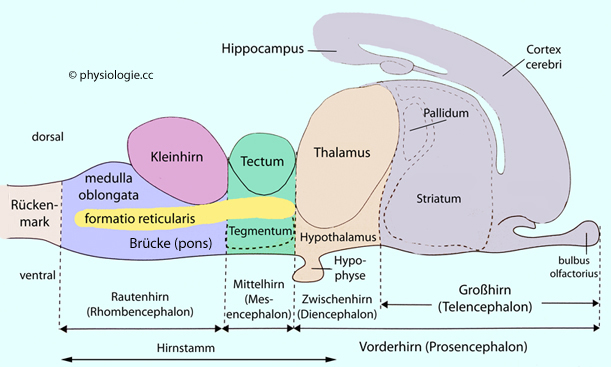
 Abbildung: Struktur eines Vertebratengehirns
Abbildung: Struktur eines Vertebratengehirns Rautenhirn (Rhombencephalon, hindbrain), bestehend aus Myelencephalon (=medulla oblongata, verlängertes Mark) und Metencephalon (pons
Rautenhirn (Rhombencephalon, hindbrain), bestehend aus Myelencephalon (=medulla oblongata, verlängertes Mark) und Metencephalon (pons plus Kleinhirn).
plus Kleinhirn). Mittelhirn (midbrain) - bestehend aus
dem sensorischen Tectum (Vierhügelplatte, colliculi) und dem motorischen Tegmentum. Durch das Rauten- und Mittelhirn zieht die formatio reticularis
Mittelhirn (midbrain) - bestehend aus
dem sensorischen Tectum (Vierhügelplatte, colliculi) und dem motorischen Tegmentum. Durch das Rauten- und Mittelhirn zieht die formatio reticularis  Zwischenhirn (Diencephalon) und
Zwischenhirn (Diencephalon) und Großhirn
(Endhirn, Telencephalon).
Großhirn
(Endhirn, Telencephalon). , dem Striatum
, dem Striatum und dem Pallium
und dem Pallium . Das dorsale Pallidum enthält den globus pallidus
(palaeostriatum).
. Das dorsale Pallidum enthält den globus pallidus
(palaeostriatum). , das Putamen
, das Putamen und den nucleus accumbens
und den nucleus accumbens . Zu den Basalganglien gehören auch der diencephale nucleus subthalamicus sowie die substantia
nigra an der Grenze zwischen Mes- und Diencephalon
. Zu den Basalganglien gehören auch der diencephale nucleus subthalamicus sowie die substantia
nigra an der Grenze zwischen Mes- und Diencephalon
 Neuronen erzeugen außer kurzzeitigen
Rechenoperationen auch Gedächtnis, d.h. die durch Synapsen übertragenen Informationen können langlebige Spuren hinterlassen (synaptische Plastizität, synaptisches Wachstum) und sich über längere Zeit (bis zu Jahrzehnten) auswirken.
Neuronen erzeugen außer kurzzeitigen
Rechenoperationen auch Gedächtnis, d.h. die durch Synapsen übertragenen Informationen können langlebige Spuren hinterlassen (synaptische Plastizität, synaptisches Wachstum) und sich über längere Zeit (bis zu Jahrzehnten) auswirken.  Über synaptische Kommunikation von Nervenzellen s. dort
Über synaptische Kommunikation von Nervenzellen s. dort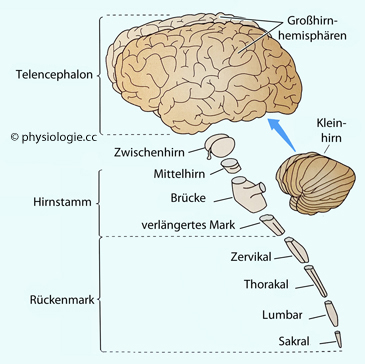
 Abbildung: Teile des Zentralnervensystems
Abbildung: Teile des Zentralnervensystems
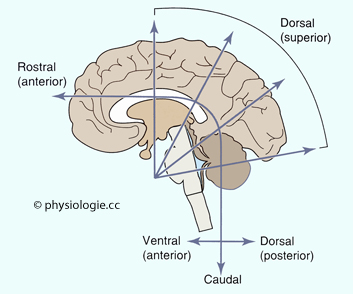
 Abbildung: Achsenbezeichnungen im Bereich des ZNS
Abbildung: Achsenbezeichnungen im Bereich des ZNS
 Abbildung).
Abbildung).  Über elektrophysiologische Grundlagen
s. dort
Über elektrophysiologische Grundlagen
s. dort  Über Durchblutung und Sauerstoffbedarf des Gehirns s. dort
Über Durchblutung und Sauerstoffbedarf des Gehirns s. dort
 Abbildung: Kortikale Netzwerke
Abbildung: Kortikale Netzwerke
 der fasciculus longitudinalis superior, er zieht vom Frontal- zum Parietal- und Temporalhirn (Aufmerksamkeit, Handlungskontrolle);
der fasciculus longitudinalis superior, er zieht vom Frontal- zum Parietal- und Temporalhirn (Aufmerksamkeit, Handlungskontrolle); der fasciculus occipitofrontalis, er zieht vom Okzipital- zum Frontalhirn (Verarbeitung sensorischer Information);
der fasciculus occipitofrontalis, er zieht vom Okzipital- zum Frontalhirn (Verarbeitung sensorischer Information); der fasciculus uncinatus, er zieht von Frontal- zum vorderen Temporalhirn (Emotions- und Sprachkontrolle);
der fasciculus uncinatus, er zieht von Frontal- zum vorderen Temporalhirn (Emotions- und Sprachkontrolle); der fasciculus arcuatus, er zieht vom hinteren Temporal- zum Frontalhirn (Sprachkontrolle);
der fasciculus arcuatus, er zieht vom hinteren Temporal- zum Frontalhirn (Sprachkontrolle); das Cingulum (medial), es zieht vom Frontal- zum mediotemporalen Gehirn inklusive entorhinalem Cortex (Gedächtnisverarbeitung);
das Cingulum (medial), es zieht vom Frontal- zum mediotemporalen Gehirn inklusive entorhinalem Cortex (Gedächtnisverarbeitung); der fasciculus longitudinalis inferior, er zieht vom Okzipital- zum Temporalhirn (Objekterkennung, Sprachverarbeitung);
der fasciculus longitudinalis inferior, er zieht vom Okzipital- zum Temporalhirn (Objekterkennung, Sprachverarbeitung); der fasciculus occipitalis verticalis, er zieht vom Okzipital- zum Parietalhirn (räumliche Wahrnehmung, Aufmerksamkeit).
der fasciculus occipitalis verticalis, er zieht vom Okzipital- zum Parietalhirn (räumliche Wahrnehmung, Aufmerksamkeit). Die Leistungsfähigkeit des Gehirns hängt von zahlreichen Parametern ab (Durchblutung, Sauerstoff- und Glucoseangebot,
Stoffwechsel, Zahl und Konnektivität von Neuronen, Isolation der Axone
durch Myelinscheide u.a.). Der Energiedurchsatz des menschlichen
Gehirns beträgt etwa 25 Watt (rund 1/4 des gesamten Grundumsatzes des
Körpers, der ~100 W beträgt). Die Leistungsfähigkeit eines Nervenverbunds steht in Relation zur Komplexität des zu bewältigenden Rechenaufwandes.
Die Leistungsfähigkeit des Gehirns hängt von zahlreichen Parametern ab (Durchblutung, Sauerstoff- und Glucoseangebot,
Stoffwechsel, Zahl und Konnektivität von Neuronen, Isolation der Axone
durch Myelinscheide u.a.). Der Energiedurchsatz des menschlichen
Gehirns beträgt etwa 25 Watt (rund 1/4 des gesamten Grundumsatzes des
Körpers, der ~100 W beträgt). Die Leistungsfähigkeit eines Nervenverbunds steht in Relation zur Komplexität des zu bewältigenden Rechenaufwandes. Als Hirnrinde (Cortex,
Hirnmantel, Pallium, cerebral cortex) bezeichnet man die äußere, an Nervenzellen bzw.
deren Somata und Dendritenbäumen reiche Schichte des Groß- (cortex cerebri) und Kleinhirns (cortex cerebelli). Die Großhirnrinde besteht zu ca. 90% aus dem sechsschichtigen Isocortex und zu ca. 10% aus dem drei- (olfaktorischer Cortex) bis vierschichtigen Allocortex (Palaeocortex, Periallocortex).
Als Hirnrinde (Cortex,
Hirnmantel, Pallium, cerebral cortex) bezeichnet man die äußere, an Nervenzellen bzw.
deren Somata und Dendritenbäumen reiche Schichte des Groß- (cortex cerebri) und Kleinhirns (cortex cerebelli). Die Großhirnrinde besteht zu ca. 90% aus dem sechsschichtigen Isocortex und zu ca. 10% aus dem drei- (olfaktorischer Cortex) bis vierschichtigen Allocortex (Palaeocortex, Periallocortex). führt das Gehirn geschätzte 1016 Rechenoperationen pro Sekunde durch (jedes Neuron kann von anderen Neuronen über bis zu ~104 Synapsen kontaktiert werden).
führt das Gehirn geschätzte 1016 Rechenoperationen pro Sekunde durch (jedes Neuron kann von anderen Neuronen über bis zu ~104 Synapsen kontaktiert werden).  Pyramidenzellen (pyramidal cells) haben einenen ausgeprägten apikalen Dendrit ("Antenne") und an der Zellbasis mehrere basale Dendriten. Sie kommen in der lamina V als große Pyramidenzellen vor und projizieren (d.h. ihr Axon erstreckt sich bis) auf subkortikale Ziele, stellen also die Efferenz der Rinde dar. Kleine Pyramidenzellen finden sich in lamina III und projizieren auf benachbarte Ziele in der Hirnrinde (vertikale Kolumnen); diese Zellen haben assoziative Funktion.
Pyramidenzellen (pyramidal cells) haben einenen ausgeprägten apikalen Dendrit ("Antenne") und an der Zellbasis mehrere basale Dendriten. Sie kommen in der lamina V als große Pyramidenzellen vor und projizieren (d.h. ihr Axon erstreckt sich bis) auf subkortikale Ziele, stellen also die Efferenz der Rinde dar. Kleine Pyramidenzellen finden sich in lamina III und projizieren auf benachbarte Ziele in der Hirnrinde (vertikale Kolumnen); diese Zellen haben assoziative Funktion.  Sternzellen (stellate cells) bleiben mit ihren Fortsätzen in der Hirnrinde. Es gibt sie in zwei Varianten: Glatte Sternzellen (smooth stellates) sind inhibitorisch, nutzen GABA als Neurotransmitter und wirken als Interneurone, bedornte Sternzellen (spiny stellates) sind exzitatorisch und glutamaterg (s. weiter unten).
Sternzellen (stellate cells) bleiben mit ihren Fortsätzen in der Hirnrinde. Es gibt sie in zwei Varianten: Glatte Sternzellen (smooth stellates) sind inhibitorisch, nutzen GABA als Neurotransmitter und wirken als Interneurone, bedornte Sternzellen (spiny stellates) sind exzitatorisch und glutamaterg (s. weiter unten).
 Zur Geschichte der Hirnforschung s. dort (externer Link)
Zur Geschichte der Hirnforschung s. dort (externer Link)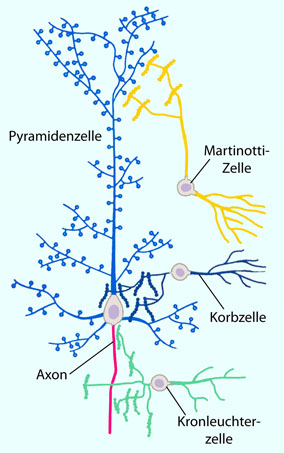
 Abbildung: Unterschiedliche Angriffszonen inhibitorischer Interneurone an einer Pyramidenzelle in der Großhirnrinde (Isocortex)
Abbildung: Unterschiedliche Angriffszonen inhibitorischer Interneurone an einer Pyramidenzelle in der Großhirnrinde (Isocortex) Martinotti-Zellen (Martinotti cells) dämpfen die Aktivität hocherregter Pyramidenzellen via axono-dendritischen Synapsen in oberen Rindenschichten
Martinotti-Zellen (Martinotti cells) dämpfen die Aktivität hocherregter Pyramidenzellen via axono-dendritischen Synapsen in oberen Rindenschichten Korbzellen (basket cells) wirken nahe dem oder direkt auf das Soma der Pyramidenzellen (axono-somatisch) inhibierend
Korbzellen (basket cells) wirken nahe dem oder direkt auf das Soma der Pyramidenzellen (axono-somatisch) inhibierend Kandelaberzellen (Kronleuchterzellen, chandelier cells) wirken ausschließlich auf das Axon der Pyramidenzelle (axono-axonal)
Kandelaberzellen (Kronleuchterzellen, chandelier cells) wirken ausschließlich auf das Axon der Pyramidenzelle (axono-axonal)

 Abbildung):
Abbildung): Die Mehrzahl der exzitatorischen (depolarisiernden) Synapsen findet sich auf dendritischen Dornenfortsätzen (dendritic spines) im Bereich der Dendriten - typischerweise ein präsynaptischer Input pro Dornenfortsatz.
Die Mehrzahl der exzitatorischen (depolarisiernden) Synapsen findet sich auf dendritischen Dornenfortsätzen (dendritic spines) im Bereich der Dendriten - typischerweise ein präsynaptischer Input pro Dornenfortsatz.  Inhibitorische Synapsen treten auf allen Teilen der Zielneurone auf
- schwerpunktmäßig je nach Art des Interneurons: Martinotti-Zellen
zielen auf distale Dendriten (und damit auf dendritische Spikes),
Korbzellen auf den Zellkörper (und damit auf die Integration der
Einflüsse von allen Dendriten), und Kandelaberzellen auf das Axon und
damit auf die Triggerung von Aktionspotentialen.
Diese Positionierung ermöglicht es inhibitorischen Synapsen, lokal auf
die Erregungsbildung des Zielneurons Einfluss zu nehmen
(Martinotti-Zellen hemmen die Bildung dendritischer Spikes, Korbzellen
beeinflussen die Summe dendritischer Einflüsse auf den Axonhügel,
Kandelaberzellen dämpfen direkt die Propagation axonaler
Aktionspotentiale).
Inhibitorische Synapsen treten auf allen Teilen der Zielneurone auf
- schwerpunktmäßig je nach Art des Interneurons: Martinotti-Zellen
zielen auf distale Dendriten (und damit auf dendritische Spikes),
Korbzellen auf den Zellkörper (und damit auf die Integration der
Einflüsse von allen Dendriten), und Kandelaberzellen auf das Axon und
damit auf die Triggerung von Aktionspotentialen.
Diese Positionierung ermöglicht es inhibitorischen Synapsen, lokal auf
die Erregungsbildung des Zielneurons Einfluss zu nehmen
(Martinotti-Zellen hemmen die Bildung dendritischer Spikes, Korbzellen
beeinflussen die Summe dendritischer Einflüsse auf den Axonhügel,
Kandelaberzellen dämpfen direkt die Propagation axonaler
Aktionspotentiale). Pyramidenzellen sind glutamaterg. Große Pyramidenzellen bauen die Efferenzen des Großhirns auf, ihre Axone verlassen den Cortex (Ausgang). Kleine Pyramidenzellen wirken assoziativ und projizieren auf kortikale Nachbargebiete.
Pyramidenzellen sind glutamaterg. Große Pyramidenzellen bauen die Efferenzen des Großhirns auf, ihre Axone verlassen den Cortex (Ausgang). Kleine Pyramidenzellen wirken assoziativ und projizieren auf kortikale Nachbargebiete. Körnerzellen (bedornte Sternzellen) empfangen extrakortikale Signale (Eingang)
und dominieren die lamina IV, wo zahlreiche Afferenzen aus dem Thalamus
und auch aus anderen Hirnregionen enden. Auch Körnerzellen sind
glutamaterg.
Körnerzellen (bedornte Sternzellen) empfangen extrakortikale Signale (Eingang)
und dominieren die lamina IV, wo zahlreiche Afferenzen aus dem Thalamus
und auch aus anderen Hirnregionen enden. Auch Körnerzellen sind
glutamaterg. Interneurone. Sie sind meist GABAerg, wirken also dämpfend; man unterscheidet zahlreiche Formen (unbedornte Sternzellen, fusiforme Zellen, Marinotti-Zellen, Horizontalzellen, Doppelbuschzellen, Kandelaberzellen / Kronleuchterzellen, bipolare Zellen).
Interneurone. Sie sind meist GABAerg, wirken also dämpfend; man unterscheidet zahlreiche Formen (unbedornte Sternzellen, fusiforme Zellen, Marinotti-Zellen, Horizontalzellen, Doppelbuschzellen, Kandelaberzellen / Kronleuchterzellen, bipolare Zellen).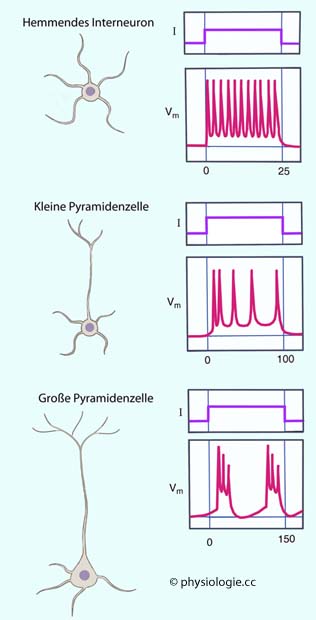
 Abbildung: Entladungsmuster verschiedener kortikaler Neuronen
Abbildung: Entladungsmuster verschiedener kortikaler Neuronen
 Abbildung). Einige reagieren auf kontinuierliche
elektrische Reizung mit fortdauernder Erregung (z.B. inhibitorische
Neurone); andere adaptieren (z.B. kleine Pyramidenzellen); wieder
andere beginnen sich rhythmisch zu entladen (z.B. große
Pyramidenzellen). Solche Zellen wirken u.a. als Rhythmusgeneratoren in
motorischen Kernen (z.B. im Atemzentrum).
Abbildung). Einige reagieren auf kontinuierliche
elektrische Reizung mit fortdauernder Erregung (z.B. inhibitorische
Neurone); andere adaptieren (z.B. kleine Pyramidenzellen); wieder
andere beginnen sich rhythmisch zu entladen (z.B. große
Pyramidenzellen). Solche Zellen wirken u.a. als Rhythmusgeneratoren in
motorischen Kernen (z.B. im Atemzentrum). Lamina I = Molekularschicht (lamina molecularis) (molecular layer)
Lamina I = Molekularschicht (lamina molecularis) (molecular layer) Lamina II = Äußere Körnerschicht (lamina granularis externa) (external granular cell layer)
Lamina II = Äußere Körnerschicht (lamina granularis externa) (external granular cell layer) Lamina III = Äußere Pyramidenschicht (lamina pyramidalis externa) (external pyramidal cell layer)
Lamina III = Äußere Pyramidenschicht (lamina pyramidalis externa) (external pyramidal cell layer)
 Lamina IV = Innere Körnerschicht (lamina granularis interna) (internal granular cell layer)
Lamina IV = Innere Körnerschicht (lamina granularis interna) (internal granular cell layer)
 Lamina V = Innere Pyramidenschicht (lamina pyramidalis interna) (internal pyramidal cell layer)
Lamina V = Innere Pyramidenschicht (lamina pyramidalis interna) (internal pyramidal cell layer)
 Lamina VI = Multiforme Schicht (lamina multiformis) (multiform / polymorphic layer)
Lamina VI = Multiforme Schicht (lamina multiformis) (multiform / polymorphic layer)
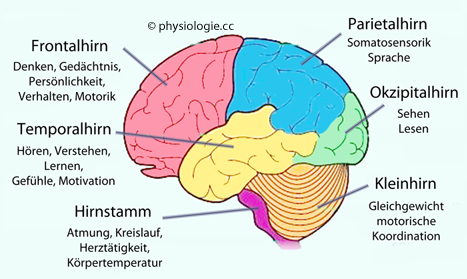
 Abbildung: Gehirnabschnitte und Funktionen (schematisch)
Abbildung: Gehirnabschnitte und Funktionen (schematisch)
 Abbildung) involviert sein können und oft eng
zusammenarbeiten.
Funktionelle Studien offenbaren die erstaunliche Dynamik (und
Individualität) bei der Aktivierung bestimmter Gehirnareale, wenn es um
die Bewältigung spezifischer Aufgaben geht.
Abbildung) involviert sein können und oft eng
zusammenarbeiten.
Funktionelle Studien offenbaren die erstaunliche Dynamik (und
Individualität) bei der Aktivierung bestimmter Gehirnareale, wenn es um
die Bewältigung spezifischer Aufgaben geht.

 Abbildung: Brodmann-Areale (BA)
Abbildung: Brodmann-Areale (BA)




































 eine auf zytoarchitektonischen Charakteristika beruhende Karte der Hirnrinde auf (Brodmann-Areale,
eine auf zytoarchitektonischen Charakteristika beruhende Karte der Hirnrinde auf (Brodmann-Areale,  Abbildung).
Abbildung). Assoziationsfasern verbinden Cortexareale miteinander,
Assoziationsfasern verbinden Cortexareale miteinander,  Projektionsfasern den Cortex mit subkortikalen Teilen des ZNS (z.B. Thalamus, Brücke).
Projektionsfasern den Cortex mit subkortikalen Teilen des ZNS (z.B. Thalamus, Brücke).  Kommissurenfasern verbinden die beiden Hälften des Gehirns miteinander (über das corpus callosum).
Kommissurenfasern verbinden die beiden Hälften des Gehirns miteinander (über das corpus callosum).  Zur Kommunikation von Neuronen s. auch dort
Zur Kommunikation von Neuronen s. auch dort EPSP, IPSP, Logische Operationen
EPSP, IPSP, Logische Operationen Abbildung: Typische Verschaltungsmuster zwischen Neuronen
Abbildung: Typische Verschaltungsmuster zwischen Neuronen
 Zur Ausbreitung von Aktionspotenzialen über kortikale Nervenzellen s. auch dort
Zur Ausbreitung von Aktionspotenzialen über kortikale Nervenzellen s. auch dort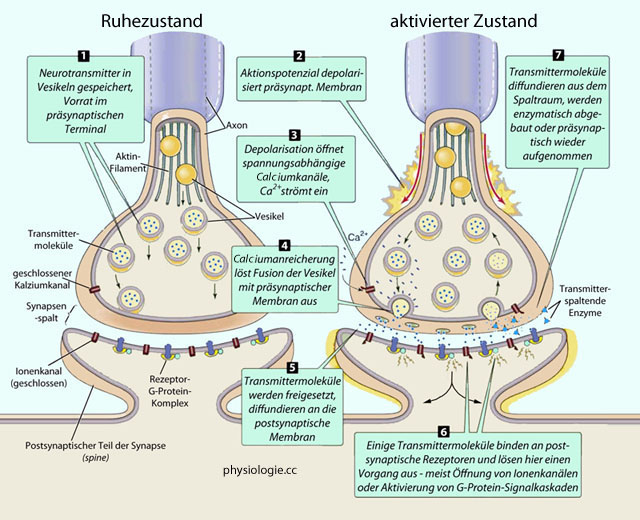
 Abbildung: Chemische Synapse
Abbildung: Chemische Synapse
 "Für
ihre Entdeckungen zur Signalübertragung im Nervensystem" wurde der
Nobelpreis für Physiologie oder Medizin 2000 dem Schweden Arvid Carlsson, dem US-Amerikaner Paul Greengard und dem in Wien geborenen Eric Kandel
zugesprochen. Während Carlsson die Rolle des Dopamins entdeckte und
Greengard an Neuriten komplexer Gehirnpräparate arbeitete, wählte
Kandel für seine Studien eine Meeresschnecke (Aplysia californica) als
einfachen Modellorganismus, von dessen sehr großen Neuronen
Potentialverläufe leicht ableitbar sind, der aber bereits Lernfähigkeit
zeigt.
"Für
ihre Entdeckungen zur Signalübertragung im Nervensystem" wurde der
Nobelpreis für Physiologie oder Medizin 2000 dem Schweden Arvid Carlsson, dem US-Amerikaner Paul Greengard und dem in Wien geborenen Eric Kandel
zugesprochen. Während Carlsson die Rolle des Dopamins entdeckte und
Greengard an Neuriten komplexer Gehirnpräparate arbeitete, wählte
Kandel für seine Studien eine Meeresschnecke (Aplysia californica) als
einfachen Modellorganismus, von dessen sehr großen Neuronen
Potentialverläufe leicht ableitbar sind, der aber bereits Lernfähigkeit
zeigt.  Abbildung) verändern dort das Membranpotential (postsynaptische Potentiale) und sind in ihrer Wirkung
teils
Abbildung) verändern dort das Membranpotential (postsynaptische Potentiale) und sind in ihrer Wirkung
teils  bahnend (depolarisierend: exzitatorische postsynaptische Potentiale, EPSPs - durch vermehrten Einstrom und/oder verringerten Ausstrom positiver Ladungsträger) oder
bahnend (depolarisierend: exzitatorische postsynaptische Potentiale, EPSPs - durch vermehrten Einstrom und/oder verringerten Ausstrom positiver Ladungsträger) oder  hemmend (inhibitorische postsynaptische Potentiale: IPSPs - z.B. durch Erhöhung der Chloridpermeabilität) auf die allfällige Generierung von Aktionspotentialen.
hemmend (inhibitorische postsynaptische Potentiale: IPSPs - z.B. durch Erhöhung der Chloridpermeabilität) auf die allfällige Generierung von Aktionspotentialen.
 Abbildung:
Konvergenz hemmender (inhibitorischer) und erregender (exzitatorischer)
synaptischer Einflüsse an einer Nervenzelle
Abbildung:
Konvergenz hemmender (inhibitorischer) und erregender (exzitatorischer)
synaptischer Einflüsse an einer Nervenzelle Näheres zu postsynaptischen Potentialen und Summation s. dort
Näheres zu postsynaptischen Potentialen und Summation s. dort
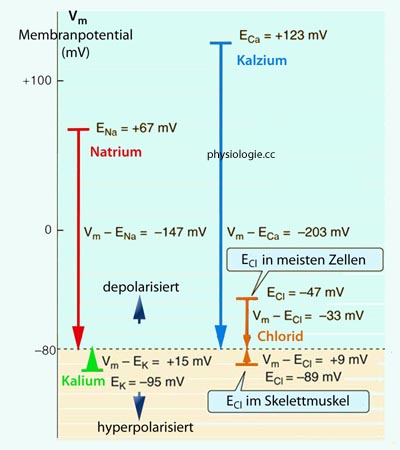
 Abbildung: Gleichgewichtspotentiale (E) und elektrochemische Gradienten für Natrium, Kalium, Calcium, Chlorid: Übersicht
Abbildung: Gleichgewichtspotentiale (E) und elektrochemische Gradienten für Natrium, Kalium, Calcium, Chlorid: Übersicht
 Abbildung), d.h. bei dieser (geringen)
Membranspannung fließt kein Cl- durch die Zellmembran
(Öffnung der Chloridkanäle bei diesem Potentialbetrag ändert nichts am
Membranpotential). Bei Skelettmuskelfasern hingegen beträgt [E]
für Chlorid -89 mV; bei einem Ruhepotential von -80 mV würde eine
Öffnung von Chloridkanälen daher zu Chlorideinstrom führen
(extrazelluläre Konzentration höher als intrazelluläre) und die Zelle
somit stärker aufladen.
Abbildung), d.h. bei dieser (geringen)
Membranspannung fließt kein Cl- durch die Zellmembran
(Öffnung der Chloridkanäle bei diesem Potentialbetrag ändert nichts am
Membranpotential). Bei Skelettmuskelfasern hingegen beträgt [E]
für Chlorid -89 mV; bei einem Ruhepotential von -80 mV würde eine
Öffnung von Chloridkanälen daher zu Chlorideinstrom führen
(extrazelluläre Konzentration höher als intrazelluläre) und die Zelle
somit stärker aufladen. Abbildung):
Abbildung): 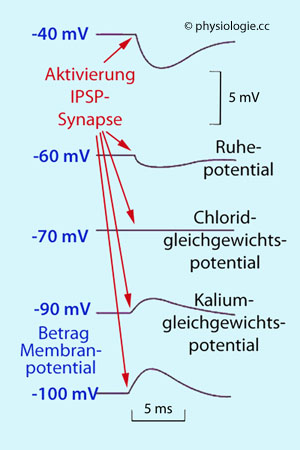
 Abbildung: Effekt der Aktivierung von IPSP-Synapsen bei unterschiedlichem Membranpotentialbetrag (blau)
Abbildung: Effekt der Aktivierung von IPSP-Synapsen bei unterschiedlichem Membranpotentialbetrag (blau) Abbildung unten) zu
Hyperpolarisierung und damit zu Inhibition (erschwerter Erregbarkeit
der postsynaptischen Zelle)
Abbildung unten) zu
Hyperpolarisierung und damit zu Inhibition (erschwerter Erregbarkeit
der postsynaptischen Zelle)
 Liegt das Membranpotential unter dem Betrag des
Chlorid-Gleichgewichtspotentials (wie beim Ruhepotential), kommt es zu
Einstrom von Cl- und Verstärkung der intrazellulären Negativität, also Hyperpolarisierung (inhibitorischer Effekt)
Liegt das Membranpotential unter dem Betrag des
Chlorid-Gleichgewichtspotentials (wie beim Ruhepotential), kommt es zu
Einstrom von Cl- und Verstärkung der intrazellulären Negativität, also Hyperpolarisierung (inhibitorischer Effekt) Liegt das Membranpotential auf dem Betrag des Chlorid-Gleichgewichtspotentials, tut sich gar nichts
Liegt das Membranpotential auf dem Betrag des Chlorid-Gleichgewichtspotentials, tut sich gar nichts Liegt das Membranpotential über
dem Betrag des Chlorid-Gleichgewichtspotentials, strömt Chlorid
aufgrund des starken elektrischen Gradienten aus der Zelle; Reizung der
Synapse führt zu Depolarisierung (reversal potential).
Liegt das Membranpotential über
dem Betrag des Chlorid-Gleichgewichtspotentials, strömt Chlorid
aufgrund des starken elektrischen Gradienten aus der Zelle; Reizung der
Synapse führt zu Depolarisierung (reversal potential). (s. unten), als inhibierende Glycin (z.B. Renshaw-Selbsthemmung motorischer Vorderhornzellen) und GABA
(γ-Aminobuttersäure). Allerdings ist die synaptische Wirkung nicht vom
Transmitter abhängig, sondern davon, welche Vorgänge die Aktivierung seiner Rezeptoren in der Empfänger-Zellmembran auslöst (
(s. unten), als inhibierende Glycin (z.B. Renshaw-Selbsthemmung motorischer Vorderhornzellen) und GABA
(γ-Aminobuttersäure). Allerdings ist die synaptische Wirkung nicht vom
Transmitter abhängig, sondern davon, welche Vorgänge die Aktivierung seiner Rezeptoren in der Empfänger-Zellmembran auslöst ( s. dort).
s. dort).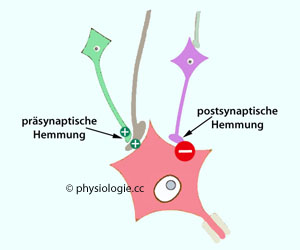 Prä- vs. postsynaptische Hemmung (
Prä- vs. postsynaptische Hemmung ( Abbildung):
Abbildung):  IPSP-Synapsen
(violettes Neuron) hemmen direkt am Neuronenkörper (axo-somatische
Synapse), indem sie das Membranpotential erhöhen (vorausgesetzt, der Betrag des
Membranpotentials ist geringer als der Betrag des
Chlorid-Gleichgewichtspotentials) und dadurch die
Erregbarkeit senken (größere Entfernung des Membranpotentials vom
Schwellenpotential). Man spricht von postsynaptischer Inhibition.
IPSP-Synapsen
(violettes Neuron) hemmen direkt am Neuronenkörper (axo-somatische
Synapse), indem sie das Membranpotential erhöhen (vorausgesetzt, der Betrag des
Membranpotentials ist geringer als der Betrag des
Chlorid-Gleichgewichtspotentials) und dadurch die
Erregbarkeit senken (größere Entfernung des Membranpotentials vom
Schwellenpotential). Man spricht von postsynaptischer Inhibition. Greifen axo-axonale Synapsen (grünes
Neuron) direkt an einer exzitatorischen Synapse an, indem sie diese
vordepolarisieren, dann senken sie dadurch den Effekt des Neurons
(hellbraun), das einen exzitierenden Transmitter (meist Glutamat)
abgibt.
Greifen axo-axonale Synapsen (grünes
Neuron) direkt an einer exzitatorischen Synapse an, indem sie diese
vordepolarisieren, dann senken sie dadurch den Effekt des Neurons
(hellbraun), das einen exzitierenden Transmitter (meist Glutamat)
abgibt.  Abbildung).
Abbildung).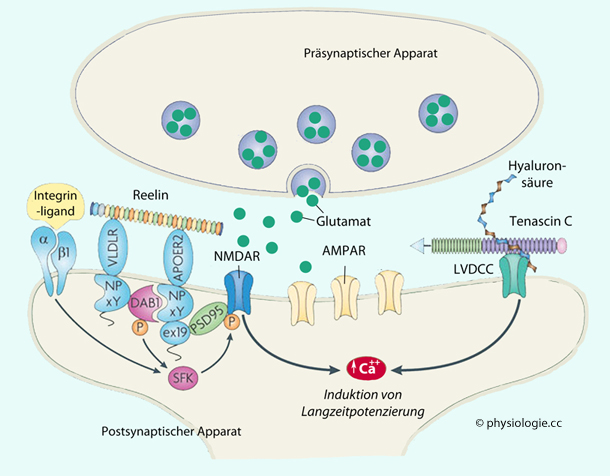
 Abbildung: Extrazelluläre Matrix und synaptische Plastizität
Abbildung: Extrazelluläre Matrix und synaptische Plastizität s. dort
s. dort  PSD95, postsynaptic density protein 95
- auch SAP-90 (synapse-associated protein 90 -, eine membran-assoziierte Guanylat-Kinase
PSD95, postsynaptic density protein 95
- auch SAP-90 (synapse-associated protein 90 -, eine membran-assoziierte Guanylat-Kinase Reelin
Reelin  ist ein von frühembryonalen Neuronen (Cajal–Retzius-Zellen) sezerniertes,
aus verschiedenen Subdomänen bestehendes Glykoprotein. Es bindet an Very-low-density lipoprotein-Rezeptoren und Apolipoprotein E-Rezeptoren (s. dort),
fördert die Neurogenese im wachsenden Gehirn, kontrolliert zelluläre
Interaktionen, beteiligt sich an der Steuerung der Migration und
Positionierung von Nervenzellen, regt die Bildung von Dendriten
(Spines) an und festigt das Langzeitgedächtnis.
ist ein von frühembryonalen Neuronen (Cajal–Retzius-Zellen) sezerniertes,
aus verschiedenen Subdomänen bestehendes Glykoprotein. Es bindet an Very-low-density lipoprotein-Rezeptoren und Apolipoprotein E-Rezeptoren (s. dort),
fördert die Neurogenese im wachsenden Gehirn, kontrolliert zelluläre
Interaktionen, beteiligt sich an der Steuerung der Migration und
Positionierung von Nervenzellen, regt die Bildung von Dendriten
(Spines) an und festigt das Langzeitgedächtnis. Die Signalübermittlung zwischen den Zellen erfolgt in verschiedenen Zeitbereichen:
Die Signalübermittlung zwischen den Zellen erfolgt in verschiedenen Zeitbereichen: Millisekunden (Aktionspotential, rasche Transmitter: spannungs- und
ligandenaktivierte Ionenkanäle)
Millisekunden (Aktionspotential, rasche Transmitter: spannungs- und
ligandenaktivierte Ionenkanäle) Sekunden bis Minuten (langsame
Transmitter, Neuromodulation, synaptische Plastizität: G-Proteine,
second messenger)
Sekunden bis Minuten (langsame
Transmitter, Neuromodulation, synaptische Plastizität: G-Proteine,
second messenger) Stunden (neuroaktive Drogen: Rezeptor
up-/down-Regulation) - oder auch länger (Remodelling: veränderte
Genexpression).
Stunden (neuroaktive Drogen: Rezeptor
up-/down-Regulation) - oder auch länger (Remodelling: veränderte
Genexpression).
 Abbildung: Schneller axonaler Transport
Abbildung: Schneller axonaler Transport
 Kinesinmoleküle bringen Passagiere
mit ~400 mm in 24 Stunden vom Zellkörper weg (anterograd: zum Plus-Ende),
Kinesinmoleküle bringen Passagiere
mit ~400 mm in 24 Stunden vom Zellkörper weg (anterograd: zum Plus-Ende),  Dyneine (wie MAP-1C: MAP = microtubule associated protein) etwas langsamer - mit 200 bis 300 mm in 24 Stunden - zum Soma hin (retrograd: zum Minus-Ende der Mikrotubuli,
Dyneine (wie MAP-1C: MAP = microtubule associated protein) etwas langsamer - mit 200 bis 300 mm in 24 Stunden - zum Soma hin (retrograd: zum Minus-Ende der Mikrotubuli,  Abbildung).
Abbildung).  Enzyme,
die sich an der Synthese des Transmitters beteiligen - z.B.
Dopa-Decarboxylase zur Umwandlung von DOPA in Dopamin oder
Dopamin-ß-Hydroxylase zur Bildung von Noradrenalin. Der so gebildete
Neurotransmitter wird vesikulär gespeichert und bei Erregung vesikulär freigesetzt;
Enzyme,
die sich an der Synthese des Transmitters beteiligen - z.B.
Dopa-Decarboxylase zur Umwandlung von DOPA in Dopamin oder
Dopamin-ß-Hydroxylase zur Bildung von Noradrenalin. Der so gebildete
Neurotransmitter wird vesikulär gespeichert und bei Erregung vesikulär freigesetzt; Propeptide,
aus denen in der Peripherie ein Peptid-Neurotransmitter abgespalten,
vesikulär gespeichert und bei Erregung vesikulär freigesetzt wird.
Propeptide,
aus denen in der Peripherie ein Peptid-Neurotransmitter abgespalten,
vesikulär gespeichert und bei Erregung vesikulär freigesetzt wird.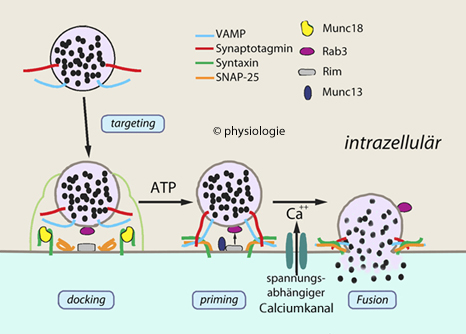
 Abbildung: Regulierte Exozytose (Modell) und SNARE-Komplex
Abbildung: Regulierte Exozytose (Modell) und SNARE-Komplex Rab3 (Ras-related), an Ca++-abhängiger Exozytose beteiligte Proteine
Rab3 (Ras-related), an Ca++-abhängiger Exozytose beteiligte Proteine  RIMs (Regulating synaptic membrane exocytosis proteins), Familie zur Ras-Superfamilie gehörenden Proteine, die an der Vesikel-Exozytose beteiligt sind
RIMs (Regulating synaptic membrane exocytosis proteins), Familie zur Ras-Superfamilie gehörenden Proteine, die an der Vesikel-Exozytose beteiligt sind  SNAP-25 (Synaptosomal nerve-associated protein), Teil des SNARE-Komplexes
SNAP-25 (Synaptosomal nerve-associated protein), Teil des SNARE-Komplexes  spannungsabhängige Caclciumkanäle s. dort
spannungsabhängige Caclciumkanäle s. dort  Synaptotagmine, Syntaxine s. dort
Synaptotagmine, Syntaxine s. dort  VAMP (vesicle-associated membrane protein), Familie vesikelassoziierter Proteine
VAMP (vesicle-associated membrane protein), Familie vesikelassoziierter Proteine 
 Abbildung). Sie bilden Membranporen aus, durch welche der Transmitter aus dem Vesikelspeicher entweichen kann.
Abbildung). Sie bilden Membranporen aus, durch welche der Transmitter aus dem Vesikelspeicher entweichen kann. Näheres zu SNARE-Proteinen s. dort
Näheres zu SNARE-Proteinen s. dort axono-dendritische Synapsen (wirken auf Dendriten),
axono-dendritische Synapsen (wirken auf Dendriten), axono-somatische Synapsen (wirken auf einen
Zellkörper) oder
axono-somatische Synapsen (wirken auf einen
Zellkörper) oder  axono-axonale Synapse (wirken auf ein Axon).
axono-axonale Synapse (wirken auf ein Axon). 
 Der wichtigste erregende (depolarisierende) Transmitter im Gehirn ist Glutamat (
Der wichtigste erregende (depolarisierende) Transmitter im Gehirn ist Glutamat ( Näheres s. dort).
Näheres s. dort). Abbildung).
Abbildung).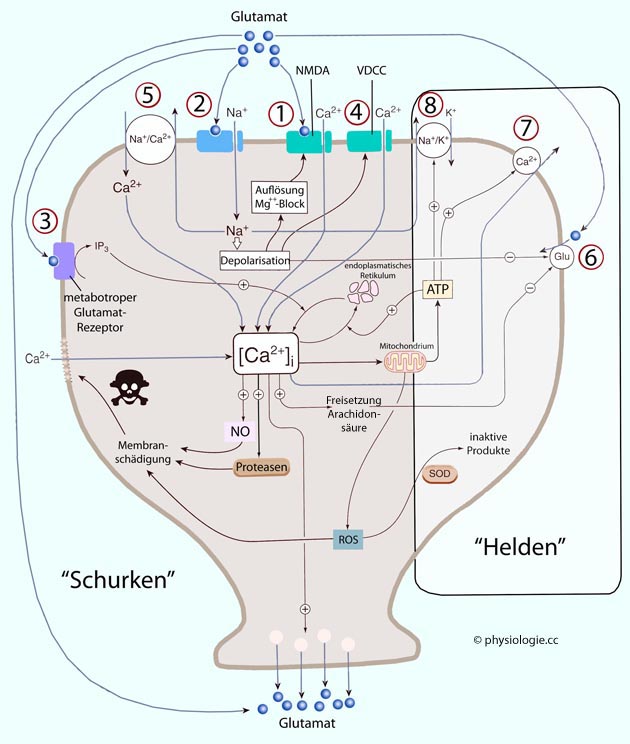
 Abbildung: Glutamatbedingte Exzitotoxizität
Abbildung: Glutamatbedingte Exzitotoxizität IP3 =
Inositoltriphosphat
IP3 =
Inositoltriphosphat  NMDA = ionotroper Glutamatrezeptor
NMDA = ionotroper Glutamatrezeptor  NO =
Stickstoffmonoxid
NO =
Stickstoffmonoxid  ROS = Sauerstoffradikale
ROS = Sauerstoffradikale  SOD = Superoxid-dismutase
SOD = Superoxid-dismutase  VDCC = spannungsgesteuerter Calciumkanal
VDCC = spannungsgesteuerter Calciumkanal

 GABA (
GABA ( Näheres s. dort)
Näheres s. dort)
 Glycin (
Glycin ( Näheres s. dort)
Näheres s. dort) vgl. dort
vgl. dort Unter Aufmerksamkeit (attention) versteht man einen kognitiven Vorgang, bei dem das Bewusstsein auf bestimmte Inhalte fokussiert wird. Von Vigilanz
Unter Aufmerksamkeit (attention) versteht man einen kognitiven Vorgang, bei dem das Bewusstsein auf bestimmte Inhalte fokussiert wird. Von Vigilanz  spricht man, wenn die Aufmerksamkeit auf Ereignisse ohne besonderen Neuigkeits- bzw. Überraschungswert gerichtet ist (auch "Wachheit", z.B. beim Autofahren).
spricht man, wenn die Aufmerksamkeit auf Ereignisse ohne besonderen Neuigkeits- bzw. Überraschungswert gerichtet ist (auch "Wachheit", z.B. beim Autofahren).  Der Begriff Bewusstsein (consciousness) hat
mehrere Bedeutungen, wie z.B.: Ein Zustand, bei dem Reize nicht nur
aufgenommen, sondern auch erlebt werden und der sich vom Schlafzustand
oder von Bewusstlosigkeit unterscheidet. Um bei Bewusstsein zu sein,
bedarf es jedenfalls der gleichzeitigen Aktivität mehrerer
Gehirnregionen - insbesondere der Großhirnrinde, des Thalamus und des
Hirnstamms.
Der Begriff Bewusstsein (consciousness) hat
mehrere Bedeutungen, wie z.B.: Ein Zustand, bei dem Reize nicht nur
aufgenommen, sondern auch erlebt werden und der sich vom Schlafzustand
oder von Bewusstlosigkeit unterscheidet. Um bei Bewusstsein zu sein,
bedarf es jedenfalls der gleichzeitigen Aktivität mehrerer
Gehirnregionen - insbesondere der Großhirnrinde, des Thalamus und des
Hirnstamms. Abbildung):
Abbildung): 
 Abbildung: Noradrenerge, serotoninerge, dopaminerge und cholinerge Projektionen aus dem Hirnstamm
Abbildung: Noradrenerge, serotoninerge, dopaminerge und cholinerge Projektionen aus dem Hirnstamm Über Acetylcholin, Katecholamine, Serotonin vgl. Hirnstammprojektionen
Über Acetylcholin, Katecholamine, Serotonin vgl. Hirnstammprojektionen
 Zu Histamin, ATP s. dort
Zu Histamin, ATP s. dort
 Zu Tachykininen und Opioiden s. dort
Zu Tachykininen und Opioiden s. dort
 Abbildung).
Abbildung). s. dort).
s. dort). 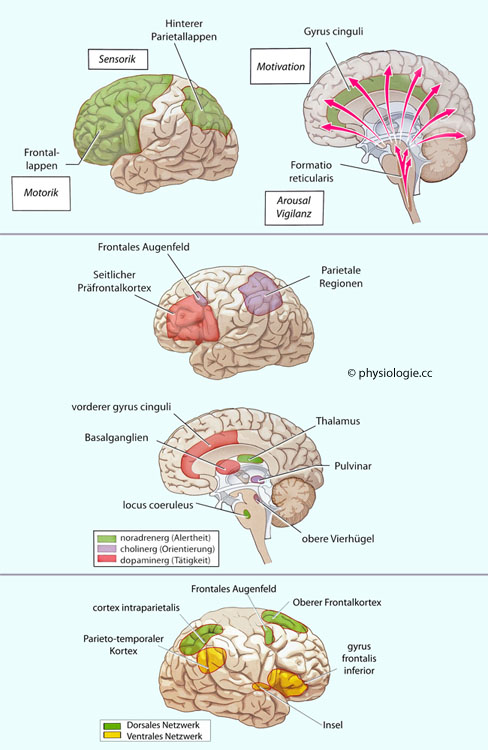
 Abbildung: Netzwerkmodelle der Aufmerksamkeit
Abbildung: Netzwerkmodelle der Aufmerksamkeit
 Abbildung:
Abbildung:  Nach dem klassischen Modell
nach M. Mesulam wird die Aufmerksamkeit durch ein kortikales Netzwerk
gesteuert, das teilweise spezialisiert, teilweise redundant angelegt
ist. Der hintere Parietalcortex entwirft eine sensorische
Karte der Umwelt, der gyrus cinguli ordnet die Aufmerksamkeit nach der
Bedeutung der Reizmuster für
die Motivation zu, das Frontalhirn entwirft situationsadäquate
motorische Programme.
Nach dem klassischen Modell
nach M. Mesulam wird die Aufmerksamkeit durch ein kortikales Netzwerk
gesteuert, das teilweise spezialisiert, teilweise redundant angelegt
ist. Der hintere Parietalcortex entwirft eine sensorische
Karte der Umwelt, der gyrus cinguli ordnet die Aufmerksamkeit nach der
Bedeutung der Reizmuster für
die Motivation zu, das Frontalhirn entwirft situationsadäquate
motorische Programme. Das Modell nach M. Posner und M. Rothbart geht von drei - ebenfalls interdependenten - Netzwerken aus: Ein dominiertes für Aufmerksamkeit (locus coeruleus, Thalamus, rechte Hemisphäre), ein noradrenergacetylcholinerges, selektierendes zur Orientierung (obere Vierhügel, Parietalcortex, frontales Augenfeld); und ein vermutlich dopaminerg gesteuertes zur Kontrolle zielgerichteter Handlungsabläufe (Basalganglien, Präfrontalhirn, vorderer gyrus cinguli).
Das Modell nach M. Posner und M. Rothbart geht von drei - ebenfalls interdependenten - Netzwerken aus: Ein dominiertes für Aufmerksamkeit (locus coeruleus, Thalamus, rechte Hemisphäre), ein noradrenergacetylcholinerges, selektierendes zur Orientierung (obere Vierhügel, Parietalcortex, frontales Augenfeld); und ein vermutlich dopaminerg gesteuertes zur Kontrolle zielgerichteter Handlungsabläufe (Basalganglien, Präfrontalhirn, vorderer gyrus cinguli).  Das Modell nach M. Corbetta und G. Shulman schlägt eine funktionelle Spezialisierung der visuellen Aufmerksamkeit auf zwei Subsysteme vor: Ein dorsales (intraparietaler Cortex, oberer Frontalcortex, frontales Augenfeld) stabilisiert die
Zielrichtung der Aufmerksamkeit ("top-down"); ein hauptsächlich in der
rechten Hirnhälfte befindliches, vielleicht in erster Linie vom locus coeruleus (noradrenerg) angetriebenes ventrales
Subsystem (temporoparietaler Cortex, unterer Frontalcortex, vordere
Insel) richtet die Aufmerksamkeit auf unerwartete neue Ziele und kann
damit laufende Zuwendung unterbrechen ("bottom-up").
Das Modell nach M. Corbetta und G. Shulman schlägt eine funktionelle Spezialisierung der visuellen Aufmerksamkeit auf zwei Subsysteme vor: Ein dorsales (intraparietaler Cortex, oberer Frontalcortex, frontales Augenfeld) stabilisiert die
Zielrichtung der Aufmerksamkeit ("top-down"); ein hauptsächlich in der
rechten Hirnhälfte befindliches, vielleicht in erster Linie vom locus coeruleus (noradrenerg) angetriebenes ventrales
Subsystem (temporoparietaler Cortex, unterer Frontalcortex, vordere
Insel) richtet die Aufmerksamkeit auf unerwartete neue Ziele und kann
damit laufende Zuwendung unterbrechen ("bottom-up").
 Die Hemisphären des Großhirns sind teilweise auf die Durchführung
unterschiedlicher Aufgaben spezialisiert (
Die Hemisphären des Großhirns sind teilweise auf die Durchführung
unterschiedlicher Aufgaben spezialisiert ( Abbildung).
Das äußert sich auch
anatomisch: Beispielsweise ist die seitliche Furche (fissura Sylvii
Abbildung).
Das äußert sich auch
anatomisch: Beispielsweise ist die seitliche Furche (fissura Sylvii  ),
die zwischen Temporal- und Parietallappen liegt, in der Mehrzahl der
Fälle links länger als rechts ausgeprägt (vor allem bei Rechtshändern),
die linke Insel ist größer als die rechte, die linke Hemisphäre weist
einen höheren Anteil an grauer Substanz auf u.a.
),
die zwischen Temporal- und Parietallappen liegt, in der Mehrzahl der
Fälle links länger als rechts ausgeprägt (vor allem bei Rechtshändern),
die linke Insel ist größer als die rechte, die linke Hemisphäre weist
einen höheren Anteil an grauer Substanz auf u.a.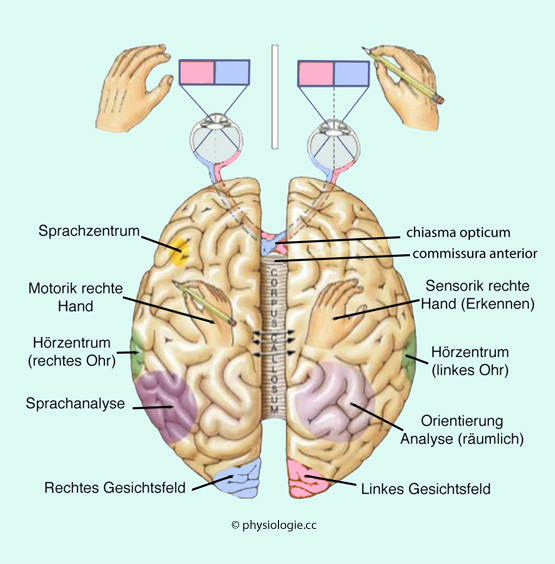
 Abbildung: Spezialisierung der Hemisphären (Lateralisation)
Abbildung: Spezialisierung der Hemisphären (Lateralisation)
| Bei den meisten Menschen ist die linke Hemisphäre sprachdominant |
 Den Nobelpreis 1982 für Physiologie oder Medizin erhielt der amerikanische Neurobiologe Roger Sperry "für seine Entdeckungen über die funktionelle Spezialisierung der Gehirnhemisphären". Zusammen mit Michael Gazzaniga
untersuchte er Patienten, denen der Balken durchtrennt wurde (split
brain) und beschrieb Details der Lateralisation.
Den Nobelpreis 1982 für Physiologie oder Medizin erhielt der amerikanische Neurobiologe Roger Sperry "für seine Entdeckungen über die funktionelle Spezialisierung der Gehirnhemisphären". Zusammen mit Michael Gazzaniga
untersuchte er Patienten, denen der Balken durchtrennt wurde (split
brain) und beschrieb Details der Lateralisation.
 die linke Hemisphäre auf adaptive Funktionen sowie das Lernern neuer Bewegungssequenzen und Fähigkeiten spezialisiert, wobei ihre prädiktive Fähigkeit im Sinne einer Kostenoptimierung eine Rolle spielen dürfte.
die linke Hemisphäre auf adaptive Funktionen sowie das Lernern neuer Bewegungssequenzen und Fähigkeiten spezialisiert, wobei ihre prädiktive Fähigkeit im Sinne einer Kostenoptimierung eine Rolle spielen dürfte. Die rechte Hemisphäre hingegen scheint sich um die Aktualisierung von Bewegungsabläufen und das Anhalten einer Bewegung bei Erreichen der Zielposition zu kümmern und dabei zur sensorimotorischen Stabilisierung beizutragen.
Die rechte Hemisphäre hingegen scheint sich um die Aktualisierung von Bewegungsabläufen und das Anhalten einer Bewegung bei Erreichen der Zielposition zu kümmern und dabei zur sensorimotorischen Stabilisierung beizutragen. )
fast ausschließlich die Kommunikation zwischen den beiden Hemisphären
übernimmt, bei Patienten zum Vorschein, denen der Balken aus Gründen
der Eindämmung von Krampfzuständen neurochirurgisch durchtrennt wurde (split brain).
Sie können mit ihrer nicht-sprachdominanten Hemisphäre Probleme korrekt
lösen, soferne dazu keine Sprachanalyse / Sprachproduktion nötig ist,
aber sie können dies nicht bewusst tun bzw. benennen (
)
fast ausschließlich die Kommunikation zwischen den beiden Hemisphären
übernimmt, bei Patienten zum Vorschein, denen der Balken aus Gründen
der Eindämmung von Krampfzuständen neurochirurgisch durchtrennt wurde (split brain).
Sie können mit ihrer nicht-sprachdominanten Hemisphäre Probleme korrekt
lösen, soferne dazu keine Sprachanalyse / Sprachproduktion nötig ist,
aber sie können dies nicht bewusst tun bzw. benennen ( Abbildung).
Abbildung).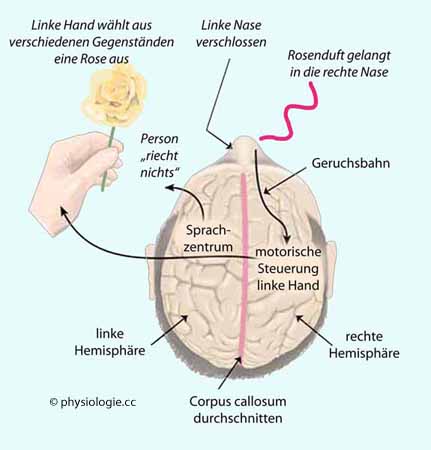
 Abbildung: Split brain: Beispiel Geruchsreiz (die linke Hemisphäre ist sprachdominant)
Abbildung: Split brain: Beispiel Geruchsreiz (die linke Hemisphäre ist sprachdominant)
 Zur Lateralisation der Sprachkontrolle s. auch dort
Zur Lateralisation der Sprachkontrolle s. auch dort s. auch dort).
s. auch dort).
 mit Nachbarsäulen;
mit Nachbarsäulen; mit weiter entfernten Rindenarealen
- Assoziationsfasern (association fibers) verbinden Teile der Rinde einer Hemisphäre
untereinander;
mit weiter entfernten Rindenarealen
- Assoziationsfasern (association fibers) verbinden Teile der Rinde einer Hemisphäre
untereinander; mit kontralateralen Rindengebieten - Kommissurenfasern (commissural fibers) verbinden die Rinde beider Hemisphären (sie
ziehen durch das corpus callosum);
mit kontralateralen Rindengebieten - Kommissurenfasern (commissural fibers) verbinden die Rinde beider Hemisphären (sie
ziehen durch das corpus callosum); mit extrakortikalen Zellen - Projektionsfasern (projection fibers) verknüpfen die
Großhirnrinde mit anderen Teilen des ZNS.
mit extrakortikalen Zellen - Projektionsfasern (projection fibers) verknüpfen die
Großhirnrinde mit anderen Teilen des ZNS. 
 Abbildung: Kortikale Module ("Säulen")
Abbildung: Kortikale Module ("Säulen")

 Abbildung):
Abbildung):
 Thalamokortikale ("afferente"),
Thalamokortikale ("afferente"),  s. unten,
s. unten,
 kortiko-kortikale, und
kortiko-kortikale, und 
 kortikofugale ("efferente") Projektionen.
kortikofugale ("efferente") Projektionen. Als Konnektom
(connectome) bezeichnet man die Gesamtheit der Verbindungen im Nervensystem. Es
betrifft sowohl die Verbindung zwischen einzelnen Zellen
("Mikroskala"), Schichten und Säulen in der Hirnrinde ("Mesoskala") wie
auch zwischen ganzen Hirnregionen ("Makroskala").
Als Konnektom
(connectome) bezeichnet man die Gesamtheit der Verbindungen im Nervensystem. Es
betrifft sowohl die Verbindung zwischen einzelnen Zellen
("Mikroskala"), Schichten und Säulen in der Hirnrinde ("Mesoskala") wie
auch zwischen ganzen Hirnregionen ("Makroskala").  (DTI: diffusion tensor imaging) wird dabei die Richtungsabhängigkeit erfasst (
(DTI: diffusion tensor imaging) wird dabei die Richtungsabhängigkeit erfasst ( Abbildung oben).
Abbildung oben).
 Abbildung). Die Pyramidenzellen der Schichte V haben
besonders ausgeprägte, lange und verzweigte Axone. Auch gibt es direkte
thalamokortikale Projektionen auf große Pyramidenzellen sowie auf
hemmende Interneurone. Schichte VI
schließlich erhält Information aus darüberliegenden Schichten sowie aus
intralaminären Thalamuskernen, und projiziert auf den Thalamus zurück.
Abbildung). Die Pyramidenzellen der Schichte V haben
besonders ausgeprägte, lange und verzweigte Axone. Auch gibt es direkte
thalamokortikale Projektionen auf große Pyramidenzellen sowie auf
hemmende Interneurone. Schichte VI
schließlich erhält Information aus darüberliegenden Schichten sowie aus
intralaminären Thalamuskernen, und projiziert auf den Thalamus zurück. Als Assoziationscortex bezeichnet
man Teile der Hirnrinde, die (primär) keine motorische oder sensorische
Rolle spielen, sondern sich mit übergeordneter Verarbeitung
sensorischer Information befassen, die für komplexe Fähigkeiten wie
Lageerfassung (wo befindet sich mein Körper bezogen auf die Umwelt, in
welchem Zustand befindet er sich?) oder das Auslösen von
Verhaltenselementen (Bewegungsfolgen, gezielte Handlungen) erforderlich
sind.
Assoziative Areale haben übergreifende Aufgaben. Diese - für "hohe und höchste" Hirnleistungen verantwortlichen -
Teile der Hirnrinde sind insbesondere die folgenden (
Als Assoziationscortex bezeichnet
man Teile der Hirnrinde, die (primär) keine motorische oder sensorische
Rolle spielen, sondern sich mit übergeordneter Verarbeitung
sensorischer Information befassen, die für komplexe Fähigkeiten wie
Lageerfassung (wo befindet sich mein Körper bezogen auf die Umwelt, in
welchem Zustand befindet er sich?) oder das Auslösen von
Verhaltenselementen (Bewegungsfolgen, gezielte Handlungen) erforderlich
sind.
Assoziative Areale haben übergreifende Aufgaben. Diese - für "hohe und höchste" Hirnleistungen verantwortlichen -
Teile der Hirnrinde sind insbesondere die folgenden ( Abbildung):
Abbildung):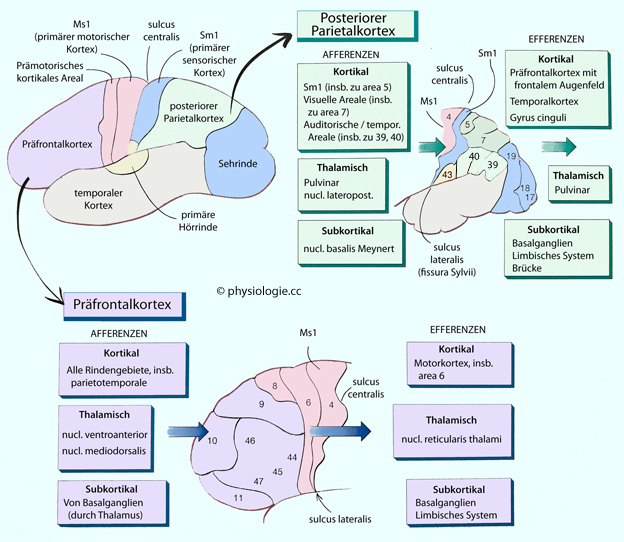
 Abbildung: Assoziationscortices
Abbildung: Assoziationscortices
 Posteriorer Parietalcortex (insbesondere area 39 und 40; Brodmann-Areale s. dort),
Posteriorer Parietalcortex (insbesondere area 39 und 40; Brodmann-Areale s. dort), Präfrontaler Cortex (entsprechend area 9-12 und 44-47),
Präfrontaler Cortex (entsprechend area 9-12 und 44-47), Temporaler Cortex (entsprechend area 21, 22, 37, 41-43).
Temporaler Cortex (entsprechend area 21, 22, 37, 41-43).  s. dort).
s. dort).
 Im
19. Jahrhundert etablierte sich die Vorstellung, dass diese Zuordnungen
- bestimmte Fähigkeiten seien in entsprechenden Hirnarealen
repräsentiert - Rückschlüsse auf die Persönlichkeit erlauben (z.B.
mathematische Fähigkeiten, Aggressionsbereitschaft, kriminelle
Neigungen...), nicht nur was die Ausprägung bestimmter Rindengebiete
betrifft, sondern z.T. sogar über die Kopfform (Lokalisationslehre, Phrenologie).
Die moderne Hirnforschung hat solche simplen Vorstellungen durch
neurophysiologisch fundierte Erkenntnisse ersetzt und u.a. gezeigt,
dass die Aktivität des Gehirns zwar einerseits auf aktuelle Probleme
fokussiert, gleichzeitig aber global, äußerst vernetzt und
bemerkenswert anpassungs- und lernfähig ist. Die Gestalt der
Hirnoberfläche läßt die "Persönlichkeit" eines Menschen nicht erkennen.
Im
19. Jahrhundert etablierte sich die Vorstellung, dass diese Zuordnungen
- bestimmte Fähigkeiten seien in entsprechenden Hirnarealen
repräsentiert - Rückschlüsse auf die Persönlichkeit erlauben (z.B.
mathematische Fähigkeiten, Aggressionsbereitschaft, kriminelle
Neigungen...), nicht nur was die Ausprägung bestimmter Rindengebiete
betrifft, sondern z.T. sogar über die Kopfform (Lokalisationslehre, Phrenologie).
Die moderne Hirnforschung hat solche simplen Vorstellungen durch
neurophysiologisch fundierte Erkenntnisse ersetzt und u.a. gezeigt,
dass die Aktivität des Gehirns zwar einerseits auf aktuelle Probleme
fokussiert, gleichzeitig aber global, äußerst vernetzt und
bemerkenswert anpassungs- und lernfähig ist. Die Gestalt der
Hirnoberfläche läßt die "Persönlichkeit" eines Menschen nicht erkennen.
 Abbildung: Lokales kortikales Spannungsfeld
Abbildung: Lokales kortikales Spannungsfeld
 Abbildung).
Abbildung).| Summierte EPSPs sind eine Grundlage der Entstehung eines EEG |
| Aufmerksame mentale Beschäftigung (wie Lernen) erzeugt γ-Wellen (30-40 / Sekunde) |
 s. dort).
s. dort).| Der thalamische Grundrhythmus erzeugt EEG-Wellen im α-Rhythmus |
 s. dort.
s. dort. | Augen öffnen |
Beste motorische Reaktion |
Beste verbale Reaktion |
Punkte |
| - |
befolgt Aufforderungen |
- |
6 |
| - |
gezielte Reaktion auf Schmerzreize |
orientiert |
5 |
| spontan |
ungezielte Reaktion auf Schmerzreize |
desorientierte, konfuse Antwort |
4 |
| auf Ansprechen |
abnorme Beugereaktionen |
inadäquate Äußerung |
3 |
| auf Schmerzreiz |
abnorme Streckreaktionen |
unverständliche Laute |
2 |
| keine Reaktion |
keine Reaktion |
keine Äußerung |
1 |
  Hauptfunktionen: Das Telenzephalon steuert Kognition und Verhalten; das Dienzephalon
ordnet sensorische Information; das Mittelhirn verwaltet basale
sensorische und motorische Funktionen; das Kleinhirn koordiniert
motorische Abläufe; die medulla oblongata überwacht Kreislauf, Atmung
und andere vitale Funktionen
Hauptfunktionen: Das Telenzephalon steuert Kognition und Verhalten; das Dienzephalon
ordnet sensorische Information; das Mittelhirn verwaltet basale
sensorische und motorische Funktionen; das Kleinhirn koordiniert
motorische Abläufe; die medulla oblongata überwacht Kreislauf, Atmung
und andere vitale Funktionen Die Großhirnrinde enthält Pyramidenzellen (glutamaterge Efferenzen),
Körnerzellen (glutamaterge Afferenzen) und Interneurone (meist
GABAerg)
Die Großhirnrinde enthält Pyramidenzellen (glutamaterge Efferenzen),
Körnerzellen (glutamaterge Afferenzen) und Interneurone (meist
GABAerg) Der Isocortex ist sechsschichtig: Lamina I, Molekularschicht
(Afferenzen, Assoziationsfasern); Lamina II, äußere Körnerschicht
(Interneurone zwischen Pyramidenzellen); Lamina III, äußere
Pyramidenschicht (Pyramidenzellen); Lamina IV, innere Körnerschicht
(Afferenzen vom Thalamus); Lamina V, innere Pyramidenschicht
(Assoziations- und Projektionssysteme); Lamina VI, multiforme Schicht
(bidirektionale Verbindungen mit Thalamus)
Der Isocortex ist sechsschichtig: Lamina I, Molekularschicht
(Afferenzen, Assoziationsfasern); Lamina II, äußere Körnerschicht
(Interneurone zwischen Pyramidenzellen); Lamina III, äußere
Pyramidenschicht (Pyramidenzellen); Lamina IV, innere Körnerschicht
(Afferenzen vom Thalamus); Lamina V, innere Pyramidenschicht
(Assoziations- und Projektionssysteme); Lamina VI, multiforme Schicht
(bidirektionale Verbindungen mit Thalamus) Der Axonhügel ist der erregbarste Teil des Neurons und der
Entstehungsort von Aktionspotentialen ("Sender"). Diese laufen über das
ganze Neuron, einerseits über den Neuriten in die Peripherie mit
synaptischen Endigungen (Efferenz), andererseits über den Zellkörper
mit seinen dendritischen Verzweigungen (Löschung laufender
Summationsprozesse)
Der Axonhügel ist der erregbarste Teil des Neurons und der
Entstehungsort von Aktionspotentialen ("Sender"). Diese laufen über das
ganze Neuron, einerseits über den Neuriten in die Peripherie mit
synaptischen Endigungen (Efferenz), andererseits über den Zellkörper
mit seinen dendritischen Verzweigungen (Löschung laufender
Summationsprozesse) Dendriten fungieren als Signalantennen der Nervenzellen ("Empfänger"), sie sammeln
synaptische Einflüsse von anderen Nervenzellen und leiten diese auf elektrotonischem Weg auf die Nachbarmembran.
Je näher die Synapsen am Axonhügel liegen, desto stärker ist ihr Effekt auf die Aktivität (Aktionspotentialfrequenz) des Neurons Dendriten fungieren als Signalantennen der Nervenzellen ("Empfänger"), sie sammeln
synaptische Einflüsse von anderen Nervenzellen und leiten diese auf elektrotonischem Weg auf die Nachbarmembran.
Je näher die Synapsen am Axonhügel liegen, desto stärker ist ihr Effekt auf die Aktivität (Aktionspotentialfrequenz) des Neurons Summation bedeutet, dass sich der Einfluss einzelner Synapsen am
"Empfangsteil" der Nervenzelle zu einem Gesamteffekt
(Membranpotential) addiert. Es gibt depolarisierende
(exzitatorische) und hyperpolarisierende (inhibitorische) Einflüsse: So
wirken Glutamat typischerweise exzitatorisch, Glycin und GABA
inhibitorisch. Die synaptische Wirkung hängt von den Mechanismen ab,
welche die Transmitter an der postsynaptischen Membran auslösen.
L-Glutamat ist ein Transmitter, der meist exzitatorisch wirkt - über
Ionenkanäle (NMDA-, AMPA-Rezeptoren) oder metabotrop (über G-Proteine).
GABA wirkt über ionotrope (GABAA) oder metabotrope Rezeptoren (GABAB), Glycin über Chloridkanäle
Summation bedeutet, dass sich der Einfluss einzelner Synapsen am
"Empfangsteil" der Nervenzelle zu einem Gesamteffekt
(Membranpotential) addiert. Es gibt depolarisierende
(exzitatorische) und hyperpolarisierende (inhibitorische) Einflüsse: So
wirken Glutamat typischerweise exzitatorisch, Glycin und GABA
inhibitorisch. Die synaptische Wirkung hängt von den Mechanismen ab,
welche die Transmitter an der postsynaptischen Membran auslösen.
L-Glutamat ist ein Transmitter, der meist exzitatorisch wirkt - über
Ionenkanäle (NMDA-, AMPA-Rezeptoren) oder metabotrop (über G-Proteine).
GABA wirkt über ionotrope (GABAA) oder metabotrope Rezeptoren (GABAB), Glycin über Chloridkanäle Neurotransmitter werden von Nervenzellen (präsynaptischer Teil:
Neuritenende) im Rahmen eines kontrollierten Vorgangs
freigesetzt: Proteinkomplexe in präsynaptischen Speichervesikeln
(SNAREs) befördern die Exozytose des Transmitters in den synaptischen
Spalt. Synapsen können an Dendriten (axono-dendritisch), am Zellkörper
(axono-somatisch) oder am Axon (axono-axonal) der Zielzelle wirken
Neurotransmitter werden von Nervenzellen (präsynaptischer Teil:
Neuritenende) im Rahmen eines kontrollierten Vorgangs
freigesetzt: Proteinkomplexe in präsynaptischen Speichervesikeln
(SNAREs) befördern die Exozytose des Transmitters in den synaptischen
Spalt. Synapsen können an Dendriten (axono-dendritisch), am Zellkörper
(axono-somatisch) oder am Axon (axono-axonal) der Zielzelle wirken Das Gehirn zeigt Lateralisation: Die linke Hemisphäre Spezialisierung auf adaptive Funktionen
und das Lernern neuer Bewegungssequenzen, die rechte auf Aktualisierung
von Bewegungsabläufen und sensorimotorische Stabilisierung bei
Erreichen einer Zielposition. Bei Läsionen können kontralaterale Teile
Funktionsausfälle kompensieren
Das Gehirn zeigt Lateralisation: Die linke Hemisphäre Spezialisierung auf adaptive Funktionen
und das Lernern neuer Bewegungssequenzen, die rechte auf Aktualisierung
von Bewegungsabläufen und sensorimotorische Stabilisierung bei
Erreichen einer Zielposition. Bei Läsionen können kontralaterale Teile
Funktionsausfälle kompensieren Kortikale Kolumnen (~1,5 mm hoch, ~0,5 mm Durchmesser) sind
Recheneinheiten in der Hirnrinde; sie kommunizieren mit
Nachbarkolumnen, weiter entfernten (auch kontralateralen) Rindenarealen
sowie extrakortikalen Zellen. Die Verbindungsfasern folgen einem
rechtwinkelig zueinander orientierten Koordinatensystem
Kortikale Kolumnen (~1,5 mm hoch, ~0,5 mm Durchmesser) sind
Recheneinheiten in der Hirnrinde; sie kommunizieren mit
Nachbarkolumnen, weiter entfernten (auch kontralateralen) Rindenarealen
sowie extrakortikalen Zellen. Die Verbindungsfasern folgen einem
rechtwinkelig zueinander orientierten Koordinatensystem Das EEG beruht im Wesentlichen auf der Summe von EPSPs, deren
elektrische Signaturen sich über das Interstitium fortpflanzen. Der
thalamische Grundrhythmus erzeugt α-Rhythmus (8-12 Wellen pro Sekunde),
intensive mentale Beschäftigung γ-Wellen (30-40 / Sekunde)
Das EEG beruht im Wesentlichen auf der Summe von EPSPs, deren
elektrische Signaturen sich über das Interstitium fortpflanzen. Der
thalamische Grundrhythmus erzeugt α-Rhythmus (8-12 Wellen pro Sekunde),
intensive mentale Beschäftigung γ-Wellen (30-40 / Sekunde) |
