 Elektro-: ἤλεκτρον = Bernstein (an ihm wurde die Elektrizität zuerst beobachtet)
Elektro-: ἤλεκτρον = Bernstein (an ihm wurde die Elektrizität zuerst beobachtet)
enzephalo-: ἐγκέφαλον = Gehirn
-graphie: γραφή = Schrift, Aufzeichnung
kardio-: καρδία = Herz
myo-: μυς, μυός = Muskel
nystagmo-: νυσταγμός = Schläfrigkeit
oculo-: oculus = Auge
orthodrom: ὀρθοδρόμος = in die richtige Richtung (geradeaus) laufend
Patch-clamp-Technik: patch = Fleck, Pflästerchen (Membranausschnitt unter der Patch-Pipette); to clamp = festklemmen (den Membranpatch auf ein Potential)
retino-: rete = Netz (Retina = Netzhaut)
Aktionspotentiale bewirken bei ihrer Bewegung durch erregtes Gewebe elektromagnetische
Potentialschwankungen. Entsprechende elektrische Signale kann man von Einzelzellen, Organen oder der
Körperoberfläche ableiten. Dazu verwendet man Ableitelektroden und bezeichnet diese als different (durch die interessierenden Potentialschwankungen wesentlich beeinflusst) oder als indifferent (davon weitgehend unbeeinflusst, aber zur Komplettierung notwendig) bezeichnet.
Auch die Stellen, von denen abgeleitet wird, bzw. die davon ausgehenden Signale kann man als different oder indifferent bezeichnen - je nachdem, ob sie unter dem Einfluss der interessierenden Potentialschwankungen stehen. Werden zwei differente Signale verglichen, handelt es sich um eine "bipolare" Ableitung (z.B. Einthoven-Schema eines EKG); ist nur eines different, ist die Ableitung "unipolar" (z.B. Wilson-Brustwandableitungen).
Die Registrierungen werden meist nach der Quelle des Signals bezeichnet
- z.B. Kardio- (Herz), Enzephalo- (Gehirn), Myo- (Muskel), Okulo- (Auge), Retinogramm (Netzhaut) - oder nach der
Art des erwarteten Signalmusters (z.B. Nystagmogramm).
Die meisten klinisch verwendeten Ableitungen sind nichtinvasiv; für spezielle Fragestellungen werden Elektrodem in den Körper eingebracht (invasiv). Liegen die Elektroden außerhalb von Zellen, handelt es sich um extrazelluläre
Ableitungen. Das Einbringen von (Glaskapillar-) Elektroden in Zellen macht deren Membranpotential messbar (keine Routinemaßnahme - neurophysiologische
Forschung), man spricht von intrazellulären Ableitungen.
|
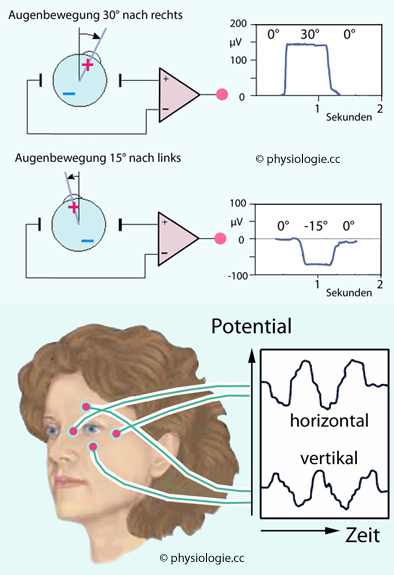
 Abbildung: Elektrookulographie (EOG)
Abbildung: Elektrookulographie (EOG)
Nach Vorlagen bei Kherlopian AR et al, Electrooculogram based system
for computer control using a multiple feature classification model.
Proc 28th IEEE EMBS Ann Int Conference NY City, sept 2006; und
biology-forums.com
Oben: Die Augen (vorne
positiv, rückwärts negativ geladen) verändern bei ihrer Bewegung die
Gestalt der sie umgebenden elektrischen Felder, und dementsprechend
verändert sich auch das Potential an der Haut im Gesichtsbereich.
Das ist von der Körperoberfläche her ableitbar (in diesem Beispiel in der Vertikalebene).
Unten: Registrierbeispiel eines Elektrookulogramms. Die Person
führt kreisförmige Augenbewegungen durch, die horizontalen und
vertikalen Bewegungen sind dementsprechend phasenverschoben. Position der Ableiteelektroden als rote Punkte gezeigt
Spezielle elektrophysiologische Ableitungen sind z.B. Elektro-
Kardio- (EKG),  Enzephalo- (EEG),
Enzephalo- (EEG),  Myo- (EMG),
Myo- (EMG),  Okulo- (EOG)
Okulo- (EOG)  (
( Abbildung),
Retino- (ERG),
Abbildung),
Retino- (ERG),  Nystagmographie (ENG).
Nystagmographie (ENG). 
Dies sind Beispiele für die Registrierung der elektrischen Aktivität
großer Gewebepartien oder ganzer Organe. Sie sind das Ergebnis der
Integration der Potentialveränderungen an sehr vielen einzelnen Zellen. Letztere können im Detail untersucht werden (siehe unten:
extrazelluläre und intrazelluläre Ableitungen), wie auch Membranstücke mit eingelagerten Ionenkanälen (Patch clamp
Technik).
 Zur Bestimmung der Nervenleitgeschwindigkeit
(NLG) s. unten und dort
Zur Bestimmung der Nervenleitgeschwindigkeit
(NLG) s. unten und dort
 Als Membranpotential (Vm) bezeichnet man den Unterschied des elektrischen Potentials (der Spannung) zwischen der Innenseite (Vin) und der Außenseite (Vex) einer Zellmembran (Vm = Vin - Vex).
Bezieht man sich auf das Potential an der Außenseite als Bezugsgröße
(auf diese Konvention hat man sich geeinigt), ist [Vex] = 0 und der
Betrag des Membranpotentials definitionsgemäß gleich [Vin] - bei nicht
aktivierten Nervenzellen meist -60 bis -70 mV ("Ruhepotential").
Als Membranpotential (Vm) bezeichnet man den Unterschied des elektrischen Potentials (der Spannung) zwischen der Innenseite (Vin) und der Außenseite (Vex) einer Zellmembran (Vm = Vin - Vex).
Bezieht man sich auf das Potential an der Außenseite als Bezugsgröße
(auf diese Konvention hat man sich geeinigt), ist [Vex] = 0 und der
Betrag des Membranpotentials definitionsgemäß gleich [Vin] - bei nicht
aktivierten Nervenzellen meist -60 bis -70 mV ("Ruhepotential").
Die Zellmembran ist Angriffspunkt für
Kontaktstellen zwischen mehreren Zellen, die der mechanischen
Festigkeit dienen (zwischen Epithelzellen, Herzmuskelzellen) oder der
Verbindung der Zellinnenräume, was den Austausch von Stoffen oder
das Fließen von elektrischen Membranströmen ermöglicht (Weiterleiten
von Aktionspotentialen: Signalfunktion).
Solche Verbindungskanäle
finden sich zwischen glatten Muskel- und Herzmuskelzellen und
ermöglichen die Fortpflanzung von Aktionspotentialen, z.B. im Lauf
eines Herzschlags.
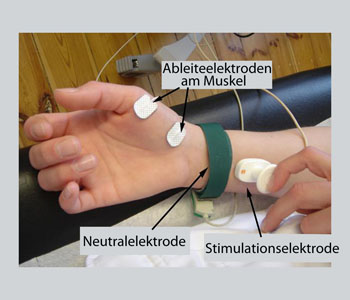
 Abbildung: Elektrophysiologische Versuchsanordnung
Abbildung: Elektrophysiologische Versuchsanordnung
Ableitelektroden am Daumenballen, Reizelektrode am Nerv. Nach elektrischer Reizung des Nerven können
vom Muskel Aktionspotentiale abgeleitet werden. Ist die
Signalüberleitung gestört, macht sich das durch Veränderungen der
abgeleiteten Potentialmuster bemerkbar
Das Verständnis bioelektrischer Vorgänge beruht auf zellphysiologischen Grundtatsachen. Kaliumionen
sind in der Zelle 30-mal höher konzentriert als extrazellulär. K+
diffundiert daher aus der Zelle und lädt die Membran zum Ruhepotential auf
(innen negativ, außen positiv) die elektrische Spannung beträgt
bis zu ~90 mV (Millivolt), z.B. bei Skelettmuskelfasern.
Grundlage solcher elektrischer Potentiale
sind Ionenbewegungen durch die Zellmembran. Diese werden durch komplex
strukturierte Öffnungen ("Kanäle", "Permeasen") für Natrium-, Kalium-, Chlorid-, Calcium- oder
Magnesiumionen geschleust.
 Das Ruhepotential der Zellen beruht im Wesentlichen auf einem Kaliumpotential.
Das Ruhepotential der Zellen beruht im Wesentlichen auf einem Kaliumpotential.

Schon Luigi Galvani stellte um 1780 Zusammenhänge zwischen elektrischer und Muskelaktivität fest, und der deutsche Physiologe Emil Du Bois-Reymond
konnte um 1840 „tierische Elektrizität“ nachweisen und präsentierte
1849 Ableitungen elektrischer Muskelaktivität. Seine Forschungen waren
die Grundlage zur Entwicklung elektromedizinischer Diagnosemethoden wie
EKG, EEG und EMG. 1922 entwickelten Joseph Erlanger und Herbert Gasser
ein Oszilloskop, mit dem Muskelaktionspotentiale aufgezeichnet werden
konnten.
 In die klinische Routine fanden EEG, EMG etc. erst im
20. Jahrhundert Eingang, insbesondere mit der Entwicklung moderner
Elektronik
In die klinische Routine fanden EEG, EMG etc. erst im
20. Jahrhundert Eingang, insbesondere mit der Entwicklung moderner
Elektronik
Was versteht man unter einem Reiz?
Das Ruhepotential ändert sich, wenn eine
Zelle gereizt wird. Ein Reiz
verändert die Ionenleitfähigkeit der Membran und damit das
Membranpotential - er kann es erhöhen (Hyperpolarisation) oder
verringern
(Depolarisation der Membran).
 Ein Reiz
ist - allgemeiner gefasst - jede Veränderung von Umgebungsbedingungen,
auf die ein lebendes System (Zelle, Organ, Organismus..) reagiert,
d.h. auf den Reiz mit veränderten Eigenschaften / Aktivitäten
antwortet.
Ein Reiz
ist - allgemeiner gefasst - jede Veränderung von Umgebungsbedingungen,
auf die ein lebendes System (Zelle, Organ, Organismus..) reagiert,
d.h. auf den Reiz mit veränderten Eigenschaften / Aktivitäten
antwortet.
Bei der Untersuchung physiologischer Systeme werden
Reiz-Reaktions-Muster zur Analyse von deren Eigenschaften herangezogen -
qualitativ und quantitativ.
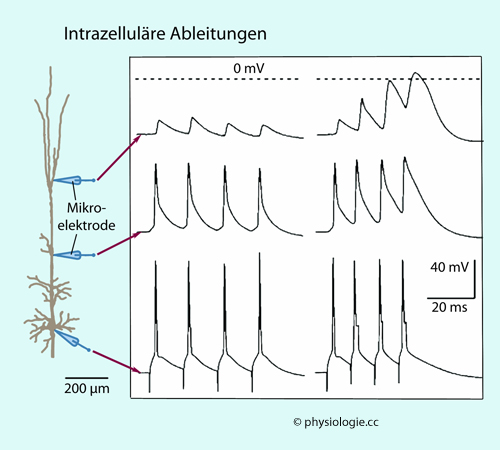
 Abbildung: Reizinduzierte Aktivität einer kortikalen Nervenzelle bei einer Ratte
Abbildung: Reizinduzierte Aktivität einer kortikalen Nervenzelle bei einer Ratte
Nach Larkum ME, Kaiser KMM, Sakmann B. Calcium
electrogenesis in distal apical dendrites of layer 5 pyramidal cells at
a critical frequency of back-propagating action potentials. PNAS 1999; 96: 14600-4
Links: Konfiguration der Ableiteelektroden entlang einer Nervenzelle. Die untere Mikroelektrode leitet vom Soma (Körper
der Nervenzelle, Ursprungsort der Aktionspotentiale) ab, die oberen beiden sind vom Soma 340 bzw. 670 µm entfernt positioniert (gestrichelte Linie: Nullpotential für die obere Ableitung) und registrieren Entladungen am Dendritenbaum.
Elektrische Stimulation wurde am Soma gesetzt (Ableitungen
Mitte: 70 Hz, rechts: 100 Hz Frequenz). Bei 100 Hz Reizfrequenz erkennt
man eine Steigerung der Intensität konsekutiver Aktionspotentiale an
der peripheren (oberen) Ableitestelle

Tritt der Reiz nicht singulär auf (wie in einer artefiziell-experimentellen Untersuchungssituation), sondern wirken mehrere Reize
gleichzeitig / kurz nacheinander auf das System ein (was in der Realität die Regel
ist), wird die Sache zunehmend komplex, und es wird immer schwieriger,
die physiologische Antwort auf eine gegebene Reizkombination
vorherzusagen. Ähnlich wie bei einer Wettervorhersage können bei mehrmaliger Simulation mit denselben Anfangsbedingungen unterschiedliche Resultate herauskommen.
Das trifft z.B. auch auf die Kombination mehrerer Medikamente (Polypharmazie: gleichzeitiger Gebrauch mehrerer Arzneimittel) zu - auch bei gutem Verständnis der Dynamik und Kinetik
der Einzelsubstanzen kann die Wirkung mehrerer synchron und/oder über
längere Zeit verabreichter Pharmaka zusehends schwerer voraussehbar sein.
"Differente" vs. "indifferente" Ableitepositionen
 Membranpotentiale
bzw. elektrische Erregungsmuster können aus dem Gewebe mittels
Ableite-Elektroden dargestellt werden, die mit einem Verstärker- bzw.
Registriersystem verbunden sind.
Membranpotentiale
bzw. elektrische Erregungsmuster können aus dem Gewebe mittels
Ableite-Elektroden dargestellt werden, die mit einem Verstärker- bzw.
Registriersystem verbunden sind.
 Dabei unterscheidet man
Dabei unterscheidet man
 "differente"
Elektroden bzw. Positionen, d.h. solche, deren Potential durch das
interessierende Biopotential (bzw. dessen Veränderung) wesentlich beeinflusst wird und
dieses darstellen;
"differente"
Elektroden bzw. Positionen, d.h. solche, deren Potential durch das
interessierende Biopotential (bzw. dessen Veränderung) wesentlich beeinflusst wird und
dieses darstellen;
 "indifferente" Elektroden bzw. Positionen, die einen Vergleichswert liefern, der nicht mit dem interessierenden Biopotential (dessen Veränderung) variiert.
"indifferente" Elektroden bzw. Positionen, die einen Vergleichswert liefern, der nicht mit dem interessierenden Biopotential (dessen Veränderung) variiert.
Beispiel: Bei den Wilson-Brustwandableitungen des EKG
stellen die Brustwandelektroden die differenten Ableitepositionen dar;
der Zusammenschluss der drei Extremitätenpotentiale (von rechtem und
linkem Handgelenk sowie linkem Fußgelenk) ergibt ein indifferentes
Vergleichspotential.
 Abbildung: Saugelektrode
Abbildung: Saugelektrode
Klassisches
Design einer EKG-Elektrode. Der Gummiball wird zwischen den Fingern einer Hand
zusammengedrückt und die Elektrode an der Kontaktfläche auf die Haut
aufgesetzt. Dann wird der Ball losgelassen, der entstehende Unterdruck
befestigt die Elektrode an der Körperoberfläche.
Solche Elektroden sind wiederverwendbar, werden heute aber zugunsten
hygienisch unbedenklicher und einfach anwendbarer Einmalelektroden kaum
noch verwendet

Eine Ableitung stellt den Vergleich des elektrischen Potentials
an zwei Positionen dar, an denen Ableitelektroden liegen.
 Da es
differente und indifferente Ableitungspositionen gibt, unterscheidet man
Da es
differente und indifferente Ableitungspositionen gibt, unterscheidet man
 unipolare
Ableitungen, d.h. solche, welche das Potential einer differenten
Position mit dem einer indifferenten Position vergleichen (z.B.
Wilson-Ableitungen des EKG), und
unipolare
Ableitungen, d.h. solche, welche das Potential einer differenten
Position mit dem einer indifferenten Position vergleichen (z.B.
Wilson-Ableitungen des EKG), und
 bipolare Ableitungen, d.h. solche,
welche das Potential einer differenten Position mit dem einer zweiten
differenten Position vergleichen (z.B. Einthoven-Ableitungen des EKG).
bipolare Ableitungen, d.h. solche,
welche das Potential einer differenten Position mit dem einer zweiten
differenten Position vergleichen (z.B. Einthoven-Ableitungen des EKG).
 Invasivität: Elektrophysiologische Ableitungen können - von der Haut - nichtinvasiv erfolgen, was den Vorteil der
Schmerzfreiheit und Ungefährlichkeit hat (kaum Infektionsgefahr, keine
Verletzung), aber den Nachteil schwächerer und weniger klarer
elektrischer Signale (Dämpfung durch dazwischenliegendes Gewebe mit
entsprechendem elektrischen Widerstand und elektrischer Kapazität, d.h.
Ladungsaufnahme).
Invasivität: Elektrophysiologische Ableitungen können - von der Haut - nichtinvasiv erfolgen, was den Vorteil der
Schmerzfreiheit und Ungefährlichkeit hat (kaum Infektionsgefahr, keine
Verletzung), aber den Nachteil schwächerer und weniger klarer
elektrischer Signale (Dämpfung durch dazwischenliegendes Gewebe mit
entsprechendem elektrischen Widerstand und elektrischer Kapazität, d.h.
Ladungsaufnahme).
Bringt man die Elektroden ins Gewebe ein, ist die
Ableitung invasiv. Solange die Elektrode nicht in eine Zelle eindringt, bleibt die Ableitung extrazellulär, sie kann z.B. die Potentialdifferenz zwischen erregtem ("entladenem") und unerregtem Gewebe erfassen.
Sticht man eine Glaselektrode durch die Außenmembran einer Zelle, wird das Membranpotential messbar (innen gegen außen - intrazelluläre
Ableitung) - vorausgesetzt, die Zelle "überlebt" diesen
Vorgang (was umso wahrscheinlicher ist, je größer die Zelle bzw. je
feiner das Ableitesystem ist).
Genaue Untersuchugen z.B. des Zusammenspiels zahlreicher
Nervenzellen in ihrem physiologischen Verbund sind
Beschränkungen unterworfen; so lassen sich solche komplexen
Fragestellungen an Schnittpräparaten durchführen, deren Neuronen in
vitro für einige Zeit weiterleben. Die Aussage der Resultate solcher Untersuchungen ist entsprechend
beschränkt, weil über das Präparat ursprünglich vorhandene Verbindungen
zu entfernter liegenden Neuronen durch die Präparation naturgemäß
zerstört worden sind.
Andererseits ist die Interaktion mehrerer Zellen so komplex, dass es
mit zunehmender Größe von Präparat und Fragestellung immer schwieriger
wird, sinnvolle kausale Strukturen festzumachen ( s. auch dort).
s. auch dort).
Durch Anwendung sogenannter Multiple Microelectrode Arrays
kann eine synchrone Vielkanal-Ableitung von zahlreichen (wie auf einem
Schachbrettmuster angeordneten) Ableitestellen Aufschluss über die
Kommunikation mehrerer unverletzter Neuronen bringen (die gleichzeitig
unter dem Mikroskop beobachtet werden können). Auf diese Weise sind
gleichzeitig mehrere hundert Registrierungen der neuronalen Aktivität
eines Nervenzellverbandes möglich.
Man unterscheidet drei prinzipielle Möglichkeiten, um neuronale Aktivität zu registrieren: Extrazellulär (extracellular recording), intrazellulär (intracellular recording) sowie Ganzzell-Registrierungen (whole-cell recording):
Extrazelluläre Ableitungen
Bei extrazellulären
invasiven Ableitungen liegen beide (oft isolierte Stahl-) Ableitelektroden im Extrazellulärraum, die
elektrisch aktiven Zellen werden (meist) nicht verletzt.
Multielektrodenarray  Nervenleitgeschwindigkeit
Nervenleitgeschwindigkeit
Solche extrazellulären Ableitungen eignen sich zur
Darstellung von Entladungsmustern und bieten präzisere Bilder
als Ableitungen von der Körperoberfläche (näher am Ort der
Ladungsveränderungen: höhere Feldstärken, weniger Widerstand,
aktive Zellen im Ableitungsbereich weniger zahlreich → elektrische
Muster klarer interpretierbar). Kommt die Spitze der Ableiteelektrode
nahe am Zellkörper einer Nervenzelle zu liegen, registriert man das
Entladungsverhalten dieser "Einheit" (single-unit recording).
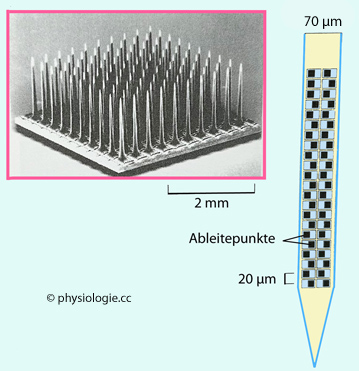
 Abbildung: Multielektroden-Arrays
Nach einer Vorlage in Liqun Luo, Principles of Neurobiology, 2nd ed. CRC Press 2021
Abbildung: Multielektroden-Arrays
Nach einer Vorlage in Liqun Luo, Principles of Neurobiology, 2nd ed. CRC Press 2021
Links:
10x10 -Array. Anordnungen wie diese werden experimentell für
Registrierungen kortikaler Aktivität sowie für neuroprosthetische
Zwecke verwendet: Dabei wird das Entladungsmuster motorischer
Kortexneurone registriert und von einem Computer in periphere
Steuerbefehle umgesetzt.
Rechts: Unterer Abschnitt einer
Neuropixel-Sonde. Elektrische Signale können von mehreren hundert
Ableitepunkten aus unterschiedlicher Tiefe des Kortex (oder von anderen
Neuronengruppen) synchron registriert werden.

Das
transmembranale Potential ist auf diese Weise
nicht erfassbar (Dabei können auch Multielektroden-Arrays zur Anwenung
kommen; das geht nur mit intrazellulären Ableitungen), aber
extrazelluläre Methoden sind nach wie vor das führende Verfahren für
die Registrierung neuronaler Aktivität in vivo. Multielektroden-Arrays
können auch zahlreiche (bis zu mehrere hundert) parallele
Registrierungen aus einem Gewebeblock liefern ( Abbildung).
Abbildung).
Extrazellulär abgeleitete Potentialverläufe integrieren meist
zahlreiche von einzelnen Nerven- und/oder Muskelfasern stammende
Aktionspotentiale: Summenaktionspotential (compound action potential), z.B. bei der Bestimmung von Nervenleitgeschwindigkeiten oder bei der Elektromyographie.
Auch diese methodischen Ansätze können invasiv durchgeführt werden, in
der Regel erfolgen sie aber von der Oberfläche der intakten Haut, also nichtinvasiv, wie die folgende Abbildung zeigt:
 Abbildung: Messung der Nervenleitgeschwindigkeit (schematisch)
Nach einer Vorlage in Berkowitz AL, Clinical Neurology & Neuroanatomy: A Localization-Based Approach, 2nd ed. Mc Graw Hill 2022
Abbildung: Messung der Nervenleitgeschwindigkeit (schematisch)
Nach einer Vorlage in Berkowitz AL, Clinical Neurology & Neuroanatomy: A Localization-Based Approach, 2nd ed. Mc Graw Hill 2022
Ein elektrischer Reiz löst
Aktionspotentiale an einem Nerv aus. Ausgehend von der Reizstelle
(roter Punkt) breiten sich diese in beide Richtungen fort - die
orthodrome Richtung ist bei sensiblen Fasern zum ZNS (so wie in der
Abbildung), bei motorischen zum Muskel bzw. dessen motorischen
Einheiten.
Die Ableiteelektroden liegen an den Stellen 1 und 2. A ist die Strecke vom Reizort bis Position 1, B ist die Strecke 1→2.
A' bedeutet die Dauer vom Reizzeitpunkt bis zum Durchlauf bei 1, B'
diejenige für den Durchlauf von 1 zu 2. Die Nervenleitgeschwindigkeit
(NLG) ergibt sich aus der Strecke B dividiert durch die Zeit B'

Solche Summenaktionspotentiale werden bei Untersuchungen der Erregungsfortpflanzung (nerve conduction studies) registriert, insbesondere zur Bestimmung der Nervenleitgeschwindigkeit (CV: nerve conduction velocity),
definiert als Betrag der Laufstrecke (Stelle 1 bis Stelle 2) dividiert
durch die für die Aktionspotentialpassage benötigte Zeit ( Abbildung).
Abbildung).
Man unterscheidet dabei motorische (CMAPs: compound muscle action potentials, compound motor action potentials) von sensorischen Potentialen (SNAPs: sensory nerve action potentials).
Bei CMAPs kann Beginn der ausgelösten Muskelkontraktion als Kriterium für die Ankunft des Aktionspotentials an "Stelle 2" dienen. Bei SNAPs wird meist peripher stimuliert und zentral von
der Reizstelle registriert.
Erfolgt die
Erregungsausbreitung im Sinne der physiologischen Richtung des Aktionspotentialablaufs, nennt man sie orthodrom  ;
bei SNAPs kann die Position der Elektroden auch ausgetauscht werden,
die Aktionspotentiale breiten sich in diesem Fall antidrom aus.
;
bei SNAPs kann die Position der Elektroden auch ausgetauscht werden,
die Aktionspotentiale breiten sich in diesem Fall antidrom aus.
Intrazelluläre Ableitungen
Intrazelluläre
Ableitungen erfordern das Eindringen einer der beiden
(gläsernen, flüssigkeitsgefüllten Glas-) Mikroelektroden in eine elektrisch aktive Zelle ( Abbildung). Sie bieten bessere Sensitivität und gutes Signal-Rausch-Verhältnis, d.h. hohen Quotienten gewünschte / unerwünschte Signalstärke (signal-to-noise ratio). Sie ermöglichen nicht nur die Messung des Ruhepotentials, sondern auch seiner unterschwelligen Änderungen (synaptische exzitatorische / inhibitorische, auch gap junction-Signale). Allerdings funktionieren sie nur bei großen Neuronen; kleine Neurone können mit patch-clamp- Methoden untersucht werden (s. unten).
Abbildung). Sie bieten bessere Sensitivität und gutes Signal-Rausch-Verhältnis, d.h. hohen Quotienten gewünschte / unerwünschte Signalstärke (signal-to-noise ratio). Sie ermöglichen nicht nur die Messung des Ruhepotentials, sondern auch seiner unterschwelligen Änderungen (synaptische exzitatorische / inhibitorische, auch gap junction-Signale). Allerdings funktionieren sie nur bei großen Neuronen; kleine Neurone können mit patch-clamp- Methoden untersucht werden (s. unten).

 Abbildung: Intrazelluläre Ableitung
Abbildung: Intrazelluläre Ableitung
Nach einer Vorlage in Kandel / Koester / Mack / Siegelbaum (eds), Principles of Neural Sciences, 6th ed. 2021 (McGraw Hill)
Mit einer konzentrierten Salzlösung gefüllte
Glas-Mikropipetten dienen als Ableitelektroden. Metalldrähte tauchen
in die Lösung und verbinden die Elektroden mit der Elektronik
(Verstärker, Bildschirm). Eine Elektrode bleibt an der Außenseite der
untersuchten Nervenzelle (extrazelluläres Bezugspotential).
Solange beide Elektroden extrazellulär positioniert sind, wird kein Potentialunterschied gemessen (links).
Dann wird die zweite Elektrode (Durchmesser der Spitze <1 µm) durch
die Membran der Nervenzelle gestochen, wodurch diese keinen
wesentlichen Schaden erleidet. Durch die hohe Impedanz des
Ableitekreises bleibt auch das Membranpotential der Zelle erhalten -
das intrazelluläre Potential wird messbar.
Ist die Zelle unerregt (trotz Einstechen der Mikroelektrode),
entspricht die abgeleitete Spannung dem Ruhepotential der Nervenzelle
(meist zwischen -60 und -70 mV)
Solche Ableitungen
sind technisch schwierig zu bewerkstelligen, können aber das
transmembranale Potential (Ruhepotential)
darstellen ( Abbildung). Mikroelektroden, die
intrazellulär positioniert werden, werden aus Glas gefertigt und sind
zur Vermeidung von Messfehlerquellen mit einer Flüssigkeit befüllt,
welche hinsichtlich Kationen (Natrium, Kalium, Calcium, Magnesium,
Wasserstoffionen) sowie Anionen (Chlorid, Bicarbonat, Phosphat) und
deren Konzentrationen der intrazellulären Zusammensetzung entspricht
und die Membran bzw. deren Ladung möglichst wenig beeinflusst.
Abbildung). Mikroelektroden, die
intrazellulär positioniert werden, werden aus Glas gefertigt und sind
zur Vermeidung von Messfehlerquellen mit einer Flüssigkeit befüllt,
welche hinsichtlich Kationen (Natrium, Kalium, Calcium, Magnesium,
Wasserstoffionen) sowie Anionen (Chlorid, Bicarbonat, Phosphat) und
deren Konzentrationen der intrazellulären Zusammensetzung entspricht
und die Membran bzw. deren Ladung möglichst wenig beeinflusst.
Man kann Mikroelektroden auch nützen, um parallel zur intrazellulären Ableitung Reizströme durch die (benachbarte) Membran der Nervenzelle zu leiten. Dadurch läßt sich die
Reaktion des Membranpotentials auf Depolarisierung (Abschwächung des
Membranpotentials) oder Hyperpolarisierung (Verstärkung des Membranpotentials) gezielt
und abgestuft darstellen. So kann man Veränderungen an
spannungsgesteuerten Ionenkanälen untersuchen (Patch-clamp-Methode - Beobachtung des "geschlossen-oder-offen"- Mechanismus der Kanäle) und das
Schwellenpotential (ab diesem können Aktionspotentiale ausgelöst
werden) bestimmen.
Optische Registrierung:
Membranpotentiale bzw. deren Zeitverlauf können nicht nur elektrisch -
mittels (Mikro-) Elektroden -, sondern auch optisch ermittelt werden.
Dazu bringt man Farbstoffe oder fluoreszierende Marker in die
Zellmembran ein, deren Farbe bzw. Lichtemission sich mit dem Betrag des
Membranpotentials ändert. Man kann dann den Zeitverlauf des
Membranpotentials mittels einem System aus Spiegel und Photodetektor
registrieren - er ist mit dem des elektrisch registrierten
Potentialverlaufs so gut wie identisch.
Patch-clamp- Methode und Ganzzell-Ableitungen
Methode und Ganzzell-Ableitungen
Elektrophysiologische Grundlagen können über das Verhalten von
Ionenkanälen in Zellmembranen sehr differenziert untersucht werden (  Abbildung):
Abbildung):
 Abbildung: Patch-Clamp-Ableitung
Nach einer Vorlage in Boron W, Boulpaep E: Medical Physiology, 3rd ed., Elsevier 2016
Abbildung: Patch-Clamp-Ableitung
Nach einer Vorlage in Boron W, Boulpaep E: Medical Physiology, 3rd ed., Elsevier 2016
An
einem Fleckchen isolierter Zellmembran wird das Öffnungsverhalten einzelner Ionenkanäle bei
vorgegebener Membranspannung
untersucht.
Die Spitze einer mit Salzlösung gefüllten Pipette - die via Elektroden
mit einem elektronischen Verstärkersystem verbunden ist - wird an die
Zellmembran herangeführt. Leichter Unterdruck in der Pipette dichtet
einen kleinen Flecken (patch) Zellmembran gegen die Umgebung ab (A).
B-G: Je nach
Sog und Manipulation an der Membran können verschiedene Konfigurationen
erreicht werden, bei denen die gewünschte Seite des Ionenkanals (extrazellulär oder zytoplasmatisch) untersucht werden kann. Dazu wird an den Kanal eine konstante Spannung angelegt (voltage clamp) und das Strömungsverhalten der Ionen registriert

 Mit einer sehr feinen Glaspipette saugt man ein Stückchen Zellmembran (ca. 1 µ2
Durchmesser) an und kann dann in vitro bei vorgegenener Membranspannung
("voltage clamp") die Bewegung von Ionen durch die Membran untersuchen.
Mit einer sehr feinen Glaspipette saugt man ein Stückchen Zellmembran (ca. 1 µ2
Durchmesser) an und kann dann in vitro bei vorgegenener Membranspannung
("voltage clamp") die Bewegung von Ionen durch die Membran untersuchen.
 Die Patch-Clamp-Methode ermöglicht den direkten Nachweis von einzelnen Ionenkanälen in Zellmembranen. Sie wurde 1976 von den deutschen Forschern Erwin Neher und Bert Sakmann entwickelt; 1991 wurde ihnen "Für
ihre Entwicklung einer Methode zum direkten Nachweis von Ionenkanälen
in Zellmembranen zur Erforschung der Signalübertragung innerhalb der
Zelle und zwischen den Zellen" der Nobelpreis für Physiologie oder Medizin verliehen.
Die Patch-Clamp-Methode ermöglicht den direkten Nachweis von einzelnen Ionenkanälen in Zellmembranen. Sie wurde 1976 von den deutschen Forschern Erwin Neher und Bert Sakmann entwickelt; 1991 wurde ihnen "Für
ihre Entwicklung einer Methode zum direkten Nachweis von Ionenkanälen
in Zellmembranen zur Erforschung der Signalübertragung innerhalb der
Zelle und zwischen den Zellen" der Nobelpreis für Physiologie oder Medizin verliehen.
Ionenkanäle
können ihre räumliche Organisation und damit ihren Zustand ändern,
abhängig von inneren und äußeren Einflüssen: Anlagerung von Agonisten /
Antagonisten an bestimmte Bindungsstellen der Kanalproteine (außen z.B.
Transmitter, innen z.B. zyklische Nukleotide); einige lassen sich durch
Kationen (Mg++, Ca++, Na+)
blockieren, andere durch Moleküle wie Polyamine (z.B. Spermin). Viele
ändern ihre Eigenschaften mit dem Membranpotential (sie sind
"spannungsgesteuert"), andere mit ihrer Phosphorylierung, wieder andere
mit mechanischen Einflüssen (sie sind "mechanorezeptiv").
Ionenkanäle
können in geöffnetem oder geschlossenen Zustand vorliegen; dabei kann
sich die Anordnung polarer Anteile von Aminosäuren ändern, und damit
die Permeabilität für "Kanalpassagiere".
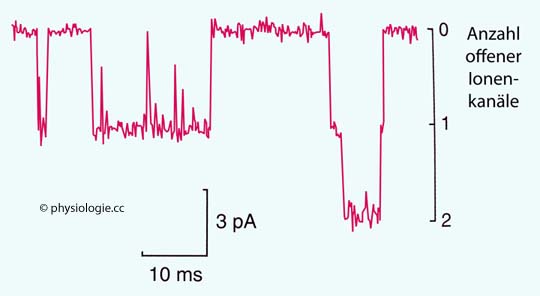
 Abbildung: Patch-clamp-Registrierung der Öffnung einzelner Ionenkanäle
Abbildung: Patch-clamp-Registrierung der Öffnung einzelner Ionenkanäle
Nach einer Vorlage in Ritter / Flower / Henderson / Loke / MacEwan / Rang, Rang & Dale's Pharmacology, 9th ed. Elsevier 2020
Ableitung von
einem Membranfragment, das von einer motorischen Endplatte mittels
Mikroelektrode gewonnen wurde. Die Pipette enthielt eine Lösung mit 10
µM Acetylcholin.
Ausschläge
nach unten zeigen den Ionenstrom durch einen oder zwei offene
Ionenkanäle. Der Wechsel des Kanalzustandes folgt
einem Alles-oder-Nichts- Muster (flip-flop), entsprechende Veränderungen des Ionenstroms (in Pikoampere
angegeben) erfolgen sprunghaft
 Mehr zu Ionenkanälen s. dort
Mehr zu Ionenkanälen s. dort
Ganzzell-Ableitungen (whole cell recording):
Hat man ein Stück unversehrte Zellmembran mit einem Kanalprotein
"angesaugt", kann man letzteres durch sanften Unterdruck aus der
Membran entfernen. Durch das entstandene mikroskopisch kleine Loch ist
ein Kontinuum zwischen Pipettenflüssigkeit und Intrazellulärraum
entstanden. Auf diese Weise ist eine direkte elektrische Verbindung zur
intrazellulären Flüssigkeit gegeben, sodass das Membranpotential
registriert werden kann, ohne dass die Pipette durch die Membran
gestoßen werden muss (wie bei der klassischen intrazellulären
Ableitung). So ist eine schonende Untersuchung auch kleiner Neurone
möglich.


 Kaliumionen sind in der Zelle 30-mal höher konzentriert als extrazellulär - wegen der Aktivität der Na/K-ATPase - und laden bei ihrem Versuch, aus der Zelle zu diffundieren, die Membran zum Ruhepotential (bis zu ~90 mV) auf (innen negativ, außen positiv: Darauf beruht das Ruhepotential der Zellen). Ionen (hydrophil) können durch Biomembranen (hydrophob) nur dann diffundieren, wenn sie geeignete Permeasen ("Kanäle") finden
- Richtung und Intensität ihrer Bewegung hängt vom Membranpotential und
dem Konzentrationsgradienten des betreffenden Ions ab Kaliumionen sind in der Zelle 30-mal höher konzentriert als extrazellulär - wegen der Aktivität der Na/K-ATPase - und laden bei ihrem Versuch, aus der Zelle zu diffundieren, die Membran zum Ruhepotential (bis zu ~90 mV) auf (innen negativ, außen positiv: Darauf beruht das Ruhepotential der Zellen). Ionen (hydrophil) können durch Biomembranen (hydrophob) nur dann diffundieren, wenn sie geeignete Permeasen ("Kanäle") finden
- Richtung und Intensität ihrer Bewegung hängt vom Membranpotential und
dem Konzentrationsgradienten des betreffenden Ions ab
 Permeasen sind
aus Proteinkomplexen aufgebaut und von komplexer Funktion. Sie können
mehr oder weniger selektiv den Durchtritt von Natrium-, Kalium-,
Chlorid-, Calciumionen etc. zulassen (Natriumpermeasen, Kaliumpermeasen
etc.). Das Verhalten einzelner Permeasen lässt sich mit der Patch-Clamp-Methode untersuchen Permeasen sind
aus Proteinkomplexen aufgebaut und von komplexer Funktion. Sie können
mehr oder weniger selektiv den Durchtritt von Natrium-, Kalium-,
Chlorid-, Calciumionen etc. zulassen (Natriumpermeasen, Kaliumpermeasen
etc.). Das Verhalten einzelner Permeasen lässt sich mit der Patch-Clamp-Methode untersuchen
 Ein Reiz ist ein Einfluss, der den Zustand und das Potential von Biomembranen verändert (hyperpolarisiert / depolarisiert) Ein Reiz ist ein Einfluss, der den Zustand und das Potential von Biomembranen verändert (hyperpolarisiert / depolarisiert)
 Potentialveränderungen
können von Zellen, Organen oder der Körperoberfläche mittels Ableitelektroden registriert werden. Man unterscheidet "differente"
Elektroden bzw. Positionen (ihr Potential wird deutlich vom
interessierenden Signal beeinflusst) von
"indifferenten" (liefern ein Referenzpotential). Eine Ableitung vergleicht das elektrische Potential zweier Ableitepunkte (Positionen, an denen Ableitelektroden liegen) bzw.
-konfigurationen Potentialveränderungen
können von Zellen, Organen oder der Körperoberfläche mittels Ableitelektroden registriert werden. Man unterscheidet "differente"
Elektroden bzw. Positionen (ihr Potential wird deutlich vom
interessierenden Signal beeinflusst) von
"indifferenten" (liefern ein Referenzpotential). Eine Ableitung vergleicht das elektrische Potential zweier Ableitepunkte (Positionen, an denen Ableitelektroden liegen) bzw.
-konfigurationen
 Membranpotentiale können durch intrazelluläre Ableitungen registriert werden: Eine mit einer Elektrolytlösung gefüllte Mikroelektrode dringt durch die Zellmembran und leitet das intrazelluläre Potential ab. Bei der Patch-clamp-Methode
werden kleine Membranstücke mit einem darin befindlichen Ionenkanal
untersucht. Entfernt man diesen Kanal durch sanften Unterdruck, kann
über das entstandene Loch in der Membran eine "Ganzzell-Ableitung" vorgenommen werden - eine Art intrazelluläre Ableitung mit weitgehend intakter Membran. Invasive extrazelluläre Ableitungen können von vielen Stellen gleichzeitig erfolgen (Multielektroden-Arrays), die Ableitepunkte bleiben extrazellulär. Nichtinvasive extrazelluläre Ableitungen (meist von der Haut) sind
weniger aufwendig und erfassen typischerweise die Aktivität eines
ganzen Organs, z.B. des Herzens. Da es differente und indifferente
Ableitungspositionen gibt, unterscheidet man unipolare Ableitungen
(Potential einer differenten im Vergleich zu einer indifferenten
Position, z.B. Wilson-Ableitungen des EKG) und bipolare Ableitungen
(Potentialunterschied zweier differenter Punkte, z.B.
Einthoven-Ableitungen des EKG) Membranpotentiale können durch intrazelluläre Ableitungen registriert werden: Eine mit einer Elektrolytlösung gefüllte Mikroelektrode dringt durch die Zellmembran und leitet das intrazelluläre Potential ab. Bei der Patch-clamp-Methode
werden kleine Membranstücke mit einem darin befindlichen Ionenkanal
untersucht. Entfernt man diesen Kanal durch sanften Unterdruck, kann
über das entstandene Loch in der Membran eine "Ganzzell-Ableitung" vorgenommen werden - eine Art intrazelluläre Ableitung mit weitgehend intakter Membran. Invasive extrazelluläre Ableitungen können von vielen Stellen gleichzeitig erfolgen (Multielektroden-Arrays), die Ableitepunkte bleiben extrazellulär. Nichtinvasive extrazelluläre Ableitungen (meist von der Haut) sind
weniger aufwendig und erfassen typischerweise die Aktivität eines
ganzen Organs, z.B. des Herzens. Da es differente und indifferente
Ableitungspositionen gibt, unterscheidet man unipolare Ableitungen
(Potential einer differenten im Vergleich zu einer indifferenten
Position, z.B. Wilson-Ableitungen des EKG) und bipolare Ableitungen
(Potentialunterschied zweier differenter Punkte, z.B.
Einthoven-Ableitungen des EKG)
|

 Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.
Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.




 Elektro-: ἤλεκτρον = Bernstein (an ihm wurde die Elektrizität zuerst beobachtet)
Elektro-: ἤλεκτρον = Bernstein (an ihm wurde die Elektrizität zuerst beobachtet) Membranpotential
Membranpotential  Differente / indifferente Punkte
Differente / indifferente Punkte  Erfassung neuronaler Aktivität: Ableitungen
Erfassung neuronaler Aktivität: Ableitungen
 Reiz
Reiz  (in) different
(in) different  uni-vs. bipolare Ableitung
uni-vs. bipolare Ableitung

 Abbildung: Elektrookulographie (EOG)
Abbildung: Elektrookulographie (EOG)


 (
( Abbildung),
Abbildung), 

 Als Membranpotential (Vm) bezeichnet man den Unterschied des elektrischen Potentials (der Spannung) zwischen der Innenseite (Vin) und der Außenseite (Vex) einer Zellmembran (Vm = Vin - Vex).
Bezieht man sich auf das Potential an der Außenseite als Bezugsgröße
(auf diese Konvention hat man sich geeinigt), ist [Vex] = 0 und der
Betrag des Membranpotentials definitionsgemäß gleich [Vin] - bei nicht
aktivierten Nervenzellen meist -60 bis -70 mV ("Ruhepotential").
Als Membranpotential (Vm) bezeichnet man den Unterschied des elektrischen Potentials (der Spannung) zwischen der Innenseite (Vin) und der Außenseite (Vex) einer Zellmembran (Vm = Vin - Vex).
Bezieht man sich auf das Potential an der Außenseite als Bezugsgröße
(auf diese Konvention hat man sich geeinigt), ist [Vex] = 0 und der
Betrag des Membranpotentials definitionsgemäß gleich [Vin] - bei nicht
aktivierten Nervenzellen meist -60 bis -70 mV ("Ruhepotential").
 Abbildung: Elektrophysiologische Versuchsanordnung
Abbildung: Elektrophysiologische Versuchsanordnung
 Das Ruhepotential der Zellen beruht im Wesentlichen auf einem Kaliumpotential.
Das Ruhepotential der Zellen beruht im Wesentlichen auf einem Kaliumpotential.


 Ein Reiz
ist - allgemeiner gefasst - jede Veränderung von Umgebungsbedingungen,
auf die ein lebendes System (Zelle, Organ, Organismus..) reagiert,
d.h. auf den Reiz mit veränderten Eigenschaften / Aktivitäten
antwortet.
Ein Reiz
ist - allgemeiner gefasst - jede Veränderung von Umgebungsbedingungen,
auf die ein lebendes System (Zelle, Organ, Organismus..) reagiert,
d.h. auf den Reiz mit veränderten Eigenschaften / Aktivitäten
antwortet. 
 Abbildung: Reizinduzierte Aktivität einer kortikalen Nervenzelle bei einer Ratte
Abbildung: Reizinduzierte Aktivität einer kortikalen Nervenzelle bei einer Ratte
 Membranpotentiale
bzw. elektrische Erregungsmuster können aus dem Gewebe mittels
Ableite-Elektroden dargestellt werden, die mit einem Verstärker- bzw.
Registriersystem verbunden sind.
Membranpotentiale
bzw. elektrische Erregungsmuster können aus dem Gewebe mittels
Ableite-Elektroden dargestellt werden, die mit einem Verstärker- bzw.
Registriersystem verbunden sind.  Dabei unterscheidet man
Dabei unterscheidet man "differente"
Elektroden bzw. Positionen, d.h. solche, deren Potential durch das
interessierende Biopotential (bzw. dessen Veränderung) wesentlich beeinflusst wird und
dieses darstellen;
"differente"
Elektroden bzw. Positionen, d.h. solche, deren Potential durch das
interessierende Biopotential (bzw. dessen Veränderung) wesentlich beeinflusst wird und
dieses darstellen; "indifferente" Elektroden bzw. Positionen, die einen Vergleichswert liefern, der nicht mit dem interessierenden Biopotential (dessen Veränderung) variiert.
"indifferente" Elektroden bzw. Positionen, die einen Vergleichswert liefern, der nicht mit dem interessierenden Biopotential (dessen Veränderung) variiert. Abbildung: Saugelektrode
Abbildung: Saugelektrode
 Da es
differente und indifferente Ableitungspositionen gibt, unterscheidet man
Da es
differente und indifferente Ableitungspositionen gibt, unterscheidet man unipolare
Ableitungen, d.h. solche, welche das Potential einer differenten
Position mit dem einer indifferenten Position vergleichen (z.B.
Wilson-Ableitungen des EKG), und
unipolare
Ableitungen, d.h. solche, welche das Potential einer differenten
Position mit dem einer indifferenten Position vergleichen (z.B.
Wilson-Ableitungen des EKG), und bipolare Ableitungen, d.h. solche,
welche das Potential einer differenten Position mit dem einer zweiten
differenten Position vergleichen (z.B. Einthoven-Ableitungen des EKG).
bipolare Ableitungen, d.h. solche,
welche das Potential einer differenten Position mit dem einer zweiten
differenten Position vergleichen (z.B. Einthoven-Ableitungen des EKG).  Invasivität: Elektrophysiologische Ableitungen können - von der Haut - nichtinvasiv erfolgen, was den Vorteil der
Schmerzfreiheit und Ungefährlichkeit hat (kaum Infektionsgefahr, keine
Verletzung), aber den Nachteil schwächerer und weniger klarer
elektrischer Signale (Dämpfung durch dazwischenliegendes Gewebe mit
entsprechendem elektrischen Widerstand und elektrischer Kapazität, d.h.
Ladungsaufnahme).
Invasivität: Elektrophysiologische Ableitungen können - von der Haut - nichtinvasiv erfolgen, was den Vorteil der
Schmerzfreiheit und Ungefährlichkeit hat (kaum Infektionsgefahr, keine
Verletzung), aber den Nachteil schwächerer und weniger klarer
elektrischer Signale (Dämpfung durch dazwischenliegendes Gewebe mit
entsprechendem elektrischen Widerstand und elektrischer Kapazität, d.h.
Ladungsaufnahme).  s. auch dort).
s. auch dort). Nervenleitgeschwindigkeit
Nervenleitgeschwindigkeit
 Abbildung: Multielektroden-Arrays
Abbildung: Multielektroden-Arrays
 Abbildung).
Abbildung).  Abbildung: Messung der Nervenleitgeschwindigkeit (schematisch)
Abbildung: Messung der Nervenleitgeschwindigkeit (schematisch)
 Abbildung).
Abbildung).  ;
bei SNAPs kann die Position der Elektroden auch ausgetauscht werden,
die Aktionspotentiale breiten sich in diesem Fall antidrom aus.
;
bei SNAPs kann die Position der Elektroden auch ausgetauscht werden,
die Aktionspotentiale breiten sich in diesem Fall antidrom aus. Abbildung). Sie bieten bessere Sensitivität und gutes Signal-Rausch-Verhältnis, d.h. hohen Quotienten gewünschte / unerwünschte Signalstärke (signal-to-noise ratio). Sie ermöglichen nicht nur die Messung des Ruhepotentials, sondern auch seiner unterschwelligen Änderungen (synaptische exzitatorische / inhibitorische, auch gap junction-Signale). Allerdings funktionieren sie nur bei großen Neuronen; kleine Neurone können mit patch-clamp- Methoden untersucht werden (s. unten).
Abbildung). Sie bieten bessere Sensitivität und gutes Signal-Rausch-Verhältnis, d.h. hohen Quotienten gewünschte / unerwünschte Signalstärke (signal-to-noise ratio). Sie ermöglichen nicht nur die Messung des Ruhepotentials, sondern auch seiner unterschwelligen Änderungen (synaptische exzitatorische / inhibitorische, auch gap junction-Signale). Allerdings funktionieren sie nur bei großen Neuronen; kleine Neurone können mit patch-clamp- Methoden untersucht werden (s. unten).
 Abbildung: Intrazelluläre Ableitung
Abbildung: Intrazelluläre Ableitung
 Abbildung). Mikroelektroden, die
intrazellulär positioniert werden, werden aus Glas gefertigt und sind
zur Vermeidung von Messfehlerquellen mit einer Flüssigkeit befüllt,
welche hinsichtlich Kationen (Natrium, Kalium, Calcium, Magnesium,
Wasserstoffionen) sowie Anionen (Chlorid, Bicarbonat, Phosphat) und
deren Konzentrationen der intrazellulären Zusammensetzung entspricht
und die Membran bzw. deren Ladung möglichst wenig beeinflusst.
Abbildung). Mikroelektroden, die
intrazellulär positioniert werden, werden aus Glas gefertigt und sind
zur Vermeidung von Messfehlerquellen mit einer Flüssigkeit befüllt,
welche hinsichtlich Kationen (Natrium, Kalium, Calcium, Magnesium,
Wasserstoffionen) sowie Anionen (Chlorid, Bicarbonat, Phosphat) und
deren Konzentrationen der intrazellulären Zusammensetzung entspricht
und die Membran bzw. deren Ladung möglichst wenig beeinflusst. Abbildung):
Abbildung): 
 Abbildung: Patch-Clamp-Ableitung
Abbildung: Patch-Clamp-Ableitung
 Mit einer sehr feinen Glaspipette saugt man ein Stückchen Zellmembran (ca. 1 µ2
Durchmesser) an und kann dann in vitro bei vorgegenener Membranspannung
("voltage clamp") die Bewegung von Ionen durch die Membran untersuchen.
Mit einer sehr feinen Glaspipette saugt man ein Stückchen Zellmembran (ca. 1 µ2
Durchmesser) an und kann dann in vitro bei vorgegenener Membranspannung
("voltage clamp") die Bewegung von Ionen durch die Membran untersuchen.  Die Patch-Clamp-Methode ermöglicht den direkten Nachweis von einzelnen Ionenkanälen in Zellmembranen. Sie wurde 1976 von den deutschen Forschern Erwin Neher und Bert Sakmann entwickelt; 1991 wurde ihnen "Für
ihre Entwicklung einer Methode zum direkten Nachweis von Ionenkanälen
in Zellmembranen zur Erforschung der Signalübertragung innerhalb der
Zelle und zwischen den Zellen" der Nobelpreis für Physiologie oder Medizin verliehen.
Die Patch-Clamp-Methode ermöglicht den direkten Nachweis von einzelnen Ionenkanälen in Zellmembranen. Sie wurde 1976 von den deutschen Forschern Erwin Neher und Bert Sakmann entwickelt; 1991 wurde ihnen "Für
ihre Entwicklung einer Methode zum direkten Nachweis von Ionenkanälen
in Zellmembranen zur Erforschung der Signalübertragung innerhalb der
Zelle und zwischen den Zellen" der Nobelpreis für Physiologie oder Medizin verliehen.
 Abbildung: Patch-clamp-Registrierung der Öffnung einzelner Ionenkanäle
Abbildung: Patch-clamp-Registrierung der Öffnung einzelner Ionenkanäle Mehr zu Ionenkanälen s. dort
Mehr zu Ionenkanälen s. dort

 Kaliumionen sind in der Zelle 30-mal höher konzentriert als extrazellulär - wegen der Aktivität der Na/K-ATPase - und laden bei ihrem Versuch, aus der Zelle zu diffundieren, die Membran zum Ruhepotential (bis zu ~90 mV) auf (innen negativ, außen positiv: Darauf beruht das Ruhepotential der Zellen). Ionen (hydrophil) können durch Biomembranen (hydrophob) nur dann diffundieren, wenn sie geeignete Permeasen ("Kanäle") finden
- Richtung und Intensität ihrer Bewegung hängt vom Membranpotential und
dem Konzentrationsgradienten des betreffenden Ions ab
Kaliumionen sind in der Zelle 30-mal höher konzentriert als extrazellulär - wegen der Aktivität der Na/K-ATPase - und laden bei ihrem Versuch, aus der Zelle zu diffundieren, die Membran zum Ruhepotential (bis zu ~90 mV) auf (innen negativ, außen positiv: Darauf beruht das Ruhepotential der Zellen). Ionen (hydrophil) können durch Biomembranen (hydrophob) nur dann diffundieren, wenn sie geeignete Permeasen ("Kanäle") finden
- Richtung und Intensität ihrer Bewegung hängt vom Membranpotential und
dem Konzentrationsgradienten des betreffenden Ions ab Permeasen sind
aus Proteinkomplexen aufgebaut und von komplexer Funktion. Sie können
mehr oder weniger selektiv den Durchtritt von Natrium-, Kalium-,
Chlorid-, Calciumionen etc. zulassen (Natriumpermeasen, Kaliumpermeasen
etc.). Das Verhalten einzelner Permeasen lässt sich mit der Patch-Clamp-Methode untersuchen
Permeasen sind
aus Proteinkomplexen aufgebaut und von komplexer Funktion. Sie können
mehr oder weniger selektiv den Durchtritt von Natrium-, Kalium-,
Chlorid-, Calciumionen etc. zulassen (Natriumpermeasen, Kaliumpermeasen
etc.). Das Verhalten einzelner Permeasen lässt sich mit der Patch-Clamp-Methode untersuchen Ein Reiz ist ein Einfluss, der den Zustand und das Potential von Biomembranen verändert (hyperpolarisiert / depolarisiert)
Ein Reiz ist ein Einfluss, der den Zustand und das Potential von Biomembranen verändert (hyperpolarisiert / depolarisiert)  Potentialveränderungen
können von Zellen, Organen oder der Körperoberfläche mittels Ableitelektroden registriert werden. Man unterscheidet "differente"
Elektroden bzw. Positionen (ihr Potential wird deutlich vom
interessierenden Signal beeinflusst) von
"indifferenten" (liefern ein Referenzpotential). Eine Ableitung vergleicht das elektrische Potential zweier Ableitepunkte (Positionen, an denen Ableitelektroden liegen) bzw.
-konfigurationen
Potentialveränderungen
können von Zellen, Organen oder der Körperoberfläche mittels Ableitelektroden registriert werden. Man unterscheidet "differente"
Elektroden bzw. Positionen (ihr Potential wird deutlich vom
interessierenden Signal beeinflusst) von
"indifferenten" (liefern ein Referenzpotential). Eine Ableitung vergleicht das elektrische Potential zweier Ableitepunkte (Positionen, an denen Ableitelektroden liegen) bzw.
-konfigurationen Membranpotentiale können durch intrazelluläre Ableitungen registriert werden: Eine mit einer Elektrolytlösung gefüllte Mikroelektrode dringt durch die Zellmembran und leitet das intrazelluläre Potential ab. Bei der Patch-clamp-Methode
werden kleine Membranstücke mit einem darin befindlichen Ionenkanal
untersucht. Entfernt man diesen Kanal durch sanften Unterdruck, kann
über das entstandene Loch in der Membran eine "Ganzzell-Ableitung" vorgenommen werden - eine Art intrazelluläre Ableitung mit weitgehend intakter Membran. Invasive extrazelluläre Ableitungen können von vielen Stellen gleichzeitig erfolgen (Multielektroden-Arrays), die Ableitepunkte bleiben extrazellulär. Nichtinvasive extrazelluläre Ableitungen (meist von der Haut) sind
weniger aufwendig und erfassen typischerweise die Aktivität eines
ganzen Organs, z.B. des Herzens. Da es differente und indifferente
Ableitungspositionen gibt, unterscheidet man unipolare Ableitungen
(Potential einer differenten im Vergleich zu einer indifferenten
Position, z.B. Wilson-Ableitungen des EKG) und bipolare Ableitungen
(Potentialunterschied zweier differenter Punkte, z.B.
Einthoven-Ableitungen des EKG)
Membranpotentiale können durch intrazelluläre Ableitungen registriert werden: Eine mit einer Elektrolytlösung gefüllte Mikroelektrode dringt durch die Zellmembran und leitet das intrazelluläre Potential ab. Bei der Patch-clamp-Methode
werden kleine Membranstücke mit einem darin befindlichen Ionenkanal
untersucht. Entfernt man diesen Kanal durch sanften Unterdruck, kann
über das entstandene Loch in der Membran eine "Ganzzell-Ableitung" vorgenommen werden - eine Art intrazelluläre Ableitung mit weitgehend intakter Membran. Invasive extrazelluläre Ableitungen können von vielen Stellen gleichzeitig erfolgen (Multielektroden-Arrays), die Ableitepunkte bleiben extrazellulär. Nichtinvasive extrazelluläre Ableitungen (meist von der Haut) sind
weniger aufwendig und erfassen typischerweise die Aktivität eines
ganzen Organs, z.B. des Herzens. Da es differente und indifferente
Ableitungspositionen gibt, unterscheidet man unipolare Ableitungen
(Potential einer differenten im Vergleich zu einer indifferenten
Position, z.B. Wilson-Ableitungen des EKG) und bipolare Ableitungen
(Potentialunterschied zweier differenter Punkte, z.B.
Einthoven-Ableitungen des EKG)