

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert

Untersuchung hoher und höchster Hirnfunktionen
© H. Hinghofer-Szalkay
 Alzheimer'sche Erkrankung: Alois Alzheimer
Alzheimer'sche Erkrankung: Alois Alzheimer
Berger-Effekt: Hans Berger
Elektroenzephalographie: ἤλεκτρον = Bernstein (lädt sich beim Reiben elektrostatisch auf), ἐγκέφαλον = Gehirn, γραφή = Aufzeichnung
Epilepsie: ἐπιλαμβάνειν = ergreifen, anfallen
Evoziertes Potential: evocare = herbeirufen (vox = Stimme), potentia = Stärke
Rheoenzephalographie: ρεῖ = fließen, ἐγκέφαλον = Gehirn, γραφή = Aufzeichnung
Schizophrenie: σχίζειν = (ab)spalten, φρήν = Seele
Ein Standardverfahren zur Beobachtung der Hirnaktivität ist die Elektroenzephalographie
(EEG). Sie misst aktivitätsabhängige Potentialschwankungen, die
nichtinvasiv (von der Kopfhaut) oder invasiv (tiefergelegen, evt. vom Cortex) abgeleitet
werden und für den jeweiligen Zustand typische Wellenmuster und
Frequenzen aufweisen.
Ereigniskorrelierte Potentiale
lassen sich durch oftmalige Wiederholung von Willkürbewegungen
(motorisch) oder Sinnesreizungen (visuell, akustisch,..) und
anschließende Mittelung (averaging) reizsynchronisierter EEG-Strecken
errechnen und beurteilen. Oftmalige Reiz- oder
Bewegungswiederholung und anschließende Überlagerung reiz- bzw.
bewegungssynchronisierter EEG-Sequenzen ermöglicht die Verstärkung der relativ
schwachen korrelierten Potentialschwankungen und das Herausmitteln nicht
korrelierter Potentiale (z.B. Betawellen) .
Magnetresonanztomographische
Signale sind vom Sauerstoffgehalt des Blutes im Gehirn abhängig (BOLD: Blood oxygenation level dependent), der
sich mit der neuronalen Aktivität ändert; sie ermöglichen die
Konstruktion einer Karte der zerebralen Stoffwechselaktivität.
Provokationstests dienen
der Untersuchung reaktiver Phänomene, z.B. reduziert Hyperventilation
die Hirndurchblutung (hypokapniebedingte zerebrale Vasokonstriktion).
|
Elektroenzephalographie (EEG)  Ereigniskorrelierte Potentialschwankungen (VEP, AEP, SEP)
Ereigniskorrelierte Potentialschwankungen (VEP, AEP, SEP)  Positronen-Emissionstomographie (PET)
Positronen-Emissionstomographie (PET)  Magneto-Enzephalographie (MEG)
Magneto-Enzephalographie (MEG)  Magnetresonanz-Enzephalographie (MRI)
Magnetresonanz-Enzephalographie (MRI)  fMRI, BOLD
fMRI, BOLD  Nahinfrarotspektroskopie (NIRS)
Nahinfrarotspektroskopie (NIRS)
 Rheoenzephalographie (REG)
Rheoenzephalographie (REG)  Default Mode Network (DMN)
Default Mode Network (DMN)

Praktische Aspekte  Core messages
Core messages
Höhere
Hirnfunktionen betreffen
hochkomplexe neuronale Leistungen wie Aufmerksamkeit, Planen,
Denken, Problemlösen, Sprechen, Erinnern, Bewerten usw. Diese sind bei
Erkrankungen des zentralen Nervensystems so gut wie immer betroffen -
Depressionen, Schizophrenie  , Demenz (Mb. Alzheimer
, Demenz (Mb. Alzheimer  ), Epilepsie
), Epilepsie  ,
neurodegenerative Erkrankungen (multiple Sklerose, Mb. Parkinson
usw.), Blutungen, Thrombosen, Tumoren etc.
,
neurodegenerative Erkrankungen (multiple Sklerose, Mb. Parkinson
usw.), Blutungen, Thrombosen, Tumoren etc.
Schon die Beobachtung des
Patienten (Körpersprache, Sprechtempo, Verhalten usw) kann zahlreiche Hinweise über mögliche
neuropathologische Veränderungen geben.
 Über transkranielle Magnetstimulation s. dort
Über transkranielle Magnetstimulation s. dort
Elektroenzephalographie
Die Aufzeichnung von Elektroenzephalogrammen
 (EEG) erfolgt ähnlich wie die anderer elektrischer Phänomene (EKG, EOG usw):
Mehrere Ableiteelektroden werden auf die Körperoberfläche positioniert
(definierte Ableitepunkte,
(EEG) erfolgt ähnlich wie die anderer elektrischer Phänomene (EKG, EOG usw):
Mehrere Ableiteelektroden werden auf die Körperoberfläche positioniert
(definierte Ableitepunkte,  Abbildung) und die
Potentialunterschiede zwischen ihnen aufgefangen und dargestellt.
Abbildung) und die
Potentialunterschiede zwischen ihnen aufgefangen und dargestellt.

 Abbildung: EEG-Standard- Ableitepunkte nach dem 10-20-System
Nach Sharbrough F et al: American electroencephalographic
society guidelines for standard electrode position nomenclature. J
Clin Neurophysiol 1991; 8: 200-2
Abbildung: EEG-Standard- Ableitepunkte nach dem 10-20-System
Nach Sharbrough F et al: American electroencephalographic
society guidelines for standard electrode position nomenclature. J
Clin Neurophysiol 1991; 8: 200-2
Referenzpunkte
sind das Nasion und Inion. Von hier aus erfolgt die Vermessung des
Schädels, 10% und 20% Abschnitte werden ermittelt und 21 Elektroden an den angegebenen Stellen an der Kopfhaut befestigt
F, C, T, P, O = frontal, central, temporal, parietal, occipital
 Über die Entstehung kortikaler Potentialschwankungen s. dort
Über die Entstehung kortikaler Potentialschwankungen s. dort
Die Gehirnaktivität - genauer: Oszillationen im aktivierenden retikulären System des Hirnstamms - erzeugt mehr oder weniger rhythmische elektrische Potentialschwankungen, die an der
Kopfhaut als EEG abgeleitet werden und deren Frequenz, Amplitude und Muster physiologische (Aufmerksamkeit? Wachheit?) und neurologisch-diagnostische Hinweise geben. Die Amplitude (bei nichtinvasiver Ableitung von der Kopfhaut) beträgt größenordnungsmäßig ~0,1 Millivolt.
Es gibt verschiedene Standards für die Anbringung von Elektroden zur
EEG-Ableitung, wobei mehrere Kanäle synchron aufgezeichnet werden und
dadurch auch zeitlich-räumliche Muster (mapping)
erfasst werden können.
Ein großer Vorteil ist die hohe zeitliche Auflösung; funktionelle
Veränderungen stellen sich in Sekundenbruchteilen dar.
"Desynchronisiertes" EEG: Im wachen Zustand findet man beim Erwachsenen pro Sekunde 13 bis 30
Beta-Wellen. ß-Wellen treten weiters während des REM-Schlafs auf, ferner unter Einwirkung einiger Psychopharmaka.
Aufmerksame mentale Beschäftigung (wie Lernen) erzeugt Gamma-Wellen (30-40 / Sekunde).

 Abbildung: Berger-Effekt (Alpha-Blockade, Alpha-Aktivierung)
Abbildung: Berger-Effekt (Alpha-Blockade, Alpha-Aktivierung)

Im entspannten Zustand, insbesodere bei geschlossenen Augen (Meditation), treten über
Frontal- und Okzipitalhirn Alpha-Wellen
mit einer Frequenz von 8-13 pro
Sekunde auf. Öffnet man die Augen, verschwindet der α-Rhythmus (Alpha-Blockade: Berger-Effekt  ,
,  Abbildung),
schließt man sie wieder, kehrt er zurück.
Abbildung),
schließt man sie wieder, kehrt er zurück.
EEG-Rhythmen
(erwachsene wache Person)
|
Bezeichnung
|
Frequenz (1/s)
|
Zustand
|
alpha
|
8-12
|
dösend, schläfrig
Augen geschlossen
|
beta
|
13-30
|
wach, Augen geöffnet
|
gamma
|
30-40
|
aufmerksam, mental aktiv
Konzentration auf Inhaltszusammenhänge
|
Kinder, insbesondere Säuglinge, zeigen
niedrigere EEG-Frequenzen, das Erwachsenenmuster wird im Pubertätsalter
erreicht.
 Über Schlaf-EEG s. dort
Über Schlaf-EEG s. dort
 Abbildung: Alternierendes Schachbrettmuster als visueller Stimulus
Abbildung: Alternierendes Schachbrettmuster als visueller Stimulus
Quelle: Wikipedia
Während
der Betrachtung dieses etwa alle 0,5 Sekunden wechselnden Musters
(Fixierung des roten Punktes) können stabile evozierte Potentiale
ermittelt werden. Bei gesunden Personen ergibt sich eine Latenz von
~100 ms (Zeit von Wechsel bis erste VEP-Spitze), diese Dauer nimmt bei
Störungen im visuellen System zu

 Provokationstests (Hyperventilation, Flimmerlicht
u.a.) bei der neurologischen Untersuchung können pathologische
Hirnstrombilder aufdecken.
Provokationstests (Hyperventilation, Flimmerlicht
u.a.) bei der neurologischen Untersuchung können pathologische
Hirnstrombilder aufdecken.
 Im Zustand der Narkose ändert sich das EEG und zeigt
schlafähnliche Muster.
Im Zustand der Narkose ändert sich das EEG und zeigt
schlafähnliche Muster.
Ereigniskorrelierte Potentialschwankungen
Ereigniskorrelierte Potentiale
(EP, event-related potentials ERP) sind aus dem EEG-Muster gemittelte Potentialverläufe, die mit
einem Ereignis (motorisch oder sensorisch) ursächlich zusammenhängen. Die Amplituden dieser Potentialschwankungen (Cortical evoked potentials, CEP) sind gering (Mikrovolt-Bereich) und werden vom Spontan-EEG überlagert.

 Abbildung: Akustisch evozierte Stammhirnpotentiale (AEP) beim Neugeborenen
Nach einer Vorlage bei emcap.iua.upf.edu
Abbildung: Akustisch evozierte Stammhirnpotentiale (AEP) beim Neugeborenen
Nach einer Vorlage bei emcap.iua.upf.edu
AEP (Auditory evoked potentials)
entstehen durch elektrische Aktivität in Innenohr (cochlea), Hörnerv
(N. cochlearis), nucleus cochlearis, oberem Olivenkomplex, lemniscus
lateralis, untere Vierhügel (colliculi inferiores), Thalamus (corpus
geniculatum mediale) und Großhirnrinde

Zum Herausfiltern des relevanten Potentialverlaufs ist die oftmalige Wiederholung des Versuchs und exakte
Synchronisierung der EEG-Strecken nach Maßgabe des Zeitpunkts, an dem
das Ereignis auftritt, notwendig. Regelmäßig reiz- bzw. aktivitätssynchrone Abweichungen werden aus dem (nicht reiz- bzw. aktivitätsabhängigen) Spontanmuster der kortikalen Spannungsschwankungen computerassistiert "herausgemittelt" (averaging).
Handelt es sich um die Reaktion des
Gehirns auf einen sensorischen Reiz, so erfolgt der Potentialverlauf nach Auftreten des Ereignisses (welches das Potential ja verursacht hat: evozierte Potentiale  : visuell, akustisch, somatosensorisch
getriggert - VEP, AEP, SEP).
: visuell, akustisch, somatosensorisch
getriggert - VEP, AEP, SEP).
 Visuell evozierte Potentiale (VEP):
Diese sind mehrphasig, dauern etwa eine Viertelsekunde und haben eine
Amplitude von ~10 µV. Die Latenz von der Reizpräsentation bis zum
Potentialbeginn beträgt ~0,1 Sekunde. (Die Abbildung rechts oben zeigt ein
Schachbrettmuster, dessen Kontrastumkehr als Stimulus dient.)
Visuell evozierte Potentiale (VEP):
Diese sind mehrphasig, dauern etwa eine Viertelsekunde und haben eine
Amplitude von ~10 µV. Die Latenz von der Reizpräsentation bis zum
Potentialbeginn beträgt ~0,1 Sekunde. (Die Abbildung rechts oben zeigt ein
Schachbrettmuster, dessen Kontrastumkehr als Stimulus dient.)
Latenzzeit und Amplitude visuell evozierter Potentiale erlauben Rückschlüsse auf die Intaktheit der Sehbahn
|
 Akustisch evozierte Potenziale (AEP):
Auch sie sind mehrphasig; ihre "sehr späten" Anteile können bis zu ~1
Sekunde nach Reizbeginn nachklingen. Die frühen Anteile (Dauer ~0,1 s;
frühe akustisch evozierte Potentiale, FAEP) stammen von Aktivität in
der Hörbahn (cochlea, Hörnerv, nucl. olivaris superior, lemniscus
lateralis, colliculus inferior). Ihre Messung wird auch als BERA (brainstem evoked response audiometry, Hirnstammaudiometrie) bezeichnet (
Akustisch evozierte Potenziale (AEP):
Auch sie sind mehrphasig; ihre "sehr späten" Anteile können bis zu ~1
Sekunde nach Reizbeginn nachklingen. Die frühen Anteile (Dauer ~0,1 s;
frühe akustisch evozierte Potentiale, FAEP) stammen von Aktivität in
der Hörbahn (cochlea, Hörnerv, nucl. olivaris superior, lemniscus
lateralis, colliculus inferior). Ihre Messung wird auch als BERA (brainstem evoked response audiometry, Hirnstammaudiometrie) bezeichnet ( s. dort).
s. dort).
 Somatisch evozierte Potentiale (SEP): Ein peripherer Nerv (z.B. N. medianus, N. tibilais) wird
mehrfach elektrisch gereizt und es werden zentrale (über dem Rückenmark
und dem Gehirn) Potentialänderungen abgeleitet. Körperlage und
-temperatur beeinflussen die Messwerte.
Somatisch evozierte Potentiale (SEP): Ein peripherer Nerv (z.B. N. medianus, N. tibilais) wird
mehrfach elektrisch gereizt und es werden zentrale (über dem Rückenmark
und dem Gehirn) Potentialänderungen abgeleitet. Körperlage und
-temperatur beeinflussen die Messwerte.
Bezeichnung gemittelter Abweichungen von der Nulllinie: EPs werden so aufgezeichnet, dass Abweichungen nach "Minus" nach oben und solche nach "Plus"
nach unten registriert werden. Ausschläge nach oben (-) werden mit
einem N (für negativ) und solche nach unten (+) mit einem P (für
positiv) bezeichnet und in der Reihenfolge ihres Auftretens (ab
Reizbeginn) nummeriert, beispielsweise:
 Der P1-Effekt erfolgt 70-100 ms nach Reizbeginn und beruht wohl auf einem frühen Selektionsmechanismus, so auch
Der P1-Effekt erfolgt 70-100 ms nach Reizbeginn und beruht wohl auf einem frühen Selektionsmechanismus, so auch
 Der N1-Effekt, der etwa 100 ms nach Reizpräsentation auftritt.
Der N1-Effekt, der etwa 100 ms nach Reizpräsentation auftritt.
 Der P3-
(auch P300-) Effekt hat mit kognitiver Verarbeitung zu tun
(Bewusstseinsmarker? Erscheint mit 5 Monaten Lebensalter) und tritt
0,3-0,5 Sekunden nach Reizbeginn auf.
Der P3-
(auch P300-) Effekt hat mit kognitiver Verarbeitung zu tun
(Bewusstseinsmarker? Erscheint mit 5 Monaten Lebensalter) und tritt
0,3-0,5 Sekunden nach Reizbeginn auf.
Positronen-Emissionstomographie (PET)
Dieses Verfahren kann zur dynamischen Funktionsuntersuchung des Gehirns eingesetzt werden (Neuroimaging).
So kann die kortikale Durchblutung oder Glucoseutilisation relativ zum
umgebenden Gewebe dargestellt werden, z.B. die stärkere Aktivierung der
Calcarinarinde beim Umherblicken, der Heschl-Querwindungen beim Zuhören
oder frontaler Rindengebiete beim Nachdenken oder bei Muskelaktivierung ( Abbildung).
Abbildung).
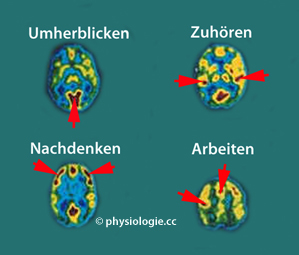
 Abbildung: PET-Hirnscans
Abbildung: PET-Hirnscans
Modifiziert nach einer Vorlage bei chm.bris.ac.uk
Rot: hohe metabolische Aktivität, Blautöne: niedrige metabolische Aktivität
 PET ist eine Variante der Emissionscomputertomographie. Das
Verfahren beruht auf der synchronen Detektion zweier Photonen
(Gammastrahlung), die beim Zerfall eines - Positronen emittierenden -
Radionuklids (das i.v. injiziert worden ist) entstehen.
PET ist eine Variante der Emissionscomputertomographie. Das
Verfahren beruht auf der synchronen Detektion zweier Photonen
(Gammastrahlung), die beim Zerfall eines - Positronen emittierenden -
Radionuklids (das i.v. injiziert worden ist) entstehen.
Zur Darstellung eines PET werden radioaktive Isotope verwendet
|
Zur Anwendung gelangen radioaktive Tracer wie 15O oder 18F.
Dies sind kurzlebige Isotope (Halbwertszeiten: 15O ~2 Minuten, 18F ~110 Minuten -
ihre Verwendung bedingt die Notwendigkeit
der unmittelbaren Nähe der Untersuchungsstätte zu einem Zyklotron, in
welchem Radiotracer hergestellt werden). Mit diesen Radiotracern bleibt
die Strahlenbelastung der untersuchten Person gering, da deren
Zerfallsprodukte ebenfalls schwache Strahler sind und leicht
ausgeschieden werden (Nieren, Lunge). Kohlenstoff
kommt in allen, Sauerstoff in vielen organischen Verbindungen vor - so
lassen sich zahlreiche physiologische Funktionen darstellen.
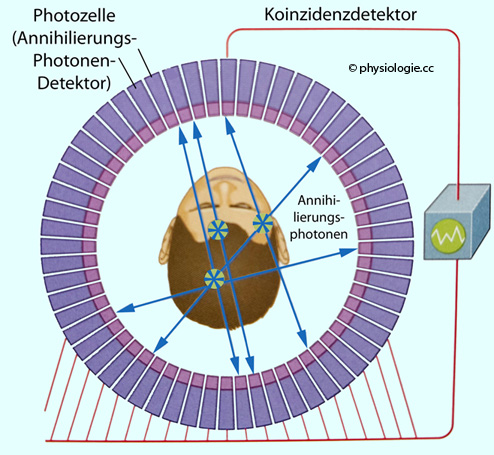
 Abbildung: PET zur Messung der Hirnaktivität
Nach einer Vorlage in Banich / Compton, Cognitive Neuroscience, 4th ed. 2018, Cambridge Univ. Press
Abbildung: PET zur Messung der Hirnaktivität
Nach einer Vorlage in Banich / Compton, Cognitive Neuroscience, 4th ed. 2018, Cambridge Univ. Press
Das Markermolekül ist typischerweise ein inerter Zucker (wie 2-deoxo-2-fluoro-D-Glucose), der z.B. mit radioaktivem Fluor (18F)
markiert ist. Es wird in die Blutbahn injiziert und gelangt so in das
Gehirn, wo es gelegentlich ein Positron emittiert (dabei seine
Aktivität verliert). Bei Kollision mit einem Elektron entstehen zwei
Photonen, die sich exakt in die jeweilige Gegenrichtung bewegen (180°).
Koinzidenzdetektoren werden an gegenüberliegenden Stellen des
Detektorringes synchron angeregt, und die Stelle des Zerfalls kann
reproduziert werden

Beim Zerfall eines solchen Isotops werden Positronen frei (Masse eines
Elektrons, aber positiv geladen). Treffen diese im Gewebe auf ein
Elektron (was nach kürzester Laufstrecke der Fall ist), entstehen zwei
Gammaquanten. Diese werden in genau
entgegengesetzte Richtung ausgesendet (und
müssen vom Detektorarray als Paar erkannt werden). Auf diese Weise
entstehen Schnittbilder des Gewebes, wobei biochemische /
physiologische Funktionen abbildbar werden ( Abbildung).
Abbildung).
Entweder wird die Parallelität von regionaler Hirndurchblutung und neuronaler Aktivität ausgenützt; verwendet wird dann Sauerstoff-15-dotiertes Wasser (Halbwertszeit ~2 Minuten). Oder es wird der Einbau eines Zuckeranalogs in aktives Hirngewebe verfolgt: Das Glucoseanalog Fluordesoxyglucose wird mit 18F
dotiert (Halbwertszeit ~110 Minuten). Hier
wird die Glucoseutilisation als Indikator der zerebralen Stoffwechselintensität
genutzt.
Die zeitliche Auflösung dieser Methode ist relativ gering (ein PET-Bild
braucht mindestens mehrere Sekunden für seine Entstehung), rasche
Veränderungen lassen sich so nicht nachweisen. Auch können sowohl
inhibitorische als auch exzitatorische Neuronengruppen Aktivitätsanstiege hervorrufen.
Magneto-Enzephalographie
Ein Magnetoenzephalogramm (MEG) ist die Registrierung magnetischer Aktivitäten des Gehirns über mehrere Sensoren. MEGs erlauben ein Real-time-Monitoring von Gehirnaktivitäten.

 Abbildung: Magnetoenzephalographie
Nach einer Vorlage bei www.lanl.gov (SQUID Magnetometry)
Abbildung: Magnetoenzephalographie
Nach einer Vorlage bei www.lanl.gov (SQUID Magnetometry)
Ein Array mit zahlreichen (bis 300) Magnetfeldsensoren (SQUIDs: Superconducting quantum interference devices)
- auf sehr niedrige Temperaturen gekühlte Sensoren zur Messung extrem
schwacher Magnetfeldänderungen - ermöglichen die nichtinvasive
Aufzeichnung elektrischer Entladungsmuster im Gehirn. Flüssiger
Stickstoff (-196°C) oder flüssiges Helium (-269°C, d.h. ~4K)
ermöglichen Supraleitung

Die magnetischen Signale des Gehirns sind sehr schwach, sie betragen nur wenige 10-15 T (Femtotesla). Zum Vergleich: In Mitteleuropa beträgt die Intensität des Erdmagnetfelds knapp 50 Mikrotesla (5.10-5T),
es ist also um fast 10 Größenordnungen stärker als die zerebralen
Signale (allerdings im Gegensatz zu diesen sehr konstant).
Daher muss
das Messsystem von äußeren Störungen hochgradig abgeschirmt werden. Es werden SQUIDs (superconducting quantum interference devices)
eingesetzt, die sehr
schwache Magnetfeldänderungen registrieren können (  Abbildung).
Abbildung).
Neu
entwickelte Sensoren können bei Raumtemperatur Feldstärken im
Picoteslabereich (10-12 T) detektieren, was die Anwendbarkeit der MEG-Methode
wesentlich erweitert.
 Vorteil von EEG / MEG: Diese Verfahren registrieren die Aktivität von
Neuronengruppen mit hoher zeitlicher Auflösung
(Millisekunden), die räumliche Auflösung ist hingegen begrenzt
(Zentimeterbereich - zum Vergleich: Millimeterbereich bei fMRT).
Außerdem tritt bei diesen Verfahren keine Strahlenbelastung der
Patienten auf (im Gegensatz zu PET, wo radioaktive Isotope injiziert
werden).
Vorteil von EEG / MEG: Diese Verfahren registrieren die Aktivität von
Neuronengruppen mit hoher zeitlicher Auflösung
(Millisekunden), die räumliche Auflösung ist hingegen begrenzt
(Zentimeterbereich - zum Vergleich: Millimeterbereich bei fMRT).
Außerdem tritt bei diesen Verfahren keine Strahlenbelastung der
Patienten auf (im Gegensatz zu PET, wo radioaktive Isotope injiziert
werden).
 Metabolische funktionelle Methoden - fMRT, NIRS, PET - haben den Vorteil verlässlicher Lokalisation der detektierten Signale (gute räumliche Qualität).
Metabolische funktionelle Methoden - fMRT, NIRS, PET - haben den Vorteil verlässlicher Lokalisation der detektierten Signale (gute räumliche Qualität).
Magnetresonanz-Enzephalographie
Magnetresonanztomographie (MR, MRT) beruht auf dem Prinzip der Kernspinresonanz (NMR: Nuclear magnetic resonance) und heißt daher auch Kernspintomographie (MRI: Magnetic resonance imaging).
MR hat eine sehr gute Auflösung, sie erlaubt z.B. die Darstellung von
Entmyelinisierungsprozessen, wie sie bei multipler Sklerose auftreten.
 Abbildung: MRI-Scanner
Nach einer Vorlage bei webmd.boots.com
Abbildung: MRI-Scanner
Nach einer Vorlage bei webmd.boots.com
Protonen in Wassermolekülen reagieren auf starke magnetische und elektrische Felder; diese Reaktionen werden von Sensoren detektiert und zu dreidimensionalen Bildern zusammengesetzt (imaging)

Die Methode verwendet ein starkes Magnetfeld
(z.B. 3 T), das einige der Wasserstoffatome im Gewebe von ihrer
Zufallsorientierung im Raum abbringt und parallel zum Magnetfeld
ausrichtet.
Ein zweites, senkrecht zum stärkeren orientiertes schwächeres Magnetfeld wird in Pulsen zugeschaltet (Wechselfeld: Die Resonanzfrequenz der Atome liegt im Radiowellenbereich) und
bringt die "geordneten" Atome ins Schwanken (Präzession - ähnlich einem
"gestörten" Kreisel).
Ist ein bestimmter Effekt erreicht (Änderung des
Spin-Winkels um einen definierten flip angle),
wird das Radiofrequenzfeld ausgeschaltet; die schwingenden Atome
orientieren sich nach dem starken Feld zurück (dabei haben verschiedene
Gewebe unterschiedliches Relaxationsverhalten) und induzieren ein
elektrisches Signal, das von
einem Empfängerstromkreis detektiert wird. Algorithmen
rechnen aus den Signalen räumliche Quellpunkte zurück. Das Ergebis sind
Schnittbilder durch das untersuchte Organ bzw. Gewebe.
MRI hat mehrere Stärken: Man braucht keine Substanz zu injizieren, sowohl die zeitliche (Hundertstelsekunden) als auch die räumliche Auflösung (<1mm) ist hoch.
MRI kann verwendet werden, um Axonbündel im Gehirn darzustellen (DTI: Diffusion tensor imaging). Wassermoleküle in engen Axonen sind in ihrem Diffusionsverhalten eingeschränkt, was sich bei der MRI als fraktionelle Anisotropie
äußert und den Verlauf von Axonbündeln durch das ZNS präzise darstellen
läßt (DTI Traktografie). Diese Information kann zur Konstruktion eines Konnektoms verwendet werden.
 Abbildung: Zuerst die Planung, dann das Bewusstwerden
Nach einer Vorlage bei Breedlove / Watson, Behavioral
Neuroscience 8th ed, Sinauer / Oxford 2018; nach Soon et al,
Unconscious determinants of free decisions in the human brain, Nature Neurosci 2008; 11: 543-5
Abbildung: Zuerst die Planung, dann das Bewusstwerden
Nach einer Vorlage bei Breedlove / Watson, Behavioral
Neuroscience 8th ed, Sinauer / Oxford 2018; nach Soon et al,
Unconscious determinants of free decisions in the human brain, Nature Neurosci 2008; 11: 543-5
MRI des Gehirns zeigt in diesem Versuch auf, dass die Entscheidung zu einer Handlung vor
dem Zeitpunkt erfolgt, an dem diese Entscheidung bewusst wird. Aus den
kernspintomographisch ermittelten Veränderungen der Gehirnaktivität
kann vorausgesagt werden, wann eine Versuchsperson "entscheiden" wird,
dass sie eine Taste drückt (oben).
Das Kriterium für das Bewusstwerden der Entscheidung ist der Buchstabe,
der zu diesem Zeitpunkt auf dem Bildschirm erscheint (Buchstaben zu
vorangenangenen Zeiten in der Mitte
angedeutet).
Die Aktivität steigt im präfrontalen und parietalen Cortex
um bis zu 10 Sekunden, im motorischen Cortex um ~5 Sekunden vor dem
Zeitpunkt, an dem die Entscheidung bewusst wird (MRI-scans unten)

MRI kann beispielsweise genutzt werden, um zu bestimmen, wann und wo sich die Gehirnaktivität vor
dem Zeitpunkt des "Beschlusses" zu einer motorischen Handlung ändert.
In diesem Versuch zeigt sich, dass sich schon mehrere Sekunden vor dem
Bewusstwerden zu einem solchen spontanen Entschluss Änderungen der
zerebralen Aktivität nachweisen lassen (  Abbildung; vgl. dort).
Abbildung; vgl. dort).
Offensichtlich handelt es sich um Gebiete "höherer Kontrolle", welche
die motorische Handlung vorbereiten, Sekunden bevor der Entschluss zu
dieser in das Bewusstsein dringt. Das Frontalhirn scheint die primäre Quelle für zielgerichtetes Verhalten zu sein.
Funktionelle Magnetresonanztomographie (fMRT, fMRI - Functional magnetic resonance tomography / imaging)
fußt auf zwei Konzepten: Der Physik der magnetischen Resonanz und der Biologie der neurovaskulären Kopplung.
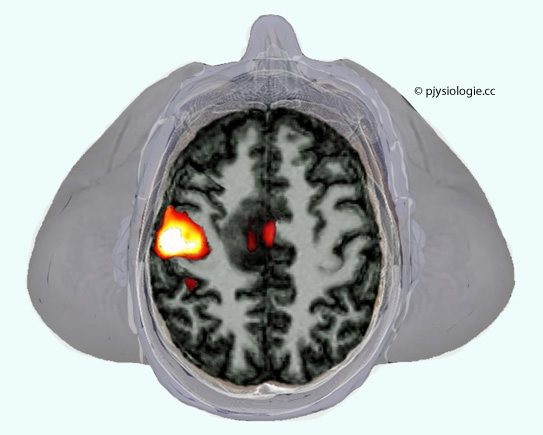
 Abbildung: Virtueller Schnitt durch den Schädel (Blick von oben) einer Person, die ihre rechte Hand bewegt
Abbildung: Virtueller Schnitt durch den Schädel (Blick von oben) einer Person, die ihre rechte Hand bewegt
Nach Kwon D. Brain imaging: fMRI advances make scans sharper and faster. Nature 2023; 617: 640-2
MRI-Untersuchungen nützen Megnetfelder einer
Intensität von mehreren Tesla (zum Vergleich: Das Magnetfeld der Erde
hat eine Stärke von 25 bis 65 µT). Höhere Feldstärken erlauben bessere
Auflösung des BOLD-Signals, z.B. kann die Aktivität verschiedener
Rindenschichten separat dargestellt werden.
In der Abbildung ist eine erhöhte neuronale Aktivität des motorischen
Cortex (Proband bewegt seine Hand) in Farbtönen von rot bis weiß
hervorgehoben

Der Sauerstoffgehalt des Blutes
schwankt mit
der neuronalen Aktivität; nimmt diese zu, steigt die Perfusion des aktiven Gebietes - es strömt vermehrt oxygeniertes Hämoglobin in das betreffende Volumenelement (neurovaskuläre Kopplung, neurovascular coupling). Es entsteht ein BOLD- (Blood oxygenation level dependent) Kontrast: Desoxygeniertes
Blut interagiert mit dem fMRI-Magnetfeld,
da es nur partiell oxygeniert ist und seine Eisenatome z.T. keinen
Sauerstoff gebunden haben; oxygeniertes Hämoglobin tut das nicht.
So bilden sich im fMRI-Bild synaptische Eingangs- und lokale Informationsverarbeitungsprozesse ab (sowohl exzitatorische als auch inhibitorische, die Unterscheidung ist nicht einfach). Diese hemodynamic response function
ergibt 4-5 Sekunden nach der neuronalen Aktivitätsspitze das Maximum
der BOLD-Antwort und klingt innerhalb von 12-15 Sekunden wieder
vollständig ab. Die Methode liefert relativ hohe räumliche Präzision
(Millimeter), aber mit - z.B. im Vergleich zum EEG - geringer
zeitlicher Auflösung (mehrere Sekunden). Man kann die methodischen Vorteile z.B. durch gleichzeitige Registrierung von EEG und fMRT kombinieren.
fMRT stellt die kortikale Aktivität bildlich mit hoher räumlicher Auflösung dar
|
fMRI ist mit
aufwändiger Vorbereitung und Datenanalyse verbunden. Man kann die
Methode z.B. verwenden, um kognitive Vorgänge bestimmten Gehirnarealen
zuzuordnen; zu analysieren, welche Art von Information in welchen
Gehirnabschnitten repräsentiert wird; oder um die Korrelation
bestimmter Aktivitäten über das zerebrale Netzwerk nachzuverfolgen. In
jedem Fall erfordert die Beurteilung der komplexen Datensätze eine
vorsichtige Interpretation.
Nahinfrarotspektroskopie
Optical imaging: Die Schädeldecke (Haut, Galea aponeurotica, Schädelknochen) ist für Nahinfrarot-Licht gut durchlässig. Nahinfrarotspektroskopie (NIRS)
- sozusagen eine Hirn-Photometrie - nützt Infrarotstrahlung (700-1000 nm) zur nichtinvasiven bildgebenden
Detektion metabolischer Vorgänge via Bestimmung von Sauerstoffgehalt
bzw. Durchblutung des Gehirns.

Abbildung: NIRS-Monitoring am Gehirn
Nach einer Vorlage bei labtimes.org
Die
Distanz der Optoden zur Lichtquelle bestimmt die mittlere
Durchdringungstiefe des Lichts (Photodetektor 1 erfasst hauptsächlich
oberflächliche, Detektor 2 tiefere Anteile des Cortex)

Das Prinzip beruht auf der Farbänderung des Hämoglobins
in Abhängigkeit seiner Sauerstoffbeladung sowie auf der Tatsache, dass
mit zunehmender Durchblutung und Blutmenge die Lichtdurchlässigkeit des
Gewebes abnimmt. Nimmt die neuronale Aktivität zu, steigt auch die
zerebrale Perfusion, und vice versa (neurovaskuläre Kopplung).
Andere Komponenten der optischen Reaktion spiegeln die elektrische Aktivität der untersuchten Rindenregion wider.
Zur Messung wird den Patienten eine Auflage aufgesetzt, welche einen
Lichtemitter und Lichtdetektoren
(Optoden) in engen Kontakt mit der Haut bringt. Die Wellenlänge wird einerseits so
gewählt, dass die Absorption des Lichts deutlich von der
Sauerstoffsättigung des Hämoglobins abhängt und andererseits so, dass eine hohe Absorption durch Hämoglobin gegeben ist. Die Tiefe der erfassten
Region beträgt bis zu etwa 2,5 cm. Sie hängt vom Abstand Emitter-Optode ab ( Abbildung). Vor
allem Vorgänge im Frontalhirn lassen sich so gut erfassen.
Abbildung). Vor
allem Vorgänge im Frontalhirn lassen sich so gut erfassen.
Das
Prozedere ist verhältnismäßig kostengünstig, kostet wenig Zeit und ist kaum belastend. Die Patienten
vergessen bald, überhaupt eine Messauflage zu tragen und sind so kaum
abgelenkt (ein Vorteil im Vergleich z.B. zu aufwändigen EEG-Hauben oder insbesondere umfangreichen / lauten Messanordnungen).
Rheoenzephalographie
Bei der Rheoenzephalographie (REG) - auch "impedance electroplethysmography" - wird über mehrere Elektroden, die an definierten Stellen am Schädel angebracht sind, kontinuierlich die Leitfähigkeit (conductance) des dazwischenliegenden Gewebes erfasst ( Abbildung).
Abbildung).

 Abbildung: Rheoenzephalographische Ableitung
Quelle: iliveok.com/health/rheoencephalography
Abbildung: Rheoenzephalographische Ableitung
Quelle: iliveok.com/health/rheoencephalography

Es wird die Impedanz gemessen, die beim Anwenden schwacher elektrischer Hochfrequenzfelder auftritt. Diese korreliert mit der Blutfüllung der Gefäße und Gehirndurchblutung.
Das REG-Registrierung ähnelt einem Sphygmogramm
(Pulskurve). Die Methode wird z.B. in der Forschung (etwa bei
Astronauten - Frage nach intrakranieller Druckerhöhung im schwerelosen
Zustand) oder für Zwecke des Biofeedback angewendet.
Default Mode Network
Mit verschiedenen Methoden (EEG, MEG, PET, fMRI) ist eine Gruppe
zerebraler Areale nachweisbar, deren Aktivität sich im Ruhezustand
(Nichtstun, d.h. ohne gerichtete Zielvorgabe, Augen geschlossen,
"Tagträumen", Gedanken schweifen lassen) koordiniert, während dieses
Zusammenspiel bei zielgerichteter Aktivität (Lösen konkreter Aufgaben)
"ausgeschaltet" wird.
 Abbildung: Default Mode Network (DMN)
Nach McCormick EM, Telzer EH. Contributions of default mode network stability and deactivation to adolescent task engagement. Nature Sci Reports 2018; 8: 18049
Abbildung: Default Mode Network (DMN)
Nach McCormick EM, Telzer EH. Contributions of default mode network stability and deactivation to adolescent task engagement. Nature Sci Reports 2018; 8: 18049
Zum
DMN gehören Regionen des medialen Präfrontalcortex, des hinteren gyrus
cinguli, des dorsal-superioren Frontallappens, des Temporalhirns mit dem Hippocampus und gyrus
angularis (zwischen Okzipitalhirn und Wernicke-Zentrum)

Man nennt diesen funktionellen Gegenpol zum (äußeren) Aufmerksamkeitssystem das Default Mode Network (DMN, Ruhezustandsnetzwerk), auch als "task negative network"
bezeichnet (im Gegensatz zum "task positive network", das bei
Konzentration auf Außenbezug aktiv ist, also im Sinne des ARS). Die Aktivität des DMN ist negativ korreliert mit der anderer neuronaler Netzwerke, insbesondere des Aufmerksamkeitssystems (arousal).
Das DMN kümmert sich um die "innere Welt", seine
Aufgaben scheinen vielfältig zu sein - Erleben eines "Selbst",
Nachdenken über Vergangenes und Zukünftiges, soziales Verstehen u.a. Es
gibt Hinweise auf eine Beteiligung des DMN im Schlaf, bei
Meditation, Akupunktur, verschiedenen psychotropen Medikamenten u.a.

 Abbildung: Verschiedene Cortexareale des DMN haben unterschiedliche funktionelle Schwerpunkte
Abbildung: Verschiedene Cortexareale des DMN haben unterschiedliche funktionelle Schwerpunkte
Nach einer Vorlage in Banich / Compton, Cognitive Neuroscience, 4th ed. 2018, Cambridge Univ. Press
Aktivierung des default mode network korreliert mit der Bearbeitung von Gedankeninhalten, welche die "innere Welt" betreffen.
Eine funktionelle Gliederung in drei einander ergänzende Teile - ein
Kern- sowie ein dorsal-mediales und ein medial-temporales System -
wurde auf Grund bildgebender Untersuchungen (MEG, PET, fMRI) vorgeschlagen

Zum DMN gehören
der Präfrontalcortex (medial) mit dem posterioren gyrus cinguli und dem gyrus angularis, das Parietalhirn, die Hippocampusformation. Die Funktionen dieses Systems scheinen schwerpunktmäßig auf unterschiedliche Cortexareale aufgeteilt zu sein ( Abbildung):
Abbildung):
 Ein zentrales System (core subsystem) - bestehend aus dem anterioren medialen Präfrontalcortex und dem posterioeren gyrus cinguli - arbeitet selbstreferentiell.
Es enthält und liefert u.a.
autobiographische Inhalte, soziale Kontexte, moralische Beurteilungen.
Es wird aktiv, wenn man über sich selbst und seine Werte nachdenkt.
Ein zentrales System (core subsystem) - bestehend aus dem anterioren medialen Präfrontalcortex und dem posterioeren gyrus cinguli - arbeitet selbstreferentiell.
Es enthält und liefert u.a.
autobiographische Inhalte, soziale Kontexte, moralische Beurteilungen.
Es wird aktiv, wenn man über sich selbst und seine Werte nachdenkt.
 Ein medial-temporäres Subsystem, das mentale Simulationen
konstruiert, liegt im Bereich des medialen Temporallappens (in der
Ein medial-temporäres Subsystem, das mentale Simulationen
konstruiert, liegt im Bereich des medialen Temporallappens (in der  Abbildung nicht gezeigt), des rückwärtigen gyrus cinguli und des
unteren Parietalcortex. Es bearbeitet Kontexte in zeitlicher Dimension
(Vergangenheit / Zukunft), episodische, autobiographische, familiäre
Erinnerungen. Dieses Subsystem ist z.B. aktiv, wenn Testpersonen in
ihrem autobiographischen Gedächtnis "wühlen" oder (szenarische)
Gedanken in die Zukunft schweifen lassen.
Abbildung nicht gezeigt), des rückwärtigen gyrus cinguli und des
unteren Parietalcortex. Es bearbeitet Kontexte in zeitlicher Dimension
(Vergangenheit / Zukunft), episodische, autobiographische, familiäre
Erinnerungen. Dieses Subsystem ist z.B. aktiv, wenn Testpersonen in
ihrem autobiographischen Gedächtnis "wühlen" oder (szenarische)
Gedanken in die Zukunft schweifen lassen.
 Ein dorsal-mediales
Subsystem (oberer und unterer Präfrontalcortex, vordere Insel,
temporo-parietaler gyrus angularis, ventral-anteriorer Temporalcortex),
das über den mentalen Status anderer Personen reflektiert ("Metakognition"). Es konzentriert sich auf semantische, szenische, Wissens- und Bedeutungsinhalte.
Ein dorsal-mediales
Subsystem (oberer und unterer Präfrontalcortex, vordere Insel,
temporo-parietaler gyrus angularis, ventral-anteriorer Temporalcortex),
das über den mentalen Status anderer Personen reflektiert ("Metakognition"). Es konzentriert sich auf semantische, szenische, Wissens- und Bedeutungsinhalte.
Insgesamt handelt es sich um ein System aus interagierenden Teilen, die
sich funktionell ergänzen und Vorgänge im Gehirn vermitteln, die sich
um selbstgenerierte Gedanken - etwa über autobiographische
Erinnerungen, Einordnung sozialer Inhalte oder Zukunftspläne - aufbauen.
Bei Erkrankungen wie Schizophrenie, Depressionen oder Autismus verändert das DMN seine Aktivität.
EEG, ereigniskorrelierte Potentiale: Die Latenzzeit zwischen Reizbeginn und Auftreten des visuell evozierten Potentials verlängert sich bei neurologischen Problemen, wie z.B. dem Auftreten einer multiplen Sklerose. Auch nimmt dann die Amplitude der VEP-Ausschläge deutlich ab.
 Die Untersuchung ereigniskorrelierter
Potentiale hat diagnostische Bedeutung, vor allem als objektive Testung
von Sinnesafferenzen. Langsame ereignisbezogene Potentiale (P=positive,
N=negative Polarität) hängen mit kognitiver Verarbeitung im Cortex
zusammen, z.B. das nach 300 ms auftretende Potential P 300.
Die Untersuchung ereigniskorrelierter
Potentiale hat diagnostische Bedeutung, vor allem als objektive Testung
von Sinnesafferenzen. Langsame ereignisbezogene Potentiale (P=positive,
N=negative Polarität) hängen mit kognitiver Verarbeitung im Cortex
zusammen, z.B. das nach 300 ms auftretende Potential P 300.
Zerebrale Erkrankungen können zu typischen
Veränderungen im EEG führen. Besonders kennzeichnend sind
Krampfpotentiale (hohe, spitze neben großen, runden Wellen,
”spike-and-wave-Muster“) bei Epilepsien. Epileptische Anfälle sind durch spontane, synchrone Entladung großer Neuronenverbände gekennzeichnet, die zu begrenzten (fokalen) oder auf beide Hirnhälften übergreifenden (generalisierten)
Anfällen führen. Ursache sind morphologische, metabolische oder
entzündliche Veränderungen, die dazu führen, dass die Öffnung von Ca++-Kanälen
unspezifische Kationenkanäle aktiviert (das bedingt Natriumeinstrom und
Depolarisation), nicht aber (ausreichend) Kalium- und Chloridkanäle
(das kompensiert normalerweise den depolarisierenden Einfluss).
Völliges Verschwinden
spontaner EEG-Wellen wird als Kriterium zur Diagnose des Hirntodes gewertet.

Abbildung: Faserbündel im linken Gehirn
(Diffusion Tensor Imaging)
Nach einer Vorlage bei MGH-UCLA Human Connectome Project
Der
fasciculus longitudinalis verbindet frontale mit okzipitalen Cortexarealen, in der capsula interna ziehen rechtwinklig darauf
orientierte Projektionen aus dem Cortex in die Tiefe

Gehirnfunktionen können mit bildgebenden Verfahren, welche
physikalisch-physiologische Wechselbeziehungen nutzen, in ihrer
zeitlich-räumlichen Organisation untersucht werden. So werden bei der
Diffusions-Tensor-Bildgebung (DTI, diffusion tensor imaging)
mittels MRI Nervenbahnen dargestellt, weil sich Wassermoleküle in Myelinscheiden
vorzugsweise in der morphologisch vorgegebenen Längsrichtung bewegen (Beispiel: s.  Abbildung).
Abbildung).
Die Resonanz von Wasserstoffionen erlaubt die Darstellung von
Gehirnstrukturen mit hoher zeitlicher Auflösung
(Magnetresonanz-Tomographie, MRI). Funktionelle Magnetresonanztomographie (fMRI)
erlaubt schließlich die Darstellung lokaler - stoffwechselabhängiger -
Durchblutungsveränderungen im Gehirn, was unmittelbar mit veränderten
Erregungsgrößen zusammenhängt. So können Areale gezeigt werden, die bei
bestimmten mentalen Vorgängen vermehrt oder vermindert durchblutet
werden, allerdings mit niedrigerer zeitlicher Auflösung wie z.B. im
EEG.

  Ein EEG entsteht durch Summierung elektrischer Entladungen einer großen
Zahl von Neuronen - vermutlich vor allem kortikalen Pyramidenzellen -
mit mehr oder weniger synchroner, räumlich ähnlich ausgerichteter
Aktivität. α-Rhythmus (8-13/s) findet sich im Ruhezustand und
entspricht dem basalen Eigenrhythmus thalamischer Neurone; ß-Wellen
(13-30/s) im Wachzustand; γ-Rhythmus (30-40/s) bei intensiver mentaler
Aktivität Ein EEG entsteht durch Summierung elektrischer Entladungen einer großen
Zahl von Neuronen - vermutlich vor allem kortikalen Pyramidenzellen -
mit mehr oder weniger synchroner, räumlich ähnlich ausgerichteter
Aktivität. α-Rhythmus (8-13/s) findet sich im Ruhezustand und
entspricht dem basalen Eigenrhythmus thalamischer Neurone; ß-Wellen
(13-30/s) im Wachzustand; γ-Rhythmus (30-40/s) bei intensiver mentaler
Aktivität
 Ereigniskorrelierte Potentiale sind aus dem EEG durch oftmalige
Wiederholung und synchrone Addition herausgemittelte, mit einem
motorischen oder sensorischen Marker ursächlich zusammenhängende
Potentialmuster. Bei einem motorischen Trigger erfolgt dieses vor (prämotorische Potentiale), bei einem sensorischen Reiz nach Auftreten des Ereignisses (visuell, akustisch, somatisch evozierte Potentiale)
Ereigniskorrelierte Potentiale sind aus dem EEG durch oftmalige
Wiederholung und synchrone Addition herausgemittelte, mit einem
motorischen oder sensorischen Marker ursächlich zusammenhängende
Potentialmuster. Bei einem motorischen Trigger erfolgt dieses vor (prämotorische Potentiale), bei einem sensorischen Reiz nach Auftreten des Ereignisses (visuell, akustisch, somatisch evozierte Potentiale)
 Positronenemissionstomographie (PET) ermöglicht funktionelles
Neuroimaging: Durchblutung oder Glucoseutilisation relativ zu
umgebendem Gewebe wird dargestellt, z.B. die Aktivierung frontaler
Rindengebiete beim Nachdenken. Die Methode beruht auf der synchronen
Detektion zweier Photonen, die beim Zerfall eines injizierten
Radionuklids entstehen (Detektorarray). Das räumliche
Auflösungsvermögen ist hoch
Positronenemissionstomographie (PET) ermöglicht funktionelles
Neuroimaging: Durchblutung oder Glucoseutilisation relativ zu
umgebendem Gewebe wird dargestellt, z.B. die Aktivierung frontaler
Rindengebiete beim Nachdenken. Die Methode beruht auf der synchronen
Detektion zweier Photonen, die beim Zerfall eines injizierten
Radionuklids entstehen (Detektorarray). Das räumliche
Auflösungsvermögen ist hoch
 Magnetoenzephalographie (MEG) registriert magnetische Aktivitäten des
Gehirns und erlaubt Real-time-Monitoring von Gehirnaktivitäten.
Üblicherweise werden SQUIDs (superconducting quantum interference
devices) eingesetzt, weil die Magnetfeldänderungen sehr schwach sind.
Der Vorteil ist hohe zeitliche Auflösung (~ms, wie EEG), die räumliche
Auflösung ist begrenzt (~cm)
Magnetoenzephalographie (MEG) registriert magnetische Aktivitäten des
Gehirns und erlaubt Real-time-Monitoring von Gehirnaktivitäten.
Üblicherweise werden SQUIDs (superconducting quantum interference
devices) eingesetzt, weil die Magnetfeldänderungen sehr schwach sind.
Der Vorteil ist hohe zeitliche Auflösung (~ms, wie EEG), die räumliche
Auflösung ist begrenzt (~cm)
 Magnetresonanztomographie (MRT) nutzt Kernspinresonanz (NMR: Nuclear
magnetic resonance, daher auch Kernspintomographie MRI: Magnetic
resonance imaging). Atomkerne werden zu Schwingungen
angeregt und die entsprechenden elektrischen Signale registriert. Sehr
gute Auflösung, Axonbündel können dargestellt werden (DTI: Diffusion
tensor imaging)
Magnetresonanztomographie (MRT) nutzt Kernspinresonanz (NMR: Nuclear
magnetic resonance, daher auch Kernspintomographie MRI: Magnetic
resonance imaging). Atomkerne werden zu Schwingungen
angeregt und die entsprechenden elektrischen Signale registriert. Sehr
gute Auflösung, Axonbündel können dargestellt werden (DTI: Diffusion
tensor imaging)
 Funktionelle Magnetresonanztomographie (fMRT, fMRI - functional
magnetic resonance tomography / imaging) stellt die kortikale Aktivität
mit hoher räumlicher (~mm), aber geringer zeitlicher Auflösung (~s)
dar. Sie misst den Sauerstoffgehalt des Blutes in den Hirngefäßen, der
mit der neuronalen Aktivität schwankt (neurovaskuläre Kopplung)
Funktionelle Magnetresonanztomographie (fMRT, fMRI - functional
magnetic resonance tomography / imaging) stellt die kortikale Aktivität
mit hoher räumlicher (~mm), aber geringer zeitlicher Auflösung (~s)
dar. Sie misst den Sauerstoffgehalt des Blutes in den Hirngefäßen, der
mit der neuronalen Aktivität schwankt (neurovaskuläre Kopplung)
 Nahinfrarotspektroskopie (NIRS) nützt transkranielle Infrarotstrahlung
zur nichtinvasiven bildgebenden
Detektion metabolischer Vorgänge des Gehirns (optical imaging).
Prinzip: Die Farbe des Hämoglobins hängt von seiner Sauerstoffbeladung
ab, und mit zunehmender Durchblutung nimmt die Lichtdurchlässigkeit des
Gewebes ab. Mit der neuronalen Aktivität steigt die Perfusion
(neurovaskuläre Kopplung)
Nahinfrarotspektroskopie (NIRS) nützt transkranielle Infrarotstrahlung
zur nichtinvasiven bildgebenden
Detektion metabolischer Vorgänge des Gehirns (optical imaging).
Prinzip: Die Farbe des Hämoglobins hängt von seiner Sauerstoffbeladung
ab, und mit zunehmender Durchblutung nimmt die Lichtdurchlässigkeit des
Gewebes ab. Mit der neuronalen Aktivität steigt die Perfusion
(neurovaskuläre Kopplung)
 Rheoenzephalographie (REG) registriert die Leitfähigkeit des Gehirns, dessen Impedanz korreliert mit der Durchblutung Rheoenzephalographie (REG) registriert die Leitfähigkeit des Gehirns, dessen Impedanz korreliert mit der Durchblutung
|

 Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.
Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.




 Alzheimer'sche Erkrankung: Alois Alzheimer
Alzheimer'sche Erkrankung: Alois Alzheimer Ereigniskorrelierte Potentialschwankungen (VEP, AEP, SEP)
Ereigniskorrelierte Potentialschwankungen (VEP, AEP, SEP)  Positronen-Emissionstomographie (PET)
Positronen-Emissionstomographie (PET)  Magneto-Enzephalographie (MEG)
Magneto-Enzephalographie (MEG)  Magnetresonanz-Enzephalographie (MRI)
Magnetresonanz-Enzephalographie (MRI)  fMRI, BOLD
fMRI, BOLD  Nahinfrarotspektroskopie (NIRS)
Nahinfrarotspektroskopie (NIRS)
 Rheoenzephalographie (REG)
Rheoenzephalographie (REG)  Default Mode Network (DMN)
Default Mode Network (DMN) 
 Core messages
Core messages , Demenz (Mb. Alzheimer
, Demenz (Mb. Alzheimer  ), Epilepsie
), Epilepsie  ,
neurodegenerative Erkrankungen (multiple Sklerose, Mb. Parkinson
usw.), Blutungen, Thrombosen, Tumoren etc.
,
neurodegenerative Erkrankungen (multiple Sklerose, Mb. Parkinson
usw.), Blutungen, Thrombosen, Tumoren etc.  (EEG) erfolgt ähnlich wie die anderer elektrischer Phänomene (EKG, EOG usw):
Mehrere Ableiteelektroden werden auf die Körperoberfläche positioniert
(definierte Ableitepunkte,
(EEG) erfolgt ähnlich wie die anderer elektrischer Phänomene (EKG, EOG usw):
Mehrere Ableiteelektroden werden auf die Körperoberfläche positioniert
(definierte Ableitepunkte,  Abbildung) und die
Potentialunterschiede zwischen ihnen aufgefangen und dargestellt.
Abbildung) und die
Potentialunterschiede zwischen ihnen aufgefangen und dargestellt. 
 Abbildung: EEG-Standard- Ableitepunkte nach dem 10-20-System
Abbildung: EEG-Standard- Ableitepunkte nach dem 10-20-System
 Abbildung: Berger-Effekt (Alpha-Blockade, Alpha-Aktivierung)
Abbildung: Berger-Effekt (Alpha-Blockade, Alpha-Aktivierung)
 ,
,  Abbildung),
schließt man sie wieder, kehrt er zurück.
Abbildung),
schließt man sie wieder, kehrt er zurück.
 Abbildung: Alternierendes Schachbrettmuster als visueller Stimulus
Abbildung: Alternierendes Schachbrettmuster als visueller Stimulus
 Provokationstests (Hyperventilation, Flimmerlicht
u.a.) bei der neurologischen Untersuchung können pathologische
Hirnstrombilder aufdecken.
Provokationstests (Hyperventilation, Flimmerlicht
u.a.) bei der neurologischen Untersuchung können pathologische
Hirnstrombilder aufdecken.  Im Zustand der Narkose ändert sich das EEG und zeigt
schlafähnliche Muster.
Im Zustand der Narkose ändert sich das EEG und zeigt
schlafähnliche Muster. 
 Abbildung: Akustisch evozierte Stammhirnpotentiale (AEP) beim Neugeborenen
Abbildung: Akustisch evozierte Stammhirnpotentiale (AEP) beim Neugeborenen
 : visuell, akustisch, somatosensorisch
getriggert - VEP, AEP, SEP).
: visuell, akustisch, somatosensorisch
getriggert - VEP, AEP, SEP).  Visuell evozierte Potentiale (VEP):
Diese sind mehrphasig, dauern etwa eine Viertelsekunde und haben eine
Amplitude von ~10 µV. Die Latenz von der Reizpräsentation bis zum
Potentialbeginn beträgt ~0,1 Sekunde. (Die Abbildung rechts oben zeigt ein
Schachbrettmuster, dessen Kontrastumkehr als Stimulus dient.)
Visuell evozierte Potentiale (VEP):
Diese sind mehrphasig, dauern etwa eine Viertelsekunde und haben eine
Amplitude von ~10 µV. Die Latenz von der Reizpräsentation bis zum
Potentialbeginn beträgt ~0,1 Sekunde. (Die Abbildung rechts oben zeigt ein
Schachbrettmuster, dessen Kontrastumkehr als Stimulus dient.) Akustisch evozierte Potenziale (AEP):
Auch sie sind mehrphasig; ihre "sehr späten" Anteile können bis zu ~1
Sekunde nach Reizbeginn nachklingen. Die frühen Anteile (Dauer ~0,1 s;
frühe akustisch evozierte Potentiale, FAEP) stammen von Aktivität in
der Hörbahn (cochlea, Hörnerv, nucl. olivaris superior, lemniscus
lateralis, colliculus inferior). Ihre Messung wird auch als BERA (brainstem evoked response audiometry, Hirnstammaudiometrie) bezeichnet (
Akustisch evozierte Potenziale (AEP):
Auch sie sind mehrphasig; ihre "sehr späten" Anteile können bis zu ~1
Sekunde nach Reizbeginn nachklingen. Die frühen Anteile (Dauer ~0,1 s;
frühe akustisch evozierte Potentiale, FAEP) stammen von Aktivität in
der Hörbahn (cochlea, Hörnerv, nucl. olivaris superior, lemniscus
lateralis, colliculus inferior). Ihre Messung wird auch als BERA (brainstem evoked response audiometry, Hirnstammaudiometrie) bezeichnet ( s. dort).
s. dort). Somatisch evozierte Potentiale (SEP): Ein peripherer Nerv (z.B. N. medianus, N. tibilais) wird
mehrfach elektrisch gereizt und es werden zentrale (über dem Rückenmark
und dem Gehirn) Potentialänderungen abgeleitet. Körperlage und
-temperatur beeinflussen die Messwerte.
Somatisch evozierte Potentiale (SEP): Ein peripherer Nerv (z.B. N. medianus, N. tibilais) wird
mehrfach elektrisch gereizt und es werden zentrale (über dem Rückenmark
und dem Gehirn) Potentialänderungen abgeleitet. Körperlage und
-temperatur beeinflussen die Messwerte.  Der P1-Effekt erfolgt 70-100 ms nach Reizbeginn und beruht wohl auf einem frühen Selektionsmechanismus, so auch
Der P1-Effekt erfolgt 70-100 ms nach Reizbeginn und beruht wohl auf einem frühen Selektionsmechanismus, so auch Der N1-Effekt, der etwa 100 ms nach Reizpräsentation auftritt.
Der N1-Effekt, der etwa 100 ms nach Reizpräsentation auftritt. Der P3-
(auch P300-) Effekt hat mit kognitiver Verarbeitung zu tun
(Bewusstseinsmarker? Erscheint mit 5 Monaten Lebensalter) und tritt
0,3-0,5 Sekunden nach Reizbeginn auf.
Der P3-
(auch P300-) Effekt hat mit kognitiver Verarbeitung zu tun
(Bewusstseinsmarker? Erscheint mit 5 Monaten Lebensalter) und tritt
0,3-0,5 Sekunden nach Reizbeginn auf. Abbildung).
Abbildung).
 Abbildung: PET-Hirnscans
Abbildung: PET-Hirnscans

 Abbildung: PET zur Messung der Hirnaktivität
Abbildung: PET zur Messung der Hirnaktivität
 Abbildung).
Abbildung). 
 Abbildung: Magnetoenzephalographie
Abbildung: Magnetoenzephalographie
 Abbildung).
Abbildung).  Vorteil von EEG / MEG: Diese Verfahren registrieren die Aktivität von
Neuronengruppen mit hoher zeitlicher Auflösung
(Millisekunden), die räumliche Auflösung ist hingegen begrenzt
(Zentimeterbereich - zum Vergleich: Millimeterbereich bei fMRT).
Außerdem tritt bei diesen Verfahren keine Strahlenbelastung der
Patienten auf (im Gegensatz zu PET, wo radioaktive Isotope injiziert
werden).
Vorteil von EEG / MEG: Diese Verfahren registrieren die Aktivität von
Neuronengruppen mit hoher zeitlicher Auflösung
(Millisekunden), die räumliche Auflösung ist hingegen begrenzt
(Zentimeterbereich - zum Vergleich: Millimeterbereich bei fMRT).
Außerdem tritt bei diesen Verfahren keine Strahlenbelastung der
Patienten auf (im Gegensatz zu PET, wo radioaktive Isotope injiziert
werden). Metabolische funktionelle Methoden - fMRT, NIRS, PET - haben den Vorteil verlässlicher Lokalisation der detektierten Signale (gute räumliche Qualität).
Metabolische funktionelle Methoden - fMRT, NIRS, PET - haben den Vorteil verlässlicher Lokalisation der detektierten Signale (gute räumliche Qualität).
 Abbildung: MRI-Scanner
Abbildung: MRI-Scanner
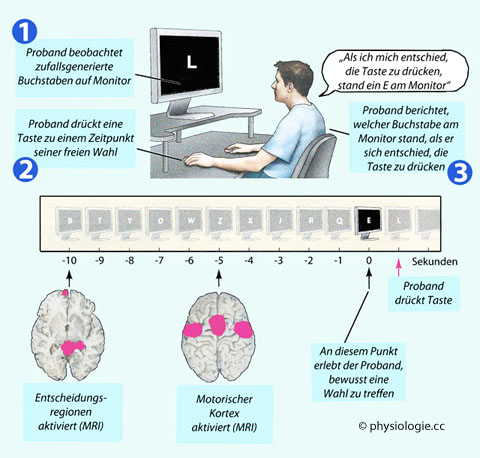
 Abbildung: Zuerst die Planung, dann das Bewusstwerden
Abbildung: Zuerst die Planung, dann das Bewusstwerden
 Abbildung; vgl. dort).
Abbildung; vgl. dort).

 Abbildung: Virtueller Schnitt durch den Schädel (Blick von oben) einer Person, die ihre rechte Hand bewegt
Abbildung: Virtueller Schnitt durch den Schädel (Blick von oben) einer Person, die ihre rechte Hand bewegt
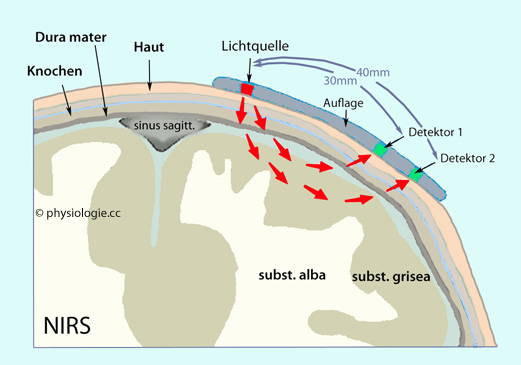
 Abbildung: NIRS-Monitoring am Gehirn
Abbildung: NIRS-Monitoring am Gehirn
 Abbildung). Vor
allem Vorgänge im Frontalhirn lassen sich so gut erfassen.
Abbildung). Vor
allem Vorgänge im Frontalhirn lassen sich so gut erfassen. 
 Abbildung).
Abbildung). 
 Abbildung: Rheoenzephalographische Ableitung
Abbildung: Rheoenzephalographische Ableitung
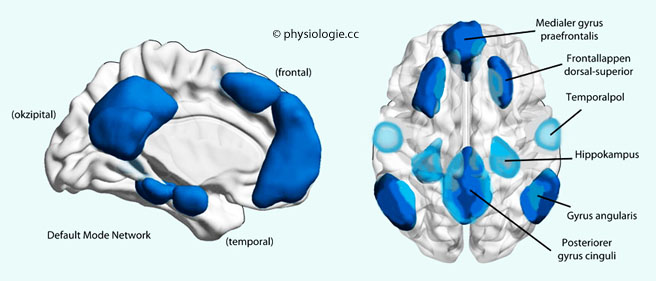
 Abbildung: Default Mode Network (DMN)
Abbildung: Default Mode Network (DMN)

 Abbildung: Verschiedene Cortexareale des DMN haben unterschiedliche funktionelle Schwerpunkte
Abbildung: Verschiedene Cortexareale des DMN haben unterschiedliche funktionelle Schwerpunkte
 Abbildung):
Abbildung):  Ein zentrales System (core subsystem) - bestehend aus dem anterioren medialen Präfrontalcortex und dem posterioeren gyrus cinguli - arbeitet selbstreferentiell.
Es enthält und liefert u.a.
autobiographische Inhalte, soziale Kontexte, moralische Beurteilungen.
Es wird aktiv, wenn man über sich selbst und seine Werte nachdenkt.
Ein zentrales System (core subsystem) - bestehend aus dem anterioren medialen Präfrontalcortex und dem posterioeren gyrus cinguli - arbeitet selbstreferentiell.
Es enthält und liefert u.a.
autobiographische Inhalte, soziale Kontexte, moralische Beurteilungen.
Es wird aktiv, wenn man über sich selbst und seine Werte nachdenkt. Ein medial-temporäres Subsystem, das mentale Simulationen
konstruiert, liegt im Bereich des medialen Temporallappens (in der
Ein medial-temporäres Subsystem, das mentale Simulationen
konstruiert, liegt im Bereich des medialen Temporallappens (in der  Abbildung nicht gezeigt), des rückwärtigen gyrus cinguli und des
unteren Parietalcortex. Es bearbeitet Kontexte in zeitlicher Dimension
(Vergangenheit / Zukunft), episodische, autobiographische, familiäre
Erinnerungen. Dieses Subsystem ist z.B. aktiv, wenn Testpersonen in
ihrem autobiographischen Gedächtnis "wühlen" oder (szenarische)
Gedanken in die Zukunft schweifen lassen.
Abbildung nicht gezeigt), des rückwärtigen gyrus cinguli und des
unteren Parietalcortex. Es bearbeitet Kontexte in zeitlicher Dimension
(Vergangenheit / Zukunft), episodische, autobiographische, familiäre
Erinnerungen. Dieses Subsystem ist z.B. aktiv, wenn Testpersonen in
ihrem autobiographischen Gedächtnis "wühlen" oder (szenarische)
Gedanken in die Zukunft schweifen lassen. Ein dorsal-mediales
Subsystem (oberer und unterer Präfrontalcortex, vordere Insel,
temporo-parietaler gyrus angularis, ventral-anteriorer Temporalcortex),
das über den mentalen Status anderer Personen reflektiert ("Metakognition"). Es konzentriert sich auf semantische, szenische, Wissens- und Bedeutungsinhalte.
Ein dorsal-mediales
Subsystem (oberer und unterer Präfrontalcortex, vordere Insel,
temporo-parietaler gyrus angularis, ventral-anteriorer Temporalcortex),
das über den mentalen Status anderer Personen reflektiert ("Metakognition"). Es konzentriert sich auf semantische, szenische, Wissens- und Bedeutungsinhalte. Die Untersuchung ereigniskorrelierter
Potentiale hat diagnostische Bedeutung, vor allem als objektive Testung
von Sinnesafferenzen. Langsame ereignisbezogene Potentiale (P=positive,
N=negative Polarität) hängen mit kognitiver Verarbeitung im Cortex
zusammen, z.B. das nach 300 ms auftretende Potential P 300.
Die Untersuchung ereigniskorrelierter
Potentiale hat diagnostische Bedeutung, vor allem als objektive Testung
von Sinnesafferenzen. Langsame ereignisbezogene Potentiale (P=positive,
N=negative Polarität) hängen mit kognitiver Verarbeitung im Cortex
zusammen, z.B. das nach 300 ms auftretende Potential P 300.
 Abbildung: Faserbündel im linken Gehirn (Diffusion Tensor Imaging)
Abbildung: Faserbündel im linken Gehirn (Diffusion Tensor Imaging)
 Abbildung).
Abbildung).

 Ein EEG entsteht durch Summierung elektrischer Entladungen einer großen
Zahl von Neuronen - vermutlich vor allem kortikalen Pyramidenzellen -
mit mehr oder weniger synchroner, räumlich ähnlich ausgerichteter
Aktivität. α-Rhythmus (8-13/s) findet sich im Ruhezustand und
entspricht dem basalen Eigenrhythmus thalamischer Neurone; ß-Wellen
(13-30/s) im Wachzustand; γ-Rhythmus (30-40/s) bei intensiver mentaler
Aktivität
Ein EEG entsteht durch Summierung elektrischer Entladungen einer großen
Zahl von Neuronen - vermutlich vor allem kortikalen Pyramidenzellen -
mit mehr oder weniger synchroner, räumlich ähnlich ausgerichteter
Aktivität. α-Rhythmus (8-13/s) findet sich im Ruhezustand und
entspricht dem basalen Eigenrhythmus thalamischer Neurone; ß-Wellen
(13-30/s) im Wachzustand; γ-Rhythmus (30-40/s) bei intensiver mentaler
Aktivität Ereigniskorrelierte Potentiale sind aus dem EEG durch oftmalige
Wiederholung und synchrone Addition herausgemittelte, mit einem
motorischen oder sensorischen Marker ursächlich zusammenhängende
Potentialmuster. Bei einem motorischen Trigger erfolgt dieses vor (prämotorische Potentiale), bei einem sensorischen Reiz nach Auftreten des Ereignisses (visuell, akustisch, somatisch evozierte Potentiale)
Ereigniskorrelierte Potentiale sind aus dem EEG durch oftmalige
Wiederholung und synchrone Addition herausgemittelte, mit einem
motorischen oder sensorischen Marker ursächlich zusammenhängende
Potentialmuster. Bei einem motorischen Trigger erfolgt dieses vor (prämotorische Potentiale), bei einem sensorischen Reiz nach Auftreten des Ereignisses (visuell, akustisch, somatisch evozierte Potentiale) Positronenemissionstomographie (PET) ermöglicht funktionelles
Neuroimaging: Durchblutung oder Glucoseutilisation relativ zu
umgebendem Gewebe wird dargestellt, z.B. die Aktivierung frontaler
Rindengebiete beim Nachdenken. Die Methode beruht auf der synchronen
Detektion zweier Photonen, die beim Zerfall eines injizierten
Radionuklids entstehen (Detektorarray). Das räumliche
Auflösungsvermögen ist hoch
Positronenemissionstomographie (PET) ermöglicht funktionelles
Neuroimaging: Durchblutung oder Glucoseutilisation relativ zu
umgebendem Gewebe wird dargestellt, z.B. die Aktivierung frontaler
Rindengebiete beim Nachdenken. Die Methode beruht auf der synchronen
Detektion zweier Photonen, die beim Zerfall eines injizierten
Radionuklids entstehen (Detektorarray). Das räumliche
Auflösungsvermögen ist hoch Magnetoenzephalographie (MEG) registriert magnetische Aktivitäten des
Gehirns und erlaubt Real-time-Monitoring von Gehirnaktivitäten.
Üblicherweise werden SQUIDs (superconducting quantum interference
devices) eingesetzt, weil die Magnetfeldänderungen sehr schwach sind.
Der Vorteil ist hohe zeitliche Auflösung (~ms, wie EEG), die räumliche
Auflösung ist begrenzt (~cm)
Magnetoenzephalographie (MEG) registriert magnetische Aktivitäten des
Gehirns und erlaubt Real-time-Monitoring von Gehirnaktivitäten.
Üblicherweise werden SQUIDs (superconducting quantum interference
devices) eingesetzt, weil die Magnetfeldänderungen sehr schwach sind.
Der Vorteil ist hohe zeitliche Auflösung (~ms, wie EEG), die räumliche
Auflösung ist begrenzt (~cm) Magnetresonanztomographie (MRT) nutzt Kernspinresonanz (NMR: Nuclear
magnetic resonance, daher auch Kernspintomographie MRI: Magnetic
resonance imaging). Atomkerne werden zu Schwingungen
angeregt und die entsprechenden elektrischen Signale registriert. Sehr
gute Auflösung, Axonbündel können dargestellt werden (DTI: Diffusion
tensor imaging)
Magnetresonanztomographie (MRT) nutzt Kernspinresonanz (NMR: Nuclear
magnetic resonance, daher auch Kernspintomographie MRI: Magnetic
resonance imaging). Atomkerne werden zu Schwingungen
angeregt und die entsprechenden elektrischen Signale registriert. Sehr
gute Auflösung, Axonbündel können dargestellt werden (DTI: Diffusion
tensor imaging) Funktionelle Magnetresonanztomographie (fMRT, fMRI - functional
magnetic resonance tomography / imaging) stellt die kortikale Aktivität
mit hoher räumlicher (~mm), aber geringer zeitlicher Auflösung (~s)
dar. Sie misst den Sauerstoffgehalt des Blutes in den Hirngefäßen, der
mit der neuronalen Aktivität schwankt (neurovaskuläre Kopplung)
Funktionelle Magnetresonanztomographie (fMRT, fMRI - functional
magnetic resonance tomography / imaging) stellt die kortikale Aktivität
mit hoher räumlicher (~mm), aber geringer zeitlicher Auflösung (~s)
dar. Sie misst den Sauerstoffgehalt des Blutes in den Hirngefäßen, der
mit der neuronalen Aktivität schwankt (neurovaskuläre Kopplung) Nahinfrarotspektroskopie (NIRS) nützt transkranielle Infrarotstrahlung
zur nichtinvasiven bildgebenden
Detektion metabolischer Vorgänge des Gehirns (optical imaging).
Prinzip: Die Farbe des Hämoglobins hängt von seiner Sauerstoffbeladung
ab, und mit zunehmender Durchblutung nimmt die Lichtdurchlässigkeit des
Gewebes ab. Mit der neuronalen Aktivität steigt die Perfusion
(neurovaskuläre Kopplung)
Nahinfrarotspektroskopie (NIRS) nützt transkranielle Infrarotstrahlung
zur nichtinvasiven bildgebenden
Detektion metabolischer Vorgänge des Gehirns (optical imaging).
Prinzip: Die Farbe des Hämoglobins hängt von seiner Sauerstoffbeladung
ab, und mit zunehmender Durchblutung nimmt die Lichtdurchlässigkeit des
Gewebes ab. Mit der neuronalen Aktivität steigt die Perfusion
(neurovaskuläre Kopplung) Rheoenzephalographie (REG) registriert die Leitfähigkeit des Gehirns, dessen Impedanz korreliert mit der Durchblutung
Rheoenzephalographie (REG) registriert die Leitfähigkeit des Gehirns, dessen Impedanz korreliert mit der Durchblutung 