




 Arachnoidea: ἀράχνη = Spinne (Spinnwebenhaut), ειδής = ähnlich
Arachnoidea: ἀράχνη = Spinne (Spinnwebenhaut), ειδής = ähnlich Foramen Magendie: Francois Magendie
Foramen Magendie: Francois Magendie  Foramen Monroi: Alexander Monro (2.)
Foramen Monroi: Alexander Monro (2.) | Gliazellen
helfen bei Signalvermittlung und Stoffwechselsteuerung und bilden
"Gliotransmitter" (Glutamat, GABA u.a.), die über längere Strecken
breite Wirkung entfalten können ("Volumentransmission"). Zu ihnen zählen Astrozyten, Oligodendrozyten und Mikrogliazellen. Astrozyten schmiegen sich eng an Nervenzellen, andere Astrozyten und Blutgefäße. Sie legen einen zerebralen Glykogenvorrat an (Energiespeicher), den sie auch metabolisieren (Lactatbildung) - Hypoglykämiephasen von mehreren Minuten Dauer können so überbrückt werden. Sie nehmen synaptisch freigesetzte Transmitter sowie freigesetztes Kalium auf (Pufferfunktion), stabilisieren Entladungsfolgen zentraler Rhythmusgeneratoren und sind Teil der Blut-Hirn-Schranke. Oligodendrozyten bilden Myelinscheiden aus, manche regulieren auch die extrazelluläre Umgebung der Nervenzellen (Satelliten-Oligodendrozyten). Mikroglia macht das Immunsystem des Gehirns aus; diese Zellen reagieren auf entsprechende Signale (Chemokine), reparieren beschädigte Nervenzellen und entsorgen - z.T. als Makrophagen - Zellfragmente. Der Liquor cerebrospinalis - produziert vom plexus chorioideus - stützt (mechanisch) und schützt (immunologisch) das Nervengewebe, erleichtert die Durchblutung und liefert ein optimales neuronal microenvironment. Der Liquordruck trägt zur Stabilisierung des Gehirns und seiner Durchblutung bei und ist lageabhängig (hydrostatische Druckgradienten); bei Lumbalpunktion in Seitenlage beträgt er normalerweise 1-2 kPa. |
 Aufgaben der Glia
Aufgaben der Glia  Astrozyten
Astrozyten  Blut-Hirn-Schranke
Blut-Hirn-Schranke  Oligodendrozyten
Oligodendrozyten  Mikroglia
Mikroglia  Liquor cerebrospinalis
Liquor cerebrospinalis
 Liquor: Zusammensetzung
Liquor: Zusammensetzung  Intrakranieller Druck
Intrakranieller Druck Glia limitans
Glia limitans
 )
bieten mechanischem Schutz des
Nervengewebes (Flüssigkeitskissen), Stützfunktion (Verankerung von
Blutgefäßen, die durch den Subarachnoidalraum ziehen),
Reinigung (Phagozytose von Peptiden wie Amyloid, Abbau /
Entfernung diverser Stoffwechselprodukte) und immunologischen Schutz
(wobei entzündliche Vorgänge limitiert werden). Sie umgeben das gesamte
ZNS und bestehen aus mehreren Lagen (
)
bieten mechanischem Schutz des
Nervengewebes (Flüssigkeitskissen), Stützfunktion (Verankerung von
Blutgefäßen, die durch den Subarachnoidalraum ziehen),
Reinigung (Phagozytose von Peptiden wie Amyloid, Abbau /
Entfernung diverser Stoffwechselprodukte) und immunologischen Schutz
(wobei entzündliche Vorgänge limitiert werden). Sie umgeben das gesamte
ZNS und bestehen aus mehreren Lagen ( Abbildung):
Abbildung):
 Abbildung: Hirnhäute
Abbildung: Hirnhäute Die dura mater
(harte Hirnhaut) ist eine kompakte bindegewebige Schutzschicht.
Sie liegt unter dem Schädelknochen, an das innere Periost angelagert
und bildet vier Einfaltungen: Die falx cerebri, das tentorium
cerebelli, die falx cerebelli und das diaphragma sellae. Die Dura
sendet afferente (sensorische) Informationen über Nervenfasern, die mit
dem N. trigeminus und obere Zervikalnerven zum ZNS gelangen.
Die dura mater
(harte Hirnhaut) ist eine kompakte bindegewebige Schutzschicht.
Sie liegt unter dem Schädelknochen, an das innere Periost angelagert
und bildet vier Einfaltungen: Die falx cerebri, das tentorium
cerebelli, die falx cerebelli und das diaphragma sellae. Die Dura
sendet afferente (sensorische) Informationen über Nervenfasern, die mit
dem N. trigeminus und obere Zervikalnerven zum ZNS gelangen. Die Arachnoidea (Spinnwebenhaut) besteht aus dünnen Zelllagen, die mittels tight junctions miteinander verknüpft sind. Die Arachnoidea bildet auch eine Schichte zwischen Liquor und Blutgefäßen im Subarachnoidalraum (zwischen Arachnoidea und Pia mater) und kann hier Fremdmaterial phagozytieren.
Die Arachnoidea (Spinnwebenhaut) besteht aus dünnen Zelllagen, die mittels tight junctions miteinander verknüpft sind. Die Arachnoidea bildet auch eine Schichte zwischen Liquor und Blutgefäßen im Subarachnoidalraum (zwischen Arachnoidea und Pia mater) und kann hier Fremdmaterial phagozytieren.  Die pia mater liegt der Gehirnoberfläche (über eine Basalmembran einer fast kontinuierlichen Lage von Astrozyten, der glia limitans) als dünne Bindegewebsschicht direkt auf. Sie bedeckt auch Blutgefäße, die aus dem Subarachnoidalraum zum Gehirn ziehen
Die pia mater liegt der Gehirnoberfläche (über eine Basalmembran einer fast kontinuierlichen Lage von Astrozyten, der glia limitans) als dünne Bindegewebsschicht direkt auf. Sie bedeckt auch Blutgefäße, die aus dem Subarachnoidalraum zum Gehirn ziehen Als glia limitans (glial limiting membrane)
bezeichnet man eine dünne (<0,01 µm) aus Astrozytenfortsätzen
aufgebaute Schichte an der Außenfläche des ZNS (glia limitans
superficialis) und um Gefäße, die in die Tiefe des Gehirns ziehen (glia
limitans perivascularis). Zusammen mit einer Basalmembran bildet sie
eine Barriere gegen den Übertritt von Zellen aus dem vaskulären und
subarachnoidalen Kompartiment in Parenchym und Meningen (was bei der Heilung nach Traumen mit entsprechendem Auswachsen von Zellfortsätzen bedeutsam werden kann). Perivaskuläre Glia beteiligt sich weiters an der Blut-Hirn-Schranke - einer Funktion, die Astrozytenfortsätze, kapilläre Endothelzellen und Perizyten zusammen wahrnehmen.
Als glia limitans (glial limiting membrane)
bezeichnet man eine dünne (<0,01 µm) aus Astrozytenfortsätzen
aufgebaute Schichte an der Außenfläche des ZNS (glia limitans
superficialis) und um Gefäße, die in die Tiefe des Gehirns ziehen (glia
limitans perivascularis). Zusammen mit einer Basalmembran bildet sie
eine Barriere gegen den Übertritt von Zellen aus dem vaskulären und
subarachnoidalen Kompartiment in Parenchym und Meningen (was bei der Heilung nach Traumen mit entsprechendem Auswachsen von Zellfortsätzen bedeutsam werden kann). Perivaskuläre Glia beteiligt sich weiters an der Blut-Hirn-Schranke - einer Funktion, die Astrozytenfortsätze, kapilläre Endothelzellen und Perizyten zusammen wahrnehmen.  Das Parenchym des Gehirns und Rückenmarks, das als "immunprivilegiert"
gilt, verschiedene immunsuppressive Membranproteine exprimiert und
Faktoren freisetzt, die entzündliche Vorgänge eindämmen können
Das Parenchym des Gehirns und Rückenmarks, das als "immunprivilegiert"
gilt, verschiedene immunsuppressive Membranproteine exprimiert und
Faktoren freisetzt, die entzündliche Vorgänge eindämmen können Perivaskuläre, subpiale und subarachnoidale Räume, die Antikörper,
Komplementfaktoren, Zyto- und Chemokine enthalten und allenfalls
immunaktiv wirken.
Perivaskuläre, subpiale und subarachnoidale Räume, die Antikörper,
Komplementfaktoren, Zyto- und Chemokine enthalten und allenfalls
immunaktiv wirken. bezeichnet werden (
bezeichnet werden ( Abbildung):
Abbildung):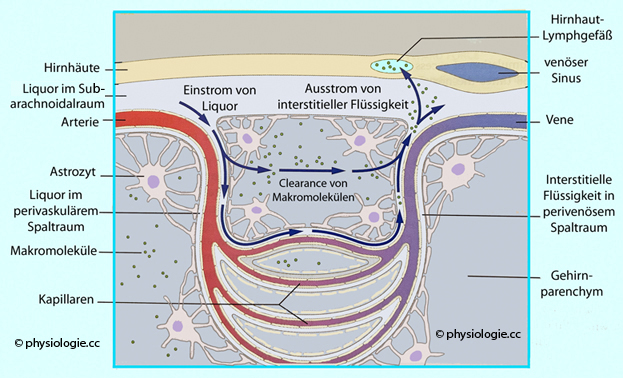
 Abbildung: "Glymphatisches" System
Abbildung: "Glymphatisches" System
 Abbildung). Druckpulsationen der arteriellen Gefäße treiben offenbar den Flüssigkeitsstrom
an.
Abbildung). Druckpulsationen der arteriellen Gefäße treiben offenbar den Flüssigkeitsstrom
an. 
 Abbildung: Neurone, Gliazellen und Kapillaren
Abbildung: Neurone, Gliazellen und Kapillaren
 beteiligen sich in besonderer Weise an den notwendigen Transportprozessen. Sie sind im Gehirn zahlreicher als Neuronen
(man schätzt ihre Zahl ungefähr auf das Zehnfache derjeniger an
Neuronen) und machen insgesamt knapp die Hälfte der Gehirnmasse aus;
sie bleiben lebenslang teilungsfähig.
beteiligen sich in besonderer Weise an den notwendigen Transportprozessen. Sie sind im Gehirn zahlreicher als Neuronen
(man schätzt ihre Zahl ungefähr auf das Zehnfache derjeniger an
Neuronen) und machen insgesamt knapp die Hälfte der Gehirnmasse aus;
sie bleiben lebenslang teilungsfähig.  Es gibt vier Gliazelltypen im Gehirn:
Es gibt vier Gliazelltypen im Gehirn:
 Astrozyten (Stützfunktion, Sekretion, Resorption)
Astrozyten (Stützfunktion, Sekretion, Resorption)
 Oligidendrozyten (Myelinbildung)
Oligidendrozyten (Myelinbildung)
 Mikroglia (Immunzellen)
Mikroglia (Immunzellen)
 Ependymzellen (Auskleidung von Ventrikeln)
Ependymzellen (Auskleidung von Ventrikeln) Abbildung).
Abbildung). 
 Abbildung: Kommunikation zwischen Glia- und Nervenzelle
Abbildung: Kommunikation zwischen Glia- und Nervenzelle

 Abbildung: Astrozyten, Oligodendrozyten, Mikroglia und Ependym unterstützen das neuronale Gewebe
Abbildung: Astrozyten, Oligodendrozyten, Mikroglia und Ependym unterstützen das neuronale Gewebe ist eine einzellige Schicht von Gliazellen mit langen Zilienfortsätzen. Es kleidet die Ventrikelwände und plexus chorioidei
aus, wo Liquor zwischen den Ependymzellen in das Interstitium des
Gehirns eintreten kann. Die Zilien helfen beim Transport des Liquor
durch Ventrikel und Verbindungsgänge.
ist eine einzellige Schicht von Gliazellen mit langen Zilienfortsätzen. Es kleidet die Ventrikelwände und plexus chorioidei
aus, wo Liquor zwischen den Ependymzellen in das Interstitium des
Gehirns eintreten kann. Die Zilien helfen beim Transport des Liquor
durch Ventrikel und Verbindungsgänge.
 Gliazellen werden 1856 von Rudolf Virchow als "Nervenkitt" bezeichnet. Gheorghe Marinescu
erkennt 1896, dass Gliazellen Neuronen phagozytieren können. Die
Unterteilung von Gliazellen in vier Gruppen erfolgt 1920 durch Pio del Rio-Hortega. 1966 zeigen Stephen Kuffler und Mitarbeiter, dass Gliazellen auf neuronale Impulse reagieren. 1970 beschreibt Pasko Rakic, wie sich wachsende Neuronen an radiären Gliazellen orientieren.
Gliazellen werden 1856 von Rudolf Virchow als "Nervenkitt" bezeichnet. Gheorghe Marinescu
erkennt 1896, dass Gliazellen Neuronen phagozytieren können. Die
Unterteilung von Gliazellen in vier Gruppen erfolgt 1920 durch Pio del Rio-Hortega. 1966 zeigen Stephen Kuffler und Mitarbeiter, dass Gliazellen auf neuronale Impulse reagieren. 1970 beschreibt Pasko Rakic, wie sich wachsende Neuronen an radiären Gliazellen orientieren. sind im Gehirn des Menschen zahlreicher als Neuronen. Man kennt sie in mehreren Spielarten: Protoplasmatische Astrozyten in der grauen Substanz, eng mit Synapsen und Blutgefäßen verknüpft; fibrilläre Astrozyten in der weißen Substanz, in Kontakt mit Ranvier-Schnürringen der Axone; weiters radiäre Gliazellen, die als Leitstrukturen und Ersatzzellen dienen (Bergmann-Glia im Kleinhirn - diese verfügt über Glutamatrezeptoren -, Müller-Zellen in der Netzhaut).
sind im Gehirn des Menschen zahlreicher als Neuronen. Man kennt sie in mehreren Spielarten: Protoplasmatische Astrozyten in der grauen Substanz, eng mit Synapsen und Blutgefäßen verknüpft; fibrilläre Astrozyten in der weißen Substanz, in Kontakt mit Ranvier-Schnürringen der Axone; weiters radiäre Gliazellen, die als Leitstrukturen und Ersatzzellen dienen (Bergmann-Glia im Kleinhirn - diese verfügt über Glutamatrezeptoren -, Müller-Zellen in der Netzhaut).
 Abbildung: Astrozyten als zentrale Mediatoren des neurovaskulären coupling
Abbildung: Astrozyten als zentrale Mediatoren des neurovaskulären coupling
 Glutamattoxizität: In solchen Situationen nimmt der intrazelluläre ATP-Spiegel und die
Aktivität der Na-K-Pumpe ab, Natrium reichert sich in den Zellen und
Kalium extrazellulär an, die
Zellmembranen depolarisieren. Gliazellen können nur wenig oder kein
Glutamat mehr aufnehmen, es tritt sogar aus den Zellen aus, was das
ionale Ungleichgewicht weiter verschlimmert und die Erregbarkeit der Nervenzellen weiter steigert - ein circulus vitiosus.
Glutamattoxizität: In solchen Situationen nimmt der intrazelluläre ATP-Spiegel und die
Aktivität der Na-K-Pumpe ab, Natrium reichert sich in den Zellen und
Kalium extrazellulär an, die
Zellmembranen depolarisieren. Gliazellen können nur wenig oder kein
Glutamat mehr aufnehmen, es tritt sogar aus den Zellen aus, was das
ionale Ungleichgewicht weiter verschlimmert und die Erregbarkeit der Nervenzellen weiter steigert - ein circulus vitiosus.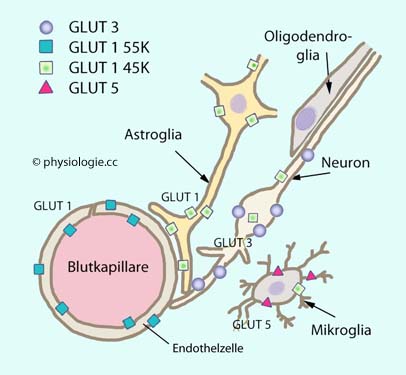
 Abbildung: Lokalisierung verschiedener Glucosetransporter im Gehirn
Abbildung: Lokalisierung verschiedener Glucosetransporter im Gehirn
 zu Nervenzellen, anderen Astrozyten (ein Astrozyt kann bis zu 3.105
andere Zellen erreichen) und Oligodendrozyten (mittels gap junctions) sowie
zu Nervenzellen, anderen Astrozyten (ein Astrozyt kann bis zu 3.105
andere Zellen erreichen) und Oligodendrozyten (mittels gap junctions) sowie zu
Blutgefäßen (sie beteiligen sich an der Sauerstoff- und Glucoseversorgung des Hirngewebes).
zu
Blutgefäßen (sie beteiligen sich an der Sauerstoff- und Glucoseversorgung des Hirngewebes).  Abbildung):
Abbildung):  Glucose
würde über die Blut-Hirn-Schranke völlig unzureichend diffundieren,
wären da nicht GLUT 1 an den zerebralen Endothelzellen (Typ 55K, sehr
reichlich) und an der Astroglia (Typ 45K), GLUT 3 an den Nervenzellen
selbst.
Glucose
würde über die Blut-Hirn-Schranke völlig unzureichend diffundieren,
wären da nicht GLUT 1 an den zerebralen Endothelzellen (Typ 55K, sehr
reichlich) und an der Astroglia (Typ 45K), GLUT 3 an den Nervenzellen
selbst.
 Abbildung: Astrozyten und Lactatversorgung der Nervenzellen
Abbildung: Astrozyten und Lactatversorgung der Nervenzellen MCT, Monocarboxylattransporter
MCT, Monocarboxylattransporter
 Versorgung der Neuronen mit Lactat: Astrozyten speichern so gut wie den gesamten Glykogenvorrat
des Gehirns. Dieser kann genutzt werden, wenn die Glucosezufuhr über
das Blut unzureichend ist; fällt die Glucoseversorgung gänzlich aus,
kann der Energiebedarf des Gehirns für maximal 5 Minuten aus diesem
Vorrat gespeist werden (Astrozyten verfügen über die dazu notwendigen
Enzyme).
Versorgung der Neuronen mit Lactat: Astrozyten speichern so gut wie den gesamten Glykogenvorrat
des Gehirns. Dieser kann genutzt werden, wenn die Glucosezufuhr über
das Blut unzureichend ist; fällt die Glucoseversorgung gänzlich aus,
kann der Energiebedarf des Gehirns für maximal 5 Minuten aus diesem
Vorrat gespeist werden (Astrozyten verfügen über die dazu notwendigen
Enzyme).  Abbildung). Dieser
Weg ist wahrscheinlich immer dann aktuell, wenn es zu intensiverer Neuronenaktivität kommt und kann stetig zur Verfügung gestellt werden, zum
Unterschied von möglicherweise stark schwankenden Werten des
Blutzuckerspiegels ("Substratpufferung").
Abbildung). Dieser
Weg ist wahrscheinlich immer dann aktuell, wenn es zu intensiverer Neuronenaktivität kommt und kann stetig zur Verfügung gestellt werden, zum
Unterschied von möglicherweise stark schwankenden Werten des
Blutzuckerspiegels ("Substratpufferung").
 Abbildung: Aquaporin 4 (AQP4) an Astrozyten
Abbildung: Aquaporin 4 (AQP4) an Astrozyten
 Astrozyten sind mit Aquaporin 4 ausgestattet, was den Wasserdurchtritt durch Grenzflächen des ZNS ermöglicht (Abbildungen). Aquaporine
sind ubiquitär (auch in Bakterien, Archeen) vorkommende
Zellmembranbestandteile mit ähnlicher Proteinstruktur. Sie erhöhen die
Wasserleitfähigkeit der Membran (bis zu mehreren 109
Wassermolekülen pro Sekunde).
Astrozyten sind mit Aquaporin 4 ausgestattet, was den Wasserdurchtritt durch Grenzflächen des ZNS ermöglicht (Abbildungen). Aquaporine
sind ubiquitär (auch in Bakterien, Archeen) vorkommende
Zellmembranbestandteile mit ähnlicher Proteinstruktur. Sie erhöhen die
Wasserleitfähigkeit der Membran (bis zu mehreren 109
Wassermolekülen pro Sekunde).  Transmitteraufnahme:
Astrozyten
nehmen synaptisch freigesetzten Transmitter auf und bauen diesen teils ab (dadurch
verhindern sie
eine Überreizung postsynaptischer Strukturen), teils retournieren sie ihn an die präsynaptische Nervenendigung. Glutaminsynthetase
der Gliazelle macht aus dem aufgenommenen Glutamin Glutamat, das
wiederum als unmittelbare Glutamat-Vorstufe der Nervenzelle retourniert
wird.
Transmitteraufnahme:
Astrozyten
nehmen synaptisch freigesetzten Transmitter auf und bauen diesen teils ab (dadurch
verhindern sie
eine Überreizung postsynaptischer Strukturen), teils retournieren sie ihn an die präsynaptische Nervenendigung. Glutaminsynthetase
der Gliazelle macht aus dem aufgenommenen Glutamin Glutamat, das
wiederum als unmittelbare Glutamat-Vorstufe der Nervenzelle retourniert
wird. 
 Abbildung: Tripartite Glutamatsynapse
Abbildung: Tripartite Glutamatsynapse Zu tripartiten Synapsen s. auch dort
Zu tripartiten Synapsen s. auch dort
 Abbildung).
Abbildung).  Abbildung). Astrozyten setzen vor allem Glutamat und ATP frei;
weitere Gliotransmitter sind Homozystein, Taurin, natriuretische Peptide und TNF-alpha).
Abbildung). Astrozyten setzen vor allem Glutamat und ATP frei;
weitere Gliotransmitter sind Homozystein, Taurin, natriuretische Peptide und TNF-alpha). Abbildung) -, das u.a. die Freisetzung von Gliotransmittern anregt.
Abbildung) -, das u.a. die Freisetzung von Gliotransmittern anregt.
 Abbildung: Kaliumaufnahme durch Astrozyten
Abbildung: Kaliumaufnahme durch Astrozyten Abbildung)
Abbildung)
 Astrozyten regulieren auch den extrazellulären Kaliumspiegel in der unmittelban Umgebung der Nervenzellen unmittelbar ausgesetzt sind und der bei
intensiver neuronaler Aktivität merklich ansteigt (
Astrozyten regulieren auch den extrazellulären Kaliumspiegel in der unmittelban Umgebung der Nervenzellen unmittelbar ausgesetzt sind und der bei
intensiver neuronaler Aktivität merklich ansteigt ( Abbildung).
Abbildung).
 Diese Eigenschaft puffert den extrazellulären Kaliumspiegel für
Neuronen, die ja bei Aktivität Kalium freisetzen (K+ buffering) - lokale Anhäufung
extrazellulären Kaliums würde das Membranpotential reduzieren und die
physiologische Ansprechbarkeit der Nervenzelle verändern.
Diese Eigenschaft puffert den extrazellulären Kaliumspiegel für
Neuronen, die ja bei Aktivität Kalium freisetzen (K+ buffering) - lokale Anhäufung
extrazellulären Kaliums würde das Membranpotential reduzieren und die
physiologische Ansprechbarkeit der Nervenzelle verändern.  Über die Abhängigkeit von Gleichgewichtspotentialen für verschiedene Kationen und Anionen vom intra / extrazellulären Ionenmuster bei Astrozyten und Nervenzellen s. dort
Über die Abhängigkeit von Gleichgewichtspotentialen für verschiedene Kationen und Anionen vom intra / extrazellulären Ionenmuster bei Astrozyten und Nervenzellen s. dort| Astrozyten sind über gap junctions mit Nachbarzellen verbunden, bilden aber keine Aktionspotentiale |

 Abbildung: "Gliakette": Kaliumtransport durch Astrozyten
Abbildung: "Gliakette": Kaliumtransport durch Astrozyten
 Abbildung).
Das ergibt einen räumlichen Pufferungseffekt, der exzessive Anhäufung
extrazellulären Kaliums verhindert - der lokale extrazelluläre [K+] steigt höchstens auf 10-12 mM an (ceiling level).
Abbildung).
Das ergibt einen räumlichen Pufferungseffekt, der exzessive Anhäufung
extrazellulären Kaliums verhindert - der lokale extrazelluläre [K+] steigt höchstens auf 10-12 mM an (ceiling level). 
 s. auch dort
s. auch dort Änderungen des arteriellen pCO2 werden mit einer Zeitkonstante von ~60 Sekunden an den liquor cerebrospinalis übertragen. Das bedeutet, dass der Liquor-pCO2 Änderungen im arteriellen pCO2 widerspiegelt. Identisch sind die Werte aber nicht, denn die Gehirnzellen produzieren ständig CO2, sodass der Liquor-pCO2 üblicherweise um bis zu 10 mmHg höher liegt als der pCO2 im arteriellen Blut - und der pH etwas niedriger (~7,32)
als im Blutplasma (7,4). Die Pufferkapazität ist im Liquor geringer als
im Blut, denn die Proteinkonzentration ist sehr niedrig (0,15-0,45 g/l)
verglichen mit Blutplasma (66-86 g/l).
Änderungen des arteriellen pCO2 werden mit einer Zeitkonstante von ~60 Sekunden an den liquor cerebrospinalis übertragen. Das bedeutet, dass der Liquor-pCO2 Änderungen im arteriellen pCO2 widerspiegelt. Identisch sind die Werte aber nicht, denn die Gehirnzellen produzieren ständig CO2, sodass der Liquor-pCO2 üblicherweise um bis zu 10 mmHg höher liegt als der pCO2 im arteriellen Blut - und der pH etwas niedriger (~7,32)
als im Blutplasma (7,4). Die Pufferkapazität ist im Liquor geringer als
im Blut, denn die Proteinkonzentration ist sehr niedrig (0,15-0,45 g/l)
verglichen mit Blutplasma (66-86 g/l). Zu den kleinen Molekülen, welchen die Passage der Blut-Hirn-Schranke weitgehend verwehrt ist, zählen Ammoniak (potentiell neurotoxisch, wird von Astrozyten rasch zu Glutamin metabolisiert), Aminosäuren (einige wirken als Neurotransmitter, wie Glutamat oder Glyzin) und Katecholamine (auch sie wirken als Neurotransmitter, z.B. Dopamin oder Noradrenalin).
Zu den kleinen Molekülen, welchen die Passage der Blut-Hirn-Schranke weitgehend verwehrt ist, zählen Ammoniak (potentiell neurotoxisch, wird von Astrozyten rasch zu Glutamin metabolisiert), Aminosäuren (einige wirken als Neurotransmitter, wie Glutamat oder Glyzin) und Katecholamine (auch sie wirken als Neurotransmitter, z.B. Dopamin oder Noradrenalin). In die Blutbahn appliziertes Dopamin ist zur Behandlung eines Mb.
Parkinson ungeeignet; L-DOPA wird hingegen von den zerebralen
Blutgefäßen nicht abgebaut, wird über kapilläre neutrale
Aminosäuretransporter (SLC-Transporter) über die Kapillarwand gebracht und ist therapeutisch wirksam.
In die Blutbahn appliziertes Dopamin ist zur Behandlung eines Mb.
Parkinson ungeeignet; L-DOPA wird hingegen von den zerebralen
Blutgefäßen nicht abgebaut, wird über kapilläre neutrale
Aminosäuretransporter (SLC-Transporter) über die Kapillarwand gebracht und ist therapeutisch wirksam.
 Abbildung: Neurovaskuläre Einheit
Abbildung: Neurovaskuläre Einheit
 Das zerebrale Endothel bildet die Blut-Hirn-Schranke - an dieser beteiligen sich Astrozyten,
indem sie - mit gap junctions verbundene - Fortsätze dicht um die
Kapillaren aufbauen (tight junctions am apikalen Pol der Endothelzellen begrenzen die parazelluläre Durchtrittsmöglichkeit für Moleküle). An perivaskulären Fortsätzen findet sich Aquaporin 4, das den Austausch von Wasser und damit osmotischen Ausgleich ermöglicht. Zerebrale Endothelzellen sind durch zahlreiche Brückenmoleküle miteinander verbunden, was für die Eigenschaften der Blut-Hirn-Schranke wesentlich ist:
Das zerebrale Endothel bildet die Blut-Hirn-Schranke - an dieser beteiligen sich Astrozyten,
indem sie - mit gap junctions verbundene - Fortsätze dicht um die
Kapillaren aufbauen (tight junctions am apikalen Pol der Endothelzellen begrenzen die parazelluläre Durchtrittsmöglichkeit für Moleküle). An perivaskulären Fortsätzen findet sich Aquaporin 4, das den Austausch von Wasser und damit osmotischen Ausgleich ermöglicht. Zerebrale Endothelzellen sind durch zahlreiche Brückenmoleküle miteinander verbunden, was für die Eigenschaften der Blut-Hirn-Schranke wesentlich ist: Direkt an der basolateralen Membran finden sich u.a. VE (vascular-endothelial) Cadherin sowie PECAM-1 (platelet endothelial cell adhesion
molecule-1). Gap junctions verbinden die Endothelzellen.
Direkt an der basolateralen Membran finden sich u.a. VE (vascular-endothelial) Cadherin sowie PECAM-1 (platelet endothelial cell adhesion
molecule-1). Gap junctions verbinden die Endothelzellen.  Nahe der apikalen Membran finden sich tight junctions,
sie dichten die Zelllage interzellulär ab (Claudin, Occludin u.a.). An
diesen Stellen finden sich mechanische Verstrebungen mit dem
Zytoskelett.
Nahe der apikalen Membran finden sich tight junctions,
sie dichten die Zelllage interzellulär ab (Claudin, Occludin u.a.). An
diesen Stellen finden sich mechanische Verstrebungen mit dem
Zytoskelett. Astrozyten haben im Bereich der Blut-Hirn-Schranke mehrere Aufgaben:
Astrozyten haben im Bereich der Blut-Hirn-Schranke mehrere Aufgaben: Sie versorgen Neurone mit Energie. Diese wird aus Glykogen,
das die Astrozyten als zellulärer Speicher anlegen (Astrozyten
enthalten so gut wie das gesamte Glykogen im Gehirn), mobilisiert und
als Lactat an die Neuronen
übertragen - falls die Glucoseversorgung aus dem Blut nicht ausreichend
ist (Hypoglykämie) oder für kurze Perioden extremer neuronaler
Aktivität. (Diese Notversorgung reicht nur für wenige Minuten.)
Sie versorgen Neurone mit Energie. Diese wird aus Glykogen,
das die Astrozyten als zellulärer Speicher anlegen (Astrozyten
enthalten so gut wie das gesamte Glykogen im Gehirn), mobilisiert und
als Lactat an die Neuronen
übertragen - falls die Glucoseversorgung aus dem Blut nicht ausreichend
ist (Hypoglykämie) oder für kurze Perioden extremer neuronaler
Aktivität. (Diese Notversorgung reicht nur für wenige Minuten.)  Sie nehmen freigesetzte Transmittermoleküle (wie Glyzin, GABA) auf und beugen Übererregung vor (insbesondere dämpfen sie die potenziell neurotoxische
Wirkung von Glutamat), und schirmen Synapsen ab - die
Transmitterwirkung bleibt örtlich begrenzt.
Sie nehmen freigesetzte Transmittermoleküle (wie Glyzin, GABA) auf und beugen Übererregung vor (insbesondere dämpfen sie die potenziell neurotoxische
Wirkung von Glutamat), und schirmen Synapsen ab - die
Transmitterwirkung bleibt örtlich begrenzt. Sie bilden
Wachstumsfaktoren, die in ihrer Umgebung funktionserhaltend wirken, sowie Zytokine. In Abwesenheit von Astrozyten nimmt die Synapsenbildung in der betroffenen Region auf ~20% des Normalwerts ab.
Sie bilden
Wachstumsfaktoren, die in ihrer Umgebung funktionserhaltend wirken, sowie Zytokine. In Abwesenheit von Astrozyten nimmt die Synapsenbildung in der betroffenen Region auf ~20% des Normalwerts ab. Sie bilden mindestens 20 verschiedene Neurotransmitter
(die sie auch aus dem Extrazellulärraum aufnehmen können - darunter
Glutamat und GABA) sowie Rezeptoren, die Neurotransmitter binden.
Sowohl für die Abgabe als auch die Aufnahme der Transmitter gibt es
spezielle Membrantransporter. Bindung von Transmittern beeinflusst (wie
bei Nervenzellen) Membrankanäle und damit Ionenflüsse und
Membranpotential.
Sie bilden mindestens 20 verschiedene Neurotransmitter
(die sie auch aus dem Extrazellulärraum aufnehmen können - darunter
Glutamat und GABA) sowie Rezeptoren, die Neurotransmitter binden.
Sowohl für die Abgabe als auch die Aufnahme der Transmitter gibt es
spezielle Membrantransporter. Bindung von Transmittern beeinflusst (wie
bei Nervenzellen) Membrankanäle und damit Ionenflüsse und
Membranpotential. Das Epithel der Arachnoidea
Das Epithel der Arachnoidea  bildet die mittlere Schicht der Meningen.
bildet die mittlere Schicht der Meningen. Der plexus chorioideus
Der plexus chorioideus  produziert den liquor cerebrospinalis (
produziert den liquor cerebrospinalis ( s. unten).
s. unten). Abbildung oben), bestehend aus Endothel-, Glia-, glatten Muskel- und
Nervenzellen. Ihre Interaktion sichert mehrere Funktionen, zu denen
außer der Dichtigkeit / Durchlässigkeit der Blut-Hirn-Schranke u.a.
Perfusion, Clearance von Transmittermolekülen, und Neubildung von
Gewebe zählen.
Abbildung oben), bestehend aus Endothel-, Glia-, glatten Muskel- und
Nervenzellen. Ihre Interaktion sichert mehrere Funktionen, zu denen
außer der Dichtigkeit / Durchlässigkeit der Blut-Hirn-Schranke u.a.
Perfusion, Clearance von Transmittermolekülen, und Neubildung von
Gewebe zählen.  Abbildung). Die Myelinisierung erfolgt lebenslang - teils intrinsisch (innate myelination), teils als Antwort auf extrinsische Faktoren (adaptive myelination). Adaptive Myelinisierung scheint u.a. für motorisches Lernen und Konsolidierung von Gedächtnisinhalten bedeutsam zu sein.
Abbildung). Die Myelinisierung erfolgt lebenslang - teils intrinsisch (innate myelination), teils als Antwort auf extrinsische Faktoren (adaptive myelination). Adaptive Myelinisierung scheint u.a. für motorisches Lernen und Konsolidierung von Gedächtnisinhalten bedeutsam zu sein.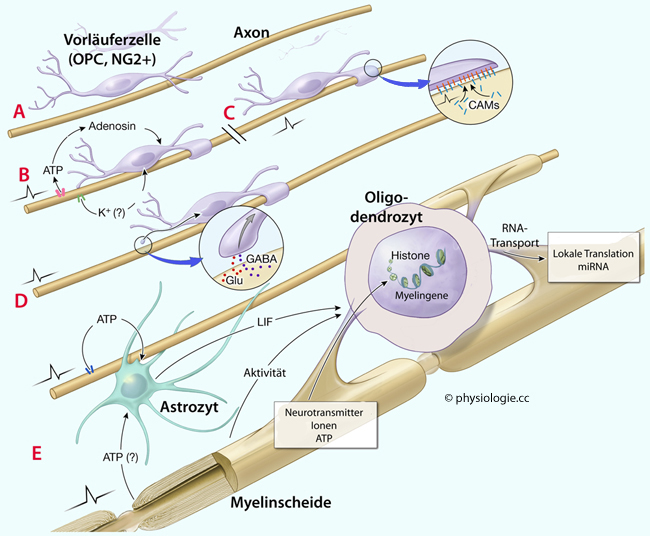
 Abbildung: Oligonendrozyten und Myelinisierung
Abbildung: Oligonendrozyten und Myelinisierung
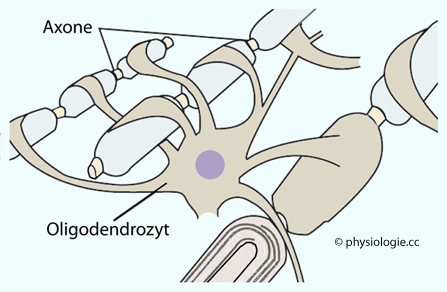
 Abbildung: Oligodendrozyt
Abbildung: Oligodendrozyt
 Abbildung). Dabei werden jeweils nur kurze (~1 µm) Abschnitte eines Axons bedeckt, dazwischen liegen Internodien frei. Wie für periphere Nerven gilt: Je dicker die Myelinscheide, desto höher ist die Leitungsgeschwindigkeit des Axons.
Abbildung). Dabei werden jeweils nur kurze (~1 µm) Abschnitte eines Axons bedeckt, dazwischen liegen Internodien frei. Wie für periphere Nerven gilt: Je dicker die Myelinscheide, desto höher ist die Leitungsgeschwindigkeit des Axons.
 Abbildung: Mikroglia verfügt über zahlreiche Rezeptoren für diverse Transmitterstoffe
Abbildung: Mikroglia verfügt über zahlreiche Rezeptoren für diverse Transmitterstoffe
 Abbildung).
Abbildung). Ultrafiltration: Die Kapillaren der Plexus sind vom fenestrierten Typ und damit relativ durchlässig, sie liegen außerhalb der Blut-Hirn-Schranke; sie filtrieren druckabhängig Ultrafiltrat in das Stroma.
Ultrafiltration: Die Kapillaren der Plexus sind vom fenestrierten Typ und damit relativ durchlässig, sie liegen außerhalb der Blut-Hirn-Schranke; sie filtrieren druckabhängig Ultrafiltrat in das Stroma.  Selektiver Transport: Das Epithel des Ependyms bildet hingegen eine - aus einer einzelligen Schicht bestehende - selektive Barriere (zwischen den Zellen liegen tight junctions). Wasser und Atemgase gelangen leicht durch diese Schicht; für Elektrolyte, Nährstoffe (Glucose), Vitamine, Spurenelemente ist nur regulierte Passage möglich (einschließlich aktivem Transport in
beide Richtungen). Auch Peptide und einige Proteine können in den
liquor cerebrospinalis gelangen (Zusammensetzung s. Tabellen unten).
Pharmaka passieren diese Barriere mit sehr unterschiedlicher
Geschwindigkeit (z.B. Penicillin schwer, Erythromycin hingegen leicht).
Selektiver Transport: Das Epithel des Ependyms bildet hingegen eine - aus einer einzelligen Schicht bestehende - selektive Barriere (zwischen den Zellen liegen tight junctions). Wasser und Atemgase gelangen leicht durch diese Schicht; für Elektrolyte, Nährstoffe (Glucose), Vitamine, Spurenelemente ist nur regulierte Passage möglich (einschließlich aktivem Transport in
beide Richtungen). Auch Peptide und einige Proteine können in den
liquor cerebrospinalis gelangen (Zusammensetzung s. Tabellen unten).
Pharmaka passieren diese Barriere mit sehr unterschiedlicher
Geschwindigkeit (z.B. Penicillin schwer, Erythromycin hingegen leicht).
 Abbildung: Liquorräume und Liquorfluss
Abbildung: Liquorräume und Liquorfluss von
den Seitenventrikeln über die foramina interventriculares (Monroi
von
den Seitenventrikeln über die foramina interventriculares (Monroi  ) zum 3. Ventrikel,
) zum 3. Ventrikel,  von hier über den
aqueductus cerebri (Sylvii
von hier über den
aqueductus cerebri (Sylvii  ) zum 4. Ventrikel,
) zum 4. Ventrikel,  und aus diesem über das foramen Magendie
und aus diesem über das foramen Magendie  (mediane Apertur) und die beiden foramina
Luschka
(mediane Apertur) und die beiden foramina
Luschka  (linke und rechte laterale Apertur) in den Subarachnoidalraum.
(linke und rechte laterale Apertur) in den Subarachnoidalraum.  (granulationes arachnoidales) aus dem Gehirnbereich, und über
Wurzeltaschen der Hirn- und Rückenmarksnerven in das venöse Blut befördert (teilweise durch Transzytose).
Der Anteil der Resorption der zerebrospinalen Flüssigkeit durch villi arachnoidales im Rückenmarksbereich ist von den Umständen abhängig (knapp 40% im Ruhezustand, ~75% bei körperlicher Belastung).
(granulationes arachnoidales) aus dem Gehirnbereich, und über
Wurzeltaschen der Hirn- und Rückenmarksnerven in das venöse Blut befördert (teilweise durch Transzytose).
Der Anteil der Resorption der zerebrospinalen Flüssigkeit durch villi arachnoidales im Rückenmarksbereich ist von den Umständen abhängig (knapp 40% im Ruhezustand, ~75% bei körperlicher Belastung). Abbildung):
Abbildung): 
 Abbildung: Bildung und Resorption des Liquor cerebrospinalis
Abbildung: Bildung und Resorption des Liquor cerebrospinalis
 bezeichnet: Statt Strömung = Druckdifferenz / Widerstand heisst es hier
bezeichnet: Statt Strömung = Druckdifferenz / Widerstand heisst es hier| ICP = Pv + F x R |
 stützt und schützt das Gehirngewebe mechanisch ("Stoßdämpferfunktion" -
die effektive Gehirnmasse ist durch die Einlagerung in Flüssigkeit mit
kaum geringerem (1,007) spezifischen Gewicht wie das Nervengewebe
(1,040) stark reduziert),
stützt und schützt das Gehirngewebe mechanisch ("Stoßdämpferfunktion" -
die effektive Gehirnmasse ist durch die Einlagerung in Flüssigkeit mit
kaum geringerem (1,007) spezifischen Gewicht wie das Nervengewebe
(1,040) stark reduziert), wirkt hämodynamisch (Blutdruck) und biochemisch (Zusammensetzung) stabilisierend,
wirkt hämodynamisch (Blutdruck) und biochemisch (Zusammensetzung) stabilisierend, entfernt
neuroendokrine Faktoren und metabolische Endprodukte aus dem
Gehirngewebe ("glymphatisches" System s. oben), weiters
entfernt
neuroendokrine Faktoren und metabolische Endprodukte aus dem
Gehirngewebe ("glymphatisches" System s. oben), weiters  verleiht er dem Nervensystem immunologischen Schutz.
verleiht er dem Nervensystem immunologischen Schutz.
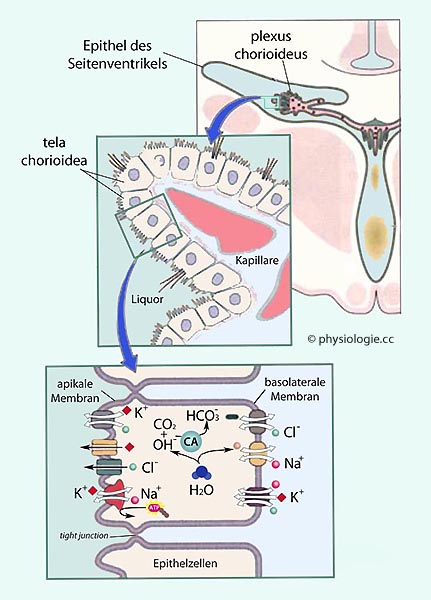
 Abbildung: Ependymale Sekretion des liquor cerebrospinalis
Abbildung: Ependymale Sekretion des liquor cerebrospinalis
 Abbildung) und Aquaporine, welche
zur Produktion der (mit ~290 mOsm isotonen) Liquorflüssigkeit nötig
sind. Diese ist kein simples Filtrat des Blutes; ihre
Zusammensetzung (s. unten) weicht von der des Plasmas ab. Verantwortlich dafür ist das einschichtige Epithel des Ependyms, das (vergleichbar dem renalen Tubulusepithel) die kapillär filtrierte Flüssigkeit sekundär modifiziert.
Abbildung) und Aquaporine, welche
zur Produktion der (mit ~290 mOsm isotonen) Liquorflüssigkeit nötig
sind. Diese ist kein simples Filtrat des Blutes; ihre
Zusammensetzung (s. unten) weicht von der des Plasmas ab. Verantwortlich dafür ist das einschichtige Epithel des Ependyms, das (vergleichbar dem renalen Tubulusepithel) die kapillär filtrierte Flüssigkeit sekundär modifiziert.
 Sehr geringe Proteinkonzentration: Der Liquor / Blutplasma-Quotient
beträgt 0,004 (Ultrafiltrat des Blutplasma),
Sehr geringe Proteinkonzentration: Der Liquor / Blutplasma-Quotient
beträgt 0,004 (Ultrafiltrat des Blutplasma), daher auch der
niedrigere pH-Wert (7,33) im Vergleich zu Blut (7.40)
daher auch der
niedrigere pH-Wert (7,33) im Vergleich zu Blut (7.40) Liquor / Blutplasma-Quotienten <1,0 finden sich für Aminosäuren (0,27), Kalium (0,66), Glucose (0,67), Calcium (0,7),
Bicarbonat (0,92) und Natrium (0,96).
Liquor / Blutplasma-Quotienten <1,0 finden sich für Aminosäuren (0,27), Kalium (0,66), Glucose (0,67), Calcium (0,7),
Bicarbonat (0,92) und Natrium (0,96). Liquor / Blutplasma-Quotienten >1,0 finden sich für Chlorid (1,03), ionisiertes Phosphat (1,2), ionisiertes Magnesium (1,8).
Liquor / Blutplasma-Quotienten >1,0 finden sich für Chlorid (1,03), ionisiertes Phosphat (1,2), ionisiertes Magnesium (1,8). Die Konzentrationswerte werden an der Blut-Hirn-Schranke genau reguliert.
Die Konzentrationswerte werden an der Blut-Hirn-Schranke genau reguliert.  Die Kaliumkonzentration im Liquor von Säugetieren beträgt stabil ~3 mM (auch wenn sich der Kaliumwert im Blutplasma ändert - Hypo- oder Hyperkaliämie),
Die Kaliumkonzentration im Liquor von Säugetieren beträgt stabil ~3 mM (auch wenn sich der Kaliumwert im Blutplasma ändert - Hypo- oder Hyperkaliämie),  [Ca++] beträgt 1,0-1,5 mM (da so gut wie kein Protein im Liquor vorhanden ist, gibt es hier fast nur freies Calcium),
[Ca++] beträgt 1,0-1,5 mM (da so gut wie kein Protein im Liquor vorhanden ist, gibt es hier fast nur freies Calcium), die Magnesiumkonzentration übersteigt mit 1,1 mM die Blutwerte um ca. 50%,
die Magnesiumkonzentration übersteigt mit 1,1 mM die Blutwerte um ca. 50%, der Glucosewert ist mit 3-4 mM auf 60-80% des Plasma-Nüchternwerts
einreguliert und ändert sich auch dann nicht, wenn der
Blutzuckerspiegel um ein Mehrfaches schwankt.
der Glucosewert ist mit 3-4 mM auf 60-80% des Plasma-Nüchternwerts
einreguliert und ändert sich auch dann nicht, wenn der
Blutzuckerspiegel um ein Mehrfaches schwankt.| Liquor cerebrospinalis: Osmolalität, pH, Blutgaswerte | |||
| Osmolalität | 290 mOsm (wie Plasma) |
pO2 | wie gemischt-venöses Blut (40 mmHg) |
| pH | 7,33 (Blut 7,40) |
pCO2 | wie gemischt-venöses Blut (46 mmHg) |
| Bicarbonat | 22 mM (Plasma 24) |
||
| Liquor cerebrospinalis: Mineralstoffe | |||
| Na+ | 145 mM (Plasma 145) |
Ca++ (frei) |
1,1 mM (Plasma 1,3) |
| K+ | 2,9 mM (Plasma 4,6) |
Mg++ (frei) |
1,1 mM (Plasma 0,6) |
| Cl- | 113 mM (Plasma 100) |
Phosphat (primär + sekundär) |
0,9 mM (Plasma 0,75) |
| Liquor cerebrospinalis: Organische Substanzen / Zellen |
|||
| Harnstoff | 4 mM (wie Plasma) |
Glucose | 3-4 mM (Plasma 5) |
| Lactat | 1,7 mM (wie Plasma) |
Kreatinin | 80 µM (wie Plasma) |
| Aminosäuren | 0,7 mM (Plasma 2,6) |
Cholesterin | 0,2 mg/dl (Plasma 175) |
| Protein | 0,3 g/l (Plasma 70) |
Leukozyten |
0-5/mm3 (Blut 4000-11000) |
 Animation). Die pulssynchronen Volumenänderungen betragen ~0,1% des intrakraniellen Volumens, entsprechend ungefähr 1% der Liquormenge und reichen aus, Austauschvorgänge zwischen Liquor und Hirngewebe deutlich zu unterstützen. Die Oszillationen sind puls-, aber auch atemsynchron.
Animation). Die pulssynchronen Volumenänderungen betragen ~0,1% des intrakraniellen Volumens, entsprechend ungefähr 1% der Liquormenge und reichen aus, Austauschvorgänge zwischen Liquor und Hirngewebe deutlich zu unterstützen. Die Oszillationen sind puls-, aber auch atemsynchron. 
 Animation: Pulsationen des liquor cerebrospinalis
Animation: Pulsationen des liquor cerebrospinalis
 s. oben) und ist in einem engen Bereich von
1-2 kPa (7-15 mmHg) reguliert. Er ist auch lageabhängig (im Liegen höher als in aufrechter Körperposition), ähnlich dem Augeninnendruck.
s. oben) und ist in einem engen Bereich von
1-2 kPa (7-15 mmHg) reguliert. Er ist auch lageabhängig (im Liegen höher als in aufrechter Körperposition), ähnlich dem Augeninnendruck.  Gliazellen - Astrozyten, Oligodendrozyten, Mikroglia - sind
regenerationsfähig, unterstützen den Stoffwechsel der Neuronen,
stabilisieren interstitielle Elektrolyt- und
Transmitterkonzentrationen, exprimieren Rezeptoren und
Transporter, und bilden selbst "Gliotransmitter" (Glutamat, GABA,
D-Serin, ATP, Wachstumsfaktoren), die breite Wirkung in der Umgebung
entfalten ("Volumentransmission")
Gliazellen - Astrozyten, Oligodendrozyten, Mikroglia - sind
regenerationsfähig, unterstützen den Stoffwechsel der Neuronen,
stabilisieren interstitielle Elektrolyt- und
Transmitterkonzentrationen, exprimieren Rezeptoren und
Transporter, und bilden selbst "Gliotransmitter" (Glutamat, GABA,
D-Serin, ATP, Wachstumsfaktoren), die breite Wirkung in der Umgebung
entfalten ("Volumentransmission") Astrozyten verknüpfen neuronale Aktivität und lokale Durchblutung und
beteiligen sich an der Sauerstoff- und Glucoseversorgung des
Hirngewebes. Glucose kann die Blut-Hirn-Schranke wegen der Anwesenheit
von GLUT 1 an zerebralen Endothelzellen und Astroglia überwinden
Astrozyten verknüpfen neuronale Aktivität und lokale Durchblutung und
beteiligen sich an der Sauerstoff- und Glucoseversorgung des
Hirngewebes. Glucose kann die Blut-Hirn-Schranke wegen der Anwesenheit
von GLUT 1 an zerebralen Endothelzellen und Astroglia überwinden Astrozyten speichern den zerebralen Glykogenvorrat. Bei unzureichender
Glucoseversorgung des Gehirns springen Astrozyten ein und bilden aus
Glykogen Lactat. Dieses gelangt mittels Transportern an umliegende
Neuronen, wird hier zu Pyruvat rückverwandelt und anschließend im
Zitratzyklus metabolisiert
Astrozyten speichern den zerebralen Glykogenvorrat. Bei unzureichender
Glucoseversorgung des Gehirns springen Astrozyten ein und bilden aus
Glykogen Lactat. Dieses gelangt mittels Transportern an umliegende
Neuronen, wird hier zu Pyruvat rückverwandelt und anschließend im
Zitratzyklus metabolisiert Astrozyten verfügen in ihrer Membran über Aquaporin 4 und erleichtern
so den Wasserdurchtritt durch Grenzflächen des Gehirns
(Blut-Hirn-Schranke)
Astrozyten verfügen in ihrer Membran über Aquaporin 4 und erleichtern
so den Wasserdurchtritt durch Grenzflächen des Gehirns
(Blut-Hirn-Schranke) Gliotransmitter beeinflussen die Freisetzung von Neurotransmittern und
Hormonen sowie Entwicklung und Funktion von Synapsen. Sie wirken sowohl
zwischen Glia- und Nervenzellen als auch zwischen Astrozyten,
Oligodendroglia und Mikroglia
Gliotransmitter beeinflussen die Freisetzung von Neurotransmittern und
Hormonen sowie Entwicklung und Funktion von Synapsen. Sie wirken sowohl
zwischen Glia- und Nervenzellen als auch zwischen Astrozyten,
Oligodendroglia und Mikroglia Astrozyten regulieren den extrazellulären Kaliumspiegel:
Spannungsgesteuerte Kaliumkanäle machen sie abhängig vom
extrazellulären Kaliumwert. Lokale Anhäufung extrazellulären Kaliums
wird weitgehend verhindert, was die Ansprechbarkeit der Nervenzellen
stabilisiert. Astrozyten sind über gap junctions mit Nachbarzellen
verbunden ("Gliaketten"), sie bilden selbst keine Aktionspotentiale
Astrozyten regulieren den extrazellulären Kaliumspiegel:
Spannungsgesteuerte Kaliumkanäle machen sie abhängig vom
extrazellulären Kaliumwert. Lokale Anhäufung extrazellulären Kaliums
wird weitgehend verhindert, was die Ansprechbarkeit der Nervenzellen
stabilisiert. Astrozyten sind über gap junctions mit Nachbarzellen
verbunden ("Gliaketten"), sie bilden selbst keine Aktionspotentiale Oligodendrozyten bilden im ZNS Myelinscheiden (erhöhte
Leitungsgeschwindigkeit) an jeweils mehreren Nervenfasern. Einige
Oligodendrozyten beteiligen sich an der Stabilisierung der
extrazellulären Umgebung von Nervenzellen (Satelliten-Oligodendrozyten)
Oligodendrozyten bilden im ZNS Myelinscheiden (erhöhte
Leitungsgeschwindigkeit) an jeweils mehreren Nervenfasern. Einige
Oligodendrozyten beteiligen sich an der Stabilisierung der
extrazellulären Umgebung von Nervenzellen (Satelliten-Oligodendrozyten) Mikroglia sind mobile Immunzellen. Sie überprüfen Neuronen auf
Intaktheit, beheben Schäden, entfernen Zellfragmente, bilden
neurotrophe Substanzen und verfügen über Rezeptoren für
Transmitterstoffe
Mikroglia sind mobile Immunzellen. Sie überprüfen Neuronen auf
Intaktheit, beheben Schäden, entfernen Zellfragmente, bilden
neurotrophe Substanzen und verfügen über Rezeptoren für
Transmitterstoffe Der Liquor cerebrospinalis (100-200 ml, 1/5 Ventrikel, 4/5
subarachnoidale Räume des ZNS) ist ein Produkt des plexus chorioideus.
Er fließt von den Hirnventrikeln in den subarachnoidalen Raum und von
dort zurück in den Blutkreislauf. Der Ausflusswiderstand trägt zum
Betrag des Liquordrucks bei. Die intrakranielle Compliance nimmt mit
dem Volumen ab
Der Liquor cerebrospinalis (100-200 ml, 1/5 Ventrikel, 4/5
subarachnoidale Räume des ZNS) ist ein Produkt des plexus chorioideus.
Er fließt von den Hirnventrikeln in den subarachnoidalen Raum und von
dort zurück in den Blutkreislauf. Der Ausflusswiderstand trägt zum
Betrag des Liquordrucks bei. Die intrakranielle Compliance nimmt mit
dem Volumen ab Der Liquor bewegt sich synchron zu Druckpulsen im Gefäßsystem. Er
stützt und schützt das Gehirn, wirkt hämodynamisch und biochemisch
stabilisierend und verleiht dem Nervensystem immunologischen Schutz
Der Liquor bewegt sich synchron zu Druckpulsen im Gefäßsystem. Er
stützt und schützt das Gehirn, wirkt hämodynamisch und biochemisch
stabilisierend und verleiht dem Nervensystem immunologischen Schutz Der hydrostatische Druck der Gehirnflüssigkeit innerhalb der
Schädelkapsel (intrakranieller Druck, Hirndruck, Liquordruck) beträgt
1-2 kPa und ergibt sich aus dem Gleichgewicht von Produktion (~60%
Ependymzellen, ~40% Blutgefäße der Ventrikelwände) und Abfluss
(Pacchioni-Granulationen, Wurzeltaschen der Hirn- und
Rückenmarksnerven) des liqour cerebrospinalis
Der hydrostatische Druck der Gehirnflüssigkeit innerhalb der
Schädelkapsel (intrakranieller Druck, Hirndruck, Liquordruck) beträgt
1-2 kPa und ergibt sich aus dem Gleichgewicht von Produktion (~60%
Ependymzellen, ~40% Blutgefäße der Ventrikelwände) und Abfluss
(Pacchioni-Granulationen, Wurzeltaschen der Hirn- und
Rückenmarksnerven) des liqour cerebrospinalis |
