

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert


 Leber und
Kohlenhydratstoffwechsel
Leber und
Kohlenhydratstoffwechsel
 Glucokinase: γλυκύς = süß, κινειν = bewegen
Glucokinase: γλυκύς = süß, κινειν = bewegen| Die
Leber ist ein Schlüsselorgan für die Stabilisierung des Blutzuckerspiegels:
Während das Angebot an Kohlenhydraten mit der Nahrung stoßweise
erfolgt, sorgt sie für kontinuierliche Versorgung des Organismus mit
Glucose (metabolische Pufferung). Im Falle längerer Hungerperioden
verwertet sie Fettsäuren und baut sie zu Ketonkörpern um. In der 2-4 Stunden dauernden postprandialen (resorptiven) Phase speichert sie Zucker als Glykogen, in der postresorptiven gibt sie Glucose an den Extrazellulärraum ab. Glucosetransporter ermöglichen die Passage von Glucose durch die Zellmembran, u.a. der insulinunabhängige GLUT 2, der zusammen mit der (insulinabhängigen) Glucokinase als Glucosesensor wirkt (der Glucosestoffwechsel reagiert auf Änderungen des Blutzuckerspiegels). Während Insulin (postprandial) den Glucoseeinbau fördert, wirken Glucagon, Katecholamine und Kortisol (postresorptiv) glucosemobilisierend. Die maximale hepatische Speicherkapazität beträgt etwa 150 g Glykogen, sie kann so gut wie vollständig anderen Organen (vor allem dem Gehirn) zur Verfügung gestellt werden. |
 Transport von Monosacchariden über Zellmembranen
Transport von Monosacchariden über Zellmembranen  Glucosesensor
Glucosesensor  Glykogenspeicher
Glykogenspeicher Glucokinase
Glucokinase

 Abbildung: Glucosestoffwechsel der Leber
Abbildung: Glucosestoffwechsel der Leber
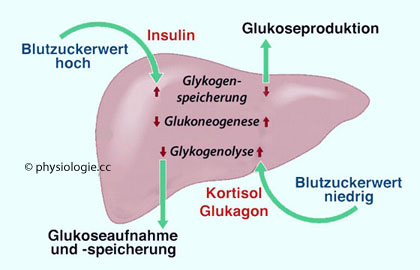
 Abbildung: Hormonelle Regelung des Glucosemetabolismus in der Leber
Abbildung: Hormonelle Regelung des Glucosemetabolismus in der Leber
 Stabilisierung des Blutzuckerspiegels (metabolische Pufferfunktion) durch Aufnahme oder Abgabe von Glucose
Stabilisierung des Blutzuckerspiegels (metabolische Pufferfunktion) durch Aufnahme oder Abgabe von Glucose Energiespeicherung in Form von Glykogen (Kapazität Leberglykogen: ca 150 g)
Energiespeicherung in Form von Glykogen (Kapazität Leberglykogen: ca 150 g) Gluconeogenese (Bildung von Glucose aus Aminosäuren, Glycerin, Lactat
Gluconeogenese (Bildung von Glucose aus Aminosäuren, Glycerin, Lactat  , Galactose, Fruktose, Xylit)
, Galactose, Fruktose, Xylit) Bildung verschiedener Verbindungen aus Intermediärstoffen des Kohlenhydratstoffwechsels (Pyruvat, Ribosen, NADPH)
Bildung verschiedener Verbindungen aus Intermediärstoffen des Kohlenhydratstoffwechsels (Pyruvat, Ribosen, NADPH)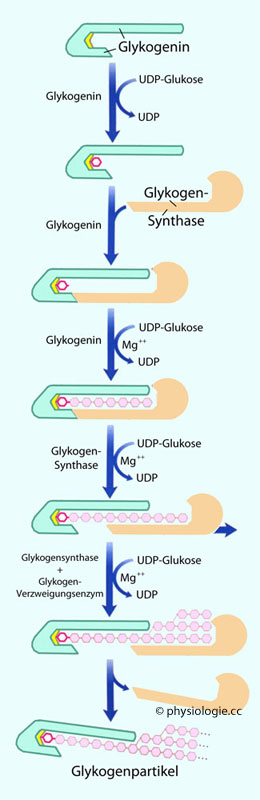
 Abbildung: Glykogenin und Glykogen-Synthase starten die Glykogenbildung
Abbildung: Glykogenin und Glykogen-Synthase starten die Glykogenbildung
 Sowohl Glykogenolyse als auch Gluconeogenese erhöhen den
Blutzuckerspiegel. Der Unterschied liegt darin, wie sie das
bewerkstelligen:
Sowohl Glykogenolyse als auch Gluconeogenese erhöhen den
Blutzuckerspiegel. Der Unterschied liegt darin, wie sie das
bewerkstelligen:  Glykogenolyse gewinnt Glucose via Glykogenabbau und Mobilisierung von
Glucose aus Glucose-6-Phosphat (nur Leberzellen verfügen über das dazu
notwendige Enzym Glucose-6-Phosphatase), vgl. dort;
Glykogenolyse gewinnt Glucose via Glykogenabbau und Mobilisierung von
Glucose aus Glucose-6-Phosphat (nur Leberzellen verfügen über das dazu
notwendige Enzym Glucose-6-Phosphatase), vgl. dort; Gluconeogenese gewinnt Glucose aus Aminosäuren oder Glycerin.
Gluconeogenese gewinnt Glucose aus Aminosäuren oder Glycerin. Abbildung), von denen die Zellen des Körpers unterschiedlich Gebrauch machen: GLUT (glucose transporter) und SGLT (sodium-glucose transporter):
Abbildung), von denen die Zellen des Körpers unterschiedlich Gebrauch machen: GLUT (glucose transporter) und SGLT (sodium-glucose transporter): GLUT binden ein Monosaccharid an einer Seite der Zellmembran, ändern
ihre Gestalt und setzen das transportierte Molekül an der anderen Seite
der Zellmembran wieder frei;
GLUT binden ein Monosaccharid an einer Seite der Zellmembran, ändern
ihre Gestalt und setzen das transportierte Molekül an der anderen Seite
der Zellmembran wieder frei;  SGLT sind Cotransporter (2 Na+ mit 1 Glucose oder Galactose - der Natriumgradient in die Zelle wird für den Transport des Monosaccharids gegen sein Konzentrationsgefälle genutzt).
SGLT sind Cotransporter (2 Na+ mit 1 Glucose oder Galactose - der Natriumgradient in die Zelle wird für den Transport des Monosaccharids gegen sein Konzentrationsgefälle genutzt). Orale
Rehydration erfolgt oft mit Flüssigkeiten, die eine Kombination von
Zucker und Salz enthalten - weil Glucose z.T. über Cotransport mit
Natriumionen in die Zellen gelangt (SGLTs nutzen den Natriumgradienten
zur "Mitnahme" von Glucose über die Zellmembran).
Orale
Rehydration erfolgt oft mit Flüssigkeiten, die eine Kombination von
Zucker und Salz enthalten - weil Glucose z.T. über Cotransport mit
Natriumionen in die Zellen gelangt (SGLTs nutzen den Natriumgradienten
zur "Mitnahme" von Glucose über die Zellmembran). 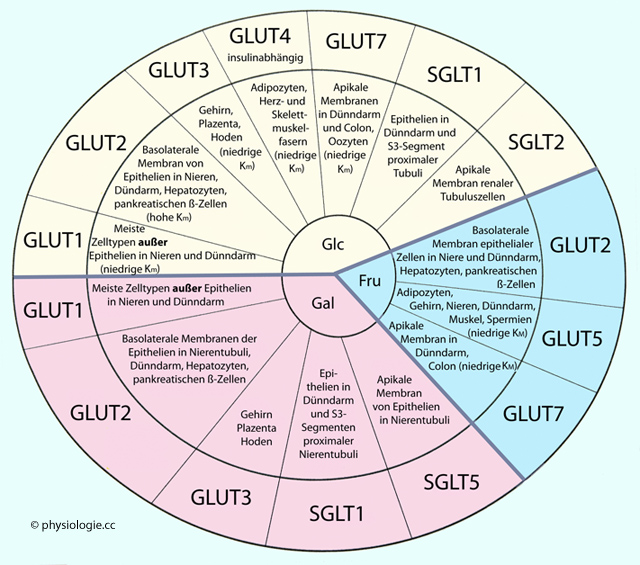

 Abbildung: Glucosetransport in verschiedenen Geweben
Abbildung: Glucosetransport in verschiedenen Geweben
| Transporter |
Verbreitung |
Funktion | Bemerkungen |
| GLUT1 |
Meiste
Körperzellen (Hepatozyten, ß-Zellen, Erythrozyten, Endothel, Gehirn,
Hoden, Plazenta, Adipozyten, quergestreifte Muskelzellen) außer Epithelien in Dünndarm und Nieren |
Bidirektionaler Transport von Glucose, Galactose | Basale Glucoseversorgung. Bei niedrigem Blutzuckerspiegel vermehrte Einlagerung |
| GLUT2 |
Leber, ß-Zellen im Pankreas, Dünndarm, proximaler Tubulus |
Bidirektionaler Transport von Glucose, Galactose, Fructose | Relativ geringe Glucoseaffinität, aber hohe Transportkapazität Teil des pankreatischen Glucosesensors |
| GLUT3 |
Gehirn (basale Versorgung), Plazenta, Hoden |
Import von Glucose, Galactose | Hohe Glucoseaffinität, basale Glucoseversorgung |
| GLUT4 |
Adipozyten, quergestreifte Muskelzellen |
Insulinabhängiger Glucoseimport | Speicherungsfunktion |
| GLUT5 |
Enterozyten (Dünndarm) |
Import von Fructose | - |
 GLUT2 ist der führende Glucosetransporter in der Leber
(Hepatozyten) und dient hier der Energiespeicherung.
GLUT2 ist der führende Glucosetransporter in der Leber
(Hepatozyten) und dient hier der Energiespeicherung.
 ß-Zellen in den Langerhans-Inseln des Pankreas
exprimieren ebenfalls GLUT2, wo Glucose je nach Konzentrationsmustern
im- oder exportiert wird; GLUT2 gleicht die intrazelluläre an die
extrazelluläre Glucosekonzentration an und dient deshalb als
"Glucosesensor": Steigt der Glucosespiegel, wird die Insulinfreisetzung angeregt - und vice versa.
ß-Zellen in den Langerhans-Inseln des Pankreas
exprimieren ebenfalls GLUT2, wo Glucose je nach Konzentrationsmustern
im- oder exportiert wird; GLUT2 gleicht die intrazelluläre an die
extrazelluläre Glucosekonzentration an und dient deshalb als
"Glucosesensor": Steigt der Glucosespiegel, wird die Insulinfreisetzung angeregt - und vice versa. GLUT2 findet sich auch der basolateralen Membran von Darmschleimhautzellen sowie in proximalen
Tubuli der Niere.
GLUT2 findet sich auch der basolateralen Membran von Darmschleimhautzellen sowie in proximalen
Tubuli der Niere.  GLUT2
hält den intrazellulären Glucosespiegel dank seiner hohen (passiven)
Transportkapazität ziemlich genau auf dem extrazellulären Wert. Glucose
und Galactose gelangen auf diesem Wege rasch vom Pfortaderblut in die
Leber, ohne dass es nach einer kohlenhydratreichen Mahlzeit zu einer
Hyperglycämie / Galactosämie kommt. Umgekehrt erlaubt GLUT2 eine rasche
Freisetzung von Glucose aus der Leber, wenn der Blutzuckerspiegel
absinkt.
GLUT2
hält den intrazellulären Glucosespiegel dank seiner hohen (passiven)
Transportkapazität ziemlich genau auf dem extrazellulären Wert. Glucose
und Galactose gelangen auf diesem Wege rasch vom Pfortaderblut in die
Leber, ohne dass es nach einer kohlenhydratreichen Mahlzeit zu einer
Hyperglycämie / Galactosämie kommt. Umgekehrt erlaubt GLUT2 eine rasche
Freisetzung von Glucose aus der Leber, wenn der Blutzuckerspiegel
absinkt. Glucokinase
Glucokinase  ist ein Enzym mit niedriger Affinität für Glucose (Halbsättigung bei 8
mM Glucose - normaler Blutspiegel 5 mM). Ihre Expression steht unter
der Kontrolle von zwei Promotorgenen, eines davon wird durch Insulin
angeregt (in Hepatozyten), das andere wirkt konstitutiv in
pankreatischen ß-Zellen.
Glucokinase phosphoryliert Glucose zu Glucose-6-phosphat (G6P), das die
Zelle nicht verlassen kann (im Gegensatz zu unphosphorylierter
Glucose).
ist ein Enzym mit niedriger Affinität für Glucose (Halbsättigung bei 8
mM Glucose - normaler Blutspiegel 5 mM). Ihre Expression steht unter
der Kontrolle von zwei Promotorgenen, eines davon wird durch Insulin
angeregt (in Hepatozyten), das andere wirkt konstitutiv in
pankreatischen ß-Zellen.
Glucokinase phosphoryliert Glucose zu Glucose-6-phosphat (G6P), das die
Zelle nicht verlassen kann (im Gegensatz zu unphosphorylierter
Glucose).  Bei niedrigen Glucosewerten bindet Glucokinase an GK-RP (glucokinase regulatory protein),
das sie daraufhin in den Zellkern eskortiert und als inaktives Molekül
in Reserve hält. So wird weniger Glucose in G6P umgesetzt.
Bei niedrigen Glucosewerten bindet Glucokinase an GK-RP (glucokinase regulatory protein),
das sie daraufhin in den Zellkern eskortiert und als inaktives Molekül
in Reserve hält. So wird weniger Glucose in G6P umgesetzt. Bei hohen Glucosewerten
löst sich die Bindung des Enzyms an GK-RP, die Glucokinase wird frei
und kann im Zytoplasma wieder wirksam werden (G6P bilden). Von hier gibt es mehrere Verwendungen:
Bei hohen Glucosewerten
löst sich die Bindung des Enzyms an GK-RP, die Glucokinase wird frei
und kann im Zytoplasma wieder wirksam werden (G6P bilden). Von hier gibt es mehrere Verwendungen: Pentosephosphatweg
(Glucose wird zu Ribulose-5-Phosphat und NADPH umgesetzt.
Ribulose-5-Phosphat kann zu Ribose-5-Phosphat isomerisiert und für die
Nukleotidsynthese - z.B. im Rahmen von Mitosen -, NADPH zur Synthese
von Steroiden oder Fettsäuren - z.B. in der laktierenden Brustdrüse -,
zur Bildung freier Radikale - z.B. im Rahmen der Phagozytose - oder im Rahmen der NO-Synthese verwendet werden),
Pentosephosphatweg
(Glucose wird zu Ribulose-5-Phosphat und NADPH umgesetzt.
Ribulose-5-Phosphat kann zu Ribose-5-Phosphat isomerisiert und für die
Nukleotidsynthese - z.B. im Rahmen von Mitosen -, NADPH zur Synthese
von Steroiden oder Fettsäuren - z.B. in der laktierenden Brustdrüse -,
zur Bildung freier Radikale - z.B. im Rahmen der Phagozytose - oder im Rahmen der NO-Synthese verwendet werden),  Glykogensynthese (Energiepeicher: Leber, Muskel),
Glykogensynthese (Energiepeicher: Leber, Muskel),  Glykolyse (Anabolie, ATP, Lipogenese).
Glykolyse (Anabolie, ATP, Lipogenese). Das Enzymprodukt Glucose-6-Phosphat inhibiert die Glucokinase nur schwach; G6P wird aber z.T. in Fructose-6-Phosphat umgesetzt, das die Einlagerung der Glucokinase in den Zellkern - und damit ihre Inaktivierung - fördert (negative Rückkopplung).
Das Enzymprodukt Glucose-6-Phosphat inhibiert die Glucokinase nur schwach; G6P wird aber z.T. in Fructose-6-Phosphat umgesetzt, das die Einlagerung der Glucokinase in den Zellkern - und damit ihre Inaktivierung - fördert (negative Rückkopplung).  Insulin fördert, Glucagon reduziert die Synthese von Glucokinase.
Insulin fördert, Glucagon reduziert die Synthese von Glucokinase. Abbildung).
Die (phosphorylierende) Aktivität der Glucokinase bestimmt die Glucoseaufnahme der Leberzelle.
Abbildung).
Die (phosphorylierende) Aktivität der Glucokinase bestimmt die Glucoseaufnahme der Leberzelle. 
 Abbildung: Glucoseaustausch zwischen den Geweben (digestive Phase)
Abbildung: Glucoseaustausch zwischen den Geweben (digestive Phase)
 Steigt das Glucoseangebot (postprandial), nimmt auch der
Insulinspiegel zu und dies aktiviert die Glucokinase.
(Bei einer durchschnittlichen Mahlzeit werden 30-60 Gramm Glucose resorbiert - Gehirn und Erythrozyten benötigen ~7-8 g/h).
Steigt das Glucoseangebot (postprandial), nimmt auch der
Insulinspiegel zu und dies aktiviert die Glucokinase.
(Bei einer durchschnittlichen Mahlzeit werden 30-60 Gramm Glucose resorbiert - Gehirn und Erythrozyten benötigen ~7-8 g/h). Nimmt das Glucoseangebot unter die Schwelle ab, unter der Glucose aus der Leber nachgeliefert wird (Nüchternzustand), wird der Glykogenabbau gefördert und die Glykogensynthese gehemmt:
Nimmt das Glucoseangebot unter die Schwelle ab, unter der Glucose aus der Leber nachgeliefert wird (Nüchternzustand), wird der Glykogenabbau gefördert und die Glykogensynthese gehemmt:

 Abbildung: Quellen der hepatischen Glucoseproduktion im Fastenversuch
Abbildung: Quellen der hepatischen Glucoseproduktion im Fastenversuch
 Bei Substratmangel (Hunger) wird Glucose aus Nichtkohlenhydraten gebildet
(Gluconeogenese).
Verwendet werden dazu Aminosäuren (aus Protein: vor
allem Muskelgewebe) und Glycerin (aus Fettgewebe), auch Lactat (aus
Glykolyse).
Bei Substratmangel (Hunger) wird Glucose aus Nichtkohlenhydraten gebildet
(Gluconeogenese).
Verwendet werden dazu Aminosäuren (aus Protein: vor
allem Muskelgewebe) und Glycerin (aus Fettgewebe), auch Lactat (aus
Glykolyse).  Aus den Glykogenreserven können 4-5 g/h Glucose gewonnen
werden,
Aus den Glykogenreserven können 4-5 g/h Glucose gewonnen
werden,  durch Gluconeogenese (aus Glycerin, Lactat und Aminosäuren) ~3
g/h.
durch Gluconeogenese (aus Glycerin, Lactat und Aminosäuren) ~3
g/h. Abbildung). Die Gluconeogenese läuft über einen längeren
Zeitraum stabil weiter, bis zunehmend auf Ketogenese umgeschaltet
werden muss.
Abbildung). Die Gluconeogenese läuft über einen längeren
Zeitraum stabil weiter, bis zunehmend auf Ketogenese umgeschaltet
werden muss. Über die Stabilisierung des Blutzuckerspiegels durch die Leber und die Versorgung der Muskulatur s. auch dort
Über die Stabilisierung des Blutzuckerspiegels durch die Leber und die Versorgung der Muskulatur s. auch dort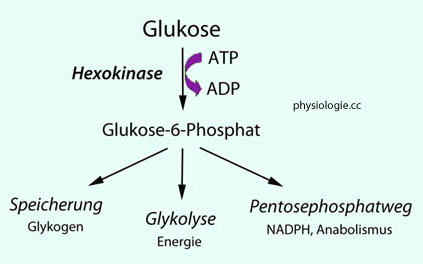
 Abbildung: Hexokinase
Abbildung: Hexokinase

 Abbildung: Glykogenkörnchen mit Glykogenin-Kern
Abbildung: Glykogenkörnchen mit Glykogenin-Kern
 Die
Polymerisierung der Glucose (
Die
Polymerisierung der Glucose ( Abbildung - Glykogenbildung - Enzym: Glykogen-Phosphorylase) dient dem
osmotischen Schutz: Einzelne Glucosemoleküle würden in
größerer Zahl
das osmotische Gleichgewicht
in der Leber schwer belasten. Da die Osmolarität von der Zahl der
gelösten Teilchen abhängt, bedeutet die Zusammenlagerung von z.B.
dreißigtausend Glucosemolekülen zu einem Glykogenkorn eine Reduktion
des
osmotischen Drucks, den diese Teichen in der Zelle ausüben würden, um
einen Faktor von 3 mal 104!
Abbildung - Glykogenbildung - Enzym: Glykogen-Phosphorylase) dient dem
osmotischen Schutz: Einzelne Glucosemoleküle würden in
größerer Zahl
das osmotische Gleichgewicht
in der Leber schwer belasten. Da die Osmolarität von der Zahl der
gelösten Teilchen abhängt, bedeutet die Zusammenlagerung von z.B.
dreißigtausend Glucosemolekülen zu einem Glykogenkorn eine Reduktion
des
osmotischen Drucks, den diese Teichen in der Zelle ausüben würden, um
einen Faktor von 3 mal 104! Abbildung).
Abbildung). 
 Abbildung: Glucoseaustausch im Organismus
Abbildung: Glucoseaustausch im Organismus

 s.
s.  Abbildung oben)
und dient dem eigenen Bedarf, nicht der Blutzuckerstabilisierung.
Abbildung oben)
und dient dem eigenen Bedarf, nicht der Blutzuckerstabilisierung.
 Die Leber übt metabolische Pufferfunktion u.a. dadurch aus, dass sie den Blutzuckerspiegel durch Aufnahme oder Abgabe von Glucose stabilisiert. Sie speichert Energie in Form von Glykogen (~150 g) und bildet Glucose aus Aminosäuren, Glycerin, Lactat , Galactose, Fruktose, Xylit (Gluconeogenese), sowie
Verbindungen aus Intermediärstoffen des Kohlenhydratstoffwechsels
(Pyruvat, Ribosen, NADPH). Ein stabiler Blutzuckerspiegel von 4,0-5,5
mM ist vor
allem für die Energieversorgung des Gehirns wichtig. Die
Glucosefreisetzung wird neuronal (Sympathikus) und humoral angeregt
(Adrenalin,
STH, Glucagon, Kortisol, T3 / T4) Die Leber übt metabolische Pufferfunktion u.a. dadurch aus, dass sie den Blutzuckerspiegel durch Aufnahme oder Abgabe von Glucose stabilisiert. Sie speichert Energie in Form von Glykogen (~150 g) und bildet Glucose aus Aminosäuren, Glycerin, Lactat , Galactose, Fruktose, Xylit (Gluconeogenese), sowie
Verbindungen aus Intermediärstoffen des Kohlenhydratstoffwechsels
(Pyruvat, Ribosen, NADPH). Ein stabiler Blutzuckerspiegel von 4,0-5,5
mM ist vor
allem für die Energieversorgung des Gehirns wichtig. Die
Glucosefreisetzung wird neuronal (Sympathikus) und humoral angeregt
(Adrenalin,
STH, Glucagon, Kortisol, T3 / T4)  In der Resorptionsphase speichert die Leberzelle Energie, vor allem in
Form von Glykogenkörnchen (bis zu 10% des Organgewichts); in der Postresorptionsphase stellt sie
energiereiche Substrate für die Peripherie zur Verfügung. Bis zu
~30.000 Glucosemoleküle werden enzymatisch zu einem Glykogenkörnchen vereint (Glykogenin, Glykogensynthase), dadurch bleibt der
osmotische Druck in der Zelle stabil. Abgebaut wird das Glykogenmolekül an mehreren
Stellen gleichzeitig (Glykogenphosphorylase). Glucose verlässt dann das endoplasmatische Retikulum über GLUT 7 und die Leberzelle über GLUT2 (Glucose kann die Zelle verlassen, Glucosephosphat nicht)
In der Resorptionsphase speichert die Leberzelle Energie, vor allem in
Form von Glykogenkörnchen (bis zu 10% des Organgewichts); in der Postresorptionsphase stellt sie
energiereiche Substrate für die Peripherie zur Verfügung. Bis zu
~30.000 Glucosemoleküle werden enzymatisch zu einem Glykogenkörnchen vereint (Glykogenin, Glykogensynthase), dadurch bleibt der
osmotische Druck in der Zelle stabil. Abgebaut wird das Glykogenmolekül an mehreren
Stellen gleichzeitig (Glykogenphosphorylase). Glucose verlässt dann das endoplasmatische Retikulum über GLUT 7 und die Leberzelle über GLUT2 (Glucose kann die Zelle verlassen, Glucosephosphat nicht)  Um durch Zellmembranen zu gelangen, braucht Glucose Transportsysteme. GLUT1 (Blut-Hirn-Schranke) und GLUT3 (ZNS) haben hohe Affinität für Glucose und übernehmen die Grundversorgung vieler Gewebe - insulin-unabhängig und auch bei niedrigem Bluzuckerspiegel. GLUT2 in Leber-, Insel- und Darmepithelzellen transportiert Glucose insulin-unabhängig und mit
hoher Kapazität bei höherer Glucosekonzentration (niedrige Affinität -
Km-Wert 15-20 mM). Insel (ß-) zellen nützen
GLUT2 zusammen mit Glucokinase als Glucosesensor. GLUT4 fördert die Glucoseaufnahme insulinabhängig (Muskel- und Fettgewebe) und senkt den Blutzuckerspiegel. GLUT5 ist der
Fruktosetransporter (Dünndarmmukosa) Um durch Zellmembranen zu gelangen, braucht Glucose Transportsysteme. GLUT1 (Blut-Hirn-Schranke) und GLUT3 (ZNS) haben hohe Affinität für Glucose und übernehmen die Grundversorgung vieler Gewebe - insulin-unabhängig und auch bei niedrigem Bluzuckerspiegel. GLUT2 in Leber-, Insel- und Darmepithelzellen transportiert Glucose insulin-unabhängig und mit
hoher Kapazität bei höherer Glucosekonzentration (niedrige Affinität -
Km-Wert 15-20 mM). Insel (ß-) zellen nützen
GLUT2 zusammen mit Glucokinase als Glucosesensor. GLUT4 fördert die Glucoseaufnahme insulinabhängig (Muskel- und Fettgewebe) und senkt den Blutzuckerspiegel. GLUT5 ist der
Fruktosetransporter (Dünndarmmukosa)  Bei Substratmangel (Hunger) werden
Aminosäuren (aus Muskelprotein) und Glycerin (aus Fettgewebe), auch Lactat (aus Glykolyse) zur Energieversorgung herangezogen.
Glykogenreserven können 4-5 g/h Glucose beistellen, Gluconeogenese (aus
Glycerin, Lactat und Aminosäuren) ~3 g/h. Nach Erschöpfung der
Glykogenreserven läuft die Gluconeogenese weiter (Leber, Nieren, Darm), bis zunehmend Ketogenese einspringt Bei Substratmangel (Hunger) werden
Aminosäuren (aus Muskelprotein) und Glycerin (aus Fettgewebe), auch Lactat (aus Glykolyse) zur Energieversorgung herangezogen.
Glykogenreserven können 4-5 g/h Glucose beistellen, Gluconeogenese (aus
Glycerin, Lactat und Aminosäuren) ~3 g/h. Nach Erschöpfung der
Glykogenreserven läuft die Gluconeogenese weiter (Leber, Nieren, Darm), bis zunehmend Ketogenese einspringt |
