

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert

Energie-
und Stoffwechsel

 Metabolischer Status
Metabolischer Status
© H. Hinghofer-Szalkay
 Aceton: Von "acetic acid" + "on" (acidum = Säure)
Aceton: Von "acetic acid" + "on" (acidum = Säure)
Kalorie: calor (lat) = Hitze, Wärme
Ketose: Von "Aketon" = Aceton
postprandial: post = nach, prandium = Frühstück, Mahlzeit
Rekonvaleszenz: valere (lat) = gesund sein, gedeihen
In der Resorptionsphase
(nach dem Essen = postprandial) werden aus dem Darmlumen Nahrungsmittel aufgenommen und der Blutbahn zugeführt. In der Postresorptionsphase greift der Metabolismus auf körpereigene Speicher zurück, um
die Blutwerte wichtiger Baustoffe und Energieträger stabil zu halten.
Dauert ein Mangelzustand (Aufnahme von weniger als 50 g
Kohlenhydrate pro Tag) an, dann reicht die hormonelle Regulation des
Stoffwechsels nicht aus, um den Blutzuckerspiegel im Referenzbereich
zu halten. Vor allem das Gehirn muss
laufend mit energieliefernden Molekülen versorgt werden, die auch die
Blut-Hirn-Schranke überwinden können. Ketonkörper (Aceton, Acetessigsäure, ß-Oxy-Buttersäure) werden von der Leber in Hungerperioden aus Fettsäuren gebildet und
ersetzen teilweise Glucose - nach einigen Tagen der enzymatischen Anpassung - als
Energielieferant (der Glucoseverbrauch des Gehirns kann bei entsprechender Zufuhr von Ketonkörpern von ~120 g/d auf ~40 g/d absinken).
Ist eine Übergangsphase mit Müdigkeit, Schwäche und reduzierter
Leistungsfähigkeit überwunden, fühlen sich die betreffenden Personen wieder gut, oft sogar besonders leistungsfähig (vorteilhaft für das Überleben unter Hungerbedingungen). Der Nachteil dieses Mechanismus besteht darin, dass er säureüberschüssig wirkt. Von Ketoazidose
spricht man, wenn die Konzentration von Ketokörpern so stark ansteigt
(5-25 mM), dass eine unkompensierte metabolische Azidose auftritt.
|
Resorptions- und Postresorptionsphase  Hunger, Ketose, Ketonkörper
Hunger, Ketose, Ketonkörper  Steuernde Signale aus dem gastrointestinalen System
Steuernde Signale aus dem gastrointestinalen System  Kalorimetrie
Kalorimetrie  Anaerobe vs. aerobe Energiegewinnung
Anaerobe vs. aerobe Energiegewinnung  Stoffwechselstress
Stoffwechselstress

 Spezifisch-dynamische Wirkung (SDA, DIT, TEF)
Spezifisch-dynamische Wirkung (SDA, DIT, TEF)
 Fasten, Hungern
Fasten, Hungern
 Praktische Aspekte
Praktische Aspekte  Core messages
Core messages
Die
Stabilität des Stoffwechsels und die Erhaltung lebensnotwendiger
Versorgung der Zellen mit Baustein- und energietragenden Molekülen
beruht auf - vor allem endokrin gesteuertem - Transport und Austausch
entsprechender Stoffe. Der aktuelle Zustand dieses Mechanismus wird als
metabolischer Status bezeichnet. Schwankender Energiebedarf (z.B.
Muskelarbeit) erfordert das Anlegen entsprechender Speicher; diese
weisen unterschiedliche Versorgungskapazität auf. So ermöglichen Fette
langfristige und ausgiebige Speicherung von Stoffwechselenergie (Wochen
bis Monate), sind aber nur auf mäßigen Energiedurchsatz ausgelegt;
Glykogen in Leber- und Muskelzellen bietet eine begrenzte Reserve
(Stunden), erlaubt aber einen hohen Energiedurchsatz; energiereiche
Phosphate (ATP u.a.) müssen bei Bedarf ad hoc neu synthetisiert werden.
Schwankende Zufuhr wird durch körpereigene Speicher und endokrine Anpassung kompensiert
Postprandiale (digestive / Absorptions-) Phase  Postdigestive Phase
Postdigestive Phase
Der
Tagesablauf geht mit einer Abfolge von Phasen einher, in denen mehr
Substrate anfallen als verbraucht werden und solchen, wo dies umgekehrt
ist ("fette und magere Zeiten"). Die eine Situation ist gekennzeichnet
durch hohes Angebot von Nährstoffen (postprandial,  d.h. nach dem Essen: resorptive Phase) und solchen mit leerem Intestinum ("nüchtern", postresorptiv, "Nahrungspause").
d.h. nach dem Essen: resorptive Phase) und solchen mit leerem Intestinum ("nüchtern", postresorptiv, "Nahrungspause").
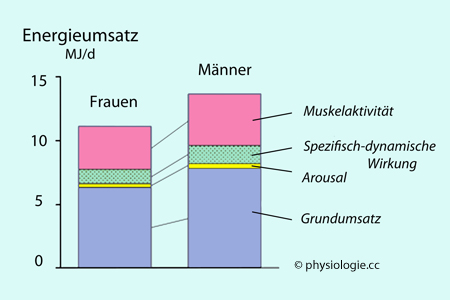
 Abbildung: 24-h-Energiestoffwechsel
Nach Westerterp KR, Verboeket-van de Venne WP, Bouten CV, de
Graaf C, van het Hof KH, Weststrate JA. Energy expenditure and physical
activity in subjects consuming full- or reduced-fat diets. Br J Nutr 1996; 76: 785-95
Abbildung: 24-h-Energiestoffwechsel
Nach Westerterp KR, Verboeket-van de Venne WP, Bouten CV, de
Graaf C, van het Hof KH, Weststrate JA. Energy expenditure and physical
activity in subjects consuming full- or reduced-fat diets. Br J Nutr 1996; 76: 785-95
Durchschnittswerte bei einer Referenzpopulation junger Frauen und Männer

 Unter der spezifisch-dynamischen Wirkung (Max Rubner) versteht man die Steigerung des Energieumsatzes durch Verwertung neu aufgenommener Nährstoffe (vor allem Eiweiß). Dieses Phänomen trägt im angloamerikanischen Raum auch folgende Bezeichnungen: Specific dynamic action (SDA), Diet-induced thermogenesis (DIT), Thermic effect of food (TEF), Heat increment of feeding (HIF). Die spezifisch-dynamische Wirkung geht mit erhöhter Durchblutung des Darms einher (postprandiale Hyperämie).
Unter der spezifisch-dynamischen Wirkung (Max Rubner) versteht man die Steigerung des Energieumsatzes durch Verwertung neu aufgenommener Nährstoffe (vor allem Eiweiß). Dieses Phänomen trägt im angloamerikanischen Raum auch folgende Bezeichnungen: Specific dynamic action (SDA), Diet-induced thermogenesis (DIT), Thermic effect of food (TEF), Heat increment of feeding (HIF). Die spezifisch-dynamische Wirkung geht mit erhöhter Durchblutung des Darms einher (postprandiale Hyperämie).
Als Glucosetoleranz bezeichnet man die Fähigkeit, eine Glucosebelastung zu verarbeiten und den Blutzuckerspiegel zu stabilisieren: Pankreas (Langerhans-Inseln), Gehirn,
Speicherorgane (Fettgewebe, Leber), Muskulatur (diese kann den
Energieverbrauch des Körpers vervielfachen).
Solche Wechsel des metabolischen Status werden vom gesunden
Stoffwechsel ohne weiteres kompensiert; die Feinregulierung von Blutzuckerspiegel und Substratutilisation erfolgt in
erster Linie hormonell.
Längere Perioden fehlenden Nachschubs führen zu
Hungerzustand und Ketose  (Anstieg des Blutspiegels der Ketonkörper - Normalbereich um die 0.5 mM, im ketotischen Zustand 2-5 mM, Ketoazidose ab ~15 mM);
auch dies kann durch hormonelle Anpassung für Tage bis Wochen
kompensiert werden (vorausgesetzt, Flüssigkeits- und Salzzufuhr
verhindert Dehydrierung und Volumenverlust).
(Anstieg des Blutspiegels der Ketonkörper - Normalbereich um die 0.5 mM, im ketotischen Zustand 2-5 mM, Ketoazidose ab ~15 mM);
auch dies kann durch hormonelle Anpassung für Tage bis Wochen
kompensiert werden (vorausgesetzt, Flüssigkeits- und Salzzufuhr
verhindert Dehydrierung und Volumenverlust).
Digestive / resorptive Phase
Nach der Nahrungsaufnahme werden die verspeistebn Substanzen aufgeschlossen (verdaut: Digestionsphase) und resorbiert (Resorptionsphase - prandial phase, absorptive state). Im Zuge dieses Vorgangs steigt
der Spiegel an Nährstoffen im Kreislauf ( Abbildung). Insbesondere
steigt der Glucosespiegel, und Glucose (Blutzucker) gelangt über
verschiedene Transportsysteme (glucose transporters, GLUT) in die Zellen.
Abbildung). Insbesondere
steigt der Glucosespiegel, und Glucose (Blutzucker) gelangt über
verschiedene Transportsysteme (glucose transporters, GLUT) in die Zellen.

 Abbildung: Stoffwechsel in der Resorptionsphase (postprandial)
Abbildung: Stoffwechsel in der Resorptionsphase (postprandial)
Nach einer Vorlage bei Hilal-Dandan / Brunton, Goodman
& Gilman's Manual of Pharmacology and Therapeutics, 2nd ed., McGraw
Hill Education 2014
In dieser
Phase produzieren die meisten Körperzellen ATP durch Oxidation
anflutender Glucose. Diese kommt aus dem Darm (Kohlenhydratresorption);
der Glucosespiegel im Blut steigt leicht an (von <100 auf ~130
mg/dl).
Die Insulinproduktion ist angeregt, der Insulinspiegel ist hoch, der
Glucagonspiegel niedrig. Leber, Muskulatur und Fettgewebe nehmen
Glucose auf. Lipolyse (Fettgewebe) und Glukoneogenese (Leber) sind
infolge Insulineinfluss gehemmt

Die digestive Phase hält - je nach Nahrungsaufnahme - 2-3 Stunden nach der Nahrungsaufnahme an. Sie ist dadurch gekennzeichnet, dass mit der Nahrung frisch
zugeführte Substrate aus dem Gastrointestinaltrakt absorbiert werden.
Die Konzentrationswerte an Glucose, Lipiden und
Aminosäuren steigen im Bluplasma während dieser Zeit an. Solange Nährstoffe zur Verfügung stehen (nach einer
Mahlzeit: postprandial), werden sie resorbiert und für Synthese (Anabolismus) und Speicherung
herangezogen.
Eine
durchschnittliche Mahlzeit liefert ~30-60 g Glucose; Gehirn (~6 g/h)
und Erythrozyten (~1,5 g/h) verbrauchen etwa 7-8 g/h, der Rest wird im
Körper zwischengespeichert - z.B. in der Leber - oder auch für andere Zwecke weiter genützt, z.B. zur Bildung von Fettsäuren oder Nukleotiden.
Bei Anwesenheit von Nährstoffen an der intestinalen Mukosa geben spezialisierte Zellen die Inkretine (insulinotropen Hormone) GIP und GLP-1
in das Blut ab - proportional zum Substratangebot. Inkretine
stimulieren - zusammen mit erhöhten Substratkonzentrationen und
parasympathischer Aktivität - die Freisetzung von Insulin,
dem einzigen Hormon, das
den Blutzuckerspiegel effektiv
senkt, indem es die Aufnahme von Glucose in Zellen mit
Insulinrezeptoren fördert.
Das bedeutet, dass die Insulinsekretion
schon steigt, bevor der Glucosespiegel im Blut noch wesentlich erhöht
ist ("vorausschauende" Inkretinfunktion), und die Insulinantwort auf
das alimentäre Zuckerangebot ist insgesamt intensiviert.
 Insulin
fördert die Einlagerung von Glucosetransportern in die Membran von Muskel- und Fettzellen und
erleichtert damit die Glucoseaufnahme. Inkretine fördern die Insulinbildung und sind ein
wesentlicher Bestandteil der Glucosetoleranz.
Insulin
fördert die Einlagerung von Glucosetransportern in die Membran von Muskel- und Fettzellen und
erleichtert damit die Glucoseaufnahme. Inkretine fördern die Insulinbildung und sind ein
wesentlicher Bestandteil der Glucosetoleranz.
Im Fettgewebe
inhibiert Insulin die hormonsensitive Lipase, die Triglyzeride zu Glycerin und Fettsäuren abbauen würde. (Intrazelluläre hormonsensitive Lipase hydrolysiert ein breites Spektrum von Estern und ist durch Katecholamine und ACTH aktivierbar.) Gleichzeitig regt es die
Synthese der Lipoproteinlipase an, was die Fetteinlagerung fördert.
Insbesondere im Muskelgewebe regt Insulin die Aufnahme von Aminosäuren und die Proteinsynthese an.


Abbildung: Metabolischer Zustand und wichtigste Stoffwechselpfade
Nach einer Vorlage in Carlson NR / Birkett MA, Physiology of Behavior, 12th ed. Pearson 2017
Oben: Absorptive (digestive, resorptive,
postprandiale), unten: Postabsorptive (postresorptive, postdigestive,
Nüchtern-, "Hunger"-) Phase.
In der resorptiven Phase (nach
einer Mahlzeit) nimmt der Darm Nährstoffe in den Körper auf. Sie
dienen der Synthese von Biomolekülen (z.B. Proteinsynthese im Muskel),
der Einlagerung von Speichersubstanzen (z.B. Glykogen in der Leber,
Neutralfette in Adipozyten) und direkt der Energiegewinnung in den
Geweben.
In der postresorptiven Phase
(leerer Darm) beziehen die Gewebe Energie aus körpereigenen Speichern
(Glucose aus der Leber, Fettsäuren / Glycerin aus dem Fettgewebe)

Anlegen metabolischer Speicher: Die Resorptionsphase wird von Stoffwechsel genützt, um Glucose in Fett
(Langzeitspeicher) sowie Glykogen umzubauen (in der Leber für den
allgemeinen, in der Muskulatur für den Eigenbedarf; der Glykogengehalt im Muskel bleibt ziemlich konstant, der in der Leber schwankt sehr stark). Auch werden andere Nährstoffe eingelagert (z.B. Aminosäuren). Die Leber bildet schließlich vermehrt VLDL für den Transport von Fettsäuren in die Peripherie (die Leber selbst speichert physiologischerweise kein Fett). Das Fettgewebe bildet in dieser Phase Energie aus der Glykolyse (und verbraucht so Zucker aus dem Blut).
Proteine werden für den Nachschub von Aminosäuren im Eiweißstoffwechsel gebraucht. Wird mehr mit der Nahrung aufgenommen als für die Proteinsynthese nötig ist, wird der Überschuss abgebaut und zu Glykogen oder Neutralfetten verwandelt.
Postdigestive / postabsorptive Phase
Eine Postresorptionsphase (postabsorptive state, fasting state) ( Abbildung) liegt im Nüchternzustand (späte Schlaf-, längere Arbeitsphasen) bzw. Fasten vor (Hungerperioden).
Der Darm ist geleert und liefert keine Nährstoffe nach, der
Stoffwechsel muss auf Versorgung durch im Körper gespeicherte Energie
umschalten und ist daher (teilweise) katabol.
Abbildung) liegt im Nüchternzustand (späte Schlaf-, längere Arbeitsphasen) bzw. Fasten vor (Hungerperioden).
Der Darm ist geleert und liefert keine Nährstoffe nach, der
Stoffwechsel muss auf Versorgung durch im Körper gespeicherte Energie
umschalten und ist daher (teilweise) katabol.
Während Leber, Fett- und Muskelgewebe in der resorptiven Phase weitgehend unabhängig voneinander agieren, zeigen sie in der Hungerphase weitgehende Koordination, um die Energieversorgung des Körpers sicherzustellen.
Der Blutzuckerspiegel muss in diesem Zustand stabilisiert werden, vor
allem für das Nervensystem - gesteuert vor allem durch Glucagon, Katecholamine, Cortisol und Wachstumshormon.
Das geschieht durch Glykogenabbau in der Leber, Einsparen von Glucose
vor allem in Muskel- und Fettgewebe, Freisetzung von freien Fettsäuren
aus Adipozyten, Bildung von Ketonkörpern in der Leber.
Tagesrhythmus. Diese Anpassung
findet täglich statt - nach einem nicht zu üppigen
Nachtmahl werden die gastrointestinalen Reserven während der
Schlafphase aufgebraucht, frühmorgens hat der Systemswitch auf interne
Speicher bereits stattgefunden (breakfast). Liegen Mahlzeiten viele Stunden
auseinander, kann es auch tagsüber zu vorübergehendem Wechsel von
postprandialem zu postabsorptivem Stoffwechsel kommen.
Die Glykogenreserven sind abhängig von der vorangegangenen Ernährungsform (Diätplan).
Die Leber
schaltet - unter Glucagoneinfluss - in der Postresorptionsphase auf
Energieversorgung des Organismus - insbesondere für die ständigen Glucoseverbraucher Gehirn, Erythrozyten und Nierenmark:
Zuerst via
 Glykogenolyse (Kapazität der Glucoseproduktion ~4,5 g/h), dann
Glykogenolyse (Kapazität der Glucoseproduktion ~4,5 g/h), dann
 Glukoneogenese (~3 g/h) - und bei längerem
Substratmangel (Hungerzustand, unbehandelter Diabetes mellitus)
Glukoneogenese (~3 g/h) - und bei längerem
Substratmangel (Hungerzustand, unbehandelter Diabetes mellitus)
 Ketogenese (Bildung von Ketonkörpern aus Fett, s. unten).
Ketogenese (Bildung von Ketonkörpern aus Fett, s. unten).
Für den Energiestoffwechswel können - außer Glucose - Glycerin, Fettsäuren,
auch Aminosäuren herangezogen werden (kataboler Stoffwechsel). Die Metabolisierung von Fettsäuren spielt eine herausragende Rolle, fast alle Gewebe können ihren Energiebedarf aus dieser Quelle decken. Im Fettgewebe aktiviert Glucagon und inhibiert Insulin die hormonsensitive Lipase - also den Fettabbau, bei dem Glycerin (dieses wird von der Leber glukoneogenetisch verwertet) und Fettsäuren entstehen (diese versorgen vor allem Muskelzellen mit Energie, und die Leber für die Ketogenese).
Die Postresorptionsphase ist durch einen niedrigen
Insulinspiegel charakterisiert und steht unter dem Einfluss mehrerer
("kontra-insulinärer") Hormone, vor allem Glucagon. Kurzfristig helfen weiters Adrenalin, längerfristig (über Enzyminduktion) Glucocorticoide und Schilddrüsenhormone.
Durch die geringen Insulinwerte fällt die Bremswirkung auf die Lipolyse
der Adipozyten weg, und das Fettgewebe liefert Fettsäuren für den
Energiehaushalt.
 Der Glucosebedarf beträgt im Normalfall ~5 g/kg
Körpermasse pro Tag (ohne intensive körperliche Belastung - das Gehirn alleine benötigt ~130 g Glucose pro Tag), er nimmt im Hungerzustand deutlich ab, auf ~3 g/kg
Körpermasse pro Tag (~2 mg/kg/min, vor allem für das Gehirn,
Der Glucosebedarf beträgt im Normalfall ~5 g/kg
Körpermasse pro Tag (ohne intensive körperliche Belastung - das Gehirn alleine benötigt ~130 g Glucose pro Tag), er nimmt im Hungerzustand deutlich ab, auf ~3 g/kg
Körpermasse pro Tag (~2 mg/kg/min, vor allem für das Gehirn,  s. dort).
s. dort).
Der
Abbau von körpereigenem Protein kann im frühen katabolen Zustand bis zu ~100 g/d
(>1 g/kg/d) betragen, reduziert sich mit andauerndem Nahrungsmangel
allerdings, weil dann ein Teil der Energieversorgung über Ketonkörper
bewerkstelligt wird (s. unten).
Die - für verschiedenste Aufgaben im Körper benötigten - Proteine
(Haut, Bewegungsapparat, glatte Muskulatur, Membranproteine, Enzyme,
Signalstoffe etc) tragen im Normalzustand nur wenig (unter 5%) zur
Energieversorgung des Körpers bei. Im "Notfall" eines Hungerzustandes
kann dieser Anteil allerdings bis zu ~15%
des Ruheumsatzes betragen, indem glucoplastische Aminosäuren vermehrt
zur Gluconeogenese herangezogen (und der Neusynthese von Proteinen
vorenthalten) werden.
Hunger, Ketose, Ketonkörper
 vgl. dort
vgl. dort
Nach
Resorption verspeister Nahrung im Darm beginnt die postabsorptive (postdigestive)
Phase, etwa nach einer durchschlafenen Nacht (s. oben). Diese ist durch
vermehrte Nutzung von Fettsäuren und Einsparung der
Glucoseutilisation gekennzeichnet - gesteuert in erster Linie
durch einen niedrigen Insulin / Glucagon-Quotienten. Haltet die
Unterversorgung des Körpers (aus unterschiedlichen Gründen) an, wird
weitere Anpassung notwendig.
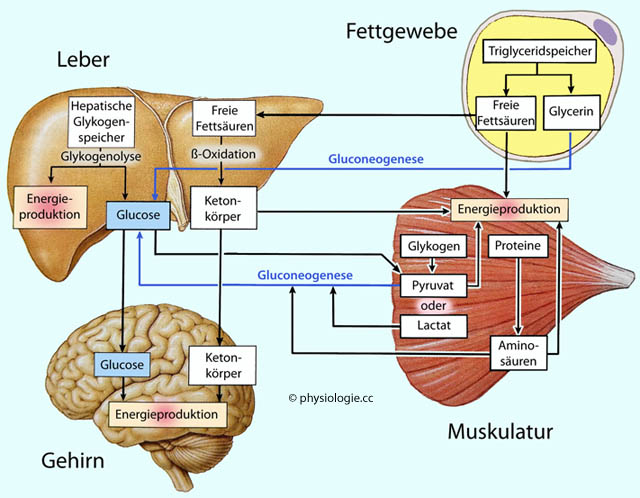
 Abbildung: Hungerstoffwechsel
Abbildung: Hungerstoffwechsel
Nach einer Vorlage bei Silverthorn, Human Physiology - an integrated approach, 4th ed. Pearson International 2007
Im Zustand des Fastens bzw. Hungerns ist die Leber
die Hauptproduktionsstätte des Körpers für im Kreislauf verfügbare
Glucose. Sie kann den Energiebedarf des Organismus auf diese Weise für
bis zu 5 Stunden mit Glucose decken. Nur die Leber verfügt über
Glucose-6-Phosphatase (vgl. dort) und kann somit ihren Glykogenspeicher direkt zur Bildung von Glucose verwenden.
Fettgewebe
liefert beim Abbau seiner Triglyceridreserven Glycerin und Fettsäuren.
Glycerin gelangt zur Leber und wird via Gluconeogenese zu Glucose.
Fettsäuren werden
von zahlreichen peripheren Geweben für ihren Energiestoffwechsel
utilisiert; die Leber kann sie im Rahmen der Beta-Oxidation (Abbau von
Fettsäureketten) zu Ketonkörpern umwandeln, die wiederum vom Gehirn als
Energielieferant genutzt werden.
Die Skelettmuskulatur
metabolisiert Glucose-6-Phosphat unter oxidativen Bedingungen zu
Pyruvat, ansonsten (anoxidativ) zu Lactat; diese gelangen über den
Kreislauf zur Leber und bildet daraus Glucose.
Das Gehirn
nutzt normalerweise Glucose für seinen Energiebedarf; nur im
prolongierten Hungerzustand reicht dieser Weg nicht aus und die
Nervenzellen müssen auf Ketonkörper ausweichen, die im Rahmen des nun
exzessiven Fettabbaus vermehrt von der Leber produziert werden.
Acetessigsäure und ß-Hydroxybuttersäure belasten den Stoffwechsel
(Ketoazidose)

 Fasten (fasting) bedeutet,
für einige Zeit willkürlich auf Nahrungsaufnahme zu verzichten. Dabei
braucht der Körper zuerst seine Glykogen-, dann seine Fettreserven
auf. Hungerzustand (starvation) bzw. Unterernährung (undernutrition) bedeutet längerfristig
fehlende bzw. unzureichende Energiezufuhr, und der Organismus ist
gezwungen, essentielle Gewebe (z.B. Muskelmasse) zum Zweck der
Energieversorgung lebenswichtiger Organe (Gehirn, Herz..) anzugreifen.
Das resultiert in Gewichtsreduktion entsprechender Organe,
Muskelschwäche, Anämie, Immundefizienzen, eingeschränkter mentaler
Kapazität u.a.
Fasten (fasting) bedeutet,
für einige Zeit willkürlich auf Nahrungsaufnahme zu verzichten. Dabei
braucht der Körper zuerst seine Glykogen-, dann seine Fettreserven
auf. Hungerzustand (starvation) bzw. Unterernährung (undernutrition) bedeutet längerfristig
fehlende bzw. unzureichende Energiezufuhr, und der Organismus ist
gezwungen, essentielle Gewebe (z.B. Muskelmasse) zum Zweck der
Energieversorgung lebenswichtiger Organe (Gehirn, Herz..) anzugreifen.
Das resultiert in Gewichtsreduktion entsprechender Organe,
Muskelschwäche, Anämie, Immundefizienzen, eingeschränkter mentaler
Kapazität u.a.
Solche Perioden mangelhafter oder fehlender Nahrungszufuhr
werden mit Anpassung beantwortet, die in mehreren Phasen abläuft:
 Während der ersten 24-48 Stunden
ausbleibender Nahrungsaufnahme sinkt der Blutzuckerspiegel, Glucagon
wird vermehrt in den Kreislauf sezerniert. Dieses regt zuerst Glykogenolyse
in
der Leber (Glykogenspeicher meist innerhalb von 16-18 Stunden,
spätestens nach 2 Tagen erschöpft - bei hoher Muskelaktivität
entsprechend rascher,
Während der ersten 24-48 Stunden
ausbleibender Nahrungsaufnahme sinkt der Blutzuckerspiegel, Glucagon
wird vermehrt in den Kreislauf sezerniert. Dieses regt zuerst Glykogenolyse
in
der Leber (Glykogenspeicher meist innerhalb von 16-18 Stunden,
spätestens nach 2 Tagen erschöpft - bei hoher Muskelaktivität
entsprechend rascher,  vgl. dort), dann
Lipolyse im Fettgewebe an (Freisetzung von Fettsäuren und Glycerin).
Niedrige Insulinwerte regen die ß-Oxidation von Fettsäuren an, hohe
Glucagonwerte die Freisetzung von Aminosäuren aus der Muskulatur.
vgl. dort), dann
Lipolyse im Fettgewebe an (Freisetzung von Fettsäuren und Glycerin).
Niedrige Insulinwerte regen die ß-Oxidation von Fettsäuren an, hohe
Glucagonwerte die Freisetzung von Aminosäuren aus der Muskulatur.

 Im Zustand des Hungerns / Fastens steigen innerhalb von 24 Stunden Acetyl-CoA und ß-Oxidation in den Mitochondrien an
Im Zustand des Hungerns / Fastens steigen innerhalb von 24 Stunden Acetyl-CoA und ß-Oxidation in den Mitochondrien an
 In Hepatozyten kondensieren AcCoA-Moleküle, Ketonkörper werden (nur in der Leber) gebildet
In Hepatozyten kondensieren AcCoA-Moleküle, Ketonkörper werden (nur in der Leber) gebildet

ß-Hydroxybuttersäure
und Acetessigsäure dienen peripheren Geweben (allen Zellen außer
Erythrozyten, vor allem dem Gehirn, auch der Muskulatur, den Nieren
etc) als Energielieferanten, Aceton wird ausgeatmet / ausgeschieden
(Harn)
Hypoglykämie senkt die Insulinfreisetzung, Fett- und Muskelzellen lagern weniger GLUT4 in ihre Zellmembranen ein - mit dem Effekt, dass sie ihre Glucoseaufnahme reduzieren und mehr für Nervenzellen - die über GLUT3 verfügen und nicht insulinabhängig sind - übrigbleibt.
 Während einiger weiterer Tage
steigt die Gluconeogenese an, Substrate sind Glycerin, Lactat und
Aminosäuren. Der
Fettsäurespiegel im Plasma (Nüchtern-Triglyzeride normal <1,7 mM) verdoppelt sich
innerhalb weniger Tage des Fastens / Hungerns.
Während einiger weiterer Tage
steigt die Gluconeogenese an, Substrate sind Glycerin, Lactat und
Aminosäuren. Der
Fettsäurespiegel im Plasma (Nüchtern-Triglyzeride normal <1,7 mM) verdoppelt sich
innerhalb weniger Tage des Fastens / Hungerns.
Die proteolytische Wirkung von Cortisolist
für die Nutzung (glucogener) Aminosäuren essentiell, ohne dessen
Wirkung ist die überlebenswichtige Gluconeogenese während Fasten- bzw.
Hungerperioden beeinträchtigt. Eine nur mäßige Erhöhung des
Cortisolspiegels reicht für die (permissive) Förderung der für die
Gluconeogenese nötigen enzymatischen Aktivitäten aus: Cortisol erhöht
das Ansprechen metabolischer Systeme auf andere hormonelle Reize (z.B.
potenziert Cortisol die adrenerge Wirkung auf den Glykogenabbau). Auch
steigert Cortisol die Lipolyse.
Der im Hungerzustand sehr niedrige
Insulinspiegel regt die Ketogenese an: Ketonkörper
gewinnen zusehends Bedeutung für den zerebralen Energiestoffwechsel.
Für eine vollständige Adaptation an ketogene Energiegewinnung benötigt
das Gehirn allerdings mehrere Wochen.
 In den darauffolgenden Wochen
nimmt die Gluconeogenese allmählich wieder ab, die Gewebe adaptieren an
die Nutzung von Ketonkörpern, der Ketonkörperspiegel im Blut steigt auf Werte bis 7
mM (Ketose ab 5 mM, s. unten). Der Grundumsatz nimmt ab. Das Aufzehren
essentieller Gewebereserven führt schrittweise zu Abnahme von
Organgrößen und -funktionen, Muskelschwäche, Anämie, Immunschwäche und
reduzierter mentaler Kapazität. Ist etwa die Hälfe des Muskelgewebes
aufgebraucht (Aminosäureabbau), reicht die Kraft der
Respirationsmuskulatur nicht mehr für eine adäquate Säuberung der Atemwege (Pneumoniegefahr). Fasten- bzw. Hungerperioden von bis zu 2 Monaten
Dauer können überlebt werden.
In den darauffolgenden Wochen
nimmt die Gluconeogenese allmählich wieder ab, die Gewebe adaptieren an
die Nutzung von Ketonkörpern, der Ketonkörperspiegel im Blut steigt auf Werte bis 7
mM (Ketose ab 5 mM, s. unten). Der Grundumsatz nimmt ab. Das Aufzehren
essentieller Gewebereserven führt schrittweise zu Abnahme von
Organgrößen und -funktionen, Muskelschwäche, Anämie, Immunschwäche und
reduzierter mentaler Kapazität. Ist etwa die Hälfe des Muskelgewebes
aufgebraucht (Aminosäureabbau), reicht die Kraft der
Respirationsmuskulatur nicht mehr für eine adäquate Säuberung der Atemwege (Pneumoniegefahr). Fasten- bzw. Hungerperioden von bis zu 2 Monaten
Dauer können überlebt werden.
Die postresorptive Phase gleitet (wenn die Glykogenreserven der Leber
erschöpft sind, was innerhalb eines Tages erfolgt) in eine Glukoneogenesephase
über, die für 2-3 Tage des Hungerzustandes andauert. Der sinkende
Insulinspiegel erleichtert die Mobilisation von Aminosäuren
(hauptsächlich Alanin und Glutamin) durch Proteolyse in der
Skelettmuskulatur; auch durch Lipolyse frei werdendes Glycerin trägt
zur Glukoneogenese bei.
Aus 1,75 g Muskelprotein kann 1 g Glucose
entstehen (nicht alle Aminosäuren wirken glukoplastisch). Da das Gehirn
100-120 g Glucose pro Tag konsumiert, würden rund 150 g Muskelprotein
zur Deckung dieser Glucosemenge benötigt werden (der Energiestoffwechsel des Gehirns ist weitgehend glucoseabhängig). Es muss also rasch eine Alternative für die Ernährung des Gehirns gefunden werden.
Schrittweise greifen Mechanismen zur Schonung der Eiweißreserven im
Muskel: Glycerin und Lactat werden möglichst effizient für
glukoneogenetische Zwecke genützt; der Energiebedarf wird abgesenkt, u.a.
durch Abnahme der Aktivität von Schilddrüsenhormonen ([T3] sinkt, [rT3] steigt an); und es
werden zunehmend Ketonkörper
gebildet ( Abbildung), die von glucoseabhängigen
Geweben für ihren Energiestoffwechsel genutzt werden können (ketogene
Phase).
Abbildung), die von glucoseabhängigen
Geweben für ihren Energiestoffwechsel genutzt werden können (ketogene
Phase).
Von ganz geringen Werten (<0,2 mM) steigt der
Ketonkörperspiegel im Blut innerhalb weniger Tage auf einige mM und
erreicht nach 2-3 Wochen des Fastens Werte um die 6-8 mM. In diesem
prolongierten Hungerzustand bezieht das Gehirn fast 70% seiner Energie
aus Ketonkörpern (und spart dadurch einen Glucoseverbrauch von 70-80
g/d ein).
Dazu werden Fettsäuren
von der Leber über Acetyl-Coenzym A in Ketonkörper (ß-Oxy-Buttersäure, Acetessigsäure und Aceton )
umgebaut - ß-Oxy-Buttersäure und Acetessigsäure können für den Energiestoffwechsel genützt werden.
Ketonkörper verstärken die Insulinwirkung und hemmen dadurch den
Proteinabbau im Muskel. Das hat auch eine Abnahme der renalen
Stickstoffausscheidung zur Folge, diese nimmt von etwa 12-14 g/d im
Laufe von 2 Wochen Nahrungskarenz auf die Hälfte ab (im Hungerzustand
erfolgt keine Stickstoffzufuhr).
 Ketonkörper entstehen in Mitochondrien (der Leber) und
Ketonkörper entstehen in Mitochondrien (der Leber) und
 werden in Mitochondrien (im gesamten Körper) abgebaut.
werden in Mitochondrien (im gesamten Körper) abgebaut.

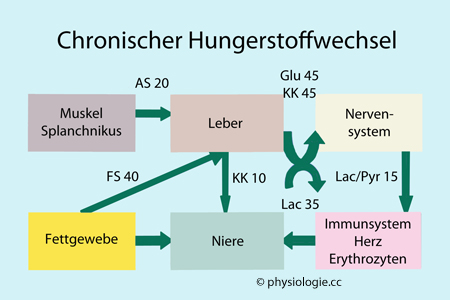

Abbildung:
Vergleich der Substratflüsse im postprandialen sowie im chronischen Hungerzustand
Schematisch, Zahlen sind gerundete Mittelwerte (g/l).
Nach einer Mahlzeit wird Glucose (Glu), die nicht unmittelbar für den Energiestoffwechsel verbraucht wurde, vor allem in insulinabhängigen Geweben gespeichert.
Im Hungerzustand werden vor allem Fettsäuren (FS) für den Energiehaushalt herangezogen. Extrapolierte Zahlenwerte in g/d
AS,
Aminosäuren; Glyc, Glycerin; Lac/Pyr, Lactat / Pyruvat; KK,
Ketonkörper

Kennzeichnend für Ketose ist ein fruchtiger Acetongeruch in der Ausatemluft bei Hungernden
oder (unbehandelten) Diabetikern. Der Ketonkörperspiegel steigt von ≤0,5 auf 2-5 mM an; bei weiterer Erhöhung spricht man von Ketoazidose (Ketonkörperspiegel im Blut bis 25 mM oder mehr). Dann liegt eine dekompensierte metabolische Azidose vor.
Ketonkörper
werden bei niedrigem Glucoseangebot von den Geweben, vor allem dem Gehirn, zur Energiegewinnung
herangezogen. Der
Blutzuckerspiegel kann dabei auch bei ausgedehnten Fastenperioden ziemlich unverändert bleiben, da er durch mehrfache hormonelle Absicherung
stabilisiert wird.
 Ketonkörper
Ketonkörper (Serum)
postprandial <0,5 mM
Hungerzustand 2-5 mM
Ketose >5 mM
Im Hungerzustand stellt das Gehirn
von fast ausschließlicher Glucoseabhängigkeit auf Verwertung von
Acetoacetat und
ß-Hydroxybutyrat um - die entsprechende Verwertungskapazität steigt
innerhalb weniger Tage des Hungerns bis zu ~20-fach an
(Enzyminduktion). Ketonkörper
werden vom Nervengewebe über Acetyl-CoA wieder in den Zitratzyklus
eingeschleust (oxidative Energiegewinnung).
Der zerebrale
Glucoseverbrauch nimmt dabei von ~120 g/d bis auf ~40 g/d ab, d.h. das
Gehirn kommt mit einem Drittel des sonst üblichen Glucoseangebotes aus.
Die folgenden Abbildungen skizzieren die metabolischen Umstellungen im länger anhaltenden Hungerzustand.

 Abbildung: Substratflüsse im längeren Hungerzustand
Nach einer Vorlage in Frayn / Evans, Human Metabolism - A Regulatory Perspective, 4th ed. Wiley Blackwell 2019
Abbildung: Substratflüsse im längeren Hungerzustand
Nach einer Vorlage in Frayn / Evans, Human Metabolism - A Regulatory Perspective, 4th ed. Wiley Blackwell 2019
Die wichtigste Energiequelle sind Triglyzeride aus Fettgewebe, sie liefern Fettsäuren und Glycerin.
Protein
(vor allem aus der Muskulatur) und Glycerin (aus dem Abbau von
Neutralfetten) sind Ausgangssubstanzen für die Bildung von Glucose.
Muskeln liefern vor allem Alanin und Glutamin. Ketonkörper dienen als alternative Energiequelle, sie reduzieren
den Verbrauch von Glucose.
Gewebe (wie Nebennierenmark oder rote Blutkörperchen), die Ketonkörper nicht oxidieren können (fehlende oxidative Kapazität) und auf Glucose angewiesen sind, produzieren Lactat, das von der Leber zur Glukoneogenese wieder verwendet wird: Cori-Zyklus.
Die
Nieren bekämpfen die drohende Azidose durch Ausscheidung von
Ammoniumionen, dabei können sie aus Glutamin (das desaminisert wird)
Glucose gewinnen - so können sie bis zur Hälfte der Glucoseproduktion
im Hungerzustand übernehmen

Der hauptsächlich im Blut vorhandene Ketonkörper ist ß-Hydroxybutyrat. Bei seiner Synthese in der Leber entsteht auch NADH/H+, das peripher in der Atmungskette für die ATP-Synthese verwendet wird.
 In katabolen Stoffwechselsituationen dienen auch
Aminosäuren der Energiegewinnung; die meisten sind für den Aufbau von Glucose nutzbar. Solche Aminosäuren nennt man glukogen oder glukoplastisch
(=zuckerbildend) - nur Leuzin und Lysin können vom Stoffwechsel nicht glukogen verwendet werden.
In katabolen Stoffwechselsituationen dienen auch
Aminosäuren der Energiegewinnung; die meisten sind für den Aufbau von Glucose nutzbar. Solche Aminosäuren nennt man glukogen oder glukoplastisch
(=zuckerbildend) - nur Leuzin und Lysin können vom Stoffwechsel nicht glukogen verwendet werden.
Der Abbau von Aminosäuren zur Energiebereitstellung
ist eine Notmaßnahme. Bei
mangelhafter Proteinzufuhr nehmen die Abwehrkräfte des Körpers ab, was
- neben Vitamin- und Spurenelementmangel - die erhöhte
Infektionsbereitschaft bei Mangelernährten erklärt.
Sauerstoff wird zur Oxidation energieliefernder
Moleküle gebraucht. Die Stoffwechselschritte, die unter
Sauerstoffverbrauch ablaufen, heißen aerob bzw. oxidativ. Ohne
O2-Verbrauch erfolgende Energiegewinnung bei Mangel an verfügbarem O2
bezeichnet man als anaerob bzw. anoxidativ; diese liefert
im Vergleich zur aeroben wenig Energie (~180 kJ/mol Glucose anaerob vs. ~2880 kJ/mol Glucose aerob; Faktor ~15).

 Abbildung: Stoffwechsel im chronischen Hungerzustand
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Abbildung: Stoffwechsel im chronischen Hungerzustand
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Dauert ein
Hungerzustand länger an, sinkt der Abbau körpereigenen Proteins (die
Ausscheidung von Harnstoff nimmt nach einigen Wochen von 10-15 g/d auf
unter 1 g/d ab). Die fallende Verfügbarkeit von Substrat (Aminosäuren)
reduziert auch die hepatische Gluconeogenese.
Innerhalb einer Woche nehmen dafür Lipolyse (Mobilisierung
freier Fettsäuren, Verdopplung ihres Plasmaspiegels) und Ketogenese
stark zu (letztere auf ca. 100 g/d).
AES, Acetessigsäure; AOP9, Aquaporin 9; ßHB, ß-Hydroxy-Buttersäure; FA, Fettsäuren; GLUT, Glucosetransporter; G6P, Glucose-6-Phosphat; TAG, Triacylglycerol
Metabolisches Gleichgewicht. Ist die Summe der verbrauchten und der aufgenommenen Energie gleich
groß, bleiben die Energiespeicher im Körper - vor allem die Menge des
Fettgewebes - und damit das Körpergewicht etwa konstant.
Energie
kann in zwei Formen verwertet werden:
 Wärmeabgabe an die Umwelt (inklusive Arbeitsleistung). Zum obligaten
Umsatz (Grundumsatz) kommt der zusätzliche Energieumsatz, vor allem
durch körperliche Belastung.
Wärmeabgabe an die Umwelt (inklusive Arbeitsleistung). Zum obligaten
Umsatz (Grundumsatz) kommt der zusätzliche Energieumsatz, vor allem
durch körperliche Belastung.
 Ist das Gleichgewicht zwischen Energiezufuhr (Nahrung) und
Energieverbrauch nicht gegeben, so wird entweder Fett verbraucht
(Abnahme der Fettmasse) oder zusätzlich angelegt (Zunahme der
Fettmasse).
Ist das Gleichgewicht zwischen Energiezufuhr (Nahrung) und
Energieverbrauch nicht gegeben, so wird entweder Fett verbraucht
(Abnahme der Fettmasse) oder zusätzlich angelegt (Zunahme der
Fettmasse).
 Faustregel: Ein Energiedefizit von 1000 Kalorien / Tag
Faustregel: Ein Energiedefizit von 1000 Kalorien / Tag  führt zu einer
Senkung der Fettmasse um ~1 kg pro Woche.
führt zu einer
Senkung der Fettmasse um ~1 kg pro Woche.


Abbildung: Rezeptoren auf / in Fettzellen
Nach einer Vorlage bei leighpeele.com
Die
Speicherfunktion der Fettzellen kann über zahlreiche Rezeptoren
endokrin gesteuert werden. Beispiele:
 Insulin
Insulin steigert die Aufnahme von Glucose und Aminosäuren in Adipozyten und fördert deren Speicherfunktion

 Wachstumshormon
Wachstumshormon wirkt lipolytisch

 Angiotensin
Angiotensin reguliert Lipidstoffwechsel, Wachstum und Differenzierung der Fettzellen

 GLP-1
GLP-1 verbessert die Insulinsensitivität der Fettzellen

 Glucocorticoide
Glucocorticoide beeinflussen die
Expression verschiedener Gene und fördern insgesamt die Fetteinlagerung

 Schilddrüsenhormone
Schilddrüsenhormone wirken in komplexer Weise auf weißes und braunes Fettgewebe und fördern die Adipogenese

 Geschlechtshormone
Geschlechtshormone fördern und kontrollieren den Stoffwechsel der Fettzellen

 Katecholamine
Katecholamine und
Glucagon fördern die Lipolyse

 TSH
TSH
hemmt die Umwandlung von weißem zu braunem Fettgewebe.
Viele dieser
Effekte sind situationsabhängig und beruhen auf Mechanismen sowie
Wechselwirkungen, die noch Gegenstand der Forschung sind.
Die Blutspiegel der hormonellen Faktoren
hängen von der aktuellen Stoffwechsellage ab, z.B. produziert das
Pankreas in der Resorptionsphase viel Insulin, und dieses regt
die Fettsynthese in den Adipozyten an


Steuernde Signale aus dem gastrointestinalen System
Steuernde Signale aus dem gastrointestinalen System:
Sowohl der Magen als auch der Darm beteiligen sich an der Steuerung
nicht nur der Vorgänge im gastrointestinalen System, sondern auch der
Insulinsekretion sowie Hunger / Sättigung und Nahrungsaufnahme. Peptide wie
Ghrelin (Magen), CCK, GLP-1 und PYY3–36 (Dünndarm) beeinflussen das Essverhalten und damit auch Speicherung und letztlich Körpergewicht.
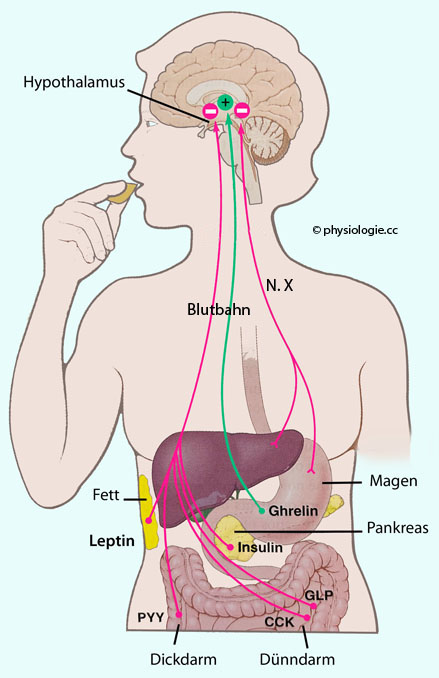

Abbildung: Rückkopplung zur Steuerung der Nahrungsaufnahme
Nach einer Vorlage bei Guyton and Hall, Textbook of Medical Physiology, 15th ed. Elsevier 2026
Nahrungsaufnahme senkt das Hungergefühl über mehrere Wege
(negative Rückkopplung): Das Gehirn erhält Signale über Afferenzen im N. vagus (Dehnung der
Magenwand, Konzentration an Glucose und freien Fettsäuren) und über die Blutbahn (im Darm gebildetes GLP-1, PYY, CCK, sowie Insulin - das vom Pankreas bei Erhöhung des Blutzuckerspiegels vermehrt sezerniert wird).
Bei Nahrungskarenz stimuliert das gastrische Hormon Ghrelin
im Gehirn Hungergefühl und hemmt im Pankreas die
Insulinsekretion - insulinabhängige Zellen nehmen nun weniger Glucose
auf, die dann für andere Organe - insbesondere das Gehirn - länger
verfügbar bleibt.
Adipozyten bilden umso mehr Leptin, je größer ihr Volumen ist (je mehr
Fett sie speichern) - das bremst über Wirkung im Hypothalamus
nachhaltig die Nahrungsaufnahme. Diese Achse vermittelt langfristige Signale und korreliert mit Fettreserven im Körper

Ghrelin
( Abbildung) entsteht im Magen, vermehrt in Hungerphasen, und wirkt appetitanregend.
Schlanke Personen haben niedrige, adipöse hohe Ghrelinspiegel.
Gastrektomie senkt den Ghrelinspiegel im Blut um ~65%, was auf einen
nicht unwesentlichen Beitrag anderer Entstehungsorte (Dünn- und
Dickdarm, Pankreas, Nieren, Hypothalamus) hinweist.
Abbildung) entsteht im Magen, vermehrt in Hungerphasen, und wirkt appetitanregend.
Schlanke Personen haben niedrige, adipöse hohe Ghrelinspiegel.
Gastrektomie senkt den Ghrelinspiegel im Blut um ~65%, was auf einen
nicht unwesentlichen Beitrag anderer Entstehungsorte (Dünn- und
Dickdarm, Pankreas, Nieren, Hypothalamus) hinweist.
Cholezystokinin
wird von duodenalen I-Zellen bei Anwesenheit von Fetten und Peptiden
freigesetzt und war das erste Peptid, von dem gezeigt werden konnte,
dass es Sattheit bewirkt. Das
tut es, indem es über CCK1-Rezeptoren vagale Afferenzen reizt; die
Impulse gelangen zum nucleus tractus solitarii (dieser ist reziprok mit
dem Hypothalamus verbunden), was Hungergefühl reduziert.
GLP-1 bremst Magenentleerung und Nahrungsaufnahme, und regt die Insulinfreisetzung an.
Das Peptid YY entsteht in
L-Zellen des Jejunum (auch des Colon) und wird bei Anwesenheit von
Spaltprodukten der Lipidverdauung freigesetzt. Über den Kreislauf
erreicht es den Hypothalamus, hemmt dort NPY-Neurone und disinhibiert
POMC-Neurone - und unterdrückt vermutlich Hungergefühl. Übergewichtige
Personen haben niedrigere PYY-Spiegel als normalgewichtige.
Man kann den Energieumsatz ziemlich genau aus dem Sauerstoffverbrauch
errechnen: Ein Liter Sauerstoff, der im Stoffwechsel verbraucht wird,
liefert etwa 5 Kilokalorien (~20 kJ) an Energie (Energie-, metabolisches oder kalorisches
Äquivalent). Dieses Verfahren heißt indirekte Kalorimetrie; misst man
die vom Körper abgegebene Wärmemenge, spricht man von direkter
Kalorimetrie.
Der Energieumsatz ist abhängig von Hautoberfläche,
Schilddrüsenfunktion, Alter und Geschlecht. Er wird je nach den
herrschenden Begleitumständen benannt als
 Grundumsatz - Energieumsatz im Nüchternzustand, bei körperlicher Ruhe und Indifferenztemperatur
Grundumsatz - Energieumsatz im Nüchternzustand, bei körperlicher Ruhe und Indifferenztemperatur

 Ruheumsatz - Energieumsatz ohne körperliche Belastung
Ruheumsatz - Energieumsatz ohne körperliche Belastung

 Leistungs- oder Arbeitsumsatz bei körperlicher Belastung
Leistungs- oder Arbeitsumsatz bei körperlicher Belastung
 Näheres dazu s. dort.
Näheres dazu s. dort.
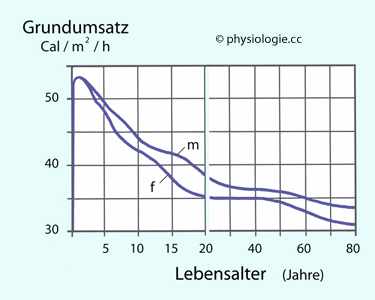
 Abbildung:
Grundumsatz als Funktion des Alters
Abbildung:
Grundumsatz als Funktion des Alters
Nach einer Vorlage bei Arthur C. Guyton, Function of the Human Body, W.B. Saunders Company 1959
Gemittelte, auf die Hautoberfläche (m2) normierte Werte. Maßstab wechselt bei 20 Jahren
m = Knaben / Männer, f = Mädchen / Frauen

Mechanisch geleistete
Energie pro Gesamt-Energieumsatz ergibt den Wirkungsgrad.
 Der
Energieumsatz - bei körperlicher Ruhe etwa 6
Kilojoule / Minute, entsprechend einem Sauerstoffverbrauch von 0,3
Liter / min - steigt bei Muskelaktivität beim Gesunden bis 10-20fach an
(je
nach Trainingszustand),
d.h. bei Maximalbelastung bis auf ~100 kJ/min - entsprechend ~1700 Watt
Leistung; dazu werden ~5 Liter Sauerstoff pro Minute benötigt. Als Faustregel gilt: Im submaximalen Bereich erhöht sich der O2-Verbrauch linear um 10 ml Sauerstoff pro Watt Belastungszunahme.
Der
Energieumsatz - bei körperlicher Ruhe etwa 6
Kilojoule / Minute, entsprechend einem Sauerstoffverbrauch von 0,3
Liter / min - steigt bei Muskelaktivität beim Gesunden bis 10-20fach an
(je
nach Trainingszustand),
d.h. bei Maximalbelastung bis auf ~100 kJ/min - entsprechend ~1700 Watt
Leistung; dazu werden ~5 Liter Sauerstoff pro Minute benötigt. Als Faustregel gilt: Im submaximalen Bereich erhöht sich der O2-Verbrauch linear um 10 ml Sauerstoff pro Watt Belastungszunahme.

Über das
SI-System (Präfixe und Einheiten)
s.
dort
Der Sauerstoffverbrauch der Muskulatur steigt mit der Belastungsstärke um ~10 ml O2 je Watt
|
Körperliche Belastung bedeutet für die Muskulatur vermehrten Energieumsatz. Bei stationärer mäßiger Arbeitsleistung stammt die Energie (wie auch im Ruhezustand) zum Großteil aus dem Abbau von Triglyzeriden, eine lange
verfügbare Reserve.
 Zum Energiestoffwechsel der Skelettmuskulatur s. dort
Zum Energiestoffwechsel der Skelettmuskulatur s. dort
Bei Höchstleistung
(mehr als ~50% der maximal möglichen Muskelleistung) reicht der
Energiefluss aus dem Fettsäureabbau nicht aus, und der Anteil der Glucose an
der Energieversorgung des
Muskels steigt auf bis zu ~75% des gesamten Energieflusses an. Diese
Energiereserve reicht allerdings nur für verhältnismäßig kurze Zeit,
bei Absinken des Blutzuckerspiegels kommt es zu raschem Absinken der
nutzbaren Substratmenge, es stellt sich Erschöpfung ein.
Anpassung an körperliche Belastung und Stress
Unmittelbarer Energielieferant für die Muskelkontraktion ist Adenosintriphosphat (ATP).
Wird der Muskel aktiviert, verbraucht sich das unmittelbar verfügbare
ATP innerhalb weniger Sekunden.
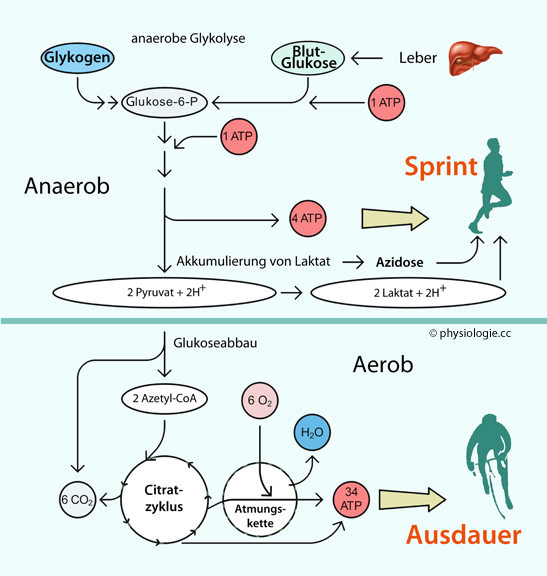

Abbildung: Anaerobe vs. aerobe Energiegewinnung
Nach einer Vorlage bei publi.cz
Insbesondere
zu Beginn der
Aktivität reicht die Sauerstoffversorgung des Muskels für oxidative
Metabolisierung nicht aus (die Durchblutung muss erst zunehmen),
Glucose wird nur bis zur Stufe von Pyruvat / Lactat abgebaut. Dabei
werden 2 mol ATP verbraucht, 4 gewonnen (Netto-Ertrag 2 mol ATP pro mol Glucose).
Bei ausreichender Sauerstoffversorgung kann die Glykolyse
über Krebs-Zyklus und Atmungskette vollständig bis Kohlendioxid
erfolgen, die Energieausbeute beträgt 34 mol ATP / mol Glucose, ist
also 17-mal höher

Die Art der zum
"Nachladen" des ATP-Pools verwendeten Energiequellen hängt von der Dauer
der Muskelaktivität ab:
 Kurzzeitig wird ATP aus einem in der Muskelzelle angelegten Speicher von Kreatinphosphat
nachgebildet - unter Wirkung der Kreatinkinase. Dieser
Energievorrat reicht für mehrere Sekunden, nach weniger als einer
Minute ist er (bei kontinuierlicher Muskelaktivität) gänzlich erschöpft.
Kurzzeitig wird ATP aus einem in der Muskelzelle angelegten Speicher von Kreatinphosphat
nachgebildet - unter Wirkung der Kreatinkinase. Dieser
Energievorrat reicht für mehrere Sekunden, nach weniger als einer
Minute ist er (bei kontinuierlicher Muskelaktivität) gänzlich erschöpft.
 Innerhalb von Sekunden springt die anaerobe Glykolyse an.
Sie kann noch vor Ablauf einer Minute mehr als die Hälfte des
Energiemusatzes des Muskels bestreiten, bei kurzzeitiger Belastung
(z.B. Sprint,
Innerhalb von Sekunden springt die anaerobe Glykolyse an.
Sie kann noch vor Ablauf einer Minute mehr als die Hälfte des
Energiemusatzes des Muskels bestreiten, bei kurzzeitiger Belastung
(z.B. Sprint,  Abbildung) reicht dieser Beitrag aus, auch wenn er
bei ungenügender Sauerstoffzufuhr rasch zu Übersäuerung führt
(Laktazidose,
Abbildung) reicht dieser Beitrag aus, auch wenn er
bei ungenügender Sauerstoffzufuhr rasch zu Übersäuerung führt
(Laktazidose,  s. dort). Anschließend nimmt der Beitrag
der Glucoseutilisation wieder ab und ist nach wenigen Minuten so gut
wie verschwunden. Nun tritt aerober Abbau auf den Plan:
s. dort). Anschließend nimmt der Beitrag
der Glucoseutilisation wieder ab und ist nach wenigen Minuten so gut
wie verschwunden. Nun tritt aerober Abbau auf den Plan:
 Nach etwa
10 Minuten gipfelt der Beitrag des aeroben Kohlenhydratabbaus in der Muskulatur (diese nimmt Glucose auf, was den Blutzuckerspiegel senkt: Die Aufnahme der Glucose aus dem Extrazellulärraum wird durch Insulin begünstigt).
Muskelglykogen ist eine Energiereserve für die Muskelzelle selbst
(Glykogen bis zu 3% der Zellmasse). Dies ist besonders für kurze Belastungen gut - auch bei ungenügendem
Sauerstoffangebot (anaerober Abbau bis Lactat), allerdings nur für kurze Zeit (metabolische Azidose!).
Nach etwa
10 Minuten gipfelt der Beitrag des aeroben Kohlenhydratabbaus in der Muskulatur (diese nimmt Glucose auf, was den Blutzuckerspiegel senkt: Die Aufnahme der Glucose aus dem Extrazellulärraum wird durch Insulin begünstigt).
Muskelglykogen ist eine Energiereserve für die Muskelzelle selbst
(Glykogen bis zu 3% der Zellmasse). Dies ist besonders für kurze Belastungen gut - auch bei ungenügendem
Sauerstoffangebot (anaerober Abbau bis Lactat), allerdings nur für kurze Zeit (metabolische Azidose!).
Zu
Beginn einer intensiven Muskelaktivität wird ATP zur Energiegewinnung
herangezogen, dann Kreatinphosphat, später Glucose, schließlich
Fettsäuren
|

Zum
Energiestoffwechsel während Muskelbelastung s. auch
dort
Der Mechanismus der Glucoseverwertung wirkt bis über eine Stunde
(maximal ~3 Stunden bei kohlenhydratreicher Kost), dann sind die
Glykogenreserven des Muskels erschöpft.
 Etwa 10 Minuten nach Beginn der Arbeit beteiligt sich der aerobe Kohlenhydratabbau in der Leber, dieser nimmt etwa 2 Stunden lang an der Energiebereitstellung teil.
Etwa 10 Minuten nach Beginn der Arbeit beteiligt sich der aerobe Kohlenhydratabbau in der Leber, dieser nimmt etwa 2 Stunden lang an der Energiebereitstellung teil.
 Gut eine Viertelstunde nach Beginn der Aktivität beginnt der aerobe Fettsäureabbau,
sein Maximum ist nach 2 Stunden (oder mehr) erreicht, und für
Ausdauerbelastung übernimmt dieser Mechanismus am Ende vollständig den Beitrag zur ATP-Synthese.
Gut eine Viertelstunde nach Beginn der Aktivität beginnt der aerobe Fettsäureabbau,
sein Maximum ist nach 2 Stunden (oder mehr) erreicht, und für
Ausdauerbelastung übernimmt dieser Mechanismus am Ende vollständig den Beitrag zur ATP-Synthese.
 Zur Durchblutung der Skelettmuskulatur s. dort
Zur Durchblutung der Skelettmuskulatur s. dort


Abbildung: Lebensstil und Energieversorgung physiologischer Systeme
Nach Pontzer H, Energy Constraint as a Novel Mechanism Linking Exercise and Health. Physiology 2018; 33: 384-93
Das gesamte Energieaufkommen des Organismus muss zwischen den einzelnen
Energieverbrauchern aufgeteilt werden. Bei besonders hoher körperlicher
Aktivität (rechts) konsumiert die Muskulatur so viel Energie, dass
andere Systeme zunehmend mit einer Einschränkung ihres Energieangebotes
konfrontiert werden: Die Immunabwehr wird geschwächt, das Vegetativum
reagiert nur begrenzt auf stressartige Herausforderungen,
Sexualfunktionen nehmen ab.
Letztlich kann Extremsport zu
gesundheitlichen Nachteilen führen, Krankheitsneigung und Mortalität
höher liegen als bei ausgewogenem (aktivem) Lebensstil

Die Muskulatur
nimmt einen Anteil des Energiestoffwechsels in Anspruch, der mit
zunehmender Aktivität immer mehr ansteigt. Bei weitgehend passivem
Lebensstil (Tätigkeiten vorwiegend im Sitzen, Büroarbeit, in der  Abbildung links) kann das einen Betrag beanspruchen, der nur
unwesentlich über dem Basisumsatz der Muskeln (15-20% des gesamten
Sauerstoffverbrauchs) liegt.
Abbildung links) kann das einen Betrag beanspruchen, der nur
unwesentlich über dem Basisumsatz der Muskeln (15-20% des gesamten
Sauerstoffverbrauchs) liegt.
Steigt die Belastung des Bewegungssystems an (sportliche Aktivität),
nimmt der Energieverbrauch zu, und die gesundheitsfördernden Effekte
des Trainings senken Morbidität und Mortalität (in der  Abbildung unten).
Solange der Anteil an Sauerstoff und Substraten, der für den
Metabolismus anderer Körpersysteme zur Verfügung steht, deren Bedarf
ausreichend deckt, werden deren physiologische Funktionen auch zur
Genüge unterstützt.
Abbildung unten).
Solange der Anteil an Sauerstoff und Substraten, der für den
Metabolismus anderer Körpersysteme zur Verfügung steht, deren Bedarf
ausreichend deckt, werden deren physiologische Funktionen auch zur
Genüge unterstützt.
Untersuchungen legen nahe, dass hingegen bei extremer körperlicher
Belastung (in der  Abbildung rechts) funktionelle Einschränkungen Platz greifen: Verringerte Lymphozytenzahlen, Infektionsneigung, möglicherweise erhöhte Tumorneigung etc (Immunsystem), abnehmende Reaktionsstärke der hypothalamisch-hypophysär-adrenergen "Stressachse", reduzierte sexuelle Potenz.
Abbildung rechts) funktionelle Einschränkungen Platz greifen: Verringerte Lymphozytenzahlen, Infektionsneigung, möglicherweise erhöhte Tumorneigung etc (Immunsystem), abnehmende Reaktionsstärke der hypothalamisch-hypophysär-adrenergen "Stressachse", reduzierte sexuelle Potenz.
Dies ist eines von unzähligen Beispielen für Optimierung
in der Physiologie: Nicht zu viel und nicht zu wenig - auf diese Weise
funktionieren die Systeme, und der Organismus insgesamt, am besten.
 Sportliche Aktivität ist gut für die Gesundheit, sie senkt
Erkrankungsneigung und Sterblichkeit, man lebt länger und gesünder.
Übertreibt man allerdings die Muskelbelastung (Extremsport mit hohem
Energieaufwand), hat das eine mit dem Belastungsgrad zunehmende
Unterversorgung der Abwehr- und Stresssysteme sowie der
Sexualfunktionen zur Folge. Es überwiegen nachteilige Effekte,
Morbidität und Mortalität nehmen wieder zu.
Sportliche Aktivität ist gut für die Gesundheit, sie senkt
Erkrankungsneigung und Sterblichkeit, man lebt länger und gesünder.
Übertreibt man allerdings die Muskelbelastung (Extremsport mit hohem
Energieaufwand), hat das eine mit dem Belastungsgrad zunehmende
Unterversorgung der Abwehr- und Stresssysteme sowie der
Sexualfunktionen zur Folge. Es überwiegen nachteilige Effekte,
Morbidität und Mortalität nehmen wieder zu.
 Schwere Belastungen (Traumen, Operationen, Unfälle, Verbrennungen) bedingen eine Umstellung auf posttraumatischen oder Postaggressionsstoffwechsel.
Zunächst tritt Blutvolumenabfall und Hypothermie auf
("Stoffwechselebbe"), anschließend (~1 Tag) aufgrund hormoneller
Aktivierung (Katecholamine, Cortisol, Glucagon, Wachstumshormon: Stresseffekt)
vermehrter Stoffwechsel mit gesteigerter Fettoxidation,
Eiweißkatabolismus und Hyperthermie ("Flutphase").
Schwere Belastungen (Traumen, Operationen, Unfälle, Verbrennungen) bedingen eine Umstellung auf posttraumatischen oder Postaggressionsstoffwechsel.
Zunächst tritt Blutvolumenabfall und Hypothermie auf
("Stoffwechselebbe"), anschließend (~1 Tag) aufgrund hormoneller
Aktivierung (Katecholamine, Cortisol, Glucagon, Wachstumshormon: Stresseffekt)
vermehrter Stoffwechsel mit gesteigerter Fettoxidation,
Eiweißkatabolismus und Hyperthermie ("Flutphase").
Insgesamt kann man die Anpassungsvorgänge des "Postaggressionssyndroms" in mehrere Phasen einteilen:
 Traumatisierung
Traumatisierung - durch depressive Verstimmung, Durstgefühl und Schmerzempfinden gekennzeichnet, Dauer wenige Tage

Normalisierung der vegetativen Funktionen (Temperatur, Kreislauf, Atmung, Appetit, Peristaltik) - einige Tage

Phase des
Anabolismus: Eiweißaufbau, Erholung, Schlafbedürfnis - ca. 2 Wochen

 Rekonvaleszenz
Rekonvaleszenz 
mit Rückerlangung des Körpergewichts und der vollständigen Leitungsfähigkeit
Der Energieumsatz steigt nach einem chirurgischen Eingriff um etwa 25% (die Stickstoffausscheidung auf mehr als das Doppelte), bei Sepsis um ~80%, nach großflächigen Verbrennungen um mehr als 120% (die Stickstoffausscheidung ist in letzteren beiden Fällen mehr als verdreifacht).


 Glucosetoleranz ist die Fähigkeit, eine Glucosebelastung zu verarbeiten und den Blutzuckerspiegel zu stabilisieren. Beteiligt sind das Pankreas (Langerhans-Inseln), Gehirn,
Speicherorgane (Fettgewebe, Leber), Muskulatur (diese kann den
Energieverbrauch des Körpers vervielfachen): Der Insulinspiegel steigt, der Glucagonspiegel ist niedrig. Im Hungerzustand steigt der Ketonkörperspiegel von
~0.5 mM auf 2-5 mM (Ketose), Ketoazidose tritt ab ~15 mM auf Glucosetoleranz ist die Fähigkeit, eine Glucosebelastung zu verarbeiten und den Blutzuckerspiegel zu stabilisieren. Beteiligt sind das Pankreas (Langerhans-Inseln), Gehirn,
Speicherorgane (Fettgewebe, Leber), Muskulatur (diese kann den
Energieverbrauch des Körpers vervielfachen): Der Insulinspiegel steigt, der Glucagonspiegel ist niedrig. Im Hungerzustand steigt der Ketonkörperspiegel von
~0.5 mM auf 2-5 mM (Ketose), Ketoazidose tritt ab ~15 mM auf
 In der Resorptions- (digestiven, postprandialen) Phase steigt der Spiegel an Glucose, Lipiden und Aminosäuren
im Kreislauf, diese werden resorbiert und für Synthese und Speicherung
herangezogen. Der Glucoseverbrauch von Gehirn (~6 g/h) und Erythrozyten
(~1,5 g/h) beträgt 7-8 g/h, der Rest wird zwischengespeichert (Leber)
oder für andere Zwecke genützt (Synthese von Fettsäuren,
Nukleotiden..). Substratangebot, Inkretine (ein wesentlicher Teil der Glucosetoleranz: Die Insulinsekretion steigt, bevor der Glucosespiegel im Blut erhöht ist) und
parasympathische Aktivität fördern die Freisetzung von Insulin In der Resorptions- (digestiven, postprandialen) Phase steigt der Spiegel an Glucose, Lipiden und Aminosäuren
im Kreislauf, diese werden resorbiert und für Synthese und Speicherung
herangezogen. Der Glucoseverbrauch von Gehirn (~6 g/h) und Erythrozyten
(~1,5 g/h) beträgt 7-8 g/h, der Rest wird zwischengespeichert (Leber)
oder für andere Zwecke genützt (Synthese von Fettsäuren,
Nukleotiden..). Substratangebot, Inkretine (ein wesentlicher Teil der Glucosetoleranz: Die Insulinsekretion steigt, bevor der Glucosespiegel im Blut erhöht ist) und
parasympathische Aktivität fördern die Freisetzung von Insulin
 Die Postresorptions- (postabsorptive, Nüchtern-) Phase ist für späte Schlaf-, längere Arbeitsphasen oder Hungerperioden charakteristisch. Der Darm ist geleert, im Körper gespeicherte Energie wird genutzt. Leber, Fett- und Muskelgewebe kooperieren, gesteuert durch Glucagon, Katecholamine, Cortisol, Wachstumshormon: Glykogenabbau und Glucoseexport (Kapazität 4-5 g/h), Glukoneogenese (~3 g/h) und
Ketogenese in der Leber, Einsparung von Glucose in Fett- und
Muskelgewebe, Freisetzung von freien Fettsäuren aus Adipozyten
(Lipolyse). Die Metabolisierung von Fettsäuren versorgt fast alle
Gewebe. Der Insulin / Glucagon-Quotient ist niedrig, kurzfristig helfen
auch Adrenalin, längerfristig (über Enzyminduktion) Glucocorticoide und
Schilddrüsenhormone. Der Glucosebedarf des Körpers beträgt im
Normalfall ~5 g/kg/d (~350 g/d, Gehirn
~130 g/d), im Hungerzustand ~3 g/kg/d. Der Abbau von körpereigenem
Protein kann in den ersten Hungertagen bis zu ~100 g/d betragen Die Postresorptions- (postabsorptive, Nüchtern-) Phase ist für späte Schlaf-, längere Arbeitsphasen oder Hungerperioden charakteristisch. Der Darm ist geleert, im Körper gespeicherte Energie wird genutzt. Leber, Fett- und Muskelgewebe kooperieren, gesteuert durch Glucagon, Katecholamine, Cortisol, Wachstumshormon: Glykogenabbau und Glucoseexport (Kapazität 4-5 g/h), Glukoneogenese (~3 g/h) und
Ketogenese in der Leber, Einsparung von Glucose in Fett- und
Muskelgewebe, Freisetzung von freien Fettsäuren aus Adipozyten
(Lipolyse). Die Metabolisierung von Fettsäuren versorgt fast alle
Gewebe. Der Insulin / Glucagon-Quotient ist niedrig, kurzfristig helfen
auch Adrenalin, längerfristig (über Enzyminduktion) Glucocorticoide und
Schilddrüsenhormone. Der Glucosebedarf des Körpers beträgt im
Normalfall ~5 g/kg/d (~350 g/d, Gehirn
~130 g/d), im Hungerzustand ~3 g/kg/d. Der Abbau von körpereigenem
Protein kann in den ersten Hungertagen bis zu ~100 g/d betragen
 Ketonkörper
entstehen in Mitochondrien (der Leber) und werden in Mitochondrien (im
gesamten Körper, vor allem im Gehirn) abgebaut. Der Blutzuckerspiegel
kann auch bei ausgedehnten Fastenperioden stabil bleiben (hormonelle
Stabilisierung). Enzyminduktion erhöht die Verwertung von Acetoacetat
und ß-Hydroxybutyrat innerhalb weniger Tage des Hungerns bis zu
~20-fach, Ketonkörper werden vom Gehirn über Acetyl-CoA in den
Zitratzyklus eingeschleust, der zerebrale Glucoseverbrauch nimmt von
~120 g/d bis auf ~40 g/d ab. Ein Energiedefizit von 1000 Kalorien /
Tag führt zu einer Senkung der Fettmasse um ~1 kg pro Woche Ketonkörper
entstehen in Mitochondrien (der Leber) und werden in Mitochondrien (im
gesamten Körper, vor allem im Gehirn) abgebaut. Der Blutzuckerspiegel
kann auch bei ausgedehnten Fastenperioden stabil bleiben (hormonelle
Stabilisierung). Enzyminduktion erhöht die Verwertung von Acetoacetat
und ß-Hydroxybutyrat innerhalb weniger Tage des Hungerns bis zu
~20-fach, Ketonkörper werden vom Gehirn über Acetyl-CoA in den
Zitratzyklus eingeschleust, der zerebrale Glucoseverbrauch nimmt von
~120 g/d bis auf ~40 g/d ab. Ein Energiedefizit von 1000 Kalorien /
Tag führt zu einer Senkung der Fettmasse um ~1 kg pro Woche
 Magen und Darm
beteiligen sich an der Steuerung der Insulinsekretion, Hunger /
Sättigung und Nahrungsaufnahme. Ghrelin, CCK, GLP-1 und PYY3–36
beeinflussen das Essverhalten: Ghrelin wirkt appetitanregend, CCK
sättigend, GLP-1 bremst Magenentleerung und Nahrungsaufnahme, PYY
unterdrückt das Hungergefühl Magen und Darm
beteiligen sich an der Steuerung der Insulinsekretion, Hunger /
Sättigung und Nahrungsaufnahme. Ghrelin, CCK, GLP-1 und PYY3–36
beeinflussen das Essverhalten: Ghrelin wirkt appetitanregend, CCK
sättigend, GLP-1 bremst Magenentleerung und Nahrungsaufnahme, PYY
unterdrückt das Hungergefühl
 Ein Liter metabolisierter Sauerstoff liefert etwa 5 Kilokalorien (~20 kJ) an Energie (metabolisches Äquivalent: Prinzip der indirekten Kalorimetrie). Der Energieumsatz heißt je nach Begleitumständen Grundumsatz - Energieumsatz im Nüchternzustand, bei körperlicher Ruhe und Indifferenztemperatur (abhängig von Hautoberfläche, Schilddrüsenfunktion, Alter und Geschlecht); Ruheumsatz - Energieumsatz ohne körperliche Belastung; Leistungs- oder Arbeitsumsatz - bei körperlicher Belastung. Ein Ruheumsatz von etwa
~6
kJ/min entspricht einem Sauerstoffverbrauch von 0,3 l/ min. Der
maximale Leistungsumsatz beträgt bis ~100 kJ/min (je nach
Trainingszustand), entsprechend ~1700 Watt Leistung; dazu werden ~5
Liter Sauerstoff pro Minute benötigt. Bei Höchstleistung (mehr als ~50%
des maximalen Leistungsumsatzes)
ist der Energiefluss aus dem Fettsäureabbau überfordert, der Anteil der
Glucose an der Energieversorgung des Muskels steigt auf bis zu ~75% an,
bei Absinken des Blutzuckerspiegels stellt sich Erschöpfung ein Ein Liter metabolisierter Sauerstoff liefert etwa 5 Kilokalorien (~20 kJ) an Energie (metabolisches Äquivalent: Prinzip der indirekten Kalorimetrie). Der Energieumsatz heißt je nach Begleitumständen Grundumsatz - Energieumsatz im Nüchternzustand, bei körperlicher Ruhe und Indifferenztemperatur (abhängig von Hautoberfläche, Schilddrüsenfunktion, Alter und Geschlecht); Ruheumsatz - Energieumsatz ohne körperliche Belastung; Leistungs- oder Arbeitsumsatz - bei körperlicher Belastung. Ein Ruheumsatz von etwa
~6
kJ/min entspricht einem Sauerstoffverbrauch von 0,3 l/ min. Der
maximale Leistungsumsatz beträgt bis ~100 kJ/min (je nach
Trainingszustand), entsprechend ~1700 Watt Leistung; dazu werden ~5
Liter Sauerstoff pro Minute benötigt. Bei Höchstleistung (mehr als ~50%
des maximalen Leistungsumsatzes)
ist der Energiefluss aus dem Fettsäureabbau überfordert, der Anteil der
Glucose an der Energieversorgung des Muskels steigt auf bis zu ~75% an,
bei Absinken des Blutzuckerspiegels stellt sich Erschöpfung ein
 ATP ist der
unmittelbare Energielieferant für die Muskelkontraktion, der Vorrat
reicht für einige Sekunden. Ein kurzfristig verfügbarer Speicher ist Kreatinphosphat (<1 min). Zuerst wird ATP zur Energiegewinnung herangezogen,
dann Kreatinphosphat, dann Glucose, schließlich Fettsäuren. Muskelglykogen macht bis zu 3% der Zellmasse aus;
beim Abbau von Glucose zu Pyruvat / Lactat werden 2 mol ATP pro mol
Glucose gewonnen (anaerobe Glykolyse ist nach Sekunden aktiv), beim
Abbau über den Zitratzyklus (aerob) 34 mol ATP / mol Glucose (17-mal
mehr). Ungenügende Sauerstoffzufuhr führt rasch zu Übersäuerung
(Laktazidose). Glucoseverwertung dominiert bis über eine Stunde intensiver Muskelarbeit (maximal ~3 Stunden
bei kohlenhydratreicher Kost), dann sind die Glykogenreserven des
Muskels erschöpft.
Gut eine Viertelstunde nach Beginn der Aktivität dominiert der
Fettsäureabbau, für Ausdauerbelastung
übernimmt dieser Mechanismus dann die
ATP-Synthese ATP ist der
unmittelbare Energielieferant für die Muskelkontraktion, der Vorrat
reicht für einige Sekunden. Ein kurzfristig verfügbarer Speicher ist Kreatinphosphat (<1 min). Zuerst wird ATP zur Energiegewinnung herangezogen,
dann Kreatinphosphat, dann Glucose, schließlich Fettsäuren. Muskelglykogen macht bis zu 3% der Zellmasse aus;
beim Abbau von Glucose zu Pyruvat / Lactat werden 2 mol ATP pro mol
Glucose gewonnen (anaerobe Glykolyse ist nach Sekunden aktiv), beim
Abbau über den Zitratzyklus (aerob) 34 mol ATP / mol Glucose (17-mal
mehr). Ungenügende Sauerstoffzufuhr führt rasch zu Übersäuerung
(Laktazidose). Glucoseverwertung dominiert bis über eine Stunde intensiver Muskelarbeit (maximal ~3 Stunden
bei kohlenhydratreicher Kost), dann sind die Glykogenreserven des
Muskels erschöpft.
Gut eine Viertelstunde nach Beginn der Aktivität dominiert der
Fettsäureabbau, für Ausdauerbelastung
übernimmt dieser Mechanismus dann die
ATP-Synthese
|

 Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.
Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.





 Metabolischer Status
Metabolischer Status
 Aceton: Von "acetic acid" + "on" (acidum = Säure)
Aceton: Von "acetic acid" + "on" (acidum = Säure) Hunger, Ketose, Ketonkörper
Hunger, Ketose, Ketonkörper  Steuernde Signale aus dem gastrointestinalen System
Steuernde Signale aus dem gastrointestinalen System  Kalorimetrie
Kalorimetrie  Anaerobe vs. aerobe Energiegewinnung
Anaerobe vs. aerobe Energiegewinnung  Stoffwechselstress
Stoffwechselstress
 Spezifisch-dynamische Wirkung (SDA, DIT, TEF)
Spezifisch-dynamische Wirkung (SDA, DIT, TEF)
 Fasten, Hungern
Fasten, Hungern
 Core messages
Core messages Postdigestive Phase
Postdigestive Phase d.h. nach dem Essen: resorptive Phase) und solchen mit leerem Intestinum ("nüchtern", postresorptiv, "Nahrungspause").
d.h. nach dem Essen: resorptive Phase) und solchen mit leerem Intestinum ("nüchtern", postresorptiv, "Nahrungspause").

 Abbildung: 24-h-Energiestoffwechsel
Abbildung: 24-h-Energiestoffwechsel
 Unter der spezifisch-dynamischen Wirkung (Max Rubner) versteht man die Steigerung des Energieumsatzes durch Verwertung neu aufgenommener Nährstoffe (vor allem Eiweiß). Dieses Phänomen trägt im angloamerikanischen Raum auch folgende Bezeichnungen: Specific dynamic action (SDA), Diet-induced thermogenesis (DIT), Thermic effect of food (TEF), Heat increment of feeding (HIF). Die spezifisch-dynamische Wirkung geht mit erhöhter Durchblutung des Darms einher (postprandiale Hyperämie).
Unter der spezifisch-dynamischen Wirkung (Max Rubner) versteht man die Steigerung des Energieumsatzes durch Verwertung neu aufgenommener Nährstoffe (vor allem Eiweiß). Dieses Phänomen trägt im angloamerikanischen Raum auch folgende Bezeichnungen: Specific dynamic action (SDA), Diet-induced thermogenesis (DIT), Thermic effect of food (TEF), Heat increment of feeding (HIF). Die spezifisch-dynamische Wirkung geht mit erhöhter Durchblutung des Darms einher (postprandiale Hyperämie). (Anstieg des Blutspiegels der Ketonkörper - Normalbereich um die 0.5 mM, im ketotischen Zustand 2-5 mM, Ketoazidose ab ~15 mM);
auch dies kann durch hormonelle Anpassung für Tage bis Wochen
kompensiert werden (vorausgesetzt, Flüssigkeits- und Salzzufuhr
verhindert Dehydrierung und Volumenverlust).
(Anstieg des Blutspiegels der Ketonkörper - Normalbereich um die 0.5 mM, im ketotischen Zustand 2-5 mM, Ketoazidose ab ~15 mM);
auch dies kann durch hormonelle Anpassung für Tage bis Wochen
kompensiert werden (vorausgesetzt, Flüssigkeits- und Salzzufuhr
verhindert Dehydrierung und Volumenverlust). Abbildung). Insbesondere
steigt der Glucosespiegel, und Glucose (Blutzucker) gelangt über
verschiedene Transportsysteme (glucose transporters, GLUT) in die Zellen.
Abbildung). Insbesondere
steigt der Glucosespiegel, und Glucose (Blutzucker) gelangt über
verschiedene Transportsysteme (glucose transporters, GLUT) in die Zellen.
 Abbildung: Stoffwechsel in der Resorptionsphase (postprandial)
Abbildung: Stoffwechsel in der Resorptionsphase (postprandial)
 Insulin
fördert die Einlagerung von Glucosetransportern in die Membran von Muskel- und Fettzellen und
erleichtert damit die Glucoseaufnahme. Inkretine fördern die Insulinbildung und sind ein
wesentlicher Bestandteil der Glucosetoleranz.
Insulin
fördert die Einlagerung von Glucosetransportern in die Membran von Muskel- und Fettzellen und
erleichtert damit die Glucoseaufnahme. Inkretine fördern die Insulinbildung und sind ein
wesentlicher Bestandteil der Glucosetoleranz.
 Abbildung: Metabolischer Zustand und wichtigste Stoffwechselpfade
Abbildung: Metabolischer Zustand und wichtigste Stoffwechselpfade
 Abbildung) liegt im Nüchternzustand (späte Schlaf-, längere Arbeitsphasen) bzw. Fasten vor (Hungerperioden).
Der Darm ist geleert und liefert keine Nährstoffe nach, der
Stoffwechsel muss auf Versorgung durch im Körper gespeicherte Energie
umschalten und ist daher (teilweise) katabol.
Abbildung) liegt im Nüchternzustand (späte Schlaf-, längere Arbeitsphasen) bzw. Fasten vor (Hungerperioden).
Der Darm ist geleert und liefert keine Nährstoffe nach, der
Stoffwechsel muss auf Versorgung durch im Körper gespeicherte Energie
umschalten und ist daher (teilweise) katabol. 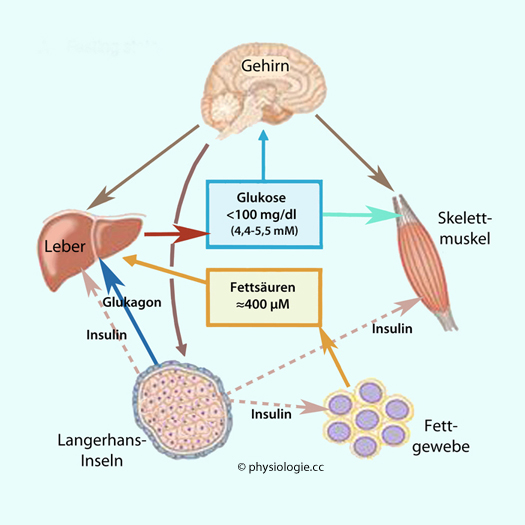
 Abbildung: Stoffwechsel in der Postresorptionsphase (leerer Darm)
Abbildung: Stoffwechsel in der Postresorptionsphase (leerer Darm)
 Glykogenolyse (Kapazität der Glucoseproduktion ~4,5 g/h), dann
Glykogenolyse (Kapazität der Glucoseproduktion ~4,5 g/h), dann  Glukoneogenese (~3 g/h) - und bei längerem
Substratmangel (Hungerzustand, unbehandelter Diabetes mellitus)
Glukoneogenese (~3 g/h) - und bei längerem
Substratmangel (Hungerzustand, unbehandelter Diabetes mellitus)
 Ketogenese (Bildung von Ketonkörpern aus Fett, s. unten).
Ketogenese (Bildung von Ketonkörpern aus Fett, s. unten).  Der Glucosebedarf beträgt im Normalfall ~5 g/kg
Körpermasse pro Tag (ohne intensive körperliche Belastung - das Gehirn alleine benötigt ~130 g Glucose pro Tag), er nimmt im Hungerzustand deutlich ab, auf ~3 g/kg
Körpermasse pro Tag (~2 mg/kg/min, vor allem für das Gehirn,
Der Glucosebedarf beträgt im Normalfall ~5 g/kg
Körpermasse pro Tag (ohne intensive körperliche Belastung - das Gehirn alleine benötigt ~130 g Glucose pro Tag), er nimmt im Hungerzustand deutlich ab, auf ~3 g/kg
Körpermasse pro Tag (~2 mg/kg/min, vor allem für das Gehirn,  s. dort).
s. dort).  vgl. dort
vgl. dort
 Abbildung: Hungerstoffwechsel
Abbildung: Hungerstoffwechsel
 Fasten (fasting) bedeutet,
für einige Zeit willkürlich auf Nahrungsaufnahme zu verzichten. Dabei
braucht der Körper zuerst seine Glykogen-, dann seine Fettreserven
auf. Hungerzustand (starvation) bzw. Unterernährung (undernutrition) bedeutet längerfristig
fehlende bzw. unzureichende Energiezufuhr, und der Organismus ist
gezwungen, essentielle Gewebe (z.B. Muskelmasse) zum Zweck der
Energieversorgung lebenswichtiger Organe (Gehirn, Herz..) anzugreifen.
Das resultiert in Gewichtsreduktion entsprechender Organe,
Muskelschwäche, Anämie, Immundefizienzen, eingeschränkter mentaler
Kapazität u.a.
Fasten (fasting) bedeutet,
für einige Zeit willkürlich auf Nahrungsaufnahme zu verzichten. Dabei
braucht der Körper zuerst seine Glykogen-, dann seine Fettreserven
auf. Hungerzustand (starvation) bzw. Unterernährung (undernutrition) bedeutet längerfristig
fehlende bzw. unzureichende Energiezufuhr, und der Organismus ist
gezwungen, essentielle Gewebe (z.B. Muskelmasse) zum Zweck der
Energieversorgung lebenswichtiger Organe (Gehirn, Herz..) anzugreifen.
Das resultiert in Gewichtsreduktion entsprechender Organe,
Muskelschwäche, Anämie, Immundefizienzen, eingeschränkter mentaler
Kapazität u.a. Während der ersten 24-48 Stunden
ausbleibender Nahrungsaufnahme sinkt der Blutzuckerspiegel, Glucagon
wird vermehrt in den Kreislauf sezerniert. Dieses regt zuerst Glykogenolyse
in
der Leber (Glykogenspeicher meist innerhalb von 16-18 Stunden,
spätestens nach 2 Tagen erschöpft - bei hoher Muskelaktivität
entsprechend rascher,
Während der ersten 24-48 Stunden
ausbleibender Nahrungsaufnahme sinkt der Blutzuckerspiegel, Glucagon
wird vermehrt in den Kreislauf sezerniert. Dieses regt zuerst Glykogenolyse
in
der Leber (Glykogenspeicher meist innerhalb von 16-18 Stunden,
spätestens nach 2 Tagen erschöpft - bei hoher Muskelaktivität
entsprechend rascher,  vgl. dort), dann
Lipolyse im Fettgewebe an (Freisetzung von Fettsäuren und Glycerin).
Niedrige Insulinwerte regen die ß-Oxidation von Fettsäuren an, hohe
Glucagonwerte die Freisetzung von Aminosäuren aus der Muskulatur.
vgl. dort), dann
Lipolyse im Fettgewebe an (Freisetzung von Fettsäuren und Glycerin).
Niedrige Insulinwerte regen die ß-Oxidation von Fettsäuren an, hohe
Glucagonwerte die Freisetzung von Aminosäuren aus der Muskulatur. 
 Im Zustand des Hungerns / Fastens steigen innerhalb von 24 Stunden Acetyl-CoA und ß-Oxidation in den Mitochondrien an
Im Zustand des Hungerns / Fastens steigen innerhalb von 24 Stunden Acetyl-CoA und ß-Oxidation in den Mitochondrien an In Hepatozyten kondensieren AcCoA-Moleküle, Ketonkörper werden (nur in der Leber) gebildet
In Hepatozyten kondensieren AcCoA-Moleküle, Ketonkörper werden (nur in der Leber) gebildet ß-Hydroxybuttersäure
und Acetessigsäure dienen peripheren Geweben (allen Zellen außer
Erythrozyten, vor allem dem Gehirn, auch der Muskulatur, den Nieren
etc) als Energielieferanten, Aceton wird ausgeatmet / ausgeschieden
(Harn)
ß-Hydroxybuttersäure
und Acetessigsäure dienen peripheren Geweben (allen Zellen außer
Erythrozyten, vor allem dem Gehirn, auch der Muskulatur, den Nieren
etc) als Energielieferanten, Aceton wird ausgeatmet / ausgeschieden
(Harn) Während einiger weiterer Tage
steigt die Gluconeogenese an, Substrate sind Glycerin, Lactat und
Aminosäuren. Der
Fettsäurespiegel im Plasma (Nüchtern-Triglyzeride normal <1,7 mM) verdoppelt sich
innerhalb weniger Tage des Fastens / Hungerns.
Während einiger weiterer Tage
steigt die Gluconeogenese an, Substrate sind Glycerin, Lactat und
Aminosäuren. Der
Fettsäurespiegel im Plasma (Nüchtern-Triglyzeride normal <1,7 mM) verdoppelt sich
innerhalb weniger Tage des Fastens / Hungerns. In den darauffolgenden Wochen
nimmt die Gluconeogenese allmählich wieder ab, die Gewebe adaptieren an
die Nutzung von Ketonkörpern, der Ketonkörperspiegel im Blut steigt auf Werte bis 7
mM (Ketose ab 5 mM, s. unten). Der Grundumsatz nimmt ab. Das Aufzehren
essentieller Gewebereserven führt schrittweise zu Abnahme von
Organgrößen und -funktionen, Muskelschwäche, Anämie, Immunschwäche und
reduzierter mentaler Kapazität. Ist etwa die Hälfe des Muskelgewebes
aufgebraucht (Aminosäureabbau), reicht die Kraft der
Respirationsmuskulatur nicht mehr für eine adäquate Säuberung der Atemwege (Pneumoniegefahr). Fasten- bzw. Hungerperioden von bis zu 2 Monaten
Dauer können überlebt werden.
In den darauffolgenden Wochen
nimmt die Gluconeogenese allmählich wieder ab, die Gewebe adaptieren an
die Nutzung von Ketonkörpern, der Ketonkörperspiegel im Blut steigt auf Werte bis 7
mM (Ketose ab 5 mM, s. unten). Der Grundumsatz nimmt ab. Das Aufzehren
essentieller Gewebereserven führt schrittweise zu Abnahme von
Organgrößen und -funktionen, Muskelschwäche, Anämie, Immunschwäche und
reduzierter mentaler Kapazität. Ist etwa die Hälfe des Muskelgewebes
aufgebraucht (Aminosäureabbau), reicht die Kraft der
Respirationsmuskulatur nicht mehr für eine adäquate Säuberung der Atemwege (Pneumoniegefahr). Fasten- bzw. Hungerperioden von bis zu 2 Monaten
Dauer können überlebt werden.
 Abbildung: Ketogenese und Verstoffwechselung der Ketonkörper
Abbildung: Ketogenese und Verstoffwechselung der Ketonkörper
 Abbildung), die von glucoseabhängigen
Geweben für ihren Energiestoffwechsel genutzt werden können (ketogene
Phase).
Abbildung), die von glucoseabhängigen
Geweben für ihren Energiestoffwechsel genutzt werden können (ketogene
Phase). 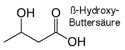


 Ketonkörper entstehen in Mitochondrien (der Leber) und
Ketonkörper entstehen in Mitochondrien (der Leber) und  werden in Mitochondrien (im gesamten Körper) abgebaut.
werden in Mitochondrien (im gesamten Körper) abgebaut. 

 Abbildung: Vergleich der Substratflüsse im postprandialen sowie im chronischen Hungerzustand
Abbildung: Vergleich der Substratflüsse im postprandialen sowie im chronischen Hungerzustand
 Ketonkörper (Serum)
Ketonkörper (Serum)
 Abbildung: Substratflüsse im längeren Hungerzustand
Abbildung: Substratflüsse im längeren Hungerzustand
 In katabolen Stoffwechselsituationen dienen auch
Aminosäuren der Energiegewinnung; die meisten sind für den Aufbau von Glucose nutzbar. Solche Aminosäuren nennt man glukogen oder glukoplastisch
(=zuckerbildend) - nur Leuzin und Lysin können vom Stoffwechsel nicht glukogen verwendet werden.
In katabolen Stoffwechselsituationen dienen auch
Aminosäuren der Energiegewinnung; die meisten sind für den Aufbau von Glucose nutzbar. Solche Aminosäuren nennt man glukogen oder glukoplastisch
(=zuckerbildend) - nur Leuzin und Lysin können vom Stoffwechsel nicht glukogen verwendet werden. 
 Abbildung: Stoffwechsel im chronischen Hungerzustand
Abbildung: Stoffwechsel im chronischen Hungerzustand
 Wärmeabgabe an die Umwelt (inklusive Arbeitsleistung). Zum obligaten
Umsatz (Grundumsatz) kommt der zusätzliche Energieumsatz, vor allem
durch körperliche Belastung.
Wärmeabgabe an die Umwelt (inklusive Arbeitsleistung). Zum obligaten
Umsatz (Grundumsatz) kommt der zusätzliche Energieumsatz, vor allem
durch körperliche Belastung. Ist das Gleichgewicht zwischen Energiezufuhr (Nahrung) und
Energieverbrauch nicht gegeben, so wird entweder Fett verbraucht
(Abnahme der Fettmasse) oder zusätzlich angelegt (Zunahme der
Fettmasse).
Ist das Gleichgewicht zwischen Energiezufuhr (Nahrung) und
Energieverbrauch nicht gegeben, so wird entweder Fett verbraucht
(Abnahme der Fettmasse) oder zusätzlich angelegt (Zunahme der
Fettmasse).  Faustregel: Ein Energiedefizit von 1000 Kalorien / Tag
Faustregel: Ein Energiedefizit von 1000 Kalorien / Tag  führt zu einer
Senkung der Fettmasse um ~1 kg pro Woche.
führt zu einer
Senkung der Fettmasse um ~1 kg pro Woche.
 Abbildung: Rezeptoren auf / in Fettzellen
Abbildung: Rezeptoren auf / in Fettzellen Insulin steigert die Aufnahme von Glucose und Aminosäuren in Adipozyten und fördert deren Speicherfunktion
Insulin steigert die Aufnahme von Glucose und Aminosäuren in Adipozyten und fördert deren Speicherfunktion
 Wachstumshormon wirkt lipolytisch
Wachstumshormon wirkt lipolytisch
 Angiotensin reguliert Lipidstoffwechsel, Wachstum und Differenzierung der Fettzellen
Angiotensin reguliert Lipidstoffwechsel, Wachstum und Differenzierung der Fettzellen
 GLP-1 verbessert die Insulinsensitivität der Fettzellen
GLP-1 verbessert die Insulinsensitivität der Fettzellen
 Glucocorticoide beeinflussen die Expression verschiedener Gene und fördern insgesamt die Fetteinlagerung
Glucocorticoide beeinflussen die Expression verschiedener Gene und fördern insgesamt die Fetteinlagerung
 Schilddrüsenhormone wirken in komplexer Weise auf weißes und braunes Fettgewebe und fördern die Adipogenese
Schilddrüsenhormone wirken in komplexer Weise auf weißes und braunes Fettgewebe und fördern die Adipogenese
 Geschlechtshormone fördern und kontrollieren den Stoffwechsel der Fettzellen
Geschlechtshormone fördern und kontrollieren den Stoffwechsel der Fettzellen
 Katecholamine und Glucagon fördern die Lipolyse
Katecholamine und Glucagon fördern die Lipolyse
 TSH
hemmt die Umwandlung von weißem zu braunem Fettgewebe.
TSH
hemmt die Umwandlung von weißem zu braunem Fettgewebe.
 Abbildung: Rückkopplung zur Steuerung der Nahrungsaufnahme
Abbildung: Rückkopplung zur Steuerung der Nahrungsaufnahme
 Abbildung) entsteht im Magen, vermehrt in Hungerphasen, und wirkt appetitanregend.
Schlanke Personen haben niedrige, adipöse hohe Ghrelinspiegel.
Gastrektomie senkt den Ghrelinspiegel im Blut um ~65%, was auf einen
nicht unwesentlichen Beitrag anderer Entstehungsorte (Dünn- und
Dickdarm, Pankreas, Nieren, Hypothalamus) hinweist.
Abbildung) entsteht im Magen, vermehrt in Hungerphasen, und wirkt appetitanregend.
Schlanke Personen haben niedrige, adipöse hohe Ghrelinspiegel.
Gastrektomie senkt den Ghrelinspiegel im Blut um ~65%, was auf einen
nicht unwesentlichen Beitrag anderer Entstehungsorte (Dünn- und
Dickdarm, Pankreas, Nieren, Hypothalamus) hinweist. Grundumsatz - Energieumsatz im Nüchternzustand, bei körperlicher Ruhe und Indifferenztemperatur
Grundumsatz - Energieumsatz im Nüchternzustand, bei körperlicher Ruhe und Indifferenztemperatur
 Ruheumsatz - Energieumsatz ohne körperliche Belastung
Ruheumsatz - Energieumsatz ohne körperliche Belastung
 Leistungs- oder Arbeitsumsatz bei körperlicher Belastung
Leistungs- oder Arbeitsumsatz bei körperlicher Belastung
 Abbildung:
Grundumsatz als Funktion des Alters
Abbildung:
Grundumsatz als Funktion des Alters
 Der
Energieumsatz - bei körperlicher Ruhe etwa 6
Kilojoule / Minute, entsprechend einem Sauerstoffverbrauch von 0,3
Liter / min - steigt bei Muskelaktivität beim Gesunden bis 10-20fach an
(je
nach Trainingszustand),
d.h. bei Maximalbelastung bis auf ~100 kJ/min - entsprechend ~1700 Watt
Leistung; dazu werden ~5 Liter Sauerstoff pro Minute benötigt. Als Faustregel gilt: Im submaximalen Bereich erhöht sich der O2-Verbrauch linear um 10 ml Sauerstoff pro Watt Belastungszunahme.
Der
Energieumsatz - bei körperlicher Ruhe etwa 6
Kilojoule / Minute, entsprechend einem Sauerstoffverbrauch von 0,3
Liter / min - steigt bei Muskelaktivität beim Gesunden bis 10-20fach an
(je
nach Trainingszustand),
d.h. bei Maximalbelastung bis auf ~100 kJ/min - entsprechend ~1700 Watt
Leistung; dazu werden ~5 Liter Sauerstoff pro Minute benötigt. Als Faustregel gilt: Im submaximalen Bereich erhöht sich der O2-Verbrauch linear um 10 ml Sauerstoff pro Watt Belastungszunahme.
 Abbildung: Anaerobe vs. aerobe Energiegewinnung
Abbildung: Anaerobe vs. aerobe Energiegewinnung
 Kurzzeitig wird ATP aus einem in der Muskelzelle angelegten Speicher von Kreatinphosphat
nachgebildet - unter Wirkung der Kreatinkinase. Dieser
Energievorrat reicht für mehrere Sekunden, nach weniger als einer
Minute ist er (bei kontinuierlicher Muskelaktivität) gänzlich erschöpft.
Kurzzeitig wird ATP aus einem in der Muskelzelle angelegten Speicher von Kreatinphosphat
nachgebildet - unter Wirkung der Kreatinkinase. Dieser
Energievorrat reicht für mehrere Sekunden, nach weniger als einer
Minute ist er (bei kontinuierlicher Muskelaktivität) gänzlich erschöpft. Innerhalb von Sekunden springt die anaerobe Glykolyse an.
Sie kann noch vor Ablauf einer Minute mehr als die Hälfte des
Energiemusatzes des Muskels bestreiten, bei kurzzeitiger Belastung
(z.B. Sprint,
Innerhalb von Sekunden springt die anaerobe Glykolyse an.
Sie kann noch vor Ablauf einer Minute mehr als die Hälfte des
Energiemusatzes des Muskels bestreiten, bei kurzzeitiger Belastung
(z.B. Sprint,  Abbildung) reicht dieser Beitrag aus, auch wenn er
bei ungenügender Sauerstoffzufuhr rasch zu Übersäuerung führt
(Laktazidose,
Abbildung) reicht dieser Beitrag aus, auch wenn er
bei ungenügender Sauerstoffzufuhr rasch zu Übersäuerung führt
(Laktazidose,  s. dort). Anschließend nimmt der Beitrag
der Glucoseutilisation wieder ab und ist nach wenigen Minuten so gut
wie verschwunden. Nun tritt aerober Abbau auf den Plan:
s. dort). Anschließend nimmt der Beitrag
der Glucoseutilisation wieder ab und ist nach wenigen Minuten so gut
wie verschwunden. Nun tritt aerober Abbau auf den Plan: Nach etwa
10 Minuten gipfelt der Beitrag des aeroben Kohlenhydratabbaus in der Muskulatur (diese nimmt Glucose auf, was den Blutzuckerspiegel senkt: Die Aufnahme der Glucose aus dem Extrazellulärraum wird durch Insulin begünstigt).
Muskelglykogen ist eine Energiereserve für die Muskelzelle selbst
(Glykogen bis zu 3% der Zellmasse). Dies ist besonders für kurze Belastungen gut - auch bei ungenügendem
Sauerstoffangebot (anaerober Abbau bis Lactat), allerdings nur für kurze Zeit (metabolische Azidose!).
Nach etwa
10 Minuten gipfelt der Beitrag des aeroben Kohlenhydratabbaus in der Muskulatur (diese nimmt Glucose auf, was den Blutzuckerspiegel senkt: Die Aufnahme der Glucose aus dem Extrazellulärraum wird durch Insulin begünstigt).
Muskelglykogen ist eine Energiereserve für die Muskelzelle selbst
(Glykogen bis zu 3% der Zellmasse). Dies ist besonders für kurze Belastungen gut - auch bei ungenügendem
Sauerstoffangebot (anaerober Abbau bis Lactat), allerdings nur für kurze Zeit (metabolische Azidose!).  Etwa 10 Minuten nach Beginn der Arbeit beteiligt sich der aerobe Kohlenhydratabbau in der Leber, dieser nimmt etwa 2 Stunden lang an der Energiebereitstellung teil.
Etwa 10 Minuten nach Beginn der Arbeit beteiligt sich der aerobe Kohlenhydratabbau in der Leber, dieser nimmt etwa 2 Stunden lang an der Energiebereitstellung teil. Gut eine Viertelstunde nach Beginn der Aktivität beginnt der aerobe Fettsäureabbau,
sein Maximum ist nach 2 Stunden (oder mehr) erreicht, und für
Ausdauerbelastung übernimmt dieser Mechanismus am Ende vollständig den Beitrag zur ATP-Synthese.
Gut eine Viertelstunde nach Beginn der Aktivität beginnt der aerobe Fettsäureabbau,
sein Maximum ist nach 2 Stunden (oder mehr) erreicht, und für
Ausdauerbelastung übernimmt dieser Mechanismus am Ende vollständig den Beitrag zur ATP-Synthese.
 Abbildung: Lebensstil und Energieversorgung physiologischer Systeme
Abbildung: Lebensstil und Energieversorgung physiologischer Systeme
 Abbildung links) kann das einen Betrag beanspruchen, der nur
unwesentlich über dem Basisumsatz der Muskeln (15-20% des gesamten
Sauerstoffverbrauchs) liegt.
Abbildung links) kann das einen Betrag beanspruchen, der nur
unwesentlich über dem Basisumsatz der Muskeln (15-20% des gesamten
Sauerstoffverbrauchs) liegt.  Abbildung unten).
Solange der Anteil an Sauerstoff und Substraten, der für den
Metabolismus anderer Körpersysteme zur Verfügung steht, deren Bedarf
ausreichend deckt, werden deren physiologische Funktionen auch zur
Genüge unterstützt.
Abbildung unten).
Solange der Anteil an Sauerstoff und Substraten, der für den
Metabolismus anderer Körpersysteme zur Verfügung steht, deren Bedarf
ausreichend deckt, werden deren physiologische Funktionen auch zur
Genüge unterstützt. Abbildung rechts) funktionelle Einschränkungen Platz greifen: Verringerte Lymphozytenzahlen, Infektionsneigung, möglicherweise erhöhte Tumorneigung etc (Immunsystem), abnehmende Reaktionsstärke der hypothalamisch-hypophysär-adrenergen "Stressachse", reduzierte sexuelle Potenz.
Abbildung rechts) funktionelle Einschränkungen Platz greifen: Verringerte Lymphozytenzahlen, Infektionsneigung, möglicherweise erhöhte Tumorneigung etc (Immunsystem), abnehmende Reaktionsstärke der hypothalamisch-hypophysär-adrenergen "Stressachse", reduzierte sexuelle Potenz.  Sportliche Aktivität ist gut für die Gesundheit, sie senkt
Erkrankungsneigung und Sterblichkeit, man lebt länger und gesünder.
Übertreibt man allerdings die Muskelbelastung (Extremsport mit hohem
Energieaufwand), hat das eine mit dem Belastungsgrad zunehmende
Unterversorgung der Abwehr- und Stresssysteme sowie der
Sexualfunktionen zur Folge. Es überwiegen nachteilige Effekte,
Morbidität und Mortalität nehmen wieder zu.
Sportliche Aktivität ist gut für die Gesundheit, sie senkt
Erkrankungsneigung und Sterblichkeit, man lebt länger und gesünder.
Übertreibt man allerdings die Muskelbelastung (Extremsport mit hohem
Energieaufwand), hat das eine mit dem Belastungsgrad zunehmende
Unterversorgung der Abwehr- und Stresssysteme sowie der
Sexualfunktionen zur Folge. Es überwiegen nachteilige Effekte,
Morbidität und Mortalität nehmen wieder zu. Schwere Belastungen (Traumen, Operationen, Unfälle, Verbrennungen) bedingen eine Umstellung auf posttraumatischen oder Postaggressionsstoffwechsel.
Zunächst tritt Blutvolumenabfall und Hypothermie auf
("Stoffwechselebbe"), anschließend (~1 Tag) aufgrund hormoneller
Aktivierung (Katecholamine, Cortisol, Glucagon, Wachstumshormon: Stresseffekt)
vermehrter Stoffwechsel mit gesteigerter Fettoxidation,
Eiweißkatabolismus und Hyperthermie ("Flutphase").
Schwere Belastungen (Traumen, Operationen, Unfälle, Verbrennungen) bedingen eine Umstellung auf posttraumatischen oder Postaggressionsstoffwechsel.
Zunächst tritt Blutvolumenabfall und Hypothermie auf
("Stoffwechselebbe"), anschließend (~1 Tag) aufgrund hormoneller
Aktivierung (Katecholamine, Cortisol, Glucagon, Wachstumshormon: Stresseffekt)
vermehrter Stoffwechsel mit gesteigerter Fettoxidation,
Eiweißkatabolismus und Hyperthermie ("Flutphase"). Traumatisierung - durch depressive Verstimmung, Durstgefühl und Schmerzempfinden gekennzeichnet, Dauer wenige Tage
Traumatisierung - durch depressive Verstimmung, Durstgefühl und Schmerzempfinden gekennzeichnet, Dauer wenige Tage Normalisierung der vegetativen Funktionen (Temperatur, Kreislauf, Atmung, Appetit, Peristaltik) - einige Tage
Normalisierung der vegetativen Funktionen (Temperatur, Kreislauf, Atmung, Appetit, Peristaltik) - einige Tage Phase des Anabolismus: Eiweißaufbau, Erholung, Schlafbedürfnis - ca. 2 Wochen
Phase des Anabolismus: Eiweißaufbau, Erholung, Schlafbedürfnis - ca. 2 Wochen
 Rekonvaleszenz
Rekonvaleszenz  mit Rückerlangung des Körpergewichts und der vollständigen Leitungsfähigkeit
mit Rückerlangung des Körpergewichts und der vollständigen Leitungsfähigkeit
 Glucosetoleranz ist die Fähigkeit, eine Glucosebelastung zu verarbeiten und den Blutzuckerspiegel zu stabilisieren. Beteiligt sind das Pankreas (Langerhans-Inseln), Gehirn,
Speicherorgane (Fettgewebe, Leber), Muskulatur (diese kann den
Energieverbrauch des Körpers vervielfachen): Der Insulinspiegel steigt, der Glucagonspiegel ist niedrig. Im Hungerzustand steigt der Ketonkörperspiegel von
~0.5 mM auf 2-5 mM (Ketose), Ketoazidose tritt ab ~15 mM auf
Glucosetoleranz ist die Fähigkeit, eine Glucosebelastung zu verarbeiten und den Blutzuckerspiegel zu stabilisieren. Beteiligt sind das Pankreas (Langerhans-Inseln), Gehirn,
Speicherorgane (Fettgewebe, Leber), Muskulatur (diese kann den
Energieverbrauch des Körpers vervielfachen): Der Insulinspiegel steigt, der Glucagonspiegel ist niedrig. Im Hungerzustand steigt der Ketonkörperspiegel von
~0.5 mM auf 2-5 mM (Ketose), Ketoazidose tritt ab ~15 mM auf  In der Resorptions- (digestiven, postprandialen) Phase steigt der Spiegel an Glucose, Lipiden und Aminosäuren
im Kreislauf, diese werden resorbiert und für Synthese und Speicherung
herangezogen. Der Glucoseverbrauch von Gehirn (~6 g/h) und Erythrozyten
(~1,5 g/h) beträgt 7-8 g/h, der Rest wird zwischengespeichert (Leber)
oder für andere Zwecke genützt (Synthese von Fettsäuren,
Nukleotiden..). Substratangebot, Inkretine (ein wesentlicher Teil der Glucosetoleranz: Die Insulinsekretion steigt, bevor der Glucosespiegel im Blut erhöht ist) und
parasympathische Aktivität fördern die Freisetzung von Insulin
In der Resorptions- (digestiven, postprandialen) Phase steigt der Spiegel an Glucose, Lipiden und Aminosäuren
im Kreislauf, diese werden resorbiert und für Synthese und Speicherung
herangezogen. Der Glucoseverbrauch von Gehirn (~6 g/h) und Erythrozyten
(~1,5 g/h) beträgt 7-8 g/h, der Rest wird zwischengespeichert (Leber)
oder für andere Zwecke genützt (Synthese von Fettsäuren,
Nukleotiden..). Substratangebot, Inkretine (ein wesentlicher Teil der Glucosetoleranz: Die Insulinsekretion steigt, bevor der Glucosespiegel im Blut erhöht ist) und
parasympathische Aktivität fördern die Freisetzung von Insulin Die Postresorptions- (postabsorptive, Nüchtern-) Phase ist für späte Schlaf-, längere Arbeitsphasen oder Hungerperioden charakteristisch. Der Darm ist geleert, im Körper gespeicherte Energie wird genutzt. Leber, Fett- und Muskelgewebe kooperieren, gesteuert durch Glucagon, Katecholamine, Cortisol, Wachstumshormon: Glykogenabbau und Glucoseexport (Kapazität 4-5 g/h), Glukoneogenese (~3 g/h) und
Ketogenese in der Leber, Einsparung von Glucose in Fett- und
Muskelgewebe, Freisetzung von freien Fettsäuren aus Adipozyten
(Lipolyse). Die Metabolisierung von Fettsäuren versorgt fast alle
Gewebe. Der Insulin / Glucagon-Quotient ist niedrig, kurzfristig helfen
auch Adrenalin, längerfristig (über Enzyminduktion) Glucocorticoide und
Schilddrüsenhormone. Der Glucosebedarf des Körpers beträgt im
Normalfall ~5 g/kg/d (~350 g/d, Gehirn
~130 g/d), im Hungerzustand ~3 g/kg/d. Der Abbau von körpereigenem
Protein kann in den ersten Hungertagen bis zu ~100 g/d betragen
Die Postresorptions- (postabsorptive, Nüchtern-) Phase ist für späte Schlaf-, längere Arbeitsphasen oder Hungerperioden charakteristisch. Der Darm ist geleert, im Körper gespeicherte Energie wird genutzt. Leber, Fett- und Muskelgewebe kooperieren, gesteuert durch Glucagon, Katecholamine, Cortisol, Wachstumshormon: Glykogenabbau und Glucoseexport (Kapazität 4-5 g/h), Glukoneogenese (~3 g/h) und
Ketogenese in der Leber, Einsparung von Glucose in Fett- und
Muskelgewebe, Freisetzung von freien Fettsäuren aus Adipozyten
(Lipolyse). Die Metabolisierung von Fettsäuren versorgt fast alle
Gewebe. Der Insulin / Glucagon-Quotient ist niedrig, kurzfristig helfen
auch Adrenalin, längerfristig (über Enzyminduktion) Glucocorticoide und
Schilddrüsenhormone. Der Glucosebedarf des Körpers beträgt im
Normalfall ~5 g/kg/d (~350 g/d, Gehirn
~130 g/d), im Hungerzustand ~3 g/kg/d. Der Abbau von körpereigenem
Protein kann in den ersten Hungertagen bis zu ~100 g/d betragen  Ketonkörper
entstehen in Mitochondrien (der Leber) und werden in Mitochondrien (im
gesamten Körper, vor allem im Gehirn) abgebaut. Der Blutzuckerspiegel
kann auch bei ausgedehnten Fastenperioden stabil bleiben (hormonelle
Stabilisierung). Enzyminduktion erhöht die Verwertung von Acetoacetat
und ß-Hydroxybutyrat innerhalb weniger Tage des Hungerns bis zu
~20-fach, Ketonkörper werden vom Gehirn über Acetyl-CoA in den
Zitratzyklus eingeschleust, der zerebrale Glucoseverbrauch nimmt von
~120 g/d bis auf ~40 g/d ab. Ein Energiedefizit von 1000 Kalorien /
Tag führt zu einer Senkung der Fettmasse um ~1 kg pro Woche
Ketonkörper
entstehen in Mitochondrien (der Leber) und werden in Mitochondrien (im
gesamten Körper, vor allem im Gehirn) abgebaut. Der Blutzuckerspiegel
kann auch bei ausgedehnten Fastenperioden stabil bleiben (hormonelle
Stabilisierung). Enzyminduktion erhöht die Verwertung von Acetoacetat
und ß-Hydroxybutyrat innerhalb weniger Tage des Hungerns bis zu
~20-fach, Ketonkörper werden vom Gehirn über Acetyl-CoA in den
Zitratzyklus eingeschleust, der zerebrale Glucoseverbrauch nimmt von
~120 g/d bis auf ~40 g/d ab. Ein Energiedefizit von 1000 Kalorien /
Tag führt zu einer Senkung der Fettmasse um ~1 kg pro Woche  Magen und Darm
beteiligen sich an der Steuerung der Insulinsekretion, Hunger /
Sättigung und Nahrungsaufnahme. Ghrelin, CCK, GLP-1 und PYY3–36
beeinflussen das Essverhalten: Ghrelin wirkt appetitanregend, CCK
sättigend, GLP-1 bremst Magenentleerung und Nahrungsaufnahme, PYY
unterdrückt das Hungergefühl
Magen und Darm
beteiligen sich an der Steuerung der Insulinsekretion, Hunger /
Sättigung und Nahrungsaufnahme. Ghrelin, CCK, GLP-1 und PYY3–36
beeinflussen das Essverhalten: Ghrelin wirkt appetitanregend, CCK
sättigend, GLP-1 bremst Magenentleerung und Nahrungsaufnahme, PYY
unterdrückt das Hungergefühl Ein Liter metabolisierter Sauerstoff liefert etwa 5 Kilokalorien (~20 kJ) an Energie (metabolisches Äquivalent: Prinzip der indirekten Kalorimetrie). Der Energieumsatz heißt je nach Begleitumständen Grundumsatz - Energieumsatz im Nüchternzustand, bei körperlicher Ruhe und Indifferenztemperatur (abhängig von Hautoberfläche, Schilddrüsenfunktion, Alter und Geschlecht); Ruheumsatz - Energieumsatz ohne körperliche Belastung; Leistungs- oder Arbeitsumsatz - bei körperlicher Belastung. Ein Ruheumsatz von etwa
~6
kJ/min entspricht einem Sauerstoffverbrauch von 0,3 l/ min. Der
maximale Leistungsumsatz beträgt bis ~100 kJ/min (je nach
Trainingszustand), entsprechend ~1700 Watt Leistung; dazu werden ~5
Liter Sauerstoff pro Minute benötigt. Bei Höchstleistung (mehr als ~50%
des maximalen Leistungsumsatzes)
ist der Energiefluss aus dem Fettsäureabbau überfordert, der Anteil der
Glucose an der Energieversorgung des Muskels steigt auf bis zu ~75% an,
bei Absinken des Blutzuckerspiegels stellt sich Erschöpfung ein
Ein Liter metabolisierter Sauerstoff liefert etwa 5 Kilokalorien (~20 kJ) an Energie (metabolisches Äquivalent: Prinzip der indirekten Kalorimetrie). Der Energieumsatz heißt je nach Begleitumständen Grundumsatz - Energieumsatz im Nüchternzustand, bei körperlicher Ruhe und Indifferenztemperatur (abhängig von Hautoberfläche, Schilddrüsenfunktion, Alter und Geschlecht); Ruheumsatz - Energieumsatz ohne körperliche Belastung; Leistungs- oder Arbeitsumsatz - bei körperlicher Belastung. Ein Ruheumsatz von etwa
~6
kJ/min entspricht einem Sauerstoffverbrauch von 0,3 l/ min. Der
maximale Leistungsumsatz beträgt bis ~100 kJ/min (je nach
Trainingszustand), entsprechend ~1700 Watt Leistung; dazu werden ~5
Liter Sauerstoff pro Minute benötigt. Bei Höchstleistung (mehr als ~50%
des maximalen Leistungsumsatzes)
ist der Energiefluss aus dem Fettsäureabbau überfordert, der Anteil der
Glucose an der Energieversorgung des Muskels steigt auf bis zu ~75% an,
bei Absinken des Blutzuckerspiegels stellt sich Erschöpfung ein  ATP ist der
unmittelbare Energielieferant für die Muskelkontraktion, der Vorrat
reicht für einige Sekunden. Ein kurzfristig verfügbarer Speicher ist Kreatinphosphat (<1 min). Zuerst wird ATP zur Energiegewinnung herangezogen,
dann Kreatinphosphat, dann Glucose, schließlich Fettsäuren. Muskelglykogen macht bis zu 3% der Zellmasse aus;
beim Abbau von Glucose zu Pyruvat / Lactat werden 2 mol ATP pro mol
Glucose gewonnen (anaerobe Glykolyse ist nach Sekunden aktiv), beim
Abbau über den Zitratzyklus (aerob) 34 mol ATP / mol Glucose (17-mal
mehr). Ungenügende Sauerstoffzufuhr führt rasch zu Übersäuerung
(Laktazidose). Glucoseverwertung dominiert bis über eine Stunde intensiver Muskelarbeit (maximal ~3 Stunden
bei kohlenhydratreicher Kost), dann sind die Glykogenreserven des
Muskels erschöpft.
Gut eine Viertelstunde nach Beginn der Aktivität dominiert der
Fettsäureabbau, für Ausdauerbelastung
übernimmt dieser Mechanismus dann die
ATP-Synthese
ATP ist der
unmittelbare Energielieferant für die Muskelkontraktion, der Vorrat
reicht für einige Sekunden. Ein kurzfristig verfügbarer Speicher ist Kreatinphosphat (<1 min). Zuerst wird ATP zur Energiegewinnung herangezogen,
dann Kreatinphosphat, dann Glucose, schließlich Fettsäuren. Muskelglykogen macht bis zu 3% der Zellmasse aus;
beim Abbau von Glucose zu Pyruvat / Lactat werden 2 mol ATP pro mol
Glucose gewonnen (anaerobe Glykolyse ist nach Sekunden aktiv), beim
Abbau über den Zitratzyklus (aerob) 34 mol ATP / mol Glucose (17-mal
mehr). Ungenügende Sauerstoffzufuhr führt rasch zu Übersäuerung
(Laktazidose). Glucoseverwertung dominiert bis über eine Stunde intensiver Muskelarbeit (maximal ~3 Stunden
bei kohlenhydratreicher Kost), dann sind die Glykogenreserven des
Muskels erschöpft.
Gut eine Viertelstunde nach Beginn der Aktivität dominiert der
Fettsäureabbau, für Ausdauerbelastung
übernimmt dieser Mechanismus dann die
ATP-Synthese