

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert


 Gastrointestinales System
Gastrointestinales System
 Cadherin: calcium-adhering - Ca++-abhängig, bewirkt Zellkontakt
Cadherin: calcium-adhering - Ca++-abhängig, bewirkt Zellkontakt| Magen-Darm-Schleimhaut nimmt Nahrungsstoffe über eine große Austauschfläche (~200 m2) in das "eigentliche Innere"
des Körpers auf. Vor physiko-chemischen und biologischen
Gefahren (Toxine, Mikroorganismen, Parasiten) schützen Ansäuerung (Magen), Schleimbildung und immunologische
Abwehr (Enzyme, sekretorische Antikörper, GALT: Gut-associated lymphatic tissue) - die sogenannte Darmbarriere. Die Darmflora (etwa 100 Billionen Bakterien,
Archaeen, Eukaryoten) ist ein komplexes
Ökosystem mit einem ziemlich individualspezifischen Muster. Ihre Aktivität wirkt sich
auf Gesundheit und Stimmungslage aus. Komplexe Nahrungsstoffe (Fremdeiweiß) sind potentielle Antigene. Die gastrointestinalen Immunmechanismen müssen so ausgelegt sein, dass sie einerseits biologischen Schutz bieten, andererseits keine Unverträglichkeitsreaktionen auf Nahrungskomponenten auftreten. Rezeptoren im Magen-Darm-Trakt detektieren mechanische und chemische Reize; das löst Sekretion, Kontraktion, Hormonsekretion aus. Ein Teil der Information wird neuroendokrin bis zum Gehirn weitergeleitet und beeinflusst u.a. Hunger- und Sattheitsgefühle. Das gastrointestinale System trägt wesentlich zur Kreislaufregulation bei. Es kann einen beträchtlichen Anteil des Blutvolumens speichern und bei hohem Sympathikustonus dem Kreislauf bereitstellen - durch Drosselung der arteriellen Durchblutung und Kontraktion der zahlreichen Venen. Das befördert Blut aus dem Splanchnikusbereich, erhöht den venösen Rückstrom und stabilisiert die Herzleistung. |
 Resorptionsoberfläche
Resorptionsoberfläche  Immunologische Besonderheiten
Immunologische Besonderheiten  Kreislaufwirksamkeit
Kreislaufwirksamkeit  Enteroendokrine Zellen
Enteroendokrine Zellen  Neurohumorales System, "Verdauungshormone"
Neurohumorales System, "Verdauungshormone"  Sensorik und autonom-nervöse Versorgung
Sensorik und autonom-nervöse Versorgung  Zöliakie
Zöliakie

 Nährstoffe
Nährstoffe  Assimilation
Assimilation  Peyer-Plaques
Peyer-Plaques
 Core messages
Core messages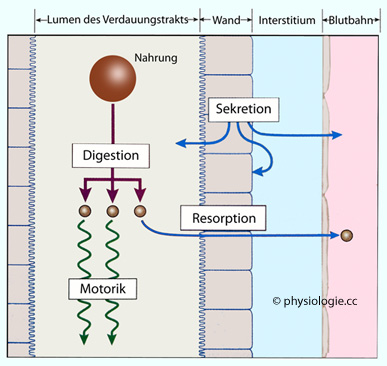
 Abbildung: Funktionen des Verdauungssystems
Abbildung: Funktionen des Verdauungssystems
 Abbildung):
Abbildung):
 Als Verdauung (digestion)
bezeichnet man das mechanische und chemische Aufteilen großer,
unlöslicher Nahrungsbestandteile zu kleinen, wasserlöslichen
Bruchstücken
Als Verdauung (digestion)
bezeichnet man das mechanische und chemische Aufteilen großer,
unlöslicher Nahrungsbestandteile zu kleinen, wasserlöslichen
Bruchstücken Resorption (absorption) ist die Aufnahme der aufgeschlossenen Bruchstücke über Mucosaepithel, Interstitium und Endothelien in den Blutkreislauf
Resorption (absorption) ist die Aufnahme der aufgeschlossenen Bruchstücke über Mucosaepithel, Interstitium und Endothelien in den Blutkreislauf Motorik (motility) ist der Transport und die Durchmischung des Darminhalts;
Motorik (motility) ist der Transport und die Durchmischung des Darminhalts; Sekretion ist die Freisetzung von Verdauungssäften für die Unterstützung der
Motilität (Viskositätssenkung), den Schutz
der Darmwand (Immunfunktion) sowie für die Verdauung (Aufschließen
der Nahrung durch Säurewirkung und Enzyme). Auch Mediatorstoffe werden
sezerniert und wirken auf Nachbarzellen (parakrin) oder werden in die
Blutbahn abgegeben (Hormone).
Sekretion ist die Freisetzung von Verdauungssäften für die Unterstützung der
Motilität (Viskositätssenkung), den Schutz
der Darmwand (Immunfunktion) sowie für die Verdauung (Aufschließen
der Nahrung durch Säurewirkung und Enzyme). Auch Mediatorstoffe werden
sezerniert und wirken auf Nachbarzellen (parakrin) oder werden in die
Blutbahn abgegeben (Hormone). ein Sinnesorgan (Chemorezeptoren, Mechanorezeptoren, Osmorezeptoren,
Nozizeptoren),
ein Sinnesorgan (Chemorezeptoren, Mechanorezeptoren, Osmorezeptoren,
Nozizeptoren),  ein Ort der Begegnung mit Faktoren der Außenwelt (mit
Nahrung und Getränken aufgenommene Substanzen, Mikroben, Parasiten - Immunfunktion),
ein Ort der Begegnung mit Faktoren der Außenwelt (mit
Nahrung und Getränken aufgenommene Substanzen, Mikroben, Parasiten - Immunfunktion),
 ein Hormonproduzent (ein endokrines Organ),
ein Hormonproduzent (ein endokrines Organ), ein wichtiges Kreislauforgan (Blutspeicher bzw. -reservoir, starke Perfusion), und
ein wichtiges Kreislauforgan (Blutspeicher bzw. -reservoir, starke Perfusion), und  mit Leber, Pankreas und (falls man sie dem GI-Trakt zuordnet) Milz enthält es zentrale Anhangsorgane im Dienst von Metabolismus und Immunabwehr.
mit Leber, Pankreas und (falls man sie dem GI-Trakt zuordnet) Milz enthält es zentrale Anhangsorgane im Dienst von Metabolismus und Immunabwehr. Darm: idg. Wurzel *ter-, durchbohren ("Loch")
Darm: idg. Wurzel *ter-, durchbohren ("Loch")
 Abbildung: Gastrointestinales System (schematisch)
Abbildung: Gastrointestinales System (schematisch)
 Das enteroendokrine
System: "Verdauungshormone" aus dem Darm übermitteln Information an
andere Stellen des GI-Systems sowie an das Zentralnervensystem
Das enteroendokrine
System: "Verdauungshormone" aus dem Darm übermitteln Information an
andere Stellen des GI-Systems sowie an das Zentralnervensystem Das Darmnervensystem verwaltet lokale Reflexe (z.B. die
Peristaltik), steuert Sekretion und Motorik und steht mit dem
restlichen Nervensystem in reziproker Verbindung
Das Darmnervensystem verwaltet lokale Reflexe (z.B. die
Peristaltik), steuert Sekretion und Motorik und steht mit dem
restlichen Nervensystem in reziproker Verbindung Das Immunsystem
des Darms ist ein Zentrum der mikrobiologischen Prüfung, angeborenen und
adaptiven Abwehr, aber auch Mäßigung (Verhinderung überschießender
Immunreaktionen z.B. auf Nahrungsmittelkomponenten).
Das Immunsystem
des Darms ist ein Zentrum der mikrobiologischen Prüfung, angeborenen und
adaptiven Abwehr, aber auch Mäßigung (Verhinderung überschießender
Immunreaktionen z.B. auf Nahrungsmittelkomponenten). Das
Verdauungssystem weist die größte Ansammlung an lymphoidem Gewebe im
Körper auf - wegen seiner enormen Kontaktfläche zur Außenwelt und der
Notwendigkeit, Pathogene wirksam zu bekämpfen.
Das
Verdauungssystem weist die größte Ansammlung an lymphoidem Gewebe im
Körper auf - wegen seiner enormen Kontaktfläche zur Außenwelt und der
Notwendigkeit, Pathogene wirksam zu bekämpfen. Durchmischung und Weiterbewegung des Darminhalts
Durchmischung und Weiterbewegung des Darminhalts Sekretion (Gleitfähigkeit, Schutz der Schleimhaut, Resorptionshilfe)
Sekretion (Gleitfähigkeit, Schutz der Schleimhaut, Resorptionshilfe) Immunologische Funktionen
Immunologische Funktionen  Aufschließung (Ansäuerung), Pufferung
Aufschließung (Ansäuerung), Pufferung Chemosensitivität: Analyse der Zusammensetzung des Chymus (Speisebreis) mittels Rezeptoren
Chemosensitivität: Analyse der Zusammensetzung des Chymus (Speisebreis) mittels Rezeptoren Bildung von Mediatorstoffen und Hormonen
Bildung von Mediatorstoffen und Hormonen Kreislaufwirksamkeit (Blutspeicherung)
Kreislaufwirksamkeit (Blutspeicherung)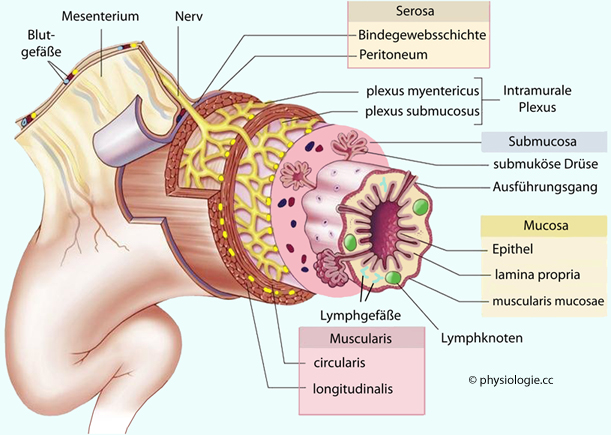
 Abbildung: Aufbau der Darmwand
Abbildung: Aufbau der Darmwand
 Auf der luminalen Seite des Darms liegt die Mucosa; auf der Gegenseite die (mit Peritonealepithel ausgekleidete) Serosa, die möglichst widerstandsfreie Beweglichkeit im Bauchraum erlauben soll. Auf der luminalen Seite der Mucosaepithelzellen liegt deren apikale
Membran (die Stoffe aus dem Darmlumen resorbiert und zur
Oberflächenvergrößerung einen Bürstensaum aufweist), auf der blutnahen
Seite die basolaterale Membran.
Auf der luminalen Seite des Darms liegt die Mucosa; auf der Gegenseite die (mit Peritonealepithel ausgekleidete) Serosa, die möglichst widerstandsfreie Beweglichkeit im Bauchraum erlauben soll. Auf der luminalen Seite der Mucosaepithelzellen liegt deren apikale
Membran (die Stoffe aus dem Darmlumen resorbiert und zur
Oberflächenvergrößerung einen Bürstensaum aufweist), auf der blutnahen
Seite die basolaterale Membran. Nährstoffe (nutrients) sind organische und anorganische Moleküle, welche Wachstum und Überleben des Organismus sichern. Man teilt sie ein in Wasser, Makronährstoffe (Kohlenhydrate, Lipide, Proteine), Mineralien, Vitamine und Spurenelemente. Benötigt werden Nährstoffe für drei Hauptzwecke:
Nährstoffe (nutrients) sind organische und anorganische Moleküle, welche Wachstum und Überleben des Organismus sichern. Man teilt sie ein in Wasser, Makronährstoffe (Kohlenhydrate, Lipide, Proteine), Mineralien, Vitamine und Spurenelemente. Benötigt werden Nährstoffe für drei Hauptzwecke:  Energieversorgung,
Energieversorgung,  Bausteine für Synthese,
Bausteine für Synthese,  Unterstützung des Metabolismus (Stoffwechsels).
Unterstützung des Metabolismus (Stoffwechsels). Recommended Dietary (Daily) Allowances (RDA) / Adequate Intake (AI),
das ist der (nach aktuellem Stand der Wissenschaft) für 98% aller
gesunden Menschen (einer bestimmten Alters- bzw. Geschlechtsgruppe) als
ausreichend angesehene tägliche Bedarf an essentiellen Nährstoffen.
Recommended Dietary (Daily) Allowances (RDA) / Adequate Intake (AI),
das ist der (nach aktuellem Stand der Wissenschaft) für 98% aller
gesunden Menschen (einer bestimmten Alters- bzw. Geschlechtsgruppe) als
ausreichend angesehene tägliche Bedarf an essentiellen Nährstoffen. Tolerable upper intake levels (UL), die Obergrenze der als noch nicht gesundheitsschädlich angesehenen täglichen Zufuhr.
Tolerable upper intake levels (UL), die Obergrenze der als noch nicht gesundheitsschädlich angesehenen täglichen Zufuhr. Estimated average requirement (EAR), der
(nach
aktuellem Stand der Wissenschaft) für 50% aller gesunden Menschen einer
bestimmten Alters- bzw. Geschlechtsgruppe als ausreichend
angesehene tägliche Bedarf an essentiellen Nährstoffen.
Estimated average requirement (EAR), der
(nach
aktuellem Stand der Wissenschaft) für 50% aller gesunden Menschen einer
bestimmten Alters- bzw. Geschlechtsgruppe als ausreichend
angesehene tägliche Bedarf an essentiellen Nährstoffen. Über Transportsysteme s. dort
Über Transportsysteme s. dort Über die Polarität epithelialer Zellen (apikale vs. basolaterale Membran) s. dort
Über die Polarität epithelialer Zellen (apikale vs. basolaterale Membran) s. dort
 Abbildung: Darmoberfläche
Abbildung: Darmoberfläche
 Unter Assimilation versteht man die Gesamtheit der digestiven (aufschließenden) und absorptiven / resorptiven Vorgänge im Darm. Sie kann in vier konsekutive Mechanismen untergliedert werden:
Unter Assimilation versteht man die Gesamtheit der digestiven (aufschließenden) und absorptiven / resorptiven Vorgänge im Darm. Sie kann in vier konsekutive Mechanismen untergliedert werden: Intraluminale
Intraluminale
 Phase (lumen: Innenraum von Hohlorganen) -
Verdauung im Darmrohr, insbesondere durch pankreatische Enzyme
Phase (lumen: Innenraum von Hohlorganen) -
Verdauung im Darmrohr, insbesondere durch pankreatische Enzyme Bürstensaumphase - Stoffe werden im Bereich der Mikrovilli weiter abgebaut, um apikal resorbiert werden zu können
Bürstensaumphase - Stoffe werden im Bereich der Mikrovilli weiter abgebaut, um apikal resorbiert werden zu können Intrazelluläre Phase - weitere Spaltung, z.B. von di- bis polymeren Molekülen, in der Mukosazelle, sowie Transport durch die Zelle
Intrazelluläre Phase - weitere Spaltung, z.B. von di- bis polymeren Molekülen, in der Mukosazelle, sowie Transport durch die Zelle Basolateralmembranphase - dient dem Transport durch die basolaterale Membran zu Pfortader und Lymphgefäßen (teils energieverbrauchend).
Basolateralmembranphase - dient dem Transport durch die basolaterale Membran zu Pfortader und Lymphgefäßen (teils energieverbrauchend).| Verweildauer des Chymus |
|||
| Ösophagus |
Magen |
Dünndarm |
Dickdarm |
| ~10 Sekunden |
bis zu 3 h |
bis zu 7 h |
bis zu 70 h |

 Abbildung: Apikale und basolaterale Transportsysteme in einer Mucosazelle des Ileums
Abbildung: Apikale und basolaterale Transportsysteme in einer Mucosazelle des Ileums  vgl. dort
vgl. dort BA = Gallensäure (Anion)
BA = Gallensäure (Anion)  CA = Carboanhydrase
CA = Carboanhydrase  G = Glucose / Galactose
G = Glucose / Galactose  OP = Oligopeptid
OP = Oligopeptid
 Die Oberfläche, die der Resorption zur Verfügung steht, würde bei einem glatten Darmrohr nur etwa 1/3 m2 betragen (
Die Oberfläche, die der Resorption zur Verfügung steht, würde bei einem glatten Darmrohr nur etwa 1/3 m2 betragen ( s. auch dort). Durch die makroskopischen Aufstülpungen der Kerckring-Falten
s. auch dort). Durch die makroskopischen Aufstülpungen der Kerckring-Falten  sowie Einfaltungen nach innen (Lieberkühn'sche Krypten) (
sowie Einfaltungen nach innen (Lieberkühn'sche Krypten) ( Abbildung unten) nimmt die Oberfläche um das Dreifache auf 1 m2 zu. Eine weitere Verzehnfachung - auf ~10 m2 - erfolgt durch die ca. 1 (0,5-1,6) mm langen Darmzotten (villi intestinales).
Abbildung unten) nimmt die Oberfläche um das Dreifache auf 1 m2 zu. Eine weitere Verzehnfachung - auf ~10 m2 - erfolgt durch die ca. 1 (0,5-1,6) mm langen Darmzotten (villi intestinales).| Oberflächenvergrößerung um den Faktor |
|
| Kerckring-Falten |
3-4 |
| Villi intestinales |
6-10 |
| Mikrovilli |
20-30 |
 Abbildung); dieser Vorgang dauert 2-5 Tage (innerhalb dieser Zeit erneuert sich der gesamte villöse Epithelbesatz). Dabei spielt Glutamin als Stickstoffquelle für die Synthese von Nukleinbasen eine wichtige Rolle.
Abbildung); dieser Vorgang dauert 2-5 Tage (innerhalb dieser Zeit erneuert sich der gesamte villöse Epithelbesatz). Dabei spielt Glutamin als Stickstoffquelle für die Synthese von Nukleinbasen eine wichtige Rolle.
 Abbildung: Erneuerung von Enterozyten
Abbildung: Erneuerung von Enterozyten
 Zur Darmflora s. auch dort
Zur Darmflora s. auch dort
 Abbildung: Intestinales Immunsystem
Abbildung: Intestinales Immunsystem Abbildung unten). Die Schleimbildung der Becherzellen
wird durch Acetylcholin angeregt.
Abbildung unten). Die Schleimbildung der Becherzellen
wird durch Acetylcholin angeregt.
 im Rachenraum als Waldeyer-Ring
im Rachenraum als Waldeyer-Ring
 (lymphatischer Rachenring - die Gesamtheit der Mandeln im
Hals-Rachen-Bereich): Rachenmandeln, Tubenmandeln (Eustachi-Röhre),
Gaumenmandeln (Tonsillen), Zungenmandeln
(lymphatischer Rachenring - die Gesamtheit der Mandeln im
Hals-Rachen-Bereich): Rachenmandeln, Tubenmandeln (Eustachi-Röhre),
Gaumenmandeln (Tonsillen), Zungenmandeln im Dünndarm (Peyer'sche Plaques) und
im Dünndarm (Peyer'sche Plaques) und  im Dickdarm
(Appendix).
im Dickdarm
(Appendix).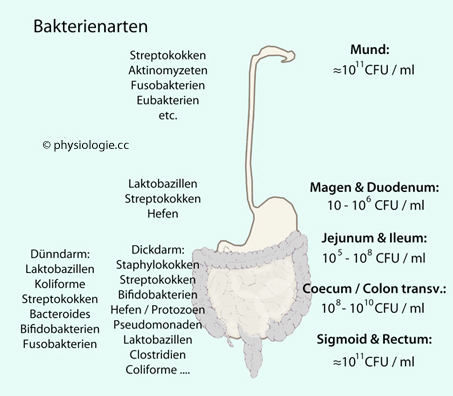
 Abbildung: Häufigkeit und Arten von Mikroorganismen im Gastrointestinaltrakt
Abbildung: Häufigkeit und Arten von Mikroorganismen im Gastrointestinaltrakt

 Abbildung) Die
Magensäure tötet die meisten Bakterien ab, sodass der Inhalt praktisch
steril ist; normalerweise findet man im Magen ~1 vitale Bakterie / g
Chymus (Helikobakter, Laktobacillus). Die Zahlen steigen nach peripher
enorm an: Duodenum, 103/g; Jejunum, 104/g; Ileum, 107/g; Colon, 1012/g. Auch die Art der beteiligten Bakterien unterscheidet sich je nach Darmabschnitt.
Abbildung) Die
Magensäure tötet die meisten Bakterien ab, sodass der Inhalt praktisch
steril ist; normalerweise findet man im Magen ~1 vitale Bakterie / g
Chymus (Helikobakter, Laktobacillus). Die Zahlen steigen nach peripher
enorm an: Duodenum, 103/g; Jejunum, 104/g; Ileum, 107/g; Colon, 1012/g. Auch die Art der beteiligten Bakterien unterscheidet sich je nach Darmabschnitt. ,
beteiligen sich an Schutz und Integrität der Darmschleimhaut.
Dazu zählen antimikrobielle Proteine, die sich u.a. in den Krypten ansammeln. Infektionsschützend wirken sekretorische
Antikörper (Klasse IgA)
und unspezifische Schutzfaktoren, u.a. eine muköse Auskleidung der
Darmschleimhaut. Der niedrige pH-Wert im Magen tut das seine.
Überreaktionen werden durch eine Art Allergieschutz des
darmassoziierten Gewebes (GALT) vermieden.
,
beteiligen sich an Schutz und Integrität der Darmschleimhaut.
Dazu zählen antimikrobielle Proteine, die sich u.a. in den Krypten ansammeln. Infektionsschützend wirken sekretorische
Antikörper (Klasse IgA)
und unspezifische Schutzfaktoren, u.a. eine muköse Auskleidung der
Darmschleimhaut. Der niedrige pH-Wert im Magen tut das seine.
Überreaktionen werden durch eine Art Allergieschutz des
darmassoziierten Gewebes (GALT) vermieden.
 Abbildung:
Schleimhaut- Immunsystem im Darm des Menschen
Abbildung:
Schleimhaut- Immunsystem im Darm des Menschen B, B-Lymphozyt
B, B-Lymphozyt  DC, dendritische
Zelle
DC, dendritische
Zelle  FDC, follikuläre dendritische Zelle
FDC, follikuläre dendritische Zelle  HEV, hochendotheliale
Venole
HEV, hochendotheliale
Venole  J, J-Kette
J, J-Kette  M, M-Zelle
M, M-Zelle  MALT, Mukosa-assoziiertes lymphatisches Gewebe (tissue)
MALT, Mukosa-assoziiertes lymphatisches Gewebe (tissue)  mSC, membranständige sekretorische Komponente
mSC, membranständige sekretorische Komponente  pIgR, polymerer Ig-Rezeptor
pIgR, polymerer Ig-Rezeptor
 sIgA,
sekretorisches IgA
sIgA,
sekretorisches IgA  sIgM, sekretorisches IgM
sIgM, sekretorisches IgM  T, T-Lymphozyt
T, T-Lymphozyt
 Schleimproduzierende Becherzellen an der Spitze der Darmzotten. Diese produzieren stark glykosylierte Proteine (Mucine),
die als Bestandteil des Schleims (Mukus) Mikroben vom Kontakt mit dem
Epithel fernhalten. Mucine werden auch von submukösen Drüsen
sezerniert.
Schleimproduzierende Becherzellen an der Spitze der Darmzotten. Diese produzieren stark glykosylierte Proteine (Mucine),
die als Bestandteil des Schleims (Mukus) Mikroben vom Kontakt mit dem
Epithel fernhalten. Mucine werden auch von submukösen Drüsen
sezerniert. 
 Abbildung: Lieberkühn´sche Krypte (bis 0,4 mm tief) mit Paneth´schen Körnerzellen
Abbildung: Lieberkühn´sche Krypte (bis 0,4 mm tief) mit Paneth´schen Körnerzellen
 In der Tiefe der Krypten
In der Tiefe der Krypten  sitzen Paneth'sche Körnerzellen
sitzen Paneth'sche Körnerzellen  (
( Abbildung). Sie bilden Abwehrpeptide, die Bakterien, Pilze, Spirochäten
und einige Viren abtöten (breitband-antibiotische Wirkung):
Abbildung). Sie bilden Abwehrpeptide, die Bakterien, Pilze, Spirochäten
und einige Viren abtöten (breitband-antibiotische Wirkung): Defensine (α- und β-HD - human defensins - Paneth-Zell-Defensine heißen auch Crypticidine), diese stammen aus Dünn- und Dickdarm und diversen Zellen auch außerhalb des Darmes: Epithelien (Haut, Lunge), Granulozyten, NK-Zellen, zytotoxische T-Lymphozyten.
Defensine wirken direkt gegen Bakterien, Pilze und hüllentragende Viren
(Angriff gegen Membrankomponenten) und regen Entzündungsvorgänge an.
Defensine (α- und β-HD - human defensins - Paneth-Zell-Defensine heißen auch Crypticidine), diese stammen aus Dünn- und Dickdarm und diversen Zellen auch außerhalb des Darmes: Epithelien (Haut, Lunge), Granulozyten, NK-Zellen, zytotoxische T-Lymphozyten.
Defensine wirken direkt gegen Bakterien, Pilze und hüllentragende Viren
(Angriff gegen Membrankomponenten) und regen Entzündungsvorgänge an. Lactoferrin,
Lactoferrin,  Lysozyme,
Lysozyme,  IgA,
IgA,  Peptidasen wie Trypsin, diese verstärken z.B. die Wirkung von Defensinen.
Peptidasen wie Trypsin, diese verstärken z.B. die Wirkung von Defensinen. M-Zellen
M-Zellen  (Microfold cells)
auf der Oberfläche domförmiger Mukosaerhebungen über Peyer'schen
Plaques (
(Microfold cells)
auf der Oberfläche domförmiger Mukosaerhebungen über Peyer'schen
Plaques ( Abbildung
oben) "sammeln" Moleküle und Mikroorganismen (die an
entsprechende
Rezeptoren binden und damit immunologisch "interessant" sind) aus dem
Darm ein und transportieren sie mittels
Endosomen zu ihrer nicht-luminalen (basolateralen) Zelloberfläche, um
sie an hier wartende Immunzellen zu "übergeben". Lymphozyten können diese Epitope von dendritischen Zellen
präsentiert bekommen.
Abbildung
oben) "sammeln" Moleküle und Mikroorganismen (die an
entsprechende
Rezeptoren binden und damit immunologisch "interessant" sind) aus dem
Darm ein und transportieren sie mittels
Endosomen zu ihrer nicht-luminalen (basolateralen) Zelloberfläche, um
sie an hier wartende Immunzellen zu "übergeben". Lymphozyten können diese Epitope von dendritischen Zellen
präsentiert bekommen. Die Epithelzellen der Darmschleimhaut (Mukosa) exprimieren verschiedene Rezeptoren
(Toll-like Rezeptoren in der Zellmembran, NOD-like Rezeptoren im
Zytoplasma) zur Erkennung von PAMPs. Werden solche Rezeptoren
aktiviert, löst das einerseits Immunantworten (antiviral,
inflammatorisch) gegen Pathogene aus, andererseits begrenzt es
Reaktionen auf harmlose Mikroben (Kommensalen). Epithelzellen können
bei Mikrobenkontakt oder Verletzung Zytokine sezernieren, die auch als Alarmine bezeichnet werden und angeborene Immunabwehr aktivieren.
Die Epithelzellen der Darmschleimhaut (Mukosa) exprimieren verschiedene Rezeptoren
(Toll-like Rezeptoren in der Zellmembran, NOD-like Rezeptoren im
Zytoplasma) zur Erkennung von PAMPs. Werden solche Rezeptoren
aktiviert, löst das einerseits Immunantworten (antiviral,
inflammatorisch) gegen Pathogene aus, andererseits begrenzt es
Reaktionen auf harmlose Mikroben (Kommensalen). Epithelzellen können
bei Mikrobenkontakt oder Verletzung Zytokine sezernieren, die auch als Alarmine bezeichnet werden und angeborene Immunabwehr aktivieren. selbst, und/oder in
tributären Lymphknoten. Der Darm enthält ~30.000 solitäre
Lymphfollikel (sie finden sich auch im gesamten Dickdarm). Im Darm befinden sich ~200 Peyer-Plaques, sie gehören zum sekundären lymphatischen Gewebe und finden sich vor allem im
distalen Ileum. Peyer-Plaques
enthalten zwischen 5 und 200 aggregierte
Lymphfollikel.
selbst, und/oder in
tributären Lymphknoten. Der Darm enthält ~30.000 solitäre
Lymphfollikel (sie finden sich auch im gesamten Dickdarm). Im Darm befinden sich ~200 Peyer-Plaques, sie gehören zum sekundären lymphatischen Gewebe und finden sich vor allem im
distalen Ileum. Peyer-Plaques
enthalten zwischen 5 und 200 aggregierte
Lymphfollikel. Unter Peyer'schen Plaques (Peyer's patches) versteht
man lymphatisches Gewebe in der lamina propria des Dünndarms, das
ähnlich wie Lymphknoten follikulär organisiert ist. Hier können
Immunreaktionen gegen Antigene / Pathogene im Darm starten.
Peyer-Plaques beinhalten vor allem B-Zellen. Diese werden nach
Selektion zu Plasmazellen, die vor allem große Mengen an IgA
produzieren.
Unter Peyer'schen Plaques (Peyer's patches) versteht
man lymphatisches Gewebe in der lamina propria des Dünndarms, das
ähnlich wie Lymphknoten follikulär organisiert ist. Hier können
Immunreaktionen gegen Antigene / Pathogene im Darm starten.
Peyer-Plaques beinhalten vor allem B-Zellen. Diese werden nach
Selektion zu Plasmazellen, die vor allem große Mengen an IgA
produzieren.
 Abbildung: Durchblutungsgrößen (erwachsene Person) im Splanchnikusgebiet
Abbildung: Durchblutungsgrößen (erwachsene Person) im Splanchnikusgebiet
 Abbildung gezeigten Organen.
Abbildung gezeigten Organen.  Reaktionslage) kommt es zu Vasokonstriktion und damit zu
verminderter Durchblutung und (druckpassiv) Entspeicherung von Blut aus
venösen Gefäßnetzen - Blut wird mobilisiert, der venöse Rückstrom verbessert und die Vorlast des Herzens erhöht, was Herzminutenvolumen und arteriellen Druck zu stabilisieren hilft.
Reaktionslage) kommt es zu Vasokonstriktion und damit zu
verminderter Durchblutung und (druckpassiv) Entspeicherung von Blut aus
venösen Gefäßnetzen - Blut wird mobilisiert, der venöse Rückstrom verbessert und die Vorlast des Herzens erhöht, was Herzminutenvolumen und arteriellen Druck zu stabilisieren hilft. Abbildung).
Abbildung). 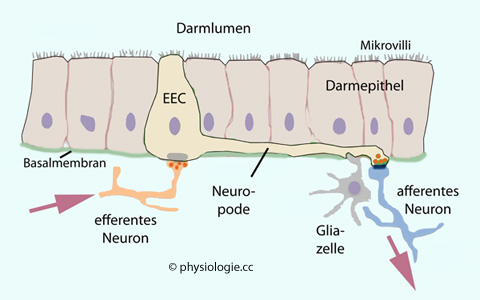
 Abbildung: Verbindung einer enteroendokrinen Zelle
Abbildung: Verbindung einer enteroendokrinen Zelle
 erreichen sie zahlreiche Nachbarzellen ganz unmittelbar (parakrine Wirkungen),
erreichen sie zahlreiche Nachbarzellen ganz unmittelbar (parakrine Wirkungen),  können Impulse (Information über die Situation im Darmlumen) an afferente
Nervenfasern übermitteln,
können Impulse (Information über die Situation im Darmlumen) an afferente
Nervenfasern übermitteln, Signale
efferenter (parasympathischer) Nerven empfangen,
Signale
efferenter (parasympathischer) Nerven empfangen,  endokrine Information in die Blutbahn senden.
endokrine Information in die Blutbahn senden.

 Cholecystokinin
Cholecystokinin  Glucagon
Glucagon  GLP
GLP  VIP
VIP  GIP
GIP Ghrelin
Ghrelin Cortistatine
Cortistatine  Oxyntomodulin
Oxyntomodulin  PYY
PYY  PP
PP Peptide aus Schleimhautepithelien (meist in zwei oder mehr molekularen Formen) und
Peptide aus Schleimhautepithelien (meist in zwei oder mehr molekularen Formen) und  einige Neurokrine (von intestinalen Nervenzellen freigesetzte Signalstoffe).
einige Neurokrine (von intestinalen Nervenzellen freigesetzte Signalstoffe). Hormonelle Reizantworten im Verdauungssystem Nach Johnson: Gastrointestinal Physiology, 9th ed., Mosby 2019 |
|||||
| Reiz |
Hormon |
||||
| Gastrin |
CCK |
Sekretin |
GIP |
Motilin |
|
| Proteine / Aminosäuren |
+ |
+ |
0 |
+ | 0 |
| Fette / Fettsäuren |
0 |
+ | + |
+ | + |
| Kohlenhydrate |
0 |
0 |
0 |
+ | 0 |
| Säure |
- |
+ |
+ | 0 |
+ |
| Dehnung |
+ | 0 |
0 |
0 |
0 |
| neuronale Aktivität |
+ | 0 |
0 |
0 |
+ |
 Abbildung) machen zusammengenommen
die größte endokrin aktive Masse des Körpers aus. Sie erzeugen "Verdauungshormone", die auf Motilität und Sekretion in
Magen, Darm, Pankreas, Leber und Gallenblase, und auch auf andere Gewebe, z.B. das Gehirn,
einwirken.
Abbildung) machen zusammengenommen
die größte endokrin aktive Masse des Körpers aus. Sie erzeugen "Verdauungshormone", die auf Motilität und Sekretion in
Magen, Darm, Pankreas, Leber und Gallenblase, und auch auf andere Gewebe, z.B. das Gehirn,
einwirken. 
 Abbildung: Gastrointestinale Hormone: Bildungsorte und Wirkungen
Abbildung: Gastrointestinale Hormone: Bildungsorte und Wirkungen
 Zahlreiche Verdauungshormone sind identisch mit Transmittern, die im
Gehirn, peripheren Nervensystem, auch in anderen Geweben vorkommen.
Agonisten / Antagonisten können daher sehr weitreichende
(Neben-)Wirkungen haben, u.a. abhängig von ihrem Verhalten an der Blut-Hirn-Schranke.
Zahlreiche Verdauungshormone sind identisch mit Transmittern, die im
Gehirn, peripheren Nervensystem, auch in anderen Geweben vorkommen.
Agonisten / Antagonisten können daher sehr weitreichende
(Neben-)Wirkungen haben, u.a. abhängig von ihrem Verhalten an der Blut-Hirn-Schranke. Abbildung unten):
Abbildung unten): Die meisten sind gegen die Schleimhautoberfläche "offen" (open enteroendocrine cells),
können also an ihrem apikalen Ende - mittels Rezeptoren und
Ionenkanälen - Stoffkonzentrationen im Darmlumen registrieren und
entsprechend (endokrin) reagieren - z.B. auf pH, Aminosäuren oder
Fettsäuren. Sekretagoge Stoffe regen diese Zellen an.
Die meisten sind gegen die Schleimhautoberfläche "offen" (open enteroendocrine cells),
können also an ihrem apikalen Ende - mittels Rezeptoren und
Ionenkanälen - Stoffkonzentrationen im Darmlumen registrieren und
entsprechend (endokrin) reagieren - z.B. auf pH, Aminosäuren oder
Fettsäuren. Sekretagoge Stoffe regen diese Zellen an. Andere erstrecken sich nicht bis zum Darmlumen, sie sind "geschlossen" (closed enteroendocrine cells); ihre Aktivität wird parakrin, neuronal oder endokrin reguliert.
Andere erstrecken sich nicht bis zum Darmlumen, sie sind "geschlossen" (closed enteroendocrine cells); ihre Aktivität wird parakrin, neuronal oder endokrin reguliert. 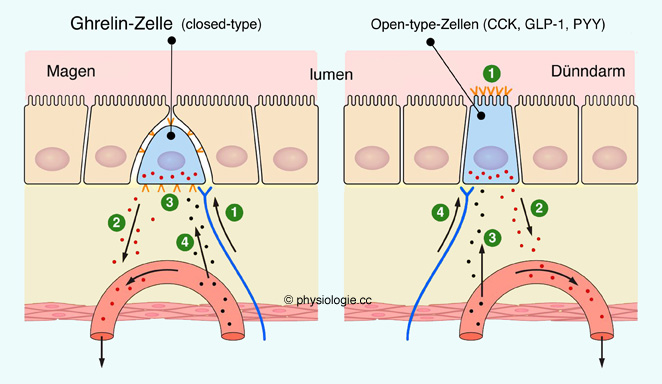
 Abbildung: Lage und Funktionsweise enteroendokriner Zellen (blau)
Abbildung: Lage und Funktionsweise enteroendokriner Zellen (blau)






 Peptidhormone im gastrointestinalen System  Nach Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021 |
|||
| Hormon |
Quelle |
Ziel |
Hauptwirkung |
| Cholecysto- kinin |
I-Zellen in Duodenum und Jejunum, Neurone in Ileum und Colon |
Pankreas Gallenblase |
Anregung von Enzym- sekretion und Kontraktion |
| GIP |
K-Zellen in Duodenum und Jejunum |
Pankreas |
Hemmung Flüssigkeits- resorption Anregung Insulin- freisetzung |
| Gastrin |
G-Zellen in Magenantrum |
Belegzellen in Magen- schleimhaut |
Sekretion von H+ |
| Gastrin- releasing peptide * |
Nervenfasern (Vagus) |
G-Zellen in Magenantrum |
Förderung der Gastrin- freisetzung |
| Guanylin * |
Ileum und Colon |
Dünn- und Dickdarm |
Steigerung der Flüssigkeits- resorption |
| Motilin |
Endokrine Zellen im oberen Verdauungs- trakt |
Ösophagus- sphincter Magen Duodenum |
Anregung glattmuskulärer Kontraktionen |
| Neurotensin * |
Endokrine Zellen im Gastrointestinal- trakt |
Glatter intestinaler Muskel |
Vasoaktive Anregung der Histamin- freisetzung |
| Peptid YY |
Endokrine Zellen in Ileum und Jejunum |
Magen Pankreas |
Hemmung vagal angeregter Säureproduktion Sekretion von Enzymen und Flüssigkeit |
| Sekretin |
S-Zellen im Dünndarm |
Pankreas Magen |
Anregung der Bicarbonat- und Flüssigkeits- produktion der Ausführungs- gänge Hemmung der Säure- produktion |
| Somatostatin |
D-Zellen in Magen und Duodenum, ∂-Zellen in Pankreas |
Magen Darm Pankreas Leber |
Inhibition Gastrin- freisetzung Steigerung Flüssigkeits- resorption, Hemmung Sekretion, Kontraktion glatte Muskulatur Hemmung Sekretion endokrin / exokrin Reduktion Gallenfluss |
| Substanz P |
enterische Neurone |
enterische Neurone | Neuro- transmitter |
| VIP |
enterische Neurone |
Dünndarm Pankreas |
Glattmuskuläre Relaxation, Steigerung Sekretion Steigerung Sekretion |
 Präprogastrin ist das primäre Transkript. Durch Sulfatierung und Enteroproteolyse entstehen
Präprogastrin ist das primäre Transkript. Durch Sulfatierung und Enteroproteolyse entstehen Progastrine, die weiterer Endoproteolyse, sowie Ringbildung zu einem Pyroglutamylrest unterliegen;
Progastrine, die weiterer Endoproteolyse, sowie Ringbildung zu einem Pyroglutamylrest unterliegen; Gastrin-Zwischenformen (Intermediate) entstehen, und nach weiteren molekularen Modifikationen schließlich
Gastrin-Zwischenformen (Intermediate) entstehen, und nach weiteren molekularen Modifikationen schließlich Gastrin, das (aus 17 Aminosäuren bestehend) biologisch aktiv (G-17) und
vor Angriff durch zirkulierende Amino- und Carboxypeptidasen geschützt
ist.
Gastrin, das (aus 17 Aminosäuren bestehend) biologisch aktiv (G-17) und
vor Angriff durch zirkulierende Amino- und Carboxypeptidasen geschützt
ist. regt über den CCK-2-Rezeptor (Gastrinrezeptor)
an Belegzellen die Säureproduktion und
regt über den CCK-2-Rezeptor (Gastrinrezeptor)
an Belegzellen die Säureproduktion und
 an Hauptzellen die Produktion von Pepsinogen an,
an Hauptzellen die Produktion von Pepsinogen an,  stärkt die Kontraktionswellen im Antrum und
stärkt die Kontraktionswellen im Antrum und
 erhöht den
Tonus des Kardiasphinkters (glatte Muskelzellen).
erhöht den
Tonus des Kardiasphinkters (glatte Muskelzellen). 
 Abbildung: Verteilung enteroendokriner Zellen auf Magen, Dünn- und Dickdarm
Abbildung: Verteilung enteroendokriner Zellen auf Magen, Dünn- und Dickdarm neuronal (parasympathische Fasern sezernieren neben Acetylcholin auch das Neuropeptid gastrin-releasing peptide GRP) und direkt durch Aminosäuren / kleine Peptide (als Produkte partieller Proteinverdauung), Milch sowie Calciumsalze angeregt,
neuronal (parasympathische Fasern sezernieren neben Acetylcholin auch das Neuropeptid gastrin-releasing peptide GRP) und direkt durch Aminosäuren / kleine Peptide (als Produkte partieller Proteinverdauung), Milch sowie Calciumsalze angeregt, durch niedrigen pH-Wert im Magen (<3,0) und endokrin (Somatostatin, Sekretin, GIP, VIP, Glucagon, Calcitonin) gehemmt.
durch niedrigen pH-Wert im Magen (<3,0) und endokrin (Somatostatin, Sekretin, GIP, VIP, Glucagon, Calcitonin) gehemmt. s. dort).
s. dort). Bestandteile des
Chymus, die infolge der CCK-Wirkung verdaut werden (Peptide, Aminosäuren, Fettsäuren) sowie niedriger
pH-Wert regen seine Produktion an. Vor allem wirken langkettige Fettsäuren und Monoglyzeride anregend auf die CCK-Sekretion.
Bestandteile des
Chymus, die infolge der CCK-Wirkung verdaut werden (Peptide, Aminosäuren, Fettsäuren) sowie niedriger
pH-Wert regen seine Produktion an. Vor allem wirken langkettige Fettsäuren und Monoglyzeride anregend auf die CCK-Sekretion.  Trypsin im Darm hemmt die
CCK-Freisetzung, Plasma-CCK-Spiegel und Trypsinsekretion sinken
(negative Rückkopplung).
Trypsin im Darm hemmt die
CCK-Freisetzung, Plasma-CCK-Spiegel und Trypsinsekretion sinken
(negative Rückkopplung). 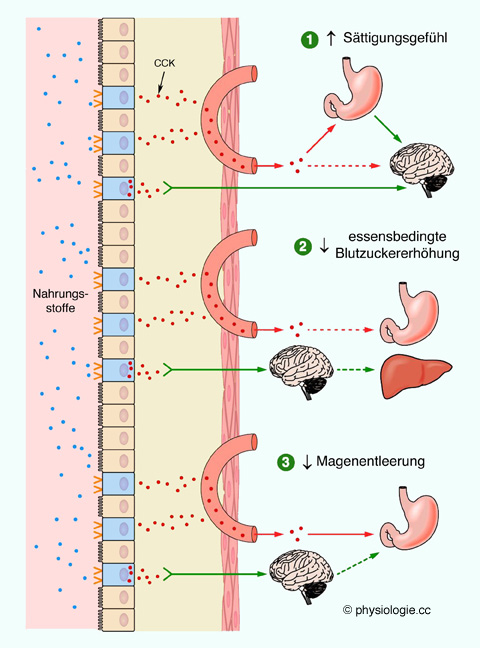
 Abbildung: Physiologie des CCK
Abbildung: Physiologie des CCK
 Abbildung): Cholecystokinin
Abbildung): Cholecystokinin verlangsamt die Magenentleerung - dadurch gewinnen die Verdauungsvorgänge im
Duodenum (insbesondere die Fettverdauung) Zeit - und reduziert die Salzsäureproduktion im Magen, indem es Gastrin vom CCKB-Rezeptor kompetitiv verdrängt
verlangsamt die Magenentleerung - dadurch gewinnen die Verdauungsvorgänge im
Duodenum (insbesondere die Fettverdauung) Zeit - und reduziert die Salzsäureproduktion im Magen, indem es Gastrin vom CCKB-Rezeptor kompetitiv verdrängt regt die Gallenblase (Fettemulsion durch gallensaure Salze) zur Kontraktion an (daher der Name
regt die Gallenblase (Fettemulsion durch gallensaure Salze) zur Kontraktion an (daher der Name ) - sowohl durch direkten Einfluss auf die Gallenblasenmuskulatur, als auch indirekt über Aktivierung parasympathischer (N. X) Nervenfasern
) - sowohl durch direkten Einfluss auf die Gallenblasenmuskulatur, als auch indirekt über Aktivierung parasympathischer (N. X) Nervenfasern regt die Enzymsekretion in der Bauchspeicheldrüse an (enzymatischer Abbau, daher der Name "Pankreozymin") und fördert ihr Wachstum
regt die Enzymsekretion in der Bauchspeicheldrüse an (enzymatischer Abbau, daher der Name "Pankreozymin") und fördert ihr Wachstum relaxiert den Sphincter Oddi (ampulla hepatopancreatica), wahrscheinlich über inhibitorische Neurotransmitter (NO)
relaxiert den Sphincter Oddi (ampulla hepatopancreatica), wahrscheinlich über inhibitorische Neurotransmitter (NO) regt die Darmmotorik
an - das stellt sicher, dass Gallensäuren ihre Emulgatorwirkung voll
ausspielen können und die Lipide am Bürstensaum der Mucosa guten Zugang
zur resorbierenden Zellmembran erhalten
regt die Darmmotorik
an - das stellt sicher, dass Gallensäuren ihre Emulgatorwirkung voll
ausspielen können und die Lipide am Bürstensaum der Mucosa guten Zugang
zur resorbierenden Zellmembran erhalten verstärkt die Wirkung von Sekretin (Anregung der Bicarbonatsekretion auch bei niedrigen Sekretinspiegeln)
verstärkt die Wirkung von Sekretin (Anregung der Bicarbonatsekretion auch bei niedrigen Sekretinspiegeln)| Cholecystokinin wird im oberen Dünndarm gebildet und regt die Sekretion eines enzymreichen Pankreassaftes an |
 CCK gehört zu den Verdauungshormonen, die auch außerhalb des
gastrointestinalen Systems wirksam sind: Es wird in mehreren
Gehirnregionen gebildet und beteiligt sich an der Regulierung von Nahrungsaufnahme (Sättigungssignal) und
Energiehaushalt.
CCK gehört zu den Verdauungshormonen, die auch außerhalb des
gastrointestinalen Systems wirksam sind: Es wird in mehreren
Gehirnregionen gebildet und beteiligt sich an der Regulierung von Nahrungsaufnahme (Sättigungssignal) und
Energiehaushalt. 
 In den ersten Jahren des 20. Jahrhunderts entdeckten und beschrieben die britischen Physiologen Ernest H. Starling und William M. Bayliss
das Sekretin und prägten den Begriff "Hormon" (von ὁρμᾶν = antreiben).
1902 untersuchten sie, inwieweit das Nervensystem Digestionsvorgänge
steuert. Durchtrennung sämtlicher Nerven zum Pankreas resultierte nicht in einem Ausfall seiner physiologischen Regulation, woraus die Bedeutung endokriner Steuerung ("Verdauungshormone") ersichtlich wurde.
In den ersten Jahren des 20. Jahrhunderts entdeckten und beschrieben die britischen Physiologen Ernest H. Starling und William M. Bayliss
das Sekretin und prägten den Begriff "Hormon" (von ὁρμᾶν = antreiben).
1902 untersuchten sie, inwieweit das Nervensystem Digestionsvorgänge
steuert. Durchtrennung sämtlicher Nerven zum Pankreas resultierte nicht in einem Ausfall seiner physiologischen Regulation, woraus die Bedeutung endokriner Steuerung ("Verdauungshormone") ersichtlich wurde. Sekretin (Nüchternplasma)
Sekretin (Nüchternplasma)
 Über Sekretin s. auch dort
Über Sekretin s. auch dort Abbildung oben) 5-30 Minuten nach Nahrungsaufnahme freigesetzt,
angeregt durch freie Fettsäuren und Glucose im Jejunum, teils über neuronale Stimulation, proportional zur aufgenommenen Kalorienmenge. In Ileum und Colon wirken freie Fettsäuren und Glucose direkt stimulierend.
Abbildung oben) 5-30 Minuten nach Nahrungsaufnahme freigesetzt,
angeregt durch freie Fettsäuren und Glucose im Jejunum, teils über neuronale Stimulation, proportional zur aufgenommenen Kalorienmenge. In Ileum und Colon wirken freie Fettsäuren und Glucose direkt stimulierend.  regt die Insulinfreisetzung an - auch in Abwesenheit einer Hyperglykämie -,
regt die Insulinfreisetzung an - auch in Abwesenheit einer Hyperglykämie -,  verlangsamt die Magenentleerung,
verlangsamt die Magenentleerung,  fördert das postprandiale Sättigungsgefühl,
fördert das postprandiale Sättigungsgefühl,  zügelt die Glukoneogenese (Leber) und
zügelt die Glukoneogenese (Leber) und  steigert die
Insulinempfindlichkeit
(Muskulatur).
steigert die
Insulinempfindlichkeit
(Muskulatur).  GLP-1 stärkt Herztätigkeit
und Knochenaufbau und wirkt trophisch auf endokrin aktive Zellen der
Bauchspeicheldrüse (Langerhans-Inseln), vor allem ß-Zellen (möglicher
Einsatz bei diabetischen Patienten).
GLP-1 stärkt Herztätigkeit
und Knochenaufbau und wirkt trophisch auf endokrin aktive Zellen der
Bauchspeicheldrüse (Langerhans-Inseln), vor allem ß-Zellen (möglicher
Einsatz bei diabetischen Patienten).| Glucose im Darm steigert die Sekretion von GLP-1, dieses wirkt u.a. appetithemmend und regt die Sekretion von Insulin an |
 VIP (Nüchternplasma)
VIP (Nüchternplasma)
 Mehr über VIP s. dort
Mehr über VIP s. dort Wirkungen: GIP wirkt
über GIP-Rezeptoren der ß-Zellen im Pankreas, die via Gs den cAMP-Spiegel heben. Es ist ein Inkretin (insulinotropes Hormon). GIP regt die Insulinausschüttung im Pankreas an, was erklärt, warum oral aufgenommene Glucose stärker insulinstimulierend wirkt als parenteral verabfolgte (Infusion) - ein Effekt, der lange bekannt, aber erst später erklärbar war: Inkretin-Effekt.
Diese Wirkung tritt auf, sobald die Dünndarmmucosa mit dem Chymus in
Berührung kommt - also schon bevor die Substratkonzentration
(Glucose,..) im Blut ansteigt.
Wirkungen: GIP wirkt
über GIP-Rezeptoren der ß-Zellen im Pankreas, die via Gs den cAMP-Spiegel heben. Es ist ein Inkretin (insulinotropes Hormon). GIP regt die Insulinausschüttung im Pankreas an, was erklärt, warum oral aufgenommene Glucose stärker insulinstimulierend wirkt als parenteral verabfolgte (Infusion) - ein Effekt, der lange bekannt, aber erst später erklärbar war: Inkretin-Effekt.
Diese Wirkung tritt auf, sobald die Dünndarmmucosa mit dem Chymus in
Berührung kommt - also schon bevor die Substratkonzentration
(Glucose,..) im Blut ansteigt. Bei höherer Konzentration hemmt GIP die Säureproduktion im Magen und verzögert die Magenentleerung,
deshalb die frühere Bezeichnung "gastrisches inhibitorisches Peptid". Dies ist als Schutzmechanismus für das Duodenum
zu
verstehen, das vor überhasteter Magenentleerung bewahrt wird: GIP hemmt
nicht nur die Säureproduktion im Magen, sondern steigert auch die
Sekretionstätigkeit im Dünndarm (Pufferung).
Bei höherer Konzentration hemmt GIP die Säureproduktion im Magen und verzögert die Magenentleerung,
deshalb die frühere Bezeichnung "gastrisches inhibitorisches Peptid". Dies ist als Schutzmechanismus für das Duodenum
zu
verstehen, das vor überhasteter Magenentleerung bewahrt wird: GIP hemmt
nicht nur die Säureproduktion im Magen, sondern steigert auch die
Sekretionstätigkeit im Dünndarm (Pufferung). Die Freisetzung von Motilin wird gefördert durch steigenden pH-Wert (Alkalinisierung) im Dünndarm.
Die Freisetzung von Motilin wird gefördert durch steigenden pH-Wert (Alkalinisierung) im Dünndarm. Die Anwesenheit von - insbesondere saurem - Chymus im Dünndarm hemmt die Motilinbildung.
Die Anwesenheit von - insbesondere saurem - Chymus im Dünndarm hemmt die Motilinbildung. Motilin beschleunigt die Magenentleerung und löst sowohl in Magen als auch im Dünndarm interdigestive Bewegungen aus, beruhend auf seiner anregenden Wirkung auf den migrierenden Motorkomplex (MMC). Tatsächlich steigt in der interdigestiven (Nüchtern-) Phase die Motilinkonzentration im Blut alle 1-2 Stunden an (zyklische Freisetzung alle ~90 Minuten).
Motilin beschleunigt die Magenentleerung und löst sowohl in Magen als auch im Dünndarm interdigestive Bewegungen aus, beruhend auf seiner anregenden Wirkung auf den migrierenden Motorkomplex (MMC). Tatsächlich steigt in der interdigestiven (Nüchtern-) Phase die Motilinkonzentration im Blut alle 1-2 Stunden an (zyklische Freisetzung alle ~90 Minuten).  Motilin wird auch als "intestinaler Hausmeister"
bezeichnet, da es die
Kontraktionen in Fundus und Antrum des Magens sowie die Peristaltik im
Dünndarm anregt und so den Darm "reinigt" - was auch das Aufsteigen von
Bakterien aus dem Colon in den Dünndarm limitieren dürfte.
Motilin wird auch als "intestinaler Hausmeister"
bezeichnet, da es die
Kontraktionen in Fundus und Antrum des Magens sowie die Peristaltik im
Dünndarm anregt und so den Darm "reinigt" - was auch das Aufsteigen von
Bakterien aus dem Colon in den Dünndarm limitieren dürfte. Der Motilinrezeptor bindet auch das Antibiotikum Erythromyzin;
dessen anregende Wirkung wird zur Behandlung verlangsamter
Magenentleerung (Gastroparese, z.B. postoperativ oder bei Diabetes
mellitus) genutzt.
Der Motilinrezeptor bindet auch das Antibiotikum Erythromyzin;
dessen anregende Wirkung wird zur Behandlung verlangsamter
Magenentleerung (Gastroparese, z.B. postoperativ oder bei Diabetes
mellitus) genutzt. Auch regt Motilin
die Gallenblase zu Kontraktionen (Fettverdauung!) und den unteren
Ösophagussphinkter zum festeren Verschluss an. Ferner stimuliert es die
Pepsinproduktion und damit die Eiweißverdauung im Magen, sowie die
Freisetzung von pankreatischem Polypeptid und Somatostatin.
Auch regt Motilin
die Gallenblase zu Kontraktionen (Fettverdauung!) und den unteren
Ösophagussphinkter zum festeren Verschluss an. Ferner stimuliert es die
Pepsinproduktion und damit die Eiweißverdauung im Magen, sowie die
Freisetzung von pankreatischem Polypeptid und Somatostatin.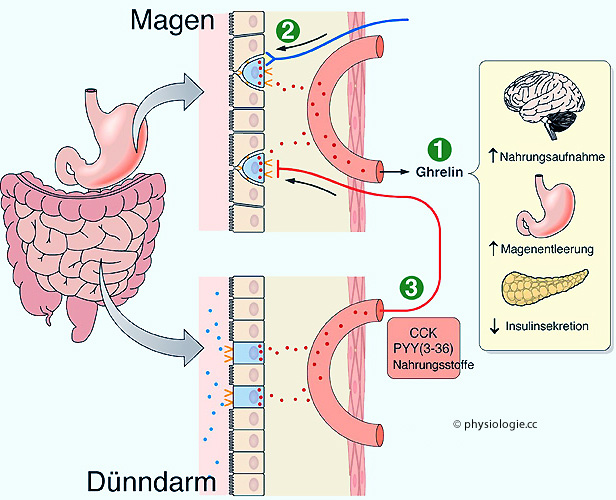
 Abbildung: Ghrelin und andere enteroendokrine Faktoren
Abbildung: Ghrelin und andere enteroendokrine Faktoren
 regt
das Hungergefühl an,
regt
das Hungergefühl an,  beschleunigt die Magenentleerung und
beschleunigt die Magenentleerung und  stimuliert
die Freisetzung von Wachstumshormon.
stimuliert
die Freisetzung von Wachstumshormon. Abbildung zeigt an Hand des Beispiels der L-Zelle, wie
spezielle Zellen in der Schleimhaut die Anwesenheit verschiedener
Substanzen im Darmlumen detektieren.
Abbildung zeigt an Hand des Beispiels der L-Zelle, wie
spezielle Zellen in der Schleimhaut die Anwesenheit verschiedener
Substanzen im Darmlumen detektieren. 
 Abbildung: Das gastrointestinale System als multipler Sensor - Beispiel L-Zelle
Abbildung: Das gastrointestinale System als multipler Sensor - Beispiel L-Zelle Über Paneth-Zellen s. dort
Über Paneth-Zellen s. dort 
 Cortistatine
Cortistatine  Oxyntomodulin
Oxyntomodulin  PYY
PYY  PP
PP Gastrin
sowie
Gastrin
sowie  niedrigen pH-Wert im Magen.
niedrigen pH-Wert im Magen. die Kontraktion der Gallenblase
die Kontraktion der Gallenblase  die Salzsäurebildung des Magens (direkt über Wirkung an Belegzellen,
und indirekt durch Hemmung der Histaminausschüttung von ECL-Zellen)
die Salzsäurebildung des Magens (direkt über Wirkung an Belegzellen,
und indirekt durch Hemmung der Histaminausschüttung von ECL-Zellen) die Sekretion von
Gastrin und anderen Hormonen, wie Insulin, Glucagon, Somatotropin (geeignet zur Therapie der Akromegalie), Prolaktin
die Sekretion von
Gastrin und anderen Hormonen, wie Insulin, Glucagon, Somatotropin (geeignet zur Therapie der Akromegalie), Prolaktin die Sekretion von Verdauungsenzymen aus Magen (Pepsinogen) und Bauchspeicheldrüse.
die Sekretion von Verdauungsenzymen aus Magen (Pepsinogen) und Bauchspeicheldrüse. Mehr über Somatostatin s. dort
Mehr über Somatostatin s. dort Mehr über Cortistatine s. dort
Mehr über Cortistatine s. dort Abbildung oben), das den Energieumsatz sowie das
Sättigungsgefühl fördert (den Appetit unterdrückt); damit könnte es als
hungerdämpfendes Medikament eingesetzt werden. Der Mechanismus seiner
Wirkung ist unklar, ebenso ob es eigene Rezeptoren nutzt oder (mur)
über
GLP-1- bzw. Glucagonrezeptoren wirkt.
Abbildung oben), das den Energieumsatz sowie das
Sättigungsgefühl fördert (den Appetit unterdrückt); damit könnte es als
hungerdämpfendes Medikament eingesetzt werden. Der Mechanismus seiner
Wirkung ist unklar, ebenso ob es eigene Rezeptoren nutzt oder (mur)
über
GLP-1- bzw. Glucagonrezeptoren wirkt. hemmt die Sekretion
exokriner pankreatischer Bicarbonat- und Enzymsekretion,
hemmt die Sekretion
exokriner pankreatischer Bicarbonat- und Enzymsekretion,  relaxiert die
Gallenblase
und
relaxiert die
Gallenblase
und  regt den intestinalen Transport an.
regt den intestinalen Transport an. | Hormon / Wirkstoff |
Syntheseort |
Hauptwirkung(en) |
Reiz für die Freisetzung |
| hauptsächlich stimulierend |
|||
| CCK |
I-Zellen (Duodenum / Jejunum) |
Gallenblasenkontraktion Sekretion pankreatischer Enzyme Verzögerung Magenentleerung Anorexigene Wirkung (ZNS) Freisetzung von Sekretin |
Im Duodenum: Peptide Aminosäuren Glucose Fettsäuren |
| Gastrin |
G-Zellen (Antrum des Magens) |
Sekretion von Salzsäure Sekretion von Pepsinogen, Pankreassaft, Galle Tonus Kardiasphinkter Antrummotilität, Peristaltik D-Zellen, histaminproduzierende ECL-Zellen |
Vagusaktivität Dehnung Magenwand GRP Peptide im Magen |
| Histamin |
ECL-Zellen (Magen) |
Sekretion von Salzsäure | Vagusaktivität Gastrin |
| GLP-1, GLP-2 |
L-Zellen (Ileum, Colon) |
Trophische Effekte (Inselzellen, Darm) |
Im Darm: Freie Fettsäuren, Glucose |
| Motilin |
M-Zellen (Jejunum) |
Magenentleerung Migrating motor complex (MMC) Gallenblase |
Im Duodenum: Niedriger pH-Wert Fettsäuren |
| Sekretin |
S-Zellen (Duodenum / Jejunum) |
Sekretion von Bicarbonat Sekretion von Pepsinogen Verzögerung Magenentleerung |
Duodenum: pH < 4 Vagusaktivität Gallensaure Salze CCK |
| hauptsächlich inhibierend |
|||
| Somatostatin |
D-Zellen (Magen / Dünndarm) |
- Kontraktion Gallenblase - Salzsäurebildung Magen - Sekretion von Gastrin, Insulin, Glucagon, Somatotropin, Prolaktin - Sekretion von Verdauungsenzymen |
Im Duodenum: pH < 2-3 Fettsäuren Peptide / Aminosäuren |
| GIP |
K-Zellen Duodenum / Jejunum) |
- Sekretion von Salzsäure - Motilität des Magens Anregung der Insulinsekretion (Inkretineffekt) |
Im Duodenum: Glucose Fettsäuren Peptide |
 Sie bilden einerseits afferente Schenkel viszeraler Reflexe,
Sie bilden einerseits afferente Schenkel viszeraler Reflexe,  andererseits führen sie zu bewussten
Empfindungen (wie Übelkeit, Stuhldrang, Schmerz - viszerosensible Afferenzen).
andererseits führen sie zu bewussten
Empfindungen (wie Übelkeit, Stuhldrang, Schmerz - viszerosensible Afferenzen). 
 Abbildung: Afferenzen aus dem Darm zum Zentralnervensystem
Abbildung: Afferenzen aus dem Darm zum Zentralnervensystem
 ), die im Rahmen einer Typ IV-Hypersensitivität auftritt (
), die im Rahmen einer Typ IV-Hypersensitivität auftritt ( s. dort): Es handelt sich um eine Überempfindlichkeit gegen Bestandteile von Klebereiweiß (Gluten), das in vielen Getreidesorten vorkommt. Fast alle betroffenen Personen zeigen ein bestimmtes HLA-Muster (HLA-DQ2 oder HLA-DQ8-Allel).
s. dort): Es handelt sich um eine Überempfindlichkeit gegen Bestandteile von Klebereiweiß (Gluten), das in vielen Getreidesorten vorkommt. Fast alle betroffenen Personen zeigen ein bestimmtes HLA-Muster (HLA-DQ2 oder HLA-DQ8-Allel).
 Abbildung: Stadien der Zoeliakie im Jejunum
Abbildung: Stadien der Zoeliakie im Jejunum
 Abbildung). Folge ist eine gestörte Resorption von Nahrung.
Abbildung). Folge ist eine gestörte Resorption von Nahrung.
 Assimilation
ist die Summe der digestiven und absorptiven Vorgänge im Darm. Sie erfolgt intraluminal (Verdauung im
Darmrohr), im Bürstensaum (Mikrovilli), intrazellulär (Spaltung und
Transport) und durch die Basolateralmembran (aus der Mukosazelle zum Kreislauf).
Die Verweildauer des Chymus beträgt im Magen bis zu 3, im Dünndarm bis
zu 7, im Dickdarm bis zu 70 Stunden, die Summe heisst Passagezeit (1-3
Tage) Assimilation
ist die Summe der digestiven und absorptiven Vorgänge im Darm. Sie erfolgt intraluminal (Verdauung im
Darmrohr), im Bürstensaum (Mikrovilli), intrazellulär (Spaltung und
Transport) und durch die Basolateralmembran (aus der Mukosazelle zum Kreislauf).
Die Verweildauer des Chymus beträgt im Magen bis zu 3, im Dünndarm bis
zu 7, im Dickdarm bis zu 70 Stunden, die Summe heisst Passagezeit (1-3
Tage) Die Resorptionsoberfläche ist durch makroskopische (mal ~3: Kerckring-Falten, Lieberkühn-Krypten), mikroskopische (Darmzotten: mal ~10) und ultramikroskopische Auffaltungen (Bürstensaum: mal ~20) auf ~200 m2
vergrößert. Darmzotten kontrahieren sich regelmäßig (Blut- und
Lymphströmung), der arterielle Druck entfaltet sie wieder
(stempelartige Relativbewegungen zum Chymus). Stammzellen aus den Krypten bilden fortlaufend Ersatz für abgeschilfertes Epithel (turnover time 3-6 Tage) Die Resorptionsoberfläche ist durch makroskopische (mal ~3: Kerckring-Falten, Lieberkühn-Krypten), mikroskopische (Darmzotten: mal ~10) und ultramikroskopische Auffaltungen (Bürstensaum: mal ~20) auf ~200 m2
vergrößert. Darmzotten kontrahieren sich regelmäßig (Blut- und
Lymphströmung), der arterielle Druck entfaltet sie wieder
(stempelartige Relativbewegungen zum Chymus). Stammzellen aus den Krypten bilden fortlaufend Ersatz für abgeschilfertes Epithel (turnover time 3-6 Tage) Lymphatische Organe des gastrointestinalen Trakts befinden sich im Rachenraum, Dünn- und Dickdarm. Das
darmassoziierte lymphatische Gewebe (GALT) beinhaltet 5-mal mehr
Lymphozyten als das Blutvolumen. Es hindert Keime an der
Passage in den Körper durch intakte Darmmucosa und Sekrete (Magensäure,
Mukus). Microfold- (M-) Zellen in den Peyerschen Plaques nehmen
Mikroorganismen auf und reichen sie an Makrophagen, antigenpräsentierende Zellen und Lymphozyten weiter. ECL-Zellen bilden Histamin, Paneth-Zellen Defensine, Becherzellen Mucin, Plasmazellen IgA. Rezeptorbestückte Epithelzellen
(Toll-like, NOD-like etc) wehren Pathogene ab und limitieren
Entzündungsreaktionen. Dazu wirken dendritische Zellen und Makrophagen
der lamina propria homöostatisch; regulatorische T-Zellen limitieren
Entzündungsreaktionen Lymphatische Organe des gastrointestinalen Trakts befinden sich im Rachenraum, Dünn- und Dickdarm. Das
darmassoziierte lymphatische Gewebe (GALT) beinhaltet 5-mal mehr
Lymphozyten als das Blutvolumen. Es hindert Keime an der
Passage in den Körper durch intakte Darmmucosa und Sekrete (Magensäure,
Mukus). Microfold- (M-) Zellen in den Peyerschen Plaques nehmen
Mikroorganismen auf und reichen sie an Makrophagen, antigenpräsentierende Zellen und Lymphozyten weiter. ECL-Zellen bilden Histamin, Paneth-Zellen Defensine, Becherzellen Mucin, Plasmazellen IgA. Rezeptorbestückte Epithelzellen
(Toll-like, NOD-like etc) wehren Pathogene ab und limitieren
Entzündungsreaktionen. Dazu wirken dendritische Zellen und Makrophagen
der lamina propria homöostatisch; regulatorische T-Zellen limitieren
Entzündungsreaktionen  Magensäure
tötet die meisten Bakterien ab; im Duodenum finden sich ~103, im Jejunum ~104, im Ileum ~107, im Colon ~1012 Mikroorganismen pro Gramm Darminhalt. Das gesamte Mikrobiom des Darmes wird auf ~1014 Zellen geschätzt (~103 verschiedene Spezies). Plasmazellen
im Darm produzieren 2 g IgA pro Tag (~10% der gesamten
Plasmaeiweißsynthese, ~65% der gesamten Immunglobulinproduktion).
Enterozyten präsentieren Antigene an T-Lymphozyten (ohne
diese zu aktivieren) und beeinflussen dendritische Zellen. Immunantworten können in der
Darmschleimhaut aktiv unterdrückt werden, wird diese Toleranz
durchbrochen, können Nahrungsmittelallergien auftreten Magensäure
tötet die meisten Bakterien ab; im Duodenum finden sich ~103, im Jejunum ~104, im Ileum ~107, im Colon ~1012 Mikroorganismen pro Gramm Darminhalt. Das gesamte Mikrobiom des Darmes wird auf ~1014 Zellen geschätzt (~103 verschiedene Spezies). Plasmazellen
im Darm produzieren 2 g IgA pro Tag (~10% der gesamten
Plasmaeiweißsynthese, ~65% der gesamten Immunglobulinproduktion).
Enterozyten präsentieren Antigene an T-Lymphozyten (ohne
diese zu aktivieren) und beeinflussen dendritische Zellen. Immunantworten können in der
Darmschleimhaut aktiv unterdrückt werden, wird diese Toleranz
durchbrochen, können Nahrungsmittelallergien auftreten Die
Durchblutung des Verdauungssystems beträgt 1,5-2,0 l/min - 1,3 l/min
aus der Pfortader. Die Steuerung erfolgt über Nerven des
Splanchnikussystems. Ergotrope Reaktionslage führt zu Vasokonstriktion,
verminderter Durchblutung und Entspeicherung von Blut aus venösen
Gefäßnetzen - Blut wird mobilisiert, der venöse Rückstrom verbessert
und die Vorlast des Herzens erhöht, was Herzminutenvolumen und
arteriellen Druck zu stabilisieren hilft (Blutreserve) Die
Durchblutung des Verdauungssystems beträgt 1,5-2,0 l/min - 1,3 l/min
aus der Pfortader. Die Steuerung erfolgt über Nerven des
Splanchnikussystems. Ergotrope Reaktionslage führt zu Vasokonstriktion,
verminderter Durchblutung und Entspeicherung von Blut aus venösen
Gefäßnetzen - Blut wird mobilisiert, der venöse Rückstrom verbessert
und die Vorlast des Herzens erhöht, was Herzminutenvolumen und
arteriellen Druck zu stabilisieren hilft (Blutreserve) Hormonproduzierende
Zellen in den Schleimhäuten bilden ein "diffuses neuroendokrines
System" - sie reagieren auf entsprechende Reize (mechanisch, chemisch,
neurokrin) und sezernieren
über ihre basolaterale Membran Hormone, die über den Kreislauf
Sekretion, Resorption, Motorik, Hormonbildung und Wachstum des Gastrointestinaltrakts beeinflussen. Viele sind identisch mit Neurotransmittern. Hormonbildende
Zellen sind meist vom "offenen" Typ, sie registrieren mittels apikaler
Rezeptoren und Ionenkanälen Stoffe im Darmlumen; "geschlossene" werden
parakrin, neuronal oder endokrin gesteuert. Als sicher physiologisch wirksam gelten
Gastrin, Sekretin, Cholecystokinin, Motilin und GIP. Zahlreiche weitere gelten als Kandidaten für eine physiologische Bedeutung (putative Hormone) - sie können
parakrin oder neurokrin, im pharmakologischen oder
pathologischen Sinne wirksam sein Hormonproduzierende
Zellen in den Schleimhäuten bilden ein "diffuses neuroendokrines
System" - sie reagieren auf entsprechende Reize (mechanisch, chemisch,
neurokrin) und sezernieren
über ihre basolaterale Membran Hormone, die über den Kreislauf
Sekretion, Resorption, Motorik, Hormonbildung und Wachstum des Gastrointestinaltrakts beeinflussen. Viele sind identisch mit Neurotransmittern. Hormonbildende
Zellen sind meist vom "offenen" Typ, sie registrieren mittels apikaler
Rezeptoren und Ionenkanälen Stoffe im Darmlumen; "geschlossene" werden
parakrin, neuronal oder endokrin gesteuert. Als sicher physiologisch wirksam gelten
Gastrin, Sekretin, Cholecystokinin, Motilin und GIP. Zahlreiche weitere gelten als Kandidaten für eine physiologische Bedeutung (putative Hormone) - sie können
parakrin oder neurokrin, im pharmakologischen oder
pathologischen Sinne wirksam sein  Gastrin aus G-zellen (2/3 Magenantrum, 1/3 Duodenum) regt die Bildung von Salzsäure im Magen an, indem es Belegzellen stimuliert und die Freisetzung von Histamin aus ECL-Zellen anregt. - Cholecystokinin
(CCK) stammt aus I-Zellen in Duodenum, Jejunum und oberem Ileum; diese
reagieren auf die Anwesenheit von Fettsäuren, Aminosäuren, Peptiden im
Chymus. CCK regt das Pankreas zur
Absonderung enzymreichen Sekrets und die Gallenblase zur Kontraktion
an, relaxiert den Sphincter Oddi, ruft Sättigungsgefühl hervor,
verlangsamt die Magenentleerung. - S-Zellen (Duodenum, Jejunum) bilden Sekretin, wenn der Chymus im Dünndarm sauer (pH<4,5) ist; es regt die Sekretion basischen
Pankreas- und Gallensekrets an, hemmt die Gastrinsekretion,
steigert die Mucinproduktion, und
regt die Sekretion von Somatostatin und Insulin an Gastrin aus G-zellen (2/3 Magenantrum, 1/3 Duodenum) regt die Bildung von Salzsäure im Magen an, indem es Belegzellen stimuliert und die Freisetzung von Histamin aus ECL-Zellen anregt. - Cholecystokinin
(CCK) stammt aus I-Zellen in Duodenum, Jejunum und oberem Ileum; diese
reagieren auf die Anwesenheit von Fettsäuren, Aminosäuren, Peptiden im
Chymus. CCK regt das Pankreas zur
Absonderung enzymreichen Sekrets und die Gallenblase zur Kontraktion
an, relaxiert den Sphincter Oddi, ruft Sättigungsgefühl hervor,
verlangsamt die Magenentleerung. - S-Zellen (Duodenum, Jejunum) bilden Sekretin, wenn der Chymus im Dünndarm sauer (pH<4,5) ist; es regt die Sekretion basischen
Pankreas- und Gallensekrets an, hemmt die Gastrinsekretion,
steigert die Mucinproduktion, und
regt die Sekretion von Somatostatin und Insulin an M-Zellen im Dünndarm setzen Motilin bei Alkalinisierung des Darminhalts frei. Es beschleunigt die Magenentleerung und löst interdigestive Motorik aus (zyklische Freisetzung alle ~90 Minuten), regt
Fundus und Antrum des Magens sowie die Peristaltik im
Dünndarm an, "reinigt" den Darm (MMC: migrierender Motorkomplex,
myoelektrischer Komplex) und regt den unteren Ösophagussphinkter zum festeren Verschluss an. - Glucoseinduziertes insulinotropes Peptid (GIP) wird aus K-Zellen im Dünndarm bei Anwesenheit von langkettigen
Fettsäuren, Triglyzeriden, Glukose und Aminosäuren freigesetzt, regt die Insulinausschüttung an (Inkretin-Effekt), verzögert die Magenaktivität (frühere Bezeichnung "gastric inhibitory
peptide") und steigert die Sekretionstätigkeit im Dünndarm (Pufferung) M-Zellen im Dünndarm setzen Motilin bei Alkalinisierung des Darminhalts frei. Es beschleunigt die Magenentleerung und löst interdigestive Motorik aus (zyklische Freisetzung alle ~90 Minuten), regt
Fundus und Antrum des Magens sowie die Peristaltik im
Dünndarm an, "reinigt" den Darm (MMC: migrierender Motorkomplex,
myoelektrischer Komplex) und regt den unteren Ösophagussphinkter zum festeren Verschluss an. - Glucoseinduziertes insulinotropes Peptid (GIP) wird aus K-Zellen im Dünndarm bei Anwesenheit von langkettigen
Fettsäuren, Triglyzeriden, Glukose und Aminosäuren freigesetzt, regt die Insulinausschüttung an (Inkretin-Effekt), verzögert die Magenaktivität (frühere Bezeichnung "gastric inhibitory
peptide") und steigert die Sekretionstätigkeit im Dünndarm (Pufferung) Der Gastrointestinaltrakt ist ein Sinnesorgan (Dehnungs-, chemische und Schmerzreize; intrinsisch afferente Fasern aus dem Darm sind cholinerg) und wird autonom-nervös versorgt. Efferenzen zum
Darm können Durchblutung und Darmtätigkeit hemmen (Sympathikus) oder Motorik, Sekretion, Resorption, Perfusion und endokrine Aktivität fördern (Parasympathikus) Der Gastrointestinaltrakt ist ein Sinnesorgan (Dehnungs-, chemische und Schmerzreize; intrinsisch afferente Fasern aus dem Darm sind cholinerg) und wird autonom-nervös versorgt. Efferenzen zum
Darm können Durchblutung und Darmtätigkeit hemmen (Sympathikus) oder Motorik, Sekretion, Resorption, Perfusion und endokrine Aktivität fördern (Parasympathikus) |
