

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert


Akme: ἀκμή = Spitze, Gipfel
Fergusson-Reflex: James K.W. Ferguson (1907-1999)
Galaktokinese: γάλακτος = Milch, κίνησις = Bewegung, Veränderung
Kardiotokografie: καρδίᾱ = Herz, τόκος = Geburt, γράφειν = schreiben, (auf)zeichnen
Lochien: λόχος = Geburt
Myometrium: μυς = Muskel, μήτρα = Gebärmutter
Oxytozin: ὠκύς = rasch, τόκος = Geburt
Perineum (Perinäum): περίνεος = Damm
Tokolyse: τόκος = Geburt, λύσις = (Er-) Lösung
Während
der wachsende Uterus bis etwa einen Monat vor dem Termin weitgehend ruht und die
feto-plazentare Einheit ungestört ist, wird er schließlich durch
Umstellung der Rezeptorbestückung und zunehmende endokrine Reize
sensibilisiert: Es treten rhythmische Kontraktionen (Wehen) auf. Diese haben unterschiedliche Funktion: Sie nehmen an Intensität und Frequenz zu (Senk-, Vor-, Eröffnungswehen), bewirken die Geburt (Presswehen), entfernen postpartal die Plazenta (Nachgeburtswehen) und helfen bei Blutstillung und Rückbildung (Nachwehen).
Gesteuert wird die Motorik des Uterus durch mehrfache endokrine
Faktoren, wie Östrogene, Oxytozin, Relaxin und Prostaglandine.
Östrogene erhöhen die Zahl der Oxytozinrezeptoren - peripartal bis zu
200-fach, unterstützt durch sinkenden Progesteronspiegel. Der Ferguson-Reflex
verstärkt die Kontraktionen, was Dehnungsreiz und Oxytozinausschüttung
weiter steigert und zusammen mit der hohen Rezeptordichte die
Wehentätigkeit maximiert.
Zu den geburtsbedingten Veränderungen im Fetus / Neugeborenen zählen
der Wechsel von fetalem zu eigenständigem Kreislauf, die Entfaltung der
Lunge, die
Umstellung der Blutgaswerte.
Prolactin läßt die Brustdrüse wachsen und unterstützt die Milchbildung; Oxytozin löst beim Stillen die Kontraktion myoepithelialer Zellen und damit die Laktation aus.
Muttermilch enthält außer Lactose,
Fett, Proteinen, Mineralien und
Vitaminen
auch immunologischen Schutz (Antikörper).
|
Regelmäßige
und in der Intensität zunehmende Wehen künden den Beginn des
Geburtsvorgangs an. Dieser läuft in mehreren Phasen ab: Verkürzung und
Öffnung des Zerixkanals, Tiefertreten des Babys im Geburtskanal und
vollständige Geburt, Ablösung und Ausstoßen der Plazenta und
Abnabelung, schließlich postpartum Erholung von Mutter und
Neugeborenem. Daran schließt die Phase der Laktation an.
Wehen sind koordinierte Aktivierungswellen im Myometrium
Eine Wehe (labor) ist
eine Kontraktion des Uterus (an der alle Muskelzellen teilnehmen, vergleichbar einem Herzschlag in
Zeitlupe); sie wird durch oszillierende Depolarisation
schrittmacherartiger Myometriumzellen ausgelöst.
Bei einer Wehe unterscheidet man drei Phasen ( Abbildung):
Abbildung):

Anstieg der Muskelkraft (
stadium incrementi)


Kontraktionsmaximum (Wehenspitze,
Akme 
)

Erschlaffung
(
stadium decrementi).
Die Wehendauer ist die Zeit vom Beginn des
stadium incrementi bis zum Abschluss des stadium decrementi, die
Wehenstärke ist die Kontraktionskraft während der Akme, die
Wehenfrequenz ist durch den zeitlichen Abstand der Akmen gegeben.
Zwischen den einzelnen Wehen liegt jeweils eine Wehenpause.
Das Myometrium  muss zu koordinierten Kontraktionen erst befähigt werden: Uterus, Plazenta und Fetus produzieren Prostaglandine, welche die Bildung von gap junctions
im Myometrium anregen (und dadurch Kontraktionen koordinieren helfen,
zusammen mit Östrogenen) und die Zervix aufweichen - sie entspannen den Geburtskanal
bei der Geburt. Auch Relaxine (Proteohormone)
muss zu koordinierten Kontraktionen erst befähigt werden: Uterus, Plazenta und Fetus produzieren Prostaglandine, welche die Bildung von gap junctions
im Myometrium anregen (und dadurch Kontraktionen koordinieren helfen,
zusammen mit Östrogenen) und die Zervix aufweichen - sie entspannen den Geburtskanal
bei der Geburt. Auch Relaxine (Proteohormone) aus Gelbkörper, Plazenta und Dezidua wirkt erschlaffend auf den Geburtskanal.
Steuernde
Faktoren stammen aus dem hypothalamisch-hypophysären System, aus der
fetoplazentaren Einheit, und aus dem Uterus selbst.
Positive Rückkopplung: Die Wehe presst den Kopf in den Geburtskanal,
Dehnungsrezeptoren melden an den Hypothalamus, was die
Oxytozinausschüttung stimuliert. Dadurch wird die Wehe weiter verstärkt.
Relaxine stammen aus
Plazenta, Chorion, Dezidua sowie den Ovarien (corpus luteum); sie weichen
bindegewebige Strukturen im Beckenbereich sowie die Zervix auf und
haben auch Kreislaufwirkungen (erhöhtes Herzzeitvolumen, gesteigerte
Gefäßdehnbarkeit, vermehrte Nierendurchblutung). Zusammen mit Östrogenen erhöhen sie weiters die Zahl der Oxytocinrezeptoren im Uterusmyometrium.
Prostaglandine aus dem Uterus fördern die Wehentätigkeit:
 Der Uterus ist gegenüber Prostaglandinen immer empfindlich, reagiert in der 1. Schwangerschaftshälfte hingegen so gut wie nicht auf Oxytocin
Der Uterus ist gegenüber Prostaglandinen immer empfindlich, reagiert in der 1. Schwangerschaftshälfte hingegen so gut wie nicht auf Oxytocin  . Östrogene erhöhen die Zahl der Oxytocinrezeptoren
an den Myometriumzellen ab Schwangerschaftsmitte bis auf das 80-fache
und direkt vor der Geburt auf das 200-fache des Ruhewertes, unterstützt
durch den nunmehr
sinkenden Progesteronspiegel. Die
reflektorische Ausschüttung von Oxytozin zu Beginn der Geburt zusammen
mit der hohen Rezeptordichte bewirkt eine intensive Wehentätigkeit.
. Östrogene erhöhen die Zahl der Oxytocinrezeptoren
an den Myometriumzellen ab Schwangerschaftsmitte bis auf das 80-fache
und direkt vor der Geburt auf das 200-fache des Ruhewertes, unterstützt
durch den nunmehr
sinkenden Progesteronspiegel. Die
reflektorische Ausschüttung von Oxytozin zu Beginn der Geburt zusammen
mit der hohen Rezeptordichte bewirkt eine intensive Wehentätigkeit.
Oxytocin wird aus dem Hinterlappen der
mütterlichen Hypophyse (und auch aus dem des Feten) ausgeschüttet;
Dehnungsrezeptoren im Geburtskanal werden durch das Tieferrücken des
Kopfes gereizt und setzen eine positive Rückkopplung in Gang (Ferguson-Reflex  :
Mehr
Oxytocin → stärkere Wehentätigkeit → stärkerer Dehnungsreiz). Die
Prostaglandinsynthese - vermittelt durch Cyclooxygenasen (COX1) - wird durch Oxytozin, und wie die
Oxytocinausschüttung durch Wehen angeregt.
:
Mehr
Oxytocin → stärkere Wehentätigkeit → stärkerer Dehnungsreiz). Die
Prostaglandinsynthese - vermittelt durch Cyclooxygenasen (COX1) - wird durch Oxytozin, und wie die
Oxytocinausschüttung durch Wehen angeregt.
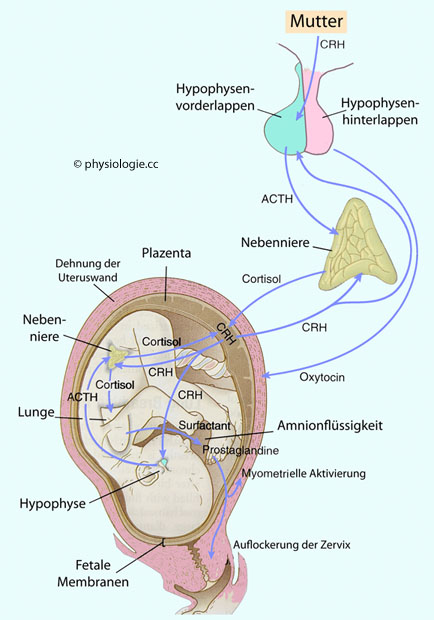

 Abbildung: Faktoren bei der Einleitung des Geburtsvorganges
Abbildung: Faktoren bei der Einleitung des Geburtsvorganges
Nach einer Vorlage in Carlson BM, Human Embryology and Developmental Biology, 7th ed. 2024 (Elsevier)
Die hypothalamisch-hypophysäre Achse ist im Zuge der Auslösung des Geburtsvorganges nicht die einzige Quelle für CRH (corticotropin-releasing hormone).
Ab der 12. Schwangerschaftswoche beginnt die Plazenta mit der Synthese
von CRH, das die Freisetzung von ACTH aus dem Hypophysenvorderlappen
sowohl bei der Mutter als auch beim Fetus stimuliert. Letzteres ist
auch für die Produktion von DHEAS (Dehydroepiandrosteronsulfat) wichtig, das die Plazenta für die
Synthese von Östrogenen benötigt.
ACTH seinerseits regt in der Nebennierenrinde die Produktion von Cortisol an (sowohl bei der Mutter als auch beim Feuts), was für zahlreiche Reifungsprozesse im Fetus wichtig ist. Dazu zählen

 Verlagerung der Blutbildung von Leber, Milz, Plazenta in das rote Knochenmark
Verlagerung der Blutbildung von Leber, Milz, Plazenta in das rote Knochenmark

 Glykogenspeicherung in der Leber
Glykogenspeicherung in der Leber

 Enzymatische Ausstattung intestinaler Zellen
Enzymatische Ausstattung intestinaler Zellen

 Surfactantsynthese in der Lunge
Surfactantsynthese in der Lunge
Prostaglandine (PGF2α) beteiligen sich nicht nur an der Auslösung der Geburtswehen, sie lockern auch das Gewebe der Zervix auf, indem sie hier helfen, Kollagen zu rekonfigurieren bzw. aufzulösen

CRH
wird (außer im Gehirn) auch von der Plazenta gebildet - beim Menschen macht das einen wesentlichen Anteil an der Initiierung der Geburtswehen aus ( Abbildung). Gegen Ende der
Schwangerschaft steigt sein Blutspiegel stark an, und es werden mehrere
Rollen dieses Hormons für die Einleitung des Geburtsvorgangs vermutet:
Abbildung). Gegen Ende der
Schwangerschaft steigt sein Blutspiegel stark an, und es werden mehrere
Rollen dieses Hormons für die Einleitung des Geburtsvorgangs vermutet:
 CRH erhöht über Wirkung auf die fetale Nebenniere und das mütterliche Gehirn den Dehydroepiandrosteron- (DHEA)- Spiegel; DHEA fördert die Wehentätigkeit
CRH erhöht über Wirkung auf die fetale Nebenniere und das mütterliche Gehirn den Dehydroepiandrosteron- (DHEA)- Spiegel; DHEA fördert die Wehentätigkeit
 CRH steigert die Verfügbarkeit von Prostaglandinen im uteroplazentaren System; Prostaglandine triggern Wehen
CRH steigert die Verfügbarkeit von Prostaglandinen im uteroplazentaren System; Prostaglandine triggern Wehen
 CRH könnte vorher auch wehenmindernd wirken (durch Steigerung des cAMP im Myometrium).
CRH könnte vorher auch wehenmindernd wirken (durch Steigerung des cAMP im Myometrium).
Das Nebennierenmark des Feten produziert zunächst nur Noradrenalin, mit dem Gestationsalter zunehmend
auch Adrenalin. Im Rahmen der Geburt steigt die Produktion von
Katecholaminen im NNM und damit die Konzentration von Noradrenalin,
Adrenalin und Dopamin im Nabelschnurblut stark an. Das steigert
Blutdruck, Herzleistung, Wärmebildung im braunen Fettgewebe,
Surfactantfreisetzung und Lungenfunktion.
Auch die Funktion der Schilddrüse
wird durch den Geburtsvorgang intensiv angeregt: TSH nimmt stark zu,
auch die Umwandlung von T4 zu T3, Fettsäuren werden mobilisiert und (Nor-) Adrenalinrezeptoren hinaufreguliert, vor allem in braunem Fettgewebe.
Wehenarten, Geburt und Nachgeburt
 Schwangerschaftswehen
Schwangerschaftswehen
treten - unregelmäßig - während der gesamten Gravidität auf, sind schmerzlos und als
“Training” der Uterusmuskulatur anzusehen (Braxton-Hicks-Kontraktionen)
 Senkwehen
Senkwehen bewirken das “Senken des Leibes” und treten 3-4 Wochen vor dem Geburtstermin auf
 Vorwehen
Vorwehen
beginnen einige Tage vor der Geburt und wirken als “Stellwehen”
(Einstellen des Feten); sie erfolgen unregelmäßig und sind oft so
stark, dass sie mit Eröffnungswehen verwechselt werden
 Eröffnungswehen
Eröffnungswehen
treten regelmäßig auf, zuerst alle 10-15 Minuten, mit steigender
Wehenfrequenz bis zu 5minütigen Abständen. Sie führen zur Erweiterung
des Geburtskanals

Zu
Kardiotokographie und
Wehenhemmung s.
unten
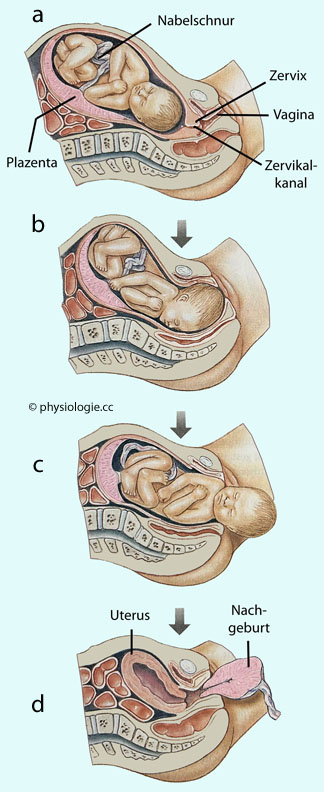

Abbildung: Phasen der Geburt
Nach einer Vorlage bei Silverthorn, Human Physiology - an integrated approach, 4th ed. 2007 (Pearson International)
a: Latenzphase. Fetus in normaler Gebärposition.
b: In
der aktiven Wehenphase (rhythmische Kontraktionen) weitet sich der Muttermund (Zervix), um dem Kopf
Platz zu machen (zervikale Dilatation).
c: Vaginale Geburt.
d: Nach der Geburt des Kindes löst sich die Plazenta von der Uteruswand ab und wird ausgestoßen
(Nachgeburt). Im Uteruscavum bleibt ein Blutgerinnsel zurück

 Presswehen
Presswehen (“Schüttelwehen”) beginnen mit der kompletten Öffnung der Zervix und bewirken die Geburt
(childbirth) des Kindes (Entbindung =
delivery). Der Uteruskörper
umfasst das Kind und presst es, zusammen mit der Bauchpresse
(unterstützt durch richtige Atemtechnik), durch den Geburtskanal.
Da
der Beckeneingang queroval, der Ausgang längsoval konfiguriert ist,
dreht sich zuerst der Kopf des Kindes mit seiner Längsachse, dann der Schultergürtel, entsprechend um 90 Grad nach.
Die Lunge ist mit Amnionflüssigkeit gefüllt (Atembewegungen treten ab
dem vierten
Schwangerschaftsmonat auf). Beim Durchtritt des Brustkorbs
wird ein Teil der Amnionflüssigkeit aus den Alveolen ausgepresst, der Rest wird nach der Geburt resorbiert
 Nachgeburtswehen
Nachgeburtswehen
führen zum Auspressen der Plazenta, deren Perfusion zuvor sistiert. Das
Durchtrennen der Nabelschnur (und wahrscheinlich erhöhte
Katecholaminspiegel sowie sympathische Stimulation) führt zu Spasmen
der Umbilikalgefäße, die sich kontrahieren und so den Blutfluss (und
Blutverlust) stoppen.
 Nachwehen
Nachwehen
im
Wochenbett fördern die Zurückbildung (Involution) des Uterus (Oxytozin
wird auch beim Stillen ausgeschüttet) und fördern die Blutstillung
(Kontraktion der Blutgefäße).
Schmerzen
unter einer Spontangeburt können zu den stärksten zählen, die der Mensch erfahren kann (intensiver als z.B.
Knochenbrüche, Phantomschmerzen, Zahnschmerzen, postherpetische
Neuralgie); sie haben viszerale (Eingeweide-) und somatische
Komponenten. Kontraktionen des Uterus können Ischämie des Myometriums
bedingen, was die Freisetzung von Kalium, Bradykinin, Histamin und
Serotonin bewirkt ( s. Schmerzmediatoren).
Starke Dehnung im unteren Uterus- sowie Zervixbereich stimuliert
darüber hinaus Mechanorezeptoren im Bereich des Geburtskanals -
inklusive Blase, Urethra und
Rektum.
s. Schmerzmediatoren).
Starke Dehnung im unteren Uterus- sowie Zervixbereich stimuliert
darüber hinaus Mechanorezeptoren im Bereich des Geburtskanals -
inklusive Blase, Urethra und
Rektum.
Schmerzen unter Vor- und Eröffnungswehen
betreffen das untere Uterussegment und die - starken Dehnungskräften
ausgesetzte - Zervix. Afferenzen aus dem unteren Uterussegment und der
inneren Zervix projizieren auf thorakolumbale Rückenmarksegmente
(Th10-L1). Der viszerale Schmerz ist auf dieser Höhe z.B. paravertebral
blockierbar. Presswehen sind
scharf und gut lokalisierbar, sie stammen aus dem Bereich der Vagina
und des Perineum (Beckenboden) und projizieren in das Sakralmark (N.
pudendus; S2-S4) - diese Projektionen lassen sich z.B. durch
Pundendusblockade beeinflussen.
Zu den physiologischen Auswirkungen perinataler Schmerzen gehören neuroendokrine
Effekte (Erhöhung des Sympathikustonus, Steigerung des
Adrenalinspiegels um das 3-6fache, des Noradrenalinspiegels um das
2-4fache, des Cortisolspiegels um das 2-3fache); sowie Effekte auf Herz
(Steigerung des Herzminutenvolumens), Kreislauf (Anstieg von peripherem
Widerstand und Blutdruck), Atmung (Hyperventilation kann Hypokapnie
bewirken), Darm und Blase (Hemmung der Motilität). Gehirn- und Uterusdurchblutung sinken unter diesen Umständen,
fetale Hypoxie kann auftreten.
Geburtstermin:
Vom 1. Tag der letzten Regelblutung vor der Empfängnis gerechnet (Gestationsalter, "p.m.", post menstruationem),
dauert die normale Schwangerschaft (Spontangeburten, ohne Sectio) etwa 40 Wochen (280 Tage). Die Wahrscheinlichkeitsverteilung erstreckt sich dabei über einen Zeitraum von mehreren Wochen:
 Geburten erfolgen zeitlich breit gestreut - am Tag des errechneten Geburtstermins (ET) etwa 4% (jede 25. Geburt), und 66% in einem Zeitraum, der
zwischen Tag 270 und 290 liegt. Dies entspricht etwa dem Bereich der
einfachen Standardabweichung SD (~68%); 95% der Geburten (2 SD)
erfolgen in einem doppelt so großen Zeitraum, also ungefähr zwischen
Tag 260 und 300. Jede zwanzigste Spontangeburt findet außerhalb dieses Zeitrahmens statt.
Geburten erfolgen zeitlich breit gestreut - am Tag des errechneten Geburtstermins (ET) etwa 4% (jede 25. Geburt), und 66% in einem Zeitraum, der
zwischen Tag 270 und 290 liegt. Dies entspricht etwa dem Bereich der
einfachen Standardabweichung SD (~68%); 95% der Geburten (2 SD)
erfolgen in einem doppelt so großen Zeitraum, also ungefähr zwischen
Tag 260 und 300. Jede zwanzigste Spontangeburt findet außerhalb dieses Zeitrahmens statt.
Gerechnet
vom Ovulations / Konzeptionszeitpunkt aus ("p.c.", post conceptionem),
verringern sich die entsprechenden Zahlen um etwas mehr als
zwei Wochen. Diese Angabe ist biologisch insoferne sinnvoller, als die
Frau in den ersten drei Wochen nach der letzten Regelblutung noch
nicht schwanger ist (die Implantation der Blastozyste in die
Uterusschleimhaut beginnt ~21 Tage p.m.).
Mutter (Postpartalperiode)
Mit dem Wort postpartal bezeichnet man üblicherweise Vorgänge und Zeiten der Rückanpassung des mütterlichen Organismus nach einer Geburt, postnatal bezieht sich hingegen meist auf Vorgänge und Zeiten der Entwicklung des Neugeborenen.
Allerdings werden die beiden Begriffe oftmals wechselweise gebraucht,
es gibt hier (noch) keinen allgemeinen Konsens im Gebrauch dieser
beiden Begriffe.
Uterus und Vagina, Ovar
Nach der Geburt
kontrahieren Uterusmuskulatur und Gefäße, die Uterusdurchblutung nimmt schlagartig
ab (relative Ischämie), das Myometrium hat einen erhöhten Tonus. Nach
dem Ende der ersten postpartalen Wochen hat sich die Masse des Uterus
von 1 kg auf 500 g halbiert - der
rasche Abfall des Östrogen- und Progesteronspiegels erhöht die
Aktivität der Kollagenase und anderer proteolytischer Enzyme -, nach 6 Wochen beträgt sie nur mehr 50 Gramm. Diese Abnahme erfolgt durch Autolyse und Verschluss der Blutgefäße. Es kommt zu
Involution und an der Stelle der Ablösung der Plazenta zu
Wundheilung. Abgestorbene Zelltrümmer werden von Makrophagen aufgenommen und abtransportiert.
Das Endometrium ist innerhalb von 2-3 Wochen vollständig wiederhergestellt, das Vaginalepithel in 6-10 Wochen postpartal..
Teile der Gebärmutterschleimhaut werden resorbiert, andere als Lochien  (Wochenfluss) - ein normalerweise keimfreies, weitgehend geruchloses
Sekret - nach außen abgegeben. Die Lochien stammen aus Uterus, Zervix
und Vagina. Sie sind die ersten vier Tage durch Blut, Dezidua- und
Endometriumfragmente rot gefärbt, anschließend durch Schleim und
Leukozyten bräunlich, schließlich weiß (Schleim); Lochien können bis zu
5 Wochen lang auftreten.
(Wochenfluss) - ein normalerweise keimfreies, weitgehend geruchloses
Sekret - nach außen abgegeben. Die Lochien stammen aus Uterus, Zervix
und Vagina. Sie sind die ersten vier Tage durch Blut, Dezidua- und
Endometriumfragmente rot gefärbt, anschließend durch Schleim und
Leukozyten bräunlich, schließlich weiß (Schleim); Lochien können bis zu
5 Wochen lang auftreten.
In der
Wochenbettphase treten verschiedene Arten von Uteruskontraktionen auf:
 Dauerkontraktion (“tonische Retraktion”) für 4-5 Tage, beginnend 4-5
Stunden nach der Nachgeburt;
Dauerkontraktion (“tonische Retraktion”) für 4-5 Tage, beginnend 4-5
Stunden nach der Nachgeburt;
 Spontane, rhythmische Nachwehen (die nach
2-3 Tagen aufhören);
Spontane, rhythmische Nachwehen (die nach
2-3 Tagen aufhören);
 Laktationswehen (“Reizwehen” durch den
Stillreflex: Oxytozinausschüttung reflektorisch beim Anlegen des
Kindes).
Laktationswehen (“Reizwehen” durch den
Stillreflex: Oxytozinausschüttung reflektorisch beim Anlegen des
Kindes).
Das Ovar nimmt seine Funktionen wieder auf, die
Östrogenbildung stellt sich auf das normale Ausmaß ein. Die
Bauchdeckenmuskulatur wird tonisiert, die Wassereinlagerung in den
Körper geht zurück, Körpergewicht, Blutvolumen und Blutbild kehren
allmählich zu den Ausgangswerten zurück.
Laktation und Muttermilch
Lactogenese (Milchbildung, Galactopoese): Vor der Geburt produziert die Brustdrüse wegen des hohen Östrogenspiegels
keine Milch: Die
hohen Konzentrationswerte an Östrogenen und Progesteron während der
Schwangerschaft regen das Wachstum der Brustdrüse an (unterstützt durch
Prolactin und hPL), hemmen aber gleichzeitig die Milchproduktion - sie machen das Brustgewebe unempfänglich für Prolactin. Der
steile Abfall der Östrogen- und Progesteronspiegel mit der Geburt (und
dem Verlust der Plazenta) hebt den inhibitorischen Effekt auf und
bewirkt eine sekretorische Aktivierung (ebenfalls
unterstützt durch Prolactin und hPL). Auch Insulin und Glucocorticoide
sind für die Anregung der Laktation unentbehrlich.
Obzwar das "Einschießen" der Milch erst 2-3 Tage postpartal in Schwung
kommt, ist das Anlegen des Babys gleich nach der Geburt sinnvoll, da
der Regelkreis (Saugen an der Brustwarze → afferente Nerven →
Hypothalamus) dopaminerge Neuronen hemmt und die Prolactinproduktion
stimuliert. Auch wird durch den Saugreiz die Oxytozinfreisetzung und
damit nicht nur die Retraktion des Uterus ("Stillwehen"), sondern auch
die Aktivierung myoepithelialer Zellen ( Abbildung
unten) angeregt. Das Saugverhalten des Babys funktioniert auch dann,
wenn aus der Brust noch gar keine Milch kommt.
Abbildung
unten) angeregt. Das Saugverhalten des Babys funktioniert auch dann,
wenn aus der Brust noch gar keine Milch kommt.
Saugreiz an der Brust führt reflektorisch zu Oxytozinfreisetzung und Kontraktion myoepithelialer Zellen (Einschießen der Milch)
|
 Falls es notwendig ist, rasch abzustillen (Mastitis = Entzünding der
Brustdrüse), kann dies mit einem Dopamin-Agonisten (z.B. Bromocriptin)
erfolgen - dadurch wird die Prolactinproduktion im
hypothalamisch-hypophysären System und damit die Milchbildung
unterdrückt.
Falls es notwendig ist, rasch abzustillen (Mastitis = Entzünding der
Brustdrüse), kann dies mit einem Dopamin-Agonisten (z.B. Bromocriptin)
erfolgen - dadurch wird die Prolactinproduktion im
hypothalamisch-hypophysären System und damit die Milchbildung
unterdrückt.

 Abbildung: Zusammensetzung reifer Muttermilch im Vergleich zu Kuhmilch
Abbildung: Zusammensetzung reifer Muttermilch im Vergleich zu Kuhmilch
Muttermilch
ist relativ arm an Eiweiß und reich an Zucker (Lactose). Fettanteil und
Brennwert (~70 Cal/dl) sind praktisch gleich hoch wie in Kuhmilch

 Bis zum 4.
postpartalen Tag wird Kolostrum
(Vormilch, colostrum, initial milk) sezerniert, eine dünnflüssige, gelbliche, eiweißreiche
Flüssigkeit (3-9% - wesentlich mehr als in reifer Muttermilch, auch mehr als in
Kuhmilch, vgl.
Bis zum 4.
postpartalen Tag wird Kolostrum
(Vormilch, colostrum, initial milk) sezerniert, eine dünnflüssige, gelbliche, eiweißreiche
Flüssigkeit (3-9% - wesentlich mehr als in reifer Muttermilch, auch mehr als in
Kuhmilch, vgl.  Abbildung). Kolostrum enthält 3% Fett, 4% Milchzucker (weniger als reife
Muttermilch), 0.4% Salze (Kalium, Calcium, Natrium / Chlorid, Phosphat) und Spurenelemente (mehr als reife
Muttermilch).
Abbildung). Kolostrum enthält 3% Fett, 4% Milchzucker (weniger als reife
Muttermilch), 0.4% Salze (Kalium, Calcium, Natrium / Chlorid, Phosphat) und Spurenelemente (mehr als reife
Muttermilch).
Schon das Kolostrum, dann auch die normale Muttermilch enthalten reichlich antimikrobielle und entzündungshemmende Proteine. Antikörper legen sich auf die Darmschleimhaut des Säuglings und schützen ihn vor
Infektionen und Allergien. Kolostrum hat weiters eine mild laxative Wirkung, was die Entfernung von Bilirubin über das Meconium ("Kindspech", der erste Stuhl Neugeborener) fördert.
100 ml Kolostrum enthalten 600 mg IgA (reife Muttermilch 80 mg), 80 mg IgG (reife Muttermilch 30 mg), 125 mg IgM (reife Muttermilch 30 mg), 370 mg Lysozyme (reife Muttermilch 240 mg) und 580 mg Lactoferrin (reife Muttermilch 200 mg).
Dann stellt sich die Zusammensetzung der Milch auf diejenige "reifer" Muttermilch um: Die Sekretion (Laktogenese) beginnt am 3.-4. Tag post partum, der Stillreflex ( Abbildung) tritt voll in Kraft. Das "Einschießen" der Milch wird als Galaktokinese
Abbildung) tritt voll in Kraft. Das "Einschießen" der Milch wird als Galaktokinese  (milk let down reflex) bezeichnet.
(milk let down reflex) bezeichnet.
 Abbildung: Stillreflex
Abbildung: Stillreflex
Modifiziert nach Silverthorn, Human Physiology, an integrated approach, 4th Int'l ed. 2007, Pearson / Benjamin Cummings
Schreie des Babys lösen einen alleinigen Anstieg des Oxytozinspiegels im Blut der Mutter aus. Der
Saugreiz an der Brust löst einen neurohumoralen Reflex aus, der zu
Oxytozin- und Prolactinsekretion
führt.
Dies fördert die Sekretion und
das Einschießen der Milch (myoepitheliale Zellen sind kontraktil und
umfassen die Drüsenazini); der Prolactinanstieg erhöht die
Milchproduktion für den folgenden Stillvorgang.
Der Reflexweg beginnt mit dem Saugreiz an Brustwarze (nipple) und Brustwarzenhof (areola),
sensorische Afferenzen laufen über thorakale Nerven und Rückenmark zum
Hypothalamus (nucleus paraventricularis und supraopticus), was die
Produktion und Sekretion von Oxytozin anregt, welches die Milch
"einschießen" lässt

 Reife Muttermilch ist nach ~2 Wochen postpartal gegeben. Sie enthält 88% Wasser, 1,3% Eiweiß
(u.a. Caseine), 4% Fett, knapp 7% Milchzucker (Lactose), 0.2%
Salze und Spurenelemente. Pro Tag werden etwa 800 ml Milch produziert; ihr Energiegehalt der Muttermilch beträgt 70 Cal (knapp 300 kJ) pro 100 ml.
Reife Muttermilch ist nach ~2 Wochen postpartal gegeben. Sie enthält 88% Wasser, 1,3% Eiweiß
(u.a. Caseine), 4% Fett, knapp 7% Milchzucker (Lactose), 0.2%
Salze und Spurenelemente. Pro Tag werden etwa 800 ml Milch produziert; ihr Energiegehalt der Muttermilch beträgt 70 Cal (knapp 300 kJ) pro 100 ml.
 Die Milchproduktion bedeutet einen Energieaufwand von rund 2,6 MJ pro Tag (600-700
Cal, etwa ein Viertel des gesamten Energieumsatzes des Körpers).
Während der Schwangerschaft speichert der Körper der Mutter zusätzlich durchschnittlich 5 kg Fett im Körper, was eventuelle nutritive Defizite während der Stillperiode ausgleichen kann.
Die Milchproduktion bedeutet einen Energieaufwand von rund 2,6 MJ pro Tag (600-700
Cal, etwa ein Viertel des gesamten Energieumsatzes des Körpers).
Während der Schwangerschaft speichert der Körper der Mutter zusätzlich durchschnittlich 5 kg Fett im Körper, was eventuelle nutritive Defizite während der Stillperiode ausgleichen kann.
Lactose steuert ~40%
der Nahrungsenergie der Milch bei; sie wird im Golgi-Apparat der
Drüsenzellen aus Glucose synthetisiert (Lactose-Synthase) und zieht
osmotisch Wasser an (in sekretorische Vesikel), was den Wasseranteil der Milch erhöht.
Ein größerer Energieanteil stammt von Lipiden in
der Milch, insbesondere Triglyzeriden (Neutralfett, ~50 g/d). Diese stammen zu einem guten Teil aus Chylomikronen und VLDL im mütterlichen Blutplasma und werden den Alveolarzellen mittels Lipoproteinlipase zugänglich gemacht. (Die laktierende Brustdrüse hat bei weitem die höchste Expression von Lipoproteinlipase
aller Gewebe im Körper - etwa eine Zehnerpotenz stärker als
Fettgewebe.)
Der andere Teil der Neutralfette stammt aus der de-novo-Lipogenese
der Brustdrüsenzellen selbst. Etwa 20% der Fettsäuren in der Milch stammen aus der endogenen Synthese des Milchdrüsenepithels. Dabei entstehen mittelkettige Fettsäuren (8-12 C Länge). Babys können Lipide mit solch relativ kurzen Fettsäureketten leicht verdauen und oxidieren.
Weiters enthält Muttermilch Oligosaccharide (human milk oligosaccharides, HMOs), deren
Muster bei jeder Frau anders ist. Diese Oligosaccharide binden an
Bakterien und fördern einerseits die Vielfalt der mikrobiellen Flora im
Darm des
Babys, tragen andererseits zu seinem Immunschutz bei.
Zum Schutz dient
auch das extrem stark antibakteriell / antiviral wirkende Lactoferrin, das ebenfalls in der Milch enthalten ist.
Milch ist saurer (pH 6,8-7,1) als Blutplasma (7,4), sodass basische Bestandteile angereichert
werden, saure in geringerer Konzentration als im Blut auftreten (Ionenfalle, ion trapping). Nichtelektrolyte wie Harnstoff oder Alkohol liegen in der Milch in der gleichen Konzentration wie im Blutplasma vor.
Was die Versorgung des Säuglings mit Vitaminen betrifft, können sich Engpässe ergeben:

So enthält Muttermilch wenig
Vitamin D,
abhängig vom Vitaminstatus, der vor allem im Winter zu wünschen übrig läßt.
Nimmt allerdings die Mutter z.B. 50 µg (2000 IE) Vitamin D
3 täglich zu sich, ist ihre Milch deutlich antirachitisch wirksam. Auch bildet der Säugling selbst Vitamin D
3, falls die Haut ausreichend UV-Licht erhält.
 Vitamin K
Vitamin K
wird kaum diaplazentar übertragen, auch die Muttermilch enthält nur
wenig davon. Abhängig von der Ernährung der Mutter enthält die Milch um
die 3 µg / 100 ml (Tagesbedarf für Kinder ~10 µg/kg Körpergewicht).
Eine Vitamin-K-Prophylaxe wird in den meisten Ländern der Welt
empfohlen, z.B. nach der Geburt, nach einer Woche und nach einem Monat
je 3
× 2 mg.

Muttermilch enthält durchschnittlich 0,05 µg
Vitamin B12
/100 ml (Kuhmilch 0,4 µg/100 ml) - abhängig vom Ernährungsverhalten.
Babies, die von vegan lebenden Müttern gestillt werden, können ohne
Zufuhr tierischer Lebensmittel im 2. Lebenshalbjahr
Vitaminmangelsymptome (megalozytäre Anämie) entwickeln, was allerdings
durch bei vegetarischer Ernährungsweise typische hohe Folsäurezufuhr nicht selten überdeckt wird.
Normalerweise produzieren gesunde Mützter 500-800 ml Milch pro Tag. Bei
einer täglichen Aufnahme von 0,8 Liter Muttermilch und einem Calciumgehalt von 1/4 Gramm erhält der Säugling ein tägliches Calciumangebot von etwa 0,2 g/d. Die Resorptionsrate liegt bei 60-70%,
d.h. die Calciumaufnahme des
Neugeborenen liegt bei 120-140 mg/d. Die Resorption wird durch Lactose
erleichtert; bei Formulanahrung mit höherem Calciumgehalt kann hingegen
die Resorptionsquote um die Hälfte niedriger liegen.
 Über die Muttermilch können auch Medikamente aus dem Körper der Mutter
eliminiert werden, was zu unerwünschten Wirkungen beim Säugling führen
kann.
Über die Muttermilch können auch Medikamente aus dem Körper der Mutter
eliminiert werden, was zu unerwünschten Wirkungen beim Säugling führen
kann.

 Abbildung: Feinbau der Milchdrüse
Abbildung: Feinbau der Milchdrüse
Nach einer Vorlage bei physiologyplus.com/physiology-of-lactation/
Die Brustdrüse ist aus Drüsenläppchen (mammary gland alveoli) aufgebaut, welche in Drüsenlappen (secretory lobules) gruppiert
sind und mittels jeweils 15-20 Milchgängen (ductuli) in
Milchgangampullen (Milchsäckchen) in der Brustwarze münden (s. nächste Abbildung).
Die
Kontraktion myoepithelialer Zellen wird durch Oxytozin angeregt und
läßt die Milch in das Ausführungsgangsystem "einschießen"

Die Milchsekretion beträgt
450-1200 ml (Mittelwert etwa 800 ml) pro
Tag.
Wichtigster Faktor bei der Regulierung ist die "Nachfrage": Je öfter
der Säugling gestillt wird, desto intensiver wirkt der reflektorische
Anreiz zur Laktogenese und desto größer wird das Milchvolumen. Dabei
löst der Saugreiz des Babys an der Brust die reflektorische Sekretion
von Oxytozin und Prolactin aus (Stressfaktoren wie z.B. Babygeschrei haben nur einen Oxytozineffekt). Die kombinierte Hormonausschüttung fördert sowohl
 oxytozinbedingt Sekretion und Einschießen der Milch (Ejektion = Abpressen in die Ausführungsgänge - myoepitheliale Zellen umfassen die Drüsenazini und sind kontraktil) als auch
oxytozinbedingt Sekretion und Einschießen der Milch (Ejektion = Abpressen in die Ausführungsgänge - myoepitheliale Zellen umfassen die Drüsenazini und sind kontraktil) als auch
 prolactinbedingt erhöhte
Milchproduktion
prolactinbedingt erhöhte
Milchproduktion
Der
Kalorienbedarf des Säuglings ist - bezogen auf das Körpergewicht - mehr
als dreimal höher (~600 kJ/kg/d) als beim Erwachsenen (~170 kJ/kg/d);
tatsächlich nimmt er ~15-20% seines Körpergewichts an Milch täglich auf.

 Abbildung: Milchbildung
Abbildung: Milchbildung
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 3rd ed., Elsevier 2016
Das
Drüsenläppchen (Azinus, Lobulus, Alveole) hat milchbildende
Epithelzellen (großes Bild unten) und sternförmige myoepitheliale Zellen, deren Kontraktion die Milch "einschießen" lässt.
Mehrere
Drüsenläppchen sind zu einem Drüsenlappen (Lobus) gruppiert (rechts
oben) - von diesen enthält eine Brust etwa 20. Die Ausscheidung erfolgt über Ductuli und Milchgänge,
schließlich Ampullen (Milchsäckchen).
Unterschiedliche Wege existieren für die Sekretion von Salzen, Zucker,
Wasser, Eiweiß und Fett: Apikale Sekretion (1), transzelluläre
Sekretion via Endo- und Exozytose (2), Bildung von Lipidtröpfchen (3),
Transzytose (4), parazellulär (5)

 Die Stillende hat - wie in der Schwangerschaft - einen erhöhten Eiweißbedarf
(1,2 - 2 g Protein / kg KG pro Tag). Fleisch, Fisch und Eier sind für
die Ernährung der stillenden Frau (in moderaten Mengen) angebracht,
auch mindestens einmal im Monat ~100 g Leber. Man geht davon aus, dass
die Energieaufnahme um ~300 Cal/d erhöht sein sollte.
Die Stillende hat - wie in der Schwangerschaft - einen erhöhten Eiweißbedarf
(1,2 - 2 g Protein / kg KG pro Tag). Fleisch, Fisch und Eier sind für
die Ernährung der stillenden Frau (in moderaten Mengen) angebracht,
auch mindestens einmal im Monat ~100 g Leber. Man geht davon aus, dass
die Energieaufnahme um ~300 Cal/d erhöht sein sollte.
Die tägliche
Flüssigkeitsaufnahme sollte ~2,5-3 Liter betragen, bei Zusatzbelastung
(Hitze) entsprechend mehr. Energiereduzierte Kost (<1500 Cal/d) und
Flüssigkeitseinschränkung (Trinkmenge <2 Liter) bedingt eine Abnahme
des Milchvolumens.
 Wie bei Substratmangel ermöglicht der Stoffwechsel des Säuglings die
Verwertung von Ketonkörpern (Acetoacetat, ß-Hydroxybutyrat). Damit kann er den hohen Fettanteil
der Muttermilch optimal nutzen. Säuglinge können Blutglucose-Spiegel
bis ~1,5 mM (Normalwert bei Erwachsenen 4-5 mM!) ohne neurologische Ausfälle tolerieren.
Wie bei Substratmangel ermöglicht der Stoffwechsel des Säuglings die
Verwertung von Ketonkörpern (Acetoacetat, ß-Hydroxybutyrat). Damit kann er den hohen Fettanteil
der Muttermilch optimal nutzen. Säuglinge können Blutglucose-Spiegel
bis ~1,5 mM (Normalwert bei Erwachsenen 4-5 mM!) ohne neurologische Ausfälle tolerieren.
Mit dem Stillen gelangen hauptsächlich milchsäureproduzierende
Bakterien in den Darm des Kindes. Die Milchsäure erschwert es
pathogenen Bakterien, sich im Darm anzusiedeln (mit Flaschennahrung
gefütterte Kinder entwickeln hingegen eine Darmflora, die derjeniger
Erwachsener ähnelt).
Steuerung der Brustdrüsen
 Prolactin ist primärer Anreger der Milchbildung; seine Sekretion unterliegt mehrfacher Kontrolle, u.a. wird sie durch Dopamin gehemmt. Prolactin hat mehrere Wirkungen: Es wirkt mammogen (fördert das Brustdrüsenwachstum), lactogen (startet die Milchproduktion) und galactopoetisch
(es erhält die einmal in Gang gekommene Milchbildung). Die
Prolactinbildung bleibt die ersten drei postpartalen Wochen dauernd
erhöht und sinkt dann auf einen Blutwert, der - solange mit dem Stillen
fortgefahren wird - immer noch über dem Basisspiegel Nichtschwangerer
liegt. Das Stillen erhöht dann jedes Mal den Prolactinspiegel
vorübergehend weiter.
Prolactin ist primärer Anreger der Milchbildung; seine Sekretion unterliegt mehrfacher Kontrolle, u.a. wird sie durch Dopamin gehemmt. Prolactin hat mehrere Wirkungen: Es wirkt mammogen (fördert das Brustdrüsenwachstum), lactogen (startet die Milchproduktion) und galactopoetisch
(es erhält die einmal in Gang gekommene Milchbildung). Die
Prolactinbildung bleibt die ersten drei postpartalen Wochen dauernd
erhöht und sinkt dann auf einen Blutwert, der - solange mit dem Stillen
fortgefahren wird - immer noch über dem Basisspiegel Nichtschwangerer
liegt. Das Stillen erhöht dann jedes Mal den Prolactinspiegel
vorübergehend weiter.
Bei Müttern, die nicht stillen, sinkt der Prolactinspiegel 1-2 Wochen nach der Geburt wieder auf Basiswerte ab.
Prolactin
stammt
aus
laktotropen Zellen des Hypophysenvorderlappens. Ihre Zahl nimmt während
der Schwangerschaft
zu (Östrogenwirkung). Die Prolactin-Freisetzung steht unter
tonischer Hemmung durch Dopamin, das über den
hypothalamisch-hypophysären Pfortaderkreislauf an den HVL gelangt.
Prolactin hemmt die Freisetzung von GnRH; regelmäßiges Stillen kann zu
Amenorrhö führen ("natürliches Kontrazeptivum").
Die Sekretion von Prolactin wird vor allem durch den Stillreflex angeregt (neuroendokriner Reflex: Hemmung
dopaminerger Neurone,  Abbildung), dabei steigt die Hormonkonzentration
im Blut innerhalb von 30 Minuten auf das 10- bis 100-fache an.
Frequenz und Dauer der Stillvorgänge korrelieren direkt mit dem Prolactinspiegel.
Abbildung), dabei steigt die Hormonkonzentration
im Blut innerhalb von 30 Minuten auf das 10- bis 100-fache an.
Frequenz und Dauer der Stillvorgänge korrelieren direkt mit dem Prolactinspiegel.
Prolactinrezeptoren (≥3 Subtypen) befinden sich nicht nur in der
Brustdrüse, sondern auch in Gehirn, Ovarien, Herz und Lungen. Prolactin
ist für die Heranreifung der Brustdrüse verantwortlich und hemmt die
Freisetzung von GnRH (Ovulationshemmung während der Stillzeit!). Prolactinrezeptoren gehören zur Zytokinrezeptor-Familie und funktionieren über den JAK-STAT-Mechanismus.
 Weitere Hormone sind für die Laktogenese erorderlich: Insulin, Cortisol, Schilddrüsenhormone. Das Fettgewebe der Brust exprimiert Aromatase (CYP19) und fördert die lokale Produktion von Östrogenen
aus zirkulierenden Androgenen. Hohe Steroidspiegel der
Schwangerschaftsperiode fördern des Wachstum und Verzweigungen des
Gang- und Alveolensystems der Brustdrüse. Östrogene fördern darüber
hinaus die Sekretion von Prolactin in laktotropen Zellen der
mütterlichen Hypophyse. Progesteron
hemmt die Produktion und Sekretion der Milch; erst der peripartale
Progesteronabfall gibt die Laktogenese innerhalb weniger Tage frei.
Weitere Hormone sind für die Laktogenese erorderlich: Insulin, Cortisol, Schilddrüsenhormone. Das Fettgewebe der Brust exprimiert Aromatase (CYP19) und fördert die lokale Produktion von Östrogenen
aus zirkulierenden Androgenen. Hohe Steroidspiegel der
Schwangerschaftsperiode fördern des Wachstum und Verzweigungen des
Gang- und Alveolensystems der Brustdrüse. Östrogene fördern darüber
hinaus die Sekretion von Prolactin in laktotropen Zellen der
mütterlichen Hypophyse. Progesteron
hemmt die Produktion und Sekretion der Milch; erst der peripartale
Progesteronabfall gibt die Laktogenese innerhalb weniger Tage frei.
 Das "Einschießen" der Milch ist bedingt durch
Oxytozin, das
aus dem Hypophysenhinterlappen reflektorisch durch den
Saugreiz an der Brustwarze freigesetzt wird (übrigens hat nicht einmal
jedes tausendste Neugeborene bei der Geburt schon Zähne - der erste
Milchzahn bricht im Schnitt erst mit 6-8 Monaten durch). Myoepitheliale
Zellen (
Das "Einschießen" der Milch ist bedingt durch
Oxytozin, das
aus dem Hypophysenhinterlappen reflektorisch durch den
Saugreiz an der Brustwarze freigesetzt wird (übrigens hat nicht einmal
jedes tausendste Neugeborene bei der Geburt schon Zähne - der erste
Milchzahn bricht im Schnitt erst mit 6-8 Monaten durch). Myoepitheliale
Zellen ( Abbildung) kontrahieren
sich und pressen aus den Alveolen
der Milchdrüse den Inhalt in die Milchgänge. Diese führen zu
sogenannten Strichkanälen, von denen 15 bis 20 in die Papille münden.
Abbildung) kontrahieren
sich und pressen aus den Alveolen
der Milchdrüse den Inhalt in die Milchgänge. Diese führen zu
sogenannten Strichkanälen, von denen 15 bis 20 in die Papille münden.
Die Stilldauer
beträgt
10-15 Minuten, dann sind 98% der in der Drüse gespeicherten Milch ausgepresst. Ruhe und
Entspannung
(Einfluss des limbischen Systems auf Hypothalamus und Hypophyse) fördern
den Stillvorgang.
 Man sollte vermeiden, in hektischer Umgebung (Handygebrauch etc) zu
stillen. Weiters ist es sinnlos, die Stilldauer über 10-15 Minuten
hinaus zu verlängern.
Man sollte vermeiden, in hektischer Umgebung (Handygebrauch etc) zu
stillen. Weiters ist es sinnlos, die Stilldauer über 10-15 Minuten
hinaus zu verlängern.
Die Milchgänge münden in die Brustwarze,
eine stark innervierte, haarlose Erhebung, umgeben von pigmentierter
Haut (Areola) mit Talgdrüsen. Sie ist stark innerviert und kann durch
sympathischen Einfluss erigiert werden, was reflektorisch beim Stillen,
aber auch bei sexueller Erregung oder Kälteeinfluss erfolgen kann.
Wird der Säugling vom Stillen entwöhnt, spricht man von Abstillen (weaning, Ablaktation).
 Primäres Abstillen liegt vor, wenn mit dem Stillen nach der Geburt gar nicht erst begonnen wird.
Primäres Abstillen liegt vor, wenn mit dem Stillen nach der Geburt gar nicht erst begonnen wird.
 Wann der richtige Zeitpunkt des sekundären
Stillens gekommen ist, hängt von mehreren Faktoren ab (individuell,
gesundheitlich, kulturell u.a.). Allgemein wird empfohlen, mit dem
Stillen etwa 6 Monate fortzufahren (optimale Ernährung und
immunologischer Schutz des Säuglings). Das spontane Abstillalter (baby-led weaning)
kann beim Menschen mehrere Jahre betragen; üblicherweise wird (zunächst
breiige, erst später festere) Beikost zugefüttert, sobald die Zunge - einige Monate postpartal - festere Nahrung nicht mehr reflektorisch aus dem Mund schiebt (Zungenstoßreflex). Am besten erfolgt eine allmähliche Entwöhnung des Säuglings von der Brust.
Wann der richtige Zeitpunkt des sekundären
Stillens gekommen ist, hängt von mehreren Faktoren ab (individuell,
gesundheitlich, kulturell u.a.). Allgemein wird empfohlen, mit dem
Stillen etwa 6 Monate fortzufahren (optimale Ernährung und
immunologischer Schutz des Säuglings). Das spontane Abstillalter (baby-led weaning)
kann beim Menschen mehrere Jahre betragen; üblicherweise wird (zunächst
breiige, erst später festere) Beikost zugefüttert, sobald die Zunge - einige Monate postpartal - festere Nahrung nicht mehr reflektorisch aus dem Mund schiebt (Zungenstoßreflex). Am besten erfolgt eine allmähliche Entwöhnung des Säuglings von der Brust.
Die Involution des Brustdrüsengewebes folgt der Beendigung des Stillens und ist ein autokrin - parallel zur endokrinen Steuerung - erfolgender Vorgang. Details dieses Mechanismus sind noch nicht bekannt.
 Die Lehre von der weiblichen Brust bezeichnet man als Senologie (nach frz. le sein, die Brust).
Die Lehre von der weiblichen Brust bezeichnet man als Senologie (nach frz. le sein, die Brust).
Hormonhaushalt der Gebärenden
Wann
die erste Menstruation nach der Geburt einsetzt, hängt davon ab, ob die
Mutter stillt. Ist das nicht der Fall, setzt die Blutung meist 6 bis 8
Wochen post partum ein. Solange der Prolactinspiegel erhöht ist
(Stillen), ist sowohl die Sekretion von Gonadotropinen im
hypothalamisch-hypophysären System als auch die Ansprechbarkeit des
Ovars auf Gonadotropine blockiert. So treten Menstruationen bei
stillenden Müttern meist 4-5 Monate nach der Geburt wieder auf - dieser
Zeitraum kann aber auch bis zu 2 Jahre betragen.
hCG regt die Schilddrüse an, Hormonwirkungen und Schilddrüsenvolumen nehmen während der Schwangerschaft zu; der steile postpartale hCG-Abfall führt zu einer Regression, die Schilddrüse erlangt nach ~4 Wochen ihre normale Funktion und nach ~12 Wochen ihr normales (prägravides) Volumen wieder.
Während der Schwangerschaft produziert die Plazenta Faktoren, welche die Ansprechbarkeit insulinempfindlicher Zellen senken und so blutzuckersteigernd
(diabetogen) wirken: Insulinase (Insulysin), CRH und plazentares
Lactogen. Bei normalgewichtigen Gebärenden ist die
Insulinempfindlichkeit 2-3 Tage postpartal wieder auf normalem Niveau,
bei übergewichtigen kann das viele Wochen dauern.
Nieren und Körperflüssigkeiten
Während der Schwangerschaft bewirkt das Renin-Aldosteron-System eine Retention von Flüssigkeit (bis zu ~8 Liter) und Natrium (bis zu ~1000
mM). Der wachsende Uterus bewirkt erhöhten Druck im Bauchraum, und der
hohe Progesteronspiegel senkt Tonus, Peristaltik und Kontraktionsdruck
des Ureter, was das Volumen im Nierenbeckenbereich um ~30% erhöht.
Postpartal stellen sich prägravide Normalverhältnisse in Nieren und
Uretern innerhalb von 4-8 Wochen wieder her. Der Serumspiegel an
natriuretischem Hormon steigt an (+50%), was die Aktivität von
Aldosteron, Angiotensin II und Vasopressin hemmt und die
Salzausscheidung in der Niere fördert. In den ersten zwei postpartalen
Wochen nimmt die Harnausscheidung zu, oftmals auf ~3
l/d. Die glomeruläre Filtrationsrate ist für zwei Monate post partum
erhöht. Es kann zu Überdehnung der Blase kommen, ohne dass dabei
gesteigerter Harndrang auftritt; andererseits klagen etwa 30% der
Frauen über Inkontinenz (vermutlich stressbedingt).
Blut und Kreislauf
Der
geburtsbedingte Blutverlust der Gebärenden kann zunächst den Hämatokrit
senken, was durch die gesteigerte Diurese rasch kompensiert wird:
Innerhalb von 3-5 Tagen ist der Hämatokrit wieder ausgeglichen;
insgesamt hat aber die Erythrozytenmasse im Kreislauf durch den
peripartalen Blutverlust abgenommen. Es dauerst mehrere Monate, bis der
Hämoglobingehalt im Blut wieder normalisiert ist.
Innerhalb von 4 Wochen normalisieren sich auch die Leukozytenzahlen im
Blut, die während der Schangerschaft erhöht waren. Die geburtsbedingte
Thrombozytopenie verschwindet innerhalb von 4-10 Tagen. Die
Gerinnungsfaktoren, deren Konzentrationen während der Schwangerschaft
erhöht waren (Fibrinogen, Faktoren VII, VIII, X, XII, vWF), kehren
innerhalb von 8-12 Wochen postpartal zu normalen Werten zurück. Damit
verschwindet auch die schwangerschaftsbedingte erhöhte
Gerinnungsbereitschaft (pregnancy-induced hypercoagulability) des mütterlichen Blutes.
Graviditätsbedingt haben sich im Kreislauf starke Veränderungen
eingestellt: Hohe Progesteron- und Relaxinspiegel senken den peripheren
Gefäßwiderstand um 35-40%. Gegen Ende der Schwangerschaft nimmt der
Blutdruck von reduzierten auf prägravide Werte zu, die Herzfrequenz
steigt um 10-20% an. Die Dicke der Ventrikelwände kann um bis zu ~50% zunehmen.
Unmittelbar nach der Geburt macht sich eine Erhöhung des effektiven
Blutvolumens der Mutter bemerkbar - bedingt durch die Kontraktion des
Uterus und den Wegfall der Obstruktion der unteren Hohlvene (diese
Faktoren erhöhen das kardiale Preload, das Schlagvolumen der Ventrikel
und die Herzfrequenz). Das Herzminutenvolumen kann peripartal um 60-80%
ansteigen. Dieser dramatische Anstieg dauert nicht lange, innerhalb
von 1-2 Stunden postpartal kehren die Werte auf das Niveau vor der
Geburt, und innerhalb von zwei Wochen auf dasjenige vor der
Schwangerschaft zurück. In dieser Zeit steigt der periphere
Gefäßwiderstand wieder auf seinen prägraviden Normalwert an.
Die (mit der Schwangerschaftsdauer linear angestiegende) Ruhefrequenz
geht innerhalb von sechs Wochen auf prägravide Normalwerte zurück.
Innerhalb von vier Wochen verschwindet auch eine
schwangerschaftsbedingte Hypertrophie der Ventrikelmuskulatur.
Neugeboreses (Postnatalperiode)
Das Gewicht des Neugeborenen nimmt in den ersten 3 bis 5 Tagen um bis
zu 10% ab; das Atem- und Wärmeregulationszentrum reifen noch
funktionell aus, Körpertemperatur und Atemmuster sind zunächst nicht
sehr stabil. Es besteht eine Azidoseneigung und Ödembereitschaft.
Am
Ende der Schwangerschaft beträgt die fetale Herzfrequenz 110-160
Schläge / Minute. Ein deutliches Absinken unter diesen Frequenzbereich
ist ein Zeichen eines Sauerstoffmangels - Ausdruck eines
Bradykardiereflexes, der bei Hypoxämie über die glomera carotica &
aortica des Feten ausgelöst wird (Kardiotokografie  s. ganz unten).
s. ganz unten).


Abbildung: Fetaler Kreislauf unmittelbar vor der Geburt
Nach Gao Y, Raj JU. Regulation of the Pulmonary Circulation in the Fetus and Newborn. Physiol Rev 2000; 90: 1271-90
Sauerstoffsättigung des Hämoglobins in grünen Kreisflächen: Die Hypoxie (Hb-Sättigung 45-65%) des Fetus ist physiologisch.
Schwarze Zahlen:
Perfusion in % des kombinierten Herzzeitvolumens (=Fördervolumen
rechter plus linker Ventrikel). Prozentzahlen geben den Anteil am
kombinierten rechts- (60%) und linksventrikulären (40%)
Herzminutenvolumens an.
AO, Aorta
 DA, ductus arteriosus (Botalli)
DA, ductus arteriosus (Botalli)  FO, foramen ovale
FO, foramen ovale  IVC, vena cava inferior
IVC, vena cava inferior  PA, Pulmonalarterie
PA, Pulmonalarterie  PV, Pulmonalvene
PV, Pulmonalvene  SVC, vena cava superior
SVC, vena cava superior

Die Pumpleistung des fetalen Herzens wird - wegen der teilweisen Überlagerung der Blutförderung des rechten und linken Herzens - als links- und
rechtsventrikulär kombiniertes Herzzeitvolumen angegeben. Der rechte Ventrikel fördert beim Fetus mehr Blut (60% des kombinierten Herzminutenvolumens,  Abbildung) als der linke (40%). Der fetale Kreislauf
läßt einen
Kurzschluss (shunt) zu
Abbildung) als der linke (40%). Der fetale Kreislauf
läßt einen
Kurzschluss (shunt) zu
 vom rechten zum linken Vorhof (foramen ovale: 19% des kombinierten Herzzeitvolumens) und
vom rechten zum linken Vorhof (foramen ovale: 19% des kombinierten Herzzeitvolumens) und
 von
der Pulmonalarterie in die Aorta (ductus
arteriosus: 39% des kombinierten Herzzeitvolumens,
von
der Pulmonalarterie in die Aorta (ductus
arteriosus: 39% des kombinierten Herzzeitvolumens,  Abbildung).
Das Resultat ist
eine weitgehende Umgehung des Lungenkreislaufs, bedingt durch den hohen
Strömungswiderstand der Pulmonalgefäße (hoher Vasomotorentonus). Für
den Pulmonalkreislauf bleiben nur ~21% des links- und
rechtsventrikulär kombinierten Herzzeitvolumens übrig (
Abbildung).
Das Resultat ist
eine weitgehende Umgehung des Lungenkreislaufs, bedingt durch den hohen
Strömungswiderstand der Pulmonalgefäße (hoher Vasomotorentonus). Für
den Pulmonalkreislauf bleiben nur ~21% des links- und
rechtsventrikulär kombinierten Herzzeitvolumens übrig ( Abbildung).
Umstellung der Hämodynamik. Die Gefäße stellen sich entsprechend den neuen
Anforderungen um: Der Plazentarkreislaufs fällt weg (und
damit ein Organs, das vorher die Hälfte des
Herzminutenvolumens konsumiert hat), die Gefäße in der
Lungenstrombahn öffnen sich, und Shunts werden geschlossen:
Abbildung).
Umstellung der Hämodynamik. Die Gefäße stellen sich entsprechend den neuen
Anforderungen um: Der Plazentarkreislaufs fällt weg (und
damit ein Organs, das vorher die Hälfte des
Herzminutenvolumens konsumiert hat), die Gefäße in der
Lungenstrombahn öffnen sich, und Shunts werden geschlossen:
 Das foramen
ovale
schließt sich rasch, aber oft nicht vollständig - bedingt durch den
Druckgradienten von linkem zu rechtem Vorhof (Klappenfunktion)
Das foramen
ovale
schließt sich rasch, aber oft nicht vollständig - bedingt durch den
Druckgradienten von linkem zu rechtem Vorhof (Klappenfunktion)
 Der ductus arteriosus Botalli okkludiert innerhalb weniger Stunden durch Kontraktion der Gefäßwand (steigender pO2?). Nach einigen Wochen ist das Lumen durch Thrombosierung und Abbau der Gefäßwand anatomisch verschlossen.
Gefäßtonus (pulmonary resistance) und damit Widerstand im Pulmonalkreislauf nehmen auf etwa die
Hälfte ab - unterstützt durch hohen Sauerstoffpartialdruck, zunehmende
Scherbelastung des Endothels sowie Weitung des Gefäßlumens durch
Restrukturierung der Gefäßwand. Dadurch nimmt die Durchblutung der
Lunge zu (von knapp 140 auf ~245 ml/min/kg), der Perfusionsdruck sinkt
von ~55 auf ~20 mmHg - bei erwachsenen Personen beträgt der Druck in den Lungenarterien 10-15 mmHg (systolisch 20-25, diastolisch ~10 mmHg).
Der periphere Gefäßwiderstand (total peripheral resistance) im "großen" Kreislauf nimmt zu - und damit auch der Blutdruck, der präpartal nur um ~60 mmHg beträgt.
Der ductus arteriosus Botalli okkludiert innerhalb weniger Stunden durch Kontraktion der Gefäßwand (steigender pO2?). Nach einigen Wochen ist das Lumen durch Thrombosierung und Abbau der Gefäßwand anatomisch verschlossen.
Gefäßtonus (pulmonary resistance) und damit Widerstand im Pulmonalkreislauf nehmen auf etwa die
Hälfte ab - unterstützt durch hohen Sauerstoffpartialdruck, zunehmende
Scherbelastung des Endothels sowie Weitung des Gefäßlumens durch
Restrukturierung der Gefäßwand. Dadurch nimmt die Durchblutung der
Lunge zu (von knapp 140 auf ~245 ml/min/kg), der Perfusionsdruck sinkt
von ~55 auf ~20 mmHg - bei erwachsenen Personen beträgt der Druck in den Lungenarterien 10-15 mmHg (systolisch 20-25, diastolisch ~10 mmHg).
Der periphere Gefäßwiderstand (total peripheral resistance) im "großen" Kreislauf nimmt zu - und damit auch der Blutdruck, der präpartal nur um ~60 mmHg beträgt.

Erster Atemzug: Mit der
Abnabelung tritt beim Neugeborenen akuter
Sauerstoffmangel auf, der - vermutlich in Kombination mit steigender
Hyperkapnie (Chemorezepteren - zentrale und periphere - nehmen mit der
Geburt ihre Funktion auf), taktilen Reizen und sinkender
Umgebungstemperatur -
reflektorisch zum ersten Atemzug
führt, womit die Füllung der Lunge mit Luft beginnt. Dieser Atemzug
(ca. 40 ml) geht - die Compliance der Lunge ist noch sehr gering - mit enormen Druckschwankungen einher (bis zu etwa 4-10 kPa,  Abbildung), was auch die Umstellung des Kreislaufs von
fetalem zu postpartalem Muster unterstützt (Schließung der Kreislaufshunts, also des foramen ovale und ductus arteriosus).
Abbildung), was auch die Umstellung des Kreislaufs von
fetalem zu postpartalem Muster unterstützt (Schließung der Kreislaufshunts, also des foramen ovale und ductus arteriosus).


 Abbildung: Druck-Volumen- Abfolge in der Lunge bei Neugeborenen: Erste Atemzüge und 40 Minuten nach der Geburt
Nach Smith CA, The first breath. Scientific American 1963; 209: 27-35
Abbildung: Druck-Volumen- Abfolge in der Lunge bei Neugeborenen: Erste Atemzüge und 40 Minuten nach der Geburt
Nach Smith CA, The first breath. Scientific American 1963; 209: 27-35
Nach der Geburt
wird das Baby durch eine Vielzahl taktiler, thermischer, visueller und
akustischer Reize überhäuft. Der Sauerstoffpartialdruck und der pH-Wert im Blut sinken, der pCO2 steigt an. All dies trägt zur Auslösung des ersten
Atemzuges bei. Dieser bedarf einer besonders intensiven Anstrengung, da die
Lunge noch flüssigkeitsgefüllt ist und die Atemwege einen hohen
Widerstand bieten

Beim ersten Atemzug treten extrem hohe Druckwerte auf ( Abbildung), die Einatmung wird durch
die Anwesenheit von Surfactants erleichtert.
Diese reduzieren die
Oberflächenspannung, die sich bei der Bildung von
Luft-Flüssigkeits-Grenzen in den Lungenbläschen aufbaut, um eine Zehnerpotenz.Elastische und Oberflächenkräfte erschweren die Inspiration, die
Druckschwankungen sind sehr hoch (eine Größenordnung
über dem Betrag späterer physiologischer Werte)
Abbildung), die Einatmung wird durch
die Anwesenheit von Surfactants erleichtert.
Diese reduzieren die
Oberflächenspannung, die sich bei der Bildung von
Luft-Flüssigkeits-Grenzen in den Lungenbläschen aufbaut, um eine Zehnerpotenz.Elastische und Oberflächenkräfte erschweren die Inspiration, die
Druckschwankungen sind sehr hoch (eine Größenordnung
über dem Betrag späterer physiologischer Werte),
um Luft in die mit Amnionflüssigkeit
gefüllte Lunge zu saugen und dabei zu entfalten. Die Alveolen sind noch kleiner, und ihre Zahl ist geringer (~10%) als bei Erwachsenen.
Einige Minuten postpartal erreicht die funktionelle Residualkapazität der Lunge des Neugeborenen einen Wert von ~20 ml/kg und steigt innerhalb weniger Stunden auf 30 ml/kg an. Das Atemzugvolumen beträgt ungefähr 20 ml (5-6 ml/kg), die Atemfrequenz ~30/min, was eine Atmung von 500-600 ml/min ergibt. Die Totraumbelüftung
macht 30-35% der Gesamtventilation aus (der Prozentsatz liegt etwas
höher als bei erwachsenen Personen). Die Totalkapazität der Lunge
beträgt ~60 ml/kg (bei 3,5 kg Geburtsgewicht ~210 ml), die Vitalkapazität davon die Hälfte (30 ml/kg).
Die Dehnbarkeit der Lunge (Compliance) ist noch gering und steigt innerhalb von Stunden postpartal deutlich an, von <2 auf >4 ml/cm H2O innerhalb von 24 Stunden. Der Atemwegwiderstand sinkt in derselben Zeitspanne von ~150 auf ~25 cm H2O/l/s. Das bedeutet insgesamt eine rasche postpartale Abnahme der Atemarbeit.
Vor der Geburt
sind die fetalen pO2- und pH-Werte
relativ niedrig ( Abbildung). Unter der Geburt
zeigt das Kind beträchtliche Hypoxie- und Azidosetoleranz. Innerhalb weniger Minuten stellt sich das Atemgasmuster beim Neugeborenen um:
Abbildung). Unter der Geburt
zeigt das Kind beträchtliche Hypoxie- und Azidosetoleranz. Innerhalb weniger Minuten stellt sich das Atemgasmuster beim Neugeborenen um:
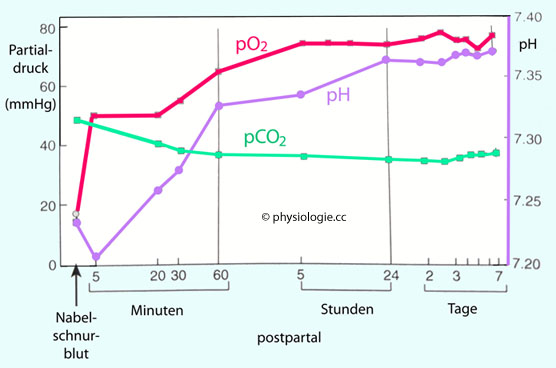
 Abbildung: Blutgase während der ersten Lebenswoche postpartal
Abbildung: Blutgase während der ersten Lebenswoche postpartal
Nacheiner Vorlage in Case / Waterhouse, Human Physiology^: Age Stress and the Environment. Oxford Medical Publication 1994
Zeitachse
logarithmisch. Sauerstoffpartialdruck und pH-Wert nehmen postpartal zu
(der pH-Wert sinkt zunächst unmittelbar nach der Geburt für einige
Minuten), der CO
2-Partialdruck stabilisiert sich von
~50 auf knapp 40 mmHg.
 Nabelschnurblut (cord blood) ist
das Blut, das sich in Plazenta und Nabelschnur befindet, nachdem das
Baby geboren und die Nabelschnur abgeklemmt bzw. durchtrennt worden
ist. Neben den üblichen Komponenten (Erythrozyten, Leukozyten,
Thrombozyten, Plasma) enthält es verschiedene Typen von - vorwiegend
hämatopoetischen, auch multipotenten - Stammzellen, die therapeutisch
genutzt werden können
Nabelschnurblut (cord blood) ist
das Blut, das sich in Plazenta und Nabelschnur befindet, nachdem das
Baby geboren und die Nabelschnur abgeklemmt bzw. durchtrennt worden
ist. Neben den üblichen Komponenten (Erythrozyten, Leukozyten,
Thrombozyten, Plasma) enthält es verschiedene Typen von - vorwiegend
hämatopoetischen, auch multipotenten - Stammzellen, die therapeutisch
genutzt werden können

Wie
die  Abbildung zeigt, beträgt der pO2 im Nabelschnurblut nur etwa 20
mmHg (<3 kPa) - ein Wert, bei dem HbA nur zu ca. einem Viertel, HbF aber schon zur Hälfte sauerstoffgesättigt ist (das Neugeborene verfügt noch über ~70% HbF).
So ist das Hämoglobin bei Fetus nur etwa zur Hälfte mit Sauerstoff
gesättigt, klettert dann aber - mit zunehmender alveolärer Ventilation
- beim Neugeborenen rasch auf Werte,
bei denen die Sauerstoffsättigung 80% übersteigt (vgl. dort).
Der Kohlendioxidwert sinkt von ca. 50 mmHg (der CO2-Austausch
in der Plazenta erfolgt sehr effizient) im Laufe von Stunden auf
Werte leicht unter 40 mmHg, um sich dann beim Normalwert von 40 mmHg
einzupendeln. Der pH-Wert des Blutes steigt nach einer anfänglichen
Reduktion (hohe Lactatwerte)
in Richtung Normalwert (7,4) an. Die
lactazidotische Stoffwechsellage weicht innerhalb weniger Tage einem
Muster, das dem erwachsener Personen nahe kommt.
Abbildung zeigt, beträgt der pO2 im Nabelschnurblut nur etwa 20
mmHg (<3 kPa) - ein Wert, bei dem HbA nur zu ca. einem Viertel, HbF aber schon zur Hälfte sauerstoffgesättigt ist (das Neugeborene verfügt noch über ~70% HbF).
So ist das Hämoglobin bei Fetus nur etwa zur Hälfte mit Sauerstoff
gesättigt, klettert dann aber - mit zunehmender alveolärer Ventilation
- beim Neugeborenen rasch auf Werte,
bei denen die Sauerstoffsättigung 80% übersteigt (vgl. dort).
Der Kohlendioxidwert sinkt von ca. 50 mmHg (der CO2-Austausch
in der Plazenta erfolgt sehr effizient) im Laufe von Stunden auf
Werte leicht unter 40 mmHg, um sich dann beim Normalwert von 40 mmHg
einzupendeln. Der pH-Wert des Blutes steigt nach einer anfänglichen
Reduktion (hohe Lactatwerte)
in Richtung Normalwert (7,4) an. Die
lactazidotische Stoffwechsellage weicht innerhalb weniger Tage einem
Muster, das dem erwachsener Personen nahe kommt.
 Gasanalysen im
kindlichen Blut helfen zu erkennen, ob
eine ausreichende Versorgung über die Nabelschnur erfolgt. Sinken die pO2-Werte, besteht die Gefahr hypoxischer Schädigung, und eine Sectio
kann notwendig werden.
Gasanalysen im
kindlichen Blut helfen zu erkennen, ob
eine ausreichende Versorgung über die Nabelschnur erfolgt. Sinken die pO2-Werte, besteht die Gefahr hypoxischer Schädigung, und eine Sectio
kann notwendig werden.
Der spezifische Sauerstoffverbrauch des
Neugeborenen beträgt (bei Indifferenztemperatur; Abfall der
Körpertemperatur erhöht den Sauerstoffbedarf des Babys erheblich)
ungefähr 7 ml O2 pro Minute pro kg Körpergewicht (beinahe das Doppelte des Wertes erwachsener Personen von ~4 ml/min/kg).
Bei mangelnder Surfactant-Bildung (Frühgeburten) kommt es zum Infant respiratory distress syndrome (Neugeborenen-Atemnotsyndrom): Die Alveolen füllen sich kaum mit Luft, es kommt zu Hypoxie. Eine CPAP-Beatmung (continuous positive airway pressure) kann notwendig werden.
Blut, fetales Hämoglobin
Der Hämatokrit im fetalen Blut ist höher (≥50%) als bei Erwachsenen (~40%), damit auch der Hämoglobingehalt sowie die Sauerstoffmenge pro Volumeneinheit Blut (hohe Sauerstofftransportkapazität des fetalen Blutes). Nachteil des gesteigerten Hämatokrit ist eine höhere Blutviskosität. Unmittelbar nach
der Geburt haben Säuglinge um ein Drittel höhere Erythrozyten-,
Hämoglobin- und Hämatokritwerte als Erwachsene. Die Erythrozyten enthalten noch viel fetales
Hämoglobin (HbF); dieses bindet Sauerstoff stärker als Erwachsenen-Hämoglobin (Abbildungen).


Abbildung: Expression von α- and β-Globin-Genen
Nach Storz JF, Gene Duplication and Evolutionary Innovations in Hemoglobin-Oxygen Transport. Physiology 2016; 31: 223-32
Oben: Funktionelle Optimierung wird erreicht, indem die Expression der Globingene ontogenetisch entsprechend reguliert wird. Die Kennkurven für die Sauerstoffbindung sind
unterschiedlich (s. dort).
Mitte: Die
Blutbildungsorgane sind zuerst der Dottersack, ab SSW 6 die Leber, ab
SSW 18 auch die Milz, und in der zweiten Schwangerschaftshälfte
zunehmend (ab dem 3. postpartalen Monat ausschließlich) das
Knochenmark.
Unten: Zeitverlauf der Anteile von α-, ζ-, γ- und β-Ketten an der Globinsynthese prä- und postpartal
 Zum fetalen Hämoglobin (HbF) s. auch dort
Zum fetalen Hämoglobin (HbF) s. auch dort
Durch
die steilere HbF-Bindungskurve kann - beim selben
Sauerstoffpartialdruck - eine erhebliche Menge Sauerstoff vom
mütterlichen auf das fetale Hämoglobin übertreten.
Im Differentialblutbild
fällt der hohe Anteil der Lymphozyten (bis 50%) auf (Erwachsener: ca.
25%).
Der Blutzuckerspiegel des
Neugeborenen sinkt - bedingt durch die hohe Glucosemetabolisierung von
4-8 mg/kg/min und das plötzliche Ausbleiben der plazentaren Versorgung
- innerhalb weniger Stunden postpartal auf etwa 2 mM ab, wobei die
Glykogenreserven der Leber aufgebraucht werden. Nimmt das
Baby Milch auf und kann so eine neue Balance des
Kohlenhydratmetabolismus finden (einschließlich Glukoneogenese aus
Alanin, Glycerin, Laktat durch entsprechende Enzyminduktion), kann der Glucosespiegel noch am ersten postpartalen Tag zum normalen Nüchternwert von 4-5 mM zurückkehren (s. auch dort).
Mit der gestiegenen Verfügbarkeit von Sauerstoff im Körper des Babys nimmt die Nutzung von Fettsäuren
für den Energiestoffwechsel zu. Etwa 16% des Körpergewichts eines
Neugeborenen entfällt auf Fettgewebe; Lipide werden über die fettreiche
Muttermilch fortlaufend zugeführt. Das Gehirn nutzt (neben Glucose) Ketonkörper - für bis zu 15% seines Energiebedarfs (der Stoffwechsel des Babys ist leicht ketotisch).
Ammoniak (NH3) ist das Endprodukt der plazentaren Desaminierung (primäres Abbauprodukt der Aminosäuren).
Es wird von der Umbilikalvene aufgenommen und kann zur Proteinsynthese
und Harnstoffsynthese in der fetalen Leber Verwendung finden.
Metabolische Schwierigkeiten unter der Geburt erhöhen u.a. den
Ammoniumspiegel; Nabelschnurblut wird dann auf Ammoniak / Ammonium untersucht. Die Konzentrationswerte
können physiologischerweise in einem weiten Bereich schwanken, im
Mittel liegen sie höher als im späteren Leben:
 Ammonium im Blut
Ammonium im Blut
Umbilikalarterie ~60 µM, Umbilikalvene ~50 µM
Normale klinische Referenzwerte  s. dort
s. dort
Bei Neugeborenen
liegt der Referenzbereich für den Serumspiegel bis etwa 140 µM/l; mit 1-6 Monaten bei 13-55 µM/l - praktisch gleich
wie beim Erwachsenen.
Verdauungssystem und Leber
Die Umstellungen im Verdauungsapparat sind durch Ausreifen der
Leberfunktionen und Einspielen der Resorptionsvorgänge gekennzeichnet.
Beginnend mit einem zunächst sterilen Darm, baut sich mit der Geburt im Neugeborenendarm schrittweise eine mikrobiologische Flora
auf (E. coli, Enterobakterien, Streptokokken..). Dies dauert mehrere
Jahre, die Besiedlungsdichte und -komplexität steigt mit zunehmendem
Lebensalter an, bis sich ein individualspezifisches Ökosystem etabliert
hat.
Eine
vorübergehende Überforderung der Leberfunktion bedingt den
physiologischen postnatalen Ikterus (Gelbsucht). Die Plazenta ermöglicht vor der
Geburt den Abtransport des aus Hämoglobin stammenden Bilirubins über
den mütterlichen Kreislauf, nach der Geburt wird das Bilirubin über die
Galle ausgeschieden. Der Neugeborenenikterus erreicht nach 4-5 Tagen
seinen Höhepunkt, Werte bis 20 mg/dl (20-facher Normalwert des
Erwachsenen), oder sogar höher, können noch toleriert werden.
Bei zu
steilem Anstieg (erhöhter Erythrozytenabbau bei
Blutgruppen-Inkompatibilität) muss wegen der Gefahr einer
Gehirnschädigung rechtzeitig therapiert werden: Phototherapie mit
UV-Licht, oder Blutaustausch über die Nabelvene: Die Menge geschädigter
Erythrozyten wird dadurch vermindert, und es fällt weniger Bilirubin
zur Ausscheidung an.
 Wehenhemmung (Tokolyse
Wehenhemmung (Tokolyse  ):
Treten zu früh regelmäßig Wehen
auf, kann der Uterus durch Gabe eines Wehenhemmers beruhigt werden.
Dies erfolgt mittels Oxytocinantagonisten, die Oxytocinrezeptoren kompetitiv blockieren (z.B. Atosiban) oder Sympathomimetika, die ß2-Rezeptoren anregen (z.B. Fenoterol) und damit die Myometriumzellen relaxieren. ß2-Sympathomimetika
wirken 2-3 Minuten nach intravenöser Injektion; als Nebenwirkung kann
der periphere Gefäßwiderstand sinken (Vasodilatation), was reflektorisch zu einer Erhöhung der Herzfrequenz führt.
):
Treten zu früh regelmäßig Wehen
auf, kann der Uterus durch Gabe eines Wehenhemmers beruhigt werden.
Dies erfolgt mittels Oxytocinantagonisten, die Oxytocinrezeptoren kompetitiv blockieren (z.B. Atosiban) oder Sympathomimetika, die ß2-Rezeptoren anregen (z.B. Fenoterol) und damit die Myometriumzellen relaxieren. ß2-Sympathomimetika
wirken 2-3 Minuten nach intravenöser Injektion; als Nebenwirkung kann
der periphere Gefäßwiderstand sinken (Vasodilatation), was reflektorisch zu einer Erhöhung der Herzfrequenz führt.
Wehenhemmer werden zur Vermeidung einer drohenden Frühgeburt oder zur Notfalltokolyse eingesetzt, d.h. wenn die Wehentätigkeit das Kind gefährdet.

 Abbildung: Ein Kardiotokogramm
Abbildung: Ein Kardiotokogramm
Synchrone peripartale Registrierung der fetalen Herzaktion (z.B. Ultraschall) und der Wehenstärke (Dehnungsmessgürtel).
Das Beispiel zeigt oben vorübergehende Abnahmen der fetalen Herzfrequenz (Dezelerationen), unten die entsprechende Wehenaktivität

Kardiotokographie
 (cardiotocography CTG,
(cardiotocography CTG,  Abbildung) nennt man die Registrierung der fetalen Herzaktion (meist über
Ultraschall-Doppler) zusammen mit der Wehenaktivität (Druckmesser:
Transducer - üblicherweise als Differenzdruckmesser: Tocodynamometrie) unter der Geburt. Die Intensität des wehenabhängigen
Drucksignals hängt stark von den anatomischen Gegebenheiten ab
(schwaches Signal bei großem Bauchumfang).
Abbildung) nennt man die Registrierung der fetalen Herzaktion (meist über
Ultraschall-Doppler) zusammen mit der Wehenaktivität (Druckmesser:
Transducer - üblicherweise als Differenzdruckmesser: Tocodynamometrie) unter der Geburt. Die Intensität des wehenabhängigen
Drucksignals hängt stark von den anatomischen Gegebenheiten ab
(schwaches Signal bei großem Bauchumfang).
Sauerstoffmangel beim Feten
(unter starken Wehen) führt zu einer Absenkung (Dezeleration) der
fetalen Herzfrequenz. Sinkt diese über mehrere Minuten auf unter 100
bpm, spricht man von einer schweren Bradykardie (normale Ruhefrequenz ~140 bpm).
Der postnatale Anstieg des Sauerstoffpartialdrucks beim Neugeborenen bedingt die Schließung des ductus arteriosus Botalli. Neugeborene, die unter Sauerstoffmangel
leiden (z.B. infolge Pneumonie), haben einen erhöhten pulmonalen
Gefäßwiderstand. Der ductus arteriosus schließt sich nicht und der
Rechts-Links-Shunt persistiert, was den Lungenkreislauf belastet.


 Wehen sind dreiphasig: Stadium incrementi, Akme, stadium decrementi.
Schwangerschaftswehen sind schmerzlos, Senkwehen treten 3-4 Wochen vor
dem Termin auf, Vorwehen einige Tage präpartal; Eröffnungswehen weiten
den Geburtskanal, Presswehen beginnen mit der kompletten Öffnung der
Zervix Wehen sind dreiphasig: Stadium incrementi, Akme, stadium decrementi.
Schwangerschaftswehen sind schmerzlos, Senkwehen treten 3-4 Wochen vor
dem Termin auf, Vorwehen einige Tage präpartal; Eröffnungswehen weiten
den Geburtskanal, Presswehen beginnen mit der kompletten Öffnung der
Zervix
 Der Uterus ist gegenüber Prostaglandinen immer empfindlich, gegenüber
Oxytozin erst präpartal: Hohe Östrogen- / niedrige Progesteronspiegel induzieren die Expression
von Oxytozinrezeptoren.
Dehnung des Geburtskanals initiiert den Ferguson-Reflex: Dehnungsreiz →
Oxytozin → stärkere Wehentätigkeit und Prostaglandinsynthese → Wehe →
stärkerer Dehnungsreiz. Relaxine (Plazenta, Chorion, Dezidua, corpus
luteum) weichen bindegewebige Strukturen auf, erhöhen Herzzeitvolumen
und Nierendurchblutung. CRH (Gehirn, Plazenta) erhöht DHEA und beeinflusst die Wehentätigkeit Der Uterus ist gegenüber Prostaglandinen immer empfindlich, gegenüber
Oxytozin erst präpartal: Hohe Östrogen- / niedrige Progesteronspiegel induzieren die Expression
von Oxytozinrezeptoren.
Dehnung des Geburtskanals initiiert den Ferguson-Reflex: Dehnungsreiz →
Oxytozin → stärkere Wehentätigkeit und Prostaglandinsynthese → Wehe →
stärkerer Dehnungsreiz. Relaxine (Plazenta, Chorion, Dezidua, corpus
luteum) weichen bindegewebige Strukturen auf, erhöhen Herzzeitvolumen
und Nierendurchblutung. CRH (Gehirn, Plazenta) erhöht DHEA und beeinflusst die Wehentätigkeit
 Schmerzen unter der Geburt betreffen das untere Uterussegment und die
Zervix (Projektion auf Th10-L1, paravertebral blockierbar), Vagina und
Beckenboden (Projektion auf S2-S4, Pundendusblockade), Blase, Urethra,
Rektum. Das steigert Sympathikustonus und Katecholaminspiegel, Atmung
(Hyperventilation), Herzminutenvolumen, peripheren Widerstand und
Blutdruck. Sinkende Uterusdurchblutung kann fetale Hypoxie bewirken Schmerzen unter der Geburt betreffen das untere Uterussegment und die
Zervix (Projektion auf Th10-L1, paravertebral blockierbar), Vagina und
Beckenboden (Projektion auf S2-S4, Pundendusblockade), Blase, Urethra,
Rektum. Das steigert Sympathikustonus und Katecholaminspiegel, Atmung
(Hyperventilation), Herzminutenvolumen, peripheren Widerstand und
Blutdruck. Sinkende Uterusdurchblutung kann fetale Hypoxie bewirken
 Der rechte Ventrikel fördert 60%, der linke 40% des kombinierten
Herzminutenvolumens. Der Lungenkreislauf ist vor der Geburt weitgehend verschlossen
(hoher Gefäßtonus), Shunts bestehen vom rechten zum linken Vorhof
(foramen ovale: 19%) und von der
Pulmonalarterie in die Aorta (ductus arteriosus: 39% des kombinierten
Herzzeitvolumens). Am Ende der Schwangerschaft beträgt die fetale
Herzfrequenz 120-160 bpm (Kardiotokografie) -
deutliches Absinken bedeutet Sauerstoffmangel (Bradykardiereflex). Der
um ≥50% höhere Hämatokrit im fetalen Blut bedeutet hohe
Sauerstofftransportkapazität, die Hb-Sauerstoffsättigung beträgt aber nur 45-65% Der rechte Ventrikel fördert 60%, der linke 40% des kombinierten
Herzminutenvolumens. Der Lungenkreislauf ist vor der Geburt weitgehend verschlossen
(hoher Gefäßtonus), Shunts bestehen vom rechten zum linken Vorhof
(foramen ovale: 19%) und von der
Pulmonalarterie in die Aorta (ductus arteriosus: 39% des kombinierten
Herzzeitvolumens). Am Ende der Schwangerschaft beträgt die fetale
Herzfrequenz 120-160 bpm (Kardiotokografie) -
deutliches Absinken bedeutet Sauerstoffmangel (Bradykardiereflex). Der
um ≥50% höhere Hämatokrit im fetalen Blut bedeutet hohe
Sauerstofftransportkapazität, die Hb-Sauerstoffsättigung beträgt aber nur 45-65%
 Der Fetus hat beträchtliche Hypoxie- und Azidosetoleranz. Die Plazenta
beansprucht die Hälfte seines Herzminutenvolumens; nach der Geburt
fällt dieser Anteil weg, die Pulmonalgefäße öffnen (pO2 und
Scherbelastung des Endothels
steigen, Gefäßwand restrukturiert sich), der Widerstand im
Pulmonalkreislauf sinkt, foramen ovale (Druckgradient von linkem zu
rechtem Vorhof) und ductus arteriosus Botalli schließen (zunehmender pO2).
Peripherer Gefäßwiderstand und Blutdruck (präpartal ~60 mmHg)
nehmen zu. Der erste Atemzug erzeugt hohe Druckwerte; die Einatmung wird durch Surfactants
erleichtert. Bis zur vollständigen Entfernung der Flüssigkeit aus der Lunge vergehen mehrere Tage Der Fetus hat beträchtliche Hypoxie- und Azidosetoleranz. Die Plazenta
beansprucht die Hälfte seines Herzminutenvolumens; nach der Geburt
fällt dieser Anteil weg, die Pulmonalgefäße öffnen (pO2 und
Scherbelastung des Endothels
steigen, Gefäßwand restrukturiert sich), der Widerstand im
Pulmonalkreislauf sinkt, foramen ovale (Druckgradient von linkem zu
rechtem Vorhof) und ductus arteriosus Botalli schließen (zunehmender pO2).
Peripherer Gefäßwiderstand und Blutdruck (präpartal ~60 mmHg)
nehmen zu. Der erste Atemzug erzeugt hohe Druckwerte; die Einatmung wird durch Surfactants
erleichtert. Bis zur vollständigen Entfernung der Flüssigkeit aus der Lunge vergehen mehrere Tage
 Nachgeburtswehen führen zum Auspressen der Plazenta, Nachwehen
fördern die Involution des Uterus: die Uterusdurchblutung nimmt
schlagartig ab, einige Stunden postpartal tritt für mehrere Tage
Dauerkontraktion (“tonische Retraktion”) auf, gefolgt von rhythmischen
Nachwehen, schließlich Laktationswehen Nachgeburtswehen führen zum Auspressen der Plazenta, Nachwehen
fördern die Involution des Uterus: die Uterusdurchblutung nimmt
schlagartig ab, einige Stunden postpartal tritt für mehrere Tage
Dauerkontraktion (“tonische Retraktion”) auf, gefolgt von rhythmischen
Nachwehen, schließlich Laktationswehen
 Das Neugeborene verliert postpartal (3-5 Tage) um bis zu 10% Gewicht;
Körpertemperatur und Atemmuster schwanken, es besteht Azidoseneigung
und Ödembereitschaft. Säuglinge können Blutglucose-Spiegel bis ~1,5 mM
ohne neurologische Ausfälle tolerieren. Die Leberfunktionen
stabilisieren sich
(Bilirubinabbau, Neugeborenenikterus) innerhalb von Wochen, die
Darmflora beginnt sich aufzubauen. Mit dem Stillen gelangen
hauptsächlich milchsäureproduzierende
Bakterien in den Darm des Kindes; Milchsäure erschwert die Ansiedelung
pathogener Bakterien
Das Neugeborene verliert postpartal (3-5 Tage) um bis zu 10% Gewicht;
Körpertemperatur und Atemmuster schwanken, es besteht Azidoseneigung
und Ödembereitschaft. Säuglinge können Blutglucose-Spiegel bis ~1,5 mM
ohne neurologische Ausfälle tolerieren. Die Leberfunktionen
stabilisieren sich
(Bilirubinabbau, Neugeborenenikterus) innerhalb von Wochen, die
Darmflora beginnt sich aufzubauen. Mit dem Stillen gelangen
hauptsächlich milchsäureproduzierende
Bakterien in den Darm des Kindes; Milchsäure erschwert die Ansiedelung
pathogener Bakterien
 Nach der Geburt entfällt der blockierende (prolactin-antagonistische)
Effekt hoher Östrogenspiegel auf die Laktogenese. Das Anlegen des Babys
löst den Stillreflex aus (Hypothalamus → Oxytozin: Kontraktion
myoepithelialer Zellen; Prolactin: Reifung der Brustdrüse). Das
"Einschießen" der Milch kommt
erst 2-3 Tage postpartal in Schwung. Die Laktogenese wird angeregt
durch Prolactin (primär), Insulin, Cortisol, Schilddrüsenhormone. Pro
Tag werden 450-1200 ml Milch gebildet
Nach der Geburt entfällt der blockierende (prolactin-antagonistische)
Effekt hoher Östrogenspiegel auf die Laktogenese. Das Anlegen des Babys
löst den Stillreflex aus (Hypothalamus → Oxytozin: Kontraktion
myoepithelialer Zellen; Prolactin: Reifung der Brustdrüse). Das
"Einschießen" der Milch kommt
erst 2-3 Tage postpartal in Schwung. Die Laktogenese wird angeregt
durch Prolactin (primär), Insulin, Cortisol, Schilddrüsenhormone. Pro
Tag werden 450-1200 ml Milch gebildet
 Der Kalorienbedarf des Babys beträgt ~600 kJ/kg/d (Erwachsene ~170
kJ/kg/d); es nimmt ~15-20% seines Körpergewichts an Milch täglich auf.
Muttermilch ist reich an Lactose;
Fettanteil und Brennwert (~70 Cal/dl) sind praktisch gleich hoch wie in
Kuhmilch, der Proteinanteil niedriger. Babys können Ketonkörper
verwerten und so den hohen Fettanteil der Muttermilch optimal nutzen.
Muttermilch enthält
individuell kombinierte Oligosaccharide (HMOs), diese fördern die
Vielfalt der mikrobiellen Flora des Babys und tragen zu seinem
Immunschutz bei. Laktoferrin wirkt antibakteriell / antiviral.
Muttermilch enthält oft wenig Vitamin D (UV-Licht,
Substitution) und K (Vitamin-K-Prophylaxe)
Der Kalorienbedarf des Babys beträgt ~600 kJ/kg/d (Erwachsene ~170
kJ/kg/d); es nimmt ~15-20% seines Körpergewichts an Milch täglich auf.
Muttermilch ist reich an Lactose;
Fettanteil und Brennwert (~70 Cal/dl) sind praktisch gleich hoch wie in
Kuhmilch, der Proteinanteil niedriger. Babys können Ketonkörper
verwerten und so den hohen Fettanteil der Muttermilch optimal nutzen.
Muttermilch enthält
individuell kombinierte Oligosaccharide (HMOs), diese fördern die
Vielfalt der mikrobiellen Flora des Babys und tragen zu seinem
Immunschutz bei. Laktoferrin wirkt antibakteriell / antiviral.
Muttermilch enthält oft wenig Vitamin D (UV-Licht,
Substitution) und K (Vitamin-K-Prophylaxe)
|

 Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.
Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.








 Mutter (Postpartalperiode)
Mutter (Postpartalperiode)  Neugeborenes (Postnatale Entwicklung)
Neugeborenes (Postnatale Entwicklung)
 Senologie
Senologie
 Core messages
Core messages Abbildung):
Abbildung): Anstieg der Muskelkraft (stadium incrementi)
Anstieg der Muskelkraft (stadium incrementi)
 Kontraktionsmaximum (Wehenspitze, Akme
Kontraktionsmaximum (Wehenspitze, Akme  )
) Erschlaffung
(stadium decrementi).
Erschlaffung
(stadium decrementi).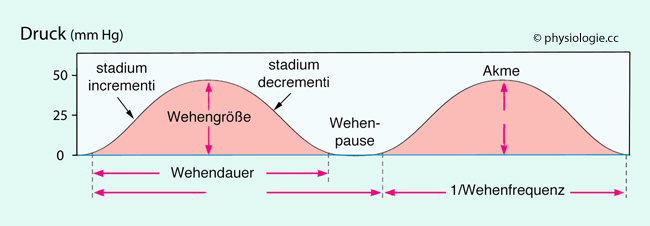
 Abbildung: Wehenstadien
Abbildung: Wehenstadien
 muss zu koordinierten Kontraktionen erst befähigt werden: Uterus, Plazenta und Fetus produzieren Prostaglandine, welche die Bildung von gap junctions
im Myometrium anregen (und dadurch Kontraktionen koordinieren helfen,
zusammen mit Östrogenen) und die Zervix aufweichen - sie entspannen den Geburtskanal
bei der Geburt. Auch Relaxine (Proteohormone) aus Gelbkörper, Plazenta und Dezidua wirkt erschlaffend auf den Geburtskanal.
muss zu koordinierten Kontraktionen erst befähigt werden: Uterus, Plazenta und Fetus produzieren Prostaglandine, welche die Bildung von gap junctions
im Myometrium anregen (und dadurch Kontraktionen koordinieren helfen,
zusammen mit Östrogenen) und die Zervix aufweichen - sie entspannen den Geburtskanal
bei der Geburt. Auch Relaxine (Proteohormone) aus Gelbkörper, Plazenta und Dezidua wirkt erschlaffend auf den Geburtskanal.  Der Uterus ist gegenüber Prostaglandinen immer empfindlich, reagiert in der 1. Schwangerschaftshälfte hingegen so gut wie nicht auf Oxytocin
Der Uterus ist gegenüber Prostaglandinen immer empfindlich, reagiert in der 1. Schwangerschaftshälfte hingegen so gut wie nicht auf Oxytocin  . Östrogene erhöhen die Zahl der Oxytocinrezeptoren
an den Myometriumzellen ab Schwangerschaftsmitte bis auf das 80-fache
und direkt vor der Geburt auf das 200-fache des Ruhewertes, unterstützt
durch den nunmehr
sinkenden Progesteronspiegel. Die
reflektorische Ausschüttung von Oxytozin zu Beginn der Geburt zusammen
mit der hohen Rezeptordichte bewirkt eine intensive Wehentätigkeit.
. Östrogene erhöhen die Zahl der Oxytocinrezeptoren
an den Myometriumzellen ab Schwangerschaftsmitte bis auf das 80-fache
und direkt vor der Geburt auf das 200-fache des Ruhewertes, unterstützt
durch den nunmehr
sinkenden Progesteronspiegel. Die
reflektorische Ausschüttung von Oxytozin zu Beginn der Geburt zusammen
mit der hohen Rezeptordichte bewirkt eine intensive Wehentätigkeit. :
Mehr
Oxytocin → stärkere Wehentätigkeit → stärkerer Dehnungsreiz). Die
Prostaglandinsynthese - vermittelt durch Cyclooxygenasen (COX1) - wird durch Oxytozin, und wie die
Oxytocinausschüttung durch Wehen angeregt.
:
Mehr
Oxytocin → stärkere Wehentätigkeit → stärkerer Dehnungsreiz). Die
Prostaglandinsynthese - vermittelt durch Cyclooxygenasen (COX1) - wird durch Oxytozin, und wie die
Oxytocinausschüttung durch Wehen angeregt. 

 Abbildung: Faktoren bei der Einleitung des Geburtsvorganges
Abbildung: Faktoren bei der Einleitung des Geburtsvorganges
 Verlagerung der Blutbildung von Leber, Milz, Plazenta in das rote Knochenmark
Verlagerung der Blutbildung von Leber, Milz, Plazenta in das rote Knochenmark
 Glykogenspeicherung in der Leber
Glykogenspeicherung in der Leber
 Enzymatische Ausstattung intestinaler Zellen
Enzymatische Ausstattung intestinaler Zellen
 Surfactantsynthese in der Lunge
Surfactantsynthese in der Lunge
 Abbildung). Gegen Ende der
Schwangerschaft steigt sein Blutspiegel stark an, und es werden mehrere
Rollen dieses Hormons für die Einleitung des Geburtsvorgangs vermutet:
Abbildung). Gegen Ende der
Schwangerschaft steigt sein Blutspiegel stark an, und es werden mehrere
Rollen dieses Hormons für die Einleitung des Geburtsvorgangs vermutet: CRH erhöht über Wirkung auf die fetale Nebenniere und das mütterliche Gehirn den Dehydroepiandrosteron- (DHEA)- Spiegel; DHEA fördert die Wehentätigkeit
CRH erhöht über Wirkung auf die fetale Nebenniere und das mütterliche Gehirn den Dehydroepiandrosteron- (DHEA)- Spiegel; DHEA fördert die Wehentätigkeit CRH steigert die Verfügbarkeit von Prostaglandinen im uteroplazentaren System; Prostaglandine triggern Wehen
CRH steigert die Verfügbarkeit von Prostaglandinen im uteroplazentaren System; Prostaglandine triggern Wehen CRH könnte vorher auch wehenmindernd wirken (durch Steigerung des cAMP im Myometrium).
CRH könnte vorher auch wehenmindernd wirken (durch Steigerung des cAMP im Myometrium). Schwangerschaftswehen
treten - unregelmäßig - während der gesamten Gravidität auf, sind schmerzlos und als
“Training” der Uterusmuskulatur anzusehen (Braxton-Hicks-Kontraktionen)
Schwangerschaftswehen
treten - unregelmäßig - während der gesamten Gravidität auf, sind schmerzlos und als
“Training” der Uterusmuskulatur anzusehen (Braxton-Hicks-Kontraktionen) Senkwehen bewirken das “Senken des Leibes” und treten 3-4 Wochen vor dem Geburtstermin auf
Senkwehen bewirken das “Senken des Leibes” und treten 3-4 Wochen vor dem Geburtstermin auf Vorwehen
beginnen einige Tage vor der Geburt und wirken als “Stellwehen”
(Einstellen des Feten); sie erfolgen unregelmäßig und sind oft so
stark, dass sie mit Eröffnungswehen verwechselt werden
Vorwehen
beginnen einige Tage vor der Geburt und wirken als “Stellwehen”
(Einstellen des Feten); sie erfolgen unregelmäßig und sind oft so
stark, dass sie mit Eröffnungswehen verwechselt werden Eröffnungswehen
treten regelmäßig auf, zuerst alle 10-15 Minuten, mit steigender
Wehenfrequenz bis zu 5minütigen Abständen. Sie führen zur Erweiterung
des Geburtskanals
Eröffnungswehen
treten regelmäßig auf, zuerst alle 10-15 Minuten, mit steigender
Wehenfrequenz bis zu 5minütigen Abständen. Sie führen zur Erweiterung
des Geburtskanals
 Abbildung: Phasen der Geburt
Abbildung: Phasen der Geburt
 Presswehen (“Schüttelwehen”) beginnen mit der kompletten Öffnung der Zervix und bewirken die Geburt (childbirth) des Kindes (Entbindung = delivery). Der Uteruskörper
umfasst das Kind und presst es, zusammen mit der Bauchpresse
(unterstützt durch richtige Atemtechnik), durch den Geburtskanal.
Presswehen (“Schüttelwehen”) beginnen mit der kompletten Öffnung der Zervix und bewirken die Geburt (childbirth) des Kindes (Entbindung = delivery). Der Uteruskörper
umfasst das Kind und presst es, zusammen mit der Bauchpresse
(unterstützt durch richtige Atemtechnik), durch den Geburtskanal.  Nachgeburtswehen
führen zum Auspressen der Plazenta, deren Perfusion zuvor sistiert. Das
Durchtrennen der Nabelschnur (und wahrscheinlich erhöhte
Katecholaminspiegel sowie sympathische Stimulation) führt zu Spasmen
der Umbilikalgefäße, die sich kontrahieren und so den Blutfluss (und
Blutverlust) stoppen.
Nachgeburtswehen
führen zum Auspressen der Plazenta, deren Perfusion zuvor sistiert. Das
Durchtrennen der Nabelschnur (und wahrscheinlich erhöhte
Katecholaminspiegel sowie sympathische Stimulation) führt zu Spasmen
der Umbilikalgefäße, die sich kontrahieren und so den Blutfluss (und
Blutverlust) stoppen.  Nachwehen
im
Wochenbett fördern die Zurückbildung (Involution) des Uterus (Oxytozin
wird auch beim Stillen ausgeschüttet) und fördern die Blutstillung
(Kontraktion der Blutgefäße).
Nachwehen
im
Wochenbett fördern die Zurückbildung (Involution) des Uterus (Oxytozin
wird auch beim Stillen ausgeschüttet) und fördern die Blutstillung
(Kontraktion der Blutgefäße). s. Schmerzmediatoren).
Starke Dehnung im unteren Uterus- sowie Zervixbereich stimuliert
darüber hinaus Mechanorezeptoren im Bereich des Geburtskanals -
inklusive Blase, Urethra und
Rektum.
s. Schmerzmediatoren).
Starke Dehnung im unteren Uterus- sowie Zervixbereich stimuliert
darüber hinaus Mechanorezeptoren im Bereich des Geburtskanals -
inklusive Blase, Urethra und
Rektum. Geburten erfolgen zeitlich breit gestreut - am Tag des errechneten Geburtstermins (ET) etwa 4% (jede 25. Geburt), und 66% in einem Zeitraum, der
zwischen Tag 270 und 290 liegt. Dies entspricht etwa dem Bereich der
einfachen Standardabweichung SD (~68%); 95% der Geburten (2 SD)
erfolgen in einem doppelt so großen Zeitraum, also ungefähr zwischen
Tag 260 und 300. Jede zwanzigste Spontangeburt findet außerhalb dieses Zeitrahmens statt.
Geburten erfolgen zeitlich breit gestreut - am Tag des errechneten Geburtstermins (ET) etwa 4% (jede 25. Geburt), und 66% in einem Zeitraum, der
zwischen Tag 270 und 290 liegt. Dies entspricht etwa dem Bereich der
einfachen Standardabweichung SD (~68%); 95% der Geburten (2 SD)
erfolgen in einem doppelt so großen Zeitraum, also ungefähr zwischen
Tag 260 und 300. Jede zwanzigste Spontangeburt findet außerhalb dieses Zeitrahmens statt. Laktation, Muttermilch
Laktation, Muttermilch  Steuerung der Brustdrüsen
Steuerung der Brustdrüsen  Abstillen
Abstillen  Hormonhaushalt
Hormonhaushalt  Nieren und Körperflüssigkeiten
Nieren und Körperflüssigkeiten  Blut und Kreislauf
Blut und Kreislauf (Wochenfluss) - ein normalerweise keimfreies, weitgehend geruchloses
Sekret - nach außen abgegeben. Die Lochien stammen aus Uterus, Zervix
und Vagina. Sie sind die ersten vier Tage durch Blut, Dezidua- und
Endometriumfragmente rot gefärbt, anschließend durch Schleim und
Leukozyten bräunlich, schließlich weiß (Schleim); Lochien können bis zu
5 Wochen lang auftreten.
(Wochenfluss) - ein normalerweise keimfreies, weitgehend geruchloses
Sekret - nach außen abgegeben. Die Lochien stammen aus Uterus, Zervix
und Vagina. Sie sind die ersten vier Tage durch Blut, Dezidua- und
Endometriumfragmente rot gefärbt, anschließend durch Schleim und
Leukozyten bräunlich, schließlich weiß (Schleim); Lochien können bis zu
5 Wochen lang auftreten.  Dauerkontraktion (“tonische Retraktion”) für 4-5 Tage, beginnend 4-5
Stunden nach der Nachgeburt;
Dauerkontraktion (“tonische Retraktion”) für 4-5 Tage, beginnend 4-5
Stunden nach der Nachgeburt;  Spontane, rhythmische Nachwehen (die nach
2-3 Tagen aufhören);
Spontane, rhythmische Nachwehen (die nach
2-3 Tagen aufhören);  Laktationswehen (“Reizwehen” durch den
Stillreflex: Oxytozinausschüttung reflektorisch beim Anlegen des
Kindes).
Laktationswehen (“Reizwehen” durch den
Stillreflex: Oxytozinausschüttung reflektorisch beim Anlegen des
Kindes).  Abbildung
unten) angeregt. Das Saugverhalten des Babys funktioniert auch dann,
wenn aus der Brust noch gar keine Milch kommt.
Abbildung
unten) angeregt. Das Saugverhalten des Babys funktioniert auch dann,
wenn aus der Brust noch gar keine Milch kommt. Falls es notwendig ist, rasch abzustillen (Mastitis = Entzünding der
Brustdrüse), kann dies mit einem Dopamin-Agonisten (z.B. Bromocriptin)
erfolgen - dadurch wird die Prolactinproduktion im
hypothalamisch-hypophysären System und damit die Milchbildung
unterdrückt.
Falls es notwendig ist, rasch abzustillen (Mastitis = Entzünding der
Brustdrüse), kann dies mit einem Dopamin-Agonisten (z.B. Bromocriptin)
erfolgen - dadurch wird die Prolactinproduktion im
hypothalamisch-hypophysären System und damit die Milchbildung
unterdrückt.
 Abbildung: Zusammensetzung reifer Muttermilch im Vergleich zu Kuhmilch
Abbildung: Zusammensetzung reifer Muttermilch im Vergleich zu Kuhmilch
 Bis zum 4.
postpartalen Tag wird Kolostrum
(Vormilch, colostrum, initial milk) sezerniert, eine dünnflüssige, gelbliche, eiweißreiche
Flüssigkeit (3-9% - wesentlich mehr als in reifer Muttermilch, auch mehr als in
Kuhmilch, vgl.
Bis zum 4.
postpartalen Tag wird Kolostrum
(Vormilch, colostrum, initial milk) sezerniert, eine dünnflüssige, gelbliche, eiweißreiche
Flüssigkeit (3-9% - wesentlich mehr als in reifer Muttermilch, auch mehr als in
Kuhmilch, vgl.  Abbildung). Kolostrum enthält 3% Fett, 4% Milchzucker (weniger als reife
Muttermilch), 0.4% Salze (Kalium, Calcium, Natrium / Chlorid, Phosphat) und Spurenelemente (mehr als reife
Muttermilch).
Abbildung). Kolostrum enthält 3% Fett, 4% Milchzucker (weniger als reife
Muttermilch), 0.4% Salze (Kalium, Calcium, Natrium / Chlorid, Phosphat) und Spurenelemente (mehr als reife
Muttermilch).
 Abbildung) tritt voll in Kraft. Das "Einschießen" der Milch wird als Galaktokinese
Abbildung) tritt voll in Kraft. Das "Einschießen" der Milch wird als Galaktokinese  (milk let down reflex) bezeichnet.
(milk let down reflex) bezeichnet.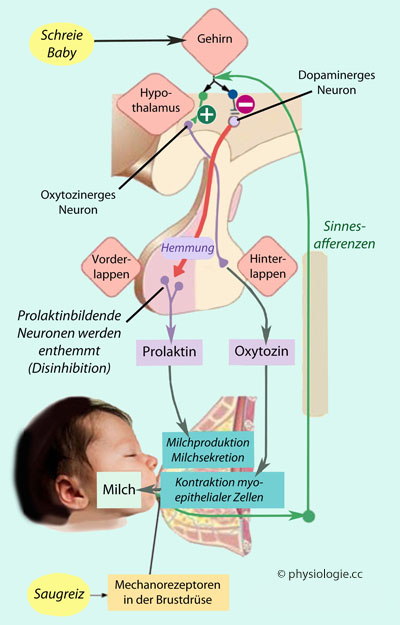
 Abbildung: Stillreflex
Abbildung: Stillreflex
 Reife Muttermilch ist nach ~2 Wochen postpartal gegeben. Sie enthält 88% Wasser, 1,3% Eiweiß
(u.a. Caseine), 4% Fett, knapp 7% Milchzucker (Lactose), 0.2%
Salze und Spurenelemente. Pro Tag werden etwa 800 ml Milch produziert; ihr Energiegehalt der Muttermilch beträgt 70 Cal (knapp 300 kJ) pro 100 ml.
Reife Muttermilch ist nach ~2 Wochen postpartal gegeben. Sie enthält 88% Wasser, 1,3% Eiweiß
(u.a. Caseine), 4% Fett, knapp 7% Milchzucker (Lactose), 0.2%
Salze und Spurenelemente. Pro Tag werden etwa 800 ml Milch produziert; ihr Energiegehalt der Muttermilch beträgt 70 Cal (knapp 300 kJ) pro 100 ml.  Die Milchproduktion bedeutet einen Energieaufwand von rund 2,6 MJ pro Tag (600-700
Cal, etwa ein Viertel des gesamten Energieumsatzes des Körpers).
Während der Schwangerschaft speichert der Körper der Mutter zusätzlich durchschnittlich 5 kg Fett im Körper, was eventuelle nutritive Defizite während der Stillperiode ausgleichen kann.
Die Milchproduktion bedeutet einen Energieaufwand von rund 2,6 MJ pro Tag (600-700
Cal, etwa ein Viertel des gesamten Energieumsatzes des Körpers).
Während der Schwangerschaft speichert der Körper der Mutter zusätzlich durchschnittlich 5 kg Fett im Körper, was eventuelle nutritive Defizite während der Stillperiode ausgleichen kann. So enthält Muttermilch wenig Vitamin D,
abhängig vom Vitaminstatus, der vor allem im Winter zu wünschen übrig läßt.
Nimmt allerdings die Mutter z.B. 50 µg (2000 IE) Vitamin D3 täglich zu sich, ist ihre Milch deutlich antirachitisch wirksam. Auch bildet der Säugling selbst Vitamin D3, falls die Haut ausreichend UV-Licht erhält.
So enthält Muttermilch wenig Vitamin D,
abhängig vom Vitaminstatus, der vor allem im Winter zu wünschen übrig läßt.
Nimmt allerdings die Mutter z.B. 50 µg (2000 IE) Vitamin D3 täglich zu sich, ist ihre Milch deutlich antirachitisch wirksam. Auch bildet der Säugling selbst Vitamin D3, falls die Haut ausreichend UV-Licht erhält. Vitamin K
wird kaum diaplazentar übertragen, auch die Muttermilch enthält nur
wenig davon. Abhängig von der Ernährung der Mutter enthält die Milch um
die 3 µg / 100 ml (Tagesbedarf für Kinder ~10 µg/kg Körpergewicht).
Eine Vitamin-K-Prophylaxe wird in den meisten Ländern der Welt
empfohlen, z.B. nach der Geburt, nach einer Woche und nach einem Monat
je 3 × 2 mg.
Vitamin K
wird kaum diaplazentar übertragen, auch die Muttermilch enthält nur
wenig davon. Abhängig von der Ernährung der Mutter enthält die Milch um
die 3 µg / 100 ml (Tagesbedarf für Kinder ~10 µg/kg Körpergewicht).
Eine Vitamin-K-Prophylaxe wird in den meisten Ländern der Welt
empfohlen, z.B. nach der Geburt, nach einer Woche und nach einem Monat
je 3 × 2 mg. Muttermilch enthält durchschnittlich 0,05 µg Vitamin B12
/100 ml (Kuhmilch 0,4 µg/100 ml) - abhängig vom Ernährungsverhalten.
Babies, die von vegan lebenden Müttern gestillt werden, können ohne
Zufuhr tierischer Lebensmittel im 2. Lebenshalbjahr
Vitaminmangelsymptome (megalozytäre Anämie) entwickeln, was allerdings durch bei vegetarischer Ernährungsweise typische hohe Folsäurezufuhr nicht selten überdeckt wird.
Muttermilch enthält durchschnittlich 0,05 µg Vitamin B12
/100 ml (Kuhmilch 0,4 µg/100 ml) - abhängig vom Ernährungsverhalten.
Babies, die von vegan lebenden Müttern gestillt werden, können ohne
Zufuhr tierischer Lebensmittel im 2. Lebenshalbjahr
Vitaminmangelsymptome (megalozytäre Anämie) entwickeln, was allerdings durch bei vegetarischer Ernährungsweise typische hohe Folsäurezufuhr nicht selten überdeckt wird. Über die Muttermilch können auch Medikamente aus dem Körper der Mutter
eliminiert werden, was zu unerwünschten Wirkungen beim Säugling führen
kann.
Über die Muttermilch können auch Medikamente aus dem Körper der Mutter
eliminiert werden, was zu unerwünschten Wirkungen beim Säugling führen
kann.
 Abbildung: Feinbau der Milchdrüse
Abbildung: Feinbau der Milchdrüse
 oxytozinbedingt Sekretion und Einschießen der Milch (Ejektion = Abpressen in die Ausführungsgänge - myoepitheliale Zellen umfassen die Drüsenazini und sind kontraktil) als auch
oxytozinbedingt Sekretion und Einschießen der Milch (Ejektion = Abpressen in die Ausführungsgänge - myoepitheliale Zellen umfassen die Drüsenazini und sind kontraktil) als auch prolactinbedingt erhöhte
Milchproduktion
prolactinbedingt erhöhte
Milchproduktion
 Abbildung: Milchbildung
Abbildung: Milchbildung
 Die Stillende hat - wie in der Schwangerschaft - einen erhöhten Eiweißbedarf
(1,2 - 2 g Protein / kg KG pro Tag). Fleisch, Fisch und Eier sind für
die Ernährung der stillenden Frau (in moderaten Mengen) angebracht,
auch mindestens einmal im Monat ~100 g Leber. Man geht davon aus, dass
die Energieaufnahme um ~300 Cal/d erhöht sein sollte.
Die Stillende hat - wie in der Schwangerschaft - einen erhöhten Eiweißbedarf
(1,2 - 2 g Protein / kg KG pro Tag). Fleisch, Fisch und Eier sind für
die Ernährung der stillenden Frau (in moderaten Mengen) angebracht,
auch mindestens einmal im Monat ~100 g Leber. Man geht davon aus, dass
die Energieaufnahme um ~300 Cal/d erhöht sein sollte.  Wie bei Substratmangel ermöglicht der Stoffwechsel des Säuglings die
Verwertung von Ketonkörpern (Acetoacetat, ß-Hydroxybutyrat). Damit kann er den hohen Fettanteil
der Muttermilch optimal nutzen. Säuglinge können Blutglucose-Spiegel
bis ~1,5 mM (Normalwert bei Erwachsenen 4-5 mM!) ohne neurologische Ausfälle tolerieren.
Wie bei Substratmangel ermöglicht der Stoffwechsel des Säuglings die
Verwertung von Ketonkörpern (Acetoacetat, ß-Hydroxybutyrat). Damit kann er den hohen Fettanteil
der Muttermilch optimal nutzen. Säuglinge können Blutglucose-Spiegel
bis ~1,5 mM (Normalwert bei Erwachsenen 4-5 mM!) ohne neurologische Ausfälle tolerieren.  Prolactin ist primärer Anreger der Milchbildung; seine Sekretion unterliegt mehrfacher Kontrolle, u.a. wird sie durch Dopamin gehemmt. Prolactin hat mehrere Wirkungen: Es wirkt mammogen (fördert das Brustdrüsenwachstum), lactogen (startet die Milchproduktion) und galactopoetisch
(es erhält die einmal in Gang gekommene Milchbildung). Die
Prolactinbildung bleibt die ersten drei postpartalen Wochen dauernd
erhöht und sinkt dann auf einen Blutwert, der - solange mit dem Stillen
fortgefahren wird - immer noch über dem Basisspiegel Nichtschwangerer
liegt. Das Stillen erhöht dann jedes Mal den Prolactinspiegel
vorübergehend weiter.
Prolactin ist primärer Anreger der Milchbildung; seine Sekretion unterliegt mehrfacher Kontrolle, u.a. wird sie durch Dopamin gehemmt. Prolactin hat mehrere Wirkungen: Es wirkt mammogen (fördert das Brustdrüsenwachstum), lactogen (startet die Milchproduktion) und galactopoetisch
(es erhält die einmal in Gang gekommene Milchbildung). Die
Prolactinbildung bleibt die ersten drei postpartalen Wochen dauernd
erhöht und sinkt dann auf einen Blutwert, der - solange mit dem Stillen
fortgefahren wird - immer noch über dem Basisspiegel Nichtschwangerer
liegt. Das Stillen erhöht dann jedes Mal den Prolactinspiegel
vorübergehend weiter. Abbildung), dabei steigt die Hormonkonzentration
im Blut innerhalb von 30 Minuten auf das 10- bis 100-fache an.
Frequenz und Dauer der Stillvorgänge korrelieren direkt mit dem Prolactinspiegel.
Abbildung), dabei steigt die Hormonkonzentration
im Blut innerhalb von 30 Minuten auf das 10- bis 100-fache an.
Frequenz und Dauer der Stillvorgänge korrelieren direkt mit dem Prolactinspiegel. Weitere Hormone sind für die Laktogenese erorderlich: Insulin, Cortisol, Schilddrüsenhormone. Das Fettgewebe der Brust exprimiert Aromatase (CYP19) und fördert die lokale Produktion von Östrogenen
aus zirkulierenden Androgenen. Hohe Steroidspiegel der
Schwangerschaftsperiode fördern des Wachstum und Verzweigungen des
Gang- und Alveolensystems der Brustdrüse. Östrogene fördern darüber
hinaus die Sekretion von Prolactin in laktotropen Zellen der
mütterlichen Hypophyse. Progesteron
hemmt die Produktion und Sekretion der Milch; erst der peripartale
Progesteronabfall gibt die Laktogenese innerhalb weniger Tage frei.
Weitere Hormone sind für die Laktogenese erorderlich: Insulin, Cortisol, Schilddrüsenhormone. Das Fettgewebe der Brust exprimiert Aromatase (CYP19) und fördert die lokale Produktion von Östrogenen
aus zirkulierenden Androgenen. Hohe Steroidspiegel der
Schwangerschaftsperiode fördern des Wachstum und Verzweigungen des
Gang- und Alveolensystems der Brustdrüse. Östrogene fördern darüber
hinaus die Sekretion von Prolactin in laktotropen Zellen der
mütterlichen Hypophyse. Progesteron
hemmt die Produktion und Sekretion der Milch; erst der peripartale
Progesteronabfall gibt die Laktogenese innerhalb weniger Tage frei. Das "Einschießen" der Milch ist bedingt durch
Oxytozin, das
aus dem Hypophysenhinterlappen reflektorisch durch den
Saugreiz an der Brustwarze freigesetzt wird (übrigens hat nicht einmal
jedes tausendste Neugeborene bei der Geburt schon Zähne - der erste
Milchzahn bricht im Schnitt erst mit 6-8 Monaten durch). Myoepitheliale
Zellen (
Das "Einschießen" der Milch ist bedingt durch
Oxytozin, das
aus dem Hypophysenhinterlappen reflektorisch durch den
Saugreiz an der Brustwarze freigesetzt wird (übrigens hat nicht einmal
jedes tausendste Neugeborene bei der Geburt schon Zähne - der erste
Milchzahn bricht im Schnitt erst mit 6-8 Monaten durch). Myoepitheliale
Zellen ( Abbildung) kontrahieren
sich und pressen aus den Alveolen
der Milchdrüse den Inhalt in die Milchgänge. Diese führen zu
sogenannten Strichkanälen, von denen 15 bis 20 in die Papille münden.
Abbildung) kontrahieren
sich und pressen aus den Alveolen
der Milchdrüse den Inhalt in die Milchgänge. Diese führen zu
sogenannten Strichkanälen, von denen 15 bis 20 in die Papille münden. Man sollte vermeiden, in hektischer Umgebung (Handygebrauch etc) zu
stillen. Weiters ist es sinnlos, die Stilldauer über 10-15 Minuten
hinaus zu verlängern.
Man sollte vermeiden, in hektischer Umgebung (Handygebrauch etc) zu
stillen. Weiters ist es sinnlos, die Stilldauer über 10-15 Minuten
hinaus zu verlängern. Primäres Abstillen liegt vor, wenn mit dem Stillen nach der Geburt gar nicht erst begonnen wird.
Primäres Abstillen liegt vor, wenn mit dem Stillen nach der Geburt gar nicht erst begonnen wird.  Wann der richtige Zeitpunkt des sekundären
Stillens gekommen ist, hängt von mehreren Faktoren ab (individuell,
gesundheitlich, kulturell u.a.). Allgemein wird empfohlen, mit dem
Stillen etwa 6 Monate fortzufahren (optimale Ernährung und
immunologischer Schutz des Säuglings). Das spontane Abstillalter (baby-led weaning)
kann beim Menschen mehrere Jahre betragen; üblicherweise wird (zunächst
breiige, erst später festere) Beikost zugefüttert, sobald die Zunge - einige Monate postpartal - festere Nahrung nicht mehr reflektorisch aus dem Mund schiebt (Zungenstoßreflex). Am besten erfolgt eine allmähliche Entwöhnung des Säuglings von der Brust.
Wann der richtige Zeitpunkt des sekundären
Stillens gekommen ist, hängt von mehreren Faktoren ab (individuell,
gesundheitlich, kulturell u.a.). Allgemein wird empfohlen, mit dem
Stillen etwa 6 Monate fortzufahren (optimale Ernährung und
immunologischer Schutz des Säuglings). Das spontane Abstillalter (baby-led weaning)
kann beim Menschen mehrere Jahre betragen; üblicherweise wird (zunächst
breiige, erst später festere) Beikost zugefüttert, sobald die Zunge - einige Monate postpartal - festere Nahrung nicht mehr reflektorisch aus dem Mund schiebt (Zungenstoßreflex). Am besten erfolgt eine allmähliche Entwöhnung des Säuglings von der Brust.  Die Lehre von der weiblichen Brust bezeichnet man als Senologie (nach frz. le sein, die Brust).
Die Lehre von der weiblichen Brust bezeichnet man als Senologie (nach frz. le sein, die Brust).  s. ganz unten).
s. ganz unten).
 Abbildung: Fetaler Kreislauf unmittelbar vor der Geburt
Abbildung: Fetaler Kreislauf unmittelbar vor der Geburt DA, ductus arteriosus (Botalli)
DA, ductus arteriosus (Botalli)  FO, foramen ovale
FO, foramen ovale  IVC, vena cava inferior
IVC, vena cava inferior  PA, Pulmonalarterie
PA, Pulmonalarterie  PV, Pulmonalvene
PV, Pulmonalvene  SVC, vena cava superior
SVC, vena cava superior
 Abbildung) als der linke (40%). Der fetale Kreislauf
läßt einen
Kurzschluss (shunt) zu
Abbildung) als der linke (40%). Der fetale Kreislauf
läßt einen
Kurzschluss (shunt) zu  vom rechten zum linken Vorhof (foramen ovale: 19% des kombinierten Herzzeitvolumens) und
vom rechten zum linken Vorhof (foramen ovale: 19% des kombinierten Herzzeitvolumens) und  von
der Pulmonalarterie in die Aorta (ductus
arteriosus: 39% des kombinierten Herzzeitvolumens,
von
der Pulmonalarterie in die Aorta (ductus
arteriosus: 39% des kombinierten Herzzeitvolumens,  Abbildung).
Abbildung).  Abbildung).
Abbildung). Das foramen
ovale
schließt sich rasch, aber oft nicht vollständig - bedingt durch den
Druckgradienten von linkem zu rechtem Vorhof (Klappenfunktion)
Das foramen
ovale
schließt sich rasch, aber oft nicht vollständig - bedingt durch den
Druckgradienten von linkem zu rechtem Vorhof (Klappenfunktion) Der ductus arteriosus Botalli okkludiert innerhalb weniger Stunden durch Kontraktion der Gefäßwand (steigender pO2?). Nach einigen Wochen ist das Lumen durch Thrombosierung und Abbau der Gefäßwand anatomisch verschlossen.
Der ductus arteriosus Botalli okkludiert innerhalb weniger Stunden durch Kontraktion der Gefäßwand (steigender pO2?). Nach einigen Wochen ist das Lumen durch Thrombosierung und Abbau der Gefäßwand anatomisch verschlossen. Abbildung), was auch die Umstellung des Kreislaufs von
fetalem zu postpartalem Muster unterstützt (Schließung der Kreislaufshunts, also des foramen ovale und ductus arteriosus).
Abbildung), was auch die Umstellung des Kreislaufs von
fetalem zu postpartalem Muster unterstützt (Schließung der Kreislaufshunts, also des foramen ovale und ductus arteriosus). Abbildung: Druck-Volumen- Abfolge in der Lunge bei Neugeborenen: Erste Atemzüge und 40 Minuten nach der Geburt
Abbildung: Druck-Volumen- Abfolge in der Lunge bei Neugeborenen: Erste Atemzüge und 40 Minuten nach der Geburt
 Abbildung), die Einatmung wird durch
die Anwesenheit von Surfactants erleichtert.
Diese reduzieren die
Oberflächenspannung, die sich bei der Bildung von
Luft-Flüssigkeits-Grenzen in den Lungenbläschen aufbaut, um eine Zehnerpotenz.Elastische und Oberflächenkräfte erschweren die Inspiration, die
Druckschwankungen sind sehr hoch (eine Größenordnung
über dem Betrag späterer physiologischer Werte),
um Luft in die mit Amnionflüssigkeit
gefüllte Lunge zu saugen und dabei zu entfalten. Die Alveolen sind noch kleiner, und ihre Zahl ist geringer (~10%) als bei Erwachsenen.
Abbildung), die Einatmung wird durch
die Anwesenheit von Surfactants erleichtert.
Diese reduzieren die
Oberflächenspannung, die sich bei der Bildung von
Luft-Flüssigkeits-Grenzen in den Lungenbläschen aufbaut, um eine Zehnerpotenz.Elastische und Oberflächenkräfte erschweren die Inspiration, die
Druckschwankungen sind sehr hoch (eine Größenordnung
über dem Betrag späterer physiologischer Werte),
um Luft in die mit Amnionflüssigkeit
gefüllte Lunge zu saugen und dabei zu entfalten. Die Alveolen sind noch kleiner, und ihre Zahl ist geringer (~10%) als bei Erwachsenen. Abbildung). Unter der Geburt
zeigt das Kind beträchtliche Hypoxie- und Azidosetoleranz. Innerhalb weniger Minuten stellt sich das Atemgasmuster beim Neugeborenen um:
Abbildung). Unter der Geburt
zeigt das Kind beträchtliche Hypoxie- und Azidosetoleranz. Innerhalb weniger Minuten stellt sich das Atemgasmuster beim Neugeborenen um: 
 Abbildung: Blutgase während der ersten Lebenswoche postpartal
Abbildung: Blutgase während der ersten Lebenswoche postpartal Nabelschnurblut (cord blood) ist
das Blut, das sich in Plazenta und Nabelschnur befindet, nachdem das
Baby geboren und die Nabelschnur abgeklemmt bzw. durchtrennt worden
ist. Neben den üblichen Komponenten (Erythrozyten, Leukozyten,
Thrombozyten, Plasma) enthält es verschiedene Typen von - vorwiegend
hämatopoetischen, auch multipotenten - Stammzellen, die therapeutisch
genutzt werden können
Nabelschnurblut (cord blood) ist
das Blut, das sich in Plazenta und Nabelschnur befindet, nachdem das
Baby geboren und die Nabelschnur abgeklemmt bzw. durchtrennt worden
ist. Neben den üblichen Komponenten (Erythrozyten, Leukozyten,
Thrombozyten, Plasma) enthält es verschiedene Typen von - vorwiegend
hämatopoetischen, auch multipotenten - Stammzellen, die therapeutisch
genutzt werden können
 Abbildung zeigt, beträgt der pO2 im Nabelschnurblut nur etwa 20
mmHg (<3 kPa) - ein Wert, bei dem HbA nur zu ca. einem Viertel, HbF aber schon zur Hälfte sauerstoffgesättigt ist (das Neugeborene verfügt noch über ~70% HbF).
So ist das Hämoglobin bei Fetus nur etwa zur Hälfte mit Sauerstoff
gesättigt, klettert dann aber - mit zunehmender alveolärer Ventilation
- beim Neugeborenen rasch auf Werte,
bei denen die Sauerstoffsättigung 80% übersteigt (vgl. dort).
Der Kohlendioxidwert sinkt von ca. 50 mmHg (der CO2-Austausch
in der Plazenta erfolgt sehr effizient) im Laufe von Stunden auf
Werte leicht unter 40 mmHg, um sich dann beim Normalwert von 40 mmHg
einzupendeln. Der pH-Wert des Blutes steigt nach einer anfänglichen
Reduktion (hohe Lactatwerte)
in Richtung Normalwert (7,4) an. Die
lactazidotische Stoffwechsellage weicht innerhalb weniger Tage einem
Muster, das dem erwachsener Personen nahe kommt.
Abbildung zeigt, beträgt der pO2 im Nabelschnurblut nur etwa 20
mmHg (<3 kPa) - ein Wert, bei dem HbA nur zu ca. einem Viertel, HbF aber schon zur Hälfte sauerstoffgesättigt ist (das Neugeborene verfügt noch über ~70% HbF).
So ist das Hämoglobin bei Fetus nur etwa zur Hälfte mit Sauerstoff
gesättigt, klettert dann aber - mit zunehmender alveolärer Ventilation
- beim Neugeborenen rasch auf Werte,
bei denen die Sauerstoffsättigung 80% übersteigt (vgl. dort).
Der Kohlendioxidwert sinkt von ca. 50 mmHg (der CO2-Austausch
in der Plazenta erfolgt sehr effizient) im Laufe von Stunden auf
Werte leicht unter 40 mmHg, um sich dann beim Normalwert von 40 mmHg
einzupendeln. Der pH-Wert des Blutes steigt nach einer anfänglichen
Reduktion (hohe Lactatwerte)
in Richtung Normalwert (7,4) an. Die
lactazidotische Stoffwechsellage weicht innerhalb weniger Tage einem
Muster, das dem erwachsener Personen nahe kommt. Gasanalysen im
kindlichen Blut helfen zu erkennen, ob
eine ausreichende Versorgung über die Nabelschnur erfolgt. Sinken die pO2-Werte, besteht die Gefahr hypoxischer Schädigung, und eine Sectio
kann notwendig werden.
Gasanalysen im
kindlichen Blut helfen zu erkennen, ob
eine ausreichende Versorgung über die Nabelschnur erfolgt. Sinken die pO2-Werte, besteht die Gefahr hypoxischer Schädigung, und eine Sectio
kann notwendig werden.
 Abbildung: Expression von α- and β-Globin-Genen
Abbildung: Expression von α- and β-Globin-Genen Zum fetalen Hämoglobin (HbF) s. auch dort
Zum fetalen Hämoglobin (HbF) s. auch dort Ammonium im Blut
Ammonium im Blut s. dort
s. dort Wehenhemmung (Tokolyse
Wehenhemmung (Tokolyse  ):
Treten zu früh regelmäßig Wehen
auf, kann der Uterus durch Gabe eines Wehenhemmers beruhigt werden.
Dies erfolgt mittels Oxytocinantagonisten, die Oxytocinrezeptoren kompetitiv blockieren (z.B. Atosiban) oder Sympathomimetika, die ß2-Rezeptoren anregen (z.B. Fenoterol) und damit die Myometriumzellen relaxieren. ß2-Sympathomimetika
wirken 2-3 Minuten nach intravenöser Injektion; als Nebenwirkung kann
der periphere Gefäßwiderstand sinken (Vasodilatation), was reflektorisch zu einer Erhöhung der Herzfrequenz führt.
):
Treten zu früh regelmäßig Wehen
auf, kann der Uterus durch Gabe eines Wehenhemmers beruhigt werden.
Dies erfolgt mittels Oxytocinantagonisten, die Oxytocinrezeptoren kompetitiv blockieren (z.B. Atosiban) oder Sympathomimetika, die ß2-Rezeptoren anregen (z.B. Fenoterol) und damit die Myometriumzellen relaxieren. ß2-Sympathomimetika
wirken 2-3 Minuten nach intravenöser Injektion; als Nebenwirkung kann
der periphere Gefäßwiderstand sinken (Vasodilatation), was reflektorisch zu einer Erhöhung der Herzfrequenz führt.
 Abbildung: Ein Kardiotokogramm
Abbildung: Ein Kardiotokogramm 
 (cardiotocography CTG,
(cardiotocography CTG,  Abbildung) nennt man die Registrierung der fetalen Herzaktion (meist über
Ultraschall-Doppler) zusammen mit der Wehenaktivität (Druckmesser:
Transducer - üblicherweise als Differenzdruckmesser: Tocodynamometrie) unter der Geburt. Die Intensität des wehenabhängigen
Drucksignals hängt stark von den anatomischen Gegebenheiten ab
(schwaches Signal bei großem Bauchumfang).
Abbildung) nennt man die Registrierung der fetalen Herzaktion (meist über
Ultraschall-Doppler) zusammen mit der Wehenaktivität (Druckmesser:
Transducer - üblicherweise als Differenzdruckmesser: Tocodynamometrie) unter der Geburt. Die Intensität des wehenabhängigen
Drucksignals hängt stark von den anatomischen Gegebenheiten ab
(schwaches Signal bei großem Bauchumfang). 
 Wehen sind dreiphasig: Stadium incrementi, Akme, stadium decrementi.
Schwangerschaftswehen sind schmerzlos, Senkwehen treten 3-4 Wochen vor
dem Termin auf, Vorwehen einige Tage präpartal; Eröffnungswehen weiten
den Geburtskanal, Presswehen beginnen mit der kompletten Öffnung der
Zervix
Wehen sind dreiphasig: Stadium incrementi, Akme, stadium decrementi.
Schwangerschaftswehen sind schmerzlos, Senkwehen treten 3-4 Wochen vor
dem Termin auf, Vorwehen einige Tage präpartal; Eröffnungswehen weiten
den Geburtskanal, Presswehen beginnen mit der kompletten Öffnung der
Zervix Der Uterus ist gegenüber Prostaglandinen immer empfindlich, gegenüber
Oxytozin erst präpartal: Hohe Östrogen- / niedrige Progesteronspiegel induzieren die Expression
von Oxytozinrezeptoren.
Dehnung des Geburtskanals initiiert den Ferguson-Reflex: Dehnungsreiz →
Oxytozin → stärkere Wehentätigkeit und Prostaglandinsynthese → Wehe →
stärkerer Dehnungsreiz. Relaxine (Plazenta, Chorion, Dezidua, corpus
luteum) weichen bindegewebige Strukturen auf, erhöhen Herzzeitvolumen
und Nierendurchblutung. CRH (Gehirn, Plazenta) erhöht DHEA und beeinflusst die Wehentätigkeit
Der Uterus ist gegenüber Prostaglandinen immer empfindlich, gegenüber
Oxytozin erst präpartal: Hohe Östrogen- / niedrige Progesteronspiegel induzieren die Expression
von Oxytozinrezeptoren.
Dehnung des Geburtskanals initiiert den Ferguson-Reflex: Dehnungsreiz →
Oxytozin → stärkere Wehentätigkeit und Prostaglandinsynthese → Wehe →
stärkerer Dehnungsreiz. Relaxine (Plazenta, Chorion, Dezidua, corpus
luteum) weichen bindegewebige Strukturen auf, erhöhen Herzzeitvolumen
und Nierendurchblutung. CRH (Gehirn, Plazenta) erhöht DHEA und beeinflusst die Wehentätigkeit  Schmerzen unter der Geburt betreffen das untere Uterussegment und die
Zervix (Projektion auf Th10-L1, paravertebral blockierbar), Vagina und
Beckenboden (Projektion auf S2-S4, Pundendusblockade), Blase, Urethra,
Rektum. Das steigert Sympathikustonus und Katecholaminspiegel, Atmung
(Hyperventilation), Herzminutenvolumen, peripheren Widerstand und
Blutdruck. Sinkende Uterusdurchblutung kann fetale Hypoxie bewirken
Schmerzen unter der Geburt betreffen das untere Uterussegment und die
Zervix (Projektion auf Th10-L1, paravertebral blockierbar), Vagina und
Beckenboden (Projektion auf S2-S4, Pundendusblockade), Blase, Urethra,
Rektum. Das steigert Sympathikustonus und Katecholaminspiegel, Atmung
(Hyperventilation), Herzminutenvolumen, peripheren Widerstand und
Blutdruck. Sinkende Uterusdurchblutung kann fetale Hypoxie bewirken Der rechte Ventrikel fördert 60%, der linke 40% des kombinierten
Herzminutenvolumens. Der Lungenkreislauf ist vor der Geburt weitgehend verschlossen
(hoher Gefäßtonus), Shunts bestehen vom rechten zum linken Vorhof
(foramen ovale: 19%) und von der
Pulmonalarterie in die Aorta (ductus arteriosus: 39% des kombinierten
Herzzeitvolumens). Am Ende der Schwangerschaft beträgt die fetale
Herzfrequenz 120-160 bpm (Kardiotokografie) -
deutliches Absinken bedeutet Sauerstoffmangel (Bradykardiereflex). Der
um ≥50% höhere Hämatokrit im fetalen Blut bedeutet hohe
Sauerstofftransportkapazität, die Hb-Sauerstoffsättigung beträgt aber nur 45-65%
Der rechte Ventrikel fördert 60%, der linke 40% des kombinierten
Herzminutenvolumens. Der Lungenkreislauf ist vor der Geburt weitgehend verschlossen
(hoher Gefäßtonus), Shunts bestehen vom rechten zum linken Vorhof
(foramen ovale: 19%) und von der
Pulmonalarterie in die Aorta (ductus arteriosus: 39% des kombinierten
Herzzeitvolumens). Am Ende der Schwangerschaft beträgt die fetale
Herzfrequenz 120-160 bpm (Kardiotokografie) -
deutliches Absinken bedeutet Sauerstoffmangel (Bradykardiereflex). Der
um ≥50% höhere Hämatokrit im fetalen Blut bedeutet hohe
Sauerstofftransportkapazität, die Hb-Sauerstoffsättigung beträgt aber nur 45-65% Der Fetus hat beträchtliche Hypoxie- und Azidosetoleranz. Die Plazenta
beansprucht die Hälfte seines Herzminutenvolumens; nach der Geburt
fällt dieser Anteil weg, die Pulmonalgefäße öffnen (pO2 und
Scherbelastung des Endothels
steigen, Gefäßwand restrukturiert sich), der Widerstand im
Pulmonalkreislauf sinkt, foramen ovale (Druckgradient von linkem zu
rechtem Vorhof) und ductus arteriosus Botalli schließen (zunehmender pO2).
Peripherer Gefäßwiderstand und Blutdruck (präpartal ~60 mmHg)
nehmen zu. Der erste Atemzug erzeugt hohe Druckwerte; die Einatmung wird durch Surfactants
erleichtert. Bis zur vollständigen Entfernung der Flüssigkeit aus der Lunge vergehen mehrere Tage
Der Fetus hat beträchtliche Hypoxie- und Azidosetoleranz. Die Plazenta
beansprucht die Hälfte seines Herzminutenvolumens; nach der Geburt
fällt dieser Anteil weg, die Pulmonalgefäße öffnen (pO2 und
Scherbelastung des Endothels
steigen, Gefäßwand restrukturiert sich), der Widerstand im
Pulmonalkreislauf sinkt, foramen ovale (Druckgradient von linkem zu
rechtem Vorhof) und ductus arteriosus Botalli schließen (zunehmender pO2).
Peripherer Gefäßwiderstand und Blutdruck (präpartal ~60 mmHg)
nehmen zu. Der erste Atemzug erzeugt hohe Druckwerte; die Einatmung wird durch Surfactants
erleichtert. Bis zur vollständigen Entfernung der Flüssigkeit aus der Lunge vergehen mehrere Tage Nachgeburtswehen führen zum Auspressen der Plazenta, Nachwehen
fördern die Involution des Uterus: die Uterusdurchblutung nimmt
schlagartig ab, einige Stunden postpartal tritt für mehrere Tage
Dauerkontraktion (“tonische Retraktion”) auf, gefolgt von rhythmischen
Nachwehen, schließlich Laktationswehen
Nachgeburtswehen führen zum Auspressen der Plazenta, Nachwehen
fördern die Involution des Uterus: die Uterusdurchblutung nimmt
schlagartig ab, einige Stunden postpartal tritt für mehrere Tage
Dauerkontraktion (“tonische Retraktion”) auf, gefolgt von rhythmischen
Nachwehen, schließlich Laktationswehen Das Neugeborene verliert postpartal (3-5 Tage) um bis zu 10% Gewicht;
Körpertemperatur und Atemmuster schwanken, es besteht Azidoseneigung
und Ödembereitschaft. Säuglinge können Blutglucose-Spiegel bis ~1,5 mM
ohne neurologische Ausfälle tolerieren. Die Leberfunktionen
stabilisieren sich
(Bilirubinabbau, Neugeborenenikterus) innerhalb von Wochen, die
Darmflora beginnt sich aufzubauen. Mit dem Stillen gelangen
hauptsächlich milchsäureproduzierende
Bakterien in den Darm des Kindes; Milchsäure erschwert die Ansiedelung
pathogener Bakterien
Das Neugeborene verliert postpartal (3-5 Tage) um bis zu 10% Gewicht;
Körpertemperatur und Atemmuster schwanken, es besteht Azidoseneigung
und Ödembereitschaft. Säuglinge können Blutglucose-Spiegel bis ~1,5 mM
ohne neurologische Ausfälle tolerieren. Die Leberfunktionen
stabilisieren sich
(Bilirubinabbau, Neugeborenenikterus) innerhalb von Wochen, die
Darmflora beginnt sich aufzubauen. Mit dem Stillen gelangen
hauptsächlich milchsäureproduzierende
Bakterien in den Darm des Kindes; Milchsäure erschwert die Ansiedelung
pathogener Bakterien Nach der Geburt entfällt der blockierende (prolactin-antagonistische)
Effekt hoher Östrogenspiegel auf die Laktogenese. Das Anlegen des Babys
löst den Stillreflex aus (Hypothalamus → Oxytozin: Kontraktion
myoepithelialer Zellen; Prolactin: Reifung der Brustdrüse). Das
"Einschießen" der Milch kommt
erst 2-3 Tage postpartal in Schwung. Die Laktogenese wird angeregt
durch Prolactin (primär), Insulin, Cortisol, Schilddrüsenhormone. Pro
Tag werden 450-1200 ml Milch gebildet
Nach der Geburt entfällt der blockierende (prolactin-antagonistische)
Effekt hoher Östrogenspiegel auf die Laktogenese. Das Anlegen des Babys
löst den Stillreflex aus (Hypothalamus → Oxytozin: Kontraktion
myoepithelialer Zellen; Prolactin: Reifung der Brustdrüse). Das
"Einschießen" der Milch kommt
erst 2-3 Tage postpartal in Schwung. Die Laktogenese wird angeregt
durch Prolactin (primär), Insulin, Cortisol, Schilddrüsenhormone. Pro
Tag werden 450-1200 ml Milch gebildet Der Kalorienbedarf des Babys beträgt ~600 kJ/kg/d (Erwachsene ~170
kJ/kg/d); es nimmt ~15-20% seines Körpergewichts an Milch täglich auf.
Muttermilch ist reich an Lactose;
Fettanteil und Brennwert (~70 Cal/dl) sind praktisch gleich hoch wie in
Kuhmilch, der Proteinanteil niedriger. Babys können Ketonkörper
verwerten und so den hohen Fettanteil der Muttermilch optimal nutzen.
Muttermilch enthält
individuell kombinierte Oligosaccharide (HMOs), diese fördern die
Vielfalt der mikrobiellen Flora des Babys und tragen zu seinem
Immunschutz bei. Laktoferrin wirkt antibakteriell / antiviral.
Muttermilch enthält oft wenig Vitamin D (UV-Licht,
Substitution) und K (Vitamin-K-Prophylaxe)
Der Kalorienbedarf des Babys beträgt ~600 kJ/kg/d (Erwachsene ~170
kJ/kg/d); es nimmt ~15-20% seines Körpergewichts an Milch täglich auf.
Muttermilch ist reich an Lactose;
Fettanteil und Brennwert (~70 Cal/dl) sind praktisch gleich hoch wie in
Kuhmilch, der Proteinanteil niedriger. Babys können Ketonkörper
verwerten und so den hohen Fettanteil der Muttermilch optimal nutzen.
Muttermilch enthält
individuell kombinierte Oligosaccharide (HMOs), diese fördern die
Vielfalt der mikrobiellen Flora des Babys und tragen zu seinem
Immunschutz bei. Laktoferrin wirkt antibakteriell / antiviral.
Muttermilch enthält oft wenig Vitamin D (UV-Licht,
Substitution) und K (Vitamin-K-Prophylaxe)