



 Bartholin-Drüse: Caspar Bartholin d.J.
Bartholin-Drüse: Caspar Bartholin d.J.| Das
Reproduktionssystem der Frau produziert haploide Gameten (Eizellen),
ermöglicht Syngamie (Befruchtung), Implantation (in die
Uterusschleimhaut) und Gravidität, während der der Embryo / Fetus
geschützt und ernährt werden kann und die mit dem Geburtsvorgang
abgeschlossen wird. Seine Funktionen stehen unter der Kontrolle des
Gehirns, das über das hypothalamisch- hypophysäre System und dessen
Gonadotropine steuernd eingreifen kann und unter dem rückkoppelnden
Einfluss peripherer Vorgänge steht. Im Ovar kooperieren Granulosa- und Thekazellen bei der Steroidhormonsynthese: Thekazellen nehmen LDL-Cholesterin aus dem Blut auf und bilden daraus Progesteron und Androgene. Granulosazellen verfügen über Aromatase und bilden Östrogene, können aber wiederum Progesteron nicht zu Androstendion umwandeln, sie "senden" es zurück zur Thekazelle, wo die Synthesekette vollendet wird. Im Ovar entstehen auch Peptide, welche - neben Östrogenen und Progesteron - die Freisetzung von Gonadotropinen aus dem Hypophysenvorderlappen modulieren (Inhibine, Aktivine). Östrogene (E: estrogen) wirken auf spezifische Rezeptoren (R), die unterschiedlich auf die Gewebe verteilt sind: -- ERα in Uterus, Scheide, Brustdrüse, Hypothalamus, Blutgefäßen, Knochen steuern u.a. reproduktives Verhalten, Entwicklung der Brust, Stabilisierung der Knochendichte, Energieumsatz (+), Nahrungsaufnahme (+), Insulinempfindlichkeit (+), Glucoseproduktion (-), Adipogenese (-) -- ERβ in Ovar, Lunge, Gehirn, Milz, Thymus sind u.a. involviert in reproduktives Verhalten, Ovulation, Immunfunktionen, Energieumsatz (+), Nahrungsaufnahme (-), Adipogenese (-), Insulinsensitivität (-). Progesteron fördert das Brustwachstum, regt Sekretion und Zellreifung im Endometrium an, hebt die Basaltemperatur, stabilisiert die Frühschwangerschaft. Praktisch alle Progesteroneffekte bedürfen des Zusammenwirkens mit Östrogenen. |
 Entwicklung und Steuerung, Pubertät
Entwicklung und Steuerung, Pubertät  Physiologie der Follikel
Physiologie der Follikel  Kooperation Theka- / Granulosazellen
Kooperation Theka- / Granulosazellen  Gonadotrope Steuerung
Gonadotrope Steuerung  Bildung und Abbau weiblicher Sexualhormone
Bildung und Abbau weiblicher Sexualhormone  Östrogene, Östrogenrezeptoren, Östrogenwirkungen
Östrogene, Östrogenrezeptoren, Östrogenwirkungen  Gestagene
Gestagene
 Androgene
Androgene  Synposis: Wirkung von Östrogenen und Progesteron auf Organe / Gewebe / Systeme
Synposis: Wirkung von Östrogenen und Progesteron auf Organe / Gewebe / Systeme Ovarielle Reserve
Ovarielle Reserve
 , Fallopian tube) und Cervix (Gebärmutterhals), Vagina - und äußere Geschlechtsorgane (Vulva: mons
pubis, Labien, Bartholin-Drüsen
, Fallopian tube) und Cervix (Gebärmutterhals), Vagina - und äußere Geschlechtsorgane (Vulva: mons
pubis, Labien, Bartholin-Drüsen , Klitoris
, Klitoris ).
).  Aufgabe der Ovarien ist die Produktion von Eizellen
Aufgabe der Ovarien ist die Produktion von Eizellen Aufgabe der Tube ist der Transport der Eizelle nach ihrer Ovulation sowie die Vorbereitung von Spermien auf die Fertilisierung
Aufgabe der Tube ist der Transport der Eizelle nach ihrer Ovulation sowie die Vorbereitung von Spermien auf die Fertilisierung Aufgabe des Uterus ist die Beherbergung und Ernährung der embryonalen /
fetalen Frucht sowie die Austreibung des Feten bei der Geburt
Aufgabe des Uterus ist die Beherbergung und Ernährung der embryonalen /
fetalen Frucht sowie die Austreibung des Feten bei der Geburt
 Abbildung: Reproduktionssystem der Frau
Abbildung: Reproduktionssystem der Frau

 Abbildung: Hormonachse bei der Frau
Abbildung: Hormonachse bei der Frau
 Die Abwesenheit eines Y-Chromosoms bedeutet das Fehlen des SRY-Gens (kein TDF) und die Expression weiblicher Transkriptionsfaktoren. Die Wolff-Gänge regredieren, denn Testosteron (Leydig-Zellen) wird nicht gebildet, auch keine Sertoli-Zellen (Anti-Müller-Hormon AMH).
Die Abwesenheit eines Y-Chromosoms bedeutet das Fehlen des SRY-Gens (kein TDF) und die Expression weiblicher Transkriptionsfaktoren. Die Wolff-Gänge regredieren, denn Testosteron (Leydig-Zellen) wird nicht gebildet, auch keine Sertoli-Zellen (Anti-Müller-Hormon AMH). Die Abwesenheit von AMH bedingt die Entwicklung der Müller-Gänge und damit die Ausbildung von Eileiter, Uterus, Zervix und innerer Vagina.
Die Abwesenheit von AMH bedingt die Entwicklung der Müller-Gänge und damit die Ausbildung von Eileiter, Uterus, Zervix und innerer Vagina.  Die Abwesenheit von DHT führt zur Ausformung der äußeren Vagina, Labien, Clitoris sowie vestibulärer Drüsen.
Die Abwesenheit von DHT führt zur Ausformung der äußeren Vagina, Labien, Clitoris sowie vestibulärer Drüsen. , bei dem wegen des Fehlens von Ovarialfollikeln kein Eisprung erfolgt und Infertilität besteht.
, bei dem wegen des Fehlens von Ovarialfollikeln kein Eisprung erfolgt und Infertilität besteht. Im Gegensatz zum männlichen Organismus - bei dem Spermatogonien erst ab der Pubertät intensiver mitotischer Proliferation unterliegen - erfolgt im weiblichen Fetus die mitotische Teilung der Oogonien
(Phase 2 der Gametogenese) schon früh: Ab dem 2. Schwangerschaftsmonat teilen sich die Oogonien und erreichen im 5. Monat (bis zur ~20. Gestationswoche) ihre Höchtzahl von ca. 7 Millionen. Die Meiose der Oogonien und das Arretieren in der
ersten meiotischen Prophase beginnt in der 7.-12.
Gestationswoche. Anschließend treten die Oogonien in die 1. Reifeteilung ein.
Im Gegensatz zum männlichen Organismus - bei dem Spermatogonien erst ab der Pubertät intensiver mitotischer Proliferation unterliegen - erfolgt im weiblichen Fetus die mitotische Teilung der Oogonien
(Phase 2 der Gametogenese) schon früh: Ab dem 2. Schwangerschaftsmonat teilen sich die Oogonien und erreichen im 5. Monat (bis zur ~20. Gestationswoche) ihre Höchtzahl von ca. 7 Millionen. Die Meiose der Oogonien und das Arretieren in der
ersten meiotischen Prophase beginnt in der 7.-12.
Gestationswoche. Anschließend treten die Oogonien in die 1. Reifeteilung ein.  ummantelt, es entstehen primordiale Follikel. In utero bleiben die Ovarien hormonell inaktiv.
ummantelt, es entstehen primordiale Follikel. In utero bleiben die Ovarien hormonell inaktiv. Arretiertes Diplotän, Ruhephase
in der Oogenese). Dieser individuelle Vorrat an Oozyten ist dann vorgegeben und nimmt mit zunehmendem Alter immer weiter ab (
Arretiertes Diplotän, Ruhephase
in der Oogenese). Dieser individuelle Vorrat an Oozyten ist dann vorgegeben und nimmt mit zunehmendem Alter immer weiter ab ( s. dort).
s. dort). (Entwicklung der weiblichen Brüste). Die Menarche
(Entwicklung der weiblichen Brüste). Die Menarche (Beginn der Monatsblutungen) erfolgt im 9.-14. Lebensjahr (dieses Alter
ist über die letzten hundert Jahre in Europa gesunken, aus nicht ganz
geklärten Gründen).
(Beginn der Monatsblutungen) erfolgt im 9.-14. Lebensjahr (dieses Alter
ist über die letzten hundert Jahre in Europa gesunken, aus nicht ganz
geklärten Gründen).  ihre erste Reifeteilung (Meiose 1). (Während
beim Mann aus einem primären Spermatozyten vier reife Spermatozoen hervorgehen, entsteht aus
einem primären Oozyten - nebst "Polkörperchen" - eine reife Eizelle.) Ein sekundärer Oozyt beginnt die 2. Reifeteilung, die aber in der Metaphase arretiert wird.
ihre erste Reifeteilung (Meiose 1). (Während
beim Mann aus einem primären Spermatozyten vier reife Spermatozoen hervorgehen, entsteht aus
einem primären Oozyten - nebst "Polkörperchen" - eine reife Eizelle.) Ein sekundärer Oozyt beginnt die 2. Reifeteilung, die aber in der Metaphase arretiert wird.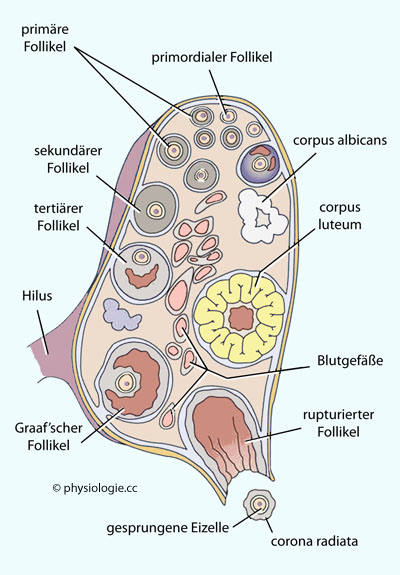
 Abbildung: Vom primordialen Follikel bis zum Gelbkörper
Abbildung: Vom primordialen Follikel bis zum Gelbkörper
 Als ovarielle Reserve (ovarian reserve) bezeichnet
man die Fähigkeit des Ovars, befruchtungsfähige Eizellen zu
produzieren, die zu einer normalen Schwangerschaft führen können. Sie
wird über die Anzahl nicht-wachsender Follikel (NGF, non-growing follicles) im Ovar quantifiziert. Die NGF-Zahl steigt während der Entwicklung in utero auf einige 105, um postnatal wieder abzusinken: Bei Frauen bis zu 20 Jahren liegt die Zahl bei über 104, bis 35 über 103, von 35-50 Jahren über 102 (Wallace WHB, Kelsey TW, Human Ovarian Reserve from Conception to the Menopause. PLoS One 2010) - vgl. dort.
Als ovarielle Reserve (ovarian reserve) bezeichnet
man die Fähigkeit des Ovars, befruchtungsfähige Eizellen zu
produzieren, die zu einer normalen Schwangerschaft führen können. Sie
wird über die Anzahl nicht-wachsender Follikel (NGF, non-growing follicles) im Ovar quantifiziert. Die NGF-Zahl steigt während der Entwicklung in utero auf einige 105, um postnatal wieder abzusinken: Bei Frauen bis zu 20 Jahren liegt die Zahl bei über 104, bis 35 über 103, von 35-50 Jahren über 102 (Wallace WHB, Kelsey TW, Human Ovarian Reserve from Conception to the Menopause. PLoS One 2010) - vgl. dort.
 AMH kann als Biomarker zur Abschätzung der ovariellen Reserve
geschlechtsreifer Frauen (definiert als die Kapazität der Ovarien, befruchtungsfähige Eizellen
zu produzieren) herangezogen werden: Sein Blutspiegel korreliert mit
der ovariellen Reserve.
AMH kann als Biomarker zur Abschätzung der ovariellen Reserve
geschlechtsreifer Frauen (definiert als die Kapazität der Ovarien, befruchtungsfähige Eizellen
zu produzieren) herangezogen werden: Sein Blutspiegel korreliert mit
der ovariellen Reserve.  Eizellen und die sie umgebenden Granulosazellen tauschen parakrine Signalstoffe aus und beeinflussen einander gegenseitig.
Eizellen und die sie umgebenden Granulosazellen tauschen parakrine Signalstoffe aus und beeinflussen einander gegenseitig. 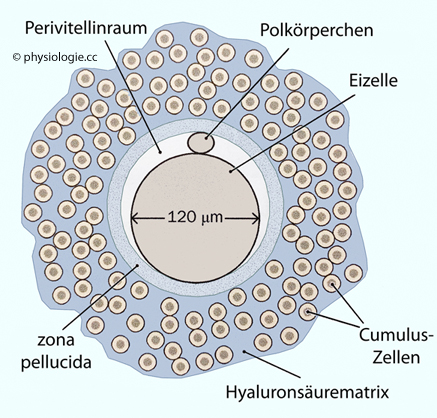
 Abbildung: Eizelle und ihre Umgebung
Abbildung: Eizelle und ihre Umgebung
 Abbildung). Über diese Vesikel werden DNA, mRNA
(Transkripte), Aminosäuren (Proteinsynthese), Proteine, Lipide (Anlegen
eines Vorrats an Lipidtröpfchen), Pyruvat (Energieversorgung), cGMP (Meiose-Arretierung), auch kleine Zellorganellen von der Cumulus- auf die Eizelle übertragen.
Abbildung). Über diese Vesikel werden DNA, mRNA
(Transkripte), Aminosäuren (Proteinsynthese), Proteine, Lipide (Anlegen
eines Vorrats an Lipidtröpfchen), Pyruvat (Energieversorgung), cGMP (Meiose-Arretierung), auch kleine Zellorganellen von der Cumulus- auf die Eizelle übertragen.  Abbildung unten),
deren Ausbildung durch die Eizelle angeregt wird und deren Zahl mit dem Follikelwachstum zunimmt:
Abbildung unten),
deren Ausbildung durch die Eizelle angeregt wird und deren Zahl mit dem Follikelwachstum zunimmt: A-TZP sind dünner und reich an Aktin (daher das A), sie binden an Mikrovilli der Eizelle über gap junctions.
A-TZP sind dünner und reich an Aktin (daher das A), sie binden an Mikrovilli der Eizelle über gap junctions. M-TZP sind dicker und reich an Mikrotubuli (daher M) und binden über Adhäsionsverbindungen
(zonulae adhaerentes) an Einstülpungen (Invaginationen) der Oozytenmembran.
M-TZP sind dicker und reich an Mikrotubuli (daher M) und binden über Adhäsionsverbindungen
(zonulae adhaerentes) an Einstülpungen (Invaginationen) der Oozytenmembran.  s. dort) .
s. dort) .
 Abbildung: Bidirektionale Kommunikation im Microenvironment des Ovarialfollikels
Abbildung: Bidirektionale Kommunikation im Microenvironment des Ovarialfollikels Durch
parakrine Faktoren (sowohl der Eizelle als auch der Granulosazellen)
Durch
parakrine Faktoren (sowohl der Eizelle als auch der Granulosazellen) Durch transzonale
Projektionen der Granulosazellen zur Eizelle, wo
diverse Nährstoffe und auch extrazelluläre Vesikel zur Oozyte gelangen.
Transzonale Projektionen sind spezialisierte Zytoplasmafortsätze, die
sich über die zona pellucida hinweg erstrecken und den Austausch
kleiner (wie Glucose, Pyruvat, Aminosäuren, Nukleotide), aber auch
großer Moleküle (Lipide, mRNA, kleine Organellen) erlauben
Durch transzonale
Projektionen der Granulosazellen zur Eizelle, wo
diverse Nährstoffe und auch extrazelluläre Vesikel zur Oozyte gelangen.
Transzonale Projektionen sind spezialisierte Zytoplasmafortsätze, die
sich über die zona pellucida hinweg erstrecken und den Austausch
kleiner (wie Glucose, Pyruvat, Aminosäuren, Nukleotide), aber auch
großer Moleküle (Lipide, mRNA, kleine Organellen) erlauben Durch extrazelluläre Vesikel mit ≤1 µm Durchmesser (welche die
Follikelflüssigkeit zwischen Eizelle und transzonalen Projektionen queren können).
Diese Vesikel sind beladen mit Proteinen, Lipiden, mRNA, DNA u.a. und
werden über Proteinerkennung und Membranfusion von Follikelzellen
endozytiert
Durch extrazelluläre Vesikel mit ≤1 µm Durchmesser (welche die
Follikelflüssigkeit zwischen Eizelle und transzonalen Projektionen queren können).
Diese Vesikel sind beladen mit Proteinen, Lipiden, mRNA, DNA u.a. und
werden über Proteinerkennung und Membranfusion von Follikelzellen
endozytiert
 s. auch dort):
s. auch dort): 
 Abbildung):
Abbildung):  Das "Einfrieren" in der Prophase I beruht auf einer hohen Konzentration an cAMP im Zytoplasma der Eizelle. cAMP stammt aus "eigener Produktion" sowie aus benachbarten Follikelzellen via transzonale Projektionen und gap junctions. Hohe cAMP-Konzentration im Oozyten inaktiviert den Proteinkomplex MPF (maturation-promoting factor, M-phase promoting factor, M-phase kinase, mitose-promoting facrtor), der die Arretierung des Oozyten zu gegebener Zeit aufhebt und die Komplettierung der Meiose I ermöglicht.
Das "Einfrieren" in der Prophase I beruht auf einer hohen Konzentration an cAMP im Zytoplasma der Eizelle. cAMP stammt aus "eigener Produktion" sowie aus benachbarten Follikelzellen via transzonale Projektionen und gap junctions. Hohe cAMP-Konzentration im Oozyten inaktiviert den Proteinkomplex MPF (maturation-promoting factor, M-phase promoting factor, M-phase kinase, mitose-promoting facrtor), der die Arretierung des Oozyten zu gegebener Zeit aufhebt und die Komplettierung der Meiose I ermöglicht. Zusätzlich bilden und "injizieren" Follikelzellen cGMP über gap
junctions in die Eizelle. cGMP hemmt PDE3A
(Phosphodiesterase) und damit den Abbau von cAMP zu 5'AMP. Der
daraus resultierende hohe cAMP-Spiegel in der Eizelle aktiviert
Proteinkinase A (PKA) und diese bewirkt die Arretierung des Oozyten in
der
ersten Reifeteilung (
Zusätzlich bilden und "injizieren" Follikelzellen cGMP über gap
junctions in die Eizelle. cGMP hemmt PDE3A
(Phosphodiesterase) und damit den Abbau von cAMP zu 5'AMP. Der
daraus resultierende hohe cAMP-Spiegel in der Eizelle aktiviert
Proteinkinase A (PKA) und diese bewirkt die Arretierung des Oozyten in
der
ersten Reifeteilung ( s. auch dort).
s. auch dort).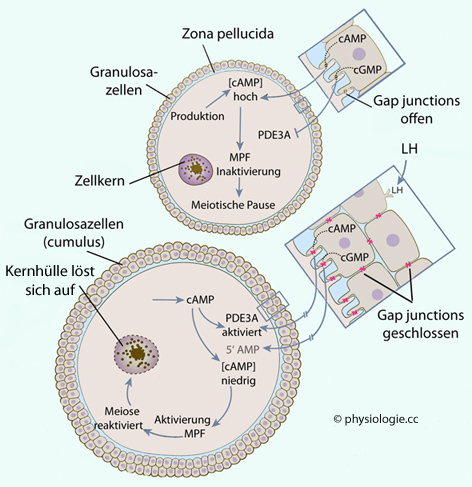

 Abbildung: Arretierung und Wiederaktivierung der Reifeteilung (Meiose I)
Abbildung: Arretierung und Wiederaktivierung der Reifeteilung (Meiose I) 
 (diese exprimieren LH-Rezeptoren und produzieren Androgene) - ein sekundärer Follikel (0,2 mm) ist entstanden. Noch gibt es keine Antrumhöhle, die Follikel werden als präantral
bezeichnet (
(diese exprimieren LH-Rezeptoren und produzieren Androgene) - ein sekundärer Follikel (0,2 mm) ist entstanden. Noch gibt es keine Antrumhöhle, die Follikel werden als präantral
bezeichnet ( Abbildung oben). Der sekundäre Oozyt vollendet einige
Stunden vor der Ovulation die Meiose 1 und sondert das erste
Polkörperchen ab; dann bleibt er in der Metaphase 2 stehen (
Abbildung oben). Der sekundäre Oozyt vollendet einige
Stunden vor der Ovulation die Meiose 1 und sondert das erste
Polkörperchen ab; dann bleibt er in der Metaphase 2 stehen ( vgl. dort).
vgl. dort). 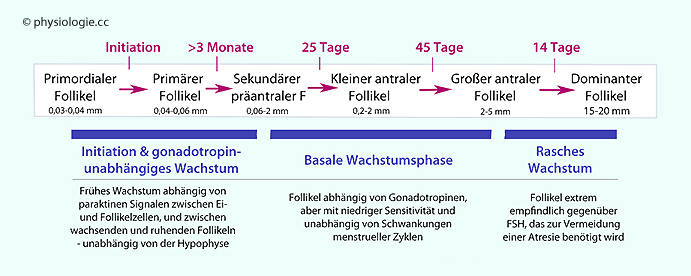
 und
Androgene; über Aromatase
zur Bildung von Östrogenen
und
Androgene; über Aromatase
zur Bildung von Östrogenen  verfügen sie nicht (
verfügen sie nicht ( Abbildung).
Abbildung). 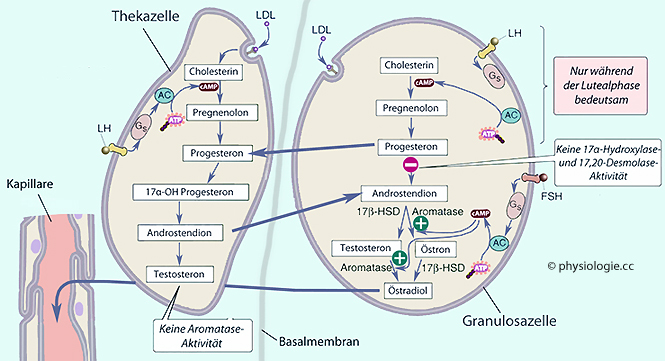
 Abbildung: Das Theka-Granulosa- Zweizellsystem im Ovar
Abbildung: Das Theka-Granulosa- Zweizellsystem im Ovar

 Progesteron wandert von der
Granulosa- zur Thekazelle, Androstendion nimmt den umgekehrten Weg.
Progesteron wandert von der
Granulosa- zur Thekazelle, Androstendion nimmt den umgekehrten Weg. Abbildung). Nach der Ovulation wird die
Basalmembran zwischen Theka- und Granulosazellschicht rasch abgebaut,
Gefäße wachsen vor und bringen Blut in die Nähe der Granulosazellen.
Bedingt durch den LH-Peak, entwickeln diese jetzt LDL-Rezeptoren - das
macht für sie LDL-Cholesterin für die Steroidsynthese (Progesteron!)
zugänglich.
Abbildung). Nach der Ovulation wird die
Basalmembran zwischen Theka- und Granulosazellschicht rasch abgebaut,
Gefäße wachsen vor und bringen Blut in die Nähe der Granulosazellen.
Bedingt durch den LH-Peak, entwickeln diese jetzt LDL-Rezeptoren - das
macht für sie LDL-Cholesterin für die Steroidsynthese (Progesteron!)
zugänglich. , vermutlich sowohl auf
hypothalamischer als auch hypophysärer Ebene.
, vermutlich sowohl auf
hypothalamischer als auch hypophysärer Ebene. Aktivin, einem Glykoprotein aus Granulosazellen - es wirkt fördernd auf die FSH-Freisetzung aus der Hypophyse
Aktivin, einem Glykoprotein aus Granulosazellen - es wirkt fördernd auf die FSH-Freisetzung aus der Hypophyse
 Östrogenen - sie wirken während der Follikelphase fördernd auf die FSH-Freisetzung
Östrogenen - sie wirken während der Follikelphase fördernd auf die FSH-Freisetzung
 Inhibin,
einem Glykoprotein aus Granulosazellen - seine Sekretion wird von FSH
angeregt, seinerseits hemmt es die FSH-Freisetzung aus der Hypophyse
(daher der Name) Rückkopplung)
Inhibin,
einem Glykoprotein aus Granulosazellen - seine Sekretion wird von FSH
angeregt, seinerseits hemmt es die FSH-Freisetzung aus der Hypophyse
(daher der Name) Rückkopplung)
 Östrogen und
Progesteron hemmen die Gonadotropinfreisetzung während der Lutealphase
Östrogen und
Progesteron hemmen die Gonadotropinfreisetzung während der Lutealphase
 Neuropeptiden
Neuropeptiden
 Aminosäuren
Aminosäuren
 CRH
CRH
 endogenen Opioiden
endogenen Opioiden Sexualhormone werden bei der Frau vorwiegend im Ovar gebildet. Über Pregnenolon entsteht aus
Cholesterin Progesteron (das wichtigste Gestagen
Sexualhormone werden bei der Frau vorwiegend im Ovar gebildet. Über Pregnenolon entsteht aus
Cholesterin Progesteron (das wichtigste Gestagen  ). In den Granulosazellen ist damit zunächst schon Schluss - für die weitere Umwandlung zu Androstendion fehlen ihnen die Enzyme (siehe oben).
). In den Granulosazellen ist damit zunächst schon Schluss - für die weitere Umwandlung zu Androstendion fehlen ihnen die Enzyme (siehe oben).
 Abbildung: Steroidhormonbildung
Abbildung: Steroidhormonbildung Rot: Mitochondriale Enzyme
Rot: Mitochondriale Enzyme  Gelbes Feld:
Gestagene (Progesteron)
Gelbes Feld:
Gestagene (Progesteron)  Blaues Feld: Androgene (Testosteron)
Blaues Feld: Androgene (Testosteron)  Rosa Feld:
Östrogene
Rosa Feld:
Östrogene
 Abbildung) und bilden aus Progesteron Androstendion. Dieses wiederum kann zu Granulosazellen zurückdiffundieren, wo es zusammen mit Testosteron (zu dem es hier teilweise umgewandelt wird) die Vorstufe für die Bildung von Östrogenen bildet:
Abbildung) und bilden aus Progesteron Androstendion. Dieses wiederum kann zu Granulosazellen zurückdiffundieren, wo es zusammen mit Testosteron (zu dem es hier teilweise umgewandelt wird) die Vorstufe für die Bildung von Östrogenen bildet: | Östrogene entstehen in Ovarien, Nebennierenrinde und Fettgewebe |
 Das übliche Schicksal von Steroiden: Sie werden in der Leber sulfatiert
und glukuroniert und damit wasserlöslich und nierengängig gemacht. Was
über die Galle in den Darm gelangt, wird über den enterohepatischen
Kreislauf zurückgewonnen; die Ausscheidung erfolgt also im Wesentlichen
über den Urin.
Das übliche Schicksal von Steroiden: Sie werden in der Leber sulfatiert
und glukuroniert und damit wasserlöslich und nierengängig gemacht. Was
über die Galle in den Darm gelangt, wird über den enterohepatischen
Kreislauf zurückgewonnen; die Ausscheidung erfolgt also im Wesentlichen
über den Urin.  Östrogene / Estrogene (Serum, Plasma)
Östrogene / Estrogene (Serum, Plasma) Östradiol wird aus Testosteron aromatisiert, stammt zum Großteil aus
Follikel-Granulosazellen und ist das physiologisch bedeutsamste
Östrogen der Frau. Es steuert nicht nur Funktion und Ausprägung der
weiblichen Geschlechtsorgane und -merkmale, sondern wirkt sich auf
praktisch alle Zellen aus (wie in Haut, Bewegungssystem, Fettgewebe,
Leber, Schleimhäuten, Nervensystem).
Östradiol wird aus Testosteron aromatisiert, stammt zum Großteil aus
Follikel-Granulosazellen und ist das physiologisch bedeutsamste
Östrogen der Frau. Es steuert nicht nur Funktion und Ausprägung der
weiblichen Geschlechtsorgane und -merkmale, sondern wirkt sich auf
praktisch alle Zellen aus (wie in Haut, Bewegungssystem, Fettgewebe,
Leber, Schleimhäuten, Nervensystem).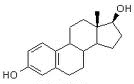 Östradiol / Estradiol (stärkste biologische Wirkung)
Östradiol / Estradiol (stärkste biologische Wirkung)

 Östron
spielt neben Östradiol die sekundäre Rolle als Östrogen der Frau; es
wird zu 3/4 in den Ovarien, zu 1/4 durch Konversion von Androgenen im
Fettgewebe gebildet.
Östron
spielt neben Östradiol die sekundäre Rolle als Östrogen der Frau; es
wird zu 3/4 in den Ovarien, zu 1/4 durch Konversion von Androgenen im
Fettgewebe gebildet.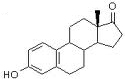 Östron / Estron
Östron / Estron
 Östriol ist ein Stoffwechselendprodukt aus Östradiol und Östron. Es ist das Östrogen mit der höchsten Serumkonzentration, hat aber die geringste Wirkung als Östrogen.
Östriol ist ein Stoffwechselendprodukt aus Östradiol und Östron. Es ist das Östrogen mit der höchsten Serumkonzentration, hat aber die geringste Wirkung als Östrogen.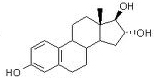 Östriol / Estriol (geringste biologische Wirkung; quantitativ wichigstes Umbauprodukt von Östradiol, Östron und Androstendion)
Östriol / Estriol (geringste biologische Wirkung; quantitativ wichigstes Umbauprodukt von Östradiol, Östron und Androstendion)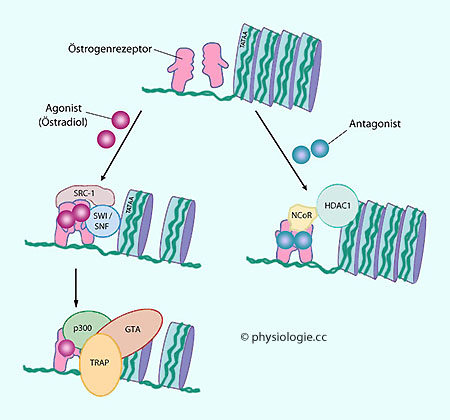
 Abbildung: Synergistische und antagonistische Wirkung an nukleären Östrogenrezeptoren
Abbildung: Synergistische und antagonistische Wirkung an nukleären Östrogenrezeptoren Abbildung), was sich auf die Proteinsynthese (Translation)
der Zelle auswirkt.
Abbildung), was sich auf die Proteinsynthese (Translation)
der Zelle auswirkt.  vgl. dort
vgl. dort Östrogenrezeptor-Modulatoren wie Tamoxifen
binden an Östrogenrezeptoren (
Östrogenrezeptor-Modulatoren wie Tamoxifen
binden an Östrogenrezeptoren ( Abbildung) und rufen - je nach
Rezeptorausstattung der Zelle (s. unten) - synergistische (Bindung von
Koaktivatoren) oder antagonistische Wirkungen (Korepressoren) hervor.
Man bezweckt mit ihnen einerseits erwünschte Östrogeneffekte (an
Gehirn, Leber, Knochen) bei gleichzeitiger Hemmung an anderen Geweben
(Brüste, Endometrium). Tamoxifen wird vor allem zur Behandlung von Mammakarzinomen
eingesetzt.
Abbildung) und rufen - je nach
Rezeptorausstattung der Zelle (s. unten) - synergistische (Bindung von
Koaktivatoren) oder antagonistische Wirkungen (Korepressoren) hervor.
Man bezweckt mit ihnen einerseits erwünschte Östrogeneffekte (an
Gehirn, Leber, Knochen) bei gleichzeitiger Hemmung an anderen Geweben
(Brüste, Endometrium). Tamoxifen wird vor allem zur Behandlung von Mammakarzinomen
eingesetzt. Der Östrogenrezeptor α (ERα)
findet sich besonders in Ovarien, Uterus, Scheide, Brustdrüse, sowie in
Hypothalamus, Blutgefäßen, Knochen. Zu seinem Wirkungsspektrum gehören
reproduktives Verhalten, Entwicklung der Mamma, Stabilisierung der
Knochendichte u.a.
Der Östrogenrezeptor α (ERα)
findet sich besonders in Ovarien, Uterus, Scheide, Brustdrüse, sowie in
Hypothalamus, Blutgefäßen, Knochen. Zu seinem Wirkungsspektrum gehören
reproduktives Verhalten, Entwicklung der Mamma, Stabilisierung der
Knochendichte u.a.  Der Östrogenrezeptor β (ERβ)
dominiert in Ovar (beim Mann in der Prostata), Lunge, Knochen, bestimmten Hirnregionen, Milz und Thymus
(beim Mann in Prostata und Hoden); er ist involviert in reproduktives
Verhalten, Ovulation, Funktionen des Immunsystems.
Der Östrogenrezeptor β (ERβ)
dominiert in Ovar (beim Mann in der Prostata), Lunge, Knochen, bestimmten Hirnregionen, Milz und Thymus
(beim Mann in Prostata und Hoden); er ist involviert in reproduktives
Verhalten, Ovulation, Funktionen des Immunsystems. 
 Östradiol bindet an ERα und ERβ
Östradiol bindet an ERα und ERβ Östron vor allem an ERα
Östron vor allem an ERα  Östriol vor allem an ERβ.
Östriol vor allem an ERβ. Nicht-genomische
Östrogenrezeptoren (
Nicht-genomische
Östrogenrezeptoren ( Abbildung) wirken
rasch: Sekunden, im Gegensatz zu genomischen Rezeptoren, deren Wirkung
erst nach Minuten bis Stunden eintritt. Ihr Effekt kann z.B. in einer
raschen und kurzlebigen Änderung des Membranpotentials der Zielzelle
bestehen.
Abbildung) wirken
rasch: Sekunden, im Gegensatz zu genomischen Rezeptoren, deren Wirkung
erst nach Minuten bis Stunden eintritt. Ihr Effekt kann z.B. in einer
raschen und kurzlebigen Änderung des Membranpotentials der Zielzelle
bestehen.
 Abbildung: Wie Östrogen auf Zellen einwirkt
Abbildung: Wie Östrogen auf Zellen einwirkt
 Östrogene und Schilddrüsenhormone steigern die Bildung von (aus der Leber stammendem) sexualhormonbindendem Globulin (SHBG). Daher finden sich bei Schwangeren und bei Hyperthyreotikern
erhöhte SHBG-Spiegel, was den freien (biologisch verfügbaren) Anteil
von Sexualsteroiden erniedrigt.
Östrogene und Schilddrüsenhormone steigern die Bildung von (aus der Leber stammendem) sexualhormonbindendem Globulin (SHBG). Daher finden sich bei Schwangeren und bei Hyperthyreotikern
erhöhte SHBG-Spiegel, was den freien (biologisch verfügbaren) Anteil
von Sexualsteroiden erniedrigt.  Umgekehrt sinkt der SHBG-Spiegel unter dem Einfluss von Progesteron, Androgenen, Wachstumshormon sowie Corticosteroiden - damit steigt der Spiegel freier Sexualsteroide im Blut.
Umgekehrt sinkt der SHBG-Spiegel unter dem Einfluss von Progesteron, Androgenen, Wachstumshormon sowie Corticosteroiden - damit steigt der Spiegel freier Sexualsteroide im Blut.
 Abbildung: Effekte der FSH-Östrogen-Achse auf Knochenstoffwechsel und Immunzellen
Abbildung: Effekte der FSH-Östrogen-Achse auf Knochenstoffwechsel und Immunzellen
 Einfluss auf primäre Geschlechtsmerkmale (Differenzierung, Reifung,
Funktion) - anabole Wirkungen: Akkumulation von Aminosäuren, Förderung
von Mitosen, Steigerung von Proteinsynthese und Zellvolumen,
Verbesserung der Durchblutung; Zunahme der Uterusperfusion (wichtig für die Proliferation des Endometriums);
Einfluss auf primäre Geschlechtsmerkmale (Differenzierung, Reifung,
Funktion) - anabole Wirkungen: Akkumulation von Aminosäuren, Förderung
von Mitosen, Steigerung von Proteinsynthese und Zellvolumen,
Verbesserung der Durchblutung; Zunahme der Uterusperfusion (wichtig für die Proliferation des Endometriums);  Steuerung der Follikel- bzw. Proliferationsphase
Steuerung der Follikel- bzw. Proliferationsphase

 Präovulatorisch Erhöhung der Penetrationsfähigkeit des Zervixschleims
für Spermien: Sekretion wässrigen, alkalischen Schleims
Präovulatorisch Erhöhung der Penetrationsfähigkeit des Zervixschleims
für Spermien: Sekretion wässrigen, alkalischen Schleims Förderung des Brustwachstums (mit Progesteron und Prolaktin)
Förderung des Brustwachstums (mit Progesteron und Prolaktin) Wirkungen auf sekundäre Geschlechtsmerkmale (Haut, Behaarung, Stimme, Fettverteilung etc)
Wirkungen auf sekundäre Geschlechtsmerkmale (Haut, Behaarung, Stimme, Fettverteilung etc) Induktion der Bildung von Progesteronrezeptoren (notwendig für Gestagenwirkung!), Anregung der Synthese von SHBG
(sexualhormonbindendem Globulin) in der Leber, vermehrte Produktion von Gerinnungsfaktoren (VII, VIII,
X, XII), aber auch herabgesetzte Bildung des
Plasminogenaktivator-Inhibitors (PAI)
Induktion der Bildung von Progesteronrezeptoren (notwendig für Gestagenwirkung!), Anregung der Synthese von SHBG
(sexualhormonbindendem Globulin) in der Leber, vermehrte Produktion von Gerinnungsfaktoren (VII, VIII,
X, XII), aber auch herabgesetzte Bildung des
Plasminogenaktivator-Inhibitors (PAI) Induktion der renalen 1-α-Hydroxylase, dadurch Aktivierung von Vitamin D3 und Unterstützung des Knochenaufbaus und des Epiphysenfugenschlusses (Osteoblastenanregung)
Induktion der renalen 1-α-Hydroxylase, dadurch Aktivierung von Vitamin D3 und Unterstützung des Knochenaufbaus und des Epiphysenfugenschlusses (Osteoblastenanregung) Weitere anabole Wirkungen am Schleimhäuten (Vaginalepithel) und extrauterinen Geweben (Muskeln, Knochen
- Beteiligung an Knochenwachstum und Epiphysenschluss; antiresorptive
Wirkung: Verringerung von Zahl und Aktivität der Osteoklasten,
Förderung der Bildung antiresorptiver Zytokine in Osteoblasten; Osteoporose bei Östrogenmangel)
Weitere anabole Wirkungen am Schleimhäuten (Vaginalepithel) und extrauterinen Geweben (Muskeln, Knochen
- Beteiligung an Knochenwachstum und Epiphysenschluss; antiresorptive
Wirkung: Verringerung von Zahl und Aktivität der Osteoklasten,
Förderung der Bildung antiresorptiver Zytokine in Osteoblasten; Osteoporose bei Östrogenmangel)| Östrogene fördern den Knochenaufbau, Östrogenmangel führt zu Osteoporose |
 Fettstoffwechsel:
Senkung des Cholesterin- (erhöhte Cholesterinausscheidung), Steigerung
des Triglyzeridspiegels; antiatherogener Effekt (Anstieg HDL, Abfall
LDL), bremst Zunahme viszeral-abdominellen Fettgewebes
Fettstoffwechsel:
Senkung des Cholesterin- (erhöhte Cholesterinausscheidung), Steigerung
des Triglyzeridspiegels; antiatherogener Effekt (Anstieg HDL, Abfall
LDL), bremst Zunahme viszeral-abdominellen Fettgewebes Kreislauf: Vasodilatation, Anregung der NO-Produktion; bei längerer
Einwirkung Abnahme von Renin, Angiotensin-Converting-Enzym,
Angiotensinrezeptoren, Endothelin-I
Kreislauf: Vasodilatation, Anregung der NO-Produktion; bei längerer
Einwirkung Abnahme von Renin, Angiotensin-Converting-Enzym,
Angiotensinrezeptoren, Endothelin-I Haut: Hemmung der Talgdrüsenfunktion
Haut: Hemmung der Talgdrüsenfunktion Wirkungen auf das Nervensystem (Gehirnentwicklung, Sexual- und soziales Verhalten)
Wirkungen auf das Nervensystem (Gehirnentwicklung, Sexual- und soziales Verhalten) Renale Wasser- und Salzretention (Disposition zu Ödemen)
Renale Wasser- und Salzretention (Disposition zu Ödemen)  Tonisch-anorexigene (appetithemmende) Wirkung
Tonisch-anorexigene (appetithemmende) Wirkung Das gestagene Steroidhormon Progesteron wird bei der Frau in der Lutealphase - vor allem durch LH reguliert - vom Gelbkörper im Ovar (corpus luteum), und
während der (späteren) Schwangerschaft von der Plazenta
gebildet. Geringe Mengen entstehen auch in der Nebennierenrinde, in Adipozyten, Nerven- und Gliazellen, bei
Männern in Leydig-Zellen des Hodens. Progesteron übt vielfache, über
das Geschlechtliche hinausgehende physiologische Wirkungen aus
(Stoffwechsel, Zentralnervensystem).
Das gestagene Steroidhormon Progesteron wird bei der Frau in der Lutealphase - vor allem durch LH reguliert - vom Gelbkörper im Ovar (corpus luteum), und
während der (späteren) Schwangerschaft von der Plazenta
gebildet. Geringe Mengen entstehen auch in der Nebennierenrinde, in Adipozyten, Nerven- und Gliazellen, bei
Männern in Leydig-Zellen des Hodens. Progesteron übt vielfache, über
das Geschlechtliche hinausgehende physiologische Wirkungen aus
(Stoffwechsel, Zentralnervensystem). Die Leber metabolisiert Progesteron zu Pregnandiol / Pregnantriol und glukuroniert / sulfatiert diese, die Ausscheidung erfolgt weitgehend über den Harn.
Die Leber metabolisiert Progesteron zu Pregnandiol / Pregnantriol und glukuroniert / sulfatiert diese, die Ausscheidung erfolgt weitgehend über den Harn.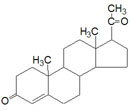
 Progesteron (Serum, Frauen)
Progesteron (Serum, Frauen) 

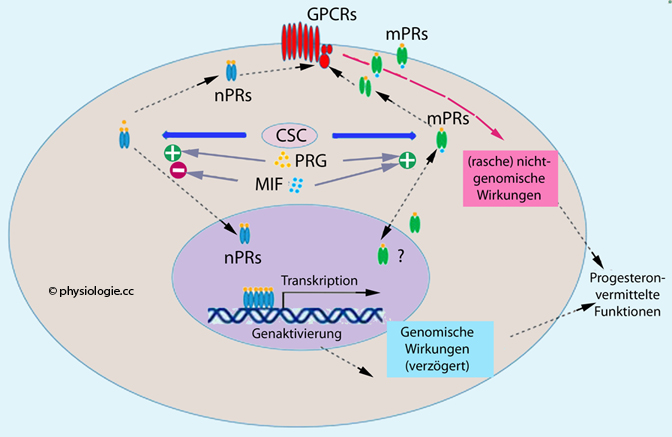
 Abbildung: Progesteronwirkung in Zielzellen
Abbildung: Progesteronwirkung in Zielzellen
 Membranassoziierte Progesteronrezeptoren (MAPR), dazu zählen PGRMC1 (progesterone receptor membran component 1),
Membranassoziierte Progesteronrezeptoren (MAPR), dazu zählen PGRMC1 (progesterone receptor membran component 1),  Klasse II-Rezeptoren - mPR(α, ß, γ, φ, έ) einerseits, AdipoQ-Progesteronrezeptoren (PAQR5, 6, 7, 8, 9) andererseits.
Klasse II-Rezeptoren - mPR(α, ß, γ, φ, έ) einerseits, AdipoQ-Progesteronrezeptoren (PAQR5, 6, 7, 8, 9) andererseits. Rückkopplung auf das hypothalamisch-hypophysäre System (senkt Frequenz
des hypothalamischen GnRH-Pulsgenerators, steigert LH-Amplituden des
Hypophysenvorderlappens; hier unterdrückt es die Expression von
Östrogenrezeptoren, was den östradiolabhängigen LH-peak verringert -
Grundlage der Wirkung von Ovulationshemmern)
Rückkopplung auf das hypothalamisch-hypophysäre System (senkt Frequenz
des hypothalamischen GnRH-Pulsgenerators, steigert LH-Amplituden des
Hypophysenvorderlappens; hier unterdrückt es die Expression von
Östrogenrezeptoren, was den östradiolabhängigen LH-peak verringert -
Grundlage der Wirkung von Ovulationshemmern) Umwandlung des Endometriums (Proliferationsphase → Sekretionsphase): Vorbereitung des Uterus auf die Nidation (Einnistung
der befruchteten Eizelle in die Schleimhaut) - Erhaltung der
Schwangerschaft (Abort bei vorzeitigem Absinken des Progesteronspiegels)
Umwandlung des Endometriums (Proliferationsphase → Sekretionsphase): Vorbereitung des Uterus auf die Nidation (Einnistung
der befruchteten Eizelle in die Schleimhaut) - Erhaltung der
Schwangerschaft (Abort bei vorzeitigem Absinken des Progesteronspiegels) Hemmung (Hyperpolarisation) der Muskelzellen in Myometrium und Eileiter → Hemmung der Motilität
Hemmung (Hyperpolarisation) der Muskelzellen in Myometrium und Eileiter → Hemmung der Motilität Verengung des Zervikalkanals, Steigerung der Zähigkeit des
Zervixsekrets → erschwerte Penetration für Spermatozoen
("Minipille": Kontrazeptive Wirkung niedriger Gestagendosen), Zunahme
kernhaltiger Zellen im Vaginalabstrich (abnehmender Karyopyknose-Index)
Verengung des Zervikalkanals, Steigerung der Zähigkeit des
Zervixsekrets → erschwerte Penetration für Spermatozoen
("Minipille": Kontrazeptive Wirkung niedriger Gestagendosen), Zunahme
kernhaltiger Zellen im Vaginalabstrich (abnehmender Karyopyknose-Index)
 Brustdrüsen (zusammen mit Östrogenen und Prolaktin): Progesteron stimuliert die Bildung sekretorischer Alveolen in der Brustdrüse (Östrogene hingegen regen das Wachstum der Ausführungsgänge an).
Brustdrüsen (zusammen mit Östrogenen und Prolaktin): Progesteron stimuliert die Bildung sekretorischer Alveolen in der Brustdrüse (Östrogene hingegen regen das Wachstum der Ausführungsgänge an). Erhöhung der Basaltemperatur (thermogenetische Wirkung: Plus ~0,5°C in 2. Zyklushälfte)
Erhöhung der Basaltemperatur (thermogenetische Wirkung: Plus ~0,5°C in 2. Zyklushälfte)| Progesteron erhöht die Basaltemperatur in der 2. Zyklushälfte um ca. 0,5°C (thermogenetischer Effekt) |
 Antagonisierung der Östrogenwirkung auf den Lipidstoffwechsel (s.
oben): Anregung der Lipoproteinlipase, verstärkte Fetteinlagerung
Antagonisierung der Östrogenwirkung auf den Lipidstoffwechsel (s.
oben): Anregung der Lipoproteinlipase, verstärkte Fetteinlagerung Tonisch-orexigene (appetitanregende) Wirkung
Tonisch-orexigene (appetitanregende) Wirkung Psychotrope Effekte (prämenstruelle Depression?)
Psychotrope Effekte (prämenstruelle Depression?) Aldosteron-antagonistische Wirkung (vermehrte Salzausscheidung, Volumen- und damit Gewichtsabnahme)
Aldosteron-antagonistische Wirkung (vermehrte Salzausscheidung, Volumen- und damit Gewichtsabnahme)
 Testosteron (Frauen, Serum / Plasma)
Testosteron (Frauen, Serum / Plasma) Zentralnervensystem: Östrogene wirken neuroprotektiv; bei Sauerstoffmangel überleben Nervenzellen länger, vielleicht durch angiogene Wirkung (Förderung des Gefäßwachstums). Progesteron steigert den Temperatur-Sollwert um ~0,3°C (zweite Zyklushälfte) und wirkt sich allgemein beruhigend auf die Gehirnfunktionen aus; Progesteronabfall gegen Ende des Zyklus ist die Grundlage des prämenstruellen Syndroms, was bis zu Dysphorie (bedrückte bis gereizte Stimmungslage) führen kann.
Zentralnervensystem: Östrogene wirken neuroprotektiv; bei Sauerstoffmangel überleben Nervenzellen länger, vielleicht durch angiogene Wirkung (Förderung des Gefäßwachstums). Progesteron steigert den Temperatur-Sollwert um ~0,3°C (zweite Zyklushälfte) und wirkt sich allgemein beruhigend auf die Gehirnfunktionen aus; Progesteronabfall gegen Ende des Zyklus ist die Grundlage des prämenstruellen Syndroms, was bis zu Dysphorie (bedrückte bis gereizte Stimmungslage) führen kann.  Kreislauf: Östrogene wirken vasodilatierend (sie regen die Bildung von NO an) und hemmen die Plättchenaggregation; beides wirkt durchblutungsfördernd. Postmenopausal häufen sich kardiovaskuläre Komplikationen.
Kreislauf: Östrogene wirken vasodilatierend (sie regen die Bildung von NO an) und hemmen die Plättchenaggregation; beides wirkt durchblutungsfördernd. Postmenopausal häufen sich kardiovaskuläre Komplikationen. Knochen: Östrogene sind für die Schließung der Epiphysenfugen
notwendig. Das Überleben von Osteoblasten einerseits, die Apoptose von
Osteoklasten andererseits wird unterstützt - dadurch wird das Knochenwachstum gefördert. Die Resorption von Ca++
in Dünndarm und Nierentubuli wird gesteigert, Östradiol hat einen
anabol / calcitropen Effekt. Postmenopausaler Östradiolmangel führt oft
zu Osteoporoseneigung.
Knochen: Östrogene sind für die Schließung der Epiphysenfugen
notwendig. Das Überleben von Osteoblasten einerseits, die Apoptose von
Osteoklasten andererseits wird unterstützt - dadurch wird das Knochenwachstum gefördert. Die Resorption von Ca++
in Dünndarm und Nierentubuli wird gesteigert, Östradiol hat einen
anabol / calcitropen Effekt. Postmenopausaler Östradiolmangel führt oft
zu Osteoporoseneigung. Leber: Östrogene fördern die Expression von LDL-Rezeptoren, was die hepatische Cholesterinclearance des Blutes erhöht. Außerdem regen sie die Expression verschiedener Transportproteine an, u.a. solcher für Geschlechshormone (wie das Glykoprotein sex hormone-bindung globulin SHBP, das Östradiol und Testosteron fest bindet und zu >50% durch den Kreislauf transportiert).
Leber: Östrogene fördern die Expression von LDL-Rezeptoren, was die hepatische Cholesterinclearance des Blutes erhöht. Außerdem regen sie die Expression verschiedener Transportproteine an, u.a. solcher für Geschlechshormone (wie das Glykoprotein sex hormone-bindung globulin SHBP, das Östradiol und Testosteron fest bindet und zu >50% durch den Kreislauf transportiert). Fettgewebe: Östrogene steigern die Aktivität der hormonsensitiven Lipase und senken die Aktivität der Lipoproteinlipase - sie haben also einen lipolytischen Effekt, das Volumen der Adipozyten sinkt. Östrogenmangel führt zu Vermehrung - vor allem des abdominellen - Fettgewebes.
Fettgewebe: Östrogene steigern die Aktivität der hormonsensitiven Lipase und senken die Aktivität der Lipoproteinlipase - sie haben also einen lipolytischen Effekt, das Volumen der Adipozyten sinkt. Östrogenmangel führt zu Vermehrung - vor allem des abdominellen - Fettgewebes. Haut: Stoffwechsel und Ausprägung des kutanen Gewebes wird durch Östrogene sowie Progesteron gefördert (glatte, feste Haut, normaler Turgor), die Kollagensynthese angeregt. Die Proliferation der Keratinozyten wird gefördert, ihre Apoptose gehemmt. Östrogene stimulieren außerdem die Synthese von Glykosaminoglykanen und fördern die Wundheilung.
Haut: Stoffwechsel und Ausprägung des kutanen Gewebes wird durch Östrogene sowie Progesteron gefördert (glatte, feste Haut, normaler Turgor), die Kollagensynthese angeregt. Die Proliferation der Keratinozyten wird gefördert, ihre Apoptose gehemmt. Östrogene stimulieren außerdem die Synthese von Glykosaminoglykanen und fördern die Wundheilung.
 Ohne Y-Chromosom ist kein SRY-Gen und kein TDF vorhanden; die
Transkriptionsmechanismen schalten auf die Entwicklung eines weiblichen
Organismus. Ohne Testosteronimpuls regredieren die Wolff-Gänge. Auch
wird kein AMH gebildet, die Müller-Gänge entwickeln sich zu Eileiter,
Uterus, Zervix und innerer Vagina. DHT bewirkt die
Ausformung von äußerer Vagina, Labien, Clitoris, vestibulären
Drüsen Ohne Y-Chromosom ist kein SRY-Gen und kein TDF vorhanden; die
Transkriptionsmechanismen schalten auf die Entwicklung eines weiblichen
Organismus. Ohne Testosteronimpuls regredieren die Wolff-Gänge. Auch
wird kein AMH gebildet, die Müller-Gänge entwickeln sich zu Eileiter,
Uterus, Zervix und innerer Vagina. DHT bewirkt die
Ausformung von äußerer Vagina, Labien, Clitoris, vestibulären
Drüsen  Die Meiose
der Oogonien und das Arretieren in der ersten Prophase
beginnt in der 7.-12. Gestationswoche. Die Zahl der Eizellen nimmt bis
zur ~20. Gestationswoche auf ~7 Millionen zu; von diesen atresieren bis zum Geburtstermin ca.
70%, primäre Oozyten bleiben bis zur Pubertät in der Meiose-Prophase 1 (in der auch das
crossing over erfolgt) arretiert (Diktyotän). Beim Eintritt in die Pubertät sind noch ~0,4 Millionen Oozyten vorhanden. Mittzyklische LH-Gipfel hemmen die cGMP-Bremse der Granulosazellen, die Eizelle setzt
die Meiose bis zur Metaphase 2 fort, wo sie bis zur Fertilisation
wieder arretiert Die Meiose
der Oogonien und das Arretieren in der ersten Prophase
beginnt in der 7.-12. Gestationswoche. Die Zahl der Eizellen nimmt bis
zur ~20. Gestationswoche auf ~7 Millionen zu; von diesen atresieren bis zum Geburtstermin ca.
70%, primäre Oozyten bleiben bis zur Pubertät in der Meiose-Prophase 1 (in der auch das
crossing over erfolgt) arretiert (Diktyotän). Beim Eintritt in die Pubertät sind noch ~0,4 Millionen Oozyten vorhanden. Mittzyklische LH-Gipfel hemmen die cGMP-Bremse der Granulosazellen, die Eizelle setzt
die Meiose bis zur Metaphase 2 fort, wo sie bis zur Fertilisation
wieder arretiert Eizellen sezernieren Matrix-Glykoproteine (ZP Proteine)
zur Bildung der zona pellucida. Diese dient der Bindung von Spermien,
unterstützt die Wanderung der Embryonalanlage durch den Eileiter, und
enthält Kontaktfortsätze (Filopodien) zwischen Ei- und Granulosazellen
(transzonale Projektionen). Extrazelluläre Vesikel mit mRNA,
Aminosäuren, Lipiden, Pyruvat, cGMP gelangen von der Cumulus- zur
Eizelle. Zwischen den Follikelzellen besteht bidirektionale
Kommunikation: Durch parakrine Faktoren, extrazelluläre Vesikel und
transzonale Projektionen Eizellen sezernieren Matrix-Glykoproteine (ZP Proteine)
zur Bildung der zona pellucida. Diese dient der Bindung von Spermien,
unterstützt die Wanderung der Embryonalanlage durch den Eileiter, und
enthält Kontaktfortsätze (Filopodien) zwischen Ei- und Granulosazellen
(transzonale Projektionen). Extrazelluläre Vesikel mit mRNA,
Aminosäuren, Lipiden, Pyruvat, cGMP gelangen von der Cumulus- zur
Eizelle. Zwischen den Follikelzellen besteht bidirektionale
Kommunikation: Durch parakrine Faktoren, extrazelluläre Vesikel und
transzonale Projektionen Follikel
bilden vorwiegend Östradiol (das führende Östrogen). Thekazellen können
kein Östradiol bilden (fehlende Aromatase), wohl aber FSH-stimulierte
Granulosazellen (aktivierte FSH-Rezeptoren regen die Bildung von
Aromatase an). Östrogene entstehen in Ovarien, Nebennierenrinde und im Fettgewebe.
Östradiol wirkt sich auf praktisch alle Zellen des Körpers aus. 99%
sind im Blut proteingebunden; freie Östrogene passieren die
Zellmembranen und binden in der Zelle an Östrogenrezeptoren, von denen sie
Bindungspartner wie HSP 90 verdrängen. Der Rezeptor-Hormon-Komplex
wandert in den Zellkern, bindet an Estrogen-responsive elements
(ERE) und beeinflusst die Transkription (unter koregulatorischer
Wechselwirkung mit anderen Transkriptionsfaktoren). Östrogene wirken
unterschiedlich rückkoppelnd auf das
hypothalamisch-hypophysäre System, abhängig von Hormonstatus und
Zyklusphase Follikel
bilden vorwiegend Östradiol (das führende Östrogen). Thekazellen können
kein Östradiol bilden (fehlende Aromatase), wohl aber FSH-stimulierte
Granulosazellen (aktivierte FSH-Rezeptoren regen die Bildung von
Aromatase an). Östrogene entstehen in Ovarien, Nebennierenrinde und im Fettgewebe.
Östradiol wirkt sich auf praktisch alle Zellen des Körpers aus. 99%
sind im Blut proteingebunden; freie Östrogene passieren die
Zellmembranen und binden in der Zelle an Östrogenrezeptoren, von denen sie
Bindungspartner wie HSP 90 verdrängen. Der Rezeptor-Hormon-Komplex
wandert in den Zellkern, bindet an Estrogen-responsive elements
(ERE) und beeinflusst die Transkription (unter koregulatorischer
Wechselwirkung mit anderen Transkriptionsfaktoren). Östrogene wirken
unterschiedlich rückkoppelnd auf das
hypothalamisch-hypophysäre System, abhängig von Hormonstatus und
Zyklusphase Die präovulatorische Phase beginnt mit dem LH-Gipfel und endet mit dem
Eisprung (Ovulation). Der dominante Follikel bildet ein Stigma, Eizelle und cumulus
oophorus gelangen in die Tube. Die zurückbleibenden Follikelzellen
entwickeln sich zum corpus luteum. Die Granulosazellen exprimieren
LDL-Rezeptoren und nehmen so Cholesterin für die Progesteronsynthese auf Die präovulatorische Phase beginnt mit dem LH-Gipfel und endet mit dem
Eisprung (Ovulation). Der dominante Follikel bildet ein Stigma, Eizelle und cumulus
oophorus gelangen in die Tube. Die zurückbleibenden Follikelzellen
entwickeln sich zum corpus luteum. Die Granulosazellen exprimieren
LDL-Rezeptoren und nehmen so Cholesterin für die Progesteronsynthese auf  Östrogene beeinflussen Differenzierung, Reifung und Funktion
verschiedenster Zellen (Gonaden, Geschlechtsmerkmale u.a.) und haben
anabole Wirkung. Sie fördern Brustwachstum, Synthese von SHBG
(Hormontransport im Blut) sowie die Produktion mehrerer
Gerinnungsfaktoren in der Leber. Sie induzieren die renale
1-α-Hydroxylase (Aktivierung von Vitamin D3: Knochenwachstum,
Epiphysenfugenschluss) und fördern den Knochenaufbau (Östrogenmangel
führt zu Osteoporose). Sie reduzieren viszeral-abdominelles Fettgewebe,
wirken vasodilatierend, appetithemmend und allgemein auf das Verhalten
(ZNS)
Östrogene beeinflussen Differenzierung, Reifung und Funktion
verschiedenster Zellen (Gonaden, Geschlechtsmerkmale u.a.) und haben
anabole Wirkung. Sie fördern Brustwachstum, Synthese von SHBG
(Hormontransport im Blut) sowie die Produktion mehrerer
Gerinnungsfaktoren in der Leber. Sie induzieren die renale
1-α-Hydroxylase (Aktivierung von Vitamin D3: Knochenwachstum,
Epiphysenfugenschluss) und fördern den Knochenaufbau (Östrogenmangel
führt zu Osteoporose). Sie reduzieren viszeral-abdominelles Fettgewebe,
wirken vasodilatierend, appetithemmend und allgemein auf das Verhalten
(ZNS) Progesteron wirkt vor allem
auf Uterus und Ovarien (über PR-A) und Brustdrüsen (über PR-B). Es
koppelt auf das hypothalamisch-hypophysäre System zurück, bereitet das
Endometrium auf eine Implantation der befruchteten Zygote vor,
hyperpolarisiert Muskelzellen in Myometrium und Eileiter (Hemmung der
Motilität), verengt den Zervikalkanal, erschwert Spermien die
Penetration des Zervixsekrets, fördert das Wachstum der Brustdrüse,
erhöht die Basaltemperatur in der 2. Zyklushälfte um ~0,5°C
(thermogenetische Wirkung), regt die Lipoproteinlipase an
(Fetteinlagerung), wirkt tonisch-orexigen (appetitanregend) und
Aldosteron-antagonistisch (vermehrte Salzausscheidung, Gewichtsabnahme) Progesteron wirkt vor allem
auf Uterus und Ovarien (über PR-A) und Brustdrüsen (über PR-B). Es
koppelt auf das hypothalamisch-hypophysäre System zurück, bereitet das
Endometrium auf eine Implantation der befruchteten Zygote vor,
hyperpolarisiert Muskelzellen in Myometrium und Eileiter (Hemmung der
Motilität), verengt den Zervikalkanal, erschwert Spermien die
Penetration des Zervixsekrets, fördert das Wachstum der Brustdrüse,
erhöht die Basaltemperatur in der 2. Zyklushälfte um ~0,5°C
(thermogenetische Wirkung), regt die Lipoproteinlipase an
(Fetteinlagerung), wirkt tonisch-orexigen (appetitanregend) und
Aldosteron-antagonistisch (vermehrte Salzausscheidung, Gewichtsabnahme) |
