




 Atemvolumina und
Atemwiderstände
Atemvolumina und
Atemwiderstände
 Asthma: ἆσθμα = schweres Atmen
Asthma: ἆσθμα = schweres Atmen | Wie jeden Fließwiderstand, ermittelt man auch den Atemwegwiderstand (Resistance) durch Messung von Strömung (der Atemluft) und Druckdifferenz (zwischen Außenluft und Alveolen). Ist die Resistance erhöht, liegt eine obstruktive Ventilationsstörung vor (z.B. Asthma bronchiale). Einfacher ist die Bestimmung des Sekundenstoßwertes (Tiffeneau-Test): Verringerte Sekundenwerte weisen auf Verengung der Atemwege (erhöhte Resistance) hin. Auch die Maximalkapazität bei forcierter Atmung ist durch Obstruktion in den Luftwegen herabgesetzt. Der Bewegungsspielraum des Lungen-Thorax-Systems drückt sich in Atemvolumina aus. Zwischen maximaler Ein- und maximaler Ausatmung liegt die Vitalkapazität. Diese kann man sich aus Atemzugvolumen plus inspiratorischem plus exspiratorischem Reservevolumen zusammengesetzt vorstellen. Verringerte Vitalkapazität weist auf eine restriktive Ventilationsstörung hin (der Bewegungsspielraum des Atemapparates ist eingeschränkt). Auch bei maximaler Ausatmung verbleibt ein Residualvolumen in der Lunge (aus anatomischen Gründen). Bei ausgeatmeter Ruhelage befindet sich die funktionelle Residualkapazität (Summe aus Residualvolumen und exspiratorischem Reservevolumen) in der Lunge. Die Oberflächenspannung in den Lungenbläschen (sie erschwert die Einatmung) wird durch das Surfactant der Alveolen auf ein Drittel des sonst zu erwartenden Wertes (~25 statt ~75 dyn/cm) reduziert. Surfactant besteht hauptsächlich aus Lipiden wie Lezithin sowie aus immunaktiven und lipophilen Proteinen. |
 Atemwegwiderstand (Resistance)
Atemwegwiderstand (Resistance)  Atemvolumina
Atemvolumina  Surfactant
Surfactant
 Geburt und erste Atemzüge
Geburt und erste Atemzüge

 Sekundenstoßwert, forcierte Vitalkapazität
Sekundenstoßwert, forcierte Vitalkapazität  Atemzugvolumen, Reservevolumina
Atemzugvolumen, Reservevolumina  Residualvolumen, funktionelle Residualkapazität
Residualvolumen, funktionelle Residualkapazität  Inspirationskapazität
Inspirationskapazität  Totalkapazität
Totalkapazität  Oberflächenspannung
Oberflächenspannung  Tenside / Detergenzien
Tenside / Detergenzien  Surfactants
Surfactants
 Core messages
Core messages Als Vitalkapazität (VC, vital capacity) bezeichnet
man die Luftmenge, die mit einem Atemzug maximal ausgeatmet werden kann
- von stärkster Einatmung bis stärkster Ausatmung. Formal kann man sie
sich als Summe von Atemzugvolumen, inspiratorischem und
exspiratorischem Reservevolumen zusammengesetzt denken ([ERV] + [VT] + [IRV]. Ihr Betrag kann mit dem Alter bis auf die Hälfte des jugendlichen Referenzwertes abnehmen.
Als Vitalkapazität (VC, vital capacity) bezeichnet
man die Luftmenge, die mit einem Atemzug maximal ausgeatmet werden kann
- von stärkster Einatmung bis stärkster Ausatmung. Formal kann man sie
sich als Summe von Atemzugvolumen, inspiratorischem und
exspiratorischem Reservevolumen zusammengesetzt denken ([ERV] + [VT] + [IRV]. Ihr Betrag kann mit dem Alter bis auf die Hälfte des jugendlichen Referenzwertes abnehmen. Im
Alter nimmt die Vitalkapazität ab, nicht notwendigerweise die
Totalkapazität der Lungen; das bedeutat, dass das Residualvolumen
zunimmt (vgl. dort).
Im
Alter nimmt die Vitalkapazität ab, nicht notwendigerweise die
Totalkapazität der Lungen; das bedeutat, dass das Residualvolumen
zunimmt (vgl. dort). Abbildung) und Trainingszustand ab.
Abbildung) und Trainingszustand ab. 
 Abbildung:
Nomogramm zur Ermittlung von
Vitalkapazität und Tiffeneau-Wert
Abbildung:
Nomogramm zur Ermittlung von
Vitalkapazität und Tiffeneau-Wert  (Einsekundenkapazität FEV1) aus Körpergröße und Lebensalter
(Einsekundenkapazität FEV1) aus Körpergröße und Lebensalter
 Der Sekundenstoßwert (forced expiratory volume in 1 second, FEV1, Tiffeneau) ist der in der ersten Sekunde forcierter Exspiration ausgeatmete Anteil (in %) der Vitalkapazität. Als forcierte Vitalkapazität (forced vital capacity) FVC bezeichnet man das Volumen, das nach maximaler Einatmung rasch und vollständig ausgeatmet werden kann.
Der Sekundenstoßwert (forced expiratory volume in 1 second, FEV1, Tiffeneau) ist der in der ersten Sekunde forcierter Exspiration ausgeatmete Anteil (in %) der Vitalkapazität. Als forcierte Vitalkapazität (forced vital capacity) FVC bezeichnet man das Volumen, das nach maximaler Einatmung rasch und vollständig ausgeatmet werden kann. Eigenelastizität der Lunge - mit den Komponenten
Oberflächenspannung in der Wand der Alveolen sowie Zug elastischer Fasern im
Lungengewebe (
Eigenelastizität der Lunge - mit den Komponenten
Oberflächenspannung in der Wand der Alveolen sowie Zug elastischer Fasern im
Lungengewebe ( s. dort)
s. dort) Strömungswiderstand der Luft beim Aus- und Einatmen (physikalisch: Strömungswiderstand = Druckgradient / Strömung, vgl. dort)
Strömungswiderstand der Luft beim Aus- und Einatmen (physikalisch: Strömungswiderstand = Druckgradient / Strömung, vgl. dort) Reibung durch Bewegungen des Thoraxapparates beim Atmen (Gewebeverformung, Pleurablätter).
Reibung durch Bewegungen des Thoraxapparates beim Atmen (Gewebeverformung, Pleurablätter).| W = (pA - pB) / Str |
 Atemwegwiderstand (Resistance)
Atemwegwiderstand (Resistance)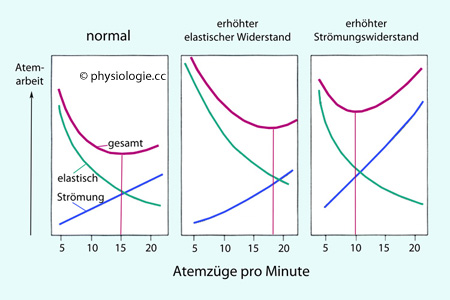
 Abbildung: Atemarbeit entgegen elastischen und
Strömungswiderständen bei konstantem Atemzeitvolumen, aber
unterschiedlicher Atemfrequenz
Abbildung: Atemarbeit entgegen elastischen und
Strömungswiderständen bei konstantem Atemzeitvolumen, aber
unterschiedlicher Atemfrequenz
 Abbildung).
Abbildung). Abbildung).
Abbildung). 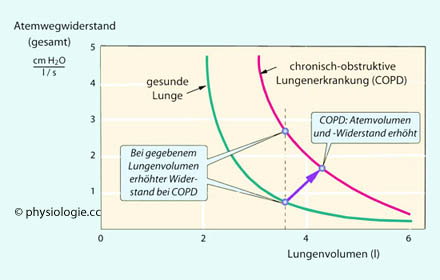
 Abbildung: Atemwegwiderstand als Funktion des Lungenvolumens
Abbildung: Atemwegwiderstand als Funktion des Lungenvolumens Der Atemwegwiderstand hängt von der Tiefe der Einatmung ab.
Zunehmende Einatmung weitet die oberen Luftwege (größere
Querschnittsfläche → geringerer Widerstand) über stärker gespannte elastische Fasern - der
Atemwegwiderstand nimmt auf weit unter
1 cm H2O pro
l/s ab, bei maximaler Ausatmung hingegen steigt er auf ~5 cm H2O pro
l/s an.
Der Atemwegwiderstand hängt von der Tiefe der Einatmung ab.
Zunehmende Einatmung weitet die oberen Luftwege (größere
Querschnittsfläche → geringerer Widerstand) über stärker gespannte elastische Fasern - der
Atemwegwiderstand nimmt auf weit unter
1 cm H2O pro
l/s ab, bei maximaler Ausatmung hingegen steigt er auf ~5 cm H2O pro
l/s an. Abbildung: Mechanische Verankerung und Strömungswiderstand
Abbildung: Mechanische Verankerung und Strömungswiderstand Abbildung oben)
Abbildung oben) Zur Messung der Atemluftströmung (mittels Pneumotachographie) und des Alveolardrucks (mittels Plethysmographie
Zur Messung der Atemluftströmung (mittels Pneumotachographie) und des Alveolardrucks (mittels Plethysmographie  ) s. dort
) s. dort| Re = (ϱ . v . l) / η |
 Bei zusätzlichem Einsatz der Exspirationsmuskulatur (z.B. Atemnot) nimmt der Druck im Pleura- und Alveolarraum zu (im Extrem bis ~100 mmHg), gleichzeitig werden die Atemwege komprimiert, der Atemwegwiderstand nimmt zu und die Atemstromstärke steigt trotz hohen Alveolardrucks kaum an (dynamische Atemwegskompression,
Bei zusätzlichem Einsatz der Exspirationsmuskulatur (z.B. Atemnot) nimmt der Druck im Pleura- und Alveolarraum zu (im Extrem bis ~100 mmHg), gleichzeitig werden die Atemwege komprimiert, der Atemwegwiderstand nimmt zu und die Atemstromstärke steigt trotz hohen Alveolardrucks kaum an (dynamische Atemwegskompression,  s. dort).
s. dort).  Forcierte Inspiration hingegen erweitert die Atemwege und führt zu deutlicher Steigerung des Luftstroms.
Forcierte Inspiration hingegen erweitert die Atemwege und führt zu deutlicher Steigerung des Luftstroms. vgl. dort
vgl. dort| Lungenvolumen |
Definition |
ergibt sich aus | Typischer Bereich (l) |
| Totalkapazität |
Luftinhalt Lunge bei maximaler Einatmungsposition |
TLC = RV+VC | 4,9 - 6,4 |
| Funktionelle Residualkapazität (FRC) |
Luftinhalt Lunge bei normaler Ausatemlage |
- | 2,6 - 3,4 |
| Residualvolumen |
Luftinhalt Lunge bei maximaler Ausatemlage |
RV = TLC-VC | 1,5 - 1,9 |
| Inspiratorische Kapazität |
Volumen zwischen FRC und TLC |
IC = TLC-FRC | 2,3 - 3,0 |
| Exspiratorisches Reservevolumen |
Volumen zwischen FRC und RV |
ERC = FRC-RV | 1,1 - 1,5 |
| Vitalkapazität |
Luftvolumen, das von TLC zu RV ausgeatmet wird |
VC = TLC-RV | 3,4 - 4,5 |
 Das Atemzugvolumen AZV (tidal volume VT, bei gesunden erwachsenen Personen 0,5-0,6 Liter in Ruhe) ist die Luftmenge, die zwischen ruhiger In- und Exspirationslage (ein)geatmet wird. Richtwert etwa 7 ml/kg KG (d.h. bei 70 kg Körpergewicht rund 0,5 l).
Das Atemzugvolumen AZV (tidal volume VT, bei gesunden erwachsenen Personen 0,5-0,6 Liter in Ruhe) ist die Luftmenge, die zwischen ruhiger In- und Exspirationslage (ein)geatmet wird. Richtwert etwa 7 ml/kg KG (d.h. bei 70 kg Körpergewicht rund 0,5 l).| Exspiratorisches Reservevolumen = Vitalkapazität - Inspirationskapazität |
 s. dort).
s. dort). Das Residualvolumen RV errechnet sich aus FRC - ERV. Es ist die Luftmenge, die bei maximaler Exspirationslage in der Lunge verbleibt. Es kann nicht spirometrisch bestimmt werden,
sondern mittels Indikatorverdünnung (Heliumverdünnung,
Stickstoff-Auswaschtechnik) oder über das Boyle-Mariotte-Prinzip (Körperplethysmographie) bestimmt werden. Das
Residualvolumenerhöht sich bei
restriktiven Ventilationsstörungen und mit zunehmendem Alter.
Das Residualvolumen RV errechnet sich aus FRC - ERV. Es ist die Luftmenge, die bei maximaler Exspirationslage in der Lunge verbleibt. Es kann nicht spirometrisch bestimmt werden,
sondern mittels Indikatorverdünnung (Heliumverdünnung,
Stickstoff-Auswaschtechnik) oder über das Boyle-Mariotte-Prinzip (Körperplethysmographie) bestimmt werden. Das
Residualvolumenerhöht sich bei
restriktiven Ventilationsstörungen und mit zunehmendem Alter.| Funktionelle Residualkapazität = Residualvolumen + exspiratorisches Reservevolumen |
 Compliance und Perfusion: Wenn die Lunge das Volumen der FRC enthält, ist das Lungen-Thorax-System am leichtesten dehnbar und der Gefäßwiderstand ist am geringsten
Compliance und Perfusion: Wenn die Lunge das Volumen der FRC enthält, ist das Lungen-Thorax-System am leichtesten dehnbar und der Gefäßwiderstand ist am geringsten Alveolarweite: Adäquate Füllung der Lungen wirkt einer Atelektase der Alveolen entgegen
Alveolarweite: Adäquate Füllung der Lungen wirkt einer Atelektase der Alveolen entgegen  Sauerstoffspeicher:
Auch wenn es nicht viel ist, enthält die Lunge in Atemruhelage doch
etwa 0,4 Liter Sauerstoff, der im Notfall zum Teil genutzt werden
könnte.
Sauerstoffspeicher:
Auch wenn es nicht viel ist, enthält die Lunge in Atemruhelage doch
etwa 0,4 Liter Sauerstoff, der im Notfall zum Teil genutzt werden
könnte. Körperposition: Der Wechsel von aufrechter zu Rückenlage reduziert das [FRC] um etwa einen Liter (!)
Körperposition: Der Wechsel von aufrechter zu Rückenlage reduziert das [FRC] um etwa einen Liter (!) Erhöhter intraabdomineller Druck (Zwerchfellhochstand): Beispielsweise
bei Obesitas, beim Hinlegen (s. oben), in der Schwangerschaft. Auch
Anästhesie (aus unklaren Gründen) und verschiedene Lungenerkrankungen
(u.a. Pulmonalödem), akutes Abdomen senken den [FRC]
Erhöhter intraabdomineller Druck (Zwerchfellhochstand): Beispielsweise
bei Obesitas, beim Hinlegen (s. oben), in der Schwangerschaft. Auch
Anästhesie (aus unklaren Gründen) und verschiedene Lungenerkrankungen
(u.a. Pulmonalödem), akutes Abdomen senken den [FRC]  Körperposition: Wechsel vom Liegen zu aufrechter Lage erhöht den Betrag des FRC
Körperposition: Wechsel vom Liegen zu aufrechter Lage erhöht den Betrag des FRC  Mit dem Körperwachstum nehmen die Werte zu. In höherem Lebensalter
nimmt der Anteil an elastischem Gewebe ab, die Lunge lässt sich weiter
dehnen
Mit dem Körperwachstum nehmen die Werte zu. In höherem Lebensalter
nimmt der Anteil an elastischem Gewebe ab, die Lunge lässt sich weiter
dehnen Druckbeatmung, Lungenemphysem, Asthma bronchiale steigern den Betrag der FRC
Druckbeatmung, Lungenemphysem, Asthma bronchiale steigern den Betrag der FRC|
Die FRC ist bei Lungenemphysem vergrößert |
 Die Inspirationskapazität (inspiratorische Reservekapazität) ist
die Summe aus Atemzugvolumen und inspiratorischem Reservevolumen (VT plus IRV), also
die Luft, die zusätzlich zur FRC bis zur maximalen Inspiration
eingeatmet werden kann. Sie
beträgt bei gesunden Frauen im Schnitt 2,4, bei Männern 3,8 Liter
Die Inspirationskapazität (inspiratorische Reservekapazität) ist
die Summe aus Atemzugvolumen und inspiratorischem Reservevolumen (VT plus IRV), also
die Luft, die zusätzlich zur FRC bis zur maximalen Inspiration
eingeatmet werden kann. Sie
beträgt bei gesunden Frauen im Schnitt 2,4, bei Männern 3,8 Liter  Eine
wichtige lungenfunktionsdiagnostische Größe ist die Vitalkapazität
(VC, vital capacity),
die aus dem Zustand tiefster Einatmung maximal ausgeatmet werden kann.
Man kann sie als die Summe von IRV, VT und ERV auffassen.
Eine
wichtige lungenfunktionsdiagnostische Größe ist die Vitalkapazität
(VC, vital capacity),
die aus dem Zustand tiefster Einatmung maximal ausgeatmet werden kann.
Man kann sie als die Summe von IRV, VT und ERV auffassen.| Restriktive Ventilationsstörungen verringern die Vitalkapazität |
 Die Totalkapatität (TLC, total lung capacity) ist das Luftvolumen, die sich bei maximaler Einatmung in der Lunge befindet (TLC = RV + ERV + AZV + IRV).
Die Totalkapatität (TLC, total lung capacity) ist das Luftvolumen, die sich bei maximaler Einatmung in der Lunge befindet (TLC = RV + ERV + AZV + IRV).| Totalkapazität = Vitalkapazität + Residualvolumen |


 Oberflächenspannung ist ein Maß für die Kraft, die benötigt wird,
Flüssigkeitsmoleküle an einer Gas-Flüssigkeits-Grenzfläche zusammenzuhalten bzw. in eine zu vergrößernde Grenzfläche zu verlagern.
In der Flüssigkeit (in unserem Fall: Wasser) sind die Anziehungskräfte
zwischen den Wassermolekülen nach allen Richtungen gleich groß und
gleichen einander aus (vgl. Abbildung).
Oberflächenspannung ist ein Maß für die Kraft, die benötigt wird,
Flüssigkeitsmoleküle an einer Gas-Flüssigkeits-Grenzfläche zusammenzuhalten bzw. in eine zu vergrößernde Grenzfläche zu verlagern.
In der Flüssigkeit (in unserem Fall: Wasser) sind die Anziehungskräfte
zwischen den Wassermolekülen nach allen Richtungen gleich groß und
gleichen einander aus (vgl. Abbildung).
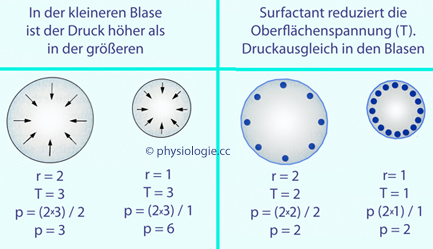
 Abbildung: LaPlace-Gesetz und Surfactant
Abbildung: LaPlace-Gesetz und Surfactant
 Detergentien bzw. Tenside sind "oberflächenaktiv": Sie bestehen aus Molekülen mit einem polaren und einem apolaren Ende und reichern sich an Grenzflächen zwischen Wasser und Luft an (Abbildung), sodass die gegenseitige Anziehungskraft der Wassermoleküle - und damit die Oberflächenspannung - reduziert wird.
Detergentien bzw. Tenside sind "oberflächenaktiv": Sie bestehen aus Molekülen mit einem polaren und einem apolaren Ende und reichern sich an Grenzflächen zwischen Wasser und Luft an (Abbildung), sodass die gegenseitige Anziehungskraft der Wassermoleküle - und damit die Oberflächenspannung - reduziert wird.  Surfactants (surface active agents)
Surfactants (surface active agents)  sind eine Mischung aus
sind eine Mischung aus
 Lipiden (~90%), davon rund die Hälfte Dipalmitoylphosphatidylcholin (DPPC), ein Lezithin, das den Hauptbestandteil des Surfactant ausmacht, und
Lipiden (~90%), davon rund die Hälfte Dipalmitoylphosphatidylcholin (DPPC), ein Lezithin, das den Hauptbestandteil des Surfactant ausmacht, und Proteinen (~10%) - immunaktiven Apoproteinen A und D (SP-A, SP-D: angeborene Immunität - sie opsonisieren Bakterien und Viren) sowie den hydrophoben Apoproteinen B und C (SP-B, SP-C), welche die Einlagerung
von Lipiden beschleunigen.
Proteinen (~10%) - immunaktiven Apoproteinen A und D (SP-A, SP-D: angeborene Immunität - sie opsonisieren Bakterien und Viren) sowie den hydrophoben Apoproteinen B und C (SP-B, SP-C), welche die Einlagerung
von Lipiden beschleunigen.
 Abbildung: Alveolarwand
Abbildung: Alveolarwand Surfactants (Sammelbezeichnung "surfactant") reduzieren
die theoretisch an einer Luft-Wasser-Grenze zu erwartende
Oberflächenspannung in der Lunge von ~70 dyn/cm auf ~25 dyn/cm, also um
etwa zwei Drittel. Surfactant hat die niedrigste Oberflächenspannung
unter allen bekannten biologischen Substanzen. Durch die Reduktion der
Oberflächenspannung verringert Surfactant auch die Tendenz von
Wassermolekülen, in die Alveole einzutreten und hilft so, die Alveolen trocken zu halten.
Surfactants (Sammelbezeichnung "surfactant") reduzieren
die theoretisch an einer Luft-Wasser-Grenze zu erwartende
Oberflächenspannung in der Lunge von ~70 dyn/cm auf ~25 dyn/cm, also um
etwa zwei Drittel. Surfactant hat die niedrigste Oberflächenspannung
unter allen bekannten biologischen Substanzen. Durch die Reduktion der
Oberflächenspannung verringert Surfactant auch die Tendenz von
Wassermolekülen, in die Alveole einzutreten und hilft so, die Alveolen trocken zu halten. (club cells, Keulenzellen, sekretorische Zellen der distalen Luftwege: exokrine Zellen in den Bronchiolen) sezernieren Surfactantproteine und Glykoproteine.
(club cells, Keulenzellen, sekretorische Zellen der distalen Luftwege: exokrine Zellen in den Bronchiolen) sezernieren Surfactantproteine und Glykoproteine. | Surfactant reduziert die Oberflächenspannung in den Alveolen und macht die Lunge dehnungsfähiger |
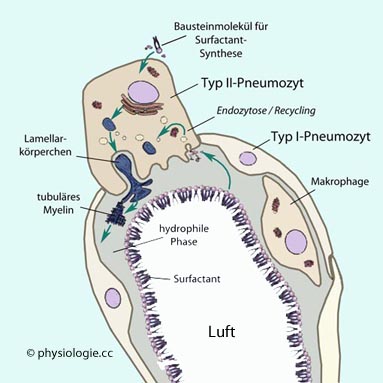
 Abbildung: Surfactant-Synthese in einer Lungenalveole (schematisch)
Abbildung: Surfactant-Synthese in einer Lungenalveole (schematisch)
 Abbildung), welche die Proteinkomponenten
synthetisieren und posttranslational modifizieren, bis in Lamellarkörperchen (lamellar bodies, lamellar granules, keratinosomes, membrane-coating granules
- Phospholipidkörnchen mit <0,5 µm Durchmesser) das fertige
Surfactant zur Exozytose bereitsteht. Pro Stunde sezerniert die Lunge
~10% des in den Lamellarkörperchen
vorliegenden Materials, das nur zum Teil neu gebildet wurde und z.T.
recycelt wird. Die in den Lamellarkörperchen gespeicherten
Phosphatidylcholine (cholinbasierten Phospholipide) sind die Grundlage
für die oberflächenspannungsverringernde Wirkung des Surfactant.
Abbildung), welche die Proteinkomponenten
synthetisieren und posttranslational modifizieren, bis in Lamellarkörperchen (lamellar bodies, lamellar granules, keratinosomes, membrane-coating granules
- Phospholipidkörnchen mit <0,5 µm Durchmesser) das fertige
Surfactant zur Exozytose bereitsteht. Pro Stunde sezerniert die Lunge
~10% des in den Lamellarkörperchen
vorliegenden Materials, das nur zum Teil neu gebildet wurde und z.T.
recycelt wird. Die in den Lamellarkörperchen gespeicherten
Phosphatidylcholine (cholinbasierten Phospholipide) sind die Grundlage
für die oberflächenspannungsverringernde Wirkung des Surfactant. Abbildung).
Abbildung). 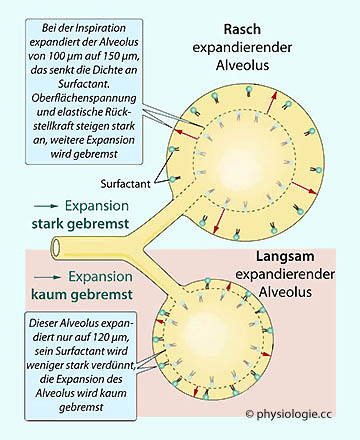
 Abbildung: "Surfactant-Bremse"
Abbildung: "Surfactant-Bremse"
| p = 2T / r |
 Abbildung):
Je schneller sich ein Aleolus ausdehnt, desto rascher nimmt - bewirkt
durch Ausdünnung der Phospholipidmoleküle des Surfactant - die
Oberflächenspannung zu, was eine zunehmende nach innen gerichtete
elastische Kraft bedeutet und ein weiteres "Aufblähen" des Alveolus verhindert
("Surfactantbremse").
Abbildung):
Je schneller sich ein Aleolus ausdehnt, desto rascher nimmt - bewirkt
durch Ausdünnung der Phospholipidmoleküle des Surfactant - die
Oberflächenspannung zu, was eine zunehmende nach innen gerichtete
elastische Kraft bedeutet und ein weiteres "Aufblähen" des Alveolus verhindert
("Surfactantbremse").  s. dort).
s. dort).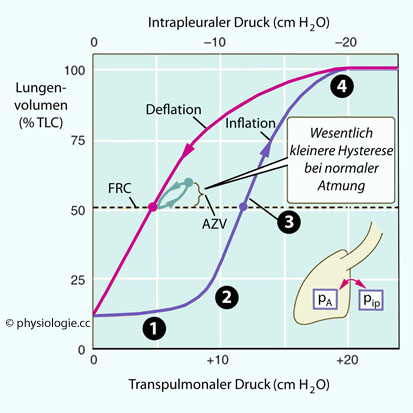

 Abbildung: Druck-Volumen-Kurven bei Inflation und Deflation einer Lunge
Abbildung: Druck-Volumen-Kurven bei Inflation und Deflation einer Lunge
 Abbildung):
Abbildung):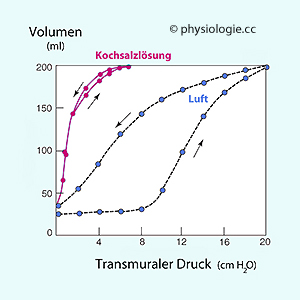
 Abbildung: Hysterese einer mit isotoner Flüssigkeit (rot) und einer mit Luft gefüllten Lunge
Abbildung: Hysterese einer mit isotoner Flüssigkeit (rot) und einer mit Luft gefüllten Lunge
 Abbildung):
Abbildung):| Die Bildung von Surfactant ist ein Reifezeichen der Lunge (ab Schwangerschaftswoche 28) Ein Mangel an Surfactant erniedrigt die Compliance (Dehnungsfähigkeit) der Lunge |

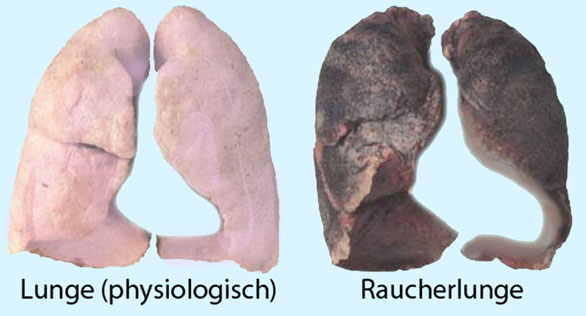
 Abbildung: Gesunde Lunge vs. Raucherlunge
Abbildung: Gesunde Lunge vs. Raucherlunge
 , chronisches Asthma bronchiale
, chronisches Asthma bronchiale  oder chronische
Bronchitis (COPD = chronic obstructive pulmonary disease, Chronische obstruktive Lungenerkrankung), verschieben die Atemlage in Richtung Inspiration; das inspiratorische Reservevolumen
ist herabgesetzt, und die Leistungsreserve nimmt ab, denn bei Belastung
wird vorwiegend das inspiratorische Reservevolumen in Anspruch genommen. Im Spätstadium der chronisch obstruktiven Lungenerkrankung unterscheidet man in der Klinik zwei Typen (die allerdings nur selten in Reinform vorliegen):
oder chronische
Bronchitis (COPD = chronic obstructive pulmonary disease, Chronische obstruktive Lungenerkrankung), verschieben die Atemlage in Richtung Inspiration; das inspiratorische Reservevolumen
ist herabgesetzt, und die Leistungsreserve nimmt ab, denn bei Belastung
wird vorwiegend das inspiratorische Reservevolumen in Anspruch genommen. Im Spätstadium der chronisch obstruktiven Lungenerkrankung unterscheidet man in der Klinik zwei Typen (die allerdings nur selten in Reinform vorliegen): Pink Puffer: Starke Dyspnoe, Gasaustausch durch kompensatorische Atemarbeit weitgehend normal (pink!), Patienten eher untergewichtig („pulmonale Kachexie“)
Pink Puffer: Starke Dyspnoe, Gasaustausch durch kompensatorische Atemarbeit weitgehend normal (pink!), Patienten eher untergewichtig („pulmonale Kachexie“) Blue Bloater:
Gasaustausch behindert, Absinken des Sauerstoffpartialdrucks im arteriellen Blut, Sauerstoffmangel (Zyanose: blue!),
kompensatorisch erhöhte Erythropoese (Hämatokritanstieg), Hyperkapnie,
Rechtsherzinsuffizienz, Patienten eher übergewichtig
Blue Bloater:
Gasaustausch behindert, Absinken des Sauerstoffpartialdrucks im arteriellen Blut, Sauerstoffmangel (Zyanose: blue!),
kompensatorisch erhöhte Erythropoese (Hämatokritanstieg), Hyperkapnie,
Rechtsherzinsuffizienz, Patienten eher übergewichtig| Bei einer COPD kann der pO2 im Blut absinken |

 Tabakrauchen reduziert Sauerstoffaufnahmevermögen und
Leistungsfähigkeit, weil Nikotin die Bronchialmuskulatur zur
Kontraktion veranlasst und dadurch den Atemwegwiderstand erhöht.
Die Trasnsportfunktion des Flimmerepithels nimmt drastisch ab, die Zilien schlagen unkoordiniert, die mukoziliäre Clearance
ist reduziert (Raucherhusten). Zusätzlich kommt es zu chronischer
Bronchitis. All dies kann - insbesondere, wenn Infektionen der Atemwege
dazukommen (Corona!) - zu Emphysem,
verringerter Sauerstoffdiffusion und innerem Ersticken führen und so - unabhängig vom Krebsrisiko - letale Folgen haben. Nach einer 2025 publizierten Studie reduziert jede gerauchte Zigarette die Lebenszeit um mindestens 20 Minuten.
Tabakrauchen reduziert Sauerstoffaufnahmevermögen und
Leistungsfähigkeit, weil Nikotin die Bronchialmuskulatur zur
Kontraktion veranlasst und dadurch den Atemwegwiderstand erhöht.
Die Trasnsportfunktion des Flimmerepithels nimmt drastisch ab, die Zilien schlagen unkoordiniert, die mukoziliäre Clearance
ist reduziert (Raucherhusten). Zusätzlich kommt es zu chronischer
Bronchitis. All dies kann - insbesondere, wenn Infektionen der Atemwege
dazukommen (Corona!) - zu Emphysem,
verringerter Sauerstoffdiffusion und innerem Ersticken führen und so - unabhängig vom Krebsrisiko - letale Folgen haben. Nach einer 2025 publizierten Studie reduziert jede gerauchte Zigarette die Lebenszeit um mindestens 20 Minuten.

 Man
unterscheidet statische und dynamische Größen der
Lungenfunktion.
Statische Volumina sind durch definierte Atemlagen begrenzt, wie das
Atemzugvolumen oder die Vitalkapazität. Dynamische Volumina sind der Atemgrenzwert und die Einsekundenkapazität (Sekundenstoßwert FEV1).
Atemvolumina hängen von Körpergröße, Alter, Geschlecht,
Trainings- und Gesundheitszustand ab. Die Vitalkapazität ist bei
restriktiven, der Sekundenstoßwert bei obstruktiven
Ventilationsstörungen vermindert Man
unterscheidet statische und dynamische Größen der
Lungenfunktion.
Statische Volumina sind durch definierte Atemlagen begrenzt, wie das
Atemzugvolumen oder die Vitalkapazität. Dynamische Volumina sind der Atemgrenzwert und die Einsekundenkapazität (Sekundenstoßwert FEV1).
Atemvolumina hängen von Körpergröße, Alter, Geschlecht,
Trainings- und Gesundheitszustand ab. Die Vitalkapazität ist bei
restriktiven, der Sekundenstoßwert bei obstruktiven
Ventilationsstörungen vermindert  Alle
Anteile der Vitalkapazität können direkt spirometrisch bestimmt werden;
Residualvolumen, funktionelle Residualkapazität (FRC) und Totalkapazität indirekt mittels Indikatorverdünnung (Helium-Einwaschmethode, Stickstoff-Auswaschmethode). Das
Atemzugvolumen liegt zwischen normaler Aus- und Einatemlage, die
Vitalkapazität zwischen maximaler Aus- und maximaler Einatmung. FRC ist
die Luftmenge, die sich
bei ausgeatmeter Ruhelage in der Lunge befindet (Residualvolumen +
exspiratorisches Reservevolumen); ihr Betrag ist bei Lungenemphysem
vergrößert. Totalkapazität = Vitalkapazität + Residualvolumen Alle
Anteile der Vitalkapazität können direkt spirometrisch bestimmt werden;
Residualvolumen, funktionelle Residualkapazität (FRC) und Totalkapazität indirekt mittels Indikatorverdünnung (Helium-Einwaschmethode, Stickstoff-Auswaschmethode). Das
Atemzugvolumen liegt zwischen normaler Aus- und Einatemlage, die
Vitalkapazität zwischen maximaler Aus- und maximaler Einatmung. FRC ist
die Luftmenge, die sich
bei ausgeatmeter Ruhelage in der Lunge befindet (Residualvolumen +
exspiratorisches Reservevolumen); ihr Betrag ist bei Lungenemphysem
vergrößert. Totalkapazität = Vitalkapazität + Residualvolumen  Nasenatmung trägt zum Atemwegwiderstand (~1,5 cm H2O pro l/s) bei: Wirbelbildungen im Bereich der
Nasenmuscheln reinigen die Luft. ~80% des Atmungswiderstandes stammen aus den Luftwegen (Atemwegwiderstand - davon ~80% durch Luftwege mit ≥2 mm Durchmesser), ~20% von Reibungsverlusten im Gewebe (Lunge und Thorax). Der Energiebedarf zur Überwindung
des Atmungswiderstandes beträgt ~1% des gesamten
Energieumsatzes. Während der Einatmung wird Arbeit zur Dehnung
elastischer
Komponenten investiert und während der
Exspiration zurückgewonnen Nasenatmung trägt zum Atemwegwiderstand (~1,5 cm H2O pro l/s) bei: Wirbelbildungen im Bereich der
Nasenmuscheln reinigen die Luft. ~80% des Atmungswiderstandes stammen aus den Luftwegen (Atemwegwiderstand - davon ~80% durch Luftwege mit ≥2 mm Durchmesser), ~20% von Reibungsverlusten im Gewebe (Lunge und Thorax). Der Energiebedarf zur Überwindung
des Atmungswiderstandes beträgt ~1% des gesamten
Energieumsatzes. Während der Einatmung wird Arbeit zur Dehnung
elastischer
Komponenten investiert und während der
Exspiration zurückgewonnen  Bei normaler Ruheatmung ist die Atemarbeit bei ~15 Atemzügen pro Minute
am geringsten. Der Atemwegwiderstand sinkt mit der Tiefe der
Einatmung (größere
Querschnittsfläche → geringerer Widerstand).
Ist der Strömungswiderstand erhöht (obstruktive Störung), ist eine
ausreichende Ventilation bei tiefer Atmung (und abnehmender
Atemfrequenz) am leichtesten. Steigt der elastische Widerstand (Fibrose), ist der Arbeitszuwachs bei flacher Atmung (mit erhöhter Atemfrequenz) am geringsten (in Atem-Mittellage ist die Lunge am besten dehnbar)
Bei normaler Ruheatmung ist die Atemarbeit bei ~15 Atemzügen pro Minute
am geringsten. Der Atemwegwiderstand sinkt mit der Tiefe der
Einatmung (größere
Querschnittsfläche → geringerer Widerstand).
Ist der Strömungswiderstand erhöht (obstruktive Störung), ist eine
ausreichende Ventilation bei tiefer Atmung (und abnehmender
Atemfrequenz) am leichtesten. Steigt der elastische Widerstand (Fibrose), ist der Arbeitszuwachs bei flacher Atmung (mit erhöhter Atemfrequenz) am geringsten (in Atem-Mittellage ist die Lunge am besten dehnbar)  Die Luftströmung erfolgt in den
Luftwegen teils laminar, teils turbulent - bedingt durch die Geometrie der Bronchien, Strömungsgeschwindigkeit, Dichte und Viskosität des
strömenden Mediums. Laminare Strömung findet sich am ehesten distal von terminalen
Bronchiolen (niedrige Strömungsgeschwindigkeit),
turbulente Strömung in der Trachea (bei höherer
Strömungsgeschwindigkeit), der effektive
Widerstand steigt dann an. An Aufzweigungsstellen
der größeren Luftwege mischen sich laminare mit
turbulenten Strömungsprofilen (transitionale Strömung). Forcierte Ausatmung steigert den Druck im Alveolarraum, die
Atemwege werden komprimiert, der Atemwegwiderstand nimmt zu (dynamische
Atemwegskompression). Forcierte Einatmung erweitert
die Atemwege Die Luftströmung erfolgt in den
Luftwegen teils laminar, teils turbulent - bedingt durch die Geometrie der Bronchien, Strömungsgeschwindigkeit, Dichte und Viskosität des
strömenden Mediums. Laminare Strömung findet sich am ehesten distal von terminalen
Bronchiolen (niedrige Strömungsgeschwindigkeit),
turbulente Strömung in der Trachea (bei höherer
Strömungsgeschwindigkeit), der effektive
Widerstand steigt dann an. An Aufzweigungsstellen
der größeren Luftwege mischen sich laminare mit
turbulenten Strömungsprofilen (transitionale Strömung). Forcierte Ausatmung steigert den Druck im Alveolarraum, die
Atemwege werden komprimiert, der Atemwegwiderstand nimmt zu (dynamische
Atemwegskompression). Forcierte Einatmung erweitert
die Atemwege Ohne Surfactant
müsste die Einatmung gegen einen Druck von ca.
3 kPa (statt knapp 0,5 kPa) erfolgen. Surfactant besteht aus Molekülen mit polaren und apolaren Enden (90% Lipide, 10% Proteine), die sich an der Wasser / Luft- Grenze so anordnen, dass die Oberflächenspannung reduziert wird - von (theoretischen) ~70 auf ~25 dyn/cm. So erhöht Surfactant die Dehnbarkeit der Lunge. Fertiges
Surfactant steht in Lamellarkörperchen (Phospholipidkörnchen) zur Exozytose aus Typ-II-Zellen bereit; pro Stunde
sezerniert die Lunge ~10% des
Materials. Die Sekretion steigt mit körperlicher Belastung, Gähnen, Seufzen. Surfactant verhindert einen alveolären "Wettlauf der Expansion": Mit der Ausdehnung des Alveolus wird das Surfactant ausgedünnt, die Oberflächenspannung steigt, was ein weiteres Aufblähen des Alveolus erschwert. Unterschiedliche Dehnbarkeit der Alveolen wird durch diese "Surfactant-Bremse" ausgeglichen, die Entfaltung der Alveolen um einen Mittelwert herum stabilisiert Ohne Surfactant
müsste die Einatmung gegen einen Druck von ca.
3 kPa (statt knapp 0,5 kPa) erfolgen. Surfactant besteht aus Molekülen mit polaren und apolaren Enden (90% Lipide, 10% Proteine), die sich an der Wasser / Luft- Grenze so anordnen, dass die Oberflächenspannung reduziert wird - von (theoretischen) ~70 auf ~25 dyn/cm. So erhöht Surfactant die Dehnbarkeit der Lunge. Fertiges
Surfactant steht in Lamellarkörperchen (Phospholipidkörnchen) zur Exozytose aus Typ-II-Zellen bereit; pro Stunde
sezerniert die Lunge ~10% des
Materials. Die Sekretion steigt mit körperlicher Belastung, Gähnen, Seufzen. Surfactant verhindert einen alveolären "Wettlauf der Expansion": Mit der Ausdehnung des Alveolus wird das Surfactant ausgedünnt, die Oberflächenspannung steigt, was ein weiteres Aufblähen des Alveolus erschwert. Unterschiedliche Dehnbarkeit der Alveolen wird durch diese "Surfactant-Bremse" ausgeglichen, die Entfaltung der Alveolen um einen Mittelwert herum stabilisiert  Das passive
Druck-Volumen-Verhalten der Lunge ist bei Ein- und Ausatmung
unterschiedlich (Hysterese), z.T. erklärbar mit einer von der Atemtiefe
abhängigen Umorientierung der Surfactantmoleküle (geringere Compliance
bei der Einatmung im Vergleich zur Ausatmung). Die ersten Atemzüge des Neugeborenen sind durch Oberflächenkräfte erschwert,
die sich bei der Bildung von Luft-Flüssigkeits-Grenzen in den Alveolen aufbauen;
Surfactant reduziert den Aufwand. Die Bildung von Surfactant ist ein
Reifezeichen der Lunge (ab SSW 28); Mangel an Surfactant erniedrigt
die Compliance der Lunge Das passive
Druck-Volumen-Verhalten der Lunge ist bei Ein- und Ausatmung
unterschiedlich (Hysterese), z.T. erklärbar mit einer von der Atemtiefe
abhängigen Umorientierung der Surfactantmoleküle (geringere Compliance
bei der Einatmung im Vergleich zur Ausatmung). Die ersten Atemzüge des Neugeborenen sind durch Oberflächenkräfte erschwert,
die sich bei der Bildung von Luft-Flüssigkeits-Grenzen in den Alveolen aufbauen;
Surfactant reduziert den Aufwand. Die Bildung von Surfactant ist ein
Reifezeichen der Lunge (ab SSW 28); Mangel an Surfactant erniedrigt
die Compliance der Lunge |
