
Die Physiologie der Herzmechanik
lässt sich besonders gut darstellen, wenn man die Druck- und
Volumenverläufe des Herzzyklus (Abbildung) gegeneinander in
Beziehung setzt:
 Die Ventrikelsystole tritt als Folge der Erregungsausbreitung über das
Kammermyokard (im EKG erzeugt das den QRS-Komplex) auf. Vorher schlägt
bereits der Vorhof, dessen Erregung sich als P-Welle im EKG abbildet.
Die Vorhofsystole unterstützt die Füllung der Kammer (späte Diastole).
Die Ventrikelsystole tritt als Folge der Erregungsausbreitung über das
Kammermyokard (im EKG erzeugt das den QRS-Komplex) auf. Vorher schlägt
bereits der Vorhof, dessen Erregung sich als P-Welle im EKG abbildet.
Die Vorhofsystole unterstützt die Füllung der Kammer (späte Diastole).
Die R-Zacke im EKG koinzidiert mit der größten Füllung des linken Ventrikels
|
 Der steigende Druck im Ventrikel schließt die Atrioventrikularklappen
(linkes Herz: Mitralklappe
Der steigende Druck im Ventrikel schließt die Atrioventrikularklappen
(linkes Herz: Mitralklappe  ), und die Ventrikelwand spannt sich an, bis
der Druck denjenigen in der Aorta erreicht und überwindet, und Blut in
die Aortenwurzel zu strömen beginnt.
), und die Ventrikelwand spannt sich an, bis
der Druck denjenigen in der Aorta erreicht und überwindet, und Blut in
die Aortenwurzel zu strömen beginnt.
All dies erzeugt
mechanisch-akustische Schwingungen, die zusammen den 1. Herzton (S1,
"Muskelton") ergeben.
 Die Zeit zwischen Mitralklappenschluss und
Aortenklappenöffnung heisst Anspannungszeit (frühe Ventrikelsystole, isovolumetrische Kontraktion; Dauer 0,05 Sekunden).
Die Zeit zwischen Mitralklappenschluss und
Aortenklappenöffnung heisst Anspannungszeit (frühe Ventrikelsystole, isovolumetrische Kontraktion; Dauer 0,05 Sekunden).
Die maximale Geschwindigkeit des Druckanstiegs (dp/dtmax) im Ventrikel ( Abbildung)
ist ein wichtiger Index seiner Kontraktilit (Messung mittels
Herzkatheter). Auch der Frank-Starling-Mechanismus wirkt sich auf die
maximale Steilheit des systolischen Druckanstiegs aus.
Abbildung)
ist ein wichtiger Index seiner Kontraktilit (Messung mittels
Herzkatheter). Auch der Frank-Starling-Mechanismus wirkt sich auf die
maximale Steilheit des systolischen Druckanstiegs aus.
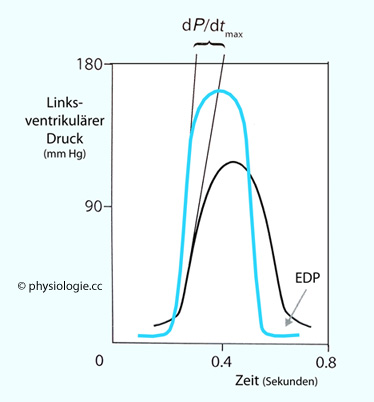
 Abbildung: dp/dtmax
Abbildung: dp/dtmax
Nach einer Vorlage in Herring / Paterson, Levick's Introduction to Cardiovascular Physiology, 6th ed. 2018
Die Abbildung
zeigt den Effekt gesteigerter Sympathikuswirkung bzw. Noradrenalingabe
(blaue Kurve) auf den Druckverlauf in einem linken Ventrikel. Schwarze
Kurve: Kontrolle (ohne Stimulierung).
dp/dtmax = maximaler Druckanstieg, EDP = enddiastolischer Druck
 In der Austreibungszeit kontrahieren die Myokardzellen weiter, nunmehr können sie sich gut
verkürzen, da das Volumen im Ventrikel abnehmen kann (Ausstrom in die
Aorta). Etwa 75% des Schlagvolumens werden in der ersten Hälfte (~0,15 Sekunden) der Austreibungszeit in die Schlagader deponiert; während dieser rapid ejection phase
nimmt die Strömung in Aorta / Pulmonalarterie bis zum Erreichen eines
Maximalwertes zu. Während des anschließenden Rests der Austreibungszeit
nimmt die Strömung in die Aorta / Pulmonalarterie wieder ab (decreased ejection), bis sie für einen Augenblick negativ (ventrikelwärts gerichtet) wird, was die Klappe sofort schließt (Ender der Systole).
In der Austreibungszeit kontrahieren die Myokardzellen weiter, nunmehr können sie sich gut
verkürzen, da das Volumen im Ventrikel abnehmen kann (Ausstrom in die
Aorta). Etwa 75% des Schlagvolumens werden in der ersten Hälfte (~0,15 Sekunden) der Austreibungszeit in die Schlagader deponiert; während dieser rapid ejection phase
nimmt die Strömung in Aorta / Pulmonalarterie bis zum Erreichen eines
Maximalwertes zu. Während des anschließenden Rests der Austreibungszeit
nimmt die Strömung in die Aorta / Pulmonalarterie wieder ab (decreased ejection), bis sie für einen Augenblick negativ (ventrikelwärts gerichtet) wird, was die Klappe sofort schließt (Ender der Systole).
Am Ende der Anspannungszeit öffnet die Aortenklappe beim Betrag des diastolischen Aortendrucks von ~80 mmHg, die Pulmonalklappe bei ~10 mmHg. Die Spitzendrucke betragen ~120 mmHg (linker Ventrikel / Aorta) bzw. ~25 mmHg (rechter Ventrikel / a. pulmonalis)
|
 Typische Druckwerte (mmHg, erwachsene Person, körperliche Ruhe, Rückenlage):
Typische Druckwerte (mmHg, erwachsene Person, körperliche Ruhe, Rückenlage):
| Nach Herring / Paterson, Levick's Introduction to Cardiovascular Physiology, 6th ed. 2018 |
Rechts
|
Links
|
Atrium
|
3
|
8
|
Ventrikel
|
|
Enddiastolisch
|
4
|
9
|
Endsystolisch
|
25
|
120
|
Die Taschen der Aortenklappe nähern sich während der Austreibungszeit
den Abgangsstellen der Koronararterien in der Aortenwand, decken diese
aber nicht ab - Wirbelbildungen halten
den Zugang offen, die Perfusion des Myokards bleibt aufrecht (wenn auch
im linken Ventrikel durch den hohen Gewebedruck des kontrahierten
Myokards - der die Koronargefäße  komprimiert - stark herabgesetzt).
komprimiert - stark herabgesetzt).
Die ventrikuläre Austreibungsphase entspricht zeitlich etwa der T-Welle
|
Gegen Ende der Austreibungszeit
(Dauer: 0,3 Sekunden) repolarisieren sich die Zellen des Ventrikelmyokards, dieser Vorgang erzeugt die T-Welle des
EKG.
Im rechten Herzen herrschen niedrigere Drucke (der Druck in der
Pulmonalarterie schwankt zwischen 25 (systolisch) und 12 mmHg
(diastolisch) im Liegen (im Stehen um jeweils 3 mmHg weniger; bei
schwerer körperlicher Arbeit steigen die Werte auf etwa 40/24 mmHg).
Das hängt mit dem wesentlich geringeren Strömungswiderstand im
Lungenkreislauf zusammen, verglichen mit der Körperperipherie.
In der Pulmonalarterie herrscht bei körperlicher Ruhe ein mittlerer Druck von 12-16 mmHg
|
Die
Strömungsgeschwindigkeit des Blutes durch die Aortenwurzel erreicht
früh in der Austreibungszeit ihren Höhepunkt ( Abbildung oben). Dann
nimmt sie fast linear ab, um (nach einer kurzen Strömungsumkehr, welche
die Aortenklappe zudrückt) auf Null zu gehen (bis zur nächsten
Austreibungszeit).
Abbildung oben). Dann
nimmt sie fast linear ab, um (nach einer kurzen Strömungsumkehr, welche
die Aortenklappe zudrückt) auf Null zu gehen (bis zur nächsten
Austreibungszeit).
| Während der Austreibungszeit ist die Aortenklappe offen, Blut strömt in die Aorta (Maximalwert in der frühen Austreibungszeit) |
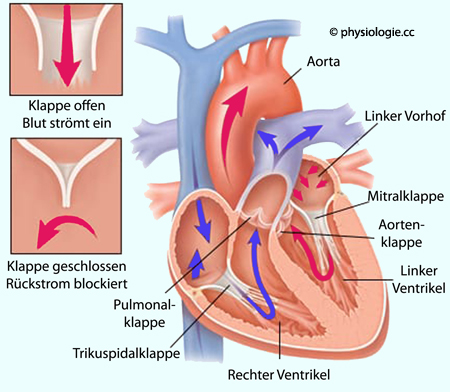
 Abbildung: Anordnung und Funktion der Herzklappen
Abbildung: Anordnung und Funktion der Herzklappen
Nach einer Vorlage bei 2minutemedicine.com
Ist eine Klappe verengt, dann öffnet
sie nicht vollständig, Blut gelangt nicht ausreichend durch die Klappe
und staut sich vor ihr zurück (Stenose).
Ist der Klappenschluss nicht komplett, strömt Blut retrograd durch die undichte Klappe (Klappeninsuffizienz)

Das physiologische Wechselspiel zwischen Öffnen und Schließen der Herzklappen ( Abbildung)
stellt nicht nur sicher, dass Blut (so gut wie) nur in einer Richtung
passiert und dadurch die Strömung im Sinne der Kreislauffunktion
stattfindet, es schont dadurch auch das Myokard. Klappenfehler
beanspruchen den Herzmuskel stärker als normal, es kommt zu reaktiver
Hypertrophie (kompensiertes Stadium), möglicherweise auch zu einer
Überforderung des Herzens (Dekompensation). Dann ist es notwendig, das
Herz zu schonen (z.B. durch Diuretika) und wieder erstarken zu lassen.
Abbildung)
stellt nicht nur sicher, dass Blut (so gut wie) nur in einer Richtung
passiert und dadurch die Strömung im Sinne der Kreislauffunktion
stattfindet, es schont dadurch auch das Myokard. Klappenfehler
beanspruchen den Herzmuskel stärker als normal, es kommt zu reaktiver
Hypertrophie (kompensiertes Stadium), möglicherweise auch zu einer
Überforderung des Herzens (Dekompensation). Dann ist es notwendig, das
Herz zu schonen (z.B. durch Diuretika) und wieder erstarken zu lassen.
Schließlich erschlaffen die Muskelzellen so weit, dass der Druck
in der Aorta wieder höher ist (Windkesseleffekt) als
im sich entspannenden Ventrikel; die Blutströmung kehrt sich Richtung
Ventrikel um (Rückfluss <5% des Schlagvolumens), was die Aortenklappe zudrückt und zum Schwingen bringt
(2. Herzton S2, "Klappenton").
Das Schließen der Aortenklappe durch beginnenden Blutrückstrom zum Ventrikel bewirkt die typische Inzisur im Aortenpuls
|
Rechtes und linkes Herz:
Die  Abbildung zeigt, wie sich die zeitlichen Abfolgen von
Kontraktionen, Klappenöffnungen und -schließungen zwischen rechtem und
linkem Herzen unterscheiden, und wie sich das auf die Struktur der
Herztöne auswirkt:
Abbildung zeigt, wie sich die zeitlichen Abfolgen von
Kontraktionen, Klappenöffnungen und -schließungen zwischen rechtem und
linkem Herzen unterscheiden, und wie sich das auf die Struktur der
Herztöne auswirkt:
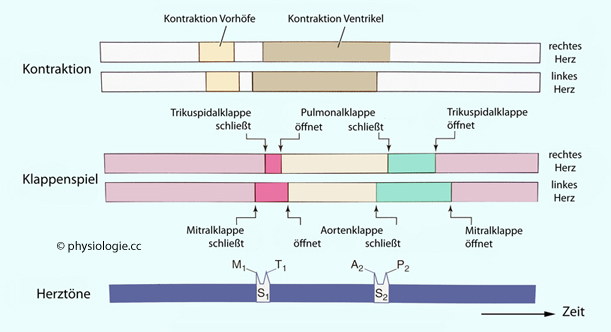
 Abbildung: Zeitliche Differenzen rechtes / linkes Herz
Abbildung: Zeitliche Differenzen rechtes / linkes Herz
Modifiziert nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Der
rechte Vorhof kontrahiert vor dem linken, der linke Ventrikel vor dem
rechten: Der Sinusknoten liegt im rechten Vorhof und wird zuerst
erregt, und die Erregung breitet sich im Bereich des Ventrikelseptums
von links nach rechts aus.
Zu
Beginn der Systole schließt die Mitralklappe vor der Trikuspidalklappe (Anteile M
1 und T
1 des ersten Herztons S
1), di
e
Pulmonalklappe öffnet vor der Aortenklappe - ein Zeichen der kürzeren
Anspannungszeit wegen des geringeren Drucks, den der rechte Ventrikel
aufbauen muss.
Am Ende der Systole schließt die Aortenklappe vor der Pulmonalklappe (A2 und P2 in S2),
und die Trikuspidalklappe öffnet vor der Mitralklappe - bedingt durch
den unterschiedlich starken Druckabfall in den Ventrikeln während der Entspannungszeit. Die Füllungszeit beginnt im rechten Ventrikel früher als im linken

Die Ventrikel
haben ineinander übergehende Lagen zirkulärer und spiralig angeordneter
Muskelzüge (>Abbildung); die Funktionsweise des rechten und des linken Ventrikels
unterscheiden sich aber in mehreren Punkten. Sie fördern (als in Serie
geschaltete Pumpen) zwar praktisch dieselbe Blutmenge pro Zeit
(Herzzeitvolumen), jedoch gegen unterschiedlich hohe Widerstände und
Kapazitäten. Im Lungenkreislauf ("kleiner Kreislauf") befinden sich ca.
0,75 Liter Blut, im systemischen ("großen") Kreislauf mehr als 4 Liter
(Durchschnittswerte bei erwachseren Personen).
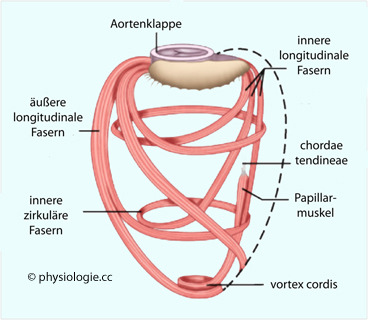
 Abbildung: Schema der Anordnung ventrikulärer Faserzüge
Abbildung: Schema der Anordnung ventrikulärer Faserzüge
Nach einer Vorlage in Benninghoff-Goerttler, Lehrbuch der Anatomie des
Menschen, Band 2: Eingeweide. Urban & Schwarzenberg, München -
Berlin 1964
Superfizielle Faserzüge ziehen von der
Klappenebene zur Herzspitze, bilden hier den vortex cordis und gelangen
von dort zur
Papillarmuskulatur, an der die Verankerung der AV-Klappen (chordae
tendineae) ansetzt. Andere Faserzüge bilden ringförmige (zirkuläre)
Strukturen

Die
Differenz der beiden Kreisläufe in Hinblick auf vor- und nachgelagerte
Blutvolumina, Dehnungsfähigkeiten der Gefäße, arterioläre
Fließwiderstände und hydrostatische Herausforderungen bei Änderungen
der Körperlage bedingen die Druckprofile, die sehr unterschiedlich sind
(auf der Nachlastseite für den rechten
Ventrikel etwa 25/10, für den linken 120/80 mmHg).
Das hat eine
wesentlich höhere Wandstärke des linken Ventrikels (das Septum ist
besonders stark ausgeprägt) zur Folge. Außerdem ist das Bewegungsmuster
unterschiedlich: Die Wand des rechten Ventrikels bewegt sich wie eine
Seite eines Blasbalgs auf das Septum zu, während der linke Ventrikel
zuerst die zirkulären Muskelstränge in apiko-basaler Folge kontrahiert
(Blut wird zur Klappe bewegt) und dann die spiraligen Anteile (was den
Klappenapparat apikalwärts zieht). Der Vorgang erinnert an das
Ausquetschen eines sackförmigen Behälters.
 Die Entspannungszeit
(Dauer: 0,08 Sekunden) läutet die Ventrikeldiastole ein: Beide Klappen sind geschlossen, daher
ist diese Phase isovolumetrisch (wie die - kürzer dauernde -
Anspannungszeit). Im Ventrikel befindet sich das Restvolumen, etwa 50 ml.
Kollagen und andere extrazelluläre Matrixelemente (die von in das
Myokard eingestreuten Fibroblasten gebildet werden) bestimmen das
elastische Entlastungsverhalten des Gewebes.
Die Entspannungszeit
(Dauer: 0,08 Sekunden) läutet die Ventrikeldiastole ein: Beide Klappen sind geschlossen, daher
ist diese Phase isovolumetrisch (wie die - kürzer dauernde -
Anspannungszeit). Im Ventrikel befindet sich das Restvolumen, etwa 50 ml.
Kollagen und andere extrazelluläre Matrixelemente (die von in das
Myokard eingestreuten Fibroblasten gebildet werden) bestimmen das
elastische Entlastungsverhalten des Gewebes.
Sinkt der intraventrikuläre Druck unter den im Vorhof
herrschenden, geht die Mitralklappe auf, und die diastolische Füllung
beginnt - unterstützt durch die Tatsache, dass sich die offene
AV-Klappenebene über einen Teil des im Atrium zwischengespeicherten
Blutes stülpt ("Ventilebenenmechanismus", rasche Füllung des Ventrikels
in der frühen Diastole).
 Die diastolische Füllungszeit
(Dauer abhängig von Herzfrequenz) tritt in drei Phasen auf:
Die diastolische Füllungszeit
(Dauer abhängig von Herzfrequenz) tritt in drei Phasen auf:
 Rasche Füllung („aktive Diastole“, Ventilebenenmechanismus). In dieser Phase liegen die Druck-Volumen-Werte noch leicht über der Ruhedehnungskurve;
Rasche Füllung („aktive Diastole“, Ventilebenenmechanismus). In dieser Phase liegen die Druck-Volumen-Werte noch leicht über der Ruhedehnungskurve;
 langsame Füllung
(manchmal als Diastase bezeichnet - eine Zeitreserve für höhere Schlagfrequenz, die langsame Füllungsphase
wird dabei immer kürzer); und
langsame Füllung
(manchmal als Diastase bezeichnet - eine Zeitreserve für höhere Schlagfrequenz, die langsame Füllungsphase
wird dabei immer kürzer); und
 ein weiterer, durch die Vorhofkontraktion
bedingter spätdiastolischer Füllungsschub (späte Füllungsphase).
ein weiterer, durch die Vorhofkontraktion
bedingter spätdiastolischer Füllungsschub (späte Füllungsphase).
Sinkt
der Druck im Ventrikel unter den im Vorhof, öffnet sich die AV-Klappe,
Blut strömt in den Ventrikel ein. Die P-Welle des EKG fällt zeitlich in
die Füllungsphase
|
Die Dauer sowohl der Systole
als auch der Diastole nimmt mit der Herzfrequenz ab, allerdings in
unterschiedlichem Ausmaß: Bei einer Schlagfrequenz von 60/min kann man
von einer durchschnittlichen Systolendauer von 0,34 s und einer
durchschnittlichen Diastolendauer von 0,66 s ausgehen. Verdreifacht
sich die Frequenz auf 180/min, nimmt die Systolendauer auf 0,2 s ab
(-41%), diejenige der Diastole auf 0,13 s (-80%), also etwa doppelt so
stark.
Eine weitere Steigerung der Herzfrequenz würde mangels ausreichender
Füllungszeit die enddiastolische Füllung des Ventrikels senken; dieser
Umstand limitiert die Steigerung des Herzminutenvolumens bei einer Pulsfrequenz von ~180/min.
Das intraventrikuläre
Volumen steigt vom endsystolischen Wert (ca. 60 ml) zum
enddiastolischen Volumen (ca. 130 ml) an. Das Verhältnis
Schlagvolumen zu enddiastolischem Volumen wird als Auswurffraktion (ejection fraction) bezeichnet.
Das enddiastolische Füllungsvolumen beträgt bei gesunden erwachsenen Personen 130-140 ml
|
 Die Ruhedehnungskurve (passive compliance curve) eines Hohlorgans (hier: Ventrikel - strichliert in der
Die Ruhedehnungskurve (passive compliance curve) eines Hohlorgans (hier: Ventrikel - strichliert in der  Abbildung) gibt den Innendruck bei entspannter Muskelwand als Funktion des Füllungsvolumens an (und damit die diastolische Compliance). Bei geringem Füllungsvolumen sind bindegewebige Begleitstrukturen (Kollagengitter) entspannt und das Organ (der Ventrikel)
gut dehnbar (hohe Compliance, flacher Kurvenverlauf im
Druck-Volumen-Diagramm). Mit steigender Füllung spannen sich diese
Strukturelemente immer mehr an (Straffung der Scherengitter), und es
ist immer mehr Druck erforderlich, um das Organ weiter zu befüllen (sinkende Compliance, steiler Kurvenverlauf im Druck-Volumen-Diagramm).
Abbildung) gibt den Innendruck bei entspannter Muskelwand als Funktion des Füllungsvolumens an (und damit die diastolische Compliance). Bei geringem Füllungsvolumen sind bindegewebige Begleitstrukturen (Kollagengitter) entspannt und das Organ (der Ventrikel)
gut dehnbar (hohe Compliance, flacher Kurvenverlauf im
Druck-Volumen-Diagramm). Mit steigender Füllung spannen sich diese
Strukturelemente immer mehr an (Straffung der Scherengitter), und es
ist immer mehr Druck erforderlich, um das Organ weiter zu befüllen (sinkende Compliance, steiler Kurvenverlauf im Druck-Volumen-Diagramm).

 Abbildung: Herzzyklus im Druck-Volumen-Diagramm: Linker Ventrikel
Abbildung: Herzzyklus im Druck-Volumen-Diagramm: Linker Ventrikel
Nach einer Vorlage bei Mohrman DE / Heller LJ, Cardiovascular Physiology, McGraw Hill 2006
Die Ruhedehnungskurve (strichliert) quantifiziert die Änderung des Innendrucks mit dem Füllungsvolumen (und damit die Compliance) während der Diastole. Von dem Punkt an, wo die Mitralklappe öffnet (blau gezeigt), kann der Druck bei beginnender Füllung
noch ein wenig abnehmen (z.B. von 7 auf 5 mmHg), während sich der
Ventrikel vollständig entspannt (hier nicht dargestellt). Anschließend
nimmt der Druck bis zum Erreichen des enddiastolischen Volumens zu
(z.B. von 5 auf 10 mmHg). Das Volumen nimmt während der Füllungszeit um
den Betrag des Schlagvolumens zu - die Compliance des entspannten
Ventrikels ist hoch.
Der Herzzyklus startet mit dem enddiastolischen Volumen (rechts auf der Ruhedehnungskurve: hier ~10 mmHg bei 130 ml) und läuft in 4 Phasen in Pfeilrichtung ab (Anspannung - Austreibung - Entspannung - Füllung)
Oben: Druck-Volumen-Diagramm für den linken Ventrikel
Unten: Korrespondierende Darstellung der Kraft-Längen-Beziehung einer Herzmuskelfaser
Grüner Punkt: Öffnen der Aortenklappe, roter Punkt: Schließen der Aortenklappe, blauer Punkt: Öffnen der Mitralklappe

Das Druck-Volumen.Diagramm des rechten Ventrikels
erreicht wesentlich niedrigere Spitzenwerte (25-30 mmHg) und hat eine
eher dreieckige Form: Auf eine sehr kurze Anspannungszeit folgt die
(früh beginnende) Austreibungsphase, während der zunächst der Druck
weiter ansteigt (und das Volumen abnimmt), gefolgt von einer
Druckabfallphase (mit weiter andauernder Volumenreduktion). Die Fläche
der umschriebenen Druck-Volumen-Kurve beträgt nur 20-25% derjeniger des
linken Ventrikels, entsprechend dem geringeren Arbeitsaufwand der
Systole des rechten Ventrikels.
Die vom Herzen während eines Herzzyklus aufzubringende Arbeit bzw. der Energieverbrauch entfällt auf drei Anteile:
 Innere Arbeit des sich anspannenden Myokards baut den Druck im Ventrikel (isovolumetrisch) auf und leistet nach außen keine mechanische Arbeit, sondern dissipiert als Wärme (tension heat).
Innere Arbeit des sich anspannenden Myokards baut den Druck im Ventrikel (isovolumetrisch) auf und leistet nach außen keine mechanische Arbeit, sondern dissipiert als Wärme (tension heat).
 Druck-Volumen-Arbeit (external work, stroke work): Die Fläche der Druck-Volumen-Schleife des Ventrikels repräsentiert die zur Förderung des Schlagvolumens erforderliche Arbeit (Druck mal Volumenänderung). Der Anteil der Druck-Volumen-Arbeit (an der Gesamtarbeit) des rechten Ventrikels ist höher als die des linken Ventrikels (der mehr Druck aufbauen muss), weshalb
das rechte Herz bei erhöhter Nachlast (pulmonale Hypertension) eher
insuffizient wird als das linke (bei systemischem Bluthochdruck).
Druck-Volumen-Arbeit (external work, stroke work): Die Fläche der Druck-Volumen-Schleife des Ventrikels repräsentiert die zur Förderung des Schlagvolumens erforderliche Arbeit (Druck mal Volumenänderung). Der Anteil der Druck-Volumen-Arbeit (an der Gesamtarbeit) des rechten Ventrikels ist höher als die des linken Ventrikels (der mehr Druck aufbauen muss), weshalb
das rechte Herz bei erhöhter Nachlast (pulmonale Hypertension) eher
insuffizient wird als das linke (bei systemischem Bluthochdruck).
 Beschleunigungsarbeit: Das Herz investiert kinetische Energie (1/2 mv2) in die Beschleunigung der Blutsäule in Aorta und Pulmonalarterie.
Beschleunigungsarbeit: Das Herz investiert kinetische Energie (1/2 mv2) in die Beschleunigung der Blutsäule in Aorta und Pulmonalarterie.
Die Summe aus Druck-Volumen- und Beschleunigungsarbeit wird als äußere Arbeit bezeichnet
(Pumparbeit). Das Verhältnis des Betrags der äußeren zur insgesamt
aufgebrachten Arbeit (also inklusive innerer Arbeit) ist ein Maß für
die Effizienz der Herzaktion (mechaniscl efficiency).
Ein geringer Arbeitsanteil wird vom nachströmenden Blut am Herzen erbracht, entsprechend der Fläche unter der Ruhedehnungskurve.
Das Produkt aus Schlagvolumen und Druck in der Austreibungsperiode wird als Druck-Volumen-Arbeit bezeichnet und ist proportional zum Energieverbrauch des Herzmuskels
|
Setzt
man nun die Druck- und Volumenwerte miteinander in Beziehung, ergibt
sich ein Diagramm wie in der  Abbildung gezeigt. Dabei ist zu
berücksichtigen, dass Kardiomyozyten unterschiedlichen Belastungen
ausgesetzt sind, je nachdem, welche Position sie im Herzmuskel
einnehmen.
Abbildung gezeigt. Dabei ist zu
berücksichtigen, dass Kardiomyozyten unterschiedlichen Belastungen
ausgesetzt sind, je nachdem, welche Position sie im Herzmuskel
einnehmen.
Laplace-Gesetz: Radius, Druck und Wandspannung
Eine der Gesetzmäßigkeiten in diesem Zusammenhang wird durch die Laplace'sche Beziehung (law of Laplace)
 beschrieben. Diese geht davon aus, dass in jedem Hohlkörper eine definierte Relation besteht zwischen der Wandspannung T (tension, Kraft / Fläche), dem Innendruck p (pressure, Kraft / Fläche) und dem Innenradius r - mit dem Druck und dem Durchmesser des Hohlorgans nimmt die Spannung in der Wand zu. In der einfachsten Form ausgedrückt:
beschrieben. Diese geht davon aus, dass in jedem Hohlkörper eine definierte Relation besteht zwischen der Wandspannung T (tension, Kraft / Fläche), dem Innendruck p (pressure, Kraft / Fläche) und dem Innenradius r - mit dem Druck und dem Durchmesser des Hohlorgans nimmt die Spannung in der Wand zu. In der einfachsten Form ausgedrückt:
Die mechanische Spannung in der Ventrikelwand nimmt proportional zu Innendruck und Innenradius zu.
Mit steigendem Durchmesser eines Hohlorgans wird nicht nur die Wand
dünner (Dehnungseffekt), sondern auch die nach innen gerichtete
Kraftkomponente wird geringer (abnehmende Krümmung der Wand, 
Abbildung).
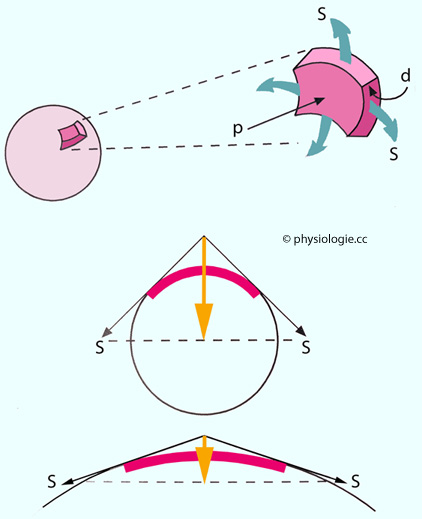

Abbildung: Laplace-Beziehung und Druckwirkung
Nach einer Vorlage in Herring / Paterson, Levick's Introduction to Cardiovascular Physiology, 6th ed. 2018
Das Bild zeigt, wie
sich die Krümmung auf die Beziehung zwischen mechanischer Spannung in
der Ventrikelwand (S - Kraft pro Wandfläche) und Innendruck (p)
auswirkt.
Die
Wandspannung entspricht diastolisch der Vorlast (passive Dehnung,
ruhendes Myokard), systolisch der Nachlast, gegen welche die
Herzmuskelzellen anarbeiten müssen (aktives Myokard).
Oben: Die Hohlkugel links dient
als Modell für ein Hohlorgan (Ventrikel). Der Ausschnitt rechts deutet
zwei senkrecht zueinander angeordnete Spannungskomponenten (grüne
Pfeile) an. Die Spannung S ist Kraft pro Fläche eines Myokardelements
der Dicke d.
Mitte: Der Querschnitt zeigt,
wie die Wandspannung (S, tangentiale Pfeile) eine nach innen gerichtete
(dem Druck entgegengesetzte) Komponente erzeugen (gelber Pfeil). Die
Länge der Pfeile ist proportional der jeweiligen Kraftkomponente.
Unten: Erhöhung des
Krümmungsradius (stärkere Füllung des Ventrikels) resultiert in
schwächerer Krümmung, reduzierter Kraftkomponente nach innen und
geringerer Druckwirkung (Laplace-Gesetz). Bei unendlich großem Radius würde die - nunmehr gerade verlaufende -
Muskelschicht nur mehr in dieser Ebene Kraft entwickeln, die Druckentfaltung (senkrecht dazu) wäre Null.
Diese Beziehung dient u.a. als Modellvorstellung für die negative Auswirkung einer Überdehnung des Herzens (Insuffizienz)

Angewendet auf
die Kreislaufphysiologie, wird das Herz als Hohlkugel (ein Blutgefäß als Hohlzylinder,  s. dort) betrachtet. Berücksichtigt man weiters die Wanddicke d
(Ventrikel, Gefäß etc - hier befindet sich außer Bindegewebe auch
Muskulatur, welche die Wandspannung aktiv verändern kann), berechnet
sich die zur Aufrechterhaltung eines bestimmten transmuralen Drucks p notwendige Wandspannung als
s. dort) betrachtet. Berücksichtigt man weiters die Wanddicke d
(Ventrikel, Gefäß etc - hier befindet sich außer Bindegewebe auch
Muskulatur, welche die Wandspannung aktiv verändern kann), berechnet
sich die zur Aufrechterhaltung eines bestimmten transmuralen Drucks p notwendige Wandspannung als
Bei einer Luftblase in Flüssigkeit wird die Komponente Wanddicke vernachlässigt und die Laplace-Beziehung auf folgende Formel gebracht:
Auf diese Weise wird der Effekt von Wandspannung und Radius auf den Innendruck (z.B. in einem Alveolarbläschen) dargestellt ( vgl. dort).
vgl. dort).
 Die Wandspannung T (tension) ist eine Kraft: Man kann sie formulieren als das Produkt aus S.d (S, stress = Kraft pro Fläche, d.h. pro Querschnittsfläche der Gefäß- bzw. Ventrikelwand; d, diameter = Wanddurchmesser). Der transmurale Druck (trans murum: über die Wand wirkend) ist der Druck im Hohlkörper minus dem Druck außerhalb, d.h. im Falle des Herzens intraventrikulärer Blutdruck minus intrathorakaler Druck.
Die Wandspannung T (tension) ist eine Kraft: Man kann sie formulieren als das Produkt aus S.d (S, stress = Kraft pro Fläche, d.h. pro Querschnittsfläche der Gefäß- bzw. Ventrikelwand; d, diameter = Wanddurchmesser). Der transmurale Druck (trans murum: über die Wand wirkend) ist der Druck im Hohlkörper minus dem Druck außerhalb, d.h. im Falle des Herzens intraventrikulärer Blutdruck minus intrathorakaler Druck.
Dieser Formalismus gilt sinngemäß für alle Hohlorgane, insbesondere Blutgefäße, die Blase, den Uterus, oder Alveolen in der Lunge. Ihre Kernaussage lautet:
 Um einen bestimmten Druck zu halten, muss die Muskulatur in der Wand eines solchen Organs umso mehr Kraft
entfalten, je größer der
Durchmesser ist (Druck = Kraft pro Fläche). Und: Die nötige
Kraft wird umso leichter bereitgestellt, je größer der muskuläre
Querschnitt, d.h. je dicker die "aktive" Wand ist.
Um einen bestimmten Druck zu halten, muss die Muskulatur in der Wand eines solchen Organs umso mehr Kraft
entfalten, je größer der
Durchmesser ist (Druck = Kraft pro Fläche). Und: Die nötige
Kraft wird umso leichter bereitgestellt, je größer der muskuläre
Querschnitt, d.h. je dicker die "aktive" Wand ist.
Die Wandspannung nimmt proportional zum Innendruck und zum Radius (des Ventrikels) zu
Steigt der Druck in der a. pulmonalis, nimmt die Wandspannung im rechten Ventrikel zu
|
 Der resultierende Druck ist umso leichter zu erzielen, je dicker die
Wand und je kleiner der Radius ist. Das
kommt in der
Umformung der Gleichung deutlich zum Ausdruck: Der generierte
(intraventrikuläre) Druck (p) nimmt proportional mit der mechanischen
Spannung (K) und der Stärke (d) der Ventrikelwand zu; umgekehrte
Proportionalität besteht mit dem Radius (r), bzw. der ventrikulären
Füllung.
Der resultierende Druck ist umso leichter zu erzielen, je dicker die
Wand und je kleiner der Radius ist. Das
kommt in der
Umformung der Gleichung deutlich zum Ausdruck: Der generierte
(intraventrikuläre) Druck (p) nimmt proportional mit der mechanischen
Spannung (K) und der Stärke (d) der Ventrikelwand zu; umgekehrte
Proportionalität besteht mit dem Radius (r), bzw. der ventrikulären
Füllung.
Der
Radius bestimmt also, wie effektiv eine bestimmte Wandspannung
(Muskelkontraktion) den Innendruck steigen lässt. Beispielsweise tut
sich der linke Ventrikel in der Austreibungszeit leichter, wenn er (bei
gegebenem Aortendruck) einen geringen Innenradius aufweist (
Abbildung oben
).
 Eine
der Aussagen der Laplace-Beziehung ist, dass sich das Ventrikelmyokard
endsystolisch (wenn das Schlagvolumen ausgeworfen und nur das
Restvolumen verblieben ist) mit der Aufrechterhaltung eines bestimmten
Innendrucks leichter tut als bei Systolenbeginn (enddiastolisches Volumen) - weil der Innendurchmesser kleiner ist als zu Beginn der Systole.
Eine
der Aussagen der Laplace-Beziehung ist, dass sich das Ventrikelmyokard
endsystolisch (wenn das Schlagvolumen ausgeworfen und nur das
Restvolumen verblieben ist) mit der Aufrechterhaltung eines bestimmten
Innendrucks leichter tut als bei Systolenbeginn (enddiastolisches Volumen) - weil der Innendurchmesser kleiner ist als zu Beginn der Systole.
 Mit zunehmender Austreibung nimmt die Nachlast des Ventrikels ab. Das hilft dem Ventrikel beim Erreichen des systolischen Spitzendrucks. Der Laplace-Effekt erleichtert die späte Austreibung.
Mit zunehmender Austreibung nimmt die Nachlast des Ventrikels ab. Das hilft dem Ventrikel beim Erreichen des systolischen Spitzendrucks. Der Laplace-Effekt erleichtert die späte Austreibung.
Das bedeutet auch, dass (ceteris paribus) der systolische Sauerstoffverbrauch des Herzmuskels mit der Vorlast (preload, enddisatolische Füllung) zunimmt. Die
Nachlast (afterload) hängt nicht nur vom
arteriellen Druck (dem klinisch gebräuchlichen Kriterium für die
Nachlast) ab, sondern auch von der Geometrie: Steigt der Radius des Ventrikels, nimmt auch die Nachlast zu, weil es dem Myokard schwerer fällt, Druck aufzubauen.
 Die Nachlast hängt sowohl vom arteriellen Druck als auch vom Ventrikeldurchmesser ab.
Insoferne unterstützt eine Senkung der diastolischen Füllung (z.B.
durch Diurese - Reduktion des Blutvolumens, Hochlagerung - Umverteilung
von Blut aus dem Thorakalraum) die Austreibungsfunktion des Ventrikels.
Die Nachlast hängt sowohl vom arteriellen Druck als auch vom Ventrikeldurchmesser ab.
Insoferne unterstützt eine Senkung der diastolischen Füllung (z.B.
durch Diurese - Reduktion des Blutvolumens, Hochlagerung - Umverteilung
von Blut aus dem Thorakalraum) die Austreibungsfunktion des Ventrikels.
Jede Weitung des Ventrikels hat also zwei gegenläufige Effekte:
Einerseits nimmt mit der Wanddehnung die Schlagkraft nach
Frank-Starling zu; andererseits wird es damit schwerer, Druck zu generieren (Laplace-Gesetz). In einem gesunden Herz überwiegt der
Frank-Starling-Effekt, aber:
Ist der Ventrikel zu stark
geweitet (ventrikuläre Dilatation), überwiegt der Effekt der
Laplace-Beziehung, und er wird insuffizient. In einem solchen Fall ist
es das Ziel der Behandlung, die Distension der Ventrikelwand durch
herzschonende Maßnahmen (insbesondere Reduktion des Blutvolumens durch
Diuretika) zu reduzieren.
Steigt die Nachlast, nimmt auch die Wandspannung im Ventrikel zu
So führt Druckerhöhung in der Pulmonalarterie zu stärkerer Belastung und evt. Hypertrophie des rechten Ventrikels
|

 Abbildung: Nomales und hypertrophes Myokard
Nach Gjesdal O, Bluemke DA, Lima JA: Cardiac remodeling at the population level - risk factors, screening, and outcomes. Nat Rev Cardiol 2011; 8: 673-85
Abbildung: Nomales und hypertrophes Myokard
Nach Gjesdal O, Bluemke DA, Lima JA: Cardiac remodeling at the population level - risk factors, screening, and outcomes. Nat Rev Cardiol 2011; 8: 673-85
Die Orientierung zusätzlicher Sarkomere macht den Typus der Hypertrophie aus:
Bei konzentrischer Hypertrophie (physiologische Anpassung an
Mehrbelastung) wächst die Breite der Muskelfasern, zusätzliche
Sarkomere werden lateral angelagert, die Leistungsfähigkeit des Muskels
gesteigert.
Überdehnung des Herzmuskels bei dehnungsbedingter Überlastung führt zu
exzentrischer Hypertrophie, zusätzliche Sarkomere lagern sich in der
Längsachse an
 Reaktive Hypertrophie: Die
myokardiale Wandspannung nimmt ab, wenn das Kammermyokard
hypertrophiert (konzentrisches Wachstum
der Sarkomeren: Diese vergrößern ihren Durchmesser bei gleichbleibender
Länge) und die Wanddicke (d) dadurch erhöht ist, die Schlagkraft steigt
(
Reaktive Hypertrophie: Die
myokardiale Wandspannung nimmt ab, wenn das Kammermyokard
hypertrophiert (konzentrisches Wachstum
der Sarkomeren: Diese vergrößern ihren Durchmesser bei gleichbleibender
Länge) und die Wanddicke (d) dadurch erhöht ist, die Schlagkraft steigt
(
Abbildung
).
Bei einer unphysiologischen exzentrischen Hypertrophe - bei Überdehnung der Herzwand - nimmt die Länge der Sarkomeren zu, nicht aber die Schlagkraft. So nimmt z.B. die
Muskelmasse bei chronisch erhöhter Nachlast (gesteigertes afterload bei Bluthochdruck oder Aortenklappenstenose) zu - oder auch wenn ständig erhöhte Vorlast den Ventrikel chronisch dehnt.
Subendokardiale vs. subperikardiale Myokardschichten: Das Laplace-Gesetz erklärt auch, warum - ceteris paribus - innen
liegende (subendokardiale) Muskelfasern weniger belastet sind als außen
liegende (subepikardiale), die einer stärkeren Streckung unterliegen als erstere. Andererseits ist die systolische
Durchblutung subendokardialer Fasern des linken Ventrikels besonders
gering, da die Koronargefäße in tiefliegenden Regionen durch die
Kontraktion umliegenden Muskelgewebes weitgehend "abgewürgt" werden und
die Perfusion verhindert wird.
Die myokardiale Perfusion profitiert von niedrigen Pulsfrequenzen, bei denen die Diastole - in der die Koronargefäße offen sind - einen hohen Zeitanteil des Schlagzyklus beansprucht.
Die folgende  Abbildung zeigt, dass der intraventrikuläre Druck während
der Austreibungszeit zunächst weiter ansteigt, nicht aber die Kraft der
kontrahierenden Muskelfasern - diese verkürzen sich, bis sie ihre
endsystolische Länge erreicht haben.
Abbildung zeigt, dass der intraventrikuläre Druck während
der Austreibungszeit zunächst weiter ansteigt, nicht aber die Kraft der
kontrahierenden Muskelfasern - diese verkürzen sich, bis sie ihre
endsystolische Länge erreicht haben.


Abbildung: Effekt gesteigerten Afterloads
Modifiziert nach einer Vorlage bei Mohrman DE / Heller LJ, Cardiovascular Physiology, McGraw Hill 2006
Wirkung
erhöhter Nachlast auf Muskelfasern (oben) und Herzkammer (unten).
Isometrische Maxima-Kurve für die Muskelfaser (oben), U-Maxima für den
Ventrikel (unten). Auf diesen Kurven kommen die jeweiligen Endpunkte zu
liegen.
Erhöhte Nachlast bedingt geringere Kontraktion bzw.
Volumenleistung
 Diese Art der Darstellung erleichtert das Verständnis für
Veränderungen, die sich aus Variationen der Vordehung von Muskelfasern
bzw. Herzräumen ergeben:
Diese Art der Darstellung erleichtert das Verständnis für
Veränderungen, die sich aus Variationen der Vordehung von Muskelfasern
bzw. Herzräumen ergeben:
Treffen die Muskelfasern auf erhöhte Vorbelastung (Gegenkraft bzw.
Gegendruck, also arterieller Blutdruck), dann müssen sie mehr in die
Kraftentfaltung bzw. den Druckanstieg investieren, und es bleibt
weniger Zeit für die Verkürzung bzw. Volumenförderung übrig. Ergebnis
ist eine geringere Ausbeute an Kontraktion bzw. Schlagvolumen.
Diese
Art der Belastung erfordert relativ viel Energie. Soll das Myokard
einer herzinsuffizienten Person geschont werden, ist es daher besonders
effizient, den arteriellen Blutdruck und damit das linksventrikuläre Afterload zu senken (Blutdrucksenker).
Andererseits bewirkt verstärkte enddiastolische Füllung des
Ventrikels eine erhöhte Ausbeute während der Systole. Diese Erhöhung
des Preload führt postwendend
zu einer Vergrößerung des Schlagvolumens (Frank-Starling- Mechanismus).
Auf diese Weise funktioniert das Herz als "angebotsorientierte" Pumpe:
Je stärker seine Befüllung, desto ergiebiger die Volumenförderung
während der Austreibungszeit.

 Abbildung: Effekt gesteigerten Preloads
Modifiziert nach einer Vorlage bei Mohrman DE / Heller LJ, Cardiovascular Physiology, McGraw Hill 2006
Abbildung: Effekt gesteigerten Preloads
Modifiziert nach einer Vorlage bei Mohrman DE / Heller LJ, Cardiovascular Physiology, McGraw Hill 2006
Wirkung erhöhter Vorlast auf Muskelfasern (oben) und Herzkammer
(unten).
Isometrische Maxima-Kurve für die Muskelfaser (oben), U-Maxima
für den Ventrikel (unten). Auf diesen Kurven kommen die jeweiligen
Endpunkte zu liegen.
Erhöhte Vorlast bedingt verstärkte Kontraktion
bzw. Volumenleistung
 Unterstützungszuckung: Die Kontraktion, die der Herzmuskel beschreibt, ist während der Anspannungszeit isovolumetrisch (Volumen bleibt gleich, nur der Druck steigt an), dann gemischt ("auxoton",
das Volumen nimmt ab, der Druck bleibt hoch, ändert seinen Betrag
allerdings, ist also nicht rein "isotonisch"). Eine solche Muskelaktion
wird als Unterstützungszuckung bezeichnet.
Unterstützungszuckung: Die Kontraktion, die der Herzmuskel beschreibt, ist während der Anspannungszeit isovolumetrisch (Volumen bleibt gleich, nur der Druck steigt an), dann gemischt ("auxoton",
das Volumen nimmt ab, der Druck bleibt hoch, ändert seinen Betrag
allerdings, ist also nicht rein "isotonisch"). Eine solche Muskelaktion
wird als Unterstützungszuckung bezeichnet.
In der Austreibungszeit ändern sich sowohl Druck als auch Volumen. Diese Kontraktionsform nennt man auxoton
|
Da sich an jedem Herzschlag alle Herzmuskelzellen beteiligen, handelt es sich beim Endzustand der Kontraktion definitionsgemäß um ein "Maximum" - beim Endpunkt der Austreibungszeit, an dem die Aortenklappe wieder schließt, ist daher ein "Unterstützungsmaximum" (U-Maximum) erreicht.
Veränderung von Vorlast und Nachlast, Kontraktilität
Veränderung der Nachlast:
Ausgehend von einem bestimmten enddiastolischen Füllungszustand, kann
der systolische Endpunkt an verschiedenen Stellen erreicht werden - je
nachdem, bei welchem Aortendruck die Aortenklappe öffnet. Ist dieser
Druck (also die Nachlast: afterload)
gering, beginnt die auxotone Auswurfphase früher, und es bleibt mehr
Zeit für die Austreibung; es wird ein Endpunkt (ein U-Maximum)
erreicht, das einem niedrigeren enddiastolischen Volumen bei einem
geringeren Druck entspricht - die Förderleistung des Ventrikels war
besonders gut.
Auswurfphase früher, und es bleibt mehr
Zeit für die Austreibung; es wird ein Endpunkt (ein U-Maximum)
erreicht, das einem niedrigeren enddiastolischen Volumen bei einem
geringeren Druck entspricht - die Förderleistung des Ventrikels war
besonders gut.
Umgekehrt kann der Aortendruck (die Nachlast) steigen,
die Klappe geht erst bei einem höheren Druck auf (längere
Anspannungszeit) und die Austreibungsphase wird kürzer, das geförderte
Volumen geringer - das U-Maximum liegt bei einem höheren Druck, das
geförderte Schlagvolumen ist aber gering.
Steigt die Nachlast, verringert sich vorübergehend das Schlagvolumen
|
 Abbildung: Veränderte Vor- oder Nachlast, Kontraktilität
Abbildung: Veränderte Vor- oder Nachlast, Kontraktilität
Modifiziert nach einer Vorlage bei Mohrman DE / Heller LJ, Cardiovascular Physiology, McGraw Hill 2006
Steigt
die Füllung der Herzkammer am Ende der Diastole, nimmt die Vorlast zu
(Pfeil nach rechts). Die Folge kann ein erhöhtes Schlagvolumen sein
(B→D statt statt A→D).
Bei Anstieg des Aortendrucks steigt die Nachlast (Pfeil nach oben:
Punkt C statt A), es muss ein höherer Druck überwunden werden, dies
erfolgt auf Kosten des Schlagvolumens (rosa Fläche).
Erhöht sich die Kontraktilität (positive Inotropie: z.B. durch
Sympathikuseinfluss), erreicht der endsystolische Zustand Werte auf
einer nach links-oben verschobenen U-Kurve (Punkte G und F statt E und
D), es werden höhere Schlagvolumina (geringere Restvolumina) erzielt
 Die Endpunkte aller diesen möglichen maximalen Unterstützungszuckungen liegen auf einer Kurve, die als U-Kurve
bezeichnet wird und im Wesentlichen als Gerade gelten kann
(
Die Endpunkte aller diesen möglichen maximalen Unterstützungszuckungen liegen auf einer Kurve, die als U-Kurve
bezeichnet wird und im Wesentlichen als Gerade gelten kann
( Abbildung).
Abbildung).
 Jedem Punkt auf der Ruhedehnungskurve ist eine U-Kurve zuzuordnen,
welche alle möglichen Maxima verbindet - vom entsprechenden isobaren Maximum (gleichbleibender
Druck während der Systole, nur Volumenverringerung) bis zum entsprechenden isovolumetrischen Maximum (konstantes systolisches
Volumen, nur Druckanstieg). Diese "Kurve" ist in der Regel eine Gerade und wird meist auch als solche dargestellt. Ihre Steilheit (die endsystolische Elastanz) ist ein Kontraktilitätsindex. Beispielsweise steigert Adrenalin die endsystolische Elastanz.
Jedem Punkt auf der Ruhedehnungskurve ist eine U-Kurve zuzuordnen,
welche alle möglichen Maxima verbindet - vom entsprechenden isobaren Maximum (gleichbleibender
Druck während der Systole, nur Volumenverringerung) bis zum entsprechenden isovolumetrischen Maximum (konstantes systolisches
Volumen, nur Druckanstieg). Diese "Kurve" ist in der Regel eine Gerade und wird meist auch als solche dargestellt. Ihre Steilheit (die endsystolische Elastanz) ist ein Kontraktilitätsindex. Beispielsweise steigert Adrenalin die endsystolische Elastanz.
 Kontraktilität ist die Fähigkeit der Kardiomyozyten, bei gegebener Vor- und Nachlast Kraft zu entwickeln. Sie ist ein Ausdruck für die intrinsische kontraktile Energie des Herzmuskels und kann durch neurohumorale Einflüsse verändert werden (Katecholamine, Angiotensin II, inotrop wirksame Pharmaka). Die Kontraktilität wird indirekt abgeschätzt über die Steilheit des systolischen Druckanstiegs (dp/dtmax - mittels Herzkatheter) oder über die systolische Blutströmungsgeschwindigkeit (mittels Ultraschall-Doppler). Die auf die Kontraktilität bezogene Herzqualität ist die Inotropie. Faktoren, welche die Kontraktilität abschwächen, wirken negativ inotrop (im Sinne einer Rechts-unten-Verschiebung der U-Kurve); solche, die sie verstärken, positiv inotrop (im Sinne einer Links-oben-Verschiebung der U-Kurve). Positiv inotrope Substanzen wirken durch Steigerung der sarkoplasmatischen Calciumkonzentration ([Ca++]i).
Kontraktilität ist die Fähigkeit der Kardiomyozyten, bei gegebener Vor- und Nachlast Kraft zu entwickeln. Sie ist ein Ausdruck für die intrinsische kontraktile Energie des Herzmuskels und kann durch neurohumorale Einflüsse verändert werden (Katecholamine, Angiotensin II, inotrop wirksame Pharmaka). Die Kontraktilität wird indirekt abgeschätzt über die Steilheit des systolischen Druckanstiegs (dp/dtmax - mittels Herzkatheter) oder über die systolische Blutströmungsgeschwindigkeit (mittels Ultraschall-Doppler). Die auf die Kontraktilität bezogene Herzqualität ist die Inotropie. Faktoren, welche die Kontraktilität abschwächen, wirken negativ inotrop (im Sinne einer Rechts-unten-Verschiebung der U-Kurve); solche, die sie verstärken, positiv inotrop (im Sinne einer Links-oben-Verschiebung der U-Kurve). Positiv inotrope Substanzen wirken durch Steigerung der sarkoplasmatischen Calciumkonzentration ([Ca++]i).
 Positiv inotrope Substanzen / Effekte erhöhen den Sauerstoffbedarf des Herzens. Bei eingeschränkter Durchblutungsmöglichkeit (koronare Herzkrankheit) kann dadurch ein Punkt erreicht werden, wo das O2-Angebot unzureichend wird und die positiv
inotrope Substanz / der positiv inotrope Effekt zu myokardialer
Ischämie führt. Dadurch nimmt das Schlagvolumen wieder ab.
Positiv inotrope Substanzen / Effekte erhöhen den Sauerstoffbedarf des Herzens. Bei eingeschränkter Durchblutungsmöglichkeit (koronare Herzkrankheit) kann dadurch ein Punkt erreicht werden, wo das O2-Angebot unzureichend wird und die positiv
inotrope Substanz / der positiv inotrope Effekt zu myokardialer
Ischämie führt. Dadurch nimmt das Schlagvolumen wieder ab.
Die myokardiale Kontraktilität wird durch folgende Faktoren beeinflusst:
 Katecholamine. Sie erhöhen die Kontraktilität via ß1-Rezeptor
Katecholamine. Sie erhöhen die Kontraktilität via ß1-Rezeptor
 Tachykardie. Durch das "Treppenphänomen" (Frequenzinotropie, Bowditch-Effekt) steigt die Kontraktilität
Tachykardie. Durch das "Treppenphänomen" (Frequenzinotropie, Bowditch-Effekt) steigt die Kontraktilität
 Medikamente (können positiv oder negativ inotrop wirken)
Medikamente (können positiv oder negativ inotrop wirken)
 Sauerstoffmangel (z.B. ischämische Herzerkrankung) senkt die Kontraktilität
Sauerstoffmangel (z.B. ischämische Herzerkrankung) senkt die Kontraktilität
 Pathologische Veränderungen (Entzündungen,
Azidosen / Alkalosen, Elektrolytstoffwechselstörungen u.a.) wirken sich
ebenfalls negativ auf die Kontraktilität aus.
Pathologische Veränderungen (Entzündungen,
Azidosen / Alkalosen, Elektrolytstoffwechselstörungen u.a.) wirken sich
ebenfalls negativ auf die Kontraktilität aus.
Ein experimenteller Kontraktilitätsindex (isoliertes Herz) ist die Distanz des endsystolischen Punktes (D, E, F, G in der  Abbildung) vom dazugehörigen Ausgangspunkt auf der Ruhedehnungskurve: Sinkt die Kontraktionskraft des Ventrikels, rückt die U-Kurve näher an
den Ausgangspunkt auf der Ruhedehnungskurve; steigt die
Kontraktionskraft, rückt sie weiter davon weg (d.h. im Diagramm nach
links oben).
Abbildung) vom dazugehörigen Ausgangspunkt auf der Ruhedehnungskurve: Sinkt die Kontraktionskraft des Ventrikels, rückt die U-Kurve näher an
den Ausgangspunkt auf der Ruhedehnungskurve; steigt die
Kontraktionskraft, rückt sie weiter davon weg (d.h. im Diagramm nach
links oben).
Die
Kontraktilität ist in Relation zu einer definierten Faserlänge (einem
gegebenen Ausgangspunkt auf der Ruhedehnungskurve) zu sehen. Eine
Erhöhung der Schlagkraft im Sinne des Frank-Starling-Mechanismus - der
aus einer Veränderung der Vordehnung resultiert - wird daher nicht als Kontraktilitätssteigerung gewertet.
Auch ein verringertes Schlagintervall (Treppenphänomen) steigert die Kontraktilität (auch hier handelt sich um einen Ca++-Effekt).
Die Kontraktionskraft kann gesteigert werden
(1) durch Erhöhung der Kontraktilität (positiv inotrop: z.B. Sympathikuswirkung) und/oder
(2) durch vermehrte Vordehnung (Frank-Starling-Mechanismus).
|
Wie sich Veränderungen der Belastung (preload, afterload)
einerseits, der Schlagkraft des Herzens andererseits auf die
Transportfunktion des Ventrikels auswirken, ist aus der  Abbildung
ersichtlich:
Abbildung
ersichtlich:
 Bei einer Referenzkontraktion öffnet die Aortenklappe bei Punkt A, und der Zustand des Herzens gelangt auf einen Punkt D auf der "normalen" U-Kurve
Bei einer Referenzkontraktion öffnet die Aortenklappe bei Punkt A, und der Zustand des Herzens gelangt auf einen Punkt D auf der "normalen" U-Kurve
 Nimmt die Nachlast zu (z.B. arterielle Hypertonie), muss der Ventrikel bis zu Punkt C Druck aufbauen; er erreicht dann nur mehr einen Punkt E auf der U-Kurve, der durch höheres (enddiastolisches) Volumen bei höherem Druck gekennzeichnet ist
Nimmt die Nachlast zu (z.B. arterielle Hypertonie), muss der Ventrikel bis zu Punkt C Druck aufbauen; er erreicht dann nur mehr einen Punkt E auf der U-Kurve, der durch höheres (enddiastolisches) Volumen bei höherem Druck gekennzeichnet ist
 Nimmt die Vorlast zu, füllt sich der Ventrikel stärker und erreicht
einen nach rechts verlagerten Punkt auf der Ruhedehnungskurve. Von hier
erreicht er - bei "normalem" Blutdruck - den Punkt B, und kann aufgrund des Starling-Mechanismus ein größeres Schlagvolumen fördern - auch diese Kontraktion endet bei Punkt D
Nimmt die Vorlast zu, füllt sich der Ventrikel stärker und erreicht
einen nach rechts verlagerten Punkt auf der Ruhedehnungskurve. Von hier
erreicht er - bei "normalem" Blutdruck - den Punkt B, und kann aufgrund des Starling-Mechanismus ein größeres Schlagvolumen fördern - auch diese Kontraktion endet bei Punkt D
 Steigt die Kontraktilität des Ventrikels (positiv inotroper
Effekt), dann entfernt sich die U-Kurve weiter vom Ausgangspunkt auf
der Ruhedehnungskurve (sie gleitet nach links oben). Dann werden -
ausgehend von A oder C - die Punkte F oder G erreicht: das Schlagvolumen ist größer als im Normalfall.
Steigt die Kontraktilität des Ventrikels (positiv inotroper
Effekt), dann entfernt sich die U-Kurve weiter vom Ausgangspunkt auf
der Ruhedehnungskurve (sie gleitet nach links oben). Dann werden -
ausgehend von A oder C - die Punkte F oder G erreicht: das Schlagvolumen ist größer als im Normalfall.
 Die Kontraktionskraft hängt
einerseits von der Kontraktilität, andererseits von der Vordehung der
Muskelzellen ab. Sie kann infolge erhöhter Kontraktilität und / oder
verstärkter Vordehnung (Frank-Starling) zunehmen.
Die Kontraktionskraft hängt
einerseits von der Kontraktilität, andererseits von der Vordehung der
Muskelzellen ab. Sie kann infolge erhöhter Kontraktilität und / oder
verstärkter Vordehnung (Frank-Starling) zunehmen.
Wirkung des Sympathikus
Unter Sympathikuseinfluss wird die Kurve isometrischer bzw. U-Maxima infolge der über ß1-Rezeptoren vermittelten Effekte auf Kardiomyozyten nach oben bzw. links verlagert (oberes
Diagramm), und die entsprechende U-Kurve wandert ebenfalls nach links
oben (unteres Diagramm). Der erreichte Endpunkt der
Ventrikelkontraktion liegt mit Noradrenalinwirkung weiter links, d.h.
es wird ein höheres Schlagvolumen gefördert als ohne sympathische
Anregung (positive Inotropie).
Werden also ß1-Rezeptoren angeregt, rücken z.B. die
iso(volu)metrischen Maxima bzw. deren Kurve im Druck-Volumen- Diagramm
nach oben (rote Kurve in der  Abbildung):
Abbildung):






 Kontraktilität, Herztöne, Venenpuls
Kontraktilität, Herztöne, Venenpuls
 auxoton: αὔξησις = Wachstum, τόνος = Anspannung
auxoton: αὔξησις = Wachstum, τόνος = Anspannung Laplace'sches Gesetz
Laplace'sches Gesetz  Veränderung von Vorlast und Nachlast, Kontraktilität
Veränderung von Vorlast und Nachlast, Kontraktilität  Wirkung des Sympathikus
Wirkung des Sympathikus  Herztöne
Herztöne  Venenpuls
Venenpuls

 Kontraktilität, Inotropie, Kontraktionskraft
Kontraktilität, Inotropie, Kontraktionskraft

 Abbildung: Dynamik eines Herzzyklus (linkes Herz)
Abbildung: Dynamik eines Herzzyklus (linkes Herz)
 Die Ventrikelsystole tritt als Folge der Erregungsausbreitung über das
Kammermyokard (im EKG erzeugt das den QRS-Komplex) auf. Vorher schlägt
bereits der Vorhof, dessen Erregung sich als P-Welle im EKG abbildet.
Die Vorhofsystole unterstützt die Füllung der Kammer (späte Diastole).
Die Ventrikelsystole tritt als Folge der Erregungsausbreitung über das
Kammermyokard (im EKG erzeugt das den QRS-Komplex) auf. Vorher schlägt
bereits der Vorhof, dessen Erregung sich als P-Welle im EKG abbildet.
Die Vorhofsystole unterstützt die Füllung der Kammer (späte Diastole). Der steigende Druck im Ventrikel schließt die Atrioventrikularklappen
(linkes Herz: Mitralklappe
Der steigende Druck im Ventrikel schließt die Atrioventrikularklappen
(linkes Herz: Mitralklappe  ), und die Ventrikelwand spannt sich an, bis
der Druck denjenigen in der Aorta erreicht und überwindet, und Blut in
die Aortenwurzel zu strömen beginnt.
), und die Ventrikelwand spannt sich an, bis
der Druck denjenigen in der Aorta erreicht und überwindet, und Blut in
die Aortenwurzel zu strömen beginnt.  Die Zeit zwischen Mitralklappenschluss und
Aortenklappenöffnung heisst Anspannungszeit (frühe Ventrikelsystole, isovolumetrische Kontraktion; Dauer 0,05 Sekunden).
Die Zeit zwischen Mitralklappenschluss und
Aortenklappenöffnung heisst Anspannungszeit (frühe Ventrikelsystole, isovolumetrische Kontraktion; Dauer 0,05 Sekunden).  Abbildung)
ist ein wichtiger Index seiner Kontraktilit (Messung mittels
Herzkatheter). Auch der Frank-Starling-Mechanismus wirkt sich auf die
maximale Steilheit des systolischen Druckanstiegs aus.
Abbildung)
ist ein wichtiger Index seiner Kontraktilit (Messung mittels
Herzkatheter). Auch der Frank-Starling-Mechanismus wirkt sich auf die
maximale Steilheit des systolischen Druckanstiegs aus.
 Abbildung: dp/dtmax
Abbildung: dp/dtmax In der Austreibungszeit kontrahieren die Myokardzellen weiter, nunmehr können sie sich gut
verkürzen, da das Volumen im Ventrikel abnehmen kann (Ausstrom in die
Aorta). Etwa 75% des Schlagvolumens werden in der ersten Hälfte (~0,15 Sekunden) der Austreibungszeit in die Schlagader deponiert; während dieser rapid ejection phase
nimmt die Strömung in Aorta / Pulmonalarterie bis zum Erreichen eines
Maximalwertes zu. Während des anschließenden Rests der Austreibungszeit
nimmt die Strömung in die Aorta / Pulmonalarterie wieder ab (decreased ejection), bis sie für einen Augenblick negativ (ventrikelwärts gerichtet) wird, was die Klappe sofort schließt (Ender der Systole).
In der Austreibungszeit kontrahieren die Myokardzellen weiter, nunmehr können sie sich gut
verkürzen, da das Volumen im Ventrikel abnehmen kann (Ausstrom in die
Aorta). Etwa 75% des Schlagvolumens werden in der ersten Hälfte (~0,15 Sekunden) der Austreibungszeit in die Schlagader deponiert; während dieser rapid ejection phase
nimmt die Strömung in Aorta / Pulmonalarterie bis zum Erreichen eines
Maximalwertes zu. Während des anschließenden Rests der Austreibungszeit
nimmt die Strömung in die Aorta / Pulmonalarterie wieder ab (decreased ejection), bis sie für einen Augenblick negativ (ventrikelwärts gerichtet) wird, was die Klappe sofort schließt (Ender der Systole). Typische Druckwerte (mmHg, erwachsene Person, körperliche Ruhe, Rückenlage):
Typische Druckwerte (mmHg, erwachsene Person, körperliche Ruhe, Rückenlage):  komprimiert - stark herabgesetzt).
komprimiert - stark herabgesetzt). Abbildung oben). Dann
nimmt sie fast linear ab, um (nach einer kurzen Strömungsumkehr, welche
die Aortenklappe zudrückt) auf Null zu gehen (bis zur nächsten
Austreibungszeit).
Abbildung oben). Dann
nimmt sie fast linear ab, um (nach einer kurzen Strömungsumkehr, welche
die Aortenklappe zudrückt) auf Null zu gehen (bis zur nächsten
Austreibungszeit).
 Abbildung: Anordnung und Funktion der Herzklappen
Abbildung: Anordnung und Funktion der Herzklappen
 Abbildung)
stellt nicht nur sicher, dass Blut (so gut wie) nur in einer Richtung
passiert und dadurch die Strömung im Sinne der Kreislauffunktion
stattfindet, es schont dadurch auch das Myokard. Klappenfehler
beanspruchen den Herzmuskel stärker als normal, es kommt zu reaktiver
Hypertrophie (kompensiertes Stadium), möglicherweise auch zu einer
Überforderung des Herzens (Dekompensation). Dann ist es notwendig, das
Herz zu schonen (z.B. durch Diuretika) und wieder erstarken zu lassen.
Abbildung)
stellt nicht nur sicher, dass Blut (so gut wie) nur in einer Richtung
passiert und dadurch die Strömung im Sinne der Kreislauffunktion
stattfindet, es schont dadurch auch das Myokard. Klappenfehler
beanspruchen den Herzmuskel stärker als normal, es kommt zu reaktiver
Hypertrophie (kompensiertes Stadium), möglicherweise auch zu einer
Überforderung des Herzens (Dekompensation). Dann ist es notwendig, das
Herz zu schonen (z.B. durch Diuretika) und wieder erstarken zu lassen.  Abbildung zeigt, wie sich die zeitlichen Abfolgen von
Kontraktionen, Klappenöffnungen und -schließungen zwischen rechtem und
linkem Herzen unterscheiden, und wie sich das auf die Struktur der
Herztöne auswirkt:
Abbildung zeigt, wie sich die zeitlichen Abfolgen von
Kontraktionen, Klappenöffnungen und -schließungen zwischen rechtem und
linkem Herzen unterscheiden, und wie sich das auf die Struktur der
Herztöne auswirkt:
 Abbildung: Zeitliche Differenzen rechtes / linkes Herz
Abbildung: Zeitliche Differenzen rechtes / linkes Herz

 Abbildung: Schema der Anordnung ventrikulärer Faserzüge
Abbildung: Schema der Anordnung ventrikulärer Faserzüge
 Die Entspannungszeit
(Dauer: 0,08 Sekunden) läutet die Ventrikeldiastole ein: Beide Klappen sind geschlossen, daher
ist diese Phase isovolumetrisch (wie die - kürzer dauernde -
Anspannungszeit). Im Ventrikel befindet sich das Restvolumen, etwa 50 ml.
Kollagen und andere extrazelluläre Matrixelemente (die von in das
Myokard eingestreuten Fibroblasten gebildet werden) bestimmen das
elastische Entlastungsverhalten des Gewebes.
Die Entspannungszeit
(Dauer: 0,08 Sekunden) läutet die Ventrikeldiastole ein: Beide Klappen sind geschlossen, daher
ist diese Phase isovolumetrisch (wie die - kürzer dauernde -
Anspannungszeit). Im Ventrikel befindet sich das Restvolumen, etwa 50 ml.
Kollagen und andere extrazelluläre Matrixelemente (die von in das
Myokard eingestreuten Fibroblasten gebildet werden) bestimmen das
elastische Entlastungsverhalten des Gewebes. Die diastolische Füllungszeit
(Dauer abhängig von Herzfrequenz) tritt in drei Phasen auf:
Die diastolische Füllungszeit
(Dauer abhängig von Herzfrequenz) tritt in drei Phasen auf:  Rasche Füllung („aktive Diastole“, Ventilebenenmechanismus). In dieser Phase liegen die Druck-Volumen-Werte noch leicht über der Ruhedehnungskurve;
Rasche Füllung („aktive Diastole“, Ventilebenenmechanismus). In dieser Phase liegen die Druck-Volumen-Werte noch leicht über der Ruhedehnungskurve; langsame Füllung
(manchmal als Diastase bezeichnet - eine Zeitreserve für höhere Schlagfrequenz, die langsame Füllungsphase
wird dabei immer kürzer); und
langsame Füllung
(manchmal als Diastase bezeichnet - eine Zeitreserve für höhere Schlagfrequenz, die langsame Füllungsphase
wird dabei immer kürzer); und  ein weiterer, durch die Vorhofkontraktion
bedingter spätdiastolischer Füllungsschub (späte Füllungsphase).
ein weiterer, durch die Vorhofkontraktion
bedingter spätdiastolischer Füllungsschub (späte Füllungsphase).  Die Ruhedehnungskurve (passive compliance curve) eines Hohlorgans (hier: Ventrikel - strichliert in der
Die Ruhedehnungskurve (passive compliance curve) eines Hohlorgans (hier: Ventrikel - strichliert in der  Abbildung) gibt den Innendruck bei entspannter Muskelwand als Funktion des Füllungsvolumens an (und damit die diastolische Compliance). Bei geringem Füllungsvolumen sind bindegewebige Begleitstrukturen (Kollagengitter) entspannt und das Organ (der Ventrikel)
gut dehnbar (hohe Compliance, flacher Kurvenverlauf im
Druck-Volumen-Diagramm). Mit steigender Füllung spannen sich diese
Strukturelemente immer mehr an (Straffung der Scherengitter), und es
ist immer mehr Druck erforderlich, um das Organ weiter zu befüllen (sinkende Compliance, steiler Kurvenverlauf im Druck-Volumen-Diagramm).
Abbildung) gibt den Innendruck bei entspannter Muskelwand als Funktion des Füllungsvolumens an (und damit die diastolische Compliance). Bei geringem Füllungsvolumen sind bindegewebige Begleitstrukturen (Kollagengitter) entspannt und das Organ (der Ventrikel)
gut dehnbar (hohe Compliance, flacher Kurvenverlauf im
Druck-Volumen-Diagramm). Mit steigender Füllung spannen sich diese
Strukturelemente immer mehr an (Straffung der Scherengitter), und es
ist immer mehr Druck erforderlich, um das Organ weiter zu befüllen (sinkende Compliance, steiler Kurvenverlauf im Druck-Volumen-Diagramm). 
 Abbildung: Herzzyklus im Druck-Volumen-Diagramm: Linker Ventrikel
Abbildung: Herzzyklus im Druck-Volumen-Diagramm: Linker Ventrikel
 Innere Arbeit des sich anspannenden Myokards baut den Druck im Ventrikel (isovolumetrisch) auf und leistet nach außen keine mechanische Arbeit, sondern dissipiert als Wärme (tension heat).
Innere Arbeit des sich anspannenden Myokards baut den Druck im Ventrikel (isovolumetrisch) auf und leistet nach außen keine mechanische Arbeit, sondern dissipiert als Wärme (tension heat).  Druck-Volumen-Arbeit (external work, stroke work): Die Fläche der Druck-Volumen-Schleife des Ventrikels repräsentiert die zur Förderung des Schlagvolumens erforderliche Arbeit (Druck mal Volumenänderung). Der Anteil der Druck-Volumen-Arbeit (an der Gesamtarbeit) des rechten Ventrikels ist höher als die des linken Ventrikels (der mehr Druck aufbauen muss), weshalb
das rechte Herz bei erhöhter Nachlast (pulmonale Hypertension) eher
insuffizient wird als das linke (bei systemischem Bluthochdruck).
Druck-Volumen-Arbeit (external work, stroke work): Die Fläche der Druck-Volumen-Schleife des Ventrikels repräsentiert die zur Förderung des Schlagvolumens erforderliche Arbeit (Druck mal Volumenänderung). Der Anteil der Druck-Volumen-Arbeit (an der Gesamtarbeit) des rechten Ventrikels ist höher als die des linken Ventrikels (der mehr Druck aufbauen muss), weshalb
das rechte Herz bei erhöhter Nachlast (pulmonale Hypertension) eher
insuffizient wird als das linke (bei systemischem Bluthochdruck). Beschleunigungsarbeit: Das Herz investiert kinetische Energie (1/2 mv2) in die Beschleunigung der Blutsäule in Aorta und Pulmonalarterie.
Beschleunigungsarbeit: Das Herz investiert kinetische Energie (1/2 mv2) in die Beschleunigung der Blutsäule in Aorta und Pulmonalarterie. Abbildung gezeigt. Dabei ist zu
berücksichtigen, dass Kardiomyozyten unterschiedlichen Belastungen
ausgesetzt sind, je nachdem, welche Position sie im Herzmuskel
einnehmen.
Abbildung gezeigt. Dabei ist zu
berücksichtigen, dass Kardiomyozyten unterschiedlichen Belastungen
ausgesetzt sind, je nachdem, welche Position sie im Herzmuskel
einnehmen.  beschrieben. Diese geht davon aus, dass in jedem Hohlkörper eine definierte Relation besteht zwischen der Wandspannung T (tension, Kraft / Fläche), dem Innendruck p (pressure, Kraft / Fläche) und dem Innenradius r - mit dem Druck und dem Durchmesser des Hohlorgans nimmt die Spannung in der Wand zu. In der einfachsten Form ausgedrückt:
beschrieben. Diese geht davon aus, dass in jedem Hohlkörper eine definierte Relation besteht zwischen der Wandspannung T (tension, Kraft / Fläche), dem Innendruck p (pressure, Kraft / Fläche) und dem Innenradius r - mit dem Druck und dem Durchmesser des Hohlorgans nimmt die Spannung in der Wand zu. In der einfachsten Form ausgedrückt: Abbildung).
Abbildung).
 Abbildung: Laplace-Beziehung und Druckwirkung
Abbildung: Laplace-Beziehung und Druckwirkung
 s. dort) betrachtet. Berücksichtigt man weiters die Wanddicke d
(Ventrikel, Gefäß etc - hier befindet sich außer Bindegewebe auch
Muskulatur, welche die Wandspannung aktiv verändern kann), berechnet
sich die zur Aufrechterhaltung eines bestimmten transmuralen Drucks p notwendige Wandspannung als
s. dort) betrachtet. Berücksichtigt man weiters die Wanddicke d
(Ventrikel, Gefäß etc - hier befindet sich außer Bindegewebe auch
Muskulatur, welche die Wandspannung aktiv verändern kann), berechnet
sich die zur Aufrechterhaltung eines bestimmten transmuralen Drucks p notwendige Wandspannung als vgl. dort).
vgl. dort). Die Wandspannung T (tension) ist eine Kraft: Man kann sie formulieren als das Produkt aus S.d (S, stress = Kraft pro Fläche, d.h. pro Querschnittsfläche der Gefäß- bzw. Ventrikelwand; d, diameter = Wanddurchmesser). Der transmurale Druck (trans murum: über die Wand wirkend) ist der Druck im Hohlkörper minus dem Druck außerhalb, d.h. im Falle des Herzens intraventrikulärer Blutdruck minus intrathorakaler Druck.
Die Wandspannung T (tension) ist eine Kraft: Man kann sie formulieren als das Produkt aus S.d (S, stress = Kraft pro Fläche, d.h. pro Querschnittsfläche der Gefäß- bzw. Ventrikelwand; d, diameter = Wanddurchmesser). Der transmurale Druck (trans murum: über die Wand wirkend) ist der Druck im Hohlkörper minus dem Druck außerhalb, d.h. im Falle des Herzens intraventrikulärer Blutdruck minus intrathorakaler Druck.  Um einen bestimmten Druck zu halten, muss die Muskulatur in der Wand eines solchen Organs umso mehr Kraft
entfalten, je größer der
Durchmesser ist (Druck = Kraft pro Fläche). Und: Die nötige
Kraft wird umso leichter bereitgestellt, je größer der muskuläre
Querschnitt, d.h. je dicker die "aktive" Wand ist.
Um einen bestimmten Druck zu halten, muss die Muskulatur in der Wand eines solchen Organs umso mehr Kraft
entfalten, je größer der
Durchmesser ist (Druck = Kraft pro Fläche). Und: Die nötige
Kraft wird umso leichter bereitgestellt, je größer der muskuläre
Querschnitt, d.h. je dicker die "aktive" Wand ist.  Der resultierende Druck ist umso leichter zu erzielen, je dicker die
Wand und je kleiner der Radius ist. Das
kommt in der
Umformung der Gleichung deutlich zum Ausdruck: Der generierte
(intraventrikuläre) Druck (p) nimmt proportional mit der mechanischen
Spannung (K) und der Stärke (d) der Ventrikelwand zu; umgekehrte
Proportionalität besteht mit dem Radius (r), bzw. der ventrikulären
Füllung.
Der resultierende Druck ist umso leichter zu erzielen, je dicker die
Wand und je kleiner der Radius ist. Das
kommt in der
Umformung der Gleichung deutlich zum Ausdruck: Der generierte
(intraventrikuläre) Druck (p) nimmt proportional mit der mechanischen
Spannung (K) und der Stärke (d) der Ventrikelwand zu; umgekehrte
Proportionalität besteht mit dem Radius (r), bzw. der ventrikulären
Füllung. Abbildung oben).
Abbildung oben). Eine
der Aussagen der Laplace-Beziehung ist, dass sich das Ventrikelmyokard
endsystolisch (wenn das Schlagvolumen ausgeworfen und nur das
Restvolumen verblieben ist) mit der Aufrechterhaltung eines bestimmten
Innendrucks leichter tut als bei Systolenbeginn (enddiastolisches Volumen) - weil der Innendurchmesser kleiner ist als zu Beginn der Systole.
Eine
der Aussagen der Laplace-Beziehung ist, dass sich das Ventrikelmyokard
endsystolisch (wenn das Schlagvolumen ausgeworfen und nur das
Restvolumen verblieben ist) mit der Aufrechterhaltung eines bestimmten
Innendrucks leichter tut als bei Systolenbeginn (enddiastolisches Volumen) - weil der Innendurchmesser kleiner ist als zu Beginn der Systole.  Mit zunehmender Austreibung nimmt die Nachlast des Ventrikels ab. Das hilft dem Ventrikel beim Erreichen des systolischen Spitzendrucks. Der Laplace-Effekt erleichtert die späte Austreibung.
Mit zunehmender Austreibung nimmt die Nachlast des Ventrikels ab. Das hilft dem Ventrikel beim Erreichen des systolischen Spitzendrucks. Der Laplace-Effekt erleichtert die späte Austreibung.  Die Nachlast hängt sowohl vom arteriellen Druck als auch vom Ventrikeldurchmesser ab.
Insoferne unterstützt eine Senkung der diastolischen Füllung (z.B.
durch Diurese - Reduktion des Blutvolumens, Hochlagerung - Umverteilung
von Blut aus dem Thorakalraum) die Austreibungsfunktion des Ventrikels.
Die Nachlast hängt sowohl vom arteriellen Druck als auch vom Ventrikeldurchmesser ab.
Insoferne unterstützt eine Senkung der diastolischen Füllung (z.B.
durch Diurese - Reduktion des Blutvolumens, Hochlagerung - Umverteilung
von Blut aus dem Thorakalraum) die Austreibungsfunktion des Ventrikels.
 Abbildung: Nomales und hypertrophes Myokard
Abbildung: Nomales und hypertrophes Myokard
 Abbildung).
Abbildung).  Abbildung zeigt, dass der intraventrikuläre Druck während
der Austreibungszeit zunächst weiter ansteigt, nicht aber die Kraft der
kontrahierenden Muskelfasern - diese verkürzen sich, bis sie ihre
endsystolische Länge erreicht haben.
Abbildung zeigt, dass der intraventrikuläre Druck während
der Austreibungszeit zunächst weiter ansteigt, nicht aber die Kraft der
kontrahierenden Muskelfasern - diese verkürzen sich, bis sie ihre
endsystolische Länge erreicht haben.
 Abbildung: Effekt gesteigerten Afterloads
Abbildung: Effekt gesteigerten Afterloads

 Abbildung: Effekt gesteigerten Preloads
Abbildung: Effekt gesteigerten Preloads
 Auswurfphase früher, und es bleibt mehr
Zeit für die Austreibung; es wird ein Endpunkt (ein U-Maximum)
erreicht, das einem niedrigeren enddiastolischen Volumen bei einem
geringeren Druck entspricht - die Förderleistung des Ventrikels war
besonders gut.
Auswurfphase früher, und es bleibt mehr
Zeit für die Austreibung; es wird ein Endpunkt (ein U-Maximum)
erreicht, das einem niedrigeren enddiastolischen Volumen bei einem
geringeren Druck entspricht - die Förderleistung des Ventrikels war
besonders gut.
 Abbildung: Veränderte Vor- oder Nachlast, Kontraktilität
Abbildung: Veränderte Vor- oder Nachlast, Kontraktilität
 Abbildung).
Abbildung).  Jedem Punkt auf der Ruhedehnungskurve ist eine U-Kurve zuzuordnen,
welche alle möglichen Maxima verbindet - vom entsprechenden isobaren Maximum (gleichbleibender
Druck während der Systole, nur Volumenverringerung) bis zum entsprechenden isovolumetrischen Maximum (konstantes systolisches
Volumen, nur Druckanstieg). Diese "Kurve" ist in der Regel eine Gerade und wird meist auch als solche dargestellt. Ihre Steilheit (die endsystolische Elastanz) ist ein Kontraktilitätsindex. Beispielsweise steigert Adrenalin die endsystolische Elastanz.
Jedem Punkt auf der Ruhedehnungskurve ist eine U-Kurve zuzuordnen,
welche alle möglichen Maxima verbindet - vom entsprechenden isobaren Maximum (gleichbleibender
Druck während der Systole, nur Volumenverringerung) bis zum entsprechenden isovolumetrischen Maximum (konstantes systolisches
Volumen, nur Druckanstieg). Diese "Kurve" ist in der Regel eine Gerade und wird meist auch als solche dargestellt. Ihre Steilheit (die endsystolische Elastanz) ist ein Kontraktilitätsindex. Beispielsweise steigert Adrenalin die endsystolische Elastanz.  Kontraktilität ist die Fähigkeit der Kardiomyozyten, bei gegebener Vor- und Nachlast Kraft zu entwickeln. Sie ist ein Ausdruck für die intrinsische kontraktile Energie des Herzmuskels und kann durch neurohumorale Einflüsse verändert werden (Katecholamine, Angiotensin II, inotrop wirksame Pharmaka). Die Kontraktilität wird indirekt abgeschätzt über die Steilheit des systolischen Druckanstiegs (dp/dtmax - mittels Herzkatheter) oder über die systolische Blutströmungsgeschwindigkeit (mittels Ultraschall-Doppler). Die auf die Kontraktilität bezogene Herzqualität ist die Inotropie. Faktoren, welche die Kontraktilität abschwächen, wirken negativ inotrop (im Sinne einer Rechts-unten-Verschiebung der U-Kurve); solche, die sie verstärken, positiv inotrop (im Sinne einer Links-oben-Verschiebung der U-Kurve). Positiv inotrope Substanzen wirken durch Steigerung der sarkoplasmatischen Calciumkonzentration ([Ca++]i).
Kontraktilität ist die Fähigkeit der Kardiomyozyten, bei gegebener Vor- und Nachlast Kraft zu entwickeln. Sie ist ein Ausdruck für die intrinsische kontraktile Energie des Herzmuskels und kann durch neurohumorale Einflüsse verändert werden (Katecholamine, Angiotensin II, inotrop wirksame Pharmaka). Die Kontraktilität wird indirekt abgeschätzt über die Steilheit des systolischen Druckanstiegs (dp/dtmax - mittels Herzkatheter) oder über die systolische Blutströmungsgeschwindigkeit (mittels Ultraschall-Doppler). Die auf die Kontraktilität bezogene Herzqualität ist die Inotropie. Faktoren, welche die Kontraktilität abschwächen, wirken negativ inotrop (im Sinne einer Rechts-unten-Verschiebung der U-Kurve); solche, die sie verstärken, positiv inotrop (im Sinne einer Links-oben-Verschiebung der U-Kurve). Positiv inotrope Substanzen wirken durch Steigerung der sarkoplasmatischen Calciumkonzentration ([Ca++]i). Positiv inotrope Substanzen / Effekte erhöhen den Sauerstoffbedarf des Herzens. Bei eingeschränkter Durchblutungsmöglichkeit (koronare Herzkrankheit) kann dadurch ein Punkt erreicht werden, wo das O2-Angebot unzureichend wird und die positiv
inotrope Substanz / der positiv inotrope Effekt zu myokardialer
Ischämie führt. Dadurch nimmt das Schlagvolumen wieder ab.
Positiv inotrope Substanzen / Effekte erhöhen den Sauerstoffbedarf des Herzens. Bei eingeschränkter Durchblutungsmöglichkeit (koronare Herzkrankheit) kann dadurch ein Punkt erreicht werden, wo das O2-Angebot unzureichend wird und die positiv
inotrope Substanz / der positiv inotrope Effekt zu myokardialer
Ischämie führt. Dadurch nimmt das Schlagvolumen wieder ab. Katecholamine. Sie erhöhen die Kontraktilität via ß1-Rezeptor
Katecholamine. Sie erhöhen die Kontraktilität via ß1-Rezeptor Tachykardie. Durch das "Treppenphänomen" (Frequenzinotropie, Bowditch-Effekt) steigt die Kontraktilität
Tachykardie. Durch das "Treppenphänomen" (Frequenzinotropie, Bowditch-Effekt) steigt die Kontraktilität Medikamente (können positiv oder negativ inotrop wirken)
Medikamente (können positiv oder negativ inotrop wirken) Sauerstoffmangel (z.B. ischämische Herzerkrankung) senkt die Kontraktilität
Sauerstoffmangel (z.B. ischämische Herzerkrankung) senkt die Kontraktilität Pathologische Veränderungen (Entzündungen,
Azidosen / Alkalosen, Elektrolytstoffwechselstörungen u.a.) wirken sich
ebenfalls negativ auf die Kontraktilität aus.
Pathologische Veränderungen (Entzündungen,
Azidosen / Alkalosen, Elektrolytstoffwechselstörungen u.a.) wirken sich
ebenfalls negativ auf die Kontraktilität aus. Abbildung) vom dazugehörigen Ausgangspunkt auf der Ruhedehnungskurve: Sinkt die Kontraktionskraft des Ventrikels, rückt die U-Kurve näher an
den Ausgangspunkt auf der Ruhedehnungskurve; steigt die
Kontraktionskraft, rückt sie weiter davon weg (d.h. im Diagramm nach
links oben).
Abbildung) vom dazugehörigen Ausgangspunkt auf der Ruhedehnungskurve: Sinkt die Kontraktionskraft des Ventrikels, rückt die U-Kurve näher an
den Ausgangspunkt auf der Ruhedehnungskurve; steigt die
Kontraktionskraft, rückt sie weiter davon weg (d.h. im Diagramm nach
links oben).  Abbildung
ersichtlich:
Abbildung
ersichtlich: Bei einer Referenzkontraktion öffnet die Aortenklappe bei Punkt A, und der Zustand des Herzens gelangt auf einen Punkt D auf der "normalen" U-Kurve
Bei einer Referenzkontraktion öffnet die Aortenklappe bei Punkt A, und der Zustand des Herzens gelangt auf einen Punkt D auf der "normalen" U-Kurve Nimmt die Nachlast zu (z.B. arterielle Hypertonie), muss der Ventrikel bis zu Punkt C Druck aufbauen; er erreicht dann nur mehr einen Punkt E auf der U-Kurve, der durch höheres (enddiastolisches) Volumen bei höherem Druck gekennzeichnet ist
Nimmt die Nachlast zu (z.B. arterielle Hypertonie), muss der Ventrikel bis zu Punkt C Druck aufbauen; er erreicht dann nur mehr einen Punkt E auf der U-Kurve, der durch höheres (enddiastolisches) Volumen bei höherem Druck gekennzeichnet ist Nimmt die Vorlast zu, füllt sich der Ventrikel stärker und erreicht
einen nach rechts verlagerten Punkt auf der Ruhedehnungskurve. Von hier
erreicht er - bei "normalem" Blutdruck - den Punkt B, und kann aufgrund des Starling-Mechanismus ein größeres Schlagvolumen fördern - auch diese Kontraktion endet bei Punkt D
Nimmt die Vorlast zu, füllt sich der Ventrikel stärker und erreicht
einen nach rechts verlagerten Punkt auf der Ruhedehnungskurve. Von hier
erreicht er - bei "normalem" Blutdruck - den Punkt B, und kann aufgrund des Starling-Mechanismus ein größeres Schlagvolumen fördern - auch diese Kontraktion endet bei Punkt D Steigt die Kontraktilität des Ventrikels (positiv inotroper
Effekt), dann entfernt sich die U-Kurve weiter vom Ausgangspunkt auf
der Ruhedehnungskurve (sie gleitet nach links oben). Dann werden -
ausgehend von A oder C - die Punkte F oder G erreicht: das Schlagvolumen ist größer als im Normalfall.
Steigt die Kontraktilität des Ventrikels (positiv inotroper
Effekt), dann entfernt sich die U-Kurve weiter vom Ausgangspunkt auf
der Ruhedehnungskurve (sie gleitet nach links oben). Dann werden -
ausgehend von A oder C - die Punkte F oder G erreicht: das Schlagvolumen ist größer als im Normalfall. Die Kontraktionskraft hängt
einerseits von der Kontraktilität, andererseits von der Vordehung der
Muskelzellen ab. Sie kann infolge erhöhter Kontraktilität und / oder
verstärkter Vordehnung (Frank-Starling) zunehmen.
Die Kontraktionskraft hängt
einerseits von der Kontraktilität, andererseits von der Vordehung der
Muskelzellen ab. Sie kann infolge erhöhter Kontraktilität und / oder
verstärkter Vordehnung (Frank-Starling) zunehmen. Abbildung):
Abbildung):
 Abbildung: Noradrenalineffekt
Abbildung: Noradrenalineffekt
 oder als Registrierung des Herzschalls
(Phonokardiograhie, PKG) erfolgen und wichtige diagnostische Hinweise geben.
oder als Registrierung des Herzschalls
(Phonokardiograhie, PKG) erfolgen und wichtige diagnostische Hinweise geben.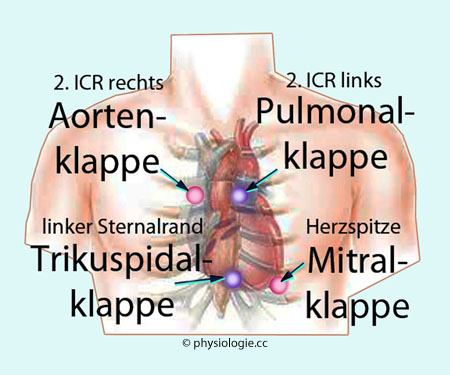
 Abbildung: Auskultationsorte für die Herzklappen
Abbildung: Auskultationsorte für die Herzklappen



 Die Untersuchung des Herzens anhand akustischer Kriterien wurde u.a. durch die Arbeiten des österreichischen Arztes Leopold Auenbrugger - der die Perkussion in die medizinische Diagnostik eingeführt hat - und des französischen Arztes Renè Laennec - dem Erfinder des Stethoskops - in
der praktischen und inneren Medizin etabliert. Beide waren Wegbereiter
der physikalischen Diagnostik. Die heute übliche Methode der
Auskultation geht auf den österreichischen Chirurgen und Internisten Josef von Skoda zurück.
Die Untersuchung des Herzens anhand akustischer Kriterien wurde u.a. durch die Arbeiten des österreichischen Arztes Leopold Auenbrugger - der die Perkussion in die medizinische Diagnostik eingeführt hat - und des französischen Arztes Renè Laennec - dem Erfinder des Stethoskops - in
der praktischen und inneren Medizin etabliert. Beide waren Wegbereiter
der physikalischen Diagnostik. Die heute übliche Methode der
Auskultation geht auf den österreichischen Chirurgen und Internisten Josef von Skoda zurück. S1
(Frequenz ~100 Hz) markiert den Beginn der Systole, entsteht durch den Schluss der
Atrioventrikularklappen und die
beginnende Anspannung der Ventrikelwand, dauert ~0,14 Sekunden,
klingt dumpf und ist für die am besten im 5. Interkostalraum links
(Mitralklappe)
bzw. im 4. Interkostalraum rechts parasternal (Trikuspidalklappe
S1
(Frequenz ~100 Hz) markiert den Beginn der Systole, entsteht durch den Schluss der
Atrioventrikularklappen und die
beginnende Anspannung der Ventrikelwand, dauert ~0,14 Sekunden,
klingt dumpf und ist für die am besten im 5. Interkostalraum links
(Mitralklappe)
bzw. im 4. Interkostalraum rechts parasternal (Trikuspidalklappe  ) zu
hören.
) zu
hören. S2
markiert den Beginn der Diastole, entsteht durch den Schluss der Taschenklappen
(zuerst Aorten-, dann
Pulmonalklappe - physiologische Spaltung des 2. Herztons, vor allem
während der Inspiration), dauert ~0,11 Sekunden, klingt hell und ist am
besten im 2. Interkostalraum zu hören (Aortenklappe rechts, Pulmonalklappe links parasternal).
S2
markiert den Beginn der Diastole, entsteht durch den Schluss der Taschenklappen
(zuerst Aorten-, dann
Pulmonalklappe - physiologische Spaltung des 2. Herztons, vor allem
während der Inspiration), dauert ~0,11 Sekunden, klingt hell und ist am
besten im 2. Interkostalraum zu hören (Aortenklappe rechts, Pulmonalklappe links parasternal). Ein niedrigfrequenter dritter Herzton ist bei Kindern und schlanken Jugendlichen zu
hören; er entsteht in der frühen Füllungsphase der Ventrikel (das
gesamte Schallmuster wird dann als "Galopprhythmus" bezeichnet).
Ein niedrigfrequenter dritter Herzton ist bei Kindern und schlanken Jugendlichen zu
hören; er entsteht in der frühen Füllungsphase der Ventrikel (das
gesamte Schallmuster wird dann als "Galopprhythmus" bezeichnet). Ein schwacher vierter Herzton kann aich phonokardiographisch als Zeichen der Vorhofkontraktion darstellen.
Ein schwacher vierter Herzton kann aich phonokardiographisch als Zeichen der Vorhofkontraktion darstellen. Abbildung). Diese sind ein Abbild der Druckereignisse im Bereich des rechten Vorhofs und damit des Zentralvenendrucks (ZVD).
Abbildung). Diese sind ein Abbild der Druckereignisse im Bereich des rechten Vorhofs und damit des Zentralvenendrucks (ZVD).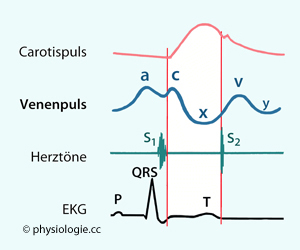
 Abbildung: Venenpuls in zeitlicher Relation zu Carotispuls, Herzschall und EKG
Abbildung: Venenpuls in zeitlicher Relation zu Carotispuls, Herzschall und EKG
 Die a-Welle (a: atrium) signalisiert den Druckansteg bei der beginnenden Vorhofkontraktion.
Es kommt zu einem leichten Reflux von Blut in die Hohlvenen (dieser ist
gering, das dem Herzen zufließende Blut hat eine gewisse Massenträgheit
und muss erst abgebremst werden), der Zentralvenendruck nimmt um 3-5
mmHg zu
Die a-Welle (a: atrium) signalisiert den Druckansteg bei der beginnenden Vorhofkontraktion.
Es kommt zu einem leichten Reflux von Blut in die Hohlvenen (dieser ist
gering, das dem Herzen zufließende Blut hat eine gewisse Massenträgheit
und muss erst abgebremst werden), der Zentralvenendruck nimmt um 3-5
mmHg zu Die c-Welle (c: carotid) wird durch das Vorwölben der (jetzt geschlossenen) AV-Klappe während der Anspannungszeit
des Ventrikels verursacht. Die c-Welle wandert von der AV-Ebene zur
Jugularvene, was zu einer Zeitverzögerung der c-Welle in Relation zum
Beginn der Vorhofkontraktion führt. Die c-Welle wird weiters
teilverursacht durch die frühe Pulswelle in der benachbarten a. carotis
("c")
Die c-Welle (c: carotid) wird durch das Vorwölben der (jetzt geschlossenen) AV-Klappe während der Anspannungszeit
des Ventrikels verursacht. Die c-Welle wandert von der AV-Ebene zur
Jugularvene, was zu einer Zeitverzögerung der c-Welle in Relation zum
Beginn der Vorhofkontraktion führt. Die c-Welle wird weiters
teilverursacht durch die frühe Pulswelle in der benachbarten a. carotis
("c") Die x-Senke
entsteht durch die Verschiebung der Ventilebene zur Herzspitze, was
einen Sogeffekt im Venenpuls und den Spitzenwert der Vorhoffüllung
bewirkt
Die x-Senke
entsteht durch die Verschiebung der Ventilebene zur Herzspitze, was
einen Sogeffekt im Venenpuls und den Spitzenwert der Vorhoffüllung
bewirkt Die v-Welle entsteht durch den Druckanstieg im Vorhof, der sich während der späten Systole bzw. frühen Diastole des Ventrikels auftritt und den Abschluss des Ventilebenenmechanismus widerspiegelt
Die v-Welle entsteht durch den Druckanstieg im Vorhof, der sich während der späten Systole bzw. frühen Diastole des Ventrikels auftritt und den Abschluss des Ventilebenenmechanismus widerspiegelt Die y-Senke hängt mit dem Druckabfall nach Öffnen der AV-Klappe zusammen (Abschluss des Ventilebenenmechanismus).
Die y-Senke hängt mit dem Druckabfall nach Öffnen der AV-Klappe zusammen (Abschluss des Ventilebenenmechanismus).
 Erregungsausbreitung über das Kammermyokard triggert die
Ventrikelsystole. Der steigende Druck drängt etwas Blut in den Vorhof,
das schließt die AV-Klappen, der Ventrikel baut Druck auf
(Anspannungszeit; die auftretenden Schwingungen ergeben den 1. Herzton). Die Geschwindigkeit des Druckanstiegs (dp/dtmax) ist ein Kontraktilitätsindex. Hat der Druck denjenigen hinter der arteriellen Klappe überwunden, wird diese geöffnet, Blut fließt aus dem Ventrikel,
~75%
des Schlagvolumens in der ersten Hälfte der
Austreibungszeit. Bei deren Ende fließen <5% des Schlagvolumens
zurück, die arterielle Klappe schließt (2. Herzton, Inzisur im
Aortenpuls). Während der Entspannungszeit befindet sich das Restvolumen
(~50
ml) im Ventrikel. Zu Beginn der Füllungsphase gleitet die offene AV-Klappe
über einen Teil des im Atrium zwischengespeicherten Blutes (Ventilebenenmechanismus), die Vorhofkontraktion schließt die Füllungszeit ab. Das enddiastolische Füllungsvolumen beträgt bei gesunden erwachsenen Personen ~130 ml (Schlagvolumen ~80 ml)
Erregungsausbreitung über das Kammermyokard triggert die
Ventrikelsystole. Der steigende Druck drängt etwas Blut in den Vorhof,
das schließt die AV-Klappen, der Ventrikel baut Druck auf
(Anspannungszeit; die auftretenden Schwingungen ergeben den 1. Herzton). Die Geschwindigkeit des Druckanstiegs (dp/dtmax) ist ein Kontraktilitätsindex. Hat der Druck denjenigen hinter der arteriellen Klappe überwunden, wird diese geöffnet, Blut fließt aus dem Ventrikel,
~75%
des Schlagvolumens in der ersten Hälfte der
Austreibungszeit. Bei deren Ende fließen <5% des Schlagvolumens
zurück, die arterielle Klappe schließt (2. Herzton, Inzisur im
Aortenpuls). Während der Entspannungszeit befindet sich das Restvolumen
(~50
ml) im Ventrikel. Zu Beginn der Füllungsphase gleitet die offene AV-Klappe
über einen Teil des im Atrium zwischengespeicherten Blutes (Ventilebenenmechanismus), die Vorhofkontraktion schließt die Füllungszeit ab. Das enddiastolische Füllungsvolumen beträgt bei gesunden erwachsenen Personen ~130 ml (Schlagvolumen ~80 ml) Das
Laplace'sche Gesetz beschreibt die Beziehung zwischen Wanddicke,
Wandspannung und Innendruck: Die zur
Aufrechterhaltung des Drucks notwendige Wandspannung ist proportional
dem Innendruck und dem Innenradius, umgekehrt proportional der Wanddicke:
Das Myokard muss um so mehr Kraft entfalten, je größer der
Innendurchmesser, und um so weniger, je dicker die Muskelwand ist
(Kardiomyozyten sind je nach ihrer Position unterschiedlich stark gefordert: Subendokardiale sind weniger belastet als subepikardiale).
Steigt die Nachlast, nimmt auch die Wandspannung im Ventrikel zu. Die
Nachlast hängt nicht nur vom Druck, sondern auch von der Geometrie des
Ventrikels ab (je enger, desto leichter); mit zunehmender Austreibung
wird der Ventrikel enger und nimmt die Nachlast ab. In einem gesunden Herz überwiegt der
Frank-Starling-Effekt, bei ventrikulärer Dilatation der
Laplace-Effekt, der Ventrikel wird insuffizient. Reaktive Hypertrophie (größere
Wanddicke) reduziert die Wandspannung und erleichtert die Herzaktion
Das
Laplace'sche Gesetz beschreibt die Beziehung zwischen Wanddicke,
Wandspannung und Innendruck: Die zur
Aufrechterhaltung des Drucks notwendige Wandspannung ist proportional
dem Innendruck und dem Innenradius, umgekehrt proportional der Wanddicke:
Das Myokard muss um so mehr Kraft entfalten, je größer der
Innendurchmesser, und um so weniger, je dicker die Muskelwand ist
(Kardiomyozyten sind je nach ihrer Position unterschiedlich stark gefordert: Subendokardiale sind weniger belastet als subepikardiale).
Steigt die Nachlast, nimmt auch die Wandspannung im Ventrikel zu. Die
Nachlast hängt nicht nur vom Druck, sondern auch von der Geometrie des
Ventrikels ab (je enger, desto leichter); mit zunehmender Austreibung
wird der Ventrikel enger und nimmt die Nachlast ab. In einem gesunden Herz überwiegt der
Frank-Starling-Effekt, bei ventrikulärer Dilatation der
Laplace-Effekt, der Ventrikel wird insuffizient. Reaktive Hypertrophie (größere
Wanddicke) reduziert die Wandspannung und erleichtert die Herzaktion Das Druck-Volumen-Diagramm des
Ventrikels zeigt dessen Compliance und Kontraktionsverhalten. Ein
Herzzyklus läuft in vier Phasen ab (Anspannung - Austreibung - Entspannung
- Füllung). Das Produkt aus Schlagvolumen und Druck entspricht der
Druck-Volumen-Arbeit und ist proportional zum Energieverbrauch des
Herzmuskels. Jedem Punkt auf der Ruhedehnungskurve ist eine U-Kurve (meist eine
Gerade) zugeordnet, welche alle Maxima verbindet (vom isobaren bis zum
isovolumetrischen Maximum). Ihre Steilheit (die endsystolische
Elastanz) ist ein Kontraktilitätsindex. Kontraktilität
ist ein Ausdruck für die Kontraktionsenergie, die durch neurohumorale Faktoren
verändert werden kann (adrenerge Anregung des Herzmuskels bewirkt einen positiv inotropen Effekt: Verlagerung der U-Kurve). Auch
ein verringertes Schlagintervall
(Treppenphänomen) steigert die Kontraktilität. Die Kontraktionskraft
kann gesteigert werden durch Erhöhung der Kontraktilität oder durch
vermehrte Vordehnung (Frank-Starling)
Das Druck-Volumen-Diagramm des
Ventrikels zeigt dessen Compliance und Kontraktionsverhalten. Ein
Herzzyklus läuft in vier Phasen ab (Anspannung - Austreibung - Entspannung
- Füllung). Das Produkt aus Schlagvolumen und Druck entspricht der
Druck-Volumen-Arbeit und ist proportional zum Energieverbrauch des
Herzmuskels. Jedem Punkt auf der Ruhedehnungskurve ist eine U-Kurve (meist eine
Gerade) zugeordnet, welche alle Maxima verbindet (vom isobaren bis zum
isovolumetrischen Maximum). Ihre Steilheit (die endsystolische
Elastanz) ist ein Kontraktilitätsindex. Kontraktilität
ist ein Ausdruck für die Kontraktionsenergie, die durch neurohumorale Faktoren
verändert werden kann (adrenerge Anregung des Herzmuskels bewirkt einen positiv inotropen Effekt: Verlagerung der U-Kurve). Auch
ein verringertes Schlagintervall
(Treppenphänomen) steigert die Kontraktilität. Die Kontraktionskraft
kann gesteigert werden durch Erhöhung der Kontraktilität oder durch
vermehrte Vordehnung (Frank-Starling) Venenpuls sind die Druck- und
Volumenschwankungen in herznahen Venen als Abbild der Druckereignisse
im Bereich des rechten Vorhofs / des Zentralvenendrucks: a-Welle
(Druckanstieg der beginnenden Vorhofkontraktion), c-Welle (Vorwölben der
geschlossenen AV-Klappe während der Anspannungszeit des Ventrikels),
x-Senke (Verschiebung der Ventilebene zur Herzspitze), v-Welle
(Abschluss des Ventilebenenmechanismus), y-Senke
(Druckabfall nach Öffnen der Trikuspidalklappe). Die Pulsationen der Jugularvene erlauben einen Rückschluss auf den Ablauf des Zentralvenendrucks
Venenpuls sind die Druck- und
Volumenschwankungen in herznahen Venen als Abbild der Druckereignisse
im Bereich des rechten Vorhofs / des Zentralvenendrucks: a-Welle
(Druckanstieg der beginnenden Vorhofkontraktion), c-Welle (Vorwölben der
geschlossenen AV-Klappe während der Anspannungszeit des Ventrikels),
x-Senke (Verschiebung der Ventilebene zur Herzspitze), v-Welle
(Abschluss des Ventilebenenmechanismus), y-Senke
(Druckabfall nach Öffnen der Trikuspidalklappe). Die Pulsationen der Jugularvene erlauben einen Rückschluss auf den Ablauf des Zentralvenendrucks