

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert

Physiologie des Herzens

 Koronargefäße und Myokardstoffwechsel
Koronargefäße und Myokardstoffwechsel
© H. Hinghofer-Szalkay




 Koronargefäße und Myokardstoffwechsel
Koronargefäße und Myokardstoffwechsel
 Infarkt: in-farcire = hinein-stopfen
Infarkt: in-farcire = hinein-stopfen| Es gibt so gut wie keine Sauerstoffreserven im Herzmuskel. Myokardzellen (die ständig aktiv sind) können ohne O2-Zufuhr
nur für sehr kurze Zeit funktionieren. Das erklärt die Bedeutung
unbehinderter Durchblutung (Herzkranzgefäße: Koronarperfusion). 5% des
Herzzeitvolumens und 10% der gesamten Sauerstoffaufnahme des Körpers
gehen in die Versorgung des Myokards. In Ruhe sind das pro Minute ca.
300 ml Blut und 30 ml Sauerstoff; bei körperlicher Belastung steigen
diese Werte bis 5-fach an. Außer dem Sauerstoff verbraucht das Myokard auch mit dem Blut angelieferte Energieträger: Mindestens 40% Fettsäuren (für deren Metabolisierung spielt Carnitin eine Rolle) und Neutralfette, mindestens 20% Glucose, mindestens 10% Lactat, weiters Ketonkörper, Pyruvat und Aminosäuren. Zur Metabolisierung all dieser Substrate wird Sauerstoff benötigt. Viele Faktoren beeinflussen den Blutstrom durch die Herzkranzgefäße: Metabolische, hämodynamische, neuronale, hormonelle. Je intensiver der Herzmuskel arbeitet, desto weiter werden die Koronararterien gestellt und umso höher ist die Durchblutung (Autoregulation). Eine besondere Situation besteht in der Wand des linken Ventrikels, vor allem in dessen inneren (subendokardialen) Zonen: Hier schnürt in der Systole das Myokard die Arterien ab - die Perfusion ist stark reduziert. Die Wand des linken Ventrikels wird daher vor allem während der Diastole durchblutet - im relaxierten Zustand läßt der "Würgegriff" des Muskelgewebes an seinen Versorgungsgefäßen nach. |
 Koronardurchblutung und myokardialer Sauerstoffbedarf
Koronardurchblutung und myokardialer Sauerstoffbedarf  Substrate für den myokardialen Energiestoffwechsel
Substrate für den myokardialen Energiestoffwechsel
 Koronare Durchblutungssteuerung
Koronare Durchblutungssteuerung Tension-time index (TTI)
Tension-time index (TTI)
 Core messages
Core messages (venae cordis minimae) münden vor allem in den linken Ventrikel (dieses Blut entgeht sozusagen dem Pulmonalkreislauf).
(venae cordis minimae) münden vor allem in den linken Ventrikel (dieses Blut entgeht sozusagen dem Pulmonalkreislauf). Abbildung), in der einerseits viel Kontraktionskraft auftritt (intramural bis ~240 mmHg), andererseits die koronaren Druck- (~80 mmHg) und Strömungswerte (~0) minimal
sind.
Abbildung), in der einerseits viel Kontraktionskraft auftritt (intramural bis ~240 mmHg), andererseits die koronaren Druck- (~80 mmHg) und Strömungswerte (~0) minimal
sind. 
 Abbildung: Links- und rechtsventrikuläre Koronardurchblutung bei körperlicher Ruhe
Abbildung: Links- und rechtsventrikuläre Koronardurchblutung bei körperlicher Ruhe
| Die
linke a. coronaria wird hauptsächlich während der Diastole perfundiert.
In der Systole fließt kaum Blut (insbesondere subendokardial) |
 Der Vorteil
der Anwendung von ß-Blockern (z.B. die selektiven ß1-Blocker Metoprolol, Atenolol) liegt z.T. in der (bradykarden)
Verlängerung der Diastolendauer und damit der Phase hoher koronarer
Durchblutung.
Der Vorteil
der Anwendung von ß-Blockern (z.B. die selektiven ß1-Blocker Metoprolol, Atenolol) liegt z.T. in der (bradykarden)
Verlängerung der Diastolendauer und damit der Phase hoher koronarer
Durchblutung. Der Tension-time Index (of the heart) TTI ist das Produkt aus aktiver Wandspannung des Myokards und der Zeitdauer, welche diese aufrechterhalten wird. Klinisch lässt
sich so der Sauerstoffverbrauch des
Herzmuskels abschätzen. Es gibt unterschiedliche Definitionen, wie z.B.
Der Tension-time Index (of the heart) TTI ist das Produkt aus aktiver Wandspannung des Myokards und der Zeitdauer, welche diese aufrechterhalten wird. Klinisch lässt
sich so der Sauerstoffverbrauch des
Herzmuskels abschätzen. Es gibt unterschiedliche Definitionen, wie z.B.
 ) auftreten, irreversible Schäden stellen sich nach ~30 Minuten Blutleere ein,
da ja das Herz auch für seine eigene Durchblutung sorgen muss
(Koronargefäße
) auftreten, irreversible Schäden stellen sich nach ~30 Minuten Blutleere ein,
da ja das Herz auch für seine eigene Durchblutung sorgen muss
(Koronargefäße  ; normales Durchblutungsmuster s.
; normales Durchblutungsmuster s.  Abbildung unten).
Abbildung unten).  Die Koronardurchblutung beträgt 4-5% des Herzzeitvolumens, in
Ruhe 70-80 ml/min/100 g Myokardgewebe (das Herz wiegt ~300 Gramm), bei
körperlicher Belastung bis ~400 ml/min/100g. Damit gehört die spezifische Durchblutung des Herzmuskels zu den höchsten im Körper.
Die Koronardurchblutung beträgt 4-5% des Herzzeitvolumens, in
Ruhe 70-80 ml/min/100 g Myokardgewebe (das Herz wiegt ~300 Gramm), bei
körperlicher Belastung bis ~400 ml/min/100g. Damit gehört die spezifische Durchblutung des Herzmuskels zu den höchsten im Körper. | Etwa 5% des Ruhe-Herzzeitvolumens fließen durch die Koronargefäße Bei Belastung nimmt die Koronardurchblutung in dem Ausmaß zu, in dem die Herzleistung steigt |

 Die Differenz zwischen maximaler und
basaler koronarer Perfusion bezeichnet man als koronare Reserve (
Die Differenz zwischen maximaler und
basaler koronarer Perfusion bezeichnet man als koronare Reserve ( Abbildung unten);
als Quotient angegeben, erreicht sie bei Gesunden einen Wert von 4-5
und kann (bei optimaler Kondition) bis zu einem Wert von fast 10
ansteigen.
Abbildung unten);
als Quotient angegeben, erreicht sie bei Gesunden einen Wert von 4-5
und kann (bei optimaler Kondition) bis zu einem Wert von fast 10
ansteigen.  Kontrahierte Muskelmasse übt auf die eigenen Blutgefäße
Druck aus (bei Umkehr des transmuralen Drucks kollabieren die Gefäße)
und behindert die Perfusion (insbesondere des linkenVentrikels, der die
höchsten Druckwerte generiert) -
Kontrahierte Muskelmasse übt auf die eigenen Blutgefäße
Druck aus (bei Umkehr des transmuralen Drucks kollabieren die Gefäße)
und behindert die Perfusion (insbesondere des linkenVentrikels, der die
höchsten Druckwerte generiert) -  s. oben.
s. oben.  Außerdem
spielt der Druck, gegen den Blut aus dem Herzen ausgeworfen wird, eine
Rolle: Mit steigendem Blutdruck (Nachlast) nimmt auch die koronare
Perfusion zu.
Außerdem
spielt der Druck, gegen den Blut aus dem Herzen ausgeworfen wird, eine
Rolle: Mit steigendem Blutdruck (Nachlast) nimmt auch die koronare
Perfusion zu.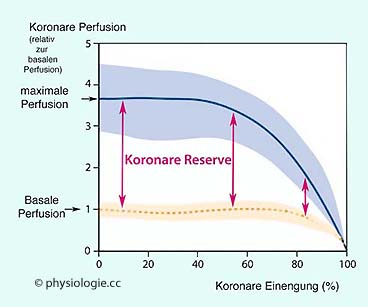
 Abbildung: Koronare Reserve
Abbildung: Koronare Reserve
 Vaskuläre Komponente: Tonus der Koronargefäße. Deren Autoregulation
ermöglicht in tiefen (subendokardialen) Schichten des linken Ventrikels
ausreichende (diastolische) Perfusion, obwohl diese von der
systolischen Drosselung der Koronardurchblutung besonders stark
betroffen sind
Vaskuläre Komponente: Tonus der Koronargefäße. Deren Autoregulation
ermöglicht in tiefen (subendokardialen) Schichten des linken Ventrikels
ausreichende (diastolische) Perfusion, obwohl diese von der
systolischen Drosselung der Koronardurchblutung besonders stark
betroffen sind Extravaskuläre Komponente: Druck der Ventrikelwand während der Systole -
die Kontraktion des linken Ventrikels "würgt" die Durchblutung ab
(
Extravaskuläre Komponente: Druck der Ventrikelwand während der Systole -
die Kontraktion des linken Ventrikels "würgt" die Durchblutung ab
( Abbildung ganz oben), vor allem in den subendokardialen Schichten. Etwa 80%
der myokardialen Durchblutung des linken Ventrikels findet während
dessen Diastole statt (dieser Effekt ist im rechten Ventrikel, dessen
Druckentwicklung nur ~1/6 derjenigen der linken Kammer beträgt, nur
schwach ausgeprägt)
Abbildung ganz oben), vor allem in den subendokardialen Schichten. Etwa 80%
der myokardialen Durchblutung des linken Ventrikels findet während
dessen Diastole statt (dieser Effekt ist im rechten Ventrikel, dessen
Druckentwicklung nur ~1/6 derjenigen der linken Kammer beträgt, nur
schwach ausgeprägt)
 Der Sauerstoffbedarf
des Herzens (10 ml/100g/min in Ruhe, bis über 50 ml/100g/min bei
körperlicher Belastung) beträgt hingegen etwa 10% des gesamten Bedarfs des Körpers
(Ruhe ~30 ml/min, schwere Arbeit bis >150 ml/min). Dies kommt in der
hohen O2-Extraktionsrate im Koronarkreislauf zum Ausdruck, sie ist mehr als doppelt so hoch (~60% arterio-venöse Sauerstoffdifferenz) als für den gesamten Organismus im Ruhezustand typisch (~25% AVDO2). Die spezifische Sauerstoffaufnahme des Myokards beträgt bei körperlicher Ruhe ~8
ml/min/100g (zwanzigmal so viel wie in ruhender Skelettmuskulatur),
dieser Wert kann sich bei körperlicher Ausbelastung verfünffachen; vor
allem durch erhöhte koronare Durchblutung, kaum durch weitere
Steigerung der (im Myokard mit 65-75% ohnehin hohen) arterio-venösen Sauerstoffdifferenz, die aber bis auf 90% steigen kann.
Der Sauerstoffbedarf
des Herzens (10 ml/100g/min in Ruhe, bis über 50 ml/100g/min bei
körperlicher Belastung) beträgt hingegen etwa 10% des gesamten Bedarfs des Körpers
(Ruhe ~30 ml/min, schwere Arbeit bis >150 ml/min). Dies kommt in der
hohen O2-Extraktionsrate im Koronarkreislauf zum Ausdruck, sie ist mehr als doppelt so hoch (~60% arterio-venöse Sauerstoffdifferenz) als für den gesamten Organismus im Ruhezustand typisch (~25% AVDO2). Die spezifische Sauerstoffaufnahme des Myokards beträgt bei körperlicher Ruhe ~8
ml/min/100g (zwanzigmal so viel wie in ruhender Skelettmuskulatur),
dieser Wert kann sich bei körperlicher Ausbelastung verfünffachen; vor
allem durch erhöhte koronare Durchblutung, kaum durch weitere
Steigerung der (im Myokard mit 65-75% ohnehin hohen) arterio-venösen Sauerstoffdifferenz, die aber bis auf 90% steigen kann. Steigerung des Sauerstoffangebots bei
zunehmender Herzleistung erfolgt weitgehend über eine Erhöhung der Durchblutung - die Sauerstoffausschöpfung kann nur gering
gesteigert werden. Tatsächlich lässt sich die koronare Durchblutung bis auf das 5-fache steigern (Koronarreserve, s. oben).
Steigerung des Sauerstoffangebots bei
zunehmender Herzleistung erfolgt weitgehend über eine Erhöhung der Durchblutung - die Sauerstoffausschöpfung kann nur gering
gesteigert werden. Tatsächlich lässt sich die koronare Durchblutung bis auf das 5-fache steigern (Koronarreserve, s. oben). Etwa die Hälfte der Energie eines Herzzyklus wird in der Anspannungszeit konsumiert.
Etwa die Hälfte der Energie eines Herzzyklus wird in der Anspannungszeit konsumiert. Sinus coronarius: Etwa 85% des
venösen Blutes aus dem Myokard stammt aus dem linken Ventrikel und
fließt über myokardiale Venen in den sinus coronarius, der seinerseits
in den rechten Vorhof mündet.
Sinus coronarius: Etwa 85% des
venösen Blutes aus dem Myokard stammt aus dem linken Ventrikel und
fließt über myokardiale Venen in den sinus coronarius, der seinerseits
in den rechten Vorhof mündet. Der rechte Ventrikel sendet venöses Blut über anteriore Herzvenen in den rechten Vorhof.
Der rechte Ventrikel sendet venöses Blut über anteriore Herzvenen in den rechten Vorhof. Thebesische Venen sind die
kleinsten venösen Gefäße des Herzens, sie bringen venöses Blut aus dem
Myokard direkt in die Herzräume (Vorhöfe, Ventrikel, vor allem
rechtsseitig. Im linken Herzen mischen sie venöses Blut zum
oxygenierten aus der Lunge: "anatomischer Shunt").
Thebesische Venen sind die
kleinsten venösen Gefäße des Herzens, sie bringen venöses Blut aus dem
Myokard direkt in die Herzräume (Vorhöfe, Ventrikel, vor allem
rechtsseitig. Im linken Herzen mischen sie venöses Blut zum
oxygenierten aus der Lunge: "anatomischer Shunt").
 Abbildung: Substratnutzung (% von gesamt) des Myokards bei körperlicher Ruhe und intensiver Arbeit
Abbildung: Substratnutzung (% von gesamt) des Myokards bei körperlicher Ruhe und intensiver Arbeit
 Abbildung): Als Substrat
ür den aeroben Energiestoffwechsel (O2-Extraktion aus dem Blut ~70%!) dienen
Abbildung): Als Substrat
ür den aeroben Energiestoffwechsel (O2-Extraktion aus dem Blut ~70%!) dienen  bei körperlicher Ruhe zu 60-90% freie Fettsäuren und Triglyzeride, zu 10-40% Glucose und Lactat (ein wenig auch Ketonkörper, Pyruvat und Aminosäuren),
wobei sich diese Substrate gegenseitig vertreten können, abhängig vom
jeweiligen Angebot im Blut.
bei körperlicher Ruhe zu 60-90% freie Fettsäuren und Triglyzeride, zu 10-40% Glucose und Lactat (ein wenig auch Ketonkörper, Pyruvat und Aminosäuren),
wobei sich diese Substrate gegenseitig vertreten können, abhängig vom
jeweiligen Angebot im Blut. Bei körperlicher Belastung verschiebt
sich das Nutzungsprofil: Die Lactatoxidation bestreitet bis
um die 60% (Lactat strömt reichlich aus der arbeitenden Muskulatur in
den Kreislauf), die Fettsäureoxidation nur noch rund 20%. Der Glucoseanteil
sinkt leicht ab (~16%); Ketonkörper, Pyruvat und Aminosäuren bestreiten nur noch 2% des gesamten Energieaufwandes.
Bei körperlicher Belastung verschiebt
sich das Nutzungsprofil: Die Lactatoxidation bestreitet bis
um die 60% (Lactat strömt reichlich aus der arbeitenden Muskulatur in
den Kreislauf), die Fettsäureoxidation nur noch rund 20%. Der Glucoseanteil
sinkt leicht ab (~16%); Ketonkörper, Pyruvat und Aminosäuren bestreiten nur noch 2% des gesamten Energieaufwandes.| Das Myokard nutzt u.a. Lactat als Energiequelle (20% des Energiebedarfs bei körperlicher Ruhe, bis ~60% bei körperlicher Belastung) Daher ist die koronararterielle Lactatkonzentration höher als die koronarvenöse. Bei unzureichender Sauerstoffversorgung (Ischämie) kann sich das umkehren Der Lactatverbrauch kann als Myokardperfusion mal arteriovenöser Konzentrationsdifferenz errechnet werden |
 Bei Feten und Neugeborenen ernährt sich
das Myokard vorwiegend von Glucose und Lactat; später schaltet es auf das Erwachsenenmuster um.
Bei Feten und Neugeborenen ernährt sich
das Myokard vorwiegend von Glucose und Lactat; später schaltet es auf das Erwachsenenmuster um.
 Ist das Myokard geschädigt (Ischämie
Ist das Myokard geschädigt (Ischämie  ), können die Myozyten wieder auf
die vorwiegende Nutzung von Glucose und Lactat zurückschalten.
), können die Myozyten wieder auf
die vorwiegende Nutzung von Glucose und Lactat zurückschalten. Das Herz wird vor allem durch Druckarbeit belastet. Um das Myokard zu schonen, wird daher klinisch die Nachlast (afterload) gesenkt, d.h. der Blutdruck reduziert. Weiters ist die Herzfrequenz direkt proportional dem Energieverbrauch; Frequenzsenkung entlastet das Herz.
Das Herz wird vor allem durch Druckarbeit belastet. Um das Myokard zu schonen, wird daher klinisch die Nachlast (afterload) gesenkt, d.h. der Blutdruck reduziert. Weiters ist die Herzfrequenz direkt proportional dem Energieverbrauch; Frequenzsenkung entlastet das Herz. 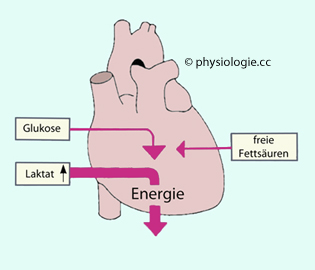
 Abbildung: Substrate für den myokardialen Energiestoffwechsel
Abbildung: Substrate für den myokardialen Energiestoffwechsel
 Abbildung).
Abbildung). | Die Koronargefäße verhalten sich druckpassiv. Bei gesteigerter Perfusion werden sie geweitet, der Strömungswiderstand sinkt. Das ermöglicht höhere Durchblutung |

 Abbildung: Koronare Perfusionsmuster
Abbildung: Koronare Perfusionsmuster Der ramus cicumflexus versorgt die posterolaterale Wand,
Der ramus cicumflexus versorgt die posterolaterale Wand, der ramus interventricularis anterior Vorderwand, vorderes Septum und Ventrikelspitze.
der ramus interventricularis anterior Vorderwand, vorderes Septum und Ventrikelspitze. Die a. coronaria dextra mit ihrem ramus interventricularis posterior versorgt das rechte Herz und hinteres Septum sowie Sinus- und AV-Knoten.
Die a. coronaria dextra mit ihrem ramus interventricularis posterior versorgt das rechte Herz und hinteres Septum sowie Sinus- und AV-Knoten.
 Carnitin ist kein essentieller Nahrungsbestandteil, der Körper kann es selbst synthetisieren. Carnitin kommt in
Fleisch, kaum in pflanzlicher Kost vor und kann mit einer
Bioverfügbarkeit von ~50-85% aus der Nahrung resorbiert werden,
Vitamine und Eisen sind dabei essentielle Cofaktoren.
Carnitin ist kein essentieller Nahrungsbestandteil, der Körper kann es selbst synthetisieren. Carnitin kommt in
Fleisch, kaum in pflanzlicher Kost vor und kann mit einer
Bioverfügbarkeit von ~50-85% aus der Nahrung resorbiert werden,
Vitamine und Eisen sind dabei essentielle Cofaktoren.| Adenosin steigert die myokardiale Perfusion |
 So steigt die Perfusion trotz erhöhten Sympathikustonus - indirekt (autoregulativ-metabolisch bedingt), aber auch über ß2-Rezeptoren in der koronaren Gefäßmuskulatur, welche dilatierende Wirkung haben.
So steigt die Perfusion trotz erhöhten Sympathikustonus - indirekt (autoregulativ-metabolisch bedingt), aber auch über ß2-Rezeptoren in der koronaren Gefäßmuskulatur, welche dilatierende Wirkung haben. Autoregulation (Adenosin, K+, H+)
- sie garantiert im Basiszustand (körperliche Ruhe, stressfrei) eine
weitgehend konstante Durchblutung in einem arteriellen Druckbereich
zwischen etwa 70 und 150 mmHg
Autoregulation (Adenosin, K+, H+)
- sie garantiert im Basiszustand (körperliche Ruhe, stressfrei) eine
weitgehend konstante Durchblutung in einem arteriellen Druckbereich
zwischen etwa 70 und 150 mmHg
 endotheliale Einflüsse (NO, PGI2)
endotheliale Einflüsse (NO, PGI2)
 Hormone (Katecholamine, Angiotensin II)
Hormone (Katecholamine, Angiotensin II)
 Neurotransmitter (Noradrenalin; purinerge, peptiderge Innervation)
Neurotransmitter (Noradrenalin; purinerge, peptiderge Innervation) Nimmt das Sauerstoffangebot an das Myokard ab (Ischämie), dann entsteht aus Pyruvat Lactat,
und der Herzmuskel gibt Milchsäure ab, statt sie zu verbrauchen. Daher
ist ein Anstieg der koronarvenösen Lactatkonzentration (genauer: ein
Absinken des arterio-venösen Quotienten) ein klinischer Indikator für
eine Myokardhypoxie.
Nimmt das Sauerstoffangebot an das Myokard ab (Ischämie), dann entsteht aus Pyruvat Lactat,
und der Herzmuskel gibt Milchsäure ab, statt sie zu verbrauchen. Daher
ist ein Anstieg der koronarvenösen Lactatkonzentration (genauer: ein
Absinken des arterio-venösen Quotienten) ein klinischer Indikator für
eine Myokardhypoxie. Abbildung ganz oben).
Abbildung ganz oben). | Die linke Koronararterie wird während der Systole vom Myokard komprimiert. Sie wird hauptsächlich während der Diastole durchblutet |
 Belastung und Sauerstoffbedarf des Herzmuskels läßt sich grob aus dem Produkt aus Herzfrequenz (min-1) und systolischem Druck (mmHg) abschätzen (rate-pressure product - hoch: >30.000, niedrig: <15.000, bei körperlicher Ruhe deutlich niedriger).
Daraus ergibt sich, dass z.B. bei gegebenem Blutdruck eine niedrigere
Herzfrequenz wesentlich zur Effizienz der Sauerstoffversorgung beiträgt
(Sportlerherz: Niedrige Ruhe-Schlagfrequenz). Eine hohe Schlagfrequenz
steigert das Risiko einer Unterversorgung (kardiale Ischämie).
Belastung und Sauerstoffbedarf des Herzmuskels läßt sich grob aus dem Produkt aus Herzfrequenz (min-1) und systolischem Druck (mmHg) abschätzen (rate-pressure product - hoch: >30.000, niedrig: <15.000, bei körperlicher Ruhe deutlich niedriger).
Daraus ergibt sich, dass z.B. bei gegebenem Blutdruck eine niedrigere
Herzfrequenz wesentlich zur Effizienz der Sauerstoffversorgung beiträgt
(Sportlerherz: Niedrige Ruhe-Schlagfrequenz). Eine hohe Schlagfrequenz
steigert das Risiko einer Unterversorgung (kardiale Ischämie). Liegt z.B. der systolische Blutdruck bei 120 mmHg und die Herzfrequenz bei 60 bpm, beträgt der rate-pressure-Wert 7200.
Liegt z.B. der systolische Blutdruck bei 120 mmHg und die Herzfrequenz bei 60 bpm, beträgt der rate-pressure-Wert 7200.  Ein Belastungs-EKG
zeigt auf, ob die Blutversorgung des Myokards auch bei entsprechender
Steigerung der Muskelarbeit gewährleistet ist (d.h. keine
Ischämiezeichen auftreten). Bei Schädigung des Herzmuskels treten
vermehrt Enzyme
(Troponin
Ein Belastungs-EKG
zeigt auf, ob die Blutversorgung des Myokards auch bei entsprechender
Steigerung der Muskelarbeit gewährleistet ist (d.h. keine
Ischämiezeichen auftreten). Bei Schädigung des Herzmuskels treten
vermehrt Enzyme
(Troponin  , CK - Kreatinkinase
, CK - Kreatinkinase  , LDH - Lactatdehydrogenase, AST -
Aspartat-Transaminase u.a.) aus dem Myokard aus, ihre Konzentration im
Blut steigt auf unphysiologisch hohe Werte an. Die Enzymanstiege sind
unterschiedlich spezifisch: Der Troponintest ist empfindlich und
myokardtypisch, der Anstieg weiterer Enzyme kann auch andere Ursachen
haben (z.B. Verletzung der Skelettmuskulatur, Leberschaden).
, LDH - Lactatdehydrogenase, AST -
Aspartat-Transaminase u.a.) aus dem Myokard aus, ihre Konzentration im
Blut steigt auf unphysiologisch hohe Werte an. Die Enzymanstiege sind
unterschiedlich spezifisch: Der Troponintest ist empfindlich und
myokardtypisch, der Anstieg weiterer Enzyme kann auch andere Ursachen
haben (z.B. Verletzung der Skelettmuskulatur, Leberschaden).  Ein
herausragendes kardiologisches Problem ist die koronare Herzkrankheit
(KHK): Sie stellt eine der häufigsten Todesursachen in westlichen
Industrieländern dar. Aufgrund mangelhafter koronarer Durchblutung ist
die
Sauerstoffversorgung des Myokards unzureichend. Es kommt zu Änderungen
im EKG (Ischämiezeichen) und zum Anstieg von Enzymwerten im Blutplasma.
Eine KHK kann sich manifestieren als Myokardinfarkt, angina pectoris (über Schmerzlokalisationen auf die Haut
Ein
herausragendes kardiologisches Problem ist die koronare Herzkrankheit
(KHK): Sie stellt eine der häufigsten Todesursachen in westlichen
Industrieländern dar. Aufgrund mangelhafter koronarer Durchblutung ist
die
Sauerstoffversorgung des Myokards unzureichend. Es kommt zu Änderungen
im EKG (Ischämiezeichen) und zum Anstieg von Enzymwerten im Blutplasma.
Eine KHK kann sich manifestieren als Myokardinfarkt, angina pectoris (über Schmerzlokalisationen auf die Haut  s. dort),
Herzrhythmusstörung oder plötzlicher Herztod. Die KHK wird akut durch
Senkung des myokardialen Sauerstoffverbrauchs behandelt, und
allgemein durch Bekämpfung von Risikofaktoren, wie Rauchen oder
Bluthochdruck.
s. dort),
Herzrhythmusstörung oder plötzlicher Herztod. Die KHK wird akut durch
Senkung des myokardialen Sauerstoffverbrauchs behandelt, und
allgemein durch Bekämpfung von Risikofaktoren, wie Rauchen oder
Bluthochdruck. Durchblutungsbehinderung und Sauerstoffmangel im Myokard schädigt die
Herzmuskelzellen (Myokardinfarkt), was zu Steigerung der
sarkoplasmatischen Ca++-Konzentration,
Absinken des intrazellulären pH und dadurch Verschluss der gap
junctions (elektrische Synapsen) führt. Dies bewirkt, dass das
betroffene Gewebe von seiner Umgebung elektrophysiologisch abgekoppelt
wird und die Ausbreitung der Schädigung begrenzt bleibt.
Durchblutungsbehinderung und Sauerstoffmangel im Myokard schädigt die
Herzmuskelzellen (Myokardinfarkt), was zu Steigerung der
sarkoplasmatischen Ca++-Konzentration,
Absinken des intrazellulären pH und dadurch Verschluss der gap
junctions (elektrische Synapsen) führt. Dies bewirkt, dass das
betroffene Gewebe von seiner Umgebung elektrophysiologisch abgekoppelt
wird und die Ausbreitung der Schädigung begrenzt bleibt.

 Das Myokard ist
auf fortwährende Versorgung mit Sauerstoff angewiesen - durch den Koronarkreislauf, der 4-5% des Herzminutenvolumens beansprucht. Die Differenz zwischen maximaler und basaler koronarer Perfusion bezeichnet man als koronare Reserve. Bei
ungenügender Durchblutung nimmt die Kontraktionskraft rasch ab. Der
Sauerstoffbedarf beträgt bei körperlicher Ruhe ~10 ml/min/100g (10% des
Ganzkörperverbrauchs) und kann sich bei schwerer körperlicher Arbeit
verfünffachen. Die Herzkranzgefäße werden während der Systole
komprimiert, 80% der Durchblutung erfolgen während der Diastole.
Abschätzen lässt sich der myokardiale Sauerstoffverbrauch über den
Tension-time Index, meist berechnet als das Produkt aus mittlerem
systolischem Ventrikeldruck, Austreibungszeit und Herzfrequenz Das Myokard ist
auf fortwährende Versorgung mit Sauerstoff angewiesen - durch den Koronarkreislauf, der 4-5% des Herzminutenvolumens beansprucht. Die Differenz zwischen maximaler und basaler koronarer Perfusion bezeichnet man als koronare Reserve. Bei
ungenügender Durchblutung nimmt die Kontraktionskraft rasch ab. Der
Sauerstoffbedarf beträgt bei körperlicher Ruhe ~10 ml/min/100g (10% des
Ganzkörperverbrauchs) und kann sich bei schwerer körperlicher Arbeit
verfünffachen. Die Herzkranzgefäße werden während der Systole
komprimiert, 80% der Durchblutung erfolgen während der Diastole.
Abschätzen lässt sich der myokardiale Sauerstoffverbrauch über den
Tension-time Index, meist berechnet als das Produkt aus mittlerem
systolischem Ventrikeldruck, Austreibungszeit und Herzfrequenz Der Sauerstoffpartialdruck in den Herzmuskelzellen beträgt 5-20 mmHg, im arteriellen Blut ~100 mmHg. Myoglobin ist bei 5 mmHg pO2
noch zu ~50% sauerstoffgesättigt. Die spezifische Sauerstoffaufnahme
des Myokards beträgt bei körperlicher Ruhe ~8 ml/min/100g, dieser Wert
kann sich bei körperlicher Ausbelastung verfünffachen, vor allem durch
erhöhte Durchblutung, die Sauerstoffausschöpfung lässt sich nur von ~65 auf 90% erhöhen.
Die Steigerung der Durchblutung wird durch metabolische und endothelial
bedingte Hyperämie / Autoregulation erreicht. Im Myokard sind
die Austauschflächen sehr groß, die Diffusionsstrecken gering. Etwa die
Hälfte der Energie eines Herzzyklus wird in der Anspannungszeit
konsumiert Der Sauerstoffpartialdruck in den Herzmuskelzellen beträgt 5-20 mmHg, im arteriellen Blut ~100 mmHg. Myoglobin ist bei 5 mmHg pO2
noch zu ~50% sauerstoffgesättigt. Die spezifische Sauerstoffaufnahme
des Myokards beträgt bei körperlicher Ruhe ~8 ml/min/100g, dieser Wert
kann sich bei körperlicher Ausbelastung verfünffachen, vor allem durch
erhöhte Durchblutung, die Sauerstoffausschöpfung lässt sich nur von ~65 auf 90% erhöhen.
Die Steigerung der Durchblutung wird durch metabolische und endothelial
bedingte Hyperämie / Autoregulation erreicht. Im Myokard sind
die Austauschflächen sehr groß, die Diffusionsstrecken gering. Etwa die
Hälfte der Energie eines Herzzyklus wird in der Anspannungszeit
konsumiert  Der Herzmuskel
nutzt aerobe Energiegewinnung. Unmittelbare Energiequelle sind ATP und
Kreatinphosphat (CP) (reicht für 10-15 Systolen). Normalerweise
sind der intrazelluäre ATP- und CP- Spiegel ziemlich konstant. Die
Nachlieferung an Energie erfolgt im Ruhezustand vorwiegend über
Fettsäuren und Triglyzeride (60-90%), bei intensiver körperlicher
Belastung vorwiegend über Lactat (~60%) - die koronararterielle Lactatkonzentration ist
höher als die koronarvenöse (bei Ischämie kann sich das umkehren). Für die Metabolisierung von Fettsäuren ist Carnitin notwendig. Das Herz wird vor allem durch Druckarbeit belastet (Schonung des Myokard durch verringerte Nachlast), auch ist der Energieverbrauch proportional der
Herzfrequenz (Frequenzsenkung entlastet das Herz) Der Herzmuskel
nutzt aerobe Energiegewinnung. Unmittelbare Energiequelle sind ATP und
Kreatinphosphat (CP) (reicht für 10-15 Systolen). Normalerweise
sind der intrazelluäre ATP- und CP- Spiegel ziemlich konstant. Die
Nachlieferung an Energie erfolgt im Ruhezustand vorwiegend über
Fettsäuren und Triglyzeride (60-90%), bei intensiver körperlicher
Belastung vorwiegend über Lactat (~60%) - die koronararterielle Lactatkonzentration ist
höher als die koronarvenöse (bei Ischämie kann sich das umkehren). Für die Metabolisierung von Fettsäuren ist Carnitin notwendig. Das Herz wird vor allem durch Druckarbeit belastet (Schonung des Myokard durch verringerte Nachlast), auch ist der Energieverbrauch proportional der
Herzfrequenz (Frequenzsenkung entlastet das Herz) Das Endothel
der Koronargefäße produziert laufend NO, andererseits bewirkt
konstanter Sympathikuseinfluss einen stetigen Gefäßtonus; die größeren
Koronargefäße haben α-Rezeptoren (Kontraktion), kleinere ß2-Rezeptoren
(Dilatation). Aktivitätssteigerung
setzt vasoaktive Stoffe frei (Adenosin, Kalium- und Wasserstoffionen,
NO, Prostazyklin), welche die Arteriolen erweitern, den
Strömungswiderstand senken und die Perfusion auf ein Mehrfaches erhöhen. Die Koronargefäße
werden bei gesteigerter Perfusion geweitet, was den Strömungswiderstand
senkt. Serotonin, Bradykinin, Histamin können über Anregung
endothelialer NO-Produktion ebenfalls das koronare Blutangebot steigern Das Endothel
der Koronargefäße produziert laufend NO, andererseits bewirkt
konstanter Sympathikuseinfluss einen stetigen Gefäßtonus; die größeren
Koronargefäße haben α-Rezeptoren (Kontraktion), kleinere ß2-Rezeptoren
(Dilatation). Aktivitätssteigerung
setzt vasoaktive Stoffe frei (Adenosin, Kalium- und Wasserstoffionen,
NO, Prostazyklin), welche die Arteriolen erweitern, den
Strömungswiderstand senken und die Perfusion auf ein Mehrfaches erhöhen. Die Koronargefäße
werden bei gesteigerter Perfusion geweitet, was den Strömungswiderstand
senkt. Serotonin, Bradykinin, Histamin können über Anregung
endothelialer NO-Produktion ebenfalls das koronare Blutangebot steigern |
