

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert

© H. Hinghofer-Szalkay
 Anabolismus: ανα-βολισμός = Hinauf-wurf (βάλλειν = werfen)
Anabolismus: ανα-βολισμός = Hinauf-wurf (βάλλειν = werfen)
Energie: εν = innen, ἔργον = Wirken
Enzym: ἐν = in, ζύμη = Hefe, Sauerteig
Glykogen: γλυκύς = süß, γενεά = Abstammung
Katabolismus: κατα-βολισμός = Herab-wurf, Kräfteverfall
Metabolismus: μετα = (her)um, βάλλειν = werfen
Mitochondrium: μίτος = Faden, χόνδρος = Korn (sehen lichtmikroskopisch wie aufgefädelte Körnchen aus)
Oxid(ation): ὀξύς = sauer, scharf (Oxy-gen: γεννάω = erzeugen;
Sauerstoff wurde im 18. Jh. als Grundkomponente zur Bildung von Säuren
gesehen, z.B. Carbonate, Nitrate, Phosphate, Sulfate)
Der Stoffwechsel verknüpft Auf-, Ab- und Umbauvorgänge im Organismus:
-- Einerseits liefert der Abbau (Katabolismus: Exergone Prozesse setzen Energie frei) neben Endprodukten (wie CO2, H2O und NH3) energiereiche Phosphate (ATP) - Elektronenübertragung in der Atmungskette spielt dabei eine zentrale Rolle
-- andererseits synthetisiert der Anabolismus aus organischen Bausteinen (Zucker, Aminosäuren..) größere Moleküle (Proteine, Polysaccharide, Lipide, Nukleinsäuren) - die zugrundeliegenden endergonen Prozesse liegen thermodynamisch ungünstig, d.h. sie konsumieren Energie.
Als Energiespeicher dienen vor allem Glykogen (Leber- und Muskelzellen) und
Neutralfette (Fettzellen). Glykolyse bis zur Brenztraubensäure (Pyruvat) liefert
auch ohne Sauerstoff Energie (anaerob),
wesentlich rascher als im aeroben Weg, allerdings nur für kurze Zeit
und um den Preis der Laktazidose (Ansäuerung durch Milchsäure). Die weitere "Verbrennung" bis zu Kohlendioxid erfolgt unter
Verbrauch von Sauerstoff (Mitochondrien) und ist viel ertragreicher als
der anaerobe Weg, benötigt aber mehr Zeit für seinen Ablauf.
Die ATP-Synthese in den Mitochondrien erfolgt mittels Enzymen der Atmungskette.
Diese bauen einen pH-Gradienten auf, der die ATP-Synthese antreibt: Sie
nutzt die Diffusion von Protonen zum Aufbau von ATP. Dabei wird
Sauerstoff für die Oxidation von Nahrungsstoffen benötigt,
Elektronen werden für die Energiegewinnung frei und auf Sauerstoff
übertragen - das Resultat ist “Oxidationswasser” (~0,3 Liter
pro Tag).
Für den Körper gilt: Die Größe des Energieumsatzes ist proportional der Hautoberfläche (Wärmeverlust!), dieser Betrag dient auch zur Normierung physiologischer Größen wie des cardiac index (~3 l/min/m2) oder der glomerulären Filtration (~120 ml/min/1,73 m2).
|
Übersicht  Energie für metabolische Reaktionen
Energie für metabolische Reaktionen  Sauerstoffverbrauch und Anabolismus
Sauerstoffverbrauch und Anabolismus  Abschätzung der Hautoberfläche
Abschätzung der Hautoberfläche  Mitochondrien
Mitochondrien


Exergone / endergone Reaktionen  Energie, Arbeit
Energie, Arbeit  Spezifischer Sauerstoffverbrauch
Spezifischer Sauerstoffverbrauch  Oxidative Phosphorylierung
Oxidative Phosphorylierung  ß-Oxidation
ß-Oxidation  Acetyl-Coenzym A
Acetyl-Coenzym A  Transkriptom
Transkriptom
 Core messages
Core messages
Energie
ist die Voraussetzung dafür, dass ein System Aktivität entfalten kann.
Alle lebenden Systeme benötigen sie, um Moleküle auf- und umzubauen, zu
wachsen, sich zu vermehren, sich zu erhalten und zu regenerieren (Stoffwechsel, Metabolismus  ). Sie
beziehen die dafür nötige Energie aus ihrer Umwelt - ob in Form von
Licht, Wärme, mechanischer, elektrischer oder chemischer Energie.
). Sie
beziehen die dafür nötige Energie aus ihrer Umwelt - ob in Form von
Licht, Wärme, mechanischer, elektrischer oder chemischer Energie.
Bioenergetik beschäftigt sich
damit, wie Organismen Energie aus ihrer Umwelt beziehen, um sie in
ihrem Stoffwechsel zu nutzen und damit Lebensvorgänge anzutreiben. Dazu
sind chemische Reaktionen notwendig: "Substrate" werden dabei zu
"Produkten". Dabei unterscheidet man verschiedene Typen der Reaktion:
 Kombination - Substrate A + B werden zum Produkt C
Kombination - Substrate A + B werden zum Produkt C
 Abbau (decomposition) - Substrat A wird zu Produkten D + E
Abbau (decomposition) - Substrat A wird zu Produkten D + E
 Austausch - z.B. A + BC wird zu AB + C
Austausch - z.B. A + BC wird zu AB + C
Wie rasch eine solche Veränderung erfolgt, kann durch verschiedene
Kennzahlen angegeben werden (z.B. Reaktionsrate: Menge umgesetzter
Teilchen pro Zeit, angegeben z.B. in mol /s).
So können Zellen Energie von einem Molekül auf ein anderes übertragen
oder Energie chemisch speichern - diese kann dann später bei Bedarf
abgerufen werden. Potentielle Energie, die in den Bindungen eines
Biomoleküls gespeichert ist und verfügbar gemacht werden kann, ist die
"freie Energie" dieses Moleküls. Je mehr Bindungen, desto mehr freie
Energie: Beispielsweise verfügt das Glucosepolymer Glykogen über mehr
freie Energie als Glucose, und diese wiederum über mehr freie Energie
als Kohlendioxid und Wasser (aus denen Glucose aufgebaut ist).
Bringt
eine Zelle potenzielle Reaktionspartner zusammen, ist dies alleine
meist zu wenig, um eine Reaktion zwischen ihnen zu initiieren. Es
bedarf dann einer Aktivierungsenergie ( Abbildung), die investiert werden muss, um die Reaktion ablaufen zu lassen. Enzyme können die nötige Aktivierungsenergie reduzieren
(die Schwelle zur Überwindung des Gipfels herabsetzen). Die
Netto-freie Energie der Reaktion ist die Differenz der freien Energie
des Substrats / der Substrate (Beginn der Reaktion) einerseits, und des
Produkts / der Produkte (Ende der Reaktion) andererseits.
Abbildung), die investiert werden muss, um die Reaktion ablaufen zu lassen. Enzyme können die nötige Aktivierungsenergie reduzieren
(die Schwelle zur Überwindung des Gipfels herabsetzen). Die
Netto-freie Energie der Reaktion ist die Differenz der freien Energie
des Substrats / der Substrate (Beginn der Reaktion) einerseits, und des
Produkts / der Produkte (Ende der Reaktion) andererseits.
Nach Ablauf der Reaktion tragen die entstandenen Produkte ein Ausmaß an
freier Energie mit sich, das sich von dem der Ausgangsstoffe
(Substrate) meist unterscheidet: Entweder, die freie Energie hat
abgenommen, oder sie ist angestiegen. Ist das Ausmaß an freier Energie
der an der Reaktion beteiligten Moleküle gesunken, hat die Reaktion Energie freigesetzt, sie war exergon.
Oder aber das Ausmaß der freien Energie der Produkte ist größer als das
der Substrate, dann hat die in den Molekülen gespeicherte freie Energie
zugenommen, die Reaktion hat Energie verbraucht, sie war endergon ( Abbildung).
Abbildung).
 Endergone Reaktionen verbrauchen Energie, exergone setzen Energie frei.
Endergone Reaktionen verbrauchen Energie, exergone setzen Energie frei.

 Abbildung: Änderung der freien Energie bei exergonen und endergonen Reaktionen
Abbildung: Änderung der freien Energie bei exergonen und endergonen Reaktionen
Nach einer Vorlage in Silverthorn, Human Physiology - an integrated approach, 4th ed. 2007 (Pearson International)
Exergone
Reaktionen (links) setzen Energie frei, da ihre Produkte weniger freie
Energie enthalten als die Substrate. Diese Energie kann von der Zelle
genutzt werden, um andere Reaktionen (z.B. Synthesen) anzutreiben.
Endergone Reaktionen (rechts)
nehmen in die Produktmoleküle Energie auf, die sie aus exergonen
Reaktionen gewinnen können. Synthesevorgänge sind endergon

Was hat
es mit exergonen und endergonen Reaktionsabläufen im Organismus an
sich? Ein Beispiel einer grundlegenden exergonen Reaktion ist Spaltung
von ATP, dem universellen Direkt-Energiespender der Zelle, an der
energiereichen Phosphatbindung:
ATP + H2O → ADP + H+ + Pi + Energie
Die bei dieser Dekomposition frei gewordene Erergie kann z.B. für Bewegung und Kraftentfaltung (z.B. in Muskelzellen) oder (im Rahmen endergoner Reaktionen) für den Aufbau verschiedenster Biomoleküle verwendet werden.
Energie, die im Rahmen endergoner Reaktionen (z.B. für die Synthese von
Glycogen aus Glucose) gespeichert wurde, wird bei Umkehr der Reaktion
(z.B. Glucose aus Glycogen - exergon) wieder frei (und für andere
Zwecke nutzbar).
Freie Energie treibt Lebensvorgänge an
Bindungsstärke, Reaktionswahrscheinlichkeit und Metabolismus: Stoffwechsel bedeutet, dass die Zelle Verbindungen auflöst (Hydrolyse - energetisch "günstig") oder herstellt (Kondensation), um Moleküle zu spalten oder aus Bausteinmolekülen komplexere Verbindungen herzustellen.
Letzteres (Kondensationsreaktion) ist energetisch "ungünstig" (Änderung
der freien Energie ΔG positiv, d.h. >0) und nur durch Koppelung an
eine andere Reaktion möglich, die ein zulänglich (=stärker) negatives ΔG hat und die Kondensationsreaktion energetisch "bergauf" anhebt, also freie Energie abgibt oder "überträgt" (Reaktionskoppelung).
 Unter Energie versteht
man die Fähigkeit eines Systems, Arbeit (bei einem Vorgang umgesetzte Energiemenge; Kraft mal Weg) zu verrichten
(mechanisch, chemisch, thermisch oder elektrisch). Als freie Energie (Symbol: G
Unter Energie versteht
man die Fähigkeit eines Systems, Arbeit (bei einem Vorgang umgesetzte Energiemenge; Kraft mal Weg) zu verrichten
(mechanisch, chemisch, thermisch oder elektrisch). Als freie Energie (Symbol: G  ) wird
in der Physiologie eine Energie bezeichnet, welche für Lebensvorgänge
verfügbar ist - die Zelle bringt sie auf, um "Ordnung zu schaffen" und
notwendige Reaktionen
(Hydrolyse von
ATP, Lösung von Kohlenstoffbindungen, Oxidation von Energieträgern,
Proteinsynthese etc.) anzutreiben, fern vom chemischen Gleichgewicht.
) wird
in der Physiologie eine Energie bezeichnet, welche für Lebensvorgänge
verfügbar ist - die Zelle bringt sie auf, um "Ordnung zu schaffen" und
notwendige Reaktionen
(Hydrolyse von
ATP, Lösung von Kohlenstoffbindungen, Oxidation von Energieträgern,
Proteinsynthese etc.) anzutreiben, fern vom chemischen Gleichgewicht.
So muss z.B. eine konkrete Energiemenge zugeführt
werden, um eine bestimmte Bindung zu lösen - ihre Bindungsstärke, angegeben in kJ/mol ( Abbildung).
Abbildung).


Abbildung: Bindungsstärken
Modifiziert nach einer Vorlage bei Alberts et al, Molecular Biology of the Cell, Garland 2008
Die Stärke einer Bindung entspricht
der Energiemenge (kJ/mol), die zu ihrer Auflösung zugeführt werden
muss.
So ist die durchschnittliche thermische Bewegung (links) in einer
Zelle nicht ausreichend, um Bindungen zu lösen. Kovalente C-C-Bindungen
sind um ~2 Zehnerpotenzen stärker als nichtkovalente
(Wasserstoffbrücken)
 Beispielsweise bezieht die Zelle freie Energie für ihre anabolen Reaktionen (Synthesevorgänge) meist aus der Koppelung an die Spaltung von ATP
(Adenosintriphosphat). Dieses entsteht durch Nutzung freier Energie aus
Nahrungsstoffen, die letztlich von Pflanzenzellen mit Hilfe von
Sonnenenergie synthetisiert wurden.
Beispielsweise bezieht die Zelle freie Energie für ihre anabolen Reaktionen (Synthesevorgänge) meist aus der Koppelung an die Spaltung von ATP
(Adenosintriphosphat). Dieses entsteht durch Nutzung freier Energie aus
Nahrungsstoffen, die letztlich von Pflanzenzellen mit Hilfe von
Sonnenenergie synthetisiert wurden.
Zum Anstoßen jeder Reaktion (auch einer energetisch "günstigen") ist ein bestimmter Energiebetrag notwendig. Dieser liegt über
dem durchschnittlichen Energiebetrag, den die Wärmebewegung
("Molekularbewegung") liefert - ansonsten wären die
Verbindungen durch spontanen Zerfall gefährdet, also instabil.
(Andererseits dürfen die für eine Reaktion notwendigen Energien nicht
zu hoch sein, weil dann kein Stoffwechsel mehr erfolgen könnte.) Eine Bindung ist umso stabiler, je größer der Energiebetrag ist, der zu ihrer Spaltung aufgebracht werden muss ( Abbildung).
Abbildung).
Die
Veränderung an freier Energie (ΔG) in einem lebenden System bedingt
dessen Dynamik. Hat eine Reaktion z.B. die Form A + B  C + D, dann ist die Änderung der freien Energie proportional zu
([C].[D]) / ([A].[B]). Änderungen der Stoffkonzentrationen verändern
auch die Dynamik der Reaktion: Steigen die Beträge für [A] oder [B],
läuft die Reaktion leichter nach rechts, und steigen sie für [C] oder
[D], leichter nach links ab.
C + D, dann ist die Änderung der freien Energie proportional zu
([C].[D]) / ([A].[B]). Änderungen der Stoffkonzentrationen verändern
auch die Dynamik der Reaktion: Steigen die Beträge für [A] oder [B],
läuft die Reaktion leichter nach rechts, und steigen sie für [C] oder
[D], leichter nach links ab.
Die meisten Reaktionen in der Zelle können in beiden Richtungen
ablaufen (sie sind reversibel). Welche Richtung in einer bestimmten
Situation bevorzugt wird, hängt nicht nur von den jeweiligen
Stoffkonzentrationen ([A], [B], [C], [D]) ab, sie kann auch von Enzymen
gesteuert werden, die jeweils eine Reaktion begünstigen. Bildung und
Abbau von Enzymen sind wiederum von verschiedenen Faktoren abhängig -
außer aktuellen Konzentrationswerten der Reaktionspartner z.B. von
hormonellen Einflüssen.
Kopplung und Energiespeicherung:
Im Stoffwechsel
können endergone Reaktionen an exergone gekoppelt werden, sodass die
exergonen (die "nützliche" Energie beisteuern können) endergone
antreiben. Dazu müssen allerdings die beiden Reaktionen gleichzeitig
und an derselben Stelle ablaufen, was oft nicht sinnvoll wäre.
Stattdessen kann die Energie aus einer exergonen Reaktion
zwischengespeichert werden - meist in Form hochenergetischer Bindungen
in Nukleotiden (NADH, FADH2, NADPH). NADH und FADH2 übertragen üblicherweise solche Energie auf ATP, das dann endergone Reaktionen antreiben kann.
Enzymatische Steuerung. Biochemische Reaktionen erfolgen nicht spontan, sondern müssen über eine Energieschwelle (Aktivierungsenergie) gehoben werden, um ablaufen zu können. Diese Aktivierungsenergie wird durch Interaktion mit Enzymen erniedrigt, die den Reaktionspartnern "zueinanderhelfen". Die Expression
verschiedener Enzyme ist von Zelle zu Zelle und von Zustand zu Zustand
unterschiedlich, so werden Richtung und Intensität der metabolischen
Reaktionen gesteuert.
Sauerstoffverbrauch und Anabolismus
 Zu Energie und Energieeinheiten s. dort
Zu Energie und Energieeinheiten s. dort
Der tägliche Energieverbrauch einer erwachsenen Person beträgt etwa 10 MJ (Megajoule: 106 J - 1 MJ = 0,278 kWh) - abhängig von spezifischer Stoffwechselintensität,
Körperoberfläche, Alter, Geschlecht, Trainingszustand, körperlicher Belastung und Umgebungsbedingungen (Temperatur). Diese Energie  wird
weitgehend durch Oxidationsvorgänge im Zellstoffwechsel bereitgestellt.
Der Verbrauch an Sauerstoff
einer erwachsenen Person beträgt rund 0,3 Liter/Minute (ebenfalls abhängig von
den genannten Größen), er entspricht dem
Energieumsatz und kann daher zu dessen Berechnung herangezogen werden (indirekte Kalorimetrie).
wird
weitgehend durch Oxidationsvorgänge im Zellstoffwechsel bereitgestellt.
Der Verbrauch an Sauerstoff
einer erwachsenen Person beträgt rund 0,3 Liter/Minute (ebenfalls abhängig von
den genannten Größen), er entspricht dem
Energieumsatz und kann daher zu dessen Berechnung herangezogen werden (indirekte Kalorimetrie).
 Als spezifischen Sauerstoffverbrauch bezeichnet man die Verstoffwechselung von Sauerstoff (quantifiziert z.B. in ml O2/min)
pro Masseneinheit (z.B. pro 100 Gramm Gewebe). Je größer der aktuelle
Energiebedarf des Gewebes, desto höher sein spezifischer
Sauerstoffverbrauch. Eine erwachsene Person verbraucht im Ruhezustand pro Minute 4,0-4,5 ml O2/min/kg KG (bei 70 kg KG ergibt das ungefähr 0,3 l/min).
Als spezifischen Sauerstoffverbrauch bezeichnet man die Verstoffwechselung von Sauerstoff (quantifiziert z.B. in ml O2/min)
pro Masseneinheit (z.B. pro 100 Gramm Gewebe). Je größer der aktuelle
Energiebedarf des Gewebes, desto höher sein spezifischer
Sauerstoffverbrauch. Eine erwachsene Person verbraucht im Ruhezustand pro Minute 4,0-4,5 ml O2/min/kg KG (bei 70 kg KG ergibt das ungefähr 0,3 l/min).
Die Bereitstellung von Nahrung mit ausreichendem nutzbaren Energiegehalt (physiologischer Brennwert) ist global sehr unterschiedlich verteilt. Wie schwierig die
Produktion adäquater Ernährung sein kann, zeigt sich u.a. an der Problematik
materiell geschlossener bioregenerativer Lebenserhaltungssysteme.
 Da
in der Biosphäre durch Photosynthese Sauerstoff in die
Atmosphäre abgegeben wird (21 Vol-%), können Lebewesen mit
entsprechender Enzymausstattung
Da
in der Biosphäre durch Photosynthese Sauerstoff in die
Atmosphäre abgegeben wird (21 Vol-%), können Lebewesen mit
entsprechender Enzymausstattung  diesen zur Bereitstellung von Stoffwechselenergie nützen. Aufgrund unterschiedlicher Genexpression und Enzymausstattung ist der Stoffwechsel gewebespezifisch gestaltet.
diesen zur Bereitstellung von Stoffwechselenergie nützen. Aufgrund unterschiedlicher Genexpression und Enzymausstattung ist der Stoffwechsel gewebespezifisch gestaltet.
 Unter einem Transkriptom versteht man die Gesamtheit aller zu einem bestimmten Zeitpunkt von einer Zelle hergestellten RNS-Moleküle.
Unter einem Transkriptom versteht man die Gesamtheit aller zu einem bestimmten Zeitpunkt von einer Zelle hergestellten RNS-Moleküle.

 Abbildung: Energietransfer in der Zelle
Abbildung: Energietransfer in der Zelle
Exergone
(katabole) Reaktionen liefern Energie für die Synthese von ATP, die
dann für endergone (anabole) Vorgänge konsumiert werden kann. Eine
typische Zelle setzt ~107 ATP-Moleküle pro Sekunde um, entsprechend einem Umsatz ihres gesamten ATP-Bestandes alle 1-2 Minuten.
Der gesamte Organismus setzt größenordnungsmäßig 1g ATP pro Minute um
 Dabei wirkt im Körper ein wechselseitiges Netzwerk: Abbauvorgänge
(katabole Prozesse) liefern Energie, die - vor allem in Form von
Adenosintriphosphat (ATP) - an anderer Stelle für Aufbauvorgänge (anabole Prozesse) verwendet werden kann. Diese
zwei großen Umsatzströme im Stoffwechsel (Metabolismus) sind durch
Energieübertragung miteinander verknüpft:
Dabei wirkt im Körper ein wechselseitiges Netzwerk: Abbauvorgänge
(katabole Prozesse) liefern Energie, die - vor allem in Form von
Adenosintriphosphat (ATP) - an anderer Stelle für Aufbauvorgänge (anabole Prozesse) verwendet werden kann. Diese
zwei großen Umsatzströme im Stoffwechsel (Metabolismus) sind durch
Energieübertragung miteinander verknüpft:

Abbau energieliefernder Nährstoffe (
Katabolismus 
:
exergone,
d.h. thermodynamisch günstige Prozesse - bei exergonen Prozessen liegt
das Gleichgewicht stärker auf der Seite der Reaktionsprodukte als bei
endergonen) zu Endprodukten wie CO
2, H
2O und NH
3
- dabei werden
energiereiche Phosphate gewonnen (via
Elektronenübertragung in der Atmungskette oder anderweitige
Energiegewinnung), und Hydrolyse von ATP erlaubt die Energieübertragung
auf anabole Prozesse:

Aufbau (
Anabolismus 
:
Endergone,
d.h. thermodynamisch ungünstige Prozesse - z.B. Aufbau eines Proteins
aus Aminosäuren) von organischen Grundbausteinen zu Makromolekülen
(Eiweiß,
Polysaccharide, Lipide, Nukleinsäuren).
Abschätzung der Hautoberfläche
Der basale Energieverbrauch hängt eng mit dem Ausmaß der Körperoberfläche (Body surface area, BSA) zusammen.

 Abbildung: Abschätzung der Hautoberfläche (in m2) aus Körpergröße (Ordinate; in cm) und Körpergewicht (Abszisse; in kg)
Abbildung: Abschätzung der Hautoberfläche (in m2) aus Körpergröße (Ordinate; in cm) und Körpergewicht (Abszisse; in kg)
Nach Daten bei Boyd E: The growth of the surface area in the human body. University of Minnesota Press 1935
Beispiel: Bei einem Körpergewicht von 80 kg und einer Körperlänge von 180 cm kann eine Hautoberfläche von ~2 m2 angenommen werden (roter Punkt)

 Der Betrag der Körperoberfläche ist nicht nur theoretisch interessant, sondern auch praktisch
wichtig, z.B. zur Abschätzung
Der Betrag der Körperoberfläche ist nicht nur theoretisch interessant, sondern auch praktisch
wichtig, z.B. zur Abschätzung
 des Wärmeverlusts,
des Wärmeverlusts,

 des Ausmaßes von
Hautdefekten (Verbrennung) oder
des Ausmaßes von
Hautdefekten (Verbrennung) oder

 des Medikamentenbedarfs (z.B.
Chemotherapie) von Patienten.
des Medikamentenbedarfs (z.B.
Chemotherapie) von Patienten.
Die Berechnung kann über zahlreiche
verschiedene Annäherungsformeln erfolgen, oder mit Hilfe von Nomogrammen ( Abbildung).
Abbildung).
Beispiele für die Körperoberfläche als Relativmaß ist z.B. der Cardiac index, d.h. das Herzminutenvolumen bezogen auf einen Quadratmeter Hautoberfläche (Normalwert ~3 l/min/m2, also z.B. bei zwei Quadratmetern Hautoberfläche 6 l/min), oder die glomeruläre Filtrationsleistung der Nieren (Normalwert ~120 ml/min/1,73 m2).
Mitochondrien nutzen Energie aus dem Transport von Elektronen
Eine Schlüsselaufgabe der Mitochondrien
 ist die Energiegewinnung unter
Sauerstoffverbrauch. Eine zentrale Stellung nimmt dabei die oxidative
Phosphorylierung ein:
ist die Energiegewinnung unter
Sauerstoffverbrauch. Eine zentrale Stellung nimmt dabei die oxidative
Phosphorylierung ein:
 Oxidative Phosphorylierung ist
die Phosphorylierung von ADP unter Verbrauch von Sauerstoff; dabei
entsteht ATP. Sie erfolgt über eine Elektronentransportkette
(Atmungskette), die (via mehrere Redoxsysteme, insbesondere die
Komplexe I bis IV) über die innere Mitochondrienmembran einen
pH-Gradienten generiert, der wiederum die ATP-Synthase antreibt. Oxidative Phosphorylierung erzeugt bei weitem mehr ATP als Glykolyse bzw. Citratzyklus. Schätzungsweise produziert der Mensch in 24 Stunden eine Menge ATP, die etwa der Hälfte seines Körpergewichts entspricht.
Oxidative Phosphorylierung ist
die Phosphorylierung von ADP unter Verbrauch von Sauerstoff; dabei
entsteht ATP. Sie erfolgt über eine Elektronentransportkette
(Atmungskette), die (via mehrere Redoxsysteme, insbesondere die
Komplexe I bis IV) über die innere Mitochondrienmembran einen
pH-Gradienten generiert, der wiederum die ATP-Synthase antreibt. Oxidative Phosphorylierung erzeugt bei weitem mehr ATP als Glykolyse bzw. Citratzyklus. Schätzungsweise produziert der Mensch in 24 Stunden eine Menge ATP, die etwa der Hälfte seines Körpergewichts entspricht.
 Exergone Reaktionen setzen Energie frei, die in ATP oder NADH gespeichert werden kann.
Exergone Reaktionen setzen Energie frei, die in ATP oder NADH gespeichert werden kann.
Ein hoher ATP/ADP-Quotient
(hohe Energieverfügbarkeit) senkt, ein niedriger ATP/ADP-Quotient (mehr
Energie wird benötigt) steigert das Ausmaß der oxidativen
Phosphorylierung in der betreffenden Zelle.
Oxidative Phosphorylierung findet
in allen Lebewesen mit aerobem Stoffwechsel statt, und zwar in
mitochondrienhältigen Zellen (Mitochondrien enthalten die für den
Vorgang notwendigen Komponenten). Dabei passieren Elektronen (in unterschiedlicher Form: e-, :H-, .H) mit zunächst hoher freier Energie ein komplexes System von Enzymen / Faktoren mit steigender Elektronenaffinität (steigendem Redoxpotential - dieses ist ein Maß für die Affinität eines Redoxsystems für Elektronen) an der inneren Mitochondrienmembran. Anders als bei der Knallgasreaktion (H2 + 1/2 O2 → H2O) - bei der Reaktionsenergie schlagartig verpufft - wird hier Energie stufenweise freigesetzt und biologisch genutzt. In der Mitochondrienmembran vorhandene Redoxsysteme mit niedrigem / negativem Redoxpotential geben dabei Elektronen an Redoxsysteme
mit hohem / positivem Redoxpotential weiter, verbunden mit der Nutzung
dabei verfügbar gewordener Energie. Das Ausmaß an (biologisch
verfügbarer) freier Energie nimmt dabei Schritt für Schritt ab.
 Der Elektronentransport ist ein exergoner Vorgang, d.h. er setzt Energie frei.
Der Elektronentransport ist ein exergoner Vorgang, d.h. er setzt Energie frei.
Die Komponenten
der Atmungskette sind also auf der inneren Mitochondrienmembran so
angeordnet, dass ihr Redoxpotential (ihre Affinität für Elektronen) in
der Richtung des Elektronenstroms schrittweise zunimmt - bis
Sauerstoffmoleküle am Komplex IV erreicht sind (und H2O entsteht).
 Sauerstoff
wirkt am Ende der mitochondrialen Elektronentrasportkette als Akzeptor
von Elektronen einerseits, und von Wasserstoffionen andererseits.
Sauerstoff
wirkt am Ende der mitochondrialen Elektronentrasportkette als Akzeptor
von Elektronen einerseits, und von Wasserstoffionen andererseits.
Der Vorgang beginnt damit, dass Elektronenakzeptoren (Komplex I, Komplex II) von einem Reduktionsmittel (NADH, FADH2 - hauptsächlich aus dem Citratzyklus) Elektronen übernehmen. Diese werden über mehrere Stationen (Coenzym
Q, Komplex III, Cytochrom C, Komplex IV) entlang der inneren
Mitochondrienmembran weitergereicht. Diese Sequenz des für den
Energiehaushalt unverzichtbaren Elektronentransports wird auch als Atmungskette bezeichnet.
Durch die
Verzahnung des Elektronentransports mit der Beförderung von Protonen
(über Redox-Systeme der Komplexe I, III und IV - "abgezweigte" Energie
wird zum Transport von Wasserstoffionen genutzt) wird H+ aus der Mitochondrienmatrix in den Intermembranraum gepumpt ( Abbildung). Dieser ist folglich
sauer (hohe [H+], niedriger pH-Wert).
Abbildung). Dieser ist folglich
sauer (hohe [H+], niedriger pH-Wert).
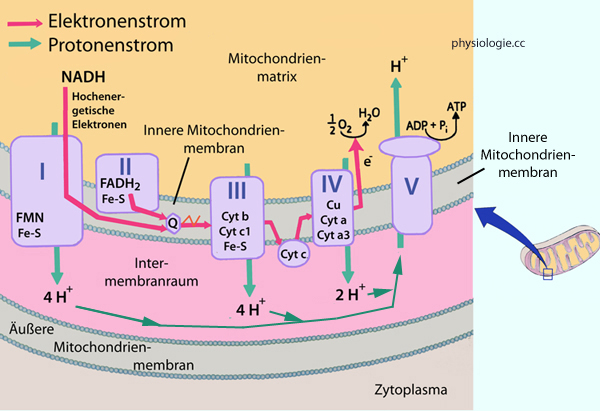
 Abbildung: Elektronentransport und ATP-Synthese durch oxidative Phosphorylierung
Abbildung: Elektronentransport und ATP-Synthese durch oxidative Phosphorylierung
Modifiziert nach einer Vorlage in Panini SR, Medical Biochemistry, 2nd ed. 2021 (Thieme)
Die Nukleotide NADH und FADH2 übertragen aus Glykolyse und Citratzyklus gewonnene metabolische
Energie auf Proteinkomplexe der mitochondriellen
Elektronentransportkette (Atmungskette) in der inneren
Mitochondrienmembran. Das treibt an den Komplexen I, III und IV H+-Ionen aus dem Matrix- in den Intermembranraum. Am Ende
dieser Transportkette haben die Elektronen ihr normales Energiemaß
erreicht und verbinden sich mit Wasserstoffionen und Sauerstoff zu H2O
("endogenes Wasser", ca. 0,3 l/d). Sauerstoff ist der terminale Elektronenakzeptor:
Er ist die letzte Substanz, die Elektronen im Rahmen der Atmungskette
aufnimmt.
Die durch den H+-Konzentrationsgradienten
aufgebaute potenzielle Energie wird in kinetische Energie
umgewandelt, wenn Wasserstoffionen durch die ATP-Synthase - aus dem
Intermembranraum in die Mitochondrienmatrix - (zurück) strömen. Ein
Teil dieser Energie wird von der Umwandlung von ADP zu ATP eingefangen.
Dabei ist die Separierung der mitochondriellen Matrix vom
Intermembranraum durch eine intakte innere Mitochondrienmembran
essentiell.
 vgl. Abbildung unten
vgl. Abbildung unten
FMN: Flavin-Mononukleotid, Fe-S: Ferredoxin (elektronenübertragendes
Protein), Q: Coenzym Q (Ubiquinon), Cyt = Cytochrom; Cu = Kupfer
Komplex I =
NADH-Hydrogenase, Komplex II = Succinat-Dehydrogenase, Komplex III =
Cytochrom c-Reduktase, Komplex IV = Cytochrom c-Oxidase, Komplex V =
ATP-Synthase

Vom Intermembranraum gelangen die H+-Ionen über Transporter (ATP-Synthasen, Komplex V) wieder in die Mitochondrienmatrix zurück. ATP-Synthasen bauen wie eine verkehrt laufende ATPase ATP auf statt es zu verbrauchen. Der H+-Strom treibt also die ATP-Synthese (ADP + P → ATP)
via ATP-Synthasen an, durch welche die Protonen - entsprechend ihrem
Konzentrationsgradienten - in die Mitochondrienmatrix zurückströmen.
 Oxidative Phosphorylierung beruht auf folgenden Komponenten:
Oxidative Phosphorylierung beruht auf folgenden Komponenten:
 Elektronentransfer von NADH und FADH2 auf O2 via Atmungskette
Elektronentransfer von NADH und FADH2 auf O2 via Atmungskette
 Aufbau eines Protonengradienten über die innere Mitochondrienmembran
Aufbau eines Protonengradienten über die innere Mitochondrienmembran
 ATP-Synthese via Protonenstrom durch die innere Mitochondrienmembran
ATP-Synthese via Protonenstrom durch die innere Mitochondrienmembran
Der komplette Abbau eines Moleküls Acetyl-CoA zu CO2 und H2O liefert 12 Moleküle energiereiches Phosphat (neun ATP aus der Oxidation von 3 NADH + H+, zwei von einem FADH2, und ein GTP aus der Reaktion der Succinyl-CoA-Synthetase (die Gleichgewichtskonstante GTP + ADP  GDP + ATP beträgt ungefähr 1).
GDP + ATP beträgt ungefähr 1).
Einige Details über die Komponenten der Atmungskette:
 Komplex I (NADH-Dehydrogenase): Dieses Transmembran-Protein überträgt Elektronen mittels mehreren integralen Bestandteilen: FMN (Flavin-Mononukleotid, phosphoryliertes Riboflavin, wirkt stärker oxidierend als NAD) und Fe-S-Clustern (Ferredoxine, elektronenübertragende Hämoproteine, die im Cytochrom-P-450-System Elektronen übertragen - mittels Eisen und Schwefel in unterschiedlichem Mengenverhältnis, z.B. Fe2-S2, Fe3-S4, Fe4-S4). Funktion: Komplex I nimmt einerseits von NADH zwei Elektronen (e-) auf und reicht sie an Coenzym Q weiter, andererseits pumpt es vier Wasserstoffionen (H+) aus der Matrix in den Intermembranraum.
Komplex I (NADH-Dehydrogenase): Dieses Transmembran-Protein überträgt Elektronen mittels mehreren integralen Bestandteilen: FMN (Flavin-Mononukleotid, phosphoryliertes Riboflavin, wirkt stärker oxidierend als NAD) und Fe-S-Clustern (Ferredoxine, elektronenübertragende Hämoproteine, die im Cytochrom-P-450-System Elektronen übertragen - mittels Eisen und Schwefel in unterschiedlichem Mengenverhältnis, z.B. Fe2-S2, Fe3-S4, Fe4-S4). Funktion: Komplex I nimmt einerseits von NADH zwei Elektronen (e-) auf und reicht sie an Coenzym Q weiter, andererseits pumpt es vier Wasserstoffionen (H+) aus der Matrix in den Intermembranraum.
 Komplex II (Succinat-Dehydrogenase) ist ein an der Matrixseite der inneren Membran befestigtes Protein. Funktion: Es fördert den Elektronentransfer (2 e-) von FADH2 auf Coenzym Q mittels FMN und Fe-S-Clustern.
Komplex II (Succinat-Dehydrogenase) ist ein an der Matrixseite der inneren Membran befestigtes Protein. Funktion: Es fördert den Elektronentransfer (2 e-) von FADH2 auf Coenzym Q mittels FMN und Fe-S-Clustern.
 Coenzym Q (Ubichinon-10, Q-10, ubiquinone
UQ) ist ein lipophiles Molekül (C6-Ring mit Isoprenoid-Seitenkette),
das sich frei in der inneren Mitochondrienmembran bewegen kann. Funktion: Es übernimmt 2 Elektronen von Komplex I oder II und überträgt sie auf Komplex III (es überträgt Elektronen auch von zytosolischem NADH, und von elektronentransferierendem Flavoprotein ETF im Rahmen der ß-Oxidation).
Coenzym Q (Ubichinon-10, Q-10, ubiquinone
UQ) ist ein lipophiles Molekül (C6-Ring mit Isoprenoid-Seitenkette),
das sich frei in der inneren Mitochondrienmembran bewegen kann. Funktion: Es übernimmt 2 Elektronen von Komplex I oder II und überträgt sie auf Komplex III (es überträgt Elektronen auch von zytosolischem NADH, und von elektronentransferierendem Flavoprotein ETF im Rahmen der ß-Oxidation).
 Komplex III (Cytochrom c-Reduktase) ist ein Transmembranprotein; es enthält Cytochrom b und c sowie Fe-S-Cluster mit eisenhältigen Häm-Molekülen. Funktion: Es übernimmt 2 e- von Ubiquinol, die es auf Cytochrom c überträgt; und pumpt 4 H+ aus der Matrix in den Intermembranraum.
Komplex III (Cytochrom c-Reduktase) ist ein Transmembranprotein; es enthält Cytochrom b und c sowie Fe-S-Cluster mit eisenhältigen Häm-Molekülen. Funktion: Es übernimmt 2 e- von Ubiquinol, die es auf Cytochrom c überträgt; und pumpt 4 H+ aus der Matrix in den Intermembranraum.
 Cytochrom c ist ein mobiles Protein, das sich an der Seite des Intermembranraums über die innere mitochondrielle Membran bewegt. Funktion:
Es übernimmt Elektronen von Komplex III und übergibt sie an Komplex IV
(dies wird durch eine eisenhältige Hämgruppe erleichtert).
Cytochrom c ist ein mobiles Protein, das sich an der Seite des Intermembranraums über die innere mitochondrielle Membran bewegt. Funktion:
Es übernimmt Elektronen von Komplex III und übergibt sie an Komplex IV
(dies wird durch eine eisenhältige Hämgruppe erleichtert).
Apoptotische
Reize wie Stress, Sauerstoffradikale oder DNA-Schäden machen die
Mitochondrienmembran undicht und bewirken die Freisetzung von Cytochrom
c. Das aktiviert Caspasen und triggert programmierten Zelltod.
 Komplex IV (Cytochrom c-Oxidase) ist ein Transmembranprotein, das Elektronen von Cytochrom c übernimmt und diese an Sauerstoff transferiert - es entsteht H2O - und pumpt 2 H+ aus der Matrix in den Intermembranraum. Kupfer, Cytochrome und Häm-a3 sind an diesem Vorgang beteiligt.
Komplex IV (Cytochrom c-Oxidase) ist ein Transmembranprotein, das Elektronen von Cytochrom c übernimmt und diese an Sauerstoff transferiert - es entsteht H2O - und pumpt 2 H+ aus der Matrix in den Intermembranraum. Kupfer, Cytochrome und Häm-a3 sind an diesem Vorgang beteiligt.
Die
Reduktion des Sauerstoffs über Cytochrom-a3-Hämoglobin - also der
letzte Schritt in der Elektronentransportkette - kann durch
Kohlenmonoxid verhindert werden, und zwar bereits bei sehr niedrigen
Anteilen in der Atemluft (s. dort).
 Komplex V (ATP-Synthase) ist ein komplexes Transmembranprotein. Die F0-Domäne
ermöglicht Protonen den Übertritt aus dem Intermembranraum in die
Matrix, die in die Matrix vorragende F1-Domäne die (durch den
Protonenstrom angetriebene) ATP-Synthese.
Komplex V (ATP-Synthase) ist ein komplexes Transmembranprotein. Die F0-Domäne
ermöglicht Protonen den Übertritt aus dem Intermembranraum in die
Matrix, die in die Matrix vorragende F1-Domäne die (durch den
Protonenstrom angetriebene) ATP-Synthese.
Mitochondrien sind folgendermaßen aufgebaut (von innen nach außen aufgezählt):
 Die mitochondrielle Matrix ist ein Reaktionsraum, in dem sich u.a. die ß-Oxidation von Fettsäuren, der Citratzyklus (Mitochondrien enthalten sämtliche Enzyme der Atmungskette und des Krebs-Zyklus),
die Synthese von Ketonkörpern, Teile des Harnstoffzyklus und der
Hämsynthese abspielen. Die Matrix ist außerdem ein Reservoir für
Calciumionen: Diese
werden in der Matrix als Phosphatkomplex reversibel gebunden. Die
äußere Mitochondrienmembran ist ziemlich durchgängig für Ca++, wobei es über die innere Membran mittels eines Uniporters eintritt und durch einen Na+/Ca++-Austauscher wieder austritt (
Die mitochondrielle Matrix ist ein Reaktionsraum, in dem sich u.a. die ß-Oxidation von Fettsäuren, der Citratzyklus (Mitochondrien enthalten sämtliche Enzyme der Atmungskette und des Krebs-Zyklus),
die Synthese von Ketonkörpern, Teile des Harnstoffzyklus und der
Hämsynthese abspielen. Die Matrix ist außerdem ein Reservoir für
Calciumionen: Diese
werden in der Matrix als Phosphatkomplex reversibel gebunden. Die
äußere Mitochondrienmembran ist ziemlich durchgängig für Ca++, wobei es über die innere Membran mittels eines Uniporters eintritt und durch einen Na+/Ca++-Austauscher wieder austritt ( Abbildung unten).
Abbildung unten).

 Unter Beta-Oxidation (so
bezeichnet, weil jeweils das C-Atom der Fettsäure in der ß-Position
oxidiert wird - s. Biochemie) versteht man die Bildung von
Acetyl-Coenzym A (AcCoA) durch Abbau von Fettsäuren. AcCoA wird in den Citratzyklus geschleust, wo es 2C-Moleküle in Form von Essigsäureresten bereitstellt. Dabei entstehen die reduzierten Coenzyme FADH2 und NADH, die für den Elektronentransport und damit für die ATP-Synthese eine zentrale Rolle spielen (oxidative Phosphorylierung). ß-Oxidartion findet in der Matrix der Mitochondrien statt.
Unter Beta-Oxidation (so
bezeichnet, weil jeweils das C-Atom der Fettsäure in der ß-Position
oxidiert wird - s. Biochemie) versteht man die Bildung von
Acetyl-Coenzym A (AcCoA) durch Abbau von Fettsäuren. AcCoA wird in den Citratzyklus geschleust, wo es 2C-Moleküle in Form von Essigsäureresten bereitstellt. Dabei entstehen die reduzierten Coenzyme FADH2 und NADH, die für den Elektronentransport und damit für die ATP-Synthese eine zentrale Rolle spielen (oxidative Phosphorylierung). ß-Oxidartion findet in der Matrix der Mitochondrien statt.
ATP kann man mit einer gespannten Feder vergleichen: Es kann überall in der
Zelle zum Antreiben energieverbrauchender Reaktionen herangezogen
werden, die gespeicherte Energie wird dabei auf die zu fördernde Reaktion übertragen.
 Die innere Mitochondrienmembran ist mehrfach gefaltet (cristae) und hat eine dementsprechend vergrößerte Oberfläche, an der
parallel mehrere Reaktionen ablaufen. Sie ist direkt durchlässig für Atemgase (O2, CO2) und Ammoniak (NH3); andere Substanzen bedürfen spezifischer Transporter für die Membranpassage. Die Membran
ist also ziemlich dicht und selektiv: Sie tauscht nur Stoffe aus,
für die eigene Transportsysteme vorhanden sind. Sie trägt Proteinkomplexe und mobile Elektronenträger für die oxidative Phosphorylierung.
Die innere Mitochondrienmembran ist mehrfach gefaltet (cristae) und hat eine dementsprechend vergrößerte Oberfläche, an der
parallel mehrere Reaktionen ablaufen. Sie ist direkt durchlässig für Atemgase (O2, CO2) und Ammoniak (NH3); andere Substanzen bedürfen spezifischer Transporter für die Membranpassage. Die Membran
ist also ziemlich dicht und selektiv: Sie tauscht nur Stoffe aus,
für die eigene Transportsysteme vorhanden sind. Sie trägt Proteinkomplexe und mobile Elektronenträger für die oxidative Phosphorylierung.
 Der Intermembranraum hat eine hohe [H+]
(niedriger pH-Wert), ein zentrales Merkmal im Rahmen der oxidativer
Phosphorylierung. Durch den Intermembranraum erfolgt der Austausch
verschiedener Stoffe in Richtung Matrix (Malat, Glutamat, Phosphat,
Pyrutat) oder in Richtung Zytoplasma (ATP, α-Ketoglutarat, Aspartat,
Malat) - vorwiegend über Austausch (Malat gegen Ketoglutarat, Aspartat
gegen Glutamat, Pyruvat gegen OH- etc).
Der Intermembranraum hat eine hohe [H+]
(niedriger pH-Wert), ein zentrales Merkmal im Rahmen der oxidativer
Phosphorylierung. Durch den Intermembranraum erfolgt der Austausch
verschiedener Stoffe in Richtung Matrix (Malat, Glutamat, Phosphat,
Pyrutat) oder in Richtung Zytoplasma (ATP, α-Ketoglutarat, Aspartat,
Malat) - vorwiegend über Austausch (Malat gegen Ketoglutarat, Aspartat
gegen Glutamat, Pyruvat gegen OH- etc).
 Die äußere Mitochondrienmembran
ist für kleine Moleküle (<10 kDa) permeabel - dank zahlreicher aus
Porinen aufgebauter Poren. Durch diese treten z.B. Malat, Glutamat,
Glycerinphosphat aus dem Zytoplasma in den Intermembranraum ein; oder
sie verlassen ihn Richtung Zytoplasma, wie Ketoglutarat, Aspartat oder
DHAP (Dihydroxyacetonphosphat).
Die äußere Mitochondrienmembran
ist für kleine Moleküle (<10 kDa) permeabel - dank zahlreicher aus
Porinen aufgebauter Poren. Durch diese treten z.B. Malat, Glutamat,
Glycerinphosphat aus dem Zytoplasma in den Intermembranraum ein; oder
sie verlassen ihn Richtung Zytoplasma, wie Ketoglutarat, Aspartat oder
DHAP (Dihydroxyacetonphosphat).
Mitochondrien wandern an Orte erhöhten Energiebedarfs. Mitochondrien werden entlang des Zytoskeletts (an Mikrotubuli) durch Motorproteine aktiv durch die Zelle transportiert
( Abbildung). So kann die ATP-Synthese dort intensiviert werden, wo viel Stoffwechselenergie benötigt wird.
Abbildung). So kann die ATP-Synthese dort intensiviert werden, wo viel Stoffwechselenergie benötigt wird.

 Abbildung: Mitochondrium
Abbildung: Mitochondrium
Nach Vos M, Lauwers E, Verstreken P. Synaptic mitochondria in synaptic transmission and organization of vesicle pools in health and disease. Front Synaptic Neurosci 2010; 2: 139
Mitochondrien können sich in der Zelle an Aktinfäden mittels Myosin (über kurze Strecken) oder in Nervenfasern entlang von Mikrotubuli bewegen - mittels Motorproteinen (Kinesin für anterograden, Dynein für retrograden axonalen Transport). So gelangen sie rasch an Orte, an denen Energie benötigt wird.
Der Citratzyklus (Krebs-Zyklus) läuft in der Matrix ab, dabei entstehen u.a. Elektronendonatoren (NADH, FADH2).
Rechts oben und links unten:
Transport von Elektronen (e-) entlang der Atmungskette (Komplexe I-IV) und von Protonen (H+) in den mitochondrialen Spaltraum.
Mitochondrien sind auch in die Calc
iumregulation
eingebunden: Der Übertritt über die innere Mitochondrienmembran erfolgt
über ein Uniporter / Austauscher-System, und die Matrix kann Calc
ium
reversibel als Phosphat speichern


 Glykolyse (Zytoplasma): 1 Mol Glucose → 2 Mol Pyruvat → ATP, NADH
Glykolyse (Zytoplasma): 1 Mol Glucose → 2 Mol Pyruvat → ATP, NADH
 Mitochondrienmatrix: Pyruvat wird decarboxyliert → Acetyl-CoA → NADH
Mitochondrienmatrix: Pyruvat wird decarboxyliert → Acetyl-CoA → NADH
 Mitochondrienmatrix: Citratzyklus: Acetyl-CoA → CO2 + NADH, FADH2, GTP
Mitochondrienmatrix: Citratzyklus: Acetyl-CoA → CO2 + NADH, FADH2, GTP
 Innere Mitochondrienmembran: Oxidative Phosphorylierung: Elektronentransport von NADH / FADH2 auf O2 → Protonengradient über Mito-Membran → ATP-Synthase
Innere Mitochondrienmembran: Oxidative Phosphorylierung: Elektronentransport von NADH / FADH2 auf O2 → Protonengradient über Mito-Membran → ATP-Synthase
 Acetyl-Coenzym A (AcCoA)
ist die "aktivierte Form der Essigsäure" (acidum aceticum): Sie besteht
aus einer Acetylgruppe, die an ein Enzym - das Coenzym A - gekoppelt
ist. Die Mitochondrienmatrix stellt diesen zentralen
Faktor im Energiestoffwechsel aus oxidativer Decarboxylierung von
Pyruvat sowie oxidativem Abbau von Fettsäuren und einigen Aminosäuren
her. AcCoA ist ein zentraler Vorläufer bei der Synthese von Lipiden und
Ketonkörpern und dient der Herstellung von ATP.
Acetyl-Coenzym A (AcCoA)
ist die "aktivierte Form der Essigsäure" (acidum aceticum): Sie besteht
aus einer Acetylgruppe, die an ein Enzym - das Coenzym A - gekoppelt
ist. Die Mitochondrienmatrix stellt diesen zentralen
Faktor im Energiestoffwechsel aus oxidativer Decarboxylierung von
Pyruvat sowie oxidativem Abbau von Fettsäuren und einigen Aminosäuren
her. AcCoA ist ein zentraler Vorläufer bei der Synthese von Lipiden und
Ketonkörpern und dient der Herstellung von ATP.
Mitochondrien bestehen zu ~70% aus Eiweiß und enthalten (mehr als 100) Enzyme des Citratzyklus, des
Elektronentransports (Atmungskette zur oxidativen Phosphorylierung: Übertragung von Elektronen durch NADH (Nikotinamid-Adenin-Dinukleotid) und FADH2
(Hydrochinonform des Flavin-Adenin-Dinukleotid) bereitgestellten Elektronen auf Oxidationsmittel  ) und der Bildung
energiereicher Phosphate. An der inneren Mitochondrienmembran treibt
der Elektronentransport (e-) einen Auswärtstransport von H+
in den mitochondrialen Intermembranraum an (vgl. weiter oben).
) und der Bildung
energiereicher Phosphate. An der inneren Mitochondrienmembran treibt
der Elektronentransport (e-) einen Auswärtstransport von H+
in den mitochondrialen Intermembranraum an (vgl. weiter oben).
Energie kann in Form elektrochemischer Gradienten an Zellmembranen gespeichert werden, z.B. [Na+] oder [H+].
Strömen diese Ionen (durch spezielle Kanäle) entlang ihres Gradienten
durch die Membran, wird dabei Energie nutzbar. So kann z.B. Glucose
mittels Natriumgradienten "bergauf" in die Zelle geschleust werden (SGLT1).


 Abbildung: Kaskade freier Energie im mitochondrialen Elektronentransport
Abbildung: Kaskade freier Energie im mitochondrialen Elektronentransport
Nach einer Vorlage in
Campbell / Urry / Cain / Wasserman / Minorsky / Orr: Biology, A Global
Approach, 12th ed. Pearson Education Ltd 2021
Glykolyse und Citratzyklus liefern lediglich
je zwei mol ATP pro mol Glucose. Der Großteil der Energieextraktion
beim Glucoseabbau erfolgt durch NADH und FADH2
im Rahmen der oxidativen Phosphorylierung. Elektronen, die direkt aus
dem Abbau von Pyruvat im Citratzyklus gewonnen wurden, gelangen in der
Form von NADH + H+ in den Elektronentransport der Atmungskette.
Der Großteil der Energieabschöpfung erfolgt im Rahmen von
Redox-Reaktionen des Elektronentransports an der inneren
Mitochondrienmembran, deren Einfaltungen Platz für tausende
entsprechender Proteinkomplexe (I-IV) bieten.
Die meisten Komponenten dieser Elektronentransportkette (auch Atmungskette genannt) sind Proteine, an die prosthetische Gruppen (Nicht-Proteine - für katalytische Funktion unverzichtbare Coenzyme / Cofaktoren) fest gebunden sind.
Der Betrag an freier (verfügbarer) Energie (y-Achse) nimmt hier
schrittweise ab, während Elektronen von einem Träger (Carrier) zum
nächsten weitergereicht werden. Dabei wechseln die Elektronencarrier
zwischen reduziertem (wenn sie vom "bergauf" liegenden Partner mit
geringerer Affinität für Elektronen diese aufnehmen) und oxidiertem
Zustand (wenn sie Elektronen an die "bergab" liegende nächste,
elektronen-affinere Komponente abgeben).
Fe.S = Eisen-Schwefel-Protein in Komplex I, Q = Ubiquinon, Cyt = Zytochrome

Erhöhung der Mitochondrienzahl: Mitochondrien vermehren sich, wenn die Zelle zusätzliche
Energie braucht; ihre Hauptaufgabe ist die Bereitstellung von Energie.
Zusätzlich haben Mitochondrien weitere Funktionen, z.B.

Bildung und Verwertung von
Ketonkörpern

Abbau von
Aminosäuren

Bildung von Neurotransmittern

Oxidation
von
Fettsäuren
 Harnstoffsynthese
Harnstoffsynthese: Teile des Harnstoffzyklus laufen in Mitochondrien ab

Speicherung von
Calciumionen (vor allem in Muskelzellen)

Mitochondrien können sich auch an der
Apoptose
("innerer" / mitochondrialer Weg) beteiligen: Dies wird ausgelöst, wenn
in der Mitochondrienwand (bedingt durch ionisierende Strahlung,
Chemikalien u.a.) Proteine wie der Apoptose-Regulierer
Bax (Bcl-2-associated X protein)
aktiviert werden. Bax bindet dann an die äußere Mitochondrienmembran,
bildet Oligomere und ermöglicht die Freisetzung von Cytochrom c, das
wiederum (über ein zytoplasmatisches Protein, APAF1 -
apoptotic protease activating factor 1) Caspasen aktiviert.
Mitochondrien sind
einige µm lang und haben eine Lebensdauer
von 1-4 Wochen. Leberzellen
enthalten mehr als 2000, Nervenzellen bis zu 10.000 Mitochondrien. Der
Mitochondrienanteil am Volumen von Leber- und Dünndarmzellen (die sehr
stoffwechselintensiv sind) beträgt ~13%.
NADH (Nicotinamid-Adenin-Dinukleotid) und FADH2
(Flavin-Adenin-Dinukleotid-Hydrat) bringen Elektronen an die
Atmungskette und letztlich an Sauerstoffmoleküle.
Nach einer Vorlage bei Thibodeau / Patton, Anatomy & Physiology (6th ed), Mosby Elsevier 2007
An der inneren Mitochondrienmembran treibt der Transport von Elektronen den Auswärtstransport von Protonen (H+) in den mitochondrialen Intermembranraum an.
Oben: Hochenergetische Elektronen (e-) werden über Coenzyme zu Komponenten des Elektronentransportsystems gebracht (NADH gibt H+ ab, es entsteht NAD+), H+ wird entlang von Proteinkomplexen ("I bis IV", u.a. Cytochromen) an der inneren Mitochondrienmembran weitergereicht.
Mitte: Die dabei frei werdende Energie nutzen die Proteinkomplexe, um H+ in den Intermembranraum zu befördern.
Unten: Die Wasserstoffionen
diffundieren durch die ATP-Synthase
wieder in das Mitochondrium zurück, dieser Vorgang treibt die Synthese
von ATP an. Dabei wird die energetisch ungünstige Reaktion ADP + Pi → ATP durch den nach innen gerichteten Protonengradienten angetrieben. Als Akzeptor für Elektronen und Protonen fungiert
Sauerstoff, dabei entsteht "Oxidationswasser" (im gesamten Körper etwa
0,3 Liter pro Tag)
 Dabei wird Energie
frei, welche genutzt wird, um Wasserstoffionen (H+)
über die innere Mitochondrienmembran zu pumpen. Der entstandene
elektrochemische Gradient treibt schließlich die ATPase an
("Turbomotor",
Dabei wird Energie
frei, welche genutzt wird, um Wasserstoffionen (H+)
über die innere Mitochondrienmembran zu pumpen. Der entstandene
elektrochemische Gradient treibt schließlich die ATPase an
("Turbomotor", 
Abbildung unten).
In braunem Fettgewebe können Adipozyten H+-Permeasen
in der inneren Mitochondrienmembran öffnen, welche Wasserstoffionen vom
Intermembranraum in die mitochondrielle Matrix eindringen lassen, ohne
dabei die ATP-Synthase zu passieren. Diese Entkopplung (uncoupling) von Protonenstrom und ATP-Generierung lässt statt ATP Wärme entstehen, was vor allem Neugeborene nützen können, um in kühler Umgebung nicht hypothermisch zu werden.
Der Elektronentransport in den Mitochondrien
produziert nicht direkt ATP, sondern vermittelt die Energieübertragung auf energiereiche
Phosphate (von Nahrungsmittel zu Sauerstoff) in kleinen Schritten. Die ATP-Synthese erfolgt schließlich durch eine "rückwärtslaufende Protonenpumpe" (eine F-Typ ATPase): Dieses Transmembranprotein nutzt die Rückdiffusion von Protonen zur ATP-Synthese (chemiosmotische Kopplung). Wahrscheinlich bedarf es der Passage von mindestens 3 Protonen aus dem Intermembranraum in die Matrix, um 1 ATP zu generieren.
 Zu Redoxpotential und Elektronentransport s. auch dort
Zu Redoxpotential und Elektronentransport s. auch dort
Mehr als 1600 Gene im Zellkern codieren für mitochondrielle Proteine,
die von zytoplasmatischen Ribosomen produziert uind dann in die
Mitochondrien importiert werden. mtDNA dient der Synthese ribosomaler
RNA und tRNA, die zur Bildung von Mitoribosomen
benötigt werden, nicht aber anderer Komponenten wie z.B. von Proteinen,
die für die Replikation, Ablesung oder Reparatur der mitochondriellen
DNA benötigt werden (s. Tabelle).
Die DNA der Mitochondrien stammt zum Großteil aus dem Zellkern, ein "Restbestand" eigener DNA stammt aus ihrer Zeit als aerobe Bakterien, die vor Urzeiten mit Eukaryoten in eine Symbiose
eingetreten sind (Endosymbiontentheorie). Beim Menschen beträgt der
mitochondrielle Anteil ~1% der gesamten zellulären DNA. Mitochondrielle DNA liegt in Form eines ringförmigen DNA-Doppelstrangs vor (pro Zelle existieren zwischen 102 und 104 Kopien). Die Replikation erfolgt unabhängig von chromosomaler DNA. Mitochondrielle DNA codiert für eine geringe Anzahl der in der Atmungskette benötigten Proteine.

 Abbildung: Der "Turbomotor" F-Typ ATPase
Nach einer Vorlage in Boron W, Boulpaep E: Medical Physiology, 3rd ed., Elsevier 2016
Abbildung: Der "Turbomotor" F-Typ ATPase
Nach einer Vorlage in Boron W, Boulpaep E: Medical Physiology, 3rd ed., Elsevier 2016
Die mitochondrielle ATP-Synthase besteht aus dem transmembranalen F0-Teil (dieser enthält den H+-Kanal) und dem F1-Teil, der aus ADP und einem Phosphatrest ATP zusammenbaut. Die fühlerförmige Struktur (rechts) hält den "Rotor" in Position.
Beim Durchtritt von Wasserstoffionen (=Protonen) vollführt der F1-Teil Drehbewegungen (wie Schaufeln der Turbine eines Wasserkraftwerks). Diese Rotation treibt die ATP-Synthase an (oben)

Beschränkte Autonomie des mitochondriellen Genoms

Nach Strachan / Read, Human Molecular Genetics, 5th ed. 2020 (CRC Press)
|
Mitochondrielle Proteine und RNAs
|
Gene in Mito-
chondrien
|
Gene im Zellkern
|
Oxidative Phosphorylierung
|
13
|
84
|
Komplex I
NADH-Ubiquinon-Oxidoreduktase- Komplex
|
7
|
37
|
Komplex II
Succinat-Dehydrogenase
|
0
|
4
|
Komplex III
Ubichinol-Cytochrom C-Reduktase- Komplex
|
1
|
9
|
Komplex IV
Cytochrom C-Oxidase- Komplex
|
3
|
16
|
Komplex V
ATP-Synthase- Komplex
|
2
|
18
|
Proteinsynthese
|
24
|
>100
|
rRNA
|
2
|
0
|
tRNA
|
22
|
0
|
Ribosomale Proteine
|
0
|
80
|
Aminoacyl tRNA-Synthasen
|
0
|
19
|
Translationsfaktoren u.a.
|
0
|
alle
|
Proteine für Replikation, Transkription, mtDNA-Reparatur
|
0
|
alle
|
Weitere mitochondrielle Proteine
|
0 |
alle
|
Cyanidvergiftung:
Blausäure (HCN) inaktiviert Enzyme der Atmungskette und blockiert
dadurch deren Elektronentransport. Die Zellen können Sauerstoff nicht
mehr verarbeiten, es kommt zu "innerem Ersticken" (trotz vorhandenem
Sauerstoff). Das venöse Blut enthält ähnlich viel O2 wie das arterielle, es färbt sich rot, ebenso die Haut. (Ähnliche Symptome zeigen sich bei CO-Vergiftung.)
Als sofort verfügbare Energiespeicher stehen Kohlenhydrate (Glykogen  in Leber- und Muskelzellen) und Fette als Langzeitreserve zur Verfügung (Neutralfette in Fettzellen).
in Leber- und Muskelzellen) und Fette als Langzeitreserve zur Verfügung (Neutralfette in Fettzellen).
Die Energiegewinnung der Zelle kann

kurzzeitig (wenige Minuten)
anaerob erfolgen, z.B. indem die Glykolyse nur bis
zur Stufe der Brenztraubensäure (Pyruvat) erfolgt (
laktazid: Es entsteht Lactat) bzw. (im Muskel)
Kreatinphosphat genützt wird (
alaktazid); oder
 aerob
aerob,
indem Brenztraubensäure oder Fettsäuren unter Verbrauch von Sauerstoff
zu Kohlendioxid und Wasser abgebaut werden. Zum Betrieb des aeroben
Weges benötigen die Mitochondrien einen Sauerstoffgehalt von mindestens
~0,3 Vol-%, entsprechend einen
Mindest-Sauerstoffpartialdruck von 0,15-0,3 kPa pO
2 - der sogenannte Pasteurpunkt
(Pasteur point). Typischerweise beträgt der pO
2 im Bereich der Mitochondrien etwa 1 kPa (rund ein Zwanzigstel des pO
2 in der Außenluft).
Der Vorteil des aeroben Mechanismus ist die hohe Energieausbeute ~ etwa 14 mal höher auf molarer
Basis im Vergleich zum anaeroben Weg: Aerob 27-29 statt anaerob 2 mol ATP pro mol Glucose (theoretisch 36-38 mol, aber die metabolische Kopplungseffizienz (coupling efficiency) ist deutlich geringer als 100%). ATP wird auf aerobem Wege allerdings relativ
langsam gebildet, und es muss ausreichend Sauerstoff zur Verfügung
stehen.
Der anaerobe
Mechanismus hingegen benötigt keinen Sauerstoff und kann ATP ~100-mal
schneller bereitstellen als Atmungskette / oxidative
Phosphorylierung im Citratzyklus; Nachteil ist (neben der geringeren
Ausbeute) die Belastung des pH-Stoffwechsels durch die Entstehung von Lactat - das wiederum von Herzmuskel-, Nierentubulus-, Leber- und anderen Zellen konsumiert werden kann.


 Der Metabolismus löst Verbindungen (Hydrolyse: Energetisch günstig, exergon, Änderung der freien Energie negativ, [ΔG]<0) oder baut sie auf (Kondensation: "Bergauf", endergon, Änderung der freien Energie positiv, [ΔG]>0). Letzteres ist möglich durch Reaktionskoppelung: Ein
Stoffwechselschritt mit stärker negativem ΔG übeträgt freie Energie an
den Kondensationsvorgang. Freie Energie für Synthese stammt aus der Spaltung energiereicher Phosphate (meist ATP) Der Metabolismus löst Verbindungen (Hydrolyse: Energetisch günstig, exergon, Änderung der freien Energie negativ, [ΔG]<0) oder baut sie auf (Kondensation: "Bergauf", endergon, Änderung der freien Energie positiv, [ΔG]>0). Letzteres ist möglich durch Reaktionskoppelung: Ein
Stoffwechselschritt mit stärker negativem ΔG übeträgt freie Energie an
den Kondensationsvorgang. Freie Energie für Synthese stammt aus der Spaltung energiereicher Phosphate (meist ATP)
 Bindungen sind umso stabiler, je größer der für ihre Spaltung nötige Energiebetrag ist. Um eine Reaktion zu starten, ist mehr Energie notwendig als bei der thermischen "Molekularbewegung" frei wird (Energieschwelle).
Enzyme reduzieren diese Aktivierungsenergie; ihre Expression ist zell-
und zustandsspezifisch, resultierend in unterschiedlicher Art, Richtung und
Intensität der metabolischen Reaktionen, die in der betreffenden Zelle ablaufen Bindungen sind umso stabiler, je größer der für ihre Spaltung nötige Energiebetrag ist. Um eine Reaktion zu starten, ist mehr Energie notwendig als bei der thermischen "Molekularbewegung" frei wird (Energieschwelle).
Enzyme reduzieren diese Aktivierungsenergie; ihre Expression ist zell-
und zustandsspezifisch, resultierend in unterschiedlicher Art, Richtung und
Intensität der metabolischen Reaktionen, die in der betreffenden Zelle ablaufen
 Der ATP-Bestand der Zellen wird alle 1-2 Minuten umgesetzt, entsprechend
~1 g
ATP pro Minute: Katabole Prozesse liefern Energie (in Form von ATP, entstanden via
Elektronenübertragung in der Atmungskette),
anabole Prozesse verbrauchen sie. Eine
erwachsene Person setzt etwa 10 MJ Energie täglich um - abhängig von
Stoffwechselintensität, Körperoberfläche, Alter, Geschlecht,
Trainingszustand, körperlicher Belastung, Umgebungstemperatur. Dazu
verbraucht sie rund 0,3 Liter Sauerstoff pro Minute - proportional dem
Energieumsatz, der aus dem O2-Verbrauch berechnet werden kann (indirekte Kalorimetrie). Die Körperoberfläche
dient als Relativmaß für Vorgänge, deren Größe mit dem
Energiestoffwechsel korreliert, z.B. als Cardiac index
(Herzminutenvolumen pro m2) oder GFR - solche Werte sind zwischen Personen besser vergleichbar Der ATP-Bestand der Zellen wird alle 1-2 Minuten umgesetzt, entsprechend
~1 g
ATP pro Minute: Katabole Prozesse liefern Energie (in Form von ATP, entstanden via
Elektronenübertragung in der Atmungskette),
anabole Prozesse verbrauchen sie. Eine
erwachsene Person setzt etwa 10 MJ Energie täglich um - abhängig von
Stoffwechselintensität, Körperoberfläche, Alter, Geschlecht,
Trainingszustand, körperlicher Belastung, Umgebungstemperatur. Dazu
verbraucht sie rund 0,3 Liter Sauerstoff pro Minute - proportional dem
Energieumsatz, der aus dem O2-Verbrauch berechnet werden kann (indirekte Kalorimetrie). Die Körperoberfläche
dient als Relativmaß für Vorgänge, deren Größe mit dem
Energiestoffwechsel korreliert, z.B. als Cardiac index
(Herzminutenvolumen pro m2) oder GFR - solche Werte sind zwischen Personen besser vergleichbar
 Mitochondrien (Leberzellen >2000, Nervenzellen bis 10.000) werden über Mikrotubuli an Orte
erhöhten Energiebedarfs in der Zelle transportiert und können sich dort vermehren. Sie enthalten sämtliche Enzyme des Citratzyklus, des Elektronentransports (Atmungskette zur oxidativen
Phosphorylierung) und der Bildung
energiereicher Phosphate. Hochenergetische
Elektronen werden auf die Komponenten der Elektronentransportkette an
der inneren Mitochondrienmembran übertragen, diese sezerniert H+ in den Intermembranraum. Der so entstandene Protonengradient treibt ATP-Synthasen an, durch die H+ in das Mitochondrium zurückdiffundieren und dabei den Aufbau von ATP antreiben (rückwärtslaufende H+-ATPase, chemiosmotische Koppelung). Die
Elektronen verlieren schrittweise Energie und verbinden sich schließlich mit
Sauerstoff, es entsteht Oxidationswasser. Mitochondrien verwerten Ketonkörper, bauen Aminosäuren ab, oxidieren Fettsäuren und speichern Ca++-Ionen Mitochondrien (Leberzellen >2000, Nervenzellen bis 10.000) werden über Mikrotubuli an Orte
erhöhten Energiebedarfs in der Zelle transportiert und können sich dort vermehren. Sie enthalten sämtliche Enzyme des Citratzyklus, des Elektronentransports (Atmungskette zur oxidativen
Phosphorylierung) und der Bildung
energiereicher Phosphate. Hochenergetische
Elektronen werden auf die Komponenten der Elektronentransportkette an
der inneren Mitochondrienmembran übertragen, diese sezerniert H+ in den Intermembranraum. Der so entstandene Protonengradient treibt ATP-Synthasen an, durch die H+ in das Mitochondrium zurückdiffundieren und dabei den Aufbau von ATP antreiben (rückwärtslaufende H+-ATPase, chemiosmotische Koppelung). Die
Elektronen verlieren schrittweise Energie und verbinden sich schließlich mit
Sauerstoff, es entsteht Oxidationswasser. Mitochondrien verwerten Ketonkörper, bauen Aminosäuren ab, oxidieren Fettsäuren und speichern Ca++-Ionen
 Energie wird
als Glykogen kurzfristig, in Neutralfetten langfristig gespeichert.
Anaerober Abbau bildet ATP rasch, aber unergiebig (bis Pyruvat) und
unter Belastung des Säure-Basen-Haushalts (Lactat), aerober vollständig (CO2) und mit ~15 mal höherer Energieausbeute, allerdings ~100-mal langsamer Energie wird
als Glykogen kurzfristig, in Neutralfetten langfristig gespeichert.
Anaerober Abbau bildet ATP rasch, aber unergiebig (bis Pyruvat) und
unter Belastung des Säure-Basen-Haushalts (Lactat), aerober vollständig (CO2) und mit ~15 mal höherer Energieausbeute, allerdings ~100-mal langsamer
|

 Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.
Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.





 Wie Zellen Energie gewinnen
und speichern
Wie Zellen Energie gewinnen
und speichern
 Anabolismus: ανα-βολισμός = Hinauf-wurf (βάλλειν = werfen)
Anabolismus: ανα-βολισμός = Hinauf-wurf (βάλλειν = werfen) Energie für metabolische Reaktionen
Energie für metabolische Reaktionen  Sauerstoffverbrauch und Anabolismus
Sauerstoffverbrauch und Anabolismus  Abschätzung der Hautoberfläche
Abschätzung der Hautoberfläche  Mitochondrien
Mitochondrien

 Energie, Arbeit
Energie, Arbeit  Spezifischer Sauerstoffverbrauch
Spezifischer Sauerstoffverbrauch  Oxidative Phosphorylierung
Oxidative Phosphorylierung  ß-Oxidation
ß-Oxidation  Acetyl-Coenzym A
Acetyl-Coenzym A  Transkriptom
Transkriptom
 ). Sie
beziehen die dafür nötige Energie aus ihrer Umwelt - ob in Form von
Licht, Wärme, mechanischer, elektrischer oder chemischer Energie.
). Sie
beziehen die dafür nötige Energie aus ihrer Umwelt - ob in Form von
Licht, Wärme, mechanischer, elektrischer oder chemischer Energie. Kombination - Substrate A + B werden zum Produkt C
Kombination - Substrate A + B werden zum Produkt C Abbau (decomposition) - Substrat A wird zu Produkten D + E
Abbau (decomposition) - Substrat A wird zu Produkten D + E Austausch - z.B. A + BC wird zu AB + C
Austausch - z.B. A + BC wird zu AB + C
 Abbildung: Wie eine Reaktion "angeschoben" werden muss
Abbildung: Wie eine Reaktion "angeschoben" werden muss
 Abbildung), die investiert werden muss, um die Reaktion ablaufen zu lassen. Enzyme können die nötige Aktivierungsenergie reduzieren
(die Schwelle zur Überwindung des Gipfels herabsetzen). Die
Netto-freie Energie der Reaktion ist die Differenz der freien Energie
des Substrats / der Substrate (Beginn der Reaktion) einerseits, und des
Produkts / der Produkte (Ende der Reaktion) andererseits.
Abbildung), die investiert werden muss, um die Reaktion ablaufen zu lassen. Enzyme können die nötige Aktivierungsenergie reduzieren
(die Schwelle zur Überwindung des Gipfels herabsetzen). Die
Netto-freie Energie der Reaktion ist die Differenz der freien Energie
des Substrats / der Substrate (Beginn der Reaktion) einerseits, und des
Produkts / der Produkte (Ende der Reaktion) andererseits.  Abbildung).
Abbildung). Endergone Reaktionen verbrauchen Energie, exergone setzen Energie frei.
Endergone Reaktionen verbrauchen Energie, exergone setzen Energie frei.
 Abbildung: Änderung der freien Energie bei exergonen und endergonen Reaktionen
Abbildung: Änderung der freien Energie bei exergonen und endergonen Reaktionen
 Unter Energie versteht
man die Fähigkeit eines Systems, Arbeit (bei einem Vorgang umgesetzte Energiemenge; Kraft mal Weg) zu verrichten
(mechanisch, chemisch, thermisch oder elektrisch). Als freie Energie (Symbol: G
Unter Energie versteht
man die Fähigkeit eines Systems, Arbeit (bei einem Vorgang umgesetzte Energiemenge; Kraft mal Weg) zu verrichten
(mechanisch, chemisch, thermisch oder elektrisch). Als freie Energie (Symbol: G  ) wird
in der Physiologie eine Energie bezeichnet, welche für Lebensvorgänge
verfügbar ist - die Zelle bringt sie auf, um "Ordnung zu schaffen" und
notwendige Reaktionen
(Hydrolyse von
ATP, Lösung von Kohlenstoffbindungen, Oxidation von Energieträgern,
Proteinsynthese etc.) anzutreiben, fern vom chemischen Gleichgewicht.
) wird
in der Physiologie eine Energie bezeichnet, welche für Lebensvorgänge
verfügbar ist - die Zelle bringt sie auf, um "Ordnung zu schaffen" und
notwendige Reaktionen
(Hydrolyse von
ATP, Lösung von Kohlenstoffbindungen, Oxidation von Energieträgern,
Proteinsynthese etc.) anzutreiben, fern vom chemischen Gleichgewicht.  Abbildung).
Abbildung).
 Abbildung: Bindungsstärken
Abbildung: Bindungsstärken
 Abbildung).
Abbildung).  C + D, dann ist die Änderung der freien Energie proportional zu
([C].[D]) / ([A].[B]). Änderungen der Stoffkonzentrationen verändern
auch die Dynamik der Reaktion: Steigen die Beträge für [A] oder [B],
läuft die Reaktion leichter nach rechts, und steigen sie für [C] oder
[D], leichter nach links ab.
C + D, dann ist die Änderung der freien Energie proportional zu
([C].[D]) / ([A].[B]). Änderungen der Stoffkonzentrationen verändern
auch die Dynamik der Reaktion: Steigen die Beträge für [A] oder [B],
läuft die Reaktion leichter nach rechts, und steigen sie für [C] oder
[D], leichter nach links ab.  wird
weitgehend durch Oxidationsvorgänge im Zellstoffwechsel bereitgestellt.
Der Verbrauch an Sauerstoff
einer erwachsenen Person beträgt rund 0,3 Liter/Minute (ebenfalls abhängig von
den genannten Größen), er entspricht dem
Energieumsatz und kann daher zu dessen Berechnung herangezogen werden (indirekte Kalorimetrie).
wird
weitgehend durch Oxidationsvorgänge im Zellstoffwechsel bereitgestellt.
Der Verbrauch an Sauerstoff
einer erwachsenen Person beträgt rund 0,3 Liter/Minute (ebenfalls abhängig von
den genannten Größen), er entspricht dem
Energieumsatz und kann daher zu dessen Berechnung herangezogen werden (indirekte Kalorimetrie). Als spezifischen Sauerstoffverbrauch bezeichnet man die Verstoffwechselung von Sauerstoff (quantifiziert z.B. in ml O2/min)
pro Masseneinheit (z.B. pro 100 Gramm Gewebe). Je größer der aktuelle
Energiebedarf des Gewebes, desto höher sein spezifischer
Sauerstoffverbrauch. Eine erwachsene Person verbraucht im Ruhezustand pro Minute 4,0-4,5 ml O2/min/kg KG (bei 70 kg KG ergibt das ungefähr 0,3 l/min).
Als spezifischen Sauerstoffverbrauch bezeichnet man die Verstoffwechselung von Sauerstoff (quantifiziert z.B. in ml O2/min)
pro Masseneinheit (z.B. pro 100 Gramm Gewebe). Je größer der aktuelle
Energiebedarf des Gewebes, desto höher sein spezifischer
Sauerstoffverbrauch. Eine erwachsene Person verbraucht im Ruhezustand pro Minute 4,0-4,5 ml O2/min/kg KG (bei 70 kg KG ergibt das ungefähr 0,3 l/min). Da
in der Biosphäre durch Photosynthese Sauerstoff in die
Atmosphäre abgegeben wird (21 Vol-%), können Lebewesen mit
entsprechender Enzymausstattung
Da
in der Biosphäre durch Photosynthese Sauerstoff in die
Atmosphäre abgegeben wird (21 Vol-%), können Lebewesen mit
entsprechender Enzymausstattung  diesen zur Bereitstellung von Stoffwechselenergie nützen. Aufgrund unterschiedlicher Genexpression und Enzymausstattung ist der Stoffwechsel gewebespezifisch gestaltet.
diesen zur Bereitstellung von Stoffwechselenergie nützen. Aufgrund unterschiedlicher Genexpression und Enzymausstattung ist der Stoffwechsel gewebespezifisch gestaltet.  Unter einem Transkriptom versteht man die Gesamtheit aller zu einem bestimmten Zeitpunkt von einer Zelle hergestellten RNS-Moleküle.
Unter einem Transkriptom versteht man die Gesamtheit aller zu einem bestimmten Zeitpunkt von einer Zelle hergestellten RNS-Moleküle. 
 Abbildung: Energietransfer in der Zelle
Abbildung: Energietransfer in der Zelle
 Abbau energieliefernder Nährstoffe (Katabolismus
Abbau energieliefernder Nährstoffe (Katabolismus  : exergone,
d.h. thermodynamisch günstige Prozesse - bei exergonen Prozessen liegt
das Gleichgewicht stärker auf der Seite der Reaktionsprodukte als bei
endergonen) zu Endprodukten wie CO2, H2O und NH3
- dabei werden energiereiche Phosphate gewonnen (via
Elektronenübertragung in der Atmungskette oder anderweitige
Energiegewinnung), und Hydrolyse von ATP erlaubt die Energieübertragung
auf anabole Prozesse:
: exergone,
d.h. thermodynamisch günstige Prozesse - bei exergonen Prozessen liegt
das Gleichgewicht stärker auf der Seite der Reaktionsprodukte als bei
endergonen) zu Endprodukten wie CO2, H2O und NH3
- dabei werden energiereiche Phosphate gewonnen (via
Elektronenübertragung in der Atmungskette oder anderweitige
Energiegewinnung), und Hydrolyse von ATP erlaubt die Energieübertragung
auf anabole Prozesse: Aufbau (Anabolismus
Aufbau (Anabolismus  : Endergone,
d.h. thermodynamisch ungünstige Prozesse - z.B. Aufbau eines Proteins
aus Aminosäuren) von organischen Grundbausteinen zu Makromolekülen
(Eiweiß,
Polysaccharide, Lipide, Nukleinsäuren).
: Endergone,
d.h. thermodynamisch ungünstige Prozesse - z.B. Aufbau eines Proteins
aus Aminosäuren) von organischen Grundbausteinen zu Makromolekülen
(Eiweiß,
Polysaccharide, Lipide, Nukleinsäuren).
 Abbildung: Abschätzung der Hautoberfläche (in m2) aus Körpergröße (Ordinate; in cm) und Körpergewicht (Abszisse; in kg)
Abbildung: Abschätzung der Hautoberfläche (in m2) aus Körpergröße (Ordinate; in cm) und Körpergewicht (Abszisse; in kg)
 Der Betrag der Körperoberfläche ist nicht nur theoretisch interessant, sondern auch praktisch
wichtig, z.B. zur Abschätzung
Der Betrag der Körperoberfläche ist nicht nur theoretisch interessant, sondern auch praktisch
wichtig, z.B. zur Abschätzung  des Wärmeverlusts,
des Wärmeverlusts, 
 des Ausmaßes von
Hautdefekten (Verbrennung) oder
des Ausmaßes von
Hautdefekten (Verbrennung) oder 
 des Medikamentenbedarfs (z.B.
Chemotherapie) von Patienten.
des Medikamentenbedarfs (z.B.
Chemotherapie) von Patienten.  Abbildung).
Abbildung). ist die Energiegewinnung unter
Sauerstoffverbrauch. Eine zentrale Stellung nimmt dabei die oxidative
Phosphorylierung ein:
ist die Energiegewinnung unter
Sauerstoffverbrauch. Eine zentrale Stellung nimmt dabei die oxidative
Phosphorylierung ein: Oxidative Phosphorylierung ist
die Phosphorylierung von ADP unter Verbrauch von Sauerstoff; dabei
entsteht ATP. Sie erfolgt über eine Elektronentransportkette
(Atmungskette), die (via mehrere Redoxsysteme, insbesondere die
Komplexe I bis IV) über die innere Mitochondrienmembran einen
pH-Gradienten generiert, der wiederum die ATP-Synthase antreibt. Oxidative Phosphorylierung erzeugt bei weitem mehr ATP als Glykolyse bzw. Citratzyklus. Schätzungsweise produziert der Mensch in 24 Stunden eine Menge ATP, die etwa der Hälfte seines Körpergewichts entspricht.
Oxidative Phosphorylierung ist
die Phosphorylierung von ADP unter Verbrauch von Sauerstoff; dabei
entsteht ATP. Sie erfolgt über eine Elektronentransportkette
(Atmungskette), die (via mehrere Redoxsysteme, insbesondere die
Komplexe I bis IV) über die innere Mitochondrienmembran einen
pH-Gradienten generiert, der wiederum die ATP-Synthase antreibt. Oxidative Phosphorylierung erzeugt bei weitem mehr ATP als Glykolyse bzw. Citratzyklus. Schätzungsweise produziert der Mensch in 24 Stunden eine Menge ATP, die etwa der Hälfte seines Körpergewichts entspricht. Exergone Reaktionen setzen Energie frei, die in ATP oder NADH gespeichert werden kann.
Exergone Reaktionen setzen Energie frei, die in ATP oder NADH gespeichert werden kann. Der Elektronentransport ist ein exergoner Vorgang, d.h. er setzt Energie frei.
Der Elektronentransport ist ein exergoner Vorgang, d.h. er setzt Energie frei. Sauerstoff
wirkt am Ende der mitochondrialen Elektronentrasportkette als Akzeptor
von Elektronen einerseits, und von Wasserstoffionen andererseits.
Sauerstoff
wirkt am Ende der mitochondrialen Elektronentrasportkette als Akzeptor
von Elektronen einerseits, und von Wasserstoffionen andererseits. Abbildung). Dieser ist folglich
sauer (hohe [H+], niedriger pH-Wert).
Abbildung). Dieser ist folglich
sauer (hohe [H+], niedriger pH-Wert).
 Abbildung: Elektronentransport und ATP-Synthese durch oxidative Phosphorylierung
Abbildung: Elektronentransport und ATP-Synthese durch oxidative Phosphorylierung vgl. Abbildung unten
vgl. Abbildung unten
 Oxidative Phosphorylierung beruht auf folgenden Komponenten:
Oxidative Phosphorylierung beruht auf folgenden Komponenten:  Elektronentransfer von NADH und FADH2 auf O2 via Atmungskette
Elektronentransfer von NADH und FADH2 auf O2 via Atmungskette Aufbau eines Protonengradienten über die innere Mitochondrienmembran
Aufbau eines Protonengradienten über die innere Mitochondrienmembran ATP-Synthese via Protonenstrom durch die innere Mitochondrienmembran
ATP-Synthese via Protonenstrom durch die innere Mitochondrienmembran GDP + ATP beträgt ungefähr 1).
GDP + ATP beträgt ungefähr 1). Komplex I (NADH-Dehydrogenase): Dieses Transmembran-Protein überträgt Elektronen mittels mehreren integralen Bestandteilen: FMN (Flavin-Mononukleotid, phosphoryliertes Riboflavin, wirkt stärker oxidierend als NAD) und Fe-S-Clustern (Ferredoxine, elektronenübertragende Hämoproteine, die im Cytochrom-P-450-System Elektronen übertragen - mittels Eisen und Schwefel in unterschiedlichem Mengenverhältnis, z.B. Fe2-S2, Fe3-S4, Fe4-S4). Funktion: Komplex I nimmt einerseits von NADH zwei Elektronen (e-) auf und reicht sie an Coenzym Q weiter, andererseits pumpt es vier Wasserstoffionen (H+) aus der Matrix in den Intermembranraum.
Komplex I (NADH-Dehydrogenase): Dieses Transmembran-Protein überträgt Elektronen mittels mehreren integralen Bestandteilen: FMN (Flavin-Mononukleotid, phosphoryliertes Riboflavin, wirkt stärker oxidierend als NAD) und Fe-S-Clustern (Ferredoxine, elektronenübertragende Hämoproteine, die im Cytochrom-P-450-System Elektronen übertragen - mittels Eisen und Schwefel in unterschiedlichem Mengenverhältnis, z.B. Fe2-S2, Fe3-S4, Fe4-S4). Funktion: Komplex I nimmt einerseits von NADH zwei Elektronen (e-) auf und reicht sie an Coenzym Q weiter, andererseits pumpt es vier Wasserstoffionen (H+) aus der Matrix in den Intermembranraum. Komplex II (Succinat-Dehydrogenase) ist ein an der Matrixseite der inneren Membran befestigtes Protein. Funktion: Es fördert den Elektronentransfer (2 e-) von FADH2 auf Coenzym Q mittels FMN und Fe-S-Clustern.
Komplex II (Succinat-Dehydrogenase) ist ein an der Matrixseite der inneren Membran befestigtes Protein. Funktion: Es fördert den Elektronentransfer (2 e-) von FADH2 auf Coenzym Q mittels FMN und Fe-S-Clustern.  Coenzym Q (Ubichinon-10, Q-10, ubiquinone
UQ) ist ein lipophiles Molekül (C6-Ring mit Isoprenoid-Seitenkette),
das sich frei in der inneren Mitochondrienmembran bewegen kann. Funktion: Es übernimmt 2 Elektronen von Komplex I oder II und überträgt sie auf Komplex III (es überträgt Elektronen auch von zytosolischem NADH, und von elektronentransferierendem Flavoprotein ETF im Rahmen der ß-Oxidation).
Coenzym Q (Ubichinon-10, Q-10, ubiquinone
UQ) ist ein lipophiles Molekül (C6-Ring mit Isoprenoid-Seitenkette),
das sich frei in der inneren Mitochondrienmembran bewegen kann. Funktion: Es übernimmt 2 Elektronen von Komplex I oder II und überträgt sie auf Komplex III (es überträgt Elektronen auch von zytosolischem NADH, und von elektronentransferierendem Flavoprotein ETF im Rahmen der ß-Oxidation). Komplex III (Cytochrom c-Reduktase) ist ein Transmembranprotein; es enthält Cytochrom b und c sowie Fe-S-Cluster mit eisenhältigen Häm-Molekülen. Funktion: Es übernimmt 2 e- von Ubiquinol, die es auf Cytochrom c überträgt; und pumpt 4 H+ aus der Matrix in den Intermembranraum.
Komplex III (Cytochrom c-Reduktase) ist ein Transmembranprotein; es enthält Cytochrom b und c sowie Fe-S-Cluster mit eisenhältigen Häm-Molekülen. Funktion: Es übernimmt 2 e- von Ubiquinol, die es auf Cytochrom c überträgt; und pumpt 4 H+ aus der Matrix in den Intermembranraum. Cytochrom c ist ein mobiles Protein, das sich an der Seite des Intermembranraums über die innere mitochondrielle Membran bewegt. Funktion:
Es übernimmt Elektronen von Komplex III und übergibt sie an Komplex IV
(dies wird durch eine eisenhältige Hämgruppe erleichtert).
Cytochrom c ist ein mobiles Protein, das sich an der Seite des Intermembranraums über die innere mitochondrielle Membran bewegt. Funktion:
Es übernimmt Elektronen von Komplex III und übergibt sie an Komplex IV
(dies wird durch eine eisenhältige Hämgruppe erleichtert). Komplex IV (Cytochrom c-Oxidase) ist ein Transmembranprotein, das Elektronen von Cytochrom c übernimmt und diese an Sauerstoff transferiert - es entsteht H2O - und pumpt 2 H+ aus der Matrix in den Intermembranraum. Kupfer, Cytochrome und Häm-a3 sind an diesem Vorgang beteiligt.
Komplex IV (Cytochrom c-Oxidase) ist ein Transmembranprotein, das Elektronen von Cytochrom c übernimmt und diese an Sauerstoff transferiert - es entsteht H2O - und pumpt 2 H+ aus der Matrix in den Intermembranraum. Kupfer, Cytochrome und Häm-a3 sind an diesem Vorgang beteiligt. Komplex V (ATP-Synthase) ist ein komplexes Transmembranprotein. Die F0-Domäne
ermöglicht Protonen den Übertritt aus dem Intermembranraum in die
Matrix, die in die Matrix vorragende F1-Domäne die (durch den
Protonenstrom angetriebene) ATP-Synthese.
Komplex V (ATP-Synthase) ist ein komplexes Transmembranprotein. Die F0-Domäne
ermöglicht Protonen den Übertritt aus dem Intermembranraum in die
Matrix, die in die Matrix vorragende F1-Domäne die (durch den
Protonenstrom angetriebene) ATP-Synthese. Die mitochondrielle Matrix ist ein Reaktionsraum, in dem sich u.a. die ß-Oxidation von Fettsäuren, der Citratzyklus (Mitochondrien enthalten sämtliche Enzyme der Atmungskette und des Krebs-Zyklus),
die Synthese von Ketonkörpern, Teile des Harnstoffzyklus und der
Hämsynthese abspielen. Die Matrix ist außerdem ein Reservoir für
Calciumionen: Diese
werden in der Matrix als Phosphatkomplex reversibel gebunden. Die
äußere Mitochondrienmembran ist ziemlich durchgängig für Ca++, wobei es über die innere Membran mittels eines Uniporters eintritt und durch einen Na+/Ca++-Austauscher wieder austritt (
Die mitochondrielle Matrix ist ein Reaktionsraum, in dem sich u.a. die ß-Oxidation von Fettsäuren, der Citratzyklus (Mitochondrien enthalten sämtliche Enzyme der Atmungskette und des Krebs-Zyklus),
die Synthese von Ketonkörpern, Teile des Harnstoffzyklus und der
Hämsynthese abspielen. Die Matrix ist außerdem ein Reservoir für
Calciumionen: Diese
werden in der Matrix als Phosphatkomplex reversibel gebunden. Die
äußere Mitochondrienmembran ist ziemlich durchgängig für Ca++, wobei es über die innere Membran mittels eines Uniporters eintritt und durch einen Na+/Ca++-Austauscher wieder austritt ( Abbildung unten).
Abbildung unten).
 Unter Beta-Oxidation (so
bezeichnet, weil jeweils das C-Atom der Fettsäure in der ß-Position
oxidiert wird - s. Biochemie) versteht man die Bildung von
Acetyl-Coenzym A (AcCoA) durch Abbau von Fettsäuren. AcCoA wird in den Citratzyklus geschleust, wo es 2C-Moleküle in Form von Essigsäureresten bereitstellt. Dabei entstehen die reduzierten Coenzyme FADH2 und NADH, die für den Elektronentransport und damit für die ATP-Synthese eine zentrale Rolle spielen (oxidative Phosphorylierung). ß-Oxidartion findet in der Matrix der Mitochondrien statt.
Unter Beta-Oxidation (so
bezeichnet, weil jeweils das C-Atom der Fettsäure in der ß-Position
oxidiert wird - s. Biochemie) versteht man die Bildung von
Acetyl-Coenzym A (AcCoA) durch Abbau von Fettsäuren. AcCoA wird in den Citratzyklus geschleust, wo es 2C-Moleküle in Form von Essigsäureresten bereitstellt. Dabei entstehen die reduzierten Coenzyme FADH2 und NADH, die für den Elektronentransport und damit für die ATP-Synthese eine zentrale Rolle spielen (oxidative Phosphorylierung). ß-Oxidartion findet in der Matrix der Mitochondrien statt.  Die innere Mitochondrienmembran ist mehrfach gefaltet (cristae) und hat eine dementsprechend vergrößerte Oberfläche, an der
parallel mehrere Reaktionen ablaufen. Sie ist direkt durchlässig für Atemgase (O2, CO2) und Ammoniak (NH3); andere Substanzen bedürfen spezifischer Transporter für die Membranpassage. Die Membran
ist also ziemlich dicht und selektiv: Sie tauscht nur Stoffe aus,
für die eigene Transportsysteme vorhanden sind. Sie trägt Proteinkomplexe und mobile Elektronenträger für die oxidative Phosphorylierung.
Die innere Mitochondrienmembran ist mehrfach gefaltet (cristae) und hat eine dementsprechend vergrößerte Oberfläche, an der
parallel mehrere Reaktionen ablaufen. Sie ist direkt durchlässig für Atemgase (O2, CO2) und Ammoniak (NH3); andere Substanzen bedürfen spezifischer Transporter für die Membranpassage. Die Membran
ist also ziemlich dicht und selektiv: Sie tauscht nur Stoffe aus,
für die eigene Transportsysteme vorhanden sind. Sie trägt Proteinkomplexe und mobile Elektronenträger für die oxidative Phosphorylierung. Der Intermembranraum hat eine hohe [H+]
(niedriger pH-Wert), ein zentrales Merkmal im Rahmen der oxidativer
Phosphorylierung. Durch den Intermembranraum erfolgt der Austausch
verschiedener Stoffe in Richtung Matrix (Malat, Glutamat, Phosphat,
Pyrutat) oder in Richtung Zytoplasma (ATP, α-Ketoglutarat, Aspartat,
Malat) - vorwiegend über Austausch (Malat gegen Ketoglutarat, Aspartat
gegen Glutamat, Pyruvat gegen OH- etc).
Der Intermembranraum hat eine hohe [H+]
(niedriger pH-Wert), ein zentrales Merkmal im Rahmen der oxidativer
Phosphorylierung. Durch den Intermembranraum erfolgt der Austausch
verschiedener Stoffe in Richtung Matrix (Malat, Glutamat, Phosphat,
Pyrutat) oder in Richtung Zytoplasma (ATP, α-Ketoglutarat, Aspartat,
Malat) - vorwiegend über Austausch (Malat gegen Ketoglutarat, Aspartat
gegen Glutamat, Pyruvat gegen OH- etc). Die äußere Mitochondrienmembran
ist für kleine Moleküle (<10 kDa) permeabel - dank zahlreicher aus
Porinen aufgebauter Poren. Durch diese treten z.B. Malat, Glutamat,
Glycerinphosphat aus dem Zytoplasma in den Intermembranraum ein; oder
sie verlassen ihn Richtung Zytoplasma, wie Ketoglutarat, Aspartat oder
DHAP (Dihydroxyacetonphosphat).
Die äußere Mitochondrienmembran
ist für kleine Moleküle (<10 kDa) permeabel - dank zahlreicher aus
Porinen aufgebauter Poren. Durch diese treten z.B. Malat, Glutamat,
Glycerinphosphat aus dem Zytoplasma in den Intermembranraum ein; oder
sie verlassen ihn Richtung Zytoplasma, wie Ketoglutarat, Aspartat oder
DHAP (Dihydroxyacetonphosphat). Abbildung). So kann die ATP-Synthese dort intensiviert werden, wo viel Stoffwechselenergie benötigt wird.
Abbildung). So kann die ATP-Synthese dort intensiviert werden, wo viel Stoffwechselenergie benötigt wird.
 Abbildung: Mitochondrium
Abbildung: Mitochondrium

 Glykolyse (Zytoplasma): 1 Mol Glucose → 2 Mol Pyruvat → ATP, NADH
Glykolyse (Zytoplasma): 1 Mol Glucose → 2 Mol Pyruvat → ATP, NADH Mitochondrienmatrix: Pyruvat wird decarboxyliert → Acetyl-CoA → NADH
Mitochondrienmatrix: Pyruvat wird decarboxyliert → Acetyl-CoA → NADH Mitochondrienmatrix: Citratzyklus: Acetyl-CoA → CO2 + NADH, FADH2, GTP
Mitochondrienmatrix: Citratzyklus: Acetyl-CoA → CO2 + NADH, FADH2, GTP Innere Mitochondrienmembran: Oxidative Phosphorylierung: Elektronentransport von NADH / FADH2 auf O2 → Protonengradient über Mito-Membran → ATP-Synthase
Innere Mitochondrienmembran: Oxidative Phosphorylierung: Elektronentransport von NADH / FADH2 auf O2 → Protonengradient über Mito-Membran → ATP-Synthase Acetyl-Coenzym A (AcCoA)
ist die "aktivierte Form der Essigsäure" (acidum aceticum): Sie besteht
aus einer Acetylgruppe, die an ein Enzym - das Coenzym A - gekoppelt
ist. Die Mitochondrienmatrix stellt diesen zentralen
Faktor im Energiestoffwechsel aus oxidativer Decarboxylierung von
Pyruvat sowie oxidativem Abbau von Fettsäuren und einigen Aminosäuren
her. AcCoA ist ein zentraler Vorläufer bei der Synthese von Lipiden und
Ketonkörpern und dient der Herstellung von ATP.
Acetyl-Coenzym A (AcCoA)
ist die "aktivierte Form der Essigsäure" (acidum aceticum): Sie besteht
aus einer Acetylgruppe, die an ein Enzym - das Coenzym A - gekoppelt
ist. Die Mitochondrienmatrix stellt diesen zentralen
Faktor im Energiestoffwechsel aus oxidativer Decarboxylierung von
Pyruvat sowie oxidativem Abbau von Fettsäuren und einigen Aminosäuren
her. AcCoA ist ein zentraler Vorläufer bei der Synthese von Lipiden und
Ketonkörpern und dient der Herstellung von ATP. ) und der Bildung
energiereicher Phosphate. An der inneren Mitochondrienmembran treibt
der Elektronentransport (e-) einen Auswärtstransport von H+
in den mitochondrialen Intermembranraum an (vgl. weiter oben).
) und der Bildung
energiereicher Phosphate. An der inneren Mitochondrienmembran treibt
der Elektronentransport (e-) einen Auswärtstransport von H+
in den mitochondrialen Intermembranraum an (vgl. weiter oben).


 Abbildung: Kaskade freier Energie im mitochondrialen Elektronentransport
Abbildung: Kaskade freier Energie im mitochondrialen Elektronentransport
 Bildung und Verwertung von Ketonkörpern
Bildung und Verwertung von Ketonkörpern Abbau von Aminosäuren
Abbau von Aminosäuren Bildung von Neurotransmittern
Bildung von Neurotransmittern Oxidation von Fettsäuren
Oxidation von Fettsäuren Harnstoffsynthese: Teile des Harnstoffzyklus laufen in Mitochondrien ab
Harnstoffsynthese: Teile des Harnstoffzyklus laufen in Mitochondrien ab Speicherung von Calciumionen (vor allem in Muskelzellen)
Speicherung von Calciumionen (vor allem in Muskelzellen) Mitochondrien können sich auch an der Apoptose
("innerer" / mitochondrialer Weg) beteiligen: Dies wird ausgelöst, wenn
in der Mitochondrienwand (bedingt durch ionisierende Strahlung,
Chemikalien u.a.) Proteine wie der Apoptose-Regulierer Bax (Bcl-2-associated X protein)
aktiviert werden. Bax bindet dann an die äußere Mitochondrienmembran,
bildet Oligomere und ermöglicht die Freisetzung von Cytochrom c, das
wiederum (über ein zytoplasmatisches Protein, APAF1 - apoptotic protease activating factor 1) Caspasen aktiviert.
Mitochondrien können sich auch an der Apoptose
("innerer" / mitochondrialer Weg) beteiligen: Dies wird ausgelöst, wenn
in der Mitochondrienwand (bedingt durch ionisierende Strahlung,
Chemikalien u.a.) Proteine wie der Apoptose-Regulierer Bax (Bcl-2-associated X protein)
aktiviert werden. Bax bindet dann an die äußere Mitochondrienmembran,
bildet Oligomere und ermöglicht die Freisetzung von Cytochrom c, das
wiederum (über ein zytoplasmatisches Protein, APAF1 - apoptotic protease activating factor 1) Caspasen aktiviert.
 Abbildung unten).
Abbildung unten). Zu Redoxpotential und Elektronentransport s. auch dort
Zu Redoxpotential und Elektronentransport s. auch dort
 Abbildung: Der "Turbomotor" F-Typ ATPase
Abbildung: Der "Turbomotor" F-Typ ATPase


 in Leber- und Muskelzellen) und Fette als Langzeitreserve zur Verfügung (Neutralfette in Fettzellen).
in Leber- und Muskelzellen) und Fette als Langzeitreserve zur Verfügung (Neutralfette in Fettzellen).  kurzzeitig (wenige Minuten) anaerob erfolgen, z.B. indem die Glykolyse nur bis
zur Stufe der Brenztraubensäure (Pyruvat) erfolgt (laktazid: Es entsteht Lactat) bzw. (im Muskel)
Kreatinphosphat genützt wird (alaktazid); oder
kurzzeitig (wenige Minuten) anaerob erfolgen, z.B. indem die Glykolyse nur bis
zur Stufe der Brenztraubensäure (Pyruvat) erfolgt (laktazid: Es entsteht Lactat) bzw. (im Muskel)
Kreatinphosphat genützt wird (alaktazid); oder aerob,
indem Brenztraubensäure oder Fettsäuren unter Verbrauch von Sauerstoff
zu Kohlendioxid und Wasser abgebaut werden. Zum Betrieb des aeroben
Weges benötigen die Mitochondrien einen Sauerstoffgehalt von mindestens
~0,3 Vol-%, entsprechend einen Mindest-Sauerstoffpartialdruck von 0,15-0,3 kPa pO2 - der sogenannte Pasteurpunkt (Pasteur point). Typischerweise beträgt der pO2 im Bereich der Mitochondrien etwa 1 kPa (rund ein Zwanzigstel des pO2 in der Außenluft).
aerob,
indem Brenztraubensäure oder Fettsäuren unter Verbrauch von Sauerstoff
zu Kohlendioxid und Wasser abgebaut werden. Zum Betrieb des aeroben
Weges benötigen die Mitochondrien einen Sauerstoffgehalt von mindestens
~0,3 Vol-%, entsprechend einen Mindest-Sauerstoffpartialdruck von 0,15-0,3 kPa pO2 - der sogenannte Pasteurpunkt (Pasteur point). Typischerweise beträgt der pO2 im Bereich der Mitochondrien etwa 1 kPa (rund ein Zwanzigstel des pO2 in der Außenluft).
 Der Metabolismus löst Verbindungen (Hydrolyse: Energetisch günstig, exergon, Änderung der freien Energie negativ, [ΔG]<0) oder baut sie auf (Kondensation: "Bergauf", endergon, Änderung der freien Energie positiv, [ΔG]>0). Letzteres ist möglich durch Reaktionskoppelung: Ein
Stoffwechselschritt mit stärker negativem ΔG übeträgt freie Energie an
den Kondensationsvorgang. Freie Energie für Synthese stammt aus der Spaltung energiereicher Phosphate (meist ATP)
Der Metabolismus löst Verbindungen (Hydrolyse: Energetisch günstig, exergon, Änderung der freien Energie negativ, [ΔG]<0) oder baut sie auf (Kondensation: "Bergauf", endergon, Änderung der freien Energie positiv, [ΔG]>0). Letzteres ist möglich durch Reaktionskoppelung: Ein
Stoffwechselschritt mit stärker negativem ΔG übeträgt freie Energie an
den Kondensationsvorgang. Freie Energie für Synthese stammt aus der Spaltung energiereicher Phosphate (meist ATP) Bindungen sind umso stabiler, je größer der für ihre Spaltung nötige Energiebetrag ist. Um eine Reaktion zu starten, ist mehr Energie notwendig als bei der thermischen "Molekularbewegung" frei wird (Energieschwelle).
Enzyme reduzieren diese Aktivierungsenergie; ihre Expression ist zell-
und zustandsspezifisch, resultierend in unterschiedlicher Art, Richtung und
Intensität der metabolischen Reaktionen, die in der betreffenden Zelle ablaufen
Bindungen sind umso stabiler, je größer der für ihre Spaltung nötige Energiebetrag ist. Um eine Reaktion zu starten, ist mehr Energie notwendig als bei der thermischen "Molekularbewegung" frei wird (Energieschwelle).
Enzyme reduzieren diese Aktivierungsenergie; ihre Expression ist zell-
und zustandsspezifisch, resultierend in unterschiedlicher Art, Richtung und
Intensität der metabolischen Reaktionen, die in der betreffenden Zelle ablaufen Der ATP-Bestand der Zellen wird alle 1-2 Minuten umgesetzt, entsprechend
~1 g
ATP pro Minute: Katabole Prozesse liefern Energie (in Form von ATP, entstanden via
Elektronenübertragung in der Atmungskette),
anabole Prozesse verbrauchen sie. Eine
erwachsene Person setzt etwa 10 MJ Energie täglich um - abhängig von
Stoffwechselintensität, Körperoberfläche, Alter, Geschlecht,
Trainingszustand, körperlicher Belastung, Umgebungstemperatur. Dazu
verbraucht sie rund 0,3 Liter Sauerstoff pro Minute - proportional dem
Energieumsatz, der aus dem O2-Verbrauch berechnet werden kann (indirekte Kalorimetrie). Die Körperoberfläche
dient als Relativmaß für Vorgänge, deren Größe mit dem
Energiestoffwechsel korreliert, z.B. als Cardiac index
(Herzminutenvolumen pro m2) oder GFR - solche Werte sind zwischen Personen besser vergleichbar
Der ATP-Bestand der Zellen wird alle 1-2 Minuten umgesetzt, entsprechend
~1 g
ATP pro Minute: Katabole Prozesse liefern Energie (in Form von ATP, entstanden via
Elektronenübertragung in der Atmungskette),
anabole Prozesse verbrauchen sie. Eine
erwachsene Person setzt etwa 10 MJ Energie täglich um - abhängig von
Stoffwechselintensität, Körperoberfläche, Alter, Geschlecht,
Trainingszustand, körperlicher Belastung, Umgebungstemperatur. Dazu
verbraucht sie rund 0,3 Liter Sauerstoff pro Minute - proportional dem
Energieumsatz, der aus dem O2-Verbrauch berechnet werden kann (indirekte Kalorimetrie). Die Körperoberfläche
dient als Relativmaß für Vorgänge, deren Größe mit dem
Energiestoffwechsel korreliert, z.B. als Cardiac index
(Herzminutenvolumen pro m2) oder GFR - solche Werte sind zwischen Personen besser vergleichbar Mitochondrien (Leberzellen >2000, Nervenzellen bis 10.000) werden über Mikrotubuli an Orte
erhöhten Energiebedarfs in der Zelle transportiert und können sich dort vermehren. Sie enthalten sämtliche Enzyme des Citratzyklus, des Elektronentransports (Atmungskette zur oxidativen
Phosphorylierung) und der Bildung
energiereicher Phosphate. Hochenergetische
Elektronen werden auf die Komponenten der Elektronentransportkette an
der inneren Mitochondrienmembran übertragen, diese sezerniert H+ in den Intermembranraum. Der so entstandene Protonengradient treibt ATP-Synthasen an, durch die H+ in das Mitochondrium zurückdiffundieren und dabei den Aufbau von ATP antreiben (rückwärtslaufende H+-ATPase, chemiosmotische Koppelung). Die
Elektronen verlieren schrittweise Energie und verbinden sich schließlich mit
Sauerstoff, es entsteht Oxidationswasser. Mitochondrien verwerten Ketonkörper, bauen Aminosäuren ab, oxidieren Fettsäuren und speichern Ca++-Ionen
Mitochondrien (Leberzellen >2000, Nervenzellen bis 10.000) werden über Mikrotubuli an Orte
erhöhten Energiebedarfs in der Zelle transportiert und können sich dort vermehren. Sie enthalten sämtliche Enzyme des Citratzyklus, des Elektronentransports (Atmungskette zur oxidativen
Phosphorylierung) und der Bildung
energiereicher Phosphate. Hochenergetische
Elektronen werden auf die Komponenten der Elektronentransportkette an
der inneren Mitochondrienmembran übertragen, diese sezerniert H+ in den Intermembranraum. Der so entstandene Protonengradient treibt ATP-Synthasen an, durch die H+ in das Mitochondrium zurückdiffundieren und dabei den Aufbau von ATP antreiben (rückwärtslaufende H+-ATPase, chemiosmotische Koppelung). Die
Elektronen verlieren schrittweise Energie und verbinden sich schließlich mit
Sauerstoff, es entsteht Oxidationswasser. Mitochondrien verwerten Ketonkörper, bauen Aminosäuren ab, oxidieren Fettsäuren und speichern Ca++-Ionen Energie wird
als Glykogen kurzfristig, in Neutralfetten langfristig gespeichert.
Anaerober Abbau bildet ATP rasch, aber unergiebig (bis Pyruvat) und
unter Belastung des Säure-Basen-Haushalts (Lactat), aerober vollständig (CO2) und mit ~15 mal höherer Energieausbeute, allerdings ~100-mal langsamer
Energie wird
als Glykogen kurzfristig, in Neutralfetten langfristig gespeichert.
Anaerober Abbau bildet ATP rasch, aber unergiebig (bis Pyruvat) und
unter Belastung des Säure-Basen-Haushalts (Lactat), aerober vollständig (CO2) und mit ~15 mal höherer Energieausbeute, allerdings ~100-mal langsamer