



 Bainbridge-Reflex: Francis A. Bainbridge
Bainbridge-Reflex: Francis A. Bainbridge| Blut strömt aus der Kreislaufperipherie zum rechten Herzvorhof - angetrieben durch ein Druckgefälle: Je
höher der periphere ("systemische") Druck und je geringer
der Vorhofdruck, desto leichter bewegt sich das Blut herzwärts. Die Strömung
nimmt mit dem Druckunterschied zu, die Kurve des venösen Rückstroms (venous return) quantifiziert diese Beziehung. Dazu kommt: Während der Systole "saugt" das Herz Blut aus dem
Venensystem an. Entsprechend dem Frank-Starling-Mechanismus fällt die Systole umso stärker aus, je mehr Blut in der Diastole in die Kammer eingelagert wurde. Die Darstellung als Druck-Strömungs-Diagramm heisst Starling-Kurve. Beide Kurven (venöser Rückstrom und Starling) überschneiden sich im aktuellen Zustandspunkt des kardiovaskulären Systems (Gefäßsystem und Herz sind hydromechanisch zusammengeschaltet) - sozusagen als Kompromiss zwischen der Mechanik des Kreislaufs und derjeniger des Herzens. Der Druck im Vorhof ist kardiologisch aufschlussreich: Im rechten Vorhof wird er als zentraler Venendruck (CVP: central venous pressure), im linken Vorhof als pulmonalkapillärer Druck (PCWP: pulmonary capillary wedged pressure) bezeichnet. Diese Druckwerte können mittels Herzkathetern ermittelt werden. Änderungen von Ventrikelkraft, Blutvolumen, Gefäßdehnbarkeit oder peripherem Strömungswiderstand äußern sich in charakteristischen Verlagerungen der entsprechenden Druck-Volumen-Beträge. So wird bei körperlicher Belastung das Herzminutenvolumen (Strömung) stark erhöht, der Vorhofdruck kann dabei unverändert bleiben, wenn sich die Zustandskurven - venöser Rückstrom und Starling - entsprechend verschieben (höhere Inotropie des Herzens, erleichterter venöser Rückstrom aus der Peripherie). Unter physiologischen Bedingungen sind die Aktionen von Herz und Kreislauf gut aufeinander abgestimmt. Das ermöglichen Feedback-Mechanismen: Die Herzwände sind mit Rezeptoren ausgestattet, die Reflexe auslösen und als Volumen- oder Frequenzwächter auftreten können. Auch ist das Herz ein hormonbildendes Organ: Natriuretische Peptide werden bei starker Dehnung in den Kreislauf freigesetzt und erhöhen u.a. die renale Salz- und Wasserausscheidung. Auf diese Weise wird das Blutvolumen gesenkt und das Herz entlastet (was auch durch Diuretika bezweckt wird, wenn der Blutdruck zu hoch oder das Herz überfordert ist). |
 Rezeptoren und Reflexe
Rezeptoren und Reflexe  Vorlast und Nachlast
Vorlast und Nachlast Bezold-Jarisch-Reflex
Bezold-Jarisch-Reflex
 Core messages
Core messages Beim rechten Herzen vom Blutvolumen und dem - durch den Sympathikus einstellbaren - Kontraktionsgrad
(venösem Tonus) der peripheren Gefäße (beides steigert den
Füllungsdruck), der Pumpaktion des rechten Ventrikels (nimmt diese zu,
sinkt der Füllungsdruck), von der Körperlage (im Liegen ist der Füllungsdruck wesentlich höher als im Sitzen oder Stehen: Orthostase), von der Atemphase (Inspiration fördert den Blutstrom zum Herzen), von der Aktivität der Skeletttmuskulatur (die Muskelpumpe fördert den Rückstrom von Blut zum Herzen).
Beim rechten Herzen vom Blutvolumen und dem - durch den Sympathikus einstellbaren - Kontraktionsgrad
(venösem Tonus) der peripheren Gefäße (beides steigert den
Füllungsdruck), der Pumpaktion des rechten Ventrikels (nimmt diese zu,
sinkt der Füllungsdruck), von der Körperlage (im Liegen ist der Füllungsdruck wesentlich höher als im Sitzen oder Stehen: Orthostase), von der Atemphase (Inspiration fördert den Blutstrom zum Herzen), von der Aktivität der Skeletttmuskulatur (die Muskelpumpe fördert den Rückstrom von Blut zum Herzen).  Beim linken Herzen hängt der diastoliche Füllungsdruck ab von der Atemlage (höher bei Exspiration), dem Sauerstoffgehalt der Luft (Vasokonstriktion bei Hypoxie), der Pumpleistung des linken Ventrikels (nimmt diese zu, sinkt der Füllungsdruck).
Beim linken Herzen hängt der diastoliche Füllungsdruck ab von der Atemlage (höher bei Exspiration), dem Sauerstoffgehalt der Luft (Vasokonstriktion bei Hypoxie), der Pumpleistung des linken Ventrikels (nimmt diese zu, sinkt der Füllungsdruck). vgl. dort).
vgl. dort). Über venösen Rückstrom und rechtskardiale Vorlast s. dort
Über venösen Rückstrom und rechtskardiale Vorlast s. dort
 Abbildung:
Effekte (rote Pfeile) von Blutvolumen, Inotropie
Abbildung:
Effekte (rote Pfeile) von Blutvolumen, Inotropie  und peripherem
Widerstand auf die Druck-Strömungs-Charakteristika im Kreislauf
und peripherem
Widerstand auf die Druck-Strömungs-Charakteristika im Kreislauf Cardiac output -Kurve s. Starling-Mechanismus
Cardiac output -Kurve s. Starling-Mechanismus

 ) und venösem Rückstrom (venous return).
) und venösem Rückstrom (venous return).| HZV ~ pms - pra |
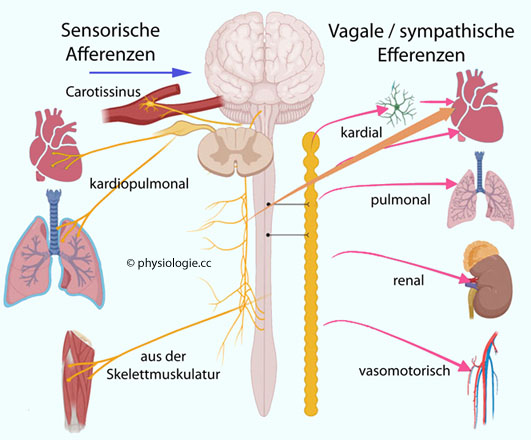
 Abbildung: Viszerale Afferenzen und Efferenzen
Abbildung: Viszerale Afferenzen und Efferenzen
 bewirkt Erhöhung des Drucks im
Bereich des rechten Vorhofs über
Vasopressin Diurese - beim Menschen spielt dieser (bei manchen Tieren
physiologisch bedautsame) Reflex eine untergeordnete Rolle, hier führt
kardiale
Drucksteigerung
vor allem zu Volumenregulation über natriuretische Peptide.
bewirkt Erhöhung des Drucks im
Bereich des rechten Vorhofs über
Vasopressin Diurese - beim Menschen spielt dieser (bei manchen Tieren
physiologisch bedautsame) Reflex eine untergeordnete Rolle, hier führt
kardiale
Drucksteigerung
vor allem zu Volumenregulation über natriuretische Peptide. Der Bezold-Jarisch-Reflex
Der Bezold-Jarisch-Reflex  ist ein Schutzreflex, der durch die Reduktion der mechanischen Belastung und verbesserte myokardiale Durchblutung (insbesondere während der Systole des linken Ventrikels) die Sauerstoffversorgung verbessert und den Herzmuskel schont (kardioprotektiver Reflex).
ist ein Schutzreflex, der durch die Reduktion der mechanischen Belastung und verbesserte myokardiale Durchblutung (insbesondere während der Systole des linken Ventrikels) die Sauerstoffversorgung verbessert und den Herzmuskel schont (kardioprotektiver Reflex). Ausgelöst wird er über Wirkung auf Rezeptoren in den Ventrikeln des Herzens - chemisch (z.B. durch das giftige Alkaloid Veratrin - erster - von Bezold - entdeckter "chemischer" Reflex), aber auch durch Vasodilatatoren wie NO (Nitrovasodilatatoren), Bradykinin oder Serotonin (-agonisten) und daraus resultierende Minderdurchblutung und Sauerstoffmangel.
Ausgelöst wird er über Wirkung auf Rezeptoren in den Ventrikeln des Herzens - chemisch (z.B. durch das giftige Alkaloid Veratrin - erster - von Bezold - entdeckter "chemischer" Reflex), aber auch durch Vasodilatatoren wie NO (Nitrovasodilatatoren), Bradykinin oder Serotonin (-agonisten) und daraus resultierende Minderdurchblutung und Sauerstoffmangel.  Die Afferenzen erfolgen (hauptsächlich über langsam leitende C-Fasern) über den N. vagus zum nucleus tractus solitarii
des Hirnstamms, vielleicht auch Nachbarkerne. Von hier aus kommt es
über das autonome Nervensystem zu den Effekten auf Herz, Gefäße und
(vermutlich) Atmung.
Die Afferenzen erfolgen (hauptsächlich über langsam leitende C-Fasern) über den N. vagus zum nucleus tractus solitarii
des Hirnstamms, vielleicht auch Nachbarkerne. Von hier aus kommt es
über das autonome Nervensystem zu den Effekten auf Herz, Gefäße und
(vermutlich) Atmung.  Der Reflexerfolg ist eine Verlangsamung des Herzschlags (negativ chronotroper Effekt: Bradykardie) und akuter Blutdruckabfall (arterielle Hypotonie), vermutlich (identer Reflex?) auch flache und langsame Atmung (Hypopnoe).
Der Reflexerfolg ist eine Verlangsamung des Herzschlags (negativ chronotroper Effekt: Bradykardie) und akuter Blutdruckabfall (arterielle Hypotonie), vermutlich (identer Reflex?) auch flache und langsame Atmung (Hypopnoe).  Ventrikuläre Chemorezeptoren:
Sie bilden den Großteil der nichtmyelinisierten Afferenzen (C-, einige
Aδ-Fasern) und melden über sympathische und parasympathische Bahnen Schmerzimpulse an das Gehirn. Aktivierbar sind sie durch Stoffe, die aus ischämischen Myozyten frei werden - Adenosin, Bradykinin, Prostaglandine, Histamin, Serotonin, Thromboxan aus Blutplättchen, Laktat, K+-Ionen, Sauerstoffradikale
(Angina pectoris!). Solche Meldungen bewirken eine reflektorische
Erhöhung des Sympathikustonus (Bradykardie, Blutdruckanstieg, evt.
Arrhythmien).
Ventrikuläre Chemorezeptoren:
Sie bilden den Großteil der nichtmyelinisierten Afferenzen (C-, einige
Aδ-Fasern) und melden über sympathische und parasympathische Bahnen Schmerzimpulse an das Gehirn. Aktivierbar sind sie durch Stoffe, die aus ischämischen Myozyten frei werden - Adenosin, Bradykinin, Prostaglandine, Histamin, Serotonin, Thromboxan aus Blutplättchen, Laktat, K+-Ionen, Sauerstoffradikale
(Angina pectoris!). Solche Meldungen bewirken eine reflektorische
Erhöhung des Sympathikustonus (Bradykardie, Blutdruckanstieg, evt.
Arrhythmien). Myelinisierte veno-atriale Mechanorezeptoren:
Bei diesen "Volumenrezeptoren" handelt es sich - wie in arteriellen
Barorezeptoren - um mechanosensible Nervenfasern. Sie liegen im
Endokard der Einmündungsgebiete der Zustromgefäße und der Vorhöfe und
signalisieren Zentralvenendruck und zentrales Blutvolumen.
Diese Größen bestimmen die Vorlast des Herzens, die von den
Volumenrezeptoren beeinflusst wird. Herzminutenvolumen und arterieller
Blutdruck stehen damit indirekt auch unter dem Einfluss der
Volumenrezeptoren.
Myelinisierte veno-atriale Mechanorezeptoren:
Bei diesen "Volumenrezeptoren" handelt es sich - wie in arteriellen
Barorezeptoren - um mechanosensible Nervenfasern. Sie liegen im
Endokard der Einmündungsgebiete der Zustromgefäße und der Vorhöfe und
signalisieren Zentralvenendruck und zentrales Blutvolumen.
Diese Größen bestimmen die Vorlast des Herzens, die von den
Volumenrezeptoren beeinflusst wird. Herzminutenvolumen und arterieller
Blutdruck stehen damit indirekt auch unter dem Einfluss der
Volumenrezeptoren. Vorhofrezeptoren
(A-Rezeptoren): Sie befinden sich in der Wand des rechten Vorhofs und signalisieren mechanische Reizung
während der Vorhofkontraktion - synchron mit der a-Welle im Venenpuls bzw. der P-Welle im EKG. Sie wurden als Herzfrequenzfühler
beschrieben.
Vorhofrezeptoren
(A-Rezeptoren): Sie befinden sich in der Wand des rechten Vorhofs und signalisieren mechanische Reizung
während der Vorhofkontraktion - synchron mit der a-Welle im Venenpuls bzw. der P-Welle im EKG. Sie wurden als Herzfrequenzfühler
beschrieben.  Hohlvenenrezeptoren (B-Rezeptoren): Diese befinden sich an den Einmündungsregionen der v. cava superior sowie der v. cava infeior. Sie melden das Ausmaß passiver Dehnung - und damit indirekt Information über die Höhe des zentralen Venendrucks; sie feuern spätsystolisch und während des frühdiastolischen Druckanstiegs, synchron mit der v-Welle des Venenpulses. Ihre Reizung reduziert den Sympathikustonus, senkt so den Blutdruck (ähnlich wie beim Barorezeptorreflex) und bremst den Renin- Angiotensin- Aldosteron- Mechanismus, was zu Volumenentlastung führt.
Hohlvenenrezeptoren (B-Rezeptoren): Diese befinden sich an den Einmündungsregionen der v. cava superior sowie der v. cava infeior. Sie melden das Ausmaß passiver Dehnung - und damit indirekt Information über die Höhe des zentralen Venendrucks; sie feuern spätsystolisch und während des frühdiastolischen Druckanstiegs, synchron mit der v-Welle des Venenpulses. Ihre Reizung reduziert den Sympathikustonus, senkt so den Blutdruck (ähnlich wie beim Barorezeptorreflex) und bremst den Renin- Angiotensin- Aldosteron- Mechanismus, was zu Volumenentlastung führt. (atrial reflex) über vagale Afferenzen und Wirkung auf das Kreislaufzentrum aktiviert:
Die Aktivität sympathischer Efferenzen zum Sinusknoten nimmt zu, das
Herz schlägt schneller (isolierte Tachykardie) - dadurch werden die
Vorhöfe entlastet.
(atrial reflex) über vagale Afferenzen und Wirkung auf das Kreislaufzentrum aktiviert:
Die Aktivität sympathischer Efferenzen zum Sinusknoten nimmt zu, das
Herz schlägt schneller (isolierte Tachykardie) - dadurch werden die
Vorhöfe entlastet.  Abbildung).
Abbildung).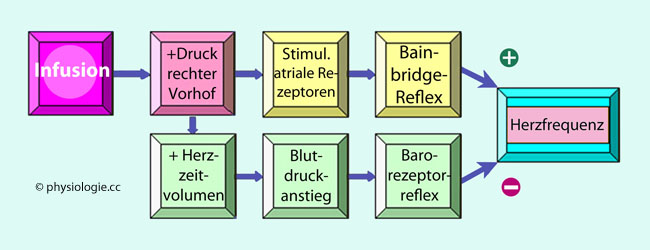
 Abbildung: Einfluss einer Volumenerhöhung ("Infusion") auf Bainbridge- und Barorezeptorreflex
Abbildung: Einfluss einer Volumenerhöhung ("Infusion") auf Bainbridge- und Barorezeptorreflex
 s. dort): Während Barorezeptoren die Stabilisierung des Blutdrucks zum Ziel haben, reagieren Volumenrezeptoren auf Dehnung mit einer Erhöhung der Flüssigkeitsausscheidung (Erniedrigung des Blutvolumens).
s. dort): Während Barorezeptoren die Stabilisierung des Blutdrucks zum Ziel haben, reagieren Volumenrezeptoren auf Dehnung mit einer Erhöhung der Flüssigkeitsausscheidung (Erniedrigung des Blutvolumens). Nichtmyelinisierte Mechanorezeptoren im Herzmuskel: Sie übertragen Mechanosensibilität aus dem gesamten Herzen und der Pulmonalarterie über sympathische und parasympathische Bahnen. Sie bewirken bei enddiastolischen Drucksteigerungen - z.B. bei tiefer Einatmung - Bradykardie und Vasodilatation
(ein Reaktionsmuster, das auch bei Reizung arterieller Barorezeptoren
auftritt). Ihr Beitrag zur Homöostase des Herzminutenvolumens ist
gering.
Nichtmyelinisierte Mechanorezeptoren im Herzmuskel: Sie übertragen Mechanosensibilität aus dem gesamten Herzen und der Pulmonalarterie über sympathische und parasympathische Bahnen. Sie bewirken bei enddiastolischen Drucksteigerungen - z.B. bei tiefer Einatmung - Bradykardie und Vasodilatation
(ein Reaktionsmuster, das auch bei Reizung arterieller Barorezeptoren
auftritt). Ihr Beitrag zur Homöostase des Herzminutenvolumens ist
gering. Barorezeptoren in den Koronararterien: Sie funktionieren wie andere arterielle Barorezeptoren und wirken stärker als Mechanorezeptoren im Ventrikelbereich.
Barorezeptoren in den Koronararterien: Sie funktionieren wie andere arterielle Barorezeptoren und wirken stärker als Mechanorezeptoren im Ventrikelbereich.  Zur Definition s. dort
Zur Definition s. dort Linkes Herz
Linkes Herz Als zentralen Venendruck
(ZVD, central venous pressure CVP) bezeichnet man den mittleren Blutdruck im Bereich der herznahem Venen
im Thorax sowie im rechten Vorhof. Er indiziert die rechtskardiale Vorlast (preload).
Als zentralen Venendruck
(ZVD, central venous pressure CVP) bezeichnet man den mittleren Blutdruck im Bereich der herznahem Venen
im Thorax sowie im rechten Vorhof. Er indiziert die rechtskardiale Vorlast (preload). Abbildung oben) bedingt sein. Der ZVD nimmt bei
Aufrichten des Körpers (Blutumverteilung in untere Körperpartien) oder
Blutverlust (mangelnde systemische Füllung) ab. Er kann mittels Zentralvenenkatheter gemessen werden -
intraoperativ oder bei Intensivpatienten, um den Kreislaufzustand zu
überwachen.
Abbildung oben) bedingt sein. Der ZVD nimmt bei
Aufrichten des Körpers (Blutumverteilung in untere Körperpartien) oder
Blutverlust (mangelnde systemische Füllung) ab. Er kann mittels Zentralvenenkatheter gemessen werden -
intraoperativ oder bei Intensivpatienten, um den Kreislaufzustand zu
überwachen.  Die Nachlast (afterload) des rechten Ventrikels ist durch den pulmonalarteriellen Druck gegeben.
Die Nachlast (afterload) des rechten Ventrikels ist durch den pulmonalarteriellen Druck gegeben. Der pulmonalkapilläre Druck (PCWP = pulmonary capillary wedge pressure)
wird als Maß für diastolische Füllung und Vorlast des linken Ventrikels angesehen.
Der pulmonalkapilläre Druck (PCWP = pulmonary capillary wedge pressure)
wird als Maß für diastolische Füllung und Vorlast des linken Ventrikels angesehen. 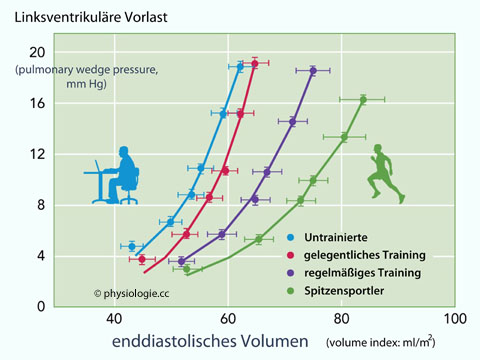
 Abbildung: Linksdiastolische Druck-Volumen- Relation in Abhängigkeit vom körperlichen Trainingsgrad
Abbildung: Linksdiastolische Druck-Volumen- Relation in Abhängigkeit vom körperlichen Trainingsgrad
 Abbildung).
Abbildung). Die Nachlast für den
linken Ventrikel ist die arterielle Impedanz (dynamischer Widerstand an
der Aortenwurzel während der Austreibungszeit), klinisch wird sie durch
die Höhe des arteriellen Blutdrucks abgeschätzt.
Die Nachlast für den
linken Ventrikel ist die arterielle Impedanz (dynamischer Widerstand an
der Aortenwurzel während der Austreibungszeit), klinisch wird sie durch
die Höhe des arteriellen Blutdrucks abgeschätzt.| rechter Ventrikel |
linker Ventrikel |
||
| Maß für die Vorlast (preload) |
Maß für die Nachlast (afterload) |
Maß für die Vorlast (preload) | Maß für die Nachlast (afterload) |
| Zentralvenen- druck |
Pulmonalarterien- druck |
PCWP |
Arterieller Blutdruck |
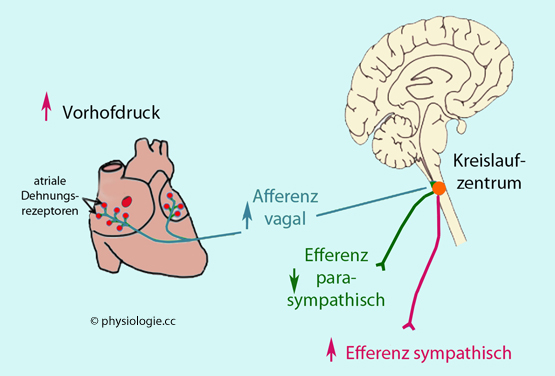
 Abbildung: Vorhofrezeptor- (Bainbridge-) Reflex
Abbildung: Vorhofrezeptor- (Bainbridge-) Reflex
 Bei bereits hohem Druck in den Vorhöfen löst weitere Dehnung von Vorhofrezeptoren über vagale Afferenzen den Bainbridge-Reflex aus (s. oben): Das Herz versucht das hohe Blutangebot über die
Schlagfrequenz 'abzuarbeiten'.
Bei bereits hohem Druck in den Vorhöfen löst weitere Dehnung von Vorhofrezeptoren über vagale Afferenzen den Bainbridge-Reflex aus (s. oben): Das Herz versucht das hohe Blutangebot über die
Schlagfrequenz 'abzuarbeiten'. Bei niedrigem Ausgangsdruck hingegen erhöht der Frank-Starling-Mechanismus das Schlagvolumen mit zunehmender diastolischer Füllung. Steigender
Blutdruck aktiviert wiederum den Barorezeptorreflex, was den Sinusknoten hemmt und die Herzfrequenz senkt (grüne Blöcke in der
Bei niedrigem Ausgangsdruck hingegen erhöht der Frank-Starling-Mechanismus das Schlagvolumen mit zunehmender diastolischer Füllung. Steigender
Blutdruck aktiviert wiederum den Barorezeptorreflex, was den Sinusknoten hemmt und die Herzfrequenz senkt (grüne Blöcke in der  Abbildung).
Abbildung). Vgl. dort
Vgl. dort
 Einerseits steigt der Druck im Venensystem
(rechtskardiale Vorlast) und es können kardiale Ödeme auftreten,
insbesondere in den Beinen und in der Leber.
Einerseits steigt der Druck im Venensystem
(rechtskardiale Vorlast) und es können kardiale Ödeme auftreten,
insbesondere in den Beinen und in der Leber.  Andererseits nimmt die
Auswurfleistung in den Lungenkreislauf ab (rechtskardiale Nachlast)
und die hier gelegenen Dehnungsrezeptoren signalisieren einen
Volumenmangel, was zu einer Retention von Wasser und Kochsalz in der
Niere führt (chronisch erhöhter Sympathikustonus!) und die Ödembildung
weiter anheizt.
Andererseits nimmt die
Auswurfleistung in den Lungenkreislauf ab (rechtskardiale Nachlast)
und die hier gelegenen Dehnungsrezeptoren signalisieren einen
Volumenmangel, was zu einer Retention von Wasser und Kochsalz in der
Niere führt (chronisch erhöhter Sympathikustonus!) und die Ödembildung
weiter anheizt.  Therapeutisch kommt eine Kombination aus Herzstärkung
(z.B. Glykoside) und Natriurese (z.B. Schleifendiuretika) in Betracht
(je nach Klassifikation des Krankheitsbildes).
Therapeutisch kommt eine Kombination aus Herzstärkung
(z.B. Glykoside) und Natriurese (z.B. Schleifendiuretika) in Betracht
(je nach Klassifikation des Krankheitsbildes). 
 Gefäßsystem (venöser Rückstrom, arterielle Impedanz) und Herz sind funktionell aufeinander abgestimmt: Erhöhung des Blutvolumens (vermehrte Vorlast) steigert (Frank-Starling),
Vasokonstriktion (erhöhter peripherer Widerstand) senkt das
Herzzeitvolumen. An der Schnittstelle Herz / Gefäßsystem überschneiden
sich die Arbeitskurven von Herz und Kreislauf im aktuellen
“Arbeitspunkt”. Steigt der periphere (systemische) Druck, fließt mehr,
steigt der Zentralvenendruck, fließt weniger Blut zum Herzen Gefäßsystem (venöser Rückstrom, arterielle Impedanz) und Herz sind funktionell aufeinander abgestimmt: Erhöhung des Blutvolumens (vermehrte Vorlast) steigert (Frank-Starling),
Vasokonstriktion (erhöhter peripherer Widerstand) senkt das
Herzzeitvolumen. An der Schnittstelle Herz / Gefäßsystem überschneiden
sich die Arbeitskurven von Herz und Kreislauf im aktuellen
“Arbeitspunkt”. Steigt der periphere (systemische) Druck, fließt mehr,
steigt der Zentralvenendruck, fließt weniger Blut zum Herzen  Kardiopulmonale Rezeptoren in Vorhöfen,
Ventrikeln und herznahen Gefäßen übertragen Information über den
Vagusnerv an Kreislaufzentrum und Hypothalamus. Ihre Reizung (z.B.
durch Drucksteigerung) senkt Herzfrequenz und peripheren Widerstand (nucl. tractus solitarii)
und inhibiert die Sekretion drucksteigernder Hormone (Hypothalamus:
Vasopressin). Sinkender Druck aktiviert umgekehrt Mechanismen, welche
die Vorlast des Herzens steigern Kardiopulmonale Rezeptoren in Vorhöfen,
Ventrikeln und herznahen Gefäßen übertragen Information über den
Vagusnerv an Kreislaufzentrum und Hypothalamus. Ihre Reizung (z.B.
durch Drucksteigerung) senkt Herzfrequenz und peripheren Widerstand (nucl. tractus solitarii)
und inhibiert die Sekretion drucksteigernder Hormone (Hypothalamus:
Vasopressin). Sinkender Druck aktiviert umgekehrt Mechanismen, welche
die Vorlast des Herzens steigern Ventrikuläre Chemorezeptoren (Adenosin, Bradykinin, Prostaglandine, Histamin, Serotonin, Thromboxan, Laktat, K+, Sauerstoffradikale) bilden den Großteil nichtmyelinisierter C- und Aδ-Afferenzen, melden Schmerz an das Gehirn und erhöhen sympathische Efferenzen (Bradykardie, Blutdruckanstieg). Myelinisierte veno-atriale Mechanorezeptoren
messen das zentrale Blutvolumen: Vorhof (A-) rezeptoren feuern während
der Vorhofkontraktion (Herzfrequenzfühler) und lösen bei starker
Dehnung den Bainbridge-Reflex (Tachykardie entlastet die Vorhöfe) aus;
Hohlvenen (B-) rezeptoren melden den zentralen Venendruck
(frühdiastolischer Druckanstieg), senken Sympathikustonus (ähnlich
wie Barorezeptorreflex) und renalen Gefäßwiderstand, und bremsen den Renin- Angiotensin- Aldosteron-
Mechanismus (Volumenentlastung). Nichtmyelinisierte Mechanorezeptoren
im gesamten Herzen (plus Pulmonalarterie) bewirken bei enddiastolischen
Drucksteigerungen (tiefe Einatmung) Bradykardie und Vasodilatation. Barorezeptoren in den Koronararterien wirken stärker reflexogen als ventrikuläre Mechanorezeptoren. Der Bezold-Jarisch-Reflex ist ein vagaler Schutzreflex, ausgelöst durch Minderdurchblutung, Sauerstoffmangel, Serotonin: er führt zu Bradykardie und Blutdrucksenkung Ventrikuläre Chemorezeptoren (Adenosin, Bradykinin, Prostaglandine, Histamin, Serotonin, Thromboxan, Laktat, K+, Sauerstoffradikale) bilden den Großteil nichtmyelinisierter C- und Aδ-Afferenzen, melden Schmerz an das Gehirn und erhöhen sympathische Efferenzen (Bradykardie, Blutdruckanstieg). Myelinisierte veno-atriale Mechanorezeptoren
messen das zentrale Blutvolumen: Vorhof (A-) rezeptoren feuern während
der Vorhofkontraktion (Herzfrequenzfühler) und lösen bei starker
Dehnung den Bainbridge-Reflex (Tachykardie entlastet die Vorhöfe) aus;
Hohlvenen (B-) rezeptoren melden den zentralen Venendruck
(frühdiastolischer Druckanstieg), senken Sympathikustonus (ähnlich
wie Barorezeptorreflex) und renalen Gefäßwiderstand, und bremsen den Renin- Angiotensin- Aldosteron-
Mechanismus (Volumenentlastung). Nichtmyelinisierte Mechanorezeptoren
im gesamten Herzen (plus Pulmonalarterie) bewirken bei enddiastolischen
Drucksteigerungen (tiefe Einatmung) Bradykardie und Vasodilatation. Barorezeptoren in den Koronararterien wirken stärker reflexogen als ventrikuläre Mechanorezeptoren. Der Bezold-Jarisch-Reflex ist ein vagaler Schutzreflex, ausgelöst durch Minderdurchblutung, Sauerstoffmangel, Serotonin: er führt zu Bradykardie und Blutdrucksenkung Ein Maß für die
Vorlast des rechten Herzens ist der zentrale Venendruck (mittlerer
Blutdruck im Bereich des rechten Vorhofs), für die Nachlast der
pulmonalarterielle Druck. Für das linke Herz wird die Vorlast durch den
pulmonalkapillären (PCWP), die Nachlast durch den arteriellen Druck
abschätzbar. Steigerung der Herzleistung senkt den Vorhofdruck Ein Maß für die
Vorlast des rechten Herzens ist der zentrale Venendruck (mittlerer
Blutdruck im Bereich des rechten Vorhofs), für die Nachlast der
pulmonalarterielle Druck. Für das linke Herz wird die Vorlast durch den
pulmonalkapillären (PCWP), die Nachlast durch den arteriellen Druck
abschätzbar. Steigerung der Herzleistung senkt den Vorhofdruck |
