




 Regulation der Atmung
Regulation der Atmung
 Bötzinger-Komplex:
Neuronengruppe im Hirnstamm (Atemzentrum), die von Jack Feldman (UCLA)
während eines Meetings nach einer auf dem Tisch stehenden Flasche
Weißwein (Bötzinger) benannt wurde
Bötzinger-Komplex:
Neuronengruppe im Hirnstamm (Atemzentrum), die von Jack Feldman (UCLA)
während eines Meetings nach einer auf dem Tisch stehenden Flasche
Weißwein (Bötzinger) benannt wurde


| Die Atmung folgt einem autonomen Rhythmus (Spontanatmung), andererseits wird sie durch zahlreiche periphere (Rückkopplung) und zentrale Impulse (Steuerung)
modifiziert. Nervenzellgruppen im Hirnstamm generieren durch wechselseitige Anregung und Hemmung spontane
Entladungssalven. Sie reagieren auf zentrale Steuerimpulse sowie Signale von peripheren Rezeptoren und werden als Atemzentrum zusammengefasst. Physische Belastung steigert die Ventilation bis etwa 20-fach, angeregt durch zentrale (vor allem aus motorischen Zentren, "Mitinnervation") und periphere Impulse (aus dem Bewegungssystem und der Lunge). Steigender pCO2 (auch sinkender pH oder pO2) - erfasst durch Chemorezeptoren in Hirnstamm und arteriellen Glomuskörperchen - ist ein weiterer wichtiger Atemantrieb, erhöhter CO2-Partialdruck (Hyperkapnie) kann die Ventilation bis ~10fach steigern. Die Empfindlichkeit der Atemantriebe kann durch Begleitfaktoren beeinflust werden, z.B. verändert der pO2 die CO2-Kennkurve (Reaktion der Atmung auf veränderte CO2-Werte). Aus der Lunge melden Dehnungs- und Irritationsrezeptoren, sie begrenzen die Atemtiefe (Hering-Breuer-Reflex) und beeinflussen Atemform und Bronchien (Weite, Sekretion). Die Bronchien sind parasympathisch (Bronchialmuskulatur) und sympathisch versorgt (Gefäße, Drüsen). Die Atmung ist in den Säure-Basen-Haushalt integriert: Sie ist das System, das die größte Menge an sauren Valenzen aus dem Körper entfernt (Kohlensäure). Nichtrespiratorische pH-Abweichungen werden durch vermehrtes oder verringertes Abatmen von CO2 korrigiert (respiratorische Kompensation). Eine Atemform, die in Relation zum Säure-Basen-Status zu viel CO2 abatmet, nennt man Hyperventilation (senkt den pCO2: Hypokapnie); atmet man zuwenig CO2 ab, spricht man von Hypoventilation (bewirkt Hyperkapnie). |
 Atmung, Rezeptoren und Afferenzen
Atmung, Rezeptoren und Afferenzen  Weitere pulmonale Rezeptoren
Weitere pulmonale Rezeptoren  Periphere Chemorezeptoren
Periphere Chemorezeptoren  Zentrale Chemorezeptoren
Zentrale Chemorezeptoren  Atemzentrum
Atemzentrum  Respiratorische Sinusarrhythmie
Respiratorische Sinusarrhythmie  CO2, Hypo- und Hyperkapnie, Hypo- und Hyperventilation
CO2, Hypo- und Hyperkapnie, Hypo- und Hyperventilation

 J-Rezeptoren
J-Rezeptoren  Azidose, Alkalose
Azidose, Alkalose  Hyper / Hypokapnie
Hyper / Hypokapnie  Eu-, Tachy-, Brady-, Apnoe
Eu-, Tachy-, Brady-, Apnoe 
 Core messages
Core messages M3-Rezeptoren dominieren in der Lunge, sie mediieren Bronchokonstiktion und Schleimbildung.
M3-Rezeptoren dominieren in der Lunge, sie mediieren Bronchokonstiktion und Schleimbildung.  M1-Rezeptoren regen die nikotinische Neurotransmission an,
M1-Rezeptoren regen die nikotinische Neurotransmission an,  M2-Rezeptoren
sind Autorezeptoren, sie vermitteln negative Rückkopplung an
postganglionären Zellen (Inhibition der Acetylcholinfreisetzung).
M2-Rezeptoren
sind Autorezeptoren, sie vermitteln negative Rückkopplung an
postganglionären Zellen (Inhibition der Acetylcholinfreisetzung).  Phosphodiesterasehemmer wirken bronchodilatierend und reduzieren den Atemwegwiderstand, indem sie [cAMP] in der Bronchialmuskulatur erhöhen. - Das direkt in die Lunge einzubringende ß2-Sympathomimetikum Salbutamol (Albutamol) wirkt bronchienerweiternd, eine Nebenwirkung (über ß1-Rezeptoren) ist Tachykardie.
Phosphodiesterasehemmer wirken bronchodilatierend und reduzieren den Atemwegwiderstand, indem sie [cAMP] in der Bronchialmuskulatur erhöhen. - Das direkt in die Lunge einzubringende ß2-Sympathomimetikum Salbutamol (Albutamol) wirkt bronchienerweiternd, eine Nebenwirkung (über ß1-Rezeptoren) ist Tachykardie.
 Abbildung: Innervation der Atemwege
Abbildung: Innervation der Atemwege| Adrenalin erniedrigt den Atemwegwiderstand über relaxierende Wirkung von ß2-Adrenozeptoren an der Bronchialmuskulatur |
 einerseits möglichst alle relevanten
Zustandsvariablen im Körper Berücksichtigung finden (wie momentane
Atemtiefe, Atemgaswerte, pH-Wert im Blut, Signale aus Oberflächen- und
Tiefensensibilität, Schmerzeinflüsse),
einerseits möglichst alle relevanten
Zustandsvariablen im Körper Berücksichtigung finden (wie momentane
Atemtiefe, Atemgaswerte, pH-Wert im Blut, Signale aus Oberflächen- und
Tiefensensibilität, Schmerzeinflüsse),  andererseits aktuelle
Präferenzen die regulative Oberhand zugewiesen bekommen (bei der Durchführung bestimmter motorischer Aufgaben, z.B. beim Sprechen, Schlucken, usw).
andererseits aktuelle
Präferenzen die regulative Oberhand zugewiesen bekommen (bei der Durchführung bestimmter motorischer Aufgaben, z.B. beim Sprechen, Schlucken, usw).  Periphere (in Paraganglien, Atemapparat,
Bewegungssystem, Haut, Sinnesorganen) und zentrale Rezeptoren (im
Gehirn) ermöglichen eine Steuerung der Atmung, die nicht auf bewusste
Kontrolle angewiesen ist.
Periphere (in Paraganglien, Atemapparat,
Bewegungssystem, Haut, Sinnesorganen) und zentrale Rezeptoren (im
Gehirn) ermöglichen eine Steuerung der Atmung, die nicht auf bewusste
Kontrolle angewiesen ist.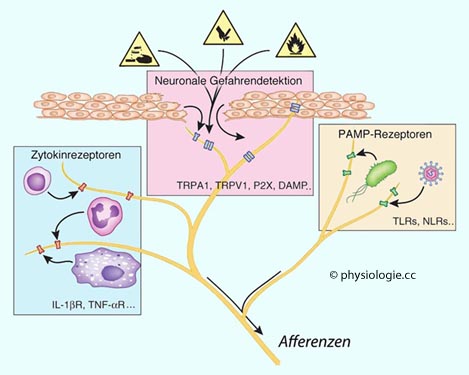
 Abbildung: Gefahrenmeldungen aus der Umwelt treffen u.a. in lufthältigen Räumen der Lunge ein
Abbildung: Gefahrenmeldungen aus der Umwelt treffen u.a. in lufthältigen Räumen der Lunge ein Neuronale Gefahrenrezeptoren: TRP-Kanäle s. dort
Neuronale Gefahrenrezeptoren: TRP-Kanäle s. dort  P2X-Rezeptoren s. dort
P2X-Rezeptoren s. dort Zytokinrezeptoren: Interleukin s. dort
Zytokinrezeptoren: Interleukin s. dort  TNF s. dort
TNF s. dort
 Rezeptoren in Lunge und Luftwegen   Nach Schwartzstein / Parker, Respiratory Physiology - A Clinical Approach (2006) |
||||
| Lage |
Fasern myelinisiert? |
Rezeptortyp |
Reiz |
Effekt auf Atmung |
| Obere Luftwege |
||||
| Nase |
ja |
mechanisch |
Strömung |
Abnahme |
| Rachen |
ja |
mechanisch |
Schlucken |
Stillstand |
| Lunge |
||||
| Langsam adaptierende Rezeptoren |
ja |
mechanisch |
Erweiterung der Lunge |
Erhöhte Exspirationszeit |
| Deflation der Lunge |
Erhöhte Atemfrequenz |
|||
| Rasch adaptierende Rezeptoren |
ja |
mechanisch und chemisch |
Deflation der Lunge | Erhöhte Atemfrequenz, Seufzen |
| C-Fasern |
nein |
mechanisch |
erhöhter Kapillardruck |
erhöhte Atemfrequenz (?) |
| chemisch |
Capsaicin Bradykinin Serotonin Prostaglandin |
|||
 RARs sind rasch adaptierende, SARs langsam
adaptierende Dehnungsrezeptoren in der Lunge. Letztere stellen ihren
Messbereich und ihr Aktivitätsverhalten gegebenenfalls auf veränderte
Bedingungen ein. Beide haben myelinisierte Afferenzen.
RARs sind rasch adaptierende, SARs langsam
adaptierende Dehnungsrezeptoren in der Lunge. Letztere stellen ihren
Messbereich und ihr Aktivitätsverhalten gegebenenfalls auf veränderte
Bedingungen ein. Beide haben myelinisierte Afferenzen. Die Afferenzen des Lungendehnungsreflexes ziehen mit dem N. vagus zum Hirnstamm.
Die Afferenzen des Lungendehnungsreflexes ziehen mit dem N. vagus zum Hirnstamm. | Dehnung der Lunge aktiviert Afferenzen über den N. vagus Aktivität dieser Afferenzen verringert die Tiefe der Inspiration (Lungendehnungsreflex, Hering-Breuer-Reflex) - zumindest bei Neugeborenen Die am Lungendehnungsreflex beteiligten Nervenfasern verlaufen im N. vagus (X) |
 1868 entdeckte und beschrieb Karl Ewald Hering zusammen mit Josef Breuer
die "Selbststeuerung der Atmung" durch dehnungsabhängige
Rezeptorreizung in den Luftwegen und - über sensible Fasern des
pulmonalen N. vagus vermittelte - Hemmung der Inspiration und Freigabe
der Exspiration ("Hering-Breuer-Reflex"). Diese experimentelle
Untersuchung und Analyse eines biologischen Regelmechanismus gilt als früher Schritt zur Entwicklung der Biokybernetik. Den molekularbiologischen Mechanismus der involvierten Mechanorezeptoren beschrieb die Arbeitsgruppe um Ardem Patapoutian.
1868 entdeckte und beschrieb Karl Ewald Hering zusammen mit Josef Breuer
die "Selbststeuerung der Atmung" durch dehnungsabhängige
Rezeptorreizung in den Luftwegen und - über sensible Fasern des
pulmonalen N. vagus vermittelte - Hemmung der Inspiration und Freigabe
der Exspiration ("Hering-Breuer-Reflex"). Diese experimentelle
Untersuchung und Analyse eines biologischen Regelmechanismus gilt als früher Schritt zur Entwicklung der Biokybernetik. Den molekularbiologischen Mechanismus der involvierten Mechanorezeptoren beschrieb die Arbeitsgruppe um Ardem Patapoutian. Rasch adaptierende Dehnungsrezeptoren
im Bronchialbaum (rapidly adapting receptors, RARs) vermitteln Irritationsreize, wie sie durch plötzliche
und anhaltende Weitung des Alveolarraums auftreten. Diese Rezeptoren
sind sehr empfindlich auf Mediatoren wie Histamin, Serotonin,
Prostaglandine, Bradykinin, aber auch auf inhalierte Reizstoffe wie
Zigarettenrauch, Ammoniak oder Äther. Ihre Aufgabe ist es, potentiell
pathologische Prozesse in der Lunge zu detektieren.
Rasch adaptierende Dehnungsrezeptoren
im Bronchialbaum (rapidly adapting receptors, RARs) vermitteln Irritationsreize, wie sie durch plötzliche
und anhaltende Weitung des Alveolarraums auftreten. Diese Rezeptoren
sind sehr empfindlich auf Mediatoren wie Histamin, Serotonin,
Prostaglandine, Bradykinin, aber auch auf inhalierte Reizstoffe wie
Zigarettenrauch, Ammoniak oder Äther. Ihre Aufgabe ist es, potentiell
pathologische Prozesse in der Lunge zu detektieren. J-Reflex: In der Wand von Alveolen und Atemwegen
befinden sich weiters "J-Rezeptoren",
die auf Irritationen
reagieren und reflektorisch
Bronchokonstriktion, Schleimsekretion, sowie flache und rasche Atmung
auslösen. Dieses Reaktionsmuster schützt die Lunge, indem es die
pulmonalen Abwehrvorgänge begünstigt. Man nimmt an, dass der J-Reflex durch Emboli oder Ödeme in der Lunge ausgelöst wird.
J-Reflex: In der Wand von Alveolen und Atemwegen
befinden sich weiters "J-Rezeptoren",
die auf Irritationen
reagieren und reflektorisch
Bronchokonstriktion, Schleimsekretion, sowie flache und rasche Atmung
auslösen. Dieses Reaktionsmuster schützt die Lunge, indem es die
pulmonalen Abwehrvorgänge begünstigt. Man nimmt an, dass der J-Reflex durch Emboli oder Ödeme in der Lunge ausgelöst wird. J-Rezeptoren sind juxtakapilläre Rezeptoren mit C-Faser-Afferenzen
in der Tiefe des Lungengewebes. Sie werden möglicherweise durch
Erhöhung des Kapillardrucks angeregt, oder durch Ansammlung pulmonaler
interstitieller Flüssigkeit (wie sie bei Herzschwäche auftritt).
J-Rezeptoren sind juxtakapilläre Rezeptoren mit C-Faser-Afferenzen
in der Tiefe des Lungengewebes. Sie werden möglicherweise durch
Erhöhung des Kapillardrucks angeregt, oder durch Ansammlung pulmonaler
interstitieller Flüssigkeit (wie sie bei Herzschwäche auftritt). Aktivierung von Schmerzfasern in der Lunge regt die Ventilation an.
Aktivierung von Schmerzfasern in der Lunge regt die Ventilation an. Rezeptoren im gesamten
Bewegungsapparat (Muskeln,
Sehnen, Gelenke) stimulieren bei physischer Belastung die Atmung von
Anfang an - z.T. als "Vorwärtskopplung", d.h. im Zuge einer motorischen
"Efferenzkopie" (efference copy) an Atem- und Kreislaufzentrum im Hirnstamm.
Die Atemgaswerte bleiben auf diese Weise im Wesentlichen stabil, es
tritt weder Hypoxie noch Azidose
auf (das erfolgt erst nach Übersteigen der aeroben Kapazität).
Rezeptoren im gesamten
Bewegungsapparat (Muskeln,
Sehnen, Gelenke) stimulieren bei physischer Belastung die Atmung von
Anfang an - z.T. als "Vorwärtskopplung", d.h. im Zuge einer motorischen
"Efferenzkopie" (efference copy) an Atem- und Kreislaufzentrum im Hirnstamm.
Die Atemgaswerte bleiben auf diese Weise im Wesentlichen stabil, es
tritt weder Hypoxie noch Azidose
auf (das erfolgt erst nach Übersteigen der aeroben Kapazität). Als Azidose versteht man im klinischen Gebrauch einen Blut-pH (arteriell) unter 7,35, als Alkalose einen solchen von über 7,45. Dabei ist zu berücksichtigen, dass der Neutralpunkt ([H+] = [OH-]) bei Körpertemperatur bei pH 6,8 (nicht 7,0) und der physiologische Blut-pH bei 7,4 (zwischen 7,35 und 7,45) liegt (
Als Azidose versteht man im klinischen Gebrauch einen Blut-pH (arteriell) unter 7,35, als Alkalose einen solchen von über 7,45. Dabei ist zu berücksichtigen, dass der Neutralpunkt ([H+] = [OH-]) bei Körpertemperatur bei pH 6,8 (nicht 7,0) und der physiologische Blut-pH bei 7,4 (zwischen 7,35 und 7,45) liegt ( Näheres s. dort).
Näheres s. dort). (
( Abbildung unten - nicht zu verwechseln mit dem drucksensiblen Sinus caroticus) sowie den dem Aortenbogen außen anliegenden glomera aortica (Paraganglien; nicht zu verwechseln mit den Barorezeptoren in der Wand des Aortenbogens).
Abbildung unten - nicht zu verwechseln mit dem drucksensiblen Sinus caroticus) sowie den dem Aortenbogen außen anliegenden glomera aortica (Paraganglien; nicht zu verwechseln mit den Barorezeptoren in der Wand des Aortenbogens).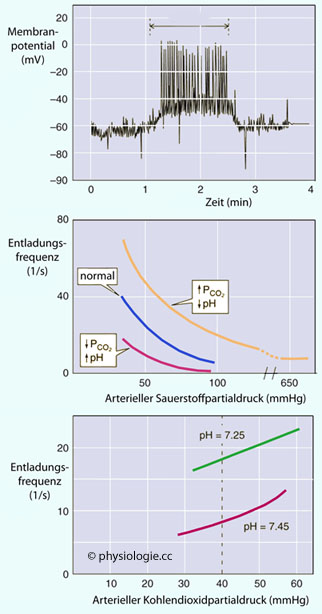
 Abbildung: Chemosensitivität eines glomus caroticum
Abbildung: Chemosensitivität eines glomus caroticum
 Abbildung). Ein Anstieg des pO2 über 100 mmHg wirkt sich hingegen so gut wie nicht aus.
Abbildung). Ein Anstieg des pO2 über 100 mmHg wirkt sich hingegen so gut wie nicht aus. Da die sauerstoffempfindlichen Rezeptoren den Partialdruck (pO2), nicht aber die transportierte Sauerstoffmenge messen, hat eine Anämie an sich - z.B. bedingt durch Eisenmangel - keinen
atemanregenden Effekt.
Da die sauerstoffempfindlichen Rezeptoren den Partialdruck (pO2), nicht aber die transportierte Sauerstoffmenge messen, hat eine Anämie an sich - z.B. bedingt durch Eisenmangel - keinen
atemanregenden Effekt. 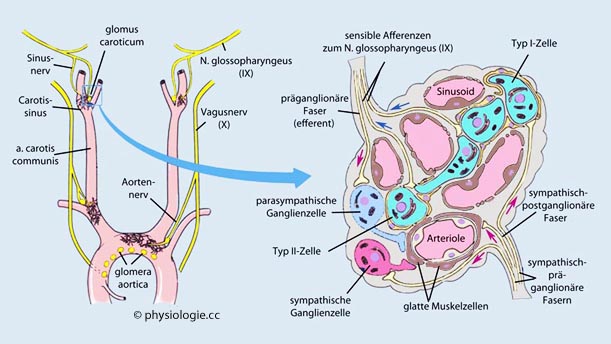
 Abbildung: Lage peripherer Chemorezeptoren (links) und Aufbau / Funktion eines Carotiskörperchens (rechts)
Abbildung: Lage peripherer Chemorezeptoren (links) und Aufbau / Funktion eines Carotiskörperchens (rechts) Typ I-Glomuszellen (Hauptzellen, etwa 10 µm Durchmesser) sind chemosensitiv und mittels gap junctions
miteinander verbunden. Der von ihnen (infolge Hypoxie, Hyperkapnie,
Azidose) freigesetzte Neurotransmitter (Dopamin?) induziert an
afferenten Nervenfasern Aktionspotentiale.
Typ I-Glomuszellen (Hauptzellen, etwa 10 µm Durchmesser) sind chemosensitiv und mittels gap junctions
miteinander verbunden. Der von ihnen (infolge Hypoxie, Hyperkapnie,
Azidose) freigesetzte Neurotransmitter (Dopamin?) induziert an
afferenten Nervenfasern Aktionspotentiale. Typ II-Zellen (sustentacular cells) sind gliaähnlich.
Typ II-Zellen (sustentacular cells) sind gliaähnlich.
 Abbildung) haben die höchste Durchblutungsrate aller Gewebe im Körper, sodass im gesamten Organ die für die Steuerung der Atmung relevanten Werte herrschen.
Abbildung) haben die höchste Durchblutungsrate aller Gewebe im Körper, sodass im gesamten Organ die für die Steuerung der Atmung relevanten Werte herrschen.  Die spezifischen Zellen der Glomera heißen Glomuszellen. Diese stammen vom Neuroektoderm ab und ähneln Nervenzellen. Ihre wichtigste Funktion ist die Reaktion auf Hypoxie:
Ihre Membran verfügt über zahlreiche spannungsgesteuerte Ionenkanäle,
sie können Aktionspotentiale generieren, und ihre intrazellulären
Vesikel enthalten Transmitterstoffe (Acetylcholin, Dopamin, ATP, Noradrenalin, Substanz P, Metenkephalin), die sie bei Stimulation freisetzen.
Diese Transmitter kontrollieren die
Aktionspotentialfrequenz der afferenten Fasern des Sinus- (glomera carotica) bzw.
Aortennerven (glomera aortica); diese enthalten ebenfalls Vesikel, sodass die Synapsen
zwischen Glomuszelle und sensibler Nervenfaser möglicherweise
bidirektional wirken.
Die spezifischen Zellen der Glomera heißen Glomuszellen. Diese stammen vom Neuroektoderm ab und ähneln Nervenzellen. Ihre wichtigste Funktion ist die Reaktion auf Hypoxie:
Ihre Membran verfügt über zahlreiche spannungsgesteuerte Ionenkanäle,
sie können Aktionspotentiale generieren, und ihre intrazellulären
Vesikel enthalten Transmitterstoffe (Acetylcholin, Dopamin, ATP, Noradrenalin, Substanz P, Metenkephalin), die sie bei Stimulation freisetzen.
Diese Transmitter kontrollieren die
Aktionspotentialfrequenz der afferenten Fasern des Sinus- (glomera carotica) bzw.
Aortennerven (glomera aortica); diese enthalten ebenfalls Vesikel, sodass die Synapsen
zwischen Glomuszelle und sensibler Nervenfaser möglicherweise
bidirektional wirken.  Abbildung) und kommunizieren über gap junctions (funktionelles Synzytium).
Abbildung) und kommunizieren über gap junctions (funktionelles Synzytium).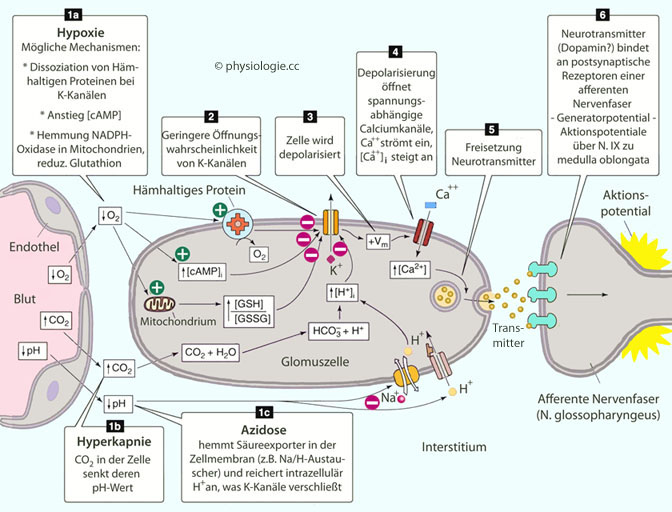
 Abbildung: Reaktion einer Glomuszelle auf Abnahme des pO2 bzw. pH oder Anstieg des pCO2
Abbildung: Reaktion einer Glomuszelle auf Abnahme des pO2 bzw. pH oder Anstieg des pCO2

 Proteine, die Häm enthalten
(O2 binden können), schließen bei Sauerstoffmangel benachbarte Kaliumkanäle;
Proteine, die Häm enthalten
(O2 binden können), schließen bei Sauerstoffmangel benachbarte Kaliumkanäle;  Mitochondrien lassen den Quotienten reduziertes / oxidiertes
Glutathion ansteigen;
Mitochondrien lassen den Quotienten reduziertes / oxidiertes
Glutathion ansteigen; die cAMP-Konzentration reagiert als Glied in der second-messenger-Kette (
die cAMP-Konzentration reagiert als Glied in der second-messenger-Kette ( Abbildung).
Abbildung).
 Abbildung: Atmungssystem und Atemzentrum
Abbildung: Atmungssystem und Atemzentrum zentralen
(Großhirn: willkürliche Beeinflussung, feed-forward-Koppelung bei
Aufnahme körperlicher Aktivität; limbisches System: emotionale
Reaktionen, z.B. Aufschreien; zentrale Chemorezeptoren: pH, pCO2) und
zentralen
(Großhirn: willkürliche Beeinflussung, feed-forward-Koppelung bei
Aufnahme körperlicher Aktivität; limbisches System: emotionale
Reaktionen, z.B. Aufschreien; zentrale Chemorezeptoren: pH, pCO2) und peripheren Quellen (Chemorezeptoren: pO2;
Dehnung der Lunge: Hering-Breuer-Reflex; Propriozeption im Muskel:
Feedback-Koppelung; Berührung, Schmerz, Temperatur: schreckhafte
Inspiration u.a.)
peripheren Quellen (Chemorezeptoren: pO2;
Dehnung der Lunge: Hering-Breuer-Reflex; Propriozeption im Muskel:
Feedback-Koppelung; Berührung, Schmerz, Temperatur: schreckhafte
Inspiration u.a.)
 erregt die zentralen Chemorezeptoren.
Unter normoxischen Bedingungen tragen sie zu 65-80% zur Reaktion auf respiratorische Azidose bei: Die Hyperkapnie wird durch Vertiefung und Beschleunigung der Atmung beseitigt.
erregt die zentralen Chemorezeptoren.
Unter normoxischen Bedingungen tragen sie zu 65-80% zur Reaktion auf respiratorische Azidose bei: Die Hyperkapnie wird durch Vertiefung und Beschleunigung der Atmung beseitigt.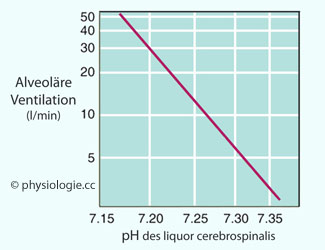
 Abbildung: Atmung in Abhängigkeit vom pH-Wert im liquor cerebrospinalis
Abbildung: Atmung in Abhängigkeit vom pH-Wert im liquor cerebrospinalis
 Abbildung).
Abbildung).
 CO2
diffundiert frei aus dem Blut in den Liquor (der kaum Proteine enthält
und daher schlechter gepuffert ist als Blut) und von dort in das
Interstitium, das u.a. die für die Atemsteuerung zuständigen Neuronen
umgibt
CO2
diffundiert frei aus dem Blut in den Liquor (der kaum Proteine enthält
und daher schlechter gepuffert ist als Blut) und von dort in das
Interstitium, das u.a. die für die Atemsteuerung zuständigen Neuronen
umgibt Durch Reaktion mit Wasser entsteht Kohlensäure, die in H+ und Bicarbonat dissoziiert
Durch Reaktion mit Wasser entsteht Kohlensäure, die in H+ und Bicarbonat dissoziiert Wasserstoffionen diffundieren in Chemorezeptoren, welche dann das Atemzentrum anregen (proportional zum arteriellen pCO2-Wert), die Ventilation steigt an, CO2 wird vermehrt abgeatmet
Wasserstoffionen diffundieren in Chemorezeptoren, welche dann das Atemzentrum anregen (proportional zum arteriellen pCO2-Wert), die Ventilation steigt an, CO2 wird vermehrt abgeatmet Seufzen, Gähnen, Husten, Niesen
Seufzen, Gähnen, Husten, Niesen
 Abbildung: Kontrolle der Atmung
Abbildung: Kontrolle der Atmung
 Eine dorsale Neuronengruppe (DRG, dorsal respiratory group) steuert vor allem das Zwerchfell (normale Einatmung)
Eine dorsale Neuronengruppe (DRG, dorsal respiratory group) steuert vor allem das Zwerchfell (normale Einatmung) Eine ventrale Neuronengruppe (VRG, ventral respiratory group)
steuert die Interkostalmuskeln (forcierte Ausatmung, Verstäkung der
Einatmung) und enthält den Prä-Bötzinger-Komplex (respiratorischer
Schrittmacher, s. unten)
Eine ventrale Neuronengruppe (VRG, ventral respiratory group)
steuert die Interkostalmuskeln (forcierte Ausatmung, Verstäkung der
Einatmung) und enthält den Prä-Bötzinger-Komplex (respiratorischer
Schrittmacher, s. unten) Ein apneustisches Zentrum verhindert Überdehnung der Lunge
Ein apneustisches Zentrum verhindert Überdehnung der Lunge Ein pneumotaktisches Zentrum bremst die Aktivität der dorsalen Neuronengruppe (Begrenzung der Inspiration) und kann die Atemfrequenz steigern.
Ein pneumotaktisches Zentrum bremst die Aktivität der dorsalen Neuronengruppe (Begrenzung der Inspiration) und kann die Atemfrequenz steigern.| Das Atemzentrum in der medulla oblongata des Hirnstamms steuert die Atmung |
 Rhythmusgenerierende Neuronen erzeugen spontane Impulsfolgen,
wobei sich wahrscheinlich "inspiratorische" und "exspiratorische"
Zellen wechselseitig hemmen und sich daraus Aktivitätsoszillationen
ergeben.
Rhythmusgenerierende Neuronen erzeugen spontane Impulsfolgen,
wobei sich wahrscheinlich "inspiratorische" und "exspiratorische"
Zellen wechselseitig hemmen und sich daraus Aktivitätsoszillationen
ergeben.  Abbildung):
Abbildung): 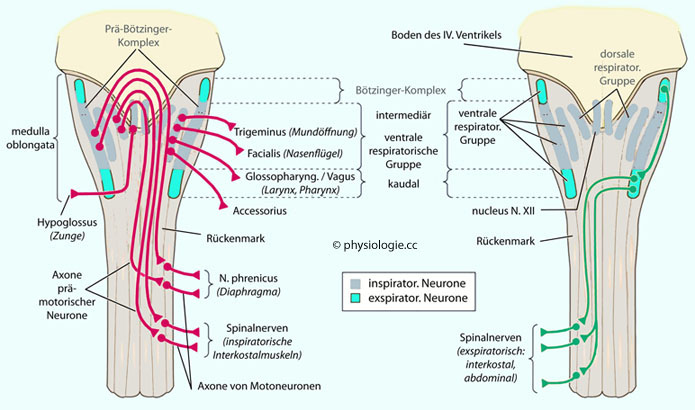
 Abbildung: Dorsale und ventrale respiratorische Neuronengruppen
Abbildung: Dorsale und ventrale respiratorische Neuronengruppen
 Die dorsale Neuronengruppe (dorsal respiratory group, DRG) in
der Nähe des nucl. tractus solitarii empfängt Afferenzen aus dem
Respirationstrakt (Dehnungsrezeptoren, periphere Chemorezeptoren u.a.),
beteiligt sich u.a. am Hering-Breuer-Reflex und Reaktionen auf Hypoxie.
Die dorsale Neuronengruppe (dorsal respiratory group, DRG) in
der Nähe des nucl. tractus solitarii empfängt Afferenzen aus dem
Respirationstrakt (Dehnungsrezeptoren, periphere Chemorezeptoren u.a.),
beteiligt sich u.a. am Hering-Breuer-Reflex und Reaktionen auf Hypoxie. Die ventrale / ventrolaterale (ventr(olater)al respiratory group,
VRG) in der Nachbarschaft des nucl. ambiguus koordiniert die
Atemmotorik. beinhaltet sowohl exspiratorisch als auch inspiratorisch
aktive Neuronen. Sie besteht aus drei Zonen:
Die ventrale / ventrolaterale (ventr(olater)al respiratory group,
VRG) in der Nachbarschaft des nucl. ambiguus koordiniert die
Atemmotorik. beinhaltet sowohl exspiratorisch als auch inspiratorisch
aktive Neuronen. Sie besteht aus drei Zonen: Der Bötzinger-Komplex
Der Bötzinger-Komplex (rostrale Gruppe, Bötzinger complex BötC) enthält Interneurone, welche die Aktivität kaudaler Neurone antreiben.
(rostrale Gruppe, Bötzinger complex BötC) enthält Interneurone, welche die Aktivität kaudaler Neurone antreiben. Die intermediäre Gruppe enthält
Die intermediäre Gruppe enthält  den Prä-Bötzinger-Komplex (preBötC, pre-Bötzinger complex): Dieser liegt ventral vom nucleus ambiguus und ist der eigentliche Schrittmacher der Atemrhythmik;
den Prä-Bötzinger-Komplex (preBötC, pre-Bötzinger complex): Dieser liegt ventral vom nucleus ambiguus und ist der eigentliche Schrittmacher der Atemrhythmik; Motoneurone
für Schlund und Kehlkopf, welche über Fasern des IX. und X. Hirnnerven
die oberen Luftwege und die Stimmritze während der Inspiration weiten, um den Luftstrom zu erleichtern;
Motoneurone
für Schlund und Kehlkopf, welche über Fasern des IX. und X. Hirnnerven
die oberen Luftwege und die Stimmritze während der Inspiration weiten, um den Luftstrom zu erleichtern; andere
Neuronen können auch Gesichtsmuskeln innervieren, z.B. solche, welche
die Nasenflügel aufstellen. Akzessorisch wirkt auch der N. hypoglossus, dessen Fasern synchron mit denen des Prä-Bötzinger-Komplexes entladen.
andere
Neuronen können auch Gesichtsmuskeln innervieren, z.B. solche, welche
die Nasenflügel aufstellen. Akzessorisch wirkt auch der N. hypoglossus, dessen Fasern synchron mit denen des Prä-Bötzinger-Komplexes entladen. Die kaudale Gruppe
enthält prämotorische exspiratorische Neurone zur Steuerung von
Motoneuronen akzessorischer Ausatemmuskulatur (Bauchdecken,
Interkostalmuskeln) - vgl.
Die kaudale Gruppe
enthält prämotorische exspiratorische Neurone zur Steuerung von
Motoneuronen akzessorischer Ausatemmuskulatur (Bauchdecken,
Interkostalmuskeln) - vgl.  Abbildung unten.
Abbildung unten. Die Funktion von Neuronen in der Brücke (potines Zentrum, pontine respiratory group)
ist weniger klar. Vielleicht glätten sie die Übergänge zwischen Ein-
und Ausatmung und "vermitteln" zwischen Großhirn und Atemzentrum.
Die Funktion von Neuronen in der Brücke (potines Zentrum, pontine respiratory group)
ist weniger klar. Vielleicht glätten sie die Übergänge zwischen Ein-
und Ausatmung und "vermitteln" zwischen Großhirn und Atemzentrum.  Zu Neuronen, die den Atemantrieb steuern, werden außer von den oben genannten Einflüssen
(Chemo-, Lungen- und Muskelrezeptoren) auch von Thermorezeptoren,
arteriellen Barorezeptoren, Schmerzrezeptoren u.a. gesteuert. Man unterscheidet
Zu Neuronen, die den Atemantrieb steuern, werden außer von den oben genannten Einflüssen
(Chemo-, Lungen- und Muskelrezeptoren) auch von Thermorezeptoren,
arteriellen Barorezeptoren, Schmerzrezeptoren u.a. gesteuert. Man unterscheidet  unspezifische (nicht-rückgekoppelte
- fast jeder intensive Reiz, sowie Impulse aus Kortex, limbischem
System, Hypothalamus - thermoregulatorisch, affektiv -, endokrine,
propriozeptive und nozizeptive Einflüsse) und
unspezifische (nicht-rückgekoppelte
- fast jeder intensive Reiz, sowie Impulse aus Kortex, limbischem
System, Hypothalamus - thermoregulatorisch, affektiv -, endokrine,
propriozeptive und nozizeptive Einflüsse) und spezifische (rückgekoppelte) Atemantriebe (Quelle: Rezeptoren in Atemmuskulatur, Schleimhaut der Atemwege - Atmungs-, Schutz-, J-, Hering-Breuer-Reflex).
spezifische (rückgekoppelte) Atemantriebe (Quelle: Rezeptoren in Atemmuskulatur, Schleimhaut der Atemwege - Atmungs-, Schutz-, J-, Hering-Breuer-Reflex). Körperliche Belastung (Sauerstoffbedarf, Säure-Basen-Gleichgewicht)
Körperliche Belastung (Sauerstoffbedarf, Säure-Basen-Gleichgewicht)| Vom
Gehirn ausgehende Mitinnervation des Atemzentrums verstärkt die Atmung
zu Beginn einer Muskelaktivität noch vor Änderung der Blutgaswerte |
 Atemanhalten bei Muskeltätigkeit,
Pressen, Niesen, Husten etc.
Atemanhalten bei Muskeltätigkeit,
Pressen, Niesen, Husten etc. Aktivitätsphasen im Rahmen der Flüssigkeits-
und Nahrungsaufnahme (Schlucken)
Aktivitätsphasen im Rahmen der Flüssigkeits-
und Nahrungsaufnahme (Schlucken) Phonation (Stimmbildung)
und Artikulation
(Laut- und Wortbildung).
Phonation (Stimmbildung)
und Artikulation
(Laut- und Wortbildung).
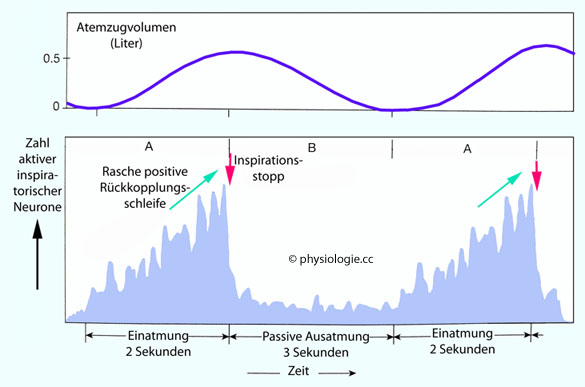
 Abbildung: Aktivität inspiratorischer Neurone bei ruhiger Atmung
Abbildung: Aktivität inspiratorischer Neurone bei ruhiger Atmung
 Fasern zu motorischen Vorderhornzellen der Atemmuskulatur (somatomotorische Atmungssteuerung)
Fasern zu motorischen Vorderhornzellen der Atemmuskulatur (somatomotorische Atmungssteuerung) Bronchomotorische Neurone (Anpassung der Bronchienweite an die Situation: Dilatation bei verstärkter (niedriger Strömungswiderstand), Konstriktion bei ruhiger Atmung (Reinigung)
Bronchomotorische Neurone (Anpassung der Bronchienweite an die Situation: Dilatation bei verstärkter (niedriger Strömungswiderstand), Konstriktion bei ruhiger Atmung (Reinigung) Neurone zu autonom-nervösen Zentren (z.B. Kreislaufzentrum: Respiratorische Arrhythmie)
Neurone zu autonom-nervösen Zentren (z.B. Kreislaufzentrum: Respiratorische Arrhythmie)| Die Herzfrequenz steigt bei Einatmung
(RR-Intervall verkürzt) und sinkt bei Ausatmung (respiratorische
Arrhythmie, durch schwankende parasympathische Aktivität vermittelt) Der Blutdruck schwankt analog, die Periodendauer liegt bei 3-5 Sekunden (Ruheatmung) |
 Der arterielle pCO2 beträgt etwa 40 (35-45) mmHg. Hyperkapnie ist eine Erhöhung (>45 mmHg), Hypokapnie eine Erniedrigung des arteriellen pCO2 (<35 mmHg).
Der arterielle pCO2 beträgt etwa 40 (35-45) mmHg. Hyperkapnie ist eine Erhöhung (>45 mmHg), Hypokapnie eine Erniedrigung des arteriellen pCO2 (<35 mmHg). Als Eupnoe bezeichnet man normale Ruheatmung. Tachypnoe ist eine erhöhte (≥20/min), Bradypnoe eine erniedrigte (<10/min) Atemfrequenz. Apnoe ist ein Atemstillstand.
Als Eupnoe bezeichnet man normale Ruheatmung. Tachypnoe ist eine erhöhte (≥20/min), Bradypnoe eine erniedrigte (<10/min) Atemfrequenz. Apnoe ist ein Atemstillstand. Atemfrequenz
Atemfrequenz -PNOE
vs. -VENTILATION: Häufig werden die Begriffe "Hyperventilation" und
"Hyperpnoe" einerseits, "Hypoventilation" und "Hypopnoe" andererseits
einfach im Sinne gesteigerter bzw. verminderter Atemtätigkeit
verwendet. Dabei ist der Bezugswert die normale Ruheatmung. Man sollte
aber unterscheiden: Die Endigung "-pnoe" bezieht sich lediglich auf das geatmete Volumen, ohne Rücksicht auf die Stoffwechselsituation bzw. -Notwendigkeit; die Endigung "-ventilation" hingegen bezieht sich auf Letzteres.
-PNOE
vs. -VENTILATION: Häufig werden die Begriffe "Hyperventilation" und
"Hyperpnoe" einerseits, "Hypoventilation" und "Hypopnoe" andererseits
einfach im Sinne gesteigerter bzw. verminderter Atemtätigkeit
verwendet. Dabei ist der Bezugswert die normale Ruheatmung. Man sollte
aber unterscheiden: Die Endigung "-pnoe" bezieht sich lediglich auf das geatmete Volumen, ohne Rücksicht auf die Stoffwechselsituation bzw. -Notwendigkeit; die Endigung "-ventilation" hingegen bezieht sich auf Letzteres. | Hyperpnoe bedeutet gesteigertes, Hypopnoe herabgesetztes Atemzeitvolumen (in Bezug auf die Ruheatmung) |
 Abbildung):
Abbildung):
 Abbildung: Atemsteigerung durch CO2 bzw. Azidose
Abbildung: Atemsteigerung durch CO2 bzw. Azidose
| Schon geringgradige Zunahmen des arteriellen pCO2 steigern die Atmung deutlich (bis zu ~70 mmHg - bei noch höheren Werten nimmt die Atmung wieder ab) |

 Abbildung: Entladungsfrequenz eines Carotiskörperchens
Abbildung: Entladungsfrequenz eines Carotiskörperchens 
 Abbildung unten).
Abbildung unten). Abbildung):
Abbildung):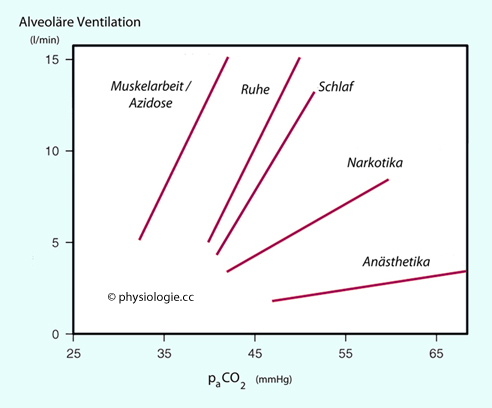
 Abbildung: Einfluss von Begleitfaktoren auf die Atmungskurve (=Ventilation in Abhängigkeit vom pACO2)
Abbildung: Einfluss von Begleitfaktoren auf die Atmungskurve (=Ventilation in Abhängigkeit vom pACO2)
 , Azidoseatmung). Dadurch werden die CO2-Werte
im Blut erniedrigt. Die akute Reaktion auf die metabolische Azidose
wird von peripheren Chemorezeptoren ausgelöst, mit Verzögerung schalten
sich die zentralen Chemorezeptoren dazu (nach Einsetzen einer metabolischen Azidose sinkt der pH-Wert im liquor cerebrospinalis mit Verzögerung und weniger stark als im Kreislauf).
, Azidoseatmung). Dadurch werden die CO2-Werte
im Blut erniedrigt. Die akute Reaktion auf die metabolische Azidose
wird von peripheren Chemorezeptoren ausgelöst, mit Verzögerung schalten
sich die zentralen Chemorezeptoren dazu (nach Einsetzen einer metabolischen Azidose sinkt der pH-Wert im liquor cerebrospinalis mit Verzögerung und weniger stark als im Kreislauf).  Abbildung zeigt, wie sich einerseits unterschiedliche Grade von
Sauerstoffmangel auf die Kennkurve des CO2-bedingten, andererseits Variationen des alveolären pCO2 auf die Kennkurve des sauerstoffbedingten Atemantriebs auswirken:
Abbildung zeigt, wie sich einerseits unterschiedliche Grade von
Sauerstoffmangel auf die Kennkurve des CO2-bedingten, andererseits Variationen des alveolären pCO2 auf die Kennkurve des sauerstoffbedingten Atemantriebs auswirken:
 Abbildung: Gesamtreaktion der Atmung auf Atemgasänderungen
Abbildung: Gesamtreaktion der Atmung auf Atemgasänderungen
 Muskelaktivität hat unter allen Atemantrieben die stärkste Wirkung. Einen intensiven Effekt auf die Abhängigkeit der alveolären Ventilation vom pCO2
im Blut hat körperliche Belastung. Bei Muskelarbeit muss die
Ventilation ausreichend (bis ~20fach) steigen, ohne dass der arterielle
pCO2 wesentlich vom Normbereich abweicht (
Muskelaktivität hat unter allen Atemantrieben die stärkste Wirkung. Einen intensiven Effekt auf die Abhängigkeit der alveolären Ventilation vom pCO2
im Blut hat körperliche Belastung. Bei Muskelarbeit muss die
Ventilation ausreichend (bis ~20fach) steigen, ohne dass der arterielle
pCO2 wesentlich vom Normbereich abweicht ( Abbildung).
Abbildung). Das bedeutet, dass die Kennkurve der pCO2-abhängigen
Ventilation nach oben verschoben ist; z.B. auf eine alveoläre
Ventilation von 120 l/m bei starker Belastung statt 5 l/min in Ruhe,
beides bei einem arteriellen Kohlendioxidpartialdruck von ~40 mmHg.
Das bedeutet, dass die Kennkurve der pCO2-abhängigen
Ventilation nach oben verschoben ist; z.B. auf eine alveoläre
Ventilation von 120 l/m bei starker Belastung statt 5 l/min in Ruhe,
beides bei einem arteriellen Kohlendioxidpartialdruck von ~40 mmHg. Die pCO2
-abhängige Atemregulation funktioniert bei physischer Belastung nach
wie vor (Hyperkapnie steigert, Hypokapnie bremst die Atmung), aber auf
sehr verschiedenen Ventilationsniveaus.
Die pCO2
-abhängige Atemregulation funktioniert bei physischer Belastung nach
wie vor (Hyperkapnie steigert, Hypokapnie bremst die Atmung), aber auf
sehr verschiedenen Ventilationsniveaus. Die erste ("neurologische")
Phase tritt sofort mit Beginn der Muskelarbeit auf, bevor sich das
Atemgasmuster im Blut noch verändern konnte. Es kommt sogar
vorübergehend zu Hyperventilation, Hypokapnie und respiratorischer
Alkalose (die Atmung steigt rascher an als der metabolische Bedarf der
aktiven Muskulatur). Vielleicht stellt dies
einen antizipatorischen
Mechanismus dar ("Mitinnervation" des Atemzentrums durch motorische
Efferenzen), auch könnten Afferenzen von Mechanorezeptoren aus dem
Bewegungsapparat eine anregende Rolle spielen.
Die erste ("neurologische")
Phase tritt sofort mit Beginn der Muskelarbeit auf, bevor sich das
Atemgasmuster im Blut noch verändern konnte. Es kommt sogar
vorübergehend zu Hyperventilation, Hypokapnie und respiratorischer
Alkalose (die Atmung steigt rascher an als der metabolische Bedarf der
aktiven Muskulatur). Vielleicht stellt dies
einen antizipatorischen
Mechanismus dar ("Mitinnervation" des Atemzentrums durch motorische
Efferenzen), auch könnten Afferenzen von Mechanorezeptoren aus dem
Bewegungsapparat eine anregende Rolle spielen.| Mitinnervation des Atemzentrums kann schon vor Beginn einer körperlichen Belastung die Atmung anregen (Hyperpnoe) |
 Die zweite ("metabolische")
Phase zeigt eine dem erhöhten Sauerstoffverbrauch bzw. der
Kohlendioxidproduktion linear proportionale Atemsteigerung. Die Partialdruckwerte der Atemgase im arteriellen Blut
bleiben stabil im Normbereich (exercise hyperpnea).
Wie die Rückkopplung funktioniert, ist unklar ("Metaborezeptoren" in
den Muskeln?), da ja die Partialdruckwerte nicht vom Normbereich
abweichen.
Die zweite ("metabolische")
Phase zeigt eine dem erhöhten Sauerstoffverbrauch bzw. der
Kohlendioxidproduktion linear proportionale Atemsteigerung. Die Partialdruckwerte der Atemgase im arteriellen Blut
bleiben stabil im Normbereich (exercise hyperpnea).
Wie die Rückkopplung funktioniert, ist unklar ("Metaborezeptoren" in
den Muskeln?), da ja die Partialdruckwerte nicht vom Normbereich
abweichen. Die dritte ("kompensatorische")
Phase tritt auf, wenn der Nachschub an Sauerstoff den Bedarf der
Muskeln nicht mehr vollständig abdecken kann. Der Stoffwechsel weicht
auf anaerobe Energiegewinnung aus, es entsteht vermehrt Lactat, und es tritt Azidose
auf. Die Atmung nimmt dadurch stark zu - bezogen auf den
Sauerstoffverbrauch steiler als in der metabolischen Phase - mit dem
Ziel, diese nicht-respiratorische Azidose zu kompensieren (daher der
Name).
Die dritte ("kompensatorische")
Phase tritt auf, wenn der Nachschub an Sauerstoff den Bedarf der
Muskeln nicht mehr vollständig abdecken kann. Der Stoffwechsel weicht
auf anaerobe Energiegewinnung aus, es entsteht vermehrt Lactat, und es tritt Azidose
auf. Die Atmung nimmt dadurch stark zu - bezogen auf den
Sauerstoffverbrauch steiler als in der metabolischen Phase - mit dem
Ziel, diese nicht-respiratorische Azidose zu kompensieren (daher der
Name).
 Abbildung: Reaktion einer Sensorzelle im glomus caroticum auf Sauerstoffmangel
Abbildung: Reaktion einer Sensorzelle im glomus caroticum auf Sauerstoffmangel
 Hyperventilation
Hyperventilation ist eine Atemform, bei der mehr Kohlendioxid abgeatmet wird als der Körper produziert, wodurch der arterielle pCO2 absinkt (auf unter 35 mmHg: Hypokapnie) und folglich eine respiratorische Alkalose auftritt (da der Körper mehr saure Valenzen verliert als produziert).
ist eine Atemform, bei der mehr Kohlendioxid abgeatmet wird als der Körper produziert, wodurch der arterielle pCO2 absinkt (auf unter 35 mmHg: Hypokapnie) und folglich eine respiratorische Alkalose auftritt (da der Körper mehr saure Valenzen verliert als produziert). Umgekehrt ist Hypoventilation
Umgekehrt ist Hypoventilation eine Atemform, bei der weniger Kohlendioxid abgeatmet wird als der Körper produziert, wodurch der arterielle pCO2 ansteigt (auf über 45 mmHg: Hyperkapnie) und eine respiratorische Azidose auftritt (da der Körper mehr saure Valenzen bildet als abgibt).
eine Atemform, bei der weniger Kohlendioxid abgeatmet wird als der Körper produziert, wodurch der arterielle pCO2 ansteigt (auf über 45 mmHg: Hyperkapnie) und eine respiratorische Azidose auftritt (da der Körper mehr saure Valenzen bildet als abgibt). Zur hypoxiebedingten pulmonalen Vasokonstriktion (Euler-Liljestrand-Mechanismus)
Zur hypoxiebedingten pulmonalen Vasokonstriktion (Euler-Liljestrand-Mechanismus)  s. dort
s. dort Zu Druckwerten in a. pulmonalis / vv. pulmonales
Zu Druckwerten in a. pulmonalis / vv. pulmonales  s. dort
s. dort
 Bei Ausfall von
Koordination und Reflexen, bei Bewusstlosen und in Narkose, besteht die
Gefahr der Aspiration (z.B. von Erbrochenem) in die Luftwege und
nachfolgender Lungenentzündung (Aspirationspneumonie). Dies kann durch tracheale
Intubation verhindert werden.
Bei Ausfall von
Koordination und Reflexen, bei Bewusstlosen und in Narkose, besteht die
Gefahr der Aspiration (z.B. von Erbrochenem) in die Luftwege und
nachfolgender Lungenentzündung (Aspirationspneumonie). Dies kann durch tracheale
Intubation verhindert werden. Bewusstlose, aber spontan atmende Patienten, die einen chronisch erhöhten pCO2 aufweisen, bedürfen des Atemantriebs über den pO2-Mechanismus.
Zufuhr von Sauerstoff nimmt ihnen diesen (hypoxischen) Stimulus und
kann zu Atemstillstand führen. In solchen Fällen ist eine künstliche
Beatmung lebensnotwendig.
Bewusstlose, aber spontan atmende Patienten, die einen chronisch erhöhten pCO2 aufweisen, bedürfen des Atemantriebs über den pO2-Mechanismus.
Zufuhr von Sauerstoff nimmt ihnen diesen (hypoxischen) Stimulus und
kann zu Atemstillstand führen. In solchen Fällen ist eine künstliche
Beatmung lebensnotwendig. : Schlafapnoe -
Ausfall der willkürlichen Atemsteuerung kann zum Ersticken führen).
: Schlafapnoe -
Ausfall der willkürlichen Atemsteuerung kann zum Ersticken führen). Besteht eine Hyperkapnie über längere Zeiträume, adaptiert das Gehirn und es ist nicht mehr CO2 sondern Hypoxie der primäre Atemantrieb. Zusätzliche Sauerstoffzufuhr kann dann den Atemantrieb stark reduzieren, der damit einhergehende weitere Anstieg des pCO2
vergiftet respiratorische Neurone und kann Apnoe bewirken. Bei
betroffenen (schwer lungenkranken) Patienten kann Erhöhung der Sauerstoffzufuhr auf
diese Weise tödliche Folgen haben.
Besteht eine Hyperkapnie über längere Zeiträume, adaptiert das Gehirn und es ist nicht mehr CO2 sondern Hypoxie der primäre Atemantrieb. Zusätzliche Sauerstoffzufuhr kann dann den Atemantrieb stark reduzieren, der damit einhergehende weitere Anstieg des pCO2
vergiftet respiratorische Neurone und kann Apnoe bewirken. Bei
betroffenen (schwer lungenkranken) Patienten kann Erhöhung der Sauerstoffzufuhr auf
diese Weise tödliche Folgen haben.

 Die Atmung wird durch zentrale Impulse und Reflexe gesteuert. Etwa 20% der Vagusfasern sind respiratorische
Afferenzen von
respiratorischem Epithel, Muskel- und Sehnenspindeln, Fibroblasten,
Immunzellen. Erfasst werden Gaszusammensetzung, mechanische (langsam
adaptierende: SARs, rasch adaptierende Rezeptoren: RARs) und chemische
Information (Irritantien), Temperatur, Sinnesreize, sowie Viren,
Bakterien, Pollen, Staub. Zytokine, Wachstumsfaktoren, biogene Amine,
Prostaglandine, ATP, H+ aktivieren afferente Neuronen. Impulse laufen zum nucl. tractus solitarii und zur Nachbarschaft gereizter Zonen. Die zentrale
Verarbeitung der Signale aus dem Respirationssystem erfolgt über
Hirnstamm (nucl. tractus solitarii) → Thalamus → Insel, motorischen und
somatosensorischen Kortex, posterioren Parietalkortex, orbitofrontalen
Kortex. Beeinflusst werden Atmung, Bronchienweite, Sekretion, Durchblutung, zentrale Projektionen (Hustenreflex, Dynpnoe) Die Atmung wird durch zentrale Impulse und Reflexe gesteuert. Etwa 20% der Vagusfasern sind respiratorische
Afferenzen von
respiratorischem Epithel, Muskel- und Sehnenspindeln, Fibroblasten,
Immunzellen. Erfasst werden Gaszusammensetzung, mechanische (langsam
adaptierende: SARs, rasch adaptierende Rezeptoren: RARs) und chemische
Information (Irritantien), Temperatur, Sinnesreize, sowie Viren,
Bakterien, Pollen, Staub. Zytokine, Wachstumsfaktoren, biogene Amine,
Prostaglandine, ATP, H+ aktivieren afferente Neuronen. Impulse laufen zum nucl. tractus solitarii und zur Nachbarschaft gereizter Zonen. Die zentrale
Verarbeitung der Signale aus dem Respirationssystem erfolgt über
Hirnstamm (nucl. tractus solitarii) → Thalamus → Insel, motorischen und
somatosensorischen Kortex, posterioren Parietalkortex, orbitofrontalen
Kortex. Beeinflusst werden Atmung, Bronchienweite, Sekretion, Durchblutung, zentrale Projektionen (Hustenreflex, Dynpnoe)  Zentrale Chemorezeptoren in der medulla oblongata messen pCO2 und pH-Wert im liquor cerebrospinalis, periphere arteriellen pO2, pCO2 und pH. In den glomera (carotica, aortica) sind die Hauptzellen (Typ I) chemosensitiv (Typ
II-Zellen Glia-ähnlich). Glomera haben die höchste spezifische Durchblutung
aller Gewebe im Körper (~40mal höher
als im Gehirn), im gesamten Organ herrschen arterielle Partialdruck- und
pH-Werte. Glomuszellen enthalten Transmitterstoffe (Acetylcholin,
Dopamin, ATP, Noradrenalin, Substanz P, Metenkephalin), die sie bei
Stimulation freisetzen; diese kontrollieren die
Aktionspotentialfrequenz der afferenten Fasern des Sinus- bzw.
Aortennerven. Niedriger pO2 (Hypoxie), hoher pCO2
(Hyperkapnie) und niedriger pH-Wert (Azidose) schließen Kaliumkanäle,
die Depolarisation öffnet spannungsgesteuerte Calciumkanäle, erhöhtes
intrazelluläres [Ca++] setzt Dopamin frei, erhöhte
Aktionspotentialfrequenz afferenter Fasern im N. glossopharyngeus
(von Carotis) bzw. vagus (von Aorta) regen die Ventilation an Zentrale Chemorezeptoren in der medulla oblongata messen pCO2 und pH-Wert im liquor cerebrospinalis, periphere arteriellen pO2, pCO2 und pH. In den glomera (carotica, aortica) sind die Hauptzellen (Typ I) chemosensitiv (Typ
II-Zellen Glia-ähnlich). Glomera haben die höchste spezifische Durchblutung
aller Gewebe im Körper (~40mal höher
als im Gehirn), im gesamten Organ herrschen arterielle Partialdruck- und
pH-Werte. Glomuszellen enthalten Transmitterstoffe (Acetylcholin,
Dopamin, ATP, Noradrenalin, Substanz P, Metenkephalin), die sie bei
Stimulation freisetzen; diese kontrollieren die
Aktionspotentialfrequenz der afferenten Fasern des Sinus- bzw.
Aortennerven. Niedriger pO2 (Hypoxie), hoher pCO2
(Hyperkapnie) und niedriger pH-Wert (Azidose) schließen Kaliumkanäle,
die Depolarisation öffnet spannungsgesteuerte Calciumkanäle, erhöhtes
intrazelluläres [Ca++] setzt Dopamin frei, erhöhte
Aktionspotentialfrequenz afferenter Fasern im N. glossopharyngeus
(von Carotis) bzw. vagus (von Aorta) regen die Ventilation an  Langsam adaptierende Dehnungsrezeptoren im
Lungengewebe begrenzen über vagale Afferenzen die Inspiration
(Hering-Breuer- Reflex). Rasch adaptierende Dehnungsrezeptoren im
Bronchialbaum vermitteln Irritationsreize (z.B. plötzliche Weitung der
Alveolen); diese Rezeptoren sind sehr empfindlich auf
Mediatoren und Reizstoffe. In der Wand der Alveolen und Atemwege
befinden sich juxtakapilläre ("J-") Rezeptoren, die auf Irritationen
reagieren und
Bronchokonstriktion, Schleimsekretion, flache und rasche Atmung
auslösen. Rezeptoren in Muskeln, Sehnen, Gelenken stimulieren bei
Belastung die Atmung (Vorwärtskopplung) Langsam adaptierende Dehnungsrezeptoren im
Lungengewebe begrenzen über vagale Afferenzen die Inspiration
(Hering-Breuer- Reflex). Rasch adaptierende Dehnungsrezeptoren im
Bronchialbaum vermitteln Irritationsreize (z.B. plötzliche Weitung der
Alveolen); diese Rezeptoren sind sehr empfindlich auf
Mediatoren und Reizstoffe. In der Wand der Alveolen und Atemwege
befinden sich juxtakapilläre ("J-") Rezeptoren, die auf Irritationen
reagieren und
Bronchokonstriktion, Schleimsekretion, flache und rasche Atmung
auslösen. Rezeptoren in Muskeln, Sehnen, Gelenken stimulieren bei
Belastung die Atmung (Vorwärtskopplung) Rhythmusgenerierende Neuronen in der medulla oblongata erzeugen spontane Impulsfolgen, inspiratorische (dorsal) und
exspiratorische Neuronen (ventrolateral) hemmen einander wechselseitig.
Ergebnis ist die rhythmische Aktivierung der Inspirationsmuskeln. Ein
Teil der ventralen Neuronengruppe (Prä-Bötzinger-Komplex) ist
vermutlich der eigentliche Schrittmacher der Atemrhythmik. Auf diese
Neuronengruppen wirken zahlreiche rückgekoppelte (aus Atemmuskulatur, Atemwegen) und
nicht-rückgekoppelte Impulse (aus Kortex, limbischem System,
Hypothalamus). Vom Gehirn ausgehende Mitinnervation verstärkt die
Atmung schon mit beginnender Muskelaktivität. Weitere Einflüsse sind
Pressen, Niesen, Husten, Schlucken, Sprechen. Die wichtigsten
Efferenzen aus dem Atemzentrum sind somatomotorische
(Atmungssteuerung), bronchomotorische, kardiovaskuläre (z.B.
respiratorische Sinusarrhythmie durch Oszillation parasympathischer Efferenzen zum Herzen) Rhythmusgenerierende Neuronen in der medulla oblongata erzeugen spontane Impulsfolgen, inspiratorische (dorsal) und
exspiratorische Neuronen (ventrolateral) hemmen einander wechselseitig.
Ergebnis ist die rhythmische Aktivierung der Inspirationsmuskeln. Ein
Teil der ventralen Neuronengruppe (Prä-Bötzinger-Komplex) ist
vermutlich der eigentliche Schrittmacher der Atemrhythmik. Auf diese
Neuronengruppen wirken zahlreiche rückgekoppelte (aus Atemmuskulatur, Atemwegen) und
nicht-rückgekoppelte Impulse (aus Kortex, limbischem System,
Hypothalamus). Vom Gehirn ausgehende Mitinnervation verstärkt die
Atmung schon mit beginnender Muskelaktivität. Weitere Einflüsse sind
Pressen, Niesen, Husten, Schlucken, Sprechen. Die wichtigsten
Efferenzen aus dem Atemzentrum sind somatomotorische
(Atmungssteuerung), bronchomotorische, kardiovaskuläre (z.B.
respiratorische Sinusarrhythmie durch Oszillation parasympathischer Efferenzen zum Herzen)  Eupnoe ist
normale Ruheatmung, Tachypnoe erhöhte (>16/min), Bradypnoe
erniedrigte (<12/min) Atemfrequenz, Apnoe Atemstillstand; Hyperpnoe
bedeutet gesteigertes, Hypopnoe herabgesetztes Atemzeitvolumen. Hyperventilation → Hypokapnie → respiratorische Alkalose, Hypoventilation → Hyperkapnie → respiratorische Azidose. Hypokapnie
kann zu vorübergehendem Atemstillstand, Hyperkapnie auf ~70 mmHg zu
~10facher Ventilationssteigerung führen. Die respiratorische Antwort
auf Azidose oder Hypoxie ist vergleichsweise geringer. Die
Empfindlichkeit des Atemzentrums auf Hypoxie hängt vom arteriellen pCO2 (steigt bei Hyperkapnie), die auf Hyperkapnie vom arteriellen pO2 ab (steigt bei Hypoxie).
Muskelaktivität hat unter allen Atemantrieben die stärkste Wirkung
(Ventilationssteigerung bis ~20fach) und erfolgt in drei Phasen: Eine neurologische (Mitinnervation), metabolische (Muskelbelastung) und kompensatorische (Azidose) Eupnoe ist
normale Ruheatmung, Tachypnoe erhöhte (>16/min), Bradypnoe
erniedrigte (<12/min) Atemfrequenz, Apnoe Atemstillstand; Hyperpnoe
bedeutet gesteigertes, Hypopnoe herabgesetztes Atemzeitvolumen. Hyperventilation → Hypokapnie → respiratorische Alkalose, Hypoventilation → Hyperkapnie → respiratorische Azidose. Hypokapnie
kann zu vorübergehendem Atemstillstand, Hyperkapnie auf ~70 mmHg zu
~10facher Ventilationssteigerung führen. Die respiratorische Antwort
auf Azidose oder Hypoxie ist vergleichsweise geringer. Die
Empfindlichkeit des Atemzentrums auf Hypoxie hängt vom arteriellen pCO2 (steigt bei Hyperkapnie), die auf Hyperkapnie vom arteriellen pO2 ab (steigt bei Hypoxie).
Muskelaktivität hat unter allen Atemantrieben die stärkste Wirkung
(Ventilationssteigerung bis ~20fach) und erfolgt in drei Phasen: Eine neurologische (Mitinnervation), metabolische (Muskelbelastung) und kompensatorische (Azidose) Die
Atemwege sind vegetativ innerviert: Die Bronchien vorwiegend
parasympathisch (Bronchokonstiktion, Schleimbildung); sympathische
Fasern innervieren Gefäße und Drüsen. Adrenalin erniedrigt
den Atemwegwiderstand über relaxierende Wirkung von ß2-Adrenozeptoren
an der Bronchialmuskulatur. Auch Mastzellen haben ß-Rezeptoren,
Katecholamine hemmen deren Mediatorfreisetzung und steigern die
mukoziliäre Clearance. NANC-Nerven setzen VIP und NO frei und
wirken bronchodilatierend Die
Atemwege sind vegetativ innerviert: Die Bronchien vorwiegend
parasympathisch (Bronchokonstiktion, Schleimbildung); sympathische
Fasern innervieren Gefäße und Drüsen. Adrenalin erniedrigt
den Atemwegwiderstand über relaxierende Wirkung von ß2-Adrenozeptoren
an der Bronchialmuskulatur. Auch Mastzellen haben ß-Rezeptoren,
Katecholamine hemmen deren Mediatorfreisetzung und steigern die
mukoziliäre Clearance. NANC-Nerven setzen VIP und NO frei und
wirken bronchodilatierend |
