

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert

Rückenmark: Motorik und Propriozeption
© H. Hinghofer-Szalkay

Charcot-Krankheit: Jean-Martin Charcot
Kinästhesie: κινέω = (sich) bewegen, αἴσθησις = Wahrnehmung
myasthenia gravis: μυς, μυός = Muskel, ἀσθένεια = Schwäche, gravis = schwer
polysynaptisch: πολύς = mehrere, viel, σύν = zusammen, ἅπτειν = fassen, ergreifen
Propriozeption: proprius = eigen, capere = (auf)fangen
Renshaw-Zelle: Birdsey Renshaw
Die Tiefensensibilität aus Muskeln,
Sehnen, Bändern, Gelenken liefert
Information über den aktuellen mechanischen Zustand des Bewegungsapparates (Lage, Kraft, Bewegung). Das dafür notwendige Rezeptorsystem liegt
insbesondere in Muskeln (Muskelspindeln) und Sehnen (Sehnenspindeln).
Intrafusale (in Muskelspindeln gelegene) mechanosensible Fasern sind Längendetektoren. Sie liegen in Form von Kernketten- (empfindlich auf Länge: Proportionaldetektoren) und Kernsack-Fasern (empfindlich auf Längenänderung: Differentialdetektoren) vor.
Muskelspindelfasern enthalten

-- mechanosensible Mittelzonen mit anulospiraligen sensorischen
(afferenten) Nervenendigungen - sie reagieren auf Verlängerung des
Muskels, und

-- kontraktile gamma-motorische Endzonen
- ihre Verkürzung dehnt die Mittelzone und hält deren Ansprechverhalten
und Empfindlichkeit (bei Kontraktion oder Dehnung des Gesamtmuskels) in
einem optimalen Bereich: Sie kompensieren im Spindelapparat Längenänderungen des gesamten Muskels.
Der Muskelspindelreflex wird
durch plötzliche Muskeldehnung (z.B. durch Schlag auf die Sehne)
ausgelöst und ist in seiner Grundform "monosynaptisch". Dieser
Reflex unterstützt vor allem die Haltearbeit von Extensoren gegen die Schwerkraft
(diese enthalten viele Muskelspindeln, Flexoren vergleichsweise weniger).
Sehnenspindeln sind Mechanodetektoren, die auf Kraftentfaltung im Muskel ansprechen
(Kraftsinn). Wird die Belastung der Sehne zu hoch, schaltet ein von ihnen ausgehender Schutzreflex
die
Muskelkontraktion ab.
|
Übersicht  Aufgaben des Rückenmarks
Aufgaben des Rückenmarks  Propriozeption, Sehnen- und Muskelspindeln
Propriozeption, Sehnen- und Muskelspindeln  Motorische Vorderhornzelle & Einheit
Motorische Vorderhornzelle & Einheit  Renshaw-Hemmung
Renshaw-Hemmung  Sehnenspindelreflex
Sehnenspindelreflex  Muskelspindelreflex
Muskelspindelreflex  Gekreuzte Reflexe
Gekreuzte Reflexe  Rhythmische Aktivität und spinaler Lokomotionsgenerator
Rhythmische Aktivität und spinaler Lokomotionsgenerator

Praktische Aspekte  Core messages
Core messages
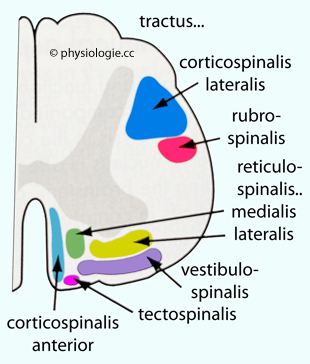
 Abbildung: Absteigende Bahnen im Rückenmark
Abbildung: Absteigende Bahnen im Rückenmark
Nach einer Vorlage bei Massey / Cunniffe / Noorani, Carpenter's Neurophysiology - A Conceptual Approach, 6th ed. CRC Press Taylor & Francis Group 2022
Gezeigt sind motorische (deszendierende) Fasersyeteme (zu aszendierenden Systemen s. dort).
Motorische Projektionen stammen aus
 Cortex - kortikospinal, zum Großteil nach Seitenkreuzung, also vom kontralateralen Motorcortex (tr. corticospinalis lateralis = Pyramidenbahn); Fasern im tr. corticospinalis anterior stammen aus der ipsilateralen Gehirnhälfte
Cortex - kortikospinal, zum Großteil nach Seitenkreuzung, also vom kontralateralen Motorcortex (tr. corticospinalis lateralis = Pyramidenbahn); Fasern im tr. corticospinalis anterior stammen aus der ipsilateralen Gehirnhälfte
 Hirnstamm
(rubrospinal vom nucl. ruber im Mittelhirn, Seite gekreuzt;
vestibulospinal vom Deiters'schen Kern in der oberen medulla oblongata,
Seite nicht gekreuzt; tractus reticulospinalis medialis aus der
formatio reticularis der Brücke, haptsächlich ungekreuzt; tractus reticulospinalis lateralis aus der formatio reticularis der medulla oblongata, gekreuzt und ungekreuzt)
Hirnstamm
(rubrospinal vom nucl. ruber im Mittelhirn, Seite gekreuzt;
vestibulospinal vom Deiters'schen Kern in der oberen medulla oblongata,
Seite nicht gekreuzt; tractus reticulospinalis medialis aus der
formatio reticularis der Brücke, haptsächlich ungekreuzt; tractus reticulospinalis lateralis aus der formatio reticularis der medulla oblongata, gekreuzt und ungekreuzt)
 Das Rückenmark
(~45 cm lang, ~1 cm Durchmesser) leitet und modifiziert motorische und sensorische Information, fasst vegetative Funktionen zusammen, kann komplexe Reflexmuster auslösen und stellt die
Verbindung zwischen dem Körper einerseits, und Hirnstamm, Kleinhirn und Großhirn andererseits her.
Das Rückenmark
(~45 cm lang, ~1 cm Durchmesser) leitet und modifiziert motorische und sensorische Information, fasst vegetative Funktionen zusammen, kann komplexe Reflexmuster auslösen und stellt die
Verbindung zwischen dem Körper einerseits, und Hirnstamm, Kleinhirn und Großhirn andererseits her.
Wesentliche Steuerelemente für die Muskulatur des Stammes und der
Extremitäten sind im Rückenmark untergebracht. Hier befinden sich
spezielle neuronale Schaltungen, die z.B. Bewegungsmuster anregen, wie
sie beim Gehen oder Laufen auftreten. Die dazu benötigten
Programmgeneratoren sitzen nicht im Gehirn, sondern im Rückenmark; das
Gehirn regt sie lediglich an (Kommandosignale), wenn es die
Gesamtsituation des Organismus verlangt. Ähnliches gilt für den Wechsel
zwischen Stehen, Gehen oder Laufen, für Richtungs- und
Geschwindigkeitsänderungen, für die dabei nötige Erhaltung des
Gleichgewichts etc.
Jedes Rückenmarksegment (Ebene der Spinalnerven) enthält in seiner
grauen Substanz mehrere Millionen Neuronen. Für die Steuerung der
Motorik sind dabei zwei Gruppen von Nervenzellen entscheidend: Motoneurone, welche Efferenzen in die Muskeln haben (alpha- und gamma-Motoneurone, s. unten) sowie Interneurone, etwa dreißig mal zahlreicher als Motoneurone, sehr
erregbare Zellen mit extrem hohen Entladungsfrequenzen (bis zu 1500
Aktionspotentiale pro Sekunde sind möglich). Interneurone
berücksichtigen eine Fülle von Information von verschiedenen afferenten
und efferenten Systemen, ermöglichen komplexe integrative Funktionen, und
sind die Hauptziele absteigender motorischer Fasern aus dem Gehirn (die
kaum mit Motoneuronen direkt, sondern weitgehend mit Interneuronen
synaptisch verknüpft sind).
Das Rückenmark leitet motorische Information und kann komplexe Muster generieren
Die
vom Rückenmark innervierte Muskulatur ist im Wesentlichen mit zwei
Arten der Motorik befasst: Einerseits die Körperhaltung und Lokomotion
betreffende, die automatisiert und dem Zugriff des Bewusstseins
weitgehend entzogen ist; und andererseits "Willkürbewegungen", die
bewusst steuerbar sind,

 Abbildung: Skelettmuskelachse des zentralen Nervensystems
Abbildung: Skelettmuskelachse des zentralen Nervensystems
Nach einer Vorlage in Guyton and Hall, Textbook of Medical Physiology, 15th ed. Elsevier 2026
Die
Skelettmuskulatur wird aus verschiedenen Partien des ZNS gesteuert
(Rückenmark, Hirnstamm, Klein- und Großhirn). Mit aufsteigender
Position der Zentren wächst die Komplexität der Aufgaben, die sie
erfüllen

 Willkürbewegungen
(z.B. Deuten, Schreiben...) werden über das laterale System von der Großhirnrinde (tractus corticospinalis,
Pyramidenbahn; tractus corticobulbaris zum Hirnstamm) und dem im Mittelhirn liegenden nucl. ruber gesteuert (tractus rubrospinalis). Das laterale
System (lateral group) kann die Extremitätem umabhängig voneinander kontrollieren (z.B.
ein Bein bewegt sich, während das andere still steht).
Willkürbewegungen
(z.B. Deuten, Schreiben...) werden über das laterale System von der Großhirnrinde (tractus corticospinalis,
Pyramidenbahn; tractus corticobulbaris zum Hirnstamm) und dem im Mittelhirn liegenden nucl. ruber gesteuert (tractus rubrospinalis). Das laterale
System (lateral group) kann die Extremitätem umabhängig voneinander kontrollieren (z.B.
ein Bein bewegt sich, während das andere still steht).
Der tractus corticospinalis regt zusammen mit dem tractus rubrospinalis vor allem die Motoneurone der Flexoren
an und hemmt die entsprechenden Extensoren (Willkürbewegungen
involvieren insbesondere Flexoren). Dieses System ermöglicht z.B.
unabhängige Bewegungen der Finger - was z.B. für Zugreifen, Manipulieren, Musizieren, Eintippen etc. unverzichtbar ist.
Der tractus corticospinalis enthält etwa eine Million Axone; er entspringt in der primären motorischen Rinde sowie in präfrontalen Rindengebieten, in Teilen des Parietal- (somatosensorischer Cortex) und
Temporalcortex. In der unteren medulla oblongata kreuzt der Großteil
der Fasern die Seite (decussatio pyramidum), weshalb die linke
Körperhälfte weitgehend vom rechten Cortex gesteuert wird (und
umgekehrt).
Der tractus corticobulbaris
(=tractus corticonuclearis) endet schon in der medulla oblongata
("bulbus cerebri") und steuert motorische Anteile der Kerne von
insgesamt 6 Hirnnerven (V, VII, IX, X, XI,
XII). Damit kontrolliert er die Motorik von Gesicht, Hals, Zunge (und
von Teilen extraokulärer Augenmuskeln).
Der tractus rubrospinalis steht unter der Kontrolle des Motorcortex (tractus corticorubralis) und auch des Kleinhirns, und wurde im
Zug der Entwicklung des Primatengehirns weitgehend durch die
Pyramidenbahn ersetzt. Er steuert vom Körperstamm unabhängige Bewegungen der Unterarme und der Hände, nicht aber Fingerbewegungen.
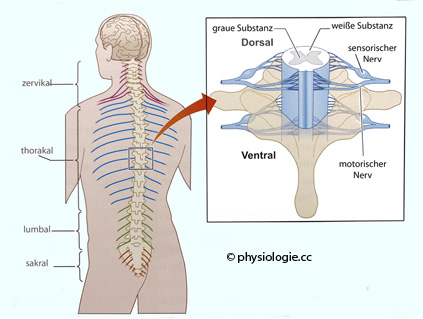
 Abbildung: Organisation des Rückenmarks
Abbildung: Organisation des Rückenmarks
Nach einer Vorlage in Banich / Compton, Cognitive Neuroscience (4th ed). Cambrindge University Press 2018
Sensorische
(aufsteigende) Information gelangt über posteriore, motorische
(absteigende) über anteriore Teile des Rückenmarks zu ihrem
Bestimmungsort (rechts).
Links: Zervikale Nerven violett, thorakale blau, lumbale grün und sakrale rot angedeutet

 Die Kontrolle über Körperhaltung (posture) und Fortbewegung (locomotion) ist weitgehend automatisiert (dem Bewusstsein entzogen) und betrifft Abläufe, für
deren Präzision Information aus mehreren Sinnesorganen (vor allem
Gleichgewichtssinn, Gesichtssinn, Gehör) ausschlaggebend ist. Diese Information wird
über Bahnen aus dem Hirnstamm übertragen (tractus tecto-,
reticulo-, vestibulospinalis). Man spricht vom ventromedialen System (ventromedial group), zu dem auch der tractus corticospinalis ventralis zählt
- sowohl wegen seiner Lage als auch wegen seiner Funktion. Dieses
System steuert die Motorik des Körperstammes und der körpernahen
Extremitätenmuskulatur.
Die Kontrolle über Körperhaltung (posture) und Fortbewegung (locomotion) ist weitgehend automatisiert (dem Bewusstsein entzogen) und betrifft Abläufe, für
deren Präzision Information aus mehreren Sinnesorganen (vor allem
Gleichgewichtssinn, Gesichtssinn, Gehör) ausschlaggebend ist. Diese Information wird
über Bahnen aus dem Hirnstamm übertragen (tractus tecto-,
reticulo-, vestibulospinalis). Man spricht vom ventromedialen System (ventromedial group), zu dem auch der tractus corticospinalis ventralis zählt
- sowohl wegen seiner Lage als auch wegen seiner Funktion. Dieses
System steuert die Motorik des Körperstammes und der körpernahen
Extremitätenmuskulatur.
Der tractus vestibulospinalis wirkt erregend auf die Motoneurone (α und γ) von Extensoren (Strecker) und hemmt entsprechende Flexoren (Beuger). Diese vom Innenohr beeinflusste Bahn steuert die automatische Stabilisierung der aufrechten Körperhaltung (Streckmuskeln stützen im Stehen und verhindern das "Einknicken" der Gelenke).
Der tractus reticulospinalis
entspringt in zahlreichen Anteilen von Kerngebieten in Mittelhirn und
formatio reticularis; diese erhalten neben Einflüssen aus dem
prämotorischen Cortex Projektionen aus verschiedenen subkortikalen
Regionen, wie Basalganglien, Hypothalamus und Amygdalae. Dieses System
beteiligt sich an der Kontrolle u.a. von Atembewegungen, Husten,
Niesen, aber auch Lokomotion.
In den oberen Vierhügeln entspringt der tractus tectospinalis; dieser beteiligt sich an der Koordination von Augen-, Kopf- und Rumpfbewegungen.
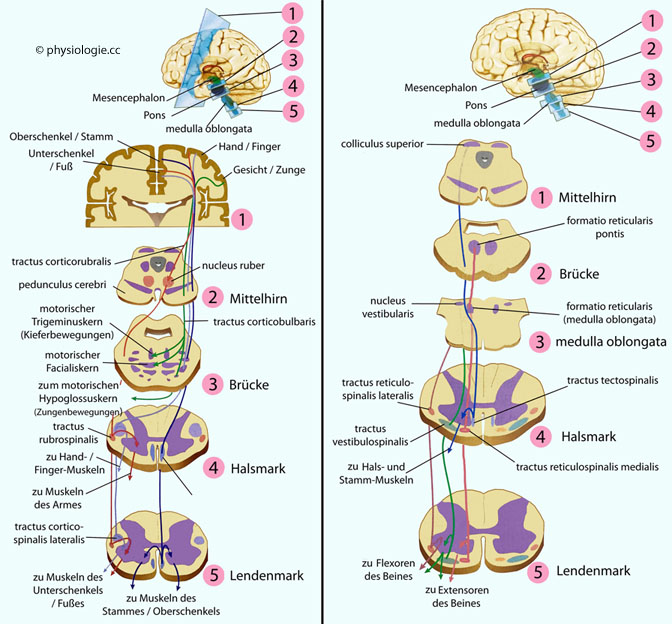

 Abbildung: Deszendierende Systeme
Abbildung: Deszendierende Systeme
Nach einer Vorlage in Carlson NR / Birkett MA, Physiology of Behavior, 12th ed. Pearson 2017
Das Gehirn projiziert motorische Impulse auf
die spinale Peripherie über zwei absteigende Systeme:
 Eine laterale Gruppe, dazu gehört der tractus corticospinalis, corticobulbaris und rubrospinalis (links); und
Eine laterale Gruppe, dazu gehört der tractus corticospinalis, corticobulbaris und rubrospinalis (links); und
 eine ventromediale Gruppe, dazu gehört der tractus tecto-, vestibulo- und reticulospinalis (rechts)
eine ventromediale Gruppe, dazu gehört der tractus tecto-, vestibulo- und reticulospinalis (rechts)

Die meisten Motoneuronen werden nicht direkt, sondern über Interneurone von
Pyramidenbahnfasern gesteuert - die Anbindung an den motorischen Cortex
erfolgt also typischerweise poly-, nicht monosynaptisch.
Auf jeder Seite gibt es 30 Spinalnerven (zervikal 1-8, thorakal 1-12,
lumbal 1-5, sakral 1-5). Diese enthalten efferente (motorische,
autonom-nervöse) und afferente Fasern. Die Segmente C3 bis T1
(intumescentia cervicalis, cervical enlargement) sowie L1 bis S3 (intumescentia lumbosacralis, lumbar enlargement)
sind dicker als die übrigen Rückenmarksabschnitte, da von hier aus Arm-
bzw. Beinmuskeln gesteuert werden, was eine dementsprechend höhere
Zahl an Nervenzellen (motorische Vorderhornzellen, Interneurone)
erfordert.
Als Sensomotorik
bezeichnet man das Zusammenspiel afferenter (sensorischer) und
efferenter (motorischer) Leistungen bei der Steuerung der Motorik.
Dabei spielen sensorische Informationen eine wichtige Rolle,
die aus dem Bewegungsapparat stammen und eine Rückkopplung zu den
motorischen Aktionen ermöglichen.
Die Propriozeption  ("Eigenwahrnehmung") dient der
Wahrnehmung der Körperlage (im Raum), der Stellung einzelner
Körperteile zueinander, sowie der verschiedenen Komponenten der
Körperbewegung. Dazu gehört
("Eigenwahrnehmung") dient der
Wahrnehmung der Körperlage (im Raum), der Stellung einzelner
Körperteile zueinander, sowie der verschiedenen Komponenten der
Körperbewegung. Dazu gehört
 die Tiefensensibilität und
die Tiefensensibilität und
 Meldungen des Vestibularorgans.
Meldungen des Vestibularorgans.
Die Oberflächensensibilität spielt für die Propriozeption eine untergeordnete Rolle.
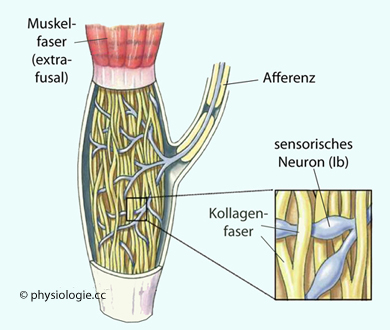
 Abbildung: Sehnenspindel
Abbildung: Sehnenspindel
Nach einer Vorlage bei Silverthorn, Human Physiology, an integrated approach, 4th Int'l ed. 2007, Pearson / Benjamin Cummings
In
Bindegewebskapseln innerhalb der Sehnen befinden sich Kraftfühler
(Golgi-Sehnenorgane), von hier gelangen Ib-Afferenzen zum ZNS (über
Nervenfaserklassen  s. dort).
s. dort).
Kontrahiert der
Muskel, wird das kollagene Gerüstwerk innerhalb der Kapsel gestrafft
und die sensorischen Neurone mechanisch gereizt, was zur Auslösung von
Aktionspotentialen an den afferenten Nervenfasern führt.
Das
aktiviert inhibitorische Interneurone im Rückenmark, diese hemmen (den
betreffenden Muskel innervierende) α-motorische Vorderhornzellen und
die Kontraktion des Muskels lässt nach oder wird ganz gestoppt. Dieser
Mechasnismus wirkt dämpfend auf die Kraftentwicklung des Muskels und
kann Einrissen im Muskelgewebe vorbeugen (Schutzreflex)

Die Tiefensensibilität verfügt über drei Komponenten: Kraft-, Lage- und Bewegungssinn.
Der Kraftsinn
informiert über die Kräfte, die an Muskeln, Sehnen und Gelenken wirken.
Auf molekularer Ebene sind es wahrscheinlich Piezo2-Sensoren
in der Membran mechanosensibler Nervenfasern, welche die einwirkenden
Kräfte zu entsprechenden Aktionspotentialsalven umwandeln: Dehnung der
Rezeptor-Ionenkanäle führt zum Einströmen von Kationen und zur
Depolarisierung distaler Terminals und des Soma betreffender
Nervenzellen.
Der Kraftsinn wird vor allem über die Golgi-schen Sehnenorgane (Sehnenspindeln,  Abbildung)
vermittelt. Sie messen die
Kraft, die an einer Sehne wirkt (durch Dehnung von außen und
durch Kontraktion des Muskels) - in der Achillessehne bis zu etwa eine Tonne Zugbelastung bei weniger als 1 cm2 Fläche.
Abbildung)
vermittelt. Sie messen die
Kraft, die an einer Sehne wirkt (durch Dehnung von außen und
durch Kontraktion des Muskels) - in der Achillessehne bis zu etwa eine Tonne Zugbelastung bei weniger als 1 cm2 Fläche.
Sehnenspindeln
dienen der Tiefensensibilität und spielen eine wichtige Rolle im Rahmen
reflektorischer Steuerung der Muskelkraft (insbesondere deren
Begrenzung, wenn auf die Sehne einwirkende Kräfte zu stark werden),
tragen aber wenig zu bewusster Wahrnehmung von Muskelaktivität bei.
Der Lagesinn
(Positionssinn) betrifft die Stellung von Körperteilen zueinander und
die Orientierung des Körpers im Raum. Dem Lagesinn liegen vor allem
Meldungen aus der Muskulatur (Muskelspindeln: Längenmessung) zugrunde,
weshalb er auch nach chirurgischem Gelenkersatz bestehen bleibt.
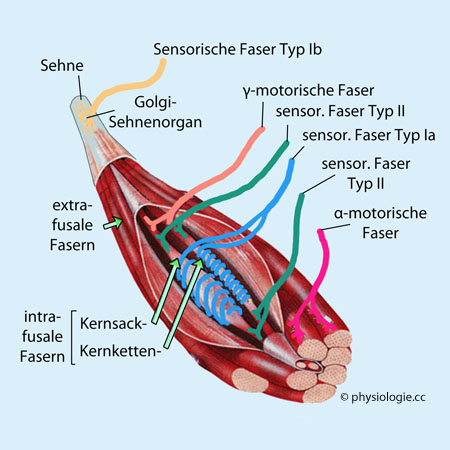

 Abbildung: Muskel- und Sehnenspindeln
Abbildung: Muskel- und Sehnenspindeln
Nach einer Vorlage in Thibodeau / Patton, Anatomy & Physiology 6th ed. Mosby Elsevier 2007
Fasern der Muskelspindel heißen intrafusal, "normale" Arbeitsmuskelfasern extrafusal -
α-Motoneurone kontrahieren extrafusale Muskelfasern. Afferenzen von der Sehnenspindel laufen über Ib-Fasern.
Ia-Fasern liegen spiralig um die Äquatorialzone der Muskelspindeln
(anulospiralige Endigung: hohe dynamische - d.h. differentielle -
Empfindlichkeit). Eine zusätzliche sekundäre Innervation erfolgt über
dünnere Typ II-Fasern (geringere dynamische Empfindlichkeit). Ia- und
II-Afferenzen messen die Dehnung (Länge)
der intrafusalen Fasern und damit (indirekt) des Muskels (Lagesinn, s. unten).
γ-Mononeurone kontrahieren die
intrafusalen Fasern und stellen dadurch ihre Längenempfindlichkeit ein
("Nachführung" bei Muskelkontraktion, Beibehaltung hoher Präzision). Dynamische γ-Motoneurone steigern die dynamische
Empfindlichkeit von Kernsackfasern zur besseren Messung von
Längenänderungen, während statische
γ-Motoneurone die statische Empfindlichkeit von Kernkettenfasern erhöhen (s. unten)

Skelettmuskeln bestehen aus Arbeitsmuskelfasern und parallel dazu
angeordneten Muskelspindeln. Diese enthalten jeweils mehrere spezielle
Fasern, die aus einer längenempfindlichen Mittelzone und zwei
kontraktilen Enden bestehen (Abbildung oben). Der Längenrezeptor sendet über
schnell leitende Nervenfasern (Typ Ia und II) umso mehr Aktionspotentiale zum ZNS, je
stärker und schneller die Mittelzone gedehnt wird.
Muskelspindel-Nervenfasern
|
Fasertyp
|
Durchmesser
|
Leitungs-
geschwindigkeit
|
α-motorisch
|
14 µm (9-20)
|
60 (30-100) m/s
|
γ-motorisch
|
4 µm (3-5)
|
2-6 m/s
|
α- (Ia-) sensorisch
|
17 µm (13-20)
|
80-120 m/s
|
β- (II-) sensorisch
|
8 µm (6-12)
|
35-75 m/s
|
In der Muskelspindel gelegene Fasern werden als intrafusal bezeichnet (fusus = Spindel), "gewöhnliche" Arbeitsmuskelfasern als extrafusal.
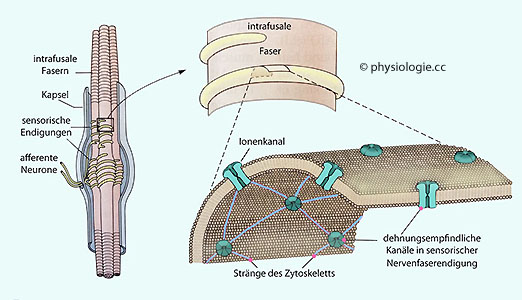
 Abbildung: Dehnungsempfindliche Ionenkanäle intrafusaler Fasern vermitteln den Lagesinn
Abbildung: Dehnungsempfindliche Ionenkanäle intrafusaler Fasern vermitteln den Lagesinn
Nach einer Vorlage in Kandel / Koester / Mack / Siegelbaum (eds), Principles of Neural Sciences, 6th ed. 2021 (McGraw Hill)
Mechanosensible Ionenkanäle in der Zellmembran
sensorischer ("anulospiraliger") Nervenfaserendigungen sind mittels
Spektrin an das intrazelluläre Zytoskelett gekoppelt und reagieren auf
Dehnung mit Einstrom von Kationen und Depolarisierung

Ionenkanäle in
der Außenmembran der "anulospiraligen" Nervenfaserendigungen
intrafusaler Muskelfasern sind mittels Spektrin an das intrazelluläre
Zytoskelett gekoppelt. So können sie mechanische Reize in
Depolarisation umwandeln (sie werden durch Dehnung durchlässig für
Kationen).
Auf diese Weise entstehen in Ia-Afferenzen zum ZNS längenproportionale
Aktionspotentialsalven als Eingangssignal von Muskelspindelreflexen.
 Über Muskelspindelreflexe s. unten
Über Muskelspindelreflexe s. unten
 Über Reflexe allgemein s. dort
Über Reflexe allgemein s. dort
Ergänzt wird der Lage / Positionssinn durch Afferenzen aus
Ruffini-Körperchen (SA-Rezeptoren) in der Haut über Gelenken, sowie von Mechanorezeptoren in Gelenkskapseln - zusätzlich zu Meldungen aus Muskelspindeln.
Bewegungssinn (Kinästhesie  )
)
Als Bewegungssinn gilt die Empfindung für Winkeländerung in Gelenken sowie deren Richtung. Hier spielen vor allem Gelenksrezeptoren eine Rolle. Diese ähneln Ruffini-Körperchen, Golgi- und Pacini-Organen; andere sind freie Nervenendigungen.
Die meisten adaptieren rasch, detektieren also vor allem vorübergehende
Änderungen, wie sie für Bewegungen im Gelenk kennzeichnend sind.
Die Stellung und Bewegung der Gelenke wird durch alle Komponenten der
Somatosensorik codiert - außer Gelenksrezeptoren sind dies Muskel- und
Sehnenspindeln sowie auch die Oberflächensensibilität der Haut, welche
die Gelenke überspannt.
Die Wahrnehmung von Lage, Kraft und Bewegung insgesamt erfolgt im ZNS
durch komplexe Kombination der einzelnen Komponenten der
Tiefensensibilität, die über Rückenmark bzw. Hirnnerven an das Gehirn
geleitet wird.
Sensorische Fasern aus der Skelettmuskulatur

Nach Kandel / Koester / Mack / Siegelbaum, Principles of Neural Sciences, 6th ed. 2021
|
Typ
|
Axon
|
Rezeptor
|
meldet
|
Ia
|
12-20 µm
myelinisiert
|
primäre Spindelendigung
|
Länge / Längenänderung
|
Ib
|
12-20 µm
myelinisiert |
Golgi Sehnenorgan
|
Kraft
|
II
|
6-12 µm
myelinisiert
|
sekundäre Spindelendigung
|
Länge
|
II
|
6-12 µm
myelinisiert |
Nichtspindel-
endigungen
|
Druck
|
III
|
2-6 µm
myelinisiert
|
freie
Nervenendigungen
|
Schmerz
Chemikalien
Temperatur
|
IV
|
0,5-2 µm
unmyelinisiert
|
freie
Nervenendigungen |
Schmerz
Chemikalien
Temperatur |
Fasern des Typs III ermöglichen physiologische Reaktionen auf Muskelbelastung.
Elektrische Reizung ermöglicht differenziertes Erreichen verschiedener
sensibler Fasern in gemischten Muskelnerven. So liegen die
Reizschwellen für Fasern des Typs II 2-5 mal, diejenigen für Fasern des
Typs III und IV 10-50 fach höher als für die am besten isolierten
(dicksten) sensorischen Fasern (Typ I), bei denen sich die Stromlinien
an den Ranvier-Schnürringe konzentrieren (hohe Reizdichte am
Internodium, vgl. saltatorische Erregungsleitung).
Die motorische Einheit: Versorgungsgebiet einer motorischen Vorderhornzelle

 Abbildung: Konvergenz verschiedener motorischer Kontrollbahnen auf eine motorische Vorderhornzelle
Abbildung: Konvergenz verschiedener motorischer Kontrollbahnen auf eine motorische Vorderhornzelle
Nach einer Vorlage bei Guyton and Hall, Textbook of Medical Physiology, 15th ed. Elsevier 2026
Auf
jede motorische Vorderhornzelle (grün dargestellt) wirken synaptische
Einflüsse von motorischen und sensomotorischen Nervenfasern:
 Aus
dem tractus corticospinalis und corticorubralis (diese deszendieren im
posterioren Teil des Seitenstrangs und projizieren vorwiegend auf
Interneurone in der Mitte der grauen Substanz)
Aus
dem tractus corticospinalis und corticorubralis (diese deszendieren im
posterioren Teil des Seitenstrangs und projizieren vorwiegend auf
Interneurone in der Mitte der grauen Substanz)
 Aus dem tractus reticulospinalis, dessen Fasern teils im Seiten- und
teils im Vorderstrang absteigen und teils direkt, teils über
Interneurone auf das Motoneuron wirken
Aus dem tractus reticulospinalis, dessen Fasern teils im Seiten- und
teils im Vorderstrang absteigen und teils direkt, teils über
Interneurone auf das Motoneuron wirken
 Aus dem tecto- und dem vestibulospinalen Trakt im Vorderstrang.
Aus dem tecto- und dem vestibulospinalen Trakt im Vorderstrang.
Diese deszendierenden Systeme binden automatisch (unbewusst ablaufende) motorische Muster im Rückenmark (z.B. gekreuzte Streckreflexe, Gangautomatismen,
Gleichgewichtserhaltung usw.) in Zielvorgaben ein, die über das Gehirn
(Großhirnrinde, Thalamus, Basalganglien, Kleinhirn, Hirnstammsysteme)
und ihm zulaufende Sinnesmeldungen (optisch, akustisch, vestibulär
u.a.) generiert und kontrolliert werden
 Motorische Vorderhornzellen (lower motor neurons)
Motorische Vorderhornzellen (lower motor neurons) leiten efferente Information, d.h. aus Gehirn / Rückenmark in die Peripherie (
 Abbildung
Abbildung). Sie empfangen Signale über jeweils rund 10
4 Synapsen (
~9000 an Dendriten und ~1000
am Zellkörper). Die meisten Synapsen stammen von Interneuronen im
Rückenmark, nur wenige von aus dem Gehirn absteigenden motorischen
Nervenfasern (die vorwiegend auf Interneurone projizieren, s. oben).
 Die kleinste vom ZNS beeinflussbare Einheit ist eine
motorische Vorderhornzelle (Aα-Motoneuron) mit den von ihr gesteuerten Muskelfasern und
wird (nach dem Nobelpreisträger C.S. Sherrington) als motorische Einheit (motor unit) bezeichnet (
Die kleinste vom ZNS beeinflussbare Einheit ist eine
motorische Vorderhornzelle (Aα-Motoneuron) mit den von ihr gesteuerten Muskelfasern und
wird (nach dem Nobelpreisträger C.S. Sherrington) als motorische Einheit (motor unit) bezeichnet ( Abbildung). Sie versorgt einen bestimmten Muskelfasertyp (der sich u.U. adaptiv verändern kann) und erstreckt sich ausschließlich auf einen
definierten Muskel; seine Fasern kontrahieren sich immer gemeinsam
(gesteuert durch die Entladung des zuständigen Motoneurons). Der
Dendritenbaum motorischer Vorderhornzellen erstreckt sich über einen
großen Bereich im Rückenmark bzw. Hirnstamm und sammelt so Impulse von
Kombinationen zahlreicher anderer (z.B. "prämotorischer") Neurone aus
diversen Gebieten des ZNS, die verschiedene Transmitter verwenden
(Glutamat, Acetylcholin, GABA, Glycin u.a.) sowie auch von
somatosensorischen Neuronen.
Abbildung). Sie versorgt einen bestimmten Muskelfasertyp (der sich u.U. adaptiv verändern kann) und erstreckt sich ausschließlich auf einen
definierten Muskel; seine Fasern kontrahieren sich immer gemeinsam
(gesteuert durch die Entladung des zuständigen Motoneurons). Der
Dendritenbaum motorischer Vorderhornzellen erstreckt sich über einen
großen Bereich im Rückenmark bzw. Hirnstamm und sammelt so Impulse von
Kombinationen zahlreicher anderer (z.B. "prämotorischer") Neurone aus
diversen Gebieten des ZNS, die verschiedene Transmitter verwenden
(Glutamat, Acetylcholin, GABA, Glycin u.a.) sowie auch von
somatosensorischen Neuronen.
 Die Gesamtheit an motorischen Neuronen (im Vorderhorn des Rückenmarks oder im Hirnstamm), welche einen Muskel versorgen, nennt man einen Motoneuronenpool (motor pool). Je nach Größe des Muskels enthält dieser von einigen 101 bis zu einigen 103 Neuronen. Die Aktivierung der Einheitsgruppen in diesem Pool erfolgt dabei nach dem Größenprinzip (size principle of motor units):
Solche mit kleinen Fasergruppen (weniger Muskelzellen) haben motorische
Neurone mit dünneren Axonen und werden zuerst aktiviert (Feinmotorik,
geringer Energieverbrauch), solche mit großen Einheiten (zahlreiche
Muskelzellen, dickere Axone) erst bei intensiverer Reizung (Kraftentfaltung, hoher Energieverbrauch).
Umgekehrt nimmt die Aktivierung großer Einheiten bei nachlassender
Reizgröße zuerst ab, gefolgt von kleineren Einheiten bei weiter
reduzierter Reizgröße.
Die Gesamtheit an motorischen Neuronen (im Vorderhorn des Rückenmarks oder im Hirnstamm), welche einen Muskel versorgen, nennt man einen Motoneuronenpool (motor pool). Je nach Größe des Muskels enthält dieser von einigen 101 bis zu einigen 103 Neuronen. Die Aktivierung der Einheitsgruppen in diesem Pool erfolgt dabei nach dem Größenprinzip (size principle of motor units):
Solche mit kleinen Fasergruppen (weniger Muskelzellen) haben motorische
Neurone mit dünneren Axonen und werden zuerst aktiviert (Feinmotorik,
geringer Energieverbrauch), solche mit großen Einheiten (zahlreiche
Muskelzellen, dickere Axone) erst bei intensiverer Reizung (Kraftentfaltung, hoher Energieverbrauch).
Umgekehrt nimmt die Aktivierung großer Einheiten bei nachlassender
Reizgröße zuerst ab, gefolgt von kleineren Einheiten bei weiter
reduzierter Reizgröße.
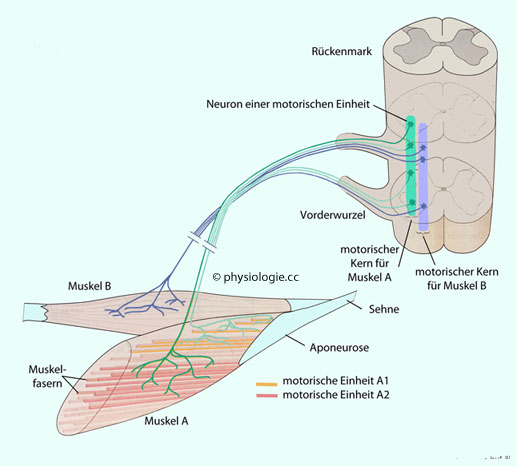
 Abbildung:
Motorische Einheiten
Nach einer Vorlage in Kandel / Koester / Mack / Siegelbaum (eds), Principles of Neural Sciences, 6th ed. 2021 (McGraw Hill)
Abbildung:
Motorische Einheiten
Nach einer Vorlage in Kandel / Koester / Mack / Siegelbaum (eds), Principles of Neural Sciences, 6th ed. 2021 (McGraw Hill)
Motorische Einheiten
(unterschiedlich eingefärbt: A1, A2..) bestehen aus motorischer Vorderhornzelle, ihrem
Axon und dessen Verzweigungen, den von diesem Axon versorgten
motorischen Endplatten, sowie den
dazugehörigen Muskelfasern. Aufgrund dieser Anordnung werden die Fasern
einer motorischen Einheit immer gleichzeitig aktiviert.
Motorische Vorderhornzellen, die einen Muskel versorgen, sind in
säulenförmigen Kernen im Bereich des Vorderhorns gruppiert, die sich
über mehrere Rückenmarksegmente erstrecken. Die Dendritenbäume der
Vorderhornzellen reichen in funktionell verknüpfte Nachbarkerne

Jede motorische Vorderhornzelle ist also mit ihrem Axon einer definierten
Gruppe von Muskelfasern zugeordnet. Das Axon verzweigt sich im Muskel,
die Verzweigungen enden an je einer motorischen Endplatte einer
Muskelzelle. (Eine Ausnahme bilden die äußeren Augenmuskeln:
Ihre Fasern werden gleichzeitig von mehreren Vorderhornzellen
innerviert, sie verfügen dementsprechend über mehr als eine motorische
Endplatte. Die Steuerung wird dadurch zusätzlich verfeinert.)
Die Zahl motorischer Vorderhornzellen pro Muskel variiert zwischen etwa 100 (Lumbrikalmuskeln) und über 4000 (m. rectus lateralis), die Zahl der Muskelfasern pro motorischer Einheit (innervation ratio kann zwischen 4 (äußere Augenmuskeln) und ~1800
liegen (m. gastrocnemius medialis) - die Zahl ist umso geringer, je
feiner das Organ gesteuert wird.
Insgesamt enthält ein Muskel zwischen ~1000
(äußere Augenmuskeln, m. tensor tympani) und über eine Million
Muskelfasern (m. temporalis, m. gastrocnemius). Außerdem sind die
Muskelfasern von sehr unterschiedlicher Größe - z.B. sehr klein im m. tensor tympani oder in äußeren Augenmuskeln, groß im m. gastrocnemius. Kombiniert mit der unterschiedlichen Zahl der Muskelfasern pro motorischer Einheit (~4 in äußeren Augenmuskeln, ~1800 im gastrocnemius) ergibt sich eine enorme Bandbreite der Kraftsteuerung (extrem fein in Augen- oder Innenohrmuskeln).
Die Fasern
verschiedener motorischer Einheiten sind nicht isoliert voneinander im Muskel gruppiert, sondern mischen sich mit denen anderer (jeweils bis zu ~50 unterschiedlicher) motorischer Einheiten. Ein typischer Muskel wie der m. biceps brachii enthält etwa 750 motorische Einheiten, d.h. er wird von ~750 motorischen Vorderhornzellen gesteuert.
Größe der motorischen Einheit und Kraftentwicklung: Die Zahl
der Muskelfasern pro motorischer Einheit kann auch innerhalb des selben Muskels
sehr unterschiedlich sein (beispielsweise für mm. interossei der Hand zwischen
etwa 20 und 1770), was eine enorme Abstufung der Kraft
verschiedener motorischer Einheiten ermöglicht. Dazu kommt,
dass kleine motorische Einheiten kleine motorische Vorderhornzellen
haben, und diese erreichen wiederum rascher ihr Schwellenpotential als
große (size principle).
Das heißt, eine geringe Erregungsgröße im Rückenmark aktiviert nur
kleinere motorische Einheiten des betreffenden Muskels und entfaltet
nur geringe Kraft.
Die maximale Kontraktionskraft beträgt ~1 mN in der äußeren Augenmuskulatur, ~500 mN im Bizeps. Die
Kraftentwicklung eines Muskels hängt - außer von der Größe seiner
motorischen Einheiten - auch von Kontraktionsgeschwindigkeit (rasche und langsame
Fasern im Muskel meist kombiniert), Maximalkraft und Ermüdung ab. All
diese Eigenschaften sind nicht fix, sondern ändern sich mit Training
(Immobilisierung führt zu Muskelschwäche), Substratangebot und Alter.

Über
Länge, Kraft, Geschwindigkeit, Kontraktionsform s.
dort, über
Ermüdungsfaktoren s.
dort
 Noradrenalin und Serotonin erhöhen die Erregbarkeit motorischer Vorderhornzellen durch Aktivierung von L-Typ Ca++-Kanälen
an deren Dendriten. Dadurch verstärken sich die synaptischen Effekte um
das Mehrfache und kann so eine aktivierte Zelle weiter zur Bildung von
Aktionspotentialen bringen (self-sustained firing).
Das ist typisch für den anregenden Einfluss des Hirnstamms im
Wachzustand. Erst ein kurzer inhibitorischer Reiz (wie im Rahmen eines
Reflexes) beendet dann diese prolongierte Aktivität des Motoneurons.
Noradrenalin und Serotonin erhöhen die Erregbarkeit motorischer Vorderhornzellen durch Aktivierung von L-Typ Ca++-Kanälen
an deren Dendriten. Dadurch verstärken sich die synaptischen Effekte um
das Mehrfache und kann so eine aktivierte Zelle weiter zur Bildung von
Aktionspotentialen bringen (self-sustained firing).
Das ist typisch für den anregenden Einfluss des Hirnstamms im
Wachzustand. Erst ein kurzer inhibitorischer Reiz (wie im Rahmen eines
Reflexes) beendet dann diese prolongierte Aktivität des Motoneurons.
Im Schlaf hingegen unterbleibt der
monoaminerge Anregungseffekt auf motorische Vorderhornzellen, was die
Relaxation insbesondere rasch kontrahierender Muskeln miterklärt.
α-motorische Vorderhornzellen werden von (nur) drei Arten Nervenfasern beeinflusst:
 Sensorische Eingänge von Muskelspindeln
Sensorische Eingänge von Muskelspindeln

 Axone von absteigenden Motoneuronen aus Motorcortex und Hirnstamm
Axone von absteigenden Motoneuronen aus Motorcortex und Hirnstamm

 Interneurone (spinale Einflüsse, inhibitorisch oder exzitatorisch)
Interneurone (spinale Einflüsse, inhibitorisch oder exzitatorisch)
Auf diese Weise werden die aktuelle Länge der beteiligten Muskeln berücksichtigt (Feedbacksysteme), motorische Steuerprogramme aus dem Gehirn (Pyramidenbahn, tractus tecto-, vestibulo-, reticulo-, rubrospinalis) exekutiert und Bewegungsprogramme auf Rückenmarksniveau ausgeführt, wobei der Einfluss der spinalen Interneurone auf α-Motoneurone der intensivste ist.
 1932 erhielten Charles Sherrington und Edgar Adian den Nobelpreis für Physiologie oder Medizin. Sherrington
konnte den Mechanismus von Reflexwegen (z.B. Kniesehnenreflex) und
neurophysiologische Grundlagen des Zusammenspiels von Synergisten bzw.
Antagonisten aufklären; er prägte u.a. den Begriff "motorische
Einheit". Adrian erforschte die elektrische Impulsübertragung über Nervenfasern und entdeckte das "Alles-oder-Nichts-Prinzip" der Reizantwort.
1932 erhielten Charles Sherrington und Edgar Adian den Nobelpreis für Physiologie oder Medizin. Sherrington
konnte den Mechanismus von Reflexwegen (z.B. Kniesehnenreflex) und
neurophysiologische Grundlagen des Zusammenspiels von Synergisten bzw.
Antagonisten aufklären; er prägte u.a. den Begriff "motorische
Einheit". Adrian erforschte die elektrische Impulsübertragung über Nervenfasern und entdeckte das "Alles-oder-Nichts-Prinzip" der Reizantwort.
Selbsthemmung durch Renshaw-Zellen
Sind motorische
Vorderhornzellen aktiv, erregen sie mittels kurzer Kollateralen ihrer
(cholinergen) Neuriten kleine, in unmittelbarer Nachbarschaft im Vorderhorn liegende
Neurone (Renshaw-Zellen  ,
,  Abbildung). Diese wirken auf die Vorderhornzelle
hemmend zurück (rekurrente Hemmung); Transmitter sind Glycin und GABA.
Dadurch kommt es zu Selbsthemmung aktiver motorischer Einheiten, die
Kontraktion wird begrenzt und ufert nicht aus. Das ist für die Abfolge
glatter, gut kontrollierbarer Bewegungen wesentlich.
Abbildung). Diese wirken auf die Vorderhornzelle
hemmend zurück (rekurrente Hemmung); Transmitter sind Glycin und GABA.
Dadurch kommt es zu Selbsthemmung aktiver motorischer Einheiten, die
Kontraktion wird begrenzt und ufert nicht aus. Das ist für die Abfolge
glatter, gut kontrollierbarer Bewegungen wesentlich.
 Abbildung: Renshaw-Hemmung
Abbildung: Renshaw-Hemmung
Nach einer Vorlage bei Massey / Cunniffe / Noorani, Carpenter's Neurophysiology - A Conceptual Approach, 6th ed. CRC Press Taylor & Francis Group 2022
Motorische Vorderhornzellen (grün) regen (cholinerg) über kurze Kollateralen Renshaw-Zellen
(rot)
an. Diese reagieren mit relativ lang anhaltender, salvenartiger
Entladung und geben ihre Neurotransmitter - Glycin und GABA - an
Rezeptoren der motorischen Vorderhornzelle(n) ab, womit sie diese
hemmen (rekurrente Inhibition). Ihre inhibierende Wirkung erstreckt sich auch auf benachbarte motorische Vorderhornzellen im umgebenden Pool von Motoneuronen (laterale Inhibition). Das führt zu einer Art "Selbstbeschränkung" der motorischen
Exzitation im betreffenden Muskel.
Vermutlich wird auf diese Weise einer synchronisierten Entladung von
α-Motoneuronen entgegengewirkt; Beschädigung / Ausfall der
Renshaw-Zellen bewirkt Muskelkrämpfe.
Strychnin
ist ein neurotoxisches Alkaloid, das vor allem den Glycinrezeptor hemmt
und damit den inhibitorischen Effekt von Renshaw-Zellen aufheben kann.
Strychninvergiftung führt zu Muskelkrämpfen, die in höherer Dosis
lebensbedrohlich sein können, weil dann das physiologische Gegengewicht
zu einer Übererregung an den motorischen Endplatten ausfällt

Der molekulare Wirkungsmechanismus der Renshaw-Inhibition ist eine erhöhte
Öffnungswahrscheinlichkeit über Glycinrezeptoren beeinflusster ligandengesteuerter Chlorid-Kanäle, es
treten inhibitorische postsynaptische Potentiale (IPSPs) an der
motorischen Vorderhornzelle auf.
(Glycin kann über NMDA-Rezeptoren auch stimulierend wirken.)
α-motorische Vorderhornzellen entsenden cholinerge Kollateralen zu glycinergen Renshaw-Zellen
Glycinrezeptoren öffnen Chloridkanäle an motorischen Vorderhornzellen und inhibieren sie dadurch
|
Der Effekt ist abhängig vom Ausgangswert des Membranpotentials: das Gleichgewichtspotential der Chloridkanäle liegt bei ~-70 mV, d.h. ihre Öffnung führt bei Membranpotentialen unter diesem Wert zu Hyperpolarisation (IPSP's, inhibitorische postsynaptische Potentiale), bei Werten darüber hingegen zu Depolarisation.
Die physiologische Bedeutung der Renshaw-Hemmung liegt in einer
Dämpfung der Kontraktion (Schutz vor zu starker Aktivierung bei
Auslösung des Muskelspindelreflexes) sowie einer Beteiligung an der Stützmotorik.
Herabgesetzte Renshaw-Hemmung (z.B. bei amyotropher Lateralsklerose) kann zu Spastizität beitragen.
Wird der Renshaw-Mechanismus lahmgelegt (z.B. durch Strychnin oder Tetanustoxin),
kommt es zu Muskelkrämpfen, die unkontrollierbar werden können. Das von Clostridium tetani-Bakterien gebildete Tetanustoxin (Tetanospasmin) ist ein Protein,
das über eine Wunde in die Axone motorischer Vorderhornzellen eintritt
und bis in Rückenmark bzw. Hirnstamm wandert und dort die Wirkung
inhibitorischer Transmitter (Glyzin, GABA)
aufhebt. Das steigert die Impulsfrequenz der Motoneurone, es kommt zu
Dauerkontraktion (Krämpfen) der betroffenen Skelettmuskeln.
Sehnenspindeln sind mit der Muskelfaser in Serie
geschaltet, d.h.
Verkürzung des Muskels stimuliert automatisch das Sehnenorgan. Dieses
reagiert auch, wenn der Muskel aureichend stark von außen gedehnt wird
(in diesem Fall erfolgt die Entladung von Sehnen- und
Muskelspindelrezeptoren in Phase).
Die Rezeptoren haben proportional-differentielle Ansprechcharakteristik (PD-Rezeptoren), ihre Empfindlichkeit kann über efferente Fasern vom ZNS her verstellt werden. In den Reflexweg zu den Motoneuronen des auslösenden Organs sind mindestens zwei Synapsen eingeschaltet.
Zweck des Sehnenspindelreflexes ( Abbildung) ist die Kontrolle der
Muskelstärke, Optimierung der Gelenksbelastung und allenfalls ein Überlastungsschutz. Die Ib-Afferenzen von Sehnenspindeln inhibieren über Interneurone zugehörige motorische Vorderhornzellen;
das ermöglicht einen Schutzmechanismus, der einer Überlastung und
möglicher Verletzung (Muskeleinriss) der Muskeln vorbeugen soll.
Abbildung) ist die Kontrolle der
Muskelstärke, Optimierung der Gelenksbelastung und allenfalls ein Überlastungsschutz. Die Ib-Afferenzen von Sehnenspindeln inhibieren über Interneurone zugehörige motorische Vorderhornzellen;
das ermöglicht einen Schutzmechanismus, der einer Überlastung und
möglicher Verletzung (Muskeleinriss) der Muskeln vorbeugen soll.
Ib-Afferenzen aus Sehnenspindeln hemmen zugehörige α-Motoneurone (Schutzwirkung)
|

Muskelspindelreflex (stretch reflex)
Die Dehnung von Muskelspindeln führt
 zur reflektorischen Anspannung der
extrafusalen Fasern desselben Muskels (
zur reflektorischen Anspannung der
extrafusalen Fasern desselben Muskels ( Abbildung) und oft
Abbildung) und oft

 zu weiteren Effekten an
anderen Muskeln.
zu weiteren Effekten an
anderen Muskeln.
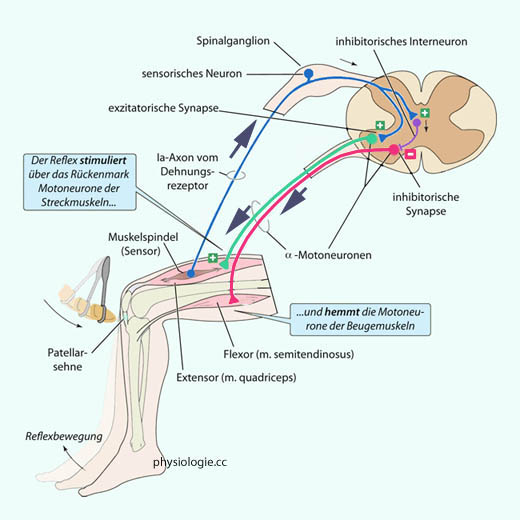

 Abbildung: Muskelspindelreflex
Abbildung: Muskelspindelreflex
Modifiziert nach einer Vorlage bei Boron / Boulpaep, Medical Physiology, 1st ed. Saunders 2003
Dieser
Reflex kann durch rasche Dehnung von Muskelspindelrezeptoren
ausgelöst werden, z.B. (wie in diesem Beispiel) infolge Hammerschlag
auf die Kniesehne (daher die Bezeichnung Patellarsehnenreflex). Dehnung
der
anulospiraligen Endigungen stimuliert Aktionspotentiale auf afferenten Ia-Fasern.
Der Reflex führt unmittelbar ("monosynaptisch") zu Anregung des
betreffenden Muskels und gleichzeitig (über inhibitorische Interneurone) zu Hemmung von Antagonisten (in diesem Beispiel Beuger im Oberschenkel), um den Reflexeffekt nicht zu antagonisieren

Der Muskelspindelreflex in seiner einfachsten Form ist formal
mit einer einzigen synaptischen Schaltung zu beschreiben
(“monosynaptisch”): Dehnung der Spindel führt über rasche Afferenzen zur
Entladung α-motorischer Vorderhornzellen und Muskelkontraktion. Beispiele: Testung des Patellarsehnenreflexes (Reizung von Spindeln im m. quadriceps femoris) oder des Achillessehnenreflexes (Reizung von Spindeln im m. triceps surae) mittels Reflexhammer.
Dieses Muster dient physiologischerweise vor allem dazu, das ”Einknicken“ von Gelenken durch
Kontraktion der entsprechenden Streckmuskeln zu verhindern. Die
Versteifung stützt den Körper gegen die Wirkung der Schwerkraft ab;
Streckmuskeln enthalten mehr Muskelspindeln als Beugemuskeln.
Der
Spindel-Längenrezeptor kann durch Dehnung des ganzen Muskels von
außen, aber auch durch Kontraktion der Spindelfaser gereizt werden.
Kontraktion des ganzen Muskels entspannt den Rezeptor; gleichzeitige
Aktivierung der γ-Fasern kann diesen Effekt auf den Längenrezeptor
kompensieren: Die "anulospiralige" Mittelzone der Spindel bleibt in
etwa gleich lang. Das ist sinnvoll, weil so bei Muskelkontraktion die
Messtätigkeit der Längenrezeptoren erhalten bleibt.
γ-motorische Vorderhornzellen steuern die kontraktilen (polaren) Anteile der Muskelspindel ( s. oben).
Durch deren Kontraktion wird der mittlere (äquatoriale) Anteil der
Spindel mit den darin enthaltenen Längenrezeptoren (Kernkettenfasern,
Kernsackfasern) gedehnt. Dehnung der anulospiraligen Mittelzonen durch γ-motorische Anteile könnte theoretisch einen Muskelspindelreflex aktivieren, ohne dass der Muskel als Ganzes gedehnt wurde. (Tatsächlich kommt es meist zu Koaktivierung der α- und γ-motorischen Vorderhornzellen).
s. oben).
Durch deren Kontraktion wird der mittlere (äquatoriale) Anteil der
Spindel mit den darin enthaltenen Längenrezeptoren (Kernkettenfasern,
Kernsackfasern) gedehnt. Dehnung der anulospiraligen Mittelzonen durch γ-motorische Anteile könnte theoretisch einen Muskelspindelreflex aktivieren, ohne dass der Muskel als Ganzes gedehnt wurde. (Tatsächlich kommt es meist zu Koaktivierung der α- und γ-motorischen Vorderhornzellen).
Muskelspindeln
können nicht nur Messimpulse (Aktionspotentiale) abgeben, deren
Frequenz die Länge von Skelettmuskeln
zu Rückenmark (über Spinalnerven) und Hirnstamm (über Hirnnerven)
melden (Längensensoren), sie sind auch in der Lage, ihre Empfindlichkeit in einem optimalen Bereich zu halten, d.h. an die jeweilige Muskellänge anzupassen. Das funktioniert folgendermaßen:

Abbildung: Muskelspindelfunktion bei einfacher Dehnung
Modifiziert
nach einer Vorlage bei Marieb E, Hoehn K, Human Anatomy &
Physiology, 7th Ed. Pearson Education / Benjamin Cummings 2007
Wird
ein Skelettmuskel von außen (passiv) gedehnt, nimmt die Länge der
Muskelspindel und ihrer Messzone zu, die anulospiraligen
Nervenendigungen werden gereizt, die Aktionspotentialfrequenz an
Ia-Afferenzen steigt an

Der primäre
Zweck der Muskelspindeln ist es, die Länge "ihres" Muskels an das
Zentralnervensystem zu signalisieren. Das ist notwendig, um für die
motorische Kontrolle notwendige Impulse bereitzustellen, an Hand derer
das Gehirn in die Lage versetzt wird, bei der Berechnung der jeweils
adäquaten Anregungspakete an die motorischen Vorderhornzellen die
aktuelle Länge der einzelnen Muskelpartien bzw. die Position der
Gelenke zu berücksichtigen.
Was passiert, wenn die Dehnung von außen
kommt? Wenn z.B. eine stehende Person im Kniegelenk einknickt, werden
u.a. im Oberschenkelstrecker (m. quadriceps femoris) Muskelspindeln
gedehnt, die anulospiraligen Endigungen in der Mittelzone der Spindeln
gereizt, und es laufen vermehrt Aktionspotentiale über Ia-Nervenfasern
( Abbildung) zum Rückenmark (in diesem Fall in die Lumbalsegmente
2-4). Das löst entsprechende Maßnahmen aus, hier das Triggern eines in
der Klinik als "Patellarsehnenreflex" (
Abbildung) zum Rückenmark (in diesem Fall in die Lumbalsegmente
2-4). Das löst entsprechende Maßnahmen aus, hier das Triggern eines in
der Klinik als "Patellarsehnenreflex" ( Abbildung oben) bezeichneten "monosynaptischen"
Musters.
Abbildung oben) bezeichneten "monosynaptischen"
Musters.
Dieses bringt den Quadrizeps über Aktivierung seiner α-motorischen
Vorderhornzellen und die davon kommandierten extrafusalen motorischen
Einheiten in sehr kurzer Zeit zur Kontraktion. Das sollte den Muskel so
festigen, dass die betroffene Person das Einknicken rechtzeitig
(unbewusst, das Gehirn ist nicht involviert und käme auch zu spät)
abfängt.
Längenzuwachs der Muskelspindel erhöht die Impulsrate seiner Ia-Fasern
|
In
diesem Fall kommt es durch die Kontraktion der extrafusalen
"Arbeitsmuskulatur" zur Wiederherstellung einer "normalen" Muskellänge,
und die Muskelspindel bleibt im Wesentlichen in ihrem normalen
Längenbereich, die anulospiraligen Endigungen senden weiter
Aktionspotentiale, sie "messen" weiterhin die Muskellänge.
Muskelspindeln passen ihre Antwort mit der Zeit an die geänderte Länge
an, die Aktionspotentialfrequenz ist zuerst dem Längenzuwachs
proportional, sinkt aber dann mit zunehmender Dauer der konstant
vergrößerten Länge der Messzone (Adaptation, Proportional-Differential-Verhalten).
Muskelspindeln verhalten sich als PD-Rezeptoren
|
Die motorische Innervation der Muskelspindeln erfolgt durch γ-Motoneurone (Axondurchmesser ca. 6 µm, vgl. Abbildung oben). Davon gibt es zwei Typen:
 Dynamische γ-Motoneurone (γd-Motoneurone) verkürzen Kernsackfasern (nuclear bag fibers - die Kerne liegen gruppiert in der Mitte der Kapsel) und steigern deren dynamische
Empfindlichkeit, was zu besserer Messung von
Längenänderungen führt - sie sind PD- (proportional- differential-empfindliche) Rezeptoren.
Diese "dynamischen" Motoneurone steigern die Sensitivität von
Ia-Afferenzen, haben aber keine Wirkung auf II-Afferenzen zum ZNS.
Dynamische γ-Motoneurone (γd-Motoneurone) verkürzen Kernsackfasern (nuclear bag fibers - die Kerne liegen gruppiert in der Mitte der Kapsel) und steigern deren dynamische
Empfindlichkeit, was zu besserer Messung von
Längenänderungen führt - sie sind PD- (proportional- differential-empfindliche) Rezeptoren.
Diese "dynamischen" Motoneurone steigern die Sensitivität von
Ia-Afferenzen, haben aber keine Wirkung auf II-Afferenzen zum ZNS.
 Statische
γ-Motoneurone (γs-Motoneurone) erhöhen hingegen die statische Empfindlichkeit von Kernkettenfasern (nuclear chain fibers - ihre Kerne sind in der Kapsel linear aufgereiht wie Erbsen in einer
Schote). Diese registrieren primär die Länge des Organs an sich, sind
also eher P-Rezeptoren. γs-Motoneurone erhöhen sie Sensitivität beider Typen von Afferenzen (nicht nur II, sondern auch Ia).
Muskelspindeln enthalten rund ein halbes Dutzend intrafusale Fasern -
meist mehrheitlich Kernkettenfasern, was die Bedeutung der Längenmessung unterstreicht.
Statische
γ-Motoneurone (γs-Motoneurone) erhöhen hingegen die statische Empfindlichkeit von Kernkettenfasern (nuclear chain fibers - ihre Kerne sind in der Kapsel linear aufgereiht wie Erbsen in einer
Schote). Diese registrieren primär die Länge des Organs an sich, sind
also eher P-Rezeptoren. γs-Motoneurone erhöhen sie Sensitivität beider Typen von Afferenzen (nicht nur II, sondern auch Ia).
Muskelspindeln enthalten rund ein halbes Dutzend intrafusale Fasern -
meist mehrheitlich Kernkettenfasern, was die Bedeutung der Längenmessung unterstreicht.
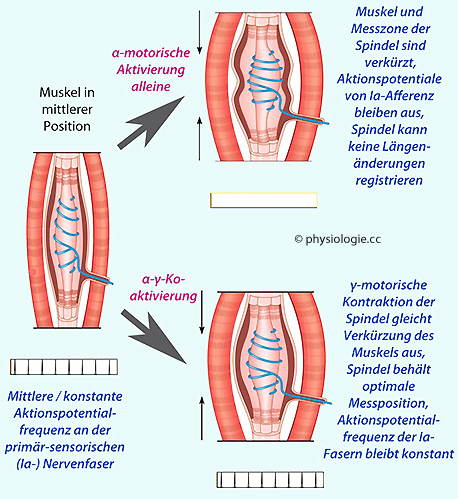

Abbildung: Muskelspindelfunktion bei Kontraktion der extrafusalen Fasern
Modifiziert
nach einer Vorlage bei Marieb E, Hoehn K, Human Anatomy &
Physiology, 7th Ed. Pearson Education / Benjamin Cummings 2007
Wird
ein Skelettmuskel durch α-motorische Impulse zur Kontraktion gebracht
(extrafusale "Arbeitsmuskulatur"), dann verkürzen sich die parallel
liegenden Messzonen der Muskelspindeln.
Ohne
Kompensation würde das dazu führen, dass die nunmehr schlaffen
Mittelzonen bzw. deren anulospiraligen Endigungen keine
Aktionspotentiale mehr bilden und daher auch keine Messung der
Muskellänge mehr stattfinden kann (rechts oben).
Das ZNS aktiviert deshalb bei "Willkürbewegungen" sowohl α-motorische als auch γ-motorische
Vorderhornzellen (Koaktivierung). Auf diese Weise wird die Verkürzung
der Spindel-Mittelzone verhindert, da die intrafusalen motorischen
Endigungen zur Messzone in Serie liegen (rechts unten)

Wie wird dieses Problem gelöst? Die Spindelfasern verfügen an ihren Enden über kontraktile Enden, die unter der Kontrolle γ-motorischer Vorderhornzellen stehen. Werden diese nun im Zuge einer Muskelanregung mitaktiviert (α-γ-Koaktivierung), dann kann die Länge der (zwischen den kontraktilen Enden, also in Serie liegende) Messzone in der Spindelmitte ziemlich konstant und die Messempfindlichkeit der Spindel im optimalen Bereich gehalten
werden ( Abbildung). So wird der für die Längenmessung ungünstige
Effekt der Verkürzung des Muskels kompensiert. Das Gehirn programmiert
sozusagen diese Korrekturen in die Berechnung der Motorik mit ein.
Abbildung). So wird der für die Längenmessung ungünstige
Effekt der Verkürzung des Muskels kompensiert. Das Gehirn programmiert
sozusagen diese Korrekturen in die Berechnung der Motorik mit ein.
Die Empfindlichkeit des Muskelspindelsystems wird durch γ-Motoneurone beeinflusst
|
γ-motorische Vorderhornzellen geben eine
bestimmte Muskellänge vor, der Muskelspindelreflex folgt automatisch nach.
Die γ-Innervation beeinflusst die Stärke des Muskelspindelreflexes: Aktivierung γ-motorischer
Vorderhornzellen reduziert die Schwelle für die Auslösung des
Muskelspindelreflexes durch Vordehnung (Sensibilisierung) der
längenempfindlichen Äquatorialzone (anulospiraligen Endigungen) im
betreffenden Muskel.
Aus den Muskelspindel-Äquatorialzonen laufen zwei Arten von Afferenzen - beide längenempfindlich - zum Rückenmark / Hirnstamm ( Abbildung): Primäre vom Typ Ia versorgen den zentralen Abschnitt beider Fasertypen mit anulospiraligen Endigungen, und sekundäre vom Typ II peripherere Anteile der Muskelspindel, vor allem Kernkettenfasern (vgl. Abbildung oben).
Abbildung): Primäre vom Typ Ia versorgen den zentralen Abschnitt beider Fasertypen mit anulospiraligen Endigungen, und sekundäre vom Typ II peripherere Anteile der Muskelspindel, vor allem Kernkettenfasern (vgl. Abbildung oben).
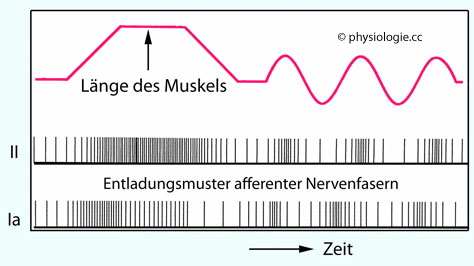
 Abbildung: Antwortverhalten von Ia- und II-Fasern
Abbildung: Antwortverhalten von Ia- und II-Fasern
Nach Matthews PBC, Muscle spindles and their control. Physiol Rev 1964; 44: 219-88
Sekundäre afferente Neurone aus Muskelspindeln (II-Fasern)
vermitteln Information über die Länge der Faser und adaptieren kaum,
verhalten sich weitgehend als Proportionalrezeptoren (P-Verhalten,
"statisch"): Ihre Entladungsfrequenz spiegelt die Länge der Muskelspindel
wider.
Im Gegensatz dazu adaptieren primäre Neurone (Ia-Fasern)
rasch, zeigen Differentialverhalten ("dynamisch"): Sie reagieren vor
allem auf Änderung der Länge des Muskels bzw. der Muskelspindel

 Ia- ("primäre") Afferenzen von den mittleren (äquatorialen) Teilen des Längensensors (
Ia- ("primäre") Afferenzen von den mittleren (äquatorialen) Teilen des Längensensors ( s. oben). Sie verfügen über eine hohe differentielle Empfindlichkeit (D-Rezeptoren), d.h. sie reagieren auf Änderungen
ihrer Länge besonders stark und beeinflussen im Rahmen des
Spindelreflexes sowohl Synergisten als auch Antagonisten des
betreffenden Muskels.
s. oben). Sie verfügen über eine hohe differentielle Empfindlichkeit (D-Rezeptoren), d.h. sie reagieren auf Änderungen
ihrer Länge besonders stark und beeinflussen im Rahmen des
Spindelreflexes sowohl Synergisten als auch Antagonisten des
betreffenden Muskels.
 II-
("sekundäre") Afferenzen - fast alle Muskelspindeln verfügen über diese
weniger stark differentiell empfindlichen Sensoren, ihr Ansprechverhalten ist eher proportional (P-Rezeptoren). Sie haben eine geringere Leitungsgeschwindigkeit (geringerer Faserdurchmesser) als Ia-Fasern. Die zentrale Verschaltung ist wesentlich breiter in die Motorik integriert, z.B. im Rahmen der Steuerung ganzer Extremitäten.
II-
("sekundäre") Afferenzen - fast alle Muskelspindeln verfügen über diese
weniger stark differentiell empfindlichen Sensoren, ihr Ansprechverhalten ist eher proportional (P-Rezeptoren). Sie haben eine geringere Leitungsgeschwindigkeit (geringerer Faserdurchmesser) als Ia-Fasern. Die zentrale Verschaltung ist wesentlich breiter in die Motorik integriert, z.B. im Rahmen der Steuerung ganzer Extremitäten.
Postreflektorische Innervationsstille:
Nach Auslösung eines Muskelspindelreflexes (z.B.
"Patellarsehnenreflex") nimmt der Muskeltonus für ~01,-0,5 Sekunden
deutlich ab (silent period im EMG). Das hat mehrere Ursachen:
 Positive Nachpotentiale an den motorischen Vorderhornzellen erschweren die Auslösung von Aktionspotentialen
Positive Nachpotentiale an den motorischen Vorderhornzellen erschweren die Auslösung von Aktionspotentialen

 Anregung der zugeordneten Renshaw-Zellen (glyzinerge Selbsthemmung) verringert die Wahrscheinlichkeit der Bildung von Aktionspotentialen
Anregung der zugeordneten Renshaw-Zellen (glyzinerge Selbsthemmung) verringert die Wahrscheinlichkeit der Bildung von Aktionspotentialen

 Die im Rahmen der Kontraktion erfolgende Entdehnung der Spindeln homonymer Muskeln reduziert die afferente Impulswahrscheinlichkeit an Ia-Fasern
Die im Rahmen der Kontraktion erfolgende Entdehnung der Spindeln homonymer Muskeln reduziert die afferente Impulswahrscheinlichkeit an Ia-Fasern

 Dehnung der Sehnenrezeptoren hemmt die Aktionspotentialbildung (Ib-Afferenzen)
Dehnung der Sehnenrezeptoren hemmt die Aktionspotentialbildung (Ib-Afferenzen)
Polysynaptische Reflexe
Im Gegensatz zu Reflexen, die sich auf das auslösende Organ auswirken ("Eigenreflexe", z.B. auf denselben Muskel zurückprojizierender Spindelreflex), werden solche, die sich auf benachbarte Organe auswirken, als Fremdreflexe bezeichnet. In deren Verschaltungen sind Interneurone integriert, deshalb nennt man diese Reflexe polysynaptisch (im Gegensatz zu den schon mit einer Umschaltung möglichen - monosynaptischen - Eigenreflexen).
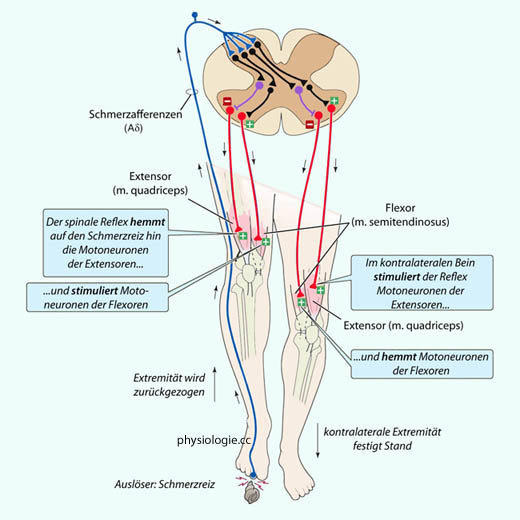
 Abbildung: Schmerzgetriggerter gekreuzter Reflex
Abbildung: Schmerzgetriggerter gekreuzter Reflex
Nach einer Vorlage bei Boron / Boulpaep, Medical Physiology, 1st ed. Saunders 2003
Der
Effekt des Reflexes ist ein koordiniertes Bewegungsmuster, in diesem
Fall das Zurückziehen des rechten Beins (Schmerzreiz an Fußsohle) und
gleichzeitige Aktivierung der Haltemuskulatur (Extensoren) im linken
Bein, also eine Stützwirkung.
Es können weitere Muskelgruppen
involviert sein, insgesamt mit dem Ziel motorischer Stabilisierung

Eigenreflexe sind bei Blockade der Pyramidenbahn gesteigert (Wegfall zentraler Hemmungen)
|
Die Reflexstruktur über mehrere Neuronen bedingt längere Reflexzeiten sowie die Möglichkeit zeitlicher und räumlicher Summation an zentralen Neuronen - zunehmende Reizstärke hat abnehmende Reflexzeit zur Folge.
Aktivitätsmuster: Welche dabei - über Einschaltung von Zwischenneuronen
- als Mitspieler (Agonisten) unterstützt und welche als Gegenspieler
(Antagonisten) gehemmt werden, ist situationsabhängig und wird via absteigende Fasern vom Gehirn festgelegt. Die
Funktionswege laufen dann über polysynaptische  Verschaltungen im ZNS:
Verschaltungen im ZNS:
 Gekreuzte Reflexe:
Schmerzreize von der Haut oder bindegewebigen Strukturen können
intensive Reflexbewegungen auslösen. Ein Beispiel zeigt die
Gekreuzte Reflexe:
Schmerzreize von der Haut oder bindegewebigen Strukturen können
intensive Reflexbewegungen auslösen. Ein Beispiel zeigt die  Abbildung: Der Tritt auf einen spitzen Gegenstand regt über
Aktivierung "rascher" Schmerzfasern
(vor allem Aδ) ein Reflexmuster an, das auf die Retraktion
(Beugeraktivierung) der betroffenen und gleichzeitig Stützfunktion
(Streckeraktivierung) der kontralateralen Extremität abzielt. Das
Reflexmuster kreuzt also teilweise die Seite, es sind Interneurone auf
beiden Seiten involviert.
Abbildung: Der Tritt auf einen spitzen Gegenstand regt über
Aktivierung "rascher" Schmerzfasern
(vor allem Aδ) ein Reflexmuster an, das auf die Retraktion
(Beugeraktivierung) der betroffenen und gleichzeitig Stützfunktion
(Streckeraktivierung) der kontralateralen Extremität abzielt. Das
Reflexmuster kreuzt also teilweise die Seite, es sind Interneurone auf
beiden Seiten involviert.
Generell wirken sich Schmerzafferenzen vorwiegend auf Flexoren
fördernd aus, da diese die betroffenen Extremitäten von der
Schmerzquelle weg (zum Körper hin) bewegen. Dabei ist die Ansteuerung
der Beugemuskeln sehr spezifisch, je nach Ort der Schmerzquelle (die
Reflexstärke korreliert mit der Schmerzintensität), und es werden
komplexe Bewegungsmuster generiert, die u.U. mehrere Extremitäten
einbinden.
Bei polysynaptischen Reflexen - die sowohl somatische als auch vegetative Fasern beinhalten können - lassen sich Anpassungsvorgänge beobachten:
 Sensitivierung:
Wirken über längere Zeit Schmerzreize im Reflexmuster, sinkt die
Reizschwelle und die Reflexzeit, das rezeptive Feld wird vergrößert -
die Empfindlichkeit nimmt zu.
Sensitivierung:
Wirken über längere Zeit Schmerzreize im Reflexmuster, sinkt die
Reizschwelle und die Reflexzeit, das rezeptive Feld wird vergrößert -
die Empfindlichkeit nimmt zu.
 Habituation:
Andererseits führt die Wiederholung nicht-schmerzhafter Reize durch
zentrale Einflüsse zu abnehmendem Reflexeffekt (bei gleichbleibender
Empfindlichkeit der Elemente, die den Reflexbogen aufbauen -
Rezeptoren, Neuronen, Muskeln).
Habituation:
Andererseits führt die Wiederholung nicht-schmerzhafter Reize durch
zentrale Einflüsse zu abnehmendem Reflexeffekt (bei gleichbleibender
Empfindlichkeit der Elemente, die den Reflexbogen aufbauen -
Rezeptoren, Neuronen, Muskeln).
 Konditionierung: Längerfristige assoziative Lernprozesse wirken sich auf das reflektorische Ansprechverhalten aus.
Konditionierung: Längerfristige assoziative Lernprozesse wirken sich auf das reflektorische Ansprechverhalten aus.
Rhythmische Aktivität und spinaler Lokomotionsgenerator
 Wer steuert die motorische Einheit? Auf jede motorische
Vorderhornzelle wirken hunderte, sogar tausende anderer Nervenzellen
ein - sie stammen aus allen Teilen des ZNS. Das Rückenmark (wie das
Gehirn) ist aber auch alleine - ohne externe Anregung, ohne sensorisches Feedback - zur Bildung von Entladungsmustern fähig. Man nennt solche Neuronengruppen, die spontane Aktivität generieren können, zentrale Mustergeneratoren (central pattern generators, CPGs). Solche komplexen Schrittmacher finden sich auch in zerebralen motorischen Neuronengruppen, wie im Hirnstamm (Mittelhirn: mesencephalic locomotor region MLR).
Wer steuert die motorische Einheit? Auf jede motorische
Vorderhornzelle wirken hunderte, sogar tausende anderer Nervenzellen
ein - sie stammen aus allen Teilen des ZNS. Das Rückenmark (wie das
Gehirn) ist aber auch alleine - ohne externe Anregung, ohne sensorisches Feedback - zur Bildung von Entladungsmustern fähig. Man nennt solche Neuronengruppen, die spontane Aktivität generieren können, zentrale Mustergeneratoren (central pattern generators, CPGs). Solche komplexen Schrittmacher finden sich auch in zerebralen motorischen Neuronengruppen, wie im Hirnstamm (Mittelhirn: mesencephalic locomotor region MLR).
Jede Extremität verfügt über mindestens einen CPG, und die CPGs sind
untereinander neuronal verknüpft. CPGs koordinieren rhythmische
Kontraktionen von Muskelensembles bei der Fortbewegung (Lokomotion, locomotion).
Dies ist auch bei Wegfall sensorischer Rückkopplung möglich (die für
die Steuerung der Muskelgruppen aber bedeutsam ist), stellt also ein
autonomes Phänomen dar - nachdem es einmal "angestoßen" worden ist.
Anregung (z.B. glutamaterg) kann aus dem Mittelhirn (mesencephalic locomotor region)
oder weiter übergeordneten Neuronengruppen stammen, die auch
verlangsamende Wirkung haben können (z.B. GABAerg). Verschiedene
spezialisierte Kerne im Hirnstamm beteiligen sich an der Aktivierung
oder Hemmung spezifischer Automatismen bzw. Bewegungsmuster.
Schon das Rückenmark
hat - neben der Verwaltung vieler Reflexe - auch die Fähigkeit
übergreifender motorischer Koordination.
Es nutzt multiple CPGs, um die Fortbewegung unter Kontrolle zu halten. So kann das Rückenmark rhythmische
Aktivierungsmuster diverser Muskelgruppen aufbauen, die Elemente der
Fortbewegung darstellen und in höhere Bewegungsprogramme integriert
werden können, sodass das Gehirn auf solche motorischen Bausteine (Automatismen) zugreifen kann, ohne Einzelheiten kontrollieren zu müssen.
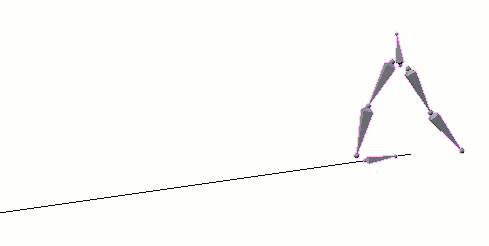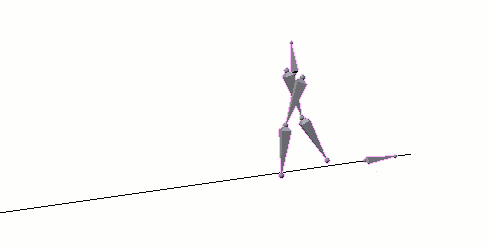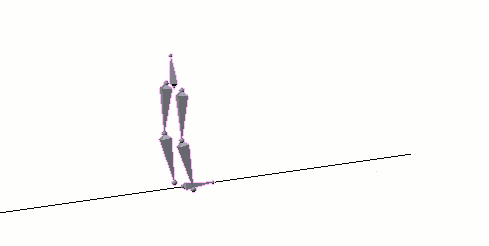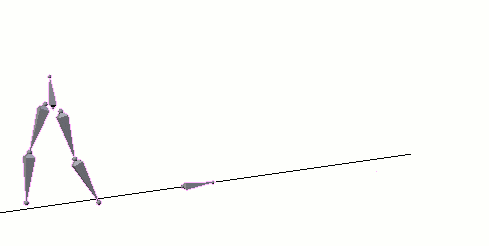 Spinaler Lokomotionsgenerator: Das Rückenmark ist prinzipiell zur Generierung einfacher, rhythmisch
wiederkehrender Bewegungsmuster (Gehbewegungen) fähig (<Animation). Eine Triggerrolle spielt dabei
wahrscheinlich die Aktivierung eines gekreuzten Streckreflexes.
Spinaler Lokomotionsgenerator: Das Rückenmark ist prinzipiell zur Generierung einfacher, rhythmisch
wiederkehrender Bewegungsmuster (Gehbewegungen) fähig (<Animation). Eine Triggerrolle spielt dabei
wahrscheinlich die Aktivierung eines gekreuzten Streckreflexes.
Rhythmische Entladungen können auf der Aktivität von Schrittmacherzellen beruhen, in neuronalen Netzwerken aber auch ohne Schrittmacherneuronen auftreten. Nach dem "Halbzentrenmodell" (half-center model)
sind exzitatorische und inhibitorische Interneurone so angeordnet, dass
sie sich gegenseitig hemmen. Danach steuert je ein "Halbzentrum" die
Motoneuronen in einem Paar antagonistischer Muskeln, z.B. Flexor /
Extensor in einem bestimmten Gelenk:
 Abbildung: Modell alternierender Rhythmusbildung für Motoneuronen in Beugern und Streckern
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Abbildung: Modell alternierender Rhythmusbildung für Motoneuronen in Beugern und Streckern
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Erregende
Interneurone (grün) werden von auf- oder absteigenden Nerven tonisch
(nicht rhythmisch) angeregt. Der inhibitorische Einfluss (rosa) ist zeitlich
begrenzt, sodass die Exzitation zwischen Flexor und Extensor hin- und
herschaltet

Es wird
postuliert, dass sensorische Afferenzen exzitatorische Interneurone
anregen, die dann rhythmisch und alternierend Strecker bzw. Beuger
aktivieren bzw. hemmen, wobei gekreuzte gegenseitige Beeinflussung
besteht. Solche Schaltungen bedeuten die
Anwesenheit von musterbildenden Zentren (motor pattern generators),
die z.B. Gangbewegungen ermöglichen. Diese
Neuronengruppen berücksichtigen sensorische Rückmeldungen (etwa von
Muskelspindeln), Information von anderen CPGs, und interagieren mit
motorischen Zentren im Hirnstamm. Die Neuronengruppen schalten sich über hemmende
Interneurone gegenseitig jeweils zeitlich begrenzt (für eine
halbe Phasendauer) aus, wobei die Phasen alternieren.
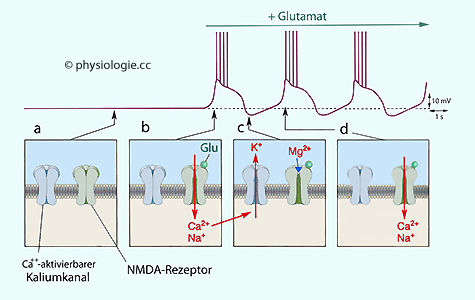
 Abbildung: Rhythmische Entladung in einem spinalen Interneuron
Nach einer Vorlage in Bear / Connors / Paradiso, Neuroscience, 4th ed. Wolters Kluwer 2016
Abbildung: Rhythmische Entladung in einem spinalen Interneuron
Nach einer Vorlage in Bear / Connors / Paradiso, Neuroscience, 4th ed. Wolters Kluwer 2016
Einige
exzitatorische Intzerneurone im Rückenmark entladen sich rhythmisch,
solange ihre NMDA-Rezeptoren durch Glutamat aktiviert werden.
a: Ruhezustand - Ionenkanäle geschlossen
b: Glutamat öffnet NMDA-Rezeptoren, Na+ / Ca++ strömen ein, die Zelle depolarisiert und feuert
c: Calciumionen öffnen Ca++-aktivierbare Kaliumkanäle, K+-Ausstrom hyperpolarisiert die Zelle, was Mg++ dazu bringt, NMDA-Kanäle für Ca++ zu blockieren
d: Das Absinken der Ca++-Konzentration im Neuron schließt die Ca++-aktivierbaren Kaliumkanäle, die Membran beginnt einen neuen Zyklus
Man vermutet, dass NMDA-Rezeptoren (durch die Na+- und Ca++-Ionen in exzitatorische
Interneurone fließen) und calciumabhängige Kalium-Kanäle (welche die Zelle
anschließend durch K-Ausstrom hyperpolarisieren) die molekularbiologische Grundlage solcher Exzitations-Inhibitions-Zyklen bilden ( Abbildung).
Abbildung).
Solange
kein Glutamat an die Rezeptoren bindet, bleibt die Zelle stumm. Wird
das Interneuron durch Aktivität glutamaterger Zellen angeregt, startet
ein Zyklus der Depolarisierung, anschließender Hyperpolarisierung, dann
wieder Depolarisierung etc. Im depolarisierten Zustand feuert die Zelle
Aktionspotentiale, motorische Vorderhornzellen und ihre motorischen
Einheiten werden zu zyklischer Tätigkeit anregt - die betroffenen
Muskeln kontrahieren sich im entsprechenden Rhythmus.
Glutamatausschüttung → Depolarisierung → Natrium- und Calciumionen strömen durch NMDA-Rezeptor in das Interneuron, Zelle generiert Aktionspotentiale
→ calciumsensitive Kaliumkanäle öffnen → Kaliumionen diffundieren aus
der Zelle → Zellmembran hyperpolarisiert → Calcium strömt nicht weiter
ein → Kaliumkanäle schließen → Membran depolarisiert, Zyklus beginnt
erneut
 Sowohl die Acetylcholin-Rezeptoren als auch die Rezeptoren der
Cholinesterase können durch Muskelrelaxantien blockiert werden; dadurch
wird der Muskel gelähmt. Eine Anwendung erfolgt in der Anästhesiologie, um Muskeln
während eines operativen Eingriffs zu entspannen (relaxieren).
Sowohl die Acetylcholin-Rezeptoren als auch die Rezeptoren der
Cholinesterase können durch Muskelrelaxantien blockiert werden; dadurch
wird der Muskel gelähmt. Eine Anwendung erfolgt in der Anästhesiologie, um Muskeln
während eines operativen Eingriffs zu entspannen (relaxieren).
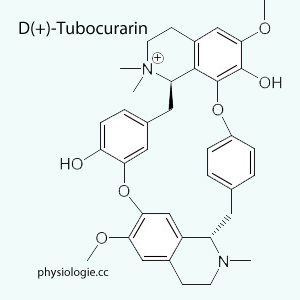
 Kurare-ähnliche
Stoffe wie das Alkaloid d-Tubocurarin (
Kurare-ähnliche
Stoffe wie das Alkaloid d-Tubocurarin ( Abbildung) verbinden sich mit Acetylcholin-Rezeptoren, ohne
die Natriumkanäle zu öffnen.
Abbildung) verbinden sich mit Acetylcholin-Rezeptoren, ohne
die Natriumkanäle zu öffnen.
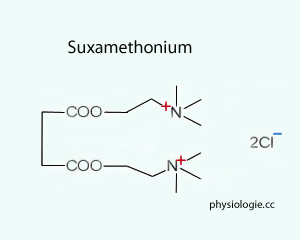
Das depolarisierende Succinyldicholin (Suxamethonium,  Abbildung) öffnet die Natriumkanäle
nachhaltig und bleibt länger am Rezeptor haften, wodurch es zu einer
Dauerdepolarisierung und Inaktivierung benachbarter Na-Kanäle kommt.
Abbildung) öffnet die Natriumkanäle
nachhaltig und bleibt länger am Rezeptor haften, wodurch es zu einer
Dauerdepolarisierung und Inaktivierung benachbarter Na-Kanäle kommt.
Der Effekt ist in beiden Fällen eine Muskellähmung (bei Kurare länger
andauernd). Hemmung der Cholinesterase (durch Neostigmin, Physostigmin u.a.)
führt schließlich ebenfalls zu dauernder Depolarisation an der
Muskelfaser.
Die Myasthenia gravis
 ist eine Autoimmunerkrankung, bei der Antikörper
gegen Acetylcholin-Rezeptoren an den Muskelfasern auftreten. Es kommt
zur Abnahme der Acetylcholinbedingten Depolarisation und rascher
Ermüdbarkeit, die sich zu schließlich tödlicher Paralyse der Muskeln (Atemmuskulatur) steigert.
ist eine Autoimmunerkrankung, bei der Antikörper
gegen Acetylcholin-Rezeptoren an den Muskelfasern auftreten. Es kommt
zur Abnahme der Acetylcholinbedingten Depolarisation und rascher
Ermüdbarkeit, die sich zu schließlich tödlicher Paralyse der Muskeln (Atemmuskulatur) steigert.
 Als Therapie werden Cholinesteraseblocker eingesetzt, deren
Wirkung nicht dauerhaft, sondern reversibel ist. Solche Substanzen
verzögern den Abbau von Acetylcholin (z.B. Neostigmin)
und können z.B. zur Beendigung der iatrogenen Lähmung nach einer
Narkose oder zur Behandlung einer Myasthenie verwendet werden. Weiters werden auch Immunsuppressiva eingesetzt.
Als Therapie werden Cholinesteraseblocker eingesetzt, deren
Wirkung nicht dauerhaft, sondern reversibel ist. Solche Substanzen
verzögern den Abbau von Acetylcholin (z.B. Neostigmin)
und können z.B. zur Beendigung der iatrogenen Lähmung nach einer
Narkose oder zur Behandlung einer Myasthenie verwendet werden. Weiters werden auch Immunsuppressiva eingesetzt.
 , Lou-Gehrig-Syndrom) geht mit einer
Degeneration spinaler und supraspinaler Motoneurone einher. Oxidativer
Stress durch Veränderung der Superoxid-Dismutase scheint in manchen
Fällen eine Rolle zu spielen, doch ist die Ursache meist unklar. Die
Behandlung zielt einerseits auf eine Verzögerung der
Neuronendegeneration ab, andererseits erfolgt sie
interdisziplinär-symptomatisch.
, Lou-Gehrig-Syndrom) geht mit einer
Degeneration spinaler und supraspinaler Motoneurone einher. Oxidativer
Stress durch Veränderung der Superoxid-Dismutase scheint in manchen
Fällen eine Rolle zu spielen, doch ist die Ursache meist unklar. Die
Behandlung zielt einerseits auf eine Verzögerung der
Neuronendegeneration ab, andererseits erfolgt sie
interdisziplinär-symptomatisch.
 Über Botulinustoxin, Acetylcholinfreisetzung und SNAREs s. dort
Über Botulinustoxin, Acetylcholinfreisetzung und SNAREs s. dort
 Läsionen
auf der Ebene des Motoneurons (motorische Vorderhornzelle) äußern sich
in einer schlaffen Lähmung der betroffenen Muskeln. Höher gelegene
Läsionen, insbesondere im Bereich der supraspinalen motorischen
Gebiete, manifestieren sich hingegen als spastische Lähmung. Diese ist durch erhöhten muskulären Grundtonus und Hyperreflexie gekennzeichnet.
Läsionen
auf der Ebene des Motoneurons (motorische Vorderhornzelle) äußern sich
in einer schlaffen Lähmung der betroffenen Muskeln. Höher gelegene
Läsionen, insbesondere im Bereich der supraspinalen motorischen
Gebiete, manifestieren sich hingegen als spastische Lähmung. Diese ist durch erhöhten muskulären Grundtonus und Hyperreflexie gekennzeichnet.

  Das Rückenmark steuert zwei Arten der Motorik: Körperhaltung und
Fortbewegung. Die Abläufe sind weitgehend automatisiert und von Bahnen
aus dem Hirnstamm (ventromediales System: tractus tecto-, reticulo-,
vestibulospinalis) kontrolliert. Der tractus vestibulospinalis steigert
die Aktivität von Extensoren und hemmt Flexoren. Der tractus
corticospinalis (Pyramidenbahn) steigert die Aktivität von Flexoren
zusammen mit dem tractus rubrospinalis
Das Rückenmark steuert zwei Arten der Motorik: Körperhaltung und
Fortbewegung. Die Abläufe sind weitgehend automatisiert und von Bahnen
aus dem Hirnstamm (ventromediales System: tractus tecto-, reticulo-,
vestibulospinalis) kontrolliert. Der tractus vestibulospinalis steigert
die Aktivität von Extensoren und hemmt Flexoren. Der tractus
corticospinalis (Pyramidenbahn) steigert die Aktivität von Flexoren
zusammen mit dem tractus rubrospinalis
 Propriozeption meldet Körperlage, Stellung von Körperteilen zueinander,
Körperbewegung. Dazu gehört Tiefensensibilität und Gleichgewichtssinn
Propriozeption meldet Körperlage, Stellung von Körperteilen zueinander,
Körperbewegung. Dazu gehört Tiefensensibilität und Gleichgewichtssinn
 Die Tiefensensibilität umfasst Kraftsinn (Golgi-Sehnenorgane:
Ib-Fasern), Lagesinn (Muskelspindeln: Ia- und II-Fasern, γ-Motorik) und
Bewegungssinn (Ruffini-Körperchen, freie Nervenendigungen in Gelenken)
Die Tiefensensibilität umfasst Kraftsinn (Golgi-Sehnenorgane:
Ib-Fasern), Lagesinn (Muskelspindeln: Ia- und II-Fasern, γ-Motorik) und
Bewegungssinn (Ruffini-Körperchen, freie Nervenendigungen in Gelenken)
 Längenzuwachs der Muskelspindeln erhöht die Impulsrate ihrer Ia-Fasern
und verhindert automatisch das "Einknicken" von Extensoren.
Ib-Afferenzen aus Sehnenspindeln vermitteln nicht nur Kraftsinn,
sondern hemmen auch zugehörige α-Motoneurone (Schutzwirkung)
Längenzuwachs der Muskelspindeln erhöht die Impulsrate ihrer Ia-Fasern
und verhindert automatisch das "Einknicken" von Extensoren.
Ib-Afferenzen aus Sehnenspindeln vermitteln nicht nur Kraftsinn,
sondern hemmen auch zugehörige α-Motoneurone (Schutzwirkung)
 Die Empfindlichkeit des Muskelspindelsystems wird durch γ-Motoneurone
beeinflusst, die bei Muskelkontraktion seine kontraktilen
Enden aktivieren (α-γ-Koaktivierung). Die
Messempfindlichkeit der Spindel bleibt einerseits im optimalen Bereich,
andererseits kann durch diese Anordnung die Stärke des
Muskelspindelreflexes reguliert werden
Die Empfindlichkeit des Muskelspindelsystems wird durch γ-Motoneurone
beeinflusst, die bei Muskelkontraktion seine kontraktilen
Enden aktivieren (α-γ-Koaktivierung). Die
Messempfindlichkeit der Spindel bleibt einerseits im optimalen Bereich,
andererseits kann durch diese Anordnung die Stärke des
Muskelspindelreflexes reguliert werden
 α-motorische Vorderhornzellen haben cholinerge Kollateralen zu
glyzinergen Renshaw-Zellen. Glyzinrezeptoren öffnen Chloridkanäle an
motorischen Vorderhornzellen und inhibieren sie dadurch (Selbsthemmung)
α-motorische Vorderhornzellen haben cholinerge Kollateralen zu
glyzinergen Renshaw-Zellen. Glyzinrezeptoren öffnen Chloridkanäle an
motorischen Vorderhornzellen und inhibieren sie dadurch (Selbsthemmung)
 Eine motorische Einheit ist eine motorische Vorderhornzelle mit den von
ihr versorgten Muskelfasern; sie ist die kleinste vom ZNS
beeinflussbare Einheit. Drei Arten von Nervenfasern versorgen
α-motorische Vorderhornzellen: Axone von absteigenden Motoneuronen aus
Motorcortex und Hirnstamm, sensorische Eingänge von Muskelspindeln,
sowie Interneurone. Sie berücksichtigen die aktuelle Länge des Muskels,
motorische Steuerprogramme aus dem Gehirn und führen Bewegungsprogramme
aus
Eine motorische Einheit ist eine motorische Vorderhornzelle mit den von
ihr versorgten Muskelfasern; sie ist die kleinste vom ZNS
beeinflussbare Einheit. Drei Arten von Nervenfasern versorgen
α-motorische Vorderhornzellen: Axone von absteigenden Motoneuronen aus
Motorcortex und Hirnstamm, sensorische Eingänge von Muskelspindeln,
sowie Interneurone. Sie berücksichtigen die aktuelle Länge des Muskels,
motorische Steuerprogramme aus dem Gehirn und führen Bewegungsprogramme
aus
 Eigenreflexe wirken sich (monosynaptisch) auf den Muskel aus, der sie
auslöst (Rückprojektion: Spindelreflex), Fremdreflexe (polysynaptisch)
auf benachbarte Organe. Eigenreflexe werden pyramidalmotorisch
inhibiert; bei Ausfall der Pyramidenbahn sind sie gesteigert
Eigenreflexe wirken sich (monosynaptisch) auf den Muskel aus, der sie
auslöst (Rückprojektion: Spindelreflex), Fremdreflexe (polysynaptisch)
auf benachbarte Organe. Eigenreflexe werden pyramidalmotorisch
inhibiert; bei Ausfall der Pyramidenbahn sind sie gesteigert
 Das Rückenmark kann repetitive Muster (wie für Gehbewegungen)
generieren (spinaler Lokomotionsgenerator), vermutlich ausgelöst durch
gekreuzte Streckreflexe, wie sie durch Berührungsreize ausgelöst
werden. Die Aktivierung von Muskelgruppen erfolgt je nach Ort des
auslösenden Reizes und durch gegenseitige Hemmung der Neurone für
Muskelgruppen, die an Gelenken antagonistisch wirken
Das Rückenmark kann repetitive Muster (wie für Gehbewegungen)
generieren (spinaler Lokomotionsgenerator), vermutlich ausgelöst durch
gekreuzte Streckreflexe, wie sie durch Berührungsreize ausgelöst
werden. Die Aktivierung von Muskelgruppen erfolgt je nach Ort des
auslösenden Reizes und durch gegenseitige Hemmung der Neurone für
Muskelgruppen, die an Gelenken antagonistisch wirken |




 Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.
Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.







 Aufgaben des Rückenmarks
Aufgaben des Rückenmarks  Propriozeption, Sehnen- und Muskelspindeln
Propriozeption, Sehnen- und Muskelspindeln  Motorische Vorderhornzelle & Einheit
Motorische Vorderhornzelle & Einheit  Renshaw-Hemmung
Renshaw-Hemmung  Sehnenspindelreflex
Sehnenspindelreflex  Muskelspindelreflex
Muskelspindelreflex  Gekreuzte Reflexe
Gekreuzte Reflexe  Rhythmische Aktivität und spinaler Lokomotionsgenerator
Rhythmische Aktivität und spinaler Lokomotionsgenerator
 Core messages
Core messages
 Abbildung: Absteigende Bahnen im Rückenmark
Abbildung: Absteigende Bahnen im Rückenmark Cortex - kortikospinal, zum Großteil nach Seitenkreuzung, also vom kontralateralen Motorcortex (tr. corticospinalis lateralis = Pyramidenbahn); Fasern im tr. corticospinalis anterior stammen aus der ipsilateralen Gehirnhälfte
Cortex - kortikospinal, zum Großteil nach Seitenkreuzung, also vom kontralateralen Motorcortex (tr. corticospinalis lateralis = Pyramidenbahn); Fasern im tr. corticospinalis anterior stammen aus der ipsilateralen Gehirnhälfte  Hirnstamm
(rubrospinal vom nucl. ruber im Mittelhirn, Seite gekreuzt;
vestibulospinal vom Deiters'schen Kern in der oberen medulla oblongata,
Seite nicht gekreuzt; tractus reticulospinalis medialis aus der
formatio reticularis der Brücke, haptsächlich ungekreuzt; tractus reticulospinalis lateralis aus der formatio reticularis der medulla oblongata, gekreuzt und ungekreuzt)
Hirnstamm
(rubrospinal vom nucl. ruber im Mittelhirn, Seite gekreuzt;
vestibulospinal vom Deiters'schen Kern in der oberen medulla oblongata,
Seite nicht gekreuzt; tractus reticulospinalis medialis aus der
formatio reticularis der Brücke, haptsächlich ungekreuzt; tractus reticulospinalis lateralis aus der formatio reticularis der medulla oblongata, gekreuzt und ungekreuzt)

 Abbildung: Skelettmuskelachse des zentralen Nervensystems
Abbildung: Skelettmuskelachse des zentralen Nervensystems

 Abbildung: Organisation des Rückenmarks
Abbildung: Organisation des Rückenmarks


 Abbildung: Deszendierende Systeme
Abbildung: Deszendierende Systeme Eine laterale Gruppe, dazu gehört der tractus corticospinalis, corticobulbaris und rubrospinalis (links); und
Eine laterale Gruppe, dazu gehört der tractus corticospinalis, corticobulbaris und rubrospinalis (links); und eine ventromediale Gruppe, dazu gehört der tractus tecto-, vestibulo- und reticulospinalis (rechts)
eine ventromediale Gruppe, dazu gehört der tractus tecto-, vestibulo- und reticulospinalis (rechts)
 ("Eigenwahrnehmung") dient der
Wahrnehmung der Körperlage (im Raum), der Stellung einzelner
Körperteile zueinander, sowie der verschiedenen Komponenten der
Körperbewegung. Dazu gehört
("Eigenwahrnehmung") dient der
Wahrnehmung der Körperlage (im Raum), der Stellung einzelner
Körperteile zueinander, sowie der verschiedenen Komponenten der
Körperbewegung. Dazu gehört die Tiefensensibilität und
die Tiefensensibilität und  Meldungen des Vestibularorgans.
Meldungen des Vestibularorgans. 
 Abbildung: Sehnenspindel
Abbildung: Sehnenspindel s. dort).
s. dort).
 Abbildung)
vermittelt. Sie messen die
Kraft, die an einer Sehne wirkt (durch Dehnung von außen und
durch Kontraktion des Muskels) - in der Achillessehne bis zu etwa eine Tonne Zugbelastung bei weniger als 1 cm2 Fläche.
Abbildung)
vermittelt. Sie messen die
Kraft, die an einer Sehne wirkt (durch Dehnung von außen und
durch Kontraktion des Muskels) - in der Achillessehne bis zu etwa eine Tonne Zugbelastung bei weniger als 1 cm2 Fläche. 

 Abbildung: Muskel- und Sehnenspindeln
Abbildung: Muskel- und Sehnenspindeln

 Abbildung: Dehnungsempfindliche Ionenkanäle intrafusaler Fasern vermitteln den Lagesinn
Abbildung: Dehnungsempfindliche Ionenkanäle intrafusaler Fasern vermitteln den Lagesinn


 Abbildung: Konvergenz verschiedener motorischer Kontrollbahnen auf eine motorische Vorderhornzelle
Abbildung: Konvergenz verschiedener motorischer Kontrollbahnen auf eine motorische Vorderhornzelle Aus
dem tractus corticospinalis und corticorubralis (diese deszendieren im
posterioren Teil des Seitenstrangs und projizieren vorwiegend auf
Interneurone in der Mitte der grauen Substanz)
Aus
dem tractus corticospinalis und corticorubralis (diese deszendieren im
posterioren Teil des Seitenstrangs und projizieren vorwiegend auf
Interneurone in der Mitte der grauen Substanz) Aus dem tractus reticulospinalis, dessen Fasern teils im Seiten- und
teils im Vorderstrang absteigen und teils direkt, teils über
Interneurone auf das Motoneuron wirken
Aus dem tractus reticulospinalis, dessen Fasern teils im Seiten- und
teils im Vorderstrang absteigen und teils direkt, teils über
Interneurone auf das Motoneuron wirken Aus dem tecto- und dem vestibulospinalen Trakt im Vorderstrang.
Aus dem tecto- und dem vestibulospinalen Trakt im Vorderstrang.
 Abbildung). Sie empfangen Signale über jeweils rund 104 Synapsen (~9000 an Dendriten und ~1000
am Zellkörper). Die meisten Synapsen stammen von Interneuronen im
Rückenmark, nur wenige von aus dem Gehirn absteigenden motorischen
Nervenfasern (die vorwiegend auf Interneurone projizieren, s. oben).
Abbildung). Sie empfangen Signale über jeweils rund 104 Synapsen (~9000 an Dendriten und ~1000
am Zellkörper). Die meisten Synapsen stammen von Interneuronen im
Rückenmark, nur wenige von aus dem Gehirn absteigenden motorischen
Nervenfasern (die vorwiegend auf Interneurone projizieren, s. oben). Die kleinste vom ZNS beeinflussbare Einheit ist eine
motorische Vorderhornzelle (Aα-Motoneuron) mit den von ihr gesteuerten Muskelfasern und
wird (nach dem Nobelpreisträger C.S. Sherrington) als motorische Einheit (motor unit) bezeichnet (
Die kleinste vom ZNS beeinflussbare Einheit ist eine
motorische Vorderhornzelle (Aα-Motoneuron) mit den von ihr gesteuerten Muskelfasern und
wird (nach dem Nobelpreisträger C.S. Sherrington) als motorische Einheit (motor unit) bezeichnet ( Abbildung). Sie versorgt einen bestimmten Muskelfasertyp (der sich u.U. adaptiv verändern kann) und erstreckt sich ausschließlich auf einen
definierten Muskel; seine Fasern kontrahieren sich immer gemeinsam
(gesteuert durch die Entladung des zuständigen Motoneurons). Der
Dendritenbaum motorischer Vorderhornzellen erstreckt sich über einen
großen Bereich im Rückenmark bzw. Hirnstamm und sammelt so Impulse von
Kombinationen zahlreicher anderer (z.B. "prämotorischer") Neurone aus
diversen Gebieten des ZNS, die verschiedene Transmitter verwenden
(Glutamat, Acetylcholin, GABA, Glycin u.a.) sowie auch von
somatosensorischen Neuronen.
Abbildung). Sie versorgt einen bestimmten Muskelfasertyp (der sich u.U. adaptiv verändern kann) und erstreckt sich ausschließlich auf einen
definierten Muskel; seine Fasern kontrahieren sich immer gemeinsam
(gesteuert durch die Entladung des zuständigen Motoneurons). Der
Dendritenbaum motorischer Vorderhornzellen erstreckt sich über einen
großen Bereich im Rückenmark bzw. Hirnstamm und sammelt so Impulse von
Kombinationen zahlreicher anderer (z.B. "prämotorischer") Neurone aus
diversen Gebieten des ZNS, die verschiedene Transmitter verwenden
(Glutamat, Acetylcholin, GABA, Glycin u.a.) sowie auch von
somatosensorischen Neuronen.  Die Gesamtheit an motorischen Neuronen (im Vorderhorn des Rückenmarks oder im Hirnstamm), welche einen Muskel versorgen, nennt man einen Motoneuronenpool (motor pool). Je nach Größe des Muskels enthält dieser von einigen 101 bis zu einigen 103 Neuronen. Die Aktivierung der Einheitsgruppen in diesem Pool erfolgt dabei nach dem Größenprinzip (size principle of motor units):
Solche mit kleinen Fasergruppen (weniger Muskelzellen) haben motorische
Neurone mit dünneren Axonen und werden zuerst aktiviert (Feinmotorik,
geringer Energieverbrauch), solche mit großen Einheiten (zahlreiche
Muskelzellen, dickere Axone) erst bei intensiverer Reizung (Kraftentfaltung, hoher Energieverbrauch).
Umgekehrt nimmt die Aktivierung großer Einheiten bei nachlassender
Reizgröße zuerst ab, gefolgt von kleineren Einheiten bei weiter
reduzierter Reizgröße.
Die Gesamtheit an motorischen Neuronen (im Vorderhorn des Rückenmarks oder im Hirnstamm), welche einen Muskel versorgen, nennt man einen Motoneuronenpool (motor pool). Je nach Größe des Muskels enthält dieser von einigen 101 bis zu einigen 103 Neuronen. Die Aktivierung der Einheitsgruppen in diesem Pool erfolgt dabei nach dem Größenprinzip (size principle of motor units):
Solche mit kleinen Fasergruppen (weniger Muskelzellen) haben motorische
Neurone mit dünneren Axonen und werden zuerst aktiviert (Feinmotorik,
geringer Energieverbrauch), solche mit großen Einheiten (zahlreiche
Muskelzellen, dickere Axone) erst bei intensiverer Reizung (Kraftentfaltung, hoher Energieverbrauch).
Umgekehrt nimmt die Aktivierung großer Einheiten bei nachlassender
Reizgröße zuerst ab, gefolgt von kleineren Einheiten bei weiter
reduzierter Reizgröße.
 Abbildung:
Motorische Einheiten
Abbildung:
Motorische Einheiten
 Noradrenalin und Serotonin erhöhen die Erregbarkeit motorischer Vorderhornzellen durch Aktivierung von L-Typ Ca++-Kanälen
an deren Dendriten. Dadurch verstärken sich die synaptischen Effekte um
das Mehrfache und kann so eine aktivierte Zelle weiter zur Bildung von
Aktionspotentialen bringen (self-sustained firing).
Das ist typisch für den anregenden Einfluss des Hirnstamms im
Wachzustand. Erst ein kurzer inhibitorischer Reiz (wie im Rahmen eines
Reflexes) beendet dann diese prolongierte Aktivität des Motoneurons.
Noradrenalin und Serotonin erhöhen die Erregbarkeit motorischer Vorderhornzellen durch Aktivierung von L-Typ Ca++-Kanälen
an deren Dendriten. Dadurch verstärken sich die synaptischen Effekte um
das Mehrfache und kann so eine aktivierte Zelle weiter zur Bildung von
Aktionspotentialen bringen (self-sustained firing).
Das ist typisch für den anregenden Einfluss des Hirnstamms im
Wachzustand. Erst ein kurzer inhibitorischer Reiz (wie im Rahmen eines
Reflexes) beendet dann diese prolongierte Aktivität des Motoneurons. Sensorische Eingänge von Muskelspindeln
Sensorische Eingänge von Muskelspindeln
 Axone von absteigenden Motoneuronen aus Motorcortex und Hirnstamm
Axone von absteigenden Motoneuronen aus Motorcortex und Hirnstamm
 Interneurone (spinale Einflüsse, inhibitorisch oder exzitatorisch)
Interneurone (spinale Einflüsse, inhibitorisch oder exzitatorisch) 1932 erhielten Charles Sherrington und Edgar Adian den Nobelpreis für Physiologie oder Medizin. Sherrington
konnte den Mechanismus von Reflexwegen (z.B. Kniesehnenreflex) und
neurophysiologische Grundlagen des Zusammenspiels von Synergisten bzw.
Antagonisten aufklären; er prägte u.a. den Begriff "motorische
Einheit". Adrian erforschte die elektrische Impulsübertragung über Nervenfasern und entdeckte das "Alles-oder-Nichts-Prinzip" der Reizantwort.
1932 erhielten Charles Sherrington und Edgar Adian den Nobelpreis für Physiologie oder Medizin. Sherrington
konnte den Mechanismus von Reflexwegen (z.B. Kniesehnenreflex) und
neurophysiologische Grundlagen des Zusammenspiels von Synergisten bzw.
Antagonisten aufklären; er prägte u.a. den Begriff "motorische
Einheit". Adrian erforschte die elektrische Impulsübertragung über Nervenfasern und entdeckte das "Alles-oder-Nichts-Prinzip" der Reizantwort. ,
,  Abbildung). Diese wirken auf die Vorderhornzelle
hemmend zurück (rekurrente Hemmung); Transmitter sind Glycin und GABA.
Dadurch kommt es zu Selbsthemmung aktiver motorischer Einheiten, die
Kontraktion wird begrenzt und ufert nicht aus. Das ist für die Abfolge
glatter, gut kontrollierbarer Bewegungen wesentlich.
Abbildung). Diese wirken auf die Vorderhornzelle
hemmend zurück (rekurrente Hemmung); Transmitter sind Glycin und GABA.
Dadurch kommt es zu Selbsthemmung aktiver motorischer Einheiten, die
Kontraktion wird begrenzt und ufert nicht aus. Das ist für die Abfolge
glatter, gut kontrollierbarer Bewegungen wesentlich.
 Abbildung: Renshaw-Hemmung
Abbildung: Renshaw-Hemmung
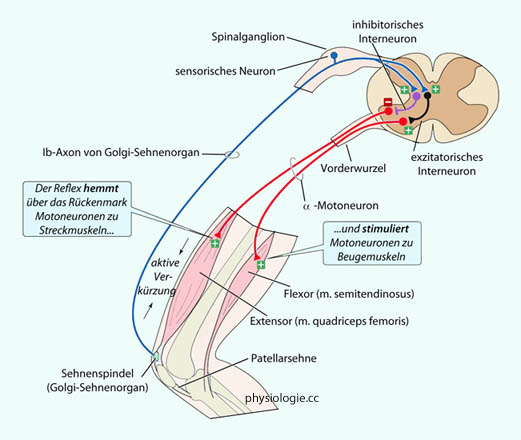
 Abbildung: Sehnenspindelreflex
Abbildung: Sehnenspindelreflex
 Abbildung) ist die Kontrolle der
Muskelstärke, Optimierung der Gelenksbelastung und allenfalls ein Überlastungsschutz. Die Ib-Afferenzen von Sehnenspindeln inhibieren über Interneurone zugehörige motorische Vorderhornzellen;
das ermöglicht einen Schutzmechanismus, der einer Überlastung und
möglicher Verletzung (Muskeleinriss) der Muskeln vorbeugen soll.
Abbildung) ist die Kontrolle der
Muskelstärke, Optimierung der Gelenksbelastung und allenfalls ein Überlastungsschutz. Die Ib-Afferenzen von Sehnenspindeln inhibieren über Interneurone zugehörige motorische Vorderhornzellen;
das ermöglicht einen Schutzmechanismus, der einer Überlastung und
möglicher Verletzung (Muskeleinriss) der Muskeln vorbeugen soll.
 zur reflektorischen Anspannung der
extrafusalen Fasern desselben Muskels (
zur reflektorischen Anspannung der
extrafusalen Fasern desselben Muskels ( Abbildung) und oft
Abbildung) und oft 
 zu weiteren Effekten an
anderen Muskeln.
zu weiteren Effekten an
anderen Muskeln. 

 Abbildung: Muskelspindelreflex
Abbildung: Muskelspindelreflex
 s. oben).
Durch deren Kontraktion wird der mittlere (äquatoriale) Anteil der
Spindel mit den darin enthaltenen Längenrezeptoren (Kernkettenfasern,
Kernsackfasern) gedehnt. Dehnung der anulospiraligen Mittelzonen durch γ-motorische Anteile könnte theoretisch einen Muskelspindelreflex aktivieren, ohne dass der Muskel als Ganzes gedehnt wurde. (Tatsächlich kommt es meist zu Koaktivierung der α- und γ-motorischen Vorderhornzellen).
s. oben).
Durch deren Kontraktion wird der mittlere (äquatoriale) Anteil der
Spindel mit den darin enthaltenen Längenrezeptoren (Kernkettenfasern,
Kernsackfasern) gedehnt. Dehnung der anulospiraligen Mittelzonen durch γ-motorische Anteile könnte theoretisch einen Muskelspindelreflex aktivieren, ohne dass der Muskel als Ganzes gedehnt wurde. (Tatsächlich kommt es meist zu Koaktivierung der α- und γ-motorischen Vorderhornzellen).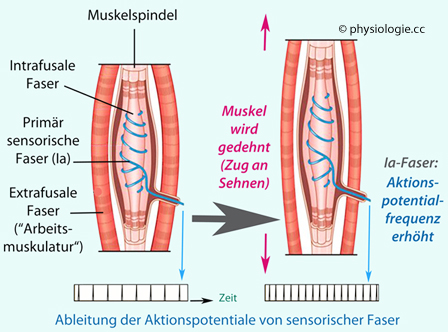
 Abbildung: Muskelspindelfunktion bei einfacher Dehnung
Abbildung: Muskelspindelfunktion bei einfacher Dehnung
 Abbildung) zum Rückenmark (in diesem Fall in die Lumbalsegmente
2-4). Das löst entsprechende Maßnahmen aus, hier das Triggern eines in
der Klinik als "Patellarsehnenreflex" (
Abbildung) zum Rückenmark (in diesem Fall in die Lumbalsegmente
2-4). Das löst entsprechende Maßnahmen aus, hier das Triggern eines in
der Klinik als "Patellarsehnenreflex" ( Abbildung oben) bezeichneten "monosynaptischen"
Musters.
Abbildung oben) bezeichneten "monosynaptischen"
Musters.  Dynamische γ-Motoneurone (γd-Motoneurone) verkürzen Kernsackfasern (nuclear bag fibers - die Kerne liegen gruppiert in der Mitte der Kapsel) und steigern deren dynamische
Empfindlichkeit, was zu besserer Messung von
Längenänderungen führt - sie sind PD- (proportional- differential-empfindliche) Rezeptoren.
Diese "dynamischen" Motoneurone steigern die Sensitivität von
Ia-Afferenzen, haben aber keine Wirkung auf II-Afferenzen zum ZNS.
Dynamische γ-Motoneurone (γd-Motoneurone) verkürzen Kernsackfasern (nuclear bag fibers - die Kerne liegen gruppiert in der Mitte der Kapsel) und steigern deren dynamische
Empfindlichkeit, was zu besserer Messung von
Längenänderungen führt - sie sind PD- (proportional- differential-empfindliche) Rezeptoren.
Diese "dynamischen" Motoneurone steigern die Sensitivität von
Ia-Afferenzen, haben aber keine Wirkung auf II-Afferenzen zum ZNS. Statische
γ-Motoneurone (γs-Motoneurone) erhöhen hingegen die statische Empfindlichkeit von Kernkettenfasern (nuclear chain fibers - ihre Kerne sind in der Kapsel linear aufgereiht wie Erbsen in einer
Schote). Diese registrieren primär die Länge des Organs an sich, sind
also eher P-Rezeptoren. γs-Motoneurone erhöhen sie Sensitivität beider Typen von Afferenzen (nicht nur II, sondern auch Ia).
Statische
γ-Motoneurone (γs-Motoneurone) erhöhen hingegen die statische Empfindlichkeit von Kernkettenfasern (nuclear chain fibers - ihre Kerne sind in der Kapsel linear aufgereiht wie Erbsen in einer
Schote). Diese registrieren primär die Länge des Organs an sich, sind
also eher P-Rezeptoren. γs-Motoneurone erhöhen sie Sensitivität beider Typen von Afferenzen (nicht nur II, sondern auch Ia).
 Abbildung: Muskelspindelfunktion bei Kontraktion der extrafusalen Fasern
Abbildung: Muskelspindelfunktion bei Kontraktion der extrafusalen Fasern
 Abbildung). So wird der für die Längenmessung ungünstige
Effekt der Verkürzung des Muskels kompensiert. Das Gehirn programmiert
sozusagen diese Korrekturen in die Berechnung der Motorik mit ein.
Abbildung). So wird der für die Längenmessung ungünstige
Effekt der Verkürzung des Muskels kompensiert. Das Gehirn programmiert
sozusagen diese Korrekturen in die Berechnung der Motorik mit ein. Abbildung): Primäre vom Typ Ia versorgen den zentralen Abschnitt beider Fasertypen mit anulospiraligen Endigungen, und sekundäre vom Typ II peripherere Anteile der Muskelspindel, vor allem Kernkettenfasern (vgl. Abbildung oben).
Abbildung): Primäre vom Typ Ia versorgen den zentralen Abschnitt beider Fasertypen mit anulospiraligen Endigungen, und sekundäre vom Typ II peripherere Anteile der Muskelspindel, vor allem Kernkettenfasern (vgl. Abbildung oben).
 Abbildung: Antwortverhalten von Ia- und II-Fasern
Abbildung: Antwortverhalten von Ia- und II-Fasern
 Ia- ("primäre") Afferenzen von den mittleren (äquatorialen) Teilen des Längensensors (
Ia- ("primäre") Afferenzen von den mittleren (äquatorialen) Teilen des Längensensors ( s. oben). Sie verfügen über eine hohe differentielle Empfindlichkeit (D-Rezeptoren), d.h. sie reagieren auf Änderungen
ihrer Länge besonders stark und beeinflussen im Rahmen des
Spindelreflexes sowohl Synergisten als auch Antagonisten des
betreffenden Muskels.
s. oben). Sie verfügen über eine hohe differentielle Empfindlichkeit (D-Rezeptoren), d.h. sie reagieren auf Änderungen
ihrer Länge besonders stark und beeinflussen im Rahmen des
Spindelreflexes sowohl Synergisten als auch Antagonisten des
betreffenden Muskels. II-
("sekundäre") Afferenzen - fast alle Muskelspindeln verfügen über diese
weniger stark differentiell empfindlichen Sensoren, ihr Ansprechverhalten ist eher proportional (P-Rezeptoren). Sie haben eine geringere Leitungsgeschwindigkeit (geringerer Faserdurchmesser) als Ia-Fasern. Die zentrale Verschaltung ist wesentlich breiter in die Motorik integriert, z.B. im Rahmen der Steuerung ganzer Extremitäten.
II-
("sekundäre") Afferenzen - fast alle Muskelspindeln verfügen über diese
weniger stark differentiell empfindlichen Sensoren, ihr Ansprechverhalten ist eher proportional (P-Rezeptoren). Sie haben eine geringere Leitungsgeschwindigkeit (geringerer Faserdurchmesser) als Ia-Fasern. Die zentrale Verschaltung ist wesentlich breiter in die Motorik integriert, z.B. im Rahmen der Steuerung ganzer Extremitäten. Positive Nachpotentiale an den motorischen Vorderhornzellen erschweren die Auslösung von Aktionspotentialen
Positive Nachpotentiale an den motorischen Vorderhornzellen erschweren die Auslösung von Aktionspotentialen
 Anregung der zugeordneten Renshaw-Zellen (glyzinerge Selbsthemmung) verringert die Wahrscheinlichkeit der Bildung von Aktionspotentialen
Anregung der zugeordneten Renshaw-Zellen (glyzinerge Selbsthemmung) verringert die Wahrscheinlichkeit der Bildung von Aktionspotentialen
 Die im Rahmen der Kontraktion erfolgende Entdehnung der Spindeln homonymer Muskeln reduziert die afferente Impulswahrscheinlichkeit an Ia-Fasern
Die im Rahmen der Kontraktion erfolgende Entdehnung der Spindeln homonymer Muskeln reduziert die afferente Impulswahrscheinlichkeit an Ia-Fasern
 Dehnung der Sehnenrezeptoren hemmt die Aktionspotentialbildung (Ib-Afferenzen)
Dehnung der Sehnenrezeptoren hemmt die Aktionspotentialbildung (Ib-Afferenzen)
 Abbildung: Schmerzgetriggerter gekreuzter Reflex
Abbildung: Schmerzgetriggerter gekreuzter Reflex
 Verschaltungen im ZNS:
Verschaltungen im ZNS: Gekreuzte Reflexe:
Schmerzreize von der Haut oder bindegewebigen Strukturen können
intensive Reflexbewegungen auslösen. Ein Beispiel zeigt die
Gekreuzte Reflexe:
Schmerzreize von der Haut oder bindegewebigen Strukturen können
intensive Reflexbewegungen auslösen. Ein Beispiel zeigt die  Abbildung: Der Tritt auf einen spitzen Gegenstand regt über
Aktivierung "rascher" Schmerzfasern
(vor allem Aδ) ein Reflexmuster an, das auf die Retraktion
(Beugeraktivierung) der betroffenen und gleichzeitig Stützfunktion
(Streckeraktivierung) der kontralateralen Extremität abzielt. Das
Reflexmuster kreuzt also teilweise die Seite, es sind Interneurone auf
beiden Seiten involviert.
Abbildung: Der Tritt auf einen spitzen Gegenstand regt über
Aktivierung "rascher" Schmerzfasern
(vor allem Aδ) ein Reflexmuster an, das auf die Retraktion
(Beugeraktivierung) der betroffenen und gleichzeitig Stützfunktion
(Streckeraktivierung) der kontralateralen Extremität abzielt. Das
Reflexmuster kreuzt also teilweise die Seite, es sind Interneurone auf
beiden Seiten involviert. Sensitivierung:
Wirken über längere Zeit Schmerzreize im Reflexmuster, sinkt die
Reizschwelle und die Reflexzeit, das rezeptive Feld wird vergrößert -
die Empfindlichkeit nimmt zu.
Sensitivierung:
Wirken über längere Zeit Schmerzreize im Reflexmuster, sinkt die
Reizschwelle und die Reflexzeit, das rezeptive Feld wird vergrößert -
die Empfindlichkeit nimmt zu. Habituation:
Andererseits führt die Wiederholung nicht-schmerzhafter Reize durch
zentrale Einflüsse zu abnehmendem Reflexeffekt (bei gleichbleibender
Empfindlichkeit der Elemente, die den Reflexbogen aufbauen -
Rezeptoren, Neuronen, Muskeln).
Habituation:
Andererseits führt die Wiederholung nicht-schmerzhafter Reize durch
zentrale Einflüsse zu abnehmendem Reflexeffekt (bei gleichbleibender
Empfindlichkeit der Elemente, die den Reflexbogen aufbauen -
Rezeptoren, Neuronen, Muskeln). Konditionierung: Längerfristige assoziative Lernprozesse wirken sich auf das reflektorische Ansprechverhalten aus.
Konditionierung: Längerfristige assoziative Lernprozesse wirken sich auf das reflektorische Ansprechverhalten aus. Wer steuert die motorische Einheit? Auf jede motorische
Vorderhornzelle wirken hunderte, sogar tausende anderer Nervenzellen
ein - sie stammen aus allen Teilen des ZNS. Das Rückenmark (wie das
Gehirn) ist aber auch alleine - ohne externe Anregung, ohne sensorisches Feedback - zur Bildung von Entladungsmustern fähig. Man nennt solche Neuronengruppen, die spontane Aktivität generieren können, zentrale Mustergeneratoren (central pattern generators, CPGs). Solche komplexen Schrittmacher finden sich auch in zerebralen motorischen Neuronengruppen, wie im Hirnstamm (Mittelhirn: mesencephalic locomotor region MLR).
Wer steuert die motorische Einheit? Auf jede motorische
Vorderhornzelle wirken hunderte, sogar tausende anderer Nervenzellen
ein - sie stammen aus allen Teilen des ZNS. Das Rückenmark (wie das
Gehirn) ist aber auch alleine - ohne externe Anregung, ohne sensorisches Feedback - zur Bildung von Entladungsmustern fähig. Man nennt solche Neuronengruppen, die spontane Aktivität generieren können, zentrale Mustergeneratoren (central pattern generators, CPGs). Solche komplexen Schrittmacher finden sich auch in zerebralen motorischen Neuronengruppen, wie im Hirnstamm (Mittelhirn: mesencephalic locomotor region MLR). Spinaler Lokomotionsgenerator: Das Rückenmark ist prinzipiell zur Generierung einfacher, rhythmisch
wiederkehrender Bewegungsmuster (Gehbewegungen) fähig (<Animation). Eine Triggerrolle spielt dabei
wahrscheinlich die Aktivierung eines gekreuzten Streckreflexes.
Spinaler Lokomotionsgenerator: Das Rückenmark ist prinzipiell zur Generierung einfacher, rhythmisch
wiederkehrender Bewegungsmuster (Gehbewegungen) fähig (<Animation). Eine Triggerrolle spielt dabei
wahrscheinlich die Aktivierung eines gekreuzten Streckreflexes. 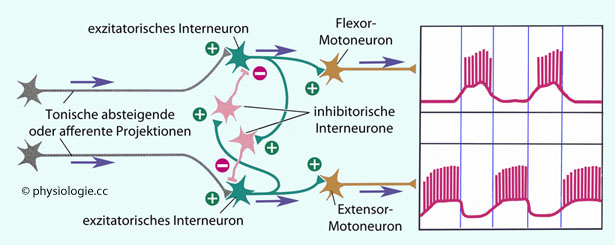
 Abbildung: Modell alternierender Rhythmusbildung für Motoneuronen in Beugern und Streckern
Abbildung: Modell alternierender Rhythmusbildung für Motoneuronen in Beugern und Streckern

 Abbildung: Rhythmische Entladung in einem spinalen Interneuron
Abbildung: Rhythmische Entladung in einem spinalen Interneuron
 Abbildung).
Abbildung).  Sowohl die Acetylcholin-Rezeptoren als auch die Rezeptoren der
Cholinesterase können durch Muskelrelaxantien blockiert werden; dadurch
wird der Muskel gelähmt. Eine Anwendung erfolgt in der Anästhesiologie, um Muskeln
während eines operativen Eingriffs zu entspannen (relaxieren).
Sowohl die Acetylcholin-Rezeptoren als auch die Rezeptoren der
Cholinesterase können durch Muskelrelaxantien blockiert werden; dadurch
wird der Muskel gelähmt. Eine Anwendung erfolgt in der Anästhesiologie, um Muskeln
während eines operativen Eingriffs zu entspannen (relaxieren).  Kurare-ähnliche
Stoffe wie das Alkaloid d-Tubocurarin (
Kurare-ähnliche
Stoffe wie das Alkaloid d-Tubocurarin ( Abbildung) verbinden sich mit Acetylcholin-Rezeptoren, ohne
die Natriumkanäle zu öffnen.
Abbildung) verbinden sich mit Acetylcholin-Rezeptoren, ohne
die Natriumkanäle zu öffnen.  Abbildung) öffnet die Natriumkanäle
nachhaltig und bleibt länger am Rezeptor haften, wodurch es zu einer
Dauerdepolarisierung und Inaktivierung benachbarter Na-Kanäle kommt.
Abbildung) öffnet die Natriumkanäle
nachhaltig und bleibt länger am Rezeptor haften, wodurch es zu einer
Dauerdepolarisierung und Inaktivierung benachbarter Na-Kanäle kommt.  ist eine Autoimmunerkrankung, bei der Antikörper
gegen Acetylcholin-Rezeptoren an den Muskelfasern auftreten. Es kommt
zur Abnahme der Acetylcholinbedingten Depolarisation und rascher
Ermüdbarkeit, die sich zu schließlich tödlicher Paralyse der Muskeln (Atemmuskulatur) steigert.
ist eine Autoimmunerkrankung, bei der Antikörper
gegen Acetylcholin-Rezeptoren an den Muskelfasern auftreten. Es kommt
zur Abnahme der Acetylcholinbedingten Depolarisation und rascher
Ermüdbarkeit, die sich zu schließlich tödlicher Paralyse der Muskeln (Atemmuskulatur) steigert. Als Therapie werden Cholinesteraseblocker eingesetzt, deren
Wirkung nicht dauerhaft, sondern reversibel ist. Solche Substanzen
verzögern den Abbau von Acetylcholin (z.B. Neostigmin)
und können z.B. zur Beendigung der iatrogenen Lähmung nach einer
Narkose oder zur Behandlung einer Myasthenie verwendet werden. Weiters werden auch Immunsuppressiva eingesetzt.
Als Therapie werden Cholinesteraseblocker eingesetzt, deren
Wirkung nicht dauerhaft, sondern reversibel ist. Solche Substanzen
verzögern den Abbau von Acetylcholin (z.B. Neostigmin)
und können z.B. zur Beendigung der iatrogenen Lähmung nach einer
Narkose oder zur Behandlung einer Myasthenie verwendet werden. Weiters werden auch Immunsuppressiva eingesetzt.  , Lou-Gehrig-Syndrom) geht mit einer
Degeneration spinaler und supraspinaler Motoneurone einher. Oxidativer
Stress durch Veränderung der Superoxid-Dismutase scheint in manchen
Fällen eine Rolle zu spielen, doch ist die Ursache meist unklar. Die
Behandlung zielt einerseits auf eine Verzögerung der
Neuronendegeneration ab, andererseits erfolgt sie
interdisziplinär-symptomatisch.
, Lou-Gehrig-Syndrom) geht mit einer
Degeneration spinaler und supraspinaler Motoneurone einher. Oxidativer
Stress durch Veränderung der Superoxid-Dismutase scheint in manchen
Fällen eine Rolle zu spielen, doch ist die Ursache meist unklar. Die
Behandlung zielt einerseits auf eine Verzögerung der
Neuronendegeneration ab, andererseits erfolgt sie
interdisziplinär-symptomatisch. Läsionen
auf der Ebene des Motoneurons (motorische Vorderhornzelle) äußern sich
in einer schlaffen Lähmung der betroffenen Muskeln. Höher gelegene
Läsionen, insbesondere im Bereich der supraspinalen motorischen
Gebiete, manifestieren sich hingegen als spastische Lähmung. Diese ist durch erhöhten muskulären Grundtonus und Hyperreflexie gekennzeichnet.
Läsionen
auf der Ebene des Motoneurons (motorische Vorderhornzelle) äußern sich
in einer schlaffen Lähmung der betroffenen Muskeln. Höher gelegene
Läsionen, insbesondere im Bereich der supraspinalen motorischen
Gebiete, manifestieren sich hingegen als spastische Lähmung. Diese ist durch erhöhten muskulären Grundtonus und Hyperreflexie gekennzeichnet.
 Das Rückenmark steuert zwei Arten der Motorik: Körperhaltung und
Fortbewegung. Die Abläufe sind weitgehend automatisiert und von Bahnen
aus dem Hirnstamm (ventromediales System: tractus tecto-, reticulo-,
vestibulospinalis) kontrolliert. Der tractus vestibulospinalis steigert
die Aktivität von Extensoren und hemmt Flexoren. Der tractus
corticospinalis (Pyramidenbahn) steigert die Aktivität von Flexoren
zusammen mit dem tractus rubrospinalis
Das Rückenmark steuert zwei Arten der Motorik: Körperhaltung und
Fortbewegung. Die Abläufe sind weitgehend automatisiert und von Bahnen
aus dem Hirnstamm (ventromediales System: tractus tecto-, reticulo-,
vestibulospinalis) kontrolliert. Der tractus vestibulospinalis steigert
die Aktivität von Extensoren und hemmt Flexoren. Der tractus
corticospinalis (Pyramidenbahn) steigert die Aktivität von Flexoren
zusammen mit dem tractus rubrospinalis Propriozeption meldet Körperlage, Stellung von Körperteilen zueinander,
Körperbewegung. Dazu gehört Tiefensensibilität und Gleichgewichtssinn
Propriozeption meldet Körperlage, Stellung von Körperteilen zueinander,
Körperbewegung. Dazu gehört Tiefensensibilität und Gleichgewichtssinn Die Tiefensensibilität umfasst Kraftsinn (Golgi-Sehnenorgane:
Ib-Fasern), Lagesinn (Muskelspindeln: Ia- und II-Fasern, γ-Motorik) und
Bewegungssinn (Ruffini-Körperchen, freie Nervenendigungen in Gelenken)
Die Tiefensensibilität umfasst Kraftsinn (Golgi-Sehnenorgane:
Ib-Fasern), Lagesinn (Muskelspindeln: Ia- und II-Fasern, γ-Motorik) und
Bewegungssinn (Ruffini-Körperchen, freie Nervenendigungen in Gelenken) Längenzuwachs der Muskelspindeln erhöht die Impulsrate ihrer Ia-Fasern
und verhindert automatisch das "Einknicken" von Extensoren.
Ib-Afferenzen aus Sehnenspindeln vermitteln nicht nur Kraftsinn,
sondern hemmen auch zugehörige α-Motoneurone (Schutzwirkung)
Längenzuwachs der Muskelspindeln erhöht die Impulsrate ihrer Ia-Fasern
und verhindert automatisch das "Einknicken" von Extensoren.
Ib-Afferenzen aus Sehnenspindeln vermitteln nicht nur Kraftsinn,
sondern hemmen auch zugehörige α-Motoneurone (Schutzwirkung) Die Empfindlichkeit des Muskelspindelsystems wird durch γ-Motoneurone
beeinflusst, die bei Muskelkontraktion seine kontraktilen
Enden aktivieren (α-γ-Koaktivierung). Die
Messempfindlichkeit der Spindel bleibt einerseits im optimalen Bereich,
andererseits kann durch diese Anordnung die Stärke des
Muskelspindelreflexes reguliert werden
Die Empfindlichkeit des Muskelspindelsystems wird durch γ-Motoneurone
beeinflusst, die bei Muskelkontraktion seine kontraktilen
Enden aktivieren (α-γ-Koaktivierung). Die
Messempfindlichkeit der Spindel bleibt einerseits im optimalen Bereich,
andererseits kann durch diese Anordnung die Stärke des
Muskelspindelreflexes reguliert werden α-motorische Vorderhornzellen haben cholinerge Kollateralen zu
glyzinergen Renshaw-Zellen. Glyzinrezeptoren öffnen Chloridkanäle an
motorischen Vorderhornzellen und inhibieren sie dadurch (Selbsthemmung)
α-motorische Vorderhornzellen haben cholinerge Kollateralen zu
glyzinergen Renshaw-Zellen. Glyzinrezeptoren öffnen Chloridkanäle an
motorischen Vorderhornzellen und inhibieren sie dadurch (Selbsthemmung) Eine motorische Einheit ist eine motorische Vorderhornzelle mit den von
ihr versorgten Muskelfasern; sie ist die kleinste vom ZNS
beeinflussbare Einheit. Drei Arten von Nervenfasern versorgen
α-motorische Vorderhornzellen: Axone von absteigenden Motoneuronen aus
Motorcortex und Hirnstamm, sensorische Eingänge von Muskelspindeln,
sowie Interneurone. Sie berücksichtigen die aktuelle Länge des Muskels,
motorische Steuerprogramme aus dem Gehirn und führen Bewegungsprogramme
aus
Eine motorische Einheit ist eine motorische Vorderhornzelle mit den von
ihr versorgten Muskelfasern; sie ist die kleinste vom ZNS
beeinflussbare Einheit. Drei Arten von Nervenfasern versorgen
α-motorische Vorderhornzellen: Axone von absteigenden Motoneuronen aus
Motorcortex und Hirnstamm, sensorische Eingänge von Muskelspindeln,
sowie Interneurone. Sie berücksichtigen die aktuelle Länge des Muskels,
motorische Steuerprogramme aus dem Gehirn und führen Bewegungsprogramme
aus Eigenreflexe wirken sich (monosynaptisch) auf den Muskel aus, der sie
auslöst (Rückprojektion: Spindelreflex), Fremdreflexe (polysynaptisch)
auf benachbarte Organe. Eigenreflexe werden pyramidalmotorisch
inhibiert; bei Ausfall der Pyramidenbahn sind sie gesteigert
Eigenreflexe wirken sich (monosynaptisch) auf den Muskel aus, der sie
auslöst (Rückprojektion: Spindelreflex), Fremdreflexe (polysynaptisch)
auf benachbarte Organe. Eigenreflexe werden pyramidalmotorisch
inhibiert; bei Ausfall der Pyramidenbahn sind sie gesteigert  Das Rückenmark kann repetitive Muster (wie für Gehbewegungen)
generieren (spinaler Lokomotionsgenerator), vermutlich ausgelöst durch
gekreuzte Streckreflexe, wie sie durch Berührungsreize ausgelöst
werden. Die Aktivierung von Muskelgruppen erfolgt je nach Ort des
auslösenden Reizes und durch gegenseitige Hemmung der Neurone für
Muskelgruppen, die an Gelenken antagonistisch wirken
Das Rückenmark kann repetitive Muster (wie für Gehbewegungen)
generieren (spinaler Lokomotionsgenerator), vermutlich ausgelöst durch
gekreuzte Streckreflexe, wie sie durch Berührungsreize ausgelöst
werden. Die Aktivierung von Muskelgruppen erfolgt je nach Ort des
auslösenden Reizes und durch gegenseitige Hemmung der Neurone für
Muskelgruppen, die an Gelenken antagonistisch wirken

