



 Aktin: ακτίς = Strahl
Aktin: ακτίς = Strahl| Motorische Vorderhornzellen in Hirnstamm und Rückenmark steuern jeweils eine definierte Gruppe von Muskelfasern, eine motorische Einheit. Elektrische Aktivität der Vorderhornzelle setzt am Ende ihres Axons Acetylcholin frei. Das erregt alle zugeordneten Muskelfasern, führt zum Einstrom von Ca++-Ionen
in ihr Zytoplasma, zu elektro-mechanischer Kopplung und schließlich zur Kontraktion der motorischen Einheit. Einzelne Aktionspotentiale führen zu Einzelzuckungen (z.B. im Rahmen eines Sehnenreflexes), mehrere in knapper Folge zu tetanischer Kontraktion (der physiologischen Form von Kraftentfaltung und Bewegung). Tetanische Kontraktionen entfalten mehr Kraft als Einzelzuckungen (längere Dauer, effizientere elektromechanische Kopplung). Die Muskelkraft hängt vom Überlappungsgrad von Aktin- und Myosinfilamenten in den Sarkomeren ab. Der normale Arbeitsbereich der Muskeln umspielt die Länge, die optimale Bedingungen für die Zahl aktiver Aktin-Myosin-Querbrücken ermöglicht (~2-3 µm Sarkomerlänge). Vordehnung, Durchblutung, Zustand des Energiestoffwechsels sind weitere Faktoren, welche die Muskelkraft bestimmen. Die Verkürzungsgeschwindigkeit nimmt mit zunehmender Belastung ab. Kann sich der Muskel gar nicht verkürzen, weil die Gegenkraft zu groß ist, führt er eine isometrische Kontraktion aus (bei noch stärkerer Belastung wird der Muskel während der Kontraktion in die Länge gedehnt). Hebt der Muskel ein konstantes Gewicht, kontrahiert er sich isotonisch. Ändern sich während der Aktivität sowohl Belastung als auch Länge (was meist der Fall ist), vollbringt der Muskel eine auxotonische Kontraktion. |
 Aufbau der Muskelfaser
Aufbau der Muskelfaser  Motorische Endplatte
Motorische Endplatte  Elektromechanische Kopplung
Elektromechanische Kopplung  Kontraktionsmechanismus
Kontraktionsmechanismus  Vordehnung und Kontraktionsformen
Vordehnung und Kontraktionsformen
 Tetanische Kontraktion
Tetanische Kontraktion  Verkürzungsgeschwindigkeit und Muskelleistung
Verkürzungsgeschwindigkeit und Muskelleistung  Beendigung der Kontraktion
Beendigung der Kontraktion
 Maligne Hyperthermie
Maligne Hyperthermie  Core messages
Core messages haben diese eine höhere Organisation: Sie formieren sich
zu Filamenten, die wiederum zu hintereinander placierten Sarkomeren
haben diese eine höhere Organisation: Sie formieren sich
zu Filamenten, die wiederum zu hintereinander placierten Sarkomeren
 angeordnet sind. Muskelzellen (Myozyten) werden auch als Muskelfasern oder Myofibrillen bezeichnet.
angeordnet sind. Muskelzellen (Myozyten) werden auch als Muskelfasern oder Myofibrillen bezeichnet.
 Abbildung: Aufbau eines Sarkomers
Abbildung: Aufbau eines Sarkomers
 Abbildung) mit einer Länge von jeweils einigen µm (meist 2-3, s. unten). Deren Kraft muss nach außen weitergeleitet werden.
Abbildung) mit einer Länge von jeweils einigen µm (meist 2-3, s. unten). Deren Kraft muss nach außen weitergeleitet werden.

 Abbildung: Sarkomer
Abbildung: Sarkomer
 Abbildung oben).
Abbildung oben).  Abbildung).
Abbildung).  Die Kraftübertragung nach außen erfolgt über Costamere
Die Kraftübertragung nach außen erfolgt über Costamere  , Proteinkomplexen in der Wand quergestreifter Muskelzellen, bestehend aus mehreren Komponenten wie Laminin,
Dystroglykanen, Dystrophin; Fibronektin, Integrinen, Talin und
Vinculin (
, Proteinkomplexen in der Wand quergestreifter Muskelzellen, bestehend aus mehreren Komponenten wie Laminin,
Dystroglykanen, Dystrophin; Fibronektin, Integrinen, Talin und
Vinculin ( s. dort). Diese verankern mittels intrazellulärer Verbindungsmoleküle
(Desmin, Aktin / Aktinin) das intrazelluläre Gerüstwerk mit
der extrazellulären Matrix wie auch der Basalmembran.
Die Aufgabe der Costameren ist die mechanische Verknüpfung von
Muskelfaser und extrazellulärer Matrix (der größere Teil dieser
Kraftübertragung erfolgt senkrecht zur Längsachse der Muskelfaser, nur
etwa ein Viertel in der Längsrichtung).
s. dort). Diese verankern mittels intrazellulärer Verbindungsmoleküle
(Desmin, Aktin / Aktinin) das intrazelluläre Gerüstwerk mit
der extrazellulären Matrix wie auch der Basalmembran.
Die Aufgabe der Costameren ist die mechanische Verknüpfung von
Muskelfaser und extrazellulärer Matrix (der größere Teil dieser
Kraftübertragung erfolgt senkrecht zur Längsachse der Muskelfaser, nur
etwa ein Viertel in der Längsrichtung).  Die Orientierung
der kontraktilen Filamente in den Sarkomeren wird durch Komponenten des
Zytoskeletts erhalten:
Die Orientierung
der kontraktilen Filamente in den Sarkomeren wird durch Komponenten des
Zytoskeletts erhalten: Titin ist
ein elastisches Verankerungsmolekül, das die
mechanische Spannung
bei Dehnung der Muskelfaser erhöht und - ohne aktive Kontraktion - eine
Rückstellkraft in Richtung Verkürzung bewirkt. Im Bereich des
I-Streifens wechseln sich hier immunglobulinähnliche Domänen und
besonders elastische sogenannte PEVK-Regionen - die zum Großteil aus 4
Aminosäuren bestehen, nämlich Prolin (P), Glutamat (E),
Titin ist
ein elastisches Verankerungsmolekül, das die
mechanische Spannung
bei Dehnung der Muskelfaser erhöht und - ohne aktive Kontraktion - eine
Rückstellkraft in Richtung Verkürzung bewirkt. Im Bereich des
I-Streifens wechseln sich hier immunglobulinähnliche Domänen und
besonders elastische sogenannte PEVK-Regionen - die zum Großteil aus 4
Aminosäuren bestehen, nämlich Prolin (P), Glutamat (E), | Titin ist an Z- und M-Streifen verankert und dehnungselastisch |
 Nebulin ist ebenfalls ein langes Molekül, das bis zu 200 Aktinmoleküle bindet und stützt. Seine Länge korreliert mit der Länge der Aktinfilamente im Sarkomer.
Nebulin ist ebenfalls ein langes Molekül, das bis zu 200 Aktinmoleküle bindet und stützt. Seine Länge korreliert mit der Länge der Aktinfilamente im Sarkomer. Obscurin
gehört wie Titin und Nebulin zu Riesen-Signalproteinen des Sarkomers,
es beteiligt sich an der intrazellulären Strukturierung bei
myofibrillären Wachstumsprozessen.
Obscurin
gehört wie Titin und Nebulin zu Riesen-Signalproteinen des Sarkomers,
es beteiligt sich an der intrazellulären Strukturierung bei
myofibrillären Wachstumsprozessen. Myomesine helfen bei der Fixierung des Titinfilaments. M-Protein (Myomesin II) findet sich in schnellen (fast twitch-) Muskelfasern und im Herzmuskel (nicht in langsamen 'slow twitch'-Skelettmuskelfasern). Es stabilisiert den M-Streifen, indem es Titin und Myosin an diesen befestigt.
Myomesine helfen bei der Fixierung des Titinfilaments. M-Protein (Myomesin II) findet sich in schnellen (fast twitch-) Muskelfasern und im Herzmuskel (nicht in langsamen 'slow twitch'-Skelettmuskelfasern). Es stabilisiert den M-Streifen, indem es Titin und Myosin an diesen befestigt. Ein System verschiedener Verankerungsproteine fixiert die Sarkomere über Z-Streifen bzw. Aktinfilamente mit der Membran der Muskelzellen (
Ein System verschiedener Verankerungsproteine fixiert die Sarkomere über Z-Streifen bzw. Aktinfilamente mit der Membran der Muskelzellen ( Abbildung oben):
Abbildung oben):  Zwischen Z-Streifen und Ankyrin im Sarkolemm ziehen Desminfilamente (Durchmesser ca. 10 nm),
Zwischen Z-Streifen und Ankyrin im Sarkolemm ziehen Desminfilamente (Durchmesser ca. 10 nm),  zwischen dem Ansatz von Aktinfilamenten und Dystroglykan-Sarcoglykan-Komplexen Dystrophin
(sein Gen ist auf X-Chromosomen lokalisiert und mit 2,4 Millionen
Basenpaaren das größte, das man beim Menschen bislang gefunden hat).
zwischen dem Ansatz von Aktinfilamenten und Dystroglykan-Sarcoglykan-Komplexen Dystrophin
(sein Gen ist auf X-Chromosomen lokalisiert und mit 2,4 Millionen
Basenpaaren das größte, das man beim Menschen bislang gefunden hat).  Abbildung) bilden Acetylcholin,
speichern es in Vesikeln und setzen bei Erregung des Motoneurons
einen Teil davon frei. Etwa 1% der Vesikel befinden sich in der aktiven Zone
- einem Streifen unmittelbar an der präsynaptischen Membran -, diese
Vesikel können bei Erregung unmittelbar Acetylcholin in den
synaptischen Spaltraum exozytieren.
Abbildung) bilden Acetylcholin,
speichern es in Vesikeln und setzen bei Erregung des Motoneurons
einen Teil davon frei. Etwa 1% der Vesikel befinden sich in der aktiven Zone
- einem Streifen unmittelbar an der präsynaptischen Membran -, diese
Vesikel können bei Erregung unmittelbar Acetylcholin in den
synaptischen Spaltraum exozytieren. Das chemische Signal an der motorischen Endplatte (der Transmitter) ist Acetylcholin.
Das chemische Signal an der motorischen Endplatte (der Transmitter) ist Acetylcholin.
 Abbildung: Motorische Endplatte
Abbildung: Motorische Endplatte
| Spaltung von Komponenten des SNARE-Komplexes verhindert die Freisetzung von Acetylcholin an der motorischen Endplatte |
 Abbildung). Unmittelbar
unter der präsynaptischen Membran (am Rande der junktionalen
Einfaltungen der Muskelfaser) befinden sich empfindlich eingestellte nikotinische Acetylcholinrezeptoren, die gleichzeitg Kationenkanäle sind (daher "ionotrop"); in der Tiefe der Einstülpungen sitzen spannungsgesteuerte Natriumkanäle,
welche die Depolarisierung verläßlich über die Reizschwelle bringen und
die Entstehung eines Aktionspotentials an der Muskelzelle garantieren.
Abbildung). Unmittelbar
unter der präsynaptischen Membran (am Rande der junktionalen
Einfaltungen der Muskelfaser) befinden sich empfindlich eingestellte nikotinische Acetylcholinrezeptoren, die gleichzeitg Kationenkanäle sind (daher "ionotrop"); in der Tiefe der Einstülpungen sitzen spannungsgesteuerte Natriumkanäle,
welche die Depolarisierung verläßlich über die Reizschwelle bringen und
die Entstehung eines Aktionspotentials an der Muskelzelle garantieren.
 Abbildung: Miniatur-Endplattenpotentiale (MEPP)
Abbildung: Miniatur-Endplattenpotentiale (MEPP)
 Abbildung).
Abbildung). 
 Abbildung: Ionenkanäle an der motorischen Endplatte
Abbildung: Ionenkanäle an der motorischen Endplatte
 Abbildung:
Abbildung: 

 Die Depolarisierung öffnet Ca++-Kanäle in der Membran der Axonverzweigung (präsynaptisch)
Die Depolarisierung öffnet Ca++-Kanäle in der Membran der Axonverzweigung (präsynaptisch)  Ca++-Ionen strömen in das Axon ein ([Ca++] extrazellulär um drei Zehnerpotenzen höher als intrazellulär)
Ca++-Ionen strömen in das Axon ein ([Ca++] extrazellulär um drei Zehnerpotenzen höher als intrazellulär)
 Ca++-Ionen initiieren Bewegung von synaptischen Vesikeln zur präsynaptischen Membran
Ca++-Ionen initiieren Bewegung von synaptischen Vesikeln zur präsynaptischen Membran Vesikel fusionieren mit der präsynaptischen Membran und entleeren Acetylcholin in den synaptischen
Spalt (Exozytose)
Vesikel fusionieren mit der präsynaptischen Membran und entleeren Acetylcholin in den synaptischen
Spalt (Exozytose) Acetylcholin diffundiert zur postsynaptischen Membran und bindet an nikotinische Rezeptoren (ROCs) - diese sind an Ionenkanäle
gekoppelt
Acetylcholin diffundiert zur postsynaptischen Membran und bindet an nikotinische Rezeptoren (ROCs) - diese sind an Ionenkanäle
gekoppelt ROCs öffnen, Natriumionen strömen ein, erzeugen ein EPSP (Endplattenpotential, ein Generatorpotential)
ROCs öffnen, Natriumionen strömen ein, erzeugen ein EPSP (Endplattenpotential, ein Generatorpotential) Das Endplattenpotential öffnet spannungsabhängige Na+-Kanäle (VOCs), diese verstärken die Depolarisierung über die Reizschwelle hinaus
Das Endplattenpotential öffnet spannungsabhängige Na+-Kanäle (VOCs), diese verstärken die Depolarisierung über die Reizschwelle hinaus Es entsteht ein Aktionspotential, dieses läuft die Muskelfaser entlang (VOCs) und in die transversalen Tubuli
Es entsteht ein Aktionspotential, dieses läuft die Muskelfaser entlang (VOCs) und in die transversalen Tubuli Die Depolarisation triggert die elektromechanische Kopplung
Die Depolarisation triggert die elektromechanische Kopplung Cholinesterasehemmer
(z.B. Physostigmin, Neostigmin) haben genau diesen Effekt, sowohl im zentralen wie im peripheren
Nervensystem. Sie spielen nicht nur als Muskelrelaxantien, sondern auch
als chemische Giftstoffe ("Nervengas") - inklusive Insektizide /
Pestizide - eine große Rolle.
Cholinesterasehemmer
(z.B. Physostigmin, Neostigmin) haben genau diesen Effekt, sowohl im zentralen wie im peripheren
Nervensystem. Sie spielen nicht nur als Muskelrelaxantien, sondern auch
als chemische Giftstoffe ("Nervengas") - inklusive Insektizide /
Pestizide - eine große Rolle. an der präsynaptischen Membran - Acetylcholin, das hier bindet, lässt Natriumionen einströmen, was Vesikel aus dem Reservepool zur aktiven Zone rücken lässt
an der präsynaptischen Membran - Acetylcholin, das hier bindet, lässt Natriumionen einströmen, was Vesikel aus dem Reservepool zur aktiven Zone rücken lässt an der extrajunktionalen Membran der Muskelzelle (außerhalb des Endplattenbereiches) - nach Denervierung proliferieren hier liegende Acetylcholinrezeptoren. Ihre Öffnungsdauer ist viel länger (bis 10 ms) als die postsynaptischer Rezeptoren.
an der extrajunktionalen Membran der Muskelzelle (außerhalb des Endplattenbereiches) - nach Denervierung proliferieren hier liegende Acetylcholinrezeptoren. Ihre Öffnungsdauer ist viel länger (bis 10 ms) als die postsynaptischer Rezeptoren. Über Blockade der motorischen Endplatte s. weiter unten
Über Blockade der motorischen Endplatte s. weiter unten Abbildung: Botulinumtoxin verhindert Acetylcholinfreisetzung
Abbildung: Botulinumtoxin verhindert Acetylcholinfreisetzung
 Die Freisetzung des Acetylcholins kann z.B. durch Botulinumtoxin
Die Freisetzung des Acetylcholins kann z.B. durch Botulinumtoxin  (Botulinustoxin; Botox: Handelsname für neurotoxische Proteine) und das Schlangengift ß-Bungarotoxin
(Botulinustoxin; Botox: Handelsname für neurotoxische Proteine) und das Schlangengift ß-Bungarotoxin  gehemmt werden (
gehemmt werden ( Abbildung). Botulinum - aus dem Bakterienstamm clostridium botulinum
- ist eines der stärksten bekannten Gifte, es hemmt die
Erregungsübertragung von Nervenzellen, führt zu Muskelschwäche (bis
Atemlähmung) und Störungen des autonomen Nervensystems.
Abbildung). Botulinum - aus dem Bakterienstamm clostridium botulinum
- ist eines der stärksten bekannten Gifte, es hemmt die
Erregungsübertragung von Nervenzellen, führt zu Muskelschwäche (bis
Atemlähmung) und Störungen des autonomen Nervensystems.| Die präsynaptische Freisetzung von Acetylcholin wird durch Botulinumtoxin spezifisch gehemmt |
 : die
Resorption ist wegen der hohen Basizität sehr gering. (Starke Säuren -
pK<3 - und starke Basen - pK>10 - werden im Darm so gut wie nicht
resorbiert.)
: die
Resorption ist wegen der hohen Basizität sehr gering. (Starke Säuren -
pK<3 - und starke Basen - pK>10 - werden im Darm so gut wie nicht
resorbiert.)  Nicht-depolarisierende peripher wirkende Muskelrelaxantien blockieren ebenfalls die nikotinischen Acetylcholinrezeptoren
an der Endplatte: Sie verhindern den sonst bei Aktivierung motorischer
Vorderhornzellen erfolgenden ROC-bedingten Natriumeinstrom (und
damit die Erregung der Muskelfaser). Sie werden in der Anästhesie verwendet, um im Rahmen
chirurgischer Eingriffe reflektorische Muskelverspannungen
auszuschalten. Da auch die Atemmuskulatur von der Muskelparalyse
betroffen ist, muss künstlich beatmet werden.
Nicht-depolarisierende peripher wirkende Muskelrelaxantien blockieren ebenfalls die nikotinischen Acetylcholinrezeptoren
an der Endplatte: Sie verhindern den sonst bei Aktivierung motorischer
Vorderhornzellen erfolgenden ROC-bedingten Natriumeinstrom (und
damit die Erregung der Muskelfaser). Sie werden in der Anästhesie verwendet, um im Rahmen
chirurgischer Eingriffe reflektorische Muskelverspannungen
auszuschalten. Da auch die Atemmuskulatur von der Muskelparalyse
betroffen ist, muss künstlich beatmet werden.  Abbildung) in die Tiefe der Muskelzelle geleitet
(vgl. Herzmuskelzelle).
Abbildung) in die Tiefe der Muskelzelle geleitet
(vgl. Herzmuskelzelle). 
 Abbildung: Feinstruktur einer Muskelfaser (=Muskelzelle)
Abbildung: Feinstruktur einer Muskelfaser (=Muskelzelle)

 Abbildung) erfolgt die Aktivierung des sarkoplasmatischen Retikulums:
Abbildung) erfolgt die Aktivierung des sarkoplasmatischen Retikulums: Spannungsgesteuerte Ca++-Kanäle (L-Typ) in der Membran des T-Tubulus werden als Dihydropyridinrezeptoren (DHPR) bezeichnet, die ihnen direkt gegenüber liegenden Ca++-Kanäle in der Membran des sarkoplasmatischen Retikulums als Ryanodinrezeptoren (RyR, Ca++ release channels - der RyR wurde nach dem pflanzlichen Alkaloid Ryanodin bezeichnet). Die Isoform RyR1 findet sich vor allem im Skelettmuskel, RyR2 im Herzmuskel, RyR3 in Neuronen des Gehirns.
Spannungsgesteuerte Ca++-Kanäle (L-Typ) in der Membran des T-Tubulus werden als Dihydropyridinrezeptoren (DHPR) bezeichnet, die ihnen direkt gegenüber liegenden Ca++-Kanäle in der Membran des sarkoplasmatischen Retikulums als Ryanodinrezeptoren (RyR, Ca++ release channels - der RyR wurde nach dem pflanzlichen Alkaloid Ryanodin bezeichnet). Die Isoform RyR1 findet sich vor allem im Skelettmuskel, RyR2 im Herzmuskel, RyR3 in Neuronen des Gehirns.| Ryanodinrezeptoren sind Ca++-Kanäle, die bei Erregung und Aktivierung durch DHPR Ca++-Ionen aus dem sarkoplasmatischen Retikulum in das Sarkoplasma lassen |
 [Ca++] steigt innerhalb von Millisekunden von ~10-7 auf 10-5 mM - etwa auf das Hundertfache - an. Calciumionen diffundieren zu den kontraktilen Filamenten, in denen Troponin als Ca++-Rezeptor
fungiert, und Troponin schaltet die
Wechselwirkung von Aktin- und Myosinfäden
ein - es kommt zur Kontraktion. Wegen der Diffusionswege erfolgt diese erst nach einer Latenzzeit von vielen Millisekunden nach Abklingen des Aktionspotentials, der Gipfel der Kontraktion tritt erst nach etwa einer Zehntelsekunde auf.
[Ca++] steigt innerhalb von Millisekunden von ~10-7 auf 10-5 mM - etwa auf das Hundertfache - an. Calciumionen diffundieren zu den kontraktilen Filamenten, in denen Troponin als Ca++-Rezeptor
fungiert, und Troponin schaltet die
Wechselwirkung von Aktin- und Myosinfäden
ein - es kommt zur Kontraktion. Wegen der Diffusionswege erfolgt diese erst nach einer Latenzzeit von vielen Millisekunden nach Abklingen des Aktionspotentials, der Gipfel der Kontraktion tritt erst nach etwa einer Zehntelsekunde auf. Relaxation: Anschließend wird Calcium unter Verbrauch von ATP wieder
ins sarkoplasmatische Retikulum zurückgepumpt (SERCA), bei Rückgang der [Ca++] auf ~10-7 mM lösen sich Aktin- und Myosinfäden voneinander, der Muskel erschlafft.
Relaxation: Anschließend wird Calcium unter Verbrauch von ATP wieder
ins sarkoplasmatische Retikulum zurückgepumpt (SERCA), bei Rückgang der [Ca++] auf ~10-7 mM lösen sich Aktin- und Myosinfäden voneinander, der Muskel erschlafft.
 Abbildung oben).
Abbildung oben). Myosin hat Bindungsstellen für Aktin und für ATP.
Myosin hat Bindungsstellen für Aktin und für ATP.
 Abbildung: Aktomyosinsystem
Abbildung: Aktomyosinsystem
 Einerseits verankert sich
das Troponin an einem Tropomyosinfaden, der sich um das Aktinfilament schlängelt
(mittels Troponin T),
Einerseits verankert sich
das Troponin an einem Tropomyosinfaden, der sich um das Aktinfilament schlängelt
(mittels Troponin T),  andererseits an das Aktinfilament (mittels
Troponin I);
andererseits an das Aktinfilament (mittels
Troponin I);  und Troponin kann Calciumionen binden, woraufhin der
Tropomyosinfaden von einer die Interaktion mit Myosin blockierenden in eine diese Reaktion ermöglichende
Position wechselt.
und Troponin kann Calciumionen binden, woraufhin der
Tropomyosinfaden von einer die Interaktion mit Myosin blockierenden in eine diese Reaktion ermöglichende
Position wechselt.  Abbildung unten) zulässt.
Abbildung unten) zulässt. Troponin ist dreiteilig: Troponin C bindet Ca++, Troponin I bindet an Aktin, Troponin T an Tropomyosin.
Troponin ist dreiteilig: Troponin C bindet Ca++, Troponin I bindet an Aktin, Troponin T an Tropomyosin.
 Abbildung: Querbrückenmechanismus
Abbildung: Querbrückenmechanismus

 Bindung von ATP
Bindung von ATP ATP-Hydrolyse
ATP-Hydrolyse schwache Querbrückenbildung
schwache Querbrückenbildung Freisetzung eines Phosphats vom Myosin
Freisetzung eines Phosphats vom Myosin Kraftschlag
Kraftschlag Freisetzung von ADP.
Freisetzung von ADP. In Ruhestellung hat der Myosinkopf ATP gebunden (dieses wird als Mg-ATP-Komplex angelagert), ist zu 45° gegen den Halsteil gewinkelt und frei beweglich ("Gleitfilament")
In Ruhestellung hat der Myosinkopf ATP gebunden (dieses wird als Mg-ATP-Komplex angelagert), ist zu 45° gegen den Halsteil gewinkelt und frei beweglich ("Gleitfilament") Steigt im Rahmen einer Erregung die sarkoplasmatische Konzentration an Ca++, bindet dieses an Troponin
Steigt im Rahmen einer Erregung die sarkoplasmatische Konzentration an Ca++, bindet dieses an Troponin der Myosinkopf wird aufgerichtet (45° zu 90°), Myosin bindet an Aktin
der Myosinkopf wird aufgerichtet (45° zu 90°), Myosin bindet an Aktin die ATPase-Aktivität des Myosinkopfs (diese entscheidet darüber, ob die Faser "rasch" oder "langsam" funktioniert) spaltet das angelagerte ATP (die ATP-ase benötigt Mg++ als Cofaktor), Pi und dann ADP wird freigesetzt
die ATPase-Aktivität des Myosinkopfs (diese entscheidet darüber, ob die Faser "rasch" oder "langsam" funktioniert) spaltet das angelagerte ATP (die ATP-ase benötigt Mg++ als Cofaktor), Pi und dann ADP wird freigesetzt der Myosinkopf kippt unter Kraftentwicklung von einer 90°- zu einer 45°-Position, "spannt" das Myosinmolekül an, und diese Energie wird auf das Aktinfilament übertragen ("Kraftschlag", power stroke). Dies führt zu einer Relativbewegung zwischen Aktin- und Myosinfilament um etwa 10 nm.
der Myosinkopf kippt unter Kraftentwicklung von einer 90°- zu einer 45°-Position, "spannt" das Myosinmolekül an, und diese Energie wird auf das Aktinfilament übertragen ("Kraftschlag", power stroke). Dies führt zu einer Relativbewegung zwischen Aktin- und Myosinfilament um etwa 10 nm.  Mit
etwa 400 Myosinköpfen "rudert sich" jedes Myosinfilament zwischen die
Reihen der umgebenden Aktinfilamente und zieht über diese die
Z-Streifen zur Sarkomermitte.
Mit
etwa 400 Myosinköpfen "rudert sich" jedes Myosinfilament zwischen die
Reihen der umgebenden Aktinfilamente und zieht über diese die
Z-Streifen zur Sarkomermitte. Der Myosinkopf bindet neues ATP - erst dann kann er sich von Aktin lösen.
Der Myosinkopf bindet neues ATP - erst dann kann er sich von Aktin lösen.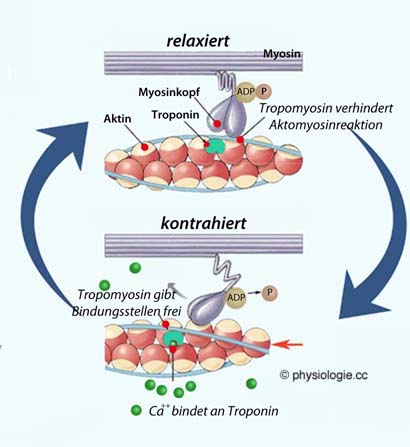
 Abbildung: Kontraktionszyklus
Abbildung: Kontraktionszyklus
 der Myosinkopf bindet an einer anderen Stelle erneut an das
Aktinfilament (vergleichbar dem "Nachgreifen" an einem Seil, das man zieht), und der Vorgang wiederholt sich.
der Myosinkopf bindet an einer anderen Stelle erneut an das
Aktinfilament (vergleichbar dem "Nachgreifen" an einem Seil, das man zieht), und der Vorgang wiederholt sich. Myosin-Aktin-Querbrücken
lösen sich nicht gleichzeitig, sondern in zufälliger Zeitfolge. Dadurch
gleiten die Filamente nicht in ihre ursprüngliche Position zurück, wenn
sich einige Querbrücken lösen; andere fixieren das Filament in der
kontrahierten Position.
Myosin-Aktin-Querbrücken
lösen sich nicht gleichzeitig, sondern in zufälliger Zeitfolge. Dadurch
gleiten die Filamente nicht in ihre ursprüngliche Position zurück, wenn
sich einige Querbrücken lösen; andere fixieren das Filament in der
kontrahierten Position.

 Animation des Kontraktionsmechanismus
Animation des Kontraktionsmechanismus Abbildung):
Abbildung): 
 Abbildung: Sarkomerlänge vs. Kraftausbeute
Abbildung: Sarkomerlänge vs. Kraftausbeute
 Bei einer Sarkomerlänge von etwas über 2 µm liegen
alle Myosinköpfe gegenüber den Aktin-Reaktionsstellen der
entsprechenden (gleichseitigen) Aktinfäden perfekt angeordnet, um mit
ihrem Kraftschlag zur Verkürzung des Sarkomers beizutragen. Das gilt
für einen Bereich, in dem die Myosinköpfchen das gegenseitige
Aktinfilament gerade noch nicht erreichen (mittlere strichlierte Linie)
bis zu dem Punkt, in dem jedes Myosinköpfchen gerade noch einen
Reaktionspartner findet (rechte strichlierte Linie).
Bei einer Sarkomerlänge von etwas über 2 µm liegen
alle Myosinköpfe gegenüber den Aktin-Reaktionsstellen der
entsprechenden (gleichseitigen) Aktinfäden perfekt angeordnet, um mit
ihrem Kraftschlag zur Verkürzung des Sarkomers beizutragen. Das gilt
für einen Bereich, in dem die Myosinköpfchen das gegenseitige
Aktinfilament gerade noch nicht erreichen (mittlere strichlierte Linie)
bis zu dem Punkt, in dem jedes Myosinköpfchen gerade noch einen
Reaktionspartner findet (rechte strichlierte Linie). Bei
geringerer Sarkomerlänge gelangt ein Teil der Aktinmoleküle in die
Reichweite von Myosinköpfen, die ihren Kraftschlag in die "falsche"
Richtung ausüben und damit der "richtigen" Zugrichtung verloren gehen
(linke strichlierte Linie);
stoßen die Myosinfilamente schließlich am Z-Streifen an, ist keine
weitere Verkürzung mehr möglich (die Kurve erreicht die Nulllinie).
Bei
geringerer Sarkomerlänge gelangt ein Teil der Aktinmoleküle in die
Reichweite von Myosinköpfen, die ihren Kraftschlag in die "falsche"
Richtung ausüben und damit der "richtigen" Zugrichtung verloren gehen
(linke strichlierte Linie);
stoßen die Myosinfilamente schließlich am Z-Streifen an, ist keine
weitere Verkürzung mehr möglich (die Kurve erreicht die Nulllinie).  Wird
das Sarkomer so stark gedehnt, dass ein Teil der Myosinköpfchen keinen
Reaktionspartner mehr findet, nimmt die Kontraktionskraft zunehmend ab
- bis zu dem Punkt, wo die Myosinfilamente aus der Reihe der
Aktinfilamente gänzlich herausgezogen ist und keine Querbrückenbildung
mehr stattfinden kann (die Kurve erreicht die Nulllinie).
Wird
das Sarkomer so stark gedehnt, dass ein Teil der Myosinköpfchen keinen
Reaktionspartner mehr findet, nimmt die Kontraktionskraft zunehmend ab
- bis zu dem Punkt, wo die Myosinfilamente aus der Reihe der
Aktinfilamente gänzlich herausgezogen ist und keine Querbrückenbildung
mehr stattfinden kann (die Kurve erreicht die Nulllinie).| Der Überlappungsgrad zwischen Aktin- und Myosinfäden bestimmt (unter anderem) die Stärke einer Kontraktion |
 Abbildung
oben) die mechanischen Eigenschaften der passiven Elemente des Muskels
- sowohl in den Sarkomeren (z.B. Titin) als auch
außerhalb (z.B. Kollagengerüst des Muskels). Dehnt man einen Muskel bis
zu etwa 70% seiner mittleren Ruhelänge, ergibt sich so gut wie kein
passiver Widerstand (Gegenkraft). Erst bei Überschreiten dieser Länge
nimmt die Gegenkraft zu (ein Teil dieser Kraft verschwindet mit der
Zeit wieder: "Plastizität"), es ergibt sich eine Ruhedehnungskurve (
Abbildung
oben) die mechanischen Eigenschaften der passiven Elemente des Muskels
- sowohl in den Sarkomeren (z.B. Titin) als auch
außerhalb (z.B. Kollagengerüst des Muskels). Dehnt man einen Muskel bis
zu etwa 70% seiner mittleren Ruhelänge, ergibt sich so gut wie kein
passiver Widerstand (Gegenkraft). Erst bei Überschreiten dieser Länge
nimmt die Gegenkraft zu (ein Teil dieser Kraft verschwindet mit der
Zeit wieder: "Plastizität"), es ergibt sich eine Ruhedehnungskurve ( Abbildung).
Abbildung).
 Abbildung: Isometrische vs. isotonische Kontraktion
Abbildung: Isometrische vs. isotonische Kontraktion
 Bleibt die Länge des Muskels während der Kontraktion
gleich, so spricht
man von isometrischer
Bleibt die Länge des Muskels während der Kontraktion
gleich, so spricht
man von isometrischer  Kontraktion
(z.B. isometrische Übungen). Eine isometrische Kontraktion leistet
keine physikalische Arbeit nach außen, da kein Weg zurückgelegt wird
(daher ist auch der Wirkungsgrad per definitionem Null)
Kontraktion
(z.B. isometrische Übungen). Eine isometrische Kontraktion leistet
keine physikalische Arbeit nach außen, da kein Weg zurückgelegt wird
(daher ist auch der Wirkungsgrad per definitionem Null) Bleibt die Belastung während seiner
Verkürzung gleich, so nennt man die Kontraktion isotonisch
Bleibt die Belastung während seiner
Verkürzung gleich, so nennt man die Kontraktion isotonisch  (z.B.
Heben eines Gewichts). Bei dieser Kontraktionsform nimmt die Länge des
Muskels ab, es wird also ein Weg zurückgelegt und Arbeit geleistet
(Wirkungsgrad bis ~25% möglich)
(z.B.
Heben eines Gewichts). Bei dieser Kontraktionsform nimmt die Länge des
Muskels ab, es wird also ein Weg zurückgelegt und Arbeit geleistet
(Wirkungsgrad bis ~25% möglich)
 Ändern sich
sowohl Länge als auch Spannung (was meist der Fall ist), heißt die
Kontraktion auxotonisch
Ändern sich
sowohl Länge als auch Spannung (was meist der Fall ist), heißt die
Kontraktion auxotonisch . Die meisten alltäglichen Muskelkontraktionen sind in diesem Sinne kombiniert.
. Die meisten alltäglichen Muskelkontraktionen sind in diesem Sinne kombiniert. Kontraktionen, die zunächst aus einer rein isometrischen und dann einer
rein isotonischen Phase bestehen, heißen Unterstützungszuckungen (wie beim Anheben eines schweren Gewichts)
Kontraktionen, die zunächst aus einer rein isometrischen und dann einer
rein isotonischen Phase bestehen, heißen Unterstützungszuckungen (wie beim Anheben eines schweren Gewichts) Kontraktionen, die zunächsat aus einer rein isotonischen und dann einer
rein isometrischen Phase bestehen, nennt man Anschlagszuckungen (wie beim Boxen gegen einen Sandsack)
Kontraktionen, die zunächsat aus einer rein isotonischen und dann einer
rein isometrischen Phase bestehen, nennt man Anschlagszuckungen (wie beim Boxen gegen einen Sandsack)
 Maxima (Kontraktionen, an denen alle
Muskelfasern teilnehmen) werden je nach ihrer Art als isometrische,
isotonische, Unterstützungs- (U-) maxima bezeichnet. Beim Skelettmuskel
sind Maxima durch gleichzeitige Aktivierung sämtlicher motorischen
Einheiten des Muskels (Rekrutierung sämtlicher zugeordneten
Motoneurone) zu erreichen; beim Herzmuskel ist jeder Herzschlag ein
Maximum, da hier alle Muskelfasern über gap junctions verbunden sich (funktionelles Synzytium)
Maxima (Kontraktionen, an denen alle
Muskelfasern teilnehmen) werden je nach ihrer Art als isometrische,
isotonische, Unterstützungs- (U-) maxima bezeichnet. Beim Skelettmuskel
sind Maxima durch gleichzeitige Aktivierung sämtlicher motorischen
Einheiten des Muskels (Rekrutierung sämtlicher zugeordneten
Motoneurone) zu erreichen; beim Herzmuskel ist jeder Herzschlag ein
Maximum, da hier alle Muskelfasern über gap junctions verbunden sich (funktionelles Synzytium)
 Abbildung: Kontraktionsformen in Abhängigkeit von der Reizfrequenz
Abbildung: Kontraktionsformen in Abhängigkeit von der Reizfrequenz
 Abbildung).
Abbildung). | Mit der Aktionspotentialfrequenz an Motoneuronen steigt die Kraftentwicklung der zugehörigen Skelettmuskelfasern |
 Abbildung oben). Die Kraftentwicklung (aktiv) kann bis zu 40 N/cm2 betragen (im glatten Muskel bis zu 60 N/cm2); passiv sind Muskelfasern bis zu einer Spannung von ~100 N/cm2 belastbar.
Abbildung oben). Die Kraftentwicklung (aktiv) kann bis zu 40 N/cm2 betragen (im glatten Muskel bis zu 60 N/cm2); passiv sind Muskelfasern bis zu einer Spannung von ~100 N/cm2 belastbar. Der Bizeps einer gut trainierten erwachsenen Person kann etwa 50 kg Gewicht heben (Querschnitt ~10 cm2).
Der Bizeps einer gut trainierten erwachsenen Person kann etwa 50 kg Gewicht heben (Querschnitt ~10 cm2). ). Bei einer bestimmten Belastung ist die Kontraktion gerade imstande,
eine Verlängerung des Muskels zu verhindern. Bei noch stärkerer
Belastung wird der Muskel trotz Kontraktion gedehnt (der Muskel wird länger statt kürzer).
). Bei einer bestimmten Belastung ist die Kontraktion gerade imstande,
eine Verlängerung des Muskels zu verhindern. Bei noch stärkerer
Belastung wird der Muskel trotz Kontraktion gedehnt (der Muskel wird länger statt kürzer). Die Fasern einer motorischen Einheit werden von “ihrer” Vorderhornzelle
jeweils synchron angeregt, und ihre gemeinsame Entladung führt zu
ein- bis dreiphasigen Summen-Aktionspotentialen, die zur Untersuchung
der Muskelfunktion mittels Oberflächenelektroden (von der Haut) oder
eingestochenen, isolierten Drähten (aus dem Muskel) abgeleitet werden
können; das Ergebnis nennt man Elektromyogramm (EMG).
Die Fasern einer motorischen Einheit werden von “ihrer” Vorderhornzelle
jeweils synchron angeregt, und ihre gemeinsame Entladung führt zu
ein- bis dreiphasigen Summen-Aktionspotentialen, die zur Untersuchung
der Muskelfunktion mittels Oberflächenelektroden (von der Haut) oder
eingestochenen, isolierten Drähten (aus dem Muskel) abgeleitet werden
können; das Ergebnis nennt man Elektromyogramm (EMG).  Mit zunehmender Kontraktionsstärke nimmt die Zahl der aktivierten
Vorderhornzellen und ihre Entladungsfrequenz zu; es werden immer mehr
motorische Einheiten rekrutiert. Bei intensiver Kontraktion lassen sich
im EMG die Potentiale der einzelnen Fasern nicht mehr differenzieren, sie überlagern sich
zu einem Interferenzmuster. Aus dem EMG kann man die
Aktivierung einzelner Muskeln bei Bewegungsabläufen ersehen und diagnostizieren, ob allenfalls eine
Myopathie (Schädigung von Muskelzellen) oder Neuropathie (Schädigung
von Nervenfasern) vorliegt.
Mit zunehmender Kontraktionsstärke nimmt die Zahl der aktivierten
Vorderhornzellen und ihre Entladungsfrequenz zu; es werden immer mehr
motorische Einheiten rekrutiert. Bei intensiver Kontraktion lassen sich
im EMG die Potentiale der einzelnen Fasern nicht mehr differenzieren, sie überlagern sich
zu einem Interferenzmuster. Aus dem EMG kann man die
Aktivierung einzelner Muskeln bei Bewegungsabläufen ersehen und diagnostizieren, ob allenfalls eine
Myopathie (Schädigung von Muskelzellen) oder Neuropathie (Schädigung
von Nervenfasern) vorliegt.
 Abbildung: Entfernung von Ca++ aus dem Sarkoplasma
Abbildung: Entfernung von Ca++ aus dem Sarkoplasma
 Abbildung):
Abbildung): Über die Zellmembran nach außen (Interstitium),
Über die Zellmembran nach außen (Interstitium), in intrazelluläre Speicher, insbesondere das sarkoplasmatische Retikulum.
in intrazelluläre Speicher, insbesondere das sarkoplasmatische Retikulum. Abbildung). Calsequestrin ist in terminalen Zisternen des endoplasmatischen Retikulums angereichert und bindet Ca++-Ionen
(bis zu 50 Calciumionen pro Molekül), was deren freie Konzentration im
Retikulum erniedrigt und die Calciumtransporter so entlastet. Das
ebenfalls lösliche Speicherprotein Calreticulin wirkt vor allem als Chaperon, es bindet nicht richtig gefaltete Glykoproteine.
Abbildung). Calsequestrin ist in terminalen Zisternen des endoplasmatischen Retikulums angereichert und bindet Ca++-Ionen
(bis zu 50 Calciumionen pro Molekül), was deren freie Konzentration im
Retikulum erniedrigt und die Calciumtransporter so entlastet. Das
ebenfalls lösliche Speicherprotein Calreticulin wirkt vor allem als Chaperon, es bindet nicht richtig gefaltete Glykoproteine.
 Blockade an der motorischen Endplatte:
Nikotinrezeptor-Liganden spielen in der Anästhesiologie eine wichtige
Rolle, da sie die Aktivierung von Muskelfasern blockieren und so
reflektorische Verspannungen der Muskulatur bei chirurgischen
Eingriffen verhindern können. Solche neuromuskulär blockierenden Stoffe lagern sich an den N-Rezeptor und konkurrieren mit Acetylcholin um die Bindung. Sie zählen zur Gruppe der peripheren Muskelrelaxantien (zu diesen gehören auch Stoffe, welche die elektromechanische Koppelung blockieren - sogenannte myotrope Muskelrelaxantien).
Blockade an der motorischen Endplatte:
Nikotinrezeptor-Liganden spielen in der Anästhesiologie eine wichtige
Rolle, da sie die Aktivierung von Muskelfasern blockieren und so
reflektorische Verspannungen der Muskulatur bei chirurgischen
Eingriffen verhindern können. Solche neuromuskulär blockierenden Stoffe lagern sich an den N-Rezeptor und konkurrieren mit Acetylcholin um die Bindung. Sie zählen zur Gruppe der peripheren Muskelrelaxantien (zu diesen gehören auch Stoffe, welche die elektromechanische Koppelung blockieren - sogenannte myotrope Muskelrelaxantien). Um die Impulsübertragung an der motorischen Endplatte zu verhindern,
muss das Muskelrelaxans 70-80% der Acetylcholinrezeptoren blockieren.
Um die Impulsübertragung an der motorischen Endplatte zu verhindern,
muss das Muskelrelaxans 70-80% der Acetylcholinrezeptoren blockieren. Nichtdepolarisierende (stabilisierende) Muskelrelaxantien, sie blockieren durch ihre Anwesenheit die Wirkung des Acetylcholins - es sind Nikotinrezeptorantagonisten
("Curare-Typ": Hierher zählen Tubocurarin und zahlreiche einschlägige
Muskelrelaxantien). Bedeutsam ist die Tastsache, dass die Wirkung
dieser Stoffe durch Gabe von Cholinesteraseinhibitoren (z.B. Neostigmin) durchbrochen werden kann, indem der Abbau des freigesetzten Transmitters gehemmt wird (Decurarisierung)
Nichtdepolarisierende (stabilisierende) Muskelrelaxantien, sie blockieren durch ihre Anwesenheit die Wirkung des Acetylcholins - es sind Nikotinrezeptorantagonisten
("Curare-Typ": Hierher zählen Tubocurarin und zahlreiche einschlägige
Muskelrelaxantien). Bedeutsam ist die Tastsache, dass die Wirkung
dieser Stoffe durch Gabe von Cholinesteraseinhibitoren (z.B. Neostigmin) durchbrochen werden kann, indem der Abbau des freigesetzten Transmitters gehemmt wird (Decurarisierung) Depolarisierende Muskelrelaxantien haben auch intrinsische Aktivität, sind also Nikotinrezeptoragonisten (Succinylcholin-Typ: Suxamethonium).
Nach vorübergehender Erregung der Muskelfaser bleiben sie am Rezeptor
länger haften und hemmen - zumindest bei den meisten Muskeln - die weitere Übertragung an der Endplatte. Nach vorübergehenden unkoordinierten Kontraktionen kommt es zu einer schlaffen Lähmung.
Depolarisierende Muskelrelaxantien haben auch intrinsische Aktivität, sind also Nikotinrezeptoragonisten (Succinylcholin-Typ: Suxamethonium).
Nach vorübergehender Erregung der Muskelfaser bleiben sie am Rezeptor
länger haften und hemmen - zumindest bei den meisten Muskeln - die weitere Übertragung an der Endplatte. Nach vorübergehenden unkoordinierten Kontraktionen kommt es zu einer schlaffen Lähmung.| Succinylcholin aktiviert an der Endplatte postsynaptische nikotinische Rezeptoren |

| Hemmung der Cholinesterase reduziert die Wirkung von Tubocurarin / Succinylcholin |
 Ist der Ryanodinrezeptor (
Ist der Ryanodinrezeptor ( Abbildung; RyR
Abbildung; RyR
 s. oben) mutiert, kann dies eine (autosomal-dominant vererbte) schwere
Komplikation verursachen, falls bestimmte Muskelrelaxantien
oder Inhalationsnarkotika zur Anwendung gelangen.
s. oben) mutiert, kann dies eine (autosomal-dominant vererbte) schwere
Komplikation verursachen, falls bestimmte Muskelrelaxantien
oder Inhalationsnarkotika zur Anwendung gelangen.
 Abbildung: Ryanodinrezeptor
Abbildung: Ryanodinrezeptor
  Die Skelettmuskulatur beansprucht bei körperlicher Ruhe ~15% des
Herzminutenvolumens (etwa 1 l/min). Bei Ausbelastung kann die
Durchblutung ~20-fach ansteigen. Je mehr motorische Einheiten (Summe
der von einer Vorderhornzelle innervierten Fasern) aktiv sind und je
höher ihre Entladungsfrequenz ist, desto stärker kontrahiert sich der
Skelettmuskel
Die Skelettmuskulatur beansprucht bei körperlicher Ruhe ~15% des
Herzminutenvolumens (etwa 1 l/min). Bei Ausbelastung kann die
Durchblutung ~20-fach ansteigen. Je mehr motorische Einheiten (Summe
der von einer Vorderhornzelle innervierten Fasern) aktiv sind und je
höher ihre Entladungsfrequenz ist, desto stärker kontrahiert sich der
Skelettmuskel Die Übertragung der Aktionspotentiale von motorischen Neuronen auf die
Muskelzellen erfolgt an der motorischen Endplatte. Sequenz:
Depolarisierung des Neuriten öffnet präsynaptisch Ca++-Kanäle → Ca++-Ionen
strömen ein, Acetylcholin enthaltende synaptische Vesikel wandern zur
präsynaptischen Membran, mit der sie fusionieren → Acetylcholin wird in
den synaptischen Spalt freigesetzt, diffundiert zur postsynaptischen
Membran, bindet an nikotinische cholinerge Rezeptoren → diese wirken als
Natriumkanäle, Na+ strömt ein, depolarisiert die Muskelzelle
(postsynaptisches Generatorpotential) → entsteht ein
Aktionspotential, läuft es über die Muskelfaser (Voltage operated
channels) und in die transversalen Tubuli → das triggert die
elektromechanische Kopplung, der Muskel kontrahiert
Die Übertragung der Aktionspotentiale von motorischen Neuronen auf die
Muskelzellen erfolgt an der motorischen Endplatte. Sequenz:
Depolarisierung des Neuriten öffnet präsynaptisch Ca++-Kanäle → Ca++-Ionen
strömen ein, Acetylcholin enthaltende synaptische Vesikel wandern zur
präsynaptischen Membran, mit der sie fusionieren → Acetylcholin wird in
den synaptischen Spalt freigesetzt, diffundiert zur postsynaptischen
Membran, bindet an nikotinische cholinerge Rezeptoren → diese wirken als
Natriumkanäle, Na+ strömt ein, depolarisiert die Muskelzelle
(postsynaptisches Generatorpotential) → entsteht ein
Aktionspotential, läuft es über die Muskelfaser (Voltage operated
channels) und in die transversalen Tubuli → das triggert die
elektromechanische Kopplung, der Muskel kontrahiert Die präsynaptische Freisetzung von Acetylcholin wird durch Botulinumtoxin spezifisch gehemmt Die präsynaptische Freisetzung von Acetylcholin wird durch Botulinumtoxin spezifisch gehemmt Curare bindet an Acetylcholinrezeptoren der motorischen
Endplatte, ohne Ionenkanäle zu öffnen (kein Natriumeinstrom, keine
Depolarisierung) und blockiert so die Erregungsübertragung. Auch
nichtdepolarisierende Muskelrelaxantien blockieren die nikotinischen
Acetylcholinrezeptoren. Abbau (Acetylcholinesterase) und
Wiederverwertung (Recycling) des Acetylcholins beendet seine Wirkung an
der Endplatte; andernfalls
erfolgt Dauerentladung und Refrakterität der motorischen Endplatte
(schlaffe Lähmung). Diesen Effekt haben Cholinesterasehemmer
(Muskelrelaxantien, Pestizide, Nervengas). Succinylcholin aktiviert an
der Endplatte postsynaptische nikotinische Rezeptoren; Hemmung der
Cholinesterase reduziert die Wirkung von Tubocurarin / Succinylcholin.
Acetylcholinesterase-Hemmer wie Neostigmin (Anwendung bei
Curarevergiftung), einige Insektizide und Nervenkampfstoffe bewirken rasche
Anreicherung von Acetylcholin im synaptischen Spaltraum der Endplatte,
der Muskeltonus steigt an
Curare bindet an Acetylcholinrezeptoren der motorischen
Endplatte, ohne Ionenkanäle zu öffnen (kein Natriumeinstrom, keine
Depolarisierung) und blockiert so die Erregungsübertragung. Auch
nichtdepolarisierende Muskelrelaxantien blockieren die nikotinischen
Acetylcholinrezeptoren. Abbau (Acetylcholinesterase) und
Wiederverwertung (Recycling) des Acetylcholins beendet seine Wirkung an
der Endplatte; andernfalls
erfolgt Dauerentladung und Refrakterität der motorischen Endplatte
(schlaffe Lähmung). Diesen Effekt haben Cholinesterasehemmer
(Muskelrelaxantien, Pestizide, Nervengas). Succinylcholin aktiviert an
der Endplatte postsynaptische nikotinische Rezeptoren; Hemmung der
Cholinesterase reduziert die Wirkung von Tubocurarin / Succinylcholin.
Acetylcholinesterase-Hemmer wie Neostigmin (Anwendung bei
Curarevergiftung), einige Insektizide und Nervenkampfstoffe bewirken rasche
Anreicherung von Acetylcholin im synaptischen Spaltraum der Endplatte,
der Muskeltonus steigt an Elektro-mechanische Koppelung verknüpft Erregung mit Kontraktion. Transversale Tubuli enthalten spannungsgesteuerte Ca++-Kanäle (Dihydropyridinrezeptoren DHPR) in unmittelbarer Nähe von Ca++-Kanälen (Ryanodinrezeptoren RyR) des sarkoplasmatischen Retikulums. DHPR wirken als Spannungssensoren, durch RyR dringt Ca++ in das Sarkoplasma, bindet an Troponin und aktiviert den Kontraktionsmechanismus. Das SERCA-System befördert Ca++ in das Retikulum zurück (Relaxation) Elektro-mechanische Koppelung verknüpft Erregung mit Kontraktion. Transversale Tubuli enthalten spannungsgesteuerte Ca++-Kanäle (Dihydropyridinrezeptoren DHPR) in unmittelbarer Nähe von Ca++-Kanälen (Ryanodinrezeptoren RyR) des sarkoplasmatischen Retikulums. DHPR wirken als Spannungssensoren, durch RyR dringt Ca++ in das Sarkoplasma, bindet an Troponin und aktiviert den Kontraktionsmechanismus. Das SERCA-System befördert Ca++ in das Retikulum zurück (Relaxation) Einzelne Aktionspotentiale bewirken Einzelzuckungen (z.B. bei Auslösung
eines Muskelspindelreflexes), Aktionspotentialsalven motorischer
Vorderhornzellen durch Summation einen Tetanus (physiologische
Kontraktionsform). Mit der Aktionspotentialfrequenz an Motoneuronen
steigt die Kraftentwicklung der zugehörigen Skelettmuskelfasern
Einzelne Aktionspotentiale bewirken Einzelzuckungen (z.B. bei Auslösung
eines Muskelspindelreflexes), Aktionspotentialsalven motorischer
Vorderhornzellen durch Summation einen Tetanus (physiologische
Kontraktionsform). Mit der Aktionspotentialfrequenz an Motoneuronen
steigt die Kraftentwicklung der zugehörigen Skelettmuskelfasern Kontraktionsmechanismus: Ca++
bindet an Troponin C, Troponin I an Aktinmoleküle, Troponin T an
Tropomyosin und unterstützt die Positionierung an Aktin. Der Myosinkopf
richtet sich auf, spaltet ATP und kippt unter Kraftentwicklung zurück,
das Myosinmolekül überträgt die Energie auf das Aktinfilament
("Kraftschlag"). Der Überlappungsgrad zwischen Aktin- und Myosinfäden bestimmt (unter anderem) die Stärke einer Kontraktion Kontraktionsmechanismus: Ca++
bindet an Troponin C, Troponin I an Aktinmoleküle, Troponin T an
Tropomyosin und unterstützt die Positionierung an Aktin. Der Myosinkopf
richtet sich auf, spaltet ATP und kippt unter Kraftentwicklung zurück,
das Myosinmolekül überträgt die Energie auf das Aktinfilament
("Kraftschlag"). Der Überlappungsgrad zwischen Aktin- und Myosinfäden bestimmt (unter anderem) die Stärke einer Kontraktion Titin ist an Z- und M-Streifen verankert und dehnungselastisch Titin ist an Z- und M-Streifen verankert und dehnungselastisch Die Kraftentwicklung hängt ab u.a. von Stoffwechselzustand
(Sauerstoffangebot), Muskellänge (Überlappungsgrad Aktin-Myosin) und Aktionspotentialfrequenz der Motoneuronen
(Ausprägung des Tetanus) Die Kraftentwicklung hängt ab u.a. von Stoffwechselzustand
(Sauerstoffangebot), Muskellänge (Überlappungsgrad Aktin-Myosin) und Aktionspotentialfrequenz der Motoneuronen
(Ausprägung des Tetanus) Die Verkürzungsgeschwindigkeit des Muskels ist umgekehrt proportional
zu seiner mechanischen Belastung. Maximale Leistung wird bei einem
Drittel der maximalen Belastung bzw. Verkürzungsgeschwindigkeit erbracht
Die Verkürzungsgeschwindigkeit des Muskels ist umgekehrt proportional
zu seiner mechanischen Belastung. Maximale Leistung wird bei einem
Drittel der maximalen Belastung bzw. Verkürzungsgeschwindigkeit erbracht |
