




 Osmolalität und Flüssigkeitsvolumina
Osmolalität und Flüssigkeitsvolumina
 Dehydrierung: ὕδωρ = Wasser ("Entwässerung")
Dehydrierung: ὕδωρ = Wasser ("Entwässerung")| Bis
auf wenige Ausnahmen sind die Körperflüssigkeiten osmotisch isoton (~
0,3 osmol/l) - entsprechend einer "physiologischen
Kochsalzlösung" (0,9%ig, d.h. 9 g NaCl/l), die meist als Grundlage für
Infusionslösungen dient. An physiologischen Grenzflächen können
osmotische Effekte auftreten; Zellmembranen sind wasserdurchlässig und
können so Unterschiede der osmotischen Konzentration durch Osmose ausgleichen. Treten unterschiedliche Konzentrationen
osmotisch wirksamer Stoffe auf (intra- vs. extrazellulär), nehmen
Zellen entweder Wasser auf (Zellschwellung oder Zytolyse in hypotoner
Umgebung) oder sie schrumpfen (in hypertoner Umgebung). Auf den ganzen Organismus bezogen ist die osmotische Konzentration wichtig, da von ihr das Milieu für biochemische und zellphysiologische Vorgänge abhängt. Sie wird präzise reguliert; das Zentrum dafür ist der Hypothalamus, der über neuronale und humorale Zugriffsmöglichkeiten verfügt, die Osmolalität - wenn nötig - zu korrigieren. Ansatzpunkte für diese Regulation sind einerseits die Aufnahme, andererseits die Ausscheidung von Wasser und Salz - also Durstempfinden, eventuell Salzappetit, und Nierenfunktion. Dehydration bedeutet zu geringe, Hyperhydration erhöhte Flüssigkeitsmenge im Körper. Meist meint man damit den Zustand des Extrazellulärraums (bei intrazellulären Abweichungen sagt man das dazu). Hydrationsänderungen können isoton, hypoton, oder hyperton sein. Immer bewegt sich das Wasser über (zelluläre, epitheliale) Grenzschichten auf die Seite der höheren Konzentration der gelösten Stoffe (Osmose); für jede dieser Störungen gibt es charakteristische klinische Beispiele. Der Normbereich der Osmolalität ist eng, etwa zwischen 280 und 295 mosmol/l (entsprechend einer Natriumkonzentration um die 145 mM). Sekretion und Blutspiegel von Vasopressin ändern sich mit der Osmolalität; unter ~280 mosmol/l betragen sie praktisch Null, darüber steigen sie an, und über ~290 mosmol/l beginnt zusätzlich Durstgefühl zu wirken (Trinken von Wasser reduziert die Osmolalität der Körperflüssigkeiten). |
 Wasserbilanz und Kompartimente
Wasserbilanz und Kompartimente  Volumenregulation
Volumenregulation  Osmoregulation
Osmoregulation  Veränderte Regulationsschwelle
Veränderte Regulationsschwelle  Dehydration
Dehydration  Vasopressin
Vasopressin

 Iso-, Hyper- / Hypotonizität
Iso-, Hyper- / Hypotonizität  Physiologische Kochsalzlösung
Physiologische Kochsalzlösung  Freiwasserclearance
Freiwasserclearance
 Core messages
Core messages Abbildung.)
Abbildung.)
 Abbildung: Osmose
Abbildung: Osmose
 Abbildung) - es entsteht ein Netto-Strom von Lösungsmittel, d.h. eine osmotische
Flüssigkeitsströmung.
Abbildung) - es entsteht ein Netto-Strom von Lösungsmittel, d.h. eine osmotische
Flüssigkeitsströmung. Osmotische
Ausgleichsströme treten auf, wenn sich die Osmolalität aneinander
grenzender Kompartimente - z.B. Intra- versus Extrazellulärraum -
unterscheidet.
Osmotische
Ausgleichsströme treten auf, wenn sich die Osmolalität aneinander
grenzender Kompartimente - z.B. Intra- versus Extrazellulärraum -
unterscheidet. 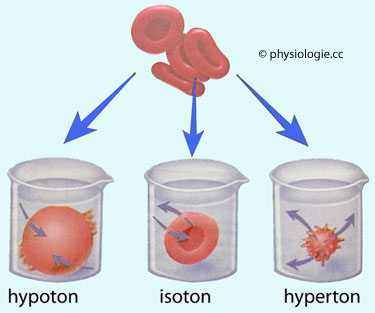
 Abbildung: Wirkung von Lösungen verschiedener Tonizität auf die Gestalt von Erythrozyten
Abbildung: Wirkung von Lösungen verschiedener Tonizität auf die Gestalt von Erythrozyten
 Die Konzentration gelöster (osmotisch wirksamer) Substanzen wird in osmol/l bzw. osmol/kg angegeben (
Die Konzentration gelöster (osmotisch wirksamer) Substanzen wird in osmol/l bzw. osmol/kg angegeben ( s. dort). Ein Tausendstel osmol ist ein milli-osmol
(mosmol).
s. dort). Ein Tausendstel osmol ist ein milli-osmol
(mosmol).  als
Osmolarität (osmotische Konzentration) in osmol / Liter Lösung
(z.B. Blutserum) - das Volumen nimmt mit der Temperatur zu, daher
müsste man zur Osmolarität streng genommen die Messtemperatur angeben
(meist ist Körpertemperatur gemeint); oder
als
Osmolarität (osmotische Konzentration) in osmol / Liter Lösung
(z.B. Blutserum) - das Volumen nimmt mit der Temperatur zu, daher
müsste man zur Osmolarität streng genommen die Messtemperatur angeben
(meist ist Körpertemperatur gemeint); oder  als Osmolalität in osmol / Kilogramm Lösungsmittel
(Wasser) - vorteilhaft, wenn die entsprechende Lösung zubereitet werden
soll (z.B. Infusionslösung). Diese Größe ist unabhängig von der
Temperatur.
als Osmolalität in osmol / Kilogramm Lösungsmittel
(Wasser) - vorteilhaft, wenn die entsprechende Lösung zubereitet werden
soll (z.B. Infusionslösung). Diese Größe ist unabhängig von der
Temperatur. Liegt der Wert der
Plasma-Osmolalität (effektiv) über 300 mosmol/l, spricht man von Hypertonizität, bei
unter 280 mosmol/l von Hypotonizität. Blutplasma hat etwa 290 mosmol/l, eine Lösung dieser osmotischen Konzentration (z.B. physiologische Kochsalzlösung) nennt man isoton (isos = gleich, gleich stark konzentriert wie Blutplasma).
Liegt der Wert der
Plasma-Osmolalität (effektiv) über 300 mosmol/l, spricht man von Hypertonizität, bei
unter 280 mosmol/l von Hypotonizität. Blutplasma hat etwa 290 mosmol/l, eine Lösung dieser osmotischen Konzentration (z.B. physiologische Kochsalzlösung) nennt man isoton (isos = gleich, gleich stark konzentriert wie Blutplasma). Osmolalität und Tonizität muss nicht das Gleiche bedeuten: Die
Osmolalität bezieht sich auf die Konzentration osmotisch aktiver
gelöster Teilchen in einer Lösung, die Tonizität auf deren
physiologischen Effekt im Körper (effektive Osmolalität).
So wirkt sich Glucose normalerweise kaum auf die Tonizität aus
(intestinal resorbierte Glucose wird von den Zellen rasch aufgenommen
und verstoffwechselt und ist dann osmotisch nicht mehr wirksam).
Osmolalität und Tonizität muss nicht das Gleiche bedeuten: Die
Osmolalität bezieht sich auf die Konzentration osmotisch aktiver
gelöster Teilchen in einer Lösung, die Tonizität auf deren
physiologischen Effekt im Körper (effektive Osmolalität).
So wirkt sich Glucose normalerweise kaum auf die Tonizität aus
(intestinal resorbierte Glucose wird von den Zellen rasch aufgenommen
und verstoffwechselt und ist dann osmotisch nicht mehr wirksam). 
 Natrium (~140 mM)
Natrium (~140 mM)
 Chlorid (~105 mM)
Chlorid (~105 mM)
 Bikarbonat (~25 mM)
Bikarbonat (~25 mM)
 Glucose (~5 mM)
Glucose (~5 mM)
 Harnstoff (~5 mM)
Harnstoff (~5 mM) den Gefrierpunkt
(Gefrierpunktserniedrigung plasmaisotoner Körperflüssigkeiten: 0,56°C) oder
den Gefrierpunkt
(Gefrierpunktserniedrigung plasmaisotoner Körperflüssigkeiten: 0,56°C) oder  den Dampfdruck der Lösung (Osmolalität proportional Dampfdruckerhöhung) - beide sind von der Osmolalität
abhängig, oder
den Dampfdruck der Lösung (Osmolalität proportional Dampfdruckerhöhung) - beide sind von der Osmolalität
abhängig, oder direkt mit einer Membran ermitteln (umständlich, im klinischen Labor nicht üblich).
direkt mit einer Membran ermitteln (umständlich, im klinischen Labor nicht üblich). Wassermangel äußert sich in einer Zunahme der
Natriumkonzentration und der Osmolalität im Blutplasma - und umgekehrt.
Da Flüssigkeitsvolumina (in und außerhalb von Zellen) über
Salzkonzentrationen reguliert werden, hilft die Osmometrie an Blut-
oder Harnproben bei der Diagnostik von Störungen des
Salz-Wasser-Haushalts.
Wassermangel äußert sich in einer Zunahme der
Natriumkonzentration und der Osmolalität im Blutplasma - und umgekehrt.
Da Flüssigkeitsvolumina (in und außerhalb von Zellen) über
Salzkonzentrationen reguliert werden, hilft die Osmometrie an Blut-
oder Harnproben bei der Diagnostik von Störungen des
Salz-Wasser-Haushalts.  Insbesondere
bei bewusstlosen oder verwirrten Patienten ist die Kontrolle des
Wassergehalts (des Hydrationszustandes) von Bedeutung, um im Falle
einer Entgleisung der Osmoregulation (in der Regel Dehydrierung)
Gegenmaßnahmen einzuleiten.
Insbesondere
bei bewusstlosen oder verwirrten Patienten ist die Kontrolle des
Wassergehalts (des Hydrationszustandes) von Bedeutung, um im Falle
einer Entgleisung der Osmoregulation (in der Regel Dehydrierung)
Gegenmaßnahmen einzuleiten. 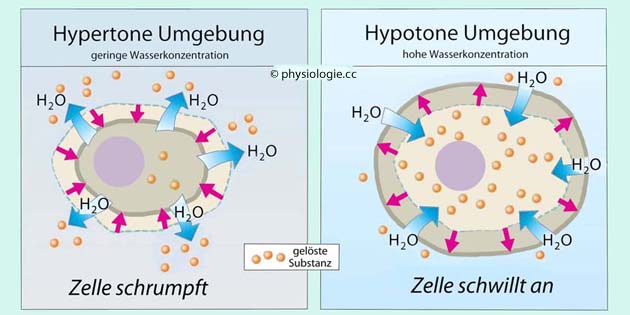
 Abbildung: Tonizität und Zellvolumen
Abbildung: Tonizität und Zellvolumen Zur Bestimmung des extrazellulären und intrazellulären Flüssigkeitsvolumens s. dort
Zur Bestimmung des extrazellulären und intrazellulären Flüssigkeitsvolumens s. dort
| Elektrolyte in Körperflüssigkeiten In mosm/l Nach Mastenbjörk / Meloni / Andersson, Fluid and Electrolytes, Medical Creations 2024 |
|||
| Komponente |
Intrazellulär |
Interstitiell |
Blutplasma |
| Na+ |
14 |
139 |
142 |
| Cl- |
4 |
108 |
108 |
| K+ |
140 |
4 |
4,2 |
| Ca++ |
0 |
1,2 |
1,3 |
| HCO3- |
10 |
28,3 |
24 |
| HPO4-- |
11 |
2 |
2 |
| Protein |
4 |
0,2 |
1,2 |
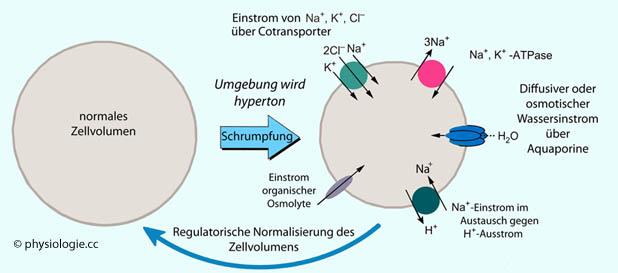
 Abbildung: Regulatorische Volumenzunahme von Zellen in Reaktion auf Schrumpfung
Abbildung: Regulatorische Volumenzunahme von Zellen in Reaktion auf Schrumpfung
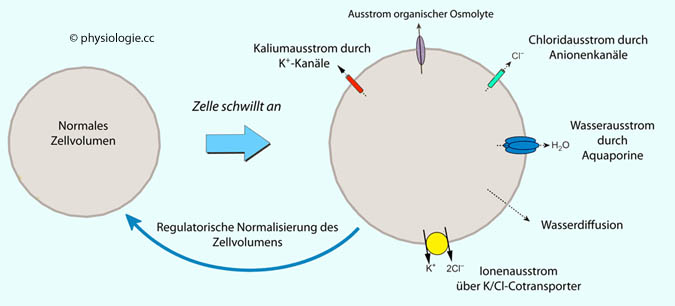
 Abbildung: Reduktion des Zellvolumens in Reaktion auf Zunahme des Zellvolumens
Abbildung: Reduktion des Zellvolumens in Reaktion auf Zunahme des Zellvolumens
 Bei isotonen
Veränderungen des extrazellulären Volumens (Hyper- oder Hypohydration)
liegt kein Unterschied zwischen intra- und extrazellulärer Osmolalität
vor, es kommt zu keiner Netto-Bewegung von Wasser durch die Zellmembranen, das Volumen der Zellen (Intrazellulärvolumen) bleibt unverändert.
Bei isotonen
Veränderungen des extrazellulären Volumens (Hyper- oder Hypohydration)
liegt kein Unterschied zwischen intra- und extrazellulärer Osmolalität
vor, es kommt zu keiner Netto-Bewegung von Wasser durch die Zellmembranen, das Volumen der Zellen (Intrazellulärvolumen) bleibt unverändert. Nimmt z.B. die extrazelluläre Natriumkonzentration ab (hypotone Störung: [Na+]
< 136 mM), dringt Wasser osmotisch in die Zelle ein
(die ja jetzt relativ hyperton
Nimmt z.B. die extrazelluläre Natriumkonzentration ab (hypotone Störung: [Na+]
< 136 mM), dringt Wasser osmotisch in die Zelle ein
(die ja jetzt relativ hyperton  ist), es kommt zu Zellschwellung
(Zellödem), was Kopfschmerzen, Verwirrtheit, Übelkeit und Muskelkrämpfe
bedingen kann. Bei hypotoner Hyperhydration ("Wasservergiftung") nimmt sowohl das Extra- als auch das Intrazellulärvolumen zu.
ist), es kommt zu Zellschwellung
(Zellödem), was Kopfschmerzen, Verwirrtheit, Übelkeit und Muskelkrämpfe
bedingen kann. Bei hypotoner Hyperhydration ("Wasservergiftung") nimmt sowohl das Extra- als auch das Intrazellulärvolumen zu.  Bei hypertoner
Störung passiert das Gegenteil: Wasser verlässt die Zellen, diese
schrumpfen ("zelluläre Exsikkose"), Unruhe, Fieber, Durst können die
Folge sein. Bei hypertoner Dehydration
("Durstexsikkose") kommt es durch Wasserdefizit (Ausscheidung >
Nachschub) zunächst zu Kontraktion des Extrazellulärraums, und die
Hyperosmolalität (erhöhte Salzkonzentration) zieht Wasser aus den
Zellen. Ein Beispiel dafür ist unkompensierter Schweißverlust:
Bei hypertoner
Störung passiert das Gegenteil: Wasser verlässt die Zellen, diese
schrumpfen ("zelluläre Exsikkose"), Unruhe, Fieber, Durst können die
Folge sein. Bei hypertoner Dehydration
("Durstexsikkose") kommt es durch Wasserdefizit (Ausscheidung >
Nachschub) zunächst zu Kontraktion des Extrazellulärraums, und die
Hyperosmolalität (erhöhte Salzkonzentration) zieht Wasser aus den
Zellen. Ein Beispiel dafür ist unkompensierter Schweißverlust:| Starkes Schwitzen → Verlust hypotoner Flüssigkeit → a) / b) a) → extrazelluläres Volumen sinkt → Harnausscheidung nimmt ab b) → Osmolalität steigt → Wasser strömt aus den Zellen → allgemeine Hypertonizität |
 Leberzellen:
Bei sinkendem Zellvolumen bauen Hepatozyten Glykogen und Proteine ab -
die entstehenden Aminosäure- und Glucosemoleküle erhöhen die
intrazelluläre Osmolarität der schrumpfenden Zelle und verursachen
Wassereinstrom, das Zellvolumen nimmt zu. Umgekehrt kommt es bei
Zellschwellung zu vermehrter Proteinsynthese und Glykogensynthese, was
Aminosäuren und Glucose verbraucht und die Zahl der osmotisch aktiven
Moleküle senkt - Wasser strömt aus der Zelle, das Zellvolumen nimmt
ab.
Leberzellen:
Bei sinkendem Zellvolumen bauen Hepatozyten Glykogen und Proteine ab -
die entstehenden Aminosäure- und Glucosemoleküle erhöhen die
intrazelluläre Osmolarität der schrumpfenden Zelle und verursachen
Wassereinstrom, das Zellvolumen nimmt zu. Umgekehrt kommt es bei
Zellschwellung zu vermehrter Proteinsynthese und Glykogensynthese, was
Aminosäuren und Glucose verbraucht und die Zahl der osmotisch aktiven
Moleküle senkt - Wasser strömt aus der Zelle, das Zellvolumen nimmt
ab. Tubuluszellen im Nierenmark: Diese sind fortwährend erhöhter Osmolarität ausgesetzt (s. dort).
Wie erhalten sie dennoch ihr normales Volumen? Sie tun das, indem sie
die Synthese organischer Osmolyte erhöhen (z.B. Sorbitol, Inositol,
Betain). Auch können sie die Bestückung ihrer Membran mit Aquaporin
ändern.
Tubuluszellen im Nierenmark: Diese sind fortwährend erhöhter Osmolarität ausgesetzt (s. dort).
Wie erhalten sie dennoch ihr normales Volumen? Sie tun das, indem sie
die Synthese organischer Osmolyte erhöhen (z.B. Sorbitol, Inositol,
Betain). Auch können sie die Bestückung ihrer Membran mit Aquaporin
ändern.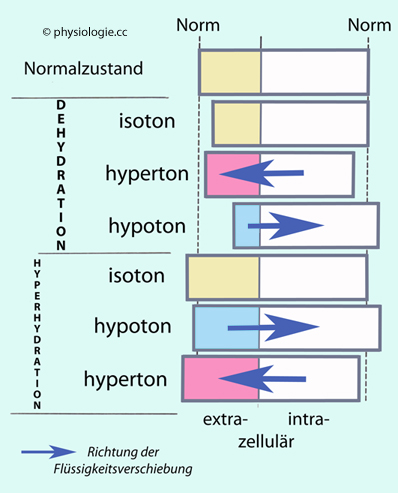
 Abbildung: Osmotischer Ausgleich bei De- oder Hyperhydration
Abbildung: Osmotischer Ausgleich bei De- oder Hyperhydration : Abnahme, Hyperhydration: Zunahme des extrazellulären Volumens.
Die Verhältnisse können - je nach Osmolatität - iso-, hyper- oder hypoton sein. Beispiele:
: Abnahme, Hyperhydration: Zunahme des extrazellulären Volumens.
Die Verhältnisse können - je nach Osmolatität - iso-, hyper- oder hypoton sein. Beispiele: Als physiologische Kochsalzlösung bezeichnet man eine dem Blutplasma isotone Lösung von 9 g NaCl pro Liter (0,9 %ige NaCl-Lösung). Diese
hat die gleiche osmotische Konzentration wie Blutplasma bzw.
interstitielle Flüssigkeit (290 mosmol/l) und wird als Grundlage für
die meisten medizinischen Infusionsflüssigkeiten verwendet.
Als physiologische Kochsalzlösung bezeichnet man eine dem Blutplasma isotone Lösung von 9 g NaCl pro Liter (0,9 %ige NaCl-Lösung). Diese
hat die gleiche osmotische Konzentration wie Blutplasma bzw.
interstitielle Flüssigkeit (290 mosmol/l) und wird als Grundlage für
die meisten medizinischen Infusionsflüssigkeiten verwendet. Wasser würde den Intrazellulärraum erhöhen (osmotisch bedingter Einstrom von H2O in die Zellen), die Zellen schwellen an,
Wasser würde den Intrazellulärraum erhöhen (osmotisch bedingter Einstrom von H2O in die Zellen), die Zellen schwellen an, die Zufuhr isotoner Kochsalzlösung würde das intrazelluläre Volumen unverändert lassen,
die Zufuhr isotoner Kochsalzlösung würde das intrazelluläre Volumen unverändert lassen, löst man NaCl in extrazellulärer Flüssigkeit, wird diese hyperton, Wasser strömt osmotisch bedingt aus den Zellen, die Zellen schrumpfen.
löst man NaCl in extrazellulärer Flüssigkeit, wird diese hyperton, Wasser strömt osmotisch bedingt aus den Zellen, die Zellen schrumpfen.| Die Osmolalität des Blutplasmas entspricht der Osmolalität einer 0,9 %igen Kochsalzlösung |
| Infusion hypertoner
Infusionslösungen (z.B. NaCl) steigert sowohl Osmolarität als auch
Volumen im Extrazellulärraum (hypertone Hyperhydration) → Wasser
diffundiert aus den Zellen (Osmose), die Zellen schrumpfen Hyperhydration senkt die Plasma-Proteinkonzentration (Verdünnungseffekt) |
 Isotone Glucoselösung wirkt stark hypoton, da Glucose
rasch von den Zellen aufgenommen wird und so aus dem Extrazellulärraum
verschwindet.
Isotone Glucoselösung wirkt stark hypoton, da Glucose
rasch von den Zellen aufgenommen wird und so aus dem Extrazellulärraum
verschwindet. ein und gleicht die Störung durch
Ausscheidung verdünnten oder konzentrierten Harns, und evt.
Wasserzufuhr, aus.
ein und gleicht die Störung durch
Ausscheidung verdünnten oder konzentrierten Harns, und evt.
Wasserzufuhr, aus. | Männer |
Frauen |
|
|
(total body water TBW) |
60% KG |
50% KG |
| Intrazelluläre Flüssigkeit |
60% TBW |
|
| Extrazelluläre Flüssigkeit (EZF) |
40% TBW |
|
| Interstitielle Flüssigkeit |
75% EZF |
|
| Blutplasma |
20% EZF |
|
| Blut |
8% KG |
7% KG |
| Transzelluläre Flüssigkeit |
5% EZF |
|
 Gesamtkörperwasser, Mann 42 kg, Frau 35 kg
Gesamtkörperwasser, Mann 42 kg, Frau 35 kg Intrazelluläre Flüssigkeit, Mann 25 l, Frau 21 l
Intrazelluläre Flüssigkeit, Mann 25 l, Frau 21 l Extrazelluläre Flüssigkeit, Mann 17 kg, Frau 15 kg
Extrazelluläre Flüssigkeit, Mann 17 kg, Frau 15 kg Interstitielle Flüssigkeit, Mann 13 kg, Frau 10 kg
Interstitielle Flüssigkeit, Mann 13 kg, Frau 10 kg Blutplasma, 3 kg
Blutplasma, 3 kg Blut, Mann 5,5 kg, Frau 5 kg
Blut, Mann 5,5 kg, Frau 5 kg Transzelluläre Flüssigkeit, 1 kg
Transzelluläre Flüssigkeit, 1 kg s. dort).
s. dort). s. dort.
s. dort. → geringer venöser Rückstrom →
reduzierte kardiale Vorlast → herabgesetztes Herzzeitvolumen) zu
Problemen, den arteriellen Blutdruck aufrechtzuerhalten, damit zu
Kreislauflabilität und schließlich Kreislaufversagen, das unbehandelt
zum Tode führt (Mb. Addison).
→ geringer venöser Rückstrom →
reduzierte kardiale Vorlast → herabgesetztes Herzzeitvolumen) zu
Problemen, den arteriellen Blutdruck aufrechtzuerhalten, damit zu
Kreislauflabilität und schließlich Kreislaufversagen, das unbehandelt
zum Tode führt (Mb. Addison). Abbildung):
Abbildung):
 Abbildung: Aktivität in Hypothalamus und Großhirnrinde und Durstgefühl bei wechselnder Plasmaosmolalität
Abbildung: Aktivität in Hypothalamus und Großhirnrinde und Durstgefühl bei wechselnder Plasmaosmolalität
 vor allem mit dem Durstempfinden korreliert, nimmt diejenige der osmosensiblen Zone im organum vasculosum
der lamina terminalis mit der Osmolalität des Blutplasmas (und damit der interstitiellen Flüssigkeit) zu (
vor allem mit dem Durstempfinden korreliert, nimmt diejenige der osmosensiblen Zone im organum vasculosum
der lamina terminalis mit der Osmolalität des Blutplasmas (und damit der interstitiellen Flüssigkeit) zu ( Abbildung).
Abbildung). Aufnahme: 2,2 l/d per os, 0,3 l/d Oxidationswasser;
Aufnahme: 2,2 l/d per os, 0,3 l/d Oxidationswasser;  Abgabe: Urin 1,5 l/d, Wasserverlust über Atmung und Haut 0,85 l/d, mit dem Stuhl 0,15 l/d
Abgabe: Urin 1,5 l/d, Wasserverlust über Atmung und Haut 0,85 l/d, mit dem Stuhl 0,15 l/d 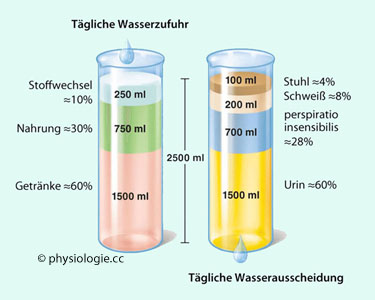
 Die tägliche Wasseraufnahme
beträgt beim Erwachsenen etwa 2-3 Liter, stark abhängig von
Begleitumständen. Bei durchschnittlicher Ernährung fallen ~600 mosmol
harnpflichtige Substanzen an. Da die Niere des Menschen auf maximal ~1200 mosmol konzentrieren
kann, werden für die Ausscheidung dieser osmotischen Last mindestens
0,5 Liter Harn benötigt.
Die tägliche Wasseraufnahme
beträgt beim Erwachsenen etwa 2-3 Liter, stark abhängig von
Begleitumständen. Bei durchschnittlicher Ernährung fallen ~600 mosmol
harnpflichtige Substanzen an. Da die Niere des Menschen auf maximal ~1200 mosmol konzentrieren
kann, werden für die Ausscheidung dieser osmotischen Last mindestens
0,5 Liter Harn benötigt.  Eine solche maximale Konzentrierung (negative Freiwasserclearance) erfolgt nur bei Wassermangel (Durstzustand).
Eine solche maximale Konzentrierung (negative Freiwasserclearance) erfolgt nur bei Wassermangel (Durstzustand).  Als Freiwasserclearance
(free water clearance) bezeichnet man diejenige Plasmamenge, die (pro Zeiteinheit) als reines
Wasser (also ohne gelöste Stoffe) ausgeschieden wird. Bei hypotonem
Harn ergibt sich ein positiver, bei hypertonem ein negativer Betrag der
Freiwasserclearance.
Als Freiwasserclearance
(free water clearance) bezeichnet man diejenige Plasmamenge, die (pro Zeiteinheit) als reines
Wasser (also ohne gelöste Stoffe) ausgeschieden wird. Bei hypotonem
Harn ergibt sich ein positiver, bei hypertonem ein negativer Betrag der
Freiwasserclearance.  Ist der 24-Stunden-Harn blutisoton, wird Wasser weder eingespart noch zusätzlich ausgeschieden (keine Freiwasserclearance).
Ist der 24-Stunden-Harn blutisoton, wird Wasser weder eingespart noch zusätzlich ausgeschieden (keine Freiwasserclearance).  Ist der Harn hypoton, besteht eine positive Freiwasserclearance (z.B. infolge Zufuhr einer Wassermenge, die zur
Erhaltung des osmotischen Gleichgewichts nicht nötig wäre - exzessives
Trinken; sie kann im Fall eines voll ausgebildeten Diabetes insipidus bis ~20 l/d betragen).
Ist der Harn hypoton, besteht eine positive Freiwasserclearance (z.B. infolge Zufuhr einer Wassermenge, die zur
Erhaltung des osmotischen Gleichgewichts nicht nötig wäre - exzessives
Trinken; sie kann im Fall eines voll ausgebildeten Diabetes insipidus bis ~20 l/d betragen). Intrazellulär ~60%
Intrazellulär ~60% Extrazellulär ~40%, bestehend aus:
Extrazellulär ~40%, bestehend aus: interstitiell (extravasale Gewebespalten) ~30%
interstitiell (extravasale Gewebespalten) ~30% Blutplasma (intravasal) 6-8%
Blutplasma (intravasal) 6-8% transzellulär ('third space', anatomisch begrenzte extravasale Flüssigkeitsräume), z.B. Pleura-, Perikardial-, Peritoneal-, Liquorraum: 3-4%
transzellulär ('third space', anatomisch begrenzte extravasale Flüssigkeitsräume), z.B. Pleura-, Perikardial-, Peritoneal-, Liquorraum: 3-4% Regulation extrazelluläres Volumen vs. Osmolalität  Nach Boron / Boulpaep: Concise Medical Physiology 2021 |
||
| |
Regulation EZV / Blutdruck |
Regulation Osmolalität |
| Was wird gemessen? |
Effektives Blutvolumen |
Osmolalität Blutplasma |
| Sensoren |
Barorezeptoren in Carotissinus, Aortenbogen, afferenten Nierenarterien, Atrien (Herz) |
Hypothalamische Osmosensoren |
| Efferenzen |
RAAS, Sympathikus, Vasopressin, ANP |
Durst Vasopressin |
| Effektoren |
 Kurzfristig: Herz, Blutgefäße Kurzfristig: Herz, Blutgefäße Langfristig: Niere Langfristig: Niere |
Niere Trinkverhalten |
| Was wird beeinflusst? |
 Kurzfristig: Blutdruck Kurzfristig: Blutdruck Langfristig: Natriumausscheidung Langfristig: Natriumausscheidung
|
Wasserausscheidung Wasseraufnahme |
 Das
"Volumensignal" aus der Peripherie (Kreislaufrezeptoren) beeinflusst
kurzfristig (Sekunden bis Minuten) den Sympathikustonus und
kreislaufwirksame Hormone, langfristig (Stunden bis Tage) nervöse,
humorale und hämodynamische Mechanismen zur Steuerung der
Natriumausscheidung.
Das
"Volumensignal" aus der Peripherie (Kreislaufrezeptoren) beeinflusst
kurzfristig (Sekunden bis Minuten) den Sympathikustonus und
kreislaufwirksame Hormone, langfristig (Stunden bis Tage) nervöse,
humorale und hämodynamische Mechanismen zur Steuerung der
Natriumausscheidung.  Änderungen
der Plasmaosmolalität beeinflussen im Gehirn das Durstempfinden
einerseits, die Sekretion von Vasopressin (ADH = antidiuretisches
Hormon, Adiuretin, AVP = Arginin-Vasopressin) andererseits (Tabelle und
Abbildungen).
Änderungen
der Plasmaosmolalität beeinflussen im Gehirn das Durstempfinden
einerseits, die Sekretion von Vasopressin (ADH = antidiuretisches
Hormon, Adiuretin, AVP = Arginin-Vasopressin) andererseits (Tabelle und
Abbildungen).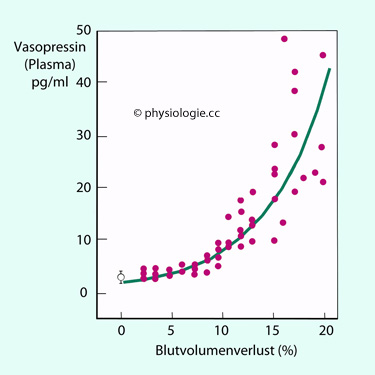
 Abbildung: Vasopressinspiegel als Funktion abnehmenden Blutvolumens
Abbildung: Vasopressinspiegel als Funktion abnehmenden Blutvolumens
 Abbildung). Dieser Anstieg ist umso
intensiver, je mehr das Blutvolumen abnimmt; bei einem Verlust von 15%
des Referenzvolumens nimmt [Vasopressin] im Schnitt beinahe 10-fach zu,
bei 20% Volumenverlust bis zu 20-fach.
Abbildung). Dieser Anstieg ist umso
intensiver, je mehr das Blutvolumen abnimmt; bei einem Verlust von 15%
des Referenzvolumens nimmt [Vasopressin] im Schnitt beinahe 10-fach zu,
bei 20% Volumenverlust bis zu 20-fach. Zum Wirkungsmechanismus des Vasopressins s. auch dort
Zum Wirkungsmechanismus des Vasopressins s. auch dort Nicht
das extrazelluläre Volumen als solches ist entscheidend für die
Volumenregulation, sondern das im Kreislauf effektiv wirksame (effective circulating volume). Dieses ist nicht anatomisch, sondern funktionell definiert als die effektive Durchblutung spezifischer Gewebeareale.
Die Dehnung ihrer Blutgefäße (Carotis, Aortenbogen, Gefäße in Lunge,
Nieren, Leber, ZNS) sowie Herzvorhöfe entspricht dem Blutspeicher bzw. Perfusionsdruck,
wird über Rezeptoren ermittelt und ist über Sympathikus und mehrere
endokrine Systeme (s. Tabelle oben) regulatorisch wirksam.
Nicht
das extrazelluläre Volumen als solches ist entscheidend für die
Volumenregulation, sondern das im Kreislauf effektiv wirksame (effective circulating volume). Dieses ist nicht anatomisch, sondern funktionell definiert als die effektive Durchblutung spezifischer Gewebeareale.
Die Dehnung ihrer Blutgefäße (Carotis, Aortenbogen, Gefäße in Lunge,
Nieren, Leber, ZNS) sowie Herzvorhöfe entspricht dem Blutspeicher bzw. Perfusionsdruck,
wird über Rezeptoren ermittelt und ist über Sympathikus und mehrere
endokrine Systeme (s. Tabelle oben) regulatorisch wirksam.
 Sinkt die Osmolarität
(Zellen schwellen in hypotoner Umgebung an), sinkt auch die
Öffnungswahrscheinlichkeit dieser Kanäle, es strömen weniger Kationen
in die Zelle ein, sie hyperpolarisiert und die Aktionspotentvialfrequenz nimmt ab
Sinkt die Osmolarität
(Zellen schwellen in hypotoner Umgebung an), sinkt auch die
Öffnungswahrscheinlichkeit dieser Kanäle, es strömen weniger Kationen
in die Zelle ein, sie hyperpolarisiert und die Aktionspotentvialfrequenz nimmt ab Steigt die Osmolarität (Zellen
schrumpfen in hypertoner Umgebung), öffnen die Kanäle vermehrt, der
Kationeneinstrom wird intensiver, die Zelle depolarisiert und die Aktionspotenzialfrequenz nimmt zu
Steigt die Osmolarität (Zellen
schrumpfen in hypertoner Umgebung), öffnen die Kanäle vermehrt, der
Kationeneinstrom wird intensiver, die Zelle depolarisiert und die Aktionspotenzialfrequenz nimmt zu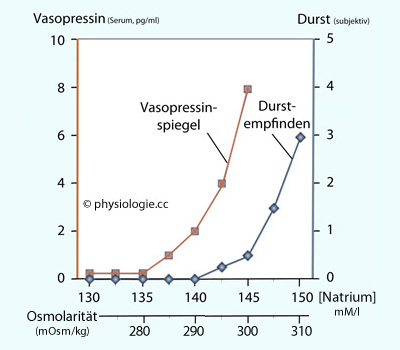
 Abbildung: Osmotische Schwellen für Vasopressinausschüttung und Durst
Abbildung: Osmotische Schwellen für Vasopressinausschüttung und Durst
 Abbildung).
Abbildung).  Abbildung unten), Alter, Geschlecht, Calciumspiegel, Medikation u.a. liegen.
Abbildung unten), Alter, Geschlecht, Calciumspiegel, Medikation u.a. liegen. Erniedrigte Osmolalität im Blut regt die Freisetzung von Aldosteron an, erhöhte Osmolalität die von Vasopressin.
Erniedrigte Osmolalität im Blut regt die Freisetzung von Aldosteron an, erhöhte Osmolalität die von Vasopressin.  Die
Empfindlichkeit des Hypothalamus, mit der er auf Änderungen der
Plasmaosmolalität mit Vasopressinsekretion reagiert, hängt davon ab,
welchen Volumenstatus die zuständigen Rezeptoren in Arterien, Venen und Herzräumen melden (
Die
Empfindlichkeit des Hypothalamus, mit der er auf Änderungen der
Plasmaosmolalität mit Vasopressinsekretion reagiert, hängt davon ab,
welchen Volumenstatus die zuständigen Rezeptoren in Arterien, Venen und Herzräumen melden ( Abbildung):
Abbildung):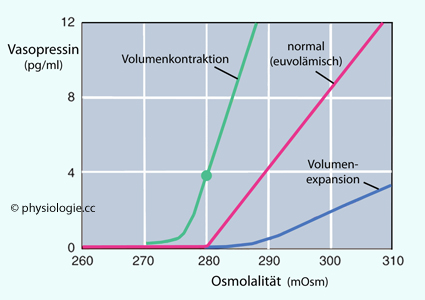
 Abbildung: Die Vasopressinkurve als Funktion der Osmolalität des Blutplasmas hängt vom Volumenstatus ab
Abbildung: Die Vasopressinkurve als Funktion der Osmolalität des Blutplasmas hängt vom Volumenstatus ab Zum Vasomotorenzentrum s.
dort
Zum Vasomotorenzentrum s.
dort
 Wenn
Volumenmangel im Kreislauf und eine Reduktion des Vorhofdrucks zu einer
Abnahme des Blutdrucks führen, so löst dies über den Baroreflex
vermehrte Freisetzung von Vasopressin (AVP) aus dem Hypothalamus aus.
Der Vasopressinspiegel schwankt (bei gleichbleibender Osmolarität) mit
dem linksatrialen Druck.
Wenn
Volumenmangel im Kreislauf und eine Reduktion des Vorhofdrucks zu einer
Abnahme des Blutdrucks führen, so löst dies über den Baroreflex
vermehrte Freisetzung von Vasopressin (AVP) aus dem Hypothalamus aus.
Der Vasopressinspiegel schwankt (bei gleichbleibender Osmolarität) mit
dem linksatrialen Druck.  Zusätzlich regt ein reduziertes effektives Blutvolumen in den granulären Zellen des juxtaglomerulären Apparats (macula densa) vermehrte Reninfreisetzung an, sodass Angiotensin II entsteht. Dieses wirkt auf Rezeptoren im Gehirn (OVLT: organum vasculosum laminae terminalis, subfornikales Organ), was wiederum Vasopressinausschüttung zur Folge hat.
Zusätzlich regt ein reduziertes effektives Blutvolumen in den granulären Zellen des juxtaglomerulären Apparats (macula densa) vermehrte Reninfreisetzung an, sodass Angiotensin II entsteht. Dieses wirkt auf Rezeptoren im Gehirn (OVLT: organum vasculosum laminae terminalis, subfornikales Organ), was wiederum Vasopressinausschüttung zur Folge hat.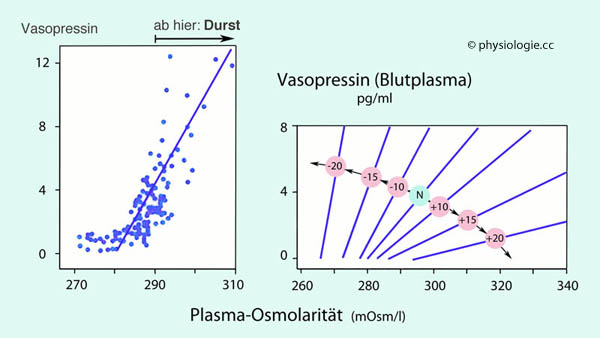
 Abbildung: Vasopressinantwort auf Osmolalitätsänderung
Abbildung: Vasopressinantwort auf Osmolalitätsänderung
 Die osmotische Regulationsschwelle ist in folgenden Situationen erniedrigt:
Die osmotische Regulationsschwelle ist in folgenden Situationen erniedrigt: Volumenmangel (geringere Reizung kardiopulmonärer Rezeptoren)
Volumenmangel (geringere Reizung kardiopulmonärer Rezeptoren) 2. Zyklusphase der Frau
2. Zyklusphase der Frau Schwangerschaft (hormonelle Effekte auf
Osmorezeptoren;
Schwangerschaft (hormonelle Effekte auf
Osmorezeptoren;  Abbildung)
Abbildung) Hypervolämie (über
den Input von kardiopulmonären / arteriellen Barorezeptoren).
Hypervolämie (über
den Input von kardiopulmonären / arteriellen Barorezeptoren).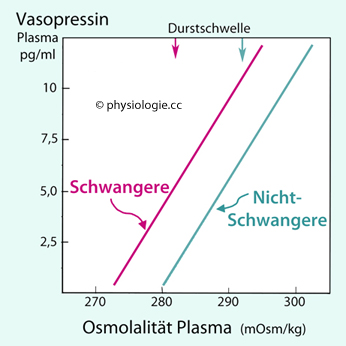
 Abbildung:
Vasopressin-Ansprechcharakteristik und Durstschwelle als Funktion der
Plasmaosmolalität bei prägraviden (grün) und Frauen am Ende des 3.
Schwangerschaftsmonats (rot)
Abbildung:
Vasopressin-Ansprechcharakteristik und Durstschwelle als Funktion der
Plasmaosmolalität bei prägraviden (grün) und Frauen am Ende des 3.
Schwangerschaftsmonats (rot)
 Hypertone Dehydration - extrazelluläre
Hypertonie bei (zunächst) intrazellulärer Normotonie. Diese Form der
Dehydration entsteht durch Verlust von Wasser, z.B. bei Fieber bzw.
intensivem Schwitzen ohne entsprechende Wasserzufuhr (Schweiß
ist hypoton). Normalerweise führt Durst zur Aufnahme einer
entsprechenden Wassermenge; wenn nicht, muss bewusst getrunken oder das
fehlende Wasser per infusionem zugeführt werden.
Hypertone Dehydration - extrazelluläre
Hypertonie bei (zunächst) intrazellulärer Normotonie. Diese Form der
Dehydration entsteht durch Verlust von Wasser, z.B. bei Fieber bzw.
intensivem Schwitzen ohne entsprechende Wasserzufuhr (Schweiß
ist hypoton). Normalerweise führt Durst zur Aufnahme einer
entsprechenden Wassermenge; wenn nicht, muss bewusst getrunken oder das
fehlende Wasser per infusionem zugeführt werden. Isotone Dehydration -
z.B. bei Durchfall oder Erbrechen: Die Osmolalität des
Extrazellularraums bleibt gleich, da die verlorene Flüssigkeit isoton
ist. Zufuhr salzhaltiger Flüssigkeit ist angesagt.
Isotone Dehydration -
z.B. bei Durchfall oder Erbrechen: Die Osmolalität des
Extrazellularraums bleibt gleich, da die verlorene Flüssigkeit isoton
ist. Zufuhr salzhaltiger Flüssigkeit ist angesagt. Hypotone
Dehydration - infolge Salzverlust, z.B. wenn nach starkem Schwitzen nur
Wasser getrunken wird. Mineralwasser kann das fehlende Salz liefern,
überschüssiges Wasser wird von den Nieren rasch ausgeschieden.
Hypotone
Dehydration - infolge Salzverlust, z.B. wenn nach starkem Schwitzen nur
Wasser getrunken wird. Mineralwasser kann das fehlende Salz liefern,
überschüssiges Wasser wird von den Nieren rasch ausgeschieden.
 Abbildung: Osmotische Toleranzgrenzen
Abbildung: Osmotische Toleranzgrenzen

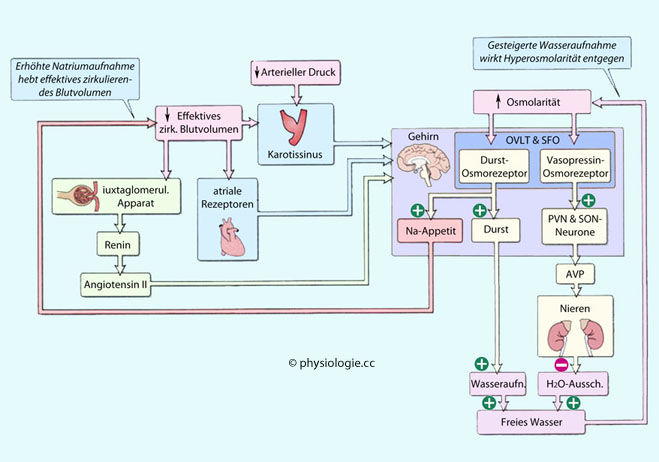
 Abbildung: Rückkopplungskreise bei der Kontrolle der Osmolarität
Abbildung: Rückkopplungskreise bei der Kontrolle der Osmolarität OVLT, organum vasculosum laminae terminalis
OVLT, organum vasculosum laminae terminalis  PVN, paraventrikulärer Kern
PVN, paraventrikulärer Kern  SFO, Subfornikalorgan
SFO, Subfornikalorgan  SON, nucl. supraopticus des Hypothalamus
SON, nucl. supraopticus des Hypothalamus
 Vasopressin (ADH, Adiuretin)
Vasopressin (ADH, Adiuretin) 

 Semipermeable
Membranen sind durchgängig für Moleküle eines Lösungsmittels, nicht
aber für gelöste Stoffe. Zellmembranen haben ähnliche Eigenschaften:
Sie lassen Wasser leichter hindurchtreten als Ionen, Glucose,
Aminosäuren etc. Die Konzentration gelöster Teilchen nennt man Osmolarität (Blutplasma
~290 mosmol/l), die Wanderung des Lösungmittels (Wasser) durch eine selektiv durchgängige Grenzfläche Osmose;
diese erfolgt nach dem Konzentrationsgradienten des Lösungsmittels,
also von der Seite niedrigerer zur Seite höherer Osmolarität (das
Wasser folgt seinem Konzentrationsgefälle, wie bei der Diffusion). Die
Zellwände geben der osmotischen Strömung nach, soferne sie Spielraum
dazu haben (eine Seite schrumpft, die andere schwillt an), ohne dass
wesentliche Druckänderungen auftreten müssen; ist ein Ausweichen nur begrenzt
möglich (z.B. Gehirn), steigt der Druck auf der Seite mit niedrigerer
Osmolalität (maximal ~19 mmHg / mosmol/l Unterschied), das kann Gefäße komprimieren und die Perfusion behindern Semipermeable
Membranen sind durchgängig für Moleküle eines Lösungsmittels, nicht
aber für gelöste Stoffe. Zellmembranen haben ähnliche Eigenschaften:
Sie lassen Wasser leichter hindurchtreten als Ionen, Glucose,
Aminosäuren etc. Die Konzentration gelöster Teilchen nennt man Osmolarität (Blutplasma
~290 mosmol/l), die Wanderung des Lösungmittels (Wasser) durch eine selektiv durchgängige Grenzfläche Osmose;
diese erfolgt nach dem Konzentrationsgradienten des Lösungsmittels,
also von der Seite niedrigerer zur Seite höherer Osmolarität (das
Wasser folgt seinem Konzentrationsgefälle, wie bei der Diffusion). Die
Zellwände geben der osmotischen Strömung nach, soferne sie Spielraum
dazu haben (eine Seite schrumpft, die andere schwillt an), ohne dass
wesentliche Druckänderungen auftreten müssen; ist ein Ausweichen nur begrenzt
möglich (z.B. Gehirn), steigt der Druck auf der Seite mit niedrigerer
Osmolalität (maximal ~19 mmHg / mosmol/l Unterschied), das kann Gefäße komprimieren und die Perfusion behindern Die osmotische
Wirkung ist durch die Konzentration gelöster Teilchen bestimmt. ~95%
der Osmolarität in Körperflüssigkeiten stammt von Salzen
(Elektrolyten). 5 Substanzen bestimmen den Großteil der Plasma-Osmolalität:
Natrium (~140 mM), Chlorid (~105 mM), Bikarbonat (~25 mM), Glucose (~5
mM), Harnstoff (~5 mM). Treten weitere Stoffe in nennenswerter
osmotischer Konzentration auf, ist die Osmolarität entsprechend höher
("osmotische Lücke"). Von Hyperosmolarität (Hypertonizität) spricht man bei Plasma-Osmolarität >300 mosmol/l, von Hypoosmolarität (Hypotonizität) bei <280 mosmol/l. Osmometrie ermittelt Gefrierpunktserniedrigung oder Dampfdruckerniedrigung (Serum- oder Harnproben: Abschätzung des Hydrationszustandes).
Bei isotoner Hyper- oder Hypohydration bleibt das Intrazellulärvolumen
unverändert. Sinkt die extrazelluläre Osmolalität (hypotone Störung),
schwellen die Zellen an, nimmt sie zu (hyperton), schrumpfen sie. Isotone Glucoselösung wirkt stark hypoton, da Glucose rasch von den Zellen aufgenommen wird. Schwitzen
macht die Körperflüssigkeiten hyperton, die Zellen verlieren Wasser,
Osmorezeptoren lösen Durst und Vasopressinfreisetzung aus Die osmotische
Wirkung ist durch die Konzentration gelöster Teilchen bestimmt. ~95%
der Osmolarität in Körperflüssigkeiten stammt von Salzen
(Elektrolyten). 5 Substanzen bestimmen den Großteil der Plasma-Osmolalität:
Natrium (~140 mM), Chlorid (~105 mM), Bikarbonat (~25 mM), Glucose (~5
mM), Harnstoff (~5 mM). Treten weitere Stoffe in nennenswerter
osmotischer Konzentration auf, ist die Osmolarität entsprechend höher
("osmotische Lücke"). Von Hyperosmolarität (Hypertonizität) spricht man bei Plasma-Osmolarität >300 mosmol/l, von Hypoosmolarität (Hypotonizität) bei <280 mosmol/l. Osmometrie ermittelt Gefrierpunktserniedrigung oder Dampfdruckerniedrigung (Serum- oder Harnproben: Abschätzung des Hydrationszustandes).
Bei isotoner Hyper- oder Hypohydration bleibt das Intrazellulärvolumen
unverändert. Sinkt die extrazelluläre Osmolalität (hypotone Störung),
schwellen die Zellen an, nimmt sie zu (hyperton), schrumpfen sie. Isotone Glucoselösung wirkt stark hypoton, da Glucose rasch von den Zellen aufgenommen wird. Schwitzen
macht die Körperflüssigkeiten hyperton, die Zellen verlieren Wasser,
Osmorezeptoren lösen Durst und Vasopressinfreisetzung aus Frauen bestehen
zu ~50%, Männer zu ~60%, Neugeborene zu ~75% aus Wasser; der
Flüssigkeitsanteil an der Körpermasse nimmt mit zunehmendem Alter ab.
Die Verteilung von Wirkstoffen richtet sich nach Kompartmentgrenzen und
Verteilungsgeschwindigkeiten; injiziert man sie, verteilen sie sich
zuerst im Blut (~5 l, mittlere Kreislaufzeit ≤1 min), gelangen dann
über die Endothelien in das Interstitium und zu den Zellen
(Wirkort) oder zurück in den Kreislauf (Lymphe). Meist werden sie um-
und abgebaut (z.B. Leber) und ausgeschieden (Nieren u.a.) Frauen bestehen
zu ~50%, Männer zu ~60%, Neugeborene zu ~75% aus Wasser; der
Flüssigkeitsanteil an der Körpermasse nimmt mit zunehmendem Alter ab.
Die Verteilung von Wirkstoffen richtet sich nach Kompartmentgrenzen und
Verteilungsgeschwindigkeiten; injiziert man sie, verteilen sie sich
zuerst im Blut (~5 l, mittlere Kreislaufzeit ≤1 min), gelangen dann
über die Endothelien in das Interstitium und zu den Zellen
(Wirkort) oder zurück in den Kreislauf (Lymphe). Meist werden sie um-
und abgebaut (z.B. Leber) und ausgeschieden (Nieren u.a.)  Bei
durchschnittlicher Ernährung fallen ~600 mOsmol harnpflichtige
Substanzen zur renalen Ausscheidung an. Da die Niere des Menschen auf
maximal ~1200 mosmol/l konzentrieren kann, sind dafür mindestens 0,5 Liter
Harn notwendig (maximale Konzentrierung, negative Freiwasserclearance).
Ist der 24-Stunden-Harn blutisoton, beträgt die Freiwasserclearance
Null; ist er hypoton, ist sie positiv. Bei Abweichungen der Osmolarität um 1% (±3 mosmol/l) setzt Osmoregulation ein. Reduktion
des Blutvolumens um >8% unter den Normalwert erhöht den
Vasopressinspiegel - bei einem Volumenverlust von 15% fast 10-fach, von
20%
~20-fach. Das bewirkt Antidiurese ("Wassersparhormon") mit Blutvolumenerhöhung sowie Vasokonstriktion (Kreislaufstabilisierung) Bei
durchschnittlicher Ernährung fallen ~600 mOsmol harnpflichtige
Substanzen zur renalen Ausscheidung an. Da die Niere des Menschen auf
maximal ~1200 mosmol/l konzentrieren kann, sind dafür mindestens 0,5 Liter
Harn notwendig (maximale Konzentrierung, negative Freiwasserclearance).
Ist der 24-Stunden-Harn blutisoton, beträgt die Freiwasserclearance
Null; ist er hypoton, ist sie positiv. Bei Abweichungen der Osmolarität um 1% (±3 mosmol/l) setzt Osmoregulation ein. Reduktion
des Blutvolumens um >8% unter den Normalwert erhöht den
Vasopressinspiegel - bei einem Volumenverlust von 15% fast 10-fach, von
20%
~20-fach. Das bewirkt Antidiurese ("Wassersparhormon") mit Blutvolumenerhöhung sowie Vasokonstriktion (Kreislaufstabilisierung) Das Vasopressinsystem reagiert auf osmotische Reize sensibler als auf solche aus dem Kreislauf: Ein Osmolaritätsanstieg
um 1-2% erhöht den Vasopressinspiegel gleich stark wie ein Blutverlust
um ~10% oder eine Blutdrucksenkung um 20-30%. Das organum vasculosum laminae terminalis und das Subfornikalorgan enthalten osmorezeptive Nervenzellen, die Kapillarwände haben hier
fenestriertes ("offenes") Endothel (keine Blut-Hirn-Schranke). Nimmt
die extrazelluläre Osmolarität zu, verlieren die Neuronen Wasser,
mechanosensitive Kationenkanäle erhöhen ihre
Öffnungswahrscheinlichkeit, die Zellen depolarisieren und die
Aktionspotenzialfrequenz
nimmt zu (bei Osmolaritätssenkung sinkt ihre Aktivität),
Durstempfinden und Vasopressinsekretion ändern sich entsprechend. Durst wird auch ausgelöst durch Blutverlust, Blutdruckabfall, Renin, Angiotensin. Die Vasopressinschwelle liegt bei ~280 mosmol/l, die Durstschwelle bei ~290 mosmol/l (wenn Durst auftritt, besteht schon ein Wasserdefizit). Sowohl die Lage der Schwellen als auch die Empfindlichkeit der Vasopressinantwort sind individuell verschieden Das Vasopressinsystem reagiert auf osmotische Reize sensibler als auf solche aus dem Kreislauf: Ein Osmolaritätsanstieg
um 1-2% erhöht den Vasopressinspiegel gleich stark wie ein Blutverlust
um ~10% oder eine Blutdrucksenkung um 20-30%. Das organum vasculosum laminae terminalis und das Subfornikalorgan enthalten osmorezeptive Nervenzellen, die Kapillarwände haben hier
fenestriertes ("offenes") Endothel (keine Blut-Hirn-Schranke). Nimmt
die extrazelluläre Osmolarität zu, verlieren die Neuronen Wasser,
mechanosensitive Kationenkanäle erhöhen ihre
Öffnungswahrscheinlichkeit, die Zellen depolarisieren und die
Aktionspotenzialfrequenz
nimmt zu (bei Osmolaritätssenkung sinkt ihre Aktivität),
Durstempfinden und Vasopressinsekretion ändern sich entsprechend. Durst wird auch ausgelöst durch Blutverlust, Blutdruckabfall, Renin, Angiotensin. Die Vasopressinschwelle liegt bei ~280 mosmol/l, die Durstschwelle bei ~290 mosmol/l (wenn Durst auftritt, besteht schon ein Wasserdefizit). Sowohl die Lage der Schwellen als auch die Empfindlichkeit der Vasopressinantwort sind individuell verschieden Osmolaritätsabfall
regt die Freisetzung von Aldosteron an, Osmolaritätsanstieg die von
Vasopressin. Auf kritische
Situationen im Kreislauf (Hypovolämie, Hypotonie) reagieren die beiden Hormone gleichsinnig. Hypovolämie und die Lutealphase senken die osmotische Regulationsschwelle, Hypervolämie lässt sie ansteigen Osmolaritätsabfall
regt die Freisetzung von Aldosteron an, Osmolaritätsanstieg die von
Vasopressin. Auf kritische
Situationen im Kreislauf (Hypovolämie, Hypotonie) reagieren die beiden Hormone gleichsinnig. Hypovolämie und die Lutealphase senken die osmotische Regulationsschwelle, Hypervolämie lässt sie ansteigen |
